Область, к которой относится изобретение
Настоящее изобретение относится к области молекулярной биологии. Предложен способ выявления видов Monilinia laxa, М. fruticola, М. fructigena с помощью полимеразной цепной реакции. Способ предусматривает выделение ДНК, амплификацию участка гена cytB с использованием ДНК-полимеразы, обладающей 5'-экзонуклеазной активностью, двух праймеров и олигонуклеотидного зонда, 5'- и 3'-концы которого связаны с парой флуоресцентный краситель/«тушитель», комплементарных участкам гена cytB, идентичному у всех видов Monilinia, амплификацию участка района ITS2 с использованием ДНК-полимеразы, обладающей 5'-экзонуклеазной активностью, двух праймеров и олигонуклеотидного зонда, 5'- и 3'-концы которого связаны с парой флуоресцентный краситель/«тушитель», комплементарных участкам района ITS2 идентичному у всех видов царства Грибы и Растения, в качестве контроля выделения ДНК; и регистрацию процесса в «реальном времени» путем одновременного измерения интенсивности флуоресценции на нескольких длинах волн, соответствующих использованным красителям. Для определения видовой принадлежности Monilinia образцы положительные по накоплению флуоресценции в канале, соответствующем зонду cytB, подвергают электрофоретическому разделению в агарозном геле. Способ позволяет проводить определение трех видов М. laxa, М. fruticola, М. fructigena. Способ может быть использован для оперативного распознавания фитопатогена, экспресс-диагностики и фитокарантинного контроля.
Уровень техники
Аналоги изобретения: CN106755476A, ЕР1157129А2, RU 2422533 С1
В настоящее время разработано несколько молекулярно-генетических методов для идентификации видов монилии на основе ПЦР. Большинство из них направлено на идентификацию М. fructicola от остальных видов монилии, как наиболее частого объекта карантинного контроля. Идентификация различных видов монилии проводится либо электрофоретически после моноплексных постановок со специфичными праймерами, либо после мультиплексирования нескольких пар праймеров в одной пробирке.
Рост флуоресценции может быть обеспечен двумя разными способами. Во-первых, используется неспецифический флуоресцентный краситель, который флуоресцирует при взаимодействии с двухцепочечной ДНК - например, SYBR. При накоплении в пробирке продуктов амплификации можно наблюдать рост флуоресценции за счет связывания красителя с двухцепочечной ДНК. Данный метод выявления Monilinia fructicola был предложен в статье (Luo et al. 2007). К сожалению данный метод не позволяет отличать специфичный продукт амплификации от неспецифичного, так как SYBR связывается с любой ДНК, накопление которой идет в ПЦР.
В статье (Papavasileiou et al. 2016) описан способ, который основан на интеркалирующем красителе, однако, позволяет идентифицировать разные виды Monilinia в одной пробирке. В данном способе используется амплификация участка гена сурВ с помощью праймеров, комплементарных идентичной последовательности для всех видов Monilinia. Амплификация проводится в присутствии интеркалирующего красителя SYTO 9 Green. После амплификации проводится съем «кривой плавления», которая представляет собой зависимость логарифма изменения флуоресценции от температуры образца. В момент расплавления ампликона происходит резкое падение флуоресценции, что отражается на графике в виде пика, максимальная точка которого отражает характерную температуру плавления ампликона. Разные длина ампликона и его нуклеотидный состав приводят к разной температуре плавления ампликона. Однако, данная методика сложно стандартизуется и мало подходит для рутинных диагностических работ в связи с вариативностью значения температуры плавления ампликона от состава буфера для проведения ПЦР, а также прибора, на котором проводится амплификация и алгоритма обсчета данных программным обеспечением прибора.
Второй способ детекции накопления ПЦР продукта основан на резонансном переносе энергии флуоресценции. В данном случае флуорофор и его «тушитель» находятся на одном зонде, комплементарном средней части амплифицируемого фрагмента. Когда Taq-полимераза разрушает зонд в ходе ПЦР реакции за счет экзонуклеазной активности, сопряженной с синтезом ДНК, флуоресцентная группа переходит в раствор и отдаляется от «тушителя». Данный способ позволяет повысить специфичность определения ПЦР-продукта за счет введения дополнительного специфичного олигонуклеотида - зонда Реализация данного метода в отношении выявления видов Monilinia предложена в статье (van Brouwershaven et al. 2010). Авторы сконструировали праймеры и зонды на основании последовательности ITS региона таким образом, что один набор праймеров/зондов работает только на ДНК М. fructicola, а другой работает на всех других видах Монилии. К сожалению, данный подход не позволяет провести видовую идентификацию М. laxa и М. fructigena, а также в системе не предусмотрен внутренний контроль амплификации, что может приводить к появлению ложноотрицательных результатов.
Также Taq-man-система идентификации видов Monilinia используется в патенте CN106755476A. Патент основан на уникальных последовательностях гена laccase 2 у разных видов Monilinia (6 видов). Для каждого вида подобраны специфичные праймеры и зонды. Однако в разработанной системе все зонды содержат один флуорофор, таким образом для каждого образца требуется постановка 6 реакций. Также в предлагаемой тест-системе нет внутреннего контроля, что может приводить к появлению ложноотрицательных результатов.
Наиболее ближайшим к заявляемому способу - прототипом, является способ, предложенный (С. Guinet et al. 2016). Данный метод основан на мультиплексной амплификации видоспецифичного маркера MO368 для трех видов Monilinia (laxa, fruticola, frutigena) с использованием зондов, несущих красители, флуоресцирующие в трех различных каналах. Также для внутреннего контроля используется ITS2 локус, консервативный для грибов и растений. Этот метод мог бы служить прототипом создания тест-системы для выявления Monilinia, однако, он не позволяет использовать его в лабораториях где нет приборов с возможностью регистрации флуоресценции в режиме реального времени или если есть прибор с возможностью регистрации флуоресценции в режиме реального времени только по двум каналам. Также использование трех пар праймеров и трех зондов значительно удорожает производство такой тест-системы.
Сущность изобретения
Технической задачей изобретения является разработка точного, быстрого и дешевого способа идентификации заражения растений грибами рода Monilinia, а также возможности видовой идентификации для трех видов Монилии (М. laxa, М. fruticola, М. frutigena).
Техническим результатом, достигаемым при использовании способа, является:
• Прямое распознавание патогена и 100% специфичность анализа независимо от присутствия других возбудителей в пробах
• Возможность различать три вида Monilinia (М. laxa, М. fruticola, М. frutigena)
• Наличие внутреннего контроля для отслеживания качества выделения ДНК из образца
• Диагностика заболевания на начальных стадиях (чувствительность не менее 1 нг)
• Скорость выполнения анализа в течении 1 рабочего дня (возможность детекции в реальном времени)
• Доступность проведения анализа для лабораторий без возможности детекции результатов в режиме реального времени
• Снижение стоимости производства набора для детекции трех видов Monilinia.
Поставленная техническая задача достигается тем, что:
1) подбор праймеров и зондов для ДНК-тестирования осуществлялся таким образом, чтобы они были комплементарны области 100% гомологии гена cytB среди всех видов Monilinia и значительно отличалась от других видов грибов;
2) подбор праймеров для ДНК-тестирования осуществлялся таким образом, чтобы получаемый амплификационный фрагмент имел разную длину для разных видов Monilinia
3) для внутреннего контроля использовались праймеры для ITS2 локуса, консервативного для грибов и растений (G. Zhou et al.)
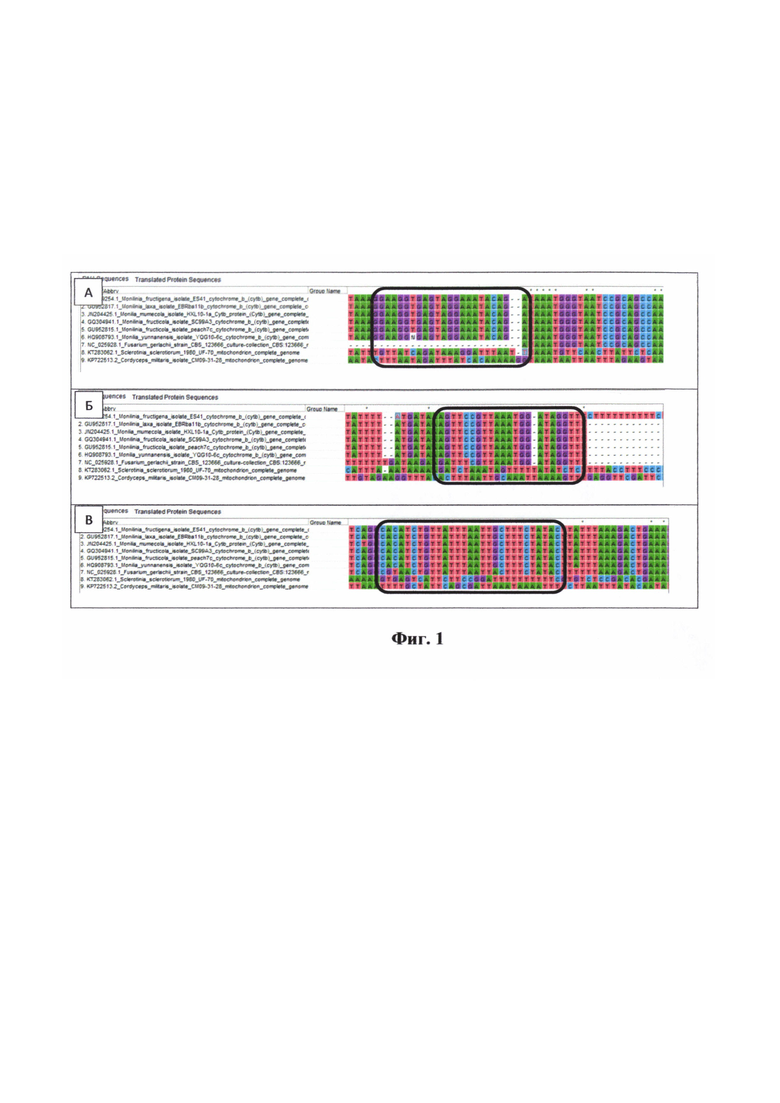
Предлагаемый способ заключается в том, что для выявления наличия Монилии анализируемую ДНК подвергают ПЦР-амплификации с использованием ДНК-полимеразы, обладающей 5'-экзонуклеазной активностью, двух праймеров и олигонуклеотидного зонда, 5'- и 3'-концы которого связаны с парой флуоресцентный краситель/«тушитель», комплементарных участкам гена cytB идентичному у всех видов Монилии (фиг. 1), а также двух праймеров и олигонуклеотидного зонда, 5'- и 3'-концы которого связаны с парой флуоресцентный краситель/«тушитель», комплементарных участкам района ITS2 идентичному у всех видов царства Грибы и Растения, в качестве контроля выделения ДНК (табл. 1).

Длительность анализа занимает 1,5 часа рабочего времени. Предлагаемый способ применим для образцов ДНК, выделенных из разных источников (плоды, листья, чистые культуры) и разными способами (СТАВ-хлороформной экстракции, сорбции на силикагеле). Для определения видовой принадлежности Монилии образцы положительные по накоплению флуоресценции в канале, соответствующем зонду cytB, подвергают электрофоретическому разделению в агарозном геле. Способ позволяет проводить определение трех видов Monilinia: laxa, fruticola, fructigena по различию в электрофоретической подвижности за счет различной длины продуктов амплификации (табл. 2).

Определяющими отличиями заявляемого способа, по сравнению с прототипом, являются:
1. Для детекции результатов ПЦР используется только две пары праймеров и два зонда (включая внутренний контроль), что удешевляет использование метода
2. Для выявления различных видов Монилии используется форезная детекция, основанная на разной длине амплификационного продукта, что позволяет проводить детекцию и при отсутствии возможности проведения «ПЦР в реальном времени».
Краткое описание чертежей.
На фиг. 1 представлено расположение праймеров и зонда для выявления монилии. Область комплементарная последовательностям праймеров и зонда показана черным прямоугольником (А. прямой праймер, Б. зонд, В. Обратный праймер). Нижние три строки - другие виды фитопатогенных грибов.
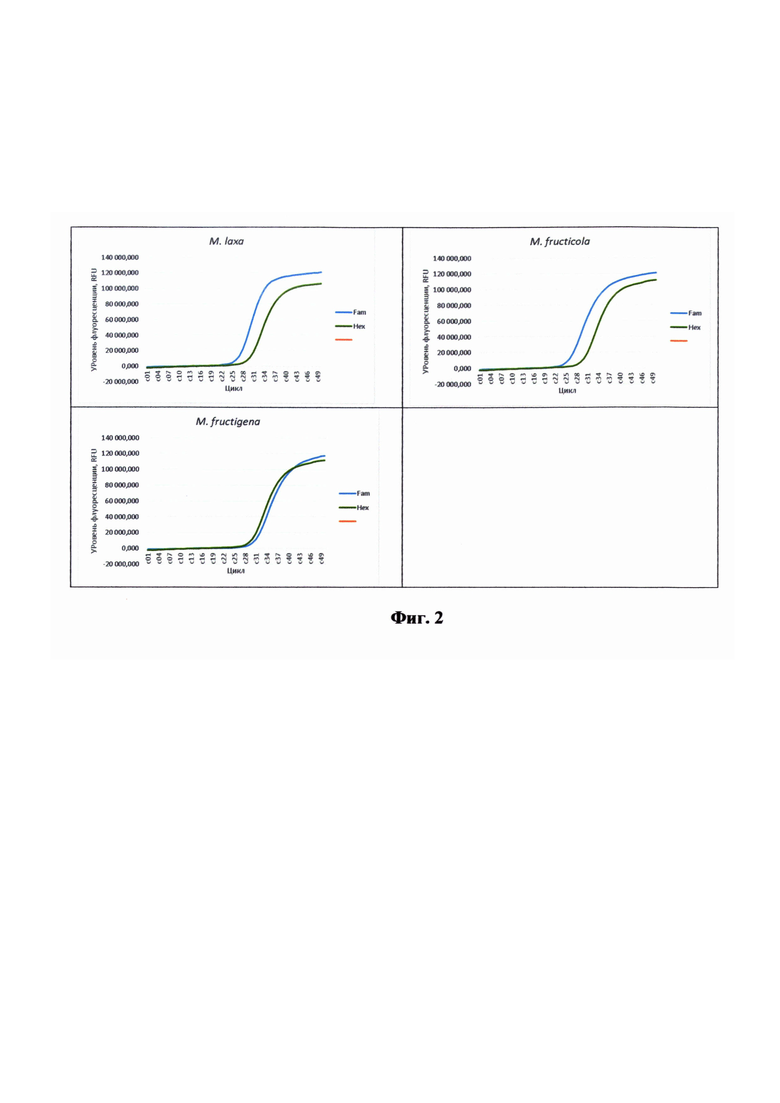
На фиг. 2 показаны кривые накопления флуоресценции в образцах, выделенных из чистых культур различных видов Monilinia. (канал Fam - праймеры и зонд Mon-cytB, канал Hex - праймеры и зонд FP-ITS2(внутренний контроль).
На фиг. 3 представлены результаты электрофореза: 1 - М. laxa; 2 - М. fructicola; 3 - М. fructigena; М - маркер молекулярной массы (100 п.н).
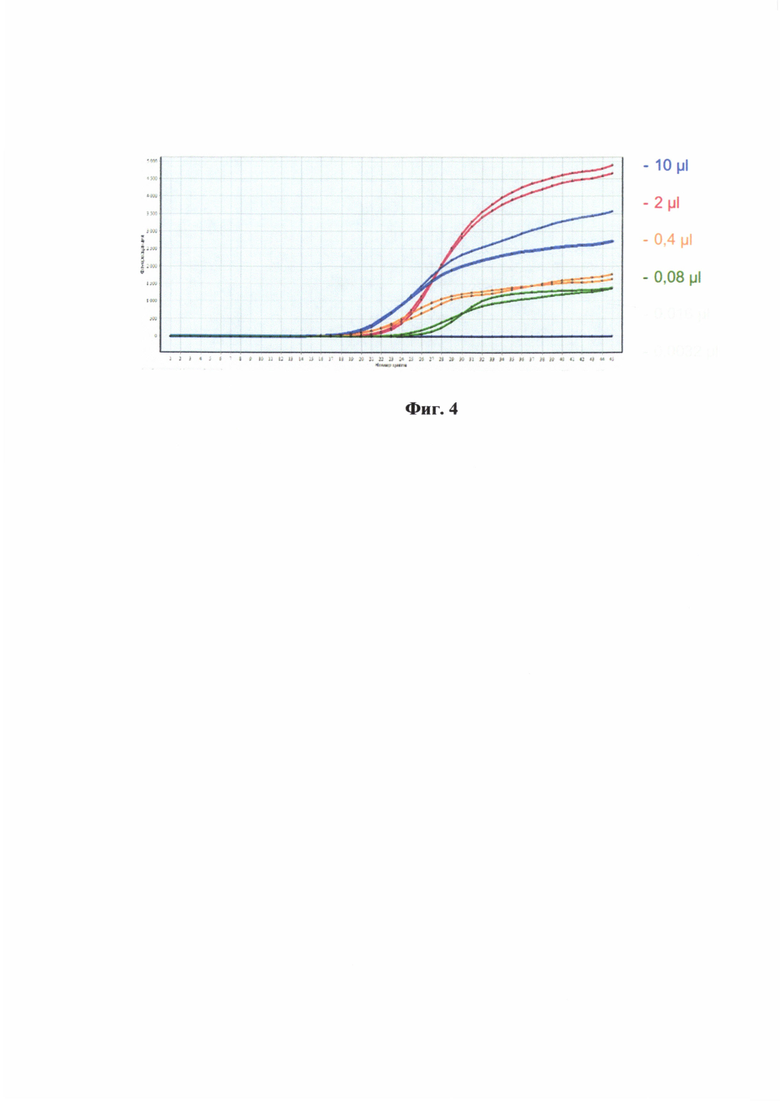
На фиг. 4 представлен пример кривых накопления флуоресценции для разных концентраций ДНК М. laxa.
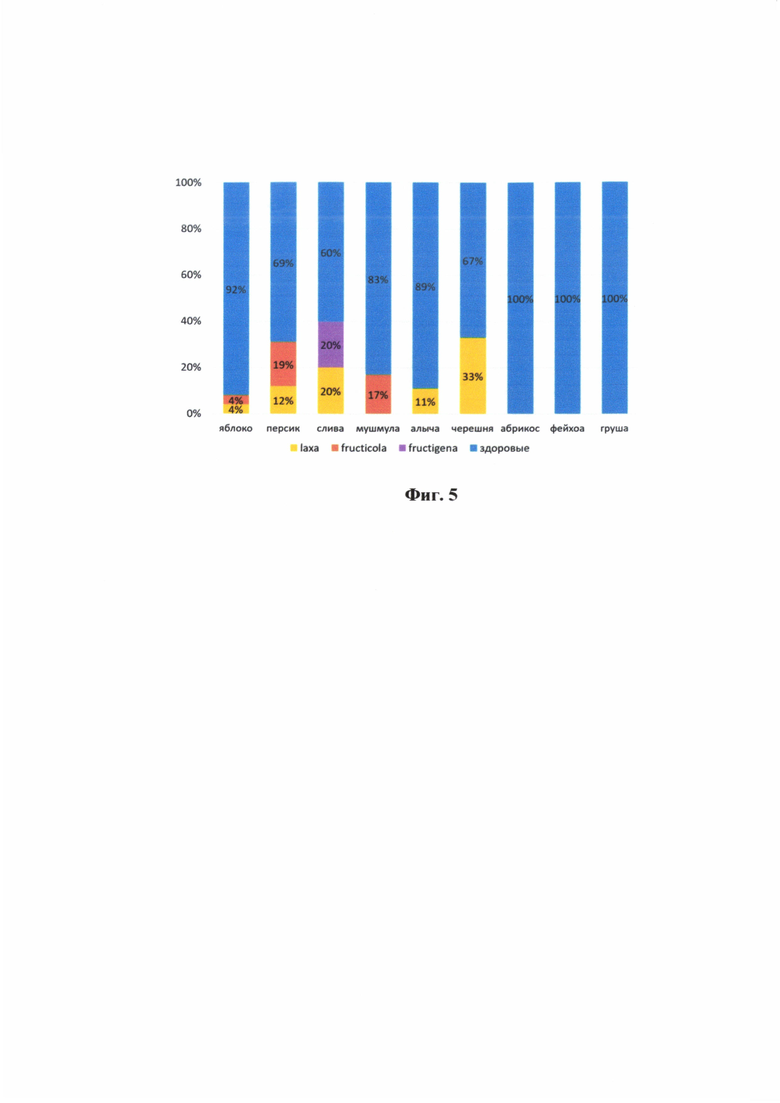
На фиг. 5 показана встречаемость различных видов Monilinia на плодах и деревьях Черноморского побережья и Абхазии.
На фиг. 6 Представлено филогенетическое древо для участка гена CYTB (жирным выделены виды, полученные в нашем исследовании).
Осуществление изобретения.
Изобретение иллюстрируется следующими конкретными примерами выполнения способа:
Пример 1. Идентификация грибов рода Монилия (Monilinia) с помощью предложенного способа по ДНК, выделенной из чистых микробиологических культур.
Выделение изолятов грибов в чистую культуру проводили из пораженных монилиозом плодов и плодовых образований. Для выделения чистой культуры патогенного гриба мы использовали агаризованную синтетическую среду Чапека, в состав которой входят такие компоненты, как: MgSO4, безводный K3PO4, KCl, Fe2(SO4)3, NaNO3, декстроза, агар, дистиллированная вода. Моноспоровые изоляты грибов культивировали при комнатной температуре (22°С) в течении 3-5 дней.
Выделение ДНК из полученных чистых культур проводили с использованием коммерческого набора «Проба-НК» (ДНК-Технология, Россия) согласно инструкциям производителя. В качестве материала для выделения отделяли с помощью скальпеля часть мукора гриба с чашки. Степень очистки выделенных препаратов ДНК и их концентрацию определяли спектрофотометрическим методом на анализаторе NanoDrop (Thermo Fisher Scientific, США). Для оценки качества (содержания примесей) препарата нуклеиновых кислот используют отношение А260/А280, которое для чистого препарата ДНК приблизительно равно 1,8.
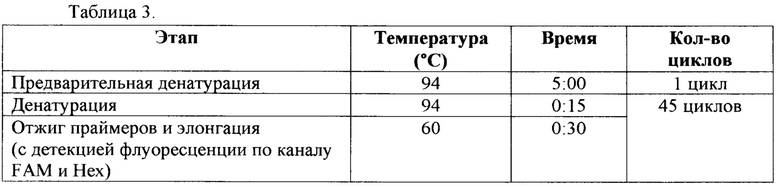
ПЦР в режиме реального времени проводили в суммарном объеме смеси 25 мкл. Стандартная реакционная смесь содержала 10 нг ДНК-матрицы, 1x qPCRmix-HS (Евроген, Россия), 10 пкмоль каждого праймера и 10 пкмоль флуоресцентного зонда. Амплификацию и учет уровня флуоресценции проводили в амплификаторе «"QuantStudio® 3 Real-Time PCR System"» (Applied Biosystems, Thermo Fisher Scientific, США) (табл. 3).
Реакционную ПЦР смесь, содержащую продукты амплификации, подвергали электрофорезу в 2% агарозном геле при постоянном напряжении 5 В/см в буфере 1x ТАЕ. Гель окрашивали интеркалирующим красителем SYBR® Safe и визуализировали в УФ свете с использованием гель-документирующей системы ChemiDoc XRS+ (BioRad, США).
Пример 2. Определение чувствительности.
Для определения аналитической чувствительности разработанных праймеров и зонда были получены серийные 5-ти кратные разведения препарата ДНК. Для воспроизводимости определения показателя чувствительности данный эксперимент был повторен дважды (табл. 4).
ПЦР в режиме реального времени проводили в суммарном объеме смеси 25 мкл. Стандартная реакционная смесь содержала 10 нг ДНК-матрицы, 1x qPCRmix-HS (Евроген, Россия), 10 пкмоль каждого праймера и 10 пкмоль флуоресцентного зонда. Амплификацию и учет уровня флуоресценции проводили в амплификаторе «ДТ» (ДНК-технологии, Россия). Детекция уровня флуоресценции проводилась по каналу FAM.
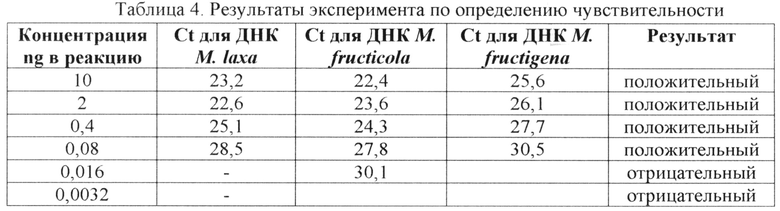
Было показано, что минимальное количество ДНК, которое способны выявлять разработанные праймеры и зонд составило 0,08 нг на реакцию.
Пример 3. Определение специфичности.
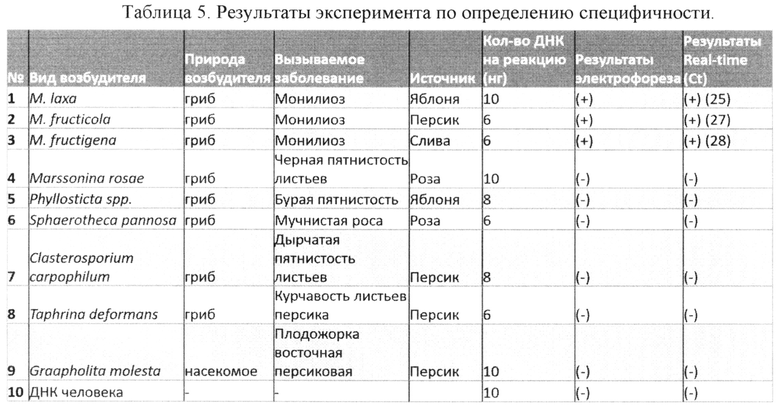
Анализ специфичности проводился на панели образцов плодов, зараженных различными фитопатогенами грибковой и бактериальной природы (табл. 5).
Пример 4. Выявление грибов рода Монилия (Monilinia) с помощью разработанной тест-системы на растениях Черноморского побережья России и Абхазии.
В исследовании было проанализировано 106 образцов различных частей растений, с подозрением на заражение монилиозом по визуальным признакам. Сбор образцов проводился на территориях Сочинского, Туапсинского, Апшеронского и Крымского районов Краснодарского края, а также на территории черноморского побережья Абхазии. Среди исследуемых плодовых культур были яблоня, персик, слива, абрикос, черешня, груша, алыча, фейхоа, мандарины и мушмула.
Гомогенизацию исследуемых плодов проводили путем их растирания в фарфоровых ступках с 300 мкл стерильного физраствора. Выделение ДНК проводили с использованием набора «Проба-НК» (ДНК-технологии, Россия) согласно инструкции производителя.
ПЦР в режиме реального времени проводили в суммарном объеме смеси 25 мкл. Стандартная реакционная смесь содержала 10 нг ДНК-матрицы, 1x qPCRmix-HS (Евроген, Россия), 10 пкмоль каждого праймера. Амплификацию и учет уровня флуоресценции проводили в амплификаторе «ДТ» (ДНК-технологии, Россия). Видовую идентификацию выявленных изолятов грибов рода Monilinia проводили определением длины наработанных ампликонов. Разделение ампликонов проводилось электрофорезом в 2% агарозном геле.
По результатам ПЦР с использованием разработанных праймеров нами было выявлено 25 образцов (23%), содержащих ДНК монилий. На черноморском побережье Краснодарского края и Абхазии монилиоз, согласно данным исследования, может поражать яблоню, персик, сливу, мушмулу, алычу и черешню. Наиболее часто монилиозами инфицированы слива, персик и черешня. Исследованные образцы абрикоса, груши и фейхоа генетического материала монилии не содержали, что вероятнее всего связано с небольшой по объему выборкой данных видов плодов.
Пример 5. Определение нуклеотидных последовательностей и видовой принадлежности исследованных грибов рода Монилия (Monilinia).
Для подтверждения правильности видового определения обнаруженных грибов рода Monilinia было проведено секвенирование некоторых ампликонов методом Сенгера (секвенирование было проведено в ЦКП Геномика СО РАН, ИХБФМ СО РАН, г. Новосибирск). По полученным нуклеотидным последовательностям была, построена дендрограмма с использованием метода максимального правдоподобия (2-х параметрическая модель Кимуры, индекс поддержки ветвей рассчитан для 500 реплик (бутстреп анализом). Все определенные виды, кластеризовались в одни клады с такими же видами из других источников, что свидетельствует о правильности проведенной видовой идентификации.
--->
Перечень последовательностей
SEQ ID NO:1 ggaaggtgagtaggaaatacaga
SEQ ID NO:2 gtatagaaagcaattaaataacagatgt
SEQ ID NO:3 agttccgttaaatggataggtt
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ТРОМБОФИЛИИ | 2007 |
|
RU2352641C1 |
| Способ идентификации видовой принадлежности тканей крыс и мышей в сухих кормах и мясных полуфабрикатах | 2019 |
|
RU2742952C1 |
| Способ определения видовой принадлежности тканей кур и свиней в продовольственном сырье, кормах и пищевых продуктах | 2018 |
|
RU2700479C1 |
| Способ идентификации ДНК ткани ежа обыкновенного (Erinaceus europaeus) в сухих кормах и мясных полуфабрикатах | 2019 |
|
RU2726433C1 |
| Тест-система для идентификации ДНК тканей крыс и мышей в сухих кормах и мясных полуфабрикатах | 2019 |
|
RU2725539C1 |
| Способ детекции последовательностей нуклеотидов методом полимеразной цепной реакции в реальном времени с универсальным зондом | 2017 |
|
RU2675378C1 |
| Способ идентификации видовой принадлежности баранины и говядины в продовольственном сырье, кормах и пищевых продуктах | 2018 |
|
RU2694713C1 |
| Способ идентификации ДНК ткани японской скумбрии (Scomber japonicus) в рыбных продуктах, в мясокостной рыбной муке и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2023 |
|
RU2814552C1 |
| Способ идентификации ДНК ткани сайры тихоокеанской (Cololabis saira) в пробе | 2023 |
|
RU2838063C2 |
| Способ идентификации ДНК ткани дальневосточной сардины, или иваси (Sardinops melanostictus), в пробе | 2023 |
|
RU2835037C2 |


Изобретение относится к области биохимии, в частности к тест-системе для обнаружения ДНК фитопатогенных грибов рода Monilinia, содержащей олигонуклеотидные праймеры и зонд. Изобретение позволяет оперативно распознавать фитопатогены Monilinia laxa, Monilinia fruticola, Monilinia fructigena и может быть использовано для экспресс-диагностики и фитокарантинного контроля. 5 табл., 5 пр., 6 ил.
Тест-система для обнаружения ДНК фитопатогенных грибов рода Monilinia методом полимеразной цепной реакции, содержащая олигонуклеотидные праймеры, имеющие следующую структуру: SEQ ID NO: 1 5'-ggaaggtgagtaggaaatacaga-3' и SEQ ID NO: 2 5'-gtatagaaagcaattaaataacagatgt-3', соответствующие последовательности гена ITS2 идентичному у всех видов царства Грибы и Растения, и зонд SEQ ID NO: 3 5'-agttccgttaaatggataggtt-3', комлементарный участку гена cytB, идентичному у всех видов рода Monilinia.
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ВОЗБУДИТЕЛЯ БОЛЕЗНЕЙ ЛИСТВЕННЫХ ПОРОД - ГРИБА POLYPORUS SQUAMOSUS МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2011 |
|
RU2465332C1 |
| CN 101857894 A, 13.10.2010 | |||
| CN 106755476 A, 31.05.2017 | |||
| GUINET C | |||
| et al., One-Step Detection of Monilinia fructicola, M | |||
| fructigena, and M | |||
| laxa on Prunus and Malus by a Multiplex Real-Time PCR Assay, Plant Dis., 2016, Volume 100, Issue 12, pp | |||
| Приспособление для изготовления цветной бумаги и растра | 1922 |
|
SU2465A1 |
| WANG J | |||
| et al., Detection and Identification of Six Monilinia | |||
Авторы
Даты
2021-07-12—Публикация
2019-12-09—Подача