Область техники, к которой относится изобретение
Настоящее изобретение относится к области молекулярной биологии и генетики и может быть использовано в медицине при определении высокого риска развития раннего атеросклероза. В частности, в настоящем изобретении предложен способ прогноза персонифицированной диагностики риска развития раннего атеросклероза, на основе бальной оценки числа полиморфных аллелей и их определенных сочетаний, включающий анализ ДНК субъекта, выявление аллельных вариантов генов липидного и углеводного обмена LPL, LIPC, АРОЕ, а также и генов окислительного и противовоспалительного гомеостаза EDN, PPARGC1A. В целом способ представляет собой набор полиморфных маркеров LPL, LIPC, АРОЕ, EDN, PPARGC1A для предиктивной диагностики раннего атеросклероза. Различные комбинации генетических вариантов полиморфных локусов Leu28Pro (rs769452) АРОЕ, G-250A (rs2070895) LIPC, Ser447Ter (rs328) LPL, Gly482Ser (rs8192678) PPARGC1A, Lys198Asn (rs5370) EDN указывают на развитие раннего атеросклероза.
Применение заявленного способа позволит диагностировать среди мужчин и женщин группы риска и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятии.
Уровень техники
Заболевания сердечно-сосудистой системы, которые обусловлены атеросклерозом, представляют собой основную причину смертности во всем мире, в том числе и в России (Roger С. et al., 2012; ВОЗ, 2017). В современной медицине, проблема атеросклероза является одной из самых актуальных, на сегодняшний день, учитывая ее распространенность и выраженность клинических симптомов. Одной из особенностей патологии является то, что длительное время атеросклероз протекает без клинических проявлений, пока не приведет к осложнениям в виде острых или хронических сосудистых событий. В настоящее время атеросклероз рассматривают в качестве мультифакторного заболевания, развитие которого может быть запущено комбинацией нескольких факторов. Индивидуальный вклад каждого фактора может быть незначительным, и только их сумма ведет к развитию заболевания. Подавляющая часть работ, направленных на исследование генетических причин развития атеросклероза, связана с изучением аллельных вариантов генов одной функциональной генной сети, например, генов липидного и углеводного обменов, генов окислительного и провоспалительного гомеостаза, генов, кодирующих компоненты дыхательной цепи митохондриального генома. В то же время известно, что ранние этапы развития атеросклероза базируются на механизмах, лежащих в основе функционирования нескольких функциональных групп белков и генов, их кодирующих.
Атеросклероз - полиэтиологичный процесс, в литературе было описано свыше 250 эндогенных и экзогенных факторов риска его развития. Однако характерно, что атеросклероз возникает как у лиц с гиперхолестеринемией, так и с нормальным содержанием холестерина в крови, у лиц с артериальной гипертензией и с нормальным давлением крови, у лиц с ожирением и кахексией, на фоне сахарного диабета и без него (Niebylski М., 2015). Существенный вклад в патогенез развития атеросклероза вносят такие факторы, как эндотелиальная дисфункция, воспаление, нарушенный метаболизм липопротеина и гомоцистеина, а также дисфункциональная коагуляция и фибринолиз (Rader, Daugherty, 2008).
Анализируемые в заявленном способе аллельные варианты генов были отобраны по результатам анализа данных литературы с учетом их патогенетического вклада в формирование атеросклероза на ранних этапах развития заболевания, а также результатов собственных исследований по генотипированию мужчин и женщин с выраженными признаками атеросклеротического поражения. Краткая характеристика, исследуемых генов представлена в таблице 1.
Ген аполипопротеина-Е (АРОЕ) оказывает выраженное влияние на уровень липидов крови и предрасположенность к ряду сердечно-сосудистых заболеваний. АРОЕ обеспечивает поглощение холестерина через В, Е-рецепторы, способствует поглощению ремнантов хломикронов и липопротеинов очень низкой плотности печенью, активирует липопротеинлипазу и лицетинхолинацилтрансферазу, связывает гепароиды с эндотелиальными клетками, участвует в формировании богатых эфирами холестерина липопротеинов низкой плотности и перераспределении липидов в тканях (Laws S. М., et al., 2002).
Ген EDN1, кодирующий предшественник эндотелина-1, локализуется на хромосоме 6 (р24-23) и содержит пять экзонов (Arinami Т., et al., 2006). В промоторной области гена располагаются последовательности СААТ и TATA, регулирующие транскрипцию (Levine et al., 1995). Установлено, что ген эндотелина-1 ассоциирован с системой патологической вазоконстрикции и артериальной гипертензией (Pare et al., 2007).
Ген LIPC, ответственный за синтез печеночной липазы, а также ремоделирование липопротеинов низкой и высокой плотности. Локализован на 15 хромосоме человека в позиции q21-q23. Общая протяженность экзонов гена - 35 kb. Экзон 1 кодирует сигнальный пептид; экзон 4 кодирует область связывания пептида с липопротеиновыми субстратами; экзон 5 кодирует каталитическую область пептида; экзоны 6 и 9 кодируют область пептида, обогащенную основными аминокислотами, с помощью которых пептид прикрепляется к эндотелиальной поверхности, взаимодействуя с кислыми доменами гликозамингликанов (Andersen et al., 2011). Печеночная липаза участвует с поверхностными протеогликанами, как лиганд в активации поглощения липопротеинов печенью, включая богатые триглицеридами липопротеиновые остатки, частицы ЛПНП и ЛПВП. Хотя роль печеночной липазы в катаболизме липопротеина хорошо установлена, ее роль в качестве анти- или про-атерогенного фактора все еще спорная (Rosamond et al., 2007).
Сывороточный уровень триглицеридов является важным независимым фактором риска развития атеросклероза. Липопротеиновая липаза (LPL) является ключевым ферментом для катаболизма богатых триглицеридом липопротеиновых частиц, используя АРОС-II в качестве кофактора. Сниженная активность LPL приводит к повышенному уровню триглицеридов (Hu et al., 2006).
В 5-м экзоне гена EDN-1 была обнаружена однонуклеотидная замена Lys198Asn, представляющая собой трансверсию G>T в 5665-м нуклеотиде, приводящую к замене лизина на аспарагин в 198-м положении аминокислотной последовательности (Holzhauser, Zolty, 2014). В нескольких исследованиях было отмечено, что частота аллеля 198Asn имеет этнические и географические особенности, которая высока среди азиатов и белых европейцев по сравнению с индийцами, афроамериканцами и якутами, а самая низкая встречаемость наблюдается среди жителей южной Америки. Для носителей генотипа Asn/Asn характерен более высокий уровень эндотелина 1 в плазме по сравнению с носителями генотипа Lys/Lys (Калинин и др., 2015).
PPARGC1 локализуется на 4 хромосоме (4р15.1). Продукт экспрессии гена PPARGC1A играет ключевую роль в метаболизме клеток миокарда. Активация PPARGC1A в миоцитах сердца ведет к индукции генов, кодирующих ферменты системы перекисного окисления липидов (Lehman et al., 2000). Также PPARGC1A активирует ряд транскрипционных факторов, таких как NRF-1, которые стимулируют биогенез митохондрий и усиливают экспрессию генов, кодирующих компоненты системы переноса электронов в митохондриях (Huss et al., 2004).
Генетические исследования сердечно-сосудистой патологии имеют несколько составляющих, в том числе и идентификацию ДНК/РНК маркеров, имеющих прогностическую ценность для оценки риска развития атеросклероза. Проведение генотипирования по одному полиморфизму не позволяет получить результат с высокой прогностической значимостью. Прогностическая значимость исследования повышается при включении в анализ аллельных вариантов нескольких функциональных групп генов, контролирующих ключевые процессы развития атеросклероза.
Известен способ выявления предрасположенности к развитию атеросклероза, раскрытый в патенте RU 2367956 C1 (опубл. 20.09.2009). Способ осуществляют путем идентификации генетических полиморфных систем, методом вертикального электрофореза в нативных условиях в 7,5% полиакриламидном геле на электрофоретической ячейке PROTEAN II xi 2-D фирмы BIO-RAD с использованием генетического анализа. Однако предложенный способ не отличается высокой надежностью получаемых данных и практически не используется в медицинских целях.
Известен способ диагностики предрасположенности к ишемической болезни сердца, заключающийся в сравнении количественного уровня повреждений митохондриальной ДНК в образце крови больного субъекта с аналогичным уровнем в образце крови контрольного субъекта, не страдающего атеросклерозом. В данном случае определяют количественную степень повреждений митохондриальной ДНК методом количественной ПЦР, где ДНК обрабатывают гликозилазой FAPY до указанного уровня ПЦР-амплификации RU 2243558C1 (опубл. 27.12.2004). Однако в известном решении исследуются только гены митохондриальной ДНК, и не учитывается роль генов ядерного генома в развитии атеросклероза, что недостаточно для обеспечения точности диагностики.
Наиболее близким к заявляемому изобретению является способ выявления предрасположенности к заболеванию атеросклерозом на основе определения экспрессии генов, вовлеченных в накопление холестерина, раскрытый в патенте RU 2698092 С1 (опубл. 22.08.2019). Способ предусматривает измерение с помощью ПЦР-РВ уровня экспрессии генов, тесно связанных с накоплением холестерина макрофагами человека, идентифицированных как IL7R, IL7, TIGIT, CXCL8, F2RL1, EIF2AK3, TSPYL2, ANXA1, DUSP1 и IL15, и сравнения полученных данных с аналогичными значениями уровня экспрессии тех же генов здоровых людей.
В способе-прототипе учитывается влияние только генов, связанных с накоплением холестерина макрофагами человека, тогда как атеросклероз является многофакторным заболеванием, и развитие патологии определяется взаимодействием факторов нескольких функциональных групп. При этом в настоящем изобретении была показана значимость полиморфных различий по генам нескольких функциональных групп - липидного и углеводного обмена, а также генов окислительного и противовоспалительного гомеостаза.
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа прогнозирования высокого риска развития раннего атеросклероза на основании определения сочетания генетических вариантов Gly482Ser PPARGC1A, Leu28Pro АРОЕ, Lys198Asn EDN, G-250A LIPC, Ser447Ter LPL, APOC3 (C3238G), т.е. аллельных вариантов 5-ти генов нескольких функциональных групп - липидного и углеводного обмена, а также генов окислительного и противовоспалительного гомеостаза для диагностики раннего атеросклероза. Указанный способ обеспечивает повышение результативности указанного прогнозирования по сравнению с известным уровнем техники.
Одним из преимуществ настоящего изобретения является увеличение эффективности, точности и достоверности выявления риска к развитию атеросклероза за счет определения генотипа по пяти аллельным вариантам генов ядерного генома Gly482Ser PPARGC1A, Leu28Pro АРОЕ, Lys198Asn EDN, G-250A LIPC, Ser447Ter LPL.
В одном из вариантов настоящего изобретения заявленный способ прогнозирования высокого риска развития раннего атеросклероза включает определение аллельных вариантов, выбранных из группы, включающей Gly482Ser PPARGC1A, Leu28Pro АРОЕ, Lys198Asn EDN, G-250A LIPC и Ser447Ter LPL и при установлении наличия по меньшей мере трех из указанных вариантов прогнозируют высокий риск развития раннего атеросклероза.
В одном из вариантов настоящего изобретения прогнозируют высокий риск развития раннего атеросклероза при следующем сочетании аллельных вариантов:
LIPC (G250A)xLPL(Ser447Ter)x PPARGC1A(Gly482Ser)
LPL(Ser447Ter)xAPOE(Leu28Pro)xPPARGC1A(Gly482Ser)
LPL(Ser447Ter)xPPARGC1A(Gly482Ser)xEDN(Lys198Asn)
LIPC (G250A)xLPL(Ser447Ter)xAPOE(Leu28Pro).
В одном из вариантов настоящего изобретения заявленный способ включает выделение ДНК из периферической венозной крови мужчин и женщин, анализ генетических полиморфизмов генов липидного и углеводного обмена Leu28Pro (rs769452) АРОЕ, G-250A (rs2070895) LIPC, Ser447Ter (rs328) LPL и генов окислительного и противовоспалительного гомеостаза Gly482Ser (rs8192678) PPARGC1A, Lys198Asn EDN и прогнозирование высокого риска развития раннего атеросклероза при выявлении одного из четырех генотипов по комбинациям исследуемых генетических полиморфизмов:
LIPC (G250A)xLPL(Ser447Ter)xPPARGC1A(Gly482Ser)
LPL(Ser447Ter)xAPOE(Leu28Pro)xPPARGC1A(Gly482Ser)
LPL(Ser447Ter)xPPARGClA(Gly482Ser)xEDN(Lys198Asn)
LIPC (G250A)xLPL(Ser447Ter)xAPOE(Leu28Pro).
Новизна и изобретательский уровень заключаются в том, что из уровня техники не известна возможность прогноза риска развития раннего атеросклероза по наличию различных сочетаний генетических вариантов полиморфных локусов генов ядерного генома Leu28Pro (rs769452) АРОЕ, G-250A (rs2070895) LIPC, Ser447Ter (rs328) LPL, Gly482Ser (rs8192678) PPARGC1A, Lysl98Asn (rs5370) EDN.
Краткое описание чертежей
На Фиг. 1 представлен пример электрофореграммы результатов амплификации после аллель-специфичной полимеразной цепной реакции.
На Фиг. 2 показаны результаты значимых трехлокусных сочетаний генов при раннем атеросклерозе, полученных при проведении MDR анализа. Ячейки темно-серого цвета - это генотипы высокого риска, ячейки светло-серого цвета - это генотипы более низкого риска, ячейки белого цвета - отсутствуют сочетания генотипов.
Осуществление изобретения
Квалифицированному специалисту очевидно, что заявленный способ может быть осуществлен различными методиками, позволяющими установить наличие указанных аллельных вариантов в генетическом материале субъекта.
При сравнении с общеизвестными частотами указанных полиморфизмов было установлено, что у больных с ранним атеросклерозом они встречаются чаще, чем у нормальных людей.
В одном из неограничивающих вариантов, способ осуществляют следующим образом.
У пациента делают забор крови и проводят исследование на наличие полиморфизмов Gly482Ser PPARGC1A, Leu28Pro АРОЕ, Lys198Asn EDN, G-250A LIPC, Ser447Ter LPL. При наличии четырех или более полиморфизмов делают заключение о возможном риске развития раннего атеросклероза.
ДНК выделяют из образцов периферической венозной крови мужчин и женщин на мембранных колонках с использованием набора реагентов ДНК (Qiagen, Германия).
Образцы лизируют в высокоденатурирующих условиях при комнатной температуре (15-25°С) в присутствии протеиназы К и буфера, которые в совокупности обеспечивают инактивацию нуклеаз. Добавить буфер АСВ, который позволяет скорректировать условия связывания для совместного выделения ДНК и РНК. Затем лизат переносят в колонку QIAamp Mini. Во время центрифугирования нуклеиновые кислоты адсорбируются кремнеземными мембранами, а примеси проходят через мембраны. Двухэтапная тщательная отмывка позволяет удалить оставшиеся примеси и ингибиторы ферментов, нуклеиновые кислоты элюируются в буфере AVE.
Основные этапы выделения ДНК: С помощью дозатора перенести 20 мкл протеиназы К в микроцентрифужную пробирку 2 мл. Добавить к протеиназе К 200 мкл крови. Добавить 100 мкл лизирующего буфера. Перемешать ее содержимое пульсационным способом. Выдержать смесь при температуре 20-25°С 15 мин. Кратковременно центрифугировать пробирку 2 мл. Добавить в образец 350 мкл буфера АСВ. Кратковременно центрифугировать пробирку 2 мл. Перенести лизат в колонку QIAamp Mini, помещенную в пробирку для сбора образцов 2 мл. Центрифугировать при 6000 × g (8000 об/мин) 1 мин. Поместить колонку QIAamp Mini в чистую пробирку. Открыть колонку QIAamp Mini и внесите в нее 600 мкл буфера AW1. Центрифугировать при 6000 × g (8000 об/мин) 1 мин. Поместить колонку QIAamp Mini в чистую пробирку для сбора образцов 2 мл и утилизируйте пробирку с фильтратом. Открыть колонку QIAamp Mini и внесите в нее 600 мкл буфера AW2. Центрифугировать при 6000 × g (8000 об/мин) 1 мин.
Поместить колонку QIAamp Mini в чистую пробирку для сбора образцов 2 мл и утилизируйте пробирку с фильтратом. Центрифугировать (20 000 × g, 14 000 об/мин) 2 мин для высушивания мембраны. Поместить колонку QIAamp Mini в чистую микроцентирфужную пробирку 1,5 мл. Открыть колонку QIAamp Mini и нанести 50-150 мкл буфера AVE по центру мембраны. Выдержать при комнатной температуре (15-25°С) 1 мин. Центрифугировать на полной скорости (20 000 × g, 14 000 об/мин) 1 мин. Полученный супернатант использовать в качестве исследуемого образца ДНК.
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием наборов реагентов SNP. Анализ основан на одновременном проведении двух реакций амплификации с двумя парами аллель-специфичныхи праймеров. Одна пара праймеров комплементарна нормальному аллелю, вторая комплементарна полиморфному варианту гена. Данный анализ позволяет выявлять как гетерозиготное состояние полиморфных вариантов гена, так и гомозиготное.
Ход работы:
Эксперимент проводится в стерильном боксе, все реагенты должны находиться в штативе со льдом. Реакционный мастер микс готовить в следующих пропорциях: Buf III 1x, MgCl2 3.5 mM, dNTPs 200 mM, SYBR Green 2x, ROX 0,3x, Taq Polymerase, MQ довести до 25 мкл для каждой пробы, предварительно учитывая прямой и обратные праймеры - по 1,25 мкл каждого на пробу и матрицу ДНК - 1 мкл.
Перенести пробирки в прогретый до 9°С программируемый термостат и провести амплификацию по следующей программе.
Далее ПЦР проводили по схеме: денатурация ДНК при 94°С в течение 5 мин, затем 35 циклов амплификации, включающей в себя денатурацию ДНК (94°С/30 секунд), отжиг праймеров (56°С/30 секунд для Leu28Pro, Lysl98Asn, G-250A, Ser447Ter, Gly482Ser) и элонгацию (синтез второй цепи) 72°С/3:30 мин, по окончании 35 циклов установить на заключительную элонгацию 72°С/7 мин.
Для каждого запуска амплификатора вместе с пробами ставить отрицательный контроль, по составу идентичный анализируемым пробам, но
вместо раствора ДНК использовать стерильную воду. Таким образом, при отсутствии амплификации в отрицательном контроле, исключить вывод об отсутствии контаминации остальных образцов чужеродными фрагментами ДНК.
После окончания амплификации провести анализ кривых флуоресценции по отдельным лункам в окне «Расчет» раздела «Анализ данных» и анализ распределения генотипов в окне «Аллельная дискриминация» согласно протоколу прибора. О наличии того или иного аллеля исследуемого локуса идентифицировать по росту флуоресценции соответствующих красителей SYBR и ROX.
Детекция продуктов амплификации
Горизонтальное электрофоретическое разделение использовать для количественной оценки выделенной ДНК в 1% агарозном геле, а также для количественной и качественной оценки продуктов амплификации в 1,5%-ном агарозном геле в присутствии бромистого этидия.
Визуализацию геля производили с помощью гель-документирующей системы Molecular Imager® Gel Doc™ XR System (BioRad) при использовании ультрафиолетового фильтра. (BIO-RAD Power Supply model 500/200), электрофорезного аппарата (LKB 2013 miniphor Elektrophore.
Возможность использования предложенного способа для прогнозирования риска развития раннего атеросклероза подтверждает анализ результатов исследования. В нашем исследовании мы использовали сыворотку мужчин и женщин в возрасте от 29 до 79 лет, для изучения межгенного взаимодействия полиморфных вариантов генов липидного, углеводного обмена, факторов окислительного и противовоспалительного гомеостаза в развитии раннего и у жителей Ростовской области. Для сбора информации, на каждого пациента, врачом была заполнена анкета, в которой отмечали: возраст, пол, отсутствие клинических проявлений заболеваний атеросклеротического генеза, уровень артериального давления, для женщин - отсутствие или наличие менопаузы (спонтанной или хирургической), а также экзогенные факторы - курение.
Критериями исключения из исследования были: ненормальная анатомическая конфигурация шеи и мышц; выраженная извитость и/или глубина залегания сонных артерий, и/или необычные места артериальных ветвей; перенесенный инфаркт миокарда, инсульт, острые преходящие нарушения мозгового кровообращения в анамнезе; перемежающаяся хромота; реваскуляризация сонных, коронарных и периферических артерий.
Всем участникам исследования проводили забор крови из локтевой вены в вакуумные пробирки с ЭДТА. Наличие каротидного атеросклероза и степени его выраженности определяли при помощи триплексного сканирования экстракраниального отдела брахиоцефальных артерий с оценкой толщины комплекса интима-медиа по Шкале Gensini.
Исследование выполнено на базе центра коллективного пользования «Высокие технологии ЮФУ», клинический материал и инструментальные исследования выполнены на базе кардиологического центра Ростовской областной клинической больницы, медицинского центра ООО «Наука».
Анализ ассоциаций сочетаний генетических вариантов с риском развития раннего атеросклероза с помощью биоинформатического подхода - Multifactor Dimensionality Reduction (программа MDR, v. 1.1.0 www.epistasis.org/mdr.html) для моделирования геномных взаимодействий высокого порядка. Метод MDR специально разработан для изучения характера межгенных взаимодействий для популяционно-генетических исследований мультифакторных полигенных заболеваний, использующих относительно небольшие объемы выборок больных и здоровых.
В Таблице 2 показаны выявленные модели межгенного взаимодействия, полученные при проведении MDR анализа по полиморфным вариантам исследуемых генов липидного и углеводного обмена и генов окислительного и провоспалительного гомеостаза среди мужчин и женщин с атеросклеротическим поражением на ранней стадии.
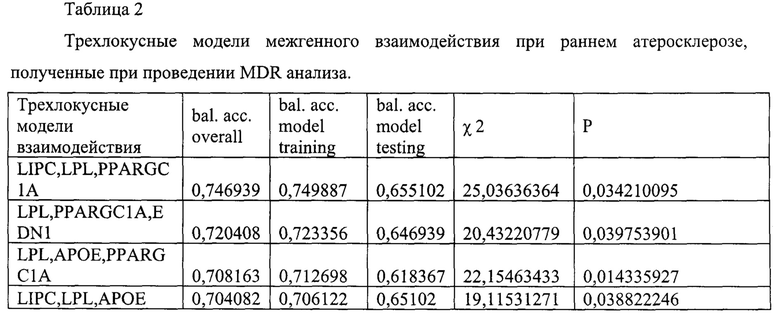
Как видно из представленных результатов при раннем атеросклерозе установлены статистически значимые трехлокусные модели взаимодействия генов LIPC, LPL, PPARGC1A (р=0,034), LPL,PPARGC1A, EDN1(p=0,039), LPL,AP0E,PPARGC1A (p=0,014), LIPC,LPL,APOE (p=0,038).
В первых трех моделях перекрестная проверка показала 10/10.
В таблице 3 и на Фиг. 2 показаны результаты сочетаний генотипов и перекрестной проверки межгенного взаимодействия при раннем атеросклерозе трехлокусной модели LIPC, LPL, PPARGC1A.


Значимые синергитические связи полиморфизмов Gly482Ser гена PPARGC1A и G250A гена LIPC (3,78%), Leu28Pro гена АроЕ и Lys198Asn гена EDN1(3,46%) и менее выраженная связь Leu28Pro гена АроЕ и Gly482Ser гена PPARGC1A.
На основании полученных данных авторы настоящего изобретения установили, что следующие генетические полиморфизмы Leu28Pro (rs769452) АРОЕ, G-250A (rs2070895) LIPC, Ser447Ter (rs328) LPL, Gly482Ser (rs8192678) PPARGC1A, Lys198Asn (rs5370) EDN играют значимую роль в формировании генетической предрасположенности к высокому риску развития раннего атеросклероза. Сочетание полиморфных вариантов
LIPC (G250A) xLPL(Ser447Ter)x PPARGC1 A(Gly482Ser)
LPL(Ser447Ter)xAPOE(Leu28Pro)xPP ARGC1 A(Gly482Ser)
LPL(Ser447Ter)xPPARGClA(Gly482Ser)xEDN(Lysl98Asn)
LIPC (G250A) xLPL(Ser447Ter)xAPOE(Leu28Pro).
ассоциированы с высоким риском развития раннего атеросклероза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К ДЛИТЕЛЬНЫМ ФИЗИЧЕСКИМ НАГРУЗКАМ | 2011 |
|
RU2468086C1 |
| Способ прогнозирования высокого риска репродуктивных потерь в первом триместре беременности | 2016 |
|
RU2611358C1 |
| Способ оценки риска развития абдоминального ожирения у лиц с вибрационной болезнью, обусловленной воздействием локальной вибрации | 2021 |
|
RU2783252C1 |
| Способ прогнозирования риска развития у мужчин эссенциальной гипертензии, ассоциированной с ожирением | 2018 |
|
RU2693469C1 |
| Способ прогнозирования риска развития пролапса гениталий у рожавших женщин на предклиническом этапе | 2023 |
|
RU2826543C1 |
| СПОСОБ РАСШИРЕННОГО СКРИНИНГА ПРЕДРАСПОЛОЖЕННОСТИ К СЕРДЕЧНО-СОСУДИСТЫМ ЗАБОЛЕВАНИЯМ И БИОЧИП ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА | 2010 |
|
RU2453606C2 |
| Способ прогнозирования задержки роста плода | 2020 |
|
RU2738674C1 |
| Способ прогнозирования риска формирования генитального пролапса у женщин | 2023 |
|
RU2823209C1 |
| СПОСОБ СКРИНИНГА СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ И БИОЧИП ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА | 2008 |
|
RU2402771C2 |
| Способ выявления у детей ранних нарушений физиологической функции сердца в условиях контаминации фенолом | 2017 |
|
RU2657821C1 |
Изобретение относится к области медицины и предназначено для прогнозирования высокого риска развития раннего атеросклероза. У пациента определяют аллельные варианты, выбранные из группы, включающей Gly482Ser PPARGC1A, Leu28Pro АРОЕ, Lys198Asn EDN, G-250A LIPC и Ser447Ter LPL. При установлении наличия по меньшей мере трех из указанных вариантов прогнозируют высокий риск развития раннего атеросклероза. Изобретение обеспечивает повышение результативности прогнозирования высокого риска развития раннего атеросклероза. 2 з.п. ф-лы, 3 табл., 2 ил.
1. Способ прогнозирования высокого риска развития раннего атеросклероза, включающий определение аллельных вариантов, выбранных из группы, включающей Gly482Ser PPARGC1A, Leu28Pro АРОЕ, Lys198Asn EDN, G-250A LIPC и Ser447Ter LPL и при установлении наличия по меньшей мере трех из указанных вариантов прогнозируют высокий риск развития раннего атеросклероза.
2. Способ по п. 1, в котором прогнозируют высокий риск развития раннего атеросклероза при следующем сочетании аллельных вариантов:
LIPC (G250A)xLPL(Ser447Ter)xPPARGC1A(Gly482Ser)
LPL(Ser447Ter)xAPOE(Leu28Pro)xPPARGC1A(Gly482Ser)
LPL(Ser447Ter)xPPARGC1A(Gly482Ser)xEDN(Lys 198Asn)
LIPC (G250A)xLPL(Ser447Ter)xAPOE(Leu28Pro).
3. Способ по п. 1 или 2, в котором определение аллельных вариантов включает выделение ДНК из периферической венозной крови мужчин и/или женщин, анализ генетических полиморфизмов генов липидного и углеводного обмена APOE(Leu28Pro), LIPC (G-250А), LPL(Ser447Ter) и окислительного и противовоспалительного гомеостаза EDN(Lys198Asn), PPARGC1A(Gly482Ser).
| Способ выявления предрасположенности к заболеванию атеросклерозом на основе определения экспрессии генов, вовлеченных в накопление холестерина | 2018 |
|
RU2698092C1 |
| CN 110205375 A, 06.09.2019 | |||
| НЕСКУБИНА О.М | |||
| Межгенные взаимодействия при раннем атеросклерозе | |||
| Генетика - фундаментальная основа инноваций в медицине и селекции: материалы Научно-практической конференции с международным участием (Ростов-на-Дону, 2-4 ноября 2017 г.) / Южный федеральный университет; [гл | |||
| ред.: Т | |||
| П | |||
Авторы
Даты
2021-07-26—Публикация
2019-12-30—Подача