Изобретение относится к экспериментальной медицине, в частности к военной токсикологии, касается способа моделирования функциональных нарушений дыхания при ингаляционном поражении сернистым ипритом (ИПСИ), которое может быть широко использовано в исследовательских целях в любой научно-исследовательской лаборатории, занимающейся вопросами медико-биологических исследований.
Сернистый иприт (СИ) относится к ядам политропного типа действия, способным вмешиваться в процессы метаболизма на различных уровнях. Ведущими механизмами действия СИ служат алкилирование гуаниновых оснований, активация АДФ-полимеразы, сопровождающиеся каскад-индуцированным запуском факторов апоптоза, нарушением синтеза белка и клеточного деления, приводящее к замедлению основного обмена или утрате метаболических процессов клетки, конъюгацией с тиолосодержащими ферментами и прооксидантным действием за счет эффекта радиолиза воды под действием образующегося хлор-иона [1, 2]. Широкий спектр биологической активности и мишеней для реализации токсического действия СИ обуславливает невозможность создания специфических антидотов, пригодных для применения в условиях чрезвычайных ситуаций (локальные конфликты с использованием СИ, террористические акты, техногенные аварии и т.п.). Определенные перспективы связывают с разработкой средств патогенетической терапии, действие которых будет направлено как в отношении блокады первичных реакций, так и, в большей степени, на предупреждение вторичных механизмов токсического действия СИ (профилактика увеличения экспрессии NB-kB, провоспалительного эффекта ФНОα, цитопротекция ингибированием сфигмомиелазы, борьба с эндотоксикозом и т.д.)
Актуальность поиска перспективных медицинских средств для профилактики и лечения последствий поражения СИ определяется существующими аналитическими выводами о высокой вероятности использования этого токсиканта в качестве боевого и диверсионного поражающего агента. Не следует забывать и о массовом затоплении (свыше 300000 т) боевых химических отравляющих веществ в различных районах Балтики после окончания Второй мировой войны. По мнению специалистов, с каждым годом не только не исчезает, но и возрастает вероятность объемного (залпового) выброса в окружающую среду отравляющих химических веществ, включая СИ, по причине коррозии металлических бочек и конструкций снарядов и бомб.
Одной из задач, стоящих перед исследователями на пути создания эффективных медицинских средств защиты от поражения СИ, является разработка экспериментальных моделей ИПСИ, максимально приближающих условия экспериментов к наиболее вероятным сценариям его применения в террористических целях, и адекватно отражающих возникающие функциональные нарушения дыхания.
Для моделирования ингаляционных поражений биообъектов часто применяют инсталляцию жидкого раствора СИ с использованием различных шприц-систем с набором канюль и инструментария для интубации трахеи. Известен способ [3], согласно которому моделирование ингаляционного поражения СИ выполняют посредством трахеотомии подопытного животного с использованием набора для хирургического вмешательства, после чего в трахеостому вводят канюлю, через которую подают токсикант. Моделирование поражения осуществляют на взрослых крысах-самцах массой тела 275-325 г. После анестезии, вызванной внутрибрюшинным введением кетамина в дозе 100 мг/кг, производят трахеотомию, в трахею ниже ее бифуркации вводят слегка изогнутый катетер Р50 для моделирования одностороннего поражения левого легкого. Инсталляция СИ в дыхательные пути крыс приводит к острому повреждению левого легкого. Недостаток такого подхода состоит в оперативном вмешательстве как таковом и его последствиях для подопытного животного. Среди явных отрицательных сторон: необходимость гемостаза, вероятные повреждения пищевода или задней стенки трахеи, возможность присоединения вторичной инфекции.
Известен способ моделирования [4], согласно которому ингаляционное поражение СИ выполняют посредством безоперационной интубации и вливания жидкого раствора токсиканта. Моделирование поражения осуществляют на крысах-самцах массой тела 280-300 г путем интратрахеальной инсталляции СИ. После анестезии кетамином, который вводят внутримышечно в дозе 100 мг/кг, СИ вводят в трахею крыс в различных дозах в расчете 0,1 мл на крысу, а затем рассчитывают среднюю смертельную дозу (ЛД50), которая составляла 2 мг/кг. В рассмотренном безоперационном варианте канюлю или зонд вводят через голосовую щель с помощью ларингоскопа. Указанный метод даже при должной сноровке и опыте экспериментатора не исключает риск введения зонда в желудок вместо трахеи.
Для обеих рассмотренных моделей ИПСИ [3, 4] прослеживается общий очевидный недостаток, а именно, использование токсиканта в жидком агрегатном состоянии. Отсутствие распыления делает невозможным создание одинаковых концентраций СИ, инстиллируемого в легкие.
Поскольку агрегатное состояние СИ в предполагаемых условиях чрезвычайных ситуаций состоит из смеси пара и аэрозоля с различными фазово-дисперсными характеристиками, адекватным подходом является моделирование ингаляционных поражений биообъектов с использованием систем ингаляционной доставки аэрозоля или пара указанного токсиканта в максимально широком диапазоне доз. При этом модель ИПСИ должна обладать достаточно высокой пропускной способностью и быть экономически рентабельной.
Известен способ моделирования ингаляционного поражения СИ [5], при реализации которого используют испаритель и систему камер, трубок и клапанов. В соответствии с указанным способом, животных помещают в камеры из полиметилметакрилата. Перед экспериментом токсикант в необходимом количестве доставляется в камеру нагрева (испаритель), откуда он пассивным способом перемещается по системе трубок и клапанов до полного испарения. В качестве биообъекта используют крыс-самцов массой тела 230-260 г. Биообъекты предварительно анестезируют внутримышечно комбинацией кетамина (80 мг/кг) и ксилазина (10 мг/кг), затем интубируют и подвергают воздействию токсиканта путем вдыхания его паров в концентрации 3,5 мг/мл в растворе абсолютного этанола в течение 50 мин. При пересчете на массу тела подопытных животных доза токсиканта составляла 1,4 мг/кг.
Основным достоинством данного способа является приближенность к наиболее вероятным сценариям применения токсиканта. Однако СИ имеет свойство проникать в различные полимерные комплектующие, быть устойчивым к используемым при обработке дегазирующим рецептурам и длительное время подвергаться десорбции, что может быть отрицательно оценено с точки зрения безопасности персонала лаборатории, и вносит фоновую нагрузку в последующие эксперименты. Кроме того, пассивное движение токсиканта по системе клапанов не позволяет точно контролировать эксперимент с момента его начала и до окончания полного испарения токсиканта. Также указанный способ не подходит для оценки эффективности средств экстренной профилактики (лечения) в первые минуты от момента поражения, так как длительность экспозиции составляет 50 мин.
Известен способ моделирования ингаляционного поражения СИ [6], предусматривающий использование небулайзера и систему камер, трубок и клапанов. Указанный способ наиболее близок по достигаемому результату к заявляемому способу и принят в качестве способа-прототипа.
В соответствии со способом-прототипом при моделировании ИПСИ в качестве биообъекта использовали взрослых морских свинок Данкина-Хартли обоих полов массой тела 480-890 г в количестве тридцати голов, из которых были сформированы пять групп: контрольная и 4 подопытные по 6 особей в каждой.
В ходе реализации способа-прототипа морские свинки контрольной группы подвергались воздействию аэрозоля растворителя СИ - этанола, а подопытных групп -аэрозоля раствора СИ в этаноле с экспозиционной дозой 40 мг/м3 продолжительностью 5 мин.
В соответствии с указанным способом, каждый раз по 6 морских свинок помещали в экспозиционную камеру в виде короба размерами 25 см ×16 см ×69 см из полиметилметакрилата таким образом, что их головы были закреплены в отсеке размерами 10 см ×16 см ×11,5 см, а тело находилось в другом отсеке размерами 15 см ×16 см ×11,5 см. В свою очередь, экспозиционную камеру помещали в герметичную камеру размерами 34 см ×23 см ×84 см.
До начала моделирования 2,5 мл раствора, содержащего 3,175 мг СИ, растворенного в этаноле (1,27 г/мл), помещали в резервуар небулайзера, откуда распыляли в течение 5 мин в экспозиционную камеру с животными при потоке воздуха 14,4 л/мин. В течение этого срока в замкнутом контуре объемом 72 л (0,072 м3) создавалась экспозиционная концентрация СИ, составляющая 40 мг/м3. Практически сразу после включения небулайзера экспозиционная камера заполнялась аэрозолем раствора СИ в этаноле и каждое животное в течение 5 мин подвергалось воздействию указанного аэрозоля в дозе 40 мг/м3.
После окончания экспозиции следовал этап дегазации. Чистый воздух через небулайзер прокачивался в экспозиционную камеру в течение 25 мин. Через выходное отверстие из камеры воздух, смешанный с остаточной концентрацией токсиканта, пропускался через резервуар объемом 30 л, содержащий 5%-ный раствор гипохлорита натрия.
Полученная при реализации способа-прототипа модель ИПСИ с применением небулайзера имеет некоторые признаки, характерные для отравления, возникшего вследствие воздействия на организм животного поражающих факторов СИ. Согласно имеющимся сведениям, в бронхоальвеолярной лаважной жидкости отравленных животных выявлены признаки воспаления (увеличение числа нейтрофилов и эозинофилов в суспензии клеток и провоспалительных цитокинов в жидкой части супернатанта), а также положительный тест бронхиконстрикции (с метахолином) [6]. Это свидетельствует о том, что в ходе моделирования ингаляционного поражения СИ с использованием способа-прототипа воспроизводится клиническая картина и макро- и микроскопические признаки, как правило, выявляемые при оценке бронхолегочной системы. Однако, в описании материальной части способа-прототипа, а точнее, полученной при его реализации модели, макроскопические признаки отравления подопытных животных СИ в достаточной степени не конкретизированы. Развернутое лабораторно-инструментальное подтверждение также отсутствует. Сведения о выявленных функциональных нарушениях дыхания, исследованиях по оценке изменения показателей функции внешнего дыхания (ФВД), связанных с локальным ингаляционным поражением СИ бронхолегочной системы, с использованием указанной модели также отсутствуют.
Основное достоинство полученной вследствие воздействия аэрозоля токсиканта модели ИПСИ - модульность и приближенность к ингаляционному сценарию поступления токсиканта.
Наряду с отмеченными достоинствами для способа-прототипа характерен ряд существенных недостатков:
- большие потери токсиканта вследствие аппликации СИ на стенки ингаляционной камеры и выход большей его части в камеру для дегазации;
-отсутствие расчетных данных о поглощенной дозе СИ, которая служит интегральным показателем тяжести модели ИПСИ, а также позволяет рассчитать показатели защитной эффективности средств патогенетической терапии;
- сложность исполнения и необходимость использования дорогостоящих модулей и расходных материалов, а именно, клапанов, системы трубок и полиметилметакрилатных пеналов общей стоимостью из расчета на одну экспозицию 6 животных более 1 млн. рублей в связи с необходимостью реализации серьезных мероприятий по обеспечению безопасности исследователя и окружающей среды;
-отсутствие в доступных источниках информации сведений о конкретной последовательности действий, способах разведения и результатах микрометрической оценки аэрозоля токсиканта, имеющих принципиальное значение для установления глубины проникновения и доли, поступившей в альвеолы, что, в свою очередь, важно для повышения значимости проведенных экспериментов по показателям повторяемость и воспроизводимость;
- материалы, из которых изготовлены используемые ингаляционные системы, это полиметилметакрилат, резина, металлы. Однако известно, что СИ способен проникать в полимерные материалы и затем подвергаться длительной десорбции из них, сохраняя при этом свои токсические свойства, несмотря на проветривание камеры чистым воздухом в течение 25 мин. Данный факт свидетельствует о повышенных рисках для здоровья персонала исследовательских лабораторий и окружающей среды, и предполагает лишь однократное использование полимерных комплектующих, что значительно увеличивает стоимость выполняемых исследовательских работ. Кроме того, продолжающаяся десорбция СИ из системы возгонки может обуславливать фоновую нагрузку в ходе последующих экспериментов и полностью исключает возможность использования оборудования для создания аэрозолей других токсикантов;
- моделирование у подопытных животных локального поражения бронхолегочной системы вследствие поражения СИ и связанных с ним функциональных нарушений дыхания не представляется возможным в связи с тем, что изоляция голов животных, как предусмотрено в способе-прототипе, не исключает контаминации токсикантом их кожных покровов и слизистых оболочек.
Отмеченные существенные недостатки свидетельствуют о невозможности использования способа-прототипа для моделирования ингаляционного поражения СИ и получения валидных данных больших выборок животных на протяжении длительного периода экспериментальной работы. В ходе анализа уровня техники не выявлены другие способы, позволяющие при использовании в качестве биологических моделей мелких лабораторных животных получить значимую модель ИПСИ, которая отражала бы условия применения токсиканта, приближенные к возможным при чрезвычайных ситуациях (локальные конфликты с использованием СИ с террористическими целями, при техногенных авариях и т.п.), но была бы при этом достаточно безопасной при минимальных уровнях трудовых и материальных затрат.
Таким образом, выявленные недостатки и ограничения существующих моделей ИПСИ указывают на необходимость их совершенствования и модификации, что весьма актуально в настоящее время.
Цель изобретения - разработка способа моделирования ингаляционного поражения СИ, простого в проведении, не требующего использования сложных устройств и приспособлений для доставки токсиканта в бронхолегочную систему, обеспечивающего возможность получения экспериментальной модели функциональных нарушений дыхания, связанных с локальным ингаляционным поражением аэрозолем СИ бронхолегочной системы крыс, достоверно отражающей воздействие на организм животных поражающих факторов СИ, высоковоспроизводимой по исследуемым показателям ФВД у всех животных экспериментальной группы, отличающегося простотой последующей дегазации используемого оборудования.
Указанная цель достигается путем создания и применения способа, позволяющего получить в бронхолегочной системе мелких лабораторных животных, в качестве которых используют крыс массой тела 200±20 г, модели локальных ингаляционных поражений аэрозолем СИ, а именно, модели функциональных нарушений дыхания у отравленных крыс, повторяемых по исследуемым показателям ФВД у всех животных экспериментальной группы.
Введение каждому животному необходимой дозы СИ в виде аэрозоля требуемой дисперсности обеспечивается за счет применения микроспреера MicroSprayer® Aerosolizer (модель IA-1B-R) («Penn-Century Ιnc», США) [7], представляющего собой шприц-систему с зондом, при опорожнении которого давлением руки экспериментатора достигается приведение находящейся внутри жидкости в аэрозольное состояние с дисперсностью, составляющей, согласно гарантиям завода-изготовителя, 30-100 мкм. Зонд вводят подопытному животному, находящемуся в наркотизированном состоянии, в трахею до уровня бифуркации (интратрахеально), после чего выходящий из микроспреера в виде облака аэрозоль СИ достигает дистальных отделов бронхолегочной системы, вызывая там локальное поражение.
При сохранении эффектов, общих со способом-прототипом, в отличие от способа-прототипа, для которого отсутствуют сведения о последовательности действий при получении конкретной модели ингаляционного поражения СИ, в заявляемом способе экспериментально определены условия и отработана последовательность действий для получения модели значимых функциональных нарушений дыхания у отравленных крыс вследствие локального ингаляционного поражения указанным токсикантом дистальных отделов бронхолегочной системы, пригодной для регистрации и изучения изменений количественных показателей ФВД, а именно, для обеспечения максимального эффекта по доставке и распределению токсиканта в дистальных отделах легких опорожнение микроспреера производят при достижении наконечником зонда уровня бифуркации трахеи, и используют раствор СИ в 4%-ном диметилсульфоксиде (ДМСО).
Экспериментально установлен оптимальный объем вводимого раствора токсиканта, который составил 100 мкл на 100 г массы тела крысы. В ходе серии экспериментов установлено, что при интратрахеальном введении токсиканта в объеме более 100 мкл на 100 г массы тела крыс выявляются случаи рефлекторной остановки дыхания и мгновенной гибели, а при снижении объема не обеспечивалось развитие объемной картины поражения бронхолегочной системы и соответствующих функциональных нарушений. Значение в 100 мкл удобно с точки зрения скорости расчета объема токсиканта, исходя из массы тела каждого животного, что важно в эксперименте при отравлении значительного количества животных (например, когда каждое животное имеет различную массу тела в пределах 180-220 г). При реализации заявляемого способа при наборе токсиканта в микроспреер исходят из массы тела каждой участвующей в эксперименте крысы.
В оптимальном объеме вводимого раствора токсиканта поглощенная доза СИ равна 0,8 от средней летальной дозы (ЛД50) и составляет 1,1 мг/кг (при ЛД50 1,37±0,12 мг/кг). Поглощенная доза токсиканта, необходимая для получения модели функциональных нарушений дыхания при реализации заявляемого способа, установлена экспериментально по принципу минимальной достаточности. Так, при поглощенной дозе СИ менее 0,8 ЛД50 значимых изменений ФВД у отравленных крыс в сравнении с интактными не выявляли. При увеличении поглощенной дозы свыше 0,8 ЛД50 наблюдали значимое возрастание количества погибших животных. В случае достижения поглощенной дозы 1,0 ЛД50 к окончанию сроков наблюдения за подопытными животными (10-14 сут) погибало около половины выборки, что вносило значимую статистическую погрешность.
Указанная поглощенная доза (1,1 мг/кг) оптимальна для получения экспериментальной модели, пригодной для регистрации значимых функциональных нарушений дыхания у отравленных крыс и изучения изменения показателей ФВД в сравнении с интактными животными.
Общеизвестно, что дисперсность аэрозоля влияет на глубину проникновения токсиканта в дыхательные пути. Экспериментально установлен фазово-дисперсный состав аэрозоля СИ, который определяли при помощи лазерного анализатора размера частиц TSI 3321 с дилютером TSI 3302А [8]. К ингаляционной камере через специальное отверстие последовательно подключали анализатор размера частиц и дилютер. На следующем этапе подавали аэрозоль СИ в камеру и в течение необходимого времени выполняли измерения. После завершения измерений регистрировали соответствующую характеристику аэрозоля, а именно, выведенное на экран лазерного анализатора значение размера частиц переносили в протоколы эксперимента. Зарегистрированный средний масс-медианный размер аэрозольных частиц раствора СИ в 4%-ном ДМСО, получаемых при использовании микроспреера указанной модели, составил 32,1±2,6 мкм.
Экспериментальным путем выявлено, что именно получаемая дисперсность аэрозоля и введение аэрозоля в трахею достигая ее бифуркации, обеспечиваемые за счет использования микроспреера MicroSprayer® Aerosolizer (модель IA-1B-R), позволяют получить достоверную модель функциональных нарушений дыхания, связанных с ингаляционным поражением, близким к реальному, наблюдаемому в условиях чрезвычайных ситуаций (поступление токсиканта в дистальные отделы легких, аэрозольное состояние токсиканта, развитие типичного угнетения ФВД).
Экспериментально отработаны условия получения достоверной и высоковоспро-изводимой модели функциональных нарушений дыхания при ингаляционном поражении аэрозолем раствора СИ в 4%-ном ДМСО, удобной для наблюдения за функциональными нарушениями дыхания, в том числе угнетением ФВД, на различных сроках наблюдения до 14 сут, включая острейший период от момента введения токсиканта, а также использования в последующем в ходе исследований по изучению действия антидотных средств и средств патогенетической терапии.
Важным существенным отличием заявляемого способа является то, что при его реализации предусмотрено введение определенной (экспериментально установленной) дозы токсиканта, лимитированной массой тела крысы, непосредственно каждой участвующей в эксперименте крысе, в то время как при реализации способа-прототипа речь идет об экспозиционной дозе токсиканта в воздухе, а именно, на местности вокруг крысы. При этом экспериментально установленная поглощенная доза 0,8 ЛД50, составляющая 1,1 мг/кг, сопоставима и даже значимо ниже, чем известная из описания аналога безоперационной интубации [4], что свидетельствует о большей биодоступности токсиканта в случае его использования при реализации заявляемого способа, и как следствие - высокой воспроизводимости получаемой модели.
Возможность достижения цели изобретения показана в представленных примерах, раскрывающих последовательность действий при реализации заявляемого способа, подтверждающих возможность получения у мелких лабораторных животных (крыс) модели функциональных нарушений дыхания, связанных с локальным ингаляционным поражением аэрозолем раствора СИ дистальных отделов бронхолегочной системы, отражающих возможность регистрации возникших вследствие отравления крыс значимых функциональных нарушений дыхания и изучения изменения показателей ФВД на различных сроках наблюдения до 14 сут.
Пример 1. Реализация заявляемого способа получения у мелких лабораторных животных модели функциональных нарушений дыхания, связанных с локальным ингаляционным поражением аэрозолем раствора сернистого иприта бронхолегочной системы.
Реализацию заявляемого способа осуществляют в соответствии с Международными рекомендациями по проведению медико-биологических исследований с использованием животных (1985). Удостоверяем, что протокол исследования соответствовал этическим нормам и принципам биомедицинских исследований, одобрен локальным этическим комитетом ФГБВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ (протокол №217 от 25.12.2018 г.).
При реализации заявляемого способа используют здоровых мелких лабораторных животных (крыс) массой тела 200±20 г. Предварительно, до начала исследования, в течение 14 дней проводят наблюдение за животными в условиях вивария при постоянной температуре 25±2°С, свободном доступе к пище, воде и с ежедневным осмотром (поведение, общее состояние).
За 5 мин до начала реализации заявляемого способа выполняют общую анестезию (наркоз), в составе которой необходим препарат с миорелаксирующим действием, для чего крысам внутримышечно вводят лекарственное средство с подобным составом. В частном конкретном случае анестезию осуществляют путем введения Золетил-100™ (Virbac, Франция) в дозе 15 мг/кг массы тела.
Ингаляционное отравление крыс аэрозолем раствора СИ выполняет один экспериментатор с использованием механического аналога струйного небулайзера - микроспреера MicroSprayer® Aerosolizer (модель IA-1B-R). Через 3-4 мин после введения наркоза экспериментатор фиксирует крысу на металлической трапециевидной решетке спиной кверху так, чтобы грудная клетка была в подвешенном состоянии и беспрепятственно экскурсировала, а верхнюю челюсть удерживает при помощи корнцанга. Далее экспериментатор с помощью ларингоскопа отводит нижнюю челюсть и язык, обеспечивая зрительный контакт с голосовой щелью крысы. Наблюдая за движениями грудной клетки крысы, экспериментатор в момент выдоха заводит наконечник микроспреера в бифуркацию трахеи до упора. Заявляемый способ предусматривает интратрахеальное введение токсиканта, для чего экспериментатор выполняет введение наконечника микроспреера до упора в бифуркацию трахеи, причем выполняет введение микроспреера очень аккуратно. Далее экспериментатор проводит контроль попадания микроспреера по визуальному контролю дыхательных экскурсий при движении поршня микроспреера на себя. Затем экспериментатор выполняет механическое давление на поршень с постоянным по величине усилием до полного опустошения микроспреера. Для достижения требуемой поглощенной дозы СИ (1,1 мг/кг) используют раствор СИ в 4%-ном ДМСО. Объем вводимого раствора СИ лимитирован массой тела подопытного животного и составил 0,1 мл на 100 г (то есть, например, крысе с массой тела 200 г вводят 0,2 мл раствора, с концентрацией СИ 1,1 мг/мл).
После вывода наконечника микроспреера из трахеи экспериментатор выполняет контроль сохранности у крысы дыхательных движений и продолжает наблюдение за ней еще в течение 30-40 мин до полного выхода из наркоза.
Заявляемый способ прост в проведении, а при его реализации используют не дорогостоящий небулайзер с комплексом клапанов и трубок (способ-прототип), а аэрозольную шприц-систему, простую в обращении и сравнительно дешевую (в 5-7 раз для разных изготовителей). Так как при реализации заявляемого способа выполняют интратрахеальное введение аэрозоля раствора СИ в 4%-ном ДМСО через смыкающуюся голосовую щель, обратный его выброс практически исключен, что очень ценно не только из соображений точности дозирования вводимого токсиканта, но и возможности обеспечения безопасности экспериментатора. Используемые при этом приборы максимально просты в конструкции, вследствие чего их просто дегазировать по окончании моделирования, что свидетельствует о возможности их многократного безопасного использования, в том числе и для введения других токсикантов.
Пример 2. Получение модели функциональных нарушений дыхания, связанных с ингаляционным поражением аэрозолем раствора сернистого иприта бронхолегочной системы крысы, с использованием заявляемого способа.
В ходе исследования по доказательству возможности использования заявляемого способа для получения модели функциональных нарушений дыхания, вызванных локальным ингаляционным поражением аэрозолем раствора СИ дистальных отделов бронхолегочной системы, была сформирована группа из 30 подопытных животных, в качестве которых использовали белых беспородных крыс массой тела 200±20 г и возрастом 1,5-2 мес.
За 5 мин до начала реализации заявляемого способа экспериментатор выполняет общую анестезию (наркоз) путем внутримышечного введения в частном конкретном случае Золетил-100™ (Virbac, Франция) в дозе 15 мг/кг массы тела крысы.
В качестве растворителя для СИ используют водный раствор ДМСО (химическое вещество с формулой (СН3)2SO, бесцветная жидкость без запаха со специфическим сладковатым вкусом, биполярный апротонный растворитель). Конечное содержание ДМСО во всех разведениях доводили до 4%. Перед отравлением аэрозолем раствора СИ с поглощенной дозой токсиканта 0,8 от ЛД50, составляющей 1,1 мг/кг, крыс наркотизировали путем введения лекарственного средства Золетил-100™ («Virbac», Франция), представляющего комбинацию тилетамина (анестетик диссоциативного действия) и золазепама (анксиолитик бензодиазепинового ряда), которое обладает быстрой скоростью наступления анестезии и достаточным для проведения интубации временем действия. При этом средство Золетил-100™ минимально подавляет дыхательный центр и обладает хорошим миорелаксирующим эффектом. Подбор дозировки средства Золетил-100™ для наркоза осуществлен по принципу минимальной достаточности достижения необходимых критериев и требуемая доза составила 15 мг/кг. При меньшей дозе не достигался эффект обездвиживания крыс, при большей - появлялись неадекватная миорелаксация и угнетение дыхания.
Для моделирования ингаляционного отравления используют микроспреер MicroSprayer® Aerosolizer (модель IA-1B-R). После наркотизации крыс экспериментатор осуществляет интратрахеальное введение им раствора СИ в 4%-ном ДМСО в объеме 100 мкл на 100 г массы тела крысы с поглощенной дозой СИ 0,8 ЛД50 (1,1 мг/кг).
Экспериментально получена модель функциональных нарушений дыхания, связанных с ингаляционным поражением аэрозолем раствора СИ дистальных отделов бронхолегочной системы мелких лабораторных животных (крыс), которую можно использовать для определения степени тяжести функциональных нарушений дыхания по результатам оценки количественных показателей ФВД, что служит доказательством возможности использования заявляемого способа.
Пример 3. Исследования по оценке функции внешнего дыхания крыс до и после локального ингаляционного поражения их бронхолегочной системы аэрозолем раствора сернистого иприта с использованием заявляемого способа.
В ходе исследования по оценке ФВД отравленных аэрозолем раствора СИ с поглощенной дозой СИ 0,8 ЛД50 (1,1 мг/кг) крыс оценивали количественные показатели, отражающие передвижение воздуха в бронхолегочной системе.
Из подопытных животных были сформированы три группы по 12 особей в каждой: группа интактных крыс, группа контроля растворителя (4%-ного ДМСО), группа крыс, отравленных аэрозолем раствора СИ в 4%-ном ДМСО. Регистрацию параметров ФВД у крыс осуществляли с помощью плетизмографа ecgTUNNEL (Emka Technologies, Франция). Крыс помещали в полиметилметакрилатные пеналы и через 60 с после нормализации показателей начинали регистрацию количественных показателей ФВД и продолжали в течение 3 мин [9]. Регистрировали дыхательный объем (ДО), частоту дыхания (ЧД), минутный объем дыхания (МОД), пиковую скорость вдоха/выдоха (ПСвд, ПСвыд.), время вдоха/выдоха (Твд, Твыд). Исследование количественных показателей ФВД проводили перед интратрахеальным введением аэрозоля раствора СИ, а также через 1, 2, 3, 4, 7, 10, 14 сут после отравления.
Также рассчитывали интегральный показатель бронхоконстрикции (ИПБК) как произведение отношения времени эластического сокращения легких (в течение которого регистрируется дыхательный поток выдоха) к общему времени выдоха минус единица и отношения максимального экспираторного потока к максимальному инспираторному:
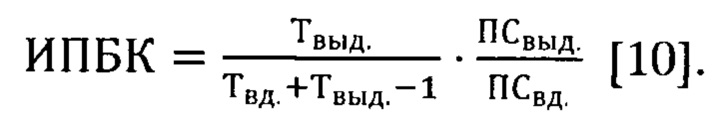
Если дыхательная пауза (Твыд./Твд+Твыд-1) равна по времени нулю, коэффициент соответственно также будет равен нулю, во всех остальных случаях - больше нуля. При наличии повышенного сопротивления в дыхательных путях тот же объем воздуха будет выдыхаться за большее время, поэтому показатель Твыд растет, дыхательная пауза (Твыд/Твд+Твыд-1) и ИПБК также будут возрастать. При повышении сопротивления в дыхательных путях пиковая скорость выдоха будет уменьшаться, что приведет к уменьшению ИПБК.
Сбор, хранение и первичную обработку полученных в ходе исследования данных осуществляли в электронных таблицах Microsoft Office Excel 2010. Статистическую обработку результатов проводили с применением Graphpad Prism 8.0.2. Проверку на нормальность распределения количественных данных осуществляли по критерию нормальности Колмогорова-Смирнова и критерию Шапиро-Уилка путем построения гистограмм нормального распределения. Для оценки различий использовали смешанную модель дисперсионного анализа для случайных и постоянных факторов с применением поправки Гейсера-Гринхауса. Межгрупповые сравнения выполнялись методом Тьюки. Различия в подопытной группе считали значимыми в сравнении с группами интактных животных при p<0,05.
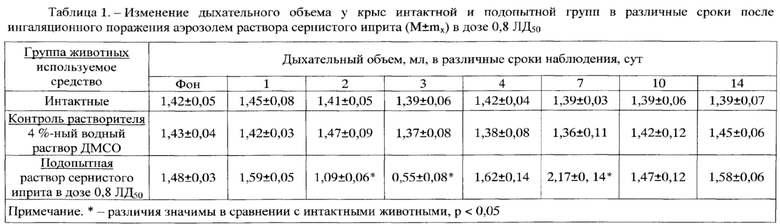
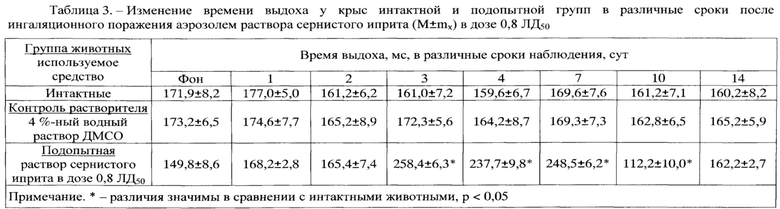
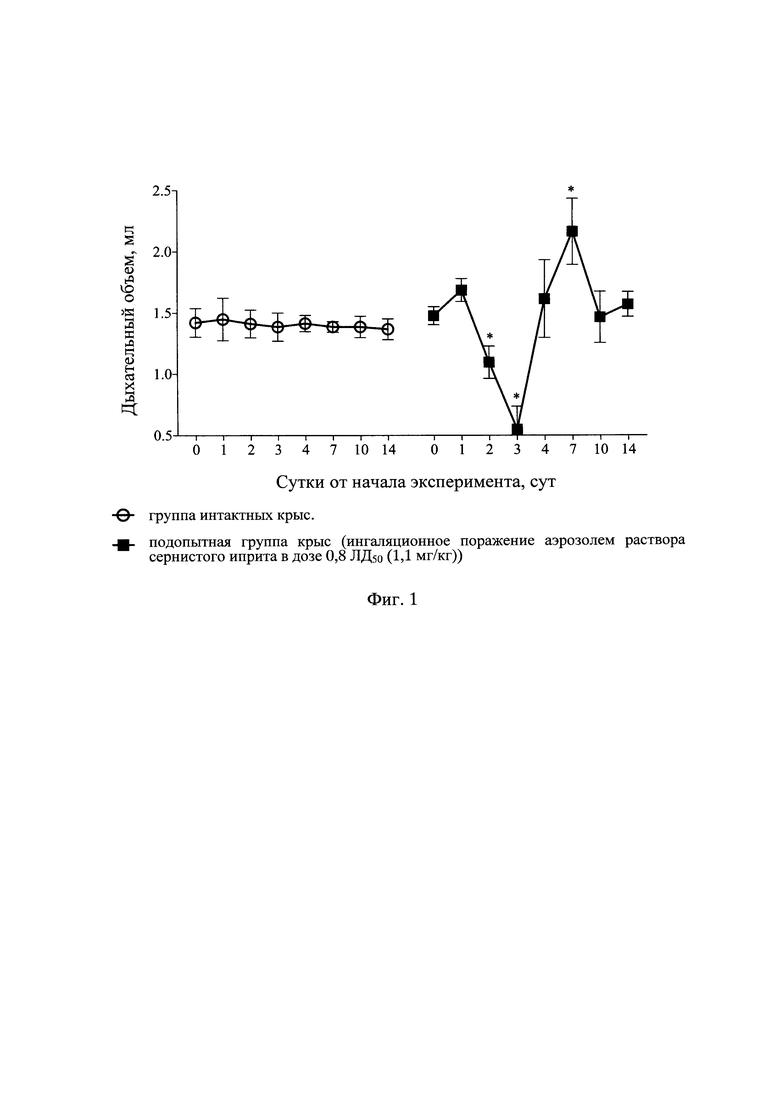
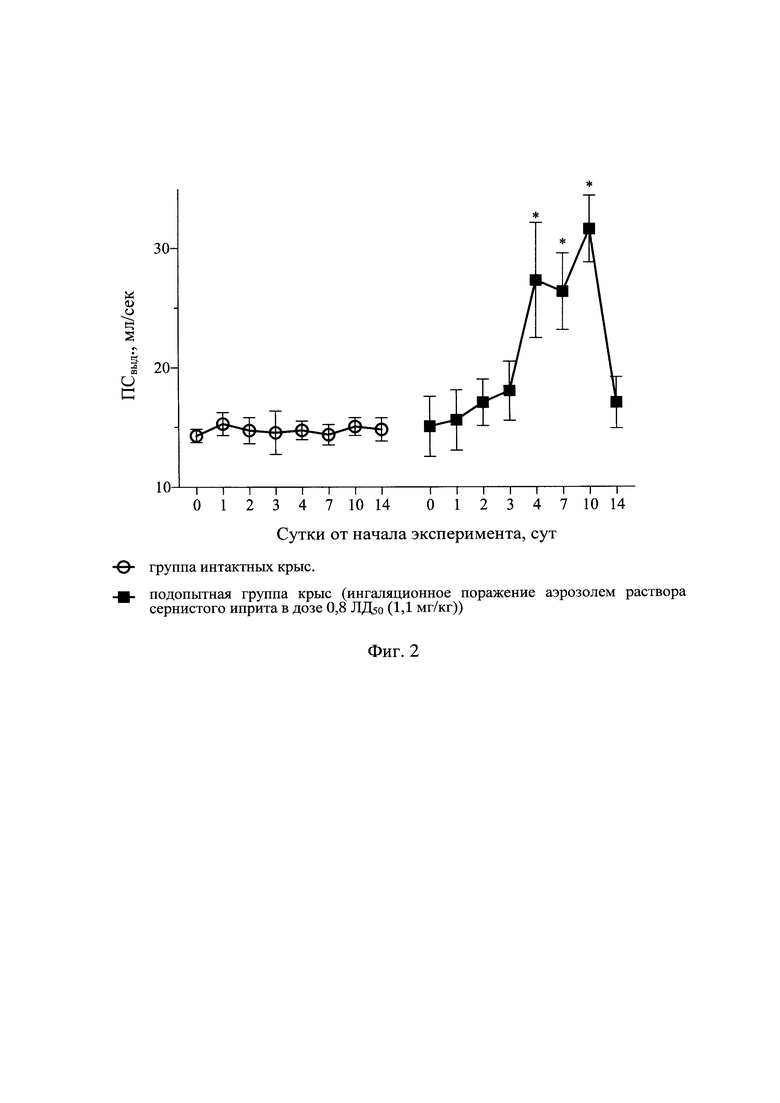
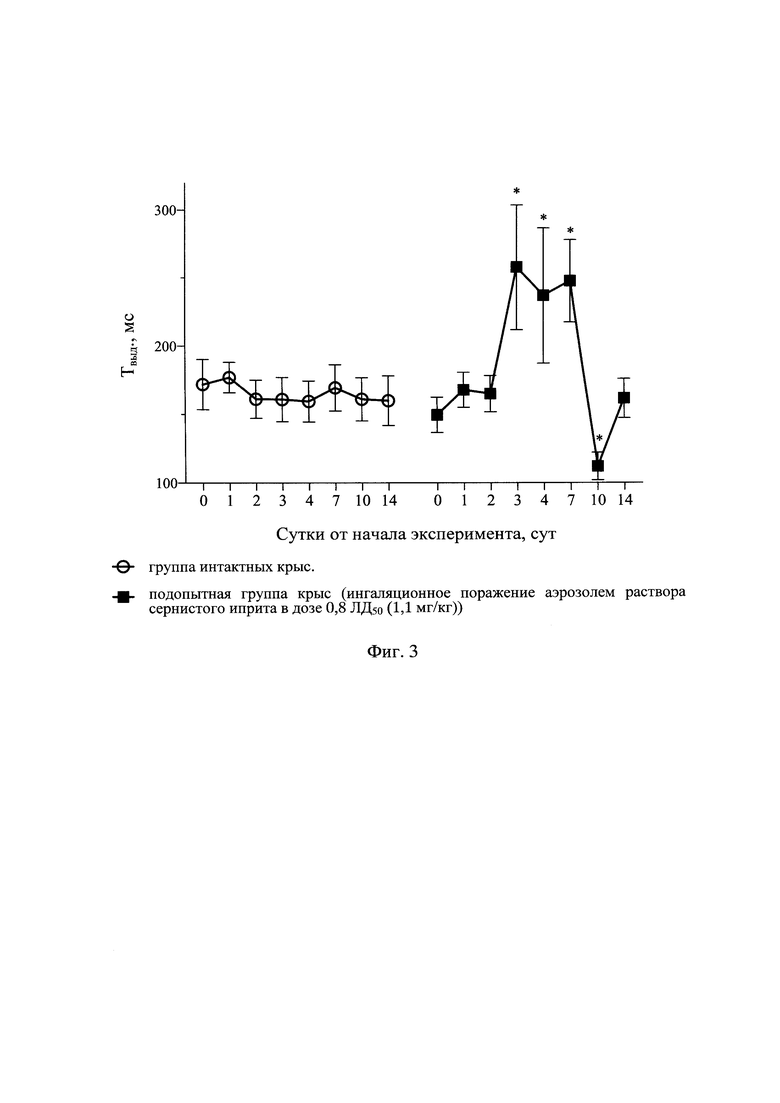
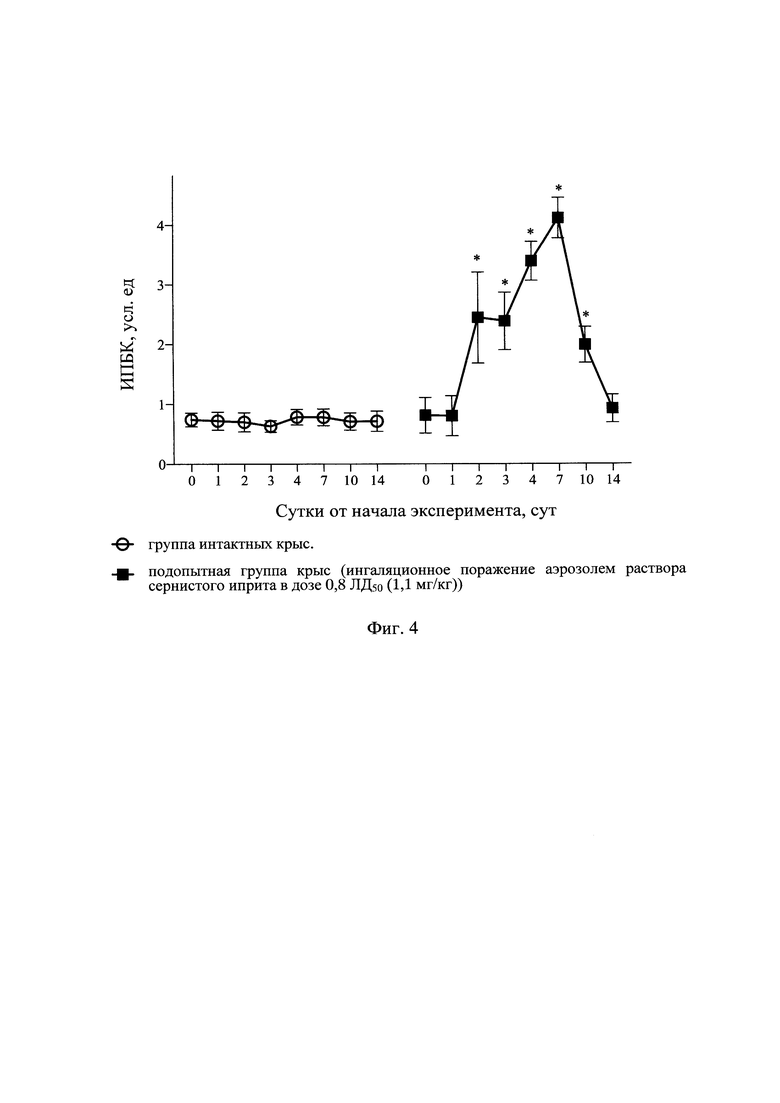
Результаты оценки показателей дыхательного объема легких в различные сроки наблюдения у интактных крыс и крыс после отравления аэрозолем раствора СИ с поглощенной дозой СИ 0,8 ЛД50 (1,1 мг/кг) представлены в табл. 1 и на фиг. 1, динамики ПСвыд - в табл. 2 и на фиг. 2, динамики Твыд. - в табл. 3 и на фиг. 3, динамики интегральных показателей бронхоконстрикции - в табл. 4 и на фиг. 4.
Полученные результаты оценки количественных показателей ФВД позволили определить степень тяжести возникших в результате отравления функциональных нарушений дыхания и оценить вклад в формирование нарушений ФВД примененного для СИ растворителя. Значимых изменений в показателях ФВД в группе контроля растворителя (4%-ный ДМСО) не выявлено. Таким образом, экспериментально доказано, что примененный для СИ растворитель, а именно 4%-ный ДМСО, не вызывает формирование нарушений ФВД у крыс подопытной группы. По этой причине в дальнейшем показатели ФВД у крыс подопытной группы сравнивали с показателями ФВД у крыс интактной группы и фоновыми значениями.
На 2-3 сут от начала эксперимента ДО снижался в подопытной группе на 50-70%, далее увеличивался на 7 сут на 40% и к 10 сут возвращался к фоновым значениям (табл. 1 и фиг. 1). Снижение ДО на 50-70% на 2-3 сут от момента интратрахеального введения раствора токсиканта свидетельствует о формировании тяжелых рестриктивных нарушений в легочной ткани, которые нормализуются к 7-10 сут за счет включения компенсаторных механизмов дыхательной системы.
Помимо показателя рестрикции (ДО), рассмотрены также скоростные показатели ФВД (ПСвыд, Твыд, ИБПК). У отравленных аэрозолем раствора СИ крыс было отмечено увеличение ПСВЫД с 4 по 10 сут на 65-105% в сравнении с исходными значениями и группой интактных крыс, которая возвращалась к фоновым значениям к 14 сут (табл. 2 и фиг. 2). Также выявлено увеличение Твыд с 3 по 7 сут на 65-80% в сравнении с фоновыми значениями, которое нормализовалось к окончанию эксперимента (табл. 3 и фиг. 3). ИБПК с 3 по 10 сут увеличивался в 2-4 раза в сравнении с фоном и группой интактных крыс. К 14 сут ИПБК, как и другие показатели, сравнивался с фоновыми значениями (табл. 4 и фиг. 4). Рост различных скоростных показателей ФВД в разы в сравнении с фоновыми значениями и показателями у крыс интактной группы свидетельствует о формировании тяжелых обструктивных вентиляционных нарушений.
Таким образом, экспериментально доказано, что у всех крыс, отравленных аэрозолем раствора СИ с поглощенной дозой СИ 0,8 ЛД50 (1,1 мг/кг), формировались тяжелые смешанные (обструктивно-рестриктивные) нарушения ФВД. Определение степени тяжести функциональных нарушений дыхания стало возможным на модели, полученной с использованием заявляемого способа.
Полученная модель отличается высокой воспроизводимостью исследуемых количественных показателей ФВД у всех крыс экспериментальных групп на всех сроках наблюдения, а именно, на 1, 2, 3, 4, 7, 10, 14 сут от начала отравления крыс аэрозолем раствора СИ в 4%-ном ДМСО.
Таким образом, заявляемый способ позволяет моделировать функциональные нарушения дыхания, вызванные ингаляционным поражением аэрозолем раствора СИ с установленной экспериментальным путем поглощенной дозой токсиканта (1,1 мг/кг) при использовании аэрозольной шприц-системы, а именно, микроспреера указанной модели. При этом заявляемый способ достаточно прост в исполнении, не требует использования специальных сложных устройств и приспособлений, проведения в специально оборудованных помещениях, практичен, в связи с чем доступен исследовательским группам и имеет перспективы для широкого использования в исследовательских целях.
Экспериментально доказано, что:
-при реализации заявляемого способа на легкие крыс действуют все факторы поражающего действия СИ, как правило, наблюдаемые в предполагаемых условиях чрезвычайных ситуаций (поступление токсиканта в дистальные отделы легких, аэрозольное состояние токсиканта, развитие в организме крыс типичных функциональных нарушений дыхания);
- в заявляемом способе не требуется выполнение сложного пересчета экспозиционной дозы в поглощенную и отсутствуют потери токсиканта при его интратрахеальном введении;
- использование микроспреера MicroSprayer Aerosolizer позволяет обеспечить ингаляционные поражения аэрозолем раствора СИ, вызывающие повторяемые изменения исследуемых количественных показателей ФВД у всех крыс экспериментальной группы на всех сроках наблюдения за ними;
-заявляемый способ не требует больших финансовых затрат, связанных с приобретением сложных ингаляционных установок для возгонки токсиканта в состояния, отличные от жидкого.
Вышесказанное свидетельствует о достижении цели изобретения.
Заявляемое изобретение удовлетворяет критерию «новизна», так как впервые предложен способ, позволяющий путем ингаляционного введения аэрозоля раствора СИ в 4%-ном ДМСО с поглощенной дозой токсиканта 1,1 мг/кг, обеспечиваемого за счет использования микроспреера MicroSprayer® Aerosolizer (модель IA-1B-R), моделировать у мелких лабораторных животных (крыс) характерные функциональные нарушения дыхания, связанные с локальным поражением дистальных отделов бронхолегочной системы, высоковоспроизводимые по исследуемым количественным показателям ФВД у всех крыс экспериментальной группы на всех сроках наблюдения, что весьма актуально в настоящее время и определяет перспективы его широкого использования в исследовательских целях.
Заявляемое изобретение удовлетворяет критерию «изобретательский уровень», так как в известных и доступных источниках информации (из уровня техники), содержащих описания способов моделирования ингаляционных поражений сернистым ипритом, нет сведений (не известны), из которых была бы очевидна возможность достижения положительного эффекта - получения у мелких лабораторных животных (крыс) моделей характерных функциональных нарушений дыхания с воспроизводимыми количественными показателями ФВД, достоверно отражающих воздействие на организм животных всех наиболее значимых факторов действия СИ (поступление в дистальные отделы легких, аэрозольное состояние, развитие типичных функциональных нарушений дыхания), и целесообразность использования микроспреера MicroSprayer® Aerosolizer (модель IA-1B-R) («Penn-Century Ιnc.», США) для интратрахеального введения токсиканта в экспериментально установленной поглощенной дозе.
Соответствие критерию «пригодность для промышленного применения» доказывается результатами выполненных экспериментов, из которых видно, что заявляемый способ достаточно прост в проведении, предусматривает использование для введения аэрозоля раствора СИ вместо сложных и дорогостоящих устройств и приспособлений микроспреера MicroSprayer® Aerosolizer (модель IA-1B-R), обращение с которым достаточно простое и не требует специальных знаний и навыков. Заявляемый способ моделирования практичен, в связи с чем доступен исследовательским группам и имеет перспективы для широкого использования в исследовательских целях при изучении функциональных нарушений дыхания у мелких лабораторных животных (крыс), связанных с поражением дистальных отделов бронхолегочной системы в случаях отравления токсикантом.
Список литературы:
1. Kumar D. Nitrogen mustard exposure of murine skin induces DNA damage, oxidative stress and activation of MAPK/Akt-AP1 pathway leading to induction of inflammatory and proteolytic mediators / D. Kumar [et al.] // Toxicol. Lett. - 2015. Vol. 235. - P. 161-171.
2. Goswami G. Topical nitrogen mustard exposure causes systemic toxic effects in mice / D.G. Goswami [et al.] // Experimental and Toxicologic Pathology. 2015. Vol. 67, №2. - P. 161-170.
3. McClintock S.D Attenuation of half sulfur mustard gas-induced acute lung injury in rats. / S.D. McClintock [et al.]// J. Appl. Toxicol. - 2006. - Vol. 26. - P. 126-131.
4. Yu D. In vitro the differences of inflammatory and oxidative reactions due to sulfur mustard induced acute pulmonary injury underlying intraperitoneal injection and intratracheal instillation in rats. / D. Yu [et al.] // Int. immunopharmacol. 2017. - Vol. 47. - P. 78-87.
5. Anderson D.R. Evaluation of protease inhibitors and an antioxidant for treatment of sulfur mustard-induced toxic lung injury. / D.R. Anderson [et al.] // Toxicology. 2009. - Vol. 263. -P. 41-46.
6. Boskabady M.H. The effect of Nigella sativa alone, and in combination with dexamethasone, on tracheal muscle responsiveness and lung inflammation in sulfur mustard exposed guinea pigs / M.H. Boskabady [et al.] // J. Ethnopharmacol. - 2011.-Vol.137(2). - P. 1028-1034.
7. Sosnowski T.R. Spraying of cell colloids in medical atomizers / T.R. Sosnowski [et al.] // Conference of Italian Association of Chemical Engineering. - 2013. - Vol. 11. - P. 371-378.
8. Harris J.A. Evaluation of the TSI aerosol impactor 3306/3321 system using a redesigned impactor stage with solution and suspension metered-dose inhalers. / J.A. Harris, S.W. Stein, P.B. Mydral // AAPS PharmSciTech. - 2006. - Vol. 7(1). - P. 138-145.
9. Robichaud A. Towards Reproducible Whole Body Plethysmography Outcomes in Mice. / A. Robichaud [et al.] // A68 new techniques, methodologies, and mathematical modeling. - 2019. - P. 2238-2238.
10. Vaickus L. Assessing Pulmonary Pathology by Detailed Examination of Respiratory Function / L. Vaickus [et al.] // Am J Pathol. - 2010. - Vol. 177(4). - P. 1861-1869.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ИНГАЛЯЦИОННОГО ПОРАЖЕНИЯ СЕРНИСТЫМ ИПРИТОМ | 2021 |
|
RU2753128C1 |
| ПРИМЕНЕНИЕ ПЕРФТОРАНА ДЛЯ ЛЕЧЕНИЯ ХИМИЧЕСКИХ ПОРАЖЕНИЙ ЛЕГКИХ | 1999 |
|
RU2169559C2 |
| Бензилпенициллина натриевая соль как средство профилактики и ранней терапии острых поражений сернистым ипритом | 2016 |
|
RU2635504C1 |
| Бициллин-3 как средство профилактики и ранней терапии острых поражений сернистым ипритом | 2016 |
|
RU2629602C1 |
| Бициллин-1 как средство профилактики и ранней терапии острых поражений сернистым ипритом | 2016 |
|
RU2635476C1 |
| АНТИДОТ ОКИСИ УГЛЕРОДА И ГЕПАТОТОКСИЧЕСКИХ ВЕЩЕСТВ | 2015 |
|
RU2584586C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ КОМБИНИРОВАННОГО ВОЗДЕЙСТВИЯ ОБЕДНЕННЫМ УРАНОМ | 2014 |
|
RU2561295C1 |
| АНТИДОТ ОКИСИ УГЛЕРОДА | 2015 |
|
RU2581467C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСТРЫХ ОТРАВЛЕНИЙ ОРГАНОФОСФАТАМИ | 2013 |
|
RU2555764C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИНТОКСИКАЦИИ БЕРИЛЛИЕМ | 2016 |
|
RU2641380C1 |
Изобретение относится к экспериментальной медицине, в частности к военной токсикологии, и может быть использовано в исследовательских целях для моделирования функциональных нарушений дыхания при ингаляционном поражении сернистым ипритом. Для осуществления способа моделирования находящимся под наркозом крысам с массой тела 200±20 г при помощи микроспреера вводят аэрозоль раствора сернистого иприта с дисперсностью 32,1±2,6 мкм в объеме 100 мкл на 100 г массы тела крысы, причем поглощенная доза сернистого иприта составляет 1,1 мг/кг. Для получения раствора сернистый иприт разводят в 4%-ном водном растворе диметилсульфоксида в концентрации 1,1 мг/мл. Вводят аэрозоль раствора сернистого иприта интратрахеально через смыкающуюся голосовую щель, заводят наконечник микроспреера в бифуркацию трахеи до упора. Проводят контроль попадания микроспреера по визуальному контролю дыхательных экскурсий при движении поршня микроспреера на себя. Затем выполняют механическое давление на поршень до полного опустошения микроспреера. Помещают крыс в пеналы из полиметилметакрилата и регистрируют количественные показатели функции внешнего дыхания в течение 3 мин: дыхательный объем, частоту дыхания, минутный объем дыхания, пиковую скорость вдоха/выдоха, время вдоха/выдоха на 1, 2, 3, 4, 7, 10, 14 сутки от начала отравления крыс. Изобретение обеспечивает высоковоспроизводимую, повторяемую по исследуемым показателям функции внешнего дыхания модель локальных ингаляционных поражений, достоверно отражающую воздействие сернистого иприта. 2 з.п. ф-лы, 3 пр., 4 табл., 4 ил.
1. Способ моделирования функциональных нарушений дыхания при ингаляционном поражении сернистым ипритом, включающий отравление находящихся под наркозом мелких лабораторных животных аэрозолем раствора сернистого иприта, отличающийся тем, что используют раствор, полученный при растворении сернистого иприта в 4%-ном водном растворе диметилсульфоксида, с концентрацией сернистого иприта 1,1 мг/мл, вводят раствор сернистого иприта в дистальные отделы бронхолегочной системы каждого участвующего в эксперименте мелкого лабораторного животного - крыс с массой тела 200±20 г - в виде аэрозоля дисперсностью 32,1±2,6 мкм, получают аэрозоль дисперсностью 32,1±2,6 мкм при помощи аэрозольной шприц-системы - микроспреера MicroSprayer® Aerosolizer модели IA-1B-R, причем в шприц микроспреера помещают раствор сернистого иприта в объеме 100 мкл на 100 г массы тела крысы и затем с помощью микроспреера вводят аэрозоль раствора сернистого иприта крысе интратрахеально через смыкающуюся голосовую щель, для чего после введения наркоза фиксируют крысу на металлической трапециевидной решетке спиной кверху так, чтобы грудная клетка была в подвешенном состоянии и беспрепятственно экскурсировала, а верхнюю челюсть удерживают при помощи корнцанга, отводят с помощью ларингоскопа нижнюю челюсть и язык, обеспечивая зрительный контакт с голосовой щелью крысы, наблюдают за движениями грудной клетки крысы и в момент выдоха заводят наконечник микроспреера в бифуркацию трахеи до упора, проводят контроль попадания микроспреера по визуальному контролю дыхательных экскурсий при движении поршня микроспреера на себя, при достижении наконечником микроспреера уровня бифуркации трахеи выполняют механическое давление на поршень до полного опустошения микроспреера, помещают крыс в пеналы из полиметилметакрилата и регистрируют количественные показатели функции внешнего дыхания, отражающие передвижение воздуха в бронхолегочной системе в течение 3 мин: дыхательный объем, частоту дыхания, минутный объем дыхания, пиковую скорость вдоха/выдоха, время вдоха/выдоха на 1, 2, 3, 4, 7, 10, 14 сут от начала отравления крыс аэрозолем раствора сернистого иприта с поглощенной дозой сернистого иприта 1,1 мг/кг массы тела крысы.
2. Способ по п. 1, отличающийся тем, что общую анестезию выполняют внутримышечно препаратом Золетил-100™ в дозе 15 мг/кг массы тела крысы.
3. Способ по п. 1, отличающийся тем, что регистрацию количественных показателей функции внешнего дыхания у крыс осуществляют с помощью плетизмографа ecgTUNNEL производства Emka Technologies, Франция.
| СПОСОБ МОДЕЛИРОВАНИЯ И ФАРМАКОЛОГИЧЕСКОЙ КОРРЕКЦИИ ОСТРОГО ПОВРЕЖДЕНИЯ ЛЕГКИХ В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2541831C2 |
| ШЕФЕР Т.В | |||
| Патогенетические основы медикаментозной коррекции ранних проявлений острого резорбтивного действия ипритов | |||
| Развитие концепции эндотоксикоза / Диссерт | |||
| на соиск | |||
| уч | |||
| степ | |||
| д.м.н., Санкт-Петербург, 2015 | |||
| MCCLINTOCK S.D | |||
| et al | |||
| Attenuation of half sulfur mustard gas-induced acute lung injury in rats / J | |||
| Appl | |||
Авторы
Даты
2021-07-29—Публикация
2021-03-05—Подача