Изобретение относится к области клеточной биологии и биотехнологии, конкретно к биосовместимым биоразлагаемым механически стабильным композиционным материалам на основе сложных полиэфиров, альгината и наночастиц гидроксиапатита с доказанным отсутствием цитотоксичности и острой токсичности. Изобретение может быть использовано в тканевой инженерии в качестве скаффолдов, а именно для посадки на них клеток перед трансплантацией в место дефекта.
Известен биосовместимый биоразлагаемый остеокондуктивный полимерный композиционный материал для регенерации костной ткани (RU 2 708 396 С1) который состоит из матрицы одного из сложного полиэфира алифатической гидроксикислоты (поли-D,L-лактид, поли-L-лактид, поли-ε-капролактон и др.) и наполнителя в количестве 1-20 мас.%, который представляет собой наноцеллюлозу с гидродинамическим диаметром частиц 100-600 нм, модифицированную пептидом и по меньшей мере одной из анионной поли(аминной кислотой). Материал характеризуется как нетоксичный, способный к кальциевому обмену, биоразлагаемый, обладающий спектром механических свойств. Однако, входящая в состав модифицированная наноцеллюлоза, не подвергается биодеструкции в живых тканях человека, поскольку отсутствуют требуемые для этого ферменты, при этом в описании к изобретению не представлены данные об исследованиях возможной отложенной токсичности при высвобождении наноцеллюлозы после полной биодеструкции полимерной матрицы.
Известны биодеградируемые скаффолды на основе тканей из натурального шелка и способ их получения (RU 2 653 428 С1), характеризующиеся ускоренной биодеградацией и получаемые путем пропитки ткани из натурального шелка раствором соли кальция и последующим нанесением по меньше мере одного вещества, способного к адгезии и пролиферации клеток млекопитающего из рассматриваемого перечня. Недостатком получаемых скаффолдов является низкая площадь поверхности, доступной для «посадки» клеток; возможность не полного закрытия альдегидных групп при использовании желатина в качестве вещества, обеспечивающего адгезию и пролиферацию клеток, и глутарового альдегида для сшивки молекул желатина; материал не может применяться для временной фиксации пустот с последующей его заменой клетками организма.
Известен биодеградируемый гидрогель с улучшенными механическими свойствами на основе альгинатной матрицы, наночастиц из со-полимера полимолочной и полигликолевой кислот, покрытых альгинатом, частиц оксида графена, содержащий глуконолактон (CN 108159502 А), характеризующийся большей механической прочностью по сравнению с чистыми гелями альгината и хорошей биосовместимостью. К недостаткам получаемого гидрогеля можно отнести присутствие в составе частиц оксида графена, который не подвергается биодеструкции, при этом в описании к изобретению не представлены данные об исследованиях возможной отложенной токсичности, а также неоднородность свойств (механическая прочность, скорость биодеструкции) по объему каркаса, поскольку имеются существенные различия в свойствах составляющих.
Известен биосовместимый, не цитотоксичный, биодеградируемый пористый скаффолд на основе композиционного материала, содержащего хитозан, гидроксиапатит и амилопектин в соотношениях 1:(0.5-1):(0.5-1), и способ его получения (US 2014/0314824 А1). К недостаткам предложенного скаффолда можно отнести тот факт, что используется гидроксиапатит, выделяемый из костей большеглазова тунца без указания стандартизированных значений характеристик реагента и их разброса.
Известен скаффолд на основе сополимера полимолочной и полигликолевой кислот (ПМГК), с доказанным отсутствием цитотоксичности и обеспечивающий хорошую адгезию клеток (US 2015/0030655 А1). Скаффолд представляет собой пористую матрицу ПМГК, покрытую эластаноподобным синтетическим аналогом внеклеточного матрикса. К недостаткам скаффолда можно отнести возможность неравномерного распределения синтетического аналога внеклеточного матрикса по поверхности трехмерного каркаса (появление незакрытых участков или блокировка доступа в узкие поры), что сокращает полезную площадь для прикрепления и пролиферации клеток.
Известен композитный скаффолд, предназначенный для использования в качестве импланта, на основе коллагена (1.8 г), гидроксиапатита (3.6 г) и микрочастиц ПМГК (от 0 до 0.01 г), содержащих пептид (WO 2014/060443). Коллаген, выделенный из материала крупного рогатого скота и входящий в состав скаффолда, сшивают путем облучения ультрафиолетом при длине волны 365 нм в течение 15 минут. К недостаткам скаффолда можно отнести ограничение по его толщине, поскольку глубина проникновения УФ-лучей ограничена, а также неоднородность свойств по объему. Кроме того, ПМГК частицы, входящие в состав скаффолда в малых концентрациях, выполняют роль системы доставки активного вещества, а не компонента каркаса.
Известен скаффолд на основе альгината, ПМГК и кальций-фосфатного цемента, предназначенный для применения в области тканевой инженерии (Qi X., Ye J., Wang Y. Alginate/poly (lactic-co-glycolic acid)/calcium phosphate cement scaffold with oriented pore structure for bone tissue engineering // Journal of Biomedical Materials Research Part A: An Official Journal of The Society for Biomaterials, The Japanese Society for Biomaterials, and The Australian Society for Biomaterials and the Korean Society for Biomaterials. - 2009. - T. 89. - №. 4. - C. 980-987). Каркас скаффолда является многослойным: верхний слой - ПМГК; внутренний слой - физическая смесь альгината и кальций-фосфатного цемента. Наличие верхнего слоя ПМГК обеспечивает повышение предельной прочности материала при сжатии в 3.6-5.6 раз по сравнению с скаффолдом, состоящим только из альгината и кальций-фосфатного цемента. К недостаткам скаффолда можно отнести тот факт, что со временем, при растворении верхнего слоя, с одной стороны, заметно снизится механическая прочность скаффолда, а с другой стороны, начнут высвобождаться молекулы альгината, которые не были сшиты в единую сеть. Так же в работе не приводятся данные по исследованию цитотоксичности и острой токсичности скаффолда.
Прототипом предлагаемого изобретения являются матриксы на основе сополимера полимолочной и полигликолевой кислот, содержащие агломераты наночастиц ГАП (Гордиенко М.Г. СУШКА МНОГОКОМПОНЕНТНЫХ ХИМИЧЕСКИХ, ФАРМАЦЕВТИЧЕСКИХ И БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ / дис. на соискание степени д.т.н., эл. ресурс: https://www.isuct.ru/activities/dissertation-council/protection/sushka-mnogokomponentnyh-himicheskih-farmacevticheskih-i). Матриксы представляют собой вспененные и отвержденные эмульсиии ПМГК и альгината натрия, стабилизированную наночастицами гидроксиапатита разных форм и размеров, которые одновременно выполняют роль усилителя каркаса матрикса, остаточный растворитель из которых был удавлен вакуумной сублимационной сушкой. Недостатком указанных матриксов является включение в их состав альгината натрия, молекулы которого не сшиты в полимерную сетку, что приводит к их растворению и, как следствие, отсутствию механической стабильности матриксов и его сильном разрушении в течение первых 5 суток после помещения матриксов в физиологический раствор. Высвобождение альгината из матриксов приводит к снижению рН среды, что обуславливает цитотоксичность матриксов (выживаемость клеток не превышала 70% по сравнению с контролем) для клеток ММСК.
Задача обеспечения механической стабильности скаффолда в физиологической среде, отсутствии цитотоксичности и острой токсичности решается заявляемым изобретением -биосовместимым биоразлагаемым скаффолдом на основе полимерного композита, содержащего наночастицы гидроксиапатита.
Заявляемый биосовместимый биоразлагаемый скаффолд на основе полимерного композита, содержащего наночастицы гидроксиапатита, характеризуется следующей совокупностью существенных признаков:
- Биосовместимый и биоразлагаемый скаффолд, отличающийся тем, что он содержит сополимер полимолочной и полигликолевой кислот или поликапролактон (ПКЛ) или их смесь в соотношении 1:1, альгинат, сшитый ионами кальция, и наночистицы гидроксиапатита стержнеобразной формы длиной 150-180 нм, в соотношениях (0.01 г) : (0.18 г) : (0.05÷0.15 г).
- Расширение спектра используемых полимеров позволяет регулировать механические свойства матриксов и скорость их биодеструкции. Сшивка альгината ионами кальция путем выдерживания пористой отвердевшей матрицы, состоящей из альгината натрия, ПМГК или ПКЛ или смеси ПМГК и ПКЛ, путем выдерживания в 5% спиртовом растворе хлорида кальция с одновременной обработкой ультразвуком перед стадией замораживания и вакуумной сублимационной сушкой обеспечивает механическую стабильность получаемых скаффолдов, отсутствие цитотоксичности и острой токсичности.
Составы заявляемых скаффолдов приведены в таблице 1.
Пример 1. Получение биосовместимых биоразлагаемых скаффолдов на основе полимерных композитов, содержащих наночастицы гидроксиапатита
Стадия 1. Формирование наночастиц гидроксиапатита стержнеобразной формы длиной 150-180 нм
Синтез наночастиц гидроксиапатита (ГАП) осуществляли методом контролируемого осаждения в присутствии цитрата натрия. Готовят водный раствор цитрата натрия в концентрации 0.15 М. Добавляют Са(NO3)2 из расчета, чтобы его концентрация составила 1 М. Раствор нагревают до 40°С и вводят при постоянном перемешивании водный 0.06 М раствор Na2HPO4 (скорость перемешивания 350 об/мин; скорость подачи раствора 1 мл/мин) до достижения расчетного соотношения Са/Р=1.67. Уровень рН контролировали в течение всего процесса и поддерживали равным 9.0±0.05 путем капельного ввода 0.1 М раствора NaOH при необходимости. По завершении подачи реакционную смесь оставляли на сутки при непрерывном перемешивании, после чего полученные наночастицы отделяли центрифугированием и многократно промывали дистиллированной водой с последующим отделением на центрифуге. Полученный осадок сушили в муфельной печи при температуре 120°С в течение 1 ч. Конечный продукт представлял собой белый мелкодисперсный порошок.
Стадия 2. Формирование матрицы полимерного композита, содержащего наночастицы гидроксиапатита
В 9 мл воды растворяли альгинат натрия из расчета, чтобы его концентрация составила 2 мас.%, оставляли на 15 мин при температуре 50°С до набухания полимера и перемешивали до достижения однородности получаемого жидкого гидрогеля. Порошок гидроксиапатита массой 0.05 г, 0.1 г или 0.15 г добавляли в гидрогель альгината натрия, тщательно перемешивали и полученную смесь подвергали воздействию УЗ в течение 30 мин для равномерного распределения гидроксиапатита в объеме гидрогеля альгината и дезагрегации наночастиц. Готовили 3 мас.% раствор биосовместимого полимера в хлористом метилене объемом 3 мл. В качестве полимеров были использованы ПМГК, ПКЛ или их смеси ПМГК/ПКЛ, взятые в соотношении 1/1 (таблица 1). Далее готовили дисперсную систему «жидкость - газ», в которой жидкость представляла собой смесь двух несмешивающихся растворов, взятых в равных объемах. При помощи погружного гомогенизатора UltraTurex Т10 начинали вспенивание жидкого гидрогеля альгината натрия и одновременно тонкой струей вливали раствор полимера, приготовленного на стадии 2. Гомогенизацию проводили при 12000 об/мин в течение 1,5 мин. При этом наночастицы гидроксиапатита выполняли роль стабилизатора получаемой сложной дисперсной системы. Полученную дисперсную систему разливали по стеклянным формам требуемого размера и оставляли под вытяжкой на 24 ч для испарения дихлорметана и отверждения полимерного композита, содержащего наночастицы гидроксиапатита.
Стадия 3. Сшивка молекул альгината в матрице полимерного композита, фильтрация, замораживание и вакуумная сублимационная сушка
Полимерные композиты, полученные на стадии 2 погружали 1 час на в 1% спиртовой раствор хлорида кальция для сшивания полимерных цепей альгината с одновременной обработкой ультразвуком. Далее образцы извлекали, промывали не менее 5 раз дистиллированной водой, замораживали при -21°С в течение 24 ч. Замороженный образец подвергали сублимационной сушке для полного удаления растворителей при следующем температурном режиме: 12 ч без нагрева полок, 6 ч при температуре полки +10 С, 6 ч при температуре полки +15 С и 6 ч при температуре полки +20 С.
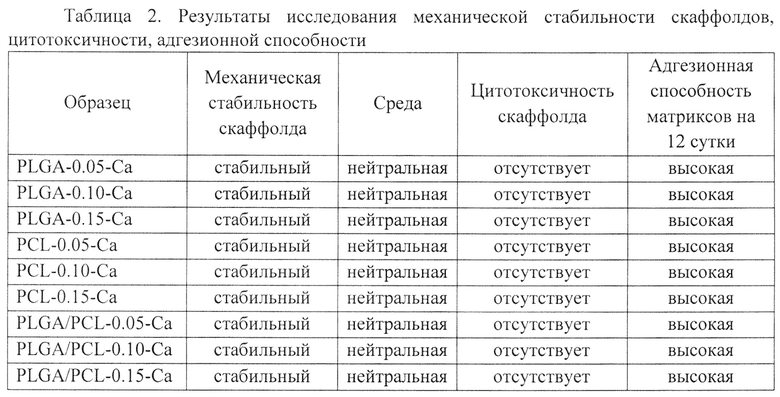
В результате были получены плотные скаффолды белого цвета, имеющие поры в одновременно в двух диапазонах: от 80 до 120 мкм и от 1 до 10 мкм (фиг. 1).
Оценка механической стабильности, цитотоксичности скаффолдов и адгезионной способности
Оценка цитотоксичности скаффолдов проводилась на культуре клеток ММСК слизистой десны человека с одновременной оценкой их механической стабильности. Перед началом эксперимента образцы матриксов стерилизовали облучением УФ, 3 раза промывали фосфатно-солевым буфером и заливали культуральной средой. Образцы оставляли на 8 часов при +4°С. Исследуемые образцы помещали в чашки Петри с монослойной культурой и оставляли на 72 и 120 часов в инкубаторе при 37°С, 5% СО2. По истечении времени отбирали супернатант и переносили в новую чашку Петри для визуальной оценки погибших клеток. Клетки в исследуемых чашках Петри снимали с поверхности чашек и производили подсчет с оценкой жизнеспособности на автоматизированном счетчике Countess (Invitrogen, Korea) по методике производителя.
Для оценки адгезионной способности спустя 120 часов образцы матриксов переносили в новую стерильную чашку Петри с культуральной средой и оставляли в инкубаторе на 7 суток при 37°С, 5% СО2. По истечении времени проводили визуальную оценку и по наличию и числу клеток около образца матрикса делали вывод об адгезионной активности образцов матриксов.
Исследования показали, что все образцы были механически стабильны в период проведения испытаний, не цитотоксичны по отношению к клеткам ММСК слизистой десны и демонстрировали адгезионную активность. Результаты испытаний приведены в таблице 2.
Оценка острой токсичности скаффолдов
Исследование проводилось на половозрелых беспородных белых мышах и крысах Вистар. До начала исследования и в его процессе было обеспечено соблюдение принципов гуманного обращения с подопытными животными. Животных содержали в контролируемых условиях окружающей среды при температуре 18-22°С и относительной влажности воздуха 30-70%. В комнатах содержания животных соблюдался 12 часовой цикл освещения «день-ночь» и 15-ти кратная смена объема воздуха комнаты в час. Для кормления животных применяли стандартный экструдированный корм фирмы ООО «Лабораторкорм» (Россия) и питьевую воду без ограничения.
Были приготовлены экстракты образцов в модельной среде. В качестве модельной среды использовали изотонический раствор натрия хлорида 0.9%.
Каждый исследуемый образец перед экстракцией измеряли, определяли площадь его поверхности и помещали в стеклянную колбу объемом 50 мл, измельчив на кусочки площадью не более 1 см2. В колбу к образцу заливали модельную среду из расчета 1 мл на 3 см2 площади поверхности, вычисленной суммарно с двух сторон образца. Колбу с образцом помещали в суховоздушный термостат при 37°С на 72 ч, ежедневно однократно перемешивая экстрагируемые образцы встряхиванием колб. Указанная температура экстракции была выбрана в связи с тем, что при использовании образцов по назначению предполагается их контакт с культурами клеток, либо с тканями организма теплокровных животных, температура которых близка к 37 С.
После изъятия из термостата колб с экстрактами исследуемых образцов их охлаждали до комнатной температуры, энергично встряхивали в течение 30 секунд и разливали содержимое в сухие стерильные конические пробирки объемом 10 мл. Пробирки с экстрактами центрифугировали при 2000 об/мин в течение 10 минут, после чего надосадочную жидкость переливали в стерильные стеклянные флаконы объемом 10 мл, закрывали резиновыми пробками и обжимали алюминиевыми колпачками. До введения животным образцы экстрактов хранили в холодильнике при 2-4°С.
Острая токсичность экстрактов образцов была изучена при внутрибрюшинном введении мышам и крысам. Экстракт каждого образца вводили пяти самцам и пяти самкам мышей внутрибрюшинно в дозе 40 мл/кг массы тела (1 мл на животное массой 25 г) и пяти самцам крыс внутрибрюшинно в объеме 25 мл/кг (5 мл на животное массой 200 г). Был выбран единый контроль - группы мышей и крыс, равные по численности животных подопытным группам, которым вводили изотонический (физиологический) раствор натрия хлорида 0.9% в тех же объемах, что и экстракты образцов подопытным мышам и крысам.
Период наблюдения за животными составил 14 дней, в течение которых оценивали их клиническое состояние, определяли массу тела (исходную, на 8-е и 14-е сутки эксперимента.
Ввиду отсутствия падежа животных в течение периода наблюдения некропсия была проведена плановом порядке на 15-е сутки после введения экстрактов образцов животным. Патологоанатомическому вскрытию подвергли всех животных подопытных и контрольных групп. Органы грудной и брюшной полостей оценивали визуально макроскопически, дополнительно обращая внимание на возможные морфологические признаки местного раздражающего действия.
При анализе результатов исследования для статистической оценки количественных данных (масса тела) в исследовании была применена описательная статистика: подсчитаны среднее значение и стандартное отклонение, которые представлены в итоговых таблицах. Межгрупповые различия определяли при уровне доверительной вероятности 95% по методу Манна-Уитни.
Для исследования острой токсичности были взяты 3 образца: PLGA-0.10-Ca, PCL-0.10-Са и PLGA/PCL-0.10-Са (таблица 1). В результате наблюдения за подопытными мышами и крысами не было отмечено каких-либо признаков интоксикации у животных или изменения их общего клинического состояния в сравнении с контрольными мышами и крысами, как непосредственно после внутрибрюшинного введения экстрактов образцов PLGA-0.10-Ca, PCL-0.10-Са и PLGA/PCL-0.10-Са в течение первых 4 часов, так и на протяжении последующего периода наблюдения в 14 дней. В течение указанного периода не было отмечено заболевания или падежа мышей и крыс, а также визуально определяемых различий в потреблении воды и корма в подопытных и контрольных группах, животные были активны, поведенческие реакции соответствовали показателям видовых норм.
При анализе показателей массы тела мышей и крыс в течение эксперимента не было установлено статистически значимых различий между подопытными и контрольными животными, при этом динамика привесов была положительной и соответствовала нормальным половозрастным показателям для мышей и крыс (таблица 3).
Ввиду отсутствия падежа мышей и крыс в течение всего периода наблюдения патоморфологическое исследование проводили на 15-й день после внутрибрюшинного введения экстрактов образцов и модельной среды животным.
При патологоанатомическом исследовании самцов и самок мышей при внешнем осмотре и обследовании не было установлено различий между животными, получившими экстракты исследуемых образцов или модельную среду: шерстный покров был гладкий, блестящий, кожа эластичная, подвижная, подкожная клетчатка умеренно выражена, видимые слизистые оболочки бледные, чистые, без изъязвлений и посторонних наложений, патологические выделения из естественных отверстий тела отсутствовали.
При вскрытии грудной и брюшной полостей у всех мышей подопытных и контрольной групп отмечалось анатомически правильное расположение органов, макроскопически различимых признаков патологии внутренних органов не установлено. В месте введения экстрактов образцов - брюшной полости - у подопытных мышей не было обнаружено перитонеального выпота, отека, кровоизлияний, инфильтратов, признаков повреждения брюшины или органов, новообразованной соединительной ткани и других воспалительных и поствоспалительных изменений, равно как и у мышей контрольной группы.
При патологоанатомическом исследовании самцов крыс при внешнем осмотре и обследовании не было установлено различий между животными, получившими экстракты исследуемых образцов или модельную среду: шерстный покров был гладкий, блестящий, кожа эластичная, подвижная, подкожная клетчатка умеренно выражена, видимые слизистые оболочки бледные, чистые, без изъязвлений и посторонних наложений, патологические выделения из естественных отверстий тела отсутствовали.
При вскрытии грудной и брюшной полостей у всех крыс подопытных и контрольной отмечалось анатомически правильное расположение органов, макроскопически различимых признаков патологии внутренних органов не установлено. В месте введения экстрактов образцов №3, 8 и 14 - брюшной полости - у подопытных крыс не было обнаружено перитонеального выпота, отека, кровоизлияний, инфильтратов, признаков повреждения брюшины или органов, новообразованной соединительной ткани и других воспалительных и поствоспалительных изменений, равно как и у крыс контрольной группы.
В результате проведенного исследования не установлено признаков острой токсичности и местного раздражающего действия образцов при внутрибрюшинном введении их водных экстрактов беспородным белым мышам и крысам Вистар.
Таким образом, полученные в результате реализации заявляемого изобретения характеристики скаффолдов на основе полимерного композита, содержащего наночастицы гидроксиапатита указывают на биосовместимость и отсутствие цитотоксичности, острой токсичности. Материалы являются контролируемыми, воспроизводимыми и могут быть стандартизованы.
Заявляемое изобретение предназначено для применения в биотехнологии и медицине в качестве биосовместимых и биоразлагаемых скаффолдов в различных формах (пленках, трехмерных пористых и непористых матриц) для временного замещения пустот и регенерации тканей.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ IN VIVO ОПРЕДЕЛЕНИЯ БИОСОВМЕСТИМОСТИ СКАФФОЛДОВ ДЛЯ НЕЙРОТРАНСПЛАНТАЦИИ | 2021 |
|
RU2812608C2 |
| БИОАКТИВНЫЙ РЕЗОРБИРУЕМЫЙ ПОРИСТЫХ 3D-МАТРИКС ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2533457C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛИЗОВАННЫХ КОМПОЗИТНЫХ МИКРОСКАФФОЛДОВ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2016 |
|
RU2660558C2 |
| БИОСОВМЕСТИМЫЕ ПРОДУКТЫ ДЛЯ ВИЗУАЛИЗАЦИИ МАГНИТНЫХ ЧАСТИЦ | 2009 |
|
RU2496525C2 |
| БИОСОВМЕСТИМЫЙ БИОРАЗЛАГАЕМЫЙ ОСТЕОКОНДУКТИВНЫЙ ПОЛИМЕРНЫЙ КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2018 |
|
RU2708396C1 |
| Способ изготовления in vitro персонифицированного клеточнозаселенного сосудистого протеза | 2021 |
|
RU2764051C1 |
| КОМПОЗИТНЫЕ МАТРИКСЫ НА ОСНОВЕ ФИБРОИНА ШЕЛКА, ЖЕЛАТИНА И ГИДРОКСИАПАТИТА ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2013 |
|
RU2563992C2 |
| ПРИМЕНЕНИЕ ИНДОЦИАНИНА В КАЧЕСТВЕ МАРКЕРА НАНОЧАСТИЦ | 2015 |
|
RU2599488C1 |
| СПОСОБ ОЦЕНКИ БИОСОВМЕСТИМОСТИ СКАФФОЛДОВ | 2014 |
|
RU2571232C1 |
| Регенеративный материал соединительных тканей, способ получения регенеративного материала, применение регенеративного материала, имплантат | 2018 |
|
RU2788658C2 |
Настоящее изобретение относится к области клеточной биологии и биотехнологии и представляет собой биосовместимый и биоразлагаемый скаффолд для временного заполнения пустот и регенерации тканей. Указанный скаффолд содержит сополимер полимолочной и полигликолевой кислот или поликапролактон (ПКЛ) или их смесь в соотношении 1:1, альгинат, сшитый ионами кальция, и наночистицы гидроксиапатита стержнеобразной формы длиной 150-180 нм, в соотношениях (0.01 г) : (0.18 г) : (0.05÷0.15 г). Скаффолд является пористым и имеет поры, лежащие одновременно в двух диапазонах: крупные поры имеют размеры от 80 до 120 мкм; малые поры имеют размеры в диапазоне от 1 до 10 мкм. Биосовместимый и биоразлагаемый скаффолд согласно настоящему изобретению обладает механической стабильностью, а также отсутствием цитотоксичности и острой токсичности. Настоящее изобретение за счёт расширения спектра используемых полимеров позволяет регулировать механические свойства скаффолдов и скорость их биодеструкции. 1 ил., 3 табл., 1 пр.
Биосовместимый и биоразлагаемый скаффолд для временного заполнения пустот и регенерации тканей, отличающийся тем, что он содержит сополимер полимолочной и полигликолевой кислот или поликапролактон (ПКЛ) или их смесь в соотношении 1:1, альгинат, сшитый ионами кальция, и наночистицы гидроксиапатита стержнеобразной формы длиной 150-180 нм, в соотношениях (0.01 г) : (0.18 г) : (0.05÷0.15 г), с доказанными механической стабильностью, отсутствием цитотоксичности и острой токсичности, представляющие собой пористые скаффолды, имеющие поры, лежащие одновременно в двух диапазонах: крупные поры имеют размеры от 80 до 120 мкм; малые поры имеют размеры в диапазоне от 1 до 10 мкм.
| ГОРДИЕНКО М.Г | |||
| Сушка многокомпонентных химических, фармацевтических и биологических материалов, Диссертация доктора технических наук, РХТУ им | |||
| Д.И | |||
| Менделеева, Москва, 2019, 417 с. | |||
| FAN D | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2021-10-01—Публикация
2019-12-30—Подача