ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящая заявка относится к новым композициям связывающих средств и белков-носителей и способам их получения и применения, в частности, в качестве терапевтических средств против злокачественных опухолей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Химиотерапия остается основным элементом системной терапии множества видов злокачественных опухолей, включая меланому. Большинство химиотерапевтических средств только немного селективны в отношении опухолевых клеток, и токсичность в отношении здоровых пролиферирующих клеток может быть высокой (Allen TM. (2002) Cancer 2:750-763), что часто требует снижения дозы и даже прерывания лечения. В теории, одним из путей преодоления трудностей с токсичностью химиотерапии, а также улучшения эффективности лекарственных средств является направление химиотерапевтического лекарственного средства к опухоли с использованием антител, которые специфичны к белкам, селективно экспрессируемым (или сверхэкспрессированным) злокачественными клетками с доставкой направленного лекарственного средства к опухоли, таким образом, изменяя биораспределение химиотерапевтического средства и обеспечивая в результате поступление большего количества лекарственного средства к опухоли и меньшее поражение здоровой ткани. Однако, несмотря на 30 лет исследований, специфической направленности в терапевтической практике добиваются редко.
[0003] Общепринятую опосредуемую антителами химиотерапию (ADC) разрабатывают с использованием токсического средства, связанного с направленным антителом посредством синтетического расщепляемого протеазами линкера. Эффективность такой ADC-терапии зависит от возможности связывания клетки-мишени с антителом, расщепления линкера и захвата токсического средства в клетку-мишень. Schrama, D. et al. (2006) Nature reviews. Drug discovery 5:147-159.
[0004] Направляемая антителами химиотерапия обещает наличие преимуществ относительно общепринятой терапии, так как это обеспечивает комбинации способности к направленному действию, нескольких цитотоксических средств и улучшенных терапевтических характеристик с потенциально меньшей токсичностью. Несмотря на широкие исследования, клинически эффективная направляемая антителами химиотерапия остается труднодостижимой: основные препятствия включают нестабильность линкеров между антителом и химиотерапевтическими лекарственными средствами, сниженную токсичность химиотерапевтического средства для опухоли при связывании с антителом и неспособность конъюгата к связыванию с опухолевыми клетками и вхождению в них. Кроме того, эти терапевтические средства не позволяют контролировать размер конъюгатов антитело-лекарственное средство.
[0005] В данной области остается необходимость в основанных на антителах терапевтических средствах против злокачественных опухолей, которые сохраняют цитотоксическое действие в отношении направленной доставки лекарственных средств с обеспечением надежного и улучшенного противоопухолевого действия по сравнению с терапевтическими средствами на предшествующем уровне техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] По настоящему изобретению описаны наночастицы, которые содержат (a) белок-носитель, (b) необязательно связывающее средство, и (c) паклитаксел, где паклитаксел находится в количестве, меньшем, чем количество, которое обеспечивает терапевтическое действие, и необязательно (d) терапевтическое средство. Определенные аспекты настоящего изобретения частично основаны на идее, что уменьшенное количество паклитаксела, например, по сравнению с количеством в связанных с альбумином наночастицах, таких как абраксан®, облегчает образование комплекса белка-носителя, такого как альбумин, со связывающим средством, таким как антитело, с обеспечением стабильной наночастицы. Эти наночастицы в настоящем документе могут быть указаны как "наночастицы со сниженной токсичностью" (RTP) или комплексы RTP.
[0007] Также в настоящем документе описаны наночастицы, которые содержат (a) белок-носитель, (b) производное паклитаксела, где это производное паклитаксела обладает сниженной по сравнению с паклитакселом токсичностью, и, необязательно, (c) связывающее средство и/или (d) терапевтическое средство.
[0008] Также в настоящем документе описаны композиции наночастиц, и способы получения и использования этих наночастиц.
[0009] В одном из аспектов предоставлена наночастица, содержащая альбумин и производное паклитаксела, где производное паклитаксела является менее токсичным, чем паклитаксел. В одном из вариантов осуществления производное паклитаксела представляет собой продукт Меервейна паклитаксела. В предпочтительном варианте осуществления производное паклитаксела представляет собой 20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол. В одном из вариантов осуществления производное паклитаксела представляет собой баккатин III ((2β,5α,7α,10α,13β)-4,10-диацетокси-1,7,13-тригидрокси-9-оксо-5,20-эпокситакс-11-ен-2-илбензоат). В одном из вариантов осуществления наночастица удерживается в целостности нековалентными связями между альбумином и производным паклитаксела. В одном из вариантов осуществления отношение относительных масс альбумина и производного паклитаксела составляет менее чем приблизительно 10:1. В одном из вариантов осуществления наночастицы не содержат паклитаксела.
[0010] В одном из вариантов осуществления предоставлен комплекс наночастицы, содержащий альбумин и производное паклитаксела и дополнительно содержащий связывающие средства (например, антитела) с антигенсвязывающим доменом. В одном из вариантов осуществления на внешней поверхности комплексов наночастиц расположено определенное количество связывающих средств (например, антител). В определенных вариантах осуществления связывающие средства по существу представляют собой единый слой связывающих средств на всей или части поверхности наночастицы. В одном из вариантов осуществления связывающие средства связаны с белком-носителем посредством нековалентных связей. Предпочтительно, связывающие средства представляют собой антитела.
[0011] В одном из вариантов осуществления комплекс наночастицы дополнительно содержит терапевтическое средство. В одном из вариантов осуществления терапевтическое средство представляет собой абиратерон, бендамустин, бортезомиб, карбоплатин, кабацитаксел, цисплатин, хлорамбуцил, дазатиниб, доцетаксел, доксорубицин, эпирубицин, эрлотиниб, этопозид, эверолимус, гефитиниб, идарубицин, иматиниб, гидроксимочевину, иматиниб, лапатиниб, лейпрорелин, мелфалан, метотрексат, митоксантрон, недаплатин, нилотиниб, оксалиплатин, паклитаксел, пазопаниб, пеметрексед, пикоплатин, ромидепсин, сатраплатин, сорафениб, вемурафениб, сунитиниб, тенипозид, триплатин, винбластин, винорелбин, винкристин или циклофосфамид. В одном из вариантов осуществления терапевтическое средство представляет собой средство, приводимое в таблице 2.
[0012] В одном из аспектов предоставлена композиция наночастиц, содержащая наночастицы или комплексы наночастиц, как описано в настоящем документе.
[0013] В одном из аспектов предоставлена наночастица, содержащая белок-носитель (например, альбумин) и паклитаксел, где паклитаксел находится в количестве, меньшем, чем количество, которое обеспечивает терапевтическое действие. В одном из вариантов осуществления наночастица удерживается в целостности нековалентными связями между белком-носителем и паклитакселом. В одном из аспектов комплекс наночастицы получен посредством комбинирования белка-носителя (например, альбумина) и паклитаксела при отношении относительных масс белка-носителя и паклитаксела большем, чем приблизительно 10:1.
[0014] В одном из вариантов осуществления количество паклитаксела, находящееся в наночастицах (комплексах наночастиц) или композиции наночастиц, составляет количество, большее или равное минимальному количеству, способному обеспечивать стабильность комплексов наночастиц, содержащих белок-носитель (например, альбумин) и паклитаксел. В одном из вариантов осуществления количество паклитаксела, находящееся в наночастицах или композиции наночастиц, составляет количество, большее или равное минимальному количеству, способному обеспечивать аффинность паклитаксела к белку-носителю (например, альбумина). В одном из вариантов осуществления количество паклитаксела, находящееся в наночастицах или композиции наночастиц составляет количество, большее или равное минимальному количеству, способному облегчать формирование комплекса паклитаксела и белка-носителя (например, альбумина).
[0015] Отношение альбумина и паклитаксела в наночастицах или композиции наночастиц предпочтительно составляет менее чем количество, находящееся в абраксане®. Абраксан® содержит 100 мг паклитаксела приблизительно на 900 мг альбумина. В одном из вариантов осуществления отношение масс белка-носителя (например, альбумина) и паклитаксела в композиции наночастиц составляет более чем приблизительно 9:1. В одном из вариантов осуществления отношение масс составляет более чем приблизительно 10:1, или 11:1, или 12:1, или 13:1, или 14:1, или 15:1, или приблизительно 16:1, или приблизительно 17:1, или приблизительно 18:1, или приблизительно 19:1, или приблизительно 20:1, или приблизительно 21:1, или приблизительно 22:1, или приблизительно 23:1, или приблизительно 24:1, или приблизительно 25:1, или приблизительно 26:1, или приблизительно 27:1, или приблизительно 28:1, или приблизительно 29:1, или приблизительно 30:1. В одном из вариантов осуществления отношение масс белка-носителя и паклитаксела в комплексе наночастицы составляет более чем приблизительно 9:1. В одном из вариантов осуществления отношение масс составляет более чем приблизительно 10:1, или 11:1, или 12:1, или 13:1, или 14:1, или 15:1, или приблизительно 16:1, или приблизительно 17:1, или приблизительно 18:1, или приблизительно 19:1, или приблизительно 20:1, или приблизительно 21:1, или приблизительно 22:1, или приблизительно 23:1, или приблизительно 24:1, или приблизительно 25:1, или приблизительно 26:1, или приблизительно 27:1, или приблизительно 28:1, или приблизительно 29:1, или приблизительно 30:1.
[0016] В одном из вариантов осуществления количество паклитаксела составляет количество, большее или равное минимальному количеству, способному обеспечивать стабильность комплексов наночастиц, содержащих белок-носитель (например, альбумин) и паклитаксел, и, необязательно, по меньшей мере одно терапевтическое средство. В одном из вариантов осуществления количество паклитаксела составляет количество, большее или равное минимальному количеству, способному обеспечивать аффинность по меньшей мере одного терапевтического средства к белку-носителю. В одном из вариантов осуществления количество паклитаксела составляет количество, большее или равное минимальному количеству, способному облегчать формирование комплекса по меньшей мере одного терапевтического средства и белка-носителя.
[0017] В любом из вариантов осуществления количество паклитаксела может составлять количество, меньшее чем терапевтическое количество паклитаксела. Другими словами, количество может представлять собой количество, меньшее чем количество, предоставляемое или предлагаемое для обеспечения положительного терапевтического действия, например, такое как химиотерапевтическое количество для эффективного лечения злокачественной опухоли.
[0018] В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет менее чем приблизительно 5 мг/мл. В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет менее чем приблизительно 4,54 мг/мл, или приблизительно 4,16 мг/мл, или приблизительно 3,57 мг/мл, или приблизительно 3,33 мг/мл, или приблизительно 3,12 мг/мл, или приблизительно 2,94 мг/мл, или приблизительно 2,78 мг/мл, или приблизительно 2,63 мг/мл, или приблизительно 2,5 мг/мл, или приблизительно 2,38 мг/мл, или приблизительно 2,27 мг/мл, или приблизительно 2,17 мг/мл, или приблизительно 2,08 мг/мл, или приблизительно 2 мг/мл, или приблизительно 1,92 мг/мл, или приблизительно 1,85 мг/мл, или приблизительно 1,78 мг/мл, или приблизительно 1,72 мг/мл, или приблизительно 1,67 мг/мл.
[0019] Не ограничиваясь какой-либо теорией, полагают, что связывание с белком-носителем, например, комплексообразование связывающего средства с белком-носителем, происходит посредством связывающего альбумин мотива на связывающем средстве и/или связывающего антитело мотива на белке-носителе. В одном из вариантов осуществления связывающее средство содержит связывающий альбумин мотив. В одном из вариантов осуществления белок-носитель содержит связывающий антитело мотив. Неограничивающие примеры связывающих антитела мотивов можно найти в заявке PCT № PCT/US2017/045643, зарегистрированной 4 августа 2017 года, полностью включенной в настоящий документ в качестве ссылки. В определенных вариантах осуществления связывающее средство представляет собой нетерапевтическое и неэндогенное антитело человека, слитый белок, например, слияние Fc-домена антитела с пептидом, который связывает антиген-мишень, или аптамер.
[0020] В одном из вариантов осуществления связывающее средство содержит антигенсвязывающий домен. В одном из вариантов осуществления антиген представляет собой CD3, CD19, CD20, CD38, CD30, CD33, CD52, PD-1, PD-L1, PD-L2, CTLA-4, RANK-L, GD-2, Ly6E, HER3, EGFR, DAF, рецептор ERBB-3, CSF-1R, HER2, STEAP1, CD3, CEA, CD40, OX40, Ang2-VEGF или VEGF.
[0021] В одном из вариантов осуществления связывающее средство представляет собой антитело, выбранное из адо-трастузумаба эмтанзина, алемтузумаба, атезолизумаба, бевацизумаб, цетуксимаб, денозумаба, динутоксимаба, ипилимумаба, ниволумаба, обинутузумаб, офатумумаба, панитумумаба, пембролизумаба, пертузумаба, ритуксимаба, рамуцирумаба, авелумаба или дурвалумаба, пидилизумаба, BMS 936559, OKT3 и трастузумаба.
[0022] Изобретение дополнительно включает лиофилизированные наночастицы и композиции наночастиц и лиофилизированные наночастицы и композиции, свойства которых по существу не отличаются или являются такими же, как свойства только что полученных наночастиц. В частности, лиофилизированная композиция, после ресуспедирования в водном растворе, является сходной или идентичной с только что полученной композицией относительно размера частиц, распределения размера частиц, токсичности для злокачественных клеток, аффинности связывающего средства и специфичности связывающего средства. Неожиданно лиофилизированные наночастицы после ресуспендирования сохраняют свойства только что полученных наночастиц, несмотря на присутствие в этих частицах двух различных белковых компонентов. В одном из вариантов осуществления лиофилизированная композиция стабильна при комнатной температуре в течение по меньшей мере приблизительно 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев или больше. В одном из вариантов осуществления лиофилизированная композиция стабильна при комнатной температуре в течение по меньшей мере 3 месяцев. В одном из вариантов осуществления восстановленные наночастицы сохраняют активность терапевтического средства и способны к связыванию с мишенью in vivo.
[0023] В определенных вариантах осуществления по меньшей мере одно терапевтическое средство находится внутри наночастицы. В других вариантах осуществления по меньшей мере одно терапевтическое средство находится на внешней поверхности наночастицы. В других вариантах осуществления по меньшей мере одно терапевтическое средство находится и внутри наночастицы, и на внешней поверхности наночастицы.
[0024] В определенных вариантах осуществления наночастица содержит более чем один вид терапевтического средства. Например, лекарственные средства с таксаном и платиной, например, паклитаксел и цисплатин.
[0025] В определенных вариантах осуществления наночастица дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство, которое не является паклитакселом. В определенных вариантах осуществления по меньшей мере одно терапевтическое средство представляет собой абиратерон, бендамустин, бортезомиб, карбоплатин, кабацитаксел, цисплатин, хлорамбуцил, дазатиниб, доцетаксел, доксорубицин, эпирубицин, эрлотиниб, этопозид, эверолимус, гефитиниб, идарубицин, иматиниб, гидроксимочевина, иматиниб, лапатиниб, лейпрорелин, мелфалан, метотрексат, митоксантрон, недаплатин, нилотиниб, оксалиплатин, пазопаниб, пеметрексед, пикоплатин, ромидепсин, сатраплатин, сорафениб, вемурафениб, сунитиниб, тенипозид, триплатин, винбластин, винорелбин, винкристин или циклофосфамид.
[0026] В определенных вариантах осуществления связывающие средства, белок-носитель и/или, когда присутствует, терапевтическое средство, связаны нековалентными связями.
[0027] В определенных вариантах осуществления белок-носитель выбран из группы, состоящей из желатина, эластина, глиадина, легумина, зеина, соевого белка, молочного белка и сывороточного белка. В предпочтительных вариантах осуществления белок-носитель представляет собой альбумин, например, сывороточный альбумин человека.
[0028] В определенных вариантах осуществления композицию формулируют для внутривенной доставки. В других вариантах осуществления композицию формулируют для прямой инъекции или перфузии в опухоль.
[0029] В определенных вариантах осуществления константа диссоциации наночастиц составляет приблизительно от 1 × 10-11 M и приблизительно 1 × 10-9M.
[0030] В одном из вариантов осуществления в настоящем документе предоставлены способы получения композиции наночастиц, где указанный способ включает приведение белка-носителя и паклитаксела и по меньшей мере одного терапевтического средства в контакт в условиях и отношениях компонентов, которые обеспечивают формирование требуемых наночастиц.
[0031] В определенных аспектах в настоящем документе предоставлены способы формирования наночастиц альбумина-производного паклитаксела или альбумина-паклитаксела, где способ включает: гомогенизацию альбумина с производным паклитаксела или паклитакселом в растворе при высоком давлениис получением наночастиц альбумина-производного паклитаксела или альбумина-паклитаксела.
[0032] В определенных аспектах в настоящем документе предоставлены способы получения композиции наночастиц, где указанные способы включают приведение белка-носителя, паклитаксела и/или терапевтического средства в контакт со связывающими средствами в растворе с pH от 5,0 до 7,5 и температурой приблизительно от 5°C до приблизительно 60°C, приблизительно от 23°C до приблизительно 60°C или приблизительно от 55°C до приблизительно 60°C в условиях и отношениях компонентов, которые обеспечивают формирование требуемых наночастиц. В одном из вариантов осуществления наночастицы получают в условиях от 55°C до 60°C и pH 7,0. В другом аспекте в настоящем документе предоставлены способы получения композиций наночастиц, где указанный способ включает (a) приведение белка-носителя, паклитаксела и терапевтического средства в контакт с формированием сердцевины и (b) необязательно приведение сердцевины в контакт с антителами в растворе с pH приблизительно от 5,0 до приблизительно 7,5 при температуре приблизительно от 5°C до приблизительно 60°C, приблизительно от 23°C до приблизительно 60°C или приблизительно от 55°C до приблизительно 60°C в условиях и отношениях компонентов, которые обеспечивают формирование требуемых наночастиц.
[0033] В определенных аспектах с белком-носителем также можно добавлять определенное количество терапевтического средства (например, терапевтического средства, которое не является паклитакселом).
[0034] В дополнительных вариантах осуществления наночастицы получают как указано выше, а затем лиофилизируют.
[0035] В другом аспекте в настоящем документе предоставлены способы лечения злокачественных клеток, где способ включает приведение клеток в контакт с эффективным количеством композиции наночастиц, описываемой в настоящем документе, с лечением злокачественных клеток.
[0036] В одном из вариантов осуществления предоставлен способ уничтожения злокачественных клеток в популяции злокачественных клеток, где способ включает приведение клеток в контакт с эффективным количеством композиции наночастиц, где указанная композиция находится в контакте с указанными клетками в течение периода времени достаточного для уничтожения злокачественных клеток, где указанная композиция наночастиц содержит комплексы наночастиц, где каждая из наночастиц, содержит альбумин и паклитаксел, где паклитаксел находится в количестве, меньшем, чем количество, которое обеспечивает терапевтическое действие.
[0037] В одном из вариантов осуществления предоставлен способ лечения злокачественной опухоли у нуждающегося в этом пациента, где способ включает введение пациенту композиции наночастиц, содержащей комплексы наночастиц, где каждая из наночастиц, содержит альбумин и паклитаксел, где паклитаксел находится в количестве, меньшем, чем количество, которое обеспечивает терапевтическое действие.
[0038] В другом аспекте в настоящем документе предоставлены способы лечения опухоли у нуждающегося в этом пациента, где способ включает приведение клетки в контакт с эффективным количеством композиции наночастиц, описываемой в настоящем документе, с лечением опухоли. В определенных вариантах осуществления размер опухоли уменьшается. В других вариантах осуществления композицию наночастиц вводят внутривенно. В других вариантах осуществления композицию наночастиц вводят посредством прямой инъекции или перфузии в опухоль.
[0039] В определенных вариантах осуществления способы, предоставляемые по настоящему документу, включают этапы: a) введения композиции наночастиц один раз в неделю в течение трех недель; b) прекращения введения композиции наночастиц в течение одной недели и c) повторения этапов a) и b) по мере необходимости для лечения опухоли.
[0040] В определенных вариантах осуществления терапевтически эффективное количество содержит приблизительно от 75 мг/м2 до приблизительно 175 мг/м2 белка-носителя (т.е., миллиграммов белка-носителя на м2 пациента). В других вариантах осуществления количество паклитаксела составляет менее чем приблизительно 75 мг/м2, например, от 5 мг/м2 до 75 мг/м2. В других вариантах осуществления количество паклитаксела составляет менее чем терапевтически эффективное количество. В определенных вариантах осуществления терапевтическое средство находится в терапевтически эффективном количестве. В определенных вариантах осуществления терапевтически эффективное количество составляет приблизительно от 30 мг/м2 до приблизительно 70 мг/м2 связывающего средства. В других вариантах осуществления терапевтически эффективное количество составляет приблизительно от 30 мг/м2 до приблизительно 70 мг/м2 бевацизумаба.
[0041] Один из вариантов осуществления изобретения относится к способу увеличения длительности захвата опухолью химиотерапевтического средства посредством введения химиотерапевтического средства в наночастицах, содержащих белок-носитель и химиотерапевтическое средство с образованием на поверхности комплексов с антителом, например, с антителом, которое специфически связывается с антигеном на опухоли или выделяемым опухолью.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0042] Приводимые ниже фигуры являются исключительно описанием изобретения и не предназначены для ограничения. Для согласованности, для наночастиц по настоящему изобретению с использованием абраксана® и бевацизумаба используют аббревиатуру "AB", а число после AB, например, AB160, предназначено для обозначения среднего размера этих наночастиц (в нанометрах). Подобным образом, когда связывающее средство представляет собой ритуксимаб, аббревиатура представляет собой "AR", при этом число после нее остается таким же.
[0043] На фиг. 1 представлена реакция паклитаксела с реагентом Меервейна с формированием продукта Меервейна паклитаксела (20-ацетокси-4-деацетил-5-эпи-20,O-секотаксола).
[0044] На фиг. 2A-2E представлен диаметр нетоксических наночастицы (NTP) отдельно (фиг. 2A) или инкубированных с 4 мг/мл (фиг. 2B), 6 мг/мл (FIG 2C), 8 мг/мл (фиг. 2D) или 10 мг/мл (фиг. 2E) бевацизумаба в течение 30 мин. Диаметр измеряли с разведением 1:300 с использованием технологии Malvern Nanosight.
[0045] На фиг. 3A и 3B представлена аффинность связывания (Kd) бевацизумаба (фиг. 3A) или ритуксимаба (фиг. 3B) с NTP. Kd измеряли с использованием технологии интерферометрии Bio Layer.
[0046] На фиг. 4A представлена стабильность комплексов наночастиц в PBS. На фиг. 4B представлена стабильность комплексов наночастиц в сыворотке.
[0047] На фиг. 5A-5E представлено блокирование CD20-позитивных клеток Дауди изотипическим контролем (фиг. 5A), антителом к CD20 (фиг. 5B), абраксаном® (фиг. 5C), AR160 (фиг. 5D), NTP (фиг. 5E), связанными с ритуксимабом NTP (NTRit; фиг. 5F) или только ритуксимабом (фиг. 5G).
ПОДРОБНОЕ ОПИСАНИЕ
[0048] После чтения этого описания специалисту в данной области будет понятно, как осуществлять изобретение в различных альтернативных вариантах осуществления и альтернативных приложениях. Однако в настоящем документе не описаны все различные варианты осуществления настоящего изобретения. Следует понимать, что предоставляемые по настоящему документы варианты осуществления предоставлены только в качестве примера, а не ограничения. По существу, настоящее подробное описание различных альтернативных вариантов осуществления не следует рассматривать, как ограничивающее область или объем настоящего изобретения, как указано ниже.
[0049] Перед раскрытием и описанием настоящего изобретения следует понимать, что аспекты, описанные ниже, не ограничены конкретными композициями, способы получения таких композиций или их применения по существу, конечно, могут варьировать. Также следует понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных аспектов и не предназначена для ограничения.
[0050] Подробное описание изобретения разделено на различные разделы только для удобства читателя, и описание, находящееся в любом из разделов, можно комбинировать с описанием в любом другом разделе. Для удобства читателя в описании могут быть использованы заголовки или подзаголовки, которые не предназначены для влияния на объем по настоящему изобретению.
Определения
[0051] Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, как обычно понимают специалисты в области, к которой принадлежит настоящее изобретение. В этом описании и в приводимой ниже формуле изобретения, приведены указания на ряд терминов, которые должны иметь следующие значения:
[0052] Терминология, используемая в настоящем документе, предназначена только для целей описания конкретных вариантов осуществления и не предназначена для ограничения изобретения. Как используют в настоящем документе, формы единственного числа также предназначены для включения форм множественного числа, если из контекста явно не следует иначе.
[0053] "Необязательный" или "необязательно" означает, что описываемые затем событие или условия может произойти или нет, и что описание включает случаи, когда событие или условия происходят, и случаи, когда они не происходят.
[0054] Термин "приблизительно", когда его используют до числового обозначения, например, перед температурой, временем, количеством, концентрацией и тому подобное, включая диапазоны, означает приближения, которые могут варьировать на (+) или (-) 10%, 5%, 1% или любой поддиапазон или подзначение между ними. Предпочтительно, термин "приблизительно", когда его используют в отношении количества дозы, означает, что доза может варьировать на +/- 10%. Например, "приблизительно от 400 до приблизительно 800 связывающих средств" означает, что внешняя поверхность наночастиц содержит связывающее средство в количестве от 360 до 880 частиц.
[0055] "Содержащий" или "содержит" предназначен для обозначения того, что композиции и способы включают перечисленные элементы, не исключают других. "По существу состоит из", когда его используют для определения композиций и способов, означает исключение других элементов с любым существенным значением для комбинации для указанной цели. Таким образом, композиция, по существу состоящая из элементов, как определено в настоящем документе, не исключает других материалов или этапов, которые существенно не влияют на основные и новые характеристики описываемого в заявке изобретения. "Состоящий из" обозначает исключение большего, чем следовые элементы других ингредиентов и существенных этапов способа. Варианты осуществления, определяемые любым из этих переходных терминов, находятся в объеме настоящего изобретения.
[0056] Как используют в настоящем документе, термин "наночастица" относится к частицам по меньшей мере с одним размером, составляющем менее 5 микрон. В предпочтительных вариантах осуществления, например, для внутривенного введения, наночастица составляет менее 1 микрона. Наночастица для прямого введения имеет большие размеры. По настоящему изобретению явно предусмотрены частицы даже больших размеров.
[0057] Во множестве частиц размеры отдельных частиц распределены вокруг среднего. Таким образом, размеры частиц для множества можно представить посредством среднего, а также посредством процентилей. D50 представляет собой размер частиц, меньше которого находится размер 50% всех частиц. Меньше значения D10 находятся 10% частиц, и размер 90% частиц меньше, чем D90. Когда существуют сомнения, "средний" размер эквивалентен D50. Таким образом, например, AB160 и AR160 относятся к наночастицам со средним размером 160 нанометров.
[0058] Также термин "наночастица" может включать дискретные мультимеры более мелких наночастиц. Таким образом, для наночастиц 160 нм, мультимеры могут составлять приблизительно 320 нм, 480 нм, 640 нм, 800 нм, 960 нм, 1120 нм и т.д.
[0059] Как используют в настоящем документе, термин "белок-носитель" относится к белкам, которые функционируют, транспортируя связывающие средства и/или терапевтические средства. Связывающие средства по настоящему изобретению могут обратимо связываться с белками-носителями. Примеры белков-носителей более подробно описаны ниже.
[0060] Как используют в настоящем документе, термин "сердцевина" относится к центральной или внутренней части наночастицы, которая может состоять из белка-носителя, белка-носителя и терапевтического средства или других средств или комбинации средств. В определенных вариантах осуществления с сердцевиной может быть ассоциирован связывающий альбумин мотив связывающего средства.
[0061] Как используют в настоящем документе, термин "терапевтическое средство" означает средство, которое является терапевтически пригодным, например, средство для лечения, осуществления ремиссии или ослабления болезненного состояния, физиологического состояния, симптомов или этиологических факторов, или для их оценки или диагностики. Терапевтическое средство может представлять собой химиотерапевтическое средство, например, ингибиторы митоза, ингибиторы топоизомеразы, стероиды, противоопухолевые антибиотики, антиметаболиты, алкилирующие средства, ферменты, ингибиторы протеосом или любое их сочетание.
[0062] Как используют в настоящем документе, термин, "связывающее средство", "связывающее средство, специфичное к" или "связывающее средство, которое специфически связывается" относится к средству, которое связывается с антигеном-мишенью и не значимым образом не связывается с посторонними соединениями. Примеры связывающих средств, которые можно эффективно использовать в описываемых способах, в качестве неограничивающих примеров включают лектины, белки и антитела, такие как моноклональные антитела, например, гуманизированные моноклональные антитела, химерные антитела или поликлональные антитела или их антигенсвязывающие фрагменты, а также аптамеры, слитые белки и аптамеры, содержащие связывающий альбумин мотив или слитые с ним. В одном из вариантов осуществления связывающее средство представляет собой экзогенное антитело. Экзогенное антитело представляет собой антитело, не синтезируемое в природе у млекопитающего, например, у человека, иммунной системой млекопитающего.
[0063] Как используют в настоящем документе, термин "антитело" или "антитела" относится к молекулам иммуноглобулинов и иммунологически активным частям молекул иммуноглобулинов (т.е., к молекулам, содержащим антигенсвязывающий участок, который иммуноспецифически связывает антиген). Термин также относится к антителам, содержащим две тяжелых цепи иммуноглобулинов и две легких цепи иммуноглобулинов, а также к множеству форм, включая полноразмерные антитела и их части; включая, например, молекулу иммуноглобулина, моноклональное антитело, химерное антитело, антитело с привитой CDR, гуманизированное антитело, Fab, Fab', F(ab')2, Fv, связанный дисульфидами Fv, scFv, однодоменное антитело (dAb), диатело, полиспецифическое антитело, антитело с двойной специфичностью, антиидиотипическое антитело, биспецифическое антитело, его функционально-активный эпитопсвязывающий фрагмент, бифункциональные гибридные антитела (например, Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)) и одиночные цепи (например, Huston et al., Proc. Natl. Acad. Sci. USA., 85, 5879-5883 (1988) и Bird et al., Science 242, 423-426 (1988), которые включены в настоящий документ в качестве ссылки). (в общих чертах cм., Hood et al., Immunology, Benjamin, N.Y., 2ND ed. (1984); Harlow and Lane, Antibodies. A Laboratory Manual, Cold Spring Harbor Laboratory (1988); Hunkapiller and Hood, Nature, 323, 15-16 (1986), которые включены в настоящий документ в качестве ссылки). Антитело может представлять собой антитело любого класса (например, IgG, IgA, IgM, IgE или IgD). Предпочтительно, антитело представляет собой IgG. Антитело может представлять собой не принадлежащее человеку антитело (например, мыши, козы или другого животного), являться полностью человеческим, гуманизированным или химерным. Антитело или антитела включают любой биоаналог(и) антител, описываемых в настоящем документе. Как используют в настоящем документе, биоаналоги относятся к биофармацевтическим средствам, которые считают сравнимыми по качеству, безопасности и эффективности с эталонным продуктом, продаваемым компанией-инноватором (Section 351(i) of the Public Health Service Act (42 U.S.C. 262(i)).
[0064] Термин "константа диссоциации", также обозначаемый как "Kd", относится к количественному выражению степени, до которой конкретное вещество разделяется на отдельные компоненты (например, белок-носитель, антитело и терапевтическое средство).
[0065] Как используют в настоящем документе, термины "лиофилизированный", "лиофилизация" и т.п. относятся к процессу, посредством которого материал для сушки (например, наночастицы) сперва замораживают, а затем лед или замороженный растворитель удаляют посредством испарения в среде с пониженным давлением. Для увеличения стабильности лиофилизированного продукта при хранении в составы перед лиофилизацией необязательно включают эксципиент. В определенных вариантах осуществления до применения в качестве терапевтического препарата из лиофилизированных компонентов (белок-носитель, паклитаксел и, необязательно, антитело и/или терапевтическое средство) можно формировать наночастицы. В других вариантах осуществления для облегчения формирования стабильных наночастиц сначала комбинируют белок-носитель и паклитаксел и, необязательно, связывающее средство, например, антитело и/или терапевтическое средство, а затем лиофилизируют. Лиофилизированный образец может дополнительно содержать дополнительные эксципиенты.
[0066] Термин "наполнители" включает средства, которые обеспечивают структуру лиофилизированного продукта. Общие примеры, используемые для наполнителей, включают маннит, глицин, лактозу и сахарозу. В дополнение к обеспечению фармацевтически пригодной формы, наполнители также могут придавать полезные свойства в отношении изменения температуры разрушения, обеспечения защиты от замораживания-оттаивания и увеличения стабильности белков при длительном хранении. Эти средства также могут служить в качестве модификаторов тоничности. В определенных вариантах осуществления лиофилизированные композиции, описываемые в настоящем документе, содержат наполнители. В определенных вариантах осуществления лиофилизированные композиции, описываемые в настоящем документе, не содержат наполнителей.
[0067] Термин "буфер" включает средства, которые поддерживают pH раствора перед лиофилизацией в приемлемом диапазоне и могут включать сукцинат (натрия или калия), гистидин, фосфат (натрия или калий), Tris (трис(гидроксиметил)аминометан), диэтаноламин, цитрат (натрия) и т.п. pH буфера по настоящему изобретению может находиться в диапазоне приблизительно от 5,5 до приблизительно 6,5; а предпочтительно pH может составлять приблизительно 6,0. Примеры буферов, которые поддерживают pH в этом диапазоне, включают сукцинат (такой как сукцинат натрия), глюконат, гистидин, цитрат и другие буферы на основе органических кислот.
[0068] Термин "криопротекторы", как правило, включает средства, которые обеспечивают стабильность белка при индуцированных замораживанием напряжениях, предположительно благодаря исключению с поверхности белка. Также они могут обеспечивать защиту при первичной и вторичной сушке и длительном хранении продукта. Примеры представляют собой полимеры, такие как декстран и полиэтиленгликоль; сахара, такие как сахароза, глюкоза, трегалоза и лактоза; поверхностно-активные вещества, такие как полисорбаты; и аминокислоты, такие как глицин, аргинин и серин.
[0069] Термин "лиопротектор" включает средства, которые обеспечивают стабильность белка в процессе сушки или "дегидратации" (первичный и вторичный циклы сушки), предположительно, обеспечивая аморфный стекловидный матрикс и связываясь с белком посредством образования водородных связей, замещая молекулы воды, которую удаляют в процессе сушки. Это помогает сохранить конформацию белка, минимизировать деградацию белка в цикле лиофилизации и улучшить длительность хранения продуктов. Примеры включают полиолы или сахара, такие как сахароза и трегалоза.
[0070] Термин "фармацевтический состав" относится к препаратам, которые находятся в такой форме, чтобы обеспечить эффективность активных ингредиентов, и которые не содержат дополнительных компонентов, которые являются токсичными для индивидуумов, которым вводят этот состав.
[0071] "Фармацевтически приемлемые" эксципиенты (носители) представляют собой эксципиенты, которые можно обоснованно вводить млекопитающему для обеспечения эффективной дозы применяемого активного ингредиента.
[0072] "Время восстановления" представляет собой время, которое необходимо для разведения лиофилизированного состава в растворе.
[0073] "Стабильный" состав представляет собой состав, в котором содержащийся в нем белок по существу сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении. Например, в данной области доступны различные аналитические способы определения стабильности белка, и они рассмотрены в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10:29-90 (1993). Стабильность можно определять при выбранной температуре в течение выбранного периода времени.
[0074] Как используют в настоящем документе, термин "эпитоп" относится к части антигена, которую распознает связывающее средство, например, антитело. Эпитопы в качестве неограничивающих примеров включают короткую аминокислотную последовательность или пептид (необязательно гликозилированный или модифицированный иным образом), обеспечивая специфическое взаимодействие с белком (например, антителом) или лигандом. Например, эпитоп может представлять собой часть молекулы с которой связывается антигенсвязывающий участок связывающего средства.
[0075] Термин "лечение" или "лечить" относится к лечению заболевания или нарушения (например, злокачественной опухоли) у индивидуума, такого как человек, и включает: (i) подавление заболевания или нарушения, т.е., торможение его развития; (ii) облегчение заболевания или нарушения, т.е., вызов регресса заболевания или нарушения; (iii) замедление прогрессирования заболевания или нарушения; и/или (iv) подавление, облегчение или замедление прогрессирования одного или нескольких симптомов заболевания или нарушения. В определенных вариантах осуществления "лечение" или "лечить" относится к уничтожению злокачественных клеток.
[0076] Термин "уничтожать" или "уничтожение" в отношении лечения злокачественных опухолей включает любую разновидность действий, которые прямо или опосредованно приводят к гибели этих злокачественных клеток или, по меньшей мере, части популяции злокачественных клеток.
[0077] Термин "аптамер" относится к молекуле нуклеиновой кислоты, которая способна к связыванию с молекулой-мишенью, такой как полипептид. Например, аптамер по изобретению может специфически связываться, например, с CD20, CD38, CD52, PD-1, PD-L1, PD-L2, Ly6E, HER2, HER3/EGFR DAF, рецептором ERBB-3, CSF-1R, STEAP1, CD3, CEA, CD40, OX40, Ang2-VEGF и VEGF. Получение антител с конкретной специфичностью связывания и терапевтическое применение аптамеров хорошо известно в данной области. См., например, патент США № 5475096, патенты США №№ 5270163, 5582981, 5840867, 6011020, 6051698, 6147204, 6180348 и 6699843 и терапевтическую эффективность макугена® (Eyetech, New York) для лечения связанной с возрастом дегенерации желтого пятна, каждый из которых полностью включен в настоящий документ в качестве ссылки.
[0078] Как используют в настоящем документе, термин "олигомер", или "олигомерный", или "олигомеризованный" относится к олигомерам, состоящим из двух или более мономеров.
[0079] Слитые белки представляют собой полученные биоинженерными способами полипептиды, которые связывают белок или его фрагмент (например, домен кристаллизующегося фрагмента (Fc) антитела) с другим биологически активным средством (например, доменом белка, пептидом или нуклеиновой кислотой или пептидным аптамером) с получением молекулы с требуемыми свойствами структуры-функции и значимым терапевтическим потенциалом. В качестве основы для получения слитых с Fc белков часто используют иммуноглобулины изотипа гамма (IgG), ввиду подходящих характеристик, таких как функция привлечения эффекторов и увеличенный период полувыведения из плазмы. Учитывая диапазон аптамеров, и из пептидных, и из нуклеиновых кислот, которые можно использовать в качестве партнеров по слиянию, слитые белки имеют множество биологических и фармацевтических применений.
[0080] Термин "нетоксические наночастицы" (NTP) или "комплексы NTP" относится к наночастицам, содержащим белок-носитель (например, альбумин) и производное паклитаксела, которое является менее токсичным, чем паклитаксел. Необязательно, NTP или комплексы NTP содержат связывающие средства (например, антитела) и/или терапевтические средства (например, химиотерапевтические средства).
[0081] Фраза "менее токсичное, чем паклитаксел" относится к производным паклитаксела, которые демонстрируют сниженную токсичность в отношении клеток (например, их уменьшенное уничтожение), включая злокачественные клетки и нормальные клетки, по сравнению с паклитакселом. Например, продукт Меервейна паклитаксела (20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол) обладает значительно меньшей токсичностью, предположительно ввиду разрыва C-4,C-5 оксетанового кольца паклитаксела.
[0082] Термин "наночастицы со сниженной токсичностью" (RTP) или "комплексы RTP" относится к наночастицам, содержащим белок-носитель (например, альбумин) и сниженное по сравнению с абраксаном® количество паклитаксела (например, отношение альбумин:паклитаксел составляет приблизительно 9:1). Необязательно, RTP или комплексы RTP содержат связывающие средства (например, антитела) и/или терапевтические средства (например, химиотерапевтические средства).
[0083] Кроме-того, определенные термины, используемые в настоящем описании, более конкретно определены ниже.
Обзор
[0084] Абраксан® для инъецируемой суспензии (частицы связанного с белком паклитаксела для инъецируемой суспензии) представляет собой связанную с альбумином форму паклитаксела со средним размером частицы приблизительно 130 нанометров. Паклитаксел в этих частицах может присутствовать в некристаллическом, аморфном состоянии. Абраксан® можно поставлять, например, в виде лиофилизированного порошка для восстановление 20 мл 0,9% хлорида натрия для инъекций, USP, перед внутривенной инфузией. Одноразовый флакон содержит 100 мг паклитаксела и приблизительно 900 мг альбумина человека. Каждый миллилитр (мл) восстановленной суспензии содержит 5 мг паклитаксела.
[0085] Наночастицы абраксана® представляют собой стабилизированный связанный с альбумином паклитаксел. Ассоциацию паклитаксела и альбумина могут осуществлять, например, гидрофобные взаимодействия. В определенных примерах наночастица является стабильной при среднем размере 130 нм. Также известно, что подобным образом, связываясь с альбумином, формировать стабилизированные наночастицы могут другие гидрофобные лекарственные средства, например, такие как доцетаксел, рапамицин.
[0086] Для эффективности общепринятых средств ADC критично, чтобы линкер был достаточно стабильным, чтобы не диссоциировать в системном кровотоке, но обеспечивал высвобождение достаточного количества лекарственного средства в участке опухоли. Alley, S.C., et al. (2008) Bioconjug Chem 19:759-765. Это оказалось серьезным препятствием в разработке эффективного конъюгата с лекарственным средством (Julien, D.C., et al. (2011) MAbs 3:467-478; Alley, S.C., et al. (2008) Bioconjug Chem 19:759-765); таким образом, привлекательным свойством наноиммунного конъюгата является отсутствие требования биохимического линкера.
[0087] Другим недостатком современных средств ADC является то, что для опухолей человека не было достоверно доказано повышенного поступления лекарственного средства в опухоли. Первоначальное тестирование средств ADC в моделях на мышах свидетельствовало, что направленное воздействие антителами на опухоль приводит к повышенной концентрации активного средства в опухоли (Deguchi, T. et al. (1986) Cancer Res 46: 3751-3755); однако это не коррелировало с лечением заболеваний человека, вероятно потому, что опухоли человека являются намного более гетерогенными по проницаемости, чем опухоли мышей. Jain, R.K. et al. (2010) Nat. Rev. Clin. Oncol. 7:653-664. Также критичным для выхода наночастиц из сосудистой системы в опухоль является размер наночастиц. В исследованиях на мышах с использованием модели ксенотрансплантата аденокарциномы кишечника человека, поры сосудов были проницаемы для липосом вплоть до размера 400 нм. Yuan, F., et al. (1995) Cancer Res 55: 3752-3756. Другое исследование размера и проницаемости пор опухоли продемонстрировало, что обе характеристики зависели от расположения и характера роста опухоли, где регрессирующие опухоли и опухоли головы проницаемы для частиц менее 200 нм. Hobbs, S.K., et al. (1998) Proc. Natl. Acad. Sci. USA 95:4607-4612. Наноиммунный конъюгат, описываемый в настоящем документе, преодолевает эту проблему в силу того, что большой комплекс, составляющий менее 200 нм в интактном состоянии, частично диссоциирует в системном кровотоке на функциональные единицы меньшего размера, которые могут легко проникать в опухолевую ткань. Кроме того, когда конъюгат достигает участка опухоли, менее крупную токсическую нагрузку можно высвобождать и захват опухолевыми клетками будет необходим только для токсической части, а не для всего конъюгата.
[0088] Появление покрытых антителом (т.е. авастином®) наночастиц альбумина, содержащих терапевтическое средство (т.е., абраксан®), привело к новой парадигме направленной доставки двух или более терапевтических средств в предопределенный участок in vivo. См. патентные публикации PCT №№ WO 2012/154861 и WO 2014/055415, каждая из которых полностью включена в настоящий документ в качестве ссылки.
[0089] Однако полагают, что лечение определенных злокачественных опухолей паклитакселом в комплексах абраксане®-антитело будет неэффективно, и/или что при лечении определенных злокачественных опухолей будут более эффективны другие терапевтические средства (например, противоопухолевые химиотерапевтические средства). В настоящем документе описаны наночастицы со сниженной токсичностью (RTP), содержащие белок-носитель (например, альбумин) и сниженное количество паклитаксела (например, по сравнению с абраксаном®), или нетоксические наночастицы (NTP), содержащие белок-носитель (например, альбумин) и производное паклитаксела, которое является менее токсичным, чем паклитаксел. Наночастицы могут дополнительно содержать терапевтическое средство и/или связывающие средства (например, антитела).
Наночастицы и композиции наночастиц
[0090] Как будет очевидно специалисту в данной области после прочтения этого описания, настоящее изобретение относится к наночастицам и композициям наночастиц, содержащим белок-носитель (например, альбумин) и производное паклитаксела (например, производное, которое является менее токсичным, чем паклитаксел) или сниженное количество паклитаксела (например, по сравнению с терапевтическим количеством и/или по сравнению с количеством в абраксане®). В определенных вариантах осуществления наночастицы также содержит связывающие средства и/или терапевтическое средство. В определенных вариантах осуществления наночастицы или композиция наночастиц являются лиофилизированными.
[0091] Настоящее изобретение дополнительно частично основано на получении наночастиц, содержащих белок-носитель и паклитаксел в меньшем количестве, чем находится в абраксане®, или производное паклитаксела, которое является менее токсичным (например, для клеток), чем паклитаксел, необязательно со связывающим средством и/или терапевтическим средством. Не ограничиваясь какой-либо теорией, полагают, полагают, что такие наночастицы обеспечивают направленную терапию опухоли, минимизируя токсичность для пациента, и их можно использовать для лечения опухолей, которые, как правило, не чувствительны к паклитакселу и/или которые лучше реагируют на другое терапевтическое средство.
[0092] В определенных вариантах осуществления белок-носитель может представлять собой альбумин, желатин, эластин (включая тропоэластин) или получаемые из эластина полипептиды (например, α-эластин и эластиноподобные полипептиды (ELP)), глиадин, легумин, зеин, соевый белок (например, изолят соевого белка (SPI)), молочный белок (например, β-лактоглобулин (BLG) и казеин) или сывороточный белок (например, концентраты сывороточного белка (WPC) и изоляты сывороточного белка (WPI)). В предпочтительных вариантах осуществления белок-носитель представляет собой альбумин. В предпочтительных вариантах осуществления альбумин представляет собой альбумин яичного белка (овальбумин), бычий сывороточный альбумин (BSA) или т.п. В еще более предпочтительных вариантах осуществления белок-носитель представляет собой сывороточный альбумин человека (HSA). В определенных вариантах осуществления белок-носитель представляет собой рекомбинантный белок (например, рекомбинантный HSA). В определенных вариантах осуществления белок-носитель, как правило, рассматривают как безопасный (GRAS) эксципиент, одобренный управлением по контролю за качеством пищевых продуктов и лекарственных средств (FDA) США.
[0093] В определенных вариантах осуществления связывающие средства представляют собой антитела, выбранные из адо-трастузумаба эмтанзина, алемтузумаба, атезолизумаба, бевацизумаба, цетуксимаба, денозумаба, динутоксимаба, ипилимумаба, ниволумаба, обинутузумаба, офатумумаба, панитумумаба, пембролизумаба, пертузумаба, ритуксимаба, авелумаба или дурвалумаба, пидилизумаба, BMS 936559 и трастузумаба. В определенных вариантах осуществления антитела выбраны из антител, приведенных в таблице 1. В определенных вариантах осуществления антитела представляют собой по существу один слой антител на всей или части поверхности наночастицы.
В таблице 1 приведен неограничивающий список антител.
Таблица 1: Антитела
[0094] В определенных вариантах осуществления по меньшей мере одно терапевтическое средство выбрано из абиратерона, бендамустина, бортезомиба, карбоплатина, кабацитаксела, цисплатина, хлорамбуцила, дазатиниба, доцетаксела, доксорубицина, эпирубицина, эрлотиниба, этопозида, эверолимуса, гефитиниба, идарубицина, иматиниба, гидроксимочевинаа, иматиниба, лапатиниба, лейпрорелина, мелфалана, метотрексата, митоксантрона, недаплатина, нилотиниба, оксалиплатина, пазопаниба, пеметрекседа, пикоплатина, ромидепсина, сатраплатина, сорафениба, вемурафениба, сунитиниба, тенипозида, триплатина, винбластина, винорелбина, винкристина и циклофосфамида.
[0095] В таблице 2 приведен неограничивающий список терапевтических средств против злокачественных опухолей. В одном из вариантов осуществления терапевтическое средство выбрано из средств, приведенных в таблице 2.
Таблица 2: Терапевтические средства против злокачественных опухолей
[0096] Следует понимать, что терапевтическое средство может находиться внутри наночастицы, на внешней поверхности наночастицы или и внутри и на внешней поверхности наночастицы. Наночастица может содержать более одного терапевтического средства, например, два терапевтических средства, три терапевтических средства, четыре терапевтических средства, пять терапевтических средств или более. Кроме того, наночастица может внутри и на внешней поверхности наночастицы содержать одинаковые или различные терапевтические средства.
[0097] В одном из аспектов наночастица содержит по меньшей мере 100 молекул связывающего средства, нековалентно связанных с поверхностью наночастицы. В одном из аспектов наночастица содержит по меньшей мере 200, 300, 400, 500, 600, 700 или 800 молекул связывающего средства, нековалентно связанных с поверхностью наночастицы.
[0098] В одном из аспектов наночастица содержит приблизительно от 100 до приблизительно 1000 молекул связывающих средств, нековалентно связанных с поверхностью наночастицы. В одном из аспектов наночастица содержит приблизительно от 200 до приблизительно 1000, приблизительно от 300 до приблизительно 1000, приблизительно от 400 до приблизительно 1000, приблизительно от 500 до приблизительно 1000, приблизительно от 600 до приблизительно 1000, приблизительно от 200 до приблизительно 800, приблизительно от 300 до приблизительно 800, или приблизительно от 400 до приблизительно 800 молекул связывающего средства, нековалентно связанных с поверхностью наночастицы. Предусмотренные значения включают любое значение или поддиапазон в любом из перечисленных диапазонов, включая конечные точки.
[0099] В одном из аспектов средний размер частиц в композиции наночастиц составляет менее чем приблизительно 1 мкм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 50 нм до приблизительно 1 мкм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 900 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 800 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 700 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 600 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 500 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 400 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 300 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 60 нм до приблизительно 200 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 80 нм до приблизительно 900 нм, 800 нм, 700 нм, 600 нм, 500 нм, 400 нм, 300 нм или 200 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 100 нм до приблизительно 900 нм, 800 нм, 700 нм, 600 нм, 500 нм, 400 нм, 300 нм или 200 нм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 120 нм до приблизительно 900 нм, 800 нм, 700 нм, 600 нм, 500 нм, 400 нм, 300 нм или 200 нм. Предусмотренные значения включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
[0100] В одном из аспектов композицию наночастиц формулируют для внутривенной инъекции. Во избежание ишемического события композиция наночастиц, сформулированная для внутривенной инъекции, должна содержать наночастицы со средним размером частиц менее чем приблизительно 1 мкм.
[0101] В одном из аспектов средний размер частиц в композиции наночастиц составляет более чем приблизительно 1 мкм. В одном из аспектов средний размер частиц в композиции наночастиц составляет приблизительно от 1 мкм до приблизительно 5 мкм, приблизительно от 1 мкм до приблизительно 4 мкм, приблизительно от 1 мкм до приблизительно 3 мкм, приблизительно от 1 мкм до приблизительно 2 мкм, или приблизительно от 1 мкм до приблизительно 1,5 мкм. Предусмотренные значения включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
[0102] В одном из аспектов композицию наночастиц формулируют для прямой инъекции в опухоль. Прямая инъекция включает инъекцию в участок опухоли или рядом с ним, перфузию в опухоль и т.п. При формулировании для прямой инъекции в опухоль средний размер наночастиц может быть любым. Не ограничиваясь какой-либо теорией, полагают, что более крупные частицы (например, более 500 нм, более 1 мкм и т.п.) с большей вероятностью иммобилизуются в опухоли, таким образом, обеспечивая положительное воздействие. Более крупные частицы могут накапливаться в опухоли или конкретных органах. См., например, 20-60 микронные стеклянные частицы, которые используют для инъекции в печеночные артерии, питающие опухоль печени, называемые "Терасфера®" (в клиническом применении для рака печени). Таким образом, для внутривенного введения, как правило, используют частицы менее 1 мкм. Непосредственно в опухоль ("прямая инъекция") или в артерию, питающую участок опухоли, более типично вводят частицы размером более 1 мкм.
[0103] В одном из аспектов размером частиц более 200 нм, более 300 нм, более 400 нм, более 500 нм, более 600 нм, более 700 нм или более 800 нм обладает менее чем приблизительно 0,01% наночастиц в композиции. В одном из аспектов размером частиц более 200 нм, более 300 нм, более 400 нм, более 500 нм, более 600 нм, более 700 нм или более 800 нм обладает менее чем приблизительно 0,001% наночастиц в композиции. В предпочтительном варианте осуществления размером частиц более 800 нм обладает менее чем приблизительно 0,01% наночастиц в композиции. В более предпочтительном варианте осуществления размером частиц более 800 нм обладает менее чем приблизительно 0,001% наночастиц в композиции.[0104] В предпочтительном аспекте размеры и диапазоны размеров, перечисляемые в настоящем документе, относятся к размерам частиц восстановленной лиофилизированной композиции наночастиц. Т.е. после ресуспендирования лиофилизированных наночастиц в водном растворе (например, воде, другом фармацевтически приемлемом эксципиенте, буфере и т.д.) размер частиц или средний размер частиц находится в диапазоне, приведенном в настоящем документе.
[0105] В одном из аспектов по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% наночастиц находятся в восстановленной композиция в виде одиночных наночастиц. Т.е. димеризовано или мультимеризовано (олигомеризовано) менее чем приблизительно 50%, 40%, 30% и т.д. наночастиц.
[0106] В определенных вариантах осуществления димеризация наночастиц в композиции по количеству составляет менее 20%, менее 10% и предпочтительно менее 5%.
[0107] В определенных вариантах осуществления размеры наночастиц можно контролировать посредством регулировки количества (например, отношения) белка-носителя относительно паклитаксела или производного паклитаксела, и/или отношения наночастиц белка-носителя-паклитаксела (или производного паклитаксела) и связывающего средства. Также важны размер и распределение размеров наночастиц. Наночастицы по изобретению в зависимости от их размера могут вести себя различным образом. При больших размерах агломерация может блокировать кровеносные сосуды. Таким образом, агломерация наночастиц может влиять на эффективность и безопасность композиции. С другой стороны, более крупные частицы в определенных условиях (например, когда их не вводят внутривенно) могут быть более терапевтическими.
[0108] Так как наночастицы используют в терапии, возникают дополнительные сложности.
[0109] Хотя перегруппировку компонентов в наночастице можно снижать посредством ковалентных связей между компонентами, такие ковалентные связи создают сложности для терапевтического применения наночастиц при лечении злокачественных опухолей. Как правило, связывающее средство, белок-носитель и терапевтическое средство действуют в различных местах опухоли и посредством различных механизмов. Нековалентные связи позволяют компонентам наночастиц диссоциировать в опухоли. Таким образом, хотя ковалентные связи могут быть благоприятны для лиофилизации, они могут мешать терапевтическому применению.
[0110] Также важны размер и распределение размеров наночастиц. Наночастицы по изобретению в зависимости от их размера могут вести себя различным образом. При больших размерах наночастицы или агломерация частиц может блокировать кровеносные сосуды, каждый из которых может влиять на эффективность и безопасность композиции.
Производные паклитаксела
[0111] Производные паклитаксела, используемые в настоящем изобретении, предпочтительно являются менее токсичными, чем паклитаксел. Т.е., производное паклитаксела является менее токсичным для клеток (например, также не уничтожает клетки злокачественных опухолей и/или нормальные клетки, или также не ингибирует клеточную пролиферацию) по сравнению с паклитакселом. Производные паклитаксела могут включать любое производное или предшественник паклитаксела. Примеры в качестве неограничивающих примеров включают 20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол (продукт Меервейна паклитаксела) или баккатин ΙII ((2β,5α,7α, 10α, 13β)-4,10-диацетокси-1,7,13-тригидрокси-9-оксо-5,20-эпокситакс-11-ен-2-илбензоат).
[0112] Например, большинство из упрощенных по C-13 производных паклитаксела и производных с различной стереохимией продемонстрировали сниженную активность по сравнении с паклитакселом. 2'-гидроксильная и 3'-бензамидная группы не существенны для биологической активности, но важны для сильного связывания с микротрубочками и цитотоксичности. Формирование простых эфиров по 2'-гидроксильной группе, таких как простой алкиловый эфир (например, простой метиловый эфир) и простой алкилсилиловый эфир (например, простой тербутилдиметилсилиловый эфир) снижало цитотоксичность. Ацилирование 2'-гидроксильной группы (например, 2'-ацетилтаксола) также приводило к потере активности. Также выявлено, что цитотоксичность значимо снижает замещение 2'-гидроксильной группы галогеном (например, фтором). Окисление тетрацетата свинца 6α-гидрокси-7-эпипаклитаксела приводит к C-норпаклитакселу и C-секо-производным паклитаксела. Окисление 6α-гидрокси-7-эпипроизводного паклитаксела перрутенатом тетрапропиламмония (TPAP) приводит к 6-формил-C-норпроизводному паклитаксела. Реакция 6α-O-трифторметансульфонил-7-эпипроизводного паклитаксела с DMAP приводит к 20-O-ацетил-4-деацетил-5,6-дегидро-6-формил-C-норпроизводному паклитаксела. C-норпаклитакселовые аналоги являются менее активными, чем паклитаксел. Таким образом, производное паклитаксела может содержать модификации по любому одному или нескольким из этих участков или его можно получать одним или несколькими из этих способов. См., например, Liang et al. Tetrahedron, 53(10):3441-3456 (1997); US 5756301; US 5981777; каждый из которых полностью включен в настоящий документ в качестве ссылки.
Способы получения наночастиц и комплексов наночастиц
[0113] В определенных аспектах настоящее изобретение относится к способам получения композиции наночастиц, как описано в настоящем документе. В определенных вариантах осуществления настоящее описание относится к способам получения композиции наночастиц, где указанный способ включает приведение белка-носителя и паклитаксела или производного паклитаксела в контакт в условиях и отношениях компонентов, которые обеспечивают формирование требуемых наночастиц. В определенных вариантах осуществления способы дополнительно относятся к приведению наночастиц в контакт со связывающими средствами и/или терапевтическим средством в условиях формирования комплексов наночастиц.
[0114] В определенных вариантах осуществления наночастицы получают, комбинируя белок-носитель и паклитаксел или производное паклитаксела, и проводя гомогенизацию при высоком давлении с формированием стабильных наночастиц. Неограничивающие способы гомогенизации альбумина и таксана (например, паклитаксела) можно найти, например, в примере 1, а также патентах США №№ 5916596; 6506405 и 6537579, каждый из которых полностью включен в настоящий документ в качестве ссылки.
[0115] В одном из вариантов осуществления связывающие средства и/или терапевтические средства образуют с наночастицами комплексы, как описано, например, в патентах США №№ 9757453 и 9446148.
[0116] В определенных аспектах в настоящем документе предоставлены способы получения комплексов наночастиц, где указанные способы включают приведение наночастиц белка-носителя-паклитаксела (или производного паклитаксела) в контакт со связывающими средствами и/или терапевтическим средством в растворе с pH от 5,0 до 7,5 и температуре приблизительно от 5°C до приблизительно 60°C, приблизительно от 23°C до приблизительно 60°C или приблизительно от 55°C до приблизительно 60°C в условиях и отношениях компонентов, которые обеспечивают формирование требуемых наночастиц. В одном из вариантов осуществления наночастицы получают при 55-60°C и pH 7,0. В другом аспекте в настоящем документе предоставлены способы получения комплексов наночастиц, где указанный способ включает (a) гомогенизацию белка-носителя и паклитаксела (или производного паклитаксела) с формированием сердцевины наночастицы и (b) приведение сердцевины в контакт с антителами в растворе с pH приблизительно от 5,0 до приблизительно 7,5 при температуре приблизительно от 5°C до приблизительно 60°C, приблизительно от 23°C до приблизительно 60°C или приблизительно от 55°C до приблизительно 60°C в условиях и отношениях компонентов, которые обеспечивают формирование требуемых комплексов наночастиц.
[0117] Другой вариант осуществления изобретения относится к способу получения композиции наночастиц посредством облегчения формирования комплекса белка-носителя и терапевтического средства, где способ включает приведение белка-носителя в контакт с определенным количеством паклитаксела, как описано в настоящем документе, и терапевтическим средством в растворе с pH 5,0 или более и с температурой приблизительно от 5°C до приблизительно 60°C с получением наночастиц. В еще одном варианте осуществления способ дополнительно включает приведение комплекса белка-носителя в контакт со связывающим средством.
[0118] Количество компонентов (например, белка-носителя, антител, паклитаксела или производного паклитаксела, терапевтических средств, их сочетаний) контролируют в целях обеспечения требуемых наночастиц. Композиция, где определенное количество компонентов является слишком разведенным, не формирует наночастиц, как описано в настоящем документе. Слишком концентрированный раствор приводит к формированию неструктурированных агрегатов.
[0119] В предпочтительном варианте осуществления отношение масс белка-носителя и связывающего средства составляет 10:4. В определенных вариантах осуществления количество белка-носителя составляет приблизительно от 1 мг/мл до приблизительно 100 мг/мл. В определенных вариантах осуществления количество связывающего средства составляет приблизительно от 1 мг/мл до приблизительно 30 мг/мл. Например, в определенных вариантах осуществления отношение белок-носитель:связывающее средство:раствор составляет приблизительно 9 мг белка-носителя (например, альбумина) на 4 мг связывающего средства (например, BEV) в 1 мл раствора (например, солевого раствора).
[0120] В одном из вариантов осуществления количество раствора или другой жидкой среды, используемых для формирования наночастиц является особенно важным. В определенных вариантах осуществления количество используемого раствора (например, стерильной воды, солевого раствора, фосфатно-солевого буфера) составляет приблизительно от 0,5 мл раствора до приблизительно 20 мл раствора.
[0121] В одном из аспектов комплексы наночастиц композиции наночастиц получают посредством приведение наночастиц белка-носителя-паклитаксела (или производного паклитаксела) и по меньшей мере одного терапевтического средства в контакт со связывающим средством в отношении частиц белка-носителя или частиц белка-носителя-терапевтического средства и связывающего средства приблизительно от 10:1 до приблизительно 10:30. В одном из вариантов осуществления отношение составляет приблизительно от 10:2 до приблизительно 10:25. В одном из вариантов осуществления отношение составляет приблизительно от 10:2 до приблизительно 1:1. В предпочтительном варианте осуществления отношение составляет приблизительно от 10:2 до приблизительно 10:6. В особенно предпочтительном варианте осуществления отношение составляет приблизительно от 10:4. Предусмотренные диапазоны включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
[0122] В одном из аспектов наночастицы композиции наночастиц получают посредством приведения в контакт наночастиц белка-носителя-паклитаксела (или производного паклитаксела) и по меньшей мере одного терапевтического средства. В одном из вариантов осуществления отношение составляет приблизительно от 10:2 до приблизительно 10:25. В одном из вариантов осуществления отношение составляет приблизительно от 10:2 до приблизительно 1:1. В предпочтительном варианте осуществления отношение составляет приблизительно от 10:2 до приблизительно 10:6. В особенно предпочтительном варианте осуществления отношение составляет приблизительно 10:4. Предусмотренные диапазоны включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
[0123] В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно от 4 до приблизительно 8. В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно 4. В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно 5. В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно 6. В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно 7. В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно 8. В предпочтительном варианте осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) приводят в контакт со связывающим средством в растворе с pH приблизительно от 5 до приблизительно 7.
[0124] В одном из вариантов осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) инкубируют со связывающим средством при температуре приблизительно от 5°C до приблизительно 60°C, или в любом диапазоне, поддиапазоне или при значении в пределах этого диапазона, включая конечные точки. В предпочтительном варианте осуществления наночастицы белка-носителя-паклитаксела (или производного паклитаксела) инкубируют со связывающим средством при температуре приблизительно от 23°C до приблизительно 60°C.
[0125] Не ограничиваясь какой-либо теорией, полагают, что стабильность комплексов наночастиц по меньшей мере частично зависит от температуры и/или pH, при которых получают наночастицы, а также от концентрации компонентов (т.е., белка-носителя, связывающего средства, паклитаксела или производного паклитаксела и терапевтического средства) в растворе. В одном из вариантов осуществления Kd наночастиц составляет приблизительно от 1 × 10-11 M до приблизительно 2 × 10-5 M. В одном из вариантов осуществления Kd наночастиц составляет приблизительно от 1 × 10-11 M до приблизительно 2 × 10-8 M. В одном из вариантов осуществления Kd наночастиц составляет приблизительно от 1 × 10-11 M до приблизительно 7 × 10-9M. В предпочтительном варианте осуществления Kd наночастиц составляет приблизительно от 1 × 10-11 M до приблизительно 3 × 10-8 M. Предусмотренные значения включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
Получение наночастиц со сниженной токсичностью
[0126] Отношение относительных масс белка-носителя и паклитаксела составляет более чем приблизительно 9:1. В одном из вариантов осуществления отношения относительных масс белка-носителя и паклитаксела составляют больше чем приблизительно 10:1, или приблизительно 11:1, или приблизительно 12:1, или приблизительно 13:1, или приблизительно 14:1, или приблизительно 15:1, или приблизительно 16:1, или приблизительно 17:1, или приблизительно 18:1, или приблизительно 19:1, или приблизительно 20:1, или приблизительно 21:1, или приблизительно 22:1, или приблизительно 23:1, или приблизительно 24:1, или приблизительно 25:1, или приблизительно 26:1, или приблизительно 27:1, или приблизительно 28:1, или приблизительно 29:1, или приблизительно 30:1. В одном из вариантов осуществления отношение масс составляет от 10:1 до 100:1, от 10:1 до 50:1, от 10:1 до 40:1, от 10:1 до 30:1, от 10:1 до 20:1, или от 10:1 до 15:1. В одном из вариантов осуществления отношение масс is от 15:1 до 50:1, 15:1 и 50:1, от 15:1 до 40:1, от 15:1 до 30:1, или от 15:1 до 20:1. Отношение масс может представлять собой любое значение или поддиапазон в перечисленных диапазонах, включая конечные точки.
[0127] В одном из вариантов осуществления количество паклитаксела эквивалентно минимальному количеству, способному обеспечивать стабильность наночастиц. В одном из вариантов осуществления количество паклитаксела составляет количество, большее или равное минимальному количеству, способному обеспечивать аффинность по меньшей мере одного терапевтического средства к белку-носителю. В одном из вариантов осуществления количество паклитаксела составляет количество, большее или равное минимальному количеству, способному облегчать формирование комплекса по меньшей мере одного терапевтического средства и белка-носителя. Например, в 1 мл раствора можно добавлять менее чем приблизительно 1 мг таксола, 9 мг белка-носителя (10 мг белок-носитель-терапевтического средства) и 4 мг связывающего средства, например, антитела, слитой с Fc молекулы или аптамера.
[0128] Следует отметить, что при использовании типичного в/в пакета, например, с раствором приблизительно 1 литр необходимо использовать 1000× количество белка-носителя/белка-носителя-терапевтического средства и антитела по сравнению с количеством, используемым в 1 мл. Таким образом, представляемые по настоящему изобретению наночастицы нельзя формировать в стандартном в/в пакете. Кроме того, когда компоненты добавляют в стандартный в/в пакет в терапевтических количествах по настоящему изобретению, компоненты не проходят самосборку с формированием наночастиц.
[0129] В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет менее чем приблизительно 5 мг/мл. В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет менее чем приблизительно 4,54 мг/мл, или приблизительно 4,16 мг/мл, или приблизительно 3,57 мг/мл, или приблизительно 3,33 мг/мл, или приблизительно 3,12 мг/мл, или приблизительно 2,94 мг/мл, или приблизительно 2,78 мг/мл, или приблизительно 2,63 мг/мл, или приблизительно 2,5 мг/мл, или приблизительно 2,38 мг/мл, или приблизительно 2,27 мг/мл, или приблизительно 2,17 мг/мл, или приблизительно 2,08 мг/мл, или приблизительно 2 мг/мл, или приблизительно 1,92 мг/мл, или приблизительно 1,85 мг/мл, или приблизительно 1,78 мг/мл, или приблизительно 1,72 мг/мл, или приблизительно 1,67 мг/мл. В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет количество, большее или равное минимальному количеству, способному обеспечивать стабильность наночастиц. В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет количество, большее или равное минимальному количеству, способному обеспечивать аффинность по меньшей мере одного терапевтического средства к белку-носителю. В одном из вариантов осуществления количество паклитаксела, находящегося в композиции наночастиц, составляет количество, большее или равное минимальному количеству, способному облегчать формирование комплекса по меньшей мере одного терапевтического средства и белка-носителя.
[0130] В одном из вариантов осуществления композиции наночастиц, описываемая в настоящем документе, не содержит связывающих средств.
Лиофилизация
[0131] Хотя белковые композиции, содержащие единственный исходный белок, как правило, хранят в лиофилизированной форме, в которой они демонстрируют значительный срок годности, такие лиофилизированные композиции не содержат самособирающихся наночастиц из двух различных белков, объединенных вместе посредством гидрофобных взаимодействий. Кроме того, конфигурация наночастиц, где большинство связывающихся частей связывающего средства выставлено на поверхности наночастиц может быть чувствительна к смещению или реконфигурации в условиях, которые в иных случаях могли бы считаться мягкими. Например, при лиофилизации ионные заряды на белках являются дегидратированными, таким образом, экспонируя нижележащие заряды. Экспонированные заряды обеспечивают межзарядовые взаимодействия двух белков, которые могут изменять аффинность связывания каждого белка с другим белком. Кроме того, при удалении растворителя (например, воды) значительно увеличивается концентрация наночастиц. Такие увеличенные концентрации наночастиц могут приводить к необратимым изменениям в олигомеризации. Олигомеризация представляет собой известное свойство белков, которое ухудшает биологические свойства олигомерной по сравнению с мономерной формой и увеличивает размер частицы, иногда до размера более 1 микрона.
[0132] С другой стороны, стабильная форма композиции наночастиц необходима для клинического и/или коммерческого использования, где требуется срок годности по меньшей мере 3 месяца, а предпочтительны сроки хранения более 6 месяцев или 9 месяцев. Такая стабильная композиция должна быть легкодоступной для внутривенной инъекции, должна сохранять свою самособирающуюся форму при внутривенной инъекции так, чтобы направлять наночастицу в предопределенный участок in vivo, ее максимальный размер должен составлять менее 1 микрона так, чтобы избежать любого ишемического события при доставке в кровоток, и, наконец, она должна быть совместима с водной композицией, используемой для инъекции.
[0133] Посредством лиофилизации или лиофильной сушки из композиции удаляют воду. В этом процессе, материал для сушки сначала замораживают, а затем лед или замороженный растворитель удаляют посредством испарения в среде с пониженным давлением. Для увеличения стабильности в процессе лиофилизации и/или лиофилизированного продукта при хранении в составы перед лиофилизацией необязательно можно включать эксципиент. Pikal, M. Biopharm. 3(9)26-30 (1990) и Arakawa et al., Pharm. Res. 8(3):285- 291 (1991).
[0134] Хотя белки можно лиофилизировать, процесс лиофилизации и восстановления может влиять на свойства белка. Так как белки являются более крупными и более сложными, чем традиционные органические и неорганические лекарственные средства (т.е. в дополнение к комплексным трехмерным структурам содержат несколько функциональных групп), состав с такими белками создает особые проблемы. Чтобы белок оставался биологически активным, состав должен сохранять интактную конформационную целостность по меньшей мере сердцевинной последовательности из аминокислот белка, в то же время защищая многочисленные функциональные группы белка от деградации. Пути деградации белков могут включать химическую нестабильность (т.е. любой процесс, который включает модификацию белка посредством формирования или расщепления связей, приводящих к новой химической структуре) или физическую нестабильность (т.е. изменения в структуре белка более высокого порядка). Химическая нестабильность может является результатом дезаминирования, рацемизации, гидролиза, окисления, бета-элиминации или обмена дисульфидами. Физическая нестабильность может является, например, результатом денатурации, агрегации, осаждения или всасывания. Три наиболее частых путей деградации белка представляют собой агрегацию, дезаминирование и окисление белка. Cleland, et al., Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993).
[0135] Наконец, криопротекторы и средства, которые способствуют процессу лиофилизации должны быть безопасными и приемлемыми для терапевтического применения.
[0136] Лиофилизированные композиции по настоящему изобретению получают стандартными способами лиофилизации с присутствием или отсутствием стабилизаторов, буферов и т.д. Неожиданно, эти условия не изменяют относительно хрупкую структуру наночастиц. Кроме того, в лучшем случае, эти наночастицы после лиофилизации сохраняю свое распределение по размерам и, более важно, их можно восстанавливать для введения in vivo (например, внутривенной доставки) по существу в той же форме и диапазонах, как будто они только что получены.
[0137] В определенных вариантах осуществления наночастицы (например, RTP или NTP) являются лиофилизированными. В определенных вариантах осуществления комплексы наночастиц (например, RTP или NTP с ассоциированными терапевтическим средством и/или связывающими средствами) являются лиофилизированными. В определенных вариантах осуществления при восстановлении водным раствором определенное количество связывающих средств находится на поверхности наночастиц. В определенных вариантах осуществления комплексы наночастиц способны к связыванию с антигеном. В определенных вариантах осуществления антитела, ассоциированные с комплексами наночастиц, остаются способными к связыванию с антигеном.
Составы
[0138] В одном из аспектов композицию наночастиц формулируют для системной доставки, например, внутривенного введения.
[0139] В одном из аспектов композицию наночастиц формулируют для прямой инъекции в опухоль. Прямая инъекция включает инъекцию в участок опухоли или рядом с участком опухоли, перфузию в опухоль и т.п. Так как композицию наночастиц не вводят системно, у композиции наночастиц, формулируемой для прямой инъекции в опухоль, может быть любой средний размер частиц. Не ограничиваясь какой-либо теорией, полагают, что более крупные частицы (например, более 500 нм, более 1 мкм и т.п.) с большей вероятностью иммобилизуются в опухоли, таким образом, обеспечивая то, что считают лучшим положительным воздействием.
[0140] В другом аспекте в настоящем документе предоставлен композиция, содержащая соединение, предоставляемое по настоящему документу, и по меньшей мере один фармацевтически приемлемый эксципиент.
[0141] Как правило, соединения, предоставляемые по настоящему документу, можно формулировать для введения пациенту любым из приемлемых способов введения. В данной области доступны различные системы доставки составов и лекарственных средств. См., например, Gennaro, A.R., ed. (1995) Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Co.
[0142] Как правило, соединения, предоставляемые по настоящему документу, вводят в виде фармацевтической композиции любым из приводимых ниже маршрутов: пероральное, системное (например, трансдермальное, интраназальное или посредством суппозитория) или парентеральное (например, внутримышечное, внутривенное или подкожное) введение.
[0143] Как правило, композиции состоят из соединения по настоящему изобретению в комбинации по меньшей мере с одним фармацевтически приемлемым эксципиентом. Приемлемые эксципиенты являются нетоксическими, способствуют введению и не оказывают неблагоприятного воздействия на положительное терапевтическое действие предоставляемых соединений. Такой эксципиент может представлять собой любые твердое тело, жидкость, полутвердое вещество или, в случае аэрозольной композиции, газообразный эксципиент, который, как правило, доступен специалисту в данной области.
[0144] Твердые фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, глицеринмоностеарат, хлорид натрия, сухое обезжиренное молоко и т.п. Жидкие и полутвердые эксципиенты можно выбирать из глицерина, пропиленгликоля, воды, этанола и различных масел, включая масла минерального, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.д. Предпочтительные жидкие носители, в частности для инъецируемых растворов, включают воду, солевой раствор, водную декстрозу и гликоли. Другие подходящие фармацевтические эксципиенты и их составы описаны в Remington's Pharmaceutical Sciences, edited by E. W. Martin (Mack Publishing Company, 18th ed., 1990).
[0145] Композиции по настоящему изобретению при желании можно предоставлять в упаковке или раздаточном устройстве, содержащих одну или несколько стандартных лекарственных форм, содержащих активный ингредиент. Такие упаковка или устройство могут содержать, например, металлическую или пластиковую фольгу, такую как блистерная упаковка, или стеклянные и резиновые пробки, такие как во флаконах. Упаковку или раздаточное устройстве можно сопровождать инструкциями для введения. Композиции, содержащие соединение по изобретению, формулируемое в фармацевтически совместимом носителе, также можно получать, помещать в подходящий контейнер и помечать для лечения указанного патологического состояния.
Способы лечения
[0146] Композиции наночастиц, как описано в настоящем документе, пригодны при лечении злокачественных клеток и/или опухолей у млекопитающего. В предпочтительном варианте осуществления млекопитающее представляет собой человека (т.е., пациента-человека). Предпочтительно, лиофилизированную композицию наночастиц перед введением восстанавливают (суспендируют в водном эксципиенте).
[0147] В одном из аспектов предоставлен способ лечения злокачественных клеток, где способ включает приведение клеток в контакт с эффективным количеством композиции наночастиц, как описано в настоящем документе, с лечением злокачественных клеток. Лечение злокачественных клеток в качестве неограничивающих примеров включает снижение пролиферации, уничтожение клеток, предотвращение метастазирования клеток и т.п.
[0148] В одном из аспектов предоставлен способ лечения опухоли у нуждающегося в этом пациента, где способ включает введение пациенту терапевтически эффективного количества композиции наночастиц, как описано в настоящем документе, с лечением опухоли. В одном из вариантов осуществления, где наночастицы содержат связывающее средство, содержащее антигенсвязывающий домен, способ включает отбор пациента со злокачественной опухолью, экспрессирующей антиген. В одном из вариантов осуществления размер опухоли уменьшается. В одном из вариантов осуществления размер опухоли не увеличивается (т.е. не прогрессирует) по меньшей мере в течение периода времени во время и/или после лечения.
[0149] В одном из вариантов осуществления композицию наночастиц вводят внутривенно. В одном из вариантов осуществления композицию наночастиц вводят непосредственно в опухоль. В одном из вариантов осуществления композицию наночастиц вводят посредством прямой инъекции или перфузии в опухоль.
[0150] В одном из вариантов осуществления способ включает:
a) введение композиции наночастиц раз в неделю в течение трех недель;
b) прекращение введения композиции наночастиц в течение одной недели; и
c) необязательно повторение этапов a) и b) по мере необходимости с лечением опухоли.
[0151] В одном из вариантов осуществления терапевтически эффективное количество наночастиц, описываемых в настоящем документе, содержит приблизительно от 1 мг/м2 до приблизительно 200 мг/м2 антитела, приблизительно от 2 мг/м2 до приблизительно 150 мг/м2, приблизительно от 5 мг/м2 до приблизительно 100 мг/м2, приблизительно от 10 мг/м2 до приблизительно 85 мг/м2, приблизительно от 15 мг/м2 до приблизительно 75 мг/м2, приблизительно от 20 мг/м2 до приблизительно 65 мг/м2, приблизительно от 25 мг/м2 до приблизительно 55 мг/м2, приблизительно от 30 мг/м2 до приблизительно 45 мг/м2 или приблизительно от 35 мг/м2 до приблизительно 40 мг/м2 антитела. В других вариантах осуществления терапевтически эффективное количество содержит приблизительно от 20 мг/м2 до приблизительно 90 мг/м2 антитела. В одном из вариантов осуществления терапевтически эффективное количество содержит от 30 мг/м2 до приблизительно 70 мг/м2 антитела.
[0152] В одном из вариантов осуществления терапевтически эффективное количество наночастиц, описываемых в настоящем документе, содержит приблизительно от 50 мг/м2 до приблизительно 200 мг/м2 белка-носителя или белка-носителя и терапевтического средства. В одном из вариантов осуществления терапевтически эффективное количество композиции наночастиц, описываемых в настоящем документе, не содержит связывающих средств. В одном из вариантов осуществления терапевтически эффективное количество композиции наночастиц, описываемых в настоящем документе, содержит менее чем приблизительно терапевтически эффективное количество паклитаксела. В предпочтительном варианте осуществления терапевтически эффективное количество содержит приблизительно менее 75 мг/м2 паклитаксела. Предусмотренные значения включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
[0153] В одном из вариантов осуществления терапевтически эффективное количество содержит приблизительно от 20 мг/м2 до приблизительно 90 мг/м2 связывающего средства, например, антитела, аптамера или слитого белка. В предпочтительном варианте осуществления терапевтически эффективное количество содержит от 30 мг/м2 до приблизительно 70 мг/м2 связывающего средства, например, антитела, аптамера или слитого белка. Предусмотренные значения включают любое значение, поддиапазон или диапазон в любом из перечисленных диапазонов, включая конечные точки.
[0154] Злокачественные опухоли или опухоли, которые можно лечить композициями и способами, описываемыми в настоящем документе, в качестве неограничивающих примеров включают злокачественные опухоли, указанные в таблицах выше, а также: рак желчных путей; злокачественные опухоли головного мозга, включая глиобластомы и медуллобластомы; рак молочной железы; рак шейки матки; хориокарциному; рак толстого кишечника; рак эндометрия; рак пищевода, рак желудка; гематологические неоплазии, включая острый лимфоцитарный и миелогенный лейкозы; множественную миелому; ассоциированные со СПИД лейкозы и Т-клеточный лейкоз взрослых; внутриэпителиальные неоплазии, включая болезнь Боуэна и болезнь Педжета; рак печени (гепатокарциному); рак легких; лимфомы, включая болезнь Ходжкина и лимфоцитарные лимфомы; нейробластомы; рак полости рта, включая плоскоклеточную карциному; злокачественные опухоли яичника, включая злокачественные опухоли, возникающие из эпителиальных клеток, стромальных клеток, половых клеток и мезенхимальных клеток; рак поджелудочной железы; рак предстательной железы; рак прямой кишки; саркомы, включая лейомиосаркому, рабдомиосаркому, липосаркому, фибросаркому и остеосаркому; рак кожи, включая меланому, саркому Капоши, базально-клеточный рак и плоскоклеточный рак; рак яичка, включая герминомы (семиному, не являющиеся семиномами опухоли [тератома, хориокарциномы]), стромальные опухоли и опухоли половых клеток; рак щитовидной железы, включая аденокарциному щитовидной железы и медуллярную карциному; и рак почки включая аденокарциному и опухоль Вильмса. В важных вариантах осуществления злокачественные опухоли или опухоли включают рак молочной железы, лимфому, множественную миелому и меланому.
[0155] Как правило, соединения по настоящему изобретению вводят в терапевтически эффективном количестве любым из приемлемых способов введения для средств, которые служат сходным целям. Фактическое количество соединения по настоящему изобретению, т.е., наночастиц, зависит от ряда факторов, таких как тяжесть подлежащего лечению заболевания, возраст и относительное состояние здоровья индивидуума, активность используемого соединения, маршрут и форма введения и другие факторы, хорошо известные специалистам в данной области.
[0156] Эффективное количество таких средств можно легко определить посредством общепринятого экспериментирования, как и наиболее эффективный и удобный маршрут введения, и наиболее подходящий состав. В данной области доступны различные составы и системы доставки лекарственных средств. См., например, Gennaro, A.R., ed. (1995) Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Co.
[0157] Эффективное количество, или терапевтически эффективное количество, или доза средства, например, соединения по изобретению, относится к такому количеству средства или соединения, которое приводит к снижению тяжести симптомов или продлению жизни индивидуума. Токсичность и терапевтическую эффективность таких молекул можно определять стандартными фармацевтическими способами в культурах клеток или у экспериментальных животных, например, посредством определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Отношение доз токсического и терапевтического эффектов представляет собой терапевтический индекс, который можно выразить как отношение LD50/ED50. Предпочтительными являются средства, которые демонстрируют более высокие терапевтические индексы.
[0158] Эффективное количество или терапевтически эффективное количество представляет собой количество соединения или фармацевтической композиции, которое вызывает биологическую или медицинскую реакцию ткани, системы, животного или человека, которую ожидает исследователь, ветеринар, лечащий врач или другой клиницист. Дозы могут варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и/или используемого маршрута введения. Точные состав, маршрут введения, дозировка и интервал дозирования следует выбирать известными в данной области способами, ввиду конкретных особенностей состояния индивидуума.
[0159] Величину и интервал дозирования можно регулировать индивидуально с обеспечением уровней активной молекулы в плазме, которых достаточно для достижения требуемого действие; т.е., минимальной эффективной концентрации (MEC). MEC варьирует для каждого соединения, но ее моно рассчитать на основе, например, данных in vitro и экспериментов над животными. Дозировки, необходимые для достижения MEC зависят от индивидуальных характеристик и маршрута введения. В случаях местного введения или селективного захвата, эффективная локальная концентрация лекарственного средства может быть не связана с концентрацией в плазме.
[0160] В родственных вариантах осуществления лечение включает введение до введения наночастиц направленного связывающего средства. В одном из вариантов осуществления направленное связывающее средство вводят в интервале приблизительно от 6 до 48 или от 12 до 48 часов перед введением наночастиц. В другом варианте осуществления направленное связывающее средство вводят в интервале от 6 до 12 часов перед введением наночастиц. В еще одном варианте осуществления направленное связывающее средство вводят в интервале от 2 до 8 часов перед введением наночастиц. В других вариантах осуществления направленное связывающее средство вводят за неделю перед введением наночастиц. Например, введение дозы BEV за 24 часа до введения комплексов наночастиц, содержащих бевацизумаб или другое связывающее VEGF антитело. В другом примере перед введением ритуксимаба до введения содержащих ритуксимаб комплексов наночастиц. Связывающее средство, вводимое до введения наночастиц, можно вводить в виде дозы, которая является субтерапевтической, такой как 1/2, 1/10 или 1/20 количества, в норме рассматриваемого как терапевтическое. Таким образом, у людей, предварительное лечение BEV может включать введение 1 мг/кг BEV, что составляет 1/10 обычной дозы, с последующим введением наночастиц или комплексов наночастиц.
ПРИМЕРЫ
[0161] Настоящее описание проиллюстрировано с использованием наночастиц, состоящих из связанного с альбумином паклитаксела или производного паклитаксела в качестве сердцевины и бевацизумаба (т.е. авастина®) или ритуксимаба (т.е. ритуксана®) в качестве антител.
[0162] Специалисту в данной области понятно, что получение и использование наночастиц из примеров приведено только с целью иллюстрации, и что настоящее описание не ограничено этой иллюстрацией.
[0163] Любое сокращение, используемое в настоящем документе, имеет нормальное научное значение. Если не указано иначе, все температуры приведены в °C. В настоящем документе, если не определено иначе, приводимые ниже термины имеют приводимые ниже значение:
Пример 1: Получение наночастиц
[0164] Паклитаксел подвергали реакции с разрушением реагентом Меервейна по схеме реакции, изложенной Samaranayake et al. in "Modified Taxols. Reaction of Taxol with Electrophilic Reagents and Preperation of a Rearranged Taxol Derivative with Tubulin Assembly Activity" (J. Org. Chem. 1991, 56, 5114-5119), полностью включенной в настоящий документ в качестве ссылки. Эта реакция разрывает C-4,C-5-оксетановое кольцо, существенно ингибируя токсичность. Реакцию и очистку проводили посредством Organix Inc. (Woburn, MA). Реакция представлена на фиг. 1.
[0165] Затем продукт Меервейна паклитаксела (20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол) гомогенизовали при высоком давлении с альбумином с получением стабильных нетоксических наночастиц (NTP). Способы гомогенизации альбумина и таксана (например, паклитаксела) можно найти, например, в патентах США №№ 5916596; 6506405; и 6537579, каждый из которых полностью включен в настоящий документ в качестве ссылки.
[0166] В кратком изложении, сывороточный альбумин человека (HSA; Sigma Aldrich) растворяли в стерильной воде с 1-1,5% масс./об. В отдельном контейнере, в хлороформе, растворяли 20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол (10% масс./масс. от HSA) до 10 мг/мл. Раствор в хлороформе добавляли в раствор альбумина и перемешивали ручным гомогенизатором в течение 5 минут при низких об./мин. Раствор пропускали через микрогомогенизирующую помпу при 1,38×108 Па в течение 15 циклов. Для предотвращения опасного повышения температуры раствора (т.е. более 50°C) змеевик насоса и сборную трубку помещали в ледяную баню. Раствор переносили в роторный испаритель с охладителем и проводили цикл при сниженном давлении в течение 45 минут с испарением хлороформа. Раствор фильтровали через 200 нм фильтр из ацетата целлюлозы.
[0167] Для получения лиофилизированных наночастиц раствор отделяли в колбы для лиофилизации с подходящими объемами с обеспечением полной лиофилизации продукта. Колбу с раствором помещали на -80°C на период 2-4 часа. Замороженный раствор в колбах лиофилизировали с использованием настольного лиофилизатора с конденсатором -85°C при <2,7 кПа.
Пример 2: Связывание NTP и бевацизумаба in vitro
[0168] Для определения взаимодействия NTP и бевацизумаба (BEV) размер NTP, получаемых в примере 1, анализировали посредством технологии Malvern Nanosight, отдельно и после инкубации с 4, 6, 8 и 10 миллиграмм на миллилитр (мг/мл) бевацизумаба в течение 30 минут.
[0169] Увеличивающийся диаметр наночастиц с увеличенной концентрацией BEV (фиг. 2A-2E) свидетельствует об увеличенном нековалентном покрытии NTP BEV. Диаметр измеряли при разведении 1:300 с использованием технологии Malvern Nanosight.
Пример 3: Аффинность связывания бевацизумаба и ритуксимаба с нетоксическими наночастицами (NTP)
[0170] Аффинность связывания (Kd) бевацизумаба (фиг. 3A) и ритуксимаб (фиг. 3B) с NTP измеряли с использованием технологии интерферометрии Bio Layer. Оба антитела биотинилировали с использованием связывания аминов, а затем индивидуально связывали со стрептавидиновым зондом BLITZ при 100 мкг/мл. NTP в различных концентрациях анализировали на связывание с зондом с периодами ассоциации и диссоциации 120 секунд. Кинетический анализ проводили посредством программного обеспечения BLITZ Evaluation. Нанопикомолекулярные аффинности свидетельствуют о сильном связывании между ритуксимабом и NTP, и бевацизумабом и NTP.
Пример 4: Стабильность нетоксических наночастиц (NTP) в PBS и сыворотке по сравнению с абраксаном® (ABX)
[0171] Получали растворы NTP и абраксана® (ABX), не содержащие антител, для 30 мкг/мл продукта Меервейна паклитаксела и паклитаксела, соответственно, в PBS. Исходное количество наночастиц на мл оценивали с использованием технологии Malvern Nanosight. Затем для обоих растворов получали диапазон разведений и определяли концентрацию частиц.
[0172] На фиг. 4A представлена стабильность ABX и NTP в солевом растворе. Наночастицы с абраксаном начинали разрушаться при разведении приблизительно 1:1,33 исходного раствора раствор до достижения исходных уровней PBS при разведении ≈1:2. Количество NTP уменьшалось линейно относительно коэффициента разведения, что свидетельствует об отсутствии разрушения частиц.
[0173] На фиг. 4B представлена стабильность ABX и NTP в сыворотке. Получали растворы NTP и ABX в сыворотке для 250 мкг/мл продукта Меервейна паклитаксела и паклитаксела, соответственно. Исходные концентрации наночастиц определяли с использованием технологии Malvern Nanosight, последующие измерения представлены в виде процента от исходной концентрации. Концентрации каждого раствора измеряли в сыворотке через 15, 30, 45 и 60 минут.
Пример 5: Блокирование CD20 клеток Дауди комплексами NTP-ритуксимаб
[0174] ABX, AR160, нетоксические наночастицы (NTP) и связанные с ритуксимабом NTP получали, как описано выше или ранее (cм., например, публикацию PCT № WO2014/055415, полностью включенную в настоящий документ в качестве ссылки). Наночастицы и немеченый ритуксимаб совместно инкубировали с CD20+ клетками лимфомы Дауди в течение 30 минут при комнатной температуре. Клетки отмывали и затем окрашивали антителом к CD20 человека с PE. Окрашенные изотипом (фиг. 5A) и антителом к CD20 (фиг. 5B) клетки служили в качестве отрицательного и положительного контролей, соответственно.
[0175] Результаты свидетельствуют, что AR160 (фиг. 5D), покрытые ритуксимабом NT частицы (NTRit; фиг. 5F) и ритуксимаб (фиг. 5G) блокируют последующее связывание антитела к CD20 человека с PE, тогда как ABX (фиг. 5C) и наночастица NT (фиг. 5E) отдельно не блокировали. Это демонстрирует, что ритуксимаб в контексте AR160 и нагруженные ритуксимабом NT частицы сохраняют свои свойства связывания лиганда.
Пример 6: Наночастицы альбумина-паклитаксела с уменьшенным количеством паклитаксела
[0176] Получали наночастицы альбумина-паклитаксела с уменьшенным по сравнению с абраксаном® количеством паклитаксела.
[0177] Например, в растворителе (например, в метиленхлориде или хлороформе и этаноле) растворяют менее 30 мг (например, от 1 мг до 25 мг) паклитаксела. Раствор добавляют в 27,0 мл раствора сывороточного альбумина человека (1% масс./об.). Смесь гомогенизируют в течение 5 минут с низкими об./мин. с получением неочищенной эмульсии, а затем переносят в гомогенизатор высокого давления. Эмульгирование проводят при 6,2×107-2,8×108 Па с рециркуляцией эмульсии в течение по меньшей мере 5 циклов. Полученную систему переносят в роторный испаритель и метиленхлорид быстро удаляют при 40°C, при пониженном давлении (4 кПа) в течение 20-30 минут. Необязательно дисперсию фильтруют через 0,22 микронный фильтр.
[0178] Фильтрованные наночастицы можно лиофилизировать и хранить.
Пример 7: Наночастицы альбумина-паклитаксела-терапевтического средства с уменьшенным количеством паклитаксела
[0179] Получали наночастицы альбумина-паклитаксела-терапевтического средства с уменьшенным по сравнению с абраксаном® количеством паклитаксела.
[0180] Например, получали наночастицы альбумина-паклитаксела, как описано в пример 6. Терапевтическое средство (например, цисплатин) инкубируют с наночастицами в отношении приблизительно 10:1 (наночастицы:средство) при комнатной температуре в течение 30 мин. В супернатанте после удаления состава наночастиц посредством ВЭЖХ определяют свободное терапевтическое средство (например, цисплатин).
Пример 8: Наночастицы альбумина-паклитаксела-антитела с уменьшенным количеством паклитаксела
[0181] Получали наночастицы альбумина-паклитаксела-антитела с уменьшенным по сравнению с абраксаном® количествами паклитаксела.
[0182] Например, наночастицы альбумина-паклитаксела получают, как описано в пример 6. Наночастицы (10 мг) комбинируют с антителом (например, бевацизумабом) (4 мг) и добавляют 840 мкл 0,9% солевого раствора с получением конечной концентрации 10 мг/мл и 2 мг/мл наночастиц и антитела, соответственно. Смесь инкубируют в течение 30 минут при комнатной температуре для обеспечения формирования частиц.
[0183] Можно получать комплекс наночастицы антитела-альбумина-паклитаксела-терапевтического средства. Необязательно, антитело инкубируют с наночастицами альбумина-паклитаксела-терапевтического средства (из примера 7) с получением комплексов наночастиц антитела-альбумина-паклитаксела-терапевтического средства. Альтернативно, антитело-наночастицы альбумина-паклитаксел можно инкубировать с терапевтическим средством с получением комплексов наночастиц антитела-альбумина-паклитаксела-терапевтического средства.
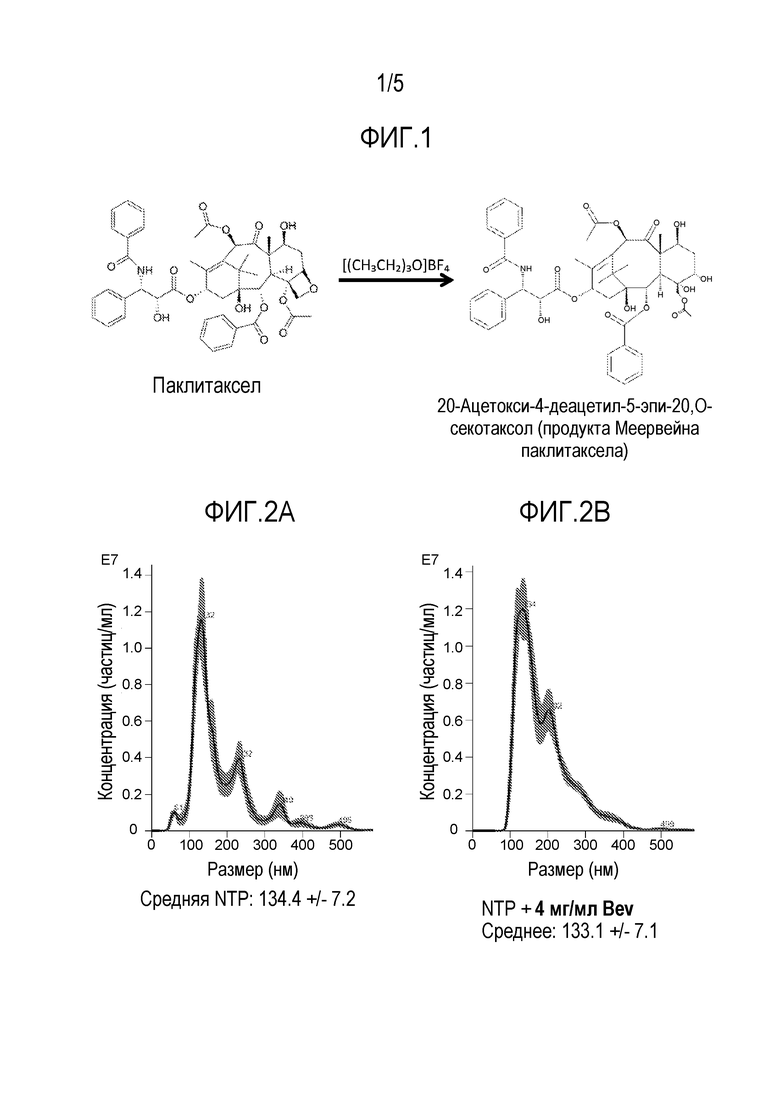
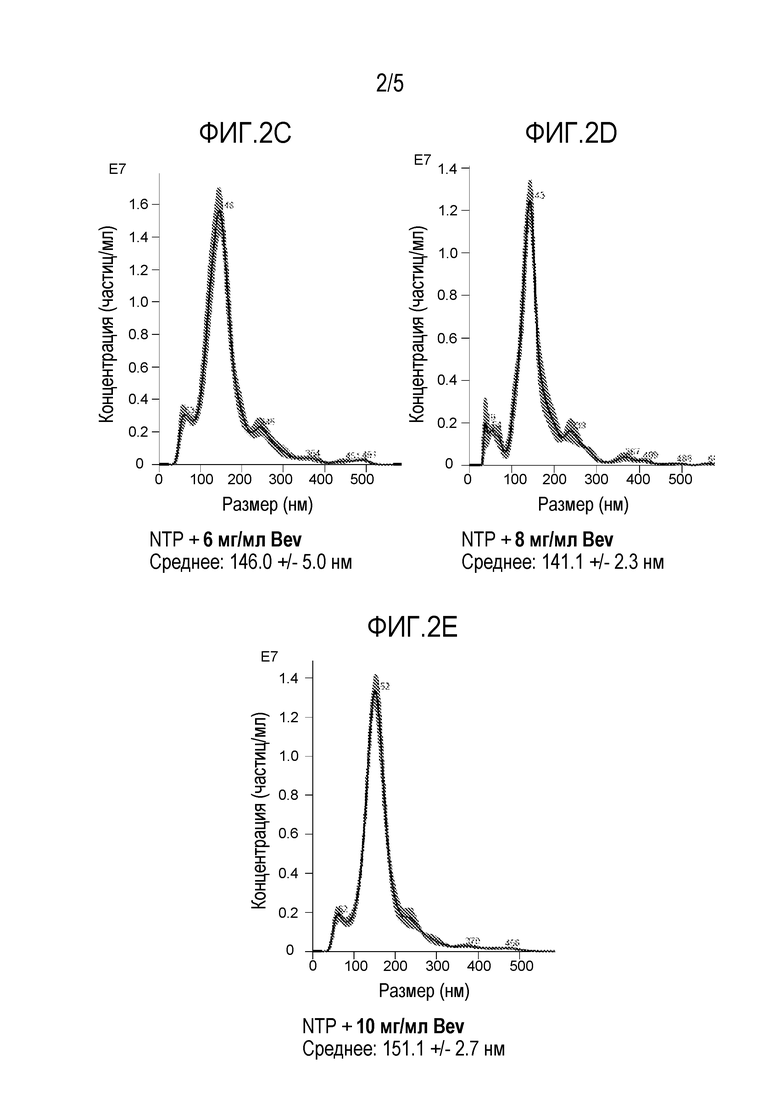

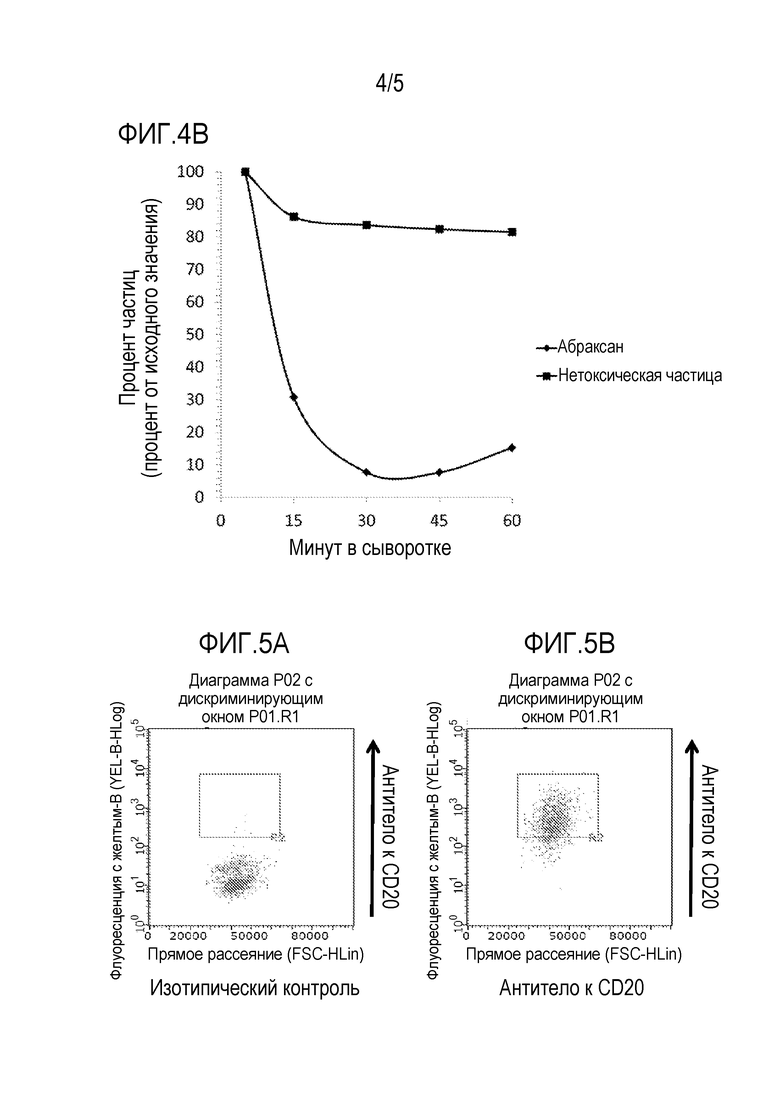
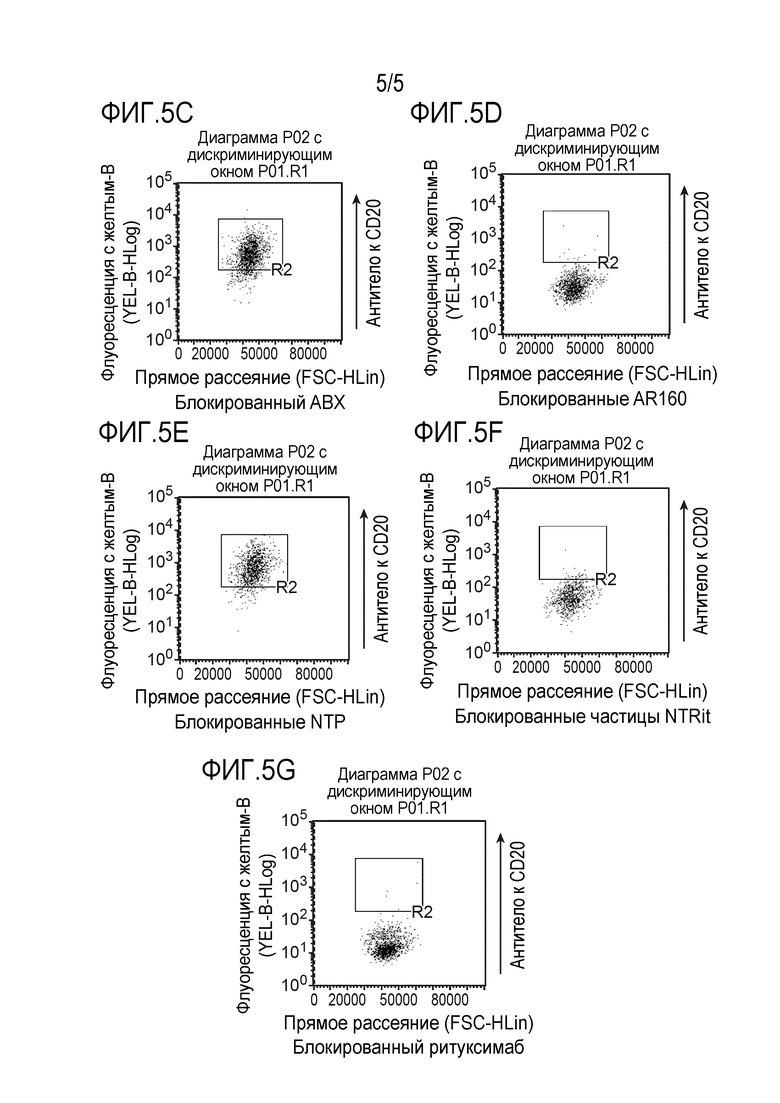
Группа изобретений относится к лечению рака. Комплекс наночастицы для лечения рака содержит альбумин, 20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол и антитела с антигенсвязывающим доменом, где антитела связаны с альбумином через нековалентные связи и расположены на внешней поверхности комплекса наночастиц и где 20-ацетокси-4-деактил-5-эпи-20,O-секотаксол менее токсичен, чем паклитаксел. Также раскрыты композиция наночастиц, способ уничтожения раковых клеток в популяции раковых клеток и способ лечения рака у нуждающегося в этом пациента. Группа изобретений обеспечивает сниженную токсичность. 4 н. и 13 з.п. ф-лы, 17 ил., 2 табл., 8 пр.
1. Комплекс наночастицы для лечения рака, содержащий:
альбумин,
20-ацетокси-4-деацетил-5-эпи-20,O-секотаксол и
антитела с антигенсвязывающим доменом,
где антитела связаны с альбумином через нековалентные связи и расположены на внешней поверхности комплекса наночастиц и, где 20-ацетокси-4-деактил-5-эпи-20,O-секотаксол менее токсичен, чем паклитаксел.
2. Комплекс наночастицы по п. 1, дополнительно содержащий терапевтическое средство.
3. Комплекс наночастицы по п. 2, где терапевтическое средство выбрано из абиратерона, бендамустина, бортезомиба, карбоплатина, кабацитаксела, цисплатина, хлорамбуцила, дазатиниба, доцетаксела, доксорубицина, эпирубицина, эрлотиниба, этопозида, эверолимуса, гефитиниба, идарубицина, иматиниба, гидроксимочевина, иматиниба, лапатиниба, лейпрорелина, мелфалана, метотрексата, митоксантрона, недаплатина, нилотиниба, оксалиплатина, паклитаксела, пазопаниба, пеметрекседа, пикоплатина, ромидепсина, сатраплатина, сорафениба, вемурафениба, сунитиниба, тенипозида, триплатина, винбластина, винорелбина, винкристина или циклофосфамида.
4. Комплекс наночастицы по п. 1, где отношение относительных масс альбумина и 20-ацетокси-4-деацетил-5-эпи-20,O-секотаксола составляет менее чем 10:1.
5. Комплекс наночастицы по п. 1, где антиген представляет собой CD3, CD19, CD20, CD38, CD30, CD33, CD52, PD-1, PD-L1, PD-L2, CTLA-4, RANK-L, GD-2, Ly6E, HER3, EGFR, DAF, рецептор ERBB-3, CSF-1R, HER2, STEAP1, CD3, CEA, CD40, OX40, Ang2-VEGF или VEGF.
6. Комплекс наночастицы по п. 1, который является лиофилизированным.
7. Комплекс наночастицы по п. 6, стабильный при температурах от 20°C до 25°C в течение 12 месяцев или долее.
8. Комплекс наночастицы по п. 1, который не является олигомеризованным.
9. Комплекс наночастицы по п. 1 с размером от 70 нм до 800 нм.
10. Комплекс наночастицы по п. 1 с размером от 100 нм до 200 нм.
11. Комплекс наночастицы по п. 1, где антитела выбраны из алемтузумаба, атезолизумаба, бевацизумаба, цетуксимаба, денозумаба, динутоксимаба, ипилимумаба, ниволумаба, обинутузумаба, офатумумаба, панитумумаба, пембролизумаба, пертузумаба, ритуксимаба, авелумаба, дурвалумаба, пидилизумаба, BMS 936559, OKT3 и трастузумаба.
12. Комплекс наночастицы по п. 1, где альбумин представляет собой сывороточный альбумин человека.
13. Комплекс наночастицы по п. 12, где альбумин представляет собой рекомбинантный сывороточный альбумин человека.
14. Комплекс наночастицы по п. 1 с константой диссоциации от 1 × 10-11 M до 1 × 10-9 M.
15. Композиция наночастиц, содержащая комплекс наночастиц по п. 1.
16. Способ уничтожения раковых клеток в популяции раковых клеток, где способ включает приведение клеток в контакт с эффективным количеством комплекса наночастиц по п.1, где указанные комплексы поддерживают в контакте с указанными клетками в течение достаточного для уничтожения раковых клеток периода времени.
17. Способ лечения рака у нуждающегося в этом пациента, где способ включает введение пациенту композиции по п.15.
| WO 2006089290 A1, 24.08.2006 | |||
| US 20150246122 A1, 03.09.2015 | |||
| Samaranayake G | |||
| et al | |||
| Modified taxols | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Reaction of taxol with electrophilic reagents and preparation of a rearranged taxol derivative with tubulin assembly activity // Journal of Organic Chemistry, 1991, Vol:56, P | |||
| Способ получения борнеола из пихтового или т.п. масел | 1921 |
|
SU114A1 |
| НОСИТЕЛИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2008 |
|
RU2505315C2 |
| WO 2010118365 A1, 14.10.2010 | |||
Авторы
Даты
2021-10-06—Публикация
2017-09-06—Подача