ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к средствам и способам детектирования бактериальных инфекций, способам различения между вирусными и бактериальными инфекциями, способам стратификации пациентов для последующего лечения и целей дальнейшей диагностики и способам мониторинга антибактериальной терапии. Настоящее изобретение основано на детектировании специфических эпитопов липокалина нейтрофилов человека (HNL) с использованием специфических связывающих средств.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Возникают и глобально распространяются новые механизмы резистентности к антибиотикам, что угрожает возможности лечить обычные инфекционные заболевания, приводит к смерти и инвалидности индивидуумов, которые до недавнего времени могли продолжать нормальный образ жизни. В отсутствие эффективного антиинфекционного лечения многие стандартные медицинские процедуры становятся неудачными или превращаются в очень высокорискованные процедуры (http://www.who.int/mediacentre/factsheets/fs194/en/; Antimicrobial resistance - Информационный бюллетень № 194, обновлен в апреле 2014 года).
В 2012 году было зарегистрировано около 450000 новых случаев туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ). Туберкулез с широкой лекарственной устойчивостью (ШЛУ-ТБ) был идентифицирован в 92 странах. Для лечения МЛУ-ТБ требуются курсы лечения, которые намного длиннее и менее эффективны, чем для нерезистентного ТБ. Во всех регионах мира высок уровень резистентности к антибиотикам (ABR) у бактерий, которые вызывают распространенные инфекции (например, инфекции мочевыводящих путей, пневмонию, инфекции кровотока). Высокий процент госпитальных инфекций вызван высоко резистентными бактериями, такими как метициллин-резистентный Staphylococcus aureus (MRSA) или полирезистентные грамотрицательные бактерии. В настоящее время в 10 странах сообщалось о неудачах лечения вследствие резистентности к крайним мерам лечения гонореи (цефалоспорины третьего поколения). Гонорея может вскоре стать неизлечимой, так как вакцины или новые препараты не разрабатываются. Пациенты с инфекциями, вызванными лекарственно-устойчивыми бактериями, как правило, подвергаются повышенному риску ухудшения клинических исходов и смерти и потребляют больше ресурсов здравоохранения, чем пациенты, инфицированные теми же, но не резистентными, бактериями.
Например, коэффициент смертности для пациентов с серьезными инфекциями, вызванными распространенными резистентными бактериями, которые подвергались лечению в стационаре, может быть приблизительно вдвое выше, чем у пациентов с инфекциями, вызванными теми же не резистентными бактериями. Например, люди с MRSA, другим распространенным источником тяжелых инфекций в обществе и в больницах, по оценкам умирают на 64% чаще, чем люди с нерезистентной формой этой инфекции.
Различные типы поведения способствуют развитию AMR. Например, антибиотики широко используются для профилактики в разведении животных и промышленном животноводстве, например для увеличения прибавки в весе. Это приводит к развитию резистентных бактерий у этих животных, их передаче людям, работающим с этими животными, или потребителям, покупающими и использующими продукты от затронутых этим животных или ферм. Другой проблемой является загрязнение окружающей среды вокруг животноводческой фермы. Кроме того, развитие AMR может также быть результатом неосторожного назначения и распределения противомикробных препаратов, например антибиотиков, пациентам, которые не нуждаются в этих медикаментах, например потому, что тяжесть заболевания не оправдывает использование антибиотиков, или заболевание не вызвано бактериальной инфекцией. Кроме того, в некоторых странах антибиотики свободно доступны в качестве безрецептурных препаратов. Пациенты часто используют эти антибиотики в течение не достаточно продолжительного периода времени, они используют неподходящие антибиотики для соответствующих заболеваний, или они должным образом не утилизируют оставшиеся антибиотики, но выпускают их в окружающую среду, например, смывая их в унитаз.
В данной области существует растущая потребность в различении между бактериальными и вирусными инфекциями и введении антибиотиков только пациентам с подтвержденными бактериальными инфекциями. Одной из целей настоящего изобретения является обеспечение средств и способов для этой цели.
Липокалин нейтрофилов человека (HNL) (также называемый липокалином, ассоциированным с желатиназой нейтрофилов (NGAL)), представляет собой широко распространенный гликопротеин, первоначально выделенный из нейтрофилов человека и локализованный в их специфических гранулах. HNL/NGAL существует в виде мономера 25 кДа или в виде дисульфидно-связанного гомодимера 45 кДа, и он ковалентно конъюгирован с желатиназой (матричной металлопротеиназой 9) с помощью межмолекулярного дисульфидного мостика в виде гетеродимерной формы 135 кДа (Cai et al., Clin J Am Soc Nephrol. Dec 2010; 5(12): 2229-2235). Аминокислотная последовательность HNL показана в SEQ ID NO: 1, что соответствует последовательности белка, которую можно найти на странице www.uniprot.org/uniprot/P80188, в частности то касается изоформы 1.
Дискриминационная способность HNL при различении острых вирусных и острых бактериальных инфекций продемонстрировала вариации чувствительности и специфичности 75-94%. Более низкие цифры, очевидно, не являются удовлетворительными в клинических условиях, и целью разработки должен быть анализ с помощью HNL, который надежно исключает бактерии в качестве причины острых инфекций, для того чтобы уменьшить необходимость в лечении этой инфекции с помощью антибиотиков. Второй целью должна быть надежная идентификация тех острых инфекций, для которых необходимо лечение антибиотиками.
Измерение HNL (липокалина нейтрофилов человека) в сыворотке или плазме может быть использовано для различения вызванных вирусом и вызванных бактериями острых инфекций, как раскрыто в EP 0756708 B1.
Целью настоящего изобретения является предоставление новых связывающих средств, специфически распознающих HNL, и предоставление способов и применений таких связывающих средств, например, при детектировании бактериальных инфекций, выборе подходящего лечения пациентов и тому подобном.
Другой целью настоящего изобретения является мониторинг пациентов с сепсисом, подвергаемых антибактериальной терапии, например для помощи при определении эффективности лечения и времени прекращения приема антибиотиков, посредством многократного тестирования образца пациентов в различные моменты времени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает средства и способы для детектирования HNL в образце. Этими средствами являются связывающие средства, например антитела или их производные, которые характеризуются своими связывающими областями (например, областями CDR), а также своей способностью специфически связываться с HNL. Связывающие средства настоящего изобретения могут быть использованы для специфического детектирования HNL и позволяют различать между бактериальными и вирусными инфекциями. В некоторых вариантах осуществления количество HNL в качестве параметра подходит для идентификации бактериальных инфекций и/или различения между бактериальными и вирусными инфекциями и может использоваться для диагностирования заболевания, прогнозирования клинических исходов или в мониторинге курса антибактериального лечения. Правильный диагноз острой бактериальной инфекции делает возможным соответствующее назначение антибиотиков субъекту, образец которого подвергнут анализу на присутствие или отсутствие или количество HNL, например в образцах крови или образцах мочи.
В вариантах осуществления настоящего изобретения биологический образец может быть предварительно обработан активатором нейтрофилов для улучшения детектирования HNL и дальнейшего улучшения раскрытых в настоящем документе способов. В предпочтительных вариантах осуществления активатор нейтрофилов представляет собой N-формилпептид, более предпочтительно трипептид fMLP. В других вариантах осуществления активатор нейтрофилов представляет собой белок A или может представлять собой комбинацию fMLP и белка A. Настоящее изобретение также предусматривает, что активатор нейтрофилов представляет собой липополисахарид (LPS), фактор активации тромбоцитов, неметилированный олигонуклеотид CpG или фактор некроза опухоли (TNF). Таким образом, в соответствии с конкретными вариантами осуществления настоящего изобретения активатор нейтрофилов может представлять собой любую комбинацию двух или более из элементов, выбранных из группы, состоящей из fMLP, белка A, липополисахарида (LPS), фактора активации тромбоцитов, неметилированного олигонуклеотида CpG и фактора некроза опухоли (TNF).
В одном варианте осуществления настоящего изобретения полипептид, например рекомбинантно полученный полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам HNL 83-154, или мономерный или димерный HNL, очищенный из человеческой плазмы/сыворотки, может быть использован для получения связывающего средства, специфически распознающего HNL. Полипептид можно использовать для иммунизации животного, получения антителообразующих клеток, продуцирования гибридомных клеток, сбора антител, необязательно, выяснения их последовательности и, также необязательно, продуцирования рекомбинантных антител, характеризации этих антител в отношении их способности специфически связывать HNL и использования этих антител в диагностировании бактериальных инфекций посредством определения уровня HNL в образце. Антитела могут быть модифицированы, как описано в настоящем документе ниже.
В вариантах осуществления настоящего изобретения предлагаются способы детектирования или диагностирования бактериальной и/или вирусной инфекции или обеспечения различения между вирусными и бактериальными инфекциями, отличающиеся тем, что уровень HNL в образце измеряют с использованием связывающего средства, специфически связывающегося с аминокислотами эпитопов HNL, которые экспонированы на внутренней и внешней периферийных поверхностях, изображенных на фиг. 1, причем эти эпитопы, предпочтительно, содержат аминокислоты 83-88 (предпочтительно, аминокислоты 82-102) и/или 141-156 HNL, изображенного в SEQ ID NO. 1. В дополнительных вариантах осуществления эти эпитопы дополнительно содержат аминокислоты 51-76 и/или 113-132 HNL, изображенного в SEQ ID NO: 1.
Таким образом, в некоторых вариантах осуществления связывающие средства, раскрытые в настоящем документе, и способы, в которых используют упомянутые связывающие средства, распознают специфически аминокислоты, охватываемые аминокислотами 51-76, и/или 82-102, и/или 113-132, и/или 141-156 HNL (SEQ ID NO: 1). В особенно предпочтительном варианте осуществления связывающее средство способно к специфическому связыванию с полипептидным эпитопом HNL, причем упомянутый полипептидный эпитоп содержит аминокислоты 141-156 HNL, определенного в SEQ ID NO: 1, или причем упомянутый полипептидный эпитоп представляет собой конформационный эпитоп, охватываемый пептидом в соответствии с SEQ ID NO: 26.
В предпочтительных вариантах осуществления настоящего изобретения связывающее средство связывается с HNL, который по меньшей мере преимущественно продуцируется нейтрофилами.
В некоторых вариантах осуществления настоящего изобретения связывающее средство, раскрытое и используемое в настоящем документе, связывается с областью HNL, которую охватывает последовательность, изображенная в SEQ ID NO: 26.
В некоторых вариантах осуществления настоящего изобретения связывающее средство содержит специфичную к эпитопу HNL связывающую область, содержащую по меньшей мере одну, две, три, четыре, пять или шесть аминокислотных последовательностей, изображенных в SEQ ID NO: 8-13, 14-19 и 20-25, или их функциональное производное.
В другом варианте осуществления настоящего изобретения предлагается способ диагностирования инфекции, например бактериальной инфекции, или повторного тестирования на бактериальную инфекцию, например в течение курса лечения с помощью антибиотиков, или отличения бактериальной инфекции от вирусной инфекции, отличающийся тем, что образец, например образец, полученный от субъекта, который, как полагают, имеет бактериальную или вирусную инфекцию, анализируют на наличие уровня HNL с использованием связывающего средства, специфически связывающегося с последовательностью, изображенной в SEQ ID NO: 26 или определенной в настоящем документе выше. Упомянутый способ может включать этапы:
a) инкубирования образца в присутствии упомянутого связывающего средства;
b) необязательно, смывания несвязанного материала образца;
c) измерения уровня HNL в образце от субъекта, который, как полагают, имеет бактериальную или вирусную инфекцию;
d) сравнения уровня HNL, измеренного на этапе c), с одним или несколькими контрольными образцами, необязательно полученными от
(i) здоровых субъектов,
(i) субъектов, о которых известно, что они имеют бактериальную инфекцию, и
(iii) субъектов, о которых известно, что они имеют вирусную инфекцию, и/или,
необязательно, сравнения уровня HNL, измеренного на этапе c), с одним или несколькими нормализованными контрольными значениями, характерными для здоровых субъектов, субъектов с вирусной инфекцией и/или субъектов с бактериальной инфекцией.
В конкретном варианте осуществления способ включает дополнительный этап диагностирования бактериальной инфекции, когда уровень HNL на этапе c) значительно выше, чем уровень, детектированный в контрольных образцах (i) здоровых субъектов и (iii) пациентов, о которых известно, что они имеют вирусную инфекцию.
В другом аспекте настоящее изобретение относится к способу исключения бактериальной инфекции у субъекта, содержащему:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) исключение бактериальной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
В другом аспекте настоящее изобретение предлагает способ исключения вирусной инфекции у субъекта, включающий:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) исключение вирусной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение.
В еще одном аспекте настоящее изобретение относится к способу подтверждения бактериальной инфекции у субъекта, содержащему:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) подтверждение бактериальной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение.
В еще одном аспекте настоящее изобретение предлагает способ подтверждения вирусной инфекции у субъекта, включающий
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) подтверждение вирусной инфекции у субъекта, если концентрация полипептида TRAIL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
В одном варианте осуществления вышеуказанный способ исключения бактериальной инфекции или подтверждения вирусной инфекции дополнительно включает
a) измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) исключение бактериальной инфекции или подтверждение вирусной инфекции у субъекта, если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение.
В другом варианте осуществления вышеуказанный способ исключения вирусной инфекции или способ подтверждения бактериальной инфекции дополнительно включает
a) измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) подтверждение бактериальной инфекции или исключение вирусной инфекции у субъекта, если концентрация полипептида TRAIL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
В другом аспекте настоящее изобретение относится к способу различения между бактериальной инфекцией и вирусной инфекцией у субъекта, включающему:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и CRP, необязательно TRAIL, в образце, полученном от субъекта;
b) применение предварительно определенной математической функции к концентрациям HNL и CRP и, необязательно, TRAIL, для вычисления балльной оценки;
c) сравнение балльной оценки с предварительно определенным эталонным значением.
В еще одном аспекте настоящее изобретение предлагает способ различения между бактериальной или смешанной инфекцией и вирусной инфекцией у субъекта, включающий:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и CRP, необязательно TRAIL, в образце, полученном от субъекта;
b) применение предварительно определенной математической функции к концентрациям HNL и CRP и, необязательно, TRAIL, для вычисления балльной оценки;
c) сравнение балльной оценки с предварительно определенным эталонным значением.
В соответствии с другим аспектом настоящее изобретение предлагает способ предоставления рекомендаций в отношении лечения субъекту, включающий:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) рекомендацию субъекту принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение;
c) рекомендацию пациенту не принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение; или
d) рекомендацию пациенту принимать противовирусное лечение, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение.
В одном варианте осуществления способ предоставления рекомендаций в отношении лечения субъекту дополнительно включает на этапе a) дополнительное измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) рекомендацию субъекту принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение, и если концентрация TRAIL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение;
c) рекомендацию пациенту не принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, и если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение; или
d) рекомендацию пациенту принимать противовирусное лечение, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, и если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение.
В соответствии с другим аспектом настоящее изобретение относится к способу предоставления рекомендаций в отношении диагностического тестирования субъекту, включающему:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) рекомендацию тестировать образец на присутствие бактерий, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение; или
c) рекомендацию тестировать образец на присутствие вируса, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение.
В соответствии с одним вариант осуществления способ предоставления рекомендаций в отношении диагностического тестирования субъекту дополнительно включает на этапе a) дополнительное измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) рекомендацию тестировать образец на присутствие бактерий, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение, и если концентрация TRAIL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение;
c) рекомендацию тестировать образец на присутствие вируса, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, и если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение.
Настоящее изобретение дополнительно предлагает, в другом аспекте, способ исключения инфекционного заболевания, предпочтительно бактериального или вирусного заболевания, у субъекта, включающий:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и концентрации полипептида одного или нескольких полипептидов, выбранных из группы, состоящей из TRAIL, IP10, ILIRa или Mac-2BP, в образце, полученном от субъекта;
b) применение предварительно определенной математической функции к измеренным концентрациям полипептидов для вычисления балльной оценки
c) сравнение балльной оценки с предварительно определенным эталонным значением.
В еще одном аспекте настоящее изобретение относится к способу идентификации типа инфекции, предпочтительно бактериальной или вирусной инфекции, у субъекта, включающему:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и уровней первой полипептидной детерминанты, выбранной из группы, состоящей из TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксина, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанных с IgG молекул, IL1, I-TAC и TNFR1, в образце, полученном от субъекта; и
b) измерение уровней второй детерминанты, выбранной из группы, состоящей из
(i) полипептидных детерминант TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксина, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанных с IgG молекул, IL1, I-TAC и TNFR1;
(ii) полипептидных детерминант IFITM3, IFIT3, EIF4B, IFIT1, LOC26010, MBOAT2, MX1, OAS2, RSAD2, ADIPOR1, CD15, CD8A, IFITM1 и IL7;
(iii) полипептидных детерминант CRP, SAA, TREM-1, PCT, IL-8, TREM-1 и IL6; или
(iv) неполипептидных детерминант возраста, абсолютного количества нейтрофилов (ANC), абсолютного количества лимфоцитов (ALC), % нейтрофилов (Neu (%)), % лимфоцитов (Lym (%)), % моноцитов (Mono (%)), максимальной температуры, времени, прошедшего после симптомов, креатинина (Cr), калия (K), пульса и мочевины;
c) сравнение уровней HNL, первой и второй детерминант с эталонным значением, посредством чего идентифицируют тип инфекции у субъекта, причем измерение первой и/или второй детерминанты повышает точность идентификации типа инфекции по измерению HNL.
В другом аспекте настоящее изобретение относится к способу идентификации типа инфекции, предпочтительно бактериальной или вирусной инфекции, у субъекта, включающему:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и уровней одной или нескольких полипептидных детерминант, выбранных из группы, состоящей из ABTB1, ADIPOR1, ARHGDIB, ARPC2, ATP6V0B, Clorf83, CD15, CES1, CORO1A, CSDA, EIF4B, EPSTI1, GAS 7, HERC5, IFI6, KIAA0082, IFIT1, IFIT3, IFITM1, IFITM3, LIPT1, IL7R, ISG20, LOC26010, LY6E, LRDD, LTA4H, MAN1C1, MBOAT2, NPM1, OAS2, PARP12, PARP9, QARS, RAB13, RAB31, RAC2, RPL34, PDIA6, PTEN, RSAD2, SART3, SDCBP, SMAD9, SOCS3, TRIM22, SART3, UBE2N, XAF1, ZBP1, CRP и MX1, в образце, полученном от субъекта; и
b) сравнение уровней HNL и одной или нескольких полипептидных детерминант с эталонным значением, посредством чего идентифицируют тип инфекции у субъекта.
В одном варианте осуществления способ идентификации типа инфекции дополнительно включает измерение одной или нескольких неполипептидных детерминант, выбранных из группы, состоящей из возраста, абсолютного количества нейтрофилов (ANC), абсолютного количества лимфоцитов (ALC), % нейтрофилов (Neu (%)), % лимфоцитов (Lym (%)), % моноцитов (Mono (%)), максимальной температуры, времени, прошедшего после симптомов, креатинина (Cr), калия (K), пульса и мочевины.
В другом варианте осуществления уровень детерминант абсолютное количество нейтрофилов (ANC) и % нейтрофилов (Neu (%)) используют для нормализации уровня HNL.
В другом варианте осуществления настоящего изобретения предлагаются способы стратификации субъектов на имеющих бактериальное заболевание и не имеющих бактериальное заболевание, включающие вышеуказанные этапы и, необязательно, включающие этап терапевтического введения антибиотиков субъектам, идентифицированным как инфицированные бактериями.
В некоторых вариантах осуществления настоящего изобретения образец выбирают из группы, состоящей из крови (то есть цельной крови) или ее фракций, например сыворотки, плазмы и/или мочи, спинномозговой жидкости (CSF), костного мозга, слюны и мокроты.
Местоположениями, к которым можно использовать тесты, раскрытые в настоящем документе, и можно осуществлять описанные способы, являются отделения интенсивной терапии (ICU), больницы, особенно отделения неотложной помощи, отделения новорожденных, кабинеты врачей общей практики/специалистов, аптеки, общественные больницы и условия 1 уровня и 2 уровня.
В другом варианте осуществления настоящее изобретение предлагает устройство для диагностирования бактериальных инфекций, причем упомянутое устройство содержит по меньшей мере отсек, например область контакта, который содержит описанные в настоящем документе связывающие средства. Устройство может представлять собой тест-полоску с иммобилизованными связывающими средствами по меньшей мере на (части) своей поверхности, частицы, несущие иммобилизованные связывающие средства по меньшей мере на (части) своей поверхности, и так далее. Поверхность может быть трехмерной, например вышеуказанные связывающие средства могут нести частицы с частично пористой поверхностью (слоем). Важно, что устройство содержит область контакта, которая может быть доступна для образца, который анализируют, например образца, который, как полагают, содержит HNL. В вариантах осуществления устройства изобретения возможно определение уровня HNL. В других вариантах осуществления устройство может быть соединено с другими устройствами, например подходящими для забора образца крови от субъекта, который, как полагают, имеет бактериальную инфекцию, или оно может быть соединено с компьютером или приспособлением, делающим возможными анализ и измерение взаимодействия между связывающими средствами, раскрытыми в настоящем документе, и HNL, который присутствует в образце. Взаимодействие может быть измерено с использованием физического, химического или биологического сигнала, который специфически генерируется при связывании HNL и описанного в настоящем документе связывающего средства (средств). Взаимодействие может создавать измеримый сигнал, например хромогенный сигнал, флюорогенный сигнал, спектроскопически измеримый сигнал, изменение ионизации, изменение проводимости и тому подобное по сравнению с контролем, в котором не происходит никого взаимодействия.
В конкретном варианте осуществления устройство, упомянутое выше, дополнительно содержит связывающее средство для одной или нескольких из дополнительных полипептидных детерминант, упомянутых выше, причем упомянутые реакции характерны для взаимодействия полипептидных детерминант, и что, также необязательно, позволяет определять уровень упомянутых полипептидных детерминант в упомянутом образце.
В конкретном варианте осуществления настоящее изобретение относится к способу, как определено в настоящем документе выше, который дополнительно содержит измерение уровня C-реактивного белка, и/или TRAIL, и /или прокальцитонина, и/или CD64, и/или определение количества белых кровяных клеток, и/или определение количества нейтрофилов.
В другом варианте осуществления настоящее изобретение предлагает способ получения антитела, включающий этап культивирования антитело-продуцирующих клеток, полученных от животного, которое ранее подвергалось воздействию антигена, содержащего последовательность в соответствии с SEQ ID NO: 26, и предоставления антител, необязательно с последующей модификацией полученных антител. Предпочтительно, антитела содержат связывающую область, содержащую по меньшей мере одну, две, три, четыре, пять или шесть аминокислотных последовательностей, изображенных в SEQ ID NO: 1-6, 7-12 и 13-18, или их функциональное производное.
Приведенное выше краткое изложение не предназначено для определения каждого аспекта настоящего изобретения, и дополнительные аспекты описаны в других разделах, таких как подробное описание. Весь документ следует рассматривать как единое раскрытие, и следует понимать, что могут быть рассмотрены все комбинации признаков, описанных в настоящем документе, даже если комбинация признаков не приведены вместе в одном предложении, или абзаце, или разделе данного документа.
В дополнение к вышеуказанному, настоящее изобретение может включать в себя в качестве дополнительного аспекта все варианты осуществления настоящего изобретения, в любом смысле более узкие по объему, чем варианты, определенные конкретными абзацами в настоящем документе. Например, некоторые аспекты настоящего изобретения описаны как род, и следует понимать, что каждый член рода по-отдельности представляет собой аспект настоящего изобретения. Кроме того, следует понимать, что аспекты, описанные как род или выбирающие член рода, охватывают комбинации двух или более членов рода.
Следует понимать, что хотя различные варианты осуществления в описании изобретения представлены с использованием термина "содержащий", в других условиях родственный вариант осуществления может также быть описан с использованием терминов "состоящий из" или "состоящий по существу из".
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой графическое представление молекулы HNL.
Фиг. 2 показывает результаты экспериментов по активации с нейтрофилами, очищенными из крови пациентов и здорового контроля с использованием fMLP. Нейтрофилы подвергали воздействию различных концентраций fMLP и инкубировали в течение 15 мин при 37°C, а затем центрифугировали и супернатант анализировали на присутствие HNL. Было обнаружено, что оптимальная концентрация для высвобождения fMLP составляет 5×10-8 моль/л. Для изучения кинетики высвобождения HNL очищенные клетки инкубировали в течение различных промежутков времени. Значительное высвобождение наблюдалось после 5 минут инкубации и дополнительно увеличивалось при длительной инкубации.
Фиг. 3 показывает тесты в отношении склонности к высвобождению HNL нейтрофилами после инкубации с fMLP. В цельной крови после коагуляции высвобождение HNL из нейтрофилов, очищенных от XX пациентов с острыми инфекциями и YY здоровых субъектов, сравнивали с концентрациями HNL в сыворотке у соответствующих субъектов. Была получена значимая и линейная корреляция (r=0,743, p=0,002) между концентрациями HNL в супернатанте и сыворотке.
Фиг. 4 a и b показывают концентрации HNL в цельной крови после активации с помощью fMLP в течение 20 мин при 37°C и в ЭДТА-плазме. Концентрации HNL в fMLP-активированной цельной крови здоровых субъектов (геометрическое среднее 98 мкг/л, 95% ДИ 90-107 мкг/л) значительно ниже, чем концентрации, измеренные у пациентов с бактериальными (геометрическое среднее 337 мкг/л, 95% ДИ 300-379 мкг/л) (p<0,0001) и пациентов с вирусными инфекциями (геометрическое среднее 117 мкг/л, 95% ДИ 101-136 мкг/л) (p<0,05).
Фиг. 5 a и b показывают диагностическую эффективность двух анализов на HNL, то есть в fMLP-активированной цельной крови и в ЭДТА-плазме. Различие между здоровыми неинфицированными субъектами и субъектами с подтвержденной бактериальной инфекцией показано с помощью рабочих характеристических (ROC) кривых. Площадь под кривой (AUC) для теста на HNL на fMLP-активированной цельной крови составила 0,95 (95% 0,91-0,97) по сравнению с 0,88 (95% ДИ 0,84-0,91), p=0,0003 для теста на HNL на ЭДТА-плазме. Для fMLP-активированной цельной крови прогностическое значение отрицательного результата (NPV) при 125 мкг/л HNL составляло 90% (95% ДИ 82-96%), а значение положительного результата 83% (95% ДИ 77-89%). Для ЭДТА-плазмы при концентрации HNL, составляющей 40 мкг/л, NPV составляло 86% (95% ДИ 72-95%), а PPV 63% (95% ДИ 57-69%). При различении между бактериальными и вирусными инфекциями AUC для fMLP-активированной цельной крови составляло 0,92 (95% ДИ 0,87-0,96), а для ЭДТА-плазмы 0,79 (95% ДИ 0,71-0,85), p=0,0006. При концентрации, составляющей 110 мкг/л, NPV составляло 93% (95% ДИ 68-100%), а PPV 85% (77-90%) для fMLP-активированной цельной крови. Соответствующие значения для HNL при концентрации в ЭДТА-плазме, составляющей 40 мкг/л, составляли NPV 52% (95% ДИ 37-67%), а PPV 85% (95% ДИ 78-90%). NPV не превышало 60% при любой концентрации HNL в ЭДТА-плазме. Таким образом, клиническая эффективность HNL в fMLP-активированной цельной крови оказалась выше, чем у HNL в ЭДТА-плазме как при различении между здоровыми субъектами и бактериальными инфекциями, так и при различении между бактериальными и вирусными инфекциями.
Фиг. 6 a-d показывают распределение биомаркеров CRP, количества нейтрофилов в крови, экспрессии CD64 на нейтрофилах крови и прокальцитонина в исследованных популяциях. За исключением количеств нейтрофилов, все другие биомаркеры были значительно повышенными как при бактериальных, так и вирусных инфекциях по сравнению со здоровыми субъектами (p<0,0001).
Фиг. 7 показывает димер HNL. Димер HNL стабилизирован с помощью цистеинового мостика, указанного черным, между двумя структурами мономера HNL. Области, участвующие в связывании антитела с антигеном, указанны черным (левая и правая часть фигуры).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Хотя настоящее изобретение будет описано со ссылкой на конкретные варианты осуществления, это описание не следует истолковывать в ограничивающем смысле. Перед подробным описанием типичных вариантов осуществления настоящего изобретения приведены определения, важные для понимания настоящего изобретения.
Как используется в данном описании изобретения и в прилагаемой формуле изобретения, формы единственного числа также включают в себя формы множественного числа, если из контекста явно не следует иное.
В контексте настоящего изобретения термины "около" и "приблизительно" обозначают интервал точности, при котором, как понятно специалисту в данной области техники, остается обеспечен технический эффект рассматриваемого признака. Данный термин, как правило, указывает на отклонение от указанного числового значения, составляющее ±20%, предпочтительно ±15%, более предпочтительно ±10% и, даже более предпочтительно, ±5%.
Следует понимать, что термин "содержащий" не является ограничивающим. Для целей настоящего изобретения термин "состоящий из" рассматривают как предпочтительный вариант осуществления термина "содержащий". Если далее в данном документе группу определяют как содержащую по меньшей мере некоторое количество вариантов осуществления, это также означает, что она охватывает группу, которая, предпочтительно, состоит только из данных варианты осуществления.
Кроме того, термины "первый", "второй", "третий" или "(a)", "(b)", "(c)", "(d)" и так далее и тому подобное в описании и в формуле изобретения используются для различения одинаковых элементов и не обязательно для описания последовательного или хронологического порядка. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми при соответствующих обстоятельствах, и что варианты осуществления настоящего изобретения, описанные в настоящем документе, могут выполняться в другой последовательности, чем описано или проиллюстрировано в настоящем документе.
В случае, когда термины "первый", "второй", "третий" или "(a)", "(b)", "(c)", "(d)" и так далее относятся к этапам способа, или применения, отсутствует согласование времени или временных интервалов между этапами, то есть этапы могут быть выполнены одновременно, или могут иметь место временные интервалы, составляющие секунды, минуты, часы, дни, недели, месяцы или даже годы между такими этапами, если иное не указано в заявке, как она изложена в настоящем документе выше или ниже. Следует понимать, что настоящее изобретение не ограничено конкретными методологией, протоколами, белками, бактериями, векторами, реагентами и так далее, описанный в настоящем документе, поскольку они могут варьироваться. Кроме того, следует понимать, что терминология, используемая в настоящем документе, служит только для цели описания конкретных вариантов осуществления, и не предназначена для ограничения объема настоящего изобретения, который будет ограничен только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют значения, которые обычно понятны среднему специалисту в данной области техники.
В контексте настоящего изобретения термин "связывающее средство" обозначает любую молекулу, например пептиды, содержащие природные и/или модифицированные аминокислоты, которые позволяют им специфически связываться с последовательностями описанных в настоящем документе областей или эпитопов HNL, например связывающее средство, которое связывается с областью HNL, которая экспонирована на внутренней и/или внешней периферийной поверхности упомянутой молекулы, как изображено на фиг. 1 (темные части 3D-изображения). Связывающие средства специфически распознают аминокислоты, охватываемые аминокислотами 51-76, и/или 82-102, и/или 113-132, и/или 141-156 HNL, изображенного в SEQ ID NO: 1, и, в частности, прерывистый, предпочтительно нелинейный, конформационный эпитоп, охватываемый пептидом в соответствии с SEQ ID NO: 26. Предпочтительными связывающими средствами являются антитела или их функциональные фрагменты или производные.
В контексте настоящей заявки эпитоп может слегка отличаться, например быть приблизительно на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичным, при условии, что эпитоп распознается связывающими средствами, которые специфически связываются с HNL, определенным выше. Предпочтительно, связывающее средство распознает HNL, производимый нейтрофилами.
В контексте настоящего изобретения специфичность связывания связывающих средств может составлять по меньшей мере приблизительно, например, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% от аффинности связывания связывающего средства, которое связывается с HNL, описанным выше, или даже больше.
В контексте настоящего изобретения "значительное" связывание также означает, что из множества одинаково доступных различных антигенов в качестве потенциальных партнеров связывания HNL связывается по меньшей мере в 10 раз, например в 50 раз, например в 100 раз или более, чаще (в кинетическом смысле), чем любой другой антиген, отличный от HNL. Такие кинетические измерения могут быть выполнены на аппарате Biacore.
Термин " уровень", как используется в настоящем документе, относится к количеству или концентрации HNL, детектированного в образце.
"Полинуклеотид" представляет собой полимерную форму нуклеотидов любой длины, или рибонуклеотидов, или дезоксирибонуклеотидов. Этот термин относится только к первичной структуре молекулы. Таким образом, этот термин включает в себя двух- и одноцепочечную ДНК и РНК. Он также включает в себя известные типы модификаций, включая метки, известные в данной области техники, метилирование, "кэпирование", замену одного или нескольких природных нуклеотидов на аналоги, и межнуклеотидные модификации, такие как незаряженные связи (например, фосфоротиоаты, фосфородитиоаты и так далее), а также немодифицированные формы полинуклеотида.
В соответствии с настоящим изобретением моноклональное антитело или его функциональный фрагмент могут быть дериватизированы, например с помощью флуоресцентной группы, радиоактивной группы, хромогенного субстрата и тому подобного.
Известно, что типичная структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара содержит одну "легкую" (приблизительно 25 кДа) и одну "тяжелую" цепь (приблизительно 50-70 кДа). N-конец каждой цепи определяет вариабельную область из приблизительно 100-110 или более аминокислот, в первую очередь отвечающую за распознавание антигена. Термины вариабельная легкая цепь (VL) и вариабельная тяжелая цепь (VH) относятся к этим легкой и тяжелой цепям, соответственно. Карбокси-концевая часть каждой цепи определяет константную область, в первую очередь отвечающую за эффекторную функцию. Иммуноглобулины могут быть отнесены к различным классам в зависимости от аминокислотной последовательности константного домена их тяжелых цепей. Тяжелые цепи классифицируются как мю (μ), дельта (δ), гамма (γ), альфа (α) и эпсилон(ε) и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE, соответственно. Некоторые из них могут быть дополнительно разделены на подклассы или изотипы, например IgGl, IgG2, IgG3, IgG4, IgAl и IgA2. Различные изотипы имеют различные эффекторные функции; например, изотипы IgGl и IgG3 имеют активность антитело-зависимой клеточной цитотоксичности (ADCC). Человеческие легкие цепи классифицируются как легкие цепи каппа (K) и лямбда ([лямбда]). В легких и тяжелых цепях вариабельные и константные области соединены областью "J" из приблизительно 12 или больше аминокислот, причем тяжелая цепь также включает в себя область "D" из еще приблизительно 10 аминокислот. Смотри, в целом, Fundamental Immunology, Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989)).
Аллотипы представляют собой вариации в последовательности антитела, часто в константной области, которые могут быть иммуногенными и кодируются определенными аллелями у людей. Аллотипы были идентифицированы для пяти из человеческих генов IGHC, генов IGHG1, IGHG2, IGHG3, IGHA2 и IGHE, и обозначаются как аллотипы GIm, G2m, G3m, A2m и Em, соответственно. Для подробного описания структуры и генерации антител смотри документ Roth, D. B., and Craig, N. L., Cell, 94:41 1-414 (1998), который включен в настоящий документ посредством ссылки во всей полноте. Кратко говоря, процесс генерации ДНК, кодирующей последовательности тяжелой и легкой цепи иммуноглобулина происходит, главным образом, при развитии B-клеток. До перестройки и объединения различных иммуноглобулиновых генных сегментов генные сегменты V, D, J и константный (C) находятся в основном относительно близко на одной хромосоме. Во время дифференцировки B-клетки по одному из каждого из соответствующих членов семейства генных сегментов V, D, J (или, в случае генов легкой цепи, только V и J) рекомбинируют с образованием функционально перестроенных вариабельных областей тяжелого и легкого иммуноглобулиновых генов. Этот процесс перестройки генных сегментов, по-видимому, является последовательным. Во-первых, создаются соединения D-J тяжелой цепи, затем соединения V-DJ тяжелой цепи и соединения V-J легкой цепи. В дополнение к перестройке сегментов V, D и J генерируется дополнительное разнообразие в первичном спектре иммуноглобулиновых тяжелых и легких цепей посредством переменной рекомбинации в местоположениях, в которых соединены сегменты V и J в легкой цепи, и в которых соединены сегменты D и J тяжелой цепи. Такие вариации в легкой цепи обычно происходят в последнем кодоне генного сегмента V и в первом кодоне сегмента J. Аналогичные неточности соединения происходят на хромосоме тяжелой цепи между сегментами D и JH и могут распространяться на вплоть до 10 нуклеотидов. Кроме того, между генными сегментами D и JH и между VH и D могут быть вставлены несколько нуклеотидов, которые не кодируются геномной ДНК. Добавление этих нуклеотидов известно как N-концевая вариабельность. Результирующим эффектом таких перестроек в генных сегментах вариабельной области и переменной рекомбинации, которая может происходить во время такого соединения, является получение первичного спектра антител.
Термин "антитело" используется в самом широком смысле и включает в себя полностью собранные антитела, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (включая биспецифические антитела), фрагменты антител, которые могут связывать антиген (включая Fab', F'(ab)2, Fv, одноцепочечные антитела, диатела), и рекомбинантные пептиды, содержащие указанное выше, если они проявляют желаемую биологическую активность. Рассматриваются мультимеры или агрегаты интактных молекул и/или фрагментов, включая химически дериватизированные антитела. Рассматриваются антитела любого класса или подкласса изотипа, включая IgG, IgM, IgD, IgA и IgE, IgGl, IgG2, IgG3, IgG4, IgAl и IgA2, или любого аллотипа.
Термин "гипервариабельная" область относится к аминокислотным остаткам из определяющей комплементарность области или CDR (то есть, остаткам 24-34 (Ll), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Даже одна CDR может распознавать и связывать антиген, хотя с более низкой аффинностью, чем весь антигенсвязывающий участок, содержащий все CDR.
Альтернативное определение остатков гипервариабельной "петли" описано в Chothia et al., J. Mol.BioL, 196: 901-917 (1987) как остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Hl), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи.
"Каркасные" или FR остатки представляют собой остатки вариабельной области, отличные от остатков гипервариабельной области.
"Фрагменты антител" содержат часть интактного иммуноглобулина, например антигенсвязывающую или вариабельную область интактного антитела, и включают мультиспецифические (биспецифические, триспецифические и так далее) антитела, образованные из фрагментов антител. Фрагменты иммуноглобулинов могут быть получены с помощью методов рекомбинантной ДНК или с помощью ферментативного или химического расщепления интактных антител. Неограничивающие примеры фрагментов антител включают Fab, Fab', F(ab')2, Fv (вариабельная область), доменные антитела (dAb, содержащие домен VH; Ward et al., Nature, 341, 544-546, 1989), фрагменты определяющей комплементарность области (CDR), одноцепочечные антитела (scFv, содержащие домены VH и VL на одной полипептидной цепи) (Bird et al., Science, 242:423-426, 1988, и Huston et al., Proc. Natl. Acad. Sci., USA 85:5879-5883, 1988, необязательно включающие в себя полипептидный линкер; и, необязательно, мультиспецифические, Gruber et al., J. Immunol., 152: 5368 (1994)), одноцепочечные фрагменты антител, диатела (домены VH и VL на одной полипептидной цепи, которые спариваются с комплементарными доменами VL и VH другой цепи) (EP 404097; WO 93/11161; и Holliger et al., Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993)), триатела, тетратела, минитела (scFv, слитые с CH3 с помощью пептидного линкера (без шарнира) или с помощью шарнира IgG), линейные антитела (тандемные сегменты Fd (VH-CH1-VH-CH1) (Zapata et al., Protein Eng., 8(10): 1057-1062 (1995)); хелатирующие рекомбинантные антитела (crAb, которые могут связываться с двумя соседними эпитопами на одном и том же антигене), битела (биспецифические Fab-scFv) или тритела (триспецифические Fab-(scFv)(2)) (Schoonjans et al., J Immunol. 165:7050-57, 2000; Willems et al., J. Chromatogr. B. Analyt. Technol. Biomed. Life Sci., 786: 161-76, 2003), нанотела (вариабельный домен тяжелой цепи приблизительно 15 кДа) (Cortez-Retamozo et al., Cancer Research 64:2853-57, 2004), белок слияния антигенсвязывающего домена иммуноглобулина, камелизированное антитело (в котором VH рекомбинирует с константной областью, которая содержит шарнирный домен, домены CH1, CH2 и CH3) (Desmyter et al., J. Biol. Chem., 276:26285-90, 2001; Ewert et al., Biochemistry, 41: 3628-36, 2002; публикации патентной заявки США №№ 2005/0136049 и 2005/0037421), содержащее VHH антитело, антитела, состоящие из тяжелых цепей (HCAb, гомодимеры из двух тяжелых цепей, имеющие структуру H2L2), или их варианты или производные, и полипептиды, которые содержат по меньшей мере часть иммуноглобулина, которой достаточно для обеспечения специфического связывания антигена с полипептидом, такую как последовательность CDR, при условии, что антитело сохраняет желаемую биологическую активность.
Термин "вариант" относится к полипептидной последовательности антитела, которая содержит по меньшей мере одну аминокислотную замену, делецию или вставку в вариабельной области или в части, эквивалентной вариабельной области, при условии, что этот вариант сохраняет желаемую аффинность связывания или биологическую активность.
Термин "модификация" включает в себя, но без ограничения, одно или несколько изменений в аминокислотах (включая замены, вставки или делеции); химические модификации, которые не мешают HNL-связывающей активности; ковалентную модификацию посредством конъюгации с диагностическими средствами; мечение (например, с помощью радионуклидов или различных ферментов); ковалентное присоединение к полимеру, такое как пэгилирование (дериватизация с помощью полиэтиленгликоля), и вставку или замену с помощью химического синтеза неприродных аминокислот. В некоторых вариантах осуществления модифицированные полипептиды (включая антитела) будут сохранять связывающие свойства немодифицированных молекул.
Термин "производное" относится к антителам или полипептидам, которые ковалентно модифицированы посредством конъюгации с диагностическими средствами, мечения (например, с помощью радионуклидов или различных ферментов), ковалентного присоединения к полимеру, такого как пэгилирование (дериватизация с помощью полиэтиленгликоля), и вставки или замены с помощью химического синтеза неприродных аминокислот. В некоторых вариантах осуществления производные будут сохранять связывающие свойства недериватизированных молекул.
Термин "моноклональное антитело", как используется в настоящем документе, относится к антителу, как этот термин определен в настоящем документе, полученному из популяции по существу гомогенных антител, то есть отдельные антитела, составляющие популяцию, идентичны, за исключением возможных природных мутаций или альтернативных посттрансляционных модификаций, которые могут присутствовать в незначительных количествах, независимо от того, получены ли они от гибридом или методами рекомбинантной ДНК. Неограничивающие примеры моноклональных антител включают мышиные, кроличьи, крысиные, куриные, химерные, гуманизированные или человеческие антитела, полностью собранные антитела, мультиспецифические антитела (включая биспецифические антитела), фрагменты антител, которые могут связывать антиген (включая Fab', F'(ab)2, Fv, одноцепочечные антитела, диатела), макситела, нанотела и рекомбинантные пептиды, содержащие указанное выше, если они проявляют желаемую биологическую активность, или их варианты или производные. Гуманизация или модификация последовательности антитела, для того чтобы оно стало более похожим на человеческое, описана, например, в документах Jones et al., Nature 321: 522 525 (1986); Morrison et al., Proc. Natl. Acad. ScL1 U.S.A., 81: 6851 6855 (1984); Morrison and Oi, Adv. Immunol., 44:65 92 (1988); Verhoeyer et al., Science 239:1534 1536 (1988); Padlan, Molec. Immun., 28:489 498 (1991); Padlan, Molec. Immunol, 31(3): 169 217 (1994); и Kettleborough, CA. et al., Protein Engineering., 4(7): 773 83 (1991); Co, М. S., et al. (1994), J. Immunol 152, 2968-2976); Srudnicka et al., Protein Engineering 7: 805-814 (1994); каждый из которых включен в настоящий документ посредством ссылки во всей полноте. Одним из способов выделения человеческих моноклональных антител является использование технологии фагового отображения. Фаговое отображение описано, например, в документах Dower et al., WO 91/17271, McCafferty et al., WO 92/01047, и Caton and Koprowski, Proc. Natl. Acad. Sci. USA, 87:6450-6454 (1990), каждый из которых включен в настоящий документ посредством ссылки во всей полноте. Другой способ выделения человеческих моноклональных антител использует трансгенные животные, у которых отсутствует эндогенное производство иммуноглобулинов, и которые разработаны так, что они содержат локусы человеческих иммуноглобулинов. Смотри, например, документы Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); WO 91/10741, WO 96/34096, WO 98/24893 или публикации патентной заявки США №№ 2003/0194404, 2003/0031667 или 2002/0199213; которые включены в настоящий документ посредством ссылки во всей полноте.
Антитела настоящего изобретения также включают в себя димеры тяжелых цепей, такие как антитела из верблюдовых. Поскольку область VH димера тяжелых цепей IgG у верблюдовых не должна вступать в гидрофобные взаимодействия с легкой цепью, область в тяжелой цепи, которая обычно контактирует с легкой цепью, заменена у верблюдовых на гидрофильные аминокислотные остатки. Домены VH димера тяжелых цепей IgG называются доменами VHH. Антитела для использования в настоящем изобретении включают в себя однодоменные антитела (dAb) и нанотела (смотри, например, Cortez-Retamozo, et al., Cancer Res. 64: 2853-2857, 2004).
Как используется в настоящем документе, "V-область" относится к домену вариабельной области антитела, содержащему сегменты каркаса 1, CDR1, каркаса 2, CDR2 и каркаса 3, включая CDR3 и каркас 4, которые добавляются к V-сегменту вследствие перестройки генов V-области тяжелой цепи и легкой цепи во время дифференцировки B-клетки. "V-сегмент", как используется в настоящем документе, относится к области V-области (тяжелой или легкой цепи), которая кодируется геном V.
Как используется в настоящем документе, "определяющая комплементарность область (CDR)" относится к трем гипервариабельным областям в каждой цепи, которые прерывают четыре "каркасные" области, образованные вариабельными областями легкой и тяжелой цепи. CDR, главным образом, отвечают за связывание с эпитопом антигена. CDR каждой цепи обычно называют CDR1, CDR2 и CDR3 с последовательной нумерацией начиная с N-конца, а также обычно идентифицируют с помощью цепи, на которой расположена конкретная CDR. Таким образом, например, VH CDR3 расположена в вариабельном домене тяжелой цепи антитела, в котором она находится, тогда как VL CDR1 представляет собой CDR1 из вариабельного домена легкой цепи антитела, в котором она находится. Последовательности каркасных областей различных легких или тяжелых цепей являются относительно консервативными в пределах вида. Каркасная область антитела, то есть объединенные каркасные области составляющих его легкой и тяжелой цепей, служат для позиционирования и выравнивания CDR в трехмерном пространстве.
Аминокислотные последовательности CDR и каркасных областей могут быть определены с использованием различных хорошо известных в данной области техники определений, например Кэбота, Чотиа, международной базы данных ImMunoGeneTics (IMGT) и AbM (смотри, например, Johnson et al., выше; Chothia & Lesk, 1987, Canonical structures for the hypervariable regions of immunoglobulins. J. Mol. Biol. 196, 901-917; Chothia C. et al., 1989, Conformations of immunoglobulin hypervariable regions. Nature 342, 877-883; Chothia C. et al., 1992, structural repertoire of the human VH segments J. Mol. Biol. 227, 799-817; Al-Lazikani et al., J.Mol.Biol 1997, 273 (4)). Определения антигенсвязывающих сайтов также описаны в следующих документах: Ruiz et al., IMGT, the international ImMunoGeneTics database. Nucleic Acids Res., 28, 219-221 (2000); и Lefranc, М.-P. IMGT, the international ImMunoGeneTics database. Nucleic Acids Res. Jan 1; 29 (1): 207-9 (2001); MacCallum et al, Antibody antigen interactions: Contact analysis and binding site topography, J. Mol. Biol., 262 (5), 732-745 (1996); и Martin et al, Proc. Natl Acad. Sci. USA, 86, 9268-9272 (1989); Martin, et al, Methods Enzymol., 203, 121-153, (1991); Pedersen et al, Immunomethods, 1, 126, (1992); и Rees et al, в Sternberg М.J.E. (ed.), Protein Structure Prediction. Oxford University Press, Oxford, 141-172 1996).
"Эпитоп" или "антигенная детерминанта" относится к участку на антигене, с которым связывается антитело. Эпитопы могут быть образованы как из смежных аминокислот, так и из несмежных аминокислот, примыкающих друг к другу благодаря третичной структуре белка. Эпитопы, образованные из смежных аминокислот, обычно сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образованные третичной структурой (также называемые прерывистыми эпитопами), обычно пропадают при обработке денатурирующими растворителями. Эпитоп обычно включает в себя по меньшей мере 3, а чаще по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопов включают в себя, например, рентгеновскую кристаллография и двухмерный ядерный магнитный резонанс. Смотри, например, Epitope Mapping Protocols в Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed (1996).
Термин "рекомбинантный", когда используется со ссылкой, например, на клетку или нуклеиновую кислоту, белок или вектор, указывает на то, что клетка, нуклеиновая кислота, белок или вектор были модифицированы посредством введения гетерологичной нуклеиновой кислоты или белка или изменения нативных нуклеиновой кислоты или белка, или на то, что клетка получена от клетки, модифицированной таким образом. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые отсутствуют в нативной (нерекомбинантной) форме этой клетки, или экспрессируют нативные гены, которые в ином случае аномально экспрессируются, слабо экспрессируются или не экспрессируются вовсе. Под термином "рекомбинантная нуклеиновая кислота" в настоящем документе понимается нуклеиновая кислота, исходно образованная in vitro, как правило посредством манипуляций с нуклеиновой кислотой, например с использованием полимераз и эндонуклеаз, в форме, обычно не встречающейся в природе. Таким образом достигается функциональная связь различных последовательностей. Таким образом, выделенная нуклеиновая кислота в линейной форме или вектор экспрессии, образованный in vitro посредством лигирования молекул ДНК, которые обычно не соединены, считаются рекомбинантными для целей настоящего изобретения. Следует понимать, что когда рекомбинантную нуклеиновую кислоту создают и повторно вводят в клетку или организм хозяина, она будет реплицироваться не рекомбинантно, то есть посредством клеточных механизмов клетки-хозяина in vivo, а не манипуляций in vitro; однако такие нуклеиновые кислоты, если они получены рекомбинантно, хотя затем реплицируются не рекомбинантно, по-прежнему считаются рекомбинантными для целей настоящего изобретения. Аналогично, "рекомбинантный белок" представляет собой белок, полученный с использованием рекомбинантных методов, то есть посредством экспрессии рекомбинантной нуклеиновой кислоты, как описано выше.
Множество композиций, содержащих одну, две и/или три CDR вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, может быть получено с помощью методов, известных в данной области техники.
Также предлагаются выделенные нуклеиновые кислоты, кодирующие моноклональные антитела, описанные в настоящем документе, необязательно функционально связанные с управляющими последовательностями, распознаваемыми клеткой-хозяином, векторы и клетки-хозяева, содержащие данные нуклеиновые кислоты, и рекомбинантные методы для получения антител, которые могут содержать культивирование клетки-хозяина, так что экспрессируется данная нуклеиновая кислота, и, необязательно, выделение антитела из культуры клеток-хозяев или культуральной среды.
Соответствующая аминокислотная последовательность из представляющего интерес иммуноглобулина может быть определена путем прямого секвенирования белка, а подходящие кодирующие нуклеотидные последовательности могут быть разработаны в соответствии с универсальной таблицей кодонов. В качестве альтернативы, геномная или кДНК, кодирующая моноклональные антитела, может быть выделена и секвенирована из клеток, продуцирующих такие антитела с использованием обычных процедур (например, посредством использования олигонуклеотидных зондов, которые способны к специфическому связыванию с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клонирование осуществляют с использованием стандартных методов (смотри, например, документ Sambrook et al. (1989) Molecular Cloning: A Laboratory Guide, Vols 1-3, Cold Spring Harbor Press, который включен в настоящий документ посредством ссылки). Например, посредством обратной транскрипции поли-A+ мРНК, например мембранно-связанной мРНК, может быть сконструирована библиотека кДНК, и эту библиотеку подвергают скринингу с использованием зондов, специфических для последовательностей генов полипептидов человеческих иммуноглобулинов. В одном варианте осуществления, однако, используют полимеразную цепную реакцию (ПЦР) для амплификации кДНК (или частей полноразмерных кДНК), кодирующих представляющий интерес генный сегмент иммуноглобулина (например, вариабельный сегмент легкой или тяжелой цепи). Амплифицированные последовательности можно легко клонировать в любой подходящий вектор, например векторы экспрессии, векторы с минигенами или векторы фагового отображения. Следует понимать, что конкретный используемый способ клонирования не существенен при условии, что можно определить последовательность некоторой части представляющего интерес иммуноглобулинового полипептида.
Фраза "специфически (или селективно) связывается" с антителом или "специфически (или селективно) иммунореактивен с", когда относится к белку или пептиду, относится к реакции связывания, которая является определяющей в присутствии данного белка в гетерогенной популяции белков и других биопрепаратов. Таким образом, при указанных условиях иммуноанализа связывание указанных антител с конкретной белковой последовательностью по меньшей мере в два раза превосходит фон и, более типично, более чем в 10-100 превосходит фон. Данный термин относится также к способности связывающего средства, антитела или функционального фрагмента или их производного к связыванию с HNL, в частности с прерывистым эпитопом, охватываемым пептидом в соответствии с SEQ ID NO: 26.
В некоторых вариантах осуществления предлагаются выделенное антитело или производное или фрагмент, которые связываются с HNL с аффинностью KD, составляющей приблизительно от 10-6 М до 10-8 М.
Термин "аффинность связывания" или "аффинность", как используется в настоящем документе, относится к равновесной константе диссоциации (KD), связанной с каждым взаимодействием антиген-антитело. В некоторых вариантах осуществления антитела, описанные в настоящем документе, проявляют желаемые свойства, такие как аффинность связывания, измеренная с помощью KD, с HNL в диапазоне от 1×10-6 М или менее, или в диапазоне вплоть до 10-16 М или ниже, (например, приблизительно 10-6, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14, 10-15, 10-16 М или менее) при приблизительно pH 7,4, причем более низкая KD указывает на лучшую аффинность. Равновесная константа диссоциации может быть определена в анализе равновесия в растворе с использованием, например, BIAcore.
Аффинность связывания непосредственно связана с отношением кинетической скорости диссоциации (которую обычно приводят в обратных времени единицах, например секундах-1), деленной на кинетическую скорость ассоциации (которую обычно приводят в единицах концентрации в единицу времени, например М/с). С помощью анализа скорости диссоциации можно оценить взаимодействие, которое происходит in vivo, поскольку низкая скорость диссоциации будет предсказывать большую степень взаимодействия в течение более продолжительного периода времени.
В других вариантах осуществления антитела, описанные в настоящем документе, проявляют специфичность или специфически связываются с HNL. Как используется в настоящем документе, антитело является "специфическим" или "специфически связывает" HNL, если оно имеет значительно более высокую аффинность связывания с HNL, и, следовательно, способно к его различению, по сравнению с другими неродственными белками в других семействах. В некоторых вариантах осуществления такие антитела могут также перекрестно реагировать с HNL других видов, такими как HNL мышей, крыс или приматов; тогда как в других вариантах осуществления антитела связываются только с человеческим HNL. Любое из вышеуказанных антител может быть моноклональным антителом или химерным, гуманизированным или человеческим антителом. В некоторых вариантах осуществления антитело представляет собой изотип IgG, такой как изотип IgGl, IgG2, IgG3 или IgG4.
В другом аспекте варианты осуществления настоящего изобретения включают в себя выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует любое из вышеуказанных антител, вектор экспрессии, содержащий любую из выделенных молекул нуклеиновой кислоты, функционально связанную с регуляторной управляющей последовательностью, клетки-хозяева, содержащие такие выделенные молекулы нуклеиновой кислоты или векторы, и способы применения таких клеток-хозяев для получения антитела. Такие способы получения содержат культивирование клетки-хозяина в подходящих условиях, так что экспрессируется нуклеиновая кислота для получения антитела, и, необязательно, выделение антитела из клетки-хозяина или культуральной среды. В родственном варианте осуществления предлагается выделенное антитело или средство, получаемое с помощью вышеуказанного способа.
Варианты осуществления, описанные в настоящем документе, включают в себя композицию, например диагностическую композицию, которая содержит любое из вышеуказанных связывающих средств, например антител.
В некоторых вариантах осуществления настоящее изобретение относится к:
1) связывающему средству, например антителу, которое сохраняет любые одну, две, три, четыре, пять или шесть из CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 или CDRL3, изображенных в No: 8-13, 14-19 и 20-25, или их производных;
2) связывающему средству, например антителу, которое сохраняет все из CDRH1, CDRH2, CDRH3, необязательно включающему в себя одну или две мутации в таких CDR, причем данное антитело проявляет специфическое связывание с эпитопом HNL, содержащимся в SEQ ID NO: 26;
3) связывающему средству, например антителу, которое сохраняет все из CDRL1, CDRL2, CDRL3, необязательно включающему в себя одну или две мутации в таких CDR, необязательно включающему в себя одну или две мутации в таких CDR, причем данное антитело проявляет специфическое связывание с эпитопом HNL, содержащимся в SEQ ID NO: 26;
4) связывающему средству, например антителу, которое связывается с тем же эпитопом HNL, что и описанные в настоящем документе антитела, например как определено посредством рентгеновской кристаллографии, или конформационным эпитопом, содержащим аминокислоту, содержащуюся в SEQ ID NO: 26, для связывания с (человеческим) HNL больше чем приблизительно на 75%, больше чем приблизительно на 80%, или больше чем приблизительно на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% или 95% (например, по оценке посредством конкурентного ELISA или Biacore или посредством других способов, известных в данной области техники).
В другом аспекте предлагаются способы мутации антител в соответствии с настоящим изобретением, которые сохраняют аффинность специфического связывания с HNL, в частности с эпитопом, охватываемым SEQ ID NO: 26. Данное антитело может представлять собой анти-HNL антитело, полученное посредством таких способов. Подходящие остатки для мутации включают остатки, которые представляют собой участки непосредственного контакта с антигеном, или участки, которые вносят вклад в образование взаимодействия между зарядами вдоль границы связывания антитело-антиген. Другие подходящие остатки включают остатки в консервативных областях антитела. Другие подходящие остатки включают каркасные остатки, которые по меньшей мере на 10% экспонированы на поверхности и находятся в пределах 4,5 Å от остатка CDR. Дополнительные подходящие остатки включают остатки, выбранные с помощью визуального осмотра трехмерной структурной модели для поиска аминокислот поблизости от CDR или выбранных каркасных остатков. Нужные аминокислоты могут быть подвергнуты мутации в одном или нескольких положениях в аминокислотной последовательности. Например, мутации, которые производят некоторый эффект изменения связывания в качестве отдельных мутаций, могут быть объединены в виде двойных, тройных или более многочисленных мутаций. Антитела, которые были подвергнуты мутации таким образом, затем подвергают скринингу в отношении изменения, например улучшения, связывания, а затем их могут дополнительно подвергать скринингу в отношении других свойств.
В одном аспекте по меньшей мере один, два, три, четыре, пять, шесть или более остатков в вариабельной области тяжелой цепи упомянутого антитела удалены и заменены на другой остаток. В другом аспекте по меньшей мере один, два, три, четыре, пять, шесть или более остатков в вариабельной области легкой цепи упомянутого антитела удалены и заменены на другой остаток. В некоторых аспектах по меньшей мере один остаток из вариабельной области легкой цепи упомянутого антитела и по меньшей мере один остаток из вариабельной области тяжелой цепи упомянутого антитела заменен на другой остаток при условии, что сохраняется активность специфического связывания упомянутого антитела.
В одном варианте осуществления антитело содержит по меньшей мере одну, две, три, четыре, пять или все из аминокислотных последовательностей, выбранных из группы, состоящей из No: 8-13, 14-19 и 20-25. В некоторых вариантах осуществления антитело содержит все три CDR легкой цепи, все три CDR тяжелой цепи или все шесть CDR. В некоторых вариантах осуществления две CDR легкой цепи от антитела могут быть объединены с третьим CDR легкой цепи от другого антитела. В качестве альтернативы, CDRL1 от одного антитела может быть объединена с CDRL2 от другого антитела и CDRL3 от еще одного антитела, в частности если эти CDR высоко гомологичны. Аналогично, две CDR тяжелой цепи от антитела могут быть объединены с третьим CDR тяжелой цепи от другого антитела; или CDRH1 от одного антитела может быть объединена с CDRH2 от другого антитела и CDRH3 от еще одного антитела, в частности если эти CDR высоко гомологичны.
Одним из источников нуклеиновых кислот антител является гибридома, получаемая посредством получения B-клетки от животного, иммунизированного представляющим интерес антигеном, и ее слияния с бессмертной клеткой. В качестве альтернативы, нуклеиновая кислота может быть выделена из B-клеток (или целой селезенки) иммунизированного животного. Еще одним источником нуклеиновых кислот, кодирующих антитела, является библиотека таких нуклеиновых кислот, созданная, например, посредством технологии фагового отображения. Полинуклеотиды, кодирующие представляющие интерес пептиды, например пептиды вариабельной области с нужными характеристиками связывания, могут быть идентифицированы с помощью стандартных методов, таких как пэннинг.
Может быть определена последовательность, кодирующая всю вариабельную область иммуноглобулинового полипептида; однако иногда может быть достаточно секвенировать только часть вариабельной области, например CDR-кодирующую часть. Секвенирование осуществляют с использованием стандартных методов (смотри, например, документы Sambrook et al. (1989) Molecular Cloning: A Laboratory Guide, Vols 1-3, Cold Spring Harbor Press, и Sanger, F. et al., (1977) Proc. Natl. Acad. Sci. USA, 74: 5463-5467, которые включены в настоящий документ посредством ссылки). Посредством сравнения последовательности клонированной нуклеиновой кислоты с опубликованными последовательностями генов и кДНК иммуноглобулинов специалист легко сможет определить, в зависимости от секвенированной области, (i) использование зародышевого сегмента гибридомного иммуноглобулинового полипептида (включая изотип тяжелой цепи) и (ii) последовательность вариабельных областей тяжелой и легкой цепи, включая последовательности, происходящие от N-концевого дополнения и процесса соматической мутации. Одним из источников информации о последовательности иммуноглобулиновых генов является National Center for Biotechnology Information, National Library of Medicine, National Institutes of Health, Bethesda, Md.
Как используется в настоящем документе, "выделенная" молекула нуклеиновой кислоты или "выделенная" последовательность нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая или (1) идентифицирована и отделена от по меньшей мере одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно связана в природном источнике нуклеиновой кислоты, или (2) клонирована, амплифицирована, помечена или иным образом отличается от фоновых нуклеиновых кислот, так что последовательность представляющей интерес нуклеиновой кислоты может быть определена. Выделенная молекула нуклеиновой кислоты не такая же, как в форме или условиях, в которых она находится в природе. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют антитело, причем, например, эта молекула нуклеиновой кислоты находится в положении на хромосоме, отличном от положения в природных клетках.
После выделения ДНК может быть функционально связана с управляющими экспрессией последовательностями или помещена в векторы экспрессии, которые затем трансфицируют в клетки-хозяева, которые в ином случае не продуцируют иммуноглобулиновый белок, для направления синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Рекомбинантное продуцирование антител хорошо известно в данной области техники. Управляющие экспрессией последовательности относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Управляющие последовательности, которые подходят для прокариот, например, включают в себя промотор, необязательно, операторную последовательность и сайт связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры. Нуклеиновая кислота функционально связана, когда она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или секреторного лидера функционально связана с ДНК для полипептида, если она экспрессируется в виде пребелка, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, чтобы облегчать трансляцию. Обычно функциональное связывание означает, что связанные последовательности ДНК являются смежными, а в случае секреторного лидера смежными и в фазе считывания. Тем не менее, энхансеры не должны быть смежными. Связывание осуществляется лигированием в удобных сайтах рестрикции. Если таких сайтов не существует, используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с обычной практикой.
В данной области техники известно множество векторов. Компоненты векторов могут включать один или несколько из следующих: сигнальную последовательность (которая может, например, направлять секрецию антитела), точку начала репликации, один или несколько селективных маркерных генов (которые могут, например, придавать резистентность к антибиотику или другому препарату, дополнять дефицит у ауксотрофов или снабжать необходимыми питательными веществами, недоступными в среде), энхансерный элемент, промотор и последовательность терминации транскрипции, которые хорошо известны в данной области техники.
Примеры клеток-хозяев для экспрессии генетической информации, содержащейся в векторе, после трансфекции или трансформации включают в себя клетки прокариот, дрожжей или высших эукариот (то есть, многоклеточного организма). Прокариотические клетки-хозяева включают эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis, Pseudomonas и Streptomyces. Эукариотические микробы, такие как нитчатые грибы или дрожжи являются подходящими хозяевами для клонирования или экспрессии рекомбинантных полипептидов или антител. Чаще всего из низших эукариотических микроорганизмов-хозяев используют Saccharomyces cerevisiae, или обычные пекарские дрожжи. Однако широко доступны и пригодны для настоящего изобретения многие другие роды, виды и штаммы, такие как Pichia, например P. pastoris, Schizosaccharomyces pombe; Kluyveromyces, Yarrowia; Candida; Trichoderma reesia; Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и хозяева Aspergillus, такие как A. nidulans и A. niger.
Клетки-хозяева для экспрессии гликозилированного полипептида или антитела могут быть получены из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypy (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступны многочисленные вирусные штаммы для трансфекции таких клеток, например L-I вариант NPV совки калифорнийской и Bm-5 штамм NPV Bombyx mori. Клетки-хозяева позвоночных также являются подходящими хозяевами, и рекомбинантное получение полипептида или антитела из таких клеток стало рутинной процедурой. Примерами полезных линий клеток-хозяев млекопитающих являются клетки яичника китайского хомячка, включая клетки CHOKl (ATCC CCL61), DXB-11, DG-44, и клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA, 77: 4216 (1980)); линия CV1 почки обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); линия человеческой эмбриональной почки (293 или 293 клеток субклонировали для роста в суспендированной культуре, [Graham et al., J. Gen Virol. 36: 59 (1977)]; клетки почки новорожденного хомяка (BHK, ATCC CCL 10); клетки Сертоли мыши (TM4, Mather, Biol. Reprod., 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); человеческие клетки карциномы шейки матки (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени серой крысы (BRL 3A, ATCC CRL 1442); человеческие клетки легкого (W 138, ATCC CCL 75); клетки гепатомы человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y Acad. Sci, 383: 44-68 (1982)); клетки MRC 5 или клетки FS4; или клетки миеломы млекопитающих. Клетки-хозяева трансформируют или трансфицируют вышеописанными нуклеиновыми кислотами или векторами для получения антитела и культивируют в питательных средах, соответствующим образом модифицированных для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности. Кроме того, новые векторы и линии трансфицированных клеток с множеством копий единиц транскрипции, выделенные с помощью селективного маркера, особенно полезны для экспрессии антител.
Клетки-хозяева, используемые для получения антитела, описанного в настоящем документе, можно культивировать в различных средах. Для культивирования клеток-хозяев подходят коммерчески доступные среды, такие как F10 Хэма (Sigma), минимальная питательная среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла ((DMEM), Sigma). Кроме того, любую из сред, описанных в документах Ham et al., Meth. Enz., 58: 44 (1979), Barnes et al., Anal. Biochem., 102: 255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патенте США Re. № 30985, можно использовать в качестве культуральной среды для клеток-хозяев. Любая из этих сред может при необходимости быть дополнена гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как препарат Gentamycin™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Также могут быть включены любые другие необходимые добавки в соответствующих концентрациях, которые известны специалистам в данной области техники. Условия культивирования, такие как температура, pH и тому подобное, являются такими же, как те, которые использовались ранее для клетки-хозяина, выбранной для экспрессии, и они будут очевидны среднему специалисту в данной области техники.
После культивирования клеток-хозяев антитело может продуцироваться внутриклеточно в периплазматическом пространстве или непосредственно секретироваться в среду. Если антитело продуцируется внутриклеточно, в качестве первого этапа, дебрис из твердых частиц, или клеток-хозяев или лизированных фрагментов, удаляют, например, центрифугированием или ультрафильтрацией.
Антитело может быть очищено с использованием, например, гидроксилапатитной хроматографии, катион- или анионобменной хроматографии или аффинной хроматографии с использованием представляющего интерес антигена или белка A или белка G в качестве аффинного лиганда. Белок A можно использовать для очистки антител, которые основаны на человеческих тяжелых цепях γ1, γ2 или γ4 (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для человеческой γ3 (Guss et al., EMBO J. 5: 15671575 (1986)). Матрица, к которой присоединен аффинный лиганд, чаще всего является агарозной, но доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол обеспечивают более высокую скорость потока и меньшее время обработки, чем можно получить с агарозой. Если антитело содержит домен CH3, для очистки годится смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, NJ.). Также возможны другие способы очистки белка, такие как осаждение этанолом, ВЭЖХ с обращенной фазой, хроматофокусирование, ДСН-ПААГ и осаждение сульфатом аммония, в зависимости от подлежащего выделению антитела.
Могут быть получены другие HNL-специфические связывающие средства, например на основе CDR из антитела или посредством скрининга библиотек различных пептидов или органических химических соединений в отношении пептидов или соединений, которые проявляют нужные связывающие свойства в отношении человеческого HNL. HNL-специфическое связывающее средство включает пептиды, содержащие аминокислотные последовательности, которые по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичны одной или нескольким CDR, раскрытым в настоящем документе. HNL-специфические связывающие средства также включают пептитела. Термин "пептитело" относится к молекуле, содержащей Fc-домен антитела, прикрепленный к по меньшей мере одному пептиду. Получение пептител в общем описано в публикации PCT WO 00/24782, опубликованной 4 мая 2000 года. Любые из этих пептидов могут быть связаны тандемно (то есть последовательно), с линкерами или без них. Пептиды, содержащие остаток цистеинил, могут быть перекрестно сшиты с другим Cys-содержащим пептидом, причем один или оба из них могут быть связаны с носителем. Любой пептид, содержащий больше чем один остаток Cys, может также образовывать внутрипептидную дисульфидную связь. Любой из этих пептидов может быть дериватизирован, например карбоксильный конец может быть кэпирован аминогруппой, могут быть кэпированы цистеины, или аминокислотные остатки могут быть замещены группами, отличными от аминокислотных остатков (смотри, например, документы Bhatnagar et al., J. Med. Chem., 39: 3814-9 (1996), и Cuthbertson et al., J. Med. Chem., 40: 2876-82 (1997), которые включены в настоящий документ посредством ссылки во всей полноте). Пептидные последовательности могут быть оптимизированы, аналогично созреванию аффинности для антител, или иным образом изменены посредством аланинового сканирования или случайного или неправленного мутагенеза с последующим скринингом для идентификации наилучших связывающих средств. Lowman, Ann. Rev. Biophys. Biomol. Struct., 26: 401-24 (1997). В структуру специфического связывающего средства могут быть вставлены различные молекулы, например в саму пептидную часть или между частями пептида и носителя специфических связывающих средств, при сохранении желаемой активности специфического связывающего средства. Можно легко вставлять, например, молекулы, такие как Fc-домен или его фрагмент, полиэтиленгликоль или другие родственные молекулы, такие как декстран, жирную кислоту, липид, холестериновую группу, небольшой углевод, пептид, детектируемый фрагмент, описанный в настоящем документе (включая флуоресцентные средства, радиоактивные метки, такие как радиоизотопы), олигосахарид, олигонуклеотид, полинуклеотид, интерференционную (или другую) РНК, ферменты, гормоны или тому подобное. Другие молекулы, подходящие для такой вставки, будут очевидны специалистам в данной области техники и включены в объем настоящего изобретения. Сюда входит, например, вставка желаемой молекулы между двумя последовательными аминокислотами, необязательно соединенными подходящим линкером.
Также предлагаются способы идентификации антител или специфических связывающих средств, которые связывают HNL, и/или которые перекрестно блокируют типичные антитела, описанные в настоящем документе, и/или которые ингибируют активность HNL. Антитела или специфические связывающие средства могут быть подвергнуты скринингу на аффинность связывания посредством способов, известных в данной области техники. Например, можно использовать анализы сдвига в геле, вестерн-блоты, конкурентный анализ с радиоактивной меткой, совместное фракционирование с помощью хроматографии, совместную преципитацию, перекрестное сшивание, ELISA и тому подобное, которые описаны, например, в документе Current Protocols in Molecular Biology (1999) John Wiley & Sons, NY, который включен в настоящий документ посредством ссылки во всей полноте. В одном варианте осуществления используют высокопроизводительный скрининг на фрагменты антител или CDR с 1, 2, 3 или более модификациями аминокислот в CDR, имеющих подходящую аффинность связывания с полипептидом целевого антигена. Анти-HNL антитела, раскрытые в настоящем документе, могут быть легко модифицированы с помощью методов, хорошо известных среднему специалисту в данной области техники. Возможные мутации включают вставку, делецию или замену одного или нескольких остатков. В некоторых вариантах осуществления вставки или делеции находятся в диапазоне приблизительно от 1 до 5 аминокислот, в диапазоне приблизительно от 1 до 3 аминокислот или в диапазоне приблизительно из 1 или 2 аминокислот. Делеционные варианты представляют собой полипептиды, в которых удален по меньшей мере один аминокислотный остаток любой аминокислотной последовательности. Делеции могут быть осуществлены с одного или обоих концов белка или с помощью удаления одного или нескольких остатков в пределах (то есть внутри) полипептида. Способы получения делеционных вариантов являются обычными в данной области техники. Смотри, например, документ Sambrook et al. (1989) Molecular Cloning: A Laboratory Guide, Vols 1-3, Cold Spring Harbor Press, раскрытие которого включено в настоящий документ посредством ссылки во всей полноте.
Вставки аминокислотной последовательности включают в себя амино- и/или карбокиконцевые слияния, имеющие длину в диапазоне от одного остатка до полипептидов, содержащих сотни или больше остатков, а также внутренние вставки последовательности из одной или нескольких аминокислот. Как и в случае любого из различных типов вариантов, описанных в настоящем документе, варианты со вставками могут быть разработаны так, что получаемый полипептид сохраняет те же биологические свойства или проявляет новое физическое, химическое и/или биологическое свойство, не связанное с родительским полипептидом, из которого он был получен. Способы получения вариантов со вставками также обычны и хорошо известны в данной области техники (Sambrook et al., выше).
Белки слияния, содержащие полипептид, содержащий анти-HNL антитело, описанное в настоящем документе, и гетерологичный полипептид, представляют собой особый тип варианта со вставками, рассматриваемый в настоящем документе. Неограничивающие примеры гетерологичных полипептидов, которые могут быть слиты с представляющими интерес полипептидами, включают белки с большим периодом полувыведения из кровотока, такие как, но без ограничения, иммуноглобулиновые константные области (например, Fc-область); маркерные последовательности, которые делают возможной идентификацию представляющего интерес полипептида; последовательности, которые облегчают очистку представляющего интерес полипептида; и последовательности, которые стимулируют образование мультимерных белков. Способы получения белков слияния антител хорошо известны в данной области техники. Смотри, например, патент США № 6306393, раскрытие которого включено в настоящий документ посредством ссылки во всей полноте. В определенных вариантах осуществления получают белки слияния, которые могут включать в себя гибкий линкер, который соединяет химерное антитело scFv с участком гетерологичного белка. Подходящими линкерными последовательностями являются те, которые не влияют на способность получаемого белка слияния быть распознанным и связывать эпитоп, специфически связываемый V-доменом белка (смотри, например, WO 98/25965, раскрытие которого включено в настоящий документ посредством ссылки во всей полноте).
Варианты с заменами представляют собой варианты, в которых по меньшей мере один остаток в аминокислотной последовательности полипептида удален, а другой остаток вставлен на его место. Модификации биологических свойств антитела достигаются путем выбора замен, которые значительно различаются по своему действию на сохранение (a) структуры полипептидного остова в области замены, например, имеющей вид конформации в форме листа или спиральной конформации, (b) заряда или гидрофобности молекулы в целевом участке или (c) объема боковой цепи. В определенных вариантах осуществления варианты с заменами конструируют, то есть один или несколько определенных (в отличие от случайных) аминокислотных остатков заменяют определенными аминокислотными остатками. Типичные изменения этих типов включают консервативные замены и/или замену одного остатка на другой на основании схожести свойств нативного и замещающего остатков.
Консервативные замены показаны ниже. Наиболее консервативная замена находится под заголовком "предпочтительные замены". Если такие замены не приводят к изменению биологической активности, то могут быть введены более существенные изменения, а продукты могут быть подвергнуты скринингу.
Аминокислотные остатки, которые имеют общие свойства боковой цепи, часто группируют следующим образом:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gln, his, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
В некоторых случаях варианты антител получают с намерением изменить те аминокислотные остатки, которые непосредственно участвуют в связывании эпитопа. В других вариантах осуществления желательна модификация остатков, которые непосредственно не участвуют в связывании эпитопа, или остатков, никаким образом не участвующих в связывании эпитопа, для целей, рассмотренных в настоящем документе. Рассматривается мутагенез в любой из областей CDR и/или каркасных областей.
Для того чтобы определить, какие аминокислотные остатки антитела важны для распознавания и связывания эпитопа, может быть выполнен мутагенез аланинового сканирования для получения вариантов с заменами. Смотри, например, документ Cunningham et al., Science, 244:1081-1085 (1989), раскрытие которого включено в настоящий документ посредством ссылки во всей полноте. В этом способе отдельные аминокислотные остатки по одному заменяют на остаток аланина, и получаемое анти-HNL антитело подвергают скринингу в отношении его способности связывать свой специфический эпитоп по сравнению с немодифицированным антителом. Модифицированные антитела с пониженной связывающей способностью секвенируют, для того чтобы определить, какой остаток был изменен, что указывает на его значимость для связывания или биологических свойств.
Варианты антител с заменами могут быть получены с помощью созревания аффинности, при котором в последовательность родительского антитела вводят случайные аминокислотные изменения. Смотри, например, документы Ouwehand et al., Vox Sang 74 (Suppl 2): 223-232, 1998; Rader et al., Proc. Natl. Acad. Sci. USA 95: 8910-8915, 1998; Dall'Acqua et al., Curr. Opin. Struct. Biol, 8: 443-450, 1998, раскрытия которых включены в настоящий документ посредством ссылки во всей полноте. Созревание аффинности включает в себя получение и скрининг анти-HNL антител или их вариантов и выбор из получаемых вариантов тех, которые обладают модифицированными биологическими свойствами, такими как повышенная аффинность связывания по отношению к родительскому анти-HNL антителу. Удобным способом генерации вариантов с заменами является созревание аффинности с использованием фагового отображения. Кратко говоря, несколько участков гипервариабельной области подвергают мутациям для создания всех возможных аминокислотных замен в каждом участке. Таким образом созданные варианты экспрессируют моновалентным образом на поверхности частиц нитчатого фага в виде слияний с продуктом гена III Ml 3, упакованным внутри каждой частицы. Затем отображенные на фаге варианты подвергают скринингу в отношении их биологической активности (например, аффинности связывания). Смотри например, WO 92/01047, WO 93/112366, WO 95/15388 и WO 93/19172.
Современные способы созревания аффинности антитела относятся к двум категориям мутагенеза: случайному и неслучайному. Допускающая ошибки ПЦР, бактериальные штаммы-мутаторы (Low et al., J. Mol. Biol. 260, 359-68, 1996) и насыщающий мутагенез (Nishimiya et al.,. J. Biol. Chem. 275: 12813-20, 2000; Chowdhury, P. S. Methods Mol. Biol. 178, 269-85, 2002) являются типичными примерами способов случайного мутагенеза (Rajpal et al., Proc Natl Acad Sci USA. 102: 8466-71, 2005). Неслучайные методы часто используют аланин-сканирующий или сайт-неправленный мутагенез для генерации ограниченных коллекций конкретных мутеинов. Некоторые способы описаны более подробно ниже. Созревание аффинности рекомбинантных антител обычно осуществляют за несколько циклов пэннинга антител-кандидатов в присутствии уменьшающегося количества антигена. Уменьшение количества антигена в каждом цикле отбирает антитела с наивысшей аффинностью к антигену, благодаря чему получают антитела с высокой аффинностью из большого количества исходного материала. Созревание аффинности посредством пэннинга хорошо известно в данной области техники и описано, например, в документе Huls et al. (Cancer Immunol Immunother. 50:163-71, 2001). Способы созревания аффинности с использованием методов фагового отображения описаны в другом месте в настоящем документе и известны в данной области техники (смотри, например, документ Daugherty et al., Proc Natl Acad Sci USA, 91:2029-34, 2000).
Просматривающий мутагенез (LTM) (Rajpal et al., Proc Natl Acad Sci USA. 102:8466-71, 2005) обеспечивает способ быстрого картирования антитело-связывающего участка. Для LTM девять аминокислот, типичных для химических структур главных боковых цепей, обеспечиваемых 20 природными аминокислотами, выбирают для выделения функциональных вкладов боковых цепей в связывание в каждом положении во всех шести CDR антитела. LTM генерирует позиционный ряд одиночных мутаций в CDR, где каждый остаток "дикого типа" систематически замещен одной из девяти выбранных аминокислот. Мутированные CDR объединяют для генерации комбинаторных библиотек одноцепочечных вариабельных фрагментов (scFv) возрастающих сложности и размера, избегая при этом излишнего количественного отображения всех мутеинов. После положительного отбора секвенируют клоны с улучшенным связыванием, и картируют полезные мутации.
Допускающая ошибки ПЦР включает в себя рандомизацию нуклеиновых кислот между различными циклами отбора. Рандомизация на низком уровне происходит вследствие присущего используемой полимеразе уровня ошибок, но она может быть увеличена с помощью допускающей ошибки ПЦР (Zaccolo et al., J. Mol. Biol. 285:775-783, 1999) с использованием полимеразы, имеющей высокий присущей ей уровень ошибок во время транскрипции (Hawkins et al., J Mol Biol. 226:889-96, 1992). После циклов мутации клоны с улучшенной аффинностью к антигену отбирают с использованием обычных способов данной области техники.
Для получения анти-HNL антител или их вариантов и их скрининга в отношении желаемой активности можно также использовать методы, использующие перетасовку генов и направленную эволюцию. Например, Jermutus et al., Proc Natl Acad Sci U S A., 98(1): 75-80 (2001), продемонстрировали объединение адаптированных стратегий отбора in vitro на основании рибосомного отображения с получением разнообразия in vitro посредством перетасовки ДНК для изменения или скорости диссоциации, или термодинамической стабильности scFv; Fermer et al., Tumour Biol. 2004 Jan-Apr; 25(1-2): 7-13, сообщили, что использование фагового отображения в комбинации с перетасовкой ДНК увеличивало аффинность почти на три порядка величины. Dougherty et al., Proc Natl Acad Sci USA. 2000 Feb. 29; 97(5):2029-2034 сообщили, что (i) функциональные клоны возникают с неожиданно высокой частотой в библиотеках гипермутаций, (ii) мутанты с приобретенными функциями хорошо представлены в таких библиотеках, и (iii) большинство мутаций scFv, приводящих к более высокой аффинности, соответствуют остаткам, отстоящим от участка связывания.
В качестве альтернативы, или в дополнение, может быть полезным анализ кристаллической структуры комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном или использование компьютерного программного обеспечения для моделирования таких точек контакта. Такие контактирующие остатки и соседние остатки являются кандидатами на замену в соответствии со способами, разработанными в настоящем документе. После создания таких вариантов, их подвергают скринингу, как описано в настоящем документе, и антитела с наилучшими свойствами в одном или нескольких соответствующих анализах могут быть выбраны для дальнейшей разработки.
В другом аспекте предлагается способ детектирования человеческого HNL в образце, содержащий приведение образца от человека в контакт с любым из вышеуказанных антител в условиях, которые делают возможным связывание антитела с человеческим HNL, и детектирование связанного антитела. В одном варианте осуществления первое антитело к HNL иммобилизуют на твердой подложке в качестве реагента для захвата, а второе антитело к HNL используют в качестве реагента для детектирования. В родственном аспекте количество HNL в образце определяют с помощью измерения количества связанного антитела. Способы детектирования могут быть использованы во множестве способов диагностирования, прогнозирования и мониторинга, включая способы диагностирования связанного с HNL нарушения, способы различения воспалительного заболевания и невоспалительного заболевания и способы мониторинга терапии с помощью анти-HNL антитела. В таких способах уровень HNL выше определенного порога коррелирует с наличием связанного с HNL нарушения, тогда как уровень ниже упомянутого порога указывает на то, что пациент вряд ли имеет связанное с HNL нарушение. Аналогичным образом, уровень HNL выше определенного порога коррелирует с присутствием бактериальной инфекции, тогда как уровень ниже упомянутого порога указывает на то, что пациент вряд ли имеет бактериальную инфекцию. Для определения присутствия или отсутствия бактериальной инфекции биологический образец от пациента приводят в контакт с одним или несколькими из анти-HNL антител, раскрытых в настоящем документе, в условиях и в течение времени, достаточных для того, чтобы обеспечить образование иммунокомплексов. Затем детектируют иммунокомплексы, образованные между анти-HNL антителом и HNL в биологическом образце. Количество HNL в образце определяют с помощью измерения количества иммунокомплекса, образованного между антителом и HNL. В некоторых способах биологический образец выделяют от пациента и инкубируют с одним или несколькими из анти-HNL антител, раскрытых в настоящем документе, и уровень комплекса антитело-HNL выше определенного порога коррелирует с присутствием бактериальной инфекции, а уровень ниже упомянутого порога указывает на то, что пациент вряд ли имеет бактериальную инфекцию.
Для мониторинга терапии, содержащего повторное тестирование пациента на присутствие HNL после начала, во время или после терапии, направленной на борьбу с бактериальной инфекцией, уровень HNL ниже определенного порога указывает на то, что терапия (препарат и/или доза) эффективна, а уровень выше упомянутого порога указывает на то, что терапия не эффективна. Варианты осуществления настоящего изобретения, таким образом, предлагают способ (повторного) тестирования субъектов с подозрением на бактериальную инфекцию (то есть измерения HNL в различные моменты времени), содержащий этапы:
- инкубирования образца в присутствии упомянутого связывающего средства;
- необязательно, смывания несвязанного материала образца;
- измерения уровня HNL в образце от субъекта, который, как полагают, имеет бактериальную инфекцию, или имеющего подтвержденную бактериальную инфекцию, и подвергаемого терапии антибиотиками;
- необязательно, сравнения уровня HNL, измеренного на этапе c), с одним или несколькими контрольными образцами, необязательно полученными от
(i) здоровых субъектов,
(ii) субъектов, о которых известно, что они имеют бактериальную инфекцию, и,
также необязательно, сравнение уровня HNL, измеренного на этапе c), с одним или несколькими нормализованными контрольными значениями HNL, характерными для здоровых субъектов и/или субъектов с бактериальной инфекцией, и/или с уровнем HNL в образце от данного пациента до лечения, причем уровень HNL в образце от субъекта, у которого диагностировано бактериальное заболевание, определяют по меньшей мере в один последующий момент времени после начала антибактериального лечения, необязательно содержащий повторение упомянутого анализа и, также необязательно, сравнение уровня HNL до, во время и/или после антибактериальной терапии.
В другом варианте осуществления настоящее изобретение предлагает способ мониторинга эффективности или неэффективности антибактериального лечения, например с помощью определенных антибиотиков, причем упомянутый субъект был идентифицирован как носитель бактерий, вызывающих сепсис, и/или резистентных к антибиотикам бактерий.
В любом из способов, раскрытых в настоящем документе, можно использовать вещество для предварительной активации для увеличения чувствительности способов тестирования, которое, предпочтительно, представляет собой N-формилпептид, более предпочтительно трипептид fMLP. Также предпочтительно, предусмотрено использование белка A. Настоящее изобретение также предусматривает использование дополнительных альтернативных активаторов нейтрофилов, таких как липополисахарид (LPS), фактор активации тромбоцитов, неметилированный олигонуклеотид CpG или фактор некроза опухоли (TNF). Эти активаторы могут быть использованы по отдельности или в любой комбинации, например, в форме fMLP и/или белок A, и/или липополисахарид (LPS), и/или фактор активации тромбоцитов, и/или неметилированный олигонуклеотид CpG, и/или фактор некроза опухоли (TNF), в том числе, например, fMLP в комбинации с белком A, fMLP в комбинации с LPS, fMLP в комбинации с фактором активации тромбоцитов, fMLP в комбинации с неметилированным олигонуклеотидом CpG или в комбинации с TNF и так далее. Также предусмотрены дополнительные комбинации активаторов, такие как белок A в комбинации с LPS, белок A в комбинации с фактором активации тромбоцитов, белок A в комбинации с неметилированным олигонуклеотидом CpG или в комбинации с TNF; или LPS в комбинации с любым из других активаторов, упомянутых выше; или неметилированный олигонуклеотид CpG в комбинации с любым из других активаторов, упомянутых выше; или TNF в комбинации с любым из других активаторов, упомянутых выше. В предпочтительном варианте осуществления активатор представляет собой fMLP или комбинацию fMLP с одним или несколькими из других активаторов, упомянутых выше.
Также предлагаются способы отличения бактериальной инфекции от небактериальной инфекции. Могут быть использованы различные иммуноанализы, известные в данной области техники, включая, но без ограничения: системы конкурентного и неконкурентного анализа с использованием таких методов, как радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), "сэндвич" иммуноанализы, иммунорадиометрические анализы, реакции диффузной преципитации в геле, иммунодиффузные анализы, иммуноанализы in situ (с использованием коллоидного золота, ферментных или радиоизотопных меток, например), вестерн-блоты, реакции преципитации, агглютинационные анализы (например, агглютинационные анализы в геле, гемагглютинационные анализы), иммунофлюоресцентные анализы, анализы на белок A и иммуноэлектрофоретические анализы и так далее, а также, например, устройства для детектирования аналитов, которые используют магнитное разделение представляющих интерес аналитов (например, устройство, раскрытое в WO2008/072156, WO2008/102218, WO2010/035204 и WO2011/036638, включенных в настоящий документ во всей полноте). В одном варианте осуществления связывание антитела детектируют посредством детектирования метки на первичном антителе. В другом варианте осуществления первичное антитело детектируют посредством детектирования связывания вторичного антитела или реагента к первичному антителу. В другом варианте осуществления вторичное антитело помечено. В данной области техники известно множество средств для детектирования связывания при иммуноанализе, и они лежат в пределах объема настоящего изобретения. Антитела: A Laboratory Manual (1988), Harlow & Lane, или более поздние издания; иммуноанализы: A Practical Approach, Oxford University Press, Gosling, J. P. (ed.) (2001), или более поздние издания; и/или Current Protocols in Molecular Biology (Ausubel et al.), которые обновляются регулярно. Примеры таких анализов обычно содержат антитело, прикрепленное к поверхности или матрице, добавление сыворотки пациента и время, обеспечивающее образование комплекса; подходящие процедуры отмывания для удаления несвязанного комплекса, за чем следует добавление или второго антитела для обеспечения детектирования комплекса (сэндвич-ELISA), или детектируемого варианта HNL для детектирования свободных участков связывания HNL на поверхности антитела (конкурентный ELISA). Уровень HNL, детектированный с помощью вышеуказанных способов, выше определенного порога коррелирует с наличием воспалительного заболевания, а уровень ниже упомянутого порога указывает на то, что пациент вряд ли имеет воспалительное заболевание. Пациент вряд ли имеет бактериальное инфекционное заболевание, когда уровень HNL находится в нормальном диапазоне. Пациент, вероятно, имеет бактериальное заболевание, когда уровень HNL превышает нормальный диапазон.
В некоторых вариантах осуществления биологический образец, полученный от пациента, тестируют на уровень HNL. Биологический образец инкубируют с одним или несколькими из анти-HNL антител, раскрытых в настоящем документе, в условиях и в течение времени, достаточных для того, чтобы обеспечить образование иммунокомплексов. Затем детектируют иммунокомплексы, образованные между HNL и антителами в биологическом образце, которые специфически связываются с HNL. Биологический образец для использования в таких способах может представлять собой любой образец, полученный от пациента, который, как ожидается, содержит HNL. Подходящие биологические образцы включают кровь, сыворотку, плазму, мочу, спинномозговую жидкость (CSF) и костный мозг. Подходящие антитела включают антитела из клеток человека, грызунов, кролика, козы, верблюда или любого другого вида.
Биологический образец инкубируют с антителами в реакционной смеси в условиях и в течение времени, достаточных для того, чтобы сделать возможным образование иммунокомплексов между HNL и антителами, которые являются иммуноспецифическими к HNL. После инкубации реакционную смесь тестируют на присутствие иммунокомплексов. Детектирование иммунокомплексов, образованных между анти-HNL антителом и HNL, присутствующим в биологическом образце, может быть выполнено с помощью множества известных методов, таких как радиоиммуноанализы (RIA) и твердофазные иммуноферментные анализы (ELISA). Подходящие анализы хорошо известны в данной области техники и подробно описаны в научной и патентной литературе (Harlow and Lane, 1988). Анализы, которые могут быть использованы, включают, но без ограничения, метод двойного сэндвич-иммуноанализа с моноклональными антителами (патент США № 4376110); сэндвич-анализы с моноклональными и поликлональными антителами (Wide L., "Solid Phase Antigen-Antibody Systems," Radioimmunoassay Methods: European Workshop September 15-17 1970, Edinburgh, Kirkham and Hunter, eds., (Churchill Livingston, Edenburgh, (1971)) pp. 405-412; способ "вестерн-блотов" (патент США № 4452901); иммунопреципитацию меченых лигандов (Brown et al., J. Biol. Chem. 4980-4983m, 1980); твердофазные иммуноферментные анализы; иммуноцитохимические методы, включающие в себя использование флуорохромов (Brooks et al., CHn. Exp. Immunol., 39: 477, 1980); и нейтрализацию активности (Bowen-Pope et al., Science, 226: 701-703, 1984). Другие иммуноанализы включают в себя, но без ограничения, описанные в патентах США №№ 3850752; 3901654; 3935074; 3984533; 3996345; 4034074; и 4098876. Для целей детектирования анти-HNL антитело может быть или меченым, или немеченым. Немеченые антитела могут быть использованы в агглютинационных анализах или в комбинации с мечеными реагентами для детектирования, которые связываются с иммунокомплексами (например, антииммуноглобулином, белком G, белком A или лектином и вторичными антителами или их антигенсвязывающими фрагментами, способными к связыванию с антителами, которые специфически связываются с HNL). Если анти-HNL антитело помечено, репортерная группа может представлять собой любую подходящую репортерную группу, известную в данной области техники, включая радиоизотопы, флуоресцентные группы (например, флуоресцеин или родамин), люминесцентные группы, ферменты, биотин и частицы красителя. Метки, которые сами могут быть непосредственно детектированны, включают флуоресцентные или люминесцентные красители, металлы или хелаты металлов, электрохимические метки, радионуклиды (например, 32P, 14C, 1251, 3H или 1311), магнитные метки или гранулы (например, DYNABEADS), парамагнитные метки или колориметрические метки (например, коллоидное золото, цветные стеклянные или пластмассовые гранулы). Такие детектируемые метки могут быть непосредственно конъюгированы с анти-HNL антителом или реагентом для детектирования или могут быть связаны с гранулой или частицей, которая прикреплена к анти-HNL антителу или реагенту для детектирования. Метки, которые могут быть детектированы посредством связывания меченого партнера по специфическому связыванию, включают в себя биотин, дигоксигенин, мальтозу, олигогистидин, 2,4-динитробензол, фениларсенат, онДНК или днДНК). Непрямые метки, которые могут быть косвенно детектированы по производству ими детектируемого продукта реакции, включают различные ферменты, хорошо известные в данной области техники, такие как щелочная фосфатаза, пероксидаза хрена, β-галактозидаза, ксантиноксидаза, глюкозооксидаза или другие сахаридоксидазы, или люциферазы, которые расщепляют соответствующий субстрат с образованием окрашенного или флуоресцентного продукта реакции.
В некоторых анализах немеченое анти-HNL антитело иммобилизуют на твердой подложке для использования в качестве "средства (или реагента) захвата", который захватывает HNL в биологическом образце. Твердая подложка может представлять собой любой материал, известный средним специалистам в данной области техники, к которому может быть прикреплено антитело. Например, твердая подложка может представлять собой тест-лунку в микротитровальном планшете или нитроцеллюлозе или другой подходящей мембране. В качестве альтернативы, подложка может представлять собой пробирку, гранулу, частицу или диск, в том числе стеклянный, стекловолоконный, латексный или пластмассовый материал, такой как полиэтилен, полипропилен, полистирол или поливинилхлорид, или пористую матрицу. Другие материалы включают агарозу, декстран, полиакриламид, нейлон, сефадекс, целлюлозу или полисахариды. Подложка может также представлять собой магнитную частицу или волоконно-оптический датчик, такой как раскрытый, например, в патенте США № 5359681. Иммобилизованное анти-HNL антитело может представлять собой поликлональное антитело или одно или несколько моноклональных антител, таких как описанные в настоящем документе, или комбинацию поликлонального и одного или нескольких моноклональных антител. Антитело может быть иммобилизовано на твердой подложке с использованием множества методов, известных специалистам в данной области техники, которые подробно описаны в патентной и научной литературе. В контексте настоящего изобретения термин "иммобилизация" относится как к нековалентному связыванию, такому как адсорбция, так и к ковалентному прикреплению (которое может представлять собой непосредственную связь между антигеном и функциональными группами на подложке или представлять собой связь посредством перекрестно-сшивающего средства). Рассматривается иммобилизация посредством адсорбции к лунке в микротитровальном планшете или к мембране. В таких случаях адсорбция может быть достигнута посредством приведения анти-HNL антитела в подходящем буфере в контакт с твердой подложкой в течение подходящего периода времени. Время контакта изменяется с изменением температуры, но обычно составляет между приблизительно 1 часом и приблизительно 1 днем. Обычно приведения лунки пластмассового (включая полистирол или поливинилхлорид) микротитровального планшета в контакт с количеством пептида в диапазоне от приблизительно 10 нг до приблизительно 10 мкг, от приблизительно 100 нг до приблизительно 1 мкг, достаточно для иммобилизации подходящего количества пептида. После иммобилизации оставшиеся участки связывания белка на подложке обычно блокируют. Может быть использовано любое подходящее блокирующее средство, известное средним специалистам в данной области техники, включая бычий сывороточный альбумин, Tween™ 20 (Sigma Chemical Co., St. Louis, Mo.), инактивированную нагреванием нормальную козью сыворотку (NGS) или BLOTTO (забуференный раствор обезжиренного сухого молока, который также содержит консервант, соли и противовспенивающее средство). Затем подложку инкубируют с биологическим образцом, который, как полагают, содержит HNL. Образец может быть применен в чистом виде, или, чаще, он может быть разбавлен, обычно забуференным раствором, который содержит небольшое количество (0,1%-5,0% по весу) белка, такого как БСА, NGS или BLOTTO. Обычно соответствующее время контакта (то есть, время инкубации) представляет собой период времени, который достаточен для детектирования присутствия антитела или антигенсвязывающего фрагмента, который является иммуноспецифическим для HNL, в образце, содержащем HNL. В некоторых вариантах осуществления время контакта достаточно для достижения уровня связывания, который составляет по меньшей мере приблизительно 95% от уровня, достигаемого при равновесии между связанным и несвязанным антителом или фрагментом антитела. Средним специалистам в данной области техники будет понятно, что время, необходимое для достижения равновесия, может быть легко определено посредством анализа уровня связывания, которое происходит в течение определенного периода времени. При комнатной температуре обычно достаточно времени инкубации приблизительно от 10 до 30 минут.
Затем несвязанный образец может быть удален посредством промывания твердой подложки соответствующим буфером, таким как ФСБ, содержащий 0,1% Tween™ 20. Затем может быть добавлен реагент для детектирования, который связывается с HNL в иммунокомплексах (образованных посредством связывания средства захвата и HNL из образца). Такой реагент для детектирования может представлять собой поликлональное антитело или одно или несколько моноклональных антител, таких как описанные в настоящем документе, или комбинацию поликлонального и одного или нескольких моноклональных антител, таких как описанные в настоящем документе, или фрагмента Fab любого антитела. Реагент для детектирования может быть непосредственно помечен, то есть может содержать по меньшей мере первую детектируемую метку или "репортерную" молекулу. В качестве альтернативы, реагент для детектирования может представлять собой немеченое анти-HNL антитело. Это немеченое анти-HNL (первичное) антитело затем детектируют посредством связывания меченого вторичного антитела или реагента с первичным антителом. Например, если первичное антитело представляет собой мышиный иммуноглобулин, вторичное антитело может представлять собой меченое антитело против мышиного иммуноглобулина. Аналогичным образом, если первичное антитело представляет собой кроличий иммуноглобулин, вторичное антитело может представлять собой меченое антитело против кроличьего иммуноглобулина.
Реагент для детектирования инкубируют с иммунокомплексом в течение периода времени, достаточного для детектирования связанного антитела или его антигенсвязывающего фрагмента. Соответствующее количество времени может быть обычно определено посредством анализа уровня связывания, которое происходит за некоторый период времени. Затем несвязанную метку или реагент для детектирования удаляют, и связанную метку или реагент для детектирования детектируют с использованием подходящего способа анализа или аналитического прибора. Способ, используемый для детектирования репортерной группы, зависит от природы репортерной группы. Для радиоактивных меток обычно подходят сцинтилляционный счет или авторадиографические способы. Для детектирования красителей, люминесцентных или хемилюминесцентных групп и различных хромогенов, флуоресцентных меток и тому подобного можно использовать спектроскопические способы. Биотин можно детектировать с использованием авидина, связанного с различными репортерными группами (обычно радиоактивной или флуоресцентной группой или ферментом). Ферментные репортерные группы (включая пероксидазу хрена, [бета]-галактозидазу, щелочную фосфатазу и глюкозооксидазу) обычно могут быть детектированы посредством добавления субстрата (обычно в течение определенного периода времени), за чем следует спектроскопический или другой анализ продуктов реакции. Независимо от конкретного используемого способа, уровень связанного реагента для детектирования, который по меньшей мере в два раза больше, чем фон (то есть, уровень, наблюдаемый для биологического образца, полученного от индивидуума с нормальным уровнем HNL) указывает на присутствие нарушения, связанного с экспрессией HNL.
В альтернативных вариантах осуществления образец и реагент для детектирования могут быть одновременно приведены в контакт со средством захвата, а не добавлены последовательно. В еще одном альтернативном варианте образец и реагент для детектирования могут быть предварительно инкубированы вместе, а затем добавлены к средству захвата. Другие варианты очевидны для среднего специалиста в данной области техники.
В другом варианте осуществления количество HNL, присутствующего в образце, определяют с помощью конкурентного анализа связывания. Конкурентные анализы связывания основаны на способности меченого стандарта (например, полипептида HNL или его иммунологически реактивной части) конкурировать с аналитом тестируемого образца (полипептида HNL) за связывание с ограниченным количеством анти-HNL антитела. После разделения свободного и связанного HNL количество HNL определяют посредством соотнесения отношения связанный/несвязанный HNL с известными стандартами. Количество полипептида HNL в тестируемом образце обратно пропорционально количеству стандарта, который оказывается связан с антителами. Для облегчения определения количества стандарта, который оказывается связанным, антитела обычно иммобилизуют на твердой подложке, так что стандарт и аналит, которые связаны с антителами, можно удобно отделять от стандарта и аналита, которые остаются несвязанными. Таким образом, в таких вариантах осуществления также предусмотрено приведение биологического образца в контакт с меченым зрелым HNL (или его меченым фрагментом, который сохраняет антигенность HNL) и антителом, которое связывается со зрелым HNL, и детектирование количества образованного комплекса антитело-меченый HNL.
Получение конъюгатов с твердыми подложками или детектируемыми метками часто содержит использование химических перекрестносшивающих средств. Перекрестносшивающие реагенты содержат по меньшей мере две реактивные группы, и обычно их разделяют на гомофункциональные перекрестносшивающие средства (содержащие идентичные реактивные группы) и гетерофункциональные перекрестносшивающие средства (содержащие неидентичные реактивные группы). Гомобифункциональные перекрестносшивающие средства, которые связывают через амины, сульфгидрилы или реагируют неспецифически, доступны из многих коммерческих источников. Малеимиды, алкил- и арилгалогениды, альфа-галогенацилы и пиридилдисульфиды являются тиольными реактивными группами. Малеимиды, алкил- и арилгалогениды, альфа-галогенацилы реагируют с сульфгидрилами с образованием тиоловых эфирных связей, тогда как пиридилдисульфиды реагируют с сульфгидрилами с образованием смешанных дисульфидов. Пиридилдисульфидный продукт является расщепляемым.
Гетеробифункциональные перекрестносшивающие средства имеют две или более различных реактивных группы, что обеспечивает последовательные конъюгации с определенными группами белков при сведении к минимуму нежелательной полимеризации или самоконъюгации. Гетеробифункциональные реагенты также используют, когда проблематична модификация аминов. Иногда амины могут находиться в активных участках макромолекул, и их модификация может приводить к потере активности. Другие группы, такие как сульфгидрилы, карбоксилы, фенолы и углеводы, могут представлять собой более подходящие мишени. Двухступенчатая стратегия обеспечивает связывание белка, который может выдерживать модификацию своих аминов, с белком с другими доступными группами. Коммерчески доступны разнообразные гетеробифункциональные перекрестносшивающие средства, которые объединяют различные атрибуты для успешной конъюгации. Перекрестносшивающие средства, которые являются аминореактивными с одного конца и сульфгидрильнореактивными с другого конца, являются довольно распространенными. При использовании гетеробифункциональных реагентов сначала обычно реагирует наиболее лабильная группа для обеспечения эффективного перекрестного сшивания и избежания ненужной полимеризации.
В некоторых вариантах осуществления способы мониторинга эффективности терапии с помощью антибиотика включают в себя мониторинг изменений уровня HNL в образце или у животного, например млекопитающего, например у пациента-человека. Способы, в которых подвергают мониторингу уровни HNL, могут содержать (a) инкубирование первого биологического образца, полученного от пациента до терапии, с одним или несколькими из анти-HNL антител, раскрытых в настоящем документе, причем инкубацию осуществляют в условиях и в течение времени, достаточных для того, чтобы обеспечить образование иммунокомплексов; (b) детектирование иммунокомплексов, образованных между HNL в биологическом образце, и антител или антигенсвязывающих фрагментов, которые специфически связывают HNL; и (c) повторение этапов (a) и (b) с использованием второго биологического образца, полученного от пациента в более позднее время, такое как, например, после терапии с помощью одного или нескольких антибиотиков; и (d) сравнение количества иммунокомплексов, детектированных в первом и втором биологических образцах. Биологический образец для использования в таких способах может представлять собой любой образец, полученный от пациента, который, как полагают, содержит HNL. Примеры биологических образцов включают кровь, плазму, сыворотку, мочу, CSF, костный мозг, слюну и мокроту. Первый биологический образец может быть получен перед началом терапии или после прохождения части терапевтического курса. Второй биологический образец должен быть получен аналогичным образом, но в момент времени после дополнительной терапии. Второй биологический образец может быть получен при завершении или после прохождения части терапии, при условии, что между получением первого и второго биологических образцов проходит по меньшей мере часть терапии. Процедуры инкубации и детектирования для обоих образцов могут быть в целом осуществлены, как описано выше. Уменьшение количества иммунокомплексов во втором образце по сравнению с первым образцом указывает на уменьшение уровней HNL и отражает успешную терапию.
Способы установления соответствующего порога для диагностирования болезненных состояний, описанных в настоящем документе, и мониторинга терапии, как описано в настоящем документе, хорошо известны в данной области техники. В качестве примера, уровни HNL в образце от достаточно репрезентативного количества нормальных субъектов (например, здоровой популяции без подлежащих детектированию состояний) анализируют по отношению к уровню HNL от достаточно репрезентативного количества заболевших субъектов (например, популяции, в которой подтверждено наличие заболевания или состояния) с использованием одних и тех же протоколов. Может быть определен предельный порог, который устанавливает различие между большинством нормальной популяции и большинством популяции заболевших. В качестве альтернативы, подходящие значения граничных точек для отрицательных, неопределенных и положительных результатов могут быть определены из данных. Например, может быть определен нормальный диапазон (указывающий на отрицательный результат), который включает в себя HNL большинства из нормальной популяции, но который исключает почти всех из популяции заболевших. Соответственно, может быть определен диапазон, указывающий на положительный результат, который включает в себя HNL большинства из популяции заболевших, но который исключает почти всех из нормальной популяции. Соответствующие значения граничных точек для порога могут быть определены для оптимизации желаемых специфичности или чувствительности, и могут также учитывать общие медицинские и эпидемиологические факторы. Факторы, которые необходимо учитывать, включают клинический показатель теста IVD и то, необходимо ли иметь высокое прогностическое значение положительного результата или высокое прогностическое значение отрицательного результата, а также распространенность заболевания в протестированной популяции.
Настоящее изобретение также относится к способам исключения бактериальной инфекции, способам исключения вирусной инфекции, способам подтверждения бактериальной инфекции и способам подтверждения вирусной инфекции у субъекта. Обычно концентрация полипептида HNL в образце пациента, имеющего бактериальную инфекцию, выше, чем в образце здорового пациента или в образце пациента, имеющего вирусную инфекцию. "Подтверждение" инфекции, соответственно, означает, что субъект имеет этот тип инфекции. "Исключение" инфекции означает, что субъект не имеет этот тип инфекции.
Например, концентрацию полипептида HNL в образце пациента, имеющего бактериальную инфекцию, считают более высокой, чем в образце здорового пациента, когда она превосходит порог, который на одно с половиной стандартное отклонение выше среднего значения концентрации, по сравнению с популяцией здоровых пациентов. Предпочтительно, концентрация полипептида HNL в образце пациента является более высокой, когда концентрация HNL превосходит порог, который на два стандартных отклонения выше среднего значения концентрации, по сравнению с популяцией здоровых пациентов. Более предпочтительно, концентрация полипептида HNL в образце пациента является более высокой, когда концентрация HNL превосходит порог, который на три стандартных отклонения выше среднего значения концентрации, по сравнению с популяцией здоровых пациентов.
Настоящее изобретение в определенных вариантах осуществления направлено, таким образом, на диагностирование бактериальной инфекции (то есть, подтверждение бактериальной инфекции) посредством сравнения общей концентрации полипептида HNL в биологическом образце пациента со статистически подтвержденным порогом для общего количества полипептида HNL и посредством сравнения концентрации детерминанты в биологическом образце пациента со статистически подтвержденным порогом для каждой специфической детерминанты. Статистически подтвержденный порог для общего количества полипептида HNL основан на общей концентрации полипептида HNL в сравнимых образцах, полученных от контрольной популяции, например от здоровых пациентов или от пациентов, имеющих заболевание, отличное от бактериальной инфекции, например вирусную инфекцию. Статистически подтвержденный порог для концентрации детерминанты специфической детерминанты (детерминант) основан на концентрации детерминанты каждой специфической детерминанты (детерминант) в сравнимых контрольных биологических образцах от контрольной популяции, например от здоровых пациентов или пациентов, имеющих заболевание, отличное от бактериальной инфекции. Различные контрольные популяции иным образом описаны в настоящем документе.
Настоящее изобретение в определенных вариантах осуществления также направлено на исключение бактериальной инфекции посредством сравнения общей концентрации полипептида HNL в биологическом образце пациента со статистически подтвержденным порогом для общего количества полипептида HNL и посредством сравнения концентрации детерминанты в биологическом образце пациента со статистически подтвержденным порогом для каждой специфической детерминанты. Статистически подтвержденный порог для общего количества полипептида HNL основан на общей концентрации полипептида HNL в сравнимых образцах, полученных от контрольной популяции, например от пациентов, имеющих бактериальную инфекцию. Статистически подтвержденный порог для концентрации детерминанты специфической детерминанты (детерминант) основан на концентрации детерминанты каждой специфической детерминанты в сравнимых контрольных биологических образцах от контрольной популяции, например от пациентов, имеющих бактериальную инфекцию. Различные контрольные популяции иным образом описаны в настоящем документе.
Способы исключения бактериальной инфекции, способы исключения вирусной инфекции, способы подтверждения бактериальной инфекции и способы подтверждения вирусной инфекции у субъекта могут по существу содержать следующие этапы:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного в настоящем документе выше, или диагностической композиции или набора, как определено в настоящем документе выше; и
b) (i) исключение бактериальной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение; или
b) (ii) исключение вирусной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение; или
b) (iii) подтверждение бактериальной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение; или
b) (iv) подтверждение вирусной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
В контексте исключения бактериальной инфекции предварительно определенный первый порог может представлять собой статистически подтвержденный порог для общего количества полипептида HNL, который основан на общей концентрации полипептида HNL в сравнимых контрольных биологических образцах от пациентов, имеющих бактериальную инфекцию.
В контексте исключения вирусной инфекции предварительно определенный первый порог может представлять собой статистически подтвержденный порог для общего количества полипептида HNL, который основан на общей концентрации полипептида HNL в сравнимых контрольных биологических образцах от пациентов, имеющих вирусную инфекцию.
В контексте подтверждения бактериальной инфекции предварительно определенный первый порог может представлять собой статистически подтвержденный порог для общего количества полипептида HNL, который основан на общей концентрации полипептида HNL в сравнимых контрольных биологических образцах от здоровых пациентов или пациентов, имеющих вирусную инфекцию.
В контексте подтверждения вирусной инфекции предварительно определенный первый порог может представлять собой статистически подтвержденный порог для общего количества полипептида HNL, который основан на общей концентрации полипептида HNL в сравнимых контрольных биологических образцах от здоровых пациентов или пациентов, имеющих бактериальную инфекцию.
В соответствии с другим аспектом настоящее изобретение относится к способу предоставления рекомендаций в отношении лечения субъекту, содержащему: a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) рекомендацию субъекту принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение;
c) рекомендацию пациенту не принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение; или
d) рекомендацию пациенту принимать противовирусное лечение, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, как определено в настоящем документе выше.
Кроме того, настоящее изобретение относится к способу предоставления рекомендаций в отношении диагностического тестирования субъекту, содержащему:
a) измерение концентрации полипептида HNL в образце, полученном от субъекта, с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше; и
b) рекомендацию тестировать образец на присутствие бактерий, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение; или
c) рекомендацию тестировать образец на присутствие вируса, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение.
Статистически подтвержденные пороги связаны со значениями, используемыми для характеризации как общей концентрации HNL, так и концентрации одной или нескольких других специфических детерминант в биологическом образце, полученном от субъекта или пациента. Таким образом, если общая концентрация HNL или концентрация детерминанты представляет собой абсолютное значение, то контрольное значение также основано на абсолютном значении. Другие детерминанты могут представлять собой любые маркеры, например полипептидные маркеры или вторичные маркеры, которые имеют прогностическое значение для определения инфекции, как определено в настоящем документе. Для этих других детерминант предложенные выше определения в отношении предварительно определенных пороговых значений применяются соответственно. "Детерминанты" в контексте настоящего изобретения охватывают, без ограничения, полипептиды, пептид, белки, изоформы белка (например, изоформы рецептора-ловушки). Детерминанты могут также включать мутантные белки.
"Детерминанта" или "детерминанты" могут, соответственно, охватывать один или несколько из всех полипептидов, уровни которых изменяются у субъектов, которые имеют инфекцию. Примеры отдельных детерминант могут включать TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксин, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанные с IgG молекулы, IL1, I-TAC, TNFR1, ABTBl, ADIPORl, ARHGDIB, ARPC2, ATP6V0B, Clorf83, CD15, CES1, COROIA, CRP, CSDA, EIF4B, EPSTI1, GAS 7, HERC5, IFI6, KIAA0082, IFIT1, IFIT3, IFITM1, IFITM3, LIPT1, IL7R, ISG20, LOC26010, LY6E, LRDD, LTA4H, MAN1C1, MBOAT2, MX1, NPM1, OAS2, PARP12, PARP9, QARS, RAB13, RAB31, RAC2, RPL34, PDIA6, PTEN, RSAD2, SART3, SDCBP, TRIM 22, SMAD9, SOCS3, UBE2N, XAFl или ZBPl; а также любую их комбинацию, например больше чем 1, в том числе 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше или все из этих детерминант. Настоящее изобретение также предусматривает обеспечение и/или использование связывающих средств против любой из вышеупомянутых детерминант, в частности, если они присутствуют в виде полипептидов, а в некоторых вариантах осуществления также включая связывающие нуклеиновую кислоту молекулы. Такое связывающее средство, предпочтительно антитело, может быть получено в соответствии с процедурами, известными специалисту, или изложенными в настоящем документе в контексте HNL, или может быть доступно из коммерческих источников. Кроме того, информация может быть получена, например, из документа Kjeldsen et al., J Biol Chem., 1993 May 15; 268(14): 10425-32, "Isolation and primary structure of NGAL, a novel protein associated with human neutrophil gelatinase".
Детерминанты могут также охватывать неполипептидные факторы, непереносимые кровью факторы или не представляющие собой аналит физиологические маркеры состояния здоровья, такие как "клинические параметры", определенные в настоящем документе, а также "традиционные лабораторные факторы риска", также определенные в настоящем документе.
Например, как используется в настоящем документе, детерминанты могут включать неполипептидные признаки (то есть неполипептидные детерминанты), такие как % нейтрофилов (сокращенно Neu (%)), % лимфоцитов (сокращенно Lym(%)), % моноцитов (сокращенно Mon(%)), абсолютное количество нейтрофилов (сокращенно ANC) и абсолютное количество лимфоцитов (сокращенно ALC), количество белых кровяных клеток (сокращенно WBC), возраст, пол и максимальную температуру (то есть максимальную центральную температуру тела с момента первоначального появления симптомов).
Детерминанты могут также включать любые расчетные показатели, созданные математически, или комбинации любых одного или нескольких из вышеуказанных измерений, включая временные тенденции и различия. Если доступно, и если иное не описано в настоящем документе, детерминанты, которые представляют собой продукты генов, идентифицируют на основании официального буквенного сокращения или символа гена, присвоенного комиссией по наименованиям международной организации по изучению генома человека (HGNC) и приведенного на дату подачи настоящего документа на веб-сайте Национального центра биотехнологической информации США (NCBI), также известного как Entrez Gene. В предпочтительных вариантах осуществления детерминанты включают полипептидные и неполипептидные признаки.
Примеры таких детерминант, упомянутых выше и предусмотренных настоящим изобретением, приведены далее:
ABTB1: Этот ген кодирует белок с областью анкириновых повторов и два домена BTB/POZ, которые, как полагают, участвуют во взаимодействиях белок-белок. Экспрессия этого гена активируется гомологом фосфатазы и тензина, онкосупрессором. Альтернативный сплайсинг приводит к трем вариантам транскриптов. Он может действовать в качестве медиатора подавляющего рост сигнального пути PTEN. Он может играть роль в процессах развития. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ADIPORl: ADIPORl представляет собой рецептор для глобулярного и полноразмерного адипонектина (APM1), необходимого гормона, секретируемого адипоцитами, который выполняет роль антидиабетического средства. Он, вероятно, участвует в метаболических путях, которые регулируют липидный метаболизм, такой как окисление жирных кислот. Он опосредует увеличение AMPK, активность лиганда PPARA, окисление жирных кислот и захват глюкозы адипонектином. ADIPORl имеет несколько высокоаффинных рецепторов для глобулярного адипонектина и низкоаффинных рецепторов для полноразмерного адипонектина. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ARHGDIB: Регулирует реакцию обмена ГДФ/ГТФ белков Rho посредством ингибирования диссоциации от них ГДФ и последующего связывания с ними ГТФ. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ARPC2: Функционирует в качестве актин-связывающего компонента комплекса Arp2/3, который участвует в регуляции полимеризации актина и вместе с активацией стимулирующего нуклеацию фактора (NPF) опосредует образование разветвленных актиновых сетей. Как полагают, входит в контакт с материнским актиновым волокном. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ATP6V0B: H<+>- АТФаза (вакуолярная АТФаза, V-АТФаза) представляет собой фермент-переносчик, функционирование которого приводит к повышению кислотности во внутриклеточном пространстве в эукариотических клетках. Он экспрессируется по всему организму и присутствует в эндомембранных органеллах, таких как вакуоли, лизосомы, эндосомы, аппарат Гольджи, хромаффинные гранулы и окаймленные везикулы, а также в плазматической мембране. H<+>- АТФаза представляет собой мультисубъединичный комплекс, состоящий из двух доменов. Домен V1 отвечает за гидролиз АТФ, а домен V0 отвечает за транслокацию белка. Существуют два основных механизма регулирования активности H<+>- АТФазы; кругооборот H<+>- АТФаза-содержащих везикул в плазматическую мембрану и из нее и глюкоза-чувствительная сборка/разборка голо-ферментного комплекса. Эти переносчики играют важную роль в таких процессах, как рецептор-опосредованный эндоцитоз, деградация белков и сопряженный транспорт. Они выполняют функцию в костной реабсорбции, и мутации в гене A3 вызывают рецессивный остеопетроз. Кроме того, H<+>- АТФазы вовлечены в метастазирование опухоли и регуляцию подвижности и созревания сперматозоидов. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
B2M: дополнительные наименования B2M включают, без ограничения, бета-2-микроглобулин и CDABP0092. B2M является компонентом молекул MHC класса I, которые присутствуют на всех ядросодержащих клетках. Белок, кодируемый этим геном, также кодирует изоформу, присутствующую в сыворотке. Данный белок имеет, преимущественно, структуру бета-складчатого листа, которая может образовывать амилоидные фибриллы при некоторых патологических состояниях. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
BCA1: BCA1 является хемоаттрактантом B-лимфоцитов, независимо клонированным и названным Angie, представляет собой хемокин CXC, сильно экспрессируемый в фолликулах селезенки, лимфатических узлах и пейеровых бляшках. Он, преимущественно, стимулирует миграцию B-лимфоцитов (по сравнению с T-клетками и макрофагами), по-видимому посредством стимуляции инфлюкса кальция и хемотаксиса у клеток, экспрессирующих рецептор 1 лимфомы Беркитта (BLR-1). Поэтому он может функционировать при хоминге B-лимфоцитов в фолликулы (предоставлено RefSeq). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
Clorf83: Функция полностью не охарактеризована. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD112: Этот ген кодирует однопроходный типа I мембранный гликопротеин с двумя Ig-подобными доменами C2-типа и Ig-подобным доменом V-типа. Этот белок является одним из компонентов адгезионных соединений плазматической мембраны. Он также служит в качестве входа для некоторых мутантных штаммов вируса простого герпеса и вируса ложного бешенства, и он участвует в распространении этих вирусов от клетки к клетке. Варианты этого гена оказались связаны с различиями в тяжести рассеянного склероза. Были охарактеризованы варианты альтернативного транскрипционного сплайсинга, кодирующие различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD134: Белок, кодируемый этим геном, является членом суперсемейства TNF-рецепторов. Было показано, что этот рецептор активирует NF-каппа-B посредством своего взаимодействия с белками-адаптерами TRAF2 и TRAF5. Нокаутные исследования на мышах говорят о том, что этот рецептор стимулирует экспрессию ингибиторов апоптоза BCL2 и BCL21L1/BCL2-XL и, таким образом, подавляет апоптоз. Нокаутные исследования также подтверждают роль этого рецептора в ответе CD4+ T-клеток, а также в зависимой от T-клеток пролиферации и дифференцировке B-клеток. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD15 (FUT4): Продукт этого гена переносит фукозу в N-ацетиллактозаминовые полисахариды для создания фукозилированных углеводных структур. Он катализирует синтез несиалированного антигена Lewis x (CD15). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD182: Белок, кодируемый этим геном, является членом семейства связанных с G-белком рецепторов. Этот белок является рецептором для интерлейкина 8 (IL8). Он связывается с IL8 с высокой аффинностью и передает сигнал посредством активированной G-белком второй системы мессенджеров. Этот рецептор также связывается с хемокиновым (мотив C-X-C) лигандом 1 (CXCL1/MGSA), белком со стимулирующей рост меланомы активностью, и было показано, что он является основным компонентом, требующимся для зависимого от сыворотки роста меланомных клеток. Этот рецептор опосредует миграцию нейтрофилов к участкам воспаления. Было обнаружено, что ангиогенные эффекты IL8 в кишечных микрососудистых эндотелиальных клетках опосредуются этим рецептором. Нокаутные исследования на мышах говорят о том, что этот рецептор управляет позиционированием предшественников олигодендроцитов при развитии спинного мозга посредством задержки их миграции. Этот ген, IL8RA, ген, кодирующий другой высокоаффинный рецептор IL8, а также IL8RBP, псевдоген IL8RB, образуют кластер генов в области, расположенной на хромосоме 2q33-q36. В качестве альтернативы, были идентифицированы варианты сплайсинга, кодирующие тот же белок. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD231: Белок, кодируемый этим геном, является членом суперсемейства трансмембранных 4, также известного как семейство тетраспанинов. Большинство из них являются белками клеточной поверхности, которые характеризуются наличием четырех гидрофобных доменов. Данные белки опосредуют события трансдукции сигналов, которые играют важную роль в регуляции развития, активации, роста и подвижности клеток. Этот кодируемый белок представляет собой гликопротеин клеточной поверхности и может играть роль в управлении нейритными отростками. Известно, что он образует комплекс с интегринами. Этот ген связан с X-сцепленными умственной отсталостью и психоневрологическими заболеваниями, такими как хорея Гентингтона, синдром ломкой X-хромосомы и миотоническая дистрофия (предоставлено RefSeq).
[000121] CD235a: CD235a является основным внутренним мембранным белком эритроцитов. N-концевой гликозилированный сегмент, который лежит за пределами мембраны эритроцита, содержит М-рецепторы группы крови. По-видимому, является важным для функционирования SLC4A1 и требуется для высокой активности SLC4A1. Может участвовать в транслокации SLC4A1 на плазматическую мембрану. Представляет собой рецептор для вируса гриппа. Представляет собой рецептор для эритроцит-связывающего антигена 175 Plasmodium falciparum (EBA-175); связывание EBA- 175 зависит от остатков сиаловой кислоты О-связанных гликанов. По-видимому, является рецептором для вируса гепатит (HAV). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD335: Рецептор, активирующий цитотоксичность, который может вносить вклад в повышение эффективности активированных клеток-естественных киллеров (K) для опосредования лизиса опухолевых клеток. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD337: Белок, кодируемый этим геном, представляет собой рецептор естественной цитотоксичности (NCR), который может помогать NK-клеткам при лизисе опухолевых клеток. Кодируемый белок взаимодействует с CD3-дзета (CD247), T-клеточным рецептором. Однонуклеотидный полиморфизм в 5'-нетранслируемой области этого гена оказался связан с легкой восприимчивостью к малярии. Для этого гена было обнаружено три варианта транскриптов, кодирующие различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD45: Белок, кодируемый этим геном, является членом семейства протеинтирозинфосфатазы (PTP). Известно, что PTP представляют собой сигнальные молекулы, которые регулируют множество клеточных процессов, включая клеточный рост, дифференцировку, митотический цикл и онкогенную трансформацию. Эта PTP содержит внеклеточный домен, один трансмембранный сегмент и два тандемных интрацитоплазматических каталитических домена и, следовательно, принадлежит к рецепторному типу PTP. Этот ген специфически экспрессируется в гемопоэтических клетках. Было показано, что эта PTP является существенным регулятором сигнализации T- и B-клеточного антигенного рецептора. Она функционирует или путем непосредственного взаимодействия с компонентами комплексов антигенного рецептора, или посредством активации различных киназ семейства Src, требующихся для сигнализации антигенного рецептора. Эта PTP также подавляет киназы JAK и, следовательно, функционирует в качестве регулятора сигнализации цитокинового рецептора. Было сообщено о нескольких вариантах транскриптов этого гена после альтернативного сплайсинга, которые кодируют различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD49d: Продукт этого гена принадлежит к семейству белков альфа-цепи интегринов. Интегрины представляют собой гетеродимерные интегральные мембранные белки, состоящие из альфа-цепи и бета-цепи. Этот ген кодирует цепь альфа-4. В отличие от других альфа-цепей интегринов, альфа-4 ни содержит I-домен, ни подвергается дисульфидно-связанному расщеплению. Альфа-4 цепь связывается или с цепью бета-1, или с цепью бета-7. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD62L: Этот ген кодирует молекулу адгезии клеточной поверхности, которая принадлежит к семейству рецепторов адгезии/хоминга. Кодируемый белок содержит лектин-подобный домен C-типа, связывающий кальций подобный эпидермальному фактору роста домен и два коротких комплемент-подобных повтора. Продукт гена требуется для связывания и последующего роллинга лейкоцитов на эндотелиальных клетках, облегчающего их миграцию во вторичные лимфоидные органы и участки воспаления. Однонуклеотидные полиморфизмы в этом гене оказались связаны с различными заболеваниями, включая иммуноглобулин-A-нефропатию. В качестве альтернативы, для этого гена были обнаружены варианты сплайсинга транскриптов (предоставлено RefSeq). Белок, кодируемый этим геном, имеет растворимую форму, обозначаемую sCD62L. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD64: Этот ген кодирует интегральный мембранный гликопротеин, известный как Fc-рецептор, который с высокой аффинностью связывает мономерные антитела IgG-типа. Структурно CD64 состоит из сигнального пептида, который допускает свою транспортировку на поверхность клетки, три внеклеточных иммуноглобулиновых домена C2-типа, которые он использует для связывания антитела, гидрофобный трансмембранный домен и короткий цитоплазматический хвост. CD64 конститутивно обнаруживается только на макрофагах и моноцитах. Обработка полиморфноядерных лейкоцитов цитокинами, такими как IFNγ и G-CSF, может вызывать экспрессию CD64 на этих клетках. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD66a: Этот ген кодирует член семейства генов карциноэмбрионального антигена (CEA), которое принадлежит к суперсемейству иммуноглобулинов. Две подгруппы семейства CEA, молекулы клеточной адгезии CEA и специфические для беременности гликопротеины, расположены в пределах кластера размером 1,2 м.п.о. на длинном плече хромосомы 19. В этом кластере также находятся одиннадцать псевдогенов подгруппы молекулы клеточной адгезии CEA. Кодируемый белок был исходно описан в желчных протоках печени как билиарный гликопротеин. Затем было обнаружено, что он является молекулой межклеточной адгезии, детектируемой на лейкоцитах, эпителии и эндотелии. Кодируемый белок опосредует клеточную адгезию посредством гомофильного, а также гетерофильного связывания с другими белками подгруппы. Кодируемому белку было приписано несколько видов клеточной активности, включая роль в дифференцировке и расположении трехмерной структуры ткани, ангиогенезе, апоптозе, подавлении опухолей, метастазировании и модуляции врожденного и адаптивного иммунного ответа. Было сообщено о нескольких вариантах транскриптов, кодирующих различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD66c: Карциноэмбриональный антиген (CEA; MIM 1 14890) является одним из наиболее широко используемых опухолевых маркеров при определении карциномы посредством иммуноанализа сыворотки. Очевидное отсутствие абсолютной специфичности рака к CEA, вероятно, частично обусловлено присутствием в нормальных и неопластических тканях антигенов, которые имеют общие антигенные детерминанты с формой CEA размером 180 кДа (Barnett et al, 1988 (PubMed 3220478)). Для дополнительной информации о семействе генов CEA смотри CEACAM1 (MIM 109770). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD66d: Этот ген кодирует член семейства родственных карциноэмбриональному антигену молекул клеточной адгезии (CEACAM), которые используются несколькими бактериальными патогенами для связывания клеток-хозяев и проникновения в них. Кодируемый трансмембранный белок направляет фагоцитоз нескольких видов бактерий, который зависит от небольшой ГТФазы Rac. Полагают, что он играет важную роль в контроле врожденной иммунной системой специфических для человека патогенов. В качестве альтернативы, были описаны варианты сплайсинга транскриптов, но не была определена их биологическая достоверность. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD66e: CD66e, член подсемейства CEACAM, служит в качестве поверхностного гликопротеина, который играет роль в клеточной адгезии и во внутриклеточной сигнализации. CD66e также служит рецептором для адгезинов Dr E.coli. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD73: Белок, кодируемый этим геном, представляет собой белок плазматической мембраны, который катализирует превращение внеклеточных нуклеотидов в способные проходить через мембрану нуклеозиды. Кодируемый белок используется в качестве детерминанты лимфоцитарной дифференцировки. Дефекты в этом гене могут приводить к кальцификации суставов и артерий. Для этого гена было обнаружено два варианта транскриптов, кодирующие различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD84: CD84 играет роль рецептора адгезии, функционирующего посредством гомофильных взаимодействий и посредством кластеризации. Рекруитирует SH2 домен-содержащие белки SH2D1 A SAP. Увеличивает пролиферативные ответы активированных T-клеток, и, по-видимому, для этого процесса не требуется SH2D1A SAP. Гомофильные взаимодействия усиливают секрецию интерферона-гамма/IFNG в лимфоцитах и вызывают стимуляцию тромбоцитов через SH2D1 A/SAP-зависимый путь. CD84 может также служить в качестве маркера для гемопоэтических клеток-предшественников. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CD8A: Антиген CD8 представляет собой гликопротеин клеточной поверхности, обнаруживаемый на большинстве цитотоксических T-лимфоцитов, который опосредует эффективные взаимодействия клетка-клетка в иммунной системе. Антиген CD8 выполняет роль корецептора с T-клеточным рецептором на T-лимфоците для распознавания антигенов, демонстрируемых антиген-презентирующей клеткой (APC) в контексте молекул MHC класса I. Корецептор функционирует или в виде гомодимера, состоящего из двух альфа-цепей, или в виде гетеродимера, состоящего из одной альфа и одной бета-цепи. Как альфа, так и бета-цепи имеют значительную гомологию с иммуноглобулиновыми вариабельными легкими цепями. Этот ген кодирует изоформы альфа-цепи CD8. Для этого гена было обнаружено несколько вариантов транскриптов, кодирующих различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CES1: Участвует в детоксикации ксенобиотиков и в активации сложноэфирных и амидных пролекарств. Гидролизует ароматические и алифатические сложные эфиры, но не имеет каталитической активности по отношению к амидам или сложному эфиру жирной кислоты ацил-CoA. Гидролизует группу сложного метилового эфира кокаина с образованием бензоилэкгонина. Катализирует переэтерификацию кокаина с образованием кокаэтилена. Демонстрирует активность синтазы этиловых эфиров жирных кислот, катализируя этиловую этерификацию олеиновой кислоты до этилолеата. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CHI3L1: хитиназа 3-подобный 1 (хрящевой гликопротеин-39); дополнительные наименования CHI3L1 включают, без ограничения, ASRT7, CGP-39, GP-39, GP39, HC-gp39, HCGP-3P, YKL-40, YKL40, YYL-40 и hCGP-39. Хитиназы катализируют гидролиз хитина, который является распространенным гликополимером, обнаруживаемом в экзоскелетах насекомых и клеточных стенках грибов. Семейство хитиназ гликозил-гидролазы 18 включает в себя восемь человеческих членов семейства. Этот ген кодирует гликопротеиновый член семейства гликозил-гидролазы 18, у которого отсутствует хитиназная активность, который может быть секретирован активированными макрофагами, хондроцитами, нейтрофилами и синовиальными клетками. CHI3L1 ингибирует окислительное-индуцированное повреждение легких, усиливает адаптивный иммунитет Th2, регулирует апоптоз, стимулирует альтернативную активацию макрофагов и участвует в фиброзе и заживлении ран. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CHP: Этот ген кодирует фосфопротеин, который связывается с обменником Na+/H+ NHE1. Этот белок служит важным кофактором, который поддерживает физиологическую активность членов семейства NHE и может играть роль в митогенетической регуляции NHE1. Белок имеет сходство с кальциневрином B и кальмодулином, а также известно, что он является эндогенным ингибитором активности кальциневрина (предоставлено RefSeq). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CMPK2: Этот ген кодирует белок, который может участвовать в синтезе дУТФ и дЦТФ в митохондриях. Способен фосфорилировать дУМФ, дЦМФ, ЦМФ, УМФ и монофосфаты пиримидиновых аналогов нуклеозидов ddC, dFdC, araC, BVDU и FdUrd с АТФ в качестве донора фосфата. Эффективность является самой высокой для дУМФ, за которым идет дЦМФ; ЦМФ и УМФ являются плохими субстратами. Может участвовать в истощении мтДНК, вызываемом продолжительным лечением с помощью ddC или других аналогов пиримидина. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CORO1A: Может быть одним из важнейших компонентов цитоскелета высоко подвижных клеток, функционируя при выпячивании больших участков плазматической мембраны, а также при образовании выступаний плазматической мембраны, участвующих в локомоции клетки. В инфицированных микобактериями клетках его сохранение на фагосомальной мембране препятствует слиянию между фагосомами и лизосомами. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CRP: C-реактивный белок. Белок, кодируемый этим геном, принадлежит к семейству пентаксинов. Он участвует в нескольких функциях, связанных с защитой хозяина, благодаря своей способности распознавать чужеродные патогены и поврежденные клетки хозяина и инициировать их элиминацию посредством взаимодействия с гуморальной и клеточной эффекторными системами в крови. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
CSDA: связывается с промотором GM-CSF и, по-видимому, действует как репрессор. Связывается также с полноразмерной мРНК и с короткими последовательностями РНК, содержащими консенсусный сайт 5'-UCCAUCA-3'. Может играть роль в репрессии трансляции. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
EGFR: Белок, кодируемый этим геном, представляет собой трансмембранный гликопротеин, который является членом суперсемейства протеинкиназ. Этот белок представляет собой рецептор для членов семейства эпидермального фактора роста. EGFR представляет собой белок клеточной поверхности, который связывается с эпидермальным фактором роста. Связывание данного белка с лигандом вызывает димеризацию рецептора и автофосфорилирование тирозина и приводит к клеточной пролиферации. Мутации в этом гене связаны с раком легкого. Для этого гена было обнаружено несколько вариантов альтернативного сплайсинга транскриптов, которые кодируют различные изоформы белка.
GPR162: Этот ген был идентифицирован при геномном анализе генетически плотной области в человеческой хромосоме 12p 13. По-видимому, он в основном экспрессируется в головном мозге; однако его функция неизвестна. В качестве альтернативы, были идентифицированы варианты сплайсинга транскриптов, кодирующие различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
EIF2AK2: EIF2AK2 представляет собой белок серин/треонинкиназы, которая приобретает ферментативную активность после автофосфорилирования, процесса, опосредуемого двухнитевой РНК (днРНК). Дополнительные наименования включают, без ограничения: PKR, PRKR, EIF2AK1, протеинкиназа, интерферон-индуцируемая двухнитевая РНК-зависимая, киназа p68 и так далее. Активация EIF2AK2 позволяет киназе фосфорилировать свой природный субстрат, альфа-субъединицу эукариотического фактора-2 инициации синтеза белка (EIF2-альфа; MIM 603907), что приводит к ингибированию синтеза белка. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
EIF4B: Требуется для связывания мРНК с рибосомами. Функционирует в тесной связи с EIF4-F и EIF4-A. Он связывается около 5'-концевого кэпа мРНК в присутствии EIF-4F и АТФ. Он стимулирует АТФазную активность и АТФ-зависимую активность раскручивания РНК как EIF4-A, так и EIF4-F. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
Эотаксин: Этот ген является одним из нескольких генов цитокинов Cys-Cys (CC), собранных в кластер на q-плече хромосомы 17. Цитокины представляют собой семейство секретируемых белков, участвующих в иммунорегуляторных и воспалительных процессах. Цитокины CC представляют собой белки, характеризующиеся двумя соседними цистеинами. Цитокин, кодируемый этим геном, демонстрирует хемотаксическую активность в отношении эозинофилов, но не мононуклеарных клеток или нейтрофилов. Этот специфический к эозинофилам хемокин, как полагают, участвует в эозинофильных воспалительных заболеваниях, таких как атопический дерматит, аллергический ринит, астма и паразитарные инфекции. В ответ на присутствие аллергенов этот белок непосредственно стимулирует накопление эозинофилов, выраженный признак аллергических воспалительных реакций. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
EPSTI1: Функция еще полностью не охарактеризована. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
GAS7: Ген блокировки роста 7 экспрессируется, главным образом, в терминально дифференцированных клетках головного мозга и, преимущественно, в зрелых нейронах мозжечка Пуркинье. GAS7, возможно, играет роль в развитии нейронов. Было описано несколько вариантов транскриптов, кодирующих белки, которые отличаются N-концом. Он может играть роль в стимуляции созревания и морфологической дифференцировки церебеллярных нейронов. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
HERC5: Основная лигаза E3 для конъюгации ISG15. Выполняет роль положительного регулятора врожденного противовирусного ответа в клетках, индуцированного интерфероном. Составляет часть аппарата ISG-илирования, который распознает белки-мишени широким и относительно неспецифическим образом. Катализирует ISG-илирование IRF3, что приводит к длительной активации. Он ослабляет взаимодействие IRF3-PIN1, которое противодействует убиквитинированию и деградации IRF3 и усиливает противовирусный ответ. Катализирует ISG-илирование NS1 вируса гриппа А, что ослабляет вирулентность; ISG-илированный NS1 не может образовывать гомодимеры и поэтому не взаимодействует со своими РНК-мишенями. Он катализирует ISG-илирование белок LI папилломавируса типа 16, что приводит к доминантно-негативному воздействию на инфекционность вируса. Физически связан с полирибосомами, широко модифицирует вновь синтезированные белки котрансляционным образом. В интерферон-стимулированных клетках недавно транслированные вирусные белки являются первичными мишенями ISG15. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
HLA-A: HLA-A принадлежит к паралогам тяжелых цепей HLA класса I. Эта молекула класса I представляет собой гетеродимер, состоящий из тяжелой цепи и легкой цепи (бета-2 микроглобулин). Тяжелая цепь закреплена в мембране. Молекулы класса I играют важную роль в иммунной системе, представляя пептиды, происходящие из просвета эндоплазматического ретикулума. Они экспрессируются почти во всех клетках. Тяжелая цепь составляет приблизительно 45 кДа, и ее ген содержит 8 экзонов. Экзон 1 кодирует лидерный пептид, экзоны 2 и 3 кодируют домены альфа-1 и альфа-2, которые связывают пептид, экзон 4 кодирует домен альфа-3, экзон 5 кодирует трансмембранную область, и экзоны 6 и 7 кодируют цитоплазматический хвост. Полиморфизмы в экзоне 2 и экзоне 3 отвечают за специфичность связывания пептида каждой молекулы класса один. Для трансплантации костного мозга и почки обычно делается определение типов этих полиморфизмов. Были описаны сотни аллелей HLA-A. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
HLA-B: HLA-B принадлежит к паралогам тяжелых цепей HLA класса I. Эта молекула класса I представляет собой гетеродимер, состоящий из тяжелой цепи и легкой цепи (бета-2 микроглобулин). Тяжелая цепь закреплена в мембране. Молекулы класса I играют важную роль в иммунной системе, представляя пептиды, происходящие из просвета эндоплазматического ретикулума. Они экспрессируются почти во всех клетках. Тяжелая цепь составляет приблизительно 45 кДа, и ее ген содержит 8 экзонов. Экзон 1 кодирует лидерный пептид, экзоны 2 и 3 кодируют домены альфа-1 и альфа-2, которые связывают пептид, экзон 4 кодирует домен альфа-3, экзон 5 кодирует трансмембранную область, и экзоны 6 и 7 кодируют цитоплазматический хвост. Полиморфизмы в экзоне 2 и экзоне 3 отвечают за специфичность связывания пептида каждой молекулы класса один. Для трансплантации костного мозга и почки обычно делается определение типов этих полиморфизмов. Были описаны сотни аллелей HLA-B. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
HLA-C: HLA-C принадлежит к паралогам тяжелых цепей HLA класса I. Эта молекула класса I представляет собой гетеродимер, состоящий из тяжелой цепи и легкой цепи (бета-2 микроглобулин). Тяжелая цепь закреплена в мембране. Молекулы класса I играют важную роль в иммунной системе, представляя пептиды, происходящие из просвета эндоплазматического ретикулума. Они экспрессируются почти во всех клетках. Тяжелая цепь составляет приблизительно 45 кДа, и ее ген содержит 8 экзонов. Экзон один кодирует лидерный пептид, экзоны 2 и 3 кодируют домены альфа-1 и альфа-2, которые связывают пептид, экзон 4 кодирует домен альфа-3, экзон 5 кодирует трансмембранную область, и экзоны 6 и 7 кодируют цитоплазматический хвост. Полиморфизмы в экзоне 2 и экзоне 3 отвечают за специфичность связывания пептида каждой молекулы класса один. Для трансплантации костного мозга и почки обычно делается определение типов этих полиморфизмов. Было описано свыше ста аллелей HLA-C. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IFI6: Этот ген был впервые идентифицирован как один из многих генов, индуцируемых интерфероном. Кодируемый белок может играть важную роль в регуляции апоптоза. Мини-спутник, который состоит из 26 повторов 12-нуклеотидного повторяющегося элемента, напоминающего консенсусную последовательность донора сплайсинга млекопитающего, начинается около конца второго экзона. В качестве альтернативы, были описаны варианты сплайсинга транскриптов, которые кодируют различные изоформы благодаря использованию двух расположенных по ходу транскрипции единиц повтора в качестве донорных сайтов сплайсинга. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IFIT1: Интерферон-индуцированный белок с тетратрикопептидными повторами. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IFIT3: Функция еще полностью не охарактеризована. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IFITM1: IFN-индуцированный противовирусный белок, который опосредует клеточный врожденный иммунитет к по меньшей мере трем важнейшим человеческим патогенам, а именно вирусу гриппа A HlNl, вирусу Западного Нила и вирусу денге, посредством ингибирования раннего этапа(ов) репликации. Играет ключевую роль в антипролиферативном действии IFN-гамма или посредством ингибирования активации ERK, или посредством блокировки клеточного роста в фазе Gl p53-зависимым образом. Участвует в контроле клеточного роста. Компонент мультимерного комплекса, участвующего в трансдукции антипролиферативных сигналов и сигналов гомотипической адгезии. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IFITM3 IFITM2: IFN-индуцированный противовирусный белок, который опосредует клеточный врожденный иммунитет к по меньшей мере трем важнейшим человеческим патогенам, а именно вирусу гриппа A HlNl, вирусу Западного Нила (WNV) и вирусу денге (WNV), посредством ингибирования раннего этапа(ов) репликации. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IL1a: Белок, кодируемый этим геном, является членом семейства цитокина интерлейкина 1. Этот цитокин является плейотропным цитокином, участвующим в различных иммунных ответах, воспалительных процессах и гемопоэзе. Этот цитокин может быть произведен моноцитами и макрофагами в виде пробелка, который протеолитически обрабатывается и высвобождается в ответ на повреждение клетки и, таким образом, индуцирует апоптоз. Этот ген и восемь других генов семейства интерлейкина 1 образуют кластер цитокиновых генов на хромосоме 2. Белки IL-1 участвуют в воспалительном ответе, будучи идентифицированы как эндогенные пирогены, и сообщалось, что они стимулируют высвобождение простагландина и коллагеназы из синовиальных клеток. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IL1RA: Белок, кодируемый этим геном, представляет собой цитокиновый рецептор, который принадлежит к семейству рецептора интерлейкина 1. Этот белок представляет собой рецептор для интерлейкина-альфа (ILIA), интерлейкина-бета (IL1B) и рецептора интерлейкина 1 типа I (ILIRI/ILIRA). Он является важным медиатором, участвующим во многих индуцированных цитокинами иммунных и воспалительных ответах. Дополнительные наименования этого гена включают, без ограничения: CD121A, IL-1RT1, p80, антиген CD121a, CD121A, IL1R и ILlra. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IL6: Этот ген кодирует цитокин, который функционирует при воспалении и созревании B-клеток. Кроме того, было показано, что кодируемый белок является эндогенным пирогеном, способным вызывать лихорадку у людей с аутоиммунными заболеваниями или инфекциями. Этот белок главным образом производится в участках острого и хронического воспаления, где он секретируется в сыворотку и индуцирует транскрипционный воспалительный ответ посредством рецептора интерлейкина 6, альфа. Функционирование этого гена связано с широким диапазоном ассоциированных с воспалением болезненных состояний, включая предрасположенность к сахарному диабету и системному ювенильному ревматоидному артриту. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IL7R: Белок, кодируемый этим геном, представляет собой рецептор для интерлейкина 7 (IL7). Для функционирования этого рецептора требуется гамма-цепь (IL2RG) рецептора интерлейкина 2, которая является общей гамма-цепью для рецепторов различных цитокинов, включая интерлейкин 2, 4, 7, 9 и 15. Было показано, что этот белок играет важную роль в V(D)J-рекомбинации во время развития лимфоцитов. Также оказалось, что этот белок контролирует доступность локуса TCR-гамма для STAT5 и ацетилирования гистонов. Нокаутные исследования на мышах говорят о том, что блокирование апоптоза является существенной функцией этого белка во время дифференцировки и активации T-лимфоцитов. Функциональные дефекты в этом белке могут быть связаны с патогенезом тяжелого комбинированного иммунодефицита (SCID). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IL-8: Белок, кодируемый этим геном, является членом хемокинового семейства CXC. Дополнительные наименования IL-8 включают, без ограничения: интерлейкин 8, K60, CXCL8, SCYB8, GCP-1, TSG-1, MDNCF, b-ENAP, MONAP, хемотаксический фактор альвеолярных макрофагов I, NAP-1, активирующий нейтрофилы пептид эндотелиальных клеток бета, GCPl, бета-тромбоглобулин-подобный белок, LECT, хемокиновый (мотив C-X-C) лиганд 8, LUCT, эмоктакин, LYNAP, интерлейкин-8, NAF, хемотаксический белок гигантских клеток карциномы легкого, NAPl, активирующий нейтрофилы пептид лимфоцитов, IL-8, нейтрофил-активирующий пептид 1, хемотаксический белок гранулоцитов 1, член 8 подсемейства B небольших индуцируемых цитокинов, моноцитарный хемотаксический фактор нейтрофилов, индуцируемый фактором некроза опухоли ген 1, моноцитарный нейтрофил-активирующий пептид, эмоктакин, T-клеточный хемотаксический фактор, хемокин 8 с мотивом C-X-C, 3-10C, нейтрофил-активирующий белок 1, AMCF-I и белок 3-10C. Этот хемокин является одним из основных медиаторов воспалительного ответа. Этот хемокин секретируется несколькими типами клеток. Он функционирует как хемоаттрактант, а также является мощным ангиогенным фактором. Полагают, что этот ген играет роль в патогенезе бронхиолита, общего заболевания дыхательных путей, вызываемого вирусной инфекцией. Этот ген и другие десять членов семейства хемокиновых генов CXC образуют кластер хемокиновых генов в области, расположенной на хромосоме 4q. IL-8 представляет собой хемотаксический фактор, который привлекает нейтрофилы, базофилы и T-клетки, но не моноциты. Он также участвует в активации нейтрофилов. IL-8(6-77) имеет в 5-10 раз более высокую активность в отношении активации нейтрофилов, IL-8(5-77) имеет повышенную активность в отношении активации нейтрофилов, и IL-8(7-77) имеет более высокую аффинность к рецепторам CXCR1 и CXCR2 по сравнению с IL-8(1-77), соответственно. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
IP10: Этот ген кодирует хемокин подсемейства CXC и лиганд для рецептора CXCR3. Связывание этого белка с CXCR3 приводит к плейотропным эффектам, включая стимуляцию моноцитов, миграцию естественных киллеров и T-клеток и модуляцию экспрессии молекул адгезии. Дополнительные наименования данного гена включают, без ограничения: CXCL10, гамма-IP 10, INP10 и хемокиновый (мотив C-X-C) лиганд 10. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ISG15: Убиквитин-подобный модификатор ISG15; дополнительные наименования ISG15 включают, без ограничения, G1P2, IFI15, IP17, UCRP и hUCRP. Этот убиквитин-подобный белок конъюгирует с внутриклеточными белками-мишенями после стимуляции IFN-альфа или IFN-бета. Его ферментативный путь частично отличается от пути убиквитина, различаясь в субстратной специфичности и взаимодействии с ферментами лигирования. Путь конъюгации ISG15 использует специализированный фермент El, но, по-видимому, сходится с путем конъюгации Ub на уровне специфического фермента E2. Мишени включают STATl, SERPINA3G/SPI2A, JAKl, MAPK3/ERK1, PLCGl, EIF2AK2/PKR, MXl/MxA и RIG-1. Демонстрирует специфическую хемотаксическую активность в отношении нейтрофилов и активирует их, вызывая высвобождение хемотаксических факторов эозинофилов. Может служить в качестве транс-активного фактора связывания, направляя ассоциацию лигированных белков-мишеней с промежуточными филаментами. Может также участвовать в аутокринном, паракринном и эндокринном механизмах, как и в межклеточной сигнализации, возможно, частично за счет индукции секреции IFN-гамма моноцитами и макрофагами. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ITGAM: Этот ген кодирует цепь интегрина альфа-М. Интегрины представляют собой гетеродимерные интегральные мембранные белки, состоящие из альфа-цепи и бета-цепи. Этот содержащий I-домен альфа-интегрин соединяется с цепью бета-2 (ITGB2) с образованием лейкоцитарного интегрина, называемого рецептором 1 макрофагов ("Mac-1") или рецептором 3 инактивированного C3b (iC3b) ("CR3"). Интегрин альфа-М-бета-2 имеет важное значение для адгезии нейтрофилов и моноцитов к стимулированному эндотелию, а также для фагоцитоза покрытых комплементом частиц. Для этого гена было обнаружено несколько вариантов транскриптов, кодирующих различные изоформы.
Mac-2-BP: Дополнительные наименования MAC-2-BP включают, без ограничения, LGALS3BP, 90K, сывороточный белок 90K, BTBD17B, M2BP и связывающий галактозид-связывающий растворимый лектин 3 белок. Галектины представляют собой семейство бета-галактозид-связывающих белков, участвующих в модуляции взаимодействий клетка-клетка и клетка-матрица. Было обнаружено, что уровни MAC-2-BP повышаются в сыворотке раковых пациентов. Он, по-видимому, участвует в иммунном ответе, связанном с цитотоксичностью клеток-естественных киллеров (NK) и лимфокин-активированных киллеров (LAK). Нативный белок может специфически связываться с человеческим ассоциированным с макрофагами лектином, известным как Mac-2, а также галектин 1. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
MCP: Белок, кодируемый этим геном, представляет собой мембранный белок типа I и представляет собой регуляторную часть системы комплемента. Кодируемый белок имеет активность кофактора для инактивации компонентов комплемента C3b и C4b сывороточным фактором I, который защищает клетку-хозяина от повреждения комплементом. Кроме того, кодируемый белок может действовать как рецептор для штамма Edmonston вируса кори, вируса человеческого герпеса-6 и пили типа IV патогенных Neisseria. Белок, кодируемый этим геном, может участвовать в слиянии сперматозоидов с ооцитом во время оплодотворения. Мутации в этом локусе оказались связаны с предрасположенностью к гемолитико-уремическому синдрому. В качестве альтернативы, были описаны варианты сплайсинга транскриптов, кодирующие различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ISG20: Экзонуклеаза со специфичностью к однонитевой РНК и, в меньшей степени, к ДНК. Деградирует РНК со скоростью, которая приблизительно в 35 раз выше, чем ее скорость для однонитевой ДНК. Участвует в противовирусной функции IFN против РНК-вирусов.
KIAA0082 (FTSJD2): S-аденозил-L-метионин-зависимая метилтрансфераза, которая опосредует кэп-1-метилирование 2'-O-рибозы мРНК до 5'-кэп-структуры мРНК. Метилирует рибозу первого нуклеотида m(7)GpppG-кэпированной мРНК с получением m(7)GpppNmp (кэп-1). Кэп-1-модификация связана с более высокими уровнями трансляции. Может участвовать в пути интерферонового ответа. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
LIPT1: Процесс передачи липоевой кислоты белкам представляет собой двухстадийный процесс. Первый этап представляет собой активацию липоевой кислоты липоат-активирующим ферментом с образованием липоил-AMP. Для второго этапа белок, кодируемый этим геном, передает липоиловый фрагмент апобелкам. Альтернативный сплайсинг в 5'-НТО этого гена приводит к пяти вариантам транскриптов, которые кодируют один и тот же белок. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
LOC26010(SPATS2): Функция еще полностью не охарактеризована. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
LRDD: Белок, кодируемый этим геном, содержит богатый лейцином повтор и домен смерти. Показано, что этот белок взаимодействует с другими белками с доменом смерти, такими как Fas (TNFRSF6)-ассоциированный домен смерти (FADD) и активируемый MAP-киназой содержащий домен смерти белок (MADD), и, таким образом, может функционировать как адаптерный белок в сигнальных процессах, связанных с клеточной смертью. Было обнаружено, что экспрессия мышиного аналога этого гена положительно регулируется онкосупрессором p53 и индуцирует клеточный апоптоз в ответ на повреждение ДНК, что говорит о роли этого гена в качестве эффектора p53-зависимого апоптоза. Альтернативный сплайсинг приводит к нескольким вариантам транскриптов. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
LTA4H: Гидролизует эпоксидный фрагмент лейкотриена A4 (LTA-4) с образованием лейкотриена B4 (LTB-4). Этот фермент также обладает некоторой пептидазной активностью. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
LY6E: Функция еще полностью не охарактеризована. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
MAN1C1: Маннозидазы делятся на два подтипа; I и II, (номера EC 3.2.1.113 и 3.2.1.114, соответственно), которые демонстрируют широкий спектр экспрессии. Маннозидаза I гидролизует (1,2)-связанные остатки альфа-D-маннозы в олигоманнозном олигосахариде Man9(GlcNAc)2, а маннозидаза II гидролизует (1,3)- и (1,6)-связанные остатки альфа-D-маннозы в Man5(GlcNAc)3. Обоим подтипам требуется кофактор двухвалентный катион. Мутации в маннозидазах могут вызывать маннозидоз (дефицит маннозидазы I). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
MBOAT2: Ацилтрансфераза, которая опосредует превращение лизофосфатидилэтаноламина (1-ацил-sn-глицеро-3-фосфоэтаноламина или LPE) в фосфатидилэтаноламин (1,2-диацил-sn-глицеро-3-фосфоэтаноламин или PE) (LPEAT-активность). Катализирует также ацилирование лизофосфатидной кислоты (LPA) в фосфатидную кислоту (PA) (LPAAT-активность). Имеет также очень слабую лизофосфатидилхолинацилтрансферазную (LPCAT-активность). Предпочитает олеоил-CoA в качестве донора ацила. Лизофосфолипидацилтрансферазы (LPLAT) катализируют этап повторного ацилирования пути ремоделинга фосфолипидов, также известного как цикл Лэндса. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
MX1/MXA: У мышей интерферон-индуцируемый белок Mx отвечает за специфическое противовирусное состояние против инфицирования вирусом гриппа. Белок, кодируемый этим геном, аналогичен мышиному белку, как определено по его антигенному родству, условиям индуцирования, физико-химическим свойствам и аминокислотному анализу. Этот цитоплазматический белок является членом как семейства динамина, так и семейства больших ГТФаз. Для этого гена были обнаружены два варианта транскриптов, кодирующие один и тот же белок. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
NPM1: Он участвует в разнообразных клеточных процессах, таких как биогенез рибосом, дупликация центросом, шаперонирование белков, сборка гистонов, клеточная пролиферация и регуляция опухолевых супрессоров TP53/p53 и ARF. Он связывается с рибосомой, предположительно для управления рибосомным ядерным экспортом. Он связан с нуклеолярными рибонуклеопротеиновыми структурами и связывает одноцепочечные нуклеиновые кислоты. Выполняет роль шаперонина для коровых гистонов H3, H2B и H4. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
NRG1: Белок, кодируемый этим геном, изначально был идентифицирован как гликопротеин размером 44 кДа, который взаимодействует с рецепторной тирозинкиназой NEU/ERBB2 для увеличения ее фосфорилирования по остаткам тирозина. Этот белок представляет собой сигнальный белок, который опосредует взаимодействия клетка-клетка и играет важную роль в росте и развитии различных систем органов. Известно, что из этого гена получается огромное разнообразие различных изоформ благодаря использованию альтернативных промоторов и сплайсинга. Эти изоформы экспрессируются ткань-специфически и значительно отличаются по своей структуре, и поэтому эти изоформы подразделяются на типы I, II, III, IV, V и VI. Дисрегуляция этого гена оказалась связана с такими заболеваниями, как рак, шизофрения и биполярное расстройство (BPD). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
OAS2: Этот ген кодирует член семейства синтетазы 2-5A, незаменимых белков, участвующих во врожденном иммунном ответе на вирусную инфекцию. Кодируемый белок индуцируется интерферонами и использует аденозинтрифосфат в 2'-специфических реакциях переноса нуклеотидила для синтеза 2',5'-олигоаденилатов (2-5 A). Эти молекулы активируют латентную РНКазу L, что приводит к деградации вирусной РНК и ингибированию вирусной репликации. Три известных члена семейства этого гена расположены в кластере на хромосоме 12. В качестве альтернативы, были описаны варианты сплайсинга транскриптов, кодирующие различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
PARP9: Поли(АДФ-рибоза)-полимераза (PARP) катализирует посттрансляционную модификацию белков посредством добавления нескольких фрагментов АДФ-рибозы. PARP переносит АДФ-рибозу от никотинамиддинуклеотида (NAD) на остатки glu/asp на белке-субстрате, а также полимеризует АДФ-рибозу с образованием полимеров с длинной/разветвленной цепью. Были разработаны ингибиторы PARP для использования при ряде патологий, включая рак, диабет, инсульт и сердечно-сосудистые заболевания. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
PARP12: Поли(АДФ-рибоза)-полимераза (PARP) катализирует посттрансляционную модификацию белков посредством добавления нескольких фрагментов АДФ-рибозы. PARP переносит АДФ-рибозу от никотинамиддинуклеотида (NAD) на остатки glu/asp на белке-субстрате, а также полимеризует АДФ-рибозу с образованием полимеров с длинной/разветвленной цепью. Были разработаны ингибиторы PARP для использования при ряде патологий, включая рак, диабет, инсульт и сердечно-сосудистые заболевания. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
PCT: Прокальцитонин (PCT) представляет собой пептидный предшественник гормона кальцитонина, причем последний связан с гомеостазом кальция. Уровни прокальцитонина возрастают в ответ на провоспалительный стимул. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
PDIA6: Протеиндисульфидизомеразы (EC 5.3.4.1), такие как PDIA6, являются резидентными белками эндоплазматического ретикулума (ER), которые катализируют образование, восстановление и изомеризацию дисульфидных связей в белках и, как полагают, играют роль в фолдинге дисульфидно связанных белков. Он может функционировать как шаперон, который ингибирует агрегацию неверно уложенных белков. Играет роль в агрегации и активации тромбоцитов такими агонистами, как конвулксин, коллаген и тромбин. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
Прокальцитонин: Представляет собой пептидный предшественник гормона кальцитонина, который связан с гомеостазом кальция. Уровень прокальцитонина возрастает в ответ на провоспалительный стимул, особенно бактериального происхождения. В этом случае он в основном производится клетками легких и кишечника. Он не возрастает значительно при вирусных или неинфекционных воспалениях. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
PTEN: Онкосупрессор. Выполняет роль протеинфосфатазы с двойной специфичностью, фосфорилирующей тирозин-, серин- и треонин-фосфорилированные белки. Также выполняет роль липидфосфатазы, удаляющей фосфат в положении D3 инозитольного кольца из фосфатидилинозитол (PI)-3,4,5-трифосфата, PI-3,4-дифосфата, PI-3-фосфата и инозитол-1,3,4,5-тетракисфосфата, причем порядок предпочтения субстратов in vitro PtdIns(3,4,5)P3 > PtdIns(3,4)P2 > PtdIns3P > Ins(1,3,4,5)P4. Липидфосфатазная активность существенна для его онкосупрессорной функции. Противодействует сигнальному пути PI3K-AKT/PKB посредством дефосфорилирования фосфоинозитидов и тем самым модуляции прохождения по клеточному циклу и клеточного выживания. Нефосфорилированная форма взаимодействует с AIP1 для подавления активации AKT1. Дефосфорилирует тирозин-фосфорилированную киназу фокальной адгезии и ингибирует клеточную миграцию и интегрин-опосредованное клеточное распространение и образование фокальной адгезии. Играет роль ключевого модулятора сигнального пути AKT-mTOR, контролируя темп процесса интеграции новорожденных нейронов во время нейрогенеза у взрослых, включая правильное расположение нейронов, развитие дендритов и образование синапсов. Может являться отрицательным регулятором инсулиновой сигнализации и глюкозного метаболизма в жировой ткани. Ядерная моноубиквитиновая форма обладает большим апоптическим потенциалом, тогда как цитоплазматическая неубиквитиновая форма обладает меньшей опухолеподавляющей способностью. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RAB13: может участвовать в поляризованном транспорте, в сборке и/или активности плотных соединений. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RAP1B: ГТФ-связывающий белок, который обладает собственной ГТФазной активностью. Вносит вклад в поляризующую активность KRIT1 и CDH5 при установлении и поддержании правильных полярности и сосудистого просвета эндотелиальных клеток. Требуется для локализации фосфорилированных PRKCZ, PARD3 и TIAMl в клеточном соединении. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RTN3: Может участвовать в мембранном трафике в раннем секреторном пути. Ингибирует активность BACE1 и процессинг белка-предшественника амилоида. Может индуцировать каскад каспазы-8 и апоптоз. Может способствовать транслокации BCL2 в митохондрии при стрессе эндоплазматического ретикулума. В случае энтеровирусной инфекции RTN3 может участвовать в вирусной репликации или патогенезе. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SAA: кодирует член семейства сывороточного амилоида A аполипопротеинов. Кодируемый белок является важным белком острой фазы, который имеет высокий уровень экспрессии в ответ на воспаление и повреждение ткани. Этот белок также играет важную роль в метаболизме HDL и гомеостазе холестерина. Высокие уровни этого белка связаны с хроническими воспалительными заболеваниями, включая атеросклероз, ревматоидный артрит, болезнь Альцгеймера и болезнь Крона. Этот белок может также быть потенциальным биомаркером для некоторых опухолей. Альтернативный сплайсинг приводит к нескольким вариантам транскриптов, которые кодируют один и тот же белок. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
QARS: Аминоацил-тРНК-синтетазы катализируют аминоацилирование тРНК своими родственными аминокислотами. Из-за их важной роли в связывании аминокислот с нуклеотидными триплетами, содержащимися в тРНК, полагают, что аминоацил-тРНК-синтетазы находятся среди первых белков, которые появились в ходе эволюции. В многоклеточных 9 аминоацил-тРНК-синтетаз, специфичных к глутамину (gin), глутаминовой кислоте (glu) и 7 другим аминокислотам, ассоциированы в мультиферментный комплекс. Хотя они присутствуют у эукариот, глутаминил-тРНК-синтетаза (QARS) отсутствует у многих прокариот, митохондрий и хлоропластов, в которых Gln-тРНК(Gln) образуется посредством трансамидирования неправильно ацилированного Glu-тРНК(Gln). Глутаминил-тРНК-синтетаза принадлежит к семейству аминоацил-тРНК-синтетаз класса I. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RAB13: может участвовать в поляризованном транспорте, в сборке и/или активности плотных соединений. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RAB31: Малые ГТФ-связывающие белки семейства RAB, такие как RAB31, играют существенную роль в таргетировании визикул и гранул. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RAC2: Малые G белки (малые ГТФазы) гомологичны белкам G-альфа, и их часто называют суперсемейством протоонкогена Ras. Суперсемейство Ras содержит свыше 100 малых ГТФаз, сгруппированных по восьми семействам; Ras, Rho, Rab, Rap, Arf, Ran, Rheb и Rad. Малые ГТФазы регулируют широкий диапазон процессов в клетке, включая рост, дифференцировку, движение и транспорт липидных визикул. Как и белки G-альфа, малые ГТФазы переходят между включенным состоянием (связаны с ГТФ) и выключенным состоянием (связаны с ГДФ). Для этого циклического процесса требуются фактор обмена гуаниновых нуклеотидов (GEF) и ГТФаза-активирующий белок (GAP). Малые ГТФазы являются нижележащими эффекторами большинства рецепторных тирозинкиназ (RTK) и связаны посредством двух белков, GRB2 и SOS. Они связаны с внутриклеточными сигнальными каскадами, включая путь MAPK, посредством взаимодействий с киназой Raf. Обычно активация малых ГТФаз индуцируется связыванием лиганда с RTK. Во многих трансформированных клетках активирование мутации ГТФаз, часто Ras, производит клеточный ответ в отсутствие лиганда, что способствует злокачественному прогрессированию. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RPL34: Рибосомы, органеллы, которые катализируют синтез белка, состоят из малой субъединицы 40S и большой субъединицы 60S. Вместе эти субъединицы состоят из 4 видов РНК и приблизительно 80 структурно различающихся белков. Этот ген кодирует рибосомный белок, который является компонентом субъединицы 60S. Этот белок принадлежит к семейству L34E рибосомных белков. Он расположен в цитоплазме. Изначально полагали, что этот ген расположен на 17q21, но он оказался расположен на 4q. Существуют варианты транскриптов, получаемые альтернативным сплайсингом, альтернативные сайты инициации транскрипции и/или альтернативное полиаденилирование; эти варианты кодируют один и тот же белок. Как типично для генов, кодирующих рибосомные белки, существует множество процессированных псевдогенов этого гена, распределенных по геному. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
RSAD2: Участвует в противовирусной защите. Может снижать размножение вирусов посредством разрушения липидных рафтов в плазматической мембране, признака, который существенен для процесса размножения многих вирусов. Действует посредством связывания и инактивации FPPS, фермента, участвующего в синтезе холестерина, фарнесилированных и геранилированных белков, убихинона, долихола и гема. Играет роль в клеточном противовирусном состоянии, индуцируемом интерфероном типа I и типа II. Демонстрирует противовирусный эффект против вируса ВИЧ-1, вируса гепатита C, человеческого цитомегаловируса и афавирусов, но не везикуловируса. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SART3: Белок, кодируемый этим геном, представляет собой РНК-связывающий ядерный белок, который представляет собой антиген отторжения опухоли. Этот антиген имеет опухолевые эпитопы, способные к индуцированию HLA-A24-ограниченных и опухоль-специфических цитотоксических T-лимфоцитов у раковых пациентов, и может быть полезен для специфической иммунотерапии. Продукт этого гена оказался важным клеточным фактором для экспрессии гена и вирусной репликации ВИЧ-1. Он также транзиторно связывается с U6 и U4/U6 мяРНП во время фазы рециклинга сплайсосомного цикла. Полагают, что этот кодируемый белок участвует в регуляции сплайсинга мРНК. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SDCBP: Белок, кодируемый этим геном, был изначально идентифицирован как молекула, связывающая синдикан-опосредованную сигнализацию с цитоскелетом. Белок синтенин содержит тандемно повторяющиеся домены PDZ, которые связываются с цитоплазматическими C-концевыми доменами множества трансмембранных белков. Этот белок может также влиять на цитоскелетно-мембранную организацию, клеточную адгезию, белковый трафик и активацию факторов транскрипции. Этот белок главным образом локализован на мембранно-связанных адгезионных соединениях и фокальных адгезиях, но также находится в эндоплазматическом ретикулуме и ядре. Альтернативный сплайсинг приводит к нескольким вариантам транскриптов, кодирующим различные изоформы. По-видимому, он связывает транскрипционный фактор SOX4 с рецептором IL-5 (IL5RA). Может играть роль в сосудистом трафике и, по-видимому, требуется для таргетирования TGFA на клеточную поверхность в раннем секреторном пути. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SELI: Этот ген кодирует селенопротеин, который содержит остаток селеноцистеина (Sec) в своем активном сайте. Селеноцистеин кодируется кодоном UGA, который обычно сигнализирует об окончании трансляции. 3'-НТО генов селенопротеина имеет общую структуру типа "петля на стебле", последовательность вставки sec (SECIS), которая необходима для распознавания UGA в качестве кодона Sec, а не в качестве сигнала остановки. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SPINT2: Этот ген кодирует трансмембранный белок с двумя внеклеточными доменами Куница, который ингибирует множество сериновых протеаз. Этот белок ингибирует активатор HGF, который предотвращает образование активного фактора роста гепатоцитов. Этот ген является возможным онкосупрессором, и мутации в этом гене приводят к врожденной натриевой диарее. Для этого гена было обнаружено несколько вариантов транскриптов, кодирующих различные изоформы. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SMAD9: Белок, кодируемый этим геном, является членом семейства SMAD, которое передает сигналы от членов семейства TGF-бета. Кодируемый белок активируется костными морфогенетическими белками и взаимодействует с SMAD4. Для этого гена было обнаружено два варианта транскриптов, кодирующие различные изоформы. Транскрипционный модулятор, активируемый киназой-рецептором BMP (костных морфогенетических белков) типа 1. SMAD9 представляет собой рецептор-регулируемый SMAD (R-SMAD). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
SOCS3: Белки семейства SOCS образуют часть классической системы отрицательной обратной связи, которая регулирует цитокиновую передачу сигнала. SOCS3 участвует в отрицательной регуляции цитокинов, которые передают сигнал посредством пути JAK/STAT. Ингибирует цитокиновую передачу сигнала посредством связывания с тирозинкиназными рецепторами, включая рецепторы gpl30, LIF, эритропоэтина, инсулина, IL12, GCSF и лептина. Связывание с JAK2 ингибирует его киназную активность. Подавляет эритропоэз фетальной печени. Регулирует начало и поддержание аллергических реакций, опосредованных T-хелперными клетками типа 2. Регулирует сигнализацию IL-6 in vivo (по сходству). Возможный компонент распознавания субстрата SCF-подобного комплекса ECS (элонгин BC-CUL2/5-SOCS-бокс-белок) убиквитин-протеинлигаза E3, который опосредует убиквитинирование и последующую протеасомальную деградацию белков-мишеней. По-видимому, распознает IL6ST (по сходству). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
TRAIL: Белок, кодируемый этим геном, представляет собой цитокин, который принадлежит к семейству лигандов фактора некроза опухоли (TNF). Дополнительные наименования этого гена включают, без ограничения, AP02L, TNF-связанный апоптоз-индуцирующий лиганд, TNFSF10 и CD253. TRAIL существует в мембранно-связанной форме и растворимой форме, причем обе из них могут вызывать апоптоз в различных клетках, таких как трансформированные опухолевые клетки. Этот белок связывается с несколькими членами суперсемейства рецепторов TNF, такими как TNFRSF1 OA/TRAILRl, NFRSFl 0B/TRAILR2, NFRSF10C/TRAILR3, TNFRSF 10D/TRAILR4 и, возможно, также с NFRSFl IB/OPG. Активность этого белка может быть модулирована посредством связывания с рецепторами-ловушками, такими как NFRSF10C/TRAILR3, TNFRSF 10D/TRAILR4 и NFRSFl IB/OPG, которые не могут вызывать апоптоз. Было показано, что связывание этого белка с его рецепторами запускает активацию MAPK8/JNK, каспазы 8 и каспазы 3. В качестве альтернативы, для этого гена были обнаружены варианты сплайсинга транскриптов, кодирующие различные изоформы. TRAIL может быть протеолитически отщеплен от клеточной поверхности с получением растворимой формы, которая имеет гомотримерную структуру. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
TREM1: Триггерный рецептор 1, экспрессируемый на миелоидных клетках; дополнительными наименованиями TREM1 являются CD354 и TREM-1. Этот ген кодирует рецептор, принадлежащий к суперсемейству Ig, который экспрессируется на миелоидных клетках. Этот белок усиливает опосредованные нейтрофилами и моноцитами воспалительные ответы, вызываемые бактериальными и грибковыми инфекциями, посредством стимуляции высвобождения провоспалительных хемокинов и цитокинов, а также повышения поверхностной экспрессии маркеров активации клеток. В качестве альтернативы, для этого гена были обнаружены варианты сплайсинга транскриптов, кодирующие различные изоформы. Белок, кодируемый этим геном, имеет растворимую форму, которая обозначается как sTREMl. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
TRIM22: Интерферон-индуцируемый противовирусный белок, участвующий в клеточном врожденном иммунитете. Противовирусная активность может частично быть опосредована TRIM22-зависимым убиквитинированием вирусных белков. Играет роль в ограничении репликации ВИЧ-1, вируса энцефаломиокардита (EMCV) и вируса гепатита B (HBV). Выполняет роль транскрипционного репрессора корового промотора HBV. Может обладать активностью убиквитин-протеинлигазы E3. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
UBE2N: Гетеродимеры UBE2V1-UBE2N и UBE2V2-UBE2N катализируют синтез неканонических "Lys-63"-связанных полиубиквитиновых цепей. Этот тип полиубиквитинирования не приводит к деградации белка протеасомой. Он опосредует транскрипционную активацию генов-мишеней. Он играет роль в контроле прохождения по клеточному циклу и дифференцировки. Играет роль в пути безошибочной репарации ДНК и вносит вклад в выживание клеток после повреждения ДНК. Действует вместе с лигазами E3, HLTF и SHPRH при "Lys-63"-связанном полиубиквитинировании PCNA при генотоксическом стрессе, которое требуется для репарации ДНК. Оказалось, что он действует вместе с лигазой E3 RNF5 при "Lys-63"-связанном полиубиквитинировании JKAMP, тем самым регулируя функцию JKAMP посредством уменьшения его ассоциации с компонентами и ERAD. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
VEGFR2: Фактор роста эндотелия сосудов (VEGF) является основным фактором роста для эндотелиальных клеток. Этот ген кодирует один из двух рецепторов VEGF. Этот рецептор, известный как рецептор, содержащий домен вставки киназы, представляет собой рецепторную тирозинкиназу типа III. Он функционирует в качестве основного медиатора VEGF-индуцированных эндотелиальной пролиферации, выживания, миграции, тубулярного морфогенеза и спрутинга. Сигнализация и трафик этого рецептора регулируются множеством факторов, включая ГТФазу Rab, рецептор P2Y пуриновых нуклеотидов, интегрин альфа-V-бета-3, T-клеточную протеинтирозинфосфатазу и так далее. Мутации этого гена связаны с инфантильными капиллярными гемангиомами (предоставлено RefSeq). Белок, кодируемый этим геном, имеет растворимую форму, обозначаемую sVEGFR2. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
XAF1: По-видимому, функционирует в качестве отрицательного регулятора членов семейства IAP (белковый ингибитор апоптоза). Ингибирует антикаспазную активность BIRC4. Индуцирует расщепление и инактивацию BIRC4 независимо от активации каспазы. Опосредует TNF-альфа-индуцированный апоптоз и участвует в апоптозе в клетках трофобласта. Может косвенно ингибировать BIRC4 посредством активирования митохондриального пути апоптоза. После транслокации в митохондрии стимулирует транслокацию BAX в митохондрии и высвобождение цитохрома C из митохондрий. По-видимому, способствует перераспределению BIRC4 из цитоплазмы в ядро, вероятно, независимо от инактивации BIRC4, которая, по-видимому, происходит в цитоплазме. Комплекс BIRC4-XAF1 опосредует понижающую регуляцию BIRC5/сурвивина; для этого процесса требуется активность лигазы E3 BIRC4. По-видимому, участвует в клеточной чувствительности к проапоптозному действию TRAIL. Может представлять собой онкосупрессор благодаря опосредованию резистентности к апоптозу у раковых клеток. Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
ZBPl: DLM1 кодирует Z-ДНК-связывающий белок. Образование Z-ДНК представляет собой динамический процесс, в значительной степени контролируемый величиной суперспирализации. Может играть роль в защите хозяина от опухолей и патогенов. Связывается с Z-ДНК (по сходству). Аминокислотная и/или нуклеотидная последовательность данной детерминанты должны быть известны специалисту или могут быть получены из соответствующих записей в базе данных, например в Genbank или Uniprot, с датой 11 ноября 2015 года.
Настоящее изобретение также предусматривает использование других детерминант в форме неполипептидных детерминант, таких как возраст, абсолютное количество нейтрофилов (ANC), абсолютное количество лимфоцитов (ALC), % нейтрофилов (Neu (%)), % лимфоцитов (Lym (%)), % моноцитов (Mono (%)), максимальная температура, время, прошедшее после симптомов, креатинин (Cr), калий (K), пульс и мочевина. Термин "% нейтрофилов (Neu (%))" относится к фракции белых кровяных клеток, которые представляют собой лимфоциты. Термин "% лимфоцитов (Lym (%))" относится к фракции белых кровяных клеток, которые представляют собой лимфоциты. Термин "% моноцитов (Mono (%))" относится к фракции белых кровяных клеток, которые представляют собой моноциты.
Особенно предпочтительными другими детерминантами являются TRAIL и CRP. Также предпочтительными являются такие детерминанты, как прокальцитонин, CD64, IP10, ILIRa или Mac-2BP. Настоящее изобретение, таким образом, предусматривает измерение HNL в комбинации с TRAIL, измерение HNL в комбинации с CRP, а также измерение HNL с прокальцитонином, измерение HNL с CD64, измерение HNL в комбинации с IP10, измерение HNL в комбинации с ILIRa, измерение HNL в комбинации с Mac-2BP или измерение HNL в комбинации с одним или несколькими из TRAIL, IP10, ILIRa и Mac-2BP. Также предпочтительными являются неполипептидные детерминанты абсолютное количество нейтрофилов (ANC) и % нейтрофилов (Neu (%)).
В другом варианте осуществления уровень детерминант абсолютное количество нейтрофилов (ANC) и % нейтрофилов (Neu (%)) используют для нормализации уровня HNL. Такая нормализация может быть осуществлена посредством соотнесения нейтрофилов (ANC) или Neu% с измеренным HNL.
Соответственно, в одном варианте осуществления вышеописанного способа исключения бактериальной инфекции или подтверждения вирусной инфекции упомянутый способ дополнительно содержит
a) измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) исключение бактериальной инфекции или подтверждение вирусной инфекции у субъекта, если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение.
В другом варианте осуществления вышеописанного способа исключения вирусной инфекции или способа подтверждения бактериальной инфекции упомянутый способ дополнительно содержит
a) измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) подтверждение бактериальной инфекции или исключение вирусной инфекции у субъекта, если концентрация полипептида TRAIL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
Кроме того, в другом варианте осуществления способ предоставления рекомендаций в отношении лечения субъекту дополнительно содержит на этапе a) дополнительное измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) рекомендацию субъекту принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение, и если концентрация TRAIL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение;
c) рекомендацию пациенту не принимать лечение антибиотиками, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, и если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение; или
d) рекомендацию пациенту принимать противовирусное лечение, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, и если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение, как определено в настоящем документе выше.
В соответствии с другим вариантом осуществления способ предоставления рекомендаций в отношении диагностического тестирования субъекту, дополнительно содержит на этапе a) дополнительное измерение концентрации полипептида TRAIL в образце, полученном от субъекта; и
b) рекомендацию тестировать образец на присутствие бактерий, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение, и если концентрация TRAIL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение;
c) рекомендацию тестировать образец на присутствие вируса, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное пороговое значение, и если концентрация полипептида TRAIL, определенная на этапе (a), выше, чем предварительно определенное пороговое значение.
Также предусмотрен способ исключения инфекционного заболевания, предпочтительно бактериального или вирусного заболевания, у субъекта, содержащий:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и концентрации полипептида одного или нескольких полипептидов, выбранных из группы, состоящей из TRAIL, IP10, ILIRa или Mac-2BP, в образце, полученном от субъекта;
b) применение предварительно определенной математической функции к измеренным концентрациям полипептидов для вычисления балльной оценки
c) сравнение балльной оценки с предварительно определенным эталонным значением.
"Эталонное значение", как используется в настоящем документе, может относиться к числу или значению, полученному из популяционных исследований, включающих в себя, без ограничения, таких субъектов, которые имеют ту же самую инфекцию, субъектов, имеющих тот же или схожий возрастной диапазон, субъектов в той же или схожей этнической группе, или может относиться к исходному образцу субъекта, подвергаемого лечению от инфекции. Такие эталонные значения могут быть получены из статистических анализов и/или данных прогнозирования риска популяций, полученных с помощью математических алгоритмов и расчетных показателей инфекции. Эталонные показатели детерминанты также могут быть сконструированы и использованы с помощью алгоритмов и других способов статистической и структурной классификации.
В одном варианте осуществления настоящего изобретения эталонное значение представляет собой количество (то есть уровень) детерминант в контрольном образце, полученном от одного или нескольких субъектов, у которых нет инфекции (то есть, здоровых и/или неинфекционных индивидуумов). В другом варианте осуществления таких субъектов подвергают мониторингу и/или периодически повторно тестируют в течение диагностически релевантного периода времени ("долговременные исследования") после такого теста для проверки продолжающегося отсутствия инфекции. Такой период времени может составлять один день, два дня, от двух до пяти дней, пять дней, от пяти до десяти дней, десять дней или десять или более дней от даты исходного тестирования для определения эталонного значения.
Кроме того, при установлении этих эталонных значений можно использовать ретроспективное измерение детерминант в образцах от соответствующим образом сгруппированных исследованных ранее субъектов, тем самым сокращая время, требуемое на исследование.
Эталонное значение может также содержать величины детерминант, полученные от субъектов, которые демонстрируют улучшение в результате лечебных процедур и/или терапий в отношении инфекции. Эталонное значение может также содержать величины детерминант, полученные от субъектов, у которых инфекция подтверждена с помощью известных методов.
В другом варианте осуществления эталонное значение представляет собой значение показателя или исходное значение. Значение показателя или исходное значение представляет собой составную выборку из эффективного количества детерминант от одного или нескольких субъектов, у которых нет инфекции. Исходное значение может также содержать величины детерминант в образце, полученном от субъекта, который продемонстрировал улучшение при лечебных процедурах или терапиях в отношении инфекции. В этом варианте осуществления для осуществления сравнения с полученным от субъекта образцом величины детерминант вычисляют аналогичным образом и сравнивают со значением показателя. Необязательно, субъекты, идентифицированные как имеющие инфекцию, выбираются для применения терапевтической схемы для замедления прогрессирования или устранения инфекции.
Кроме того, величина детерминанты в тестируемом образце может быть измерена и подвергнута сравнению с "нормальным контрольным уровнем" с использованием таких методов, как справочные пределы, пределы разрешения или определяющие риск пороги для определения граничных точек и аномальных значений. "Нормальный контрольный уровень" означает уровень одной или нескольких детерминант или объединенных показателей детерминант, обычно обнаруживаемый у субъекта, не страдающего от инфекции. Такой нормальный контрольный уровень и граничные точки могут изменяться в зависимости от того, используется ли детерминанта отдельно или в формуле, объединяющей ее с другими детерминантами в показатель. В качестве альтернативы, нормальный контрольный уровень может представлять собой базу данных образцов детерминант от протестированных ранее субъектов.
Эффективность лечебной схемы можно контролировать посредством детектирования детерминанты в эффективном количестве (которое может составлять один или несколько) образцов, полученных от субъекта за некоторое время, и сравнения детектированной величины детерминанты. Например, первый образец может быть получен перед тем, как субъект получит лечение, а один или несколько последующих образцов получают после или во время лечения субъекта.
Например, способы настоящего изобретения можно использовать для различения между бактериальными, вирусными и смешанными инфекциями (то есть бактериальными и вирусными коинфекциями). Этот даст возможность соответствующим образом стратифицировать и лечить пациентов.
Для объединения результатов детерминант в показатели, подходящие для реализации настоящего изобретения на практике, может быть использована любая формула. Как указано выше, и без ограничения, такие показатели могут указывать, помимо различных других показаний, на вероятность, правдоподобие, абсолютный или относительный риск, время или скорость перехода из одной стадии заболевания в другую, или делать предсказания будущих измерений биомаркеров инфекции. Показатель может быть для определенного периода или промежутка времени или для риска в течение оставшейся жизни, или он может быть просто предоставлен в виде показателя относительно другой референтной популяции субъектов.
Хотя в настоящем документе описаны различные предпочтительные формулы, некоторые другие типы моделей и формул, помимо упомянутых в настоящем документе и в определениях выше, хорошо известны специалисту в данной области техники. Фактический тип модели или используемая формула сами могут быть выбраны из всех возможных моделей на основании характеристик эффективности и диагностической точности их результатов в обучающей популяции. Детали самой формулы могут обычно быть получены из результатов детерминанты в релевантной обучающей популяции. Помимо других применений, такая формула может быть предназначена для отображения пространства признаков, полученных из одного или нескольких входов детерминант, на набор классов субъектов (например, полезно при предсказании членства субъектов в классе как нормальных, имеющих инфекцию), для получения оценки вероятностной функции риска с использованием байесовского подхода или для оценки обусловленных классами вероятностей, причем используют правило Байеса для получения вероятностной функции класса, как в предыдущем случае.
Предпочтительные формулы включают широкий класс алгоритмов статистической классификации и, в частности, использование дискриминантного анализа. Целью дискриминантного анализа является предсказание членства в классе по ранее идентифицированному набору признаков. В случае линейного дискриминантного анализа (LDA) идентифицируют линейную комбинацию признаков, которая максимизирует разделение между группами по некоторым критериям. Признаки для LDA могут быть идентифицированы с использованием подхода на основе собственных генов с различными порогами (ELD A) или шагового алгоритма на основе многомерного дисперсионного анализа (MANOVA). Могут быть выполнены алгоритмы прямого и обратного хода и пошаговые алгоритмы, которые минимизируют вероятность отсутствия разделения на основании статистики Хоттелинга-Лоули.
Линейный дискриминантный анализ на основе собственных генов (ELD A) представляет собой метод отбора признаков, разработанный Shen et al. (2006). Формула отбирает признаки (например, биомаркеры) в многомерной системе с использованием модифицированного анализа собственных чисел для идентификации признаков, связанных с наиболее важными собственными векторами. Как "важные" определяют те собственные векторы, которые объясняют наибольшую дисперсию в различиях между образцами, которые подвергаются попытке классификации по отношению к некоторому порогу.
Машина опорных векторов (SVM) представляет собой классификационную формулу, которая пытается найти гиперплоскость, которая разделяет два класса. Эта гиперплоскость содержит опорные векторы, точки данных, которые расположены точно на граничном расстоянии от гиперплоскости. В вероятном случае, что разделяющая гиперплоскость при текущей размерности данных не существует, степень размерности значительно расширяют с помощью проецирования данных в большую размерность посредством взятия нелинейных функций исходных переменных (Venables and Ripley, 2002). Хотя это не обязательно, фильтрация признаков для SVM часто улучшает предсказание. Признаки (например, биомаркеры) могут быть идентифицированы для машины опорных векторов с использованием непараметрического критерия Краскела-Уоллиса (KW) для выбора наилучших одномерных признаков. Также для идентификации комбинаций биомаркеров, которые являются наиболее важными, можно по-отдельности или в комбинации использовать случайный лес (RF, Breiman, 2001) или рекурсивное разбиение (RPART, Breiman et al., 1984). Как KW, так и RF требуют, чтобы из общего количества был выбран ряд признаков. RPART создает единое дерево классификации с использованием подмножества доступных биомаркеров. Можно использовать другую формулу для того, чтобы предварительно обработать результаты измерения отдельной детерминанты в более подходящие для оценивания формы информации перед их передачей в прогностическую формулу. Следует отметить, что нормализация результатов биомаркеров с использованием или обычных математических преобразований, таких как логарифмические, или логистических функций, в качестве положений на нормальном или другом распределении по отношению к средним значениям популяции и так далее хорошо известна специалистам в данной области техники. Особый интерес представляет ряд нормализаций на основании клинических детерминант, таких как возраст, время, прошедшее после симптомов, гендер, раса или пол, причем конкретную формулу используют исключительно в отношении субъектов, принадлежащих к классу, или непрерывно комбинируя клинические детерминанты в качестве входных данных. В других случаях биомаркеры на основе аналитов могут быть объединены в расчетные переменные, которые затем передают в формулу.
В дополнение к потенциальной нормализации индивидуальных значений параметра одного субъекта сама общая прогностическая формула для всех субъектов или любого известного класса субъектов может быть перекалибрована или иным образом скорректирована на основании корректировки по ожидаемой распространенности в популяции и средним значениям параметра биомаркера в соответствии с методом, изложенным в документе D'Agostino et al, (2001) JAMA 286: 180-187, или другими аналогичными методами нормализации и перекалибровки. Такая эпидемиологическая корректирующая статистика может собираться, подтверждаться, улучшаться и обновляться непрерывно посредством реестра ранее переданных в модель данных, который может быть доступен для считывания машинным или иным образом, или периодически посредством ретроспективного запроса сохраненных образцов или соотнесения с осуществленными ранее исследованиями таких параметров и статистики. Дополнительные примеры, которые могут представлять собой предмет перекалибровки или других корректировок формулы, включают статистику, использованную в исследованиях Pepe, М.S. et al, 2004, на ограничениях отношений шансов; Cook, N.R., 2007, в отношении ROC-кривых. Наконец, числовой результат самой формулы классификатора может быть трансформирован постобработкой посредством его соотнесения с фактической клинической популяцией, результатами исследования и наблюдаемыми конечными точками, для того чтобы произвести калибровку на абсолютный риск и предоставить доверительные интервалы для изменения числовых результатов формулы классификатора или риска.
Некоторые детерминанты могут проявлять тенденции, которые зависят от возраста пациента (например, исходный уровень популяции может повышаться или понижаться как функция возраста), который можно использовать в качестве неполипептидной детерминанты, как описано в настоящем документе выше. Схему нормализации или стратификации в зависимости от возраста можно, таким образом, использовать для корректировки связанных с возрастом различий. Осуществление зависящей от возраста нормализации или стратификации можно использовать для улучшения точности детерминант при различении между различными типами инфекций. Например, специалист в данной области техники может создать функцию, которая будет соответствовать средним уровням в популяции каждой детерминанты как функции возраста, и использовать ее для нормализации детерминанты уровней отдельных субъектов различных возрастов. Другим примером является стратификация субъектов в соответствии с их возрастом и определение специфических для возраста порогов или значений показателя для каждой возрастной группы независимо.
Эффективность и, следовательно, абсолютная и относительная клиническая применимость настоящего изобретения могут быть оценены несколькими способами, как отмечено выше. Из различных оценок эффективности настоящее изобретение стремится обеспечить точность при клиническом диагностировании и прогнозировании. Точность диагностического или прогностического теста, анализа или способа относится к способности теста, анализа или способа различать между субъектами, имеющими инфекцию, исходя из того, имеют ли субъекты "значимое изменение" (например, клинически значимое, диагностически значимое) уровней детерминанты. Под "эффективной величиной" понимается измерение соответствующего числа детерминант (которое может составлять один или несколько) для получения "значимого изменения" (например, уровня экспрессии или активности детерминанты), которое отличается от предварительно определенной граничной точки (или порогового значения) для этой детерминанты (детерминант) и поэтому указывает на то, что субъект имеет инфекцию, детерминантой которой является данная детерминанта(ы). Различие в уровне детерминанты, предпочтительно, является статистически значимым. Как отмечено ниже, и без любого ограничения настоящего изобретения, достижение статистической значимости и, следовательно, предпочтительной аналитической, диагностической и клинической точности обычно, но не всегда, требует, чтобы комбинации нескольких детерминант были использованы вместе в панели и объединены с помощью математических алгоритмов для получения статистически значимого показателя детерминанты.
В категориальном диагностировании болезненного состояния изменение граничной точки или порогового значения теста (или анализа) обычно изменяет чувствительность и специфичность, но в качественно обратной зависимости. Поэтому при оценке точности и полезности предложенного медицинского теста, анализа или способа оценки состояния субъекта следует всегда учитывать как чувствительность, так и специфичность и помнить о том, что существует граничная точка, для которой сообщаются чувствительность и специфичность, поскольку чувствительность и специфичность могут значительно изменяться по диапазону граничных точек. Одним из способов достижения этой цели является использование метрики MCC, которая зависит как от чувствительности, так и от специфичности. Использование статистики, например AUC, охватывающей все потенциальные значения граничных точек, является предпочтительным для большинства категориальных мер риска, использующих настоящее изобретение, тогда как для непрерывных мер риска предпочтительными являются статистика критерия согласия и калибровка по наблюдаемым результатам или другим золотым стандартам.
Термин "MCC" означает коэффициент корреляции Мэтьюса и рассчитывается следующим образом: MCC=(TP*TN-FP*FN)/{(TP+FN)*(TP+FP)*(TN+FP)*(TN+FN)}<A>0,5, где TP, FP, TN, FN представляют собой истинно положительные, ложно положительные, истинно отрицательные и ложно отрицательные результаты, соответственно. Следует отметить, что значения MCC находятся в диапазоне от -1 до +1, которые указывают на полностью неправильную и идеальную классификацию, соответственно. MCC, равный 0, указывает на случайную классификацию. Было показано, что MCC является полезным для объединения чувствительности и специфичности в единую метрику (Baldi, Brunak et al. 2000). Он также полезен для измерения и оптимизации точности классификации в случаях несбалансированных размеров класса (Baldi, Brunak et al. 2000).
Значения MCC могут находиться в диапазоне от -1 до +1, которые указывают на полностью неправильную и идеальную классификацию, соответственно. MCC, равный 0, указывает на случайную классификацию. Было показано, что MCC особенно полезен для измерения и оптимизации точности классификации в случаях несбалансированных размеров класса (Baldi, Brunak et al. 2000). Дифференциальное диагностирование детерминант может быть оценено с использованием линейной схемы классификации, в которой вычисляют граничный уровень, который максимизирует MCC по обучающему набору, и затем используют его для классификации пациентов в тестовом наборе.
Термин "TP" означает "истинно положительный", то есть положительный результат теста, который точно отражает проверяемую активность. Например, в контексте настоящего изобретения TP представляет собой, например, но без ограничения, бактериальную инфекцию, правильно классифицированную как таковая.
"TN" представляет собой истинно отрицательный и означает отрицательный результат теста, который точно отражает проверяемую активность. Например, в контексте настоящего изобретения TN представляет собой, например, но без ограничения, вирусную инфекцию, правильно классифицированную как таковая.
"FN" представляет собой ложно отрицательный и означает результат, который кажется отрицательным, но неправильно отображает ситуацию. Например, в контексте настоящего изобретения FN представляет собой, например, но без ограничения, бактериальную инфекцию, ложно классифицированную как вирусная инфекция.
"FP" представляет собой ложно положительный и означает результат теста, который ошибочно классифицирован в положительную категорию. Например, в контексте настоящего изобретения FP представляет собой например, но без ограничения, вирусную инфекцию, ложно классифицированную как бактериальная инфекция.
"Чувствительность" вычисляется по формуле TP/(TP+FN) или как истинно положительная фракция заболевших субъектов. "Специфичность" вычисляется по формуле TN/(TN+FP) или как истинно отрицательная фракция не заболевших или нормальных субъектов. "Общая точность" вычисляется по формуле (TN+TP)/(TN+FP+TP+FN). "Прогностическое значение положительного результата" или "PPV" вычисляется по формуле TP/(TP+FP) или как истинно положительная фракция всех положительных результатов теста. На него по своей природе влияет распространенность заболевания и претестовая вероятность в популяции, предназначенной к тестированию. "Прогностическое значение отрицательного результата" или "NPV" вычисляется по формуле TN/(TN+FN) или как истинно отрицательная фракция всех отрицательных результатов теста. На него также по своей природе влияет распространенность заболевания и претестовая вероятность в популяции, предназначенной к тестированию. Смотри, например, документ O'Marcaigh AS, Jacobson RM, "Estimating The Predictive Value Of A Diagnostic Test, How To Prevent Misleading Or Confusing Results", Clin. Ped. 1993, 32(8): 485-491, в котором обсуждаются специфичность, чувствительность и прогностические значения положительного и отрицательного результатов теста, например клинического диагностического теста.
Термин "точность" относится к степени соответствия измеренной или вычисленной величины (полученное в тесте значение) к ее фактическому (или истинному) значению. Клиническая точность относится к доле истинных результатов (истинно положительные (TP) или истинно отрицательные (TN) в сравнении с неверно классифицированными результатами (ложно положительные (FP) или ложно отрицательные (FN)) и может быть сформулирована как чувствительность, специфичность, прогностические значения положительного результата (PPV) или прогностические значения отрицательного результата (NPV), коэффициент корреляции Мэтьюса (MCC) или как правдоподобие, отношение шансов, рабочая характеристическая (ROC) кривая, площадь под кривой (AUC), помимо других мер.
Часто для бинарных подходов к классификации болезненных состояний с использованием непрерывного диагностического тестового измерения чувствительность и специфичность суммируют с помощью рабочей характеристической (ROC) кривой в соответствии с документом Pepe et al, "Limitations of the Odds Ratio in Gauging the Performance of a Diagnostic, Prognostic, or Screening Marker", Am. J. Epidemiol 2004, 159 (9): 882-890, и суммируют с помощью площади под кривой (AUC) или c-статистики, показателя, который делает возможным представление чувствительности и специфичности теста, анализа или способа по всему диапазону граничных точек теста (или анализа) с помощью всего одного значения. Смотри также, например, Shultz, "Clinical Interpretation Of Laboratory Procedures", глава 14, в Teitz, Fundamentals of Clinical Chemistry, Burtis and Ashwood (eds.), 4th edition 1996, W.B. Saunders Company, стр. 192-199; и Zweig et al., "ROC Curve Analysis: An Example Showing The Relationships Among Serum Lipid And Apolipoprotein Concentrations In Identifying Subjects With Coronory Artery Disease", Clin. Chem., 1992, 38(8): 1425-1428. Альтернативный подход с использованием функций правдоподобия, отношений шансов, информационной теории, прогностических значений, калибровки (включая критерий согласия) и переклассификационных измерений кратко изложен в соответствии с документом Cook, "Use and Misuse of the Receiver Operating Characteristic Curve in Risk Prediction", Circulation 2007, 115: 928-935.
"Формула", "алгоритм" или "модель", как используется в настоящем документе, представляет собой любое математическое уравнение, алгоритмический, аналитический или программный процесс или статистический метод, которые принимают одно или несколько непрерывных категориальных входных значений (в настоящем документе называемых "параметрами") и вычисляют выходное значение, иногда называемое "показателем" или "значением показателя". Неограничивающие примеры "формул" включают суммы, отношения и операторы регрессии, такие как коэффициенты или показатели степени, преобразования значений биомаркеров и нормализации (включая, без ограничения, схемы нормализации, основанные на клинических детерминантах, таких как пол, возраст или этническая принадлежность), правила и руководства, статистически модели классификации и нейронные сети, обученные на ранее исследованных популяциях. Особое значение в объединении детерминант имеют линейные и нелинейные уравнения и статистические классификационные анализы для определения взаимосвязи между уровнями детерминант, детектированными в образце субъекта, и вероятностью наличия у субъекта инфекции или определенного типа инфекции. Из панельных и комбинированных построений особый интерес представляют структурные и синтаксические статистические алгоритмы классификации и способы построения показателей, использующие признаки распознавания образов, включая известные методы, такие как кросс-корреляция, анализ главных компонент (PCA), вращение факторов, логистическая регрессия (LogReg), линейный дискриминантный анализ (LDA), линейный дискриминантный анализ собственных генов (ELD A), машины опорных векторов (SVM), случайный лес (RF), дерево рекурсивного разбиения (RPART), а также другие схожие методы классификации деревьев решений, суживающиеся центроиды (SC), StepAIC, K ближайших соседей, бустинг, деревья решений, нейронные сети, байесовские сети и скрытые марковские модели, помимо прочего. В анализе выживания и времени до опасного события можно использовать другие методы, включая модели Коскса, Вейбулла, Каплана-Майера и Гринвуда, хорошо известные специалистам в данной области техники. Многие из этих методов или являются полезными в сочетании с методом выбора детерминант, таким как прямой выбор, обратный выбор или пошаговый выбор, полный перебор всех возможных панелей заданного размера, генетические алгоритмы, или сами могут включать методики выбора биомаркеров в свой собственный метод. Это может быть объединено с информационными критериями, такими как информационный критерий Акаике (AIC) или информационный критерий Байеса (BIC), для того чтобы количественно определять компромисс между дополнительными биомаркерами и улучшением модели, и для того чтобы способствовать минимизации переобучения. Получаемые прогностические модели могут быть подтверждены в других исследованиях или перекрестно подтверждены в исследовании, в котором они исходно проходили обучение, с использованием таких методов как бутстреп, исключение по одному (LOO) и 10-проходная перекрестная проверка (10-Fold CV). На различных этапах уровень ложного обнаружения может быть оценен по перестановке значений в соответствии с методами, известными в данной области техники. "Функция экономической оценки полезности для здоровья" представляет собой формулу, которую выводят из комбинации ожидаемой вероятности диапазона клинических результатов в идеализированной подходящей популяции пациентов как до, так и после введения диагностического или терапевтического вмешательства в стандарт оказания медицинской помощи. Она охватывает оценки характеристик точности, эффективности и результативности такого вмешательства и измерение затрат и/или стоимости (полезность), связанных с каждым результатом, которые могут быть получены из фактических затрат на медицинское обслуживание в системе здравоохранения (услуги, материалы, устройства и препараты и так далее) и/или как оценка приемлемой стоимости года жизни с поправкой на ее качество (QALY), приводящей к каждому результату. Сумма по всем предсказанным результатам предсказанного размера популяции для результата, умноженного на ожидаемую полезность соответствующего результата, представляет собой общую экономическую оценку полезности для здоровья для данного стандарта оказания медицинской помощи. Разница между (i) общей экономической оценкой полезности для здоровья, вычисленной для стандарта оказания медицинской помощи с вмешательством, и (ii) общей экономической оценкой полезности для здоровья для стандарта оказания медицинской помощи без этого вмешательства дает общий показатель экономической стоимости здоровья или эффекта вмешательства. Само это значение может быть разделено на всю группу подвергаемых анализу пациентов (или только на группу вмешательства) для получения стоимости единичного вмешательства и для принятия таких решений, как позиционирование на рынке, ценообразование и предположения о приемлемости для системы здравоохранения. Такие функции экономической оценки полезности для здоровья обычно используются для сравнения экономической эффективности вмешательства, но их также можно трансформировать для оценки приемлемой стоимости, которую должна заплатить система здравоохранения за QALY, или требуемых приемлемых экономически эффективных клинических характеристик результативности нового вмешательства.
Для диагностических (или прогностических) вмешательств настоящего изобретения, поскольку все результаты (которые в диагностическом тесте классификации заболевания могут представлять собой TP, FP, TN или FN) имеют различную стоимость, функция экономической оценки полезности для здоровья может, преимущественно, поддерживать чувствительность за счет специфичности или PPV за счет NPV на основании клинической ситуации и затрат и стоимости отдельных результатов и, таким образом, обеспечивает другой показатель экономической эффективности и стоимости здоровья, который может отличаться от более прямых клинических или аналитических показателей эффективности. Эти различные измерения и относительные компромиссы обычно будут сходиться только в случае идеального теста с нулевым процентом ошибок (также известного как нулевая ошибка в предсказании результатов для субъекта или FP и FN), который все показатели эффективности будут предпочитать по сравнению с неидеальным, но в различной степени.
В другом аспекте настоящее изобретение, соответственно, относится к способу различения между бактериальной инфекцией и вирусной инфекцией у субъекта, содержащему:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и CRP, необязательно TRAIL, в образце, полученном от субъекта;
b) применение предварительно определенной математической функции к концентрациям HNL и CRP и, необязательно, TRAIL, для вычисления балльной оценки;
c) сравнение балльной оценки, как определено в настоящем документе выше, с предварительно определенным эталонным значением, как определено в настоящем документе выше.
В другом аспекте настоящее изобретение, соответственно, предлагает способ различения между бактериальной или смешанной инфекцией и вирусной инфекцией у субъекта, содержащий:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного выше, или диагностической композиции или набора, как определено выше, и CRP, необязательно TRAIL, в образце, полученном от субъекта;
b) применение предварительно определенной математической функции к концентрациям HNL и CRP и, необязательно, TRAIL, для вычисления балльной оценки;
c) сравнение балльной оценки, как определено в настоящем документе выше, с предварительно определенным эталонным значением, как определено в настоящем документе выше.
В еще одном аспекте предлагается способ идентификации типа инфекции, предпочтительно бактериальной или вирусной инфекции, у субъекта, содержащий:
a) измерение концентрации полипептида HNL с использованием связывающего средства, определенного в любом из п.п. 1-5, или диагностической композиции или набора по п.п. 6 или 7 и уровней первой полипептидной детерминанты, как определено в настоящем документе выше, выбранной из группы, состоящей из TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксина, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанных с IgG молекул, IL1, I-TAC и TNFR1, в образце, полученном от субъекта; и
b) измерение уровней второй детерминанты, выбранной из группы, состоящей из
(i) полипептидных детерминант, как определено в настоящем документе выше, TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксина, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанных с IgG молекул, IL1, I-TAC и TNFR1;
(ii) полипептидных детерминант, как определено в настоящем документе выше, IFITM3, IFIT3, EIF4B, IFIT1, LOC26010, MBOAT2, MX1, OAS2, RSAD2, ADIPOR1, CD15, CD8A, IFITM1 и IL7;
(iii) полипептидных детерминант, как определено в настоящем документе выше, CRP, SAA, TREM-1, PCT, IL-8, TREM-1 и IL6; или
(iv) неполипептидных детерминант, как определено в настоящем документе выше, возраста, абсолютного количества нейтрофилов (ANC), абсолютного количества лимфоцитов (ALC), % нейтрофилов (Neu (%)), % лимфоцитов (Lym (%)), % моноцитов (Mono (%)), максимальной температуры, времени, прошедшего после симптомов, креатинина (Cr), калия (K), пульса и мочевины;
c) сравнение уровней HNL, первой и второй детерминант с эталонным значением, посредством чего идентифицируют тип инфекции у субъекта, причем измерение первой и/или второй детерминанты повышает точность идентификации типа инфекции по измерению HNL.
Подразумевается, что "тип инфекции", как используется в настоящем документе, включает в себя бактериальные инфекции, вирусный инфекции, смешанные инфекции, отсутствие инфекции (то есть, неинфекционные). Более конкретно, некоторые способы настоящего изобретения используют для различения субъектов, имеющих бактериальную инфекцию, вирусную инфекцию, смешанную инфекцию (то есть бактериальную и вирусную коинфекции), пациентов с неинфекционным заболеванием и здоровых индивидуумов.
Для удобства антитело, раскрытое в настоящем документе, может предлагаться в наборе, то есть упакованной комбинации реагентов в предварительно определенных количествах с инструкциями по выполнению диагностического анализа. Если антитело помечено ферментом, набор будет включать в себя субстраты и кофакторы, требующиеся для фермента (например, субстрат-предшественник, который предоставляет детектируемый хромофор или флуорофор). Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или лизисный буфер) и тому подобное. Относительные количества различных реагентов могут изменяться в широких пределах для обеспечения концентраций в растворе реагентов, которые по существу оптимизируют чувствительность анализа. В частности, реагенты могут быть предоставлены в виде сухих порошков, обычно лиофилизированных, включая вспомогательные вещества, что при растворении будет обеспечивать раствор реагента, имеющий соответствующую концентрацию.
Также предлагаются диагностические реагенты и наборы, содержащие один или несколько таких реагентов, для использования во множестве диагностических анализов, включая, например, иммуноанализы, такие как ELISA (сэндвич-типа или в конкурентном формате). В некоторых вариантах осуществления такие наборы могут включать в себя по меньшей мере первый пептид (необязательно, соответствующим образом уложенный зрелый стандарт HNL, как описано в настоящем документе), или первое антитело или антигенсвязывающий фрагмент, описанные в настоящем документе, их функциональный фрагмент или их коктейль, и средство для генерации сигнала. Компоненты набора могут быть предварительно прикреплены к твердой подложке или могут быть нанесены на поверхность твердой подложки при использовании набора. В некоторых вариантах осуществления средство для генерации сигнала может приходить предварительно связанным с антителом, описанным в настоящем документе, или может требовать комбинирования с одним или несколькими компонентами, например буферами, конъюгатами антитело-фермент, субстратами ферментов или тому подобным перед использованием. Наборы могут также включать в себя дополнительные реагенты, например блокирующие реагенты для уменьшения неспецифического связывания с поверхностью твердой фазы, промывающие реагенты, субстраты ферментов и тому подобное. Поверхность твердой фазы может иметь форму пробирки, гранулы, микротитровального планшета, микросферы или других материалов, подходящих для иммобилизации белков, пептидов или полипептидов. В некоторых вариантах осуществления фермент, который катализирует образование хемилюминесцентного или хромогенного продукта или восстановление хемилюминесцентного или хромогенного субстрата является компонентом средства для генерации сигнала. Такие ферменты хорошо известны в данной области техники. Наборы могут содержать любые из средств для захвата и реагентов для детектирования, описанных в настоящем документе. Необязательно, набор может также содержать инструкции по осуществлению способов, описанных в настоящем документе. Наборы могут, дополнительно, содержать средства для детектирования и измерения других биологических параметров, например средства для измерения экспрессии и количества прокальцитонина, C-реактивного белка, CD64 или любых из полипептидных детерминант, упомянутых в настоящем документе выше, и для определения количества белых кровяных клеток, например нейтрофилов, T-клеток, B-клеток, моноцитов, эозинофилов, базофилов.
Могут также быть получены диагностические наборы, раскрытые в настоящем документе, которые содержат по меньшей мере одно из антитела, пептида, антигенсвязывающего фрагмента или полинуклеотида, раскрытых в настоящем документе, и инструкции по использованию композиции в качестве диагностического реагента или терапевтического средства. Контейнеры для использования в таких наборах могут, как правило, содержать по меньшей мере один флакон, тестовую пробирку, колбу, бутыль, шприц или другой подходящий контейнер, в который могут быть помещены и соответствующим образом разделены на аликвоты одна или несколько из диагностических и/или терапевтических композиций. Если также предлагается второе терапевтическое средство, набор может также содержать второй отдельный контейнер, в который может быть помещена эта вторая диагностическая и/или терапевтическая композиция. В качестве альтернативы, из множества соединений может быть получена одна фармацевтическая композиция, и она может быть упакована в одно упаковочное средство, такое как флакон, колба, шприц, бутыль или другой подходящий единственный контейнер. Наборы настоящего изобретения будут также, как правило, включать в себя средство для помещения флакона(ов) в закрытую оболочку для коммерческой продажи, такую как, например, получаемые литьем под давлением или литьем с раздувом пластмассовые контейнеры, в которые помещают нужный флакон(ы). Если в набор включены радиоактивные, хромогенные, флюорогенные или другого типа детектируемая метка или средство для детектирования, то средство для мечения или может быть предусмотрено в том же контейнере, что и сама диагностическая или терапевтическая композиция, или может, альтернативно, быть помещено во втором отдельном упаковочном средстве, в которое эта вторая композиция может быть помещена и соответствующим образом разделена на аликвоты. В качестве альтернативы, реагент для детектирования и метка могут быть приготовлены в одном упаковочном средстве, и в большинстве случаев набор будет также, как правило, включать в себя средство для помещения флакона(ов) в закрытую оболочку для коммерческой продажи и/или удобных упаковывания и доставки.
Также предлагаются устройство или приспособление для осуществления способов диагностирования или мониторинга, описанных в настоящем документе. Такое приспособление может включать в себя камеру или пробирку, в которую может быть введен образец, систему для работы с жидкостью, необязательно включающую в себя клапаны или насосы для направления потока образца через устройство, необязательно, фильтры для отделения плазмы или сыворотки от крови, смесительные камеры для добавления средств для захвата или реагентов для детектирования и, необязательно, детектирующее устройство для детектирования количества детектируемой метки, связанной с иммунокомплексом средства для захвата. Поток образца может быть пассивным (например, обусловленным капиллярными, гидростатическими или другими силами, которые не требуют дополнительных манипуляций с устройством после нанесения образца), или активным (например, обусловленным прикладыванием силы, создаваемой с помощью механических насосов, электроосмотических насосов, центробежной силы или повышенным давлением воздуха), или обусловленным комбинацией активных и пассивных сил. Также для выполнения тестов и способов, раскрытых в настоящем документе, можно использовать устройства для детектирования аналитов, которые используют магнитное разделение представляющих интерес аналитов (например, устройство, раскрытое в WO2008/072156, WO2008/102218, WO2010/035204 и WO2011/036638).
В родственных вариантах осуществления также предлагается процессор, машиночитаемая память и процедура, сохраненная на машиночитаемой памяти и выполненная с возможностью исполнения на процессоре для осуществления любого из способов, описанных в настоящем документе, и/или для генерации в качестве выходных данных детектированного уровня HNL и порога или диапазона пороговых уровней, рассматриваемых как "нормальные", так что уровни за пределами "нормального" диапазона коррелируют с одним или несколькими из состояний, описанных в настоящем документе. В некоторых вариантах осуществления также предлагаются машиночитаемые среды, содержащие программы или процедуры для выполнения аналогичных функций. Примеры подходящих вычислительных систем, сред и/или конфигураций включают персональные компьютеры, серверные компьютеры, портативные или переносные устройства, многопроцессорные системы, системы на основе микропроцессоров, телевизионные приставки, программируемую бытовую электронику, сетевые ПК, миникомпьютеры, универсальные компьютеры, распределенные вычислительные среды, которые включают в себя любые из вышеупомянутых систем или устройств, или любые другие системы, известные в данной области техники.
Антитела, раскрытые в настоящем документе, могут быть использованы в диагностических анализах на целевой антиген, например в детектировании его экспрессии в определенных клетках, тканях или сыворотке. Антитела могут также быть использованы для диагностических анализов in vivo. Обычно для этих целей антитело помечают радионуклидом, так что участок может быть локализован с использованием иммуносцинтиграфии.
Антитела, раскрытые в настоящем документе, могут быть использованы в любом известном способе анализа, таком как конкурентные анализы связывания, прямой и непрямой сэндвич-анализы, такие как ELISA, и иммунопреципитационные анализы. Zola, Monoclonal Antibodies: A Manual of Techniques, pp. 147-158 (CRC Press, Inc. 1987). Антитела также могут быть использованы в иммуногистохимии для мечения клеточных образцов с использованием способов, известных в данной области техники.
ЭКСПЕРИМЕНТЫ
1. Характеризация антител и эпитопов HNL
Картирование эпитопов с помощью масс-спектрометрии MALDI больших масс
До начала картирования эпитопов был выполнен анализ MALDI больших масс с каждым образцом (антитела и антиген), для того чтобы проверить уровень их целостности и агрегации. Для теста целостности/агрегации были осуществлены измерения с использованием масс-спектрометра Ultraflex III MALDI ToF (Bruker), оснащенного модулем взаимодействия HM3 от CovalX. Модуль взаимодействия от CovalX содержит специальную систему детектирования, разработанную для оптимизации детектирования вплоть до 2 МДа с наномолярной чувствительностью. 20 мкл образца каждого белка (анти-HNL клон MAB1; клон MAB2 и клон MAB3 и HNL отмеряли пипеткой для получения 8 разведений с конечным объемом 10 мкл. Концентрация антител в этих разведениях составляла 1,0 мг/мл, 0,5 мг/мл, 250 мкг/мл, 125 мкг/мл, 62,5 мкг/мл, 31,25 мкг/мл, 15,63 мкг/мл, 7,82 мкг/мл. Антиген HNL разбавляли для получения следующих концентраций: 350 мкг/мл, 175 мкг/мл, 87,5 мкг/мл, 43,75 мкг/мл, 21,88 мкг/мл, 10,94 мкг/мл, 5,47 мкг/мл и 2,74 мкг/мл. Эти 8 разведений образцов подготавливали для того, чтобы получить следующие ожидаемые концентрации:
1 мкл каждого полученного разведения смешивали с 1 мкл матрицы, состоящей из перекристаллизованной матрицы синапиновой кислоты (10 мг/мл) в ацетонитриле/воде (1:1, об/об), TFA 0,1% (K200 MALDI Kit). После смешивания 1 мкл каждого образца наносили на планшет для MALDI (SCOUT 384). После кристаллизации при комнатной температуре планшет вводили в масс-спектрометр MALDI и немедленно анализировали в режиме MALDI больших масс. Анализ повторяли в трех повторностях.
Эксперименты по перекрестному сшиванию делают возможным непосредственный анализ нековалентного взаимодействия с помощью масс-спектрометрии MALDI больших масс. Посредством смешивания белкового образца, содержащего нековалентные взаимодействия, со специально разработанной смесью для перекрестного сшивания (Bich, C. et al. Anal. Chem., 2010, 82 (1), pp 172-179) можно специфически детектировать нековалентный комплекс с высокой чувствительностью. Создание ковалентного связывания позволяет взаимодействующим образцам выдерживать процесс подготовки образца и ионизацию MALDI. Специальная система детектирования для больших масс позволяет характеризовать взаимодействие в диапазоне больших масс.
Каждую полученную смесь для контрольного эксперимента (оставляли 9 мкл) подвергали перекрестному сшиванию с использованием набора для анализа K200 MALDI MS от CovalX. 9 мкл смесей (от 1 до 1/128) смешивали с 1 мкл реагента K200 Stabilizer (2 мг/мл) и инкубировали при комнатной температуре. По прошествии времени инкубации (180 минут) образцы подготавливали для анализа MALDI как для контрольных экспериментов. Образцы анализировали посредством анализа с помощью MALDI больших масс немедленно после кристаллизации. Анализ MALDI ToF MS осуществляли с использованием модуля взаимодействия HM3 от CovalX со стандартным азотным лазером и с фокусировкой на различных диапазонах масс от 0 до 1500 кДа. Для анализа были применены следующие параметры: масс-спектрометр: линейный и положительный режим, источник ионов 1: 20 кВ, источник ионов 2: 17 кВ, линза: 12 кВ, импульсная экстракция ионов: 400 нс, HM3: напряжение усиления: 3,14 кВ, ускоряющее напряжение: 20 кВ.
Результаты
Антитело анти-HNL MAB1
В контрольных экспериментах детектировали один главный пик для каждого разбавления от 1 до 1/64 с MH+=146,935±0,098 кДа. Наблюдаемый молекулярный вес (кДа) составляет 146,935±0,098, анти-HNL MAB1.
В экспериментах по перекрестному сшиванию детектировали один главный пик для каждого разбавления от 1 до 1/64 с MH+=148,717±0,112 кДа. Наблюдаемый молекулярный вес (кДа) составляет 148,717±0,112, анти-HNL MAB1. Других нековалентных комплексов в вышеуказанном диапазоне масс не было детектировано. Кроме того, с использованием программного обеспечения Complex Tracker нековалентные комплексы не (были детектированы).
Антитело анти-HNL MAB2
В контрольных экспериментах детектировали один главный пик для каждого разбавления от 1 до 1/64 с MH+=152,657±0,115 кДа. Наблюдаемый молекулярный вес (кДа) составляет 152,657±0,115, анти-HNL MAB2.
В экспериментах по перекрестному сшиванию детектировали один главный пик для каждого разбавления от 1 до 1/64 с MH+=154,521±0,142 кДа. Наблюдаемый молекулярный вес (кДа) составляет 154,521±0,142, анти-HNL MAB2. Других нековалентных комплексов в вышеуказанном диапазоне масс не было детектировано. С использованием программного обеспечения Complex Tracker нековалентные комплексы не были детектированы.
Антитело анти-HNL MAB3
В контрольных экспериментах детектировали один главный пик для каждого разбавления от 1 до 1/64 с MH+=147,717±0,133 кДа. Наблюдаемый молекулярный вес (кДа) составляет 147,717±0,133, анти-HNL MAB3.
В экспериментах по перекрестному сшиванию детектировали один главный пик для каждого разбавления от 1 до 1/64 с MH+=149,134±0,089 кДа. Наблюдаемый молекулярный вес (кДа) составляет 149,134±0,089, анти-HNL MAB3. Других нековалентных комплексов в вышеуказанном диапазоне масс не было детектировано. С использованием программного обеспечения Complex Tracker нековалентные комплексы не детектировали.
Антиген HNL
В контрольных экспериментах детектировали один главный пик для каждого разбавления от 1 до 1/32 с MH+=45,431±0,33 кДа. Наблюдаемый молекулярный вес (кДа) составляет 45,431±0,33.
В экспериментах по перекрестному сшиванию детектировали один главный пик для каждого разбавления от 1 до 1/32 с MH+=48,509±0,052 кДа. Наблюдаемый молекулярный вес (кДа) составляет 48,509±0,052. Других нековалентных комплексов в вышеуказанном диапазоне масс не было детектировано. С использованием программного обеспечения Complex Tracker нековалентные комплексы не детектировали.
Заключение по тесту агрегации
С использованием масс-спектрометрии MALDI больших масс и химического перекрестного сшивания не были детектированы нековалентные агрегаты анти-HNL антитела и мультимеры антигенов HNL.
Характеризация природы эпитопа
Для того чтобы определить природу эпитопа (то есть линейную или конформационную), оценивали, может ли взаимодействие между антигенными белками и антителами быть ингибировано неструктурированными пептидами, полученными в результате протеолиза антигена.
- Если пептиды, полученные в результате полного протеолиза антигена, способны ингибировать связывание антигена на антителе, взаимодействие не основано на конформации. В этом случае эпитоп является линейным. Простого конкурентного анализа с помощью банка перекрывающихся пептидов, полученных из последовательности антигена, будет достаточно для определения последовательности эпитопа.
- Если пептиды, полученные в результате полного протеолиза антигена, неспособны ингибировать связывание антигена на антителе, то для взаимодействий необходима конформация. В этом случае эпитоп может быть непрерывным (со специальной конформацией, то есть петлей) или прерывистым (из-за третичной структуры). В этом случае будет необходимо использование ковалентного мечения, пептидного картирования и масс-спектрометрии высокого разрешения.
Для характеризации природы эпитопа выполняли измерения с использованием масс-спектрометра Ultraflex III MALDI ToF (Bruker), оснащенного системой HM3 для больших масс от CovalX.
Контрольные эксперименты
Получали смесь mAb/Ag (анти-HNL MAB1/HNL; анти-HNL MAB2/HNL и анти-HNL MAB3/HNL). 1 мкл полученной смеси смешивали с 1 мкл матрицы, состоящей из перекристаллизованной матрицы синапиновой кислоты (10 мг/мл) в ацетонитриле/воде (1:1, об/об), TFA 0,1% (K200 MALDI Kit). После смешивания 1 мкл каждого образца наносили на планшет для MALDI (SCOUT 384). После кристаллизации при комнатной температуре планшет вводили в масс-спектрометр MALDI и немедленно анализировали. Анализ повторяли в трех повторностях.
Эксперименты по перекрестному сшиванию
Смесь, полученную для контрольного эксперимента (оставляли 9 мкл), подвергали перекрестному сшиванию с использованием набора для анализа K200 MALDI MS от CovalX. 9 мкл смеси смешивали с 1 мкл реагента K200 Stabilizer (2 мг/мл) и инкубировали при комнатной температуре. По прошествии времени инкубации (180 минут) образцы подготавливали для анализа MALDI как для контрольных экспериментов. Образцы анализировали посредством анализа с помощью MALDI больших масс немедленно после кристаллизации.
Конкурентный анализ
Для того чтобы определить природу эпитопа, осуществляли протеолиз антигена HNL с помощью иммобилизованного пепсина. 25 мкл антигена с концентрацией 10 мкМ смешивали с иммобилизованным пепсином 2,5 мкМ и инкубировали при комнатной температуре в течение 30 минут. По прошествии времени инкубации образец центрифугировали, и супернатант удаляли пипеткой. Завершение протеолиза контролировали с помощью масс-спектрометрии MALDI больших масс в линейном режиме и рефлектронном режиме. Пепсиновый протеолиз оптимизировали для получения большого количества пептида в диапазоне 1000-3500 Да. 5 мкл антигенных пептидов, полученных в результате протеолиза (7,6 мкМ), смешивали с 5 мкл анти-HNL антитела (3,8 мкМ) и инкубировали при 37° в течение 2 часов. После инкубации антител с антигенными пептидами 5 мкл смеси смешивали с 5 мкл интактного антигена (3,8 мкМ).
Анализ взаимодействия
Для конкурентного анализа осуществляли анализ взаимодействия антитело/антиген по протоколу, описанному выше (контрольные эксперименты и эксперименты по перекрестному сшиванию).
Анализ с помощью MS MALDI больших масс
Анализ с помощью MALDI ToF MS осуществляли с использованием модуля взаимодействия HM3 от CovalX со стандартным азотным лазером и с фокусировкой на различных диапазонах масс от 0 до 2000 кДа. Для анализа были применены следующие параметры: масс-спектрометр: линейный и положительный режим; источник ионов 1: 20 кВ; источник ионов 2: 17 кВ; линза: 12 кВ; импульсная экстракция ионов: 400 нс; HM3: напряжение усиления: 3,14 кВ; ускоряющее напряжение: 20 кВ. Для калибровки прибора применяли внешнюю калибровку с помощью кластеров инсулина, БСА и IgG. Для каждого образца анализировали 3 пятна (300 лазерных импульса на пятно). Представленный спектр соответствует сумме 300 лазерных импульсов. Данные MS анализировали с использованием программного обеспечения для анализа Complex Tracker версии 2.0 от CovalX.
Результаты
Анти-HNL MAB1/HNL
В контрольных экспериментах антиген и антитело имели MH+=45,862 кДа и MH+=148,577 кДа. Наблюдаемый молекулярный вес (кДа) 45,725, HNL; 148,431, анти-HNL MAB1.
Эксперимент по перекрестному сшиванию заканчивали после 180 минут инкубации с перекрестно-сшивающим реагентом K200. После перекрестного сшивания были детектированы два дополнительных пика MH+=195,941 кДа и MH+=241,619 кДа. С использованием программного обеспечения Complex Tracker осуществляли наложение контрольного спектра и спектра после перекрестного сшивания. Было детектировано два нековалентных комплекса со следующей стехиометрией. Наблюдаемый молекулярный вес (кДа) и стехиометрия представляли собой 194,865 [анти-HNL MAB1/HNL] и 241,287 [анти-HNL MAB1/2HNL], соответственно.
В конкурентных экспериментах не было детектировано ингибирование связывания анти-HNL антитела с антигеном HNL. Пептиды антигена не ингибировали связывание антитела с антигеном.
Анти-HNL MAB2/HNL
В контрольных экспериментах антиген и антитело имели MH+=45,755 кДа и MH+=148,531 кДа, соответственно. Наблюдаемый молекулярный вес (кДа) составлял 45,755, HNL, и 148,531, анти-HNL MAB2.
Эксперимент по перекрестному сшиванию заканчивали после 180 минут инкубации с перекрестно-сшивающим реагентом K200. После перекрестного сшивания были детектированы два дополнительных пика MH+=201,793 кДа и MH+=248,696 кДа. С использованием программного обеспечения Complex Tracker осуществляли наложение контрольного спектра и спектра после перекрестного сшивания. Было детектировано два нековалентных комплекса со следующей стехиометрией: наблюдаемый молекулярный вес (кДа) и стехиометрия 194,881 [анти-HNL MAB2/HNL] и 240,978 [анти-HNL MAB2/2HNL].
В конкурентных экспериментах не было детектировано ингибирование связывания анти-HNL антитела с антигеном HNL. Пептиды антигена не ингибировали связывание антитела с антигеном.
Анти-HNL MAB3/HNL
В контрольных экспериментах антиген и антитело были детектированы с MH+=45,742 кДа и MH+=148,554 кДа. Наблюдаемый молекулярный вес (кДа) составлял 45,742, HNL, и 148,554, анти-HNL MAB3, соответственно.
Эксперимент по перекрестному сшиванию заканчивали после 180 минут инкубации с перекрестно-сшивающим реагентом K200. После перекрестного сшивания были детектированы два дополнительных пика MH+=196,482 кДа и MH+=243,468 кДа. С использованием программного обеспечения Complex Tracker авторы осуществляли наложение контрольного спектра и спектра после перекрестного сшивания. Было детектировано два нековалентных комплекса со следующей стехиометрией. Наблюдаемый молекулярный вес (кДа) и стехиометрия представляли собой 194,130 [анти-HNL MAB3/HNL] и 240,793 [анти-HNL MAB3/2HNL], соответственно.
В конкурентных экспериментах не было детектировано ингибирование связывания анти-HNL антитела с антигеном HNL. Пептиды антигена не ингибировали связывание антитела на антигене.
Заключение по конкурентному анализу
Конкурентный анализ показал, что пептиды антигена не ингибируют связывание антитела на антигене. Эпитоп анти-HNL на HNL не является линейным.
Характеризация и отпечаток пептидных масс антигена HNL
Для того чтобы охарактеризовать HNL, его образцы подвергали протеолизу с помощью ASP-N, трипсина, химотрипсина, эластазы и термолизина с последующим анализом с помощью LC-LTQ Orbitrap MS/MS. Для характеризации антигена проводили нано-LC-хроматографию с использованием системы Ultimate 3000 (Dionex) вместе с масс-спектрометром LTQ Orbitrap XL (Thermo). 10 мкл антигена (0,35 мг/мл) смешивали с 40 мкл бикарбоната аммония (25 мМ, pH 8,3). После смешивания добавляли к раствору 2 мкл ДТТ (500 мМ). Затем смесь инкубировали 1 час при 55°C. После инкубации добавляли 2 мкл иодоацетамида (1M) перед 1 часом инкубации при комнатной температуре в темной комнате. После инкубации раствор разбавляли в соотношении 1/5 посредством добавления 120 мкл буфера, используемого для протеолиза с помощью трипсина, химотрипсина, ASP-N, эластазы или термолизина:
- 145 мкл восстановленного/алкилированного антигена смешивали с 0,7 мкл трипсина (Roche Diagnostic) в соотношении 1/100. Протеолитическую смесь инкубировали в течение ночи при 37°C.
- 145 мкл восстановленного/алкилированного антигена смешивали с 0,35 мкл химотрипсина (Roche Diagnostic) в соотношении 1/200. Протеолитическую смесь инкубировали в течение ночи при 25°C.
- 145 мкл восстановленного/алкилированного антигена смешивали с 0,35 мкл ASP-N (Roche Diagnostic) в соотношении 1/200. Протеолитическую смесь инкубировали в течение ночи при 37°C.
- 145 мкл восстановленного/алкилированного антигена смешивали с 0,70 мкл эластазы (Roche Diagnostic) в соотношении 1/100. Протеолитическую смесь инкубировали в течение ночи при 37°C.
- 145 мкл восстановленного/алкилированного антигена смешивали с 1,40 мкл термолизина (Roche Diagnostic) в соотношении 1/50. Протеолитическую смесь инкубировали в течение ночи при 70°C.
После протеолиза 10 мкл пептида, полученного в результате протеолиза, загружали в систему для жидкостной нано-хроматографии (Ultimate 3000, Dionex) и подвергали анализу. Генерацию DTA и фильтрацию осуществляли с использованием LTQ OrbiTrap.
Характеризация молекулярных интерфейсов
Для того чтобы с высоким разрешением определить эпитоп для анти-HNL MAB1; анти-HNL MAB2 и анти-HNL MAB3 на антигене HNL, комплексы антитело/антиген инкубировали с дейтерированными перекрестносшивающими средствами и подвергали мультиферментативному расщеплению. После обогащения перекрестно сшитых пептидов образцы анализировали с помощью масс-спектрометрии высокого разрешения (nLC-Orbitrap MS), и полученные данные анализировали с использованием программного обеспечения XQuest и Stavrox.
Комплекс антитело/антиген
5 мкл образца антигена (концентрация 3,8 мкМ) смешивали с 5 мкл образца антитела (концентрация 1,9 мкМ), для того чтобы получить смесь антитело/антиген с итоговой концентрацией 0,95 мкМ/1,9 мкМ. Смесь инкубировали при 37°C в течение 180 минут.
На первом этапе 1 мг перекрестносшивающего средства d0 смешивали с 1 мг перекрестносшивающего средства d12. Полученные 2 мг смешивали с 1 мл DMF, для того чтобы получить 2 мг/мл раствора DSS d0/d12. 10 мкл смеси антитело/антиген, приготовленной ранее, смешивали с 1 мкл полученного раствора перекрестносшивающего средства d0/d12 (2 мг/мл). Раствор инкубируют 180 минут при комнатной температуре, для того чтобы добиться реакции перекрестного сшивания.
10 мкл антигена (0,35 мг/мл) смешивали с 40 мкл бикарбоната аммония (25 мМ, pH 8,3). После смешивания добавляли к раствору 2 мкл ДТТ (500 мМ). Затем смесь инкубировали 1 час при 55°C. После инкубации добавляли 2 мкл иодоацетамида (1M) перед 1 часом инкубации при комнатной температуре в темной комнате. После инкубации раствор разбавляли в соотношении 1/5 посредством добавления 120 мкл буфера, используемого для протеолиза.
145 мкл восстановленного/алкилированного антигена смешивали с 0,7 мкл трипсина (Roche Diagnostic) в соотношении 1/100. Протеолитическую смесь инкубировали в течение ночи при 37°C.
145 мкл восстановленного/алкилированного антигена смешивали с 0,35 мкл химотрипсина (Roche Diagnostic) в соотношении 1/200. Протеолитическую смесь инкубировали в течение ночи при 25°C.
145 мкл восстановленного/алкилированного антигена смешивали с 0,35 мкл ASP-N (Roche Diagnostic) в соотношении 1/200. Протеолитическую смесь инкубировали в течение ночи при 37°C.
145 мкл восстановленного/алкилированного антигена смешивали с 0,70 мкл эластазы (Roche Diagnostic) в соотношении 1/100. Протеолитическую смесь инкубировали в течение ночи при 37°C.
145 мкл восстановленного/алкилированного антигена смешивали с 1,40 мкл термолизина (Roche Diagnostic) в соотношении 1/50. Протеолитическую смесь инкубировали в течение ночи при 70°C.
Перекрестносшитые пептиды анализировали с использованием программного обеспечения Xquest версии 2.0 и Stavrox 2.1.
Антитело анти-HNL MAB1
После перекрестного сшивания пептиды, полученные в результате мультиферментативного протеолиза, охватывают 95% от всей последовательности антигена.
С использованием предоставленных анти-HNL MAB1 гибридом было осуществлено секвенирование кДНК со следующим результатом:
Вариабельная область легкой цепи:
DIVMTQTPATLSVTPGDSVSLSCRASQSIITDLHWYQQRSHESPRLLIKSASQSISGIPSRFSGSGSGTDFTLTINSVETEDFGMYFCQQSNSWPLTFGAGTKLELKRADAAPTVS
Вариабельная область тяжелой цепи:
VQLQESGPDLVAPSQSLSITCTVSGFSLSSYGVHWVRQPPGKGLEWLIVMWSDGSTTSNSALKSRLSISKDNSKSQVFLKVNSLQSDDTAIYYCARHYGYFTMDYWGQGTSVTVSS
С использованием химического перекрестного сшивания, масс-спектрометрии MALDI больших масс и масс-спектрометрии nLC-Orbitrap охарактеризовали интерфейс взаимодействия между антигеном HNL и моноклональным антителом анти-HNL MAB1. Эпитоп этого моноклонального антитела включает в себя следующие аминокислоты на антигене HNL: 144; 145; 154. На антителе паратоп включает в себя следующие аминокислоты: тяжелая цепь: 80; 86.
Антитело анти-HNL MAB2
После перекрестного сшивания пептиды, полученные в результате мультиферментативного протеолиза, охватывают 95% от всей последовательности антигена. С использованием предоставленных гибридом анти-HNL MAB2 было осуществлено секвенирование кДНК со следующим результатом:
Вариабельная область легкой цепи:
DIVLTQSTSSLSVSLGDRVTINCRASQDISNYLNWYQEKPDGTVKLLIYFTSRLHSGVPSRFSGSGSGTDYSLTITNLEQEDIATYFCQQGNTLPWTFGGGTKLEIKRADAAPTV
Вариабельная область тяжелой цепи:
EVQLEESGPGLVAPSQSLSITCTISGFSLTSYGIHWLRQPPGKDLEWLVVIWGDGSTTSNSALKSRLSISKDNSKSQVFFKMSGLQTDDTAIYYCARHRYSDYHAMDYWGPGTSVTVS
С использованием химического перекрестного сшивания, масс-спектрометрии MALDI больших масс и масс-спектрометрии nLC-Orbitrap охарактеризовали интерфейс взаимодействия между антигеном HNL и моноклональным антителом анти-HNL MAB2. Анализ указывает на то, что эпитоп этого моноклонального антитела включает в себя следующие аминокислоты на антигене HNL: 83; 88; 145; 154. На антителе паратоп включает в себя следующие аминокислоты: тяжелая цепь: 76; легкая цепь: 114.
Антитело анти-HNL MAB3
После перекрестного сшивания пептиды, полученные в результате мультиферментативного протеолиза, охватывают 95% от всей последовательности антигена. С использованием предоставленных гибридом анти-HNL MAB3 было осуществлено секвенирование кДНК со следующим результатом:
Вариабельная область легкой цепи:
DIVLTQTTSSLSVSLGDRVTINCRASQDISNYLNWYQEKPDGTVKLLIYFTSRLHSGVPSRFSGSGSGTDYSLTITNLEQEDIATYFCQQGNTLPWTFGGGTKLEIKRADAAPTV
Вариабельная область тяжелой цепи:
EVKLQESGPGLVAPSQSLSITCTISGFSLTSYGIHWLRQPPGKDLEWLVVIWGDGSTTSNSALKSRLSISKDNSKSQVFFKMSGLQTDDTAIYYCARHRYSDYHAMDYWGPGTSVTVSS
С использованием химического перекрестного сшивания, масс-спектрометрии MALDI больших масс и масс-спектрометрии nLC-Orbitrap охарактеризовали интерфейс взаимодействия между антигеном HNL и моноклональным антителом анти-HNL MAB3. Анализ указывает на то, что эпитоп этого моноклонального антитела включает в себя следующие аминокислоты на антигене HNL: 145; 154. На антителе паратоп включает в себя следующие аминокислоты: легкая цепь: 74; 76; 85.
2. Анализ клинических образцов с использованием анти-HNL антител
Высокая дискриминационная способность HNL лучше всего видна при измерениях в сыворотке, а не в ЭДТА-плазме, что, по-видимому, означает, что нейтрофилы в тестовой пробирке ex vivo продолжают высвобождать HNL после получения сыворотки. Эта активность высвобождения отражает состояние активации нейтрофилов, которая была вызвана бактериальным заражением, а не вирусами. Для получения пользы в отделении неотложной помощи или в кабинете врача общее время анализа от забора крови до результата по любому биомаркеру должно быть небольшим, то есть <15-20 минут, что является основным принципом при разработке анализов для исследования по месту лечения (POC). Такие требования являются достаточно сложными для измерения HNL в сыворотке, поскольку, как указанно выше, оно требует достаточно продолжительной предварительной активации нейтрофилов. Была исследована возможность того, что активация нейтрофилов в крови хорошо известным активатором нейтрофилов трипептидом fMLP позволит обойти эту проблему. Активатор нейтрофилов используют для имитации активации нейтрофилов, происходящей во время коагуляции цельной крови, и он заменяет требование в отношении измерения HNL в сыворотке после продолжительной инкубации.
В этом примере кровь получали от большой когорты пациентов с признаками острой инфекции для сравнения диагностической эффективности концентраций HNL в цельной крови после активации с помощью fMLP с диагностической эффективностью HNL в неактивированной плазме. Кроме того, диагностическую эффективность теста на HNL с использованием этого принципа сравнивали с диагностической эффективностью современных тестов, таких как количество нейтрофилов в крови, CRP, экспрессия на нейтрофилах IgG1-рецептора CD64 и прокальцитонин.
Активация нейтрофилов с помощью fMLP
Нейтрофилы, очищенные из крови пациентов и здоровых, подвергали воздействию различных концентраций fMLP и инкубировали в течение 15 мин при 37°C, а затем центрифугировали и анализировали супернатант на присутствие HNL. Оптимальная концентрация для высвобождения fMLP оказалась равной 5×10-8 моль/л. Для изучения кинетики высвобождения HNL очищенные клетки инкубировали в течение различных промежутков времени. Значительное высвобождение наблюдалось после 5 минут инкубации и дополнительно увеличивалось при длительной инкубации (фиг. 2).
Для тестирования возможности того, что склонность к высвобождению нейтрофилов после инкубации с fMLP отражает высвобождение HNL в цельной крови после коагуляции, высвобождение HNL из нейтрофилов, очищенных от 23 пациентов с острыми инфекциями и 20 здоровых субъектов, сравнивали с концентрациями HNL в сыворотке у соответствующих субъектов. Как можно видеть из фиг. 3, была получена значимая и линейная корреляция (r=0,743, p=0,002) между концентрациями HNL в супернатанте и сыворотке.
Клинические результаты
Гепаринизированную цельную кровь и ЭДТА-плазму получали от 600 пациентов с симптомами острой инфекции и от 144 по-видимому неинфицированных здоровых субъектов. Без знания о результатах в отношении исследуемых биомаркеров (HNL, PCT и экспрессия CD64 на нейтрофилах крови) инфицированных пациентов классифицировали по клиническим признакам, как имеющих бактериальную или вирусную причину заболевания. Эта классификация включала знание концентраций CRP и белых кровяных клеток и лейкограмм. 240 пациентов были классифицированы как имеющие бактерию или вирус в качестве вероятной причины их инфекций, и о 325 пациентах было решено, что причина их инфекций является возможной или неопределенной. 35 пациентов имели микоплазму в качестве причины их инфекций. У пациентов с вероятной причиной их инфекции инфекцию подтверждали с помощью объективных тестов, таких как бактериальное культивирование, и/или ПЦР, и/или другие объективные тесты. Также в диагностирование включали CRP и количество белых кровяных клеток. Эта последняя группа пациентов, без имеющих микоплазматическую инфекцию, составила всего 384 субъекта (здоровые: 144, бактериальные инфекции: 185, вирусные инфекции: 55) и представляла собой группу, использованную в этом отчете для исследования диагностической эффективности биомаркеров.
Диагностическая эффективность HNL для диагностирования острой бактериальной инфекции
На фиг. 4 a и b показаны концентрации HNL в цельной крови после активации с помощью fMLP в течение 20 мин при 37°C и в ЭДТА-плазме. По сравнению с концентрациями HNL в fMLP-активированной цельной крови здоровых субъектов (геометрическое среднее 98 мкг/л, 95% ДИ 90-107 мкг/л) концентрации у пациентов с бактериальными (геометрическое среднее 337 мкг/л, 95% ДИ 300-379 мкг/л) (p<0,0001) и вирусными инфекциями (геометрическое среднее 117 мкг/л, 95% ДИ 101-136 мкг/л) (p<0,05) были значительно повышенными.
Концентрации HNL в плазме здоровых субъектов составляли 35 мкг/л (геометрическое среднее, 95% ДИ 34-36 мкг/л) при значительно более высоких концентрациях у пациентов с бактериальными инфекциями, 64 мкг/л (геометрическое среднее, 95% ДИ 60-69) (p<0,0001), и у пациентов с вирусными инфекциями, 43 мкг/л (геометрическое среднее 95% ДИ 38-49) (p=0,0001). Очевидно, что перекрывание между здоровыми и имеющими бактериальные инфекции больше для ЭДТА-плазмы. В среднем дополнительное количество HNL, высвобождаемое из нейтрофилов в цельной крови, активированной fMLP, оказалось 2,8-кратным для здоровых субъектов, 5,3-кратным для пациентов с бактериальными инфекциями и 2,7-кратным для пациентов с вирусными инфекциями. Таким образом, не наблюдали никакого дополнительного высвобождения HNL по сравнению со здоровыми субъектами в fMLP-активированной цельной крови.
Фиг. 5 a и b показывают диагностическую эффективность двух анализов на HNL, то есть в fMLP-активированной цельной крови и в ЭДТА-плазме. На фиг. 5a различие между здоровыми неинфицированными субъектами и субъектами с подтвержденной бактериальной инфекцией показано с помощью рабочих характеристических (ROC) кривых. Площадь под кривой (AUC) для теста на HNL на fMLP-активированной цельной крови составила 0,95 (95% 0,91-0,97) по сравнению с 0,88 (95% ДИ 0,84-0,91), p=0,0003 для теста на HNL на ЭДТА-плазме. Для fMLP-активированной цельной крови прогностическое значение отрицательного результата (NPV) при 125 мкг/л HNL составляло 90% (95% ДИ 82-96%), а значение положительного результата 83% (95% ДИ 77-89%). Для ЭДТА-плазмы при концентрации HNL, составляющей 40 мкг/л, NPV составляло 86% (95% ДИ 72-95%), а PPV 63% (95% ДИ 57-69%). При различении между бактериальными и вирусными инфекциями AUC для fMLP-активированной цельной крови составляло 0,92 (95% ДИ 0,87-0,96), а для ЭДТА-плазмы 0,79 (95% ДИ 0,71-0,85), p=0,0006. При концентрации, составляющей 110 мкг/л, NPV составляло 93% (95% ДИ 68-100%), а PPV 85% (77-90%) для fMLP-активированной цельной крови. Соответствующие значения для HNL при концентрации в ЭДТА-плазме, составляющей 40 мкг/л, составляли NPV 52% (95% ДИ 37-67%), а PPV 85% (95% ДИ 78-90%). NPV не превышало 60% при любой концентрации HNL в ЭДТА-плазме. Таким образом, клиническая эффективность HNL в fMLP-активированной цельной крови оказалась выше, чем у HNL в ЭДТА-плазме как при различении между здоровыми субъектами и бактериальными инфекциями, так и при различении между бактериальными и вирусными инфекциями.
Диагностическая эффективность CRP, количества нейтрофилов в крови, экспрессии CD64 на нейтрофилах и прокальцитонина для диагностирования острой бактериальной инфекции
Фиг. 6 a-d показывают распределение биомаркеров CRP, количества нейтрофилов в крови, экспрессии CD64 на нейтрофилах крови и прокальцитонина в исследованных популяциях. За исключением количеств нейтрофилов, все другие биомаркеры были значительно повышенными как при бактериальных, так и вирусных инфекциях по сравнению со здоровыми субъектами (p<0,0001). Все биомаркеры были значительно выше при бактериальных инфекциях, чем при вирусных (p<0,0001). Средние концентрации показаны в таблице 1.
Таблица 1. Концентрации и величины экспрессии четырех биомаркеров.
мг/L
109/л
(0,90-1,26)
(3,38-3,81)
(0,65-0,75)
(0,038-0,047)
(68,8-95,4)
(7,60-8,88)
(2,78-3,52)
(0,205-0,335)
(14,7-29,0)
(3,23-4,53)
(1,26-2,01)
(0,093-0,149)
AUC приведены в таблице 2. При различении между здоровыми и имеющими бактериальные инфекции четыре биомаркера продемонстрировали AUC>90, и это были CRP, HNL в fMLP-активированной цельной крови, экспрессия CD64 на нейтрофилах крови и количество нейтрофилов в крови. AUC HNL в активированной fMLP цельной крови была значительно выше, чем AUC HNL в ЭДТА-плазме (p<0,001) и прокальцитонин (p<0,05), и AUC экспрессии CD64 на нейтрофилах была выше, чем у HNL в ЭДТА-плазме (p=0,002), но не значительно отличалась от PCT (p=0,06). CRP продемонстрировал наивысшую AUC, но статистика не была рассчитана из-за имеющегося риска смещения.
При различении между бактериальными и вирусными инфекциями только AUC fMLP-активированной цельной крови составляла >90%. Она значительно отличалась от HNL в ЭДТА-плазме (p=0,003), экспрессии CD64 на нейтрофилах и прокальцитонина (p<0,0001 для обоих сравнений). AUC HNL в ЭДТА-плазме была значительно выше, чем у прокальцитонина (p=0,01).
Таблица 2. Площади под ROC-кривыми для всех исследованных биомаркеров
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> KONINKL PHILIPS ELECTRONICS NV
<120> Связывающие HNL средства и их применения
<130> 2014PF00930
<160> 26
<170> PatentIn version 3.5
<210> 1
<211> 198
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Pro Leu Gly Leu Leu Trp Leu Gly Leu Ala Leu Leu Gly Ala Leu
1 5 10 15
His Ala Gln Ala Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro
20 25 30
Leu Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln
35 40 45
Gly Lys Trp Tyr Val Val Gly Leu Ala Gly Asn Ala Ile Leu Arg Glu
50 55 60
Asp Lys Asp Pro Gln Lys Met Tyr Ala Thr Ile Tyr Glu Leu Lys Glu
65 70 75 80
Asp Lys Ser Tyr Asn Val Thr Ser Val Leu Phe Arg Lys Lys Lys Cys
85 90 95
Asp Tyr Trp Ile Arg Thr Phe Val Pro Gly Cys Gln Pro Gly Glu Phe
100 105 110
Thr Leu Gly Asn Ile Lys Ser Tyr Pro Gly Leu Thr Ser Tyr Leu Val
115 120 125
Arg Val Val Ser Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys
130 135 140
Lys Val Ser Gln Asn Arg Glu Tyr Phe Lys Ile Thr Leu Tyr Gly Arg
145 150 155 160
Thr Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser
165 170 175
Lys Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile
180 185 190
Asp Gln Cys Ile Asp Gly
195
<210> 2
<211> 116
<212> БЕЛОК
<213> Mus musculus
<400> 2
Asp Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Asp Ser Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Ile Thr Asp
20 25 30
Leu His Trp Tyr Gln Gln Arg Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Ser Ala Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Val Glu Thr
65 70 75 80
Glu Asp Phe Gly Met Tyr Phe Cys Gln Gln Ser Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser
115
<210> 3
<211> 116
<212> БЕЛОК
<213> Mus musculus
<400> 3
Val Gln Leu Gln Glu Ser Gly Pro Asp Leu Val Ala Pro Ser Gln Ser
1 5 10 15
Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Gly
20 25 30
Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu Ile
35 40 45
Val Met Trp Ser Asp Gly Ser Thr Thr Ser Asn Ser Ala Leu Lys Ser
50 55 60
Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
65 70 75 80
Val Asn Ser Leu Gln Ser Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Arg
85 90 95
His Tyr Gly Tyr Phe Thr Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser
115
<210> 4
<211> 115
<212> БЕЛОК
<213> Mus musculus
<400> 4
Asp Ile Val Leu Thr Gln Ser Thr Ser Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Glu Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Phe Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Thr Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val
115
<210> 5
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 5
Glu Val Gln Leu Glu Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Ile Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Ile His Trp Leu Arg Gln Pro Pro Gly Lys Asp Leu Glu Trp Leu
35 40 45
Val Val Ile Trp Gly Asp Gly Ser Thr Thr Ser Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Ser Gly Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg His Arg Tyr Ser Asp Tyr His Ala Met Asp Tyr Trp Gly Pro Gly
100 105 110
Thr Ser Val Thr Val Ser
115
<210> 6
<211> 115
<212> БЕЛОК
<213> Mus musculus
<400> 6
Asp Ile Val Leu Thr Gln Thr Thr Ser Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Glu Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Phe Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Thr Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val
115
<210> 7
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 7
Glu Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Ile Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Ile His Trp Leu Arg Gln Pro Pro Gly Lys Asp Leu Glu Trp Leu
35 40 45
Val Val Ile Trp Gly Asp Gly Ser Thr Thr Ser Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Ser Gly Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg His Arg Tyr Ser Asp Tyr His Ala Met Asp Tyr Trp Gly Pro Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 8
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 8
Arg Ala Ser Gln Ser Ile Ile Thr Asp Leu His
1 5 10
<210> 9
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 9
Ser Ala Ser Gln Ser Ile Ser
1 5
<210> 10
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 10
Gln Gln Ser Asn Ser Trp Pro Leu Thr
1 5
<210> 11
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 11
Gly Phe Ser Leu Ser Ser Tyr Gly Val His
1 5 10
<210> 12
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 12
Val Met Trp Ser Asp Gly Ser Thr Thr Ser Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 13
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 13
His Tyr Gly Tyr Phe Thr Met Asp Tyr
1 5
<210> 14
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 14
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 15
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 15
Phe Thr Ser Arg Leu His Ser
1 5
<210> 16
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 16
His Arg Tyr Ser Asp Tyr His Ala Met Asp Tyr
1 5 10
<210> 17
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 17
Gly Phe Ser Leu Thr Ser Tyr Gly Ile His
1 5 10
<210> 18
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 18
Val Ile Trp Gly Asp Gly Ser Thr Thr Ser Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 19
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 19
His Arg Tyr Ser Asp Tyr His Ala Met Asp Tyr
1 5 10
<210> 20
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 20
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 21
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 21
Phe Thr Ser Arg Leu His Ser
1 5
<210> 22
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 22
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 23
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 23
Gly Phe Ser Leu Thr Ser Tyr Gly Ile His
1 5 10
<210> 24
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 24
Val Ile Trp Gly Asp Gly Ser Thr Thr Ser Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 25
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 25
His Arg Tyr Ser Asp Tyr His Ala Met Asp Tyr
1 5 10
<210> 26
<211> 72
<212> БЕЛОК
<213> Homo sapiens
<400> 26
Ser Tyr Asn Val Thr Ser Val Leu Phe Arg Lys Lys Lys Cys Asp Tyr
1 5 10 15
Trp Ile Arg Thr Phe Val Pro Gly Cys Gln Pro Gly Glu Phe Thr Leu
20 25 30
Gly Asn Ile Lys Ser Tyr Pro Gly Leu Thr Ser Tyr Leu Val Arg Val
35 40 45
Val Ser Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Lys Val
50 55 60
Ser Gln Asn Arg Glu Tyr Phe Lys
65 70
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| САПОВИРУСНЫЕ ВАКЦИНЫ | 2022 |
|
RU2839769C2 |
| НЕ ОТНОСЯЩИЕСЯ К ЧЕЛОВЕКУ ЖИВОТНЫЕ, ЭКСПРЕССИРУЮЩИЕ ГУМАНИЗИРОВАННЫЙ КОМПЛЕКС CD3 | 2015 |
|
RU2726446C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2808018C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2698131C2 |
| ВАКЦИНЫ НА ОСНОВЕ РЕОВИРУСОВ ПТИЦ | 2015 |
|
RU2724497C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ИММУНИЗАЦИИ СВИНЕЙ ПРОТИВ ЦИРКОВИРУСА ТИПА 3 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2016 |
|
RU2771533C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ИММУНИЗАЦИИ СВИНЕЙ ПРОТИВ ЦИРКОВИРУСА ТИПА 3 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803427C1 |
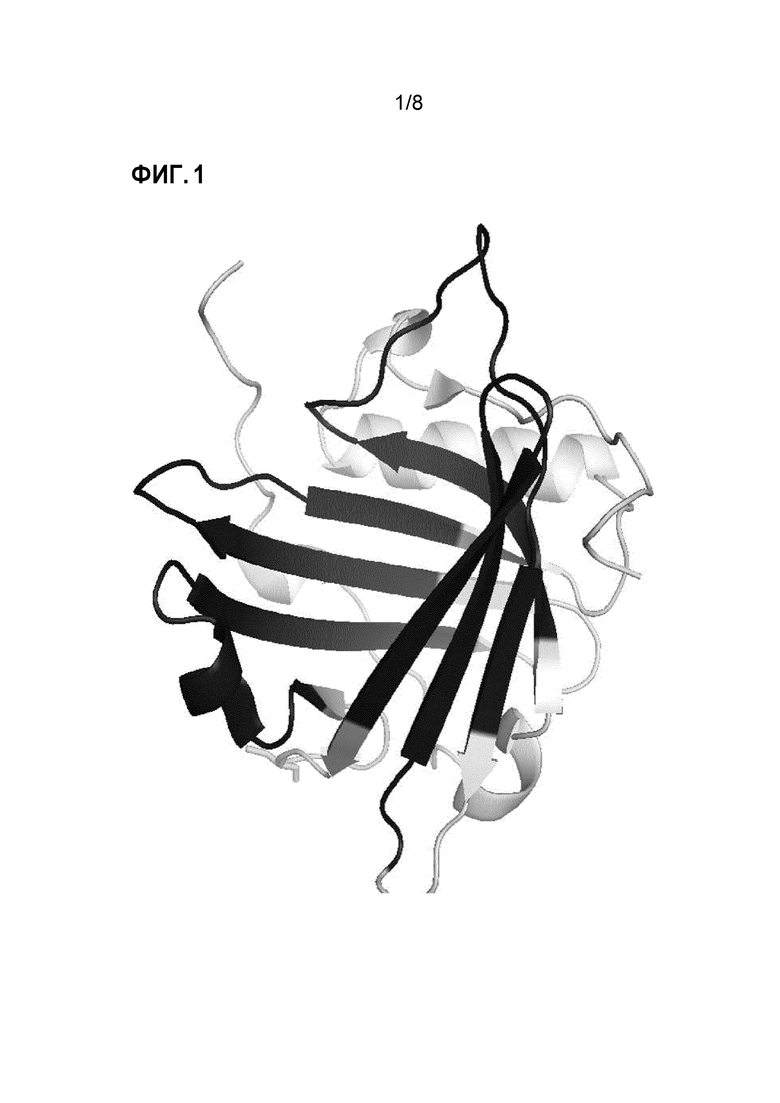
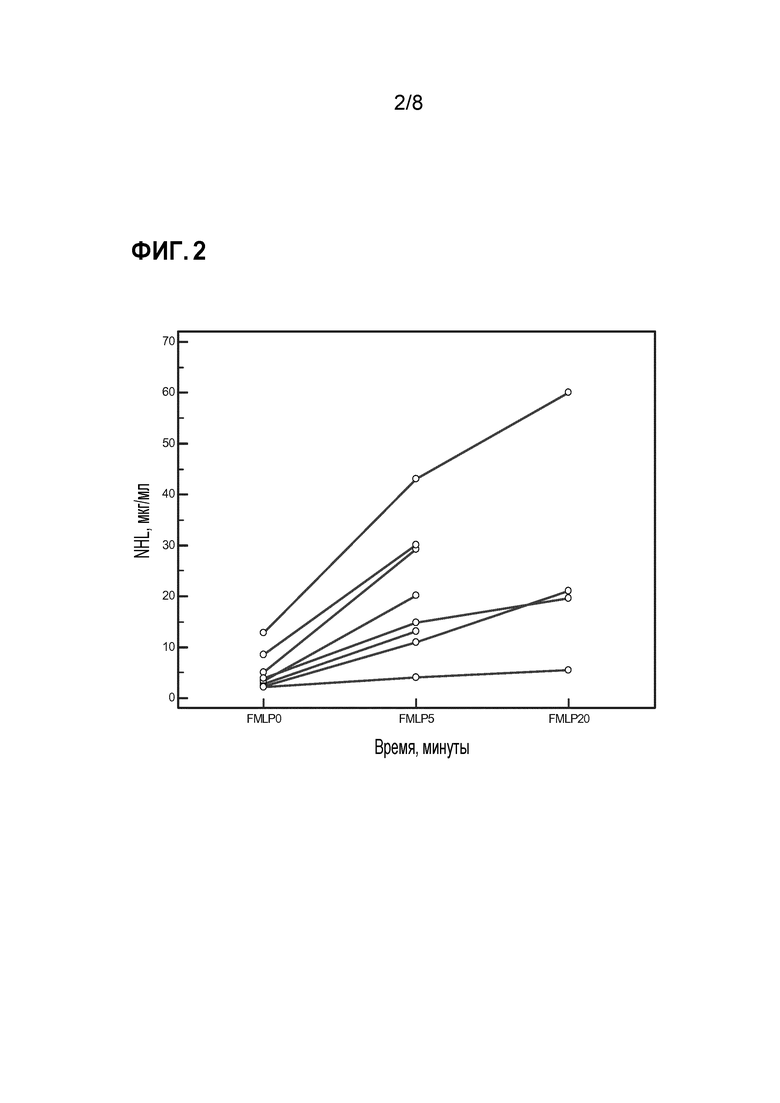
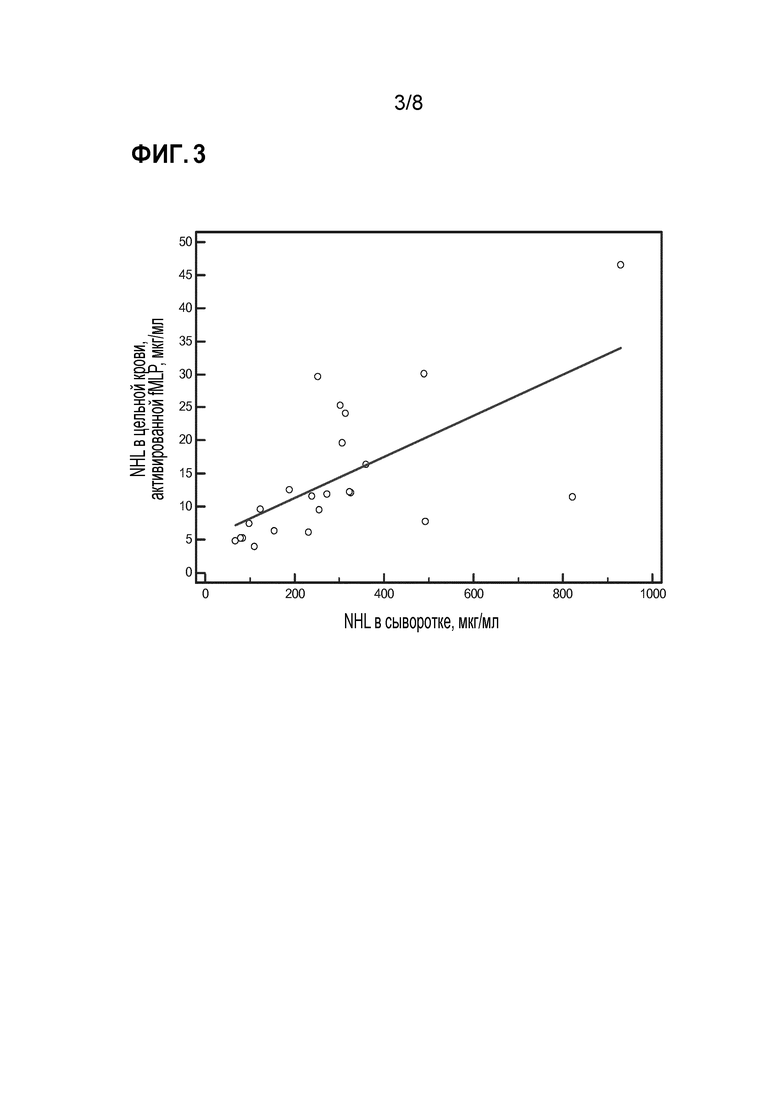
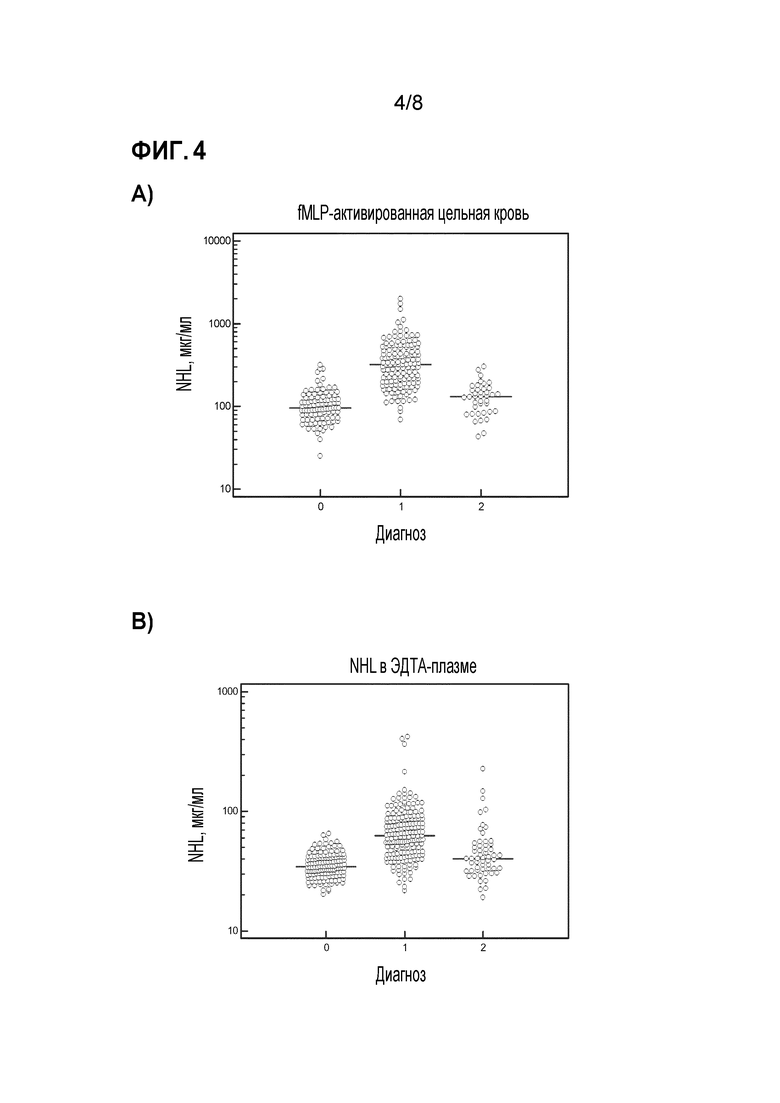
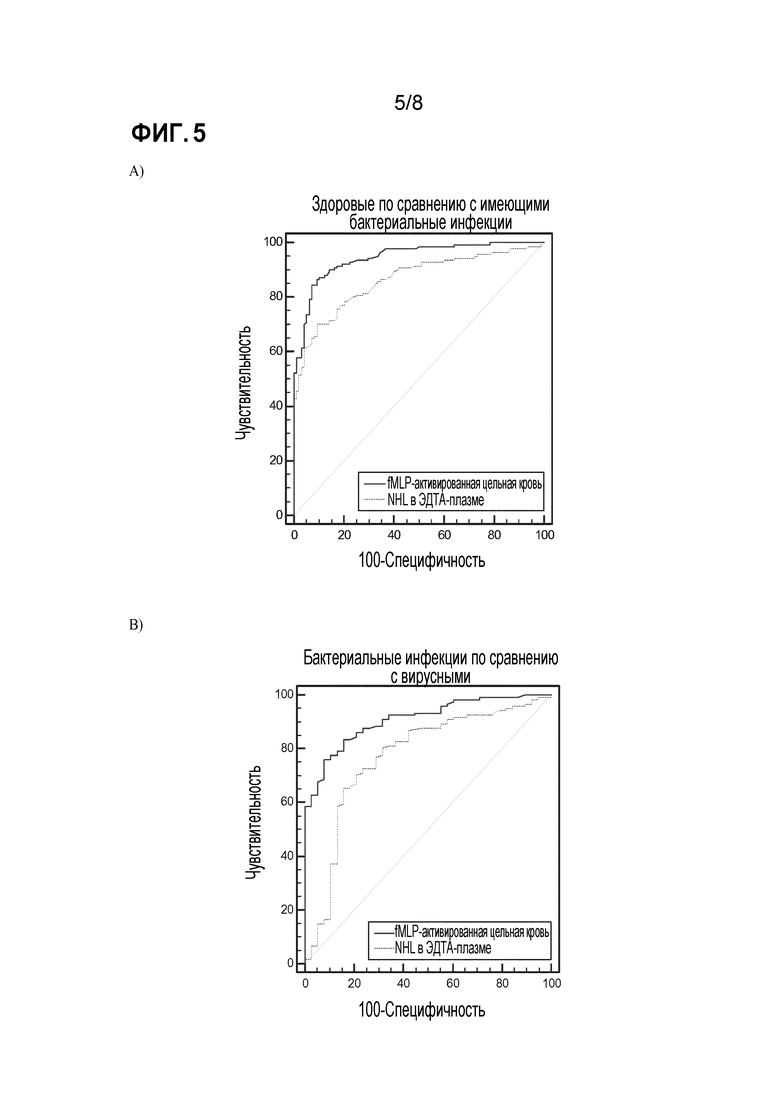
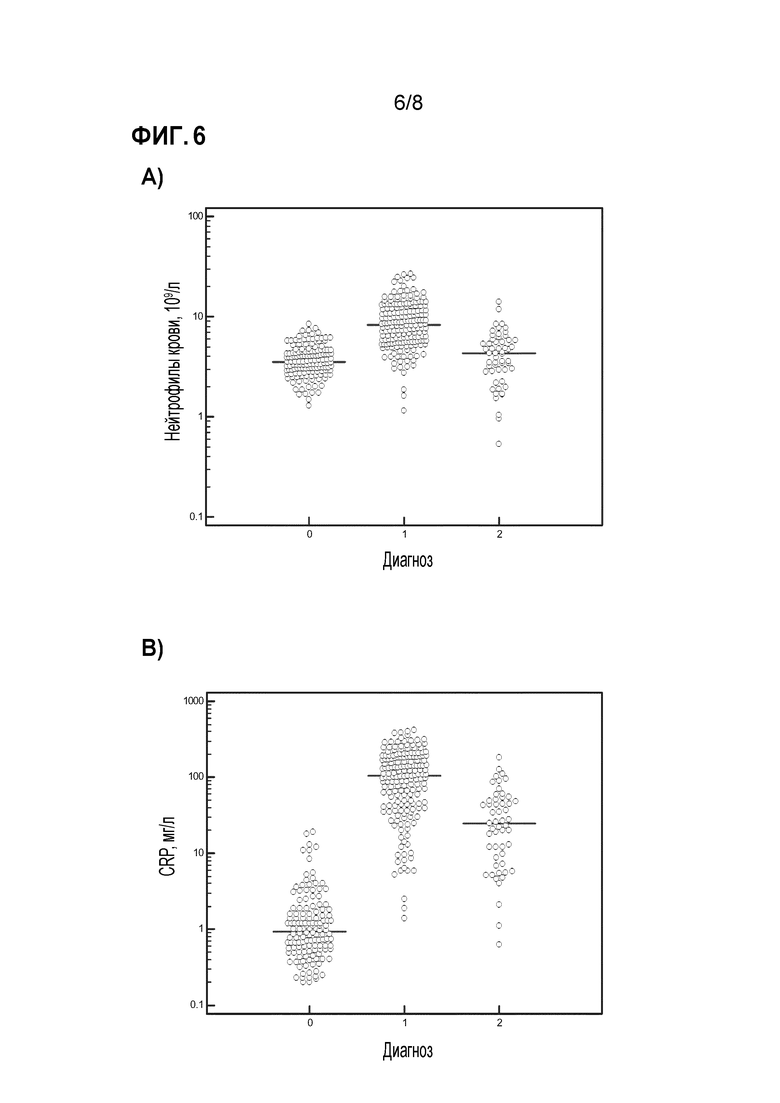
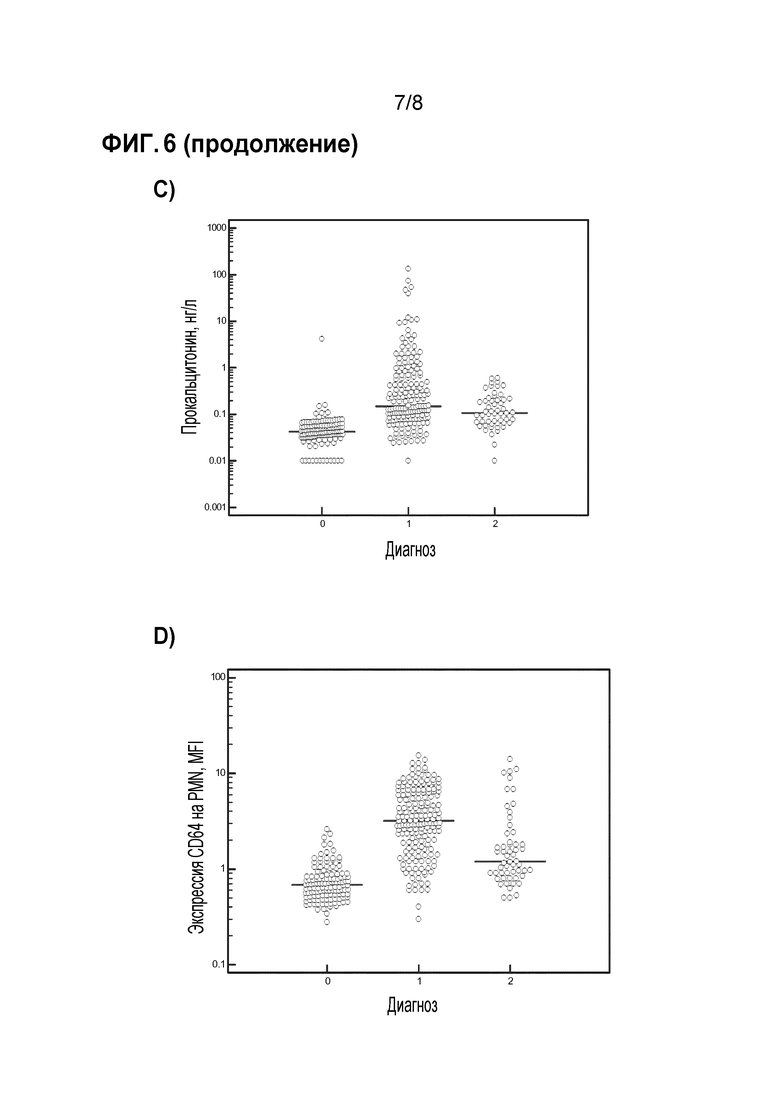
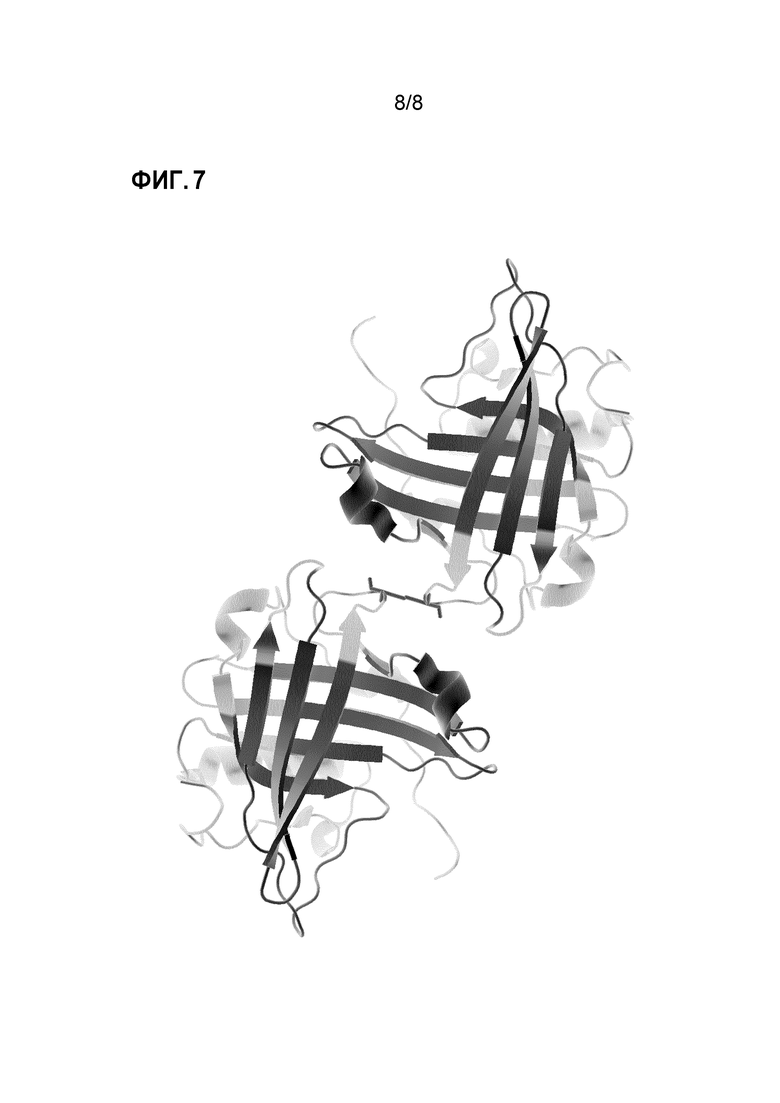
Настоящее изобретение относится к области иммунологии. Предложено антитело, способное к специфическому связыванию с полипептидным эпитопом HNL. Кроме того, рассмотрена диагностическая композиция, диагностический набор, способ диагностирования бактериальной инфекции, способ исключения бактериальной инфекции, способ исключения вирусной инфекции. Также предложен способ подтверждения бактериальной инфекции, способ подтверждения вирусной инфекции, способ различения между бактериальной или смешанной инфекцией и вирусной инфекцией, способ исключения инфекционного заболевания, способ идентификации типа инфекции, устройство для диагностирования бактериальных инфекций. Данное изобретение может найти дальнейшее применение в детектировании специфических эпитопов липокалина нейтрофилов человека (HNL) и диагностировании бактериальной инфекции. 13 н. и 1 з.п. ф-лы, 7 ил., 3 табл., 2 пр.
1. Антитело, способное к специфическому связыванию с полипептидным эпитопом HNL, где упомянутый полипептидный эпитоп содержит аминокислоты 141-156 HNL, определенного в SEQ ID NO: 1, или где упомянутый полипептидный эпитоп представляет собой конформационный эпитоп, охватываемый пептидом в соответствии с SEQ ID NO: 26, и где антитело содержит шесть связывающих эпитоп областей последовательности аминокислот, которые изображены в SEQ ID NO: 8-13, 14-19 или 20-25.
2. Антитело по п. 1, где тяжелая цепь имеет последовательность, выбранную из группы последовательностей, изображенных в SEQ ID NO: 3, 5 и 7,
и легкая цепь имеет последовательность, выбранную из группы последовательностей, изображенных в SEQ ID NO: 2, 4 и 6.
3. Диагностическая композиция для детектирования бактериальной инфекции, содержащая эффективное количество антитела, определенного в п. 1 или 2.
4. Диагностический набор для детектирования бактериальной инфекции, содержащий контейнеры, содержащие антитело, упомянутое в любом из предшествующих пунктов, необязательно, инструкции по применению, буферы и устройство для анализа образцов крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты.
5. Способ диагностирования бактериальной инфекции или отличения бактериальной инфекции от вирусной инфекции, отличающийся тем, что образец крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученный от субъекта, который, как полагают, имеет бактериальную или вирусную инфекцию, анализируют на уровень HNL с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4, где упомянутый способ включает:
a) инкубирование образца в присутствии упомянутого антитела;
b) необязательно, смывание несвязанного материала образца;
c) измерение уровня HNL в образце от субъекта, который, как полагают, имеет бактериальную или вирусную инфекцию;
d) сравнение уровня HNL, измеренного на этапе c), с контрольным уровнем;
e) диагностирование бактериальной инфекции, когда уровень HNL на этапе c) значительно выше, чем уровень, детектированный в контрольных образцах (i) здоровых субъектов и (iii) пациентов, о которых известно, что они имеют вирусную инфекцию,
и где данный способ, необязательно, дополнительно включает
сравнение уровня HNL, измеренного на этапе c), с одним или несколькими контрольными образцами, полученными от
i) здоровых субъектов,
ii) субъектов, о которых известно, что они имеют бактериальную инфекцию, и
iii) субъектов, о которых известно, что они имеют вирусную инфекцию.
6. Способ исключения бактериальной инфекции у субъекта, включающий:
a) измерение концентрации полипептида HNL в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта, с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4; и
b) исключение бактериальной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
7. Способ исключения вирусной инфекции у субъекта, включающий:
a) измерение концентрации полипептида HNL в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта, с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4; и
b) исключение вирусной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение.
8. Способ подтверждения бактериальной инфекции у субъекта, включающий:
a) измерение концентрации полипептида HNL в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта, с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4; и
b) подтверждение бактериальной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), выше, чем предварительно определенное первое пороговое значение.
9. Способ подтверждения вирусной инфекции у субъекта, включающий
a) измерение концентрации полипептида HNL в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта, с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4; и
b) подтверждение вирусной инфекции у субъекта, если концентрация полипептида HNL, определенная на этапе (a), ниже, чем предварительно определенное первое пороговое значение.
10. Способ различения между бактериальной или смешанной инфекцией и вирусной инфекцией у субъекта, включающий:
a) измерение концентрации полипептида HNL с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4, и CRP, необязательно TRAIL, в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта;
b) применение предварительно определенной математической функции к концентрациям HNL, и CRP, и, необязательно, TRAIL для вычисления балльной оценки;
c) сравнение балльной оценки с предварительно определенным эталонным значением.
11. Способ исключения инфекционного заболевания, предпочтительно бактериального или вирусного заболевания, у субъекта, включающий:
a) измерение концентрации полипептида HNL с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4, и концентрации полипептида одного или нескольких полипептидов, выбранных из группы, состоящей из TRAIL, IP10, ILIRa или Mac-2BP, в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта;
b) применение предварительно определенной математической функции к измеренным концентрациям полипептидов для вычисления балльной оценки;
c) сравнение балльной оценки с предварительно определенным эталонным значением.
12. Способ идентификации типа инфекции, предпочтительно бактериальной или вирусной инфекции, у субъекта, включающий:
a) измерение концентрации полипептида HNL с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4 и уровней первой полипептидной детерминанты, выбранной из группы, состоящей из TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксина, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанных с IgG молекул, IL1, I-TAC и TNFR1, в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта; и
b) измерение уровней второй детерминанты, выбранной из группы, состоящей из
(i) полипептидных детерминант TRAIL, IL1RA, IP10, Mac-2BP, B2M, BCA-1, CHI3L1, эотаксина, IL1a, MCP, CD62L, VEGFR2, CHP, CMPK2, CORO1C, EIF2AK2, ISG15, RPL22L1, RTN3, CD112, CD134, CD182, CD231, CD235A, CD335, CD337, CD45, CD49D, CD66A/C/D/E, CD73, CD84, EGFR, GPR162, HLA-A/B/C, ITGAM, NRG1, RAP1B, SELI, SPINT2, SSEA1, неспецифически связанных с IgG молекул, IL1, I-TAC и TNFR1;
(ii) полипептидных детерминант IFITM3, IFIT3, EIF4B, IFIT1, LOC26010, MBOAT2, MX1, OAS2, RSAD2, ADIPOR1, CD15, CD8A, IFITM1 и IL7;
(iii) полипептидных детерминант CRP, SAA, TREM-1, PCT, IL-8, TREM-1 и IL6; или
(iv) неполипептидных детерминант возраста, абсолютного количества нейтрофилов (ANC), абсолютного количества лимфоцитов (ALC), % нейтрофилов (Neu (%)), % лимфоцитов (Lym (%)), % моноцитов (Mono (%)), максимальной температуры, времени, прошедшего после симптомов, креатинина (Cr), калия (K), пульса и мочевины;
c) сравнение уровней HNL, первой и второй детерминант с эталонным значением, посредством чего идентифицируют тип инфекции у субъекта, причем измерение первой и/или второй детерминанты повышает точность идентификации типа инфекции по измерению HNL.
13. Способ идентификации типа инфекции, предпочтительно бактериальной или вирусной инфекции, у субъекта, включающий:
a) измерение концентрации полипептида HNL с использованием антитела, определенного в п. 1 или 2, или диагностической композиции или набора по п. 3 или 4, и уровней одной или нескольких полипептидных детерминант, выбранных из группы, состоящей из ABTB1, ADIPOR1, ARHGDIB, ARPC2, ATP6V0B, Clorf83, CD15, CES1, CORO1A, CSDA, EIF4B, EPSTI1, GAS 7, HERC5, IFI6, KIAA0082, IFIT1, IFIT3, IFITM1, IFITM3, LIPT1, IL7R, ISG20, LOC26010, LY6E, LRDD, LTA4H, MAN1C1, MBOAT2, NPM1, OAS2, PARP12, PARP9, QARS, RAB13, RAB31, RAC2, RPL34, PDIA6, PTEN, RSAD2, SART3, SDCBP, SMAD9, SOCS3, TRIM22, SART3, UBE2N, XAF1, ZBP1, CRP и MX1, в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, полученном от субъекта; и
b) сравнение уровней HNL и одной или нескольких полипептидных детерминант с эталонным значением, посредством чего идентифицируют тип инфекции у субъекта,
и где данный способ, необязательно,
дополнительно включает измерение одной или нескольких неполипептидных детерминант, выбранных из группы, состоящей из возраста, абсолютного количества нейтрофилов (ANC), абсолютного количества лимфоцитов (ALC), % нейтрофилов (Neu (%)), % лимфоцитов (Lym (%)), % моноцитов (Mono (%)), максимальной температуры, времени, прошедшего после симптомов, креатинина (Cr), калия (K), пульса и мочевины.
14. Устройство для диагностирования бактериальных инфекций в образце крови, плазмы, сыворотки, мочи, CSF, костного мозга, слюны или мокроты, содержащее отсек, содержащий антитело по п. 1 или 2, причем упомянутый отсек подходит для приведения в контакт с упомянутым образцом, необязательно содержащее отсек, содержащий химический субстрат, способный к активированию нейтрофилов, присутствующих в образце, до последующего анализа, причем упомянутый отсек содержит отверстие, соединяющее его с упомянутым отсеком, содержащим связывающее средство, необязательно содержащее соединитель для соединения упомянутого устройства с другим устройством для забора образца крови у предполагаемого больного, и/или соединитель для объединения упомянутого устройства с компьютером и/или приспособлением для анализа химических, физических или биологических реакций в упомянутом устройстве, причем упомянутые реакции характерны для взаимодействия HNL и упомянутого связывающего средства, что, также необязательно, позволяет определять уровень HNL в упомянутом образце,
и где, необязательно, данное устройство
дополнительно содержит антитело для одной или нескольких из дополнительных полипептидных детерминант, упомянутых в любом из пп. 11-13, причем упомянутые реакции характерны для взаимодействия полипептидных детерминант, и что, также необязательно, позволяет определять уровень упомянутых полипептидных детерминант в упомянутом образце.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| XU S, VENGE P "Lipocalins as biochemical markers of disease", Biochimica et Biophysica Acta, 2000, Vol | |||
| Устройство для ослабления пульсации выпрямленного тока | 1924 |
|
SU1482A1 |
| РАССЕИВАЮЩИЙ ТОПЛИВО МЕХАНИЗМ | 1920 |
|
SU298A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2021-11-01—Публикация
2015-11-19—Подача