Настоящая заявка относится к области биотехнологии, иммунологии, вирусологии, генетики и молекулярной биологии. Более конкретно, настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 (коронавирус 2 типа, вызывающий тяжёлый острый респираторный синдром), экспрессионной кассете и вектору на ее основе, а также к рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, вакцине на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, и их применению для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2.
УРОВЕНЬ ТЕХНИКИ
Коронавирус SARS-CoV-2 (коронавирус 2 типа, вызывающий тяжёлый острый респираторный синдром) относится к роду Betacoronavirus, подроду Sarbecovirus.
Вирус SARS-CoV-2 обнаружен в декабре 2019 года в результате анализа образцов, взятых у пациентов с пневмонией. 31 декабря 2019 года Всемирная организация здравоохранения была оповещена о нескольких случаях вирусной пневмонии, вызванной ранее неизвестным патогеном. Впервые геном вируса был полностью расшифровали в Китае.
Коронавирусы, к которым относится SARS-CoV-2, обычно вызывают острые респираторные заболевания. К этому же семейству относятся вирусы SARS-CoV и MERS-CoV, вызывающие тяжёлый острый респираторный синдром и ближневосточный респираторный синдром соответственно.
Коронавирусом SARS-CoV-2 обусловлена продолжающаяся пандемия COVID-19. В январе 2020 года Всемирная организация здравоохранения объявила вспышку эпидемии, связанной с SARS-CoV-2, чрезвычайной ситуацией в области здравоохранения международного значения, а 11 марта 2020 года охарактеризовала принявшее мировой масштаб распространение болезни как пандемию.
В БД GenBank, Wu F., Severe acute respiratory syndrome coronavirus 2 isolate Wuhan-Hu-1, complete genome, 2020, GenBank: MN908947.3 (https://www.ncbi.nlm.nih.gov/nuccore/MN908947) и в статье Fan Wu ET AL., A new coronavirus associated with human respiratory disease in China, 2020, Nature, volume 579, pages 265–269 (https://www.nature.com/articles/s41586-020-2008-3) представлена информация о геноме SARS-CoV-2.
В патентном документе CN110951756 (B) описаны последовательности нуклеотидных кислот, кодирующие пептид антигена вируса SARS-CoV-2, и указано, что данные последовательности нуклеотидных кислот могут использоваться для индукции соответствующих реакций иммунной защиты, и ожидается, что они будут использованы в вакцинах против SARS-CoV-2.
В патентном документе CN110974950B описана вакцина для предотвращения инфекции SARS-CoV-2, где вакцина содержит аденовирусный вектор Ad5, включающий последовательность нуклеиновой кислоты, кодирующую пептид антигена вируса SARS-CoV-2.
В патентном документе RU2720614 C1 (Национальный исследовательский центр эпидемиологии и микробиологии имени академика Н.Ф. Гамалеи Минздрава России (ФГБУ "НИЦЭМ им. Н.Ф. Гамалеи" Минздрава России)) описана вакцина на основе рекомбинантных аденовирусных частиц 5 и/или 26 серотипа, которые содержат ген белка S вируса SARS-CoV-2.
В патентных документах RU 2733831C1, RU 2733832 C1, RU 2733834 C1, (ФБУН ГНЦ ВБ "Вектор") описаны различные варианты искусственного гена, используемого для создания вакцины против коронавируса SARS-CoV-2, кодирующего искусственный белок-иммуноген, который включает последовательностей рецептор-связывающего домена (RBD) гликопротеина S коронавируса SARS-CoV-2.
В патентном документе RU 2738081 C1 (ФБУН ГНЦ ВБ "Вектор") описаны пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов.
На дату подачи данной заявки, коронавирусом SARS-CoV-2 заболело более 71 миллионов человек, более 1 миллиона 600 тысяч человек умерли от коронавируса SARS-CoV-2. Более того, пандемия COVID-19 продолжается и на дату подачи заявки. Таким образом, существует острая общемировая потребность в эффективных средствах профилактики и лечения заболеваний, вызванных вирусом тяжелого острого респираторного синдрома SARS-CoV-2.
Описание изобретения
Авторами изобретения была разработана кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2, который используется в качестве антигена для эффективной иммунизации млекопитающих с индукцией специфического иммунитета к вирусу SARS-CoV-2, что будет обуславливать профилактику заболеваний, вызванных вирусом SARS-CoV-2. Авторами изобретения также была разработана кассета, экспрессирующая рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2, которая включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту. Авторами изобретения были также разработаны средства доставки вышеуказанного антигена в организм млекопитающего, а именно, экспрессионный вектор, который включает нуклеиновую кислоту, кодирующую вышеуказанный антиген, или вышеуказанную экспрессионную кассету, рекомбинантный вирус на основе AAV5 (аденоассоциированный вирус 5 серотипа), который включает вышеуказанную нуклеиновую кислоту, кодирующую вышеуказанный антиген, или вышеуказанную экспрессионную кассету, вакцины, которые включают вышеуказанные объекты и способы их применения для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2.
Краткое описание изобретения
В одном из аспектов настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, которая представляет собой нуклеотидную последовательность SEQ ID NO: 18.
В одном из аспектов настоящее изобретение относится к кассете, которая экспрессирует рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, которая включает вышеуказанную нуклеиновую кислоту.
В некоторых вариантах кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV (цитомегаловирусный) энхансер;
CMV (цитомегаловирусный) промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах кассета включает нуклеиновую кислоту с нуклеотидной последовательностью SEQ ID NO: 19.
В одном из аспектов настоящее изобретение относится к вектору, который экспрессирует рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO:1, который включает вышеуказанную нуклеиновую кислоту или любую из вышеуказанных кассет.
В одном из аспектов настоящее изобретение относится к выделенному рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, который экспрессирует рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO:1, который включает вышеуказанную нуклеиновую кислоту или любую из вышеуказанных кассет.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с мутациями S2A и T711S.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV (цитомегаловирусный) энхансер;
CMV (цитомегаловирусный) промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеиновую кислоту с SEQ ID NO: 19.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с точечными мутациями S2A и T711S, которая представляет собой аминокислотную последовательностью SEQ ID NO: 5.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2.
В одном из аспектов настоящее изобретение относится к вакцине для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в эффективном количестве.
В одном из аспектов настоящее изобретение относится к способу индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, который включает введение в организм млекопитающих любого из вышеуказанных рекомбинантных вирусов на основе AAV5, вышеуказанной композиции или вышеуказанной вакцины, в эффективном количестве.
Краткое описание чертежей
Краткое описание чертежей
Фигура 1 представляет собой схему плазмиды pAAV-RBD-SCO, предназначенной для получения AAV вектора с экспрессионной кассетой, которая содержит кодон-оптимизированную последовательность гена RBD-S (RBD-SCO) рекомбинантного рецептор-связывающего домена гликопротеина S (RBD-S) вируса SARS-CoV-2, где
Leader peptide - лидерный пептид, обеспечивающий секрецию целевого белка;
RBD-SCO - кодон-оптимизированная последовательность гена рекомбинантного рецептор-связывающего домена гликопротеина S вируса SARS-CoV-2;
AmpR - ген бета-лактамазы, обеспечивающий устойчивость к ампициллину;
pUC origin- pUC ориджин репликации в бактериях;
ITR - инвертированные терминальные повторы;
CMV-Promoter - промотор ранних генов цитомегаловируса;
Poly A - последовательность сигнала полиаденилирования, для повышения стабильности мРНК;
HBG Intron - (human beta globine intron), фрагмент гена β глобина человека, несущий интрон.
Фигура 2 представляет собой график, показывающий концентрацию белка RBD-S в культуральной жидкости спустя 7 дней после трансдукции клеток CHO-K1-S вирусными препаратом AAV5-RBD-S, несущим ген RBD-S дикого типа (AAV5-RBD-SWT) и препаратом AAV5-RBD-S, несущим кодон-оптимизированный ген RBD-S (AAV5-RBD-SCO).
MOI (Multiplicity of infection) - количество вирусных геномов на одну клетку.
*** - p-value < 0,001.
Статистический анализ проведен с помощью one-way ANOVA.
Фигура 3 представляет собой график, который показывает содержание антител к белку RBD-S в плазме крови экспериментальных животных после проведения иммунизации препаратом AAV5-RBD-S, несущим ген RBD-S дикого типа (AAV5-RBD-SWT) и препаратом AAV5-RBD-S, несущим кодон-оптимизированный ген RBD-S (AAV5-RBD-SCO) (внутримышечное введение из расчета 1.0х1011 VG/мышь; объем введения – 200 мкл). Средние значения ± стандартная ошибка (n=8).
Viral genomes или вирусные геномы.
*** - p-value < 0,001.
* - p-value < 0,05.
Статистический анализ проведен с помощью one-way ANOVA.
Фигура 4 представляет собой график, который показывает содержание антител к белку RBD-S в плазме крови экспериментальных животных после проведения иммунизации препаратом очищенного рекомбинантного белка RBD-S. Внутримышечное введение из расчета 20 мкг/мышь).
А - индивидуальные показатели для каждого животного в исследовании.
Б - средние значения ± стандартная ошибка (n=7).
Фигура 5 представляет собой график, который показывает результаты определения содержания антител к белку RBD-S в плазме крови экспериментальных животных после проведения иммунизации препаратом AAV5, геном которого не содержит экспрессионную кассету с геном RBD-S (препарат с пустыми капсидами AAV5). Внутримышечное введение из расчета 4.3×1011 CP/мышь; объем введения - 200 мкл).
CP - viral capsids или вирусные капсиды.
Фигура 6 представляет собой график, который показывает результаты определения содержания антител к белку RBD-S в плазме крови экспериментальных животных после проведения иммунизации контрольным препаратом, не содержащим AAV. На графике приведены индивидуальные показатели для каждого животного в исследовании.
Фигура 7 представляет собой график, который показывает результаты определения нейтрализующей активности антител к нативному вирусу SARS-CoV-2 в образцах сыворотки крови экспериментальных животных.
** - p-value < 0,002.
**** - p-value < 0,0001.
Статистический анализ проведен с помощью one-way ANOVA.
AAV5-RBD-SWT – образцы сыворотки крови животных, иммунизированных препаратом AAV5-RBD-S, несущим ген RBD-S дикого типа (AAV5-RBD-SWT).
AAV5-RBD-SCO - образцы сыворотки крови животных, иммунизированных препаратом AAV5-RBD-S, несущим кодон-оптимизированный ген RBD-S (AAV5-RBD-SCO).
Placebo - образцы сыворотки крови животных, иммунизированных препаратом, не содержащим AAV.
AAV5 empty - образцы сыворотки крови животных, иммунизированных препаратом AAV5, геном которого не содержит экспрессионную кассету с геном RBD-S (препарат с пустыми капсидами AAV5).
RBD-S - образцы сыворотки крови животных, иммунизированных препаратом очищенного рекомбинантного белка RBD-S.
RC - образцы сыворотки крови COVID-19 реконвалесцентов.
Определения и общие методы
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы культивирования клеток, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
«Выделенный» означает измененный или удаленный из природного состояния. Например, нуклеиновая кислота или пептид, в природе присутствующие в животном, не являются «выделенными», но те же нуклеиновая кислота или пептид, частично или полностью отделенные от материалов, сопутствующих им в их природном состоянии, являются «выделенными». Выделенная нуклеиновая кислота или белок могут существовать, по существу, в очищенной форме или могут существовать в неприродном окружении, таком как, например, генетически модифицированной клетке.
Определения «встречающийся в природе», «нативный» или «дикого типа» используют для описания объекта, который можно обнаружить в природе как отличающийся от получаемого искусственно. Например, белок или нуклеотидная последовательность, присутствующие в организме (включая вирус), которые можно изолировать из источника в природе, и которые не модифицированы умышленно специалистом в лаборатории, являются встречающимися в природе.
Термин «геном» относится к полному генетическому материалу организма.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «включать» и «содержать» или их вариации, такие как «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Белок (Пептид)
В настоящем описании термины «пептид», «полипептид» и «белок» используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не существует ограничений по максимальному количеству аминокислот, которые может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислот, соединенных друг с другом пептидными связями. Как применяют в настоящем описании, термин относится и к коротким цепям, также общепринято обозначаемым в этой области, например, как пептиды, олигопептиды и олигомеры, и к более длинным цепям, как правило, обозначаемым в этой области как белки, множество типов которых существует. «Полипептиды» включают, помимо прочего, например, биологически активные фрагменты, по существу, гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитные белки. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию.
Молекулы нуклеиновых кислот
Термины «нуклеиновая кислота», «нуклеиновая последовательность» или «нуклеиновокислотная последовательность», «полинуклеотид», «олигонуклеотид», «полинуклеотидная последовательность» и «нуклеотидная последовательность», которые используются равнозначно в данном описании, обозначают четкую последовательность нуклеотидов, модифицированных или не модифицированных, определяющую фрагмент или участок нуклеиновой кислоты, содержащую или не содержащую неприродные нуклеотиды и являющуюся либо двухцепочечной ДНК или РНК, либо одноцепочечной ДНК или РНК, либо продуктами транскрипции указанных ДНК.
Специалист в этой области имеет общие знания о том, что нуклеиновые кислоты являются полинуклеотидами, которые можно гидролизовать до мономерных «нуклеотидов». Мономерные нуклеотиды можно гидролизовать в нуклеозиды. Как применяют в настоящем описании, полинуклеотиды включают, в качестве неограничивающих примеров, все последовательности нуклеиновой кислоты, получаемые любыми способами, доступными в этой области, включая, в качестве неограничивающих примеров, рекомбинантные способы, т.е. клонирование последовательностей нуклеиновой кислоты из рекомбинантной библиотеки или генома клетки, использование обычной технологии клонирования и ПЦР и т.п., и способами синтеза.
Здесь также следует упомянуть, что данное изобретение не относится к нуклеотидным последовательностям в их природной хромосомной среде, т.е. в природном состоянии. Последовательности данного изобретения были выделены и/или очищены, т.е. были взяты прямо или косвенно, например, путем копирования, при этом их среда была по меньшей мере частично модифицирована. Таким образом, также здесь следует подразумевать изолированные нуклеиновые кислоты, полученные путем генетической рекомбинации, например, с помощью принимающих клеток (клеток-хозяев), или полученные путем химического синтеза.
Термин нуклеотидная последовательность охватывает его комплемент, если не указано иное. Таким образом, нуклеиновую кислоту, имеющую определенную последовательность следует понимать как охватывающие ее комплементарную цепь с ее комплементарной последовательностью.
Аденоассоциированный вирус (AAV)
Вирусы семейства Parvoviridae представляют собой небольшие ДНК-содержащие вирусы животных. Семейство Parvoviridae может быть разделено на два подсемейства: Parvovirinae, представители которого инфицируют позвоночных животных, и Densovirinae, представители которого инфицируют насекомых. К 2006 году были описаны 11 серотипов аденоассоциированного вируса (Mori, S. ET AL., 2004, «Two novel adeno-associated viruses from cynomolgus monkey: pseudotyping characterization of capsid protein», Virology, Т. 330 (2): 375-83). Все известные серотипы могут инфицировать клетки многих видов тканей. Тканевая специфичность определяется серотипом белков капсида, поэтому векторы на основе аденоассоциированого вируса конструируют, задавая необходимый серотип. Дополнительная информация по парвовирусам и другим представителям Parvoviridae описана в литературе (Kenneth I. Berns, «Parvoviridae: The Viruses and Their Replication», Chapter 69 in Fields Virology (3d Ed. 1996)).
Геномная организация всех известных серотипов AAV очень сходна. Геном AAV представляет собой линейную одноцепочечную молекулу ДНК, которая содержит менее чем примерно 5000 нуклеотидов (нт) в длину. Инвертированные концевые повторы (ITR) фланкируют уникальные кодирующие нуклеотидные последовательности репликации неструктурных белков (Rep) и структурных белков (Cap). Ген Cap кодирует белки VP (VP1, VP2 и VP3), которые образуют капсид. Концевые 145 нуклеотидов являются самокомплементарными и организованы таким образом, что может быть сформирован энергетически стабильный внутримолекулярный дуплекс, образующий Т-образную шпилечную структуру. Такие шпилечные структуры функционируют как точки начала репликации ДНК вируса, являясь праймерами для клеточного ДНК-полимеразного комплекса. После инфекции клеток млекопитающих AAV дикого типа (wtAAV) гены Rep (например, Rep78 и Rep52) экспрессируются с помощью P5 промотора и P19 промотора, соответственно, и оба белка Rep выполняют определенную функцию в репликации генома вируса. Сплайсинг в открытой рамке считывания Rep (Rep ORF) приводит к экспрессии фактически четырех белков Rep (например, Rep78, Rep68, Rep52 и Rep40). Однако было показано, что несплайсированная мРНК, кодирующая белки Rep78 и Rep52, является достаточной для продукции вектора AAV в клетках млекопитающих.
Вектор
Термин «вектор» при использовании в настоящем документе означает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она соединена. Кроме того, термин «вектор» в данном настоящем документе означает вирусную частицу, способную транспортировать нуклеиновую кислоту.
Как применяют в настоящем описании, термин «экспрессия» определяют как транскрипцию и/или трансляцию конкретной нуклеотидной последовательности, запускаемую ее промотором.
Применение
Термин «профилактика» или «предупреждение» и подобные им означает замедление или предотвращение появления симптомов заболевания, расстройства или инфекции.
Термин «индукция иммунного ответа» как используют в настоящем изобретении, относится к специфическому контролю или к влиянию на активность иммунного ответа и включает активацию иммунного ответа, стимуляцию иммунного ответа, усиление иммунного ответа.
Термин «специфический иммунитет» как используют в настоящем изобретении, относится к состоянию невосприимчивости к заболеванию вследствие индукции иммунного ответа.
Термин «нарушение» означает любое состояние, которое можно улучшить в результате лечения по настоящему изобретению. В определение данного термина входят хронические и острые нарушения или заболевания, включающие в себя патологические состояния, которые вызывают предрасположенность млекопитающего к возникновению данного нарушения.
«Заболевание» является состоянием здоровья животного, где животное не может поддерживать гомеостаз, и где, если заболевание не облегчают, то здоровье животного продолжает ухудшаться.
Термин «субъект», «пациент», «индивидуум» и т.п. используют в настоящем описании взаимозаменяемо, и они относятся к любому животному, поддающемуся воздействию способами, представленными в настоящем описании. В конкретных неограничивающих вариантах осуществления субъект, пациент или индивидуум является человеком. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
«Терапевтически эффективным количеством» или «эффективным количеством» считается количество вводимого терапевтического агента, которое избавит в определенной степени от одного или нескольких симптомов заболевания, по поводу которого проводится профилактика.
Подробное описание изобретения
Пептидный антиген
В одном из аспектов настоящее изобретение относится к выделенному рекомбинантному рецептор-связывающему домену гликопротеина S (RBD-S) вируса SARS-CoV-2 (коронавирус 2 типа, вызывающий тяжёлый острый респираторный синдром), который представлен аминокислотной последовательностью
RVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVVVLSFELLHAPATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPSSFGGVS (SEQ ID NO:1).
Данный RBD-S вируса SARS-CoV-2 был получен из полноразмерного гликопротеина S вируса SARS-CoV-2, который описан в БД GenBank, Wu F., Severe acute respiratory syndrome coronavirus 2 isolate Wuhan-Hu-1, complete genome, 2020, GenBank: MN908947.3 (https://www.ncbi.nlm.nih.gov/nuccore/MN908947) и в статье Fan Wu ET AL., A new coronavirus associated with human respiratory disease in China, 2020, Nature, volume 579, pages 265–269 (https://www.nature.com/articles/s41586-020-2008-3) и имеет следующую аминокислотную последовательность:
MFVFLVLLPLVSSQCVNLTTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFSNVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIVNNATNVVIKVCEFQFCNDPFLGVYYHKNNKSWMESEFRVYSSANNCTFEYVSQPFLMDLEGKQGNFKNLREFVFKNIDGYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQTLLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETKCTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVVVLSFELLHAPATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGGVSVITPGTNTSNQVAVLYQDVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAGCLIGAEHVNNSYECDIPIGAGICASYQTQTNSPRRARSVASQSIIAYTMSLGAENSVAYSNNSIAIPTNFTISVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQEVFAQVKQIYKTPPIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDCLGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAGAALQIPFAMQMAYRFNGIGVTQN VLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQDVVNQNAQALNTLVKQLSSNFGAISSVLNDILSRLDKVEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRASANLAATKMSECVLGQSKRVDFCGKGYHLMSFPQSAPHGVVFLHVTYVPAQEKNFTTAPAICHDGKAHFPREGVFVSNGTHWFVTQRNFYEPQIITTDNTFVSGNCDVVIGIVNNTVYDPLQPELDSFKEELDKYFKNHTSPDVDLGDISGINASVVNIQKEIDRLNEVAKNLNESLIDLQELGKYEQYIKWPWYIWLGFIAGLIAIVMVTIMLCCMTSCCSCLKGCCSCGSCCKFDEDDSEPVLKGVKLHYT (SEQ ID NO:6).
Из вышеуказанной последовательности гликопротеина S вируса SARS-CoV-2 был выбран на основе анализа структуры данного гликопротеина (См. пример 1) рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2, который имеет следующую аминокислотную последовательность
RVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVVVLSFELLHAPATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGGVS (SEQ ID NO:7).
Далее в аминокислотную последовательность с SEQ ID NO:7 была внесена точечная аминокислотная замена C272S для обеспечения дополнительной стабильности белка RBD-S вируса SARS-CoV-2 и, таким образом, был получен рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO: 1.
Нуклеиновая кислота
В одном из аспектов настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, которая представляет собой нуклеотидную последовательность SEQ ID NO: 18.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена от по меньшей мере одной молекулы нуклеиновой кислоты-примеси, с которой она обычно связана в естественном источнике нуклеиновой кислоты нуклеазы. Выделенная молекула нуклеиновой кислоты отличается от той формы или набора, в которых она находится в естественных условиях. Таким образом, выделенная молекула нуклеиновой кислоты отличается от молекулы нуклеиновой кислоты, существующей в клетках в естественных условиях. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, находящуюся в клетках, в которых в норме происходит экспрессия нуклеазы, например, в случае, если молекула нуклеиновой кислоты имеет локализацию в хромосоме, отличную от ее локализации в клетках в естественных условиях.
Для получения вышеуказанной кодон-оптимизированной нуклеиновой кислоты была проведена кодон-оптимизации нуклеиновой кислоты дикого типа с нуклеотидной последовательностью
AGAGTCCAACCAACAGAATCTATTGTTAGATTTCCTAATATTACAAACTTGTGCCCTTTTGGTGAAGTTTTTAACGCCACCAGATTTGCATCTGTTTATGCTTGGAACAGGAAGAGAATCAGCAACTGTGTTGCTGATTATTCTGTCCTATATAATTCCGCATCATTTTCCACTTTTAAGTGTTATGGAGTGTCTCCTACTAAATTAAATGATCTCTGCTTTACTAATGTCTATGCAGATTCATTTGTAATTAGAGGTGATGAAGTCAGACAAATCGCTCCAGGGCAAACTGGAAAGATTGCTGATTATAATTATAAATTACCAGATGATTTTACAGGCTGCGTTATAGCTTGGAATTCTAACAATCTTGATTCTAAGGTTGGTGGTAATTATAATTACCTGTATAGATTGTTTAGGAAGTCTAATCTCAAACCTTTTGAGAGAGATATTTCAACTGAAATCTATCAGGCCGGTAGCACACCTTGTAATGGTGTTGAAGGTTTTAATTGTTACTTTCCTTTACAATCATATGGTTTCCAACCCACTAATGGTGTTGGTTACCAACCATACAGAGTAGTAGTACTTTCTTTTGAACTTCTACATGCACCAGCAACTGTTTGTGGACCTAAAAAGTCTACTAATTTGGTTAAAAACAAATGTGTCAATTTCAACTTCAATGGTTTAACAGGCACAGGTGTTCTTACTGAGTCTAACAAAAAGTTTCTGCCTTTCCAACAATTTGGCAGAGACATTGCTGACACTACTGATGCTGTCCGTGATCCACAGACACTTGAGATTCTTGACATTACACCATCTTCTTTTGGTGGTGTCAGT (SEQ ID NO: 2).
В результате кодон-оптимизации нуклеиновой кислоты дикого типа RBD-S с нуклеотидной последовательностью SEQ ID NO: 2 был получен ряд кодон-оптимизированных нуклеиновых кислот, которые были в дальнейшем протестированы на уровень продукции белка по сравнению с контролем (нуклеиновая кислота дикого типа с SEQ ID NO:2).
Все кодон-оптимизированные нуклеиновые кислоты показали увеличение уровня продукции белка RBD-S по сравнению с диким типом в несколько раз, при этом кодон-оптимизированная нуклеиновая кислота по изобретению с нуклеотидной последовательностью SEQ ID NO: 18 неожиданно показала самый лучший показатель, а именно уровень продукции белка RBD-S был в 29 раз выше, чем в случае использования препарата с природной версией гена RBD-S (SEQ ID NO:2) (см. Пример 4).
Вышеуказанная кодон-оптимизированная нуклеиновая кислота с нуклеотидной последовательностью SEQ ID NO: 18 характеризуется повышенным индексом адаптации кодонов (стандартная метрика для оценки последовательности на предмет частот использованных кодонов) для клеток млекопитающих по сравнению с нуклеиновой кислотой дикого типа с нуклеотидную последовательностью SEQ ID NO: 2.
Вышеуказанная кодон-оптимизированная нуклеиновая кислота с нуклеотидной последовательностью SEQ ID NO: 18 обозначается в материалах заявки как RBD-SCO.
Экспрессионная кассета. Экспрессионный вектор.
В одном из аспектов настоящее изобретение относится к кассете, которая экспрессирует рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, которая включает вышеуказанную нуклеиновую кислоту.
Термин «кассета, которая экспрессирует» или «экспрессионная кассета» при использовании в данном документе, в частности, относится к фрагменту ДНК, который способен в соответствующей обстановке запускать экспрессию полинуклеотида, кодирующего представляющий интерес полипептид, который включен в указанную экспрессионную кассету. При введении в клетку-хозяина экспрессионная кассета помимо прочего способна задействовать клеточные механизмы для транскрипции полинуклеотида, кодирующего представляющий интерес полипептид, в РНК, которая затем обычно дополнительно процессируется и, наконец, транслируется в представляющий интерес полипептид. Экспрессионная кассета может содержаться в экспрессионном векторе.
Экспрессионная кассета по настоящему изобретению содержит в качестве элемента промотор. Термин «промотор», используемый в настоящем документе, в частности, относится к элементу ДНК, который способствует транскрипции полинуклеотида, с которым функционально связан промотор. Промотор может также составлять часть элемента «промотор/энхансер». Хотя физические границы между элементами «промотор» и «энхансер» не всегда ясны, термин «промотор» обычно относится к месту на молекуле нуклеиновой кислоты, с которым связывается РНК-полимераза и/или связанные с ней факторы, и с которого инициируется транскрипция. Энхансеры усиливают активность промотора во времени, а также пространственно. В данной области известно множество промоторов, которые транскрипционно активны в широком диапазоне типов клеток. Промоторы могут быть разделены на два класса: на тех, которые функционируют конститутивно, и тех, которые регулируются индукцией или снятием репрессии. Для экспрессии белка пригодны оба класса. Промоторы, которые используются для продукции высокого уровня полипептидов в эукариотических клетках и, в частности, в клетках млекопитающих, должны быть сильными и, предпочтительно, должны быть активными в широком диапазоне типов клеток. Сильные конститутивные промоторы, которые способны запускать экспрессию во многих типах клеток, хорошо известны в данной области и, поэтому, нет необходимости в их подробном описании в данном документе. В соответствии с идеей настоящего изобретения предпочтительно использовать промотор цитомегаловируса (CMV). Промотор или промотор/энхансер, полученные из немедленной ранней (IE) области цитомегаловируса (hCMV) человека, в особенности подходят в качестве промотора в экспрессионной кассете по настоящему изобретению. Немедленная ранняя (IE) область цитомегаловируса (hCMV) человека и полученные из нее функциональные запускающие экспрессию фрагменты и/или функциональные усиливающие экспрессию фрагменты, например, описаны в ЕР0173177 и ЕР0323997, а также хорошо известны в данной области. Таким образом, несколько фрагментов немедленной ранней (IE) области hCMV могут использоваться в качестве промотора и/или промотора/энхансера. Согласно одному варианту осуществления изобретения промотор CMV человека используется в экспрессионной кассете по настоящему изобретению.
В некоторых вариантах кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV (цитомегаловирусный) энхансер;
CMV (цитомегаловирусный) промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO: 1, и имеет нуклеотидную последовательность SEQ ID NO: 18;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах левый (первый) ITR (инвертированные концевые повторы) имеет следующую последовательность нуклеиновой кислоты:
Cctgcaggcagctgcgcgctcgctcgctcactgaggccgcccgggcgtcgggcgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcactaggggttcct (SEQ ID NO: 8).
В некоторых вариантах CMV (цитомегаловирусный) энхансер имеет следующую последовательность нуклеиновой кислоты:
cgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgCcaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatg (SEQ ID NO: 9).
В некоторых вариантах CMV (цитомегаловирусный) промотер имеет следующую последовательность нуклеиновой кислоты:
gtgatgcggttttggcagtacatcaatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccattgacgtcaatgggagtttgttttgGcaccaaaatcaacgggactttccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatataagcagagct (SEQ ID NO: 10).
В некоторых вариантах интрон гена hBG1 (ген субъединицы гемоглобина гамма-1) имеет следующую последовательность нуклеиновой кислоты:
cgaatcccggccgggaacggtgcattggaacgcggattccccgtgccaagagtgacgtaagtaccgcctatagagtctataggcccacaaaaaatgctttcttcttttaatatacttttttgtttatcttatttctaatactttccctaatctctttctttcagggcaataatgatacaatgtatcatgcctctttgcaccattctaaagaataacagtgataatttctgggttaaggcaatagcaatatttctgcatataaatatttctgcatataaattgtaactgatgtaagaggtttcatattgctaatagcagctacaatccagctaccattctgcttttattttatggttgggataaggctggattattctgagtccaagctaggcccttttgctaatcatgttcatacctcttatcttcctcccacagctcctgggcaacgtgctggtctgtgtgctggcccatcactttggcaaagaattgggat (SEQ ID NO: 11).
В некоторых вариантах сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека) имеет следующую последовательность нуклеиновой кислоты:
Acgggtggcatccctgtgacccctccccagtgcctctcctggccctggaagttgccactccagtgcccaccagccttgtcctaataaaattaagttgcatcattttgtctgactaggtgtccttctataatattatggggtggaggggggtggtatggagcaaggggcaagttgggaagacaacctgtagggcctgcggggtctattgggaaccaagctggagtgcagtggcacaatcttggctcactgcaatctccgcctcctgggttcaagcgattctcctgcctcagcctcccgagttgttgggattccaggcatgcatgaccaggctcagctaatttttgtttttttggtagagacggggtttcaccatattggccaggctggtctccaactcctaatctcaggtgatctacccaccttggcctcccaaattgctgggattacaggcgtgaaccactgctcccttccctgtcctt (SEQ ID NO: 12).
В некоторых вариантах правый (второй) ITR имеет следующую последовательность нуклеиновой кислоты:
aggaacccctagtgatggagttggccactccctctctgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggcctcagtgagcgagcgagcgcgcagctgcctgcagg (SEQ ID NO: 13).
В некоторых вариантах кассета включает нуклеиновую кислоту с нуклеотидной последовательностью: cctgcaggcagctgcgcgctcgctcgctcactgaggccgcccgggcgtcgggcgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcactaggggttcctgcggccgcacgcgtctagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgCcaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatggtgatgcggttttggcagtacatcaatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccattgacgtcaatgggagtttgttttgGcaccaaaatcaacgggactttccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatataagcagagctcgtttagtgaaccgtcagatcgcctggagacgccatccacgctgttttgacctccatagaagacaccgggaccgatccagcctccgcggattcgaatcccggccgggaacggtgcattggaacgcggattccccgtgccaagagtgacgtaagtaccgcctatagagtctataggcccacaaaaaatgctttcttcttttaatatacttttttgtttatcttatttctaatactttccctaatctctttctttcagggcaataatgatacaatgtatcatgcctctttgcaccattctaaagaataacagtgataatttctgggttaaggcaatagcaatatttctgcatataaatatttctgcatataaattgtaactgatgtaagaggtttcatattgctaatagcagctacaatccagctaccattctgcttttattttatggttgggataaggctggattattctgagtccaagctaggcccttttgctaatcatgttcatacctcttatcttcctcccacagctcctgggcaacgtgctggtctgtgtgctggcccatcactttggcaaagaattgggattcgaacatcgattgaGCCACCATGGAGACCGACACCCTGCTGCTGTGGGTGCTGCTGCTGTGGGTGCCCGGGTCGACCGGGAGAGTGCAGCCTACCGAGAGCATCGTGAGATTCCCCAACATCACCAACCTGTGCCCATTCGGAGAGGTGTTCAACGCCACTAGATTTGCCAGCGTGTATGCCTGGAATAGGAAGAGGATCTCCAATTGTGTGGCCGACTACTCCGTGCTGTATAATTCCGCCTCCTTTAGCACCTTCAAGTGTTATGGCGTGTCCCCCACAAAGCTGAATGACCTGTGCTTCACCAACGTGTACGCCGATTCCTTCGTGATTAGAGGCGACGAGGTGAGGCAGATTGCACCAGGACAGACTGGCAAGATTGCCGACTACAACTACAAGCTGCCCGATGATTTCACAGGCTGTGTGATCGCCTGGAACAGCAATAACCTGGACAGCAAAGTGGGAGGCAACTACAACTACCTGTACAGACTGTTCAGGAAGTCCAATCTGAAGCCTTTCGAGAGAGACATCAGCACCGAGATCTACCAGGCCGGCTCAACACCATGTAATGGAGTGGAGGGCTTTAACTGTTACTTCCCCCTGCAGTCTTACGGCTTCCAGCCCACTAATGGCGTGGGATATCAGCCCTATAGAGTGGTGGTGCTGAGCTTTGAGCTGCTGCATGCTCCAGCTACCGTGTGTGGCCCTAAGAAGAGCACCAATCTGGTGAAGAATAAGTGCGTGAACTTCAACTTCAACGGCCTGACCGGCACAGGAGTGCTGACAGAAAGCAATAAGAAGTTCCTGCCCTTCCAGCAGTTCGGCAGAGATATTGCCGACACAACCGATGCCGTGAGGGACCCACAGACTCTGGAGATCCTGGATATTACACCTAGCAGCTTTGGGGGCGTGTCCtaatagggatcctctagagtcgacctgcagaagcttgcctcgagcagcgctgctcgagagatctacgggtggcatccctgtgacccctccccagtgcctctcctggccctggaagttgccactccagtgcccaccagccttgtcctaataaaattaagttgcatcattttgtctgactaggtgtccttctataatattatggggtggaggggggtggtatggagcaaggggcaagttgggaagacaacctgtagggcctgcggggtctattgggaaccaagctggagtgcagtggcacaatcttggctcactgcaatctccgcctcctgggttcaagcgattctcctgcctcagcctcccgagttgttgggattccaggcatgcatgaccaggctcagctaatttttgtttttttggtagagacggggtttcaccatattggccaggctggtctccaactcctaatctcaggtgatctacccaccttggcctcccaaattgctgggattacaggcgtgaaccactgctcccttccctgtccttctgattttgtaggtaaccacgtgcggaccgagcggccgcaggaacccctagtgatggagttggccactccctctctgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggcctcagtgagcgagcgagcgcgcagctgcctgcagg (SEQ ID NO: 19).
В одном из аспектов настоящее изобретение относится к вектору, который экспрессирует рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO:1, который включает вышеуказанную нуклеиновую кислоту или любую из вышеуказанных кассет.
В некоторых вариантах осуществления изобретения вектор представляет собой плазмиду, т.е. кольцевую двухцепочечную часть ДНК, в которую могут быть лигированы дополнительные сегменты ДНК.
В некоторых вариантах осуществления изобретения вектор представляет собой вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном.
В некоторых вариантах осуществления изобретения векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации и эписомные векторы млекопитающих). В других вариантах осуществления изобретения векторы (например, неэписомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина, и таким образом реплицируются вместе с геном хозяина. Более того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально соединены. Такие векторы упоминаются в данном документе как «рекомбинантные экспрессирующие векторы» (или просто «экспрессирующие векторы» («вектор экспрессии» или «экспрессионный вектор»)).
Экспрессионные векторы включают плазмиды, ретровирусы, аденовирусы, аденоассоциированные вирусы (AAV), вирусы растений, такие как вирус мозаики цветной капусты, вирусы табачной мозаики, космиды, YAC, EBV полученные эписомы и тому подобное. Молекулы ДНК могут быть лигированы в вектор таким образом, что последовательности, контролирующие транскрипцию и трансляцию в векторе, выполняют предусмотренную функцию регуляции транскрипции и трансляции ДНК. Экспрессионный вектор и последовательности контроля экспрессии могут быть выбраны таким образом, чтобы быть совместимыми с используемой экспрессирующей клеткой-хозяином. Молекулы ДНК могут быть введены в экспрессионный вектор стандартными способами (например, лигированием комплементарных сайтов рестрикции или лигированием тупых концов, если сайты рестрикции отсутствуют).
Рекомбинантный экспрессионный вектор также может кодировать лидерный пептид (или сигнальный пептид), который облегчает выработку белка-интереса клеткой-хозяином. Ген белка-интереса может быть клонирован в вектор таким образом, что сигнальный пептид соединен с рамкой считывания аминоконца белка-интереса. Лидерным пептидом (или сигнальным пептидом) может быть лидерный пептид иммуноглобулина или иной лидерный пептид (то есть, лидерный пептид белка не иммуноглобулиновой природы).
Помимо гена RBD-S вируса SARS-CoV-2 по данному изобретению, рекомбинантная экспрессия векторов по данному изобретению может нести регулирующие последовательности, которые контролируют экспрессию гена RBD-S вируса SARS-CoV-2 в клетке-хозяине. Специалистам в этой области будет понятно, что дизайн экспрессионного вектора, включая выбор регулирующих последовательностей, может зависеть от таких факторов, как селекция клетки-хозяина для трансформации, уровень экспрессии желаемого белка, и т.д. Предпочтительные регулирующие последовательности для экспрессирующей клетки-хозяина млекопитающих включают вирусные элементы обеспечивающие высокий уровень экспрессии белков в клетках млекопитающих, таких как промоторы и/или энхансеры, полученные из ретровирусной LTR, цитомегаловируса (CMV) (например, CMV промотора/энхансера), обезьяньего вируса 40 (SV40) (например, SV40 промотора/энхансера), аденовируса, (например, большого позднего промотора аденовируса (AdMLP)), вирус полиомы, а также сильных промоторов млекопитающих, таких как промотор нативных иммуноглобулинов или промотор актина.
Выражение «контролирующие последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Пригодные для прокариот контролирующие последовательности представляют собой, например, промотор, необязательно оператор и сайт связывания рибосомы. Как известно, в эукариотических клетках присутствуют промоторы, сигналы полиаденилирования и энхансеры.
В контексте настоящего описания термин «промотор» или «регуляторная последовательность транскрипции» или «регуляторная последовательность» относится к фрагменту нуклеиновой кислоты, который контролирует транскрипцию одной или нескольких кодирующих последовательностей, и который расположен против направления считывания информации относительно направления транскрипции от сайта инициации транскрипции кодирующей последовательности, а также который структурно идентифицируется по наличию сайта связывания для ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и других последовательностей ДНК, включающих, без ограничения, сайты связывания фактора транскрипции, сайты связывания репрессора и активатора белка, а также любые другие последовательности нуклеотидов, известные специалистам в данной области, которые непосредственно или опосредованно регулируют уровень транскрипции с данным промотором. «Конститутивный» промотор представляет собой такой промотор, который активен в большинстве тканей в обычных физиологических условиях и условиях развития. «Индуцибельный» промотор представляет собой промотор, который подвергается физиологической регуляции или регуляции в ходе развития, например, при воздействии химического индуктора. «Тканеспецифичный» промотор активен только в конкретных типах тканей или клеток.
Термины «энхансеры» или «энхансер», используемые в изобретении, могут относиться к последовательности ДНК, которая расположена как смежная с последовательностью ДНК, кодирующей рекомбинантный продукт. Энхансерные элементы обычно расположены в 5'-направлении от промоторного элемента или могут быть расположены ниже или в пределах кодирующей последовательности ДНК (например, последовательности ДНК, транскрибированной или транслированной в рекомбинантный продукт или продукты). Таким образом, энхансерный элемент может быть расположен на расстоянии 100 пар оснований, 200 пар оснований или 300 или больше пар оснований перед последовательностью ДНК, которая кодирует рекомбинантный продукт, или после этой последовательности. Энхансерные элементы могут увеличивать количество экспрессируемого рекомбинантного продукта от последовательности ДНК, превышая экспрессию, обусловленную одиночным промоторным элементом. Специалистам в данной области техники доступно множество энхансерных элементов.
В дополнение к вышеуказанным генам и регулирующим последовательностям, рекомбинантные векторы экспрессии изобретения могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации) и гены селектируемого маркера. Ген селектируемого маркера облегчает селекцию клеток-хозяев, в которые был введен вектор (см., например, патенты США 4,399,216, 4,634,665 и 5,179,017). Например, обычно ген селектируемого маркера придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую вектор введен. Например, гены селектируемого маркера включают ген дигидрофолат редуктазы (DHFR) (для использования в dhfr-клетках-хозяевах при селекции/амплификации метотрексата), ген нео (для селекции G418) и ген синтетазы глутамата.
Термин «последовательность контроля экспрессии», используемый в данном описании, означает полинуклеотидные последовательности, которые необходимы для воздействия на экспрессию и процессинг кодирующих последовательностей, к которым они лигированы. Контролирующие экспрессию последовательности включают соответствующие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы процессинга РНК, такие как сплайсинг и сигналы полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т.е. консенсусная последовательность Козака); последовательности, которые повышают стабильность белка; и, при желании, последовательности, которые усиливают секрецию белка. Характер таких контролирующих последовательностей различается в зависимости от организма-хозяина; в прокариотах такие контролирующие последовательности, как правило, включают промотор, сайт связывания рибосомы, а также последовательности терминации транскрипции; в эукариотах, как правило, такие контролирующие последовательности включают промоторы и последовательности терминации транскрипции. Термин «контролирующие последовательности» включает, как минимум, все компоненты, наличие которых имеет важное значение для экспрессии и процессинга, и может также включать дополнительные компоненты, чье присутствие является полезным, например, лидирующие последовательности и последовательности слившихся клеток.
В контексте настоящего описания термин «функционально связанный» относится к связи полинуклеотидных (или полипептидных) элементов в функциональную связь. Нуклеиновая кислота является «функционально связанной», если она находится в условиях функциональной связи с другой последовательностью нуклеиновой кислоты. Например, регуляторная последовательность транскрипции функционально связана с кодирующей последовательностью, если она влияет на транскрипцию указанной кодирующей последовательности. Термин «функционально связанный» означает, что связанные последовательности ДНК являются, как правило, непрерывными, и при необходимости соединения двух участков, кодирующих белок, являются также непрерывными и находятся в рамке считывания.
В одном из вариантов настоящего изобретения «экспрессионный вектор» относится к вектору, содержащему одну или несколько интересующих полинуклеотидных последовательностей, интересующих генов или «трансгенов», которые фланкированы парвовирусными или инвертированными концевыми повторяющимися последовательностями (ITR).
Ни кассета, ни вектор по изобретению не содержит нуклеотидные последовательности генов, кодирующих неструктурные белки (Rep) и структурные белки (Cap) аденоассоциированного вируса.
Рекомбинантный вирус на основе AAV5 (аденоассоциированный вирус 5 серотипа)
В одном из аспектов настоящее изобретение относится к выделенному рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, который экспрессирует рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO:1, который включает вышеуказанную нуклеиновую кислоту или любую из вышеуказанных кассет.
Термин «рекомбинантный вирус на основе AAV» (или «вирусоподобная частица на основе AAV», или «рекомбинантный вирусный штамм AAV», или «рекомбинантный вектор AAV», или «вектор rAAV») в контексте настоящего описания относится к вышеуказанной экспрессионной кассете (или вышеуказанному экспрессионному вектору), которая заключена внутри капсида AAV.
Ген Cap, помимо других альтернативных продуктов, кодирует 3 капсидных белка (VP1, VP2 и VP3). Белки VP1, VP2 и VP3 находятся в соотношении 1:1:10, образуя икосаэдрический капсид (Xie Q. et al. The atomic structure of adeno-associated virus (AAV-2), a vector for human gene therapy. Proc Natl Acad Sci USA, 2002; 99:10405-10410). Транскрипция этих генов начинается с одного промотора, p40. Молекулярная масса соответствующих белков (VP1, VP2 и VP3) составляет 87, 72 и 62 кДа, соответственно. Все три белка транслируются с одной мРНК. После транскрипции пре-мРНК может подвергаться сплайсингу двумя разными способами, при этом вырезается более длинный или более короткий интрон и образуются мРНК различной нуклеотидной длины.
При образовании рекомбинантного вируса на основе AAV (rAAV) кассета экспрессии, фланкированная ИКП (ITR), упаковывается в капсид AAV. Гены, необходимые для репликации AAV, как было указано выше, не входят в кассету.
ДНК экспрессионной кассеты упакована в вирусный капсид в виде одноцепочечной молекулы ДНК (оцДНК) длиной приблизительно 3000 нуклеотидов. После инфицирования клетки вирусом, одноцепочечную ДНК конвертируют в форму двухцепочечной ДНК (дцДНК). Только дцДНК могут использовать белки клетки, которые транскрибируют содержащийся ген или гены в РНК.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность MSFVDHPPDWLEEVGEGLREFLGLEAGPPKPKPNQQHQDQARGLVLPGYNYLGPGNGLDRGEPVNRADEVAREHDISYNEQLEAGDNPYLKYNHADAEFQEKLADDTSFGGNLGKAVFQAKKRVLEPFGLVEEGAKTAPTGKRIDDHFPKRKKARTEEDSKPSTSSDAEAGPSGSQQLQIPAQPASSLGADTMSAGGGGPLGDNNQGADGVGNASGDWHCDSTWMGDRVVTKSTRTWVLPSYNNHQYREIKSGSVDGSNANAYFGYSTPWGYFDFNRFHSHWSPRDWQRLINNYWGFRPRSLRVKIFNIQVKEVTVQDSTTTIANNLTSTVQVFTDDDYQLPYVVGNGTEGCLPAFPPQVFTLPQYGYATLNRDNTENPTERSSFFCLEYFPSKMLRTGNNFEFTYNFEEVPFHSSFAPSQNLFKLANPLVDQYLYRFVSTNNTGGVQFNKNLAGRYANTYKNWFPGPMGRTQGWNLGSGVNRASVSAFATTNRMELEGASYQVPPQPNGMTNNLQGSNTYALENTMIFNSQPANPGTTATYLEGNMLITSESETQPVNRVAYNVGGQMATNNQSSTTAPATGTYNLQEIVPGSVWMERDVYLQGPIWAKIPETGAHFHPSPAMGGFGLKHPPPMMLIKNTPVPGNITSFSDVPVSSFITQYSTGQVTVEMEWELKKENSKRWNPEIQYTNNYNDPQFVDFAPDSTGEYRTTRPIGTRYLTRPL (SEQ ID NO: 4).
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5, имеющий следующую аминокислотную последовательность: TAPTGKRIDDHFPKRKKARTEEDSKPSTSSDAEAGPSGSQQLQIPAQPASSLGADTMSAGGGGPLGDNNQGADGVGNASGDWHCDSTWMGDRVVTKSTRTWVLPSYNNHQYREIKSGSVDGSNANAYFGYSTPWGYFDFNRFHSHWSPRDWQRLINNYWGFRPRSLRVKIFNIQVKEVTVQDSTTTIANNLTSTVQVFTDDDYQLPYVVGNGTEGCLPAFPPQVFTLPQYGYATLNRDNTENPTERSSFFCLEYFPSKMLRTGNNFEFTYNFEEVPFHSSFAPSQNLFKLANPLVDQYLYRFVSTNNTGGVQFNKNLAGRYANTYKNWFPGPMGRTQGWNLGSGVNRASVSAFATTNRMELEGASYQVPPQPNGMTNNLQGSNTYALENTMIFNSQPANPGTTATYLEGNMLITSESETQPVNRVAYNVGGQMATNNQSSTTAPATGTYNLQEIVPGSVWMERDVYLQGPIWAKIPETGAHFHPSPAMGGFGLKHPPPMMLIKNTPVPGNITSFSDVPVSSFITQYSTGQVTVEMEWELKKENSKRWNPEIQYTNNYNDPQFVDFAPDSTGEYRTTRPIGTRYLTRPL (SEQ ID NO: 14).
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5, имеющий следующую аминокислотную последовательность MSAGGGGPLGDNNQGADGVGNASGDWHCDSTWMGDRVVTKSTRTWVLPSYNNHQYREIKSGSVDGSNANAYFGYSTPWGYFDFNRFHSHWSPRDWQRLINNYWGFRPRSLRVKIFNIQVKEVTVQDSTTTIANNLTSTVQVFTDDDYQLPYVVGNGTEGCLPAFPPQVFTLPQYGYATLNRDNTENPTERSSFFCLEYFPSKMLRTGNNFEFTYNFEEVPFHSSFAPSQNLFKLANPLVDQYLYRFVSTNNTGGVQFNKNLAGRYANTYKNWFPGPMGRTQGWNLGSGVNRASVSAFATTNRMELEGASYQVPPQPNGMTNNLQGSNTYALENTMIFNSQPANPGTTATYLEGNMLITSESETQPVNRVAYNVGGQMATNNQSSTTAPATGTYNLQEIVPGSVWMERDVYLQGPIWAKIPETGAHFHPSPAMGGFGLKHPPPMMLIKNTPVPGNITSFSDVPVSSFITQYSTGQVTVEMEWELKKENSKRWNPEIQYTNNYNDPQFVDFAPDSTGEYRTTRPIGTRYLTRPL (SEQ ID NO: 15).
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1, VP2 и VP3 AAV5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 4, VP2 c аминокислотной последовательность SEQ ID NO: 14 и VP3 c аминокислотной последовательность SEQ ID NO: 15.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность, которая включает аминокислотные замены в положениях S2A и T711S VP1 AAV5 дикого типа (SEQ ID NO: 4), и имеет аминокислотную последовательность
MAFVDHPPDWLEEVGEGLREFLGLEAGPPKPKPNQQHQDQARGLVLPGYNYLGPGNGLDRGEPVNRADEVAREHDISYNEQLEAGDNPYLKYNHADAEFQEKLADDTSFGGNLGKAVFQAKKRVLEPFGLVEEGAKTAPTGKRIDDHFPKRKKARTEEDSKPSTSSDAEAGPSGSQQLQIPAQPASSLGADTMSAGGGGPLGDNNQGADGVGNASGDWHCDSTWMGDRVVTKSTRTWVLPSYNNHQYREIKSGSVDGSNANAYFGYSTPWGYFDFNRFHSHWSPRDWQRLINNYWGFRPRSLRVKIFNIQVKEVTVQDSTTTIANNLTSTVQVFTDDDYQLPYVVGNGTEGCLPAFPPQVFTLPQYGYATLNRDNTENPTERSSFFCLEYFPSKMLRTGNNFEFTYNFEEVPFHSSFAPSQNLFKLANPLVDQYLYRFVSTNNTGGVQFNKNLAGRYANTYKNWFPGPMGRTQGWNLGSGVNRASVSAFATTNRMELEGASYQVPPQPNGMTNNLQGSNTYALENTMIFNSQPANPGTTATYLEGNMLITSESETQPVNRVAYNVGGQMATNNQSSTTAPATGTYNLQEIVPGSVWMERDVYLQGPIWAKIPETGAHFHPSPAMGGFGLKHPPPMMLIKNTPVPGNITSFSDVPVSSFITQYSTGQVTVEMEWELKKENSKRWNPEIQYTNNYNDPQFVDFAPDSTGEYRSTRPIGTRYLTRPL (SEQ ID NO: 5).
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 14 с одной или несколькими точечными мутациями.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5, имеющий аминокислотную последовательность, которая включает аминокислотные замены в положении T575S VP2 AAV5 дикого типа (SEQ ID NO: 14), и имеет аминокислотную последовательность
TAPTGKRIDDHFPKRKKARTEEDSKPSTSSDAEAGPSGSQQLQIPAQPASSLGADTMSAGGGGPLGDNNQGADGVGNASGDWHCDSTWMGDRVVTKSTRTWVLPSYNNHQYREIKSGSVDGSNANAYFGYSTPWGYFDFNRFHSHWSPRDWQRLINNYWGFRPRSLRVKIFNIQVKEVTVQDSTTTIANNLTSTVQVFTDDDYQLPYVVGNGTEGCLPAFPPQVFTLPQYGYATLNRDNTENPTERSSFFCLEYFPSKMLRTGNNFEFTYNFEEVPFHSSFAPSQNLFKLANPLVDQYLYRFVSTNNTGGVQFNKNLAGRYANTYKNWFPGPMGRTQGWNLGSGVNRASVSAFATTNRMELEGASYQVPPQPNGMTNNLQGSNTYALENTMIFNSQPANPGTTATYLEGNMLITSESETQPVNRVAYNVGGQMATNNQSSTTAPATGTYNLQEIVPGSVWMERDVYLQGPIWAKIPETGAHFHPSPAMGGFGLKHPPPMMLIKNTPVPGNITSFSDVPVSSFITQYSTGQVTVEMEWELKKENSKRWNPEIQYTNNYNDPQFVDFAPDSTGEYRSTRPIGTRYLTRPL (SEQ ID NO: 16).
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 15 с одной или несколькими точечными мутациями.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5, имеющий аминокислотную последовательность, которая включает аминокислотные замены в положении T519S VP3 AAV5 дикого типа (SEQ ID NO: 15), и имеет аминокислотную последовательность
MSAGGGGPLGDNNQGADGVGNASGDWHCDSTWMGDRVVTKSTRTWVLPSYNNHQYREIKSGSVDGSNANAYFGYSTPWGYFDFNRFHSHWSPRDWQRLINNYWGFRPRSLRVKIFNIQVKEVTVQDSTTTIANNLTSTVQVFTDDDYQLPYVVGNGTEGCLPAFPPQVFTLPQYGYATLNRDNTENPTERSSFFCLEYFPSKMLRTGNNFEFTYNFEEVPFHSSFAPSQNLFKLANPLVDQYLYRFVSTNNTGGVQFNKNLAGRYANTYKNWFPGPMGRTQGWNLGSGVNRASVSAFATTNRMELEGASYQVPPQPNGMTNNLQGSNTYALENTMIFNSQPANPGTTATYLEGNMLITSESETQPVNRVAYNVGGQMATNNQSSTTAPATGTYNLQEIVPGSVWMERDVYLQGPIWAKIPETGAHFHPSPAMGGFGLKHPPPMMLIKNTPVPGNITSFSDVPVSSFITQYSTGQVTVEMEWELKKENSKRWNPEIQYTNNYNDPQFVDFAPDSTGEYRSTRPIGTRYLTRPL (SEQ ID NO: 17).
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, VP2 c аминокислотной последовательность SEQ ID NO: 14 с одной или несколькими точечными мутациями и VP3 c аминокислотной последовательность SEQ ID NO: 15 с одной или несколькими точечными мутациями.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 5, VP2 c аминокислотной последовательность SEQ ID NO: 16 и VP3 c аминокислотной последовательность SEQ ID NO: 17.
Под «несколькими точечными мутациями» подразумеваются две, три, четыре, пять, шесть, семь, восемь, девять или десять точечных замен.
Особенно предпочтительные варианты включают замены (мутации), которые являются консервативными по природе, т.е. те замены, которые имеют место в семействе аминокислот, которые объединены по их боковым цепям. В частности, аминокислоты обычно делят на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серин треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, достаточно обосновано предсказание о том, что выделенная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин или схожая консервативная замена аминокислоты на структурно родственную аминокислоту не окажет важного влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать вплоть до приблизительно 5-10 консервативных или неконсервативных аминокислотных замен, при условии, что желаемая функция молекулы остается незатронутой.
Вариант точечных мутаций в последовательностях белков VP1, VP2 или VP3 AAV5 с помощью аминокислотных замен представляет собой замену, по меньшей мере, одного аминокислотного остатка в белке VP1, VP2 или VP3 AAV5 на другой аминокислотный остаток.
Консервативные замены показаны в таблице А под заголовком «предпочтительные замены».
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV (цитомегаловирусный) энхансер;
CMV (цитомегаловирусный) промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO: 1, и имеет нуклеотидную последовательность SEQ ID NO: 18;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 4, VP2 c аминокислотной последовательность SEQ ID NO: 14 и VP3 c аминокислотной последовательность SEQ ID NO: 15, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV энхансер;
CMV промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO: 1, и имеет нуклеотидную последовательность SEQ ID NO: 18;
сигнал полиаденилирования hGH1;
правый ITR.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, VP2 c аминокислотной последовательность SEQ ID NO: 14 с одной или несколькими точечными мутациями и VP3 c аминокислотной последовательность SEQ ID NO: 15 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV энхансер;
CMV промотер;
интрон гена hBG1;
кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO: 1, и имеет нуклеотидную последовательность SEQ ID NO: 18;
сигнал полиаденилирования hGH1;
правый ITR.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 5, VP2 c аминокислотной последовательность SEQ ID NO: 16 и VP3 c аминокислотной последовательность SEQ ID NO: 17, а экспрессионная кассета включает следующие элементы в направлении от 5''конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV энхансер;
CMV промотер;
интрон гена hBG1;
кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO: 1, и имеет нуклеотидную последовательность SEQ ID NO: 18;
сигнал полиаденилирования hGH1;
правый ITR.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеиновую кислоту с SEQ ID NO: 19.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с точечными мутациями S2A и T711S, которая представляет собой аминокислотную последовательностью SEQ ID NO: 5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 4, VP2 c аминокислотной последовательность SEQ ID NO: 14 и VP3 c аминокислотной последовательность SEQ ID NO: 15, а экспрессионная кассета включает нуклеиновую кислоту с SEQ ID NO: 19.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, VP2 c аминокислотной последовательность SEQ ID NO: 14 с одной или несколькими точечными мутациями и VP3 c аминокислотной последовательность SEQ ID NO: 15 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеиновую кислоту с SEQ ID NO: 19.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 c аминокислотной последовательность SEQ ID NO: 5, VP2 c аминокислотной последовательность SEQ ID NO: 16 и VP3 c аминокислотной последовательность SEQ ID NO: 17, а экспрессионная кассета включает нуклеиновую кислоту с SEQ ID NO: 19.
Фармацевтическая композиция/вакцина
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для профилактики коронавирусной инфекции, вызванной вирусом SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для индукции специфического иммунитета к вирусу SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
Действующее вещество в вышеуказанных композициях находится в эффективном количестве, например, в биологически эффективном количестве.
В конкретных вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей рекомбинантный вирус на основе AAV5 по изобретению в фармацевтически приемлемом носителе или в других фармацевтических агентах, адъювантах, разбавителях и т.д. Носитель для инъекций обычно является жидким. Носитель для других способов введения может быть или твердым, или жидким, таким как стерильная апирогенная вода или стерильный апирогенный фосфатно-солевой буферный раствор. Для введения путем ингаляции носитель является вдыхаемым и предпочтительно находится в твердой или жидкой дисперсной форме. В качестве инъекционной среды предпочтительно использовать воду, содержащую добавки, общепринятые для инъекционных растворов, такие как стабилизирующие агенты, соли или солевые растворы и/или буферы.
«Фармацевтическая композиция» обозначает композицию, включающую в себя вышеуказанный рекомбинантный вирус на основе AAV5 по изобретению и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых эксипиентов, таких как наполнители, растворители, разбавители, носители, вспомогательные, распределяющие, средства доставки, консерванты, стабилизаторы, эмульгаторы, суспендирующие агенты, загустители, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Фармацевтические композиции по настоящему изобретению и способы их изготовления будут бесспорно очевидными для специалистов в этой области. Производство фармацевтических композиций предпочтительно должно соответствовать требованиям GMP (надлежащей производственной практики). Композиция может включать буферную композицию, тонические агенты, стабилизаторы и солюбилизаторы.
«Фармацевтически приемлемым» считается материал, который не имеет биологических или других противопоказаний, например, материал можно вводить субъекту без каких-либо нежелательных биологических эффектов. Таким образом, такие фармацевтические композиции можно использовать, например, для трансдукции клетки ex vivo или для введения in vivo рекомбинантного вируса на основе AAV5 по изобретению непосредственно субъекту.
Термин «эксципиент» или «вспомогательное вещество» используется в данном документе для описания любого компонента, отличающегося от ранее описанных по данному изобретению. Это вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Под «стабилизатором» понимается вспомогательное вещество или смесь двух и более вспомогательных веществ, которые обеспечивают физическую и/или химическую стабильность активного агента.
Под термином «буфер», «буферная композиция», «буферный агент» понимается раствор, способный сохранять значение pH, благодаря взаимодействию кислотных и щелочных компонентов, входящих в его состав, который дает возможность препарату вектора на основе rAAV5, проявлять устойчивость к изменениям рН. В общем случае, преимущественными являются значения рН фармацевтической композиции от 4,0 до 8,0. В качестве буферных агентов могут быть использованы, например, ацетатный, фосфатный, цитратный, гистидиновый, сукцинатный и т.п. буферные растворы, но, не ограничиваясь ими.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при 2-8 °С. Предпочтительно, чтобы активный агент сохранял и физическую, и химическую стабильность, а также биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или широко продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
В одном из аспектов настоящее изобретение относится к вакцине для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в эффективном количестве.
В одном из аспектов настоящее изобретение относится к вакцине для профилактики коронавирусной инфекции, вызванной вирусом SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в эффективном количестве.
В одном из аспектов настоящее изобретение относится к вакцине для индукции специфического иммунитета к вирусу SARS-CoV-2, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в эффективном количестве.
Термин «вакцина» относится к иммуногенной композиции, включающей антиген, полученный от патогена, который используется для индуцирования иммунного ответа против патогена, который обеспечивает защитный иммунитет (например, иммунитет, который защищает субъекта от инфекции, вызываемой патогеном, и/или ослабляет тяжесть заболевания или состояния, вызываемого инфекцией вследствие патогена). Защитный иммунитет может включать формирование антител и/или клеточно-опосредованный ответ.
В зависимости от контекста термин «вакцина» может также относиться к суспензии или раствору антигена, который вводят позвоночному для выработки защитного иммунитета.
Вакцина включает рекомбинантный вирус на основе AAV5, который содержится предпочтительно в биологически эффективном количестве. «Биологически эффективное» количество рекомбинантного вируса представляет собой количество, которое достаточно, чтобы вызвать инфекцию (или трансдукцию) и экспрессию доставляемой последовательности нуклеиновой кислоты в клетке. Если вирус вводят в клетку in vivo (например, вирус вводят субъекту, как описано ниже), «биологически эффективное» количество вирусного вектора представляет собой количество, которое достаточно, чтобы вызвать трансдукцию и экспрессию доставляемой последовательности нуклеиновой кислоты в клетке-мишени.
Все определения и пояснения, относящиеся к фармацевтической композиции, также относятся и к вакцине.
Применение
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной фармацевтической композиции для профилактики коронавирусной инфекции, вызванной вирусом SARS-CoV-2.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной фармацевтической композиции для индукции специфического иммунитета к вирусу SARS-CoV-2.
В одном из аспектов настоящее изобретение относится к способу индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, который включает введение в организм млекопитающих любого из вышеуказанных рекомбинантных вирусов на основе AAV5, вышеуказанной композиции или вышеуказанной вакцины, в эффективном количестве.
В одном из аспектов настоящее изобретение относится к способу индукции специфического иммунитета к вирусу SARS-CoV-2, который включает введение в организм млекопитающих любого из вышеуказанных рекомбинантных вирусов на основе AAV5, вышеуказанной композиции или вышеуказанной вакцины для индукции специфического иммунитета к вирусу SARS-CoV-2, в эффективном количестве.
В одном из аспектов настоящее изобретение относится к способу для профилактики коронавирусной инфекции, вызванной вирусом SARS-CoV-2, включающий введение в организм млекопитающих любого из вышеуказанных рекомбинантных вирусов на основе AAV5, вышеуказанной композиции или вышеуказанной вакцины для профилактики коронавирусной инфекции, вызванной вирусом SARS-CoV-2, в эффективном количестве.
Экспрессия RBD-S вируса SARS-CoV-2 в клетках млекопитающего, который получил любого из вышеуказанных рекомбинантных вирусов на основе AAV5 по изобретению, профилактика коронавирусной инфекции, вызванной вирусом SARS-CoV-2, у данного млекопитающего, а также индукция специфического иммунитета к вирусу SARS-CoV-2 у данного млекопитающего являются звеньями одной цепи, так как экспрессионная кассета по изобретению, которая включает кодон-оптимизированную нуклеиновую кислоту по изобретению, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2, который представлен аминокислотной последовательностью SEQ ID NO:1, встраивается в геном клетки млекопитающего и запускается экспрессия выделенного рекомбинантного рецептор-связывающий домена гликопротеина S (RBD-S) вируса SARS-CoV-2, который представлен аминокислотной последовательностью SEQ ID NO:1. Далее белок RBD-S вируса SARS-CoV-2 синтезируется в клетке и выходит из клетки, где запускает индукцию специфического иммунитета к вирусу SARS-CoV-2, которая приводит к профилактике коронавирусной инфекции, вызванной вирусом SARS-CoV-2, у млекопитающего, которое получило любой из вышеуказанных рекомбинантных вирусов на основе AAV5 по изобретению.
Любой способ введения рекомбинантного вируса на основе AAV5, принятый в данной области, может соответствующим образом использоваться для вышеуказанного рекомбинантного вируса на основе AAV5 по данному изобретению.
Примеры способов введения включают в себя местное применение, интраназальное, ингаляционное, чрезслизистое, трансдермальное, энтеральное (например, пероральное, ректальное), парентеральное (например, внутривенное, подкожное, внутрикожное, внутримышечное) введения, а также инъекции непосредственно в ткань или в орган.
Инъекционные препараты могут быть приготовлены в общепринятых лекарственных формах: в виде жидких растворов или суспензий, твердых форм, подходящих для приготовления растворов или суспензий в жидкости перед инъекцией, или в виде эмульсий. Альтернативно, можно вводить вышеуказанный рекомбинантный вирус на основе AAV5 по данному изобретению локально, а не системно, например, в виде депо или в композиции с замедленным высвобождением.
Рекомбинантный вирус на основе AAV5 вводят в организм в эффективном количестве. Рекомбинантный вирус на основе AAV5 предпочтительно вводят в организм в биологически эффективном количестве. «Биологически эффективное» количество рекомбинантного вируса представляет собой количество, которое достаточно, чтобы вызвать инфекцию (или трансдукцию) и экспрессию последовательности нуклеиновой кислоты в клетке. Если вирус вводят в клетку in vivo (например, вирус вводят субъекту, как описано ниже), «биологически эффективное» количество вирусного вектора представляет собой количество, которое достаточно, чтобы вызвать трансдукцию и экспрессию последовательности нуклеиновой кислоты в клетке-мишени.
Дозировки вышеуказанного рекомбинантного вируса на основе AAV5 по данному изобретению будут зависеть от способа введения, конкретного вирусного вектора и их можно определять рутинными способами. Примерными дозами для достижения терапевтического эффекта являются вирусные титры, составляющие по меньшей мере примерно 105, 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014, 1015, 1016 трансдуцирующих единиц или больше, предпочтительно приблизительно от 108 до 1013 трансдуцирующих единиц, еще более предпочтительно 1012 трансдуцирующих единиц.
Клетка для введения вышеуказанного рекомбинантного вируса на основе AAV5 по изобретению может быть клеткой любого типа, включая в себя без ограничения, эпителиальные клетки (например, эпителиальные клетки кожи, дыхательных путей и кишечника), печеночные клетки, мышечные клетки, клетки селезенки, фибробласты, эндотелиальные клетки и тому подобное.
Вышеуказанный рекомбинантный вирус на основе AAV5 по изобретению не используется для модификации генетической целостности клеток зародышевой линии человека.
Примеры
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Материалы и общие методы
Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии использовали согласно инструкциям производителей. Вкратце, плазмидную ДНК нарабатывали для дальнейших манипуляций в клетках E. coli, выращиваемых под селективным давлением с антибиотиками для того, чтобы плазмиды не терялись в клеточной популяции. Плазмидную ДНК выделяли из клеток коммерческими наборами, измеряли концентрацию и использовали для клонирования с помощью обработки эндонуклеазами рестрикции или методами ПЦР-амплификации. Фрагменты ДНК лигировали между собой с помощью лигаз и трансформировали в бактериальные клетки для отбора клонов и дальнейших наработок. Все полученные генетические конструкции подтверждали по паттернам рестрикции и полным секвенированием по Сэнгеру.
Синтез генов
Требуемые сегменты генов получали из олигонуклеотидов, созданных путем химического синтеза. Генные сегменты длиной от 300 до 1000 п. н., которые фланкированы уникальными сайтами рестрикции, собирали путем ренатурации олигонуклеотидов друг на друге с последующей ПЦР-амплификацией с крайних праймеров. В результате получали смесь фрагментов, включая нужный. Фрагменты клонировали по сайтам рестрикции в промежуточные векторы, после чего последовательности ДНК субклонированных фрагментов подтверждали путем секвенирования ДНК.
Определение последовательностей ДНК
Последовательности ДНК определяли путем секвенирования по Сэнгеру. Анализ последовательностей ДНК и белков и обработку данных о последовательностях осуществляли в программе SnapGene 4.2 и выше для создания, картирования, анализа, аннотирования и иллюстрации последовательностей.
Культивирование клеточных культур
В экспериментах были использованы клеточные линии HEK293 (Human Embryonic Kidney clone 293), CHO-K1-S (Chinese Hamster Ovary Cells) и Vero-CCL81. Суспензионные клетки HEK293, используемые для наработки AAV, культивировались в стандартных условиях при 37°С и 5% СO2, на полной питательной среде без FBS и антибиотика. Адгезионные клетки CHO-K1-S, используемые для проверки эффективности препаратов AAV, культивировались в стандартных условиях при 37°С и 5% СO2, на полной питательной среде DMEM/F12 добавлением 5% FBS, антибиотика/антимикотика. Пересев клеток CHO-K1-S осуществлялся при достижении 80-90% конфлюентности. Жизнеспособность клеток оценивалась с помощью окраски Trypan Blue и камеры Горяева либо с помощью окраски PI и проточной цитометрии. Адгезионные клетки Vero-CCL81, используемые для оценки нейтрализующей активности образцов сыворотки крови животных, культивировались в стандартных условиях при 37°С и 5% СO2, на полной питательной среде DMEM с антибиотиком-антимикотиком в присутствии 10% FBS.
Определение уровня белка RBD-S и специфических антител к белку RBD-S
Оценку содержания белка RBD-S после трансдукции клеток и антител к белку RBD-S в плазме крови животных после иммунизации проводили посредством постановки твердофазного иммуноферментного анализа (ИФА) с применением пероксидазы хрена в качестве индикаторного фермента. Вкратце, лунки 96-луночного планшета сенсибилизировали первичными антителами к белку RBD-S, после наслаивали исследуемые образцы. В случае постановки ИФА на выявление антител к белку RBD-S - сенсибилизацию планшета проводили белком RBD-S, после в лунки вносили плазму крови животных. Далее к образцам добавляли вторичные антитела к RBD-S (при анализе на сам белок) или вторичные антитела к иммуноглобулинам экспериментальных животных (при анализе на наличие антител к RBD-S), меченные биотином и конъюгат стрептавидин-HRP. После вносили раствор TMB для визуализации ферментативной реакции и стоп-раствор для остановки развития реакции.
Для определения концентрации RBD-S/антител к RBD-S в исследуемых образцах, строили калибровочную кривую зависимости оптической плотности раствора от концентрации RBD-S/ антител к RBD-S в стандартных образцах и по оптической плотности тестируемого образца находили концентрацию.
Сборка и очистка вирусных частиц рекомбинантных векторов AAV
Для сборки вирусных частиц AAV, содержащих ген кодон-оптимизированный ген RBD-S (coRBD-S), использовали клетки-продуценты HEK293, которые трансфецировали 3-мя плазмидами:
Плазмида pAAV-RBD-SCO, содержащая геном AAV с кассетой для экспрессии трансгена RBD-S (Фиг.1.);
Плазмида для экспрессии гена Cap серотипа AAV5 и гена Rep серотипа AAV2. Каждый ген с помощью альтернативных рамок считывания кодирует несколько белковых продуктов;
Плазмида для экспрессии генов аденовируса Ad5, необходимых для сборки и упаковки капсидов AAV.
Через 72 часа клетки лизировали и проводили очистку и концентрирование вирусных частиц с помощью методов фильтрации, хроматографии и ультрацентифугирования. Титр вирусных частиц определяли с помощью количественной ПЦР с праймерами и пробой, специфичными к участку рекомбинантного вирусного генома и выражали в виде количества копий вирусных геномов на 1 мл.
Трансдукция клеточных культур
Клеточную линию заранее засевали в лунки 6-луночных планшетов с плотностью посадки 10 000 кл/см2, после чего добавляли препарат с вирусными частицами при MOI 500 000 вг/кл и на 7 день определяли содержание белка RBD-S в культуральной жидкости методом ИФА, как описано выше. Все работы проводились в 2 независимых экспериментах. Для негативного контроля были использованы интактные клетки.
Проведение in vivo исследования на лабораторных животных
Для экспериментов были использованы мыши линии BALB/c (самцы и самки возрастом 6-8 недель). Иммунизацию проводили однократно путем внутримышечно введения препаратов в тазовые конечности. Группе животных отрицательного контроля вводился буферный раствор, положительного контроля - смесь белка RBD-S, полного адъюванта Фрейнда и физиологического раствора. Отбор плазмы крови производился в день инъекции до введения препаратов, далее - на 14, 21, 28, 42 и 56 день после проведения иммунизации.
Пример 1. Выбор последовательности RBD-S вируса SARS-CoV-2 и ее модификация
При разработке антигена RBD-S вируса SARS-CoV-2 был проведен анализ структуры 5WRG белка Spike Glycoprotein вируса SARS-CoV из статьи Gui M. ET AL., Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding, 2017, Cell Res. 27, p. 119-129. Проведенный нами анализ структуры белка Spike Glycoprotein вируса SARS-CoV показал, что для иммунизации возможно использовать как консервативный домен RBD-S, так и его удлиненную часть. На основании проведенного нами анализа было установлено, что увеличение длины рассматриваемого участка RBD-S должно способствовать стабилизации структуры белка RBD-S за счет сохранения вторичных структур, которые повышают вероятность сохранения стабильной конфирмации белка без стремления к расплетанию. При этом незначительное увеличение длины домена RBD-S не должно сказываться на результатах иммунизации. Вышеуказанный анализ структуры белка Spike Glycoprotein вируса SARS-CoV был экстраполирован на структуру белка Spike Glycoprotein вируса SARS-CoV-2. Кроме того, в структуру белка RBD-S вируса SARS-CoV-2 была введена замена ближайшего к домену неспаренного цистеина на серин (аминокислотная замена в положении C272S) для обеспечения дополнительной стабильности белка RBD-S вируса SARS-CoV-2. Таким образом, в качестве антигена RBD-S вируса SARS-CoV-2 была выбрана следующая аминокислотная последовательность c SEQ ID NO: 1.
Нуклеиновая кислота дикого типа с нуклеотидной последовательностью SEQ ID NO: 2, кодирует антиген RBD-S вируса SARS-CoV-2 с аминокислотной последовательностью SEQ ID NO:1.
В результате кодон-оптимизации нуклеиновой кислоты дикого типа RBD-S с нуклеотидной последовательностью SEQ ID NO: 2 был получен ряд кодон-оптимизированных нуклеиновых кислот, которые были в дальнейшем протестированы на уровень продукции белка по сравнению с контролем (нуклеиновая кислота дикого типа с SEQ ID NO: 2).
Все кодон-оптимизированные нуклеиновые кислоты показали увеличение уровня продукции белка RBD-S по сравнению с диким типом в несколько раз, при этом кодон-оптимизированная нуклеиновая кислота по изобретению с нуклеотидной последовательностью SEQ ID NO: 18 неожиданно показала самый лучший показатель, а именно уровень продукции белка RBD-S был в 29 раз выше, чем в случае использования препарата с природной версией гена RBD-S (SEQ ID NO:2) (см. Пример 4).
Кодон-оптимизированная нуклеиновая кислота с нуклеотидной последовательностью SEQ ID NO: 18 характеризуется повышенным индексом адаптации кодонов (стандартная метрика для оценки последовательности на предмет частот использованных кодонов) для клеток млекопитающих по сравнению с нуклеиновой кислотой дикого типа с нуклеотидную последовательностью SEQ ID NO: 2.
Кодон-оптимизированная нуклеиновая кислота с нуклеотидной последовательностью SEQ ID NO: 18 обозначается далее в примерах как RBD-SCO.
Пример 2. Сборка генетической конструкции, содержащей экспрессионную кассету AAV с рекомбинантным кодон-оптимизированным геном RBD-S (RBD-SCO).
Целевая плазмида pAAV-RBD-SCO (Фиг. 1.), предназначенная для получения вирусных векторов AAV5 с экспрессионной кассетой, включающей кодон-оптимизированный ген RBD-S (SEQ ID NO:2.), была получена путем замены последовательности модифицированного зеленого флуоресцентного белка в исходной конструкции pAAV-GFP Control plasmid (VPK-402) от CellBiolab (США), с помощью рестриктазно-лигазного метода клонирования по сайтам ClaI/BamHI, на кодон-оптимизированную последовательность RBD-S с сигнальным пептидом, синтезированную de novo из олигонуклеотидов, созданных путем химического синтеза, с добавлением сайтов рестрикции ClaI с 5'-конца и BamHI с 3'-конца.
Конечный вектор содержит все необходимые элементы для экспрессии гена и сборки в составе генома рекомбинантного AAV:
1) Терминальные повторы ITR на концах последовательности, которая инкапсидируется в вирусный капсид;
2) Элементы для экспрессии целевого гена (промотор, энхансер, интрон, последовательность Kozak, трансген, сайт полиаденилирования);
3) Ориджин бактериальной репликации и ген устойчивости к антибиотику для наработки плазмидной ДНК в бактериальных клетках.
Пример 3. Создание вирусных препаратов, экспрессирующих RBD-S
Целевая плазмида pAAV-RBD-SCO (Фиг 1.) вместе с остальными плазмидами, необходимыми для получения вирусных частиц рекомбинантного AAV (см. выше), были использованы для наработки препарата AAV5-RBD-S, несущего кодон-оптимизированную версию гена RBD-S (AAV5-RBD-SCO). В результате биопроцесса были получены рекомбинантные вирусные частицы AAV5-RBD-S, содержащие экспрессионную кассету с кодон-оптимизированным геном RBD-S (AAV5-RBD-SCO). Очищенный препарат AAV5-RBD-SCO, используемый для проведения in vitro и in vivo исследований был подготовлен с применением стандартным буферов и эксципиентов, которые являются безопасными и не изменяют свойств AAV. В качестве препарата сравнения с использованием описанной выше технологии был также наработан препарат AAV5-RBD-S, содержащие экспрессионную кассету с природным геном RBD-S (AAV5-RBD-SWT).
Пример 4. Проверка работоспособности препарата AAV5-RBD-S in vitro
Перед проведением исследований на животных очищенный препарата AAV5-RBD-S был протестирован in vitro. Данные эксперименты были проведены с использованием адгезионной клеточной линии CHO-K1-S (Фиг 2.). В лунки 6-луночных планшетов были посеяны клетки линии CHO-K1-S. Посев проводили в ростовую среду: ДМЕМ/F12 с глутамином, содержание глюкозы 4,5 г/л, 5% сыворотки эмбриональной телячьей (FBS).
Плотность посадки клеток составила 10 000 клеток/см2. При постановке трансдукции подготовленные заранее клетки были трансдуцированы при MOI 500 000 вг/клетка. Все образцы были поставлены в трипликатах. Для негативного контроля были использованы интактные клетки. Было показано, что разработанный нами препарат AAV5-RBD-S, несущий кодон-оптимизированную версию гена RBD-S (AAV5-RBD-SCO) позволяет эффективно доставить трансген RBD-S в клетки и обеспечить продукцию целевого белка, что подтверждается данными ИФА (Фиг 2.). Важно отметить, что при использовании препарата с кодон-оптимизированной версией гена RBD-S (AAV5-RBD-SCO) наблюдается уровень продукции белка RBD-S в 29 раз выше, чем в случае использования препарата с природной версией гена RBD-S (AAV5-RBD-SWT) (Фиг 2.).
Пример 5. Проверка работоспособности препарата AAV5-RBD-S in vivo
Для проведения in vivo исследований препараты AAV5-RBD-S были использованы лабораторные мыши линии BALB/с. В исследовании использовали дозу препаратов AAV5-RBD-SWT и AAV5-RBD-SCO равную 1×1011 VG/мышь. В качестве негативного контроля были использованы контрольный раствор без AAV и препарат AAV5, не содержащий экспрессионную кассету с геном RBD-S (пустые капсиды AAV5). В качестве положительного контроля использовали очищенный рекомбинантный белок RBD-S. Иммунизацию животных проводили однократно посредством внутримышечных инъекций в тазовые конечности. После проведения иммунизации через 0, 14, 21, 28, 42 и 56 дней определяли титр антител к белку RBD-S в плазме крови методом ИФА, как описано выше. Также проводили оценку нейтрализующей активности антител с использованием нативного вируса SARS-CoV-2 для образцов сыворотки крови, полученных через 56 дней после иммунизации. В результате проведенных in vivo исследований было показано, что иммунизация препаратом AAV5-RBD-S, несущим кодон-оптимизированную версию гена RBD-S (AAV5-RBD-SCO) приводит к выработке специфических антител к RBD-S (Фиг. 3). При этом уровень антител к RBD-S был сопоставим с уровнем антител в группе животных, иммунизированных рекомбинантным белком RBD-S (Фиг. 4). В тоже время, не наблюдалась выработка антител к RBD-S в группах животных, которым вводили контрольный раствор без AAV и препарат AAV5, не содержащий экспрессионную кассету с геном RBD-S (пустые капсиды AAV5) (Фиг. 5, 6). Важно отметить, что при иммунизации препаратом AAV5-RBD-S, несущим кодон-оптимизированную версию гена RBD-S (AAV5-RBD-SCO), динамика развития иммунного ответа была достоверно выше, чем при иммунизации препаратом AAV5-RBD-S, несущим природную версию гена RBD-S (AAV5-RBD-SWT) (Фиг. 3). С помощью реакции микронейтрализации было показано, что антитела к белку RBD-S, образующиеся в результате иммунизации животных препаратом AAV5-RBD-SCO, обладают нейтрализующей активностью по отношению к нативному вирусу SARS-CoV-2 (Фиг. 7). При этом титр нейтрализующих антител в образцах сывороток крови животных, иммунизированных препаратом AAV5-RBD-SCO был достоверно выше, по сравнению с образцами сывороток крови животных, иммунизированных препаратом AAV5-RBD-SWT и был сопоставим с титром нейтрализиющих антител в образцах сыворотки крови COVID-19 реконвалесцентов (Фиг. 7).
Таким образом, рекомбинантный вирус на основе AAV5 несущий кодон-оптимизированную версию гена RBD-S по изобретению и вакцина на его основе обладают высоким потенциалом для индукции специфического иммунитета к вирусу SARS-CoV-2 и могут использоваться для профилактики коронавирусной инфекции, вызванной вирусом SARS-CoV-2. Кроме того, они имеют преимущество перед классическими системами на основе рекомбинантных белковых антигенов, так как вектор AAV способен обеспечить долговременную многолетнюю экспрессию антигена.
--->
Перечень последовательностей
<110> ЗАО «БИОКАД»
<120> Вакцина на основе AAV5 для индукции специфического иммунитета
к вирусу SARS-CoV-2 и/или профиактик коронавирусной инфекции,
вызванной SARS-CoV-2
<160> 19
<170> BiSSAP 1.3.6
<210> 1
<211> 278
<212> PRT
<213> Искусственная последовательность
<220>
<223> Выделенный рекомбинантный рецептор-связывающий домен гликопротеина
S (RBD-S) вируса SARS-CoV-2 с аминокислотной заменой в 272 положении
<400> 1
Arg Val Gln Pro Thr Glu Ser Ile Val Arg Phe Pro Asn Ile Thr Asn
1 5 10 15
Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala Ser Val
20 25 30
Tyr Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp Tyr Ser
35 40 45
Val Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr Gly Val
50 55 60
Ser Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr Ala Asp
65 70 75 80
Ser Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro Gly Gln
85 90 95
Thr Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp Phe Thr
100 105 110
Gly Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys Val Gly
115 120 125
Gly Asn Tyr Asn Tyr Leu Tyr Arg Leu Phe Arg Lys Ser Asn Leu Lys
130 135 140
Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly Ser Thr
145 150 155 160
Pro Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu Gln Ser
165 170 175
Tyr Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr Arg Val
180 185 190
Val Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val Cys Gly
195 200 205
Pro Lys Lys Ser Thr Asn Leu Val Lys Asn Lys Cys Val Asn Phe Asn
210 215 220
Phe Asn Gly Leu Thr Gly Thr Gly Val Leu Thr Glu Ser Asn Lys Lys
225 230 235 240
Phe Leu Pro Phe Gln Gln Phe Gly Arg Asp Ile Ala Asp Thr Thr Asp
245 250 255
Ala Val Arg Asp Pro Gln Thr Leu Glu Ile Leu Asp Ile Thr Pro Ser
260 265 270
Ser Phe Gly Gly Val Ser
275
<210> 2
<211> 834
<212> DNA
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая рекомбинантный рецептор-связывающий
домен гликопротеина S (RBD-S) вируса SARS-CoV-2
<400> 2
agagtccaac caacagaatc tattgttaga tttcctaata ttacaaactt gtgccctttt 60
ggtgaagttt ttaacgccac cagatttgca tctgtttatg cttggaacag gaagagaatc 120
agcaactgtg ttgctgatta ttctgtccta tataattccg catcattttc cacttttaag 180
tgttatggag tgtctcctac taaattaaat gatctctgct ttactaatgt ctatgcagat 240
tcatttgtaa ttagaggtga tgaagtcaga caaatcgctc cagggcaaac tggaaagatt 300
gctgattata attataaatt accagatgat tttacaggct gcgttatagc ttggaattct 360
aacaatcttg attctaaggt tggtggtaat tataattacc tgtatagatt gtttaggaag 420
tctaatctca aaccttttga gagagatatt tcaactgaaa tctatcaggc cggtagcaca 480
ccttgtaatg gtgttgaagg ttttaattgt tactttcctt tacaatcata tggtttccaa 540
cccactaatg gtgttggtta ccaaccatac agagtagtag tactttcttt tgaacttcta 600
catgcaccag caactgtttg tggacctaaa aagtctacta atttggttaa aaacaaatgt 660
gtcaatttca acttcaatgg tttaacaggc acaggtgttc ttactgagtc taacaaaaag 720
tttctgcctt tccaacaatt tggcagagac attgctgaca ctactgatgc tgtccgtgat 780
ccacagacac ttgagattct tgacattaca ccatcttctt ttggtggtgt cagt 834
<210> 3
<211> 2940
<212> DNA
<213> Искусственная последовательность
<220>
<223> Экспрессионная кассета с геном рекомбинантного рецептор-связывающего
домена гликпротеина S (RBD-S) вируса SARS-CoV-2
<400> 3
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcgtcg ggcgaccttt 60
ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtggccaa ctccatcact 120
aggggttcct gcggccgcac gcgtctagtt attaatagta atcaattacg gggtcattag 180
ttcatagccc atatatggag ttccgcgtta cataacttac ggtaaatggc ccgcctggct 240
gaccgcccaa cgacccccgc ccattgacgt caataatgac gtatgttccc atagtaacgc 300
caatagggac tttccattga cgtcaatggg tggagtattt acggtaaact gcccacttgg 360
cagtacatca agtgtatcat atgccaagta cgccccctat tgacgtcaat gacggtaaat 420
ggcccgcctg gcattatgcc cagtacatga ccttatggga ctttcctact tggcagtaca 480
tctacgtatt agtcatcgct attaccatgg tgatgcggtt ttggcagtac atcaatgggc 540
gtggatagcg gtttgactca cggggatttc caagtctcca ccccattgac gtcaatggga 600
gtttgttttg gcaccaaaat caacgggact ttccaaaatg tcgtaacaac tccgccccat 660
tgacgcaaat gggcggtagg cgtgtacggt gggaggtcta tataagcaga gctcgtttag 720
tgaaccgtca gatcgcctgg agacgccatc cacgctgttt tgacctccat agaagacacc 780
gggaccgatc cagcctccgc ggattcgaat cccggccggg aacggtgcat tggaacgcgg 840
attccccgtg ccaagagtga cgtaagtacc gcctatagag tctataggcc cacaaaaaat 900
gctttcttct tttaatatac ttttttgttt atcttatttc taatactttc cctaatctct 960
ttctttcagg gcaataatga tacaatgtat catgcctctt tgcaccattc taaagaataa 1020
cagtgataat ttctgggtta aggcaatagc aatatttctg catataaata tttctgcata 1080
taaattgtaa ctgatgtaag aggtttcata ttgctaatag cagctacaat ccagctacca 1140
ttctgctttt attttatggt tgggataagg ctggattatt ctgagtccaa gctaggccct 1200
tttgctaatc atgttcatac ctcttatctt cctcccacag ctcctgggca acgtgctggt 1260
ctgtgtgctg gcccatcact ttggcaaaga attgggattc gaacatcgcg ataattagcc 1320
gccaccatgg agaccgacac cctgctgctg tgggtgctgc tgctgtgggt gcccgggtcg 1380
accgggagag tccaaccaac agaatctatt gttagatttc ctaatattac aaacttgtgc 1440
ccttttggtg aagtttttaa cgccaccaga tttgcatctg tttatgcttg gaacaggaag 1500
agaatcagca actgtgttgc tgattattct gtcctatata attccgcatc attttccact 1560
tttaagtgtt atggagtgtc tcctactaaa ttaaatgatc tctgctttac taatgtctat 1620
gcagattcat ttgtaattag aggtgatgaa gtcagacaaa tcgctccagg gcaaactgga 1680
aagattgctg attataatta taaattacca gatgatttta caggctgcgt tatagcttgg 1740
aattctaaca atcttgattc taaggttggt ggtaattata attacctgta tagattgttt 1800
aggaagtcta atctcaaacc ttttgagaga gatatttcaa ctgaaatcta tcaggccggt 1860
agcacacctt gtaatggtgt tgaaggtttt aattgttact ttcctttaca atcatatggt 1920
ttccaaccca ctaatggtgt tggttaccaa ccatacagag tagtagtact ttcttttgaa 1980
cttctacatg caccagcaac tgtttgtgga cctaaaaagt ctactaattt ggttaaaaac 2040
aaatgtgtca atttcaactt caatggttta acaggcacag gtgttcttac tgagtctaac 2100
aaaaagtttc tgcctttcca acaatttggc agagacattg ctgacactac tgatgctgtc 2160
cgtgatccac agacacttga gattcttgac attacaccat cttcttttgg tggtgtcagt 2220
taaggatcct ctagagtcga cctgcagaag cttgcctcga gcagcgctgc tcgagagatc 2280
tacgggtggc atccctgtga cccctcccca gtgcctctcc tggccctgga agttgccact 2340
ccagtgccca ccagccttgt cctaataaaa ttaagttgca tcattttgtc tgactaggtg 2400
tccttctata atattatggg gtggaggggg gtggtatgga gcaaggggca agttgggaag 2460
acaacctgta gggcctgcgg ggtctattgg gaaccaagct ggagtgcagt ggcacaatct 2520
tggctcactg caatctccgc ctcctgggtt caagcgattc tcctgcctca gcctcccgag 2580
ttgttgggat tccaggcatg catgaccagg ctcagctaat ttttgttttt ttggtagaga 2640
cggggtttca ccatattggc caggctggtc tccaactcct aatctcaggt gatctaccca 2700
ccttggcctc ccaaattgct gggattacag gcgtgaacca ctgctccctt ccctgtcctt 2760
ctgattttgt aggtaaccac gtgcggaccg agcggccgca ggaaccccta gtgatggagt 2820
tggccactcc ctctctgcgc gctcgctcgc tcactgaggc cgggcgacca aaggtcgccc 2880
gacgcccggg ctttgcccgg gcggcctcag tgagcgagcg agcgcgcagc tgcctgcagg 2940
<210> 4
<211> 724
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность белка VP1 капсида AAV5 дикого типа
<400> 4
Met Ser Phe Val Asp His Pro Pro Asp Trp Leu Glu Glu Val Gly Glu
1 5 10 15
Gly Leu Arg Glu Phe Leu Gly Leu Glu Ala Gly Pro Pro Lys Pro Lys
20 25 30
Pro Asn Gln Gln His Gln Asp Gln Ala Arg Gly Leu Val Leu Pro Gly
35 40 45
Tyr Asn Tyr Leu Gly Pro Gly Asn Gly Leu Asp Arg Gly Glu Pro Val
50 55 60
Asn Arg Ala Asp Glu Val Ala Arg Glu His Asp Ile Ser Tyr Asn Glu
65 70 75 80
Gln Leu Glu Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Glu Lys Leu Ala Asp Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Phe
115 120 125
Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Thr Gly Lys Arg Ile
130 135 140
Asp Asp His Phe Pro Lys Arg Lys Lys Ala Arg Thr Glu Glu Asp Ser
145 150 155 160
Lys Pro Ser Thr Ser Ser Asp Ala Glu Ala Gly Pro Ser Gly Ser Gln
165 170 175
Gln Leu Gln Ile Pro Ala Gln Pro Ala Ser Ser Leu Gly Ala Asp Thr
180 185 190
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
195 200 205
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
210 215 220
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
225 230 235 240
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
245 250 255
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
260 265 270
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
275 280 285
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
290 295 300
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
305 310 315 320
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
325 330 335
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
340 345 350
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
355 360 365
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
370 375 380
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
385 390 395 400
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
405 410 415
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
420 425 430
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
435 440 445
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
450 455 460
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
465 470 475 480
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
485 490 495
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
500 505 510
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
515 520 525
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
530 535 540
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
545 550 555 560
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
565 570 575
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
580 585 590
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
595 600 605
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
610 615 620
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
625 630 635 640
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
645 650 655
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
660 665 670
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
675 680 685
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
690 695 700
Ser Thr Gly Glu Tyr Arg Thr Thr Arg Pro Ile Gly Thr Arg Tyr Leu
705 710 715 720
Thr Arg Pro Leu
<210> 5
<211> 724
<212> PRT
<213> Искусственная последовательность
<220>
<223> Выделенный модифицированный белок VP1 капсида AAV5, который
включает замены S2A и T711S
<400> 5
Met Ala Phe Val Asp His Pro Pro Asp Trp Leu Glu Glu Val Gly Glu
1 5 10 15
Gly Leu Arg Glu Phe Leu Gly Leu Glu Ala Gly Pro Pro Lys Pro Lys
20 25 30
Pro Asn Gln Gln His Gln Asp Gln Ala Arg Gly Leu Val Leu Pro Gly
35 40 45
Tyr Asn Tyr Leu Gly Pro Gly Asn Gly Leu Asp Arg Gly Glu Pro Val
50 55 60
Asn Arg Ala Asp Glu Val Ala Arg Glu His Asp Ile Ser Tyr Asn Glu
65 70 75 80
Gln Leu Glu Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Glu Lys Leu Ala Asp Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Phe
115 120 125
Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Thr Gly Lys Arg Ile
130 135 140
Asp Asp His Phe Pro Lys Arg Lys Lys Ala Arg Thr Glu Glu Asp Ser
145 150 155 160
Lys Pro Ser Thr Ser Ser Asp Ala Glu Ala Gly Pro Ser Gly Ser Gln
165 170 175
Gln Leu Gln Ile Pro Ala Gln Pro Ala Ser Ser Leu Gly Ala Asp Thr
180 185 190
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
195 200 205
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
210 215 220
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
225 230 235 240
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
245 250 255
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
260 265 270
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
275 280 285
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
290 295 300
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
305 310 315 320
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
325 330 335
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
340 345 350
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
355 360 365
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
370 375 380
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
385 390 395 400
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
405 410 415
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
420 425 430
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
435 440 445
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
450 455 460
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
465 470 475 480
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
485 490 495
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
500 505 510
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
515 520 525
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
530 535 540
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
545 550 555 560
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
565 570 575
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
580 585 590
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
595 600 605
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
610 615 620
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
625 630 635 640
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
645 650 655
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
660 665 670
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
675 680 685
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
690 695 700
Ser Thr Gly Glu Tyr Arg Ser Thr Arg Pro Ile Gly Thr Arg Tyr Leu
705 710 715 720
Thr Arg Pro Leu
<210> 6
<211> 1273
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность полноразмерного гликопротеина S
вируса SARS-CoV-2
<400> 6
Met Phe Val Phe Leu Val Leu Leu Pro Leu Val Ser Ser Gln Cys Val
1 5 10 15
Asn Leu Thr Thr Arg Thr Gln Leu Pro Pro Ala Tyr Thr Asn Ser Phe
20 25 30
Thr Arg Gly Val Tyr Tyr Pro Asp Lys Val Phe Arg Ser Ser Val Leu
35 40 45
His Ser Thr Gln Asp Leu Phe Leu Pro Phe Phe Ser Asn Val Thr Trp
50 55 60
Phe His Ala Ile His Val Ser Gly Thr Asn Gly Thr Lys Arg Phe Asp
65 70 75 80
Asn Pro Val Leu Pro Phe Asn Asp Gly Val Tyr Phe Ala Ser Thr Glu
85 90 95
Lys Ser Asn Ile Ile Arg Gly Trp Ile Phe Gly Thr Thr Leu Asp Ser
100 105 110
Lys Thr Gln Ser Leu Leu Ile Val Asn Asn Ala Thr Asn Val Val Ile
115 120 125
Lys Val Cys Glu Phe Gln Phe Cys Asn Asp Pro Phe Leu Gly Val Tyr
130 135 140
Tyr His Lys Asn Asn Lys Ser Trp Met Glu Ser Glu Phe Arg Val Tyr
145 150 155 160
Ser Ser Ala Asn Asn Cys Thr Phe Glu Tyr Val Ser Gln Pro Phe Leu
165 170 175
Met Asp Leu Glu Gly Lys Gln Gly Asn Phe Lys Asn Leu Arg Glu Phe
180 185 190
Val Phe Lys Asn Ile Asp Gly Tyr Phe Lys Ile Tyr Ser Lys His Thr
195 200 205
Pro Ile Asn Leu Val Arg Asp Leu Pro Gln Gly Phe Ser Ala Leu Glu
210 215 220
Pro Leu Val Asp Leu Pro Ile Gly Ile Asn Ile Thr Arg Phe Gln Thr
225 230 235 240
Leu Leu Ala Leu His Arg Ser Tyr Leu Thr Pro Gly Asp Ser Ser Ser
245 250 255
Gly Trp Thr Ala Gly Ala Ala Ala Tyr Tyr Val Gly Tyr Leu Gln Pro
260 265 270
Arg Thr Phe Leu Leu Lys Tyr Asn Glu Asn Gly Thr Ile Thr Asp Ala
275 280 285
Val Asp Cys Ala Leu Asp Pro Leu Ser Glu Thr Lys Cys Thr Leu Lys
290 295 300
Ser Phe Thr Val Glu Lys Gly Ile Tyr Gln Thr Ser Asn Phe Arg Val
305 310 315 320
Gln Pro Thr Glu Ser Ile Val Arg Phe Pro Asn Ile Thr Asn Leu Cys
325 330 335
Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala Ser Val Tyr Ala
340 345 350
Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp Tyr Ser Val Leu
355 360 365
Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr Gly Val Ser Pro
370 375 380
Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr Ala Asp Ser Phe
385 390 395 400
Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro Gly Gln Thr Gly
405 410 415
Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp Phe Thr Gly Cys
420 425 430
Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys Val Gly Gly Asn
435 440 445
Tyr Asn Tyr Leu Tyr Arg Leu Phe Arg Lys Ser Asn Leu Lys Pro Phe
450 455 460
Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly Ser Thr Pro Cys
465 470 475 480
Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu Gln Ser Tyr Gly
485 490 495
Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr Arg Val Val Val
500 505 510
Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val Cys Gly Pro Lys
515 520 525
Lys Ser Thr Asn Leu Val Lys Asn Lys Cys Val Asn Phe Asn Phe Asn
530 535 540
Gly Leu Thr Gly Thr Gly Val Leu Thr Glu Ser Asn Lys Lys Phe Leu
545 550 555 560
Pro Phe Gln Gln Phe Gly Arg Asp Ile Ala Asp Thr Thr Asp Ala Val
565 570 575
Arg Asp Pro Gln Thr Leu Glu Ile Leu Asp Ile Thr Pro Cys Ser Phe
580 585 590
Gly Gly Val Ser Val Ile Thr Pro Gly Thr Asn Thr Ser Asn Gln Val
595 600 605
Ala Val Leu Tyr Gln Asp Val Asn Cys Thr Glu Val Pro Val Ala Ile
610 615 620
His Ala Asp Gln Leu Thr Pro Thr Trp Arg Val Tyr Ser Thr Gly Ser
625 630 635 640
Asn Val Phe Gln Thr Arg Ala Gly Cys Leu Ile Gly Ala Glu His Val
645 650 655
Asn Asn Ser Tyr Glu Cys Asp Ile Pro Ile Gly Ala Gly Ile Cys Ala
660 665 670
Ser Tyr Gln Thr Gln Thr Asn Ser Pro Arg Arg Ala Arg Ser Val Ala
675 680 685
Ser Gln Ser Ile Ile Ala Tyr Thr Met Ser Leu Gly Ala Glu Asn Ser
690 695 700
Val Ala Tyr Ser Asn Asn Ser Ile Ala Ile Pro Thr Asn Phe Thr Ile
705 710 715 720
Ser Val Thr Thr Glu Ile Leu Pro Val Ser Met Thr Lys Thr Ser Val
725 730 735
Asp Cys Thr Met Tyr Ile Cys Gly Asp Ser Thr Glu Cys Ser Asn Leu
740 745 750
Leu Leu Gln Tyr Gly Ser Phe Cys Thr Gln Leu Asn Arg Ala Leu Thr
755 760 765
Gly Ile Ala Val Glu Gln Asp Lys Asn Thr Gln Glu Val Phe Ala Gln
770 775 780
Val Lys Gln Ile Tyr Lys Thr Pro Pro Ile Lys Asp Phe Gly Gly Phe
785 790 795 800
Asn Phe Ser Gln Ile Leu Pro Asp Pro Ser Lys Pro Ser Lys Arg Ser
805 810 815
Phe Ile Glu Asp Leu Leu Phe Asn Lys Val Thr Leu Ala Asp Ala Gly
820 825 830
Phe Ile Lys Gln Tyr Gly Asp Cys Leu Gly Asp Ile Ala Ala Arg Asp
835 840 845
Leu Ile Cys Ala Gln Lys Phe Asn Gly Leu Thr Val Leu Pro Pro Leu
850 855 860
Leu Thr Asp Glu Met Ile Ala Gln Tyr Thr Ser Ala Leu Leu Ala Gly
865 870 875 880
Thr Ile Thr Ser Gly Trp Thr Phe Gly Ala Gly Ala Ala Leu Gln Ile
885 890 895
Pro Phe Ala Met Gln Met Ala Tyr Arg Phe Asn Gly Ile Gly Val Thr
900 905 910
Gln Asn Val Leu Tyr Glu Asn Gln Lys Leu Ile Ala Asn Gln Phe Asn
915 920 925
Ser Ala Ile Gly Lys Ile Gln Asp Ser Leu Ser Ser Thr Ala Ser Ala
930 935 940
Leu Gly Lys Leu Gln Asp Val Val Asn Gln Asn Ala Gln Ala Leu Asn
945 950 955 960
Thr Leu Val Lys Gln Leu Ser Ser Asn Phe Gly Ala Ile Ser Ser Val
965 970 975
Leu Asn Asp Ile Leu Ser Arg Leu Asp Lys Val Glu Ala Glu Val Gln
980 985 990
Ile Asp Arg Leu Ile Thr Gly Arg Leu Gln Ser Leu Gln Thr Tyr Val
995 1000 1005
Thr Gln Gln Leu Ile Arg Ala Ala Glu Ile Arg Ala Ser Ala Asn Leu
1010 1015 1020
Ala Ala Thr Lys Met Ser Glu Cys Val Leu Gly Gln Ser Lys Arg Val
1025 1030 1035 1040
Asp Phe Cys Gly Lys Gly Tyr His Leu Met Ser Phe Pro Gln Ser Ala
1045 1050 1055
Pro His Gly Val Val Phe Leu His Val Thr Tyr Val Pro Ala Gln Glu
1060 1065 1070
Lys Asn Phe Thr Thr Ala Pro Ala Ile Cys His Asp Gly Lys Ala His
1075 1080 1085
Phe Pro Arg Glu Gly Val Phe Val Ser Asn Gly Thr His Trp Phe Val
1090 1095 1100
Thr Gln Arg Asn Phe Tyr Glu Pro Gln Ile Ile Thr Thr Asp Asn Thr
1105 1110 1115 1120
Phe Val Ser Gly Asn Cys Asp Val Val Ile Gly Ile Val Asn Asn Thr
1125 1130 1135
Val Tyr Asp Pro Leu Gln Pro Glu Leu Asp Ser Phe Lys Glu Glu Leu
1140 1145 1150
Asp Lys Tyr Phe Lys Asn His Thr Ser Pro Asp Val Asp Leu Gly Asp
1155 1160 1165
Ile Ser Gly Ile Asn Ala Ser Val Val Asn Ile Gln Lys Glu Ile Asp
1170 1175 1180
Arg Leu Asn Glu Val Ala Lys Asn Leu Asn Glu Ser Leu Ile Asp Leu
1185 1190 1195 1200
Gln Glu Leu Gly Lys Tyr Glu Gln Tyr Ile Lys Trp Pro Trp Tyr Ile
1205 1210 1215
Trp Leu Gly Phe Ile Ala Gly Leu Ile Ala Ile Val Met Val Thr Ile
1220 1225 1230
Met Leu Cys Cys Met Thr Ser Cys Cys Ser Cys Leu Lys Gly Cys Cys
1235 1240 1245
Ser Cys Gly Ser Cys Cys Lys Phe Asp Glu Asp Asp Ser Glu Pro Val
1250 1255 1260
Leu Lys Gly Val Lys Leu His Tyr Thr
1265 1270
<210> 7
<211> 278
<212> PRT
<213> Искусственная последовательность
<220>
<223> Выделенный рекомбинантный рецептор-связывающий домен гликопротеина
S (RBD-S) вируса SARS-CoV-2
<400> 7
Arg Val Gln Pro Thr Glu Ser Ile Val Arg Phe Pro Asn Ile Thr Asn
1 5 10 15
Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala Ser Val
20 25 30
Tyr Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp Tyr Ser
35 40 45
Val Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr Gly Val
50 55 60
Ser Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr Ala Asp
65 70 75 80
Ser Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro Gly Gln
85 90 95
Thr Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp Phe Thr
100 105 110
Gly Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys Val Gly
115 120 125
Gly Asn Tyr Asn Tyr Leu Tyr Arg Leu Phe Arg Lys Ser Asn Leu Lys
130 135 140
Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly Ser Thr
145 150 155 160
Pro Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu Gln Ser
165 170 175
Tyr Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr Arg Val
180 185 190
Val Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val Cys Gly
195 200 205
Pro Lys Lys Ser Thr Asn Leu Val Lys Asn Lys Cys Val Asn Phe Asn
210 215 220
Phe Asn Gly Leu Thr Gly Thr Gly Val Leu Thr Glu Ser Asn Lys Lys
225 230 235 240
Phe Leu Pro Phe Gln Gln Phe Gly Arg Asp Ile Ala Asp Thr Thr Asp
245 250 255
Ala Val Arg Asp Pro Gln Thr Leu Glu Ile Leu Asp Ile Thr Pro Cys
260 265 270
Ser Phe Gly Gly Val Ser
275
<210> 8
<211> 130
<212> DNA
<213> Природная последовательность
<220>
<223> Рлевый (первый) ITR (инвертированный концевые повторы)
<400> 8
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcgtcg ggcgaccttt 60
ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtggccaa ctccatcact 120
aggggttcct 130
<210> 9
<211> 304
<212> DNA
<213> Природная последовательность
<220>
<223> CMV (цитомегаловирусный) энхансер
<400> 9
cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt 60
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc attgacgtca 120
atgggtggag tatttacggt aaactgccca cttggcagta catcaagtgt atcatatgcc 180
aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt atgcccagta 240
catgacctta tgggactttc ctacttggca gtacatctac gtattagtca tcgctattac 300
catg 304
<210> 10
<211> 204
<212> DNA
<213> Природная последовательность
<220>
<223> CMV (цитомегаловирусный) промотер
<400> 10
gtgatgcggt tttggcagta catcaatggg cgtggatagc ggtttgactc acggggattt 60
ccaagtctcc accccattga cgtcaatggg agtttgtttt ggcaccaaaa tcaacgggac 120
tttccaaaat gtcgtaacaa ctccgcccca ttgacgcaaa tgggcggtag gcgtgtacgg 180
tgggaggtct atataagcag agct 204
<210> 11
<211> 493
<212> DNA
<213> Природная последовательность
<220>
<223> интрон гена hBG1 (ген субъединицы гемоглобина гамма-1)
<400> 11
cgaatcccgg ccgggaacgg tgcattggaa cgcggattcc ccgtgccaag agtgacgtaa 60
gtaccgccta tagagtctat aggcccacaa aaaatgcttt cttcttttaa tatacttttt 120
tgtttatctt atttctaata ctttccctaa tctctttctt tcagggcaat aatgatacaa 180
tgtatcatgc ctctttgcac cattctaaag aataacagtg ataatttctg ggttaaggca 240
atagcaatat ttctgcatat aaatatttct gcatataaat tgtaactgat gtaagaggtt 300
tcatattgct aatagcagct acaatccagc taccattctg cttttatttt atggttggga 360
taaggctgga ttattctgag tccaagctag gcccttttgc taatcatgtt catacctctt 420
atcttcctcc cacagctcct gggcaacgtg ctggtctgtg tgctggccca tcactttggc 480
aaagaattgg gat 493
<210> 12
<211> 479
<212> DNA
<213> Природная последовательность
<220>
<223> сигнал полиаденирования hBG1 (сигнал полиаденирования гена гормона
роста человека)
<400> 12
acgggtggca tccctgtgac ccctccccag tgcctctcct ggccctggaa gttgccactc 60
cagtgcccac cagccttgtc ctaataaaat taagttgcat cattttgtct gactaggtgt 120
ccttctataa tattatgggg tggagggggg tggtatggag caaggggcaa gttgggaaga 180
caacctgtag ggcctgcggg gtctattggg aaccaagctg gagtgcagtg gcacaatctt 240
ggctcactgc aatctccgcc tcctgggttc aagcgattct cctgcctcag cctcccgagt 300
tgttgggatt ccaggcatgc atgaccaggc tcagctaatt tttgtttttt tggtagagac 360
ggggtttcac catattggcc aggctggtct ccaactccta atctcaggtg atctacccac 420
cttggcctcc caaattgctg ggattacagg cgtgaaccac tgctcccttc cctgtcctt 479
<210> 13
<211> 141
<212> DNA
<213> Природная последовательность
<220>
<223> правый (второй) ITR
<400> 13
aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg ctcactgagg 60
ccgggcgacc aaaggtcgcc cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc 120
gagcgcgcag ctgcctgcag g 141
<210> 14
<211> 588
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность белка VP2 капсида AAV5 дикого типа
<400> 14
Thr Ala Pro Thr Gly Lys Arg Ile Asp Asp His Phe Pro Lys Arg Lys
1 5 10 15
Lys Ala Arg Thr Glu Glu Asp Ser Lys Pro Ser Thr Ser Ser Asp Ala
20 25 30
Glu Ala Gly Pro Ser Gly Ser Gln Gln Leu Gln Ile Pro Ala Gln Pro
35 40 45
Ala Ser Ser Leu Gly Ala Asp Thr Met Ser Ala Gly Gly Gly Gly Pro
50 55 60
Leu Gly Asp Asn Asn Gln Gly Ala Asp Gly Val Gly Asn Ala Ser Gly
65 70 75 80
Asp Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Val Thr Lys
85 90 95
Ser Thr Arg Thr Trp Val Leu Pro Ser Tyr Asn Asn His Gln Tyr Arg
100 105 110
Glu Ile Lys Ser Gly Ser Val Asp Gly Ser Asn Ala Asn Ala Tyr Phe
115 120 125
Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Ser
130 135 140
His Trp Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Tyr Trp Gly
145 150 155 160
Phe Arg Pro Arg Ser Leu Arg Val Lys Ile Phe Asn Ile Gln Val Lys
165 170 175
Glu Val Thr Val Gln Asp Ser Thr Thr Thr Ile Ala Asn Asn Leu Thr
180 185 190
Ser Thr Val Gln Val Phe Thr Asp Asp Asp Tyr Gln Leu Pro Tyr Val
195 200 205
Val Gly Asn Gly Thr Glu Gly Cys Leu Pro Ala Phe Pro Pro Gln Val
210 215 220
Phe Thr Leu Pro Gln Tyr Gly Tyr Ala Thr Leu Asn Arg Asp Asn Thr
225 230 235 240
Glu Asn Pro Thr Glu Arg Ser Ser Phe Phe Cys Leu Glu Tyr Phe Pro
245 250 255
Ser Lys Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Thr Tyr Asn Phe
260 265 270
Glu Glu Val Pro Phe His Ser Ser Phe Ala Pro Ser Gln Asn Leu Phe
275 280 285
Lys Leu Ala Asn Pro Leu Val Asp Gln Tyr Leu Tyr Arg Phe Val Ser
290 295 300
Thr Asn Asn Thr Gly Gly Val Gln Phe Asn Lys Asn Leu Ala Gly Arg
305 310 315 320
Tyr Ala Asn Thr Tyr Lys Asn Trp Phe Pro Gly Pro Met Gly Arg Thr
325 330 335
Gln Gly Trp Asn Leu Gly Ser Gly Val Asn Arg Ala Ser Val Ser Ala
340 345 350
Phe Ala Thr Thr Asn Arg Met Glu Leu Glu Gly Ala Ser Tyr Gln Val
355 360 365
Pro Pro Gln Pro Asn Gly Met Thr Asn Asn Leu Gln Gly Ser Asn Thr
370 375 380
Tyr Ala Leu Glu Asn Thr Met Ile Phe Asn Ser Gln Pro Ala Asn Pro
385 390 395 400
Gly Thr Thr Ala Thr Tyr Leu Glu Gly Asn Met Leu Ile Thr Ser Glu
405 410 415
Ser Glu Thr Gln Pro Val Asn Arg Val Ala Tyr Asn Val Gly Gly Gln
420 425 430
Met Ala Thr Asn Asn Gln Ser Ser Thr Thr Ala Pro Ala Thr Gly Thr
435 440 445
Tyr Asn Leu Gln Glu Ile Val Pro Gly Ser Val Trp Met Glu Arg Asp
450 455 460
Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro Glu Thr Gly Ala
465 470 475 480
His Phe His Pro Ser Pro Ala Met Gly Gly Phe Gly Leu Lys His Pro
485 490 495
Pro Pro Met Met Leu Ile Lys Asn Thr Pro Val Pro Gly Asn Ile Thr
500 505 510
Ser Phe Ser Asp Val Pro Val Ser Ser Phe Ile Thr Gln Tyr Ser Thr
515 520 525
Gly Gln Val Thr Val Glu Met Glu Trp Glu Leu Lys Lys Glu Asn Ser
530 535 540
Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Asn Asn Tyr Asn Asp Pro
545 550 555 560
Gln Phe Val Asp Phe Ala Pro Asp Ser Thr Gly Glu Tyr Arg Thr Thr
565 570 575
Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
580 585
<210> 15
<211> 532
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность белка VP3 капсида AAV5 дикого типа
<400> 15
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
1 5 10 15
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
20 25 30
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
35 40 45
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
50 55 60
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
65 70 75 80
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
85 90 95
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
100 105 110
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
115 120 125
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
130 135 140
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
145 150 155 160
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
165 170 175
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
180 185 190
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
195 200 205
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
210 215 220
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
225 230 235 240
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
245 250 255
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
260 265 270
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
275 280 285
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
290 295 300
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
305 310 315 320
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
325 330 335
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
340 345 350
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
355 360 365
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
370 375 380
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
385 390 395 400
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
405 410 415
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
420 425 430
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
435 440 445
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
450 455 460
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
465 470 475 480
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
485 490 495
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
500 505 510
Ser Thr Gly Glu Tyr Arg Thr Thr Arg Pro Ile Gly Thr Arg Tyr Leu
515 520 525
Thr Arg Pro Leu
530
<210> 16
<211> 588
<212> PRT
<213> Искусственная последовательность
<220>
<223> Выделенный модифицированный белок VP1 капсида AAV5, который включает
замену T575S
<400> 16
Thr Ala Pro Thr Gly Lys Arg Ile Asp Asp His Phe Pro Lys Arg Lys
1 5 10 15
Lys Ala Arg Thr Glu Glu Asp Ser Lys Pro Ser Thr Ser Ser Asp Ala
20 25 30
Glu Ala Gly Pro Ser Gly Ser Gln Gln Leu Gln Ile Pro Ala Gln Pro
35 40 45
Ala Ser Ser Leu Gly Ala Asp Thr Met Ser Ala Gly Gly Gly Gly Pro
50 55 60
Leu Gly Asp Asn Asn Gln Gly Ala Asp Gly Val Gly Asn Ala Ser Gly
65 70 75 80
Asp Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Val Thr Lys
85 90 95
Ser Thr Arg Thr Trp Val Leu Pro Ser Tyr Asn Asn His Gln Tyr Arg
100 105 110
Glu Ile Lys Ser Gly Ser Val Asp Gly Ser Asn Ala Asn Ala Tyr Phe
115 120 125
Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Ser
130 135 140
His Trp Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Tyr Trp Gly
145 150 155 160
Phe Arg Pro Arg Ser Leu Arg Val Lys Ile Phe Asn Ile Gln Val Lys
165 170 175
Glu Val Thr Val Gln Asp Ser Thr Thr Thr Ile Ala Asn Asn Leu Thr
180 185 190
Ser Thr Val Gln Val Phe Thr Asp Asp Asp Tyr Gln Leu Pro Tyr Val
195 200 205
Val Gly Asn Gly Thr Glu Gly Cys Leu Pro Ala Phe Pro Pro Gln Val
210 215 220
Phe Thr Leu Pro Gln Tyr Gly Tyr Ala Thr Leu Asn Arg Asp Asn Thr
225 230 235 240
Glu Asn Pro Thr Glu Arg Ser Ser Phe Phe Cys Leu Glu Tyr Phe Pro
245 250 255
Ser Lys Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Thr Tyr Asn Phe
260 265 270
Glu Glu Val Pro Phe His Ser Ser Phe Ala Pro Ser Gln Asn Leu Phe
275 280 285
Lys Leu Ala Asn Pro Leu Val Asp Gln Tyr Leu Tyr Arg Phe Val Ser
290 295 300
Thr Asn Asn Thr Gly Gly Val Gln Phe Asn Lys Asn Leu Ala Gly Arg
305 310 315 320
Tyr Ala Asn Thr Tyr Lys Asn Trp Phe Pro Gly Pro Met Gly Arg Thr
325 330 335
Gln Gly Trp Asn Leu Gly Ser Gly Val Asn Arg Ala Ser Val Ser Ala
340 345 350
Phe Ala Thr Thr Asn Arg Met Glu Leu Glu Gly Ala Ser Tyr Gln Val
355 360 365
Pro Pro Gln Pro Asn Gly Met Thr Asn Asn Leu Gln Gly Ser Asn Thr
370 375 380
Tyr Ala Leu Glu Asn Thr Met Ile Phe Asn Ser Gln Pro Ala Asn Pro
385 390 395 400
Gly Thr Thr Ala Thr Tyr Leu Glu Gly Asn Met Leu Ile Thr Ser Glu
405 410 415
Ser Glu Thr Gln Pro Val Asn Arg Val Ala Tyr Asn Val Gly Gly Gln
420 425 430
Met Ala Thr Asn Asn Gln Ser Ser Thr Thr Ala Pro Ala Thr Gly Thr
435 440 445
Tyr Asn Leu Gln Glu Ile Val Pro Gly Ser Val Trp Met Glu Arg Asp
450 455 460
Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro Glu Thr Gly Ala
465 470 475 480
His Phe His Pro Ser Pro Ala Met Gly Gly Phe Gly Leu Lys His Pro
485 490 495
Pro Pro Met Met Leu Ile Lys Asn Thr Pro Val Pro Gly Asn Ile Thr
500 505 510
Ser Phe Ser Asp Val Pro Val Ser Ser Phe Ile Thr Gln Tyr Ser Thr
515 520 525
Gly Gln Val Thr Val Glu Met Glu Trp Glu Leu Lys Lys Glu Asn Ser
530 535 540
Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Asn Asn Tyr Asn Asp Pro
545 550 555 560
Gln Phe Val Asp Phe Ala Pro Asp Ser Thr Gly Glu Tyr Arg Ser Thr
565 570 575
Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
580 585
<210> 17
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> Выделенный модифицированный белок VP1 капсида AAV5, который включает
замену T519S
<400> 17
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
1 5 10 15
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
20 25 30
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
35 40 45
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
50 55 60
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
65 70 75 80
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
85 90 95
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
100 105 110
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
115 120 125
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
130 135 140
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
145 150 155 160
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
165 170 175
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
180 185 190
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
195 200 205
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
210 215 220
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
225 230 235 240
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
245 250 255
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
260 265 270
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
275 280 285
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
290 295 300
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
305 310 315 320
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
325 330 335
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
340 345 350
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
355 360 365
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
370 375 380
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
385 390 395 400
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
405 410 415
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
420 425 430
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
435 440 445
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
450 455 460
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
465 470 475 480
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
485 490 495
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
500 505 510
Ser Thr Gly Glu Tyr Arg Ser Thr Arg Pro Ile Gly Thr Arg Tyr Leu
515 520 525
Thr Arg Pro Leu
530
<210> 18
<211> 834
<212> DNA
<213> Искусственная последовательность
<220>
<223> экспрессионная кассета с кодон-оптимизированным геном рекомбинантный
рецептор-связывающий домен гликопротеина S (RBD-SCO) вируса SARS-CoV-2
<400> 18
agagtgcagc ctaccgagag catcgtgaga ttccccaaca tcaccaacct gtgcccattc 60
ggagaggtgt tcaacgccac tagatttgcc agcgtgtatg cctggaatag gaagaggatc 120
tccaattgtg tggccgacta ctccgtgctg tataattccg cctcctttag caccttcaag 180
tgttatggcg tgtcccccac aaagctgaat gacctgtgct tcaccaacgt gtacgccgat 240
tccttcgtga ttagaggcga cgaggtgagg cagattgcac caggacagac tggcaagatt 300
gccgactaca actacaagct gcccgatgat ttcacaggct gtgtgatcgc ctggaacagc 360
aataacctgg acagcaaagt gggaggcaac tacaactacc tgtacagact gttcaggaag 420
tccaatctga agcctttcga gagagacatc agcaccgaga tctaccaggc cggctcaaca 480
ccatgtaatg gagtggaggg ctttaactgt tacttccccc tgcagtctta cggcttccag 540
cccactaatg gcgtgggata tcagccctat agagtggtgg tgctgagctt tgagctgctg 600
catgctccag ctaccgtgtg tggccctaag aagagcacca atctggtgaa gaataagtgc 660
gtgaacttca acttcaacgg cctgaccggc acaggagtgc tgacagaaag caataagaag 720
ttcctgccct tccagcagtt cggcagagat attgccgaca caaccgatgc cgtgagggac 780
ccacagactc tggagatcct ggatattaca cctagcagct ttgggggcgt gtcc 834
<210> 19
<211> 2936
<212> DNA
<213> Искусственная последовательность
<220>
<223> экспрессионная кассета с кодон-оптимизированным геном рекомбинантный
рецептор-связывающий домен гликопротеина S (RBD-SCO) вируса SARS-CoV-2
<400> 19
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcgtcg ggcgaccttt 60
ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtggccaa ctccatcact 120
aggggttcct gcggccgcac gcgtctagtt attaatagta atcaattacg gggtcattag 180
ttcatagccc atatatggag ttccgcgtta cataacttac ggtaaatggc ccgcctggct 240
gaccgcccaa cgacccccgc ccattgacgt caataatgac gtatgttccc atagtaacgc 300
caatagggac tttccattga cgtcaatggg tggagtattt acggtaaact gcccacttgg 360
cagtacatca agtgtatcat atgccaagta cgccccctat tgacgtcaat gacggtaaat 420
ggcccgcctg gcattatgcc cagtacatga ccttatggga ctttcctact tggcagtaca 480
tctacgtatt agtcatcgct attaccatgg tgatgcggtt ttggcagtac atcaatgggc 540
gtggatagcg gtttgactca cggggatttc caagtctcca ccccattgac gtcaatggga 600
gtttgttttg gcaccaaaat caacgggact ttccaaaatg tcgtaacaac tccgccccat 660
tgacgcaaat gggcggtagg cgtgtacggt gggaggtcta tataagcaga gctcgtttag 720
tgaaccgtca gatcgcctgg agacgccatc cacgctgttt tgacctccat agaagacacc 780
gggaccgatc cagcctccgc ggattcgaat cccggccggg aacggtgcat tggaacgcgg 840
attccccgtg ccaagagtga cgtaagtacc gcctatagag tctataggcc cacaaaaaat 900
gctttcttct tttaatatac ttttttgttt atcttatttc taatactttc cctaatctct 960
ttctttcagg gcaataatga tacaatgtat catgcctctt tgcaccattc taaagaataa 1020
cagtgataat ttctgggtta aggcaatagc aatatttctg catataaata tttctgcata 1080
taaattgtaa ctgatgtaag aggtttcata ttgctaatag cagctacaat ccagctacca 1140
ttctgctttt attttatggt tgggataagg ctggattatt ctgagtccaa gctaggccct 1200
tttgctaatc atgttcatac ctcttatctt cctcccacag ctcctgggca acgtgctggt 1260
ctgtgtgctg gcccatcact ttggcaaaga attgggattc gaacatcgat tgagccacca 1320
tggagaccga caccctgctg ctgtgggtgc tgctgctgtg ggtgcccggg tcgaccggga 1380
gagtgcagcc taccgagagc atcgtgagat tccccaacat caccaacctg tgcccattcg 1440
gagaggtgtt caacgccact agatttgcca gcgtgtatgc ctggaatagg aagaggatct 1500
ccaattgtgt ggccgactac tccgtgctgt ataattccgc ctcctttagc accttcaagt 1560
gttatggcgt gtcccccaca aagctgaatg acctgtgctt caccaacgtg tacgccgatt 1620
ccttcgtgat tagaggcgac gaggtgaggc agattgcacc aggacagact ggcaagattg 1680
ccgactacaa ctacaagctg cccgatgatt tcacaggctg tgtgatcgcc tggaacagca 1740
ataacctgga cagcaaagtg ggaggcaact acaactacct gtacagactg ttcaggaagt 1800
ccaatctgaa gcctttcgag agagacatca gcaccgagat ctaccaggcc ggctcaacac 1860
catgtaatgg agtggagggc tttaactgtt acttccccct gcagtcttac ggcttccagc 1920
ccactaatgg cgtgggatat cagccctata gagtggtggt gctgagcttt gagctgctgc 1980
atgctccagc taccgtgtgt ggccctaaga agagcaccaa tctggtgaag aataagtgcg 2040
tgaacttcaa cttcaacggc ctgaccggca caggagtgct gacagaaagc aataagaagt 2100
tcctgccctt ccagcagttc ggcagagata ttgccgacac aaccgatgcc gtgagggacc 2160
cacagactct ggagatcctg gatattacac ctagcagctt tgggggcgtg tcctaatagg 2220
gatcctctag agtcgacctg cagaagcttg cctcgagcag cgctgctcga gagatctacg 2280
ggtggcatcc ctgtgacccc tccccagtgc ctctcctggc cctggaagtt gccactccag 2340
tgcccaccag ccttgtccta ataaaattaa gttgcatcat tttgtctgac taggtgtcct 2400
tctataatat tatggggtgg aggggggtgg tatggagcaa ggggcaagtt gggaagacaa 2460
cctgtagggc ctgcggggtc tattgggaac caagctggag tgcagtggca caatcttggc 2520
tcactgcaat ctccgcctcc tgggttcaag cgattctcct gcctcagcct cccgagttgt 2580
tgggattcca ggcatgcatg accaggctca gctaattttt gtttttttgg tagagacggg 2640
gtttcaccat attggccagg ctggtctcca actcctaatc tcaggtgatc tacccacctt 2700
ggcctcccaa attgctggga ttacaggcgt gaaccactgc tcccttccct gtccttctga 2760
ttttgtaggt aaccacgtgc ggaccgagcg gccgcaggaa cccctagtga tggagttggc 2820
cactccctct ctgcgcgctc gctcgctcac tgaggccggg cgaccaaagg tcgcccgacg 2880
cccgggcttt gcccgggcgg cctcagtgag cgagcgagcg cgcagctgcc tgcagg 2936
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| БЕЛОК И ВАКЦИНА ПРОТИВ ИНФЕКЦИИ SARS-CoV-2 | 2020 |
|
RU2815060C1 |
| АНТИТЕЛА ПРОТИВ SARS-COV-2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2021 |
|
RU2832025C1 |
| Однодоменное антитело и его модификации, специфически связывающиеся с RBD S белка вируса SARS-CoV-2, и способ их применения для терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 | 2021 |
|
RU2763001C1 |
| Генная конструкция для экспрессии рекомбинантных белков на основе участка S-белка SARS-CoV-2, включающего RBD и SD1, слитого с Fc фрагментом IgG, способ получения рекомбинантных белков, антигены и антигенные композиции для индукции длительного антительного и клеточного иммунитета против вируса SARS-CoV-2 | 2021 |
|
RU2802825C2 |
| Гуманизированное моноклональное антитело, специфически связывающиеся с RBD S белка вируса SARS-CoV-2, средство и способ для терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 | 2021 |
|
RU2765731C1 |
| Средство и способ терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 на основе рекомбинантного антитела и гуманизированного моноклонального антитела | 2021 |
|
RU2769223C1 |
| Выделенный рекомбинантный вирус на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и/или профилактики заболеваний, вызванных вирусом гриппа | 2021 |
|
RU2813150C2 |
| УСОВЕРШЕНСТВОВАННАЯ КОРОНАВИРУСНАЯ ВАКЦИНА | 2022 |
|
RU2816182C2 |
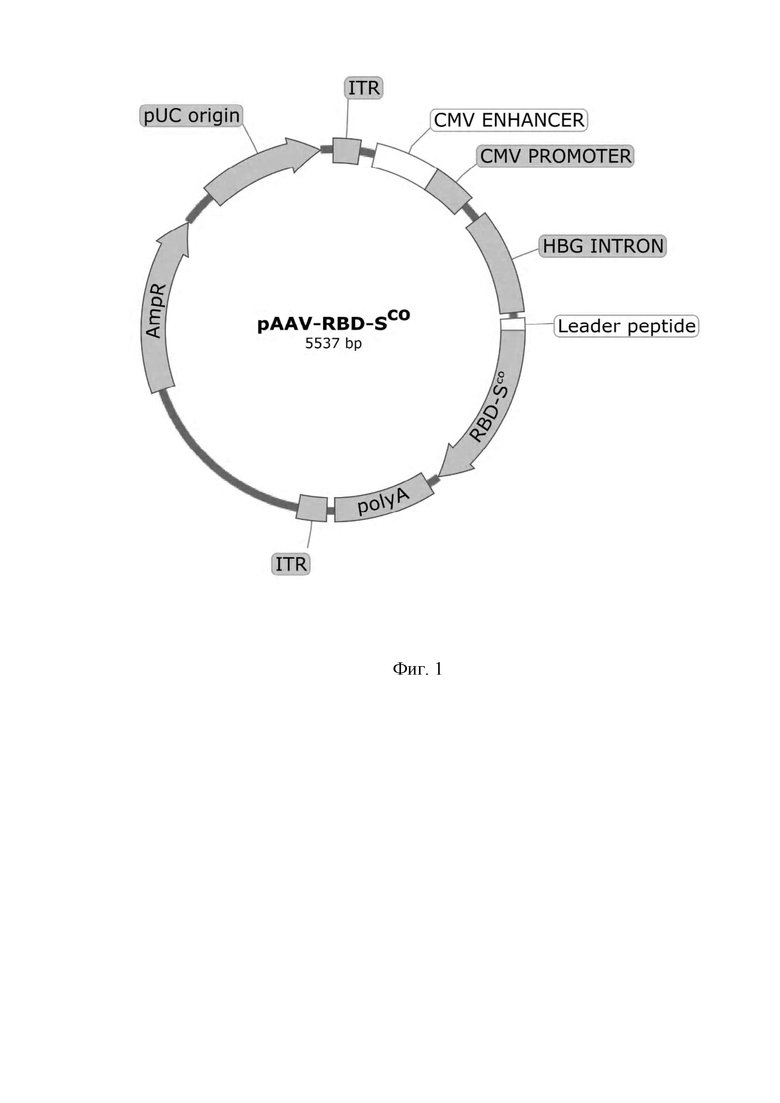
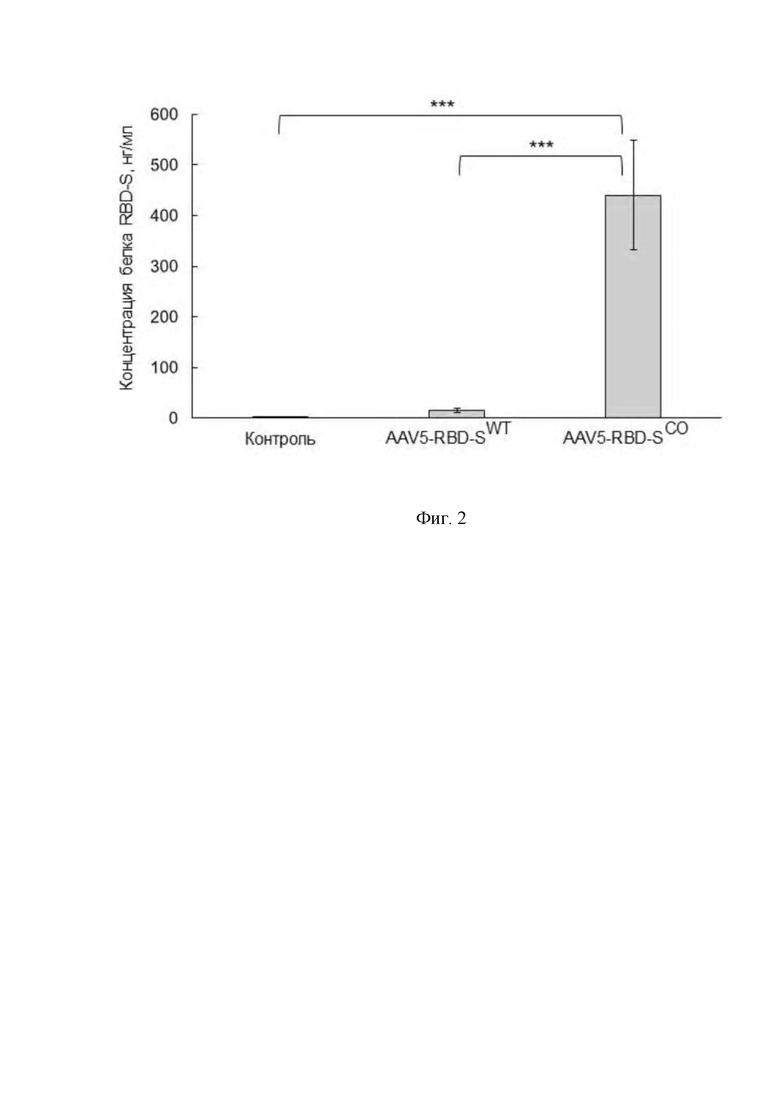
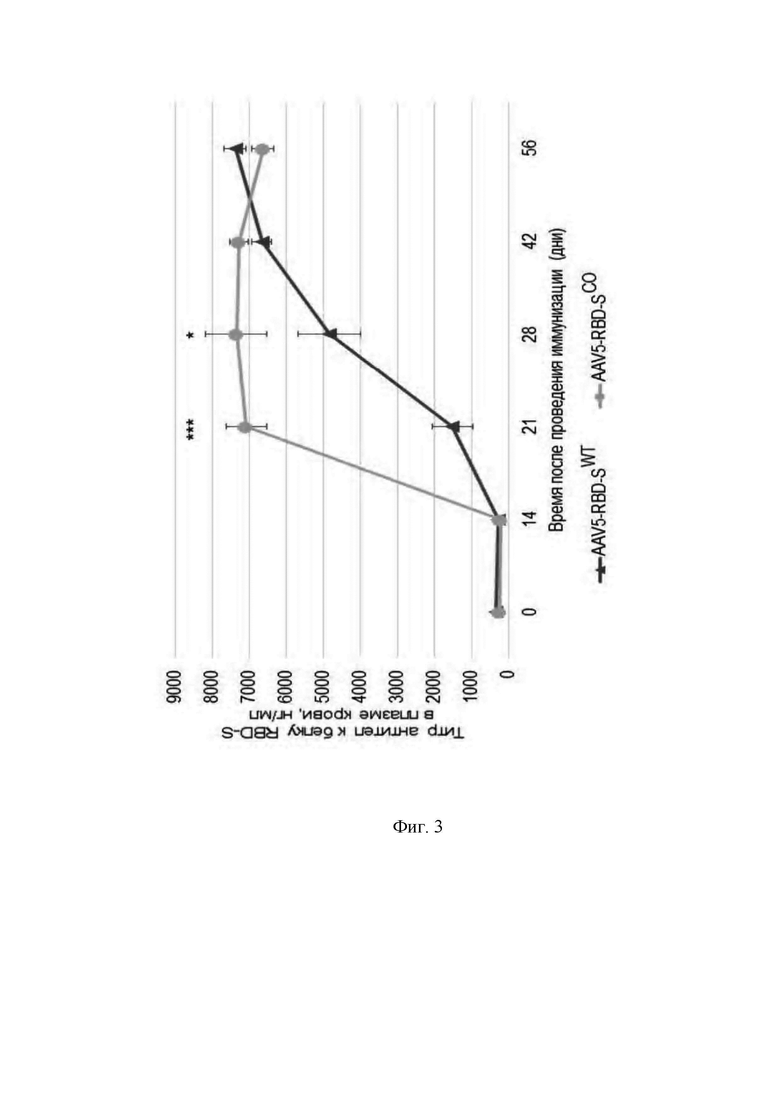
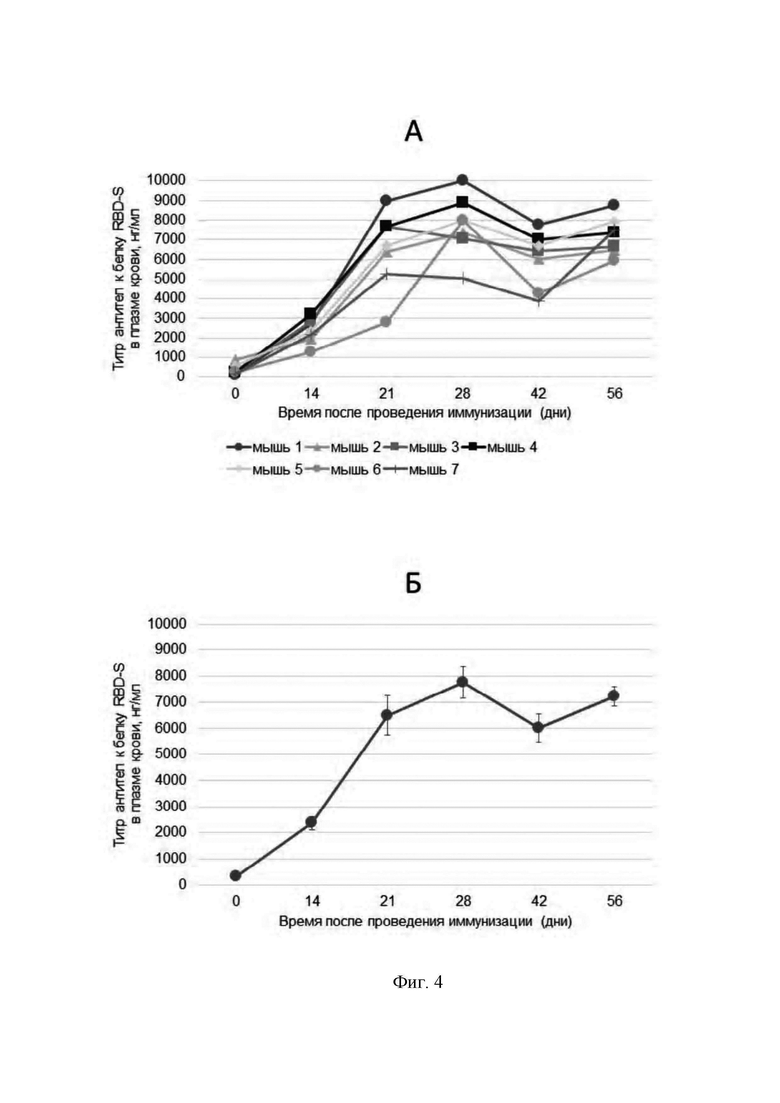
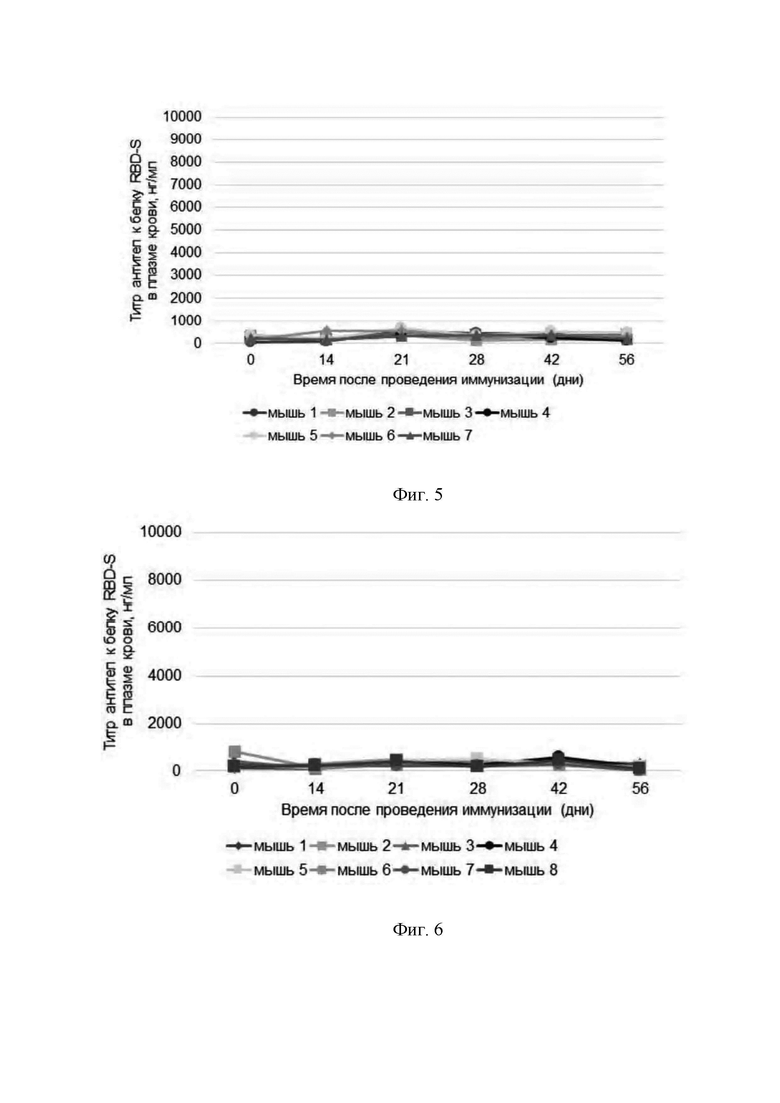
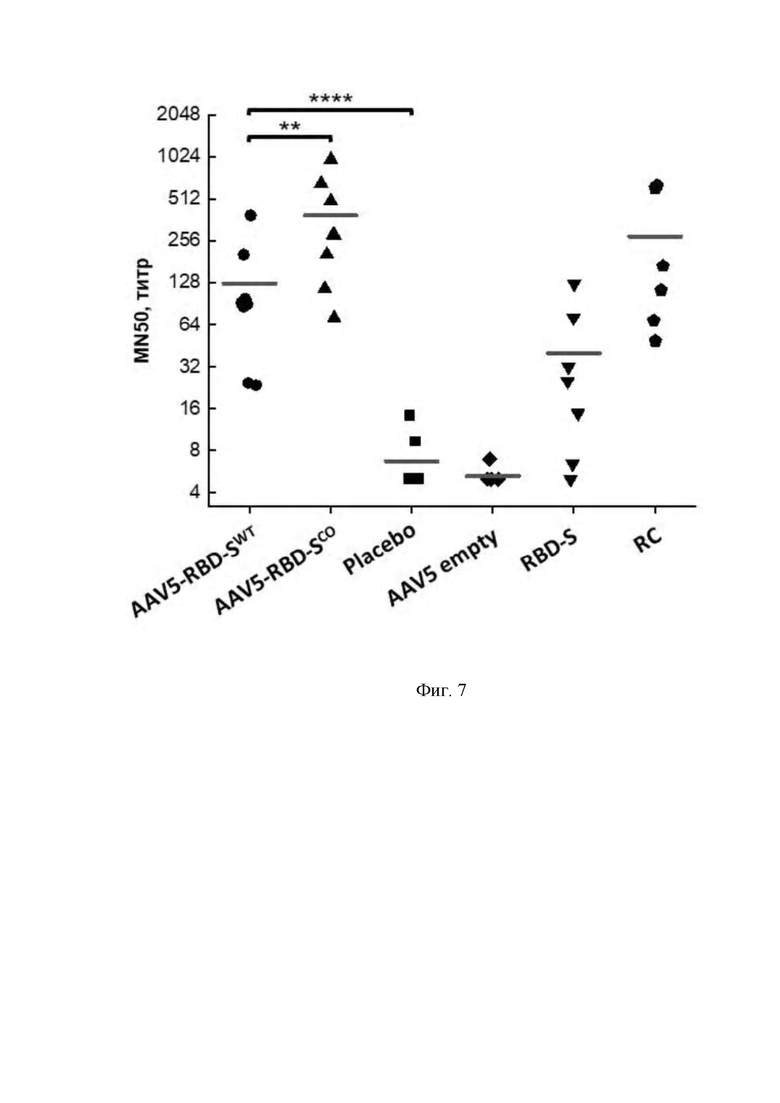
Изобретение относится к области биотехнологии, иммунологии, вирусологии, генетики и молекулярной биологии. Описана выделенная кодон-оптимизированная нуклеиновая кислота, которая кодирует выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2, экспрессионная кассета и вектор на ее основе. Представлен рекомбинантный вирус на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2. Раскрыто их применение для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2. Изобретение расширяет арсенал средств для борьбы с коронавирусной инфекцией. 6 н. и 9 з.п. ф-лы, 7 ил., 1 табл., 5 пр.
1. Выделенная нуклеиновая кислота, кодирующая выделенный рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, которая представляет собой нуклеотидную последовательность SEQ ID NO: 18.
2. Кассета, экспрессирующая рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, которая включает нуклеиновую кислоту по п. 1.
3. Кассета по п.2, включающая следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV (цитомегаловирусный) энхансер;
CMV (цитомегаловирусный) промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
нуклеиновую кислоту по п. 1;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
4. Кассета по п.3, которая включает нуклеиновую кислоту с нуклеотидной последовательностью SEQ ID NO: 19.
5. Выделенный рекомбинантный вирус на основе AAV5 (аденоассоциированный вирус 5 серотипа) для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, экспрессирующий рекомбинантный рецептор-связывающий домен гликопротеина S (RBD-S) вируса SARS-CoV-2 c аминокислотной последовательностью SEQ ID NO: 1, который включает нуклеиновую кислоту по п. 1 или кассету по любому из пп. 2-4.
6. Рекомбинантный вирус на основе AAV5 по п. 5, где капсид включает белок VP1 AAV5.
7. Рекомбинантный вирус на основе AAV5 по п. 6, где капсид включает белок VP1 AAV, имеющий аминокислотную последовательность SEQ ID NO: 4.
8. Рекомбинантный вирус на основе AAV5 по п. 6, где капсид включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями.
9. Рекомбинантный вирус на основе AAV5 по п. 8, где капсид включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 5.
10. Рекомбинантный вирус на основе AAV5 по любому из пп. 5-9, где капсид включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
CMV (цитомегаловирусный) энхансер;
CMV (цитомегаловирусный) промотер;
интрон гена hBG1 (ген субъединицы гемоглобина гамма-1);
нуклеиновую кислоту по п. 1;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
11. Рекомбинантный вирус на основе AAV5 по п. 10, где капсид включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеиновую кислоту с SEQ ID NO: 19.
12. Рекомбинантный вирус на основе AAV5 по любому из пп. 10, 11, где белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 4 с одной или несколькими точечными мутациями, представляет собой аминокислотную последовательность SEQ ID NO: 5.
13. Фармацевтическая композиция для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, включающая рекомбинантный вирус на основе AAV5 по любому из пп. 5-12 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
14. Применение рекомбинантного вируса на основе AAV5 по любому из пп. 5-12 или композиции по п. 13 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2.
15. Способ индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2, включающий введение в организм млекопитающих рекомбинантного вируса на основе AAV5 по любому из пп. 5-12 или композиции по п. 13 в эффективном количестве.
Авторы
Даты
2021-11-23—Публикация
2020-12-21—Подача