По настоящей заявке испрашивает приоритет по заявке на патент Китая 201810575543.4, поданной 6 июня 2018 года и имеющей название "АНТИТЕЛА ПРОТИВ ЛИГАНДА ПРОГРАММИРУЕМОЙ СМЕРТИ (PD-L1) И ИХ ПРИМЕНЕНИЕ", содержание которой полностью включено сюда путем указания ссылки.
Область, к которой относится изобретение
Настоящая заявка относится к области биомедицины и, более конкретно, описывает антитела против лиганда программируемой смерти (PD-L1) и их применение, в частности, для лечения и/или предотвращения заболеваний, связанных с PD-L1.
Уровень техники
Рецептор программируемой смерти-1 (PD-1) представляет собой член семейства рецепторов CD28, которое включает CD28, CTLA-4, ICOS, PD-1 и BTLA. Первые члены данного семейства, CD28 и ICOS, были открыты благодаря функции стимулирования пролиферации Т-клеток после добавления моноклональных антител. Для PD-1 были идентифицированы два гликопротеиновых лиганда клеточной поверхности: PD-L1 и PD-L2. Было показано, что после связывания с PD-1 они снижают активацию Т-клеток и секрецию цитокинов. PD-L1 (В7-Н1) и PD-L2 (B7-DC) представляют собой гомологи В7, которые могут связываться с PD-1, но не могут связываться с другими членами семейства CD28.
Экспрессия PD-L1 была обнаружена при некоторых видах рака у мышей и человека, включая рак легкого человека, рак яичника, рак толстой кишки, меланому и различные виды миеломы. Результаты показали, что PD-L1, который экспрессируется в больших количествах опухолевыми клетками, может повышать апоптоз Т-клеток, тем самым играя важную роль в иммунном ускользании опухолей. Исследователи обнаружили, что линия опухолевых клеток Р815, трансфицированная геном PD-L1, может сопротивляться лизису определенных CTL in vivo, при этом после инокуляции мышам она обладает большей онкогенностью и инвазивностью. Данные биологические характеристики могут быть изменены путем блокирования PD-L1. У нокаутных по гену PD-1 мышей сигнальный путь PD-L1/PD-1 является заблокированным, при этом инокулированные опухолевые клетки не могут образовывать опухоли. Также было высказано предположение, что PD-L1 может быть связан с воспалением слизистой оболочки кишечника, при этом ингибирование PD-L1 предотвращает развитие атрофического заболевания, связанного с колитом.
Ранее были разработаны некоторые антитела против PD-L1, такие как MDX-1105 (WO2007/005874), Tecentriq (Атезолизумаб) и др. Тем не менее, в данной области сохраняется потребность в антителах против PD-L1, которые могут связываться с PD-L1 с высокой аффинностью и могут блокировать связывание PD-1 с PD-L1.
Краткое описание изобретения
В одном аспекте предусмотрено антитело против PD-L1 (PD-L1 антитело) или его антигенсвязывающий фрагмент, при этом антитело или его антигенсвязывающий фрагмент специфически распознает и связывает PD-L1.
В одном варианте осуществления антитело против PD-L1 включает антитело против PD-L1 В10, антитело против PD-L1 В11, антитело против PD-L1 Н12 или их комбинацию, в частности, антитело против PD-L1 ВН.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент может специфически распознавать и связывать PD-L1, при этом аффинность составляет 1×10-9 М или менее, предпочтительно 5×10-10 М или менее, более предпочтительно 1×10-10 М или менее.
В одном аспекте предусмотрено антитело В10 против PD-L1 (также известное здесь как антитело против PD-L1 В10 или антитело В10) или его антигенсвязывающий фрагмент,
при этом антитело включает вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
Н CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 1,
Н CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 2, и
Н CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 3;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 5,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 6, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 7.
В одном варианте осуществления антитело против PD-L1 В10 включает вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 4, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 4.
В другом варианте осуществления антитело против PD-L1 В10 включает вариабельный участок легкой цепи, при этом вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 8, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 8.
В другом аспекте предусмотрено антитело В11 против PD-L1 (также известное здесь как антитело против PD-L1 В11 или антитело В11) или его антигенсвязывающий фрагмент,
при этом антитело включает вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
Н CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 9,
Н CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 10, и
Н CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 11;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 13,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 14, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 15.
В одном варианте осуществления антитело против PD-L1 В11 включает вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 12, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 12.
В другом варианте осуществления антитело против PD-L1 В11 включает вариабельный участок легкой цепи, при этом вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 16, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 16.
В другом варианте осуществления антитело против PD-L1 В11 включает тяжелую цепь, при этом тяжелая цепь включает аминокислотную последовательность, как показано в SEQ ID NO: 28, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 28.
В другом варианте осуществления антитело против PD-L1 В11 включает легкую цепь, при этом легкая цепь включает аминокислотную последовательность, как показано в SEQ ID NO: 27, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 27.
В другом аспекте предусмотрено антитело Н12 против PD-L1 (также известное здесь как антитело против PD-L1 Н12 или антитело Н12) или его антигенсвязывающий фрагмент,
при этом антитело включает вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
Н CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 17,
Н CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 18, и
Н CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 19;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 21,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 22, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 23.
В другом варианте осуществления антитело против PD-L1 Н12 включает вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 20, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 20.
В другом варианте осуществления антитело против PD-L1 Н12 включает вариабельный участок легкой цепи, при этом вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 24, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 24.
В другом аспекте предусмотрена фармацевтическая композиция, включающая антитело в соответствии с настоящим изобретением или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель. В одном варианте осуществления антитело включает антитело против PD-L1 В10, антитело против PD-L1 В11, антитело против PD-L1 Н12 или их комбинацию, в частности, антитело против PD-L1 ВН.
В одном аспекте предусмотрено применение антитела или его антигенсвязывающего фрагмента в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением для производства лекарственного средства для лечения неопластического заболевания.
В другом аспекте предусмотрен способ лечения неопластического заболевания, включающий введение нуждающемуся в этом субъекту антитела или его антигенсвязывающего фрагмента в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением.
В другом аспекте предусмотрено антитело или его антигенсвязывающий фрагмент в соответствии с изобретением или фармацевтическая композиция в соответствии с изобретением для применения при лечении неопластического заболевания.
В одном варианте осуществления вышеуказанное антитело включает антитело против PD-L1 В10, антитело против PD-L1 В11, антитело против PD-L1 Н12 или их комбинацию, в частности, антитело против PD-L1 ВН.
В другом варианте осуществления неопластическое заболевание представляет собой PD-L1-положительную опухоль. В другом варианте осуществления PD-L1-положительная опухоль представляет собой рак легкого, рак яичника, рак толстой кишки, меланому или миелому, в частности, рак толстой кишки или немелкоклеточный рак легкого.
В некоторых вариантах осуществления вышеуказанный способ или применение также включает применение других видов противоопухолевого лечения, например введение химиотерапевтического агента, антитела, нацеленного против другого опухолеспецифического антигена, или радиотерапию.
В другом аспекте предусмотрена выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент в соответствии с изобретением. В другом аспекте предусмотрен вектор экспрессии, включающий молекулу нуклеиновой кислоты в соответствии с изобретением. В другом аспекте предусмотрена клетка-хозяин, которая преобразована с помощью молекулы нуклеиновой кислоты в соответствии с изобретением или вектора экспрессии в соответствии с изобретением.
Описание фигур
Фиг. 1: Кривая связывания антител-кандидатов.
Фиг. 2: Результаты ELISA антител В10, В11 и H12.
Фиг. 3: Результаты активации Т-клеток, повышение уровней экспрессии IFNγ и IL-2 с помощью антител В10, В11, Н12.
Фиг. 4: Результаты блокирования связывания между hPD-L1 и hPD-1 с помощью антитела ВН.
Фиг. 5: Результаты блокирования взаимодействия между CD80 и PD-L1 с помощью антитела ВН.
Фиг. 6: Результаты клеточной биологической активности антитела ВН.
Фиг. 7: Результаты ингибирования роста опухолей с помощью антитела ВН.
Фиг. 8: Результаты ингибирования активности опухолей с помощью антитела ВН.
Подробное описание изобретения
Определения
В рамках настоящего контекста, если не указано иное, используемые здесь научные и технические термины обладают значением, которое обычно понимается специалистом в данной области. Более того, используемые здесь термины, относящиеся к химии белков и нуклеиновых кислот, молекулярной биологии, культивированию клеток и тканей, микробиологии, связанные с иммунологией термины и лабораторные процедуры являются терминами и стандартными процедурами, которые широко применяются в данной области. В то же время, в целях лучшего понимания изобретения приводятся следующие определения и объяснения.
В соответствии с используемым здесь значением термин "по меньшей мере, один" или "один или несколько" может означать 1, 2, 3, 4, 5, 6, 7, 8 или более.
В соответствии с используемым здесь значением термин "антитело" означает иммуноглобулин или фрагмент иммуноглобулина, являющийся природными или полученным частично или полностью синтетически (например, рекомбинантным), включающий любой фрагмент, включающий, по меньшей мере, часть вариабельного участка молекулы иммуноглобулина, и сохраняющий специфичность связывания полноразмерного иммуноглобулина. Таким образом, антитело включает любой белок, имеющий домен связывания, который является гомологичным или по существу гомологичным антигенсвязывающему домену иммуноглобулина (участок связывания антитела). Термин "антитело" охватывает фрагмент антитела. В соответствии с используемым здесь значением термин "антитело" включает синтетическое антитело, рекомбинантное антитело, мультиспецифическое антитело (например, биспецифическое антитело), антитело человека, антитело отличного от человека вида, гуманизированное антитело, химерное антитело, внутриклеточное антитело и фрагмент антитела, такой как, но без ограничения, Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, дисульфид-связанный Fv (dsFv), Fd фрагмент, Fd' фрагмент, одноцепочечный Fv (scFv), одноцепочечный Fab (scFab), диатело, антиидиотипическое (анти-Id) антитело или антигенсвязывающий фрагмент любого из вышеуказанных антител. Приведенные здесь антитела включают членов с иммуноглобулином любого типа (например IgG, IgM, IgD, IgE, IgA и IgY), любого класса (например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса (например IgG2a и IgG2b). В предпочтительном варианте осуществления антитело в соответствии с данным изобретением представляет собой антитело человека.
В соответствии с используемым здесь значением термин "фрагмент антитела" или "антигенсвязывающий фрагмент" антитела означает любую часть полноразмерного антитела, длина которого является более короткой, чем его полная длина, но которая, по меньшей мере, включает часть вариабельного участка антитела, связывающегося с антигеном (такую как один или несколько CDR и/или один или несколько участков связывания антитела), и, таким образом, сохраняет специфичность связывания и, по меньшей мере, часть специфичной способности связывания полноразмерного антитела. Таким образом, термин "антигенсвязывающий фрагмент" означает фрагмент антитела, который включает антигенсвязывающую часть, связывающуюся с тем же антигеном, что и антитело, производным которого является данный фрагмент антитела. Фрагмент антитела включает производное антитела, полученное путем ферментативной обработки полноразмерного антитела, и синтетически полученное производное, такое как производное, полученное с помощью рекомбинантных способов. Антитело включает фрагмент антитела. Примеры фрагментов антитела включают, но без ограничения, Fab, Fab', F(ab')2, одноцепочечный Fv (scFv), Fv, dsFv, диатело, Fd и Fd' фрагменты и другие фрагменты, включая модифицированные фрагменты (см., например, Methods in Molecular Biology, т 207: Recombinant Antibodies for Cancer Therapy Methods and Protocols (2003); Глава 1; стр. 3-25, Kipriyanov). Фрагмент может включать множество цепей, связанных друг с другом, например с помощью дисульфидной связи и/или пептидного линкера. Фрагмент антитела в целом содержит как минимум или около 50 аминокислот, и, как правило, как минимум или около 200 аминокислот. Антигенсвязывающий фрагмент включает любой фрагмент антитела, который образует антитело, которое иммуноспецифическим образом связывается с антигеном, при вставке в каркас антитела (например, путем замены соответствующего участка).
В соответствии с используемым здесь значением термин "стандартное антитело" означает антитело, которое включает две тяжелые цепи (которые могут быть обозначены как Н и Н') и две легкие цепи (которые могут быть обозначены как L и L') и два антигенсвязывающих участка, при этом каждая тяжелая цепь может представлять собой тяжелую цепь полноразмерного иммуноглобулина или любой его функциональный участок, которых сохраняет антигенсвязывающую способность (например, тяжелая цепь включает, но без ограничения, Vh цепь, Vh-Ch1 цепь и Vh-Ch1-Ch2-Ch3 цепь), а каждая легкая цепь может представлять собой полноразмерную легкую цепь или любой функциональный участок (например, легкая цепь включает, но без ограничения, Vl цепь и Vl-Cl цепь). Каждая тяжелая цепь (Н и Н') связана с легкой цепью (L и L', соответственно).
В соответствии с используемым здесь значением термин "полноразмерное антитело" означает антитело, которое имеет две полноразмерные тяжелые цепи (например, Vh-Ch1-Ch2-Ch3 или Vh-Ch1-Ch2-Ch3-Ch4) и две полноразмерные легкие цепи (Vl-Cl) и шарнирный участок. Например, полученное естественным образом антитело, секретируемое В-клетками, и полученное синтетическим способом антитело с теми же доменами.
В соответствии с используемым здесь значением термин "dsFv" означет Fv со сконструированным внутримолекулярными дисульфидными связями, которые стабилизируют пару Vh-Vl.
В соответствии с используемым здесь значением термин "Fab фрагмент" означает фрагмент антитела, полученный путем расщепления полноразмерного иммуноглобулина папаином или, например, фрагмент с такой же структурой, синтезируемый с помощью рекомбинантного способа. Fab фрагмент содержит легкую цепь (включающую Vl и Cl) и другую цепь, содержащую вариабельный домен тяжелой цепи (Vh) и домен константного участка тяжелой цепи (Сн1).
В соответствии с используемым здесь значением термин "F(ab')2 фрагмент" означает фрагмент антитела, полученный путем расщепления пепсином иммуноглобулинов при рН 4,0-4,5, или, например, фрагмент с такой же структурой, синтезированный с помощью рекомбинантного способа. F(ab')2 фрагмент по существу содержит два Fab фрагмента, при этом каждая часть тяжелой цепи содержит несколько дополнительных аминокислот, включая цистеины, которые образуют дисульфидную связь, соединяющую данные два фрагмента.
В соответствии с используемым здесь значением Fab' фрагмент представляет собой фрагмент, содержащий половину F(ab')2 фрагмента (тяжелую цепь и легкую цепь).
В соответствии с используемым здесь значением термин "scFv фрагмент" означает фрагмент антитела, включающий вариабельную легкую цепь (Vl) и вариабельную тяжелую цепь (Vh), ковалентно соединенные в любом порядке с помощью полипептидного линкера. Длина линкера обеспечивает по существу беспрепятственное связывание данных двух вариабельных доменов. Примером линкера являются (Gly-Ser)n-остатки с добавлением нескольких Glu и Lys остатков для повышения растворимости.
В соответствии с используемым здесь значением термин "вариабельный домен" или "вариабельный участок" означает определенный Ig домен тяжелой цепи или легкой цепи антитела, который включает аминокислотные последовательности, которые являются отличными у различных антител. Каждая легкая цепь и каждая тяжелая цепь имеет домен вариабельного участка Vl и Vh, соответственно. Вариабельные домены обеспечивают антигенную специфичность и таким образом отвечают за распознавание антигенов. Каждый вариабельный участок включает CDR и каркасный участок (FR), при этом CDR является частью антигенсвязывающего домена.
В соответствии с используемым здесь значением термины "антигенсвязывающий домен" и "антигенсвязывающий участок" используются взаимозаменяемым образом для обозначения домена в рамках антитела, который распознает и физически взаимодействует с соответствующим ему антигеном. Природная стандартная полноразмерная молекула антитела имеет два стандартных антигенсвязывающих участка, каждый из которых содержит часть в виде вариабельного участка тяжелой цепи и часть в виде вариабельного участка легкой цепи. Стандартный антигенсвязывающий участок содержит петлю, которая соединяет встречно-параллельные р-цепи в домене вариабельного участка. Антигенсвязывающий участок может содержать другие части домена вариабельного участка. Каждый стандартный антигенсвязывающий участок содержит 3 гипервариабельных участка из тяжелой цепи и 3 гипервариабельных участка из легкой цепи. Гипервариабельный участок также называется определяющим комплементарность участком (CDR).
В соответствии с используемым здесь значением термины "гипервариабельный участок", "HV", "определяющий комплементарность участок", "CDR" и "CDR антитела" могут использоваться взаимозаменяемым образом и означать каждую из множества частей в рамках вариабельных участков, которые совместно образуют антигенсвязывающий участок антитела. Каждый домен вариабельного участка содержит 3 CDR, обозначаемых как CDR1, CDR2 и CDR3. Например, домен вариабельного участка легкой цепи содержит 3 CDR, обозначаемых как L CDR1 (или VL CDR1), L CDR2 (или VL CDR2) и L CDR3 (или VL CDR3); домен вариабельного участка тяжелой цепи содержит 3 CDR, обозначаемых как Н CDR1 (или VH CDR1), Н CDR2 (или VH CDR2) и Н CDR3 (или VH CDR3). Данные 3 CDR в вариабельном участке расположены прерывистым образом в рамках аминокислотной последовательности, однако располагаются близко друг к другу в уложенном полипептиде. Данные CDR располагаются в петле, соединяющей параллельные цепи р-листов вариабельных доменов. Как описано здесь, специалист в данной области знаком и способен идентифицировать CDR на основе нумерации Kabat или Chothia (см., например, Kabat, Е.А. et al. (1991) Sequences of Proteins of Immunological Interest, 5-e изд., U.S. Department of Health and Human Services, NIH Publication No. 91-3242, и Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917).
В соответствии с используемым здесь значением термин "каркасный участок" (FR) означает структурный домен в рамках домена вариабельного участка антитела, расположенный в р-листе. В рамках аминокислотной последовательности FR участок является относительно более консервативным, чем гипервариабельный участок.
В соответствии с используемым здесь значением термин "домен константного участка" означает домен в тяжелой цепи или легкой цепи антитела, который содержит аминокислотную последовательность, которая является относительно более консервативной, чем аминокислотная последовательность домена вариабельного участка. В стандартной полноразмерной молекуле антитела каждая легкая цепь имеет один домен константного участка легкой цепи (CL), при этом каждая тяжелая цепь содержит один или несколько доменов константного участка тяжелой цепи (Сн), включая Сн1, Сн2, Сн3 и Сн4. Полноразмерные IgA, IgD и IgG изотипы содержат Сн1, Сн2, Сн3 и шарнирный участок, в то время как IgE и IgM содержат Сн1, Сн2, Сн3 и Сн4. Сн1 и CL домены располагаются в Fab плече молекулы антитела и, таким образом, могут обеспечивать взаимодействие с антигенами и поворот плеча антитела. Константный участок антитела может обеспечивать эффекторные функции, такие как, но без ограничения, удаление антигенов, патогенов и токсинов, специфически связываемых антителом, например путем взаимодействия с различными клетками, биологическими молекулами и тканями.
В соответствии с используемым здесь значением термин "функциональный участок Vh домена" означает, по меньшей мере, часть полного Vh домена, которая сохраняет, по меньшей мере, часть специфичности связывания полного Vh домена (например, за счет сохранения одного или нескольких CDR полного Vh домена), так что функциональный участок Vh домена самостоятельно или в комбинации с другим доменом антитела (таким как Vl домен) или его участком связывается с антигеном. Примером функционального участка Vh домена является участок, включающий CDR1, CDR2 и/или CDR3 VH домена.
В соответствии с используемым здесь значением термин "функциональный участок Vl домена" представляет собой, по меньше мере, часть полного Vl домена, которая сохраняет, по меньшей мере, часть специфичности связывания полного Vl домена (например, за счет сохранения одного или нескольких CDR полного Vl домена), так что функциональный участок Vl домена самостоятельно или в комбинации с другим доменом антитела (таким как Vh домен) или его участком связывается с антигеном. Примером функционального участка Vl домена является участок, включающий CDR1, CDR2 и/или CDR3 Vl домена.
KD "аффинности" или "аффинности связывания" зачастую определяют путем измерения равновесной константы ассоциации (ka) и равновесной константы диссоциации (kd) и вычисления отношения kd и ka (KD=kd/ka). В соответствии с используемым здесь значением термин "специфическое связывание" или "иммуноспецифическое связывание" при применении в отношении антитела или его антигенсвязывающего фрагмента применяется здесь взаимозаменяемым образом и означает способность антитела или его антигенсвязывающего фрагмента образовывать одну или несколько нековалентных связей с соответствующим ему антигеном за счет нековалентного взаимодействия между антителом и связывающим антитело участком антигена. Антиген может представлять собой выделенный антиген или присутствовать, например, в опухолевых клетках.
В одном варианте осуществления в соответствии с изобретением антитело или его антигенсвязывающий фрагмент в соответствии с изобретением может связывать антиген-мишень с аффинностью 2×10-9М или менее, 1×10-9М или менее, 9×10-10М или менее, 8×10-10М или менее, 7×10-10М или менее, 6×10-10М или менее, 5×10-10М или менее, 4×10-10М или менее, 3×10-10М или менее, 2×10-10М или менее, 1×10-10М или менее (например, PD-L1, такой как PD-L1 человека).
Аффинность может быть легко определена с применением стандартных способов, таких как равновесный диализ, путем применения инструмента BIAcore 2000 с использованием общих способов, указанных производителем, путем применения меченного радиоактивным изотопом антигена-мишени для радиоиммуноанализа или путем других способов, известных специалисту в данной области.
Термин "выделенный белок", "выделенный полипептид" или "выделенное антитело" означает, что белок, полипептид или антитело (1) не связано со своими естественным образом связанными с ним компонентами в рамках своей природной среды, (2) не содержит другого белка того же биологического вида, (3) экспрессируется клетками другого биологического вида, или (4) не существует в природе. Таким образом, химически синтезированный полипептид или полипептид, синтезированный в клеточной системе, отличной от природного источника данного полипептида, будет являться "отделенным" от своих естественным образом связанных с ним компонентов. Он также может быть выделен, то есть белок по существу не будет содержать естественным образом связанных с ним компонентов, например с помощью способов очистки белков, которые хорошо известны в данной области.
Специалисту в данной области известны подходящие консервативные аминокислотные замещения в пептиде или белке, которые в целом могут быть реализованы без изменения биологической активности получаемой молекулы. В целом, специалисту в данной области будет очевидно, что единичное аминокислотное замещение в несущественном участке полипептида не будет приводить к значительному изменению биологической активности (см., например, Watson et al., Molecular Biology of the Gene, 4-е изд., 1987, The Benjamin/Cummings Pub. со., стр. 224).
В соответствии с используемым здесь значением термины "полинуклеотид" и "молекула нуклеиновой кислоты" означают олигомер или полимер, включающий, по меньшей мере, два связанных нуклеотида или нуклеотидных производных, включая дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК), которые в целом являются связанными фосфоэфирными связями.
В соответствии с используемым здесь значением термин "выделенная молекула нуклеиновой кислоты" означает молекулу нуклеиновой кислоты, которая отделена от других молекул нуклеиновой кислоты, присутствующих в природном источнике молекул нуклеиновой кислоты. "Выделенная" молекула нуклеиновой кислоты, такая как кДНК молекула, может быть получена с помощью рекомбинантных способов и являться по существу свободной от других клеточных материалов или культуральных сред или по существу свободной от химических прекурсоров или иных химических компонентов при химическом синтезе. Примеры указанной здесь выделенной молекулы нуклеиновой кислоты включают выделенную молекулу нуклеиновой кислоты, кодирующую указанное антитело или антигенсвязывающий фрагмент.
Термин "идентичность последовательности" имеет хорошо известное значение в данной области, при этом процентная величина идентичности последовательности двух молекул нуклеиновой кислот или полипептидов или участков может быть вычислена с применением опубликованных способов. Идентичность последовательности может быть определена в рамках всей длины полинуклеотида или полипептида или в рамках участка молекулы (см., например Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, 4.1, Griffin, A.M., and Griffin, H.G, eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G, Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991). Несмотря на существование многих способов определения идентичности двух полинуклеотидов или полипептидов, термин "идентичность" хорошо известен специалисту в данной области (Carrillo, Н. & Lipman, D., SIAM J Applied Math 48:1073 (1988)).
В соответствии с используемым здесь значением термин "экспрессия" означает процесс получения полипептидов путем транскрипции и трансляции полинуклеотидов. Уровень экспрессии полипептидов может быть оценен с помощью любого способа, известного в данной области, включая, например, способы измерения количества полипептида, полученного из клетки-хозяина. Такие способы могут включать, но без ограничения, количественный анализ полипептидов в клеточных лизатах с помощью ELISA, окрашивания кумасси синим после электрофореза с применением геля, анализа белков Лоури и анализа белков Брэдфорда.
В соответствии с используемым здесь значением термин "клетка-хозяин" представляет собой клетку, используемую для получения, сохранения, репликации и амплификации вектора. Клетка-хозяин также может применяться для экспрессирования полипептида, кодируемого вектором. При делении клетки-хозяина содержащаяся в векторе нуклеиновая кислота реплицируется, при этом таким образом осуществляется амплификация нуклеиновой кислоты. Клетка-хозяин может представлять собой эукариотическую клетку или прокариотическую клетку. Подходящие клетки-хозяева включают, но без ограничения, СНО клетки, различные COS клетки, HeLa клетки, HEK клетки, такие как HEK 293 клетки.
В соответствии с используемым здесь значением термин "вектор" означает способную подвергаться репликации нуклеиновую кислоту. При переносе вектора в подходящую клетку-хозяина из вектора может экспрессироваться один или несколько гетеро логичных белков. Данный термин включает векторы, которые обычно расщепляются рестрикционными ферментами и подвергаются лигированию, в которые вводят кодирующую полипептид нуклеиновую кислоту или его фрагмент. Термин "вектор" также включает векторы, содержащие кодирующую полипептид нуклеиновую кислоту. Вектор применяют для введения кодирующей полипептид нуклеиновой кислоты в клетку-хозяин для амплификации нуклеиновой кислоты или для экспрессии/дисплея полипептида, кодируемого нуклеиновой кислотой. Вектор в целом не включает, но может быть модифицирован для встраивания гена или его части в хромосому генома. Данный термин также охватывает вектор искусственной хромосомы, такой как искусственный вектор дрожжей и вектор искусственной хромосома млекопитающего. Выбор и применение подобного вектора хорошо знакомы специалисту в данной области.
В соответствии с используемым здесь значением термин "вектор" также включает "вектор вируса" или "вирусный вектор". Вирусный вектор представляет собой сконструированный вирус, который функционально связан с чужеродным геном для переноса в клетку (в качестве носителя или челнока).
В соответствии с используемым здесь значением термин "вектор экспрессии" включает вектор, способный экспрессировать ДНК, при этом указанная ДНК функционально связана с регуляторной последовательностью, такой как промоторный участок, который может влиять на экспрессию подобных фрагментов ДНК. Подобные дополнительные фрагменты могут включать промоторные и концевые последовательности и могут необязательно включать одну или несколько точек начала репликации, один или несколько селективных маркеров, энхансеров, сигналов полиаденилирования и так далее. Вектор экспрессии в целом является производным плазмидной или вирусной ДНК или может включать оба данных компонента. Таким образом, термин "вектор экспрессии" означает конструкт в виде рекомбинантной ДНК или РНК, такой как плазмида, бактериофаг, рекомбинантный вирус или другие векторы при введении в подходящие клетки-хозяева, что приводит к экспрессии клонируемой ДНК. Подходящие векторы экспрессии хорошо известны специалисту в данной области и включают те из них, которые могут подвергаться репликации в эукариотических и/или прокариотических клетках, а также те, которые могут оставаться в свободном виде или встраиваться в геном клетки-хозяина.
В соответствии с используемым здесь значением термин "лечение" применительно к субъекту, страдающему заболеванием или имеющему связанное с заболеванием состояние, означает, что симптомы субъекта частично или полностью устраняются или остаются неизменными после лечения. Таким образом, лечение включает предотвращение, лечение и/или излечение. Термин "предотвращение" означает предотвращение потенциального заболевания и/или предотвращение ухудшения симптомов или прогрессирования заболевания. Лечение также включает любое фармацевтическое применение любого предусмотренного здесь антитела или его антигенсвязывающего фрагмента и композиции.
В соответствии с используемым здесь значением термин "терапевтический эффект" означает эффект, вызываемый благодаря лечению субъекта, то есть изменение, обычно в виде облегчения или улучшения симптомов заболевания или связанного с заболеванием состояния или излечение заболевания или связанного с заболеванием состояния.
В соответствии с используемым здесь значением термин "терапевтически эффективное количество" или "терапевтически эффективная доза" означает количество вещества, соединения, материала или композиции, содержащей соединение, которое является, по меньшей мере, достаточным для обеспечения терапевтического эффекта после введения субъекту. Таким образом, она представляет собой количество, необходимое для предотвращения, излечения, улучшения, блокирования или частичного блокирования симптомов заболевания или расстройства. Аналогичным образом, в соответствии с используемым здесь значением термин "профилактически эффективное количество" или "профилактически эффективная доза" означает количество вещества, соединения, материала или композиции, содержащей соединение, которое при введение субъекту будет вызывать ожидаемый профилактический эффект, например предотвращать или замедлять возникновение или повторное возникновение заболевания или симптома, снижать вероятность возникновения или повторного возникновения заболевания или симптома. Полная профилактически эффективная доза не обязательно соответствует введению одной дозы и может возникать лишь после введения нескольких доз. Таким образом, профилактически эффективное количество может быть введено в рамках одного или нескольких введений.
В соответствии с используемым здесь значением термин "субъект" означает млекопитающее, такое как человек.
Используемые здесь номера антитела (такой как B10, В11, Н12) применяются лишь для различения или идентификации антител или продуктов и не должны рассматриваться в качестве указывающих на то, что подобная идентификация представляет собой признак антитела или продукта в соответствии с изобретением. Специалисту в данной области будет понятно, что, например, для целей различения или идентификации другое антитело или продукт также может использовать подобную идентификацию, однако она не указывает на то же самое или эквивалентное антитело или продукт. Аналогичным образом, одинаковые номера или идентификаторы, применяемые в рамках раздела Примеры, приведены лишь для удобства описания. Антитело или продукт в соответствии с изобретением определяется на основе описанных здесь признаков в рамках прилагаемой формулы изобретения.
Антитела в соответствии с изобретением
Предусмотрено антитело против PD-L1 (PD-L1 антитело) или его антигенсвязывающий фрагмент, при этом антитело или его антигенсвязывающий фрагмент специфически распознает и связывает PD-L1.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент способен специфически распознавать и связывать PD-L1, при этом аффинность (KD) составляет 1×10-9 М или менее, предпочтительно 5×10-10 М или менее, более предпочтительно 1×10-10 М или менее.
В другом варианте осуществления антитело или его антигенсвязывающий фрагмент обладает, по меньшей мере, одним из следующих свойств:
1) блокирует взаимодействие между PD-L1 и PD-1; 2) блокирует взаимодействие между PD-L1 и CD80; 3) активирует Т-клетки; 4) ингибирует рост опухоли.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент в соответствии с изобретением способно специфически связываться PD-L1 (например, PD-L1 человека) и блокировать его взаимодействие с PD-1.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент в соответствии с изобретением способно специфически связываться PD-L1 (например, PD-L1 человека) и блокировать его взаимодействие с CD80.
В некоторых вариантах осуществления являющиеся мишенями опухоли включают, но без ограничения, описанные ниже неопластические заболевания. В некоторых других вариантах осуществления антитело или его антигенсвязывающий фрагмент в соответствии с изобретением может ингибировать рост опухоли, по меньшей мере, на 10%, предпочтительно, по меньшей мере, приблизительно на 20%, более предпочтительно, по меньшей мере, приблизительно на 30%, более предпочтительно, по меньшей мере, приблизительно на 40%, более предпочтительно, по меньшей мере, приблизительно на 50%, более предпочтительно, по меньшей мере, приблизительно на 60%, более предпочтительно, по меньшей мере, приблизительно на 70%, более предпочтительно, по меньшей мере, приблизительно на 80%.
В одном варианте осуществления антитело против PD-L1 включает антитело против PD-L1 В10, антитело против PD-L1 В11, антитело против PD-L1 Н12 или их комбинацию, в частности, антитело против PD-L1 В11.
Антитело В10
В одном аспекте предусмотрено антитело В10 против PD-L1 или его антигенсвязывающий фрагмент,
при этом антитело включает вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
Н CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 1,
Н CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 2, и
Н CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 3;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 5,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 6, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 7.
В другом варианте осуществления антитело В10 против PD-L1 включает вариабельный участок тяжелой цепи (VH),
при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 4, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 4.
В другом варианте осуществления антитело В10 против PD-L1 включает вариабельный участок легкой цепи (VL),
при этом вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 8, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 8.
В другом варианте осуществления антитело В10 против PD-L1 включает константный участок тяжелой цепи (СН),
при этом константный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 26, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 26.
В другом варианте осуществления антитело В10 против PD-L1 включает константный участок легкой цепи (CL),
при этом константный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 25, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 25.
Антитело В11
В другом аспекте предусмотрено антитело В11 против PD-L1 или его антигенсвязывающий фрагмент,
при этом антитело включает вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
Н CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 9,
Н CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 10, и
Н CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 11;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 13,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 14, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 15.
В другом варианте осуществления антитело В11 против PD-L1 включает вариабельный участок тяжелой цепи (VH),
при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 12, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 12.
В одном варианте осуществления антитело В11 против PD-L1 включает вариабельный участок легкой цепи (VL),
при этом вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 16, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 16.
В предпочтительном варианте осуществления антитело В11 против PD-L1 включает вариабельный участок тяжелой цепи (VH) и вариабельный участок легкой цепи (VL),
при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 12; вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 16.
В другом варианте осуществления антитело В11 против PD-L1 включает константный участок тяжелой цепи (СН),
при этом константный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 26, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 26.
В другом варианте осуществления антитело В11 против PD-L1 включает константный участок легкой цепи (CL),
при этом константный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 25, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 25.
В другом отдельном варианте осуществления антитело В11 против PD-L1 включает тяжелую цепь,
при этом тяжелая цепь включает аминокислотную последовательность, как показано в SEQ ID NO: 28, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 28.
В другом отдельном варианте осуществления антитело В11 против PD-L1 включает легкую цепь,
при этом легкая цепь включает аминокислотную последовательность, как показано в SEQ ID NO: 27, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 27.
В особенно предпочтительном варианте осуществления антитело В11 против PD-L1 включает тяжелую цепь и легкую цепь,
при этом тяжелая цепь включает аминокислотную последовательность, как показано в SEQ ID NO: 28, а легкая цепь включает аминокислотную последовательность, как показано в SEQ ID NO: 27.
Антитело Н12
В другом аспекте предусмотрено антитело Н12 против PD-L1 или его антигенсвязывающий фрагмент,
при этом антитело включает вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
Н CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 17,
Н CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 18, и
Н CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 19;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO: 21,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO: 22, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO: 23.
В другом варианте осуществления антитело Н12 против PD-L1 включает вариабельный участок тяжелой цепи,
при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 20, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 20.
В другом варианте осуществления антитело Н12 против PD-L1 включает вариабельный участок легкой цепи,
при этом вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 24, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 24.
В другом варианте осуществления антитело Н12 против PD-L1 включает константный участок тяжелой цепи (СН),
при этом константный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 26, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 26.
В другом варианте осуществления антитело Н12 против PD-L1 включает константный участок легкой цепи (CL),
при этом константный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO: 25, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO: 25.
Неопластические заболевания
Блокирование PD-L1, осуществляемое с помощью антитела в соответствии с изобретением, может стимулировать иммунный ответ на раковые клетки у пациентов. PD-L1 присутствует в больших количествах при различных видах рака человека. Взаимодействие между PD-1 и PD-L1 ведет к снижению количества проникающих в опухоль лимфоцитов, снижению рецептор-опосредуемой пролиферации Т-клеток, и иммунному ускользанию раковых клеток. Ингибирование взаимодействия между PD-L1 и PD-1 может обеспечивать изменение иммуносупрессии.
Антитело или его антигенсвязывающий фрагмент в соответствии с изобретением могут применяться для лечения неопластического заболевания. Предпочтительное неопластическое заболевание (или рак), которое может предотвращаться и/или подвергаться лечению антителом или его антигенсвязывающим фрагментом в соответствии с изобретением, включает виды рака, которые в целом являются чувствительными к иммунотерапии. Неограничивающие примеры подвергаемых лечению видов рака включают, без ограничения, рак легкого, рак яичника, рак толстой кишки, рак прямой кишки, меланому, рак почки, рак мочевого пузыря, рак груди, рак печени, лимфому, злокачественное гематологическое заболевание, рак головы и шеи, глиому, рак желудка, рак носоглотки, рак гортани, рак шейки матки, опухоль тела матки и остеосаркому. Примеры других видов рака включают, без ограничения, рак кости, рак поджелудочной железы, рак кожи, рак предстательной железы, кожную или внутриглазную злокачественную меланому, рак матки, анальный рак, рак яичка, рак фаллопиевой трубы, рак эндометрия, рак влагалища, рак вульвы, болезнь Ходжкина, неходжкинскую лимфому, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягких тканей, рак уретры, рак полового члена, хронический или острый лейкоз, включая острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, детскую солидную опухоль, лимфатическую лимфому, рак мочевого пузыря, рак почки или мочеточника, рак почечной лоханки, опухоль центральной нервной системы (ЦНС), первичную лимфому ЦНС, ангиогенез опухоли, опухоль спинного мозга, глиому ствола мозга, аденому гипофиза, саркому Капоши, эпидермальную карциному, плоскоклеточную карциному, Т-клеточную лимфому, вызванный окружающей средой рак, включая рак, вызванный асбестом, и комбинации указанных видов рака. Антитело в соответствии с изобретением также может применяться для лечения метастазирующих видов рака, в частности, метастазирующих видов рака, сопровождающихся экспрессией PD-L1. В еще одном варианте осуществления неопластическое заболевание (или рак) представляет собой рак легкого, рак яичника, рак толстой кишпи, меланому, рак почки, рак мочевого пузыря, рак груди, рак печени, лимфому, злокачественное гематологическое заболевание, рак головы и шеи, глиому, рак желудка, рак носоглотки, рак гортани, рак шейки матки, карциному тела матки или остеосаркому, в частности, рак толстой кишки или не мелко клеточный рак легкого. В одном варианте осуществления неопластическое заболевание представляет собой PD-L1-положительную опухоль.
В предпочтительном варианте осуществления антитело включает антитело против PD-L1 В10, антитело против PD-L1 В11, антитело против PD-L1 Н12 или их комбинацию, в частности, антитело против PD-L1 В11.
Процесс получения нуклеиновых кислот, векторов и антител
В другом аспекте предусмотрена выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент в соответствии с изобретением, как описано выше. В некоторых вариантах осуществления нуклеотидная последовательность молекулы нуклеиновой кислоты может являться кодон-оптимизированной для клетки-хозяина, применяемой для экспрессии. Также предусмотрен вектор экспрессии, включающий, по меньшей мере, одну из молекул нуклеиновой кислоты в соответствии с изобретением, как описано выше.
В одном аспекте предусмотрена клетка-хозяин, в которую переносят, по меньшей мере, одну из молекул нуклеиновой кислоты или один из векторов экспрессии, в соответствии с изобретением, как описано выше.
В другом аспекте предусмотрен процесс получения антитела против PD-L1 или его антигенсвязывающего фрагмента, включающий
(i) культивирование клетки-хозяина в соответствии с изобретением при условиях, подходящих для экспрессии молекулы нуклеиновой кислоты или вектора экспрессии, и (ii) выделение и очистку антитела или его антигенсвязывающего фрагмента, экспрессируемого молекулой нуклеиновой кислоты или вектором экспрессии.
Фармацевтические композиции
Также предусмотрена фармацевтическая композиция, включающая антитело в соответствии изобретением и фармацевтически приемлемый носитель. В одном варианте осуществления вышеуказанное антитело включает антитело против PD-L1 В10, антитело против PD-L1 В11, антитело против PD-L1 Н12 или их комбинацию, в частности, антитело против PD-L1 В11.
В соответствии с используемым здесь значением термин "фармацевтически приемлемый носитель" включает любые и все физиологически совместимые растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты, и им подобные. Предпочтительным образом, носитель является подходящим для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, посредством инъекции или инфузии). В соответствии со способом введения, активное соединение (то есть молекула антитела) и иммуноконъюгат могут быть инкапсулированы в некотором материале для защиты соединения от кислот и других естественных условий, которые могут вызвать инактивацию соединения.
Фармацевтическая композиция в соответствии с изобретением также может содержать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) растворимые в воде антиоксид анты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия, и им подобные; (2) маслорастворимые антиоксиданты. такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, а-токоферол, и им подобные; и (3) металлхелатирующие агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбитол, винная кислота, фосфорная кислота, и им подобные.
Композиция также может содержать адъювант, такой как консервант, смачивающий агент, эмульгатор и диспергатор.
Предотвращение развития микроорганизмов может быть обеспечено с помощью процедур стерилизации или путем включения различных антибактериальных и противогрибковых агентов, таких как парабены, хлорбутанол, фенол, сорбиновая кислота, и им подобных. Во многих случаях композиция предпочтительно включает изотонический агент, например сахар, полиол, такой как маннитол, сорбитол и оксид натрия. Путем включения задерживающего абсорбцию агента в композицию, такого как моностеарат и желатин, может быть достигнута пролонгированная абсорбция инъецируемых лекарственных средств.
Фармацевтически приемлемый носитель включает стерильный водный раствор или дисперсию и порошок для быстрого приготовления стерильной инъекции или дисперсии. Применение подобных сред и реагентов для фармацевтически активного вещества хорошо известно в данной области. В фармацевтической композиции в соответствии с изобретением могут присутствовать стандартные среды или реагенты, за исключением несовместимых с активным соединением. В композицию могут быть также включено дополнительное активное соединение.
Терапевтическая композиция в целом должна являться стерильной и стабильной в рамках условий приготовления и хранения. Композиция может иметь форму раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Носитель может представлять собой растворитель или диспергатор, содержащий, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, и жидкий полиэтиленгликоль, или им подобные) и их подходящую смесь. Например, подходящая степень текучести может поддерживаться путем применения покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии, и путем применения поверхностно-активного вещества.
Стерильная инъекция может быть получена путем смешивания активного соединения в подходящем растворителе в требуемом количестве и добавления одного или комбинации вышеуказанных ингредиентов, если это требуется, и далее путем использования стерильной микрофильтрации. В целом, дисперсию получают путем включения активного соединения в стерильный носитель, содержащий основную диспергирующую среду и другие требуемые ингредиенты, перечисленные выше. Для стерильного порошка и приготовления стерильной инъекции предпочтительным процессом получения является вакуумная сушка или сушка сублимацией (лиофилизация), при этом активный ингредиент в виде порошка плюс любые дополнительные требуемые ингредиенты получают из предварительно простерилизованного отфильтрованного раствора.
Количество активного ингредиента, которое может быть соединено с материалом-носителем для получения одной лекарственной формы, варьируется в зависимости от подвергаемого лечению субъекта и конкретного способа введения. Количество активного ингредиента, которое может быть соединено с материалом-носителем для получения одной лекарственной формы, в целом соответствует количеству композиции, вызывающему терапевтический эффект. В целом, исходя из 100%, данное количество варьируется от около 0,01% до около 99% активного ингредиента, предпочтительно от около 0,1% до около 70%, и, наиболее предпочтительно, от около 1% до около 30% активного ингредиента, соединенного с фармацевтически приемлемым носителем.
Схема приема может быть скорректирована для обеспечения оптимальной требуемой реакции (например, терапевтической реакции). Например, может быть введен один болюс, несколько разделенных доз могут быть введены с течением времени, или, в зависимости от срочности, связанной с подвергаемым лечением состоянием, доза может быть пропорционально снижена или увеличена. Является особенно удобным составлять парентеральную композицию в виде единичной лекарственной формы для легкого введения и соблюдения равной дозировки. Используемый здесь термин "единичная лекарственная форма" означает физически отдельную единицу, которая является подходящей для подвергаемого лечению субъекта в качестве единичной дозы; при этом каждая единица содержит предварительно определенное количество активного соединения, при этом данное предварительно определенное количество вычисляют в комбинации с требуемым фармацевтическим носителем для получения требуемого терапевтического эффекта. Конкретное описание единичной лекарственной формы согласно изобретению ограничено и непосредственно зависит от (а) уникальных характеристик активного соединения и конкретного требуемого терапевтического эффекта, и (b) естественных ограничений в плане разработки состава подобных активных соединения с учетом чувствительности подвергаемого лечению субъекта.
Для введения молекул антител доза варьируется от около 0,0001 до 100 мг/кг, более часто - от около 0,01 до 20 мг/кг массы тела пациента. Например, дозы могут составлять 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела, 10 мг/кг массы тела или 20 мг/кг массы тела, или находиться в диапазоне 1-20 мг/кг. Пример схемы лечения требует введения раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, раз в месяц, один раз каждые 3 месяца, один раз каждые 3-6 месяцев, или чуть более короткого начального интервала и длинного интервала для более поздних введений. В одном варианте осуществления применяемая доза может составлять 1200 мг и вводиться каждые три недели. Способ введения может представлять собой внутривенную инфузию.
В качестве альтернативы, нацеленная против опухоли молекула антитела также может быть введена в виде состава с замедленным высвобождением, при этом требуется менее частое введение. Дозировка и частота могут варьироваться в зависимости от длительности полураспада молекулы антитела у пациента. В целом, антитело человека демонстрирует наиболее длительный полураспад, за ним следует гуманизированное антитело, химерное антитело, и антитело не являющегося человеком вида. Дозировка и частота введения меняются в зависимости от того, является лечение профилактическим или терапевтическим. При профилактическом применении вводят относительно малые дозы с менее частыми интервалами в течение более длительного периода времени. Некоторые пациенты продолжают получать лечение в течение всей их оставшейся жизни. При терапевтическом применении иногда является необходимым ввести более высокие дозы в течение более коротких интервалов вплоть до замедления прогрессирования заболевания или его остановки, предпочтительно до демонстрации пациентом частичного или полного устранения симптомов заболевания. Затем пациенту может быть назначено профилактическое лечение.
Конкретный уровень дозировки активного ингредиента в рамках фармацевтической композиции может варьироваться для получения количества активного ингредиента, которое может обеспечивать эффективное достижение терапевтической реакции у конкретного пациента и способ введения, не являющийся токсичным для пациента. Выбранный уровень дозировки зависит от различных фармакокинетических факторов, включая активность конкретной применяемой композиции в соответствии с изобретением, способ введения, время введения, время выведения конкретного применяемого соединения, продолжительность лечения, и конкретный способ применения композиции с другими лекарствами, соединениями и/или материалами, возраст, пол, вес, состояние, общее состояние здоровья и медицинскую историю подвергаемого лечению пациента, а также аналогичные факторы, известные в области медицины.
"Эффективное количество" антитела или его антигенсвязывающего фрагмента в соответствии с изобретением предпочтительно приводит к снижению тяжести симптомов, повышению частоты и продолжительности бессимптомного периода заболевания, или предотвращению увечья или инвалидности, вызванной болью вследствие заболевания. Например, для лечения опухоли "эффективное количество" антитела или его антигенсвязывающего фрагмента в соответствии изобретением предпочтительно ингибирует клеточный рост или рост опухоли, по меньшей мере, приблизительно на 10%, предпочтительно, по меньшей мере, приблизительно на 20%, более предпочтительно, по меньшей мере, приблизительно на 20%, более предпочтительно, по меньшей мере, приблизительно на 30%, более предпочтительно, по меньшей мере, приблизительно на 40%, более предпочтительно, по меньшей мере, приблизительно на 50%, более предпочтительно, по меньшей мере, приблизительно на 60%, более предпочтительно, по меньшей мере, приблизительно на 70%, более предпочтительно, по меньшей мере, приблизительно на 80% по сравнению с не подвергаемым лечению субъектом. Способность ингибировать рост опухоли может быть оценена в рамках системы с животными-моделями, которая обеспечивает возможность прогнозирования эффективности на опухолях человека. В качестве альтернативы, она также может быть оценена путем определения способности ингибировать рост клеток, при этом данное ингибирование может быть определено in vitro с помощью теста, который хорошо известен специалисту в данной области. Эффективное количество антитела или его антигенсвязывающего фрагмента в соответствии с изобретением может снижать размер опухоли или облегчать симптомы у субъекта иным образом, например путем предотвращения и/или лечения метастазов или устранения повторного выявления. Специалист в данной области может определить данное количество на основе следующих факторов, например размера субъекта, тяжести симптомов субъекта и конкретной выбранной композиции или способа введения.
Антитело или его антигенсвязывающий фрагмент в соответствии с изобретением или фармацевтическая композиция в соответствии с изобретением могут быть введены с помощью одного или нескольких способов введения с применением одного или нескольких способов, известных в данной области. Специалисту в данной области следует понимать, что способ введения и/или его форма варьируется в соответствии с требуемыми результатами. Предпочтительный способ введения для антитела в соответствии с изобретением включает внутривенный, внутримышечный, внутрикожный, внутрибрюшинный, подкожный, спинальны или иной парентеральный способ введения, такой как инъекция или инфузия. Термин "парентеральное введение" в соответствии с используемым здесь значением означает способ введения, являющийся отличным от энтерального и местного введения, обычно с помощью инъекции, включая, но без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную, эпидуральную и внутригрудинную инъекцию и инфузию.
В качестве альтернативы, антитело или его антигенсвязывающий фрагмент в соответствии с изобретением или фармацевтическая композиция в соответствии с изобретением также могут быть введены с помощью непарентерального пути, такого как местный, эпидермальный или мукозальный путь, например интраназально, перорально, вагинально, ректально, сублингвально или местно.
Активное соединение может быть получено с носителем, который защищает соединение от быстрого высвобождения, таким как состав с контролируемым высвобождением, включая имплантат, трансдермальный пластырь и микроинкапсулированная система доставки. Может применяться биоразлагаемый, биосовместимый полимер, такой как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфир и полимолочная кислота. Многие процессы приготовления подобных препаратов защищены патентами или в целом известны специалисту в данной области.
Антитело или его антигенсвязывающий фрагмент в соответствии с изобретением в рамках фармацевтической композиции также может быть конъюгирован с терапевтическим компонентом, таким как цитотоксин, радиометка, биологически активный белок или им подобные.
Цитотоксин включает любой агент, который является вредоносным для клеток (например, убивающим клетки). Примеры включают, но без ограничения: паклитаксел, цитохалазин В, грамицидин D, бромид этидия, эметин, митомицин, эпиподофиллотоксин глюкопиранозид, эпиподофиллотоксин тиофенгликозид, винкристин, винбластин, колхицин, адриамицин, даунорубицин, дигидроксиантрацендион, митоксантрон, пликамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоид, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи.
Терапевтические агенты, которые могут применяться для конъюгации, также включают, например: антиметаболит (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, дакарбазин), алкилирующий агент (например, азотистый иприт, хлорамбуцил, фенилаланин иприта, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнитол, стрептозотоцин, митомицин С и цис-дихлордиамин платины (II) (DDP) цисплатин), антрамицины (например, даунорубицин (ранее известный как дауномицин) и адриамицин), антибиотики (например, актиномицин D (ранее известный как актиномицин), блеомицин, пликамицин и антрамицин (АМС)) и антимитотический агент (например, винкристин и винбластин).
Другие предпочтительные примеры терапевтических цитотоксинов, которые могут быть конъюгированы с антителом в соответствии с изобретением, включают дуокармицин, калихеамицин, майтанзин, ауристатин и их производные.
Цитотоксин может быть конъюгирован с антителом в соответствии с изобретением с применением технологии на основе линкеров, известной в данной области. Примеры типов линкеров, которые применялись для конъюгирования цитотоксина и антитела, включают, но без ограничения, гидразон, тиоэфир, сложный эфир, дисульфид и пептид-содержащий линкер. Например, может быть выбран линкер, который легко расщепляется с помощью низкого рН или протеазы в лизосомальном отсеке, при этом протеаза представляет собой, например, протеазу, которая предпочтительно экспрессируется в опухолевых тканях, такую как катепсин (например, катепсин В, С, D).
Антитело в соответствии с изобретением также может быть конъюгировано с радиоизотопом для получения цитотоксического радиоактивного препарата, который также называют радиоактивным конъюгатом антитела. Пример радиоизотопов, которые могут быть конъюгированы с антителом для диагностики или терапевтического применения, включают, но без ограничения, йод 131, индий 111, иттрий 90 и лютеций 177. Процессы получения радиоактивных конъюгатов антител хорошо известны в данной области.
Антитело в соответствии с изобретением также может быть конъюгировано с белком, который имеет требуемую биологическую активность и может применяться для модификации определенной биологической реакции. Подобные биологически активные белки включают, например: токсин с ферментативной активностью или его активный фрагмент, такой как абрин, рицин А, экзотоксин псевдомонады или дифтерийный токсин; белок, такой как фактор некроза опухоли или интерферон-у; или модификатор биологической реакции, такой как лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), интерлейкин-10 ("IL-10"), колониестимулирующий фактор гранулоцитов-макрофагов ("GM-CSF"), колониестимулирующий фактор гранулоцитов ("G-CSF") или другие иммунные факторы, такие как IFN, и так далее.
Комбинированная терапия
Антитело или фармацевтическая композиция в соответствии с изобретением могут быть введены в комбинации с химиотерапевтическим агентом или антителом, нацеленным против другого опухолевого антигена. Антитело в соответствии с изобретением и химиотерапевтический агент или антитело, нацеленное против другого опухолевого антигена, могут быть введены одновременно или по отдельности. При введении по отдельности (при использовании различных графиков введения) они могут быть введены непрерывно без прерывания или с предварительно определенными интервалами. Антитело в соответствии с изобретением или фармацевтическая композиция в соответствии с изобретением также могут быть объединена с радиотерапией, например, включая лечение пациента с применением ионизирующего излучения, которое осуществляют до, одновременно и/или после процесса введения антитела или фармацевтической композиции в соответствии с изобретением.
Наборы
Охватываемая изобретением область также включает набор, который включает антитело или его антигенсвязывающий фрагмент в соответствии с изобретением, а также инструкции по применению. Набор в целом включает этикетку с указанием предполагаемого применения и/или способа применения содержимого набора. Термин "этикетка" включает любые письменные или записанные материалы, нанесенные на набор или предоставляемые вместе с ним или иным образом представленные с набором.
Преимущества
Антитело в соответствии с изобретением обладает очень сильной аффинностью в отношении антигена-мишени, активирует Т-клетки, может демонстрировать отличную (in vivo) противоопухолевую активность, отличную стабильность, низкие побочные эффекты, и его эффект превосходит уровень техники.
Примеры
Дальнейшее понимание изобретения может быть достигнуто на основе конкретных приведенных здесь примеров, при этом данные примеры используются лишь для иллюстрации настоящего изобретения, но не ограничения его объема. Очевидно, что могут быть осуществлены различные изменения и модификации изобретения без выхода за рамки его сути, и, таким образом, подобные изменения и модификации также находятся в рамках объема настоящего изобретения, для которого испрашивается защита. Если не указано иное, приведенные здесь соотношения, включая процентные доли, вычислены на основе массы.
Все используемые в рамках раздела Примеры реагенты и инструменты являются коммерчески доступными. Tecentriq может быть приобретен у компании Roche.
Пример 1. Скрининг антител
Собирали периферическую кровь 106 здоровых взрослых участников (53 мужчины и 53 женщины) и отделяли РВМС клетки (мононуклеарные клетки периферической крови) с применением раствора для отделения лимфоцитов, при этом собирали всего 2×109 клеток. Все РНК экстрагировали с помощью способа с применением Trizol и подвергали обратной транскрипции в кДНК. Применяли традиционный ПЦР способ для амплификации генов вариабельных участков различных подтипов антител, руководствуясь способом, описанным в "Recombinant Antibody" (Science Press, 2005), при этом клонировали гены вариабельных участков антител в pDF вектор, расщепляемый одинаковым ферментом с применением традиционных способов молекулярной биологии. Проводили перенос в Е. coli XL1-Blue (Agilent Technology) с помощью электропорации. После роста в SB среде добавляли 1×1013 PFU хелперный вирус VCSM13 (BioVector NTCC Inc.) для инфицирования с получением фаговой библиотеки первичных антител и смешивали фаговую библиотеку первичных антител и бактерии BS1365 (MOI инфекции> 200) для получения библиотеки антител большого объема.
После блокинга пробирки для иммуноанализа (пробирка для иммуноанализа Maxisorp, Thermo Nunc), покрытой рекомбинантным PD-L1 (продукт компании R&D) с 5% сухого обезжиренного молока, добавляли вышеуказанную фаговую библиотеку антител и инкубировали при 37°С в течение 2 часов; несвязанные фаги удаляли, применяли TBS раствор для промывания 5 раз, при этом неспецифически адсорбированные фаги полностью вымывали; добавляли 1 мл буфера для элюирования (0,1 моль/л глицин-HCl, рН 2,2) для элюирования фагов и применяли 40 мкл 2 моль/л трис раствор для нейтрализации. Добавляли XL1-Blue бактерии (Agilent Technology) на логарифмической фазе, SB среду (SB среда: 30 г триптона, 20 г экстракта дрожжей, 10 г MOPS, растворенные в 950 мл деионизированной воды, рН доведен до 7,0 с помощью гидроксида натрия, объем доведен до 1 л, подвергнута автоклавированию) и хелперный фаг VCSM13 для амплификации и обогащения. Процесс повторяли 3-4 раза, при этом элюированные фаги применяли для заражения планшета для культивирования, покрытого свежими XL1-Blue бактериями (логарифмическая фаза). После инкубирования в течение ночи при 37°С получали отдельный клон (конкретные способы и реагенты можно найти в "Phage Display", Humana Press).
Рекомбинантный PD-L1 инкубировали с применением 96-луночного планшета при 4°С в течение 16 часов, при этом неспецифическое связывание блокировали BSA раствором. Из фаговой библиотеки с очевидным обогащением, определенным после скрининга, отбирали и культивировали около 1000 (12 96-луночных планшетов) отдельных фаговых клонов в 500 мкл жидкой среды 2YT с добавлением карбенициллина и ампициллина в течение 24 ч и инкубировали с раствором рекомбинантного PD-L1 в течение 2 ч. Смесь добавляли в 96-луночный планшет с вышеуказанным рекомбинантным PD-L1 и инкубировали в течение 15 мин. После промывания PBST осуществляли инкубирование с HRP-конъюгированным антителом против фагов (анти-М13 HRP) и наконец добавляли субстрат для проявления цвета для определения количества фагов, связанных с 96-луночным планшетом. Поскольку PD-L1 в растворе образовывал прочные связи с фагами с высокой аффинностью, он конкурентно ингибировал связывание фагов с PD-L1, связанным на 96-луночном планшете, и, таким образом, при проведении ELIS А определяли более низкое значение OD. С помощью данного эксперимента были первоначально отобраны 12 антител-кандидатов с относительно высокой аффинностью и специфическими последовательностями для дальнейшего тестирования и скрининга.
Рекомбинантный PD-L1 инкубировали с применением 96-луночного планшета при 4°С в течение 16 часов, при этом неспецифическое связывание блокировали BSA раствором. Клоны фагов, отобранные на основе вышеуказанного конкурентного анализа ELISA, инкубировали с растворами рекомбинантного PD-L1 с различными концентрациями (0,03 нМ-90 нМ) в течение 2 ч и далее добавляли смесь на 96-луночный планшет с вышеуказанным рекомбинантным PD-L1 и инкубировали в течение 15 мин. После промывания PBST осуществляли инкубирование с HRP-конъюгированным антителом против фагов (анти-М13 HRP) и наконец добавляли субстрат для проявления цвета для определения количества фагов, связанных с 96-луночном планшетом. Применяли GraphPad Prism для построения кривой связи на основе показателя OD, полученного с помощью ELISA. Результаты показаны на Фиг. 1 (WT представляет собой положительный контроль, то есть антитело, имеющее такую же последовательность, что и Tecentriq).
Для 3 антител-кандидатов с наиболее высокой аффинностью (HZPDL1-B10, HZPDL1-B11, HZPDL1-H12 (далее по тексту и на фигурах для удобства использовали аббревиатуры B10, В11, Н12)) осуществляли анализ последовательности.
Последовательности соответствуют приведенным ниже:
клон В10 имеет HCDR1 с последовательностью SEQ ID NO: 1, HCDR2 с последовательностью SEQ ID NO: 2, HCDR3 с последовательностью SEQ ID NO: 3, VH с последовательностью SEQ ID NO: 4; LCDR1 с последовательностью SEQ ID NO: 5, LCDR2 с последовательностью SEQ ID NO: 6, L CDR3 с последовательностью SEQ ID NO: 7, VL с последовательностью SEQ ID NO: 8.
клон B11 имеет HCDR1 с последовательностью SEQ ID NO: 9, HCDR2 с последовательностью SEQ ID NO: 10, HCDR3 с последовательностью SEQ ID NO: 11, VH с последовательностью SEQ ID NO: 12; LCDR1 с последовательностью SEQ ID NO: 13, LCDR2 с последовательностью SEQ ID NO: 14, L CDR3 с последовательностью SEQ ID NO: 15, VL с последовательностью SEQ ID NO: 16.
клон H12 имеет HCDR1 с последовательностью SEQ ID NO: 17, HCDR2 с последовательностью SEQ ID NO: 18, HCDR3 с последовательностью SEQ ID NO: 19, VH с последовательностью SEQ ID NO: 20; LCDR1 с последовательностью SEQ ID NO: 21, LCDR2 с последовательностью SEQ ID NO: 22, L CDR3 с последовательностью SEQ ID NO: 23, VL с последовательностью SEQ ID NO: 24.
Пример 2. Экспрессия антител
Полученные гены вариабельного участка клонов B10, B11, Н12 сливали с геном константного участка IgG человека (последовательность константного участка легкой цепи - SEQ ID NO: 25; последовательность константного участка тяжелой цепи - SEQ ID NO: 26) и клонировали в вектор экспрессии pCDNA3.4 (Thermo Fisher). Полученные эукариотические векторы экспрессии быстро трансфицировали в Expi-CHO клетки (Thermo Fisher). Спустя приблизительно 8 дней культивирования клеток без сыворотки собирали культуральный супернатант и проводили тест ELISA (с применением антител козы против IgG человека и меченных ферментом хрена антител козы против IgG человека для двойного "сэндвич" ELISA анализа для детектирования содержания антитела в супернатанте). Определяли уровень экспрессии антител в сыворотке и очищали культуральный супернатант, содержащий антитело-кандидат, с помощью смолы на основе белка А для получения требуемого антитела.
Пример 3. Анализ специфической активности распознавания антитела
В рамках данного примера применяли анализ ELISA для определения связывания антитела-кандидата с PD-L1 человека, обезьяны и мыши.
PD-L1 человека, обезьяны и мыши (R&D) разбавляли PBS до 5 мкг/мл и наносили на 96-луночные планшеты. После инкубирования в течение ночи при 4°С на следующий день раствор для покрытия сливали и промывали PBST. В каждую лунку добавляли 200 мкл BSA блокирующего раствора и инкубировали в течение 1 ч при комнатной температуре. Три раза осуществляли промывание с помощью PBST и проводили 2-кратное последовательное разбавление антител-кандидатов и антитела-положительного контроля (WT, положительные контроль, антитело с той же последовательностью, что и Tecentriq) для получения 11 концентраций с 1 нМ в качестве наиболее высокой концентрации. Затем в каждую лунку добавляли 100 мкл антитела и инкубировали в течение 2 ч при комнатной температуре. Три раза осуществляли промывание PBST, добавляли антитело против Fc-HRP человека (Sino Biological) и инкубировали в течение 1 ч при комнатной температуре. Наконец, каждую лунку промывали четыре раза PBST, добавляли раствор ТВМ для проявления цвета (Beijing Tiangen BioTech), при этом цвет получали при комнатной температуре. После прекращения проявления цвета определяли значение OD с помощью микропланшетного ридера при 600 нм. Результаты ELISA показаны на Фиг. 2 (А, В, и С относятся к PD-L1 человека, обезьяны и мыши, соответственно, а ЕС50 значение приведено в пМ). Антитела-кандидаты В10, В11 и Н12 могут связываться с PD-L1 белками человека, обезьяны и мыши.
Пример 4. Анализ аффинности антител
В рамках данного примера применяли BIAcore для определения аффинности антител. В данном эксперименте применяли набор для захвата антител человека (GE, BR100839) для связывания антитела против IgG человека с СМ5 сенсорным чипом серии S (GE, BR100530) через аминогруппу перед связыванием лиганда и аналита. Рекомбинантные антитела против PD-L1, В10, В11 и Н12, разбавляли буфером HBS-EP+ в качестве лигандов. Рекомбинантный меченный His PD-L1 разбавляли буфером HBS-EP+ до 8 мкг/мл, 4 мкг/мл, 1,6 мкг/мл, 0,64 мкг/мл, 0,256 мкг/мл и 0,102 мкг/мл в качестве аналитов. В режиме Biacore Wizard осуществляли эксперименты по анализу аффинности в мультицикловом режиме. Тестирование каждого образца включало 3 запуска, 1 контроль нулевой концентрации, 6 образцов с градиентной концентрацией и 1 образец с повторной концентрацией. После каждого цикла применяли раствор для восстановления 10 мМ глицин HCl рН 2,1 для восстановления чипа. Каждый цикл концентрирования аналита был следующим: время захвата 180 с, скорость потока раствора лиганда 10 мкл/мин, время связывания лиганда и аналита 180 с, скорость потока раствора аналита 30 мкг/мл; время диссоциации 2400 с. Сырые данные вводили в программное обеспечения для анализа, вычитали контроль нулевой концентрации и вычитали контрольный канал для устранения эффекта объема. Применяли 1:1 режим связывания в рамках способа анализа кинетических показателей для подгонки графика, при этом данные по аффинности антитела против антигена вычисляли с помощью регрессионного анализа с применением аналитического программного обеспечения на основе кривой связывания. Экспериментальные результаты показали, что антитела-кандидаты В10, В11 и Н12 могут распознавать антиген-мишень с высокой аффинностью (Таблица 1).
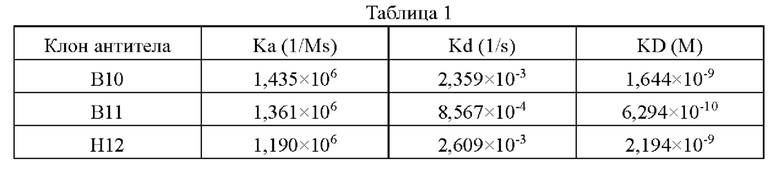
Пример 5. Активация Т-клеток
В рамках данного примера применяли эксперимент на основе реакции смешанной культуры лимфоцитов (MLR) для тестирования способности антител-кандидатов против PD-L1 активировать Т-клетки. Раствор для отделения лимфоцитов периферической крови человека (Ficoll) применяли для выделения РВМС из обработанной гепарином свежей крови здоровых людей и далее использовали набор II для выделения моноцитов человека (Miltenyi) для выделения моноцитов из РВМС. Моноциты наносили на 96-луночный планшет при плотности 2,5×104 клеток на лунку и добавляли 25 нг/мл GM-CSF (Sino Biological) и 50 нг/мл IL-4 (Sino Biological) для культивирования при 37°С с заменой среды на свежую каждые 3 дня. После 7 дней культивирования моноциты дифференцировали с образованием дендритных клеток. На 7 день дифференцировки с образование дендритных клеток и созревания применяли набор для выделения CD4+ Т-клеток (Miltenyi) для выделения CD4+ Т-клеток из РВМС другого здорового субъекта. Затем CD4+ Т-клетки в количестве 2×105/лунка и дендритные клетки подвергали совместному культивированию в RPMI среде (Invitrogen), содержащей различные концентрации антитела. Спустя 5 дней применяли набор для ELISA IFNγ (R&D) и набор для ELISA IL-2 ELISA (eBioscience) для определения содержания IFNγ и IL-2, секретируемых активированными Т-клетками в культуральном супернатанте.
Результаты показаны на Фиг. 3 (положительное антитело представляет собой антитело, имеющее ту же последовательность, что и Tecentriq, а контрольное антитело представляет собой контроль в виде изотипа IgG, а именно IgG1 человека). Антитела B10, В11 и Н12 могут активировать Т-клетки и повышать уровни экспрессии IFNγ и IL-2.
Пример 6. Антитело блокирует взаимодействие между PD-1 и PD-L1
Ген вариабельного участка клона В11 и ген константного участка IgG человека (последовательность константного участка легкой цепи соответствует SEQ ID NO: 25; последовательность константного участка тяжелой цепи соответствует SEQ ID NO: 26) сливали и экспрессировали для получения полноразмерной молекулы антитела, при этом аминокислотная последовательность легкой цепи соответствует SEQ ID NO: 27; аминокислотная последовательность тяжелой цепи соответствует SEQ ID NO: 28), и анализировали биологическую активность.
Анализировали активность антитела в плане блокирования взаимодействия между PD-1 и PD-L1. Белок hPD-L1-Fc (R&D) разбавляли в буфере для иммобилизации до концентрации 1 мкг/мл, затем добавляли при концентрации 100 мкл/лунка в лунки планшета для иммобилизации и осуществляли иммобилизацию в течение ночи при 4°С. Планшет промывали три раза промывочным раствором (PBST) с добавлением 2% альбумина бычьей сыворотки в соответствующую лунку при концентрации 100 мкл/лунка и блокировали в течение 2 ч при 37°С. Наиболее высокая концентрация В11 составляла 10 мкг/мл при 2,5-кратном разбавлении и 10 концентрациях. Меченный биотином PD-1 (hPD-1-Fc-биотин) (R&D) разбавляли разбавителем (1% BSA) до 0,25 мкг/мл и смешивали раствор с градиентно-разбавленным антителом В11 1:1. Смесь добавляли в заблокированные реакционные лунки для ELISA, 180 мкг/лунка, и использовали по три лунки для каждой концентрации образца. Планшет покрывали герметичной мембраной и располагали горизонтально при 37°С в течение 2 ч. Планшет промывали три раза промывочным раствором, добавляли меченный HRP авидин (Shanghai Beyotime Biotech) и располагали горизонтально при 37°С в течение 1 ч. Планшет промывали промывочным раствором три раза и похлопывали по впитывающей бумаге, чтобы как можно больше удалить оставшиеся капли. В каждую лунку добавляли 100 мкл (Beijing Tiangen BioTech) и располагали планшет в темноте при комнатной температуре в течение 45 мин. В каждую лунку добавляли 100 мкл 1 М H2SO4 терминирующего раствора для остановки реакции субстрата и определяли значение OD при 450 нм с помощью микропланшетного ридера.
Результаты показали, что антитело В11 может блокировать связывание hPD-L1 с hPD-1, при этом наблюдали, что степень блокирования зависит от дозы, как показано на Фиг. 4.
Пример 7. Антитело блокирует взаимодействие между CD80 и PD-L1
Белок hPD-L1-Fc разбавляли в буфере для иммобилизации до концентрации 1 мкг/мл, добавляли при концентрации 100 мкл/лунка в лунки планшета для иммобилизации и осуществляли иммобилизацию в течение ночи при 4°С. Планшет промывали три раза промывочным раствором (PBST) с добавлением 2% альбумина бычьей сыворотки в соответствующую лунку при концентрации 100 мкл/лунка и блокировали при 37°С в течение 2 ч. В11 подвергали 2,5-кратному последовательному разбавлению для получения 10 концентраций с 10 мкг/мл в качестве наиболее высокой концентрации. Меченный биотином CD80 (CD80-6hothh) (R&D) разбавляли разбавителем (1% BSA) до 0,25 мкг/мл и смешивали раствор с градиентно-разбавленным антителом В11 1:1. Смесь добавляли в заблокированные реакционные лунки для ELISA, 180 мкг/лунка, и использовали по три лунки для каждой концентрации образца. Планшет покрывали герметичной мембраной и располагали горизонтально при 37°С в течение 2 ч. Планшет промывали три раза промывочным раствором, добавляли меченный HRP авидин (Shanghai Beyotime Biotech) и располагали горизонтально при 37°С в течение 1 ч. Планшет промывали промывочным раствором три раза и похлопывали по впитывающей бумаге, чтобы как можно больше удалить оставшиеся капли. В каждую лунку добавляли 100 мкл ТМВ и располагали в темноте при комнатной температуре в течение 45 минут. В каждую лунку добавляли 100 мкл 1 М H2SO4 терминирующего раствора для остановки реакции субстрата и определяли значение OD при 450 нм с помощью микропланшетного ридера. Анализировали активность антитела в плане блокирования взаимодействия между CD80 и PD-L1. Результаты показаны на Фиг. 5. Антитело В11 может блокировать взаимодействие между CD80 (CD80-6hothh) и PD-L1, при этом наблюдали, что степень блокирования зависит от дозы.
Пример 8. Клеточная биологическая активность антитела
Брали CHO/PD-L1 клетки (Promega) на логарифмической фазе роста и доводили плотность клеток до 5,0×105 клеток/мл с помощью экспериментальной среды (2% FBS).
Клетки инокулировали в белый непрозрачный 96-луночный планшет для культивирования клеток при объеме 80 мкл/лунка и инкубировали в СО2 инкубаторе в течение 16-18 ч.
Экспериментальная группа: В11 разбавляли до 6,3 мкг/мл RPMI1640 средой (содержащей 2% фетальной бычьей сыворотки, обе получены от Gibco), подвергали 2,5-кратному градиентному разбавлению с получением всего 9 точек концентрации с тремя лунками на каждую концентрацию образца и добавляли при объеме 40 мкл/лунка в планшет для культивирования, инокулированный CHO/PD-L1 клетками. Пустая контрольная группа: экспериментальную среду в объеме 40 мкл/лунка добавляли в планшет для культивирования, инокулированный CHO/PD-L1 клетками. Jurkat/PD-1 (Promega) доводили до плотности клеток 1,0×106 - 1,25×106 клеток/мл и добавляли в объеме 40 мкл/клетка в экспериментальную группу и пустую контрольную группу. Культуральный планшет подвергали инкубированию в инкубаторе в течение 5,5-6,5 ч. В каждую лунку добавляли 80 мкл субстрата на основе раствора люциферазы (Promega). Реакцию проводили в темноте при комнатной температуре в течение 5-30 мин. Определяли величину относительных световых единицы (RLU) с помощью микропланшетного ридера в хемилюминесцентном режиме и применяли аналитическое программного обеспечение для анализа данных. Логарифм концентрации антитела соответствовал абсциссе, соответствующие кратные показатели сигнальной индукции соответствовали ординате (формула для вычисления: RLU экспериментальных лунок/RLU пустых контрольных лунок), при этом строили кривую уравнения с четырьмя параметрами.
Результаты показали, что антитело В11 обладает клеточной биологической активностью, при этом наблюдали, что ее степень зависит от дозы. Результаты показаны на Фиг. 6.
Пример 9. In vivo ингибиторная активность антитела против рака толстой кишки
В рамках данного примера применяли модель с опухолью, созданную путем подкожной трансплантации гуманизированным мышам В-hPD-1 клеток рака толстой кишки MC38-hPD-L1 для оценки in vivo противоопухолевой активности антитела ВН.
Клетки рака толстой кишки MC38-hPD-L1 (CrownBio) подкожно прививали в правый передний бок самок гуманизированных мышей B-hPD-1 (CrownBio) в количестве 5×105 клеток/0,1 мл. Когда опухоли достигали размера около 160 мм3, их произвольным образом разделяли на следующие группы: контроль в виде растворителя, Tecentriq (10 мг/кг, Q2D×8), B11 (10 мг/кг, Q2D×8), B11 (3 мг/кг, Q2D×8), B11 (1 мг/кг, Q2D×8) в соответствии с объемом опухоли (10 в каждой группе, всего 5 групп), соответственно. Способ введения представлял собой внутрибрюшинную инъекцию, при этом эксперимент завершали на 22-й день группового введения. Объем опухолей и массу тела измеряли два раза в неделю, при этом записывали массу тела мышей и объем опухолей.
Результаты показали, что при проведении эксперимента животные сохраняли хорошее состояние здоровья, при этом мыши хорошо переносили каждое терапевтическое антитело. Результаты ингибирования опухолей показаны на Фиг. 7 и в Таблице 2. К концу эксперимента (то есть на 21-й день группового введения) средний объем опухолей в группе с растворителем в качестве контроля составлял 1917±264 мм3. Средний объем опухолей в группе с В11 при уровнях дозы 10 мг/кг, 3 мг/кг, 1 мг/кг составлял 232±76 мм3, 235±71 мм3 и 999±306 мм3, соответственно; степень ингибирования опухолей составляла 96,0%, 95,9% и 52,3%, соответственно; при этом ингибирование массы опухолей составляло 92,4%, 91,9% и 60,2%, соответственно. Средний объем опухолей в группе с положительным контролем в виде лекарства Tecentriq (Roche) при уровне дозы 10 мг/кг составлял 323±146 мм3, степень ингибирования опухолей составляла 90,8%, ингибирование массы опухолей составляло 91,1%. По сравнению с группой с контролем в виде растворителя, как Tecentriq, так и В11 показали значительное отличие в плане объема опухолей (Р<0,05), что свидетельствует о том, что В11 обладает значительным эффектом в плане ингибирования опухолей.
При дозе 3 мг/кг активность антитела против PD-L1 В11 была эквивалентна эффективности контрольного лекарства Tecentriq при дозе 10 мг/кг, что свидетельствует о том, что антитело против PD-L1 В11 имеет большую противоопухолевую активность, чем Tecentriq.
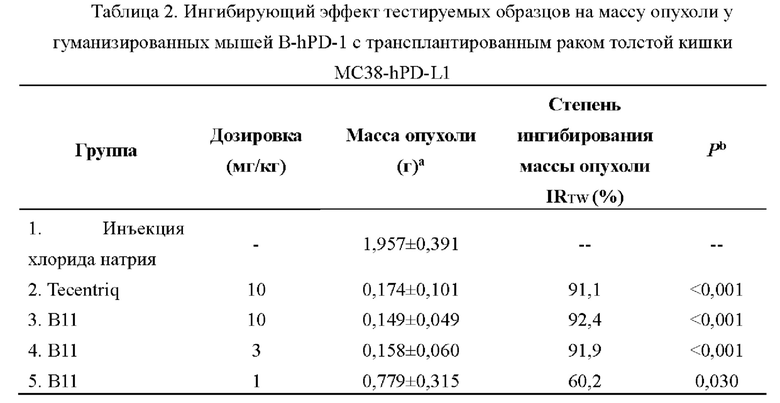
Примечание: а: средняя ± стандартная ошибка; b: Статистическое сравнение массы опухолей между группами с введенным антителом и группой с контролем в виде растворителя спустя 22 дня после введения группам, анализ на основе t-критерия Стьюдента.
Пример 10. In vivo ингибиторная активность антитела против немелкоклеточного рака легкого
В рамках данного примера применяли NCG мышей с ксенографтом клеток НСС827 немелкоклеточного рака легкого человека (Sino Biological) в качестве модели опухоли для оценки противоопухолевой активности антитела Bll in vivo.
Собирали НСС827 клетки на логарифмической фазе роста (Sino Biological) и инокулировали NCG мышам подкожно в правую заднюю часть в День 0 при дозе 5×106/мышь. Спустя 5 дней после инокулирования опухолевых клеток (День 5) мышей с умеренным объемом опухолей отбирали и равномерным образом разделяли на 5 групп, по 12 мышей в каждой группе. Осуществляли внутрибрюшинную трансплантацию РВМС (1×108/мл), 6 из 12 мышам в каждой группе инокулировали РВМС от донора #86, а другим 6 мышам инокулировали РВМС от донора #119. Клетки ресуспендировали в PBS (0,1 мл инокулированного объема). Экспериментальные группы представляли собой группы с 15 мг/кг В11, 5 мг/кг В11 и 1,5 мг/кг В11, группу с положительным контролем в виде 15 мг/кг Tecentriq и группу с 15 мг/кг отрицательного контроля (IgG1 человека). Введение путем внутрибрюшинной инъекции было осуществлено спустя 5, 8, 12, 15, 19 и 22 дня после инокулирования опухолевых клеток, в общей сложности шесть введений. Эффективность оценивали на основе относительной степени ингибирования опухолей (TGIRTV), при этом безопасность оценивали на основе изменения массы тела животных и показателей смерти.
Результаты показали, что в течение 23 дней после инокуляции опухолей в каждой подвергнутой лечению группе какая-либо токсическая реакция на лекарство отсутствовала, при этом мыши с опухолями хорошо переносили тестируемые антитела при тестируемых дозах.
Противоопухолевые результаты показаны на Фиг. 8. Группа, подвергаемая лечению В11 (15 мг/кг), продемонстрировала значительный эффект, связанный с ингибированием опухолей, спустя 12 и 15 дней после инокулирования опухолевых клеток, при этом относительные величины степени ингибирования опухолей TGIRTV (%) составляли 31% и 34%, соответственно, что показывает статистически значимое различие по сравнению с контрольной группой (р значения составляли 0,018 и 0,016, соответственно).
Группа, подвергаемая лечению В11 (5 мг/кг), продемонстрировала значительный эффект, связанный с ингибированием опухолей, спустя 12, 15 и 20 дней после инокулирования опухолевых клеток в подвергаемой лечению группе с трансплантированными РВМС, при этом относительные величины степени ингибирования опухолей TGIRTV (%) составляли 44%, 43%, и 28%, соответственно, что показывает статистически значимое различие по сравнению с контрольной группой (р значения составляли 0,001, 0,006 и 0,046, соответственно).
Группа, подвергаемая лечению В11 (1,5 мг/кг), продемонстрировала значительный эффект, связанный с ингибированием опухолей, спустя 12, 15, 18, 20 и 22 дня после инокулирования опухолевых клеток, при этом относительные величины степени ингибирования опухолей TGIRTV (%) составляли 35%, 30%, 39%, 38% и 49%, соответственно, что показывает статистически значимое различие по сравнению с контрольной группой (р значения составляли 0,013, 0,031, 0,005, 0,003 и 0,002, соответственно).
Положительный контроль в виде лекарства Tecentriq (15 мг/кг) показал малый эффект, связанный с ингибированием опухолей, спустя 12 дней после инокулирования опухолевых клеток, при этом относительная величина степени ингибирования опухолей TGIRTV (%) составляла 23%, что не показывало статистически значимого различия по сравнению с контрольной группой (р значение 0,084).
Вышеуказанные результаты показали, что антитело В11 обладает прекрасной противоопухолевой активностью, при этом данная активность превосходит Tecentriq.
Перечень последовательностей
В10
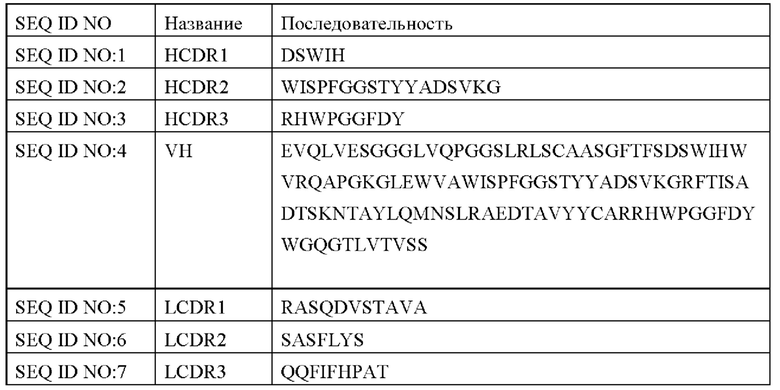

B11
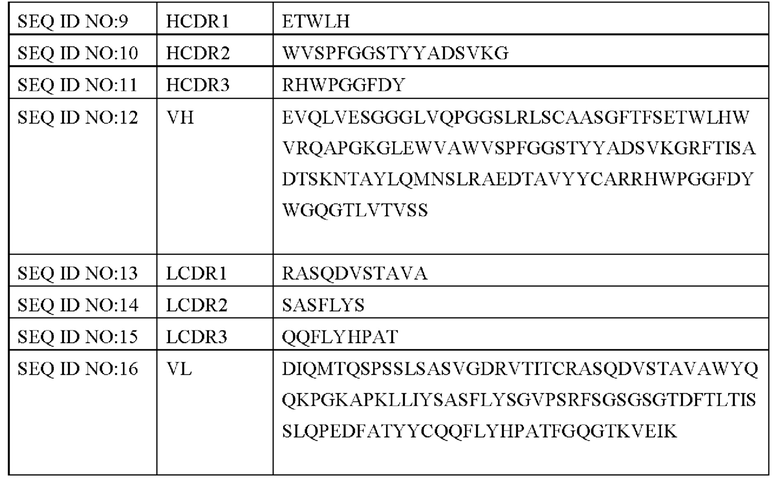
H12
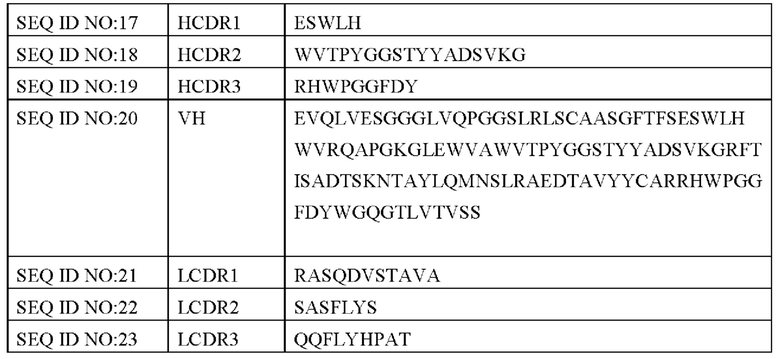




Специалисту в данной области будет очевидно, что могут быть осуществлены различные модификации и изменения изобретения без выхода за рамки его сути и объема. Конкретные описанные здесь варианты осуществления приведены лишь в качестве примером и не должны рассматриваться в качестве каким-либо образом ограничивающих. Действительный объем и суть описаны в рамках прилагаемой формулы изобретения и описания, при этом варианты осуществления являются лишь примерами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И АНТИТЕЛА ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2016 |
|
RU2757489C2 |
| НОВЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1(PD-1) | 2016 |
|
RU2757316C2 |
| АНТИТЕЛА ПРОТИВ VISTA И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2750723C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С GD2 (ГАНГЛИОЗИД GD2), И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2796937C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2013 |
|
RU2599417C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ СВЯЗЫВАЮЩИЕ TIGIT АГЕНТЫ | 2017 |
|
RU2765410C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2016 |
|
RU2732924C2 |
| АНТИТЕЛА ПРОТИВ PD-1 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2788616C2 |
| АНТИТЕЛО ПРОТИВ ЛИГАНДА 1 ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТОК (PD-L1), ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2727914C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2006 |
|
RU2494107C2 |
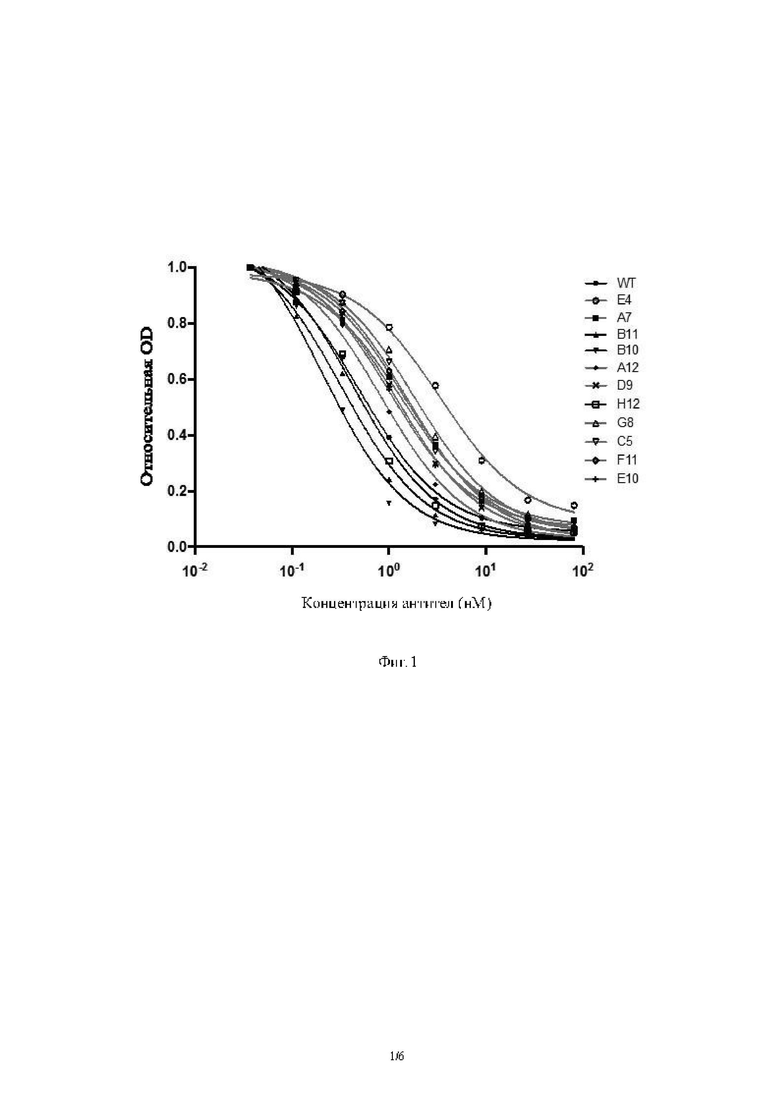
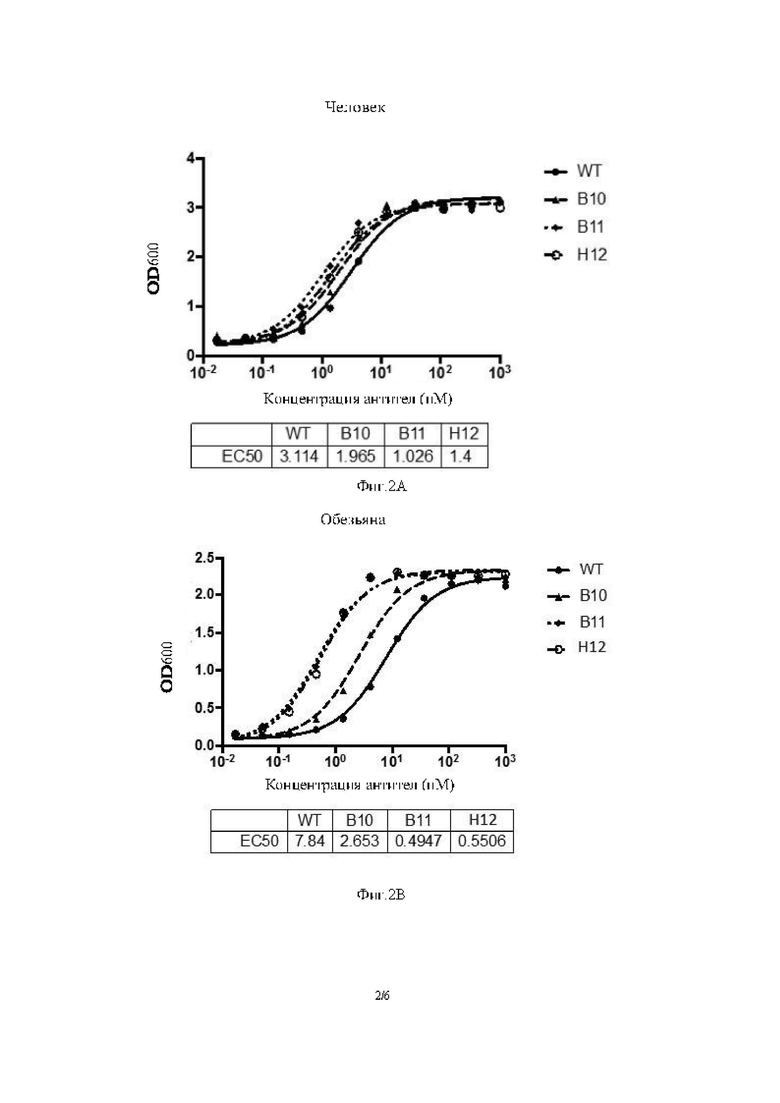
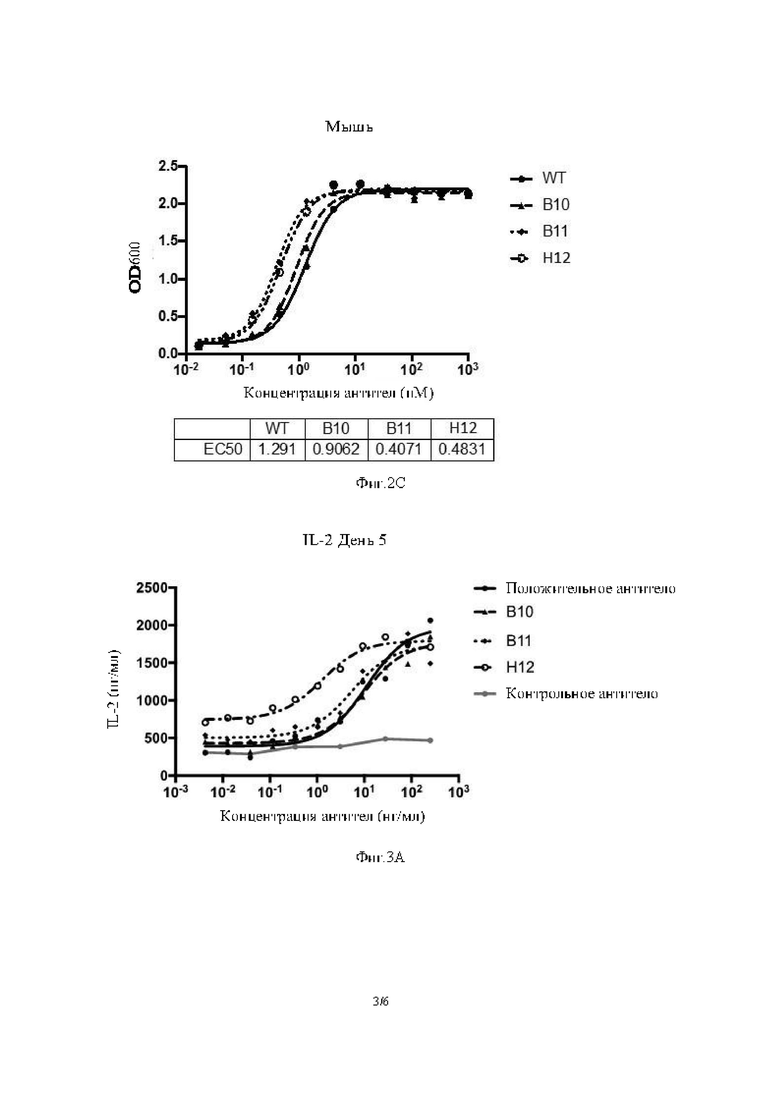
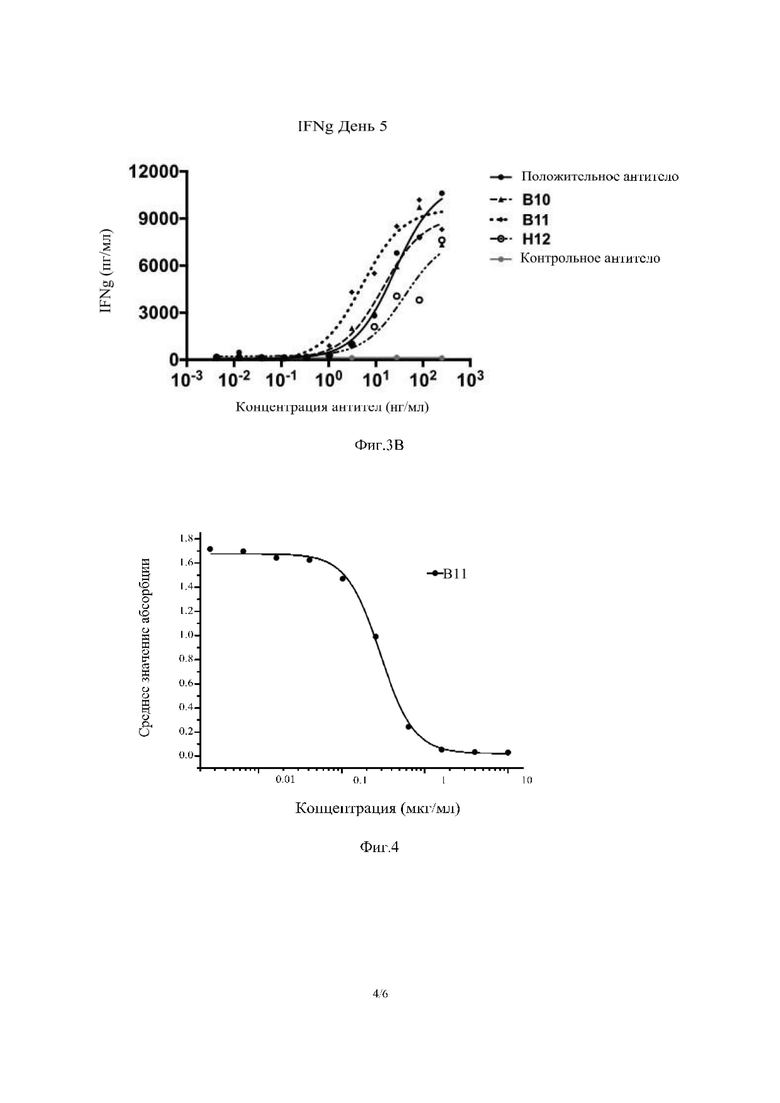
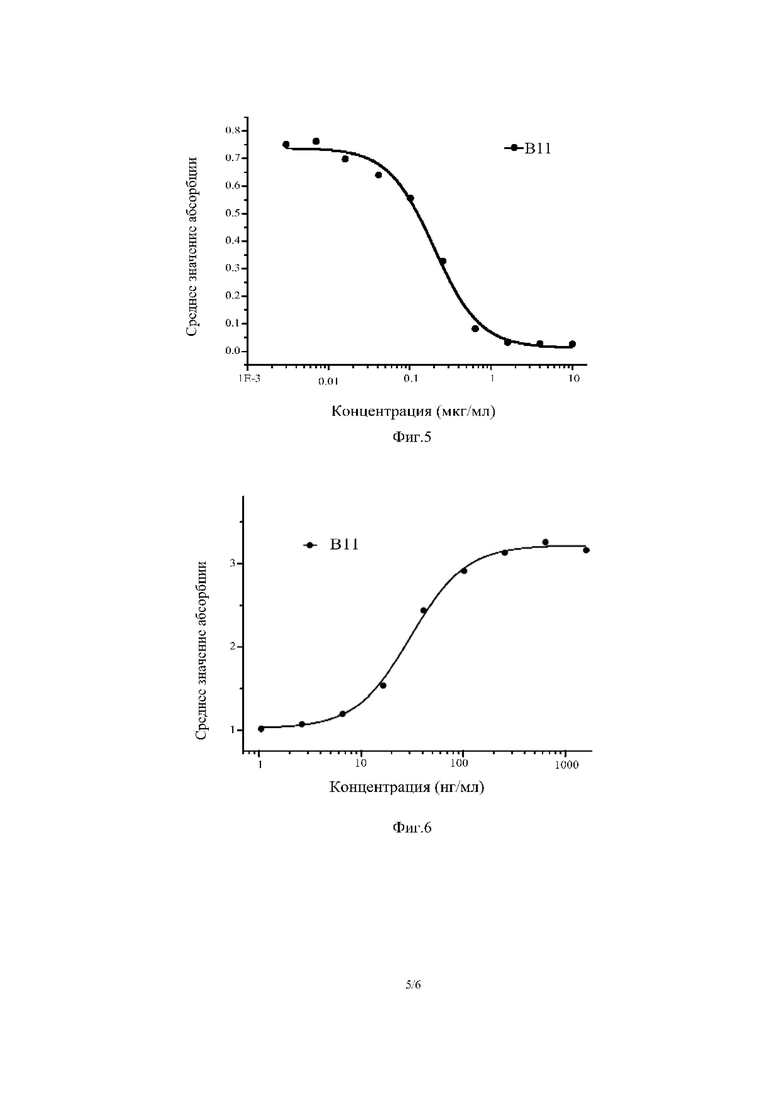
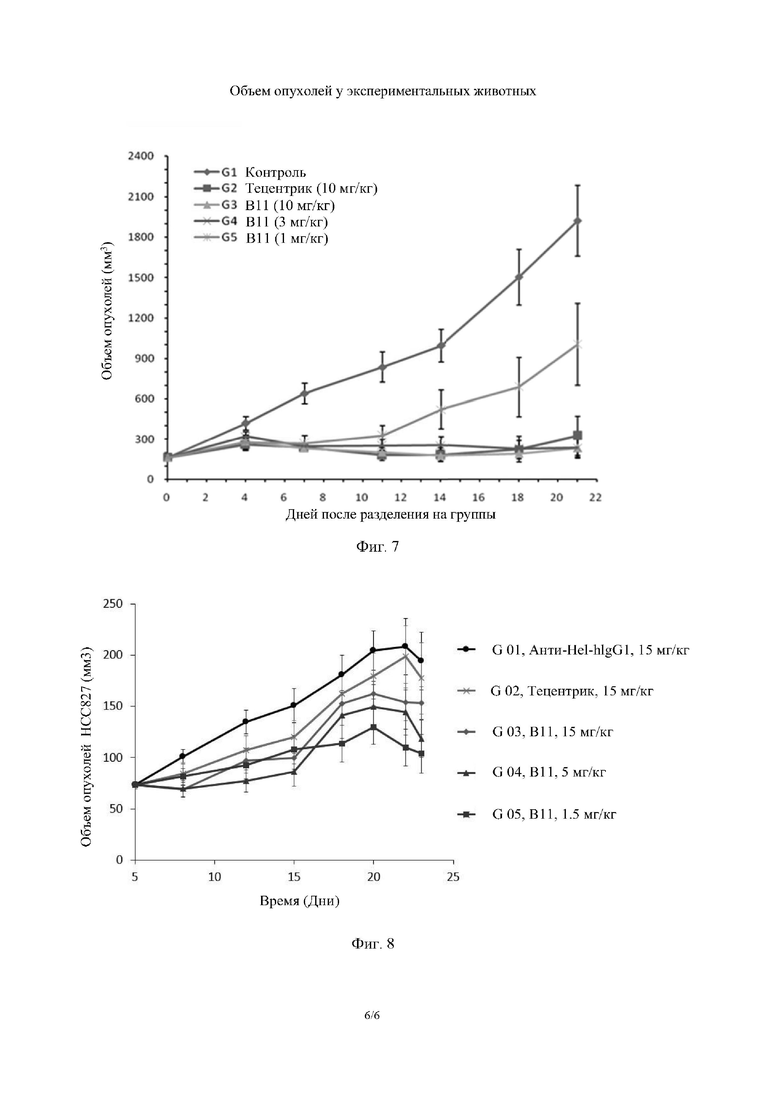
Группа изобретений относится к биотехнологии. Описаны антитело против лиганда программируемой смерти (PD-L1) и его применение для производства лекарственного средства для лечения неопластического заболевания, выделенная молекула нуклеиновой кислоты, фармацевтическая композиция, вектор экспрессии, клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента и способ получения антитела. Изобретение позволяет получить новое антитело против лиганда программируемой смерти и эффективно использовать его при лечении или предотвращении состояний, связанных с PD-L1, в частности, таких как PD-L1-положительная опухоль. 7 н. и 14 з.п. ф-лы, 8 ил., 2 табл., 10 пр.
1. Антитело против PD-L1 или его антигенсвязывающий фрагмент, при этом антитело или его антигенсвязывающий фрагмент специфически распознает и связывает PD-L1, при этом антитело выбрано из группы, состоящей из:
(1) антитела, включающего в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:1,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:2, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:3;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:5,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:6, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:7;
(2) антитела, включающего в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:9,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:10, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:11;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:13,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:14, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:15;
(3) антитела, включающего в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:17,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:18, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:19;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:21,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:22, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:23.
2. Антитело или его антигенсвязывающий фрагмент по п.1, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:1,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:2, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:3;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:5,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:6, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:7; и
вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:4.
3. Антитело или его антигенсвязывающий фрагмент по п.1 или 2, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:1,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:2, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:3;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:5,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:6, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:7; и
вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:8.
4. Антитело или его антигенсвязывающий фрагмент по п.1, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:9,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:10, и H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:11;
вариабельный участок легкой цепи включает: L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:13, L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:14, и L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:15; и вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:12.
5. Антитело или его антигенсвязывающий фрагмент по п.1 или 4, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:9,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:10, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:11;
вариабельный участок легкой цепи включает: L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:13, L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:14, и L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:15; и вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:16.
6. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1, 4 и 5, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом
вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:9,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:10, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:11;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:13,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:14, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:15; и
тяжелая цепь включает аминокислотную последовательность, как показано в SEQ ID NO:28.
7. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1 и 4-6, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:9,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:10, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:11;
вариабельный участок легкой цепи включает: L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:13, L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:14, и L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:15; и антитело содержит легкую цепь, при этом легкая цепь включает аминокислотную последовательность, как показано в SEQ ID NO:27.
8. Антитело или его антигенсвязывающий фрагмент по п.1, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:17,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:18, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:19;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:21,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:22, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:23, и
вариабельный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:20.
9. Антитело или его антигенсвязывающий фрагмент по п.1 или 8, отличающееся тем, что антитело представляет собой антитело, включающее в себя вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок тяжелой цепи включает:
H CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:17,
H CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:18, и
H CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:19;
вариабельный участок легкой цепи включает:
L CDR1, включающий аминокислотную последовательность, как показано в SEQ ID NO:21,
L CDR2, включающий аминокислотную последовательность, как показано в SEQ ID NO:22, и
L CDR3, включающий аминокислотную последовательность, как показано в SEQ ID NO:23, и
вариабельный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:24.
10. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1-9, отличающееся тем, что антитело включает в себя константный участок тяжелой цепи (CH), при этом константный участок тяжелой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:26, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO:26.
11. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1-10, отличающееся тем, что антитело включает в себя константный участок легкой цепи (CL), при этом константный участок легкой цепи включает аминокислотную последовательность, как показано в SEQ ID NO:25, или аминокислотную последовательность, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или бóльшую идентичность последовательности относительно SEQ ID NO:25.
12. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1-11, отличающееся тем, что антитело или его антигенсвязывающий фрагмент способен специфически распознавать и связывать PD-L1, при этом аффинность (KD) составляет 1×10-9 M или менее, предпочтительно 5×10-10 M или менее, более предпочтительно 1×10-10 M или менее.
13. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1-12, отличающееся тем, что антитело или его антигенсвязывающий фрагмент обладает, по меньшей мере, одним из следующих свойств:
1) блокирует взаимодействие между PD-L1 и PD-1;
2) блокирует взаимодействие между PD-L1 и CD80;
3) активирует T-клетки;
4) ингибирует рост опухоли.
14. Антитело или его антигенсвязывающий фрагмент по любому одному из пп.1-13, отличающееся тем, что антитело представляет собой антитело человека.
15. Фармацевтическая композиция для лечения PD-L1-положительной опухоли, включающая в себя эффективное количество антитела или его антигенсвязывающего фрагмента по любому одному из пп.1-14 или их комбинацию и фармацевтически приемлемый носитель.
16. Применение антитела или его антигенсвязывающего фрагмента по любому одному из пп.1-14 или фармацевтической композиции по п.15 для производства лекарственного средства для лечения неопластического заболевания, при этом неопластическое заболевание представляет собой PD-L1-положительную опухоль.
17. Применение по п.16, отличающееся тем, что PD-L1-положительная опухоль представляет собой рак легкого, рак яичника, рак толстой кишки, меланому, рак почки, рак мочевого пузыря, рак груди, рак печени, лимфому, злокачественное гематологическое заболевание, рак головы и шеи, глиому, рак желудка, рак носоглотки, рак гортани, рак шейки матки, карциному тела матки или остеосаркому.
18. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому одному из пп.1-14.
19. Вектор экспрессии, включающий выделенную молекулу нуклеиновой кислоты по п.18.
20. Клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента по любому одному из пп.1-14, которая содержит выделенную молекулу нуклеиновой кислоты по п.18 или вектор экспрессии по п.19.
21. Способ получения антитела против PD-L1 или его антигенсвязывающего фрагмента, включающий в себя (i) культивирование клетки-хозяина по п.20 при условиях, подходящих для экспрессии молекулы нуклеиновой кислоты или вектора экспрессии, и (ii) выделение и очистку антитела или его антигенсвязывающего фрагмента, экспрессируемого молекулой нуклеиновой кислоты или вектором экспрессии.
| US 20150322153 A1, 12.11.2015 | |||
| WO 2012155019 A1, 15.11.2012 | |||
| RU 2016113757 A, 17.10.2017 | |||
| CN 105777906 A, 20.07.2016 | |||
| HERBST R.S | |||
| et al., Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients, Nature, 2014, Volume 515, Issue 7528, pp | |||
| РАДИОПРИЕМНИК - ВОЛНОМЕР | 1923 |
|
SU563A1 |
| RUDIKOFF S | |||
| et al., Single amino acid substitution altering | |||
Авторы
Даты
2021-12-13—Публикация
2019-06-06—Подача