Изобретение относится к медицине, педиатрии, детской нефрологии, методам лабораторной диагностики и прогнозирования и касается исследования уровня одного из цитокинов для прогноза развития рецидивов острого пиелонефрита (ПН) после его дебюта у детей и предотвращения рецидивов, прогрессирования хронической болезни почек.
TGF-β1 (трансформирующий фактор роста бета-1) относится к мультифункциональным цитокинам, впервые выделен из тромбоцитов в 1990-х гг. и способен стимулировать рост клеток и вызывать их трансформацию in vitro. TGF-β в норме - важный регулятор клеточной пролиферации, дифференцировки, апоптоза, воспаления, иммунного ответа, ремоделирования экстрацеллюлярного матрикса. Ряд исследователей считают, что TGF-β1 играет роль в прогрессировании гломерулосклероза и интерстициального фиброза. С помощью иммуногистохимического метода была отмечена выраженная экспрессия TGF-β1 в гломерулах и интерстиции при различных формах нефрита (IgA-нефропатии, фокально-сегментарном гломерулосклерозе, нефрите с полулуниями и диффузном пролиферативном волчаночном нефрите), сопровождающихся накоплением фибронектина, а также ингибитора активатора плазминогена-1 (PAI-1). Повышение количества мРНК TGF-β1 отмечено в клубочках, а также в перигломерулярных и тубулоинтерстициальной областях, местах макрофагальной инфильтрации и отложений эндоплазматического ретикулума (Л.И. Уразаева, А.Н. Максудова. Биомаркеры раннего повреждения почек: обзор литературы // Практическая медицина. 2014. 04 (14). Инновационные технологии в медицине. Том 1. 30.07.2014, http://pmarchive.ru/biomarkery-rarmego-povrezhdeniya-pochek-obzor-literatury/).
В ряде исследований оценена информативность мочевой экскреции МСР-1 и TGF-β1 для мониторинга фиброгенеза в интерстиции почки при хроническом гломерулонефрите (ХГН). Было показано, что МСР-1, начиная с уровня 4,0 пг/мл может быть использован как маркер ранней фазы формирования фиброза (более 10% общей площади коркового слоя). Уровень данного фактора в моче в концентрации более 20 пг/мл и TGF-β1 более 2,0 пг/мл - информативные маркеры сформированного фиброза (более 20% площади коркового слоя) [Бобкова И.Н. и др. Определение экскреции с мочой моноцитарного хемотаксического протеина-1 (МСР-1) и трансформирующего фактора роста β1 (TGF-β1 - неинвазивный метод оценки тубулоинтерстициального фиброза при хроническом гломерулонефрите // Нефрология. - 2006. - Т. 10, № 4. - С. 49-55].
У взрослых пациентов с задними клапанами уретры (PUV) часто встречается долгосрочное ухудшение состояния почек, и раннее выявление вредных факторов может помочь в руководстве будущей терапией. В одном из исследований оценивали уровень TGF-β1 и других цитокинов, а также микроальбуминурии до и после абляции PUV, и изучали влияние ранней индукции ингибиторов ангиотензинпревращающего фермента (АПФ-1) на восстановление почек. В результате были получены выводы, что TGF-β1 в моче, TNF-α в моче и микроальбуминурия могут быть использованы в качестве биомаркеров для раннего распознавания продолжающегося повреждения почек у пациентов (Ankur Mandelia et al. The role of urinary TGF-β1, TNF-α, 1L-6 and microalbuminuria for monitoring therapy in posterior urethral valves // Pediatric Nephrology. 28(10). June 2013. DOI:10.1007/s00467-013-2506-8, https://www.researchgate.net/publication/237092945_The_role_of_urinary_TGF-bl_TNF-a_IL-6_and_microalbuminuria_for_monitoring therapy_in_posterior_urethral_valves).
Что касается детского возраста, то частой причиной заболеваемости в первые годы жизни является инфекция мочевыводящих путей (ИМП) и может приводить к почечной недостаточности. TGF-β1 является одновременно иммунорегулятором и важным медиатором интерстициального фиброза. TGF-бета был обнаружен в моче 52% из 48 детей в возрасте от 1 до 24 месяцев с первым эпизодом ИМП и отсутствием обструктивной нефропатии по сравнению с 0 из 20 здоровых детей раннего возраста (р<0,001). TGF-бета обнаруживался в моче только на ранней стадии (<1 дня) после начала лечения. Он был обнаружен чаще (р=0,06) и в значительно более высоких концентрациях (р=0,046) у детей с нормальным (99m) сканированием Тс-димеркаптосукциновой кислоты по сравнению с детьми с аномальными сканированиями, выполненными через 3-14 дней после постановки диагноза ИМП, что свидетельствует о регуляторной роли в фиброгенезе и исходе пиелонефрита в детском возрасте. (Evangelia Farmaki et al. Transforming growth factor- β1 in the urine of young children with urinary tract infection // Pediatric Nephrology. February 2005. 20(2): 180-3. DOI:10.1007/s00467-004-1705-8. Shirley A. Cotton et al. Role of TGF-β1 in renal parenchymal scarring following childhood urinary tract infection // Kidney International. Volume 61, Issue 1, January 2002, Pages 61-67. https://doi.org/10.1046/j.1523-1755.2002.00110.x.
https://www.sciencedirect.com/science/article/pii/S0085253815481529).
Имеются также исследования в области ветеринарии - при болезнях почек у кошек (Jack Lawsona et al. Renal fibrosis in feline chronic kidney disease: Known mediators and mechanisms of injury // The Veterinary Journal. Vol. 203, Iss. 1, Jan 2015, Pp. 18-26. https://doi.org/10.1016/j.tvjl.2014.10.009). Так, считается, что фиброз почек, характеризующийся обширным накоплением внеклеточного матрикса в интерстиции, является последним общим путем для всех заболеваний почек и является патологическим поражением, которое лучше всего коррелирует с функцией как у людей, так и у кошек. Как конвергентный путь, фиброз почек обеспечивает идеальную цель для лечения хронических болезней почек, и знание лежащего в основе фиброзного процесса имеет важное значение для будущей разработки новых методов лечения. Обнаружено значительное увеличение соотношения уровней TGF-β1 и креатинина в моче (uTGF-β1/Cr) в группе из 23 животных с хронической болезнью почек по сравнению с группой из 13 здоровых животных (Arat et al., 2005). При этом не было выявлено различий в концентрациях TGF-β1 в сыворотке крови. В другом исследовании, где сравнивали 18 здоровых животных с 26 кошками, страдающими от хронической болезни почек, также было продемонстрировало увеличение соотношения в моче uTGFβ1/Cr у кошек с болезнью почек и положительную корреляцию между uTGF-β1/Cr и сывороточным креатинином (Habenicht et al., 2013). Эти результаты предполагают, что TGF-β1 полезен в качестве биомаркера повреждения при хронической болезни почек и как потенциальный инструмент для оценки ответа на терапевтические вмешательства.
Таким образом, в литературе показано, что целый ряд цитокинов, включая TGF-β1, принимает непосредственное участие в развитии и прогрессировании различных заболеваний почек, обладая достаточно большим диагностическим потенциалом. Внедрение мочевых тестов в клиническую практику существенно расширяет возможности диагностики, позволяет проводить неинвазивный мониторинг прогрессирования заболевания и контроль эффективности нефропротективной терапии.
Известен способ прогнозирования течения пиелонефрита у взрослых пациентов старшего возраста (US 20200150132 Al. 02.11.2020. Kai Singbart et al. University of Pittsburgh of the commonwealth system of higher education, параграфы 0009, 0018, 0019, 0062, 0068) с помощью определяемых биомаркеров почечного повреждения в моче пациентов. Так, например, прогноз долгосрочного лечения диализом может быть определен путем мониторинга биомаркеров мочи, связанных с развитием хронической болезни почек. В течение нормализованного временного интервала примерно в несколько дней измеряют уровень гиалуроновой кислоты, и/или TGF-β1 с последующим прогнозированием риска выздоровления или невыздоровления у пациента, перенесшего острое повреждение почек. При этом в одном из вариантов осуществления способа пороговое значение определяют по отношению к уровню в моче креатинина. Например, для уровня гиалуроновой кислоты в моче оно составляет приблизительно 12 мкг/мг креатинина. В другом варианте осуществления данного известного способа определяют прогнозирующее пороговое значение для уровня TGF-β1 по отношению к уровню креатинина в моче, и оно составляет приблизительно 274 пг/мг креатинина. Полученные данные используют для прогноза долгосрочной заместительной почечной терапии, например, диализа.
Однако большинство исследователей не проводили стандартизации TGF-β1 на уровень креатинина или использовали оценку данных показателей на фоне антибактериальной терапии [Renata Y, Jassar Н, Katz R, Hochberg A, Nir RR, Klein- Kremer A. Urinary concentration of cytokines in children with acute pyelonephritis. // Eur. J. Pediatr. 2013; 172 (6): 769-774].
Согласно результатам исследований, при оценке уровня TGF-β1 в сыворотке крови у детей с рефлюкс-нефропатией (РН) TGF-β1 был ниже у детей контрольной группы [Zajaczkowska М, Bienias В, Borzecka Н, Sikora Р, Majewski М, Bojarska-Junak A. Serum TGF-betal level in children with reflux nephropathy // Przeglad. Lekarski. 2006; 63 (3): 121-123]. Также ученые оценили значение мочевого уровня TGF-β1 у взрослых пациентов с односторонним блоком почки, уропатиями с обструкцией и без обструкции мочевыводящих путей как полезного неинвазивного маркера повреждения почечной ткани [Chen X, Zhu W, Al-Hayek S, Yan X, Jiang C, Zheng X, Guo H. Urinary TGF-1 has a supplementary value in predicting renal function recovery post unilateral ureteral obstruction. Int. Urol. Nephrol. 2015; 47: 33-37]. Также в исследованиях российских и зарубежных ученых показано, что высокий уровень TGF-β1 в моче обнаруживается у детей с РН и обструктивным ПН [Zieg J, Blahova K, Seeman Т, Bronsky J, Dvorakova H, Pechova M, et al. Urinary transforming growth factor-рЧ in children with obstructive uropathy // Nephrology. 2011; 16: 595-598. Зайкова H.M., Длин B.B., Синицына Л.А., Корсунский А.А., Гацкан Ш.Г. Маркеры определения степени фиброгенеза у детей с пузырно-мочеточниковым рефлюксом // Педиатрия им. Т.Н. Сперанского. 20 i 5; 94 (3): 45-51].
Таким образом, по-прежнему актуален поиск биомаркеров, отражающих вероятность рецидивирующего течения ПН у детей с дебютом острого ПН. Ранее прогнозирование высокого риска рецидивирующего течения позволяет своевременно назначить пациенту противорецидивный курс терапии уросептическими препаратами и предотвратить рецидивы.
Обычно после курса непрерывной антибактериальной терапии («защищенными» пенициллинами, цефалоспоринами и др.) всем детям проводят противорецидивное лечение не менее 6 недель. Более длительную противорецидивную терапию (6 мес и более) проводят у пациентов с обструктивным вариантом пиелонефрита (особенно на фоне пузырно-мочеточникового рефлюкса) или при его непрерывно-рецидивирующем течении (>3 раз/год). Если в течение периода такой профилактики эпизоды инфекции не возникают, то лечение прекращают. В противном случае, оно возобновляется вновь (Мальцев С.В., Сафина А.И. Лечение пиелонефрита у детей. // Практическая медицина, 5 (24), ноябрь 2007, с. 20-24.
Рекомендуют, в частности, следующие варианты противорецидивной терапии (Durbin W., Petr G., 1985; Игнатова М.С., 1987; Коровина Н.А., 2000):
- фуразидин: полная доза в течение 2-3 недель, затем переходят на 1/2-1/3 от максимальной лечебной дозы один раз в сутки на ночь,
- один из препаратов нефторированных хинолонов - налидиксовой кислоты и пипемидиновой кислоты, которые при длительном назначении могут использоваться по 10 дней каждого месяца.
В качестве противорецидивной терапии также можно использовать фитотерапевтический препарат Канефрон®, который используют либо совместно с уросептиками, либо в качестве монотерапии. Длительность курсовой терапии не менее 4 недель.
Задачей заявленного изобретения является разработка неинвазивного способа отбора детей с дебютом острого пиелонефрита для проведения курса противорецидивной терапии пиелонефрита.
Технический результат от реализации предлагаемого способа заключается в получении достоверных сведений о высокой вероятности рецидивирующего течения острого ПН у детей и своевременном проведении терапии уросептиками, позволяющей избежать в последующем рецидивов ПН. Таким образом, обеспечивается более ранняя точная оценка необходимости назначения уросептических препаратов после завершения антибиотикотерапии для профилактики рецидивирующего течения и снижения активности нефросклеротических процессов в паренхиме почек, а следовательно, сдерживания темпов прогрессирования хронической болезни почек.
Способ характеризуется:
- полной безопасностью для здоровья пациента;
- возможностью простого проведения исследования у детей;
- для исследования необходимо небольшое количество биологического материала (5 мл мочи);
- отсутствием реактогенности со стороны организма больного;
- забор материала не представляет технических трудностей для родителей, может производиться в домашних условиях;
- своевременная противорецидивная терапия детей позволяет исключить рецидивы после дебюта острого пиелонефрита.
Предлагаемый способ отбора детей с дебютом острого пиелонефрита для проведения курса противорецидивной терапии пиелонефрита включает сбор порции мочи в объеме 5 мл после туалета половых органов, до начала антибиотикотерапии, с определением в данной порции мочи уровней трансформирующего фактора роста β1 (TGF-β1) и креатинина (Cr).
В случае, если отношение уровней TGF-β1 и Cr в моче (uTGF-β1/Cr) составляет более 5,55 пг/мг, прогнозируют высокий риск развития рецидивирующего течения пиелонефрита, в связи с чем, по завершении курса антибиотикотерапии ребенку проводят противорецидивный курс терапии уросептическим препаратом.
Предложенный способ оценки технически прост, неинвазивен, информативен, его внедрение не требует больших экономических затрат.
Исследуют мочу ребенка с определением содержания в ней TGF-β1, методом энзимсвязанного иммуносорбентного анализа (ELISA) на иммуноферментном автоматическом анализаторе. Для стандартизации результатов исследования дополнительно проводят исследование уровня креатинина в моче, так как его концентрация в моче коррелирует со степенью канальцевой реабсорбции воды в мочевой системе. Уровень uTGF-β1 выражают в пг на 1 мл мочи и в пересчете на 1 мг креатинина. При уровне uTGF-β1/Cr 5,55 пг/мг и выше, пациентов относят к группе высокого риска рецидивирующего течения острого ПН, в связи с чем по завершении антибактериальной терапии проводят противорецидивный курс терапии уросептическими препаратами.
Работоспособность способа была доказана путем клинико-лабораторного обследования 90 пациентов ГБУЗ «ДГКБ № 9 им. Г.Н. Сперанского ДЗМ» г. Москвы, в возрасте на момент участия в исследовании от 1 года до 15 лет с дебютом острого и хроническим вторичным пиелонефритом, проходивших лечение и обследование в Детской городской клинической больнице №9 имени Г.Н. Сперанского Департамента здравоохранения Москвы (главный врач проф., д.м.н. Корсунский А.А.).
Группу А составили 30 пациентов с дебютом острого ПН без пороков развития органов мочевой системы (ОМС), признаков нарушения уродинамики и метаболических изменений, у которых в течение 36 и более месяцев не отмечалось рецидивов ПН или признаков его латентного течения.
Группа В состояла из 30 пациентов с дебютом острого ПН, у которых в течение 36 месяцев наблюдения отмечен один или более рецидивов ПН.
В группу С было включено 30 детей с уже установленным рецидивирующим течением вторичного хронического ПН. Диагностика заболевания осуществлялась в соответствии со стандартами Федеральных клинических рекомендаций союза Педиатров России (2018) [Федеральные клинические рекомендации по оказанию медицинской помощи детям с инфекцией мочевыводящих путей [Электронный ресурс] М.: Союз педиатров России, 2018. http://www.pediatr-russia.ru/sites/default/files/file/kr_imvp2018.pdf].
В группу контроля включили 30 практически здоровых детей, сопоставимых по возрасту и полу, не имеющих в анамнезе и на момент исследования заболеваний почек и изменений в анализах мочи. Группы обследованных детей не отличались между собой по половому и массо-ростовому показателям (р<0,05). Всем детям в моче определяли уровень TGF-β1 (uTGF-β1) методом энзимсвязанного иммуносорбентного анализа (ELISA) на иммуноферментном автоматическом анализаторе с использованием реактивов Bio Vendor Laboratory Medicine, а также уровень креатинина в моче (иммуноферментный анализ), на значение которого и нормировали полученные значения uTGF-β1.
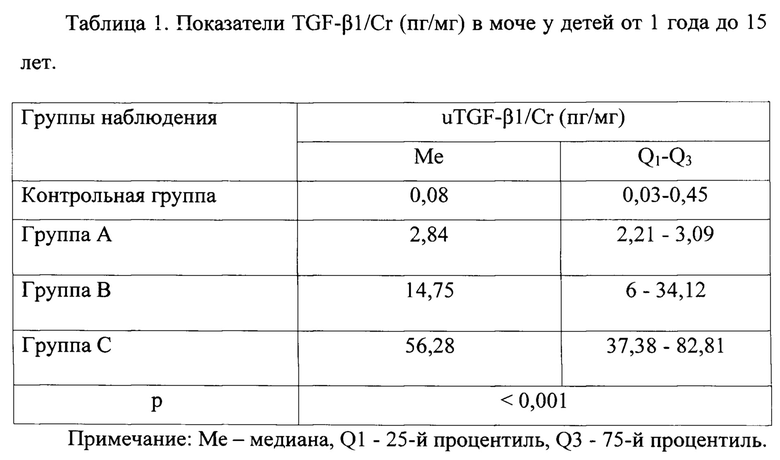
Значение 5,55 пг/мг уровня uTGF-β1/Cr было получено при проведении ROC анализа с расчетом более 90% чувствительности и специфичности маркера, с учетом участия в исследовании детей с дебютом острого ПН, у которых впоследствии отмечались его рецидивы (см. выше группа В) и группа без рецидивов острого ПН в последующем (группа А), а также дети с уже установленным рецидивирующим течением вторичного хронического ПН (группа С).
Примеры
Клинический пример 1. Больная А., 3 года 7 месяцев, поступила с жалобами на фебрильную лихорадку, боли в животе, не связанные с приемом пищи, снижение аппетита, боли при мочеиспускании. Со слов мамы, данные жалобы беспокоят в течение 2-х дней, амбулаторно был рекомендован прием парацетамола в виде суспензии, на фоне которого температура снижалась на несколько часов, потом вновь повышалась. Объективно: состояние средней степени тяжести. Температура 38,4°С. Кожа бледная, сухая, отеков нет. Пульс - 102 удара в мин. Тоны сердца ясные, ритмичные. АД - 90/60 мм рт.ст. Мочеполовая система сформирована по женскому типу. Пальпация живота безболезненная. Беспокойство при мочеиспускании. Учитывая жалобы и данные объективного осмотра, пациентку госпитализировали. Из анамнеза жизни: ребенок от первой беременности, первых родов, неонатальный период без особенностей. Находилась на грудном вскармливании до года 4-х месяцев, прикормы введены с 4 месяцев. Аллергологический анамнез не отягощен.
В общем анализе крови: эритроциты - 4,1⋅1012/л, Hb - 105 г/л, лейкоциты - 18,7⋅109/л, палочкоядерные нейтрофилы - 8%, сегментоядерные нейтрофилы - 56%, лимфоциты - 24%, моноциты - 10%, эозинофилы - 2%, СОЭ - 25 мм/ч.
В общем анализе мочи: удельный вес - 1005, моча мутная, реакция кислая, белок - 0,2 г/л, лейкоциты - 52-58 в поле зрения, эритроциты - 0-1 в п/зр, бактерии +++, слизь +, кристаллы +.
По данным УЗИ почек и мочевого пузыря отмечалось расширение чашечно-лоханочной системы левой почки до 5 мм.
После проведенного комплексного обследования ребенку был выставлен диагноз: Острый пиелонефрит. Пациенту проведено обследование на уровень uTGF-β1/Cr в моче. У данного пациента уровень uTGF-β1/Cr составил 11,7 пг/мг. Таким образом, у ребенка дошкольного возраста в результате комплексного обследования диагностирован острый пиелонефрит. Исследование уровня uTGF-β1/Cr в моче позволило отнести его в группу риска по рецидивирующему течению пиелонефрита, в связи с чем, после окончания антибактериальной терапии (Цефотаксим 700 мг 2 раза в/м 7 дней, далее Цефиксим 60 мг 2 раза внутрь 7 дней) ему рекомендовано назначение противорецидивной терапии уросептиками. Ребенок получал Фуразидин 25 мг 3 раза в день, в течение 21 дня, затем 25 мг 1 раз вечером в течение 21 дня. После курса уросептика повторно определен уровень uTGF-β1/Cr в моче - и он составил 4,2 пг/мг. В течение последующих трех лет (36 мес) рецидивы пиелонефрита не наблюдались, т.е. своевременное назначение уросептиков в качестве противорецидивной терапии позволило предотвратить рецидивы острого пиелонефрита у данного пациента.
Клинический пример 2. Больная Л., 10 лет, обратилась с жалобами на повышение температуры до 38,7°С, вялость, снижение аппетита, боли в поясничной области. Анамнез заболевания: в течение последней недели жалобы на боли в поясничной области, обратились к педиатру, рекомендована консультация невролога и УЗИ почек. Невролог - патологических изменений со стороны нервной системы не выявлено, по данным УЗИ почек без патологии. За время обследования присоединилась слабость и отмечено повышение температуры. Из анамнеза жизни известно, что девочка от первой беременности, первых родов. Объективно: состояние средней тяжести, температура 38,7°С. Кожа бледная, периорбитальные «тени», отеков нет. Пульс - 98 ударов в минуту. Тоны сердца ритмичные, громкие. Мочеполовая система сформирована по женскому типу. Стул задержан в течение 48 часов. Мочится свободно.
В общем анализе крови: эритроциты - 3,8⋅1012/л, Hb - 120 г/л, лейкоциты - 11,8⋅109 /л, палочкоядерные нейтрофилы - 8%, сегментоядерные нейтрофилы - 55%, лимфоциты - 31%, моноциты - 5%, эозинофилы - 1%, СОЭ - 19 мм/ч.
В общем анализе мочи: удельный вес - 1009, моча мутная, реакция кислая, белок - 0,02 г/л, лейкоциты - 105-107 п/зр, эритроциты - 0-2 п/зр, бактерии +, слизь ++.
У данного пациента уровень uTGF-β1/Cr был 1,5 пг/мг. Таким образом, проведенное комплексное клинико-диагностическое обследование позволило установить диагноз: Острый пиелонефрит, а определение содержания в моче uTGF-β1/Cr выявило низкий риск рецидивирования, что позволило отказаться от проведения противорецидивного курса терапии после окончания антибиотикотерапии «защищенным» пенициллином. В процессе последующего наблюдения в течение трех лет рецидивов, действительно, не отмечено. Уровень uTGF-β1/Cr сохранялся ниже 5,55 пг/мг.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ контроля эффективности проводимой антибиотикотерапии при лечении острого пиелонефрита у детей грудного возраста | 2021 |
|
RU2759469C1 |
| СПОСОБ ВОССТАНОВИТЕЛЬНОГО ЛЕЧЕНИЯ ДЕТЕЙ С ВТОРИЧНЫМ ХРОНИЧЕСКИМ ПИЕЛОНЕФРИТОМ | 2018 |
|
RU2707027C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ МОЧЕВЫВОДЯЩИХ ПУТЕЙ У ДЕТЕЙ | 2001 |
|
RU2199358C2 |
| Способ лечения детей раннего возраста с рецидивирующей инфекцией мочевой системы | 2020 |
|
RU2724186C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПИЕЛОНЕФРИТА У ДЕТЕЙ | 2001 |
|
RU2197292C1 |
| СПОСОБ ВОССТАНОВИТЕЛЬНОГО ЛЕЧЕНИЯ ДЕТЕЙ С ПЕРВИЧНЫМ ХРОНИЧЕСКИМ ПИЕЛОНЕФРИТОМ | 2018 |
|
RU2725276C2 |
| СПОСОБ ДИАГНОСТИКИ РЕФЛЮКС-НЕФРОПАТИИ | 2003 |
|
RU2239838C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЛОМЕРУЛОНЕФРИТОВ С НЕФРОТИЧЕСКИМ СИНДРОМОМ РЕЦИДИВИРУЮЩЕГО ТЕЧЕНИЯ | 2020 |
|
RU2764216C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕФРОСКЛЕРОЗА У ДЕТЕЙ С ХРОНИЧЕСКИМ ПИЕЛОНЕФРИТОМ | 2018 |
|
RU2689790C1 |
| СПОСОБ ЛЕЧЕНИЯ ПИЕЛОНЕФРИТА | 1996 |
|
RU2145899C1 |
Изобретение относится к медицине, а именно к педиатрии, нефрологии, и может быть использовано для отбора детей с дебютом острого пиелонефрита для проведения курса противорецидивной терапии пиелонефрита. Проводят сбор порции мочи в объеме 5 мл после туалета половых органов, до начала антибиотикотерапии, с определением в данной порции мочи уровней трансформирующего фактора роста β1 (TGF-β1) и креатинина (Cr). В случае, если отношение уровней TGF-β1 и Cr в моче (uTGF-β1/Cr) составляет более 5,55 пг/мг, прогнозируют высокий риск развития рецидивирующего течения пиелонефрита, в связи с чем по завершении курса антибиотикотерапии ребенку проводят противорецидивный курс терапии уросептическим препаратом. Способ обеспечивает возможность получения достоверных сведений о высокой вероятности рецидивирующего течения острого пиелонефрита у детей и своевременном проведении терапии уросептиками, позволяющей избежать в последующем рецидивов пиелонефрита, за счет неинвазивного метода оценки отношения уровней TGF-β1 и Cr в моче пациентов. 1 табл., 2 пр.
Способ отбора детей с дебютом острого пиелонефрита для проведения курса противорецидивной терапии пиелонефрита, включающий сбор порции мочи в объеме 5 мл после туалета половых органов, до начала антибиотикотерапии, с определением в данной порции мочи уровней трансформирующего фактора роста β1 (TGF-β1) и креатинина (Cr), и в случае, если отношение уровней TGF-β1 и Cr в моче (uTGF-β1/Cr) составляет более 5,55 пг/мг, прогнозируют высокий риск развития рецидивирующего течения пиелонефрита, в связи с чем по завершении курса антибиотикотерапии ребенку проводят противорецидивный курс терапии уросептическим препаратом.
| Способ контроля эффективности проводимой антибиотикотерапии при лечении острого пиелонефрита у детей грудного возраста | 2021 |
|
RU2759469C1 |
| US 20200150132 A1, 14.05.2020 | |||
| ЕРЕМЕЕВА А.В | |||
| и др | |||
| Неинвазивные маркеры фиброгенеза у детей с острым и хроническим вторичным пиелонефритом | |||
| Педиатрия | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| Шланговое соединение | 0 |
|
SU88A1 |
| HAHN H | |||
| et al., Urinary transforming growth factor-beta1 (TGF-beta1)/creatinine ratio and its clinical implications in childhood acute | |||
Авторы
Даты
2021-12-13—Публикация
2021-06-07—Подача