Заявление об исследовании, финансируемом из федерального бюджета
[0001] Настоящее изобретение создано при государственной поддержке в рамках грантов №№ R24 DK085610 и K08 AG048354, присужденных Национальными институтами здравоохранения. Правительство США обладает определенными правами на настоящее изобретение.
Перекрестная ссылка на родственные заявки
[0002] В соответствии с §119(e) Раздела 35 Свода Законов США (U.S.С.) настоящая заявка испрашивает приоритет по дате подачи предварительной заявки на патент США №62/346975, поданной 7 июня 2016 года, полное содержание которой включено в настоящее описание посредством ссылки.
Введение
[0003] Кетогенные диеты и кетоновые тела представляют интерес с точки зрения лечения различных расстройств у человека, включая эпилепсию, деменцию и заболевания, связанные со старением. Кетоновые тела представляют собой низкомолекулярные соединения, образующиеся из жира, которые служат заменой сахара при истощении запасов энергии в организме, как то во время голодания или при интенсивных физических нагрузках. Кетогенные диеты стимулируют выработку кетоновых тел, поскольку включают очень мало сахара или других углеводов. Основными кетоновыми телами у людей являются ацетоацетат (АсАс) и β-гидроксибутират (ВНВ). Кетогенные диеты находят клиническое применение в качестве терапии эпилепсии, но часто их сложно придерживаться в течение длительных периодов времени. Чрезвычайно высокое содержание жиров (и низкое содержание углеводов) может придавать продуктам кетогенной диеты неприятный вкус и в ряде случаев вызывать желудочно-кишечные расстройства, образование камней в почках, повышение уровня холестерина и оказывать другие побочные действия.
[0004] ВНВ представляет собой промежуточный продукт метаболизма, который является посредником для получения энергии в клетках, а также выполняет несколько сигнальных функций, не связанных с получением энергии. Энергетическая и сигнальная функции, совместно или по отдельности, могут быть важны для действия ВНВ в отношении заболеваний человека. В условиях дефицита глюкозы, например, во время голодания или интенсивных физических нагрузок, ВНВ является посредником, с помощью которого энергия, запасенная в жировой ткани, превращается в энергетические эквиваленты, которые могут быть использованы клетками всего организма для поддержания их функций. Жир, мобилизованный из жировой ткани, транспортируется в печень и превращается в ВНВ. С кровотоком ВНВ переносится во все ткани. После поглощения клеткой ВНВ расщепляется в митохондриях с образованием ацетил-КоА, который подвергается дальнейшему метаболизму с образованием АТФ. В этом заключается каноническая функция ВНВ в качестве «энергетического посредника».
[0005] Помимо этого, ВНВ может выполнять несколько сигнальных функций. Большинство из них не связаны с его функцией в качестве энергетического посредника, поскольку они представляют собой действие самой молекулы ВНВ и обычно не являются вторичными эффектами ее метаболизма с образованием ацетил-КоА и АТФ. Сигнальные функции могут включать: 1) ингибирование гистондеацетилаз класса I и IIa с последующими изменениями в модификациях гистонов и экспрессии генов, а также изменениями степени ацетилирования и активности негистоновых белков; 2) метаболизм с образованием ацетил-КоА приводит к увеличению выработки клетками ацетил-КоА, служащего субстратом для ферментов ацетилтрансфераз, что приводит к схожим изменениям ацетилирования гистоновых и негистоновых белков вследствие ингибирования деацетилазы; 3) ковалентное присоединение к гистонам и, возможно, другим белкам по типу β-гидроксибутирилирования лизина, которое может оказывать действие, подобное действию ацетилирования лизина; 4) связывание и активация рецептора 2 гидроксикарбоновых кислот (HCAR2) с последующими изменениями в метаболизме жировой ткани; 5) связывание и ингибирование рецептора 3 свободных жирных кислот (FFAR3) с последующими изменениями в активации симпатической нервной системы и скорости метаболизма во всем организме и 6) ингибирование инфламмасомы NOD-подобного рецептора 3 (NLRP3).
Краткое описание
[0006] Аспекты настоящего изобретения включают β-гидроксиэфирные соединения жирных кислот (например, сложные эфиры жирных кислот и β-гидроксибутирата), сложные эфиры жирных кислот и бутандиола и их фармацевтически приемлемые соли. Также предложены фармацевтические композиции, содержащие одно или более β-гидроксиэфирных соединений жирных кислот и/или один или более сложных эфиров жирных кислот и бутандиола. Также предложены способы лечения субъекта путем введения субъекту одного или более сложных эфиров. Также описаны наборы, содержащие один или более предложенных сложных эфиров.
Краткое описание чертежей
[0007] На фигурах 1а и 1b изображены спектры 1Н-ЯМР и ГХ-МС, соответственно, С6-замещенного сложного эфира β-гидроксибутирата в соответствии с некоторыми вариантами реализации.
[0008] На фигурах 2а и 2b изображены спектры 1H-ЯМР и ГХ-МС, соответственно, С8-замещенного сложного эфира β-гидроксибутирата в соответствии с некоторыми вариантами реализации.
[0009] На фигурах 3а и 3b изображены спектры 1H-ЯМР и ГХ-МС, соответственно, С6-замещенного β-гидроксиэфирного соединения жирной кислоты в соответствии с некоторыми вариантами реализации.
[0010] На фигурах 4а и 4b изображены спектры 1H-ЯМР и ГХ-МС, соответственно, С6-ацилзамещенного сложного эфира бутандиола в соответствии с некоторыми вариантами реализации.
[0011] На фигурах 5а и 5b изображены спектры 1H-ЯМР и ГХ-МС, соответственно, С8-ацилзамещенного сложного эфира бутандиола в соответствии с некоторыми вариантами реализации.
[0012] На фигурах 6а-6с представлена биологическая функция С6 и С8 сложных эфиров бутандиола и β-гидроксибутирата, определенная путем внутрибрюшинной инъекции двух доз каждого самцам мышей C57BL/6 дикого типа. На фигуре 6а представлена концентрация в плазме в течение 6 часов после инъекции С6 и С8 сложных эфиров β-гидроксибутирата. На фигуре 6b представлена концентрация в плазме в течение 6 часов после инъекции С6 и С8 сложных эфиров бутандиола (BD). На фигуре 6с представлена концентрация в плазме в течение 4 часов после инъекции С6 и С8 сложных эфиров β-гидроксибутирата.
[0013] На фигурах 7a-7h показано, что кетогенная диета (КД), в отличие от голодания, приводила к стабильному сокращению числа эпилептиформных спайков у мышей APPJ20. Фиг. 7а: 23-часовая ЭЭГ, зарегистрированная через 2 дня после начала КД, демонстрирует ~30% снижение числа спайков по сравнению с предшествующим исходным уровнем при контрольной диете. При голодании в течение ночи не наблюдается изменений. Фиг. 7b: общее число спайков в час за 23 часа регистрации. Фиг. 7с: сокращение числа спайков у отдельных мышей, нормированное к зарегистрированному исходному уровню каждой мыши (закрашенные кружки, Р<0,05; столбец = медиана). Фиг. 7d: количество движений было схожим в условиях всех диет, как и (фиг. 7е) общий нормированный гамма-ритм. Фиг. 7f: наиболее точные прямые линейной регрессии с 95% ДИ для диаграмм рассеяния числа спайков и движений в минуту. APPJ20 обычно характеризуются меньшим числом спайков при более выраженном исследовательском поведении; при КД наблюдается меньшее число спайков при всех степенях выраженности движения. Фиг. 7g: наиболее точные прямые линейной регрессии с 95% ДИ для диаграмм рассеяния нормированного гамма-ритма и движений в минуту, показывающие отсутствие изменений в скорости индукции гамма-ритма при движении в случае КД. Фиг. 7h: при КД общая средняя мощность гамма-ритма остается неизменной. P-значения, полученные с помощью t-критерия, для двусторонних сравнений и ANOVA с поправкой Тьюки для множественных сравнений. N=9-12 мышей на каждые условия; данные для А, В, D, Е показывают N=7, которые выполнили все условия с получением высококачественных данных.
[0014] На фигурах 8a-8h показано сокращение числа эпилептиформных спайков при продолжении КД в течение месяцев и связь с когнитивными улучшениями при привыкании к открытому полю. Фиг. 8а: временная шкала эксперимента. Фиг. 8b: в семи 50-минутных ЭЭГ APPJ20 при КД демонстрировали сокращение числа спайков на ~40% по сравнению с мышами, получавшими контрольную диету. Фиг. 8с: среднее число спайков/мин за 50-минутный период регистрации; число спайков у мышей при контрольной диете возрастает по мере того, как исследовательская активность уменьшается в конце регистрации. Фиг. 8d: наиболее точные прямые линейной регрессии с 95% ДИ для диаграмм рассеяния числа спайков и движений в минуту демонстрирует, что при КД число спайков является более низким при всех степенях выраженности движения. Фиг. 8е: общее число движений (пересечения лучей) при проведении тестов открытого поля после привыкания на 53 и 72 дни показывает, что исследовательское поведение является схожим у АРР, получающих КД, и контрольных нетрансгенных мышей (НТГ). Фиг. 8f-h: общее число движений (фиг. 8f), подъемов на задние лапы (фиг. 8g) и движений в центральной зоне (фиг. 8h) являются схожими у АРР, получающих КД, и контрольных НТГ, что свидетельствует об успешном привыкании. P-значения, полученные с помощью t-критерия, для двусторонних сравнений и ANOVA с поправкой Тьюки для множественных сравнений. N=4-6 на группу.
[0015] На фигурах 9a-9h показано, что долгосрочная кетогенная диета приводит к улучшению когнитивных функций, а также, в случае самцов, выживаемости. Фиг. 9а: изменения массы тела у мышей APPJ20 и НТГ при КД или контрольной диете, начатых в возрасте 2 месяцев. Фиг. 9b: концентрации ВНВ в плазме представляют собой среднее из шести утренних определений, проводимых примерно каждые две недели с начала исследования. Фиг. 9с, 9d: кривые выживаемости самцов и самок APPJ20, соответственно, при КД по сравнению с контрольной диетой. Не было зарегистрировано случаев смерти среди НТГ мышей. Фиг. 9e-9h: тест с водным лабиринтом Морриса проводили через три месяца после начала диеты. Пробные испытания выполняли через 24 часа после последнего обучения со скрытой платформой; воспроизведение навыка начинали через 24 часа после первого пробного испытания. Мыши АРР при КД продемонстрировали улучшенную обучаемость как при начальном обучении, так и при воспроизведении навыка (фиг. 9е, 9g), однако при пробных испытаниях не наблюдали различий (фиг. 9f, 9h). P-значения, полученные с помощью t-критерия, для двусторонних сравнений и ANOVA с поправкой Тьюки для множественных сравнений. N=21-26 на группу генотип-диета в начале исследования; N=11-14 на группу для водного лабиринта.
[0016] На фигурах 10а-10f показано, что соединения, описанные в настоящем описании, которые подвергаются метаболизму с образованием ВНВ, вызывают немедленное сокращение числа эпилептиформных спайков. Фиг. 10а: структурная формула примера кетогенных соединений, содержащих сложный эфир среднецепочечной жирной кислоты, связанный с ВНВ. Фиг. 10b-10f: группе мышей инъекционно вводили как С6-ВНВ, так и нормальный физиологический раствор в разные дни, при этом регистрировали ЭЭГ до и после каждой инъекции. Фиг. 10b: инъекция С6-ВНВ приводит к повышению концентрации ВНВ в крови при определении примерно через 70-80 минут после инъекции (после ЭЭГ). Фиг. 10с: инъекция С6-ВНВ приводит к сокращению числа спайков по сравнению как с исходным уровнем до инъекции, так и с инъекцией физиологического раствора. Фиг. 10d: график среднего числа спайков в процессе 50-минутной регистрации ЭЭГ демонстрирует постепенное его сокращение после инъекции С6-ВНВ, подобно КД. Фиг. 10е: анализ сокращения числа спайков после введения С6-ВНВ по сравнению с введением физиологического раствора на уровне отдельных мышей демонстрирует значительное сокращение числа спайков для большинства мышей (закрашенные кружки, Р<0,05; столбец = медиана). Фиг. 10f: различия в числе спайков, вызванные инъекциями С6-ВНВ и физиологического раствора, были наиболее выражены, когда мыши находились в состоянии покоя (и гамма-ритм был наименьшим), подобно КД. P-значения, полученные с помощью t-критерия, для двусторонних сравнений и ANOVA с поправкой Тьюки для множественных сравнений. N=22, анализ ограничен до 17 мышей, которые выполнили все условия с получением высококачественных данных.
[0017] На фигуре 11 представлено потребление калорий с пищей, содержащей различные концентрации С6 сложных эфиров β-гидроксибутирата, в зависимости от времени.
[0018] На фигуре 12 представлено снижение массы тела у мышей после получения пищи, содержащей различные количества С6 сложных эфиров β-гидроксибутирата, в зависимости от времени.
[0019] На фигуре 13 представлена концентрация глюкозы в крови у мышей при потреблении пищи, содержащей различные количества С6 сложных эфиров β-гидроксибутирата, в зависимости от времени.
[0020] На фигуре 14 представлена концентрация β-гидроксибутирата в крови после получения мышами пищи, содержащей различные количества С6 сложных эфиров β-гидроксибутирата, в зависимости от времени.
[0021] На фигуре 15 представлено потребление калорий с пищей, содержащей различные сложные эфиры бутандиола и β-гидроксибутирата, в зависимости от времени.
[0022] На фигуре 16 представлено изменение массы тела у мышей при потреблении пищевых композиций с добавлением различных сложных эфиров бутандиола и β-гидроксибутирата в зависимости от времени.
[0023] На фигуре 17 представлены концентрации глюкозы в крови у мышей при потреблении пищи с добавлением различных сложных эфиров бутандиола и β-гидроксибутирата в зависимости от времени.
[0024] На фигуре 18 представлена концентрация β-гидроксибутирата в крови после получения мышами пищи, содержащей различные сложные эфиры бутандиола и β-гидроксибутирата, в зависимости от времени.
[0025] На фигуре 19 представлено сравнение концентрации β-гидроксибутирата в плазме, концентрации глюкозы в крови и потребления калорий у мышей, которые потребляли контрольную пищу, и мышей, которые потребляли пищу с добавлением С6 сложных эфиров β-гидроксибутирата.
Определения
[0026] В контексте настоящего описания термины «лечение», «осуществление лечения» и тому подобное относятся к получению желаемого фармакологического и/или физиологического эффекта. Указанный эффект может являться профилактическим с точки зрения полного или частичного предотвращения состояния, заболевания, патологического процесса или его симптома и/или может являться терапевтическим с точки зрения частичного или полного излечения состояния, заболевания, патологического процесса и/или неблагоприятного воздействия, связанного с указанным состоянием, заболеванием или патологическим процессом. Термин «лечение» в контексте настоящего описания включает, например, любое лечение состояния, заболевания или патологического процесса у млекопитающего, в частности, у человека, и включает: (а) предотвращение возникновения состояния, заболевания или патологического процесса у субъекта, который может быть предрасположен к указанному состоянию, заболеванию или патологическому процессу, но у которого его наличие еще не было диагностировано; (b) подавление состояния или заболевания, то есть прекращение его развития; и (с) облегчение состояния, заболевания или патологического процесса, то есть обусловливание регресса указанного состояния, заболевания или патологического процесса.
[0027] Термины «индивидуум», «субъект», «хозяин» и «пациент», взаимозаменяемо используемые в настоящем описании, относятся к млекопитающему, включая, но не ограничиваясь перечисленными, крыс или мышей (крыс, мышей), приматов, не являющихся человеком, людей, собак, кошек, копытных (например, лошадей, быков, овец, свиней, коз) и т.д.
[0028] Термин «терапевтически эффективное количество» или «эффективное количество» относится к количеству соединения, которое при введении млекопитающему или другому субъекту для лечения заболевания является достаточным для осуществления такого лечения заболевания. «Терапевтически эффективное количество» будет меняться в зависимости от соединения или клетки, заболевания и его тяжести, а также возраста, массы тела и т.д. подлежащего лечению субъекта.
[0029] Термины «совместное введение» и «в комбинации с» включают введение двух или более терапевтических агентов одновременно, параллельно или последовательно без каких-либо конкретных временных ограничений. В одном из вариантов реализации указанные агенты присутствуют в клетке или в организме субъекта в одно и то же время или оказывают свое биологическое или терапевтическое действие в одно и то же время. В одном из вариантов реализации терапевтические агенты находятся в одной композиции или единичной лекарственной форме. В других вариантах реализации терапевтические агенты находятся в отдельных композициях или единичных лекарственных формах. В некоторых вариантах реализации первый агент может быть введен до введения (например, за минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель до), одновременно с введением или после (например, через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель после) введения второго терапевтического агента.
[0030] В контексте настоящего описания термин «фармацевтическая композиция» предназначен для охвата композиции, подходящей для введения субъекту, такому как млекопитающее, в частности, человеку. Как правило, «фармацевтическая композиция» является стерильной и не содержит загрязняющих веществ, которые способны вызывать нежелательный ответ у субъекта (например, соединение (соединения) в фармацевтической композиции имеет фармацевтическую степень чистоты). Фармацевтические композиции могут быть созданы с возможностью введения нуждающимся в этом субъектам или пациентам посредством ряда различных путей введения, включая пероральный, буккальный, ректальный, парентеральный, внутрибрюшинный, внутрикожный, интратрахеальный и тому подобное. В некоторых вариантах реализации композиция является подходящей для введения чрескожным путем с применением усилителя проникновения, отличного от диметилсульфоксида (ДМСО). В других вариантах реализации фармацевтические композиции являются подходящими для введения путем, отличным от чрескожного пути введения. В некоторых вариантах реализации фармацевтическая композиция будет содержать соединение согласно настоящему описанию и фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах реализации фармацевтически приемлемое вспомогательное вещество является отличным от ДМСО.
[0031] В контексте настоящего описания «фармацевтически приемлемые производные» соединения согласно настоящему изобретению включают его соли, сложные эфиры, енольные простые эфиры, енольные сложные эфиры, ацетали, кетали, ортоэфиры, полуацетали, полукетали, кислоты, основания, сольваты, гидраты или пролекарства. Такие производные могут быть легко получены специалистами в данной области техники с применением известных способов получения таких производных. Полученные соединения могут быть введены животным или людям, не оказывая при этом существенного токсического действия, и либо являются фармацевтически активными, либо представляют собой пролекарства.
[0032] Термин «фармацевтически приемлемая соль» соединения означает соль, которая является фармацевтически приемлемой и обладает желаемой фармакологической активностью исходного соединения. Такие соли включают: (1) кислотно-аддитивные соли, образованные неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)-бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис-(3-гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и тому подобное; или (2) соли, образующиеся в случае, когда протон кислоты, присутствующий в исходном соединении, либо заменен на ион металла, например, ион щелочного металла, ион щелочноземельного металла или ион алюминия; или координирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и тому подобное.
[0033] Термин «активный агент» относится к химическому веществу или соединению, которое оказывает фармакологическое действие и способно обеспечивать лечение, предотвращение или улучшение течения одного или более состояний/заболеваний (например, болезни Альцгеймера), описанных в настоящем описании. Примеры представляющих интерес активных агентов включают β-гидроксиэфирные соединения жирных кислот (например, сложные эфиры жирных кислот и β-гидроксибутирата) и сложные эфиры жирных кислот и бутандиола.
[0034] Термин «пролекарство» относится к производному активного агента, для высвобождения активного агента из которого требуется превращение в организме. В некоторых вариантах реализации указанное превращение представляет собой ферментативное превращение. Пролекарства часто, хотя и не обязательно, являются фармакологически неактивными до превращения в активный агент.
Определения некоторых химических терминов
[0035] Названия некоторых соединений или заместителей используются в их общепринятом смысле, как описано в химической литературе, включая, но не ограничиваясь перечисленными, Lo Loudon, Organic Chemistry, Fourth Edition, New York: Oxford University Press, 2002, pp. 360-361, 1084-1085; Smith and March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, Fifth Edition, Wiley-Interscience, 2001.
[0036] В контексте настоящего описания термин «алкил» отдельно или в качестве части другого заместителя относится к насыщенному разветвленному или линейному одновалентному углеводородному радикалу, полученному путем удаления одного атома водорода от одного атома углерода исходного алкана. Типичные алкильные группы включают, но не ограничиваются перечисленными, метил; этил, пропилы, такие как пропан-1-ил или пропан-2-ил; и бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил или 2-метилпропан-2-ил. В некоторых вариантах реализации алкильная группа содержит от 1 до 20 атомов углерода. В других вариантах реализации алкильная группа содержит от 1 до 10 атомов углерода. В других вариантах реализации алкильная группа содержит от 1 до 6 атомов углерода, как то от 1 до 4 атомов углерода.
[0037] Термин «алканил» отдельно или в качестве части другого заместителя относится к насыщенному разветвленному, линейному или циклическому алкильному радикалу, полученному путем удаления одного атома водорода от одного атома углерода алкана. Типичные алканильные группы включают, но не ограничиваются перечисленными, метанил; этанил; пропанилы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил и т.д.; бутанилы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (т-бутил), циклобутан-1-ил и т.д.; и тому подобное.
[0038] Термин «алкилен» относится к разветвленной или неразветвленной насыщенной углеводородной цепи, обычно содержащей от 1 до 40 атомов углерода, более часто от 1 до 10 атомов углерода и еще более часто от 1 до 6 атомов углерода. Этот термин иллюстрируется такими группами, как метилен (-СН2-), этилен (-СН2СН2-), изомеры пропилена (например, -СН2СН2СН2- и -СН(СН3)СН2-) и тому подобное.
[0039] Термин «алкенил» отдельно или в качестве части другого заместителя относится к ненасыщенному разветвленному, линейному или циклическому алкильному радикалу, содержащему по меньшей мере одну двойную связь углерод-углерод, полученному путем удаления одного атома водорода от одного атома углерода алкена. Указанная группа может находиться либо в цис-, либо в транс-конформации относительно двойной связи (связей). Типичные алкенильные группы включают, но не ограничиваются перечисленными, этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д.; и тому подобное.
[0040] Термин «алкинил» отдельно или в качестве части другого заместителя относится к ненасыщенному разветвленному, линейному или циклическому алкильному радикалу, содержащему по меньшей мере одну тройную связь углерод-углерод, полученному путем удаления одного атома водорода от одного атома углерода алкина. Типичные алкинильные группы включают, но не ограничиваются перечисленными, этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и тому подобное.
[0041] Термин «ацил» отдельно или в качестве части другого заместителя относится к радикалу -C(O)R30, где R30 представляет собой водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, определенные в настоящем описании, и их замещенные варианты. Типичные примеры включают, но не ограничиваются перечисленными, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, бензилкарбонил, пиперонил, сукцинил и малонил и тому подобное.
[0042] Термин «аминоацил» относится к группе -C(O)NR21R22, где R21 и R22 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероарила, замещенного гетероарила, гетероциклила и замещенного гетероциклила, и где R21 и R22 необязательно объединены со связанным с ними атомом азота с образованием гетероциклической или замещенной гетероциклической группы, и где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклил и замещенный гетероциклил являются такими, как определено в настоящем описании.
[0043] Термин «алкокси» отдельно или в качестве части другого заместителя относится к радикалу -OR31, где R31 представляет собой алкильную или циклоалкильную группу, определенные в настоящем описании. Типичные примеры включают, но не ограничиваются перечисленными, метокси, этокси, пропокси, бутокси, циклогексилокси и тому подобное.
[0044] Термин «алкоксикарбонил» отдельно или в качестве части другого заместителя относится к радикалу -C(O)OR31, где R31 представляет собой алкильную или циклоалкильную группу, определенные в настоящем описании. Типичные примеры включают, но не ограничиваются перечисленными, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, циклогексилоксикарбонил и тому подобное.
[0045] Термин «арил» отдельно или в качестве части другого заместителя относится к одновалентному ароматическому углеводородному радикалу, полученному путем удаления одного атома водорода от одного атома углерода ароматической кольцевой системы. Типичные арильные группы включают, но не ограничиваются перечисленными, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, асимм-индацена, симм-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталина и тому подобного. В некоторых вариантах реализации арильная группа содержит от 6 до 20 атомов углерода. В некоторых вариантах реализации арильная группа содержит от 6 до 12 атомов углерода. Примерами арильных групп являются фенил и нафтил.
[0046] Термин «арилалкил» отдельно или в качестве части другого заместителя относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, как правило, концевым или sp3-атомом углерода, заменен на арильную группу. Типичные арилалкильные группы включают, но не ограничиваются перечисленными, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и тому подобное. В случае, когда предполагаются конкретные алкильные фрагменты, используется название арилалканил, арилалкенил и/или арилалкинил. В некоторых вариантах реализации арилалкильная группа представляет собой (С7-С30) арилалкил, например, алканильный, алкенильный или алкинильный фрагмент арилалкильной группы представляет собой (C1-С10), и арильный фрагмент представляет собой (С6-С20). В некоторых вариантах реализации арилалкильная группа представляет собой (С7-С20) арилалкил, например, алканильный, алкенильный или алкинильный фрагмент арилалкильной группы представляет собой (C1-C8), и арильный фрагмент представляет собой (С6-С12).
[0047] Термин «ариларил» отдельно или в качестве части другого заместителя относится к одновалентной углеводородной группе, полученной путем удаления одного атома водорода от одного атома углерода кольцевой системы, в которой две или более идентичных или неидентичных ароматических кольцевых системы непосредственно соединены одинарной связью, где число таких непосредственных связей между кольцами на единицу меньше, чем число содержащихся ароматических кольцевых систем. Типичные ариларильные группы включают, но не ограничиваются перечисленными, бифенил, трифенил, фенилнафтил, бинафтил, бифенилнафтил и тому подобное. В случае, если указано число атомов углерода в ариларильной группе, указанные числа относятся к атомам углерода, составляющим каждое ароматическое кольцо. Например, (С5-С14) ариларил представляет собой ариларильную группу, в которой каждое ароматическое кольцо содержит от 5 до 14 атомов углерода, например, бифенил, трифенил, бинафтил, фенилнафтил и т.д. В некоторых вариантах реализации каждая ароматическая кольцевая система ариларильной группы независимо представляет собой (С5-С14) ароматическое соединение. В некоторых вариантах реализации каждая ароматическая кольцевая система ариларильной группы независимо представляет собой (С5-С10) ароматическое соединение. В некоторых вариантах реализации все ароматические кольцевые системы идентичны, например, бифенил, трифенил, бинафтил, тринафтил и т.д.
[0048] Термин «циклоалкил» отдельно или в качестве части другого заместителя относится к насыщенному или ненасыщенному циклическому алкильному радикалу. В случае, если предполагается конкретная степень насыщения, используется название «циклоалканил» или «циклоалкенил». Типичные циклоалкильные группы включают, но не ограничиваются перечисленными, группы, полученные из циклопропана, циклобутана, циклопентана, циклогексана и тому подобного. В некоторых вариантах реализации цикл о алкильная группа представляет собой (С3-С10) циклоалкил. В некоторых вариантах реализации циклоалкильная группа представляет собой (С3-С7) циклоалкил.
[0049] Термин «циклогетероалкил» или «гетероциклил» отдельно или в качестве части другого заместителя относится к насыщенному или ненасыщенному циклическому алкильному радикалу, в котором один или более атомов углерода (и любых связанных атомов водорода) независимо заменены на одинаковые или различные гетероатомы. Типичные гетероатомы, заменяющие атом (атомы) углерода, включают, но не ограничиваются перечисленными, N, Р, О, S, Si и т.д. В случае, если предполагается конкретная степень насыщения, используется название «циклогетероалканил» или «циклогетероалкенил». Типичные циклогетероалкильные группы включают, но не ограничиваются перечисленными, группы, полученные из эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидина, хинуклидина и тому подобного.
[0050] Термин «гетероалкил, гетероалканил, гетероалкенил и гетероалкинил» отдельно или в качестве части другого заместителя относится к алкильным, алканильным, алкенильным и алкинильным группам, соответственно, в которых один или более атомов углерода (и любых связанных атомов водорода) независимо заменены на одинаковые или различные гетероатомные группы. Типичные гетероатомные группы, которые могут быть включены в эти группы, включают, но не ограничиваются перечисленными, -О-, -S-, -S-S-, -О-S-, -NR37R38-, =N-N=, -N=N-, -N=N-NR39R40, -PR41-, -P(O)2-, -POR42-, -O-P(O)2-, - S-O-, -S-(O)-, -SO2-, -SnR43R44- и тому подобное, где R37, R38, R39, R40, R41, R42, R43 и R44 независимо представляют собой водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил или замещенный гетероарилалкил.
[0051] Термин «гетероарил» отдельно или в качестве части другого заместителя относится к одновалентному гетероароматическому радикалу, полученному путем удаления одного атома водорода от одного атома гетероароматической кольцевой системы. Типичные гетероарильные группы включают, но не ограничиваются перечисленными, группы, полученные из акридина, арсиндола, карбазола, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена, бензодиоксола и тому подобного. В некоторых вариантах реализации гетероарильная группа получена из 5-20-членного гетероарила. В некоторых вариантах реализации гетероарильная группа получена из 5-10-членного гетероарила. В некоторых вариантах реализации гетероарильные группы представляют собой группы, полученные из тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина.
[0052] Термин «гетероарилалкил» отдельно или в качестве части другого заместителя относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, как правило, концевым или sp3-атомом углерода, заменен на гетероарильную группу. В случае, когда предполагаются конкретные алкильные фрагменты, используется название гетероарилалканил, гетероарилалкенил и/или гетероарилалкинил. В некоторых вариантах реализации гетероарилалкильная группа представляет собой 6-30-членный гетероарилалкил, например, алканильный, алкенильный или алкинильный фрагмент гетероарилалкила является 1-10-членным, и гетероарильный фрагмент представляет собой 5-20-членный гетероарил. В некоторых вариантах реализации гетероарилалкильная группа представляет собой 6-20-членный гетероарилалкил, например, алканильный, алкенильный или алкинильный фрагмент гетероарилалкила является 1-8-членным, и гетероарильный фрагмент представляет собой 5-12-членный гетероарил.
[0053] Термин «ароматическая кольцевая система» отдельно или в качестве части другого заместителя относится к ненасыщенной циклической или полициклической кольцевой системе, содержащей сопряженную π-электронную систему. В частности, в определение «ароматическая кольцевая система» включены конденсированные кольцевые системы, в которых одно или более колец являются ароматическими и одно или более колец являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален и т.д. Типичные ароматические кольцевые системы включают, но не ограничиваются перечисленными, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, асимм-индацен, симм-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плеяден, пирен, пирантрен, рубицен, трифенилен, тринафталин и тому подобное.
[0054] Термин «гетероароматическая кольцевая система» отдельно или в качестве части другого заместителя относится к ароматической кольцевой системе, в которой один или более атомов углерода (и любых связанных атомов водорода) независимо заменены на одинаковые или различные гетероатомы. Типичные гетероатомы, заменяющие атомы углерода, включают, но не ограничиваются перечисленными, N, Р, О, S, Si и т.д. В частности, в определение «гетероароматических кольцевых систем» включены конденсированные кольцевые системы, в которых одно или более колец являются ароматическими и одно или более колец являются насыщенными или ненасыщенными, такие как, например, арсиндол, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Типичные гетероароматические кольцевые системы включают, но не ограничиваются перечисленными, арсиндол, карбазол, β-карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и тому подобное.
[0055] Термин «замещенный» относится к группе, в которой один или более атомов водорода независимо заменены на одинаковые или различные заместители. Типичные заместители включают, но не ограничиваются перечисленными, алкилендиокси (такой как метилендиокси), -М, -R60, -О-, =O, -OR60, -SR60, -S-, =S, -NR60R61, =NR60, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2O-, -S(O)2OH, -S(O)2R60, -OS(O)2O-, -OS(O)2R60, -P(O)(O-)2, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(S)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-, -C(S)OR60, -NR62C(O)NR60R61, -NR62C(S)NR60R61, -NR62C(NR63)NR60R61 и -C(NR62)NR60R61, где M представляет собой атом галогена; R60, R61, R62 и R63 независимо представляют собой водород, алкил, замещенный алкил, алкокси, замещенный алкокси, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, арил, замещенный арил, гетероарил или замещенный гетероарил, или необязательно R60 и R61 совместно с атомом азота, к которому они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо; и R64 и R65 независимо представляют собой водород, алкил, замещенный алкил, арил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, арил, замещенный арил, гетероарил или замещенный гетероарил, или необязательно R64 и R65 совместно с атомом азота, к которому они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо. В некоторых вариантах реализации заместители включают -М, -R60, =O, -OR60, -SR60, -S-, =S, -NR60R61, =NR60, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2R60, -OS(O)2O-, -OS(O)2R60, -P(O)(O-)2, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(S)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-, -NR62C(O)NR60R61. В некоторых вариантах реализации заместители включают -М, -R60, =O, -OR60, -SR60, -NR60R61, -CF3, -CN, -NO2, -S(O)2R60, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-. В некоторых вариантах реализации заместители включают -М, -R60, =O, -OR60, -SR60, -NR60R61, -CF3, -CN, -NO2, -S(O)2R60, -OP(O)(OR60)(OR61), -C(O)R60, -C(O)OR60, -C(O)O-, где R60, R61 и R62 являются такими, как определено выше. Например, замещенная группа может содержать заместитель метилендиокси или один, два или три заместителя, выбранных из атома галогена, (1-4С)алкильной группы и (1-4С)алкоксигруппы.
[0056] Соединения, описанные в настоящем описании, могут содержать один или более хиральных центров и/или двойных связей, и, таким образом, могут существовать в виде стереоизомеров, таких как изомеры относительно двойной связи (то есть геометрические изомеры), энантиомеры или диастереомеры. Соответственно, все возможные энантиомеры и стереоизомеры указанных соединений, включая стереоизомерно чистую форму (например, геометрически-изомерно чистую, энантиомерно чистую или диастереомерно чистую) и энантиомерные и стереоизомерные смеси, включены в приведенное описание соединений. Энантиомерные и стереоизомерные смеси могут быть разделены на составляющие их энантиомеры или стереоизомеры с помощью методик разделения или методик хирального синтеза, хорошо известных специалисту в данной области техники. Соединения также могут существовать в нескольких таутомерных формах, включая енольную форму, кетоформу и их смеси. Соответственно, химические структуры, изображенные в настоящем описании, охватывают все возможные таутомерные формы приведенных соединений. Описанные соединения также включают изотопно-меченые соединения, где один или более атомов имеют атомную массу, отличную от атомной массы, обычно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения, раскрытые в настоящем описании, включают, но не ограничиваются перечисленными, 2Н, 3Н, 11С, 13С, 14С, 15N, 18O, 17O и т.д. Соединения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Как правило, соединения могут быть гидратированными или сольватированными. Некоторые соединения могут существовать в нескольких кристаллических или аморфных формах. В целом, все физические формы эквивалентны для применения, предложенного в настоящем описании, и предполагается, что они находятся в пределах объема настоящего описания.
[0057] Прежде чем настоящее изобретение будет дополнительно описано, следует понимать, что настоящее изобретение не ограничено конкретными описанными вариантами реализации, так как они, безусловно, могут меняться. Также следует понимать, что используемая в контексте настоящего описания терминология предназначена только для описания конкретных вариантов реализации и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
[0058] В случае, если представлен диапазон значений, подразумевается, что каждое промежуточное значение до десятой части единицы нижнего предела, если контекст явным образом не предписывает иное, находящееся между верхним и нижним пределом этого диапазона, и любое другое указанное или промежуточное значение в этом указанном диапазоне входит в объем настоящего изобретения. Верхний и нижний пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны и также входят в объем настоящего изобретения с учетом любого специально исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба из пределов, диапазоны, исключающие один или оба из этих включенных пределов, также включены в настоящее изобретение.
[0059] Если не указано иное, все технические и научные термины в контексте настоящего описания имеют то же значение, которое обычно понимается средним специалистом в области техники, к которой относится настоящее изобретение. Несмотря на то, что любые способы и материалы, подобные или эквивалентные описанным в настоящем описании, также могут быть применены при осуществлении или испытании настоящего изобретения, в настоящем описании описаны предпочтительные способы и материалы. Все публикации, упомянутые в настоящем описании, включены в настоящее описание посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми упоминаются указанные публикации.
[0060] Следует отметить, что в контексте настоящего описания и в прилагаемой формуле изобретения определенные и неопределенные формы единственного числа включают определяемые объекты во множественном числе, если контекст явным образом не предписывает иное. Как таковое, это утверждение предназначено для использования в качестве предшествующей основы для применения таких исключающих терминов, как «исключительно», «только» и тому подобное, в связи с перечислением элементов формулы изобретения или использования «отрицательного» ограничения.
[0061] Следует понимать, что некоторые признаки настоящего изобретения, которые для ясности описаны в контексте отдельных вариантов реализации, также могут быть представлены в комбинации в одном варианте реализации. И наоборот, различные признаки настоящего изобретения, которые для краткости описаны в контексте одного варианта реализации, также могут быть представлены отдельно или в любой подходящей субкомбинации. Все комбинации вариантов реализации, относящихся к настоящему изобретению, конкретно охватываются настоящим изобретением и раскрыты в настоящем описании в той же степени, как если бы каждая комбинация была отдельно и явным образом раскрыта. Помимо этого, все субкомбинации различных вариантов реализации и их элементов также конкретно охватываются настоящим изобретением и раскрыты в настоящем описании в той же степени, как если бы каждая такая субкомбинация была отдельно и явным образом раскрыта в настоящем описании.
[0062] Публикации, упомянутые в настоящем описании, представлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в настоящем описании не должно быть истолковано как признание того, что настоящее изобретение не является предшествующим по отношению к такой публикации. Кроме того, представленные даты публикации могут отличаться от фактических дат публикации, которые, возможно, потребуют независимого подтверждения.
Подробное описание
[0063] В настоящем описании предложены β-гидроксиэфирные соединения жирных кислот (например, сложные эфиры жирных кислот и β-гидроксибутирата), сложные эфиры жирных кислот и бутандиола и их фармацевтически приемлемые соли. Также предложены фармацевтические композиции, содержащие одно или более β-гидроксиэфирных соединений жирных кислот и/или один или более сложных эфиров жирных кислот и бутандиола.
[0064] Дополнительно в настоящем описании предложены способы лечения субъекта путем введения одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола субъекту. В некоторых вариантах реализации способы включают лечение болезни Альцгеймера у субъекта, у которого диагностировано наличие болезни Альцгеймера, путем введения указанному субъекту одного или более β-гидроксиэфирных соединений жирных кислот, описанных в настоящем описании, и/или одного или более сложных эфиров бутандиола, описанных в настоящем описании. В некоторых случаях количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для уменьшения эпилептиформной активности у субъекта. В некоторых случаях количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для повышения когнитивных функций у субъекта.
[0065] В настоящем описании также предложены способы лечения одного или более из эпилепсии, болезни Паркинсона, сердечной недостаточности, травматического повреждения головного мозга, инсульта, геморрагического шока, острого повреждения легкого после жидкостной реанимации, острого повреждения почек, инфаркта миокарда, ишемии миокарда, диабета, мультиформной глиобластомы, диабетической нейропатии, рака предстательной железы, бокового амиотрофического склероза, болезни Хантингтона, кожной Т-клеточной лимфомы, множественной миеломы, периферической Т-клеточной лимфомы, ВИЧ, болезни Ниманна-Пика типа С, возрастной макулярной дегенерации, подагры, атеросклероза, ревматоидного артрита и рассеянного склероза путем введения субъекту одного или более β-гидроксиэфирных соединений жирных кислот, описанных в настоящем описании, и/или одного или более из сложных эфиров бутандиола, описанных в настоящем описании.
[0066] Также в настоящем описании предложены соединения, введение которых обеспечивает повышенную концентрацию кетоновых тел у субъекта. β-Гидроксиэфирные соединения жирных кислот (например, сложные эфиры жирных кислот и β-гидроксибутирата) и сложные эфиры жирных кислот и бутандиола, описанные в настоящем описании, высвобождают посредством гидролиза сложного эфира β-гидроксибутират или бутандиол, которые увеличивают концентрацию кетоновых тел у субъекта, а также являются дополнительным источником среднецепочечных жирных кислот, которые обеспечивают устойчивую выработку кетоновых тел у субъекта. В некоторых вариантах реализации в настоящем описании предложены сложные эфиры жирных кислот и β-гидроксибутирата, которые после введения подвергаются гидролизу с образованием β-гидроксибутирата и среднецепочечных жирных кислот. В этих вариантах реализации высвобождение β-гидроксибутирата обеспечивает повышение концентрации кетоновых тел у субъекта, а полученные при гидролизе среднецепочечные жирные кислоты обеспечивают субстрат для устойчивой физиологической выработки кетоновых тел. В других вариантах реализации в настоящем описании предложены сложные эфиры жирных кислот и бутандиола, которые после введения подвергаются гидролизу с образованием бутандиола и среднецепочечных жирных кислот. В этих вариантах реализации высвобождение бутандиола обеспечивает повышение выработки кетоновых тел у субъекта, а полученные при гидролизе среднецепочечные жирные кислоты обеспечивают дополнительный субстрат для устойчивой физиологической выработки кетоновых тел.
β-Гидроксиэфирные соединения жирных кислот и сложные эфиры жирных кислот и бутандиола
[0067] β-Гидроксиэфирные соединения жирных кислот и сложные эфиры жирных кислот и бутандиола, подходящие для практического осуществления предложенных способов (более подробно описанных ниже), включают соединения формул I и II, описанные ниже.
Соединения формул I и II
[0068] Композиции согласно настоящему описанию включают соединения формул I и II, представленные ниже. Фармацевтические композиции и способы согласно настоящему описанию также предусматривают соединения формул I и II.
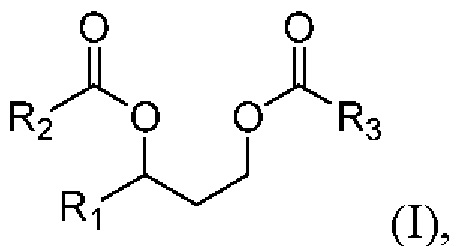
[0069] В одном из аспектов, относящихся к композиции, в вариантах реализации настоящего изобретения предложено соединение формулы I:
 где
где
R1 выбран из водорода, алкила и замещенного алкила; и
R2 и R3 независимо представляют собой незамещенный или замещенный алкил; и его соли, сольваты или гидраты.
[0070] В формуле I R1 выбран из водорода, алкила и замещенного алкила. В некоторых случаях R1 представляет собой водород. В других случаях R1 представляет собой алкил. В других случаях R1 представляет собой замещенный алкил. В некоторых случаях R1 представляет собой алкил, такой как C1-С6 алкил, включая C1-С3 алкил. В некоторых случаях R1 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил или т-бутил. В некоторых случаях R1 представляет собой метил.
[0071] В формуле I R2 выбран из алкила и замещенного алкила. В некоторых случаях R2 представляет собой алкил. В других случаях R2 представляет собой замещенный алкил. В некоторых случаях R2 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R2 представляет собой гексил или октил (С6 или С8). В некоторых случаях R2 представляет собой гексил (С6). В некоторых случаях R2 представляет собой октил (C8).
[0072] В формуле I R3 выбран из алкила и замещенного алкила. В некоторых случаях R3 представляет собой алкил. В других случаях R3 представляет собой замещенный алкил. В некоторых случаях R3 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R3 представляет собой гексил или октил (С6 или C8). В некоторых случаях R3 представляет собой гексил (С6). В некоторых случаях R3 представляет собой октил (C8).
[0073] В формуле I, в соответствии с некоторыми вариантами реализации, R1 представляет собой метил, и R2 и R3 независимо представляют собой гексил. В некоторых случаях R1 представляет собой метил, и R2 и R3 независимо представляют собой октил. В других случаях R1 представляет собой метил, и R2 представляет собой гексил, и R3 представляет собой октил. В других случаях R1 представляет собой метил, и R2 представляет собой октил, и R3 представляет собой гексил.
[0074] В некоторых вариантах реализации представляющие интерес сложные эфиры жирных кислот и 1,3-бутандиола являются энантиомерно чистыми (<95% э.и.). 1,3-бутандиол подвергается метаболизму с образованием ВНВ под действием алкогольдегидрогеназы и альдегиддегидрогеназы, обе из которых действуют на 1'-гидроксильную группу и не являются специфичными в отношении хиральности 3'-группы. Таким образом, под действием этих ферментов R-1,3-бутандиол подвергается метаболизму с образованием R-BHB, а S-1,3-бутандиол подвергается метаболизму с образованием S-BHB.
[0075] Соединения, описанные в настоящей заявке, включают сложный эфир 1,3-бутандиола, связанный с одной или более жирными кислотами, или сложный эфир ВНВ, связанный с одной или более жирными кислотами. Указанные соединения являются хиральными, поскольку фрагменты 1,3-бутандиола и ВНВ хиральны. Однако важно отметить, что фрагмент жирной кислоты может быть метаболизирован в организме только до R-BHB вследствие стереоспецифичности бета-гидроксибутиратдегидрогеназы, описанной выше. Таким образом, соединение, которое содержит S-BHB, связанный с жирной кислотой, в итоге будет служить источником одной единицы S-BHB, а также нескольких единиц R-BHB. В некоторых вариантах реализации ни одно из соединений, описанных в настоящем описании, не будет служить источником исключительно S-BHB, будучи полностью метаболизированным в организме.
[0076] В некоторых вариантах реализации различия в метаболизме между R-ВНВ и S-BHB важны с точки зрения их относительной эффективности при лечении заболеваний человека. Как описано выше, только R-BHB может быть легко метаболизирован с образованием ацетил-КоА и АТФ, выполняя функцию ВНВ в качестве «энергетического посредника». Если эффективность лечения заболевания основана на этой энергетической функции ВНВ, то R-BHB будет значительно более эффективным, чем S-BHB. Однако в некоторых случаях эффективность ВНВ при некоторых заболеваниях человека может зависеть от сигнальных функций ВНВ, а не от энергетической функции. Некоторые из представляющих интерес сигнальных функций могут включать, но не ограничиваются перечисленными, ингибирование HCAR2, ингибирование инфламмасомы и ингибирование ферментов деацетилаз. В этих вариантах реализации, где S-BHB обладает таким же молекулярным эффектом, что и R-ВНВ, более медленный метаболизм S-BHB может обеспечить большую продолжительность действия в организме.
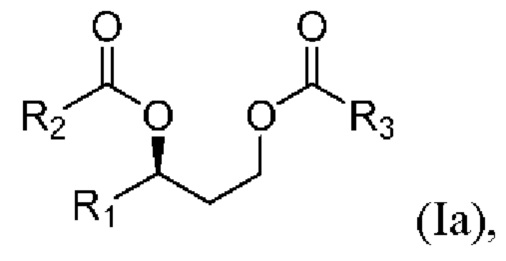
[0077] В другом аспекте, относящемся к композиции, в вариантах реализации настоящего изобретения предложено соединение формулы Ia:
 где
где
R1 выбран из водорода, алкила и замещенного алкила; и
R2 и R3 независимо представляют собой незамещенный или замещенный алкил; и его соли, сольваты или гидраты.
[0078] В формуле Ia R1 выбран из водорода, алкила и замещенного алкила. В некоторых случаях R1 представляет собой водород. В других случаях R1 представляет собой алкил. В других случаях R1 представляет собой замещенный алкил. В некоторых случаях R1 представляет собой алкил, такой как C1-С6 алкил, включая С1-С3 алкил. В некоторых случаях R1 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил или т-бутил. В некоторых случаях R1 представляет собой метил.
[0079] В формуле Ia R2 выбран из алкила и замещенного алкила. В некоторых случаях R2 представляет собой алкил. В других случаях R2 представляет собой замещенный алкил. В некоторых случаях R2 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R2 представляет собой гексил или октил (С6 или C8). В некоторых случаях R2 представляет собой гексил (С6). В некоторых случаях R2 представляет собой октил (C8).
[0080] В формуле Ia R3 выбран из алкила и замещенного алкила. В некоторых случаях R3 представляет собой алкил. В других случаях R3 представляет собой замещенный алкил. В некоторых случаях R3 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R3 представляет собой гексил или октил (С6 или C8). В некоторых случаях R3 представляет собой гексил (С6). В некоторых случаях R3 представляет собой октил (C8).
[0081] В соответствии с некоторыми вариантами реализации в формуле Ia R1 представляет собой метил, и R2 и R3 независимо представляют собой гексил. В некоторых случаях R1 представляет собой метил, и R2 и R3 независимо представляют собой октил. В других случаях R1 представляет собой метил, и R2 представляет собой гексил, и R3 представляет собой октил. В других случаях R1 представляет собой метил, и R2 представляет собой октил, и R3 представляет собой гексил.
[0082] В некоторых вариантах реализации представляющие интерес сложные эфиры жирных кислот и бутандиола включают соединение формулы BDE-1a - BDE-1b:
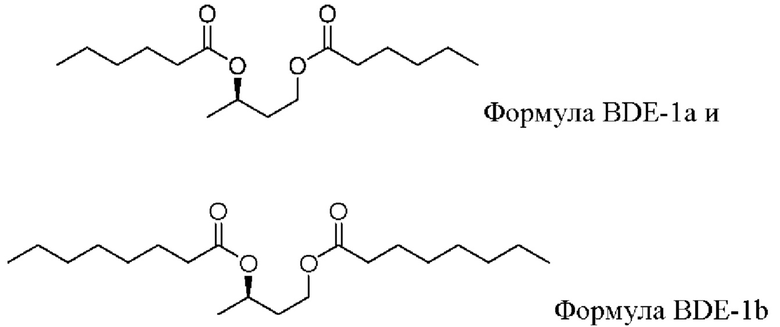
и его соли, сольваты или гидраты.
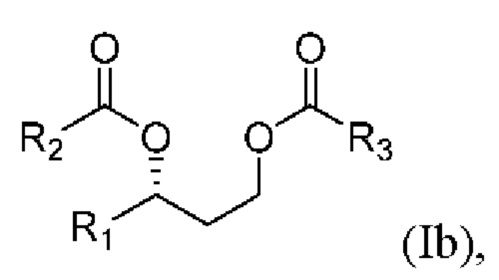
[0083] В другом аспекте, относящемся к композиции, в вариантах реализации настоящего изобретения предложено соединение формулы Ib:
 где
где
R1 выбран из водорода, алкила и замещенного алкила; и
R2 и R3 независимо представляют собой незамещенный или замещенный алкил; и его соли, сольваты или гидраты.
[0084] В формуле Ib R1 выбран из водорода, алкила и замещенного алкила. В некоторых случаях R1 представляет собой водород. В других случаях R1 представляет собой алкил. В других случаях R1 представляет собой замещенный алкил. В некоторых случаях R1 представляет собой алкил, такой как C1-С6 алкил, включая С1-С3 алкил. В некоторых случаях R1 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил или т-бутил. В некоторых случаях R1 представляет собой метил.
[0085] В формуле Ib R2 выбран из алкила и замещенного алкила. В некоторых случаях R2 представляет собой алкил. В других случаях R2 представляет собой замещенный алкил. В некоторых случаях R2 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R2 представляет собой гексил или октил (С6 или С8). В некоторых случаях R2 представляет собой гексил (С6). В некоторых случаях R2 представляет собой октил (C8).
[0086] В формуле Ib R3 выбран из алкила и замещенного алкила. В некоторых случаях R3 представляет собой алкил. В других случаях R3 представляет собой замещенный алкил. В некоторых случаях R3 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R3 представляет собой гексил или октил (С6 или C8). В некоторых случаях R3 представляет собой гексил (С6). В некоторых случаях R3 представляет собой октил (C8).
[0087] В соответствии с некоторыми вариантами реализации в формуле Ib R1 представляет собой метил, и R2 и R3 независимо представляют собой гексил. В некоторых случаях R1 представляет собой метил, и R2 и R3 независимо представляют собой октил. В других случаях R1 представляет собой метил, и R2 представляет собой гексил, и R3 представляет собой октил. В других случаях R1 представляет собой метил, и R2 представляет собой октил, и R3 представляет собой гексил.
[0088] В другом аспекте, относящемся к композиции, в вариантах реализации настоящего изобретения предложено соединение формулы II:
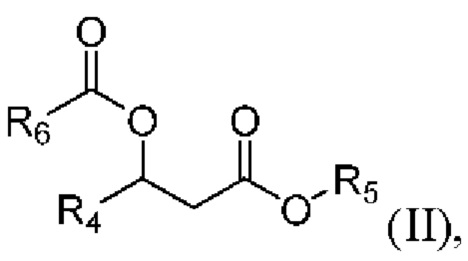 где
где
R4 выбран из водорода, алкила и замещенного алкила; и
R5 и R6 независимо представляют собой незамещенный или замещенный алкил; и его соли, сольваты или гидраты.
[0089] В формуле II R4 выбран из водорода, алкила и замещенного алкила. В некоторых случаях R4 представляет собой водород. В других случаях R4 представляет собой алкил. В других случаях R4 представляет собой замещенный алкил. В некоторых случаях R4 представляет собой алкил, такой как C1-С6 алкил, включая C1-С3 алкил. В некоторых случаях R4 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил или т-бутил. В некоторых случаях R4 представляет собой метил.
[0090] В формуле II R5 выбран из алкила и замещенного алкила. В некоторых случаях R5 представляет собой алкил. В других случаях R5 представляет собой замещенный алкил. В некоторых случаях R5 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R5 представляет собой гексил или октил (С6 или С8). В некоторых случаях R5 представляет собой гексил (С6). В некоторых случаях R5 представляет собой октил (С8).
[0091] В формуле II R6 выбран из алкила и замещенного алкила. В некоторых случаях R6 представляет собой алкил. В других случаях R6 представляет собой замещенный алкил. В некоторых случаях R6 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R3 представляет собой гексил или октил (С6 или C8). В некоторых случаях R6 представляет собой гексил (С6). В некоторых случаях R3 представляет собой октил (C8).
[0092] В соответствии с некоторыми вариантами реализации в формуле II R4 представляет собой метил, и R5 и R6 независимо представляют собой гексил. В некоторых случаях R4 представляет собой метил, и R5 и R6 независимо представляют собой октил. В других случаях R4 представляет собой метил, и R5 представляет собой гексил, и R6 представляет собой октил. В других случаях R4 представляет собой метил, и R5 представляет собой октил, и R6 представляет собой гексил.
[0093] В некоторых вариантах реализации представляющие интерес β-гидроксиэфирные соединения жирных кислот являются энантиомерно чистыми (<95% э.и.). R-BHB является нормальным продуктом метаболизма человека. Эта хиральная специфичность вводится ферментом, который катализирует конечную стадию синтеза ВНВ, бета-гидроксибутиратдегидрогеназой. Этот фермент восстанавливает 3'-карбонильную группу ацетоацетата до 3'-гидроксильной группы ВНВ. Тот же фермент является необходимым для утилизации ВНВ, при которой он катализирует ту же реакцию в обратном направлении. Вследствие хиральной специфичности β-гидроксибутиратдегидрогеназы при нормальном метаболизме вырабатывается только R-BHB, и только R-BHB может быть легко расщеплен с образованием ацетил-КоА и АТФ. Голодание, физические нагрузки, ограничение потребления калорий, кетогенная диета и любые другие состояния, которые приводят к эндогенной выработке ВНВ, приводят к образованию только R-ВНВ.
[0094] Сам S-BHB не является нормальным продуктом метаболизма человека. Однако S-BHB-КоА представляет собой нестабильное промежуточное соединение последней стадии бета-окисления жирных кислот. При нормальных условиях он не должен сохраняться достаточно долго, чтобы покинуть митохондрию или находиться в кровотоке. Эксперименты, включающие инфузионное введение меченых R-BHB, S-BHB или их смесей крысам или свиньям, показали, что S-BHB в основном превращается в R-BHB; молекулярный механизм этого процесса неизвестен, но может осуществляться посредством превращения S-BHB в ацетил-КоА, а затем образования R-BHB из этого ацетил-КоА. По меньшей мере некоторая часть S-BHB в итоге превращается в СО2, по-видимому, будучи метаболизированным до ацетил-КоА, который затем метаболизируется в цикле трикарбоновых кислот (ЦТК). S-BHB может метаболизироваться намного медленнее, чем R-BHB, следовательно, инфузия того же количества S-BHB может приводить к более высоким концентрациям S-BHB в крови в течение более длительного времени, чем концентрации R-BHB в крови при аналогичной инфузии R-BHB.
[0095] В другом аспекте, относящемся к композиции, в вариантах реализации настоящего изобретения предложено соединение формулы IIa:
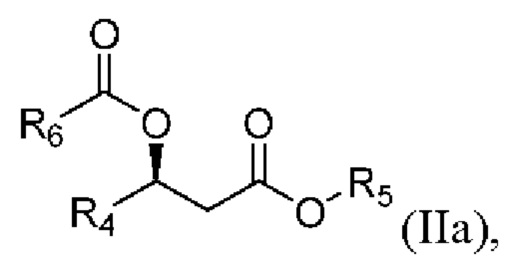 где
где
R4 выбран из водорода, алкила и замещенного алкила; и
R5 и R6 независимо представляют собой незамещенный или замещенный алкил; и его соли, сольваты или гидраты.
[0096] В формуле IIa R4 выбран из водорода, алкила и замещенного алкила. В некоторых случаях R4 представляет собой водород. В других случаях R4 представляет собой алкил. В других случаях R4 представляет собой замещенный алкил. В некоторых случаях R4 представляет собой алкил, такой как C1-С6 алкил, включая C1-С3 алкил. В некоторых случаях R4 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил или т-бутил. В некоторых случаях R4 представляет собой метил.
[0097] В формуле IIa R5 выбран из алкила и замещенного алкила. В некоторых случаях R5 представляет собой алкил. В других случаях R5 представляет собой замещенный алкил. В некоторых случаях R5 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R5 представляет собой гексил или октил (С6 или C8). В некоторых случаях R5 представляет собой гексил (С6). В некоторых случаях R5 представляет собой октил (C8).
[0098] В формуле IIa R6 выбран из алкила и замещенного алкила. В некоторых случаях R6 представляет собой алкил. В других случаях R6 представляет собой замещенный алкил. В некоторых случаях R6 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R3 представляет собой гексил или октил (С6 или С8). В некоторых случаях R6 представляет собой гексил (С6). В некоторых случаях R3 представляет собой октил (С8).
[0099] В соответствии с некоторыми вариантами реализации в формуле IIa R4 представляет собой метил, и R5 и R6 независимо представляют собой гексил. В некоторых случаях R4 представляет собой метил, и R5 и R6 независимо представляют собой октил. В других случаях R4 представляет собой метил, и R5 представляет собой гексил, и R6 представляет собой октил. В других случаях R4 представляет собой метил, и R5 представляет собой октил, и R6 представляет собой гексил.
[00100] В некоторых вариантах реализации представляющие интерес β-гидроксиэфирные соединения жирных кислот включают соединение β-гидроксибутирата формулы ВНЕ-2а - BHE-2d:
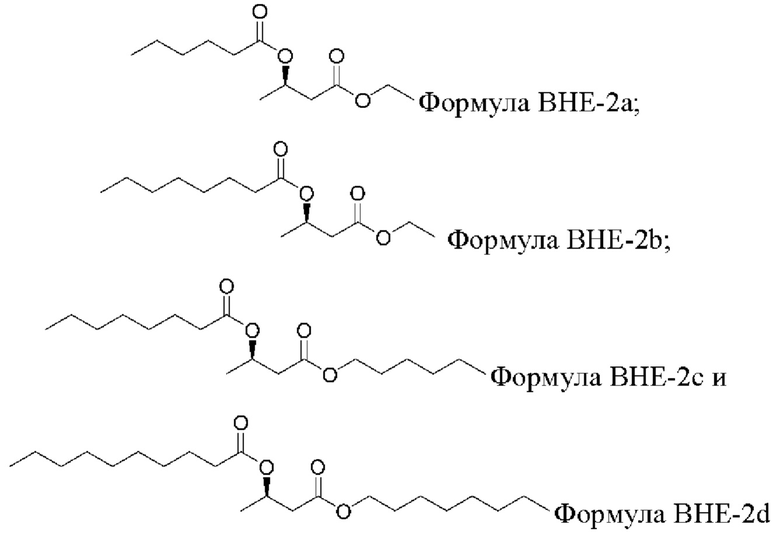
и его соли, сольваты или гидраты.
[00101] В другом аспекте, относящемся к композиции, в вариантах реализации настоящего изобретения предложено соединение формулы IIa:
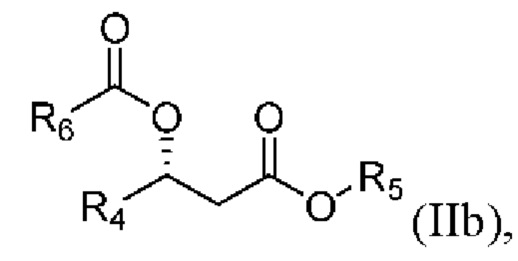 где
где
R4 выбран из водорода, алкила и замещенного алкила; и
R5 и R6 независимо представляют собой незамещенный или замещенный алкил; и его соли, сольваты или гидраты.
[00102] В формуле IIb R4 выбран из водорода, алкила и замещенного алкила. В некоторых случаях R4 представляет собой водород. В других случаях R4 представляет собой алкил. В других случаях R4 представляет собой замещенный алкил. В некоторых случаях R4 представляет собой алкил, такой как C1-С6 алкил, включая С1-С3 алкил. В некоторых случаях R4 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил или т-бутил. В некоторых случаях R4 представляет собой метил.
[00103] В формуле IIb R5 выбран из алкила и замещенного алкила. В некоторых случаях R5 представляет собой алкил. В других случаях R5 представляет собой замещенный алкил. В некоторых случаях R5 представляет собой алкил, такой как С4-С30 алкил, включая C6-C8 алкил. В некоторых случаях R5 представляет собой гексил или октил (С6 или С8). В некоторых случаях R5 представляет собой гексил (С6). В некоторых случаях R5 представляет собой октил (C8).
[00104] В формуле IIb R6 выбран из алкила и замещенного алкила. В некоторых случаях R6 представляет собой алкил. В других случаях R6 представляет собой замещенный алкил. В некоторых случаях R6 представляет собой алкил, такой как С4-С30 алкил, включая С6-С8 алкил. В некоторых случаях R3 представляет собой гексил или октил (С6 или C8). В некоторых случаях R6 представляет собой гексил (С6). В некоторых случаях R3 представляет собой октил (C8).
[00105] В соответствии с некоторыми вариантами реализации в формуле IIb R4 представляет собой метил, и R5 и R6 независимо представляют собой гексил. В некоторых случаях R4 представляет собой метил, и R5 и R6 независимо представляют собой октил. В других случаях R4 представляет собой метил, и R5 представляет собой гексил, и R6 представляет собой октил. В других случаях R4 представляет собой метил, и R5 представляет собой октил, и R6 представляет собой гексил.
Составы, дозы и пути введения
[00106] Фармацевтически приемлемые носители, предпочтительные для применения с активными агентами (и необязательно одним или более дополнительными терапевтическими агентами), могут включать стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и подходящие для инъекционного введения органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии и микрочастицы, включая физиологический раствор и буферные среды. Переносящие среды для парентерального введения включают раствор хлорида натрия, раствор Рингера с декстрозой, декстрозу и хлорид натрия, раствор Рингера с лактатом или нелетучие масла. Переносящие среды для внутривенного введения включают средства для восполнения жидкостей и питательных веществ, средства для восполнения электролитов (такие как средства на основе раствора Рингера с декстрозой) и тому подобное. Композиция, содержащая активный агент (и необязательно один или более дополнительных терапевтических агентов), также может быть подвергнута лиофилизации с применением способов, хорошо известных в данной области техники, для последующего растворения и применения в соответствии с настоящим изобретением.
Составы
[00107] Предложенные β-гидроксиэфирные соединения жирных кислот и/или предложенные сложные эфиры жирных кислот и бутандиола могут быть введены нуждающемуся в этом индивидууму в виде состава совместно с фармацевтически приемлемым вспомогательным веществом (веществами). В данной области техники известен широкий спектр фармацевтически приемлемых вспомогательных веществ, и не имеется необходимости в подробном их рассмотрении в настоящем описании. Фармацевтически приемлемые вспомогательные вещества подробно описаны в различных источниках, включая, например, A. Gennaro (2000) «Remington: The Science and Practice of Pharmacy», 20th edition, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Ansel et al., eds 7th ed., Lippincott, Williams, & Wilkins; и Handbook of Pharmaceutical Excipients (2000) A.H. Kibbe et al., eds., 3rd ed. Amer. Pharmaceutical Assoc. В контексте приведенного ниже описания составов термин «активный агент» включает активный агент, описанный выше, например, β-гидроксиэфирное соединение жирной кислоты или сложный эфир жирной кислоты и бутандиола, описанные в настоящем описании, и необязательно один или более дополнительных терапевтических агентов.
[00108] В предложенном способе активный агент может быть введен хозяину с применением любого подходящего протокола. Так, активный агент может быть введен в различные составы для терапевтического введения. Например, активный агент может быть введен в состав фармацевтических композиций путем объединения с подходящими фармацевтически приемлемыми носителями или разбавителями и может быть приготовлен в виде препаратов в твердой, полутвердой, жидкой или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, лекарственные формы для инъекций, ингалянты и аэрозоли. В иллюстративном варианте реализации активный агент готовят в виде геля, в виде раствора или в какой-либо другой форме, подходящей для интравагинального введения. В другом иллюстративном варианте реализации активный агент готовят в виде геля, в виде раствора или в какой-либо другой форме, подходящей для ректального (например, интраректального) введения.
[00109] В составе фармацевтических лекарственных форм активный агент может быть введен в форме его фармацевтически приемлемых солей, также он может применяться отдельно или в подходящем сочетании, а также в комбинации с другими фармацевтически активными соединениями. Следующие способы и вспомогательные вещества представлены исключительно в качестве примера и никоим образом не являются ограничивающими.
[00110] В некоторых вариантах реализации активное вещество готовят в водном буфере. Подходящие водные буферы включают, но не ограничиваются перечисленными, ацетатный, сукцинатный, цитратный и фосфатный буферы, различающиеся по ионной силе от примерно 5 мМ до примерно 100 мМ. В некоторых вариантах реализации водный буфер содержит реагенты, которые обеспечивают изотоничность раствора. Такие реагенты включают, но не ограничиваются перечисленными, хлорид натрия и сахара, например, маннитол, декстрозу, сахарозу и тому подобное. В некоторых вариантах реализации водный буфер дополнительно содержит неионное поверхностно-активное вещество, такое как полисорбат 20 или 80. Кроме того, составы могут необязательно содержать консервант. Подходящие консерванты включают, но не ограничиваются перечисленными, бензиловый спирт, фенол, хлорбутанол, бензалкония хлорид и тому подобное. Во многих случаях состав хранится при примерно 4°С. Составы также могут быть подвергнуты лиофилизации, и в этом случае они обычно содержат криопротекторные агенты, такие как сахароза, трегалоза, лактоза, мальтоза, маннитол и тому подобное. Лиофилизированные составы могут храниться в течение длительных периодов времени даже при температуре окружающей среды.
[00111] В случае препаратов для перорального введения активный агент может быть применен отдельно или в комбинации с подходящими добавками для получения таблеток, порошков, гранул или капсул, например, с обычными добавками, такими как лактоза, маннитол, кукурузный крахмал или картофельный крахмал; со связующими веществами, такими как кристаллическая целлюлоза, производные целлюлозы, камедь, кукурузный крахмал или желатины; с разрыхлителями, такими как кукурузный крахмал, картофельный крахмал или натрий карбоксиметилцеллюлоза; со смазывающими веществами, такими как тальк или стеарат магния; и, если желательно, с разбавителями, буферными агентами, увлажняющими агентами, консервантами и ароматизирующими агентами.
[00112] Активный агент, описанный в настоящем описании, может быть обеспечен и/или введен в виде пищевой добавки, например, совместно с одним или более компонентами кетогенной диеты. Иллюстративные кетогенные диеты и их компоненты описаны, например, в патенте США №6207856, содержание которого включено в настоящее описание посредством ссылки.
[00113] Активный агент может быть приготовлен в виде препаратов для инъекций путем растворения, суспендирования или эмульгирования его в водном или неводном растворителе, таком как растительные или другие подобные масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль; и, если желательно, с обычными добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгирующие агенты, стабилизаторы и консерванты.
[00114] Активный агент может быть применен в составе аэрозоля, подлежащем введению путем ингаляции. Активный агент может быть приготовлен в среде находящихся под давлением приемлемых пропеллентов, таких как дихлордифторметан, пропан, азот и тому подобное.
[00115] Кроме того, активный агент может быть приготовлен в виде суппозиториев путем смешивания с различными основами, такими как эмульгирующие основы или водорастворимые основы. Активный агент может быть введен ректально с применением суппозитория. Суппозиторий может содержать переносящие среды, такие как масло какао, карбоваксы и полиэтиленгликоли, которые плавятся при температуре тела, но затвердевают при комнатной температуре.
[00116] Могут быть предложены единичные лекарственные формы для перорального или ректального введения, такие как сиропы, эликсиры и суспензии, где каждая единичная доза, например, чайная ложка, столовая ложка, таблетка или суппозиторий, содержит предварительно определенное количество композиции, содержащей один или более активных агентов. Схожим образом единичные лекарственные формы для инъекций или внутривенного введения могут содержать в композиции активный агент (агенты) в виде раствора в стерильной воде, физиологическом растворе или другом фармацевтически приемлемом носителе.
[00117] Могут быть предложены единичные лекарственные формы для интравагинального или интраректального введения, такие как сиропы, эликсиры, гели и суспензии, где каждая единичная доза, например, чайная ложка, столовая ложка, таблетка, единичный объем геля или суппозиторий содержит предварительно определенное количество композиции, содержащей один или более активных агентов.
[00118] В контексте настоящего описания термин «единичная лекарственная форма» относится к физически отдельным единицам, подходящим для применения в качестве единичных доз у субъектов, являющихся людьми или животными, причем каждая единица содержит предварительно определенное количество активного агента, рассчитанное в количестве, достаточном для получения желаемого эффекта, совместно с фармацевтически приемлемым разбавителем, носителем или переносящей средой. Конкретные значения для данного активного агента будут частично зависеть от конкретного применяемого соединения и эффекта, который должен быть достигнут, а также от фармакодинамики каждого соединения в организме хозяина.
[00119] Другие способы введения также найдут применение для предложенного изобретения. Например, активный агент может быть приготовлен в виде суппозиториев, и, в некоторых случаях, аэрозолей и композиций для интраназального введения. В случае суппозиториев состав переносящей среды будет содержать обычные связующие вещества и носители, такие как полиалкиленгликоли или триглицериды. Такие суппозитории могут быть приготовлены из смесей, содержащих активный ингредиент в диапазоне от примерно 0,5% до примерно 25% (масс./масс.), например, от примерно 5% до примерно 20%, в том числе от 5% до 15%.
[00120] Активный агент может быть введен в виде лекарственной формы для инъекционного введения. Как правило, композиции для инъекционного введения получают в виде жидких растворов или суспензий; также могут быть получены твердые формы, подходящие для приготовления раствора или суспензии в жидких переносящих средах, после чего осуществляют инъекционное введение. Препарат также может быть эмульгирован или активный ингредиент может быть инкапсулирован в липосомальные переносящие среды.
[00121] В некоторых вариантах реализации активный агент будет приготовлен для вагинальной доставки. Предложенный состав для интравагинального введения содержит активный агент, приготовленный в виде интравагинальной биоадгезивной таблетки, интравагинальной биоадгезивной микрочастицы, интравагинального крема, интравагинального лосьона, интравагинальной пены, интравагинальной мази, интравагинальной пасты, интравагинального раствора или интравагинального геля.
[00122] В некоторых вариантах реализации активный агент будет приготовлен для ректальной доставки. Предложенный состав для интраректального введения содержит активный агент, приготовленный в виде интраректальной биоадгезивной таблетки, интраректальной биоадгезивной микрочастицы, интраректального крема, интраректального лосьона, интраректальной пены, интраректальной мази, интраректальной пасты, интраректального раствора или интраректального геля.
[00123] Предложенный состав, содержащий активный агент, содержит одно или более вспомогательных веществ (например, сахарозу, крахмал, маннитол, сорбитол, лактозу, глюкозу, целлюлозу, тальк, фосфат кальция или карбонат кальция), связующее вещество (например, целлюлозу, метилцеллюлозу, гидроксиметилцеллюлозу, полипропилпирролидон, поливинилпирролидон, желатин, аравийскую камедь, поли(этиленгликоль), сахарозу или крахмал), разрыхлитель (например, крахмал, карбоксиметилцеллюлозу, гидроксипропил крахмал, низкозамещенную гидроксипропилцеллюлозу, бикарбонат натрия, фосфат кальция или цитрат кальция), смазывающее вещество (например, стеарат магния, легкую безводную кремниевую кислоту, тальк или лаурилсульфат натрия), ароматизирующий агент (например, лимонную кислоту, ментол, глицин или порошок апельсиновой цедры), консервант (например, бензоат натрия, бисульфит натрия, метилпарабен или пропилпарабен), стабилизатор (например, лимонную кислоту, цитрат натрия или уксусную кислоту), суспендирующий агент (например, метилцеллюлозу, поливинилпирролидон или стеарат алюминия), диспергирующий агент (например, гидроксипропилметилцеллюлозу), разбавитель (например, воду) и восковую основу (например, масло какао, белый вазелин или полиэтиле нгликоль).
[00124] Таблетки, содержащие активный агент, могут быть покрыты подходящим пленкообразующим агентом, например, гидроксипропилметилцеллюлозой, гидроксипропилцеллюлозой или этилцеллюлозой, к которому необязательно может быть добавлено подходящее вспомогательное вещество, например, смягчающий агент, такой как глицерин, пропиленгликоль, диэтилфталат или триацетат глицерина; наполнитель, такой как сахароза, сорбитол, ксилитол, глюкоза или лактоза; окрашивающий агент, такой как гидроксид титана; и тому подобное.
[00125] Подходящими вспомогательными переносящими средами являются, например, вода, физиологический раствор, декстроза, глицерин, этанол или тому подобное и их комбинации. Помимо этого, если желательно, переносящая среда может содержать незначительные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты или буферные агенты, регулирующие рН. Применяемые способы получения таких лекарственных форм известны или будут очевидны специалистам в данной области техники. См., например, Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 17th edition, 1985. Композиция или состав, подлежащие введению, в любом случае будут содержать количество агента, достаточное для достижения желаемого состояния у субъекта, подлежащего лечению.
[00126] Фармацевтически приемлемые вспомогательные вещества, такие как переносящие среды, адъюванты, носители или разбавители, легкодоступны для всеобщего сведения. Кроме того, фармацевтически приемлемые вспомогательные вещества, такие как агенты, регулирующие рН, и буферные агенты, агенты, регулирующие тоничность, стабилизаторы, смачивающие агенты и тому подобное, легко доступны для всеобщего сведения.
Дозы
[00127] Несмотря на то, что применяемая доза будет меняться в зависимости от клинических целей, которые должны быть достигнуты, подходящим диапазоном доз активного агента является такой диапазон, который обеспечивает количество вплоть до от примерно 1 г до примерно 100 г, например, от примерно 1 г до примерно 90 г, от примерно 2,5 г до примерно 80 г, от примерно 5,0 г до примерно 70 мг, от примерно 7,5 г до примерно 60 г, от примерно 10 г до примерно 50 г, от примерно 12,5 г до примерно 40 г, от примерно 15 г до примерно 30 г или от 5 г до 20 г активного агента, который может быть введен в дозе для однократного введения.
[00128] Специалистам будет понятно, что величины доз могут меняться в зависимости от конкретного соединения, тяжести симптомов и подверженности субъекта побочным эффектам. Предпочтительные дозы для данного соединения могут быть легко определены специалистами в данной области техники с помощью различных способов.
[00129] В некоторых вариантах реализации вводят дозу активного агента для однократного введения. В других вариантах реализации вводят дозы активного агента для многократного введения. В случае, если дозы для многократного введения вводят в течение некоторого периода времени, активный агент вводят два раза в день (qid), ежедневно (qd), через день (qod), один раз в три дня, три раза в неделю (tiw) или два раза в неделю (biw) в течение некоторого периода времени. Например, активный агент вводят qid, qd, qod, tiw или biw в течение периода, составляющего от одного дня до примерно 2 лет или более. Например, активный агент вводят с любой из вышеупомянутых частот в течение одной недели, двух недель, одного месяца, двух месяцев, шести месяцев, одного года или двух лет или более, в зависимости от различных факторов.
[00130] Соответственно, количество активного агента, вводимое субъекту в день, может находиться в пределах от 10 граммов/сутки до 500 граммов/сутки, как то от 15 граммов/сутки до 450 граммов/сутки, как то от 25 граммов/сутки до 400 граммов/сутки, как то от 50 граммов/сутки до 300 граммов/сутки и в том числе от 100 граммов/сутки до 200 граммов/сутки.
[00131] В случае, если вводят два различных активных агента, первый активный агент и второй активный агент могут быть введены в отдельных составах. Первый активный агент и второй активный агент могут быть введены по существу одновременно или один за другим в течение примерно 30 минут, примерно 1 часа, примерно 2 часов, примерно 4 часов, примерно 8 часов, примерно 16 часов, примерно 24 часов, примерно 36 часов, примерно 72 часов, примерно 4 дней, примерно 7 дней или примерно 2 недель.
[00132] Необходимо отметить, что в случае, если конкретный способ, доза, схема введения, путь введения и т.д., описанные в настоящем описании, не являются подходящими в связи с формой соединения согласно настоящему описанию, например, вследствие присутствия соединения согласно настоящему описанию в форме соли, форма соединения может быть выбрана в соответствии со способом, дозой, схемой введения, путем введения и т.д., соответственно. Например, если присутствие соединения согласно настоящему описанию в форме соли не является подходящим (например, вследствие присутствия нежелательного количества соли в лекарственной форме), форма соединения, предложенная для конкретного способа, дозы, схемы введения, пути введения и т.д., может специально исключать указанное соединение в форме соли.
Пути введения
[00133] Активный агент вводят индивидууму с применением доступного способа и пути, подходящих для доставки лекарственного средства, включая способы in vivo и ex vivo, а также системные и местные пути введения.
[00134] Общепринятые и фармацевтически приемлемые пути введения включают пероральный, интраназальный, внутримышечный, интратрахеальный, чрескожный, подкожный, внутрикожный, посредством местного применения, внутривенный, вагинальный, назальный и другие парентеральные пути введения. В некоторых вариантах реализации активный агент вводят перорально. В некоторых вариантах реализации активный агент вводят с помощью интравагинального пути введения. В других вариантах реализации активный агент вводят с помощью интраректального пути введения. Пути введения могут быть объединены, если желательно, или скорректированы в зависимости от агента и/или желаемого эффекта. Композиция может быть введена в дозе для однократного введения или в дозах для многократного введения.
[00135] Активный агент может быть введен хозяину с применением любых доступных общепринятых способов и путей, подходящих для доставки обычных лекарственных средств, включая системные или местные пути. В целом, пути введения, предусмотренные настоящим изобретением, включают, но не обязательно ограничиваются перечисленными, энтеральный, парентеральный или ингаляционный пути.
[00136] Парентеральные пути введения, отличные от ингаляционного введения, включают, но не обязательно ограничиваются перечисленными, местный, вагинальный, чрескожный, подкожный, внутримышечный и внутривенный пути, то есть любой путь введения, отличный от введения через желудочно-кишечный тракт. Парентеральное введение может быть осуществлено для обеспечения системной или местной доставки агента. В случае, если желаемой является системная доставка, введение, как правило, включает инвазивное введение фармацевтических препаратов или обеспечивающие их системную адсорбцию либо местное применение, либо применение на слизистых оболочках.
[00137] Активный агент также может быть доставлен субъекту путем энтерального введения. Энтеральные пути введения включают, но не обязательно ограничиваются перечисленными, пероральную и ректальную (например, с применением суппозитория) доставку.
[00138] В контексте настоящего описания термин «лечение» может относиться к ослаблению симптомов, связанных с патологическим состоянием, поражающим хозяина, где термин «улучшение» используется в широком смысле для обозначения по меньшей мере уменьшения величины параметра, например, симптома, связанного с патологическим состоянием, подлежащим лечению, например, наличия аномальных эпилептиформных спайков. По существу, лечение также включает ситуации, когда патологическое состояние или по меньшей мере связанные с ним симптомы полностью подавляются, например, предотвращается их возникновение, или останавливаются, например, прекращаются, таким образом, что хозяин более не страдает от патологического состояния или по меньшей мере симптомов, которыми характеризуется указанное патологическое состояние.
[00139] Соединения и композиции, описанные в настоящем описании, могут быть введены различным хозяевам (причем в настоящем описании термин «хозяин» используется взаимозаменяемо с терминами «субъект» и «пациент»). В некоторых вариантах реализации субъект представляет собой «млекопитающее» или «относится к млекопитающим», причем эти термины используются в широком смысле для описания организмов, относящихся к классу млекопитающих, включая отряды хищных животных (например, собаки и кошки), грызунов (например, мыши, морские свинки и крысы) и приматов (например, люди, шимпанзе и обезьяны). В некоторых случаях субъекты представляют собой людей. Субъекты, являющиеся людьми, могут иметь любой пол и находиться на любой стадии развития (то есть являться новорожденными, детьми, юношами/девушками, подростками, взрослыми), где в некоторых вариантах реализации субъект, являющийся человеком, представляет собой юношу/девушку, подростка, взрослого. Несмотря на то, что соединения согласно настоящему описанию могут быть введены субъекту, являющемуся человеком, следует понимать, что предложенные β- гидроксиэфирные соединения жирных кислот и сложные эфиры жирных кислот и бутандиола также могут быть введены субъектам, являющимся животными (то есть «субъектам, не являющимся людьми»), таким как, но не ограничиваясь перечисленными, птицы, мыши, крысы, собаки, кошки, домашний скот и лошади.
Наборы, емкости, устройства, системы доставки
[00140] Предложены наборы, содержащие единичные дозы активного агента, например, дозы для перорального, вагинального, ректального, чрескожного или инъекционного введения (например, для внутримышечной, внутривенной или подкожной инъекции). В таких наборах помимо емкостей, содержащих единичные дозы, будет находиться информационный вкладыш в упаковку с описанием применения и полезных свойств предложенных композиций. Подходящие активные агенты и единичные дозы являются такими, которые описаны выше в настоящем описании.
[00141] Во многих вариантах реализации предложенный набор будет дополнительно содержать инструкции по практическому применению предложенных способов или средств для их получения (например, URL-адрес веб-сайта, направляющий пользователя на веб-страницу, которая предоставляет инструкции), причем эти инструкции, как правило, напечатаны на носителе, который может представлять собой одно или более из: вкладыша в упаковку, материала упаковки, емкостей для составов и тому подобного.
[00142] В некоторых вариантах реализации предложенный набор содержит один или более компонентов или имеет один или более признаков, которые повышают комфорт пациента, например, содержит компонент или систему, помогающие пациенту помнить о приеме активного агента в соответствующее время или период времени. Такие компоненты включают, но не ограничиваются перечисленными, систему календарного планирования, помогающую пациенту помнить о приеме активного агента в соответствующее время или период времени.
[00143] В некоторых вариантах реализации система доставки представляет собой систему доставки, которая обеспечивает инъекционное введение состава, содержащего активный агент, подкожно, внутривенно или внутримышечно. В других вариантах реализации система доставки представляет собой вагинальную или ректальную систему доставки.
[00144] В некоторых вариантах реализации активный агент упакован для перорального введения. В настоящем изобретении предложена упаковочная единица, содержащая суточное количество единиц доз активного агента. Например, в некоторых вариантах реализации упаковочная единица представляет собой обычную блистерную упаковку или любую другую форму, которая содержит таблетки, пилюли и тому подобное. Указанная блистерная упаковка будет содержать подходящее число единичных лекарственных форм в запечатанной блистерной упаковке с подложкой из картона, бумаги, фольги или пластика и заключена в подходящую оболочку. Каждая блистерная емкость может быть пронумерована или иным образом помечена, например, начиная с первого дня.
[00145] В некоторых вариантах реализации предложенная система доставки содержит устройство для инъекционного введения. Типичные неограничивающие устройства для доставки лекарственных средств включают устройства для инъекционного введения, такие как шприц-ручки и устройства типа шприц с иглой. Шприц-ручки хорошо известны в данной области техники. Примерами устройств, которые могут быть адаптированы для применения в настоящих способах, являются любые из множества шприц-ручек от Becton Dickinson, например, BD™ Pen, BD™ Pen II, BD™ Auto-Injector; шприц-ручка от Innoject, Inc.; любая из шприц-ручек для доставки лекарственных средств, рассматриваемых в патентах США №№5728074, 6096010, 6146361, 6248095, 6277099 и 6221053; содержание каждого из которых включено в настоящее описание посредством ссылки; и тому подобное. Шприц-ручки для доставки лекарственных средств могут быть предназначены для одноразового применения или быть пригодными для повторного применения и выполненными с возможностью повторного наполнения.
[00146] В настоящем изобретении предложена система доставки для вагинальной или ректальной доставки активного агента во влагалище или прямую кишку индивидуума. Указанная система доставки включает устройство для введения во влагалище или прямую кишку. В некоторых вариантах реализации указанная система доставки включает аппликатор для доставки состава во влагалище или прямую кишку и емкость, которая содержит состав, содержащий активный агент. В этих вариантах реализации указанная емкость (например, туба) адаптирована для осуществления доставки состава в аппликатор. В других вариантах реализации указанная система доставки включает устройство, содержащее активный агент, которое вводят во влагалище или прямую кишку. Например, указанное устройство покрыто, пропитано составом, содержащим активный агент, или содержит его иным образом.
[00147] В некоторых вариантах реализации вагинальная или ректальная система доставки представляет собой тампон или тампоноподобное устройство, которое содержит предложенный состав. Тампоны для доставки лекарственных средств известны в данной области техники, и любой такой тампон может быть применен совместно с предложенной системой доставки лекарственных средств. Тампоны для доставки лекарственных средств описаны, например, в патенте США №6086909, содержание которого включено в настоящее описание посредством ссылки. В случае применения тампона или тампоноподобного устройства существует множество способов, с помощью которых активный агент может быть введен в указанное устройство. Например, лекарственное средство может быть помещено в гелеобразный биоадгезивный резервуар в наконечнике устройства. В качестве альтернативы, лекарственное средство может находиться в форме порошкообразного материала, расположенного на наконечнике тампона. Также лекарственным средством могут быть пропитаны волокна на наконечнике тампона, например, путем растворения лекарственного средства в фармацевтически приемлемом носителе и пропитывания волокон тампона раствором лекарственного средства. Также лекарственное средство может быть растворено в материале покрытия, которое наносят на наконечник тампона. В качестве альтернативы, лекарственное средство может быть помещено в подлежащий введению суппозиторий, который соединен с наконечником тампона.
[00148] В других вариантах реализации устройство для доставки лекарственных средств представляет собой вагинальное или ректальное кольцо. Вагинальные или ректальные кольца обычно состоят из инертного эластомерного кольца, покрытого еще одним слоем эластомера, содержащим активный агент, подлежащий доставке. Кольца могут быть легко введены, оставлены на месте в течение желаемого периода времени (например, до 7 дней), затем удалены пользователем. Кольцо может необязательно содержать третий, внешний, контролирующий скорость слой эластомера, который не содержит лекарственного средства. Третье кольцо может необязательно содержать второе лекарственное средство в случае кольца с двойным высвобождением. Лекарственное средство может быть включено в слой полиэтиленгликоля на всей поверхности силиконового эластомерного кольца, служащий в качестве резервуара для лекарственного средства, подлежащего доставке.
[00149] В других вариантах реализации предложенная вагинальная или ректальная система доставки представляет собой вагинальную или ректальную губку. Активный агент вводят в силиконовую матрицу, которую наносят на не содержащую лекарственных средств полиуретановую губку цилиндрической формы, описанную в литературе.
[00150] Пессарии, таблетки и суппозитории являются другими примерами систем доставки лекарственных средств, которые могут быть применены, например, при осуществлении способа согласно настоящему описанию. Такие системы широко описаны в литературе.
[00151] Биоадгезивные микрочастицы представляют собой еще одну систему доставки лекарственных средств, подходящую для применения в целях настоящего изобретения. Эта система представляет собой многофазный жидкий или полутвердый препарат, который, в отличие от многих составов суппозиториев, не вытекает из влагалища или прямой кишки. Эти материалы остаются прикрепленными к стенке влагалища или прямой кишки и высвобождают лекарственное средство в течение некоторого периода времени. Многие из этих систем были выполнены с возможностью назального применения, однако они также могут быть применены во влагалище или прямой кишке (например, патент США №4756907, содержание которого включено в настоящее описание посредством ссылки). Указанная система может содержать микросферы с активным агентом и поверхностно-активное вещество для усиления всасывания лекарственного средства. Микрочастицы имеют диаметр 10-100 мкм и могут быть приготовлены из крахмала, желатина, альбумина, коллагена или декстрана.
[00152] Другая система представляет собой емкость, содержащую предложенный состав (например, тубу), которая адаптирована для применения с аппликатором. Активный агент вводят в кремы, лосьоны, пены, пасту, мази и гели, которые могут быть нанесены на область влагалища или прямой кишки с помощью аппликатора. Способы получения фармацевтических препаратов в форме крема, лосьона, пены, пасты, мази и геля широко описаны в литературе. Примером подходящей системы является стандартный состав лосьона, не содержащий ароматизаторов, содержащий глицерин, церамиды, минеральное масло, вазелин, парабены, ароматизатор и воду, такой как продукт, реализуемый под торговой маркой JERGENS™ (Andrew Jergens Co., Cincinnati, Ohio). Подходящие нетоксичные фармацевтически приемлемые системы для применения для композиций согласно настоящему изобретению будут очевидны специалистам в области фармацевтических составов, а также их примеры описаны в Remington's Pharmaceutical Sciences, 19th Edition, A. R. Gennaro, ed., 1995. Выбор подходящих носителей будет зависеть от точных характеристик конкретной желаемой вагинальной или ректальной лекарственной формы, например, от того, должен ли активный ингредиент (ингредиенты) быть приготовлен в виде крема, лосьона, пены, мази, пасты, раствора или геля, а также от природы активного ингредиента (ингредиентов). Другими подходящими устройствами для доставки являются устройства, описанные в патенте США №6476079, содержание которого включено в настоящее описание посредством ссылки.
Способы лечения
[00153] Также в настоящем описании предложены способы осуществления лечения субъекта путем введения указанному субъекту одного или более β-гидроксиэфирного соединения жирной кислоты и/или одного или более сложных эфиров бутандиола или их фармацевтически приемлемой соли. В некоторых вариантах реализации способы включают введение субъекту одного или более β-гидроксиэфирного соединения жирной кислоты или его фармацевтически приемлемой соли. В других вариантах реализации способы включают введение субъекту одного или более сложных эфиров бутандиола или их фармацевтически приемлемой соли. В некоторых вариантах реализации способы включают введение субъекту комбинации одного или более β-гидроксиэфирного соединения жирной кислоты или его фармацевтически приемлемой соли и одного или более сложных эфиров бутандиола или их фармацевтически приемлемой соли. В случае, если субъекту вводят и β-гидроксиэфирное соединение жирной кислоты, и сложный эфир бутандиола, в некоторых случаях массовое отношение β-гидроксиэфирного соединения жирной кислоты к сложному эфиру бутандиола находится в диапазоне от 10:1 до 1:1, как то от 9:1 до 1,5:1, как то от 8:1 до 2:1, как то от 7:1 до 2,5:1, как то от 6:1 до 3:1 и в том числе от 5:1 до 4:1. В других случаях массовое отношение β-гидроксиэфирного соединения жирной кислоты к сложному эфиру бутандиола находится в диапазоне от 1:10 до 1:1, как то от 1:9 до 1:1, как то от 1:8 до 1:1,5, как то от 1:7 до 1:2, как то от 1:6 до 1:2,5 и в том числе от 1:5 до 1:3.
[00154] В некоторых вариантах реализации способы включают лечение одного или более из болезни Альцгеймера, эпилепсии, болезни Паркинсона, сердечной недостаточности, травматического повреждения головного мозга, инсульта, геморрагического шока, острого повреждения легкого после жидкостной реанимации, острого повреждения почек, инфаркта миокарда, ишемии миокарда, диабета, мультиформной глиобластомы, диабетической нейропатии, рака предстательной железы, бокового амиотрофического склероза, болезни Хантингтона, кожной Т-клеточной лимфомы, множественной миеломы, периферической Т-клеточной лимфомы, ВИЧ, болезни Ниманна-Пика типа С, возрастной макулярной дегенерации, подагры, атеросклероза, ревматоидного артрита и рассеянного склероза путем введения субъекту одного или более из β-гидроксиэфирных соединений жирных кислот и/или одного или более из сложных эфиров бутандиола, описанных в настоящем описании.
[00155] В некоторых вариантах реализации способы включают лечение болезни Альцгеймера путем введения субъекту одного или более из β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, описанных в настоящем описании. В некоторых случаях количество (описанное выше) одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для уменьшения эпилептиформной активности у субъекта. Например, предложенные способы могут включать введение количества предложенных β-гидроксиэфирных соединений жирных кислот или сложных эфиров бутандиола, достаточного для уменьшения эпилептиформной активности на 5% или более, как то на 10% или более, как то на 15% или более, как то на 25% или более, как то на 40% или более, как то на 50% или более, как то на 75% или более, как то на 90% или более, как то на 95% или более, как то на 99% или более и в том числе уменьшения эпилептиформной активности на 99,9% или более.
[00156] В других случаях количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для повышения когнитивных функций у субъекта. Например, предложенные способы могут включать введение количества предложенных β-гидроксиэфирных соединений жирных кислот или сложных эфиров жирных кислот и бутандиола, достаточного для повышения когнитивных функций у субъекта на 5% или более, как то на 10% или более, как то на 15% или более, как то на 25% или более, как то на 40% или более, как то на 50% или более, как то на 75% или более, как то на 90% или более, как то на 95% или более, как то на 99% или более и в том числе повышения когнитивных функций у субъекта на 99,9% или более.
[00157] В других случаях количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для уменьшения скорости снижения когнитивных функций у субъекта. Например, предложенные способы могут включать введение количества предложенных β-гидроксиэфирных соединений жирных кислот или сложных эфиров жирных кислот и бутандиола, достаточного для уменьшения скорости снижения когнитивных функций у субъекта на 5% или более, как то на 10% или более, как то на 15% или более, как то на 25% или более, как то на 40% или более, как то на 50% или более, как то на 75% или более, как то на 90% или более, как то на 95% или более, как то на 99% или более и в том числе уменьшения скорости снижения когнитивных функций у субъекта на 99,9% или более.
[00158] Уровень когнитивных функций у субъекта может быть оценен с помощью любого подходящего протокола, включая, но не ограничиваясь перечисленными, Монреальскую шкалу оценки когнитивных функций (Montreal Cognitive Assessment (МоСА)), шкалу психического состояния университета Сент-Луиса (St. Louis University Mental State Exam (SLUMS)), краткое исследование психического состояния (Mini Mental State Exam (MMSE)) и, для исследовательских целей, шкалу оценки болезни Альцгеймера (Alzheimer's Disease Assessment Scale), субшкалу оценки когнитивных функций (ADAS-Cog), а также способы оценки, включающие шкалу повседневной деятельности (Activities of Daily Living (ADLs)) и шкалу повседневной инструментальной деятельности (Instrumental Activities of Daily Living (IADLs)).
[00159] В некоторых вариантах реализации количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для улучшения повседневной деятельности субъекта, такой как деятельность, определяемая с помощью оценки по шкале повседневной деятельности (Activities of Daily Living (ADLs)) и шкале повседневной инструментальной деятельности (Instrumental Activities of Daily Living (IADLs)).
[00160] В других вариантах реализации количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для снижения возбужденного поведения у субъекта. Например, предложенные способы могут включать введение количества предложенных β-гидроксиэфирных соединений жирных кислот или сложных эфиров жирных кислот и бутандиола, достаточного для снижения возбужденного поведения у субъекта на 5% или более, как то на 10% или более, как то на 15% или более, как то на 25% или более, как то на 40% или более, как то на 50% или более, как то на 75% или более, как то на 90% или более, как то на 95% или более, как то на 99% или более и в том числе снижения возбужденного поведения у субъекта на 99,9% или более. Возбужденное поведение может быть оценено с помощью любого подходящего протокола, например, оценено с помощью нейропсихиатрического опросника (Neuropsychiatric Inventory (NPI)).
[00161] В других вариантах реализации количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для ослабления делирия у субъекта. Например, предложенные способы могут включать введение количества предложенных β-гидроксиэфирных соединений жирных кислот или сложных эфиров жирных кислот и бутандиола, достаточного для ослабления делирия у субъекта на 5% или более, как то на 10% или более, как то на 15% или более, как то на 25% или более, как то на 40% или более, как то на 50% или более, как то на 75% или более, как то на 90% или более, как то на 95% или более, как то на 99% или более и в том числе ослабления делирия у субъекта на 99,9% или более.
[00162] В других вариантах реализации количество одного или более β-гидроксиэфирных соединений жирных кислот и/или одного или более сложных эфиров бутандиола, вводимое субъекту, является достаточным для снижения стресса, вызванного присутствием лица, осуществляющего уход, у субъекта. Например, предложенные способы могут включать введение количества предложенных β-гидроксиэфирных соединений жирных кислот или сложных эфиров жирных кислот и бутандиола, достаточного для снижения стресса, вызванного присутствием лица, осуществляющего уход, у субъекта на 5% или более, как то на 10% или более, как то на 15% или более, как то на 25% или более, как то на 40% или более, как то на 50% или более, как то на 75% или более, как то на 90% или более, как то на 95% или более, как то на 99% или более и в том числе снижения стресса, вызванного присутствием лица, осуществляющего уход, у субъекта на 99,9% или более. Стресс, вызванный присутствием лица, осуществляющего уход, может быть оценен с помощью любого подходящего протокола, например, оценен с помощью шкалы воспринимаемого стресса (Perceived Stress Scale (PSS)).
[00163] При осуществлении предложенных способов протоколы для конкретных субъектов могут различаться, как то, например, в зависимости от возраста, массы тела, степени боли, общего состояния здоровья субъекта, а также от конкретной концентрации β-гидроксиэфирного соединения жирной кислоты и/или сложного эфира жирной кислоты и бутандиола, подлежащих введению. В вариантах реализации доза, доставляемая во время введения, может различаться, в некоторых случаях в пределах от 5 мг до 800 мг. По существу, в зависимости от физиологического состояния субъекта, а также от желаемого терапевтического эффекта, доза, обеспечиваемая предложенными способами, может находиться в пределах от 5 до 800 мг, как то от 10 до примерно 500 мг, как то от 20 до 400 мг, как то от 25 до 350 мг, как то от 30 до 300 мг, как то от 40 до 250 мг и в том числе от 40 до 200 мг.
[00164] Таким образом, представляющая интерес доза может меняться в пределах от примерно 0,1 г/кг до 25 г/кг в день, как то от 0,1 г/кг до 20 г/кг в день, как то от 0,1 г/кг до 18 г/кг в день, как то от 0,1 г/кг до 15 г/кг в день, как то от 0,1 г/кг до 10 г/кг в день, и в том числе от 0,1 г/кг до 5 г/кг в день, как то от 0,5 г/кг до 10 г/кг в день, как то от 0,5 г/кг до 9 г/кг в день, как то от 0,5 г/кг до 8 г/кг в день, как то от 0,5 г/кг до 5 г/кг в день, как то от 0,5 г/кг до 3 г/кг в день, как то от 0,5 г/кг до 2 г/кг в день и в том числе от 0,5 г/кг до 1 г/кг в день. В некоторых случаях доза составляет 1 г/кг в день. В других вариантах реализации доза может находиться в пределах от 0,1 до 6,5 г/кг четыре раза в день (QID), как то от 0,1 до 5 г/кг QID, как то от 0,1 г/кг до 4 г/кг QID. В других вариантах реализации доза при пероральном введении может находиться в пределах от 0,01 г/кг до 8,5 г/кг три раза в день (TID), как то от 0,1 г/кг до 6 г/кг TID, как то от 0,1 г/кг до 5 г/кг TID и в том числе от 0,1 г/кг до 4 г/кг TID. В других вариантах реализации доза при пероральном введении может находиться в пределах от 0,1 г/кг до 13 г/кг два раза в день (BID), как то от 0,1 г/кг до 12 г/кг BID, как то от 5 г/кг до 10 г/кг BID, в том числе от 0,1 г/кг до 8 г/кг BID. Вводимое количество соединения будет зависеть от физиологического состояния субъекта, характеристик всасывания β-гидроксиэфирного соединения жирной кислоты и/или сложного эфира жирной кислоты и бутандиола у субъекта, а также от величины желаемого терапевтического эффекта. Схемы введения могут включать, но не ограничиваются перечисленным, введение пять раз в день, четыре раза в день, три раза в день, два раза в день, один раз в день, три раза в неделю, два раза в неделю, один раз в неделю, два раза в месяц, один раз в месяц и любую их комбинацию.
[00165] В некоторых вариантах реализации предложенные способы могут включать длительное применение, для которого требуются предложенные способы и композиции в дозах для многократного введения в течение длительного периода, например, в течение одного месяца и до 10 лет.
[00166] Длительность промежутков между периодами введения при схеме лечения с многократными периодами введения может меняться в зависимости от физиологического состояния субъекта или в соответствии со схемой лечения, определяемой специалистом в области здравоохранения. В некоторых случаях длительность промежутков между периодами введения при схеме лечения с многократным введением может быть определена предварительно, и введение осуществляют через равные промежутки времени. По существу, время между периодами введения может меняться и может составлять 0,5 часа или более, как то 1 час или более, как то 2 часа или более, как то 4 часа или более, как то 8 часов или более, как то 12 часов или более, как то 16 часов или более, как то 24 часа или более, как то 48 часов или более и в том числе 72 часа или более.
[00167] В некоторых вариантах реализации предложенные способы включают введение субъекту одного или более β-гидроксиэфирных соединений жирных кислот или их фармацевтически приемлемых солей и/или одного или более сложных эфиров бутандиола или их фармацевтически приемлемых солей в комбинации с кетогенной диетой. В контексте настоящего описания фраза «кетогенная диета» используется в ее общепринятом смысле для обозначения диеты, которая после потребления, переваривания и метаболизма обеспечивает кетоновые тела в качестве основного источника энергии. Кетоновые тела, физиологически обеспечиваемые кетогенной диетой, включают ацетоацетат, β-гидроксибутират и ацетон. Подходящие кетогенные диеты могут включать, но не ограничиваются перечисленными, диеты, описанные в источниках Fenton et al., ICAN 2009, 1:338; Neal et al., Lancet Neurology 2008, 7:500; Hartman and Vinning, Epilepsia 2007, 1:31; Kossoff et al., Epilepsia 2009, 50:304, содержание которых включено в настоящее описание посредством ссылки. При осуществлении предложенных способов предложенные β-гидроксиэфирные соединения жирных кислот или их фармацевтически приемлемые соли и/или сложные эфиры бутандиола или их фармацевтически приемлемые соли могут быть введены до, после или одновременно с кетогенной диетой. В некоторых вариантах реализации предложенные способы включают введение предложенных β-гидроксиэфирных соединений жирных кислот или их фармацевтически приемлемых солей и/или сложных эфиров бутандиола или их фармацевтически приемлемых солей, после которого начинают кетогенную диету. В других вариантах реализации способы включают введение предложенных β-гидроксиэфирных соединений жирных кислот или их фармацевтически приемлемых солей и/или сложных эфиров бутандиола или их фармацевтически приемлемых солей после завершения одного или более периодов кетогенной диеты. В других вариантах реализации способы включают введение предложенных β-гидроксиэфирных соединений жирных кислот или их фармацевтически приемлемых солей и/или сложных эфиров бутандиола или их фармацевтически приемлемых солей одновременно с кетогенной диетой.
Иллюстративные неограничивающие аспекты настоящего описания
[00168] Аспекты, включая варианты реализации, описанного выше в настоящем описании могут являться полезными для применения отдельно или в комбинации с одним или более другими аспектами или вариантами реализации. Без ограничения приведенного выше описания, некоторые неограничивающие аспекты настоящего изобретения, пронумерованные от 1 до 48, представлены ниже. Как будет понятно специалистам в данной области техники после прочтения настоящего описания, каждый из отдельно пронумерованных аспектов может быть применен или объединен с любым из предшествующих или последующих отдельно пронумерованных аспектов. Это предназначено для обеспечения поддержки всех таких комбинаций аспектов и не ограничивается комбинациями аспектов, явным образом представленными ниже.
1. Соединение формулы I:
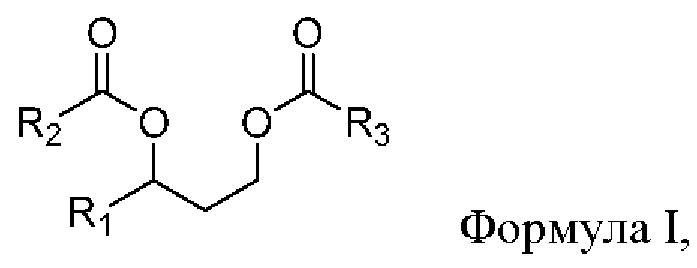
где
R1 представляет собой Н, или С(1-6) алкил, или замещенный алкил; и
R2 и R3 независимо представляют собой незамещенный или замещенный С(4-30) алкил.
2. Соединение в соответствии с 1, где R1 представляет собой незамещенный С(1-6) алкил.
3. Соединение в соответствии с 2, где R1 представляет собой метил.
4. Соединение в соответствии с любым из 1-3, где R2 и R3 независимо представляют собой незамещенный С(6-18) алкил.
5. Соединение в соответствии с любым из 1-3, где R2 и R3 независимо представляют собой незамещенный С6 алкил.
6. Соединение в соответствии с любым из 1-3, где R2 и R3 независимо представляют собой незамещенный С8 алкил.
7. Соединение в соответствии с 1, причем указанное соединение имеет формулу Ia:
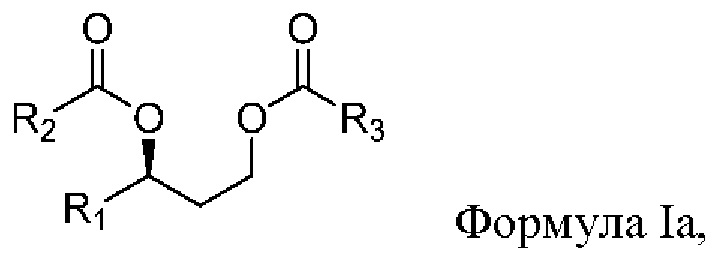
где
R1 представляет собой Н, или С(1-6) алкил, или замещенный алкил; и
R2 и R3 независимо представляют собой незамещенный или замещенный С(4-30) алкил.
8. Соединение в соответствии с 7, где R1 представляет собой незамещенный С(1-6) алкил.
9. Соединение в соответствии с 8, где R1 представляет собой метил.
10. Соединение в соответствии с любым из 7-9, где R2 и R3 независимо представляют собой незамещенный С(6-18) алкил.
11. Соединение в соответствии с любым из 7-9, где R2 и R3 независимо представляют собой незамещенный С6 алкил.
12. Соединение в соответствии с любым из 7-9, где R2 и R3 независимо представляют собой незамещенный С8 алкил.
13. Соединение в соответствии с 1, причем указанное соединение имеет формулу Ib:
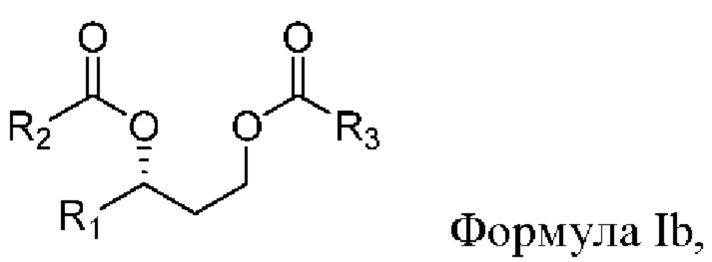
где
R1 представляет собой Н, или С(1-6) алкил, или замещенный алкил; и
R2 и R3 независимо представляют собой незамещенный или замещенный С(4-30) алкил.
14. Соединение в соответствии с 13, где R1 представляет собой незамещенный С(1-6) алкил.
15. Соединение в соответствии с 14, где R1 представляет собой метил.
16. Соединение в соответствии с любым из 13-15, где R2 и R3 независимо представляют собой незамещенный С(6-18) алкил.
17. Соединение в соответствии с любым из 13-15, где R2 и R3 независимо представляют собой незамещенный С6 алкил.
18. Соединение в соответствии с любым из 13-15, где R2 и R3 независимо представляют собой незамещенный С8 алкил.
19. Композиция, содержащая соединение в соответствии с любым из 1-18 и фармацевтически приемлемый носитель.
20. Способ, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения в соответствии с любым из 1-18 или композиции в соответствии с 19.
21. Способ в соответствии с 20, где указанное терапевтически эффективное количество является достаточным для уменьшения эпилептиформной активности в головном мозге субъекта.
22. Способ лечения одного или более из болезни Альцгеймера, эпилепсии, болезни Паркинсона, сердечной недостаточности, травматического повреждения головного мозга, инсульта, геморрагического шока, острого повреждения легкого после жидкостной реанимации, острого повреждения почек, инфаркта миокарда, ишемии миокарда, диабета, мультиформной глиобластомы, диабетической нейропатии, рака предстательной железы, бокового амиотрофического склероза, болезни Хантингтона, кожной Т-клеточной лимфомы, множественной миеломы, периферической Т-клеточной лимфомы, ВИЧ, болезни Ниманна-Пика типа С, возрастной макулярной дегенерации, подагры, атеросклероза, ревматоидного артрита и рассеянного склероза, включающий:
введение указанному субъекту терапевтически эффективного количества соединения в соответствии с любым из 1-18 или композиции в соответствии с 19.
23. Способ в соответствии с 22, где указанное терапевтически эффективное количество является достаточным для уменьшения эпилептиформной активности в головном мозге субъекта.
24. Способ уменьшения эпилептиформной активности в головном мозге субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения в соответствии с любым из 1-18 или композиции в соответствии с 19.
25. Пищевая добавка, содержащая соединение в соответствии с любым из 1-18.
26. Композиция, содержащая:
пищевую добавку, содержащую соединение в соответствии с любым из 1-18; и
один или более дополнительных компонентов кетогенной диеты.
27. Композиция в соответствии с 26, отличающаяся тем, что содержание указанного соединения в композиции составляет от примерно 1% масс./масс. до примерно 25% масс./масс.
28. Композиция в соответствии с 26, отличающаяся тем, что содержание указанного соединения в композиции составляет от примерно 5% масс./масс. до примерно 15% масс./масс.
29. Композиция в соответствии с 26, отличающаяся тем, что содержание указанного соединения в композиции составляет примерно 10% масс./масс.
30. Композиция в соответствии с 26, где указанная кетогенная диета включает массовое отношение жира к белку и углеводам, составляющее от примерно 2:1 до примерно 10:1.
31. Композиция в соответствии с 30, где указанная кетогенная диета включает массовое отношение жира к белку и углеводам, составляющее от примерно 3:1 до примерно 6:1.
32. Композиция в соответствии с 30, где указанная кетогенная диета включает массовое отношение жира к белку и углеводам, составляющее примерно 4:1.
33. Соединение формулы II:
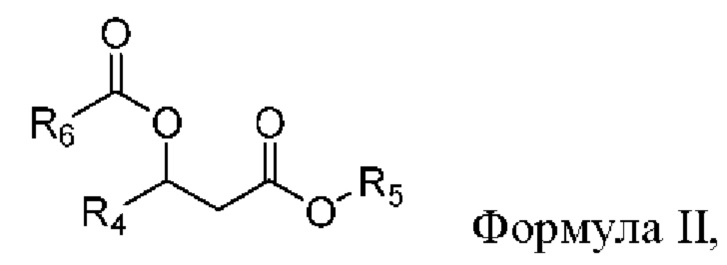
где
R4 представляет собой Н, или С(1-6) алкил, или замещенный алкил; и
R5 и R6 независимо представляют собой незамещенный или замещенный С(4-30) алкил.
34. Соединение в соответствии с 33, где R4 представляет собой незамещенный С(1-6) алкил.
35. Соединение в соответствии с 34, где R4 представляет собой метил.
36. Соединение в соответствии с любым из 33-35, где R5 и R6 независимо представляют собой незамещенный С(6-18) алкил.
37. Соединение в соответствии с любым из 33-35, где R5 и R6 независимо представляют собой незамещенный С6 алкил.
38. Соединение в соответствии с любым из 33-35, где R5 и R6 независимо представляют собой незамещенный С8 алкил.
39. Соединение в соответствии с 33, причем указанное соединение имеет формулу IIa:
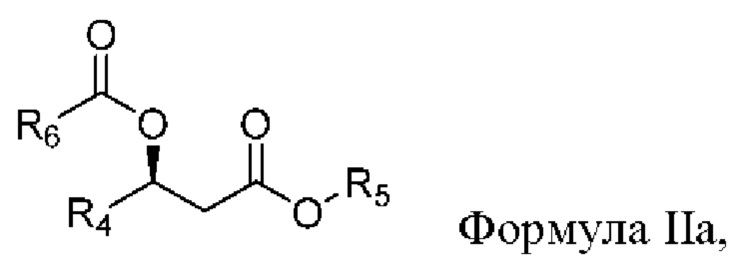
где
R4 представляет собой Н, или С(1-6) алкил, или замещенный алкил; и
R5 и R6 независимо представляют собой незамещенный или замещенный С(4-30) алкил.
40. Соединение в соответствии с 39, где R4 представляет собой незамещенный С(1-6) алкил.
41. Соединение в соответствии с 40, где R4 представляет собой метил.
42. Соединение в соответствии с любым из 39-41, где R5 и R6 независимо представляют собой незамещенный С(6-18) алкил.
43. Соединение в соответствии с любым из 39-41, где R5 и R6 независимо представляют собой незамещенный С6 алкил.
44. Соединение в соответствии с любым из 39-41, где R5 и R6 независимо представляют собой незамещенный С8 алкил.
45. Соединение в соответствии с 33, причем указанное соединение имеет формулу IIb:
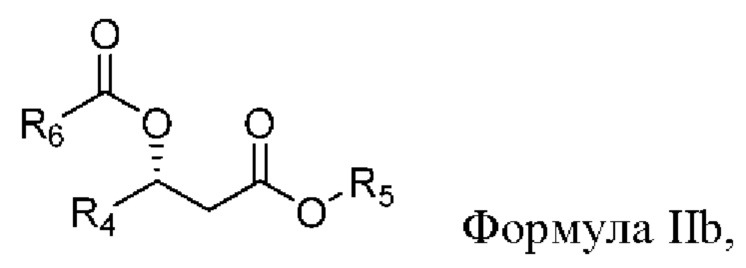
где
R4 представляет собой Н, или С(1-6) алкил, или замещенный алкил; и
R5 и R6 независимо представляют собой незамещенный или замещенный С(4-30) алкил.
46. Соединение в соответствии с 45, где R4 представляет собой незамещенный С(1-6) алкил.
47. Соединение в соответствии с 46, где R4 представляет собой метил.
48. Соединение в соответствии с любым из 45-47, где R5 и R6 независимо представляют собой незамещенный С(6-18) алкил.
49. Соединение в соответствии с любым из 45-47, где R5 и R6 независимо представляют собой незамещенный С6 алкил.
50. Соединение в соответствии с любым из 45-47, где R5 и R6 независимо представляют собой незамещенный С8 алкил.
51. Композиция, содержащая соединение в соответствии с любым из 33-50 и фармацевтически приемлемый носитель.
52. Способ, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения в соответствии с любым из 33-50 или композиции в соответствии с 51.
53. Способ в соответствии с 52, где указанное терапевтически эффективное количество является достаточным для уменьшения эпилептиформной активности в головном мозге субъекта.
54. Способ лечения одного или более из болезни Альцгеймера, эпилепсии, болезни Паркинсона, сердечной недостаточности, травматического повреждения головного мозга, инсульта, геморрагического шока, острого повреждения легкого после жидкостной реанимации, острого повреждения почек, инфаркта миокарда, ишемии миокарда, диабета, мультиформной глиобластомы, диабетической нейропатии, рака предстательной железы, бокового амиотрофического склероза, болезни Хантингтона, кожной Т-клеточной лимфомы, множественной миеломы, периферической Т-клеточной лимфомы, ВИЧ, болезни Ниманна-Пика типа С, возрастной макулярной дегенерации, подагры, атеросклероза, ревматоидного артрита и рассеянного склероза, включающий:
введение указанному субъекту терапевтически эффективного количества соединения в соответствии с любым из 33-50 или композиции в соответствии с 51.
55. Способ в соответствии с 54, где указанное терапевтически эффективное количество является достаточным для уменьшения эпилептиформной активности в головном мозге субъекта.
56. Способ уменьшения эпилептиформной активности в головном мозге субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения в соответствии с любым из 33-50 или композиции в соответствии с 51.
57. Пищевая добавка, содержащая соединение в соответствии с любым из 33-50.
58. Композиция, содержащая:
пищевую добавку, содержащую соединение в соответствии с любым из 33-50; и
один или более компонентов кетогенной диеты.
59. Композиция в соответствии с 58, отличающаяся тем, что содержание указанного соединения в композиции составляет от примерно 1% масс./масс. до примерно 25% масс./масс.
60. Композиция в соответствии с 58, отличающаяся тем, что содержание указанного соединения в композиции составляет от примерно 5% масс./масс. до примерно 15% масс./масс.
61. Композиция в соответствии с 58, отличающаяся тем, что содержание указанного соединения в композиции составляет примерно 10% масс./масс.
62. Композиция в соответствии с 58, где указанная кетогенная диета включает массовое отношение жира к белку и углеводам, составляющее от примерно 2:1 до примерно 10:1.
63. Композиция в соответствии с 58, где указанная кетогенная диета включает массовое отношение жира к белку и углеводам, составляющее от примерно 3:1 до примерно 6:1.
64. Композиция в соответствии с 58, где указанная кетогенная диета включает массовое отношение жира к белку и углеводам, составляющее примерно 4:1.
Примеры
[00169] Следующие примеры приведены для того, чтобы обеспечить специалистов в данной области техники полным раскрытием и описанием способов получения и применения согласно настоящему изобретению, и они не ограничивают объем материала, который авторы настоящего изобретения рассматривают в качестве своего изобретения, также они не представляют приведенные ниже эксперименты в качестве всех или единственных проведенных экспериментов. Были предприняты меры для обеспечения точности в отношении используемых численных значений (например, количеств, температуры и так далее), однако следует учитывать некоторые ошибки эксперимента и отклонения. Если не указано иное, доли представляют собой доли по массе, молекулярная масса представляет собой средневесовую молекулярную массу, температура измерена в градусах Цельсия и давление представляет собой атмосферное давление или близкое к нему. Могут использоваться стандартные сокращения, например, п.о. - пара(ы) оснований; т.п.н. - тысяча(и) пар нуклеотидов; пл - пиколитр(ы); с или сек - секунда(ы); мин - минута(ы); ч - час(ы); АК - аминокислота(ы); т.п.н. - тысяча(и) пар нуклеотидов; п.о. - пара(ы) оснований; нт - нуклеотид(ы); в/м - внутримышечный (внутримышечно); в/б - внутрибрюшинный (внутрибрюшинно); п/к - подкожный (подкожно) и тому подобное.
Общие способы синтеза
[00170] Кетоновые эфиры согласно настоящему описанию могут быть получены с помощью методов химического синтеза, известных специалистам в данной области техники (см., например, Green et al., "Protective Groups in Organic Chemistry", (Wiley, 2nd ed. 1991); Harrison et al., "Compendium of Synthetic Organic Methods", Vols. 1 8 (John Wiley and Sons, 1971 1996); "Beilstein Handbook of Organic Chemistry", Beilstein Institute of Organic Chemistry, Frankfurt, Germany; Feiser et al., "Reagents for Organic Synthesis", Volumes 1 17, (Wiley Interscience); Trost et al., "Comprehensive Organic Synthesis" (Pergamon Press, 1991); "Theilheimer's Synthetic Methods of Organic Chemistry", Volumes 1 45 (Karger, 1991); March, "Advanced Organic Chemistry" (Wiley Interscience), 1991; Larock "Comprehensive Organic Transformations" (VCH Publishers, 1989); Paquette, "Encyclopedia of Reagents for Organic Synthesis" (John Wiley & Sons, 1995), Bodanzsky, "Principles of Peptide Synthesis" (Springer Verlag, 1984); Bodanzsky, "Practice of Peptide Synthesis" (Springer Verlag, 1984). Кроме того, исходные вещества могут быть получены из коммерческих источников или с помощью хорошо известных способов синтеза.
β-Гидроксиэфирные соединения
[00171] β-Гидроксиэфирные соединения согласно настоящему описанию могут быть получены методами синтеза, в общем виде представленными ниже:
Схема 1
[00172] Согласно схеме 1, гидроксильную группу β-гидроксиэфира ГЭ-1 депротонируют под действием слабого основания (например, пиридина) и подвергают реакции с замещенным ацилхлоридом с получением ацилзамещенного β-гидроксиэфира АГЭ-1. R4 может представлять собой Н или замещенный или незамещенный С(1-6) алкил; R5 и R6 независимо представляют собой замещенный или незамещенный С(4-30) алкил.
Схема 2
[00173] Согласно схеме 2, натриевую соль β-гидроксиэфира ГЭ-2 подвергают реакции с алкилбромидом в полярном апротонном растворителе (например, диметилформамиде) с получением алкил-β-гидроксиэфира ГЭ-3. Депротонирование гидроксильной группы β-гидроксиэфира ГЭ-3 под действием слабого основания (например, пиридина) и введение в реакцию с замещенным ацилхлоридом приводит к получению ацилзамещенного β-гидроксиэфира АГЭ-2. R4 может представлять собой Н или замещенный или незамещенный С(1-6) алкил; R6 и R7 независимо представляют собой замещенный или незамещенный С(4-30) алкил.
ПРИМЕР 1 - Синтез ацилзамещенного этил-β-гидроксибутирата
Схема 3
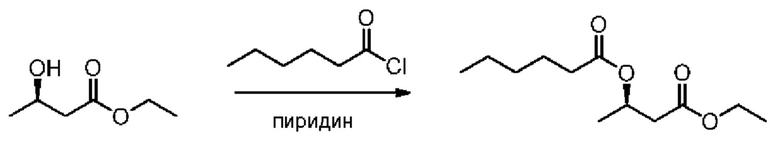
[00174] Как представлено на схеме 3, один молярный эквивалент R-этил-β-гидроксибутирата растворяли в пиридине до концентрации 0,2 моль/л. Раствор помещали в атмосферу азота и охлаждали до 0°С. К раствору β-гидроксиэфира по каплям с помощью шприца добавляли замещенный (например, гексил, фигуры 1a-1b, и октил, фигуры 2а-2b) ацилхлорид в количестве 2 молярных эквивалентов при перемешивании. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь помещали в делительную воронку и разбавляли 1,5 объемами этилацетата (из расчета на объем реакционной смеси) и затем промывали 5 раз 0,5 объема раствора соляной кислоты (10% HCl), затем 4 раза 0,5 объема насыщенного водного раствора бикарбоната натрия и один раз солевым раствором. Затем слой этилацетата сушили с помощью сульфата магния, фильтровали и удаляли растворитель на роторном испарителе. Неочищенный продукт подвергали анализу посредством 1Н ЯМР (фиг. 1а и 2а) и газовой хроматографии в сочетании с масс-спектрометрией (фиг. 1b и 2b). Был определен чистый (>95%) продукт, содержащий в качестве основной загрязняющей примеси пиридин, который затем удаляли под вакуумом.
ПРИМЕР 2 - Синтез ацилзамещенного гексил-β-гидроксибутирата
Схема 4
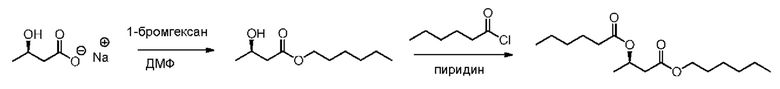
[00175] Как представлено на схеме 4, β-гидроксибутират натрия (1 молярный эквивалент) суспендировали в сухом диметилформамиде до концентрации 0,2 моль/л. Добавляли 1-бромгексан (0,7 молярного эквивалента), реакционную колбу герметично закрывали и нагревали до 60°С при перемешивании в течение 18 ч, за это время реакционная смесь становилась прозрачной. Затем смесь охлаждали и помещали в делительную воронку и разбавляли 1,5 объемами этилацетата (из расчета на объем реакционной смеси). Затем смесь промывали пять раз 0,5 объема насыщенного водного раствора бикарбоната натрия и один раз солевым раствором. Затем слой этилацетата сушили с помощью сульфата магния, фильтровали и удаляли растворитель на роторном испарителе. Неочищенный продукт подвергали анализу посредством 1Н ЯМР и ГХ-МС. Был определен чистый (>95%) продукт, содержащий в качестве основной загрязняющей примеси 1-бромгексан, который затем удаляли под вакуумом.
[00176] Далее полученный продукт, гексил-β-гидроксибутират, растворяли в пиридине до концентрации 0,2 моль/л. Раствор помещали в атмосферу азота и охлаждали до 0°С. К раствору по каплям с помощью шприца добавляли соответствующий ацилхлорид (2 молярных эквивалента) при перемешивании. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь помещали в делительную воронку и разбавляли 1,5 объемами этилацетата (из расчета на объем реакционной смеси). Затем смесь промывали пять раз 0,5 объема раствора соляной кислоты (10%), затем четыре раза 0,5 объема насыщенного водного раствора бикарбоната натрия и один раз солевым раствором. Затем слой этилацетата сушили с помощью сульфата магния, фильтровали и удаляли растворитель на роторном испарителе. Неочищенный продукт подвергали анализу посредством 1Н ЯМР (фиг. 3а) и ГХ-МС (фиг. 3b). Был определен чистый (>95%) продукт, содержащий в качестве основной загрязняющей примеси пиридин, который затем удаляли под вакуумом.
Сложные эфиры 1,3-бутандиола
[00177] Сложные эфиры 1,3-бутандиола согласно настоящему описанию могут быть получены методами синтеза, в общем виде представленными ниже:
Схема 5
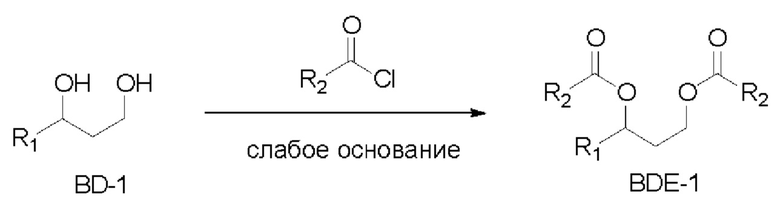
[00178] Согласно схеме 5, гидроксильные группы 1,3-бутандиола BD-1 депротонируют под действием слабого основания (например, пиридина) и подвергают реакции с по меньшей мере 2 эквивалентами замещенного ацилхлорида с получением гомо-ацилзамещенного сложного эфира 1,3-бутандиола BDE-1. R1 может представлять собой Н или замещенный или незамещенный С(1-6) алкил; R2 представляет собой замещенный или незамещенный С(4-30) алкил.
Схема 6
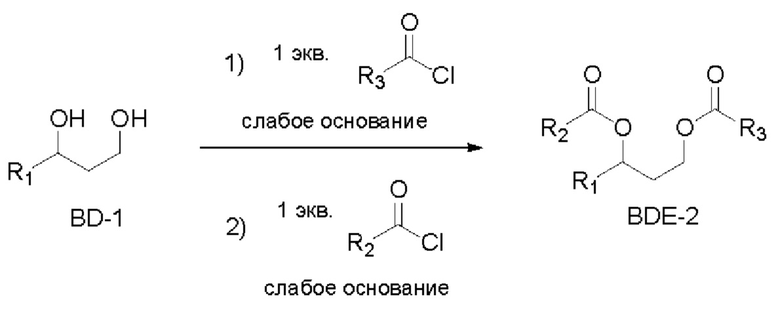
[00179] Согласно схеме 6, каждую гидроксильную группу 1,3-бутандиола BD-1 постадийно депротонируют под действием слабого основания (например, пиридина) и подвергают реакции с 1 эквивалентом первого замещенного ацилхлорида и 1 эквивалентом второго замещенного ацилхлорида с получением гетеро-ацилзамещенного сложного эфира 1,3-бутандиола BDE-2. R1 может представлять собой Н или замещенный или незамещенный С(1-6) алкил; R2 и R3 независимо представляют собой замещенный или незамещенный С(4-30) алкил.
ПРИМЕР 3 - Синтез ацилзамещенного R-1,3-бутандиола
Схема 7
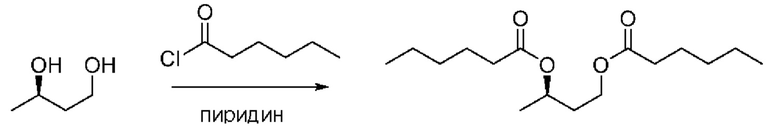
[00180] Как представлено на схеме 7, R-1,3-бутандиол (1 молярный эквивалент) растворяли в пиридине до концентрации 0,2 моль/л. Раствор помещали в атмосферу азота и охлаждали до 0°С. К раствору по каплям с помощью шприца добавляли 3-3,5 молярных эквивалента соответствующего ацилхлорида (гексил, фигуры 4а-4b; октил, фигуры 5а-5b) при перемешивании. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь помещали в делительную воронку и разбавляли 1,5 объемами этилацетата (из расчета на объем реакционной смеси). Затем смесь промывали пять раз 0,5 объема раствора соляной кислоты (10%), затем четыре раза 0,5 объема насыщенного водного раствора бикарбоната натрия и один раз солевым раствором. Затем слой этилацетата сушили с помощью сульфата магния, фильтровали и удаляли растворитель на роторном испарителе. Неочищенный продукт подвергали анализу посредством 1Н ЯМР (фиг. 4а и 5а) и ГХ-МС (фиг. 4b и 5b). Был определен чистый (>95%) продукт, содержащий в качестве основной загрязняющей примеси пиридин, который затем удаляли под вакуумом.
ПРИМЕР 4 - Биологическая функция увеличения концентрации ВНВ в крови самцов мышей C57BL/6 дикого типа
Материалы и методы
[00181] С6 и С8 сложные эфиры бутандиола и С6 и С8 сложные эфиры β-гидроксибутирата были синтезированы, как описано выше, и очищены для исследования на самцах мышей C57BL/6Ncrl дикого типа, полученных от компании Charles River Laboratories. Возраст мышей на момент эксперимента составлял 8 месяцев. Биологическую функцию С6 и С8 сложных эфиров бутандиола и β-гидроксибутирата определяли путем внутрибрюшинной инъекции двух доз каждого, 50 мкл и 100 мкл. Введение осуществляли примерно в 9 часов утра (мышей содержали в условиях 12-часового цикла чередования света и темноты со сменой фазы в 7 часов утра и в 7 часов вечера), и мыши в любое время имели доступ к пище и воде. Молярное количество, вводимое посредством инъекции, находилось в диапазоне от 0,13 до 0,41 ммоль в зависимости от соединения и дозы. Масса тела исследуемых мышей составляла примерно 30 граммов, соответственно, количество вводимого соединения находилось в диапазоне примерно от 1 г/кг до 3 г/кг. Для сравнения, эти количества теоретически могли бы обеспечить примерно 1/20 от суточной потребности в калориях для мышей - для людей эта величина эквивалентна примерно 100 килокалориям. Кровь забирали с помощью дистального надреза хвоста непосредственно перед инъекцией (исходный уровень) и через 30 мин, 1 ч, 2 ч, 4 ч и 6 ч после инъекции. Примерно 40 мкл крови собирали в микропробирки для взятия капиллярной крови, содержащие литий-гепарин (Sarstedt CB-300LH), и затем центрифугировали в течение 15 мин при 1500 x g при 4°С для отделения плазмы. Концентрацию ВНВ в плазме определяли посредством колориметрического ферментативного анализа (Stanbio Laboratory 2440-058).
Результаты
[00182] Все соединения увеличивали концентрацию ВНВ в крови (фиг. 6а-6с). Соединения С6-ВНВ и С8-ВНВ в обеих исследованных дозах увеличивали концентрацию ВНВ до значений, наблюдаемых при кетогенной диете (0,5-2 мМ) или после ночного голодания (1-3 мМ) у соответствующих мышей (фиг. 6а). Единственным наблюдаемым побочным эффектом была умеренная седация при более высокой дозе С6-ВНВ. Потребление калорий с пищей не определяли, но 6-часовое голодание не приводило к значительному увеличению концентрации ВНВ в крови (фиг. 6с), следовательно, увеличение, наблюдаемое в результате введения соединений, не было обусловлено непреднамеренным голоданием. Важно отметить, что увеличение концентрации ВНВ в крови было большим, чем в случаях введения такой же молярной дозы ВНВ (фиг. 6с) или BD (фиг. 6b) отдельно, и этот факт свидетельствует о том, что компоненты соединения - жирная кислота и BHB/BD - обладают ожидаемыми независимыми и взаимодополняющими активностями в отношении увеличения концентрации ВНВ в крови. В целом, эти данные показывают, что новым сложноэфирным соединениям жирных кислот и BHB/BD присуща ожидаемая биологическая функция в отношении увеличения концентрации ВНВ в крови, в некоторых случаях до такой же степени, как при ночном голодании и при голодании в течение нескольких часов.
ПРИМЕР 5 - Кетогенная диета резко подавляет возникновение эпилептиформных спайков у мышей APPJ20
Материалы и методы
[00183] Кетогенную диету и ночное голодание исследовали для определения подавления возникновения эпилептиформных спайков у мышей APPJ20 в возрасте одного года. Мыши APPJ20 являются носителями гена АРР человека, содержащего несколько мутаций, которые вызывают болезнь Альцгеймера у людей. Были исследованы мыши-гетерозиготы, несущие трансген АРР, по сравнению с нетрансгенными (НТГ) однопометными животными дикого типа. У этих мышей наблюдают ранние и тяжелые когнитивные нарушения, а также характерные эпилептиформные спайки на электроэнцефалограммах (ЭЭГ), которые способствуют развитию их когнитивных нарушений. Сокращение числа эпилептиформных спайков посредством генетических манипуляций или применения противоэпилептического лекарственного средства леветирацетама связано с когнитивными улучшениями. Во всех исследованиях, описанных в настоящем раскрытии, использовали как самцов, так и самок мышей, и данные представлены в виде обобщенных результатов для всех мышей за исключением случаев, в которых мыши были специфически стратифицированы по полу. В случаях, когда результаты были стратифицированы по полу, различий не наблюдали за исключением специально отмеченных случаев. Мыши и указанная эпилептиформная активность подробно описаны в Palop et al., Neuron 2007, 55:697-711.
[00184] В этом исследовании использовали когорту мышей, наблюдаемых в течение длительного времени, которых подвергали серийным 23-часовым ЭЭГ, регистрируемым для трех состояний: первого, исходного уровня при нормальной контрольной диете; второго, через два дня после начала кетогенной диеты (КД); третьего, во время ночного голода. Мыши получали контрольную диету в течение восьми недель до ЭЭГ для исходного уровня и в течение трех недель между ЭЭГ для КД и голодания. Контрольная диета была основана на AIN-93M, включая 10% калорий из белка и 78% калорий из углеводов. Кетогенная диета содержала 90% калорий из жира и не содержала углеводов, но, с другой стороны, соответствовала контрольной диете с точки зрения калорийности. Диеты были специально приготовлены в соответствии со спецификациями Harlan-Teklad (в настоящее время Envigo). Потребление калорий и концентрации ВНВ в крови были стабильными в течение двух дней после перехода на КД, и эта КД и голодание приводили к схожим концентрациям ВНВ в крови, составляющим 1-2 мМ.
[00185] Во время регистрации ЭЭГ мыши свободно передвигались в одном из четырех прозрачных пластиковых цилиндров размером примерно с домашнюю клетку. Для регистрации ЭЭГ и для автоматического детектирования островолновых спайков использовали программное обеспечение Harmonie Stellate. Во время сеансов ЭЭГ мышей также записывали на видео и использовали программное обеспечение Noldus Ethovision для количественной оценки движения. Необработанные данные по числу движений были очищены с целью устранения отражения или других артефактов, затем проводили анализ данных. Мощность гамма-ритма, определяемую как мощность, регистрируемую на ЭЭГ в диапазоне 20-80 Гц, количественно определяли с использованием программного обеспечения LabChart. Анализ данных проводили с использованием программы GraphPad Prism и специально разработанных программ на Perl. Методология проведения ЭЭГ, регистрации данных и анализа данных подробно описана в Verret et al., Cell 2012, 149:708-721.
Результаты
[00186] На фигурах 7а-7h показано, что кетогенная диета, в отличие от голодания, приводила к стабильному сокращению числа эпилептиформных спайков у мышей APPJ20. Как показано на фигуре 7а, 23-часовая ЭЭГ, зарегистрированная через 2 дня после начала КД, демонстрировала ~30% снижение среднего числа спайков по сравнению с предшествующим исходным уровнем при контрольной диете, от 2,13 спайка/мин до 1,48 спайка/мин. Мыши, подвергнутые ночному голоданию, в среднем не показали изменений. На фигуре 7b показано общее число спайков в час за 23 часа регистрации, которое демонстрирует, что подавление возникновения спайков было стабильным на протяжении всей 23-часовой регистрации. На фигуре 7с показано сокращение числа спайков у отдельных мышей, нормированное к зарегистрированному исходному уровню каждой мыши (закрашенные кружки, Р<0,05; столбец = медиана). У 6 из 9 мышей наблюдали общее сокращение числа спайков при КД, при этом ни у одного животного не было увеличения по сравнению с исходным уровнем. Напротив, несмотря на то, что голодание приводило к сокращению числа спайков у некоторых мышей, оно увеличивало это число у других, что являлось причиной отсутствия изменений в среднем.
ПРИМЕР 6 - Подавление возникновения спайков за счет кетогенной диеты не зависит от функции вставочных нейронов
Материалы и методы
[00187] Кетогенную диету и ночное голодание использовали для исследования механизма подавления возникновения эпилептиформных спайков за счет кетогенной диеты у мышей APPJ20 в возрасте одного года. Когорта мышей, наблюдаемых в течение длительного времени, которых подвергали серийным 23-часовым ЭЭГ, описана выше в примере 5. Методология сбора и анализа данных также описана выше в примере 5. Данные по числу движений, данные по мощности гамма-ритма и данные по числу спайков были сопоставлены в промежутках времени длительностью в одну минуту для изучения мгновенных взаимосвязей между исследовательским поведением, тормозным гамма-ритмом вставочных нейронов и числом спайков.
Результаты
[00188] Исследовательское поведение связано с подавлением возникновения эпилептиформных спайков за счет увеличения мощности тормозного гамма-ритма парвальбумин-положительных интернейронов (Verret et al., Cell 2012, 149:708-721). Три возможных механизма, посредством которых КД может подавлять возникновение спайков, могут заключаться в увеличении выраженности исследовательского поведения, усилении индукции гамма-ритма на заданном уровне исследовательского поведения или увеличении мощности гамма-ритма на исходном уровне. Общее количество движений было схожим в условиях всех трех диет (фиг. 7d), и, таким образом, увеличение исследовательской активности не объясняло подавление возникновения спайков за счет КД. Относительная мощность гамма-ритма также была схожей в условиях трех диет (фиг. 7е). На фиг. 7f представлены наиболее точные прямые линейной регрессии с 95% ДИ для диаграмм рассеяния числа спайков и движений в минуту. Мыши APPJ20 обычно характеризуются меньшим числом спайков при более выраженном исследовательском поведении; КД была связана с подавлением возникновения спайков при всех степенях выраженности движения (фиг. 7f). На фиг. 7g представлены наиболее точные прямые линейной регрессии с 95% ДИ для диаграмм рассеяния нормированного гамма-ритма и движений в минуту, показывающие отсутствие изменений в скорости индукции гамма-ритма при движении в случае КД. Другими словами, скорость увеличения гамма-ритма при движении была схожей в случаях контрольной диеты и КД (фиг. 7g). Наконец, общая средняя мощность гамма-ритма у большинства мышей, получавших КД, оставалась неизменной и не была связана с изменением числа спайков (фиг. 7h). В целом, КД, по-видимому, оказывает эффект либо независимо от функции парвальбумин-положительных интернейронов, либо этот эффект обусловлен нижележащим по отношению к пресинаптическим потенциалам, которые генерируют гамма-ритм в этой популяции нейронов, процессами.
ПРИМЕР 7 - Долгосрочная кетогенная диета сокращает число спайков и обеспечивает когнитивные улучшения
Материалы и методы
[00189] Долгосрочную стабильность подавления возникновения эпилептиформных спайков на КД и наличие связи между подавлением возникновения спайков и когнитивными улучшениями определяли следующим образом. Группы мышей APPJ20 в возрасте одного года (эти мыши описаны в примере 5) получали либо контрольную диету, либо КД (диеты описаны в примере 5), и за животными осуществляли наблюдение в течение трех месяцев. Мышей подвергали семи 50-минутным сессиям регистрации ЭЭГ во второй половине указанного периода времени (методология регистрации ЭЭГ описана в примере 5). Кроме того, мышей подвергали привыканию к открытому полю в течение первого месяца, в то время как две из сессий ЭЭГ, проведенные через две недели и пять недель после привыкания, служили в качестве пробных испытаний для проверки того, приведет ли ознакомленность с открытым полем в результате предшествующего привыкания к уменьшению исследовательской активности (фиг. 8а).
[00190] Привыкание к открытому полю является общим тестом на зрительно-пространственную память и когнитивную функцию (Verret et al., Cell 2012, 149:708-721). Мышей помещают в одну из четырех идентичных прозрачных пластиковых камер (40×40×30 см), которые снабжены двумя источниками световых лучей для измерения движения по осям X и Y по всему полу камеры, а также дополнительной парой источников, поднятых по оси Z, для детекции подъемов на задние лапы. Управление прибором осуществляют с использованием программного обеспечения Photobeam Activity System от компании San Diego Instruments. Анализ необработанных данных по пересечению лучей проводят с использованием специально разработанной программы. Данные по числу движений в открытом поле интегрируют с полученными при проведении ЭЭГ данными по числу спайков и мощности гамма-ритма с использованием специально разработанных программ. Нормальные мыши демонстрируют быстрое привыкание, поскольку их исследовательская активность быстро уменьшается при повторном помещении в открытое поле в течение дней или недель. Мыши APPJ20 демонстрируют нарушение привыкания, проявляющееся в том, что их исследовательская активность остается повышенной, несмотря на повторное помещение в открытое поле в течение дней или недель (Verret et al., Cell 2012, 149:708-721).
Результаты
[00191] На фигурах 8a-8h показано, что сокращение числа эпилептиформных спайков в результате КД продолжается в течение месяцев и связано с когнитивными улучшениями при привыкании к открытому полю. На фигуре 8а представлена временная шкала эксперимента. После демонстрации того, что КД приводит к подавлению возникновения эпилептиформных спайков в течение дней, следующих после ее начала, этот эффект оценивали, чтобы определить его стабильность при продолжении диеты в течение недель или месяцев и наличие связи между подавлением возникновения спайков и когнитивными улучшениями. На фигуре 8b показано, что долгосрочная КД приводила к стабильному сокращению числа эпилептиформных спайков в течение трех месяцев примерно на 40%, в среднем от 2,51 спайка/мин до 1,53 (фиг. 8b). На фигурах 8с и 8d показано, что возникновение спайков стабильно подавлялось при всех степенях выраженности движения (фиг. 8d) и за 50-минутный период регистрации (фиг. 8с), тогда как мыши, получавшие контрольную диету, позднее во время сеансов регистрации ЭЭГ демонстрировали большее число спайков в периоды низкой степени выраженности движения. Как и предполагали, мыши APPJ20, получавшие КД, демонстрировали пониженную исследовательскую активность при повторном помещении в открытое поле после предварительного привыкания. В целом степени выраженности движения были схожими с таковыми для нетрансгенных контрольных животных (дикого типа) (фиг. 8е и 8f), как и более специфическое исследовательское поведение, такое как движения в центральной зоне (в противоположность периферии) открытого поля (фиг. 8g) и подъемы на задние лапы (фиг. 8h). Трансгенные мыши APPJ20, получавшие контрольную диету, напротив, продолжали демонстрировать гиперактивность и высокую степень выраженности исследовательского поведения (фиг. 8e-h).
[00192] Предыдущее исследование с регистрацией 23-часовых ЭЭГ проводили в течение длительного времени (пример 5), при этом ЭЭГ регистрировали для одних и тех же мышей, получавших как контрольную диету, так и КД, но в настоящем более долгосрочном исследовании мышей в силу необходимости разделяли на отдельные группы в соответствии с диетой. С целью подтверждения того, что единичные отклонения в числе спайков у мышей APPJ20 не объясняли различия в числе эпилептиформных спайков между группами, получавшими разные диеты, в течение дней или недель, было проведено второе долгосрочное исследование. Группа мышей поочередно получала контрольную диету и КД с регистрацией четырех 50-минутных ЭЭГ во время каждой диеты. В этом случае мыши также демонстрировали значительное подавление возникновения эпилептиформных спайков в период получения КД более чем на 50% при том же отсутствии взаимосвязи между исследовательской активностью и числом спайков, замеченном ранее.
ПРИМЕР 8 - Длительная кетогенная диета связана с ожирением, выживаемостью самцов и улучшенной обучаемостью
Материалы и методы
[00193] Когнитивные улучшения, выживаемость самцов и ожирение, обусловленные длительной кетогенной диетой, исследовали на мышах APPJ20 в возрасте одного года.
[00194] Проведение этого шестимесячного исследования начинали на мышах APPJ20 (мыши подробно описаны в примере 5) и однопометных нетрансгенных контрольных мышах (дикого типа), находящихся в возрасте 2 месяцев. Цель исследования заключалась в получении ответов на три вопроса: 1) имеет ли получаемая мышами долгосрочная КД неблагоприятные метаболические эффекты, такие как ожирение; 2) приведет ли КД к снижению ранней смертности, часто наблюдаемой у мышей APPJ20, уровень которой можно уменьшить с помощью других методов лечения, обеспечивающих подавление возникновения эпилептиформных спайков; и 3) будут ли мыши APPJ20, получающие КД, демонстрировать улучшение в других зрительно-пространственных тестах для оценки когнитивной функции? Используемые в исследовании диеты описаны в примере 5.
[00195] Водный лабиринт Морриса представляет собой распространенный тест для оценки зрительно-пространственной памяти. Лабиринт состоит из неглубокой ванны (диаметром 122 см), наполненной водой, которой придают непрозрачность с помощью порошкообразной белой краски. На стены комнаты помещают большие высококонтрастные зрительные ориентиры. Мышей приучали к комнате и к бассейну с водой за день до начала эксперимента. Протокол эксперимента состоял из шести дней тренировочных (обучающих) испытаний с последующим пробным испытанием (проверкой памяти) через 24 ч после последнего тренировочного испытания. Во время тренировочных испытаний платформу площадью 14×14 см погружали немного ниже поверхности воды. Во время повторных 60-секундных испытаний мыши учились определять местоположение скрытой платформы с помощью находящихся в комнате зрительных ориентиров. В процессе тренировок положение платформы оставалось постоянным, в то время как точку входа для мышей меняли полупроизвольным образом между испытаниями. В последний день платформу снимали для проведения пробного испытания. Движение мышей контролировали с помощью программного обеспечения для отслеживания движения на видеозаписи Ethovision (Nolus). Эффективность в тренировочных испытаниях оценивали по скорости определения мышами местоположения платформы во время каждого испытания. Эффективность в пробном испытании оценивали по доле времени, в течение которого мыши пребывали в правильном квадранте бассейна, где ранее была расположена платформа. После завершения этого 7-дневного экспериментального протокола меняли местоположение платформы. Затем мышей подвергали 3-дневному «воспроизведению навыка» при этом новом местоположении, после чего проводили повторное пробное испытание со снятой платформой через 24 ч после последнего тренировочного испытания.
Результаты
[00196] На фигурах 9a-9h показано, что долгосрочная кетогенная диета приводила к улучшению когнитивных функций, а также, в случае самцов, выживаемости. На фигуре 9а показаны изменения массы тела у мышей APPJ20 и НТГ при КД или контрольной диете, начатых в возрасте 2 месяцев. КД по существу приводила к развитию ожирения и у мышей APPJ20, и у НТГ мышей, вызывая значительное увеличение массы тела. На фигуре 9b показаны концентрации ВНВ в плазме, представляющие собой среднее из шести утренних определений, проводимых примерно каждые две недели с начала исследования. Обе группы демонстрировали наличие ВНВ в плазме в концентрации, которая в среднем составляла ~ 1 мМ в течение шестимесячного периода и, как правило, была выше на ранних стадиях. Эти концентрации были примерно в 10 раз выше, чем у мышей, получавших контрольную диету. Концентрации глюкозы в плазме были схожими во всех группах. Самцы во всех группах имели большую массу тела, чем самки, и у самок была несколько более высокая концентрация ВНВ при КД.
[00197] Фигуры 9с и 9d представляют собой кривые выживаемости самцов и самок мышей APPJ20 при КД по сравнению с контрольной диетой. Не было зарегистрировано случаев смерти среди НТГ мышей. У мышей APPJ20 ранняя смертность достигала 40%, что, предположительно, являлось следствием летальных судорожных припадков. Была обнаружена тенденция к снижению смертности, и стратификация по полу показала, что эта тенденция обусловлена значительным снижением более высокого уровня смертности самцов мышей; выживаемость самок, будучи высокой, не изменялась (фиг. 9с и 9d).
[00198] На фигурах 9e-9h показаны результаты тестов с водным лабиринтом Морриса, проведенных через три месяца после начала диет, когда возраст выживших животных составлял 5 месяцев. Мыши АРР при КД демонстрировали значительно улучшенную эффективность в фазе тренировки (обучения) со скрытой платформой в водном лабиринте (фиг. 9е). Это улучшение оставалось неизменным при изменении местоположения платформы (воспроизведение навыка, фиг. 9g). Однако во время фазы пробных испытаний/проверки памяти в водном лабиринте не наблюдали различий в эффективности ни после первоначального обучения со скрытой платформой, ни после воспроизведения навыка (фиг. 9f и 9h).
ПРИМЕР 9 - Кетогенные соединения подавляют возникновение спайков при нормальной диете
Материалы и методы
[00199] С6 и С8 сложные эфиры бутандиола и С6 и С8 сложные эфиры β-гидроксибутирата были синтезированы, как описано выше. С6 сложный эфир β-гидроксибутирата исследовали на эффективность подавления возникновения спайков у мышей APPJ20 путем внутрибрюшинной инъекции мышам APPJ20 в возрасте 1-2 лет, среди которых были как самцы, так и самки. Мыши APPJ20 описаны в примере 5.
[00200] Регистрацию ЭЭГ у мышей APPJ20 осуществляли до и после внутрибрюшинной инъекции С6-ВНВ или эквивалентного объема физиологического раствора. После завершения первой 50-минутной регистрации выполняли инъекцию. Затем мышей оставляли для восстановления в их домашней клетке на 20 минут, после чего проводили вторую 50-минутную регистрацию ЭЭГ. Кровь забирали непосредственно после завершения второго сеанса ЭЭГ для измерения концентрации ВНВ в плазме (как описано в примере 4). Вводили меньшую из двух ранее исследованных доз согласно примеру 4 в объеме 50 мкл на 30 г массы тела, что составляет примерно 1,5 г/кг и примерно 0,2 миллимоль.
[00201] Во время регистрации ЭЭГ мыши свободно передвигались в одном из четырех прозрачных пластиковых цилиндров размером примерно с домашнюю клетку. Методология регистрации и анализа ЭЭГ и отслеживания движения на видеозаписи описана в примере 5. Методология забора крови и измерения содержания ВНВ в плазме описана в примере 4.
[00202] Для исследования использовали перекрестный дизайн, в соответствии с которым всем мышам вводили как С6-ВНВ, так и физиологический раствор в разные дни с промежутком времени между инъекциями, составляющим по меньшей мере 48 ч. Анализ данных был ограничен включением только тех мышей, для которых были выполнены все инъекции и регистрации ЭЭГ.
Результаты
[00203] На фигурах 10a-10f показано, что соединения согласно настоящему описанию, которые метаболизируются до ВНВ, незамедлительно вызывали сокращение числа эпилептиформных спайков. На фигуре 10а представлена структурная формула примера кетогенных соединений, содержащих сложный эфир среднецепочечной жирной кислоты, связанный с ВНВ. На фигуре 10b показано, что инъекция С6-ВНВ приводила к увеличению концентрации ВНВ в крови при определении примерно через 70-80 минут после инъекции (после ЭЭГ). Инъекция С6-ВНВ приводила к увеличению концентрации ВНВ в плазме от медианного значения, составляющего примерно 200 мкМ, до медианного значения, составляющего примерно 600 мкМ. На фигуре 10с показано, что инъекция С6-ВНВ приводила к сокращению числа спайков по сравнению как с исходным уровнем до инъекции, так и с инъекцией физиологического раствора. График среднего числа спайков в процессе 50-минутной регистрации ЭЭГ демонстрирует постепенное его сокращение после инъекции С6-ВНВ, подобно КД. С6-ВНВ вызывал сокращение числа эпилептиформных спайков примерно на 35% по сравнению с инъекцией физиологического раствора, от 1,25 спайка/мин до 0,82 спайка/мин. Анализ сокращения числа спайков после введения С6-ВНВ по сравнению с введением физиологического раствора на уровне отдельных мышей демонстрирует значительное сокращение числа спайков для большинства мышей (закрашенные кружки, Р<0,05; столбец = медиана) (фигура 10е). Различия в числе спайков, вызванные инъекциями С6-ВНВ и физиологического раствора, были наиболее выражены, когда мыши находились в состоянии покоя (и гамма-ритм был наименьшим), подобно КД (фигура 10f).
Краткое описание результатов ПРИМЕРОВ 6-9
[00204] Нарушение нормальной активности нейронной сети и связанные с этим эпилептиформные спайки от дисфункциональных тормозных интернейронов являются важными с точки зрения патогенеза снижения когнитивных функций в моделях болезни Альцгеймера у мышей. Способы лечения, приводящие к снижению числа эпилептиформных спайков, улучшают когнитивные функции в этих моделях. Кетогенную диету и голодание применяли для лечения некоторых форм эпилепсии, включая те из них, которые механически связаны с нарушением активности нейронной сети в моделях болезни Альцгеймера. Например, было обнаружено, что пониженная экспрессия субъединицы натриевого канала SCN1A является ключевым механизмом, приводящим к ранней смертности, эпилептиформным спайкам и когнитивным нарушениям у мышей APPJ20, а восстановление нормальной экспрессии облегчало эти дефекты (Verret et al., 2012). Существует группа генетических расстройств человека, сопровождающихся припадками, вызванных мутациями в гене SCN1A, включая синдром Драве, который часто не поддается лечению с применением обычных противоэпилептических лекарственных средств, но при котором может наблюдаться ответ на кетогенную диету (КД) (Korff et al., J Child Neurol 2007, 22:185). Мыши, несущие мутацию в гене SCN1A, также демонстрируют ответ на КД (Dutton et al., Epilepsia 2011, 52:2050). Были проведены исследования для установления того, может ли КД приводить к сокращению числа эпилептиформных спайков и улучшать таким образом когнитивную функцию в модели болезни Альцгеймера у мышей.
[00205] Кетогенная диета, в отличие от голодания, приводила к стабильному сокращению числа эпилептиформных спайков у мышей APPJ20 в модели болезни Альцгеймера. Это сокращение числа спайков не зависело от тормозной функции вставочных нейронов или было обусловлено нижележащим по отношению к ней процессами. Эффект сокращения числа спайков сохранялся в течение нескольких месяцев лечения. Долгосрочное лечение приводило к когнитивным улучшениям в тесте с водным лабиринтом и в тесте привыкания к открытому полю и также улучшало выживаемость самцов мышей APPJ20, которые имели более тяжелые поражения. Наконец, лечение соединениями согласно настоящему описанию, которые метаболизируются до кетонового тела β-гидроксибутирата, незамедлительно сокращало число эпилептиформных спайков до такой же степени, как и кетогенная диета. Согласно настоящему изобретению предложены агенты, увеличивающие содержание β-гидроксибутирата в крови или воздействующие на нижележащие мишени β-гидроксибутирата, для лечения болезни Альцгеймера посредством улучшения функции нейронной сети и уменьшения эпилептиформной активности.
ПРИМЕР 10 - Пилотное исследование с добавлением в пищу С6 сложного эфира β-гидроксибутирата
МАТЕРИАЛЫ И МЕТОДЫ
[00206] С6 сложный моноэфир β-гидроксибутирата был синтезирован, как описано выше, и очищен для проведения исследований на мышах. С6 сложный моноэфир β-гидроксибутирата смешивали с измельченной контрольной пищей (10% калорий из белка), представляющей собой ту же контрольную диету, которую использовали в описанных выше примерах, включающих кетогенную и контрольную диеты. Корм помещали в стеклянную емкость внутри клетки для животных в начале ночного цикла кормления, в 19:00. С6 сложный моноэфир β-гидроксибутирата смешивали с контрольной пищей в различных концентрациях (масс./масс.) для определения концентрации, которая была достаточной для повышения уровней ВНВ у мышей, n = 4 мыши/условия эксперимента (2 мыши на клетку). Все мыши представляли собой самцов C57BL/6 в возрасте 12 месяцев.
РЕЗУЛЬТАТЫ
[00207] На фигуре 11 представлено потребление калорий с пищей, содержащей различные концентрации С6 сложных эфиров β-гидроксибутирата, в зависимости от времени. Было обнаружено, что пища, содержащая 10% и 20% по массе С6 сложного моноэфира β-гидроксибутирата, была менее привлекательной на вкус для мышей и потреблялась с меньшей скоростью. Включение С6 сложного моноэфира β-гидроксибутирата в количестве 5% по массе не изменяло количество пищи, потребляемой мышами в течение первых 12 ч, относительно контрольной пищи.
[00208] На фигуре 12 представлено снижение массы тела у мышей после получения пищи, содержащей различные количества С6 сложного моноэфира β-гидроксибутирата, в зависимости от времени. Снижение массы тела у мышей, которые получали пищу, содержащую 2,5% и 5% по массе С6 сложных эфиров β-гидроксибутирата, не было связано с голоданием, поскольку в ходе исследования мыши потребляли нормальное количество пищи.
[00209] На фигуре 13 представлены концентрации глюкозы в крови мышей в ходе исследования с добавлением соединений в пищу. У мышей, потреблявших контрольную пищевую композицию, и у мышей, потреблявших пищу с различными количествами С6 сложного моноэфира β-гидроксибутирата, концентрация глюкозы в крови находилась в пределах нормального диапазона гликемии (минимум = 70 мг/дл; максимум = 180 мг/дл). У мышей, потреблявших пищу, содержащую 10% и 20% по массе С6 сложного моноэфира β-гидроксибутирата, обнаруживали снижение содержания глюкозы в крови в течение первых 12 часов. Наблюдения показали, что эти мыши потребляли небольшое количество пищи, содержащей 10% и 20% по массе С6 сложного моноэфира β-гидроксибутирата, в течение первых 12 ч. Без привязки к какой-либо конкретной теории, предполагается, что данное голодание приводило к снижению содержания глюкозы в крови в этих условиях. На фигуре 14 представлена концентрация β-гидроксибутирата в крови после получения мышами пищи, содержащей различные количества С6 сложного моноэфира β-гидроксибутирата, в зависимости от времени. Потребление пищи, содержащей 2,5% по массе или 5% по массе С6 сложного моноэфира β-гидроксибутирата, приводило к незначительному увеличению концентрации ВНВ в крови, но было недостаточным для обеспечения концентрации, превышающей целевой порог 500 мкМ. У мышей, получавших пищу, содержащую 10% или 20% по массе С6 сложного моноэфира β-гидроксибутирата, обнаруживали большее увеличение концентрации β-гидроксибутирата. Однако, без привязки к какой-либо конкретной теории, предполагается, что это повышение концентрации ВНВ, по-видимому, не являлось результатом использования более высокой концентрации С6 сложного моноэфира β-гидроксибутирата в пище, поскольку мыши потребляли очень малое количество такой пищи. Более вероятно, это увеличение объясняется тем, что мыши испытывали голод.
ПРИМЕР 11 - Пилотное исследование с добавлением в пищу сложных эфиров β-гидроксибутирата и бутандиола
МАТЕРИАЛЫ И МЕТОДЫ
[00210] Различные сложные эфиры β-гидроксибутирата и бутандиола были синтезированы, как описано выше, и очищены для проведения исследований на мышах. Сложные эфиры β-гидроксибутирата и бутандиола, которые добавляли в рацион мышей в этом исследовании, представляли собой следующие: 1) С8 сложные диэфиры бутандиола (C8×2-BD); 2) С8 сложные моноэфиры β-гидроксибутирата (С8-ВНВ); 3) С6 сложные диэфиры β-гидроксибутирата (С6×2-ВНВ); 4) С6 сложные моноэфиры β-гидроксибутирата (С6-ВНВ) и 5) С6 сложные диэфиры бутандиола (C6×2-BD). Также исследовали пищевые композиции с добавлением 1,3-бутандиола. Соединения в количестве 10% масс./масс. смешивали с измельченным обычным кормом (20% калорий из белка) для соответствия стандартному питанию в виварии. Пищу помещали в стеклянную емкость внутри клетки для животных, n = 2 мыши/условия эксперимента, всего 18 мышей. Все мыши представляли собой самцов C57BL/6 в возрасте 12 месяцев. Мышей помещали в индивидуальные клетки для более точного учета потребления калорий. Пищу меняли обратно на обычный корм (измельченный и помещенный в стеклянную емкость) в момент времени 72 ч.
РЕЗУЛЬТАТЫ
[00211] На фигуре 15 представлено потребление калорий с пищей, содержащей перечисленные выше сложные эфиры бутандиола и сложные эфиры β-гидроксибутирата, в зависимости от времени. В качестве контроля использовали обычный корм, не содержащий добавок. Также исследовали пищу, в которую добавляли 1,3-бутандиол, сложный эфир 6-углеродной жирной кислоты, связанной с 2-углеродной алкильной группой (С6), в качестве контроля для С6 сложного моноэфира β-гидроксибутирата и сложный эфир 6-углеродной жирной кислоты, связанной с 6-углеродной алкильной группой (С6×2), в качестве контроля для С6 сложного диэфира β-гидроксибутирата.
[00212] В зависимости от соединения, мышам требовалось от 2 до 4 дней для того, чтобы приспособиться к вкусу/запаху содержащего добавки корма и начать потребление пищи в нормальном количестве.
[00213] На фигуре 16 представлено снижение массы тела у мышей при потреблении пищевых композиций с добавлением различных сложных эфиров бутандиола и β-гидроксибутирата в зависимости от времени. Результаты показывают четкое различие между соединениями, вызывающими значительное снижение массы тела, и соединениями, вызывающими снижение массы тела, схожее с контролем. Мыши, потреблявшие пищу с добавлением С8 сложных диэфиров бутандиола, теряли примерно такое же количество массы тела, как и мыши, потреблявшие контрольную пищевую композицию, тогда как мыши, получавшие С6 сложные диэфиры β-гидроксибутирата, С6 сложные диэфиры бутандиола, С8 сложные моноэфиры β-гидроксибутирата и С6 сложные моноэфиры β-гидроксибутирата, демонстрировали значительное снижение массы тела. Без привязки к какой-либо конкретной теории, предполагается, что эти результаты можно объяснить не только различиями в количествах потребляемой пищи (например, потребление пищи, содержащей C6×2-BD, было нормальным, но снижение массы тела все же происходило). Без привязки к какой-либо конкретной теории, предполагается, что снижение массы тела у контрольных мышей можно объяснить меньшим потреблением пищи в начале эксперимента при адаптации к консистенции и размещению измельченного корма, а также более высокой потерей тепла в результате использования индивидуальных клеток.
[00214] На фигуре 17 представлены концентрации глюкозы в крови мышей в ходе исследования с добавлением соединений в пищу. У мышей, потреблявших контрольную пищевую композицию, и мышей, потреблявших пищу, содержащую различные типы сложных эфиров бутандиола и β-гидроксибутирата, концентрация глюкозы в крови находилась в пределах нормального диапазона гликемии (мин. = 70 мг/дл; макс. = 180 мг/дл). Некоторые из обнаруженных случаев гипогликемии можно объяснить голоданием ((С8-ВНВ) и С6), но другие (С6-ВНВ), вероятно, являются результатом введения соединения. Седативного эффекта не обнаруживали.
[00215] На фигуре 18 представлена концентрация β-гидроксибутирата в крови после получения мышами пищи, содержащей различные сложные эфиры бутандиола и β-гидроксибутирата, в зависимости от времени. Горизонтальная пунктирная линия обозначает целевой порог 500 мкМ. При интерпретации результатов следует учитывать эффект голодания. Например, высокое значение концентрации ВНВ для С8-ВНВ, скорее всего, является результатом голодания, а не результатом введения соединения. Распределение между днем и ночью также становилось очевидными через 48 ч, при этом концентрация ВНВ была высокой во время ночного цикла кормления и более низкой в течение дня. Без привязки к какой-либо конкретной теории, предполагается, что это суточное распределение согласуется с тем, что потребляемые соединения превращаются в организме в ВНВ во время цикла кормления.
ПРИМЕР 12 - Исследование с добавлением в пищу мышей С6 сложных диэфиров β-гидроксибутирата
МАТЕРИАЛЫ И МЕТОДЫ
[00216] На основании результатов описанных выше пилотных исследований, С6 сложные диэфиры β-гидроксибутирата были выбраны для более длительного исследования, включающего большее число мышей и проводимого для установления того, будут ли соединения оставаться кетогенными даже после нормализации потребления калорий с пищей. С6 сложные диэфиры β-гидроксибутирата были синтезированы, как описано выше, и очищены для проведения исследований на мышах. С6 сложные диэфиры β-гидроксибутирата в количестве 10% масс./масс. смешивали с измельченным обычным кормом (20% калорий из белка), который преобразовывали в гранулы. Повторно гранулированную пищу использовали с целью минимизации любых эффектов различий, возникающих в результате изменения консистенции корма до измельченного состояния.
[00217] Мыши потребляли гранулированный корм после помещения его в стеклянную емкость в клетке для животных. Исследовали по четыре мыши для каждого вида диеты, при этом мышей содержали в индивидуальных клетках. Все мыши представляли собой самцов C57BL/6 в возрасте 12 месяцев. Ежедневно контролировали массу тела и потребление калорий, и на восьмую ночь забирали кровь для определения концентрации глюкозы и β-гидроксибутирата. Мыши, получавшие пищу с добавлением С6 сложных эфиров β-гидроксибутирата, изначально поедали меньшее количество пищи, и у них наблюдалось снижение массы тела. К 7-ой ночи масса тела мышей стабилизировалась, и потребление калорий в течение 24 ч было одинаковым для мышей, получавших контрольную диету, и мышей, потреблявших пищу с добавлением С6 сложных эфиров β-гидроксибутирата. На восьмую ночь обе группы мышей потребляли схожее количество калорий в течение четырех часов между началом времени естественного кормления в 19:00 и временем забора крови, который начинали в 23:00.
РЕЗУЛЬТАТЫ
[00218] На фигуре 19 представлено сравнение концентрации β-гидроксибутирата в плазме, концентрации глюкозы в крови и потребление калорий у мышей, которые потребляли контрольную пищу, и мышей, которые потребляли пищу с добавлением 10% масс./масс. С6 сложных диэфиров β-гидроксибутирата. У мышей, получавших пищу с добавлением С6 сложных диэфиров β-гидроксибутирата даже в составе обычного рациона с нормальным потреблением калорий, были обнаружены более высокие концентрации β-гидроксибутирата в плазме, которые достигали целевого порога 500 мкМ.
[00219] Несмотря на то, что настоящее изобретение было описано со ссылкой на конкретные варианты его реализации, специалистам в данной области техники должно быть понятно, что могут быть сделаны различные изменения и замены эквивалентов без отступления от сущности и объема настоящего изобретения. Кроме того, могут быть сделаны многочисленные модификации для приведения конкретной ситуации, материала, состава вещества, процесса, стадии или стадий процесса в соответствие с сущностью и объемом настоящего изобретения. Все такие модификации входят в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОБРАЗУЕМЫЕ СРЕДНЕЦЕПОЧЕЧНЫМИ ЖИРНЫМИ КИСЛОТАМИ СЛОЖНЫЕ ЭФИРЫ БЕТА-ГИДРОКСИБУТИРАТА И БУТАНДИОЛА, И КОМПОЗИЦИИ И СПОСОБЫ НА ИХ ОСНОВЕ | 2017 |
|
RU2831011C1 |
| Композиции и способы, используемые для повышения и поддержания кетоза | 2014 |
|
RU2659386C2 |
| КЕТОГЕННАЯ КОМПОЗИЦИЯ | 2021 |
|
RU2769242C1 |
| СПОСОБ УЛУЧШЕНИЯ СТРУКТУРЫ И/ИЛИ ФУНКЦИЙ АРТЕРИОЛ | 2005 |
|
RU2414236C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ (II) | 1999 |
|
RU2242227C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МИКОБАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ С ПРИМЕНЕНИЕМ ТЕТРАЦИКЛИНОВЫХ СОЕДИНЕНИЙ | 2019 |
|
RU2831120C2 |
| БЛОКАДА ВОСПАЛИТЕЛЬНЫХ ПРОТЕАЗ ТЕТА-ДЕФЕНЗИНАМИ | 2012 |
|
RU2652605C2 |
| ЭФФЕКТИВНЫЙ СИНТЕЗ ХЕЛАТОРОВ ДЛЯ ЯДЕРНОЙ ТОМОГРАФИИ И РАДИОТЕРАПИИ: СОСТАВЫ И ПРИМЕНЕНИЕ | 2007 |
|
RU2512491C2 |
| Новые производные CYP-эйкозаноидов | 2015 |
|
RU2730512C2 |
| СОЕДИНЕНИЯ СУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ STAT5 | 2015 |
|
RU2707094C2 |
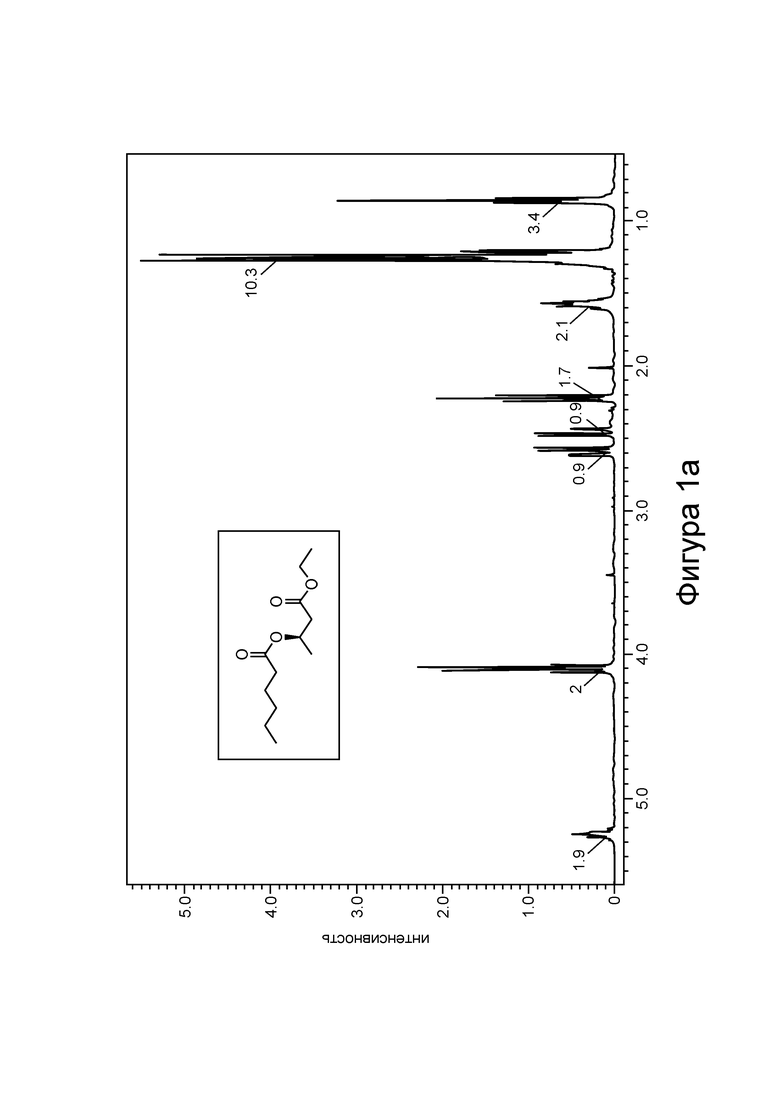
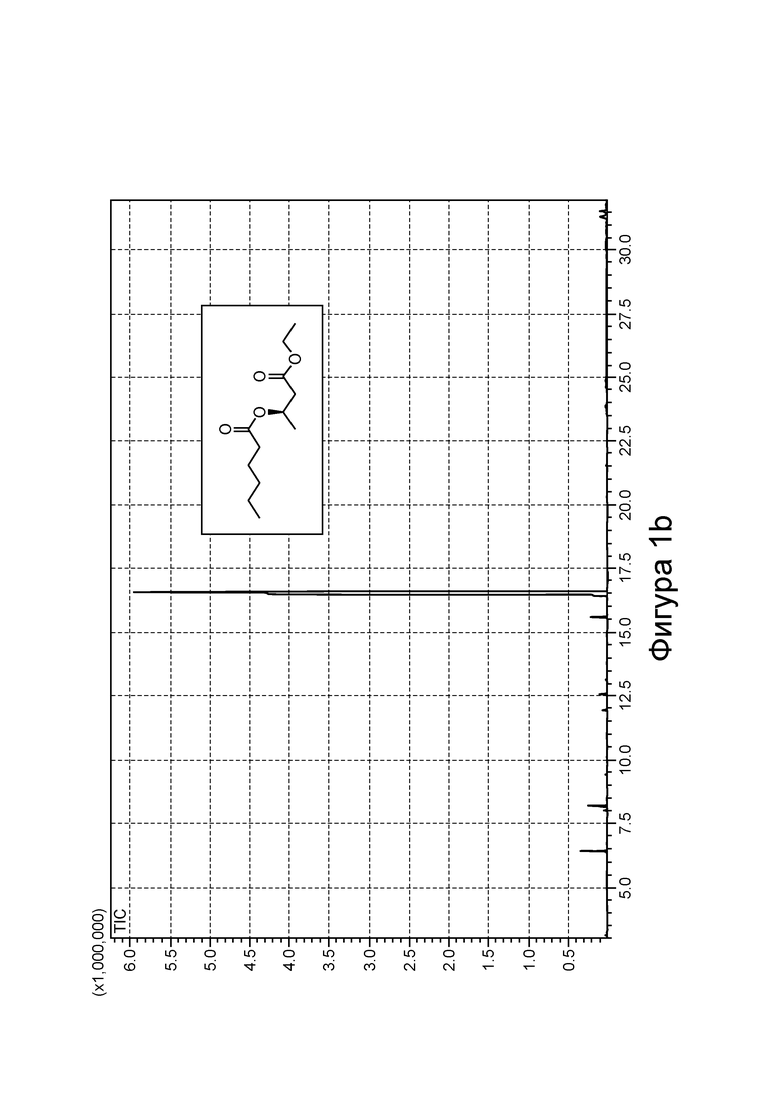
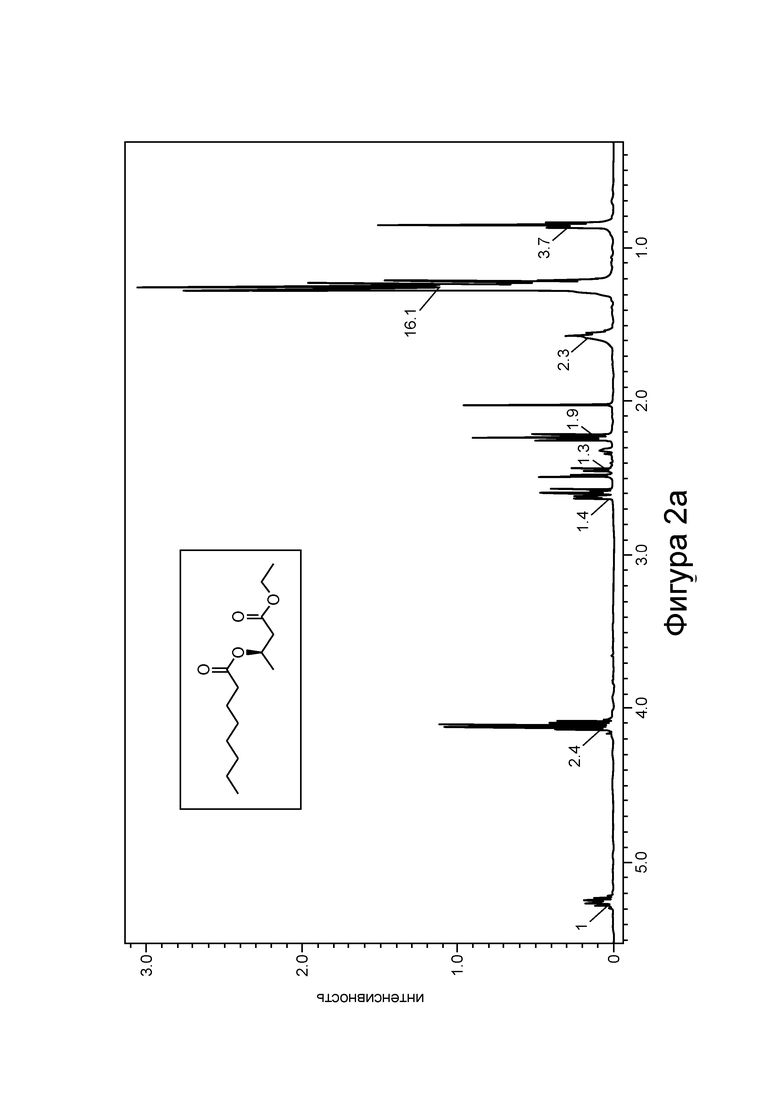
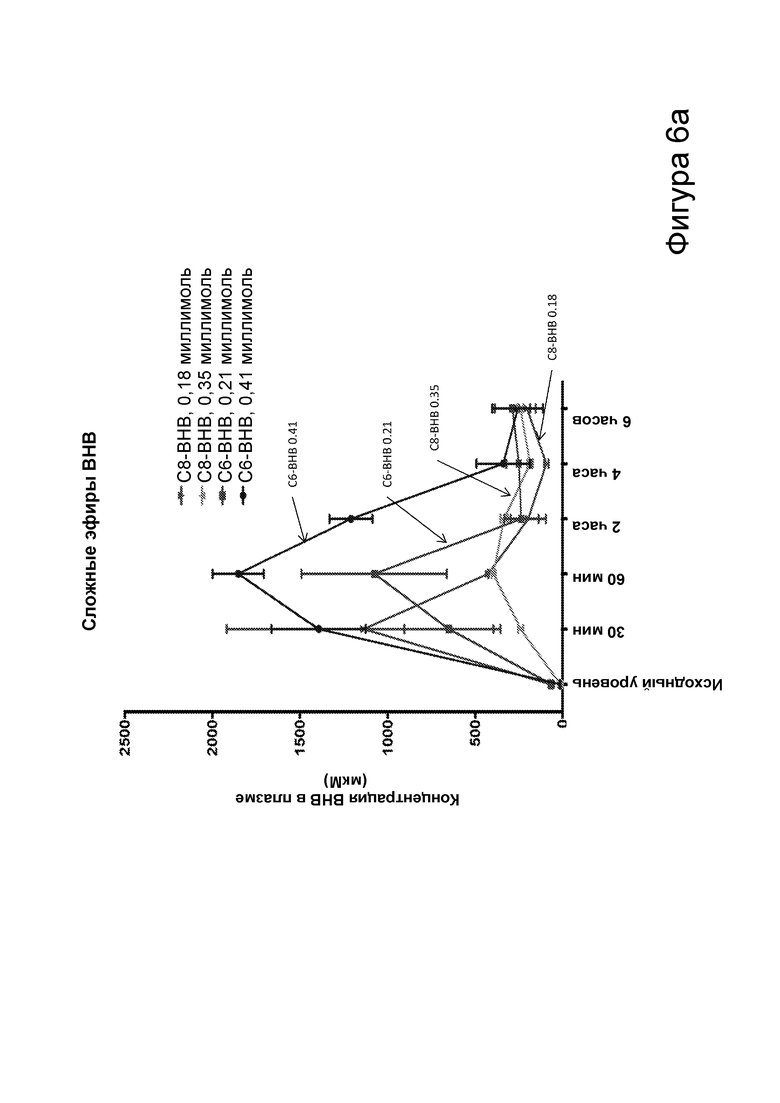
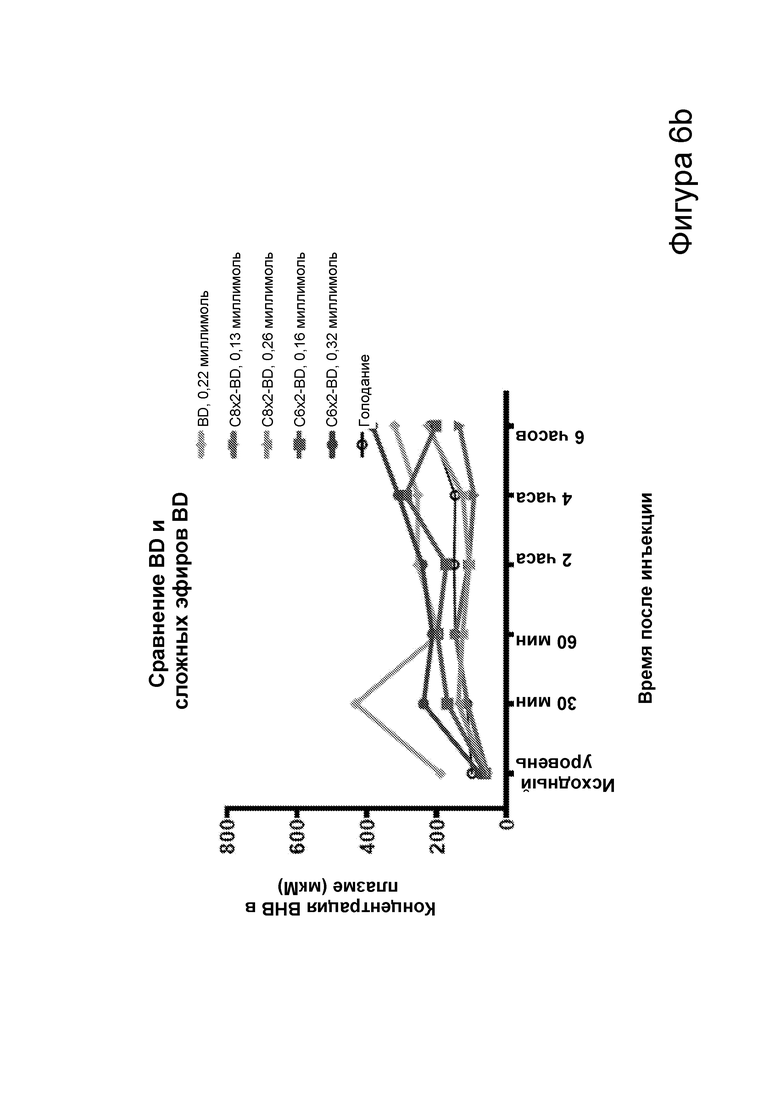
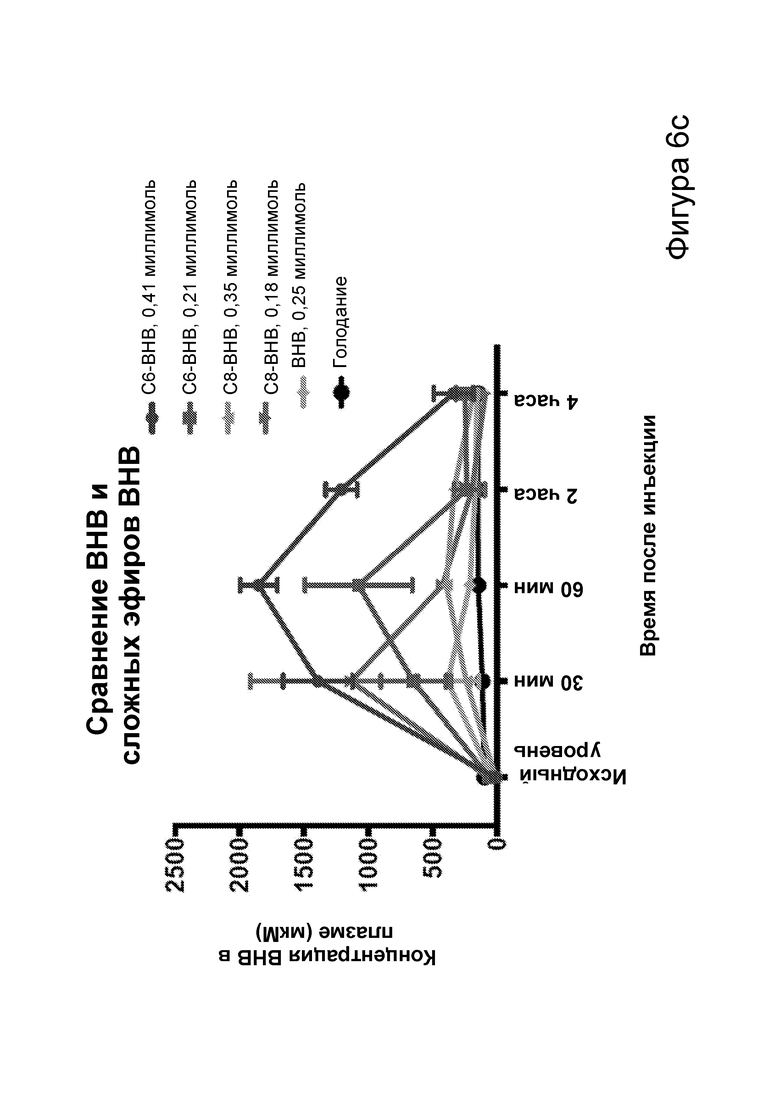
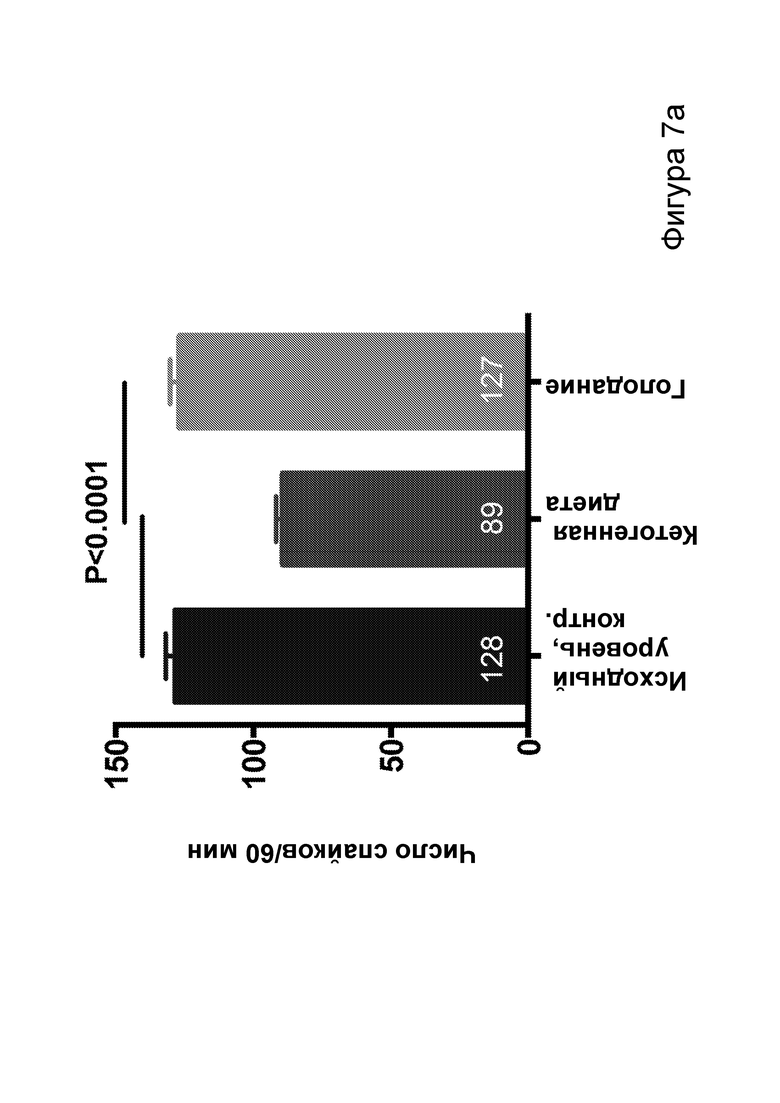
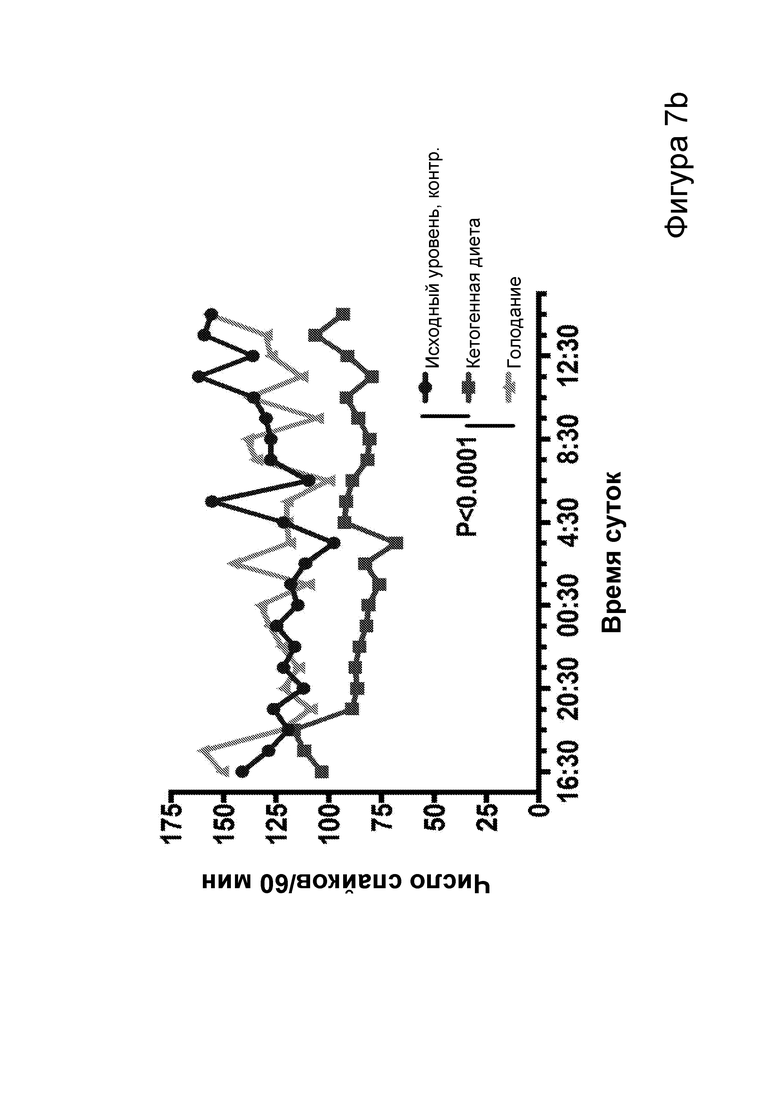
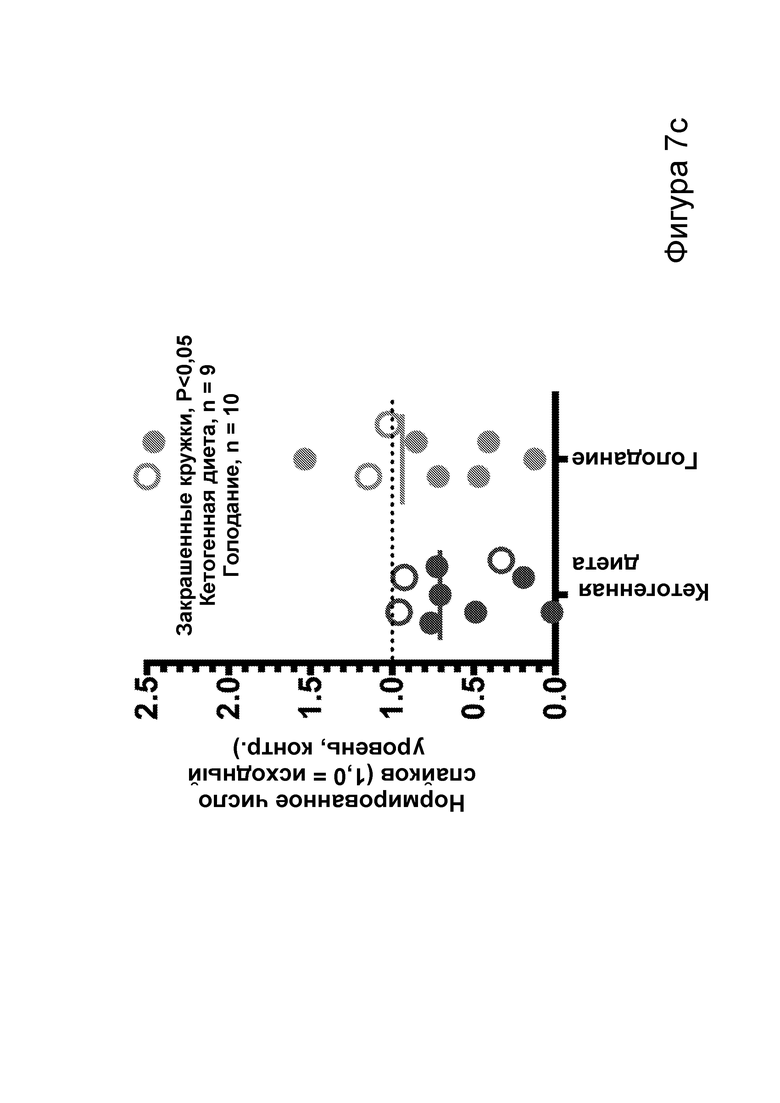
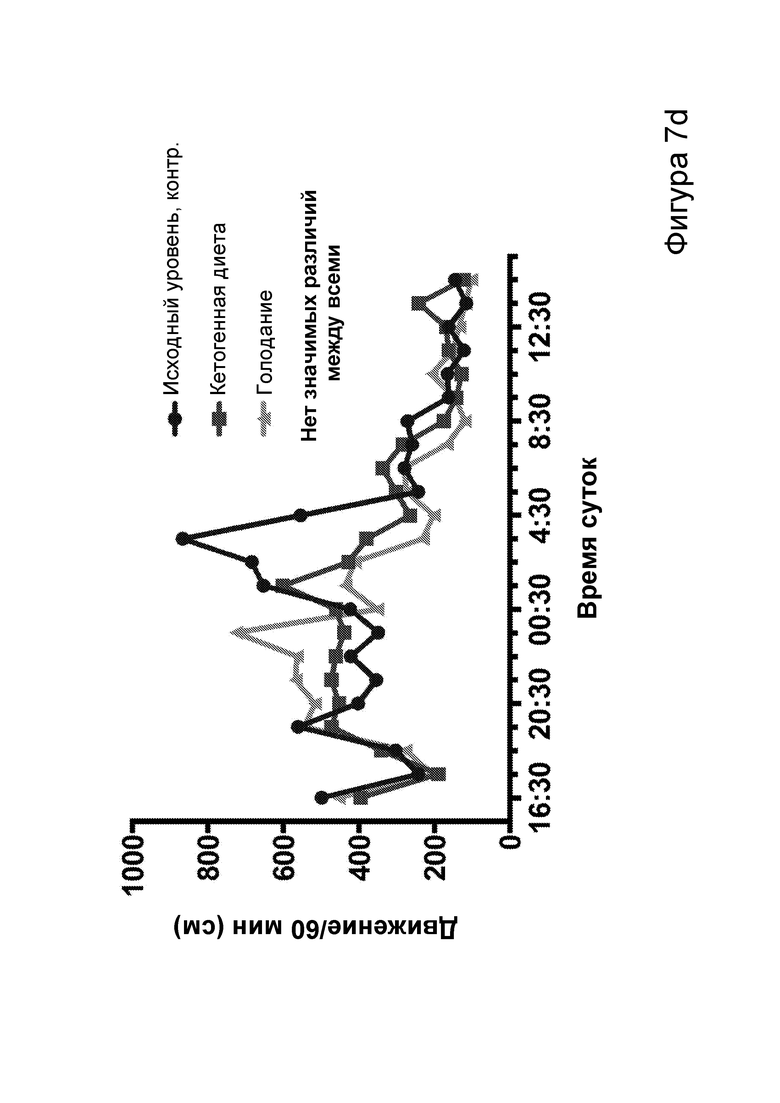
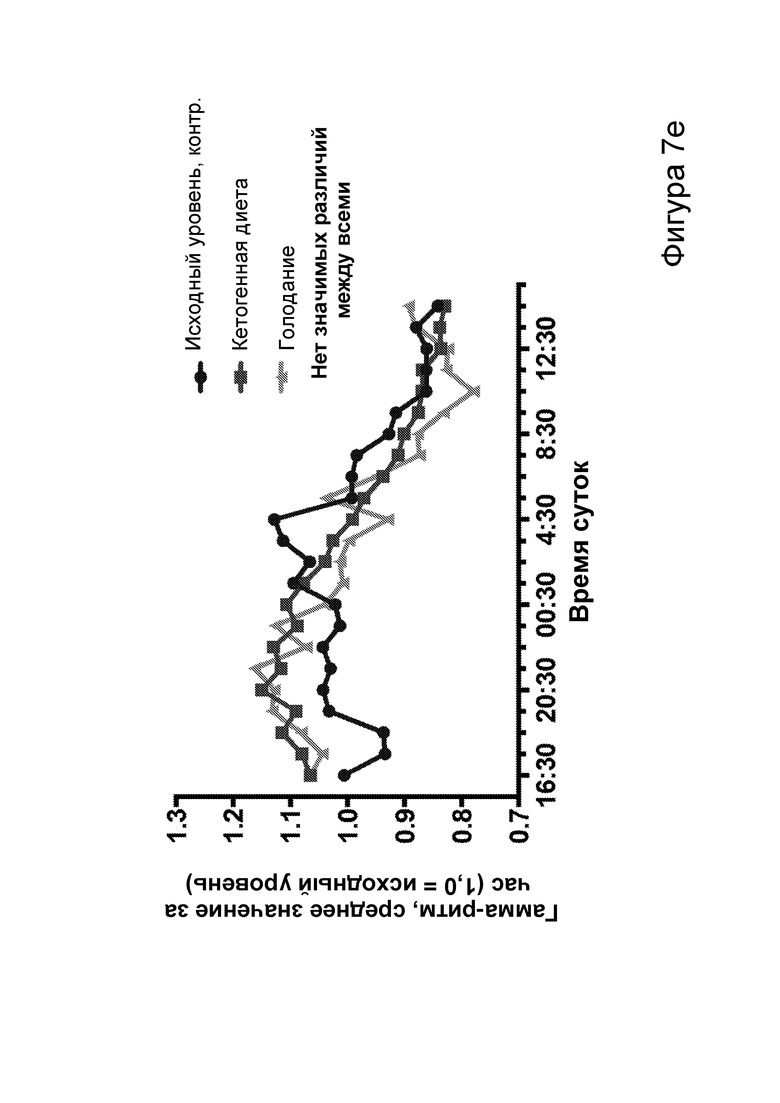
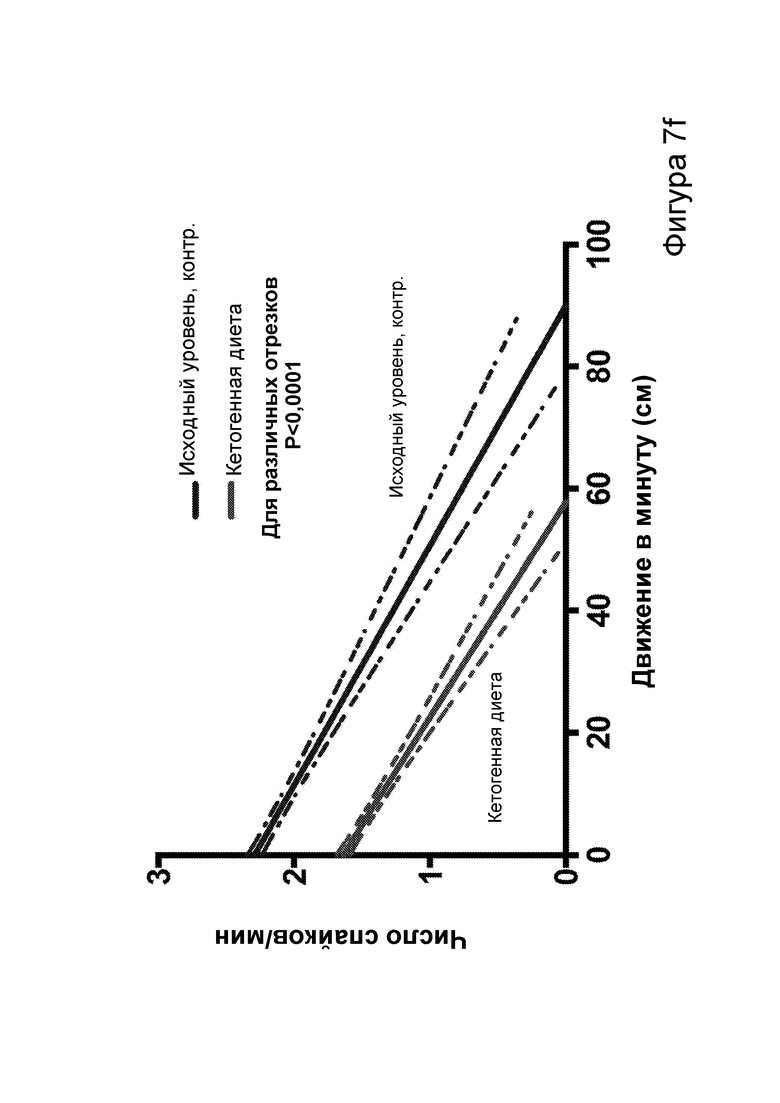
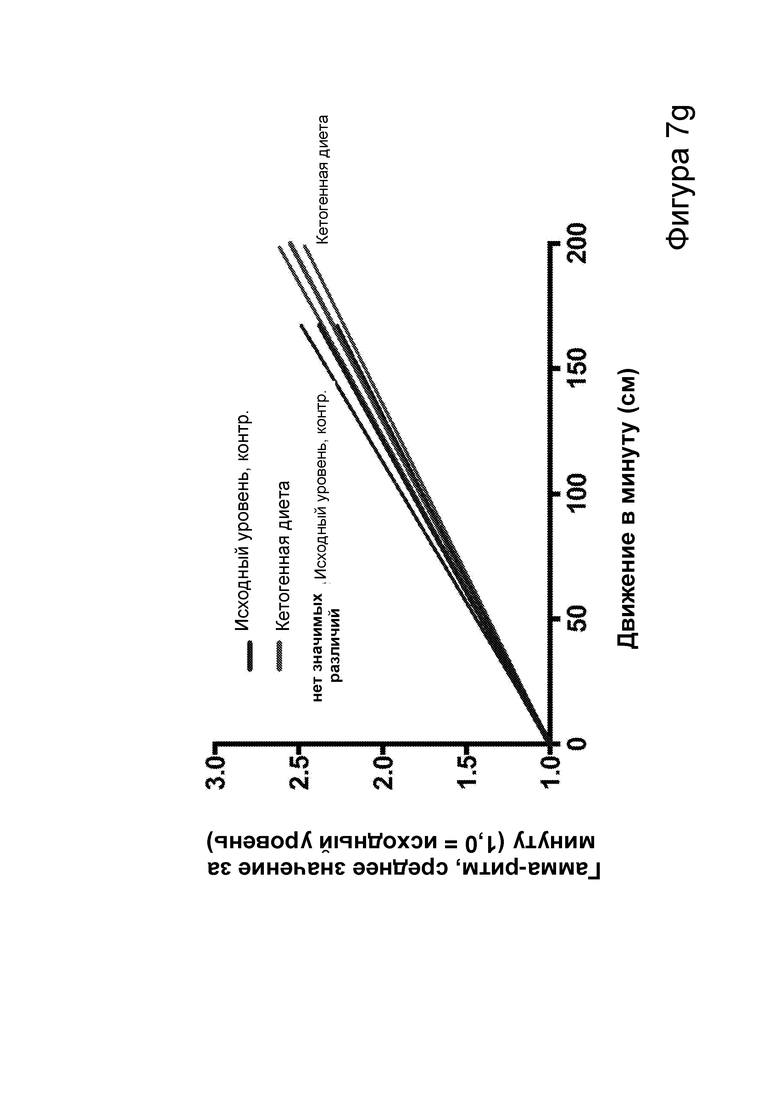
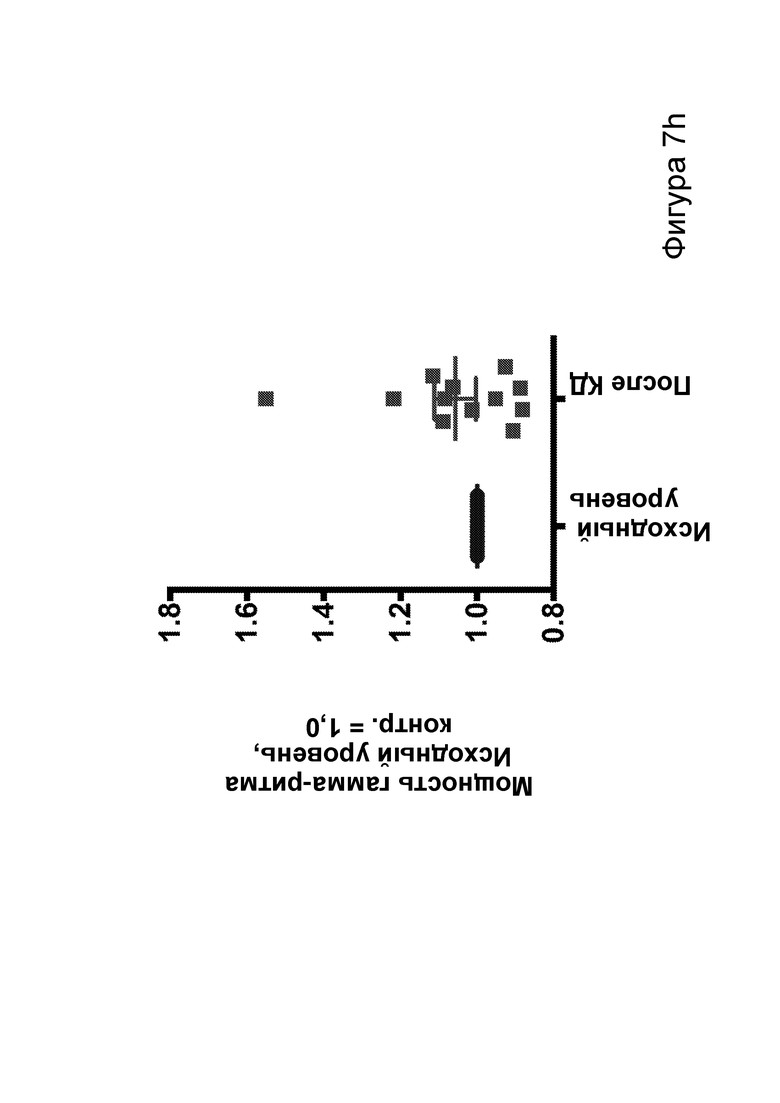

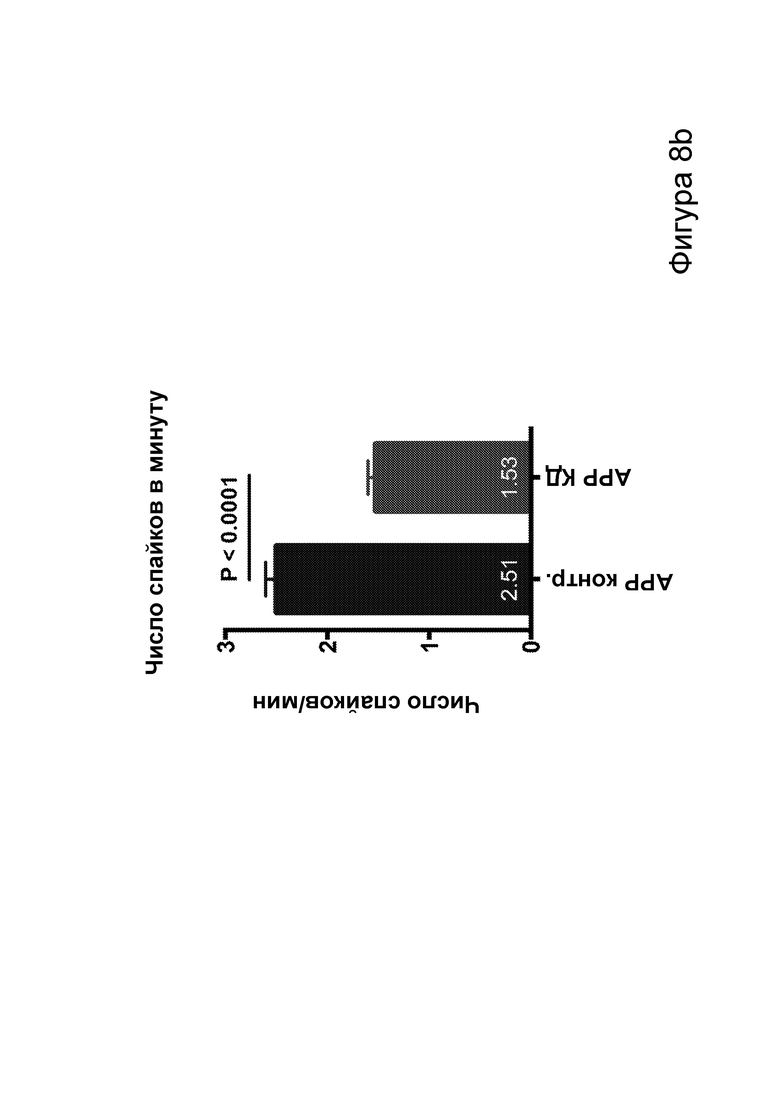
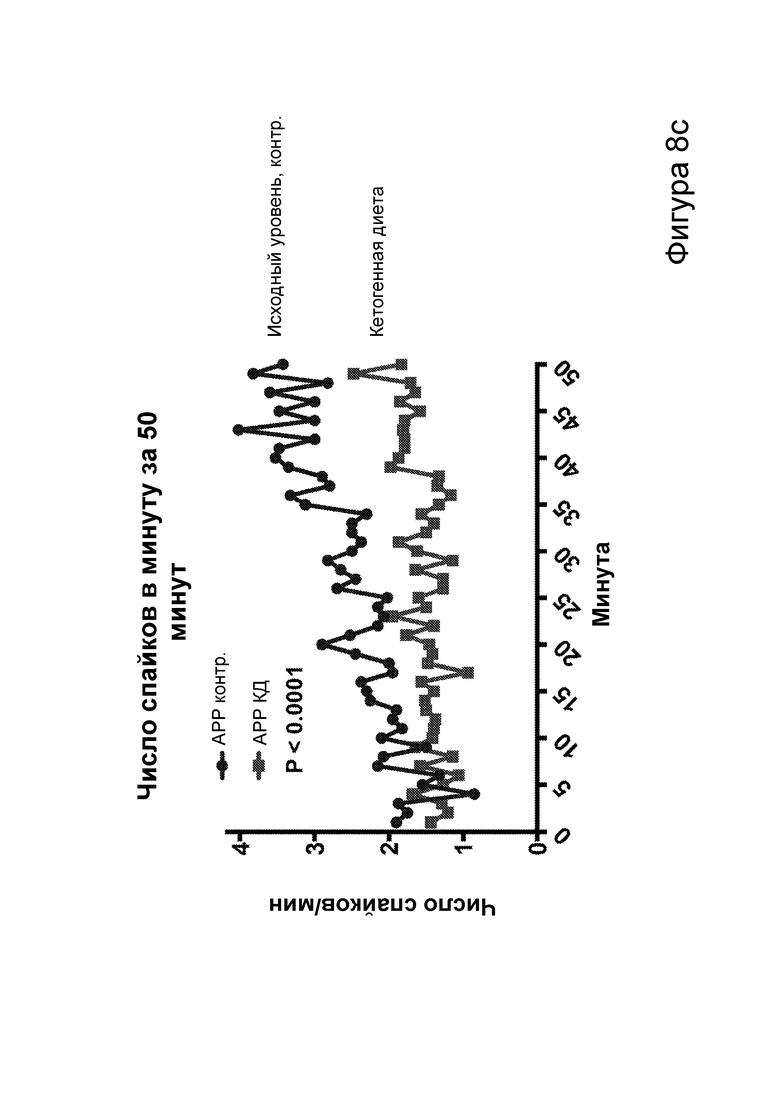
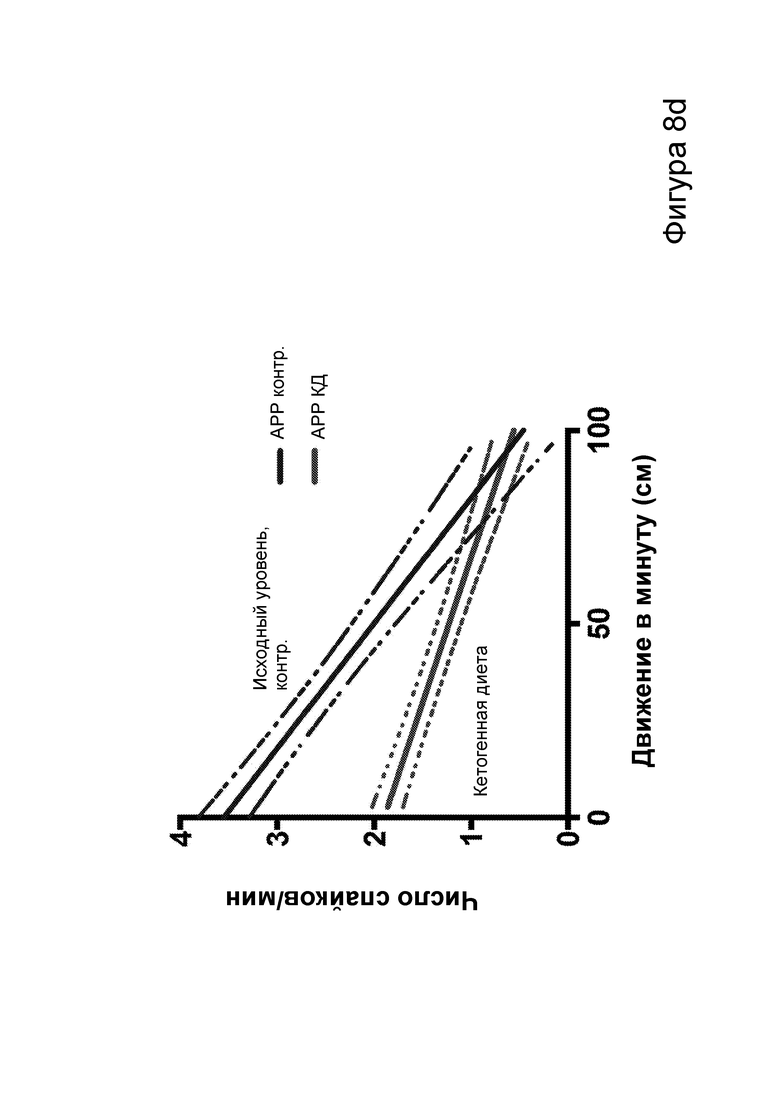
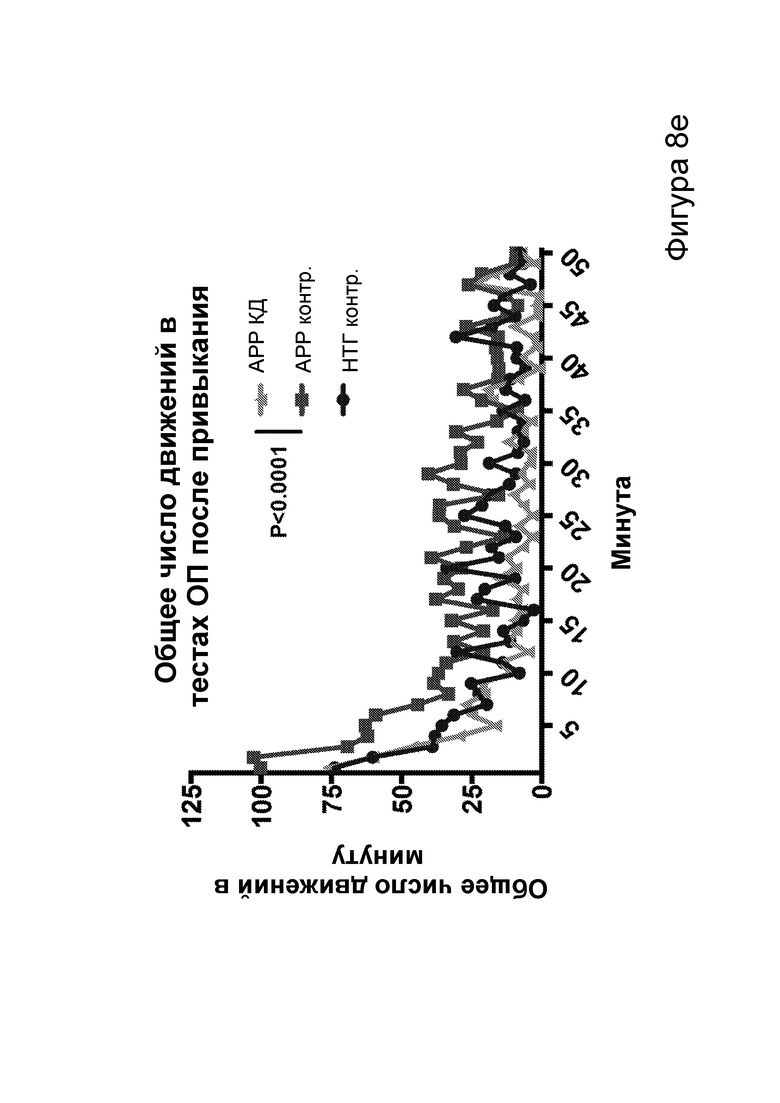
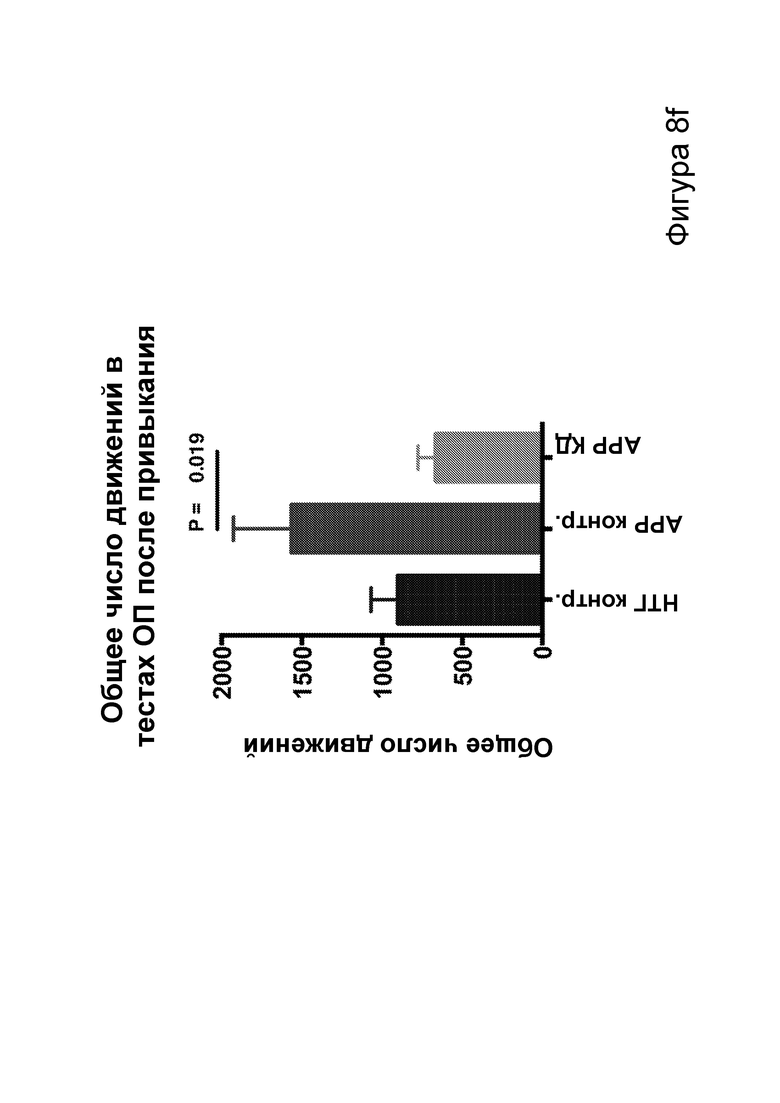
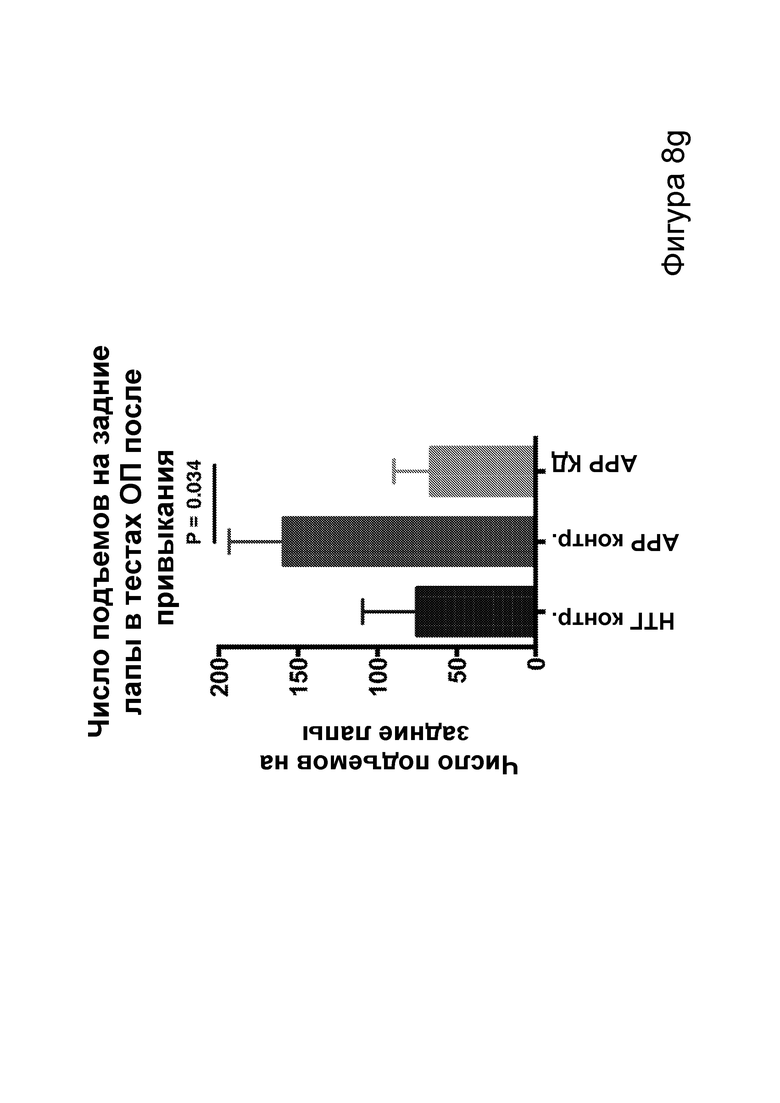
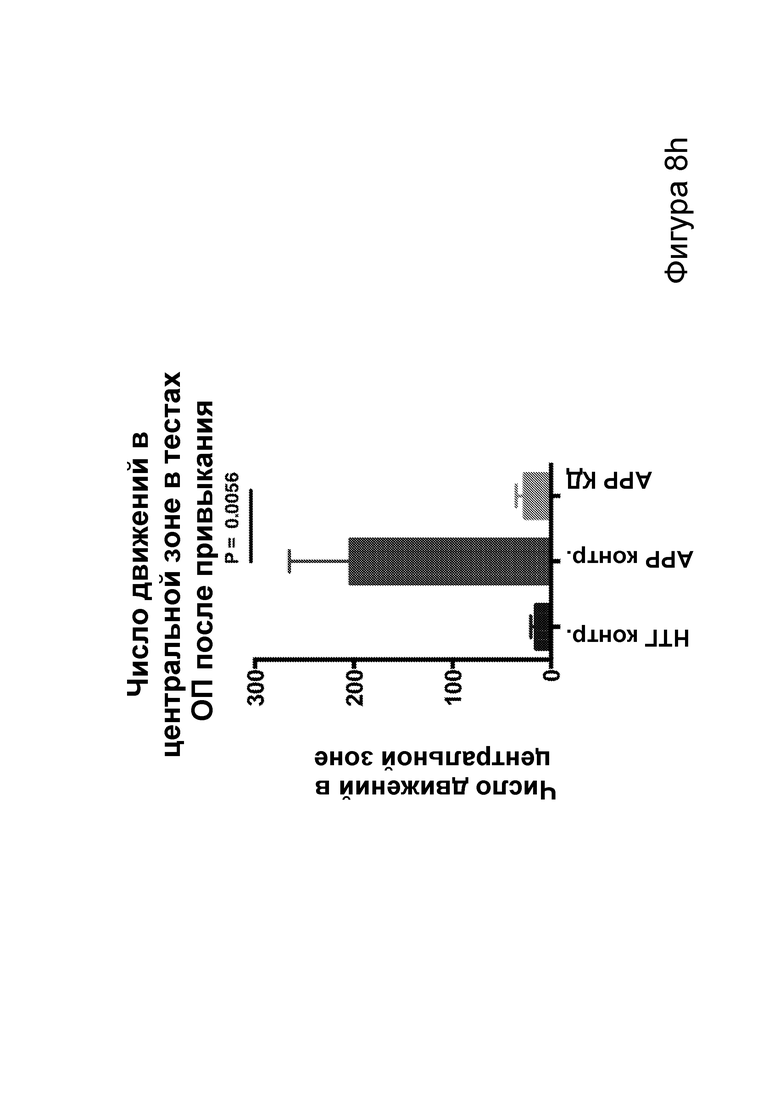
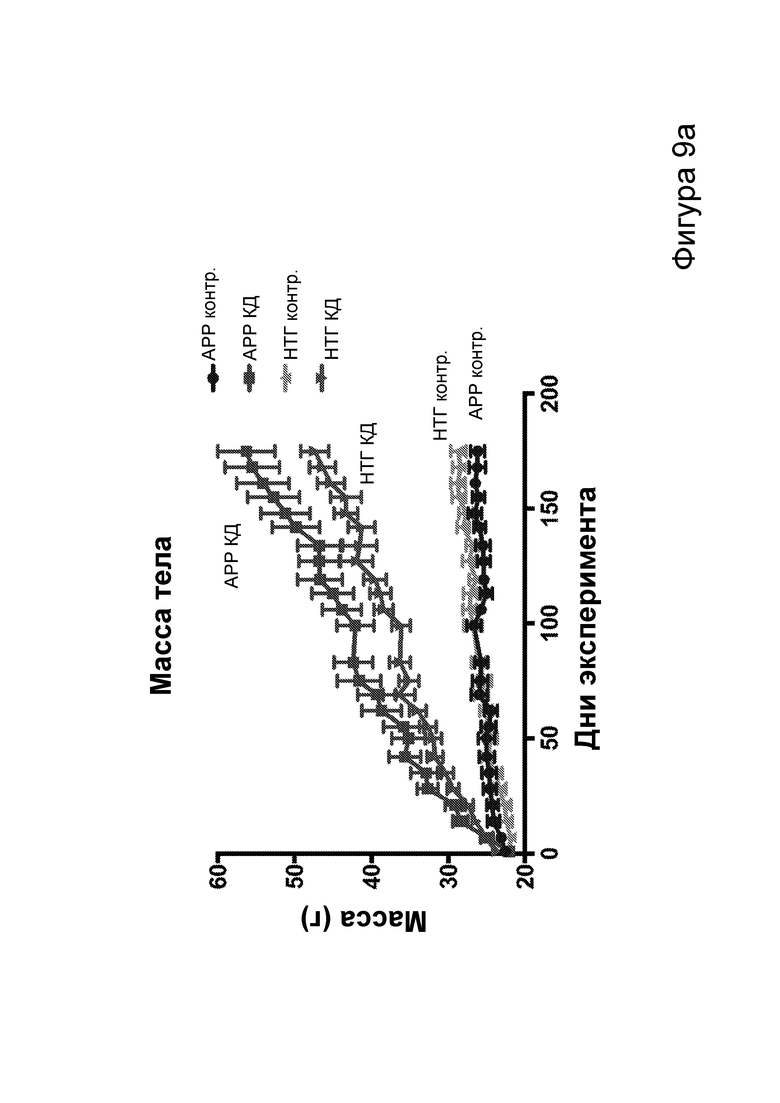
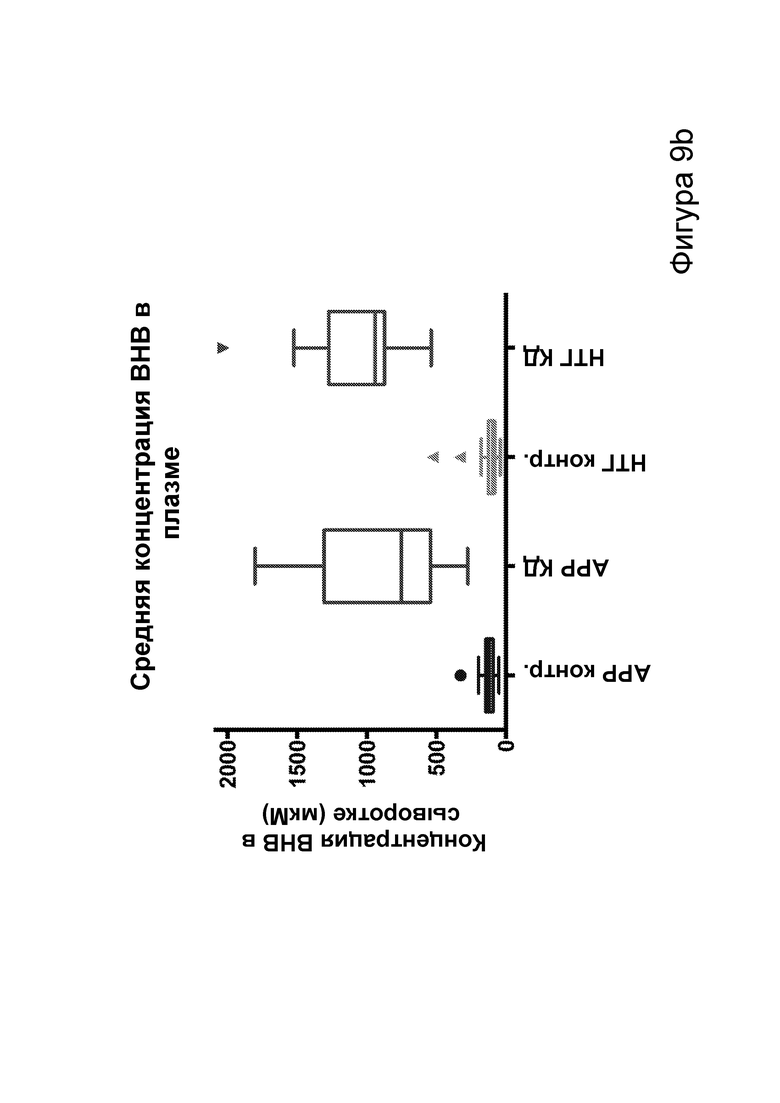
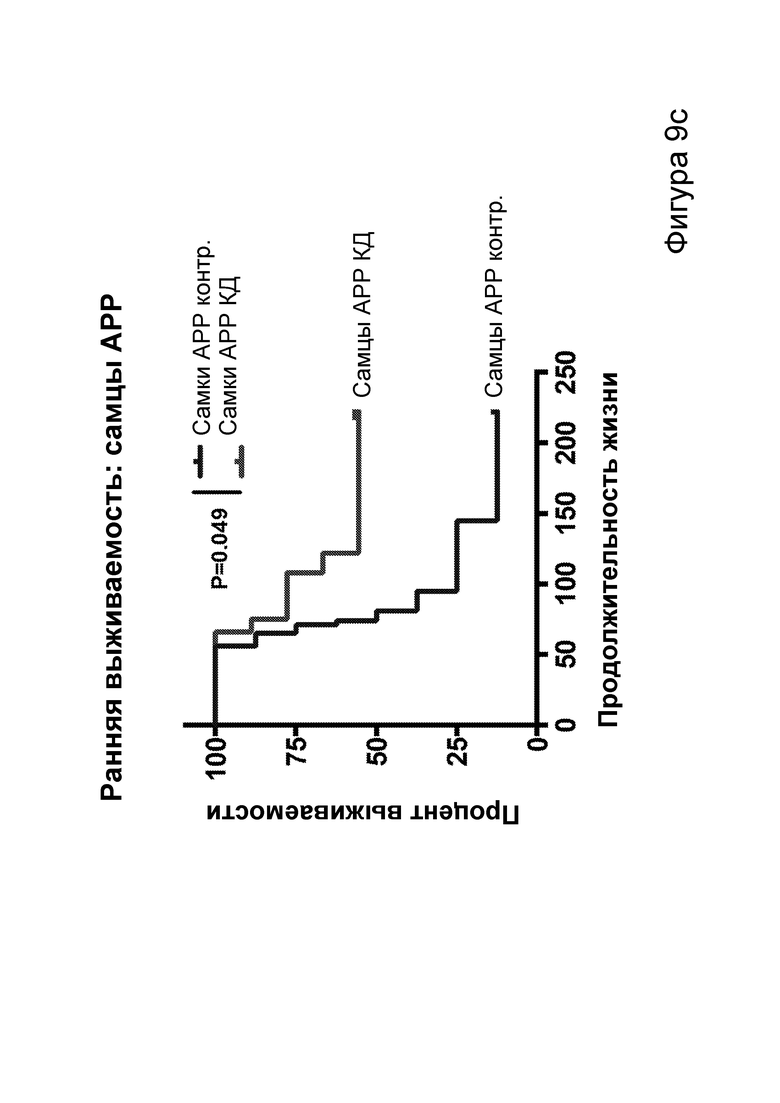
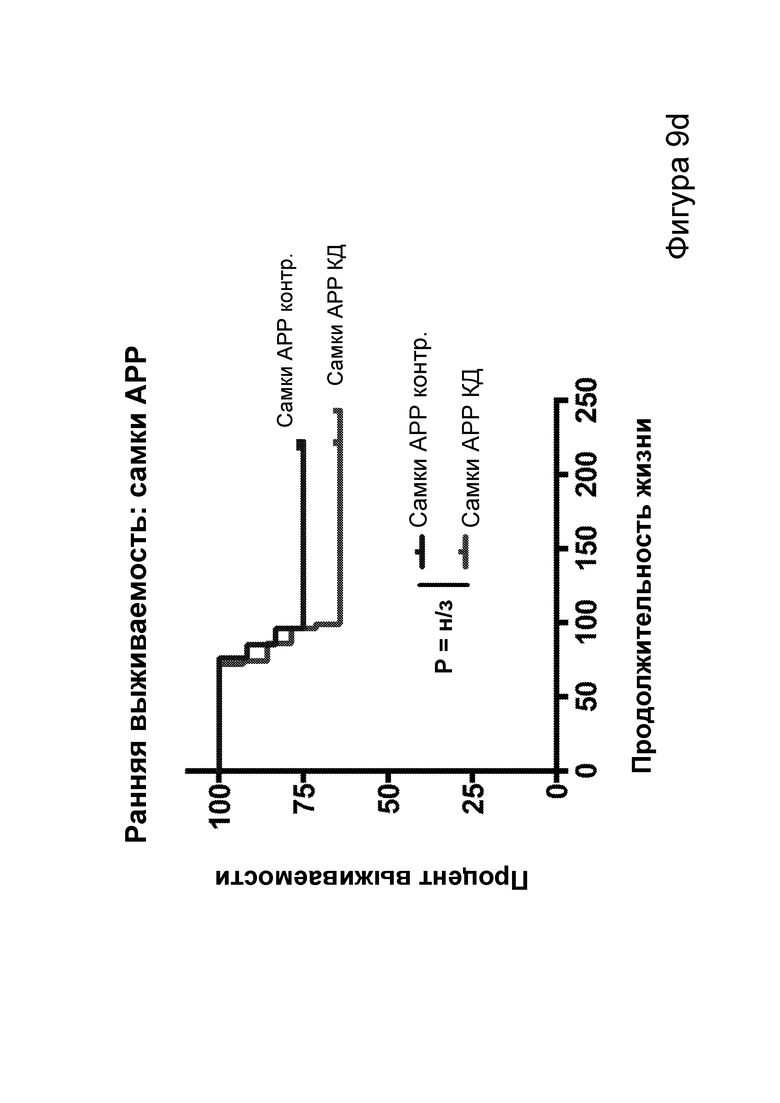
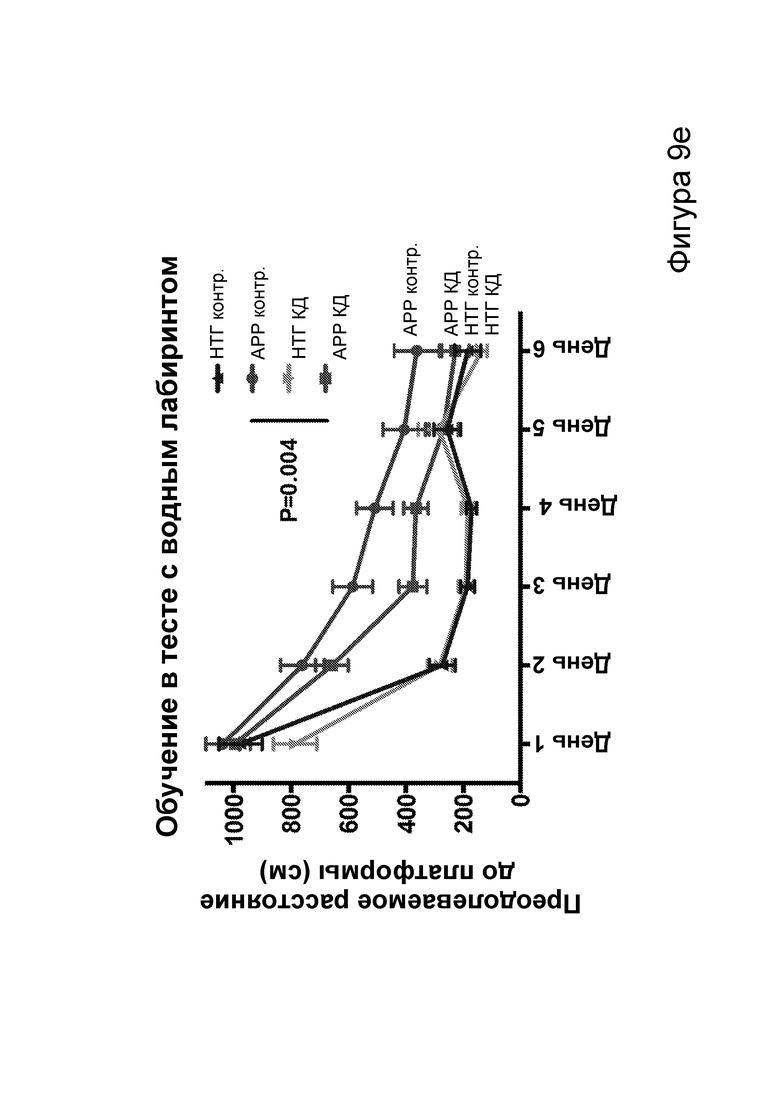
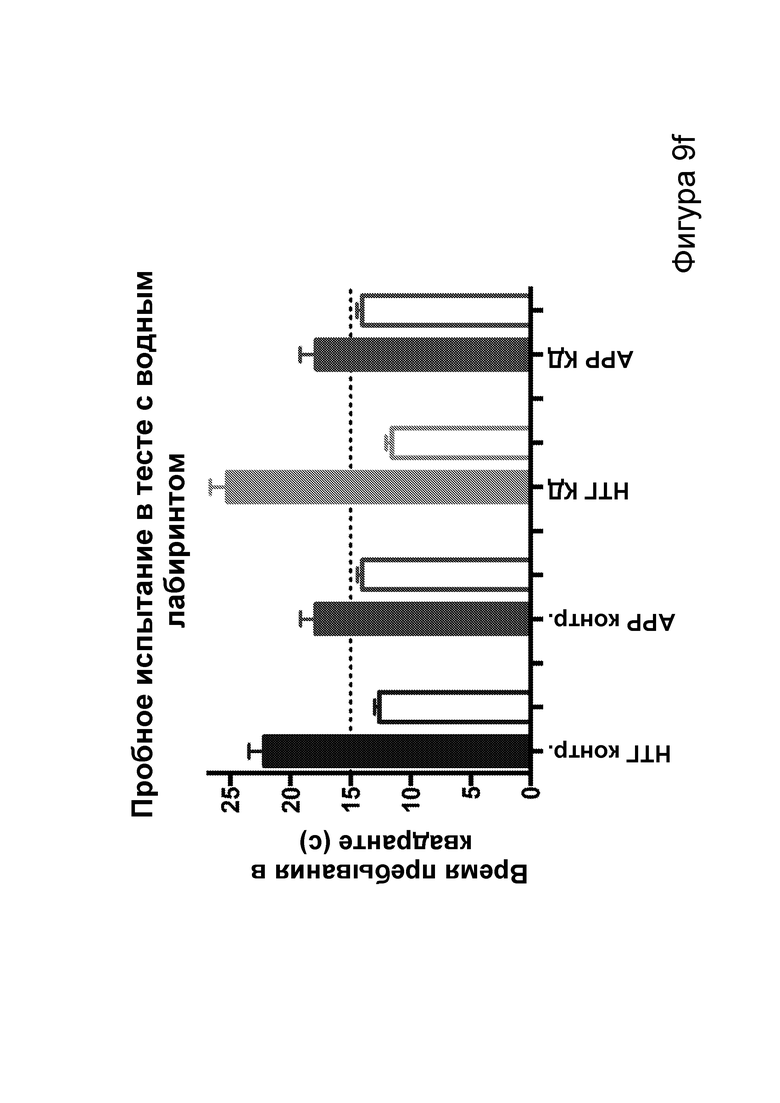
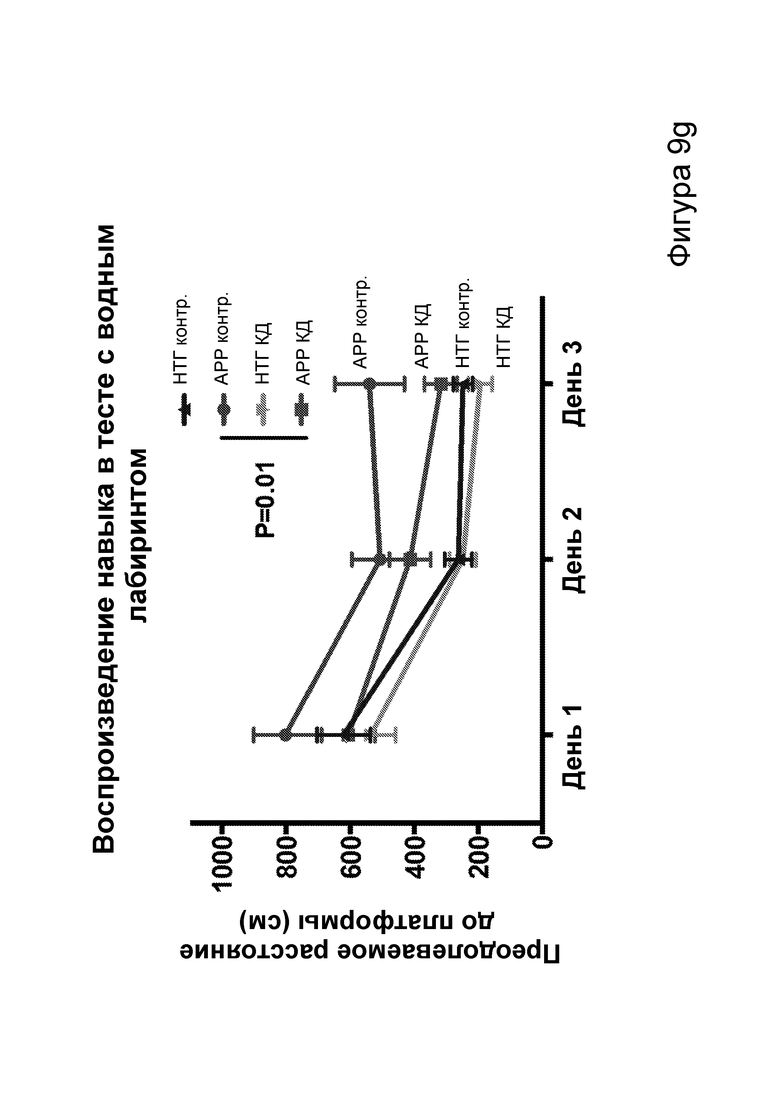
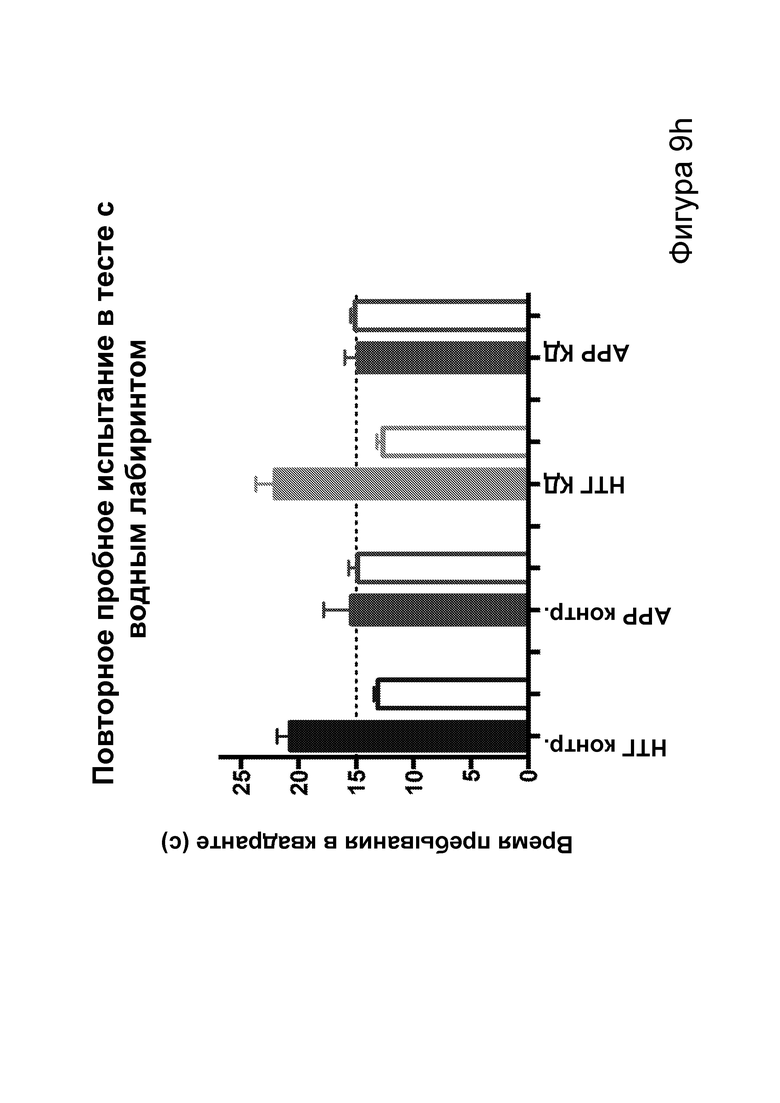
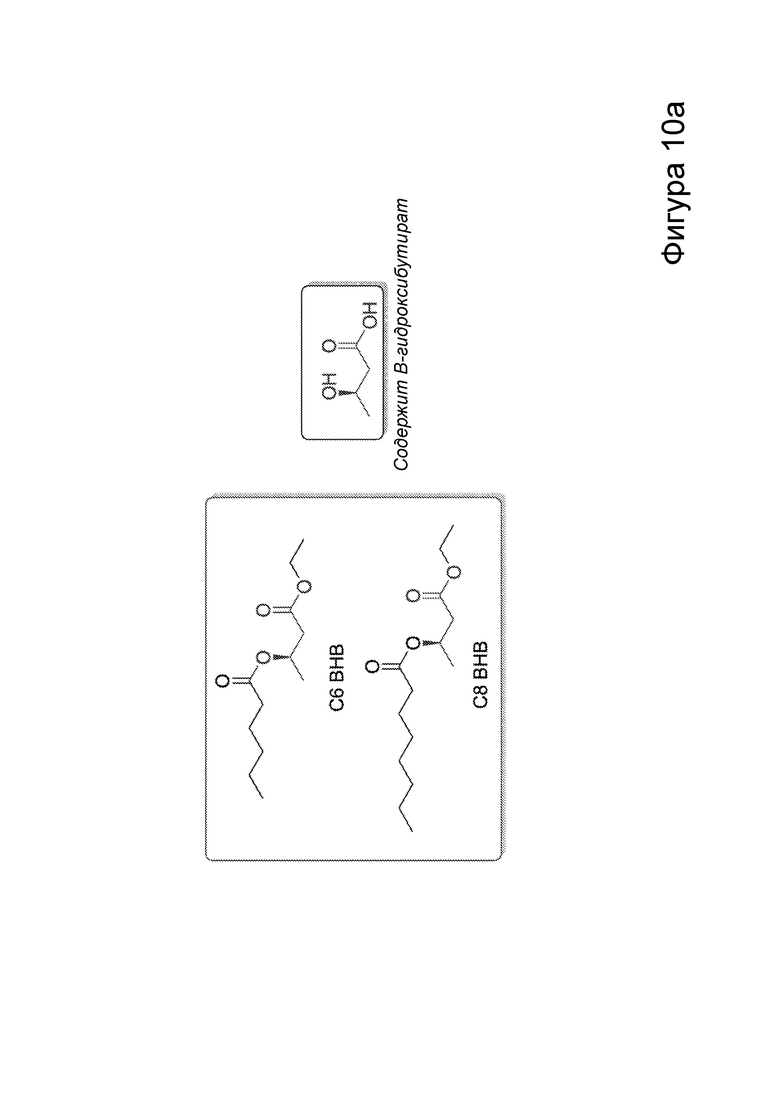
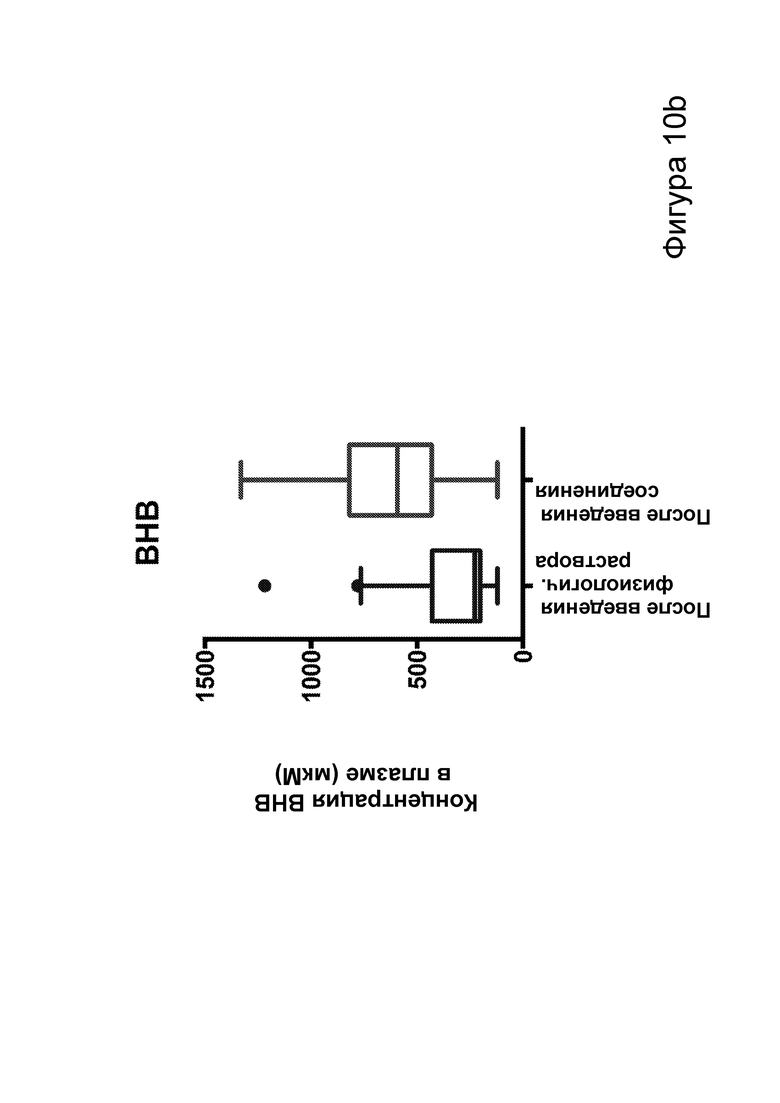
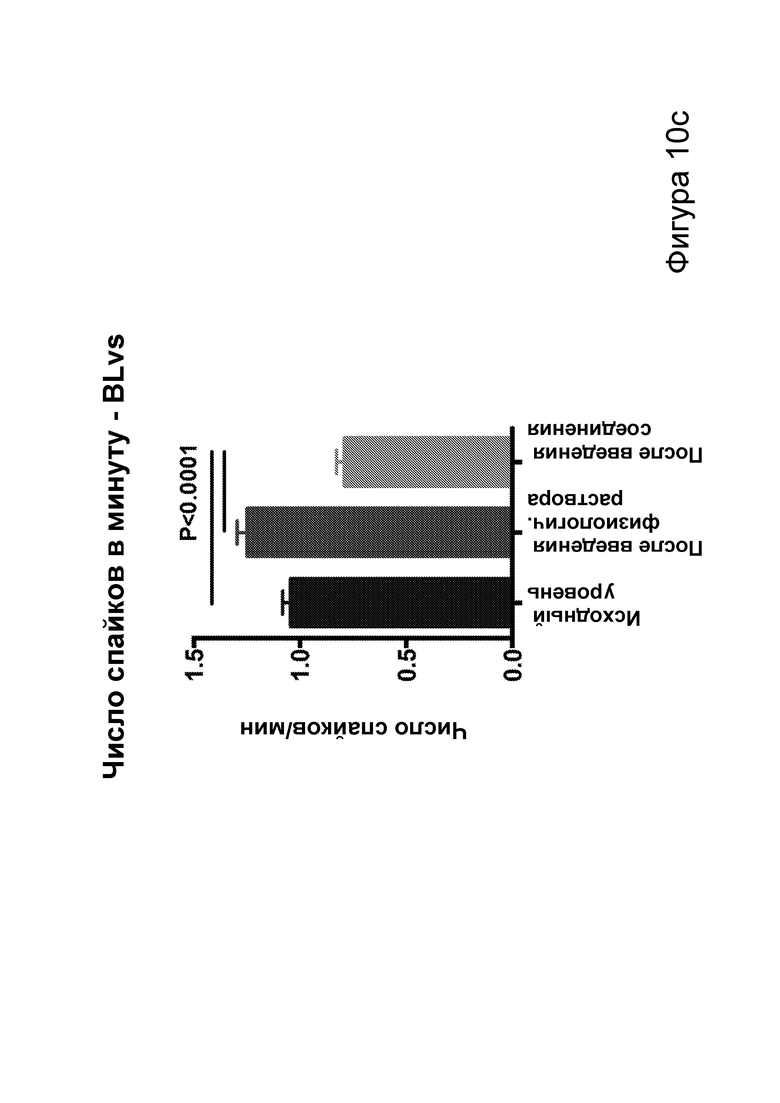
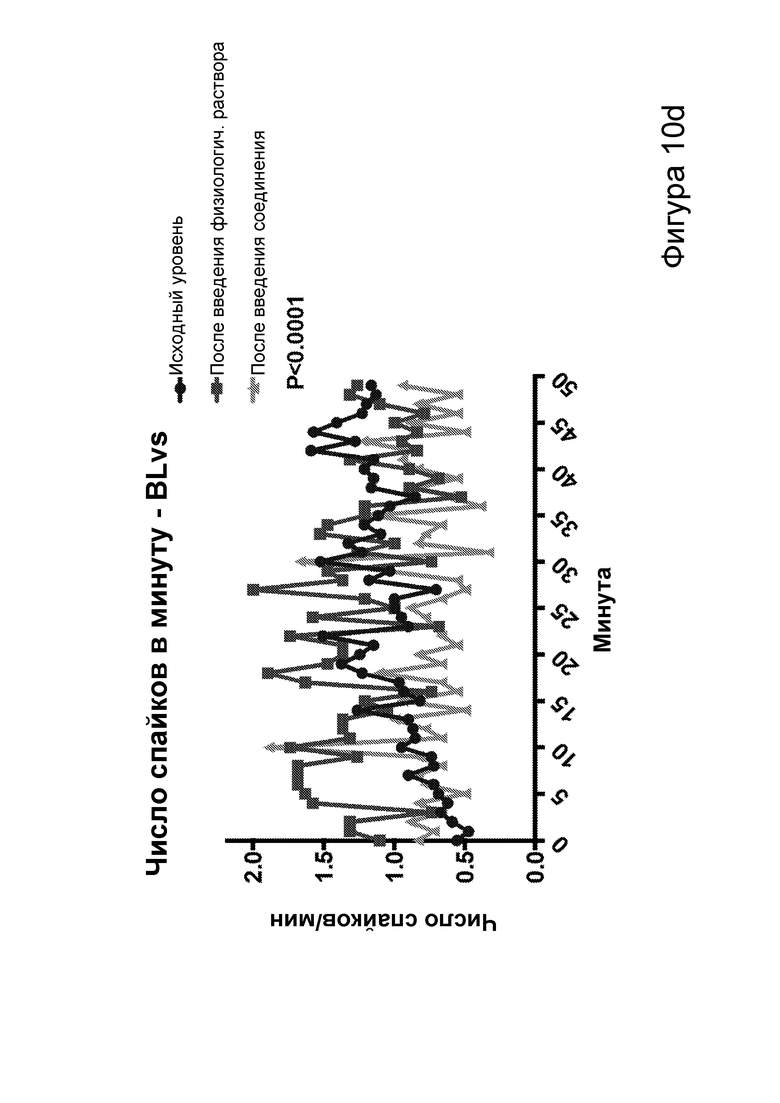
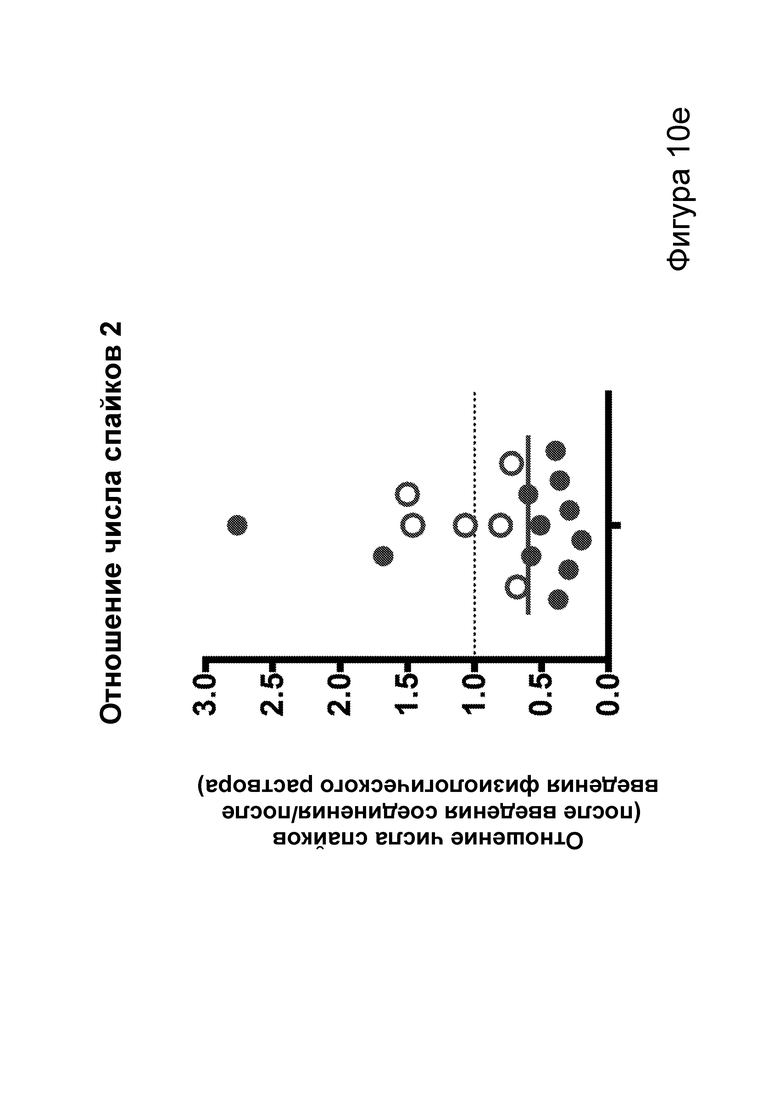
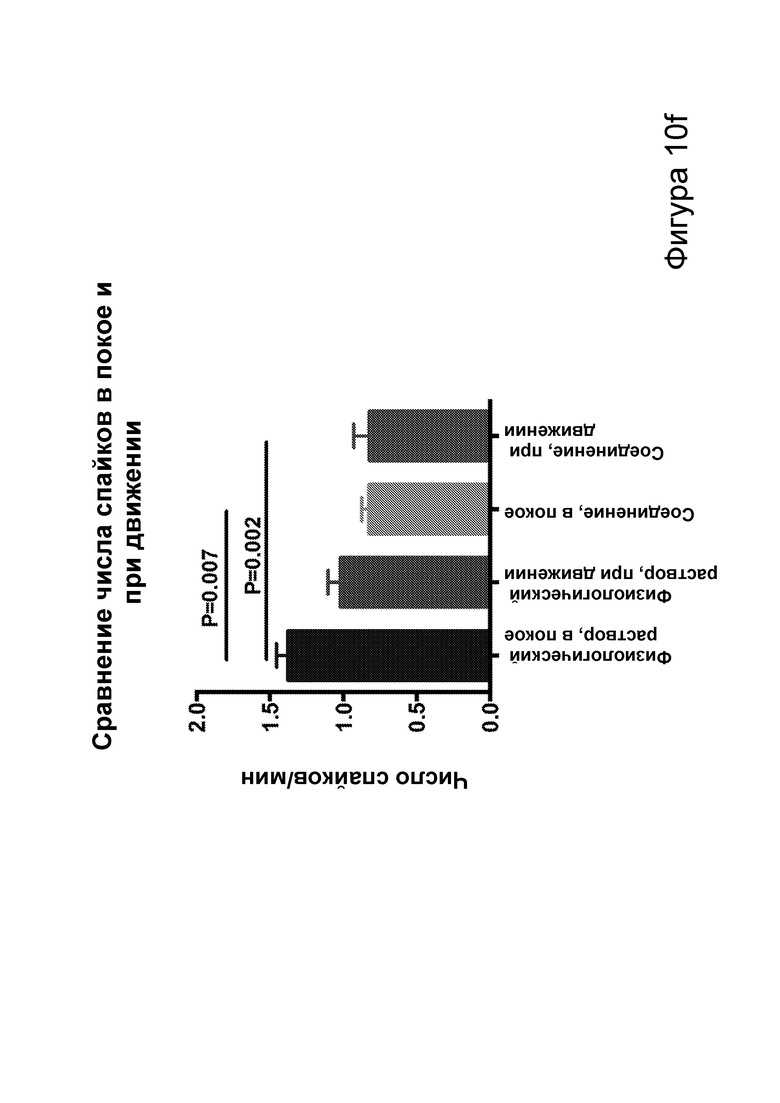
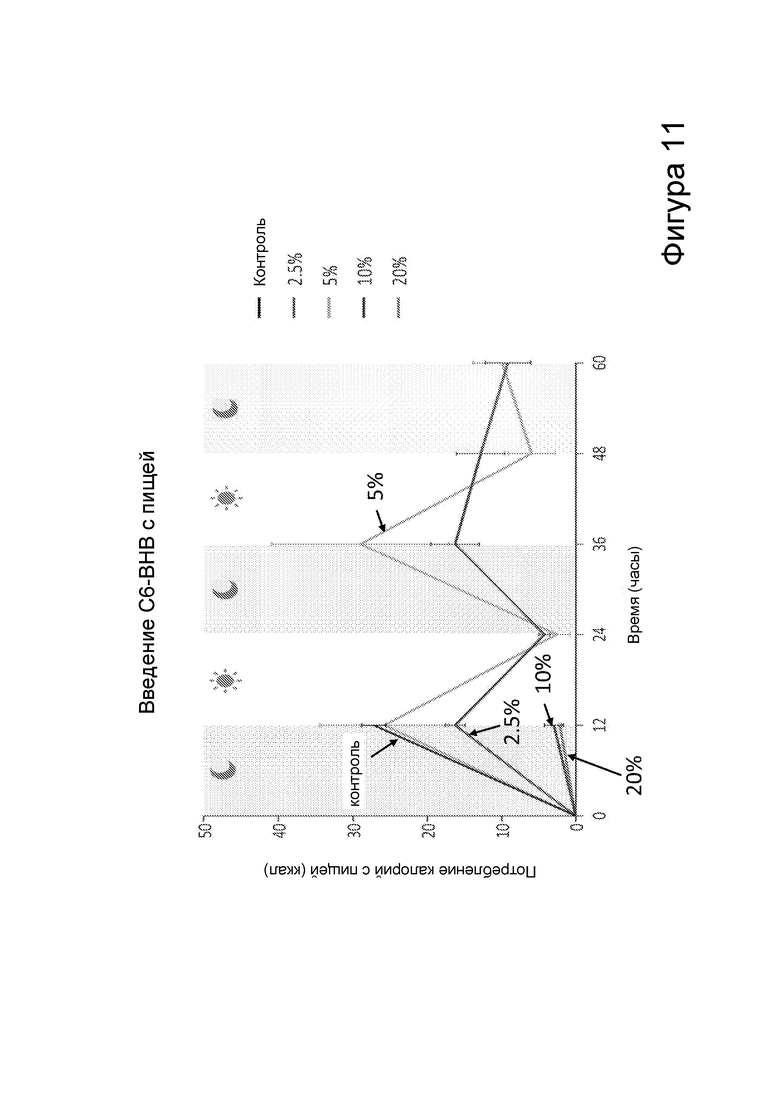
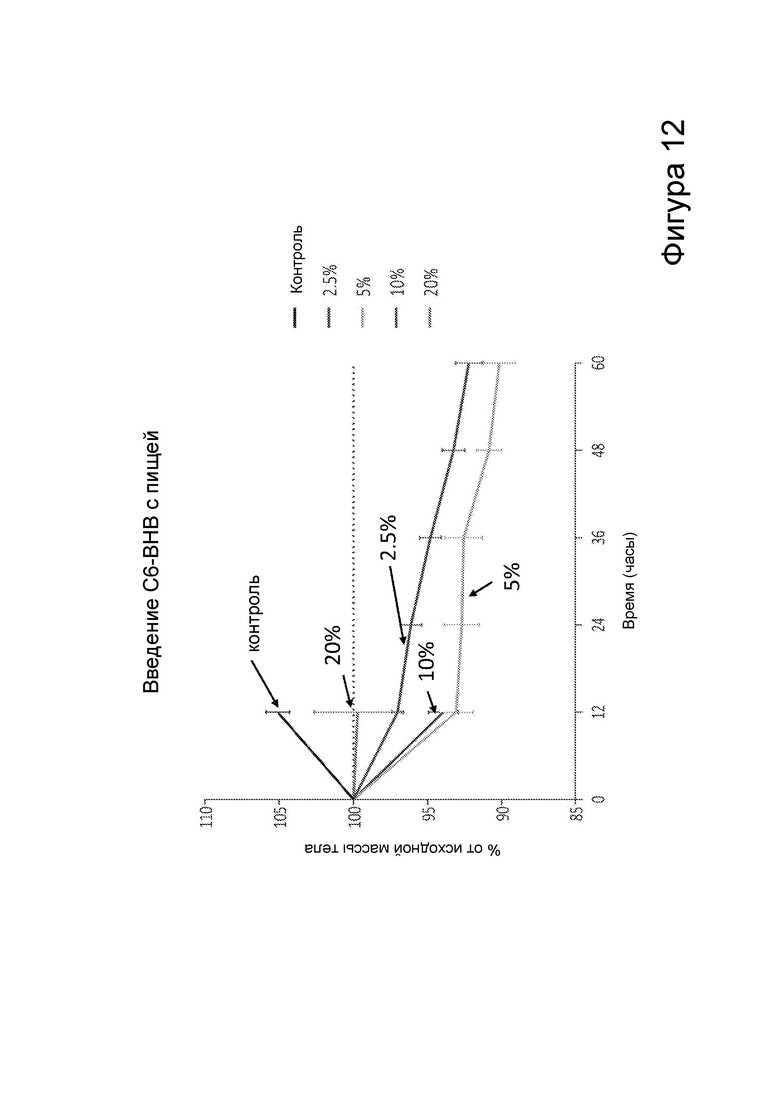
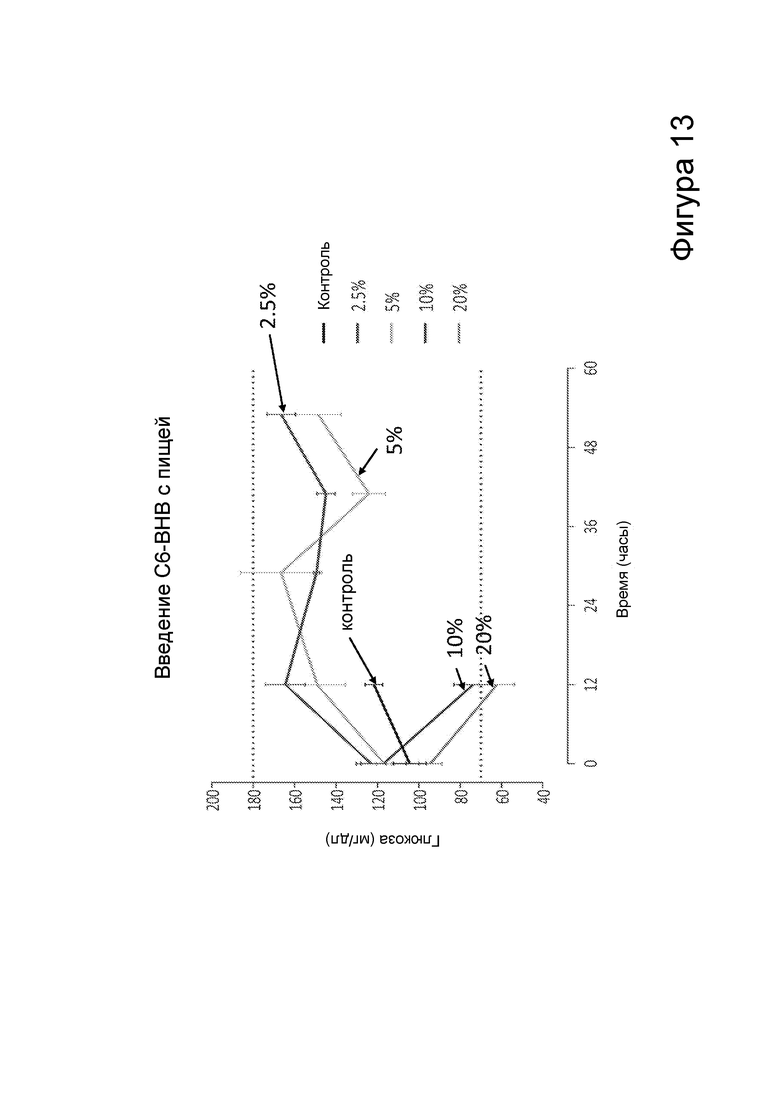
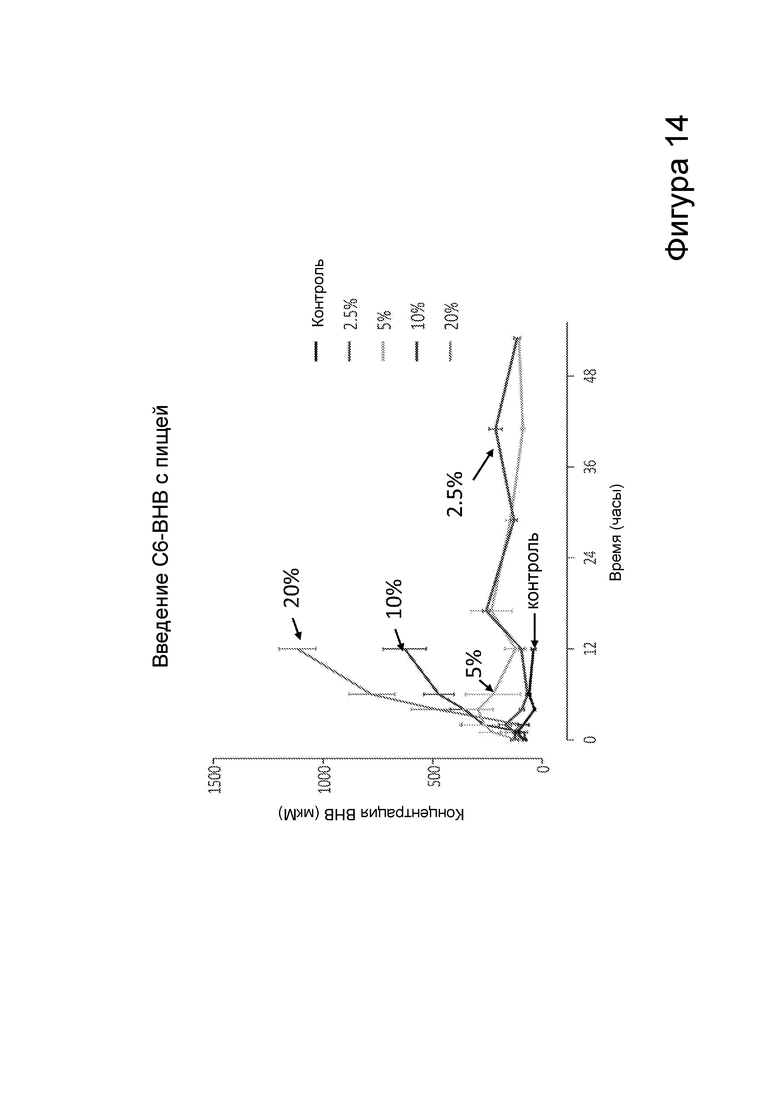
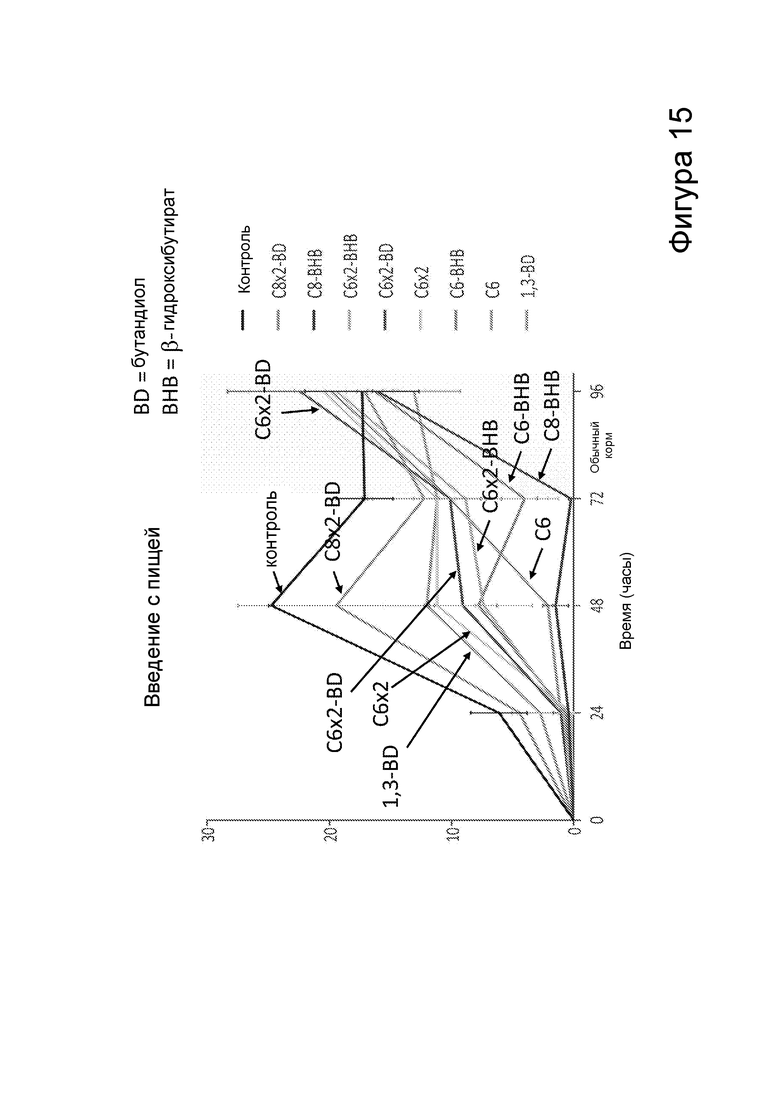
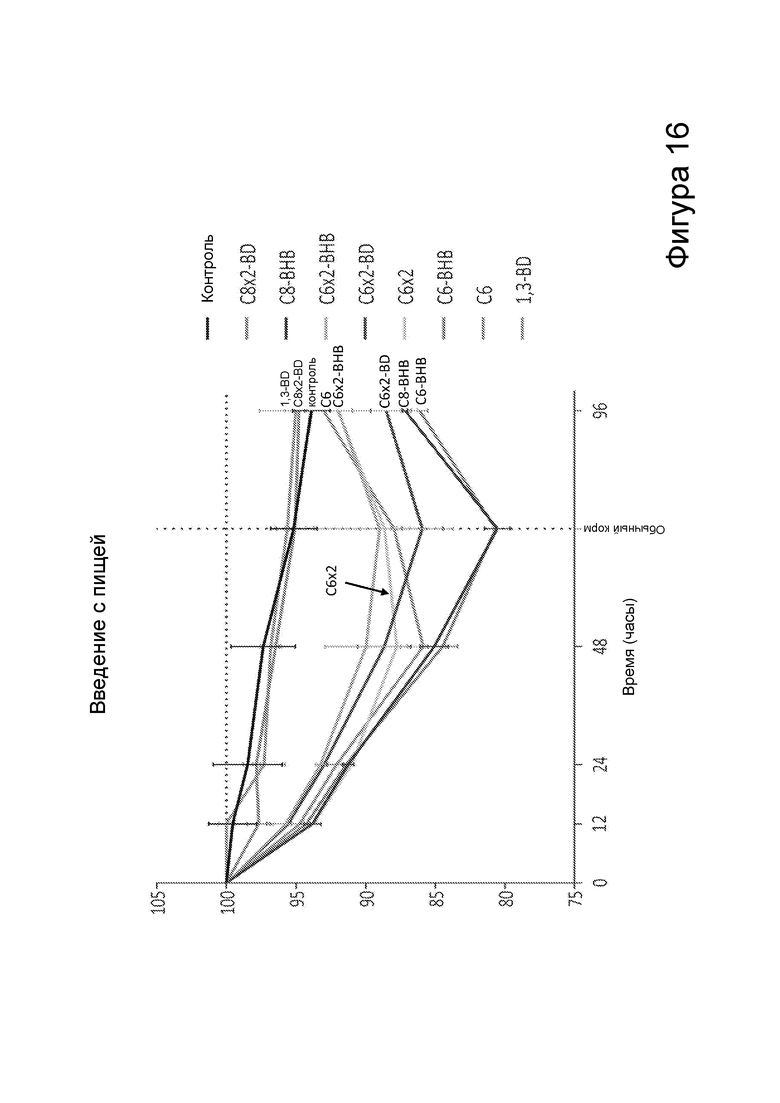
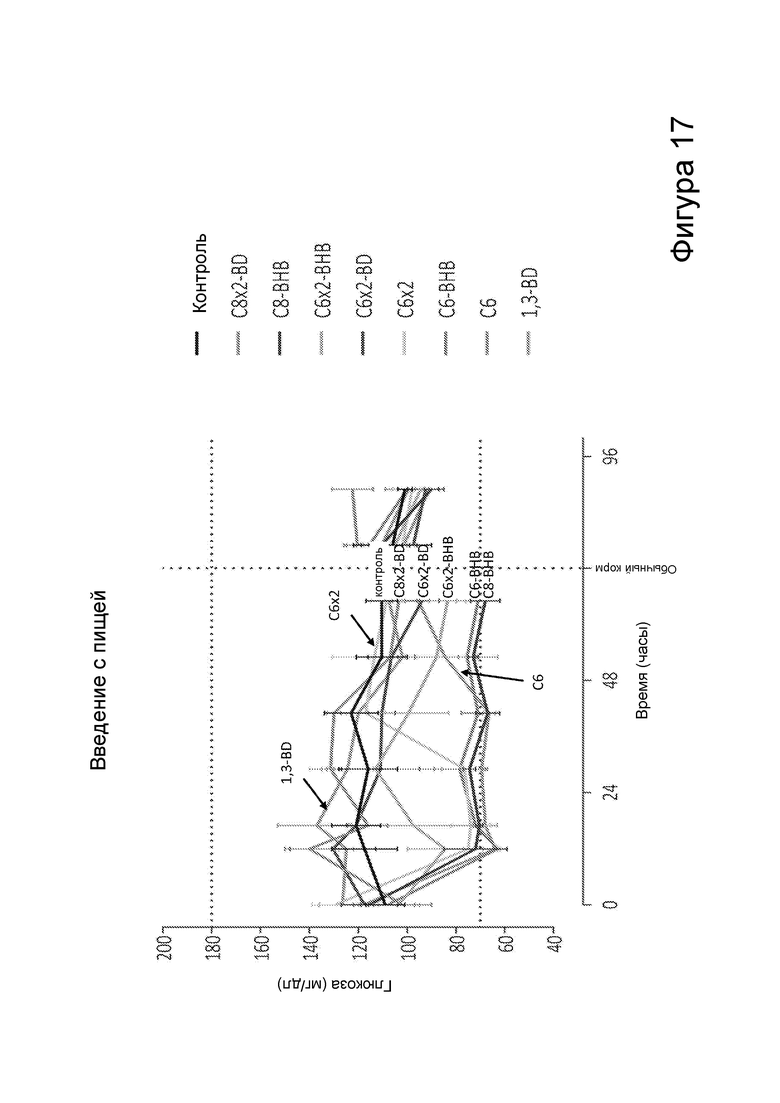
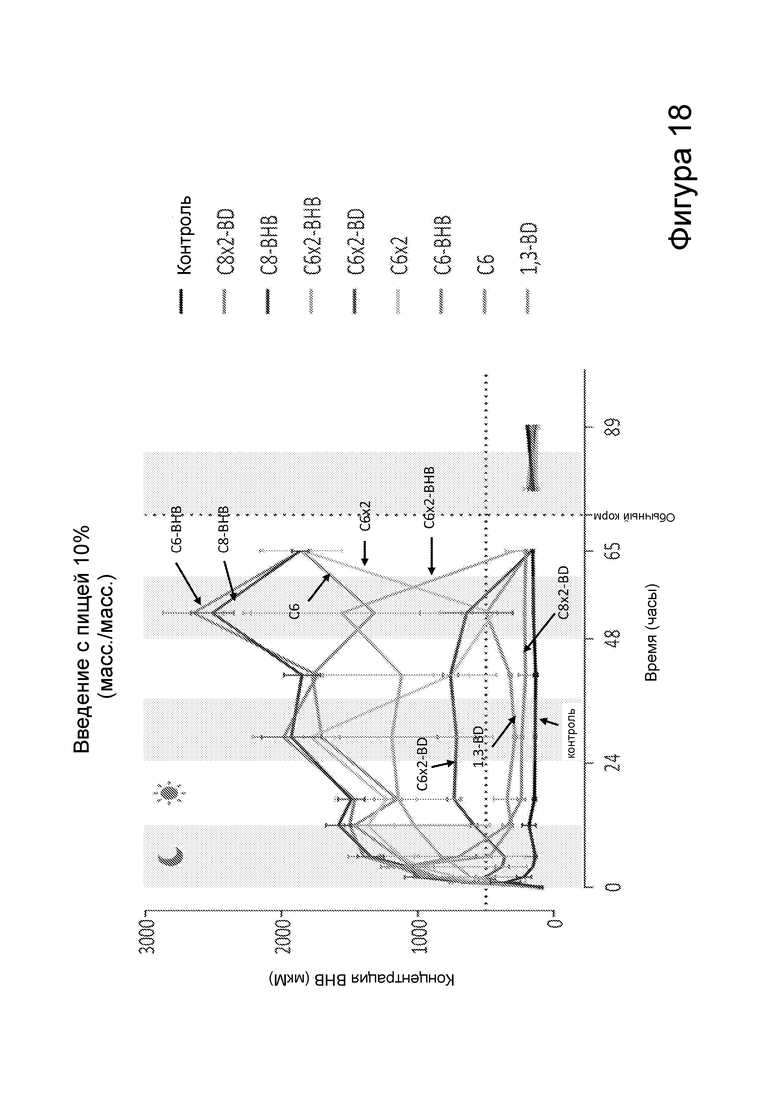
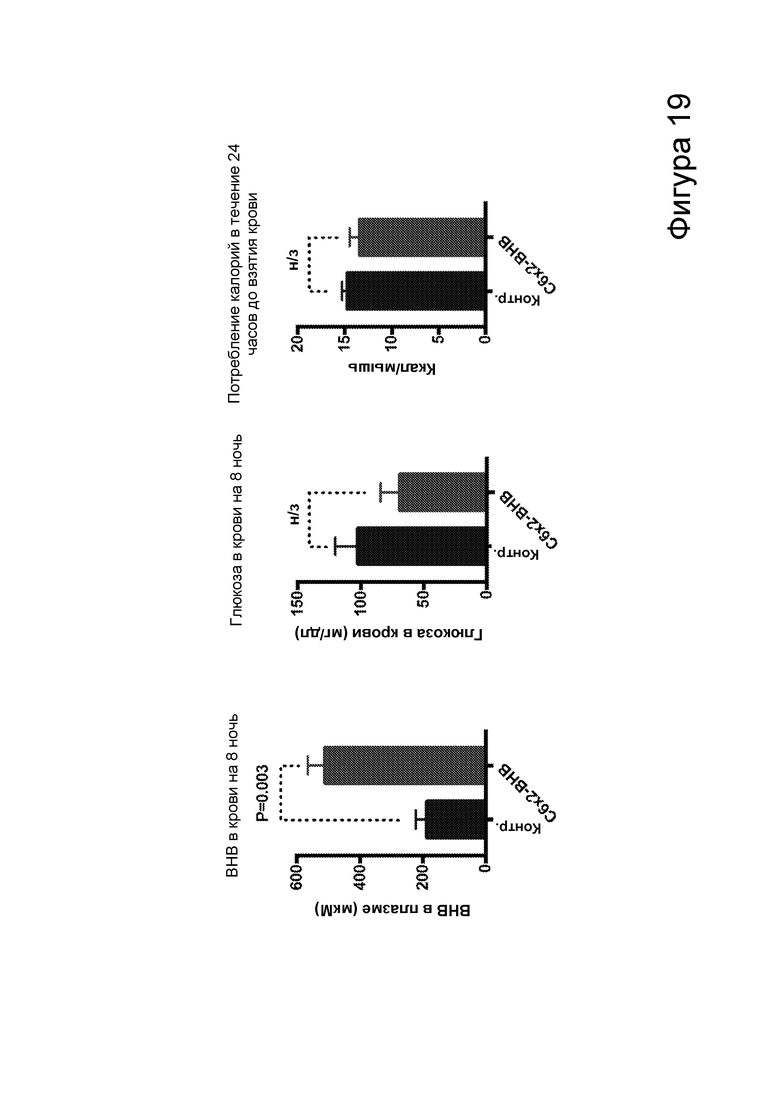
Изобретение относится к новым соединениям формулы I, в которой R1 представляет собой незамещенный C(1-6) алкил и R2 и R3 независимо представляют собой линейный незамещенный C(4-30) алкил. Также предложены способы лечения субъекта путем введения указанному субъекту соединения формулы I. Также описаны фармацевтические и пищевые композиции, содержащие один или более предложенных сложных эфиров. 6 н. и 25 з.п. ф-лы, 12 пр., 19 ил.
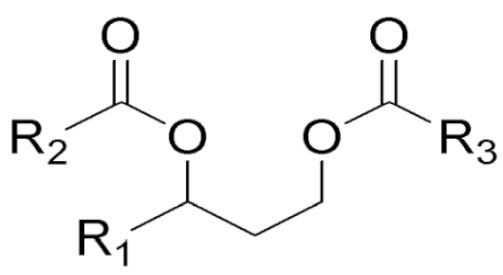 Формула I
Формула I
1. Соединение формулы I
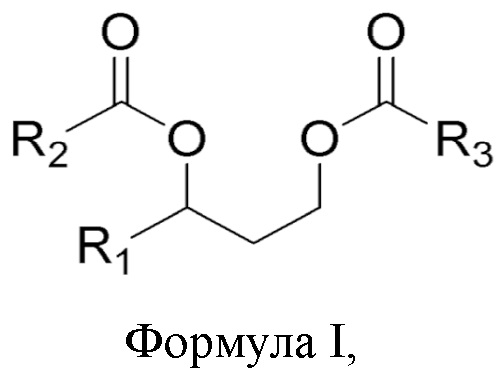
где R1 представляет собой незамещенный C(1-6) алкил; и
R2 и R3 независимо представляют собой линейный незамещенный C(4-30) алкил.
2. Соединение по п. 1, где R1 представляет собой метил.
3. Соединение по любому из пп. 1 или 2, где R2 и R3 независимо представляют собой незамещенный C(6-18) алкил.
4. Соединение по любому из пп. 1 или 2, где R2 и R3 независимо представляют собой незамещенный C6 алкил или незамещенный С8 алкил.
5. Соединение по п. 1, имеющее формулу Ia
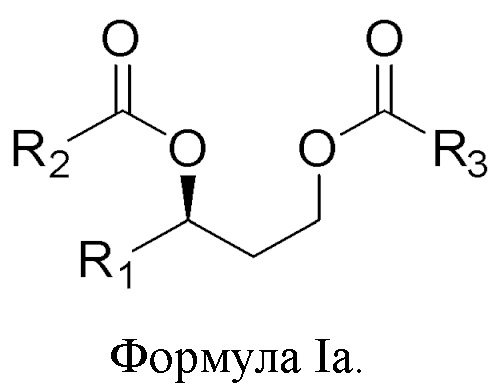
6. Соединение по п. 1, имеющее формулу Ib
:
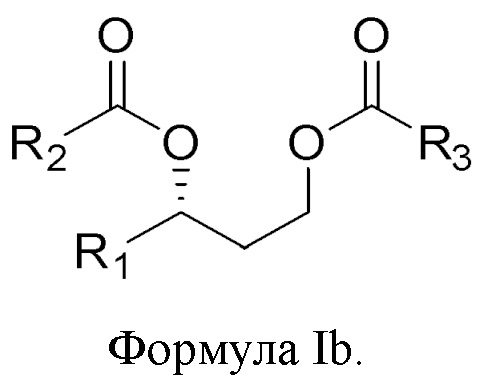
7. Соединение по п. 5, имеющее формулу
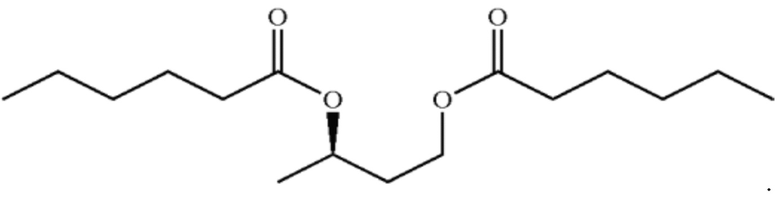
8. Соединение по п. 5, имеющее формулу
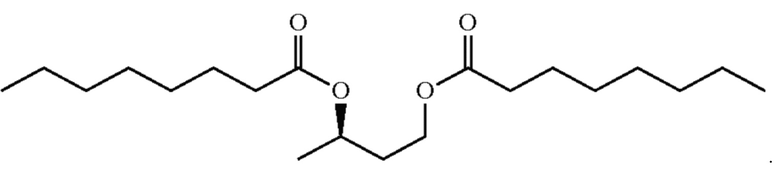
9. Состав для перорального приема для кетогенной диеты, содержащий эффективное количество одного или более соединений по п. 1 и консервант и/или ароматизатор.
10. Состав для перорального приема по п. 9, где указанный состав содержит воду.
11. Состав для перорального приема по п. 10, где указанный состав включает сироп или эликсир.
12. Состав для перорального приема по п. 10, где указанный состав включает суспензию.
13. Состав для перорального приема по п. 9, где указанный состав содержит связующее вещество.
14. Состав для перорального приема по п. 13, где указанный состав содержит связующее вещество, выбранное из группы, состоящей из целлюлозы, метилцеллюлозы, гидроксиметилцеллюлозы, полипропилпирролидона, поливинилпирролидона, желатина, аравийской камеди, поли(этиленгликоля), сахарозы и крахмала.
15. Состав для перорального приема по п. 9, где указанный состав содержит ароматизатор.
16. Состав для перорального приема по п. 15, где указанный состав содержит ароматизатор, выбранный из группы, состоящей из лимонной кислоты, ментола, глицина и апельсинового порошка.
17. Состав для перорального приема по п. 9, где указанный состав содержит консервант.
18. Состав для перорального приема по п. 17, где указанный состав содержит консервант, выбранный из группы, состоящей из бензоата натрия, бисульфита натрия, метилпарабена и пропилпарабена.
19. Состав для перорального приема по п. 9, где указанное соединение включает соединение формулы

20. Состав для перорального приема по п. 9, где указанное соединение включает соединение формулы

21. Пищевая композиция, содержащая одно или более соединений по п. 1.
22. Пищевая композиция по п. 21, где указанные одно или более соединений включают соединение формулы

23. Пищевая композиция по п. 21, где указанные одно или более соединений включают соединение формулы

24. Пищевая композиция по п. 21, где указанная пищевая композиция содержит один или более дополнительных компонентов кетогенной диеты.
25. Пищевая композиция по п. 24, где:
содержание указанного соединения составляет от примерно 1% масс./масс. до примерно 25% масс./масс. и/или
указанная кетогенная диета включает массовое отношение жиров к белку и углеводам, составляющее от примерно 2:1 до примерно 10:1.
26. Пищевая композиция по п. 21, где указанное соединение представляет собой соединение формулы

27. Пищевая композиция по п. 21, где указанное соединение представляет собой соединение формулы

28. Фармацевтическая композиция для лечения заболевания, выбранного из группы, включающей болезнь Альцгеймера, эпилепсию и болезнь Паркинсона, содержащая терапевтически эффективное количество соединения по любому из пп. 1-8 и фармацевтически приемлемый носитель.
29. Способ лечения одного или более из болезни Альцгеймера, эпилепсии, болезни Паркинсона, сердечной недостаточности, травматического повреждения головного мозга, инсульта, геморрагического шока, острого повреждения легкого после жидкостной реанимации, острого повреждения почек, инфаркта миокарда, ишемии миокарда, диабета, мультиформной глиобластомы, диабетической нейропатии, рака предстательной железы, бокового амиотрофического склероза, болезни Хантингтона, кожной Т-клеточной лимфомы, множественной миеломы, периферической Т-клеточной лимфомы, ВИЧ, болезни Ниманна-Пика типа С, возрастной макулярной дегенерации, подагры, атеросклероза, ревматоидного артрита и рассеянного склероза, включающий
введение субъекту терапевтически эффективного количества соединения по любому из пп. 1-8.
30. Способ по п. 29, где указанное терапевтически эффективное количество является достаточным для уменьшения эпилептиформной активности в головном мозге субъекта.
31. Способ уменьшения эпилептиформной активности в головном мозге субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп. 1-8 или композиции по п. 28.
| Pasquale Stano et al | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| W Irene C Rijpstra Structural identification of the beta-hydroxy fatty | |||
Авторы
Даты
2021-12-13—Публикация
2017-06-02—Подача