Настоящее изобретение относится к соединениям согласно общей формуле (I), которые являются аналогами эпоксиметаболитов, продуцируемых ферментами цитохрома Р450 (CYP) из полиненасыщенных жирных кислот (ПНЖК, англ. PUFAs) омега-3 (n-3). Настоящее изобретение также относится к композициям, содержащим одно или более таких соединений, и к применению указанных соединений или композиций для лечения или предотвращения состояния или заболевания, связанного с воспалением, пролиферацией, гипертензией, коагуляцией, иммунной функцией, патологическим ангиогенезом, сердечной недостаточностью и сердечными аритмиями.
Уровень техники
Полиненасыщенные жирные кислоты омега-6 и омега-3 (ПНЖК n-6 и n-3) являются необходимыми компонентами рациона млекопитающего. Наиболее важными с биологической точки зрения ПНЖК n-3 являются эйкозапентаеновая кислота (ЕРА, 20:5 n-3) и докозагексаеновая кислота (DHA, 22:6 n-3). Используемые в пищу ПНЖК n-3 обладают действием в отношении различных изиологических процессов, способствующих нормальному состоянию здоровья и хроническим заболеваниям (обзор см., например, в Jump, D.В. (2002) J. Biol. Chem. 277, 8755-8758), таких как регуляция уровней липидов в плазме (Rambjor, G.S., Walen, A.I., Windsor, S.L, and Harris, W.S. (1996) Lipids, 45-49; Harris, W.S. (1997) Am. J. Clin. Nutr. 65, 1645-1654; Harris, W.S., Hustvedt, B-E., Hagen, E., Green, M.H., Lu, G., and Drevon, C.A. (1997) J. Lipid Res. 38, 503-515; Mori, T.A., Burke, V., Puddey, I.В., Watts, G.F., O'Neal, D.N., Best, J.D., and Beilen, L.J. (2000) Am. J. Clin. Nutr. 71, 1085-1094), ункционирование сердечно-сосудистой системы (Nordoy, A. (1999) Lipids 34, 19-22; Sellmayer, A., Hrboticky, N., and Weber, P.C. (1999) Lipids 34, 13-18; Leaf, A. (2001) J. Nutr. Health Aging 5,173-178) и иммунная ункция (Hwang, D. (2000) Annu. Rev. Nutr. 20, 431-456), воспаление (Calder, P.C. (2012) Mol. Nutr. Food Res. 56, 1073-1080), действие инсулина (Storlien, L, Hulbert, A.J., and Else, P.L. (1998) Curr. Opin. Clin. Nutr. Metab. Care 1, 559-563; Storlien, L.H., Kriketos, A.D., Calvert, G.D., Baur, L.A., and Jenkins, A.B. (1997) Prostaglandins Leukotrienes Essent. Fatty Acids 57, 379-385; Oh, D.Y., Talukadar, S., Bae, E.J., Imamura, Т., Morinaga, H., Fan, W., Li, P., Lu, W.J., Watkins, S.M., Olefsky, J.M. (2010) Cell 142 (5), 687-98), а также развитие нейронов и зрительная ункция (Salem, N., Jr., Litman, В., Kim, H-Y., and Gawrisch, K. (2001) Lipids 36, 945-959). Прием ПНЖК n-3 будет способствовать их распространению практически в каждую клетку организма, что влияет на состав и ункционирование мембран, синтез эйкозаноидов и передачу сигнала, а также на регуляцию экспрессии генов (Salem, N., Jr., Litman, В., Kim, H-Y., and Gawrisch, K. (2001) Lipids 36, 945-959; Jump, D.В., and Clarke, S.D. (1999) Annu. Rev. Nutr. 19, 63-90; Duplus, E., Glorian, M., and Forest, C. (2000) 275, 30749-30752; Dubois, R.N., Abramson, S.В., Crofford, L., Gupta, R.A., Simon, L.S., Van De Putte, L.B.A., and Lipsky, P.E. (1998) FASEB J. 12, 1063-1073).
Эпидемиологические, клинические и экспериментальные исследования показали, что ПНЖК n-3 из рыбьего жира (ЕРА и DHA) защищают от сердечно-сосудистых заболеваний (Kris-Etherton РМ, Harris WS, Appel LJ. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation 2002; 106(21):2747-57). ПНЖК n-3 уменьшают смертность от ишемической болезни сердца и снижают количество внезапных сердечных смертей (Mozaffarian D. Fish and n-3 fatty acids for the prevention of fatal coronary heart disease and sudden cardiac death. Am J Clin Nutr 2008;87(6):1991S-6S). Защита от желудочковой аритмии, предположительно, является основным актором, отвечающим за предотвращение внезапной сердечной смерти жирными кислотами ПНЖК n-3 у пациентов после ин аркта миокарда и у пациентов, имеющих сердечную недостаточность (Leaf А, Kang JX, Xiao YF, Billman GE. Clinical prevention of sudden cardiac death by n-3 polyunsaturated fatty acids and mechanism of prevention of arrhythmias by n-3 fish oils. Circulation 2003; 107(21):2646-52; и Marchioli R, Barzi F, Bomba E, et al. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)-Prevenzione. Circulation 2002; 105(16): 1897-903). Также наблюдалось значительное антиаритмическое влияние ПНЖК n-3 при исследованиях по ибрилляции предсердий человека (Calo L, Bianconi L, Colivicchi F, et al. N-3 fatty acids for the prevention of atrial fibrillation after coronary artery bypass surgery: a randomized, controlled trial. J Am Coll Cardiol 2005; 45(10): 1723-8). Потенциальное положительное действие жирных кислот ПНЖК n-3 также распространяется на предотвращение и лечение сердечной недостаточности и атеросклероза, а также на уменьшение общих акторов риска, таких как высокие уровни триглицеридов и провоспалительных цитокинов в плазме (Lavie CJ, Milani RV, Mehra MR, Ventura HO. Omega-3 polyunsaturated fatty acids and cardiovascular diseases. J Am Coll Cardiol 2009; 54(7):585-94).
Кроме того, эпидемиологические и экспериментальные исследования показали, что потребление ПНЖК n-3 связано со сниженным риском дегенерации желтого пятна и снижением числа случаев рака толстой кишки, молочной железы, предстательной железы и других видов рака (Serini S, Piccioni Е, Calviello G. Dietary n-3 PUFA vascular targeting and the prevention of tumor growth and age-related macular degeneration. Curr Med Chem. 2009; 16(34):4511-26). Основной общий механизм защиты от макулярной дегенерации и рака состоит в способности ПНЖК n-3 подавлять патологический ангиогенез. ЕРА и DHA подавляют аномальную неоваскуляризацию сетчатки, проницаемость сосудов и воспаление (Connor KM, SanGiovanni JP, Lofqvist C, Aderman CM, Chen J, Higuchi A, Hong S, Pravda EA, Majchrzak S, Carper D, Hellstrom A, Kang JX, Chew EY, Salem N Jr, Serhan CN, Smith LE. Increased dietary intake of omega-3-polyunsaturated fatty acids reduces pathological retinal angiogenesis. Nat Med. 2007 Jul; 13(7):868-73). Ангиогенез представляет собой важный этап роста опухоли и метастазирования, прохождению которого способствуют ПНЖК n-6 и метаболиты, полученные из ПНЖК n-6, но он подавляется ПНЖК n-3 и метаболитами, полученными из ПНЖК n-3 (Kang JX, Liu A. The role of the tissue omega-6/omega-3 fatty acid ratio in regulating tumor angiogenesis. Cancer Metastasis Rev. 2013 Jun; 32(1-2):201-10).
Кроме того, одна из наиболее важных биологических ролей ПНЖК заключается в поставке предшественников для выработки биологически активных метаболитов жирных кислот, которые могут модулировать большое количество ункций (Arm, J.P., and Lee, Т.H. (1993) Clin. Sci. 84: 501-510). Например, арахидоновая кислота (АА; 20:4, n-6) метаболизируется ерментами цитохрома Р450 (CYP) с получением окисленных метаболитов различных классов с высокой биологической активностью (Roman RJ. Р-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 2002; 82:131-85). Основные метаболиты включают 20-гидроксиэйкозатетраеновую кислоту (20-НЕТЕ) и разновидности регио- и стереизомерных эпоксиэйкозатриеновых кислот (EETs). Изо ормы CYP4A и CYP4F позволяют получить 20-НЕТЕ, а изо ормы CYP2C и CYP2J позволяют получить EETs.
Известно, что ЕРА (20:5, n-3) и DHA (22:6, n-3) могут служить альтернативными субстратами при метаболизации аминокислот изо ормами CYP. Представители подсемейств CYP2C и CYP2J, которые эпоксидируют аминокислоты с получением EETs метаболизируют ЕРА в эпоксиэйкозатетраеновые кислоты (EEQs) и DHA в эпоксидокозапентаеновые кислоты (EDPs). Двойная связь ω-3, которая отличает ЕРА и DHA от аминокислот, является предпочтительным местом воздействия большинства эпоксигеназ, в результате которого образуются 17,18-EEQ и 19,20-EDP в качестве основных метаболитов. Изо ормы CYP4A и CYP4F, гидроксилирующие аминокислоты с получением 20-НЕТЕ, метаболизируют ЕРА в 20-гидроксиэйкозапентаеновую кислоту (20-НЕРЕ) и DHA в 22-гидроксидокозагексаеновую кислоту (22-HDHA). CYP1A1, CYP2E1 и другие изо ормы, превращающие аминокислоты предпочтительно в 19-НЕТЕ, демонстрируют выраженную ω-3 эпоксигеназную активность по отношению к ЕРА и DHA (Theuer J, Shagdarsuren Е, Muller DN, Kaergel E, Honeck H, Park JK, Fiebeler A, Dechend R, Haller H, Luft FC, SchunckWH. Inducible NOS inhibition, eicosapentaenoic acid supplementation and angiotensin II-induced renal damage. Kidney Int. 2005; 67:248-58; Schwarz D, Kisselev P, Ericksen SS, Szklarz GD, Chernogolov A, Honeck H, Schunck WH, Roots I. Arachidonic and eicosapentaenoic acid metabolism by human CYP1A1: highly stereoselective formation of 17(R),18(S)-epoxyeicosatetraenoic acid. Biochem Pharmacol. 2004;67:1445-57; Schwarz D, Kisselev P, Chernogolov A, Schunck WH, Roots I. Human CYP1A1 variants lead to differential eicosapentaenoic acid metabolite patterns. Biochem Biophys Res Commun. 2005;336:779-83; Lauterbach B, Barbosa-Sicard E, Wang МЫ, Honeck H, Kargel E, Theuer J, Schwartzman ML, Haller H, Luft FC, Gollasch M, Schunck WH. Cytochrome P450-dependent eicosapentaenoic acid metabolites are novel BK channel activators. Hypertension. 2002;39:609-13; Barbosa-Sicard E, Markovic M, Honeck H, Christ B, Muller DN, Schunck WH. Eicosapentaenoic acid metabolism by cytochrome P450 enzymes of the CYP2C subfamily. Biochem Biophys Res Commun. 2005; 329:1275-81). Значительным признаком CYP-зависимого метаболизма ПНЖК n-3 является предпочтительное эпоксидирование двойной связи n-3, которая отличает ЕРА и DHA от аминокислот. Получаемые метаболиты - 17,18-EEQ из ЕРА и 19,20-EDP из DHA - уникальны в том, что они не имеют гомологов среди аминокислотных продуктов. Наряду с субстратной специ ичностью изо орм CYP, добавка EPA/DHA в пищу вызывает основательный сдвиг от аминокислотных к полученным из ЕРА и DHA эпокси- и ω-гидроксиметаболитам в большинстве органов и тканей у крыс и, предположительно, у человека (Arnold С, Markovic М, Blossey К, Wallukat G, Fischer R, Dechend R, Konkel A, von Schacky C, Luft FC, Muller DN, Rothe M, Schunck WH. Arachidonic acid-metabolizing cytochrome P450 enzymes are targets of (omega}-3 fatty acids. J Biol Chem. 2010 Oct 22;285(43):32720-33 и Keenan AH, Pedersen TL, Fillaus K, Larson MK, Shearer GC, Newman JW. Basal omega-3 fatty acid status affects fatty acid and oxylipin responses to high-dose n3-HUFA in healthy volunteers. J Lipid Res. 2012 Aug; 53(8):1662-9).
EETs и 20-HETE играют важную роль в регуляции различных ункций сердечнососудистой системы (Roman RJ. Р-450 metabolites of arachidonic acid in the control of cardiovasular function. Physiol Rev. 2002;82:131-85). Было показано, что индуцируемая ангиотензином II (Ang II) гипертензия связана с понижающей регуляцией CYP-зависимого метаболизма аминокислот (Kaergel Е, Muller DN, Honeck Н, Theuer J, Shagdarsuren E, Mullally A, Luft FC, Schunck WH. P450-dependent arachidonic acid metabolism and angiotensin II-induced renal damage. Hypertension. 2002; 40:273-9) в модели индуцированной Ang II гипертезии и повреждения органов-мишеней на двойных трансгенных крысах (dTGR, англ.: double-transgenic rat) (Luft FC, Mervaala E, Muller DN, Gross V, Schmidt F, Park JK, Schmitz C, Lippoldt A, Breu V, Dechend R, Dragun D, Schneider W, Ganten D, Haller H. Hypertension-induced end-organ damage: A new transgenic approach to an old problem. Hypertension. 1999; 33:212-8). Трансгенные крысы имеют гены ренина и ангиотензиногена человека, у них местно вырабатывается Ang II, развивается значительная гипертензия, ин аркт миокарда и альбуминурия. Животные погибают от миокардиальной и почечной недостаточности в возрасте менее восьми недель. Данная модель демонстрирует серьезные признаки воспаления, индуцируемого Ang II. Образуются активные ормы кислорода, акторы транскрипции NF-κВ и АР-1 активируются, и активируются гены, содержащие сайты связывания этих акторов транскрипции.
Недавно было показано, что добавка эйкозапентаеновой кислоты (ЕРА) значительно уменьшала смертность dTGR (Theuer J, Shagdarsuren E, Muller DN, Kaergel E, Honeck H, Park JK, Fiebeler A, Dechend R, Haller H, Luft FC, Schunck WH. Inducible NOS inhibition, eicosapentaenoic acid supplementation and angiotensin ll-induced renal damage. Kidney Int. 2005; 67:248-58). Кроме того, было показано, что у dTGR развиваются желудочковые аритмии вследствие индуцируемого Ang II электрического ремоделирования (Fischer R, Dechend R, Gapelyuk A, Shagdarsuren E, Gruner K, Gruner A, Gratze P, Qadri F, Wellner M, Fiebeler A, Dietz R, Luft FC, Muller DN, Schirdewan A. Angiotensin II-induced sudden arrhythmic death and electrical remodeling. Am J Physiol Heart Circ Physiol. 2007; 293:H1242-1253). Лечение крыс dTGR посредством активатора PPAR-аль а вызывало интенсивную СУР2С23-зависимую выработку ЕЕТ и защищало от гипертензии и повреждения органов-мишеней (Muller DN, Theuer J, Shagdarsuren E, Kaergel E, Honeck H, Park JK, Markovic M, Barbosa-Sicard E, Dechend R, Wellner M, Kirsch T, Fiebeler A, Rothe M, Haller H, Luft FC, Schunck WH. A peroxisome proliferator-activated receptor-alpha activator induces renal CYP2C23 activity and protects from angiotensin II-induced renal injury. Am J Pathol. 2004; 164:521-32).
Длительное кормление dTGR (в возрасте с 4 до 7 недель) смесью чистых сложных э иров ЕРА и DHA (Omacor from Solvay Arzneimittel, Hannover, Germany) улучшало электрическое ремоделирование сердца в данной модели индуцируемой ангиотензином II гипертензии. В частности, ЕРА и DHA уменьшали смертность, подавляли индуцибельность сердечных аритмий и защищали от ремоделирования, связанного со щелевыми контактами, содержащими коннексин 43 (Fischer R, Dechend R, Qadri F, Markovic M, Feldt S, Herse F, Park JK, Gapelyuk A, Schwarz I, Zacharzowsky UB, Plehm R, Safak E, Heuser A, Schirdewan A, Luft FC, Schunck WH, Muller DN. Dietary n-3 polyunsaturated fatty acids and direct renin inhibition improve electrical remodeling in a model of high human renin hypertension. Hypertension. 2008 Feb; 51(2):540-6). В целом, CYP-зависимые эйкозаноиды должны считаться вторичными мессенджерами: EETs и 20-НЕТЕ вырабатываются ерментами CYP после индуцируемого внеклеточным сигналом высвобождения аминокислот от мембранных ос олипидов (посредством ос олипазы А2) и выполняют свою ункцию в контексте сигнальных путей, обеспечивающих модулирование транспорта ионов, проли ерации клеток и воспаления. В зависимости от рациона ПНЖК n-3 частично замещают аминокислоты в положении sn2 ос олипидов и, таким образом, могут быть вовлечены в следующие сигнальные пути в качестве альтернативных молекул.
В нескольких исследованиях биологической активности CYP-зависимых эйкозаноидов в сердце была показана важная роль EETs и 20-НЕТЕ в регуляции Са2+ каналов L-типа и чувствительных к АТФ калиевых (КАТР) каналов в сакролемме и митохондриях. В сердечных миоцитах потоки Са2+ через каналы L-типа и сокращение клеток (cell shorting) уменьшаются в результате ингибирования выработки ЕЕТ, и на эти э екты может быть оказано обратное действие путем добавления 11,12-ЕЕТ (Xiao YF, Huang L, Morgan JP. Cytochrome P450: a novel system modulating Ca2+ channels and contraction in mammalian heart cells. J Physiol. 1998; 508 (Pt 3):777-92). Также было показано, что EETs активируют КАТР каналы в сердце. Данный э ект является высокостереоселективным: только S,R-энантиомер 11,12-ЕЕТ был э ективен, а R,S-энантиомер э ективности не проявил (Lu Т, VanRollins М, Lee НС. Stereospecific activation of cardiac ATP-sensitive K(+) channels by epoxyeicosatrienoic acids: a structural determinant study. Mol Pharmacol. 2002;62:1076-83). Сверхэкспрессия вырабатывающего ЕЕТ CYP2J2 человека обеспечила улучшенное ункциональное восстановление сердца трансгенных мышей после ишемии благодаря активации КАТР каналов (Seubert J, Yang В, Bradbury JA, Graves J, Degraff LM, Gabel S, Gooch R, Foley J, Newman J, Mao L, Rockman HA, Hammock BD, Murphy E, Zeldin DC. Enhanced postischemic functional recovery in CYP2J2 transgenic hearts involves mitochondrial ATP-sensitive K+ channels and p42/p44 МАРК pathway. Circ Res. 2004;95:506-14). 20-HETE, как представляется, играет обратную роль, активируя эндогенный блокатор КАТР каналов (Gross ER, Nithipatikom К, Hsu АК, Peart JN, Falck JR, Campbell WB, Gross GJ. Cytochrome P450 omega-hydroxylase inhibition reduces infarct size during reperfusion via the sarcolemmal KATP channel. J Mol Cell Cardiol. 2004;37:1245-9; Nithipatikom K, Gross ER, Endsley MP, Moore JM, Isbell MA, Falck JR, Campbell WB, Gross GJ. Inhibition of cytochrome P450omega-hydroxylase: a novel endogenous cardioprotective pathway. Circ Res. 2004; 95:e65-71).
Известные в настоящее время биологические активности метаболитов, полученных из ЕРА и DHA при помощи CYP, частично похожи на активности их аналогов, полученных из аминокислот, оказываются частично уникальными, или указанные соединения могут оказывать даже противоположные э екты (Westphal С, Konkel A, Schunck WH. Сур-eicosanoids--a new link between omega-3 fatty acids and cardiac disease? Prostaglandins Other Lipid Medial 2011; 96:99-108). Эпоксиметаболиты всех трех ПНЖК обладают сосудорасширяющими свойствами, благодаря которым активности EEQs и EDPs могут превосходить активности EETs в некоторых сосудистых руслах (Lauterbach В, Barbosa-Sicard Е, Wang МН, Honeck Н, Kargel Е, Theuer J, Schwartzman ML, Haller H, Luft FC, Gollasch M, Schunck WH. Cytochrome P450-dependent eicosapentaenoic acid metabolites are novel BK channel activators. Hypertension. 2002;39:609-13). Противовоспалительные э екты были сначала выявлены для 11,12- и 14,15-ЕЕТ, но также их проявляют эпоксиды ЕРА, примером которых является 17,18-EEQ (Morin С, Sirois М, Echave V, Albadine R, Rousseau E. 17,18-epoxyeicosatetraenoic acid targets ppargamma and p38 mitogen-activated protein kinase to mediate its anti-inflammatory effects in the lung: Role of soluble epoxide hydrolase. Am J Respir Cell Mol Biol. 2010; 43:564-575). 17,18-EEQ и 19,20-EDP подавляют индуцируемые Ca2+ и изопротеренолом сокращения кардиомиоцитов у новорожденных, что демонстрирует тот акт, что указанные метаболиты могут служить эндогенными медиаторами антиаритмических э ектов ЕРА и DHA, описанных выше (Arnold С, Markovic М, Blossey К, Wallukat G, Fischer R, Dechend R, Konkel A, von Schacky C, Luft FC, Muller DN, Rothe M, Schunck WH. Arachidonic acid-metabolizing cytochrome P450 enzymes are targets of {omega}-3 fatty acids. J Biol Chem. 2010 Oct 22;285(43):32720-33). Недавно были описаны химически синтезированные соединения, которые обладают антиаритмическими свойствами, как и 17,18-EEQ, в отношении кардиомиоцитов новорожденных и снижают желудочковую тахиаритмию в модели ин аркта миокарда на крысах (Falck JR, Wallukat G, Puli N, Goli M, Arnold C, Konkel A, Rothe M, Fischer R, Muller DN, Schunck WH, 17(R),18(S)-epoxyeicosatetraenoic acid, a potent eicosapentaenoic acid (EPA) derived regulator of cardiomyocyte contraction: structure-activity relationships and stable analogues. J Med Chem. 2011 Jun 23; 54(12):4109-18; WO 2010/081683 A1, также опубликована как патентная публикация США 2012/0122972, содержание указанных источников полностью включено в настоящее описание посредством ссылки, как и содержание других патентных и непатентных публикаций, на которые приводятся ссылки в настоящем описании). Образование 17,18-EEQ и 19,20-EDP может также способствовать антитромботическим э ектам ПНЖК n-3 (Jung F, Schulz С, Blaschke F, Muller DN, Mrowietz C, Franke RP, Lendlein A, Schunck WH. Effect of cytochrome P450-dependent epoxyeicosanoids on Ristocetin-induced thrombocyte aggregation. Clin Hemorheol Microcirc. 2012; 52(2-4):403-16). Более того, существует доказательство важной роли CYP-зависимых эпоксиметаболитов в опосредовании противоположных э ектов ПНЖК n-6 и n-3 в процессах патологического ангиогенеза, описанных выше. Таким образом, полученные из аминокислот EETs способствуют ангиогенезу опухоли и метастазированию (Panigrahy D, Edin ML, Lee CR, Huang S, Bielenberg DR, Butterfield CE, Barnes CM, Mammoto A, Mammoto T, Luria A, Benny O, Chaponis DM, Dudley AC, Greene ER, Vergilio JA, Pietramaggiori G, Scherer-Pietramaggiori SS, Short SM, Seth M, Lih FB, Tomer KB, Yang J, Schwendener RA, Hammock BD, Falck JR, Manthati VL, Ingber DE, Kaipainen A, D'Amore PA, Kieran MW, Zeldin DC. Epoxyeicosanoids stimulate multiorgan metastasis and tumor dormancy escape in mice. J Clin Invest. 2012;122:178-191). Напротив, 19,20-EDP и другие региоизомерные DHA-эпоксиды подавляют эти разрушительные действия в канцерогенезе (Zhang G, Panigrahy D, Mahakian LM, Yang J, Liu JY, Stephen Lee KS, Wettersten HI, Ulu А, Ни X, Tarn S, Hwang SH, Ingham ES, Kieran MW, Weiss RH, Ferrara KW, Hammock BD. Epoxy metabolites of docosahexaenoic acid (dha) inhibit angiogenesis, tumor growth and metastasis. Proc Natl Acad Sci USA. 2013; 110:6530-6535).
Несмотря на то, что метаболиты, полученные из ПНЖК n-3 при помощи CYP, такие как 17,18-EEQ и 19,20-EDP, играют важную роль в опосредовании положительных э ектов ПНЖК n-3 в организме млекопитающего, их не используют в качестве терапевтических агентов из-за их ограниченной биодоступности, а также химической и метаболической нестабильности. Эти эпоксиметаболиты ПНЖК n-3 поддаются автоокислению, быстро инактивируются растворимыми эпоксидгидролазами и разлагаются путем В-окисления. Таким образом, значительный интерес представляют новые агенты для лечения или предотвращения состояний и заболеваний, связанных с воспалением, проли ерацией, патологическим ангиогенезом, гипертензией, коагуляцией, иммунной ункцией, сердечной недостаточностью и сердечными аритмиями, поскольку указанные состояния приводят к значительной смертности у пациентов, а введение большинства используемых в настоящее время лекарственных средств связано со сложными лекарственными взаимодействиями и большим количеством нежелательных побочных э ектов.
Таким образом, проблема, лежащая в основе настоящего изобретения, состоит в обеспечении новых аналогов метаболитов ПНЖК n-3, которые более стабильны в отношении дезактивации растворимой эпоксидгидролазой и/или меньше поддаются автоокислению и которые обладают противовоспалительной, антипроли еративной, антигипертензивной, антикоагуляционной, антиангиогенной и иммуномодулирующей активностью, в частности кардиозащитной активностью, включая защиту от желудочковой аритмии и ибрилляции предсердий.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению общей формулы (I):

или его фармацевтически приемлемой соли,
где
Р представляет собой группу, представленную общей формулой (II):
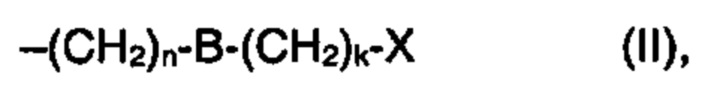
где
В представляет собой связь углерод-углерод; -О-; или -S-;
n равен 0 или представляет собой целое число от 3 до 8; и
k равен 0 или 1; при условии, что, если n равен 0, k равен 1;
X представляет собой группу:
 ;
;  ;
;  ;
;  ;
;
 ;
;  ;
;  :
: ;
;
 ;
;  ;
; 
 ;
; 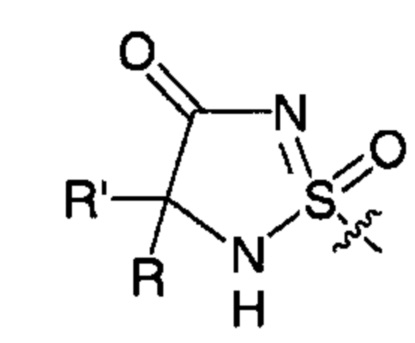 ;
; 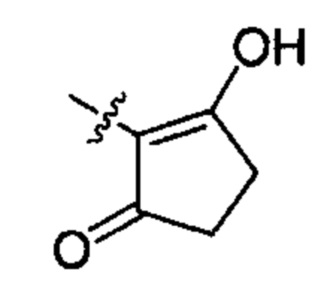 ;
;
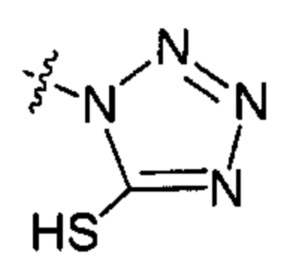 ;
; 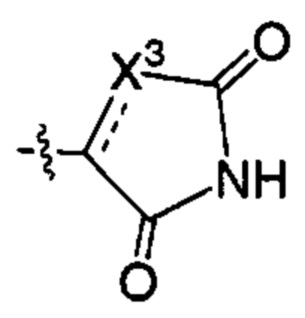 ;
; 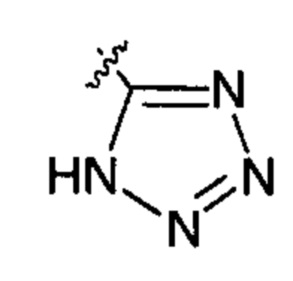 ;
; 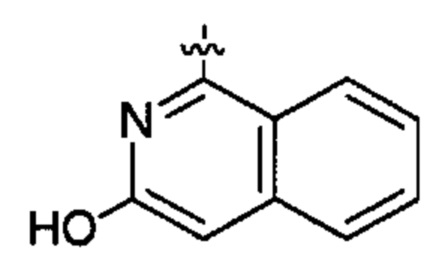 ;
;
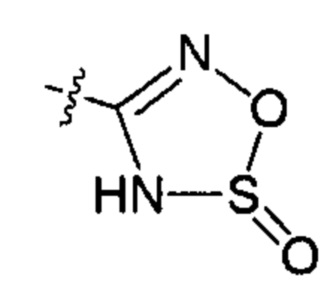 ;
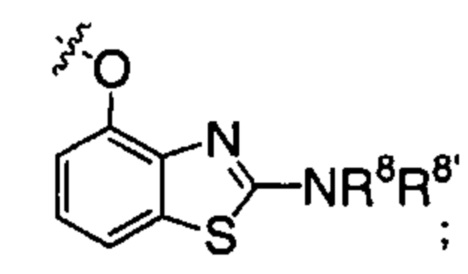
; 
 или
или 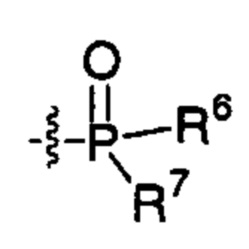 ,
,
где
каждый из R и R' независимо представляет собой атом водорода или C1-С6алкильную группу, которая может содержать в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп);
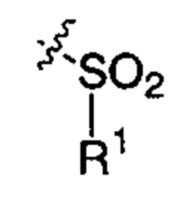
R1 представляет собой гидроксильную группу, С1-С6алкокси, -NHCN, -NH(С1-С6алкил), -NH(С3-С6циклоалкил), -NH(арил) или -O(С1-С6алкилдиил)O(С=O)R11; R11 представляет собой С1-С6алкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора; или С3-С6циклоалкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп);
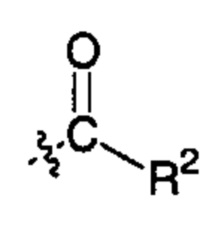
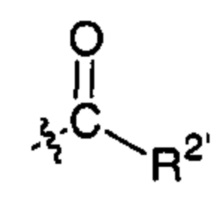
R2 представляет собой -NHR3; -NR20R21; -OR22; -(OCH2-CH2)i-R23; -Хаао; моно- или дисахарид, или их производное, которые присоединены к -С(О) посредством сложноэфирной связи через 1-О-, 3-О- или 6-О-положение сахарида; или выбран из группы, состоящей из:

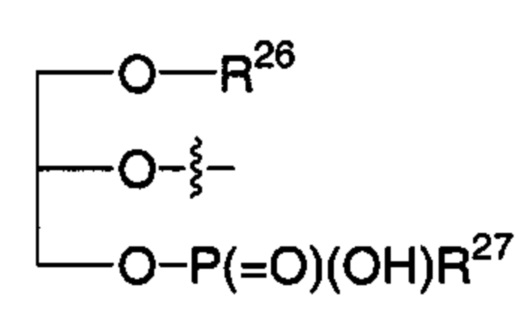
 ,
,
где
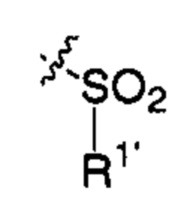
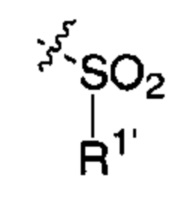
R3 представляет собой (SO2R30); (OR31); -С1-С6алкандиил(SO2R32); или -C1-С6алкандиил(СО2Н);
R30 представляет собой C1-С6алкильную или арильную группу, причем указанная С1-С6алкильная группа необязательно содержит в качестве заместителя -NH2, -NH(C1-С6)алкил, -N(С1-С6)диалкил, C1-С6алкилкарбонилокси-, С1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, С1-С6алкиламинокарбонил-, ди(С1-С6)алкиламинокарбонил-, один, два или три атома фтора или хлора, или гидроксильную группу; и причем указанная арильная группа необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из С1-С6алкила, С1-С6алкокси, C1-С6алкилтио, атома фтора или хлора, гидроксильной группы, аминогруппы, -NH(С1-С6алкил) и -N(C1-С6)диалкила;
R31 представляет собой C1-С6алкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп); или С3-С6циклоалкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп);
R32 представляет собой С1-С6алкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп); или С3-С6циклоалкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп);
R20 и R21 каждый независимо представляет собой атом водорода; C1-С6алкильную группу, которая может содержать в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп); С3-С6циклоалкильную группу, которая может содержать в качестве заместителей один или более атом (-ов) фтора или хлора или гидроксильную (-ых) группу (групп); или -С1-С6алкилдиил(СО2Н);
R22 представляет собой атом водорода, C1-С6алкильную группу или С3-С6циклоалкильную группу; причем указанная C1-С6алкильная группа или указанная С3-С6циклоалкильная группа необязательно содержат в качестве заместителя -NH2, -NH(С1-С6)алкил, -N(C1-С6)диалкил, -NH(С1-С6)алкилдиил- С1-С6алкокси, один, два или три атома фтора или хлора, гидрокси или С1-С6алкокси;
R23 представляет собой -ОН, -O(С1-С3)алкил или -N(С1-С3)диалкил; i представляет собой целое число от 1 до 10;
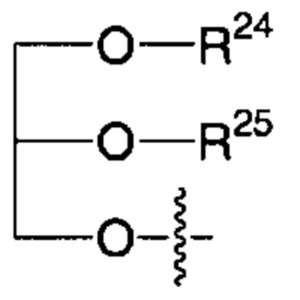
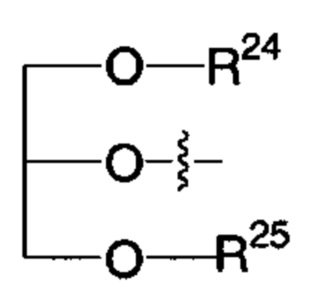
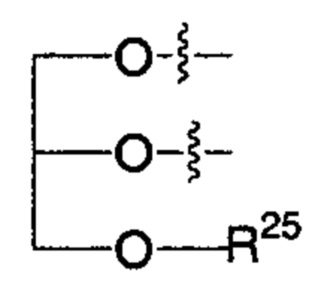
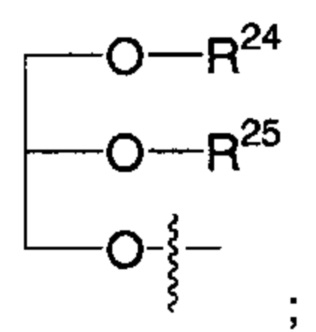
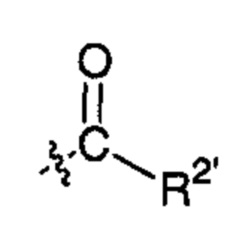
каждый из R24, R25 и R26 независимо представляет собой атом водорода; -С(=O)С11-С21алкил или -С(=O)С11-С21алкенил;
R27 представляет собой -ОН; -O(CH2)2NH2, -OCH2-[CH(NH2)(CO2H)], -O(CH2)2N(CH3)3 или 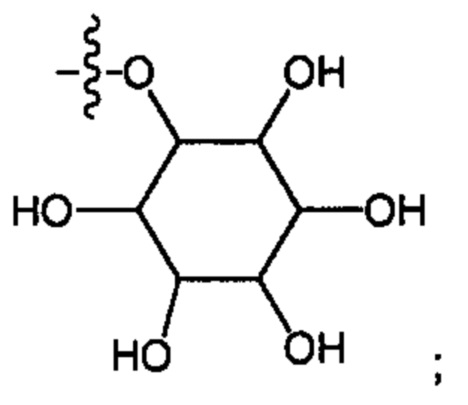
Хаа представляет собой Gly, стандартную D,L-, D- или L-аминокислоту, нестандартную D,L-, D- или L-аминокислоту или 2-10-мерный пептид; и присоединена к -С(О) посредством амидной связи; о представляет собой целое число от 1 до 10;
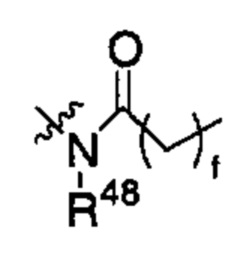
R4 представляет собой
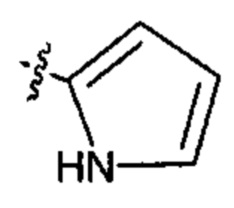 ;
; 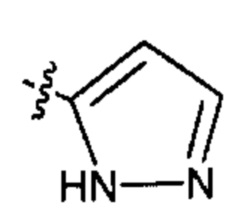 ;
; 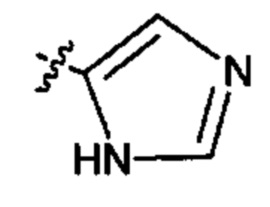 ;
; 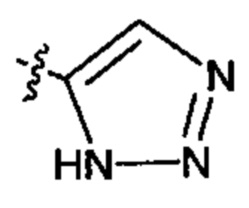 ;
; 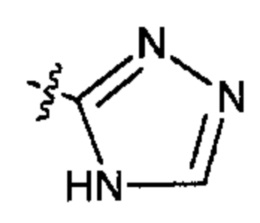 ;
;
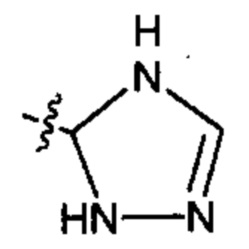 ;
; 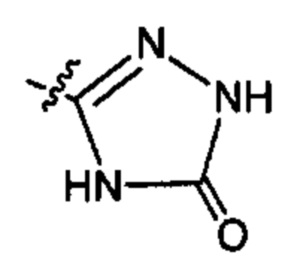 ;
;  или
или 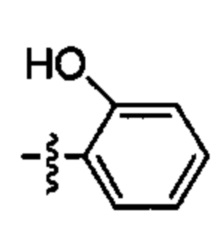 ;
;
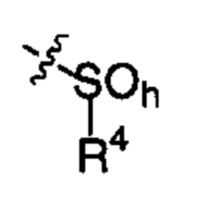
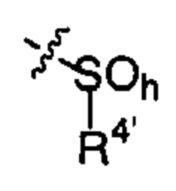
h равен 0, 1 или 2;
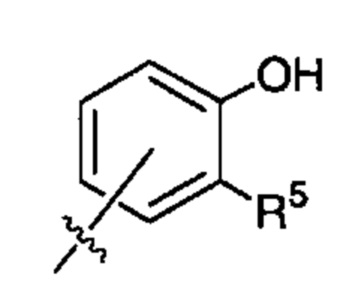
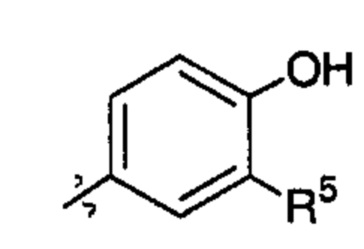
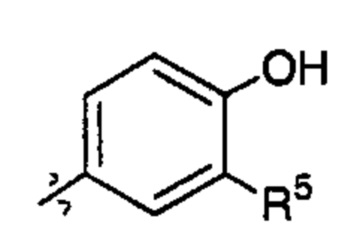
R5 представляет собой атом водорода; атом фтора или хлора; -CF3; -C(=O)OR51; -NHC(=O)R52; -C(=O)NR53R54 или -S(O2)OH;
R51 представляет собой атом водорода; C1-С6алкилыную группу или С3-С6циклоалкильную группу; причем указанная С1-С6алкильная группа или указанная С3-С6циклоалкильная группа необязательно содержат в качестве заместителя -NH2, -NH(С1-С6)алкил, -N(C1-С6)диалкил, -NH(С1-С6)алкилдиил-С1-С6алкокси, один, два или три атома фтора или хлора, гидрокси или С1-С6алкокси;
каждый из R52, R53 и R54 независимо представляет собой C1-С6алкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора; С3-С6циклоалкильную группу, которая необязательно содержит в качестве заместителей один или более атом (-ов) фтора или хлора; или арильную группу, которая необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из C1-С6алкила, C1-С6галогеналкила, С1-С6алкокси, С1-С6алкилтио, атома фтора или хлора, гидроксильной группы, аминогруппы, -NH(С1-С6алкила), -N(C1-С6)диалкила и оксозаместителя;
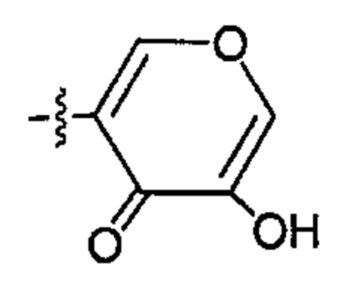
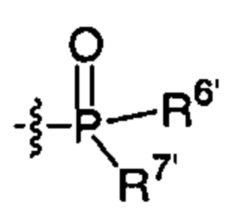
каждый из R6 и R7 независимо представляет собой гидроксильную группу; -O(С1-С6)алкильную группу, -O(С2-С6)алкенильную группу, -O(С1-С6)алкилдиилО(С=O)(С1-С6)алкильную группу или -O(С1-С6)алкилдиилО(С=O)(С2-С6)алкенильную группу; причем указанная C1-С6алкильная группа и указанная С2-С6алкенильная группа могут содержать в качестве заместителей NH2, -NH(С1-С6)алкил, -N(С1-С6)диалкил, С1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонил-, ди(С1-С6)алкиламинокарбонил- или один, два или три атома фтора или хлора; или R6 представляет собой гидроксильную группу и R7 представляет собой группу:
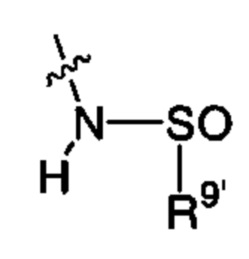
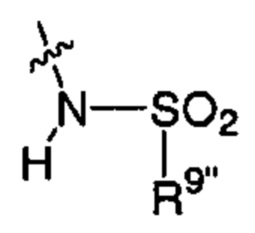
каждый из R8 и R8' независимо представляет собой атом водорода; C1-С6алкильную группу; -С(=O)С1-С6алкил; -С(=O)С3-С6циклоалкил; -С(=О)арил; или -С(=О)гетероарил; причем указанная С1-С6алкильная, указанная С3-С6циклоалкильная, указанная арильная или указанная гетероарильная группы могут содержать один, два или три заместителя, выбранных из группы, состоящей из атома фтора или хлора, гидрокси, -NH2, -NH(C1-С6)алкила, -N(С1-С6)диалкила, -NH(С1-С6)алкандиил-С1-С6алкокси и С1-С6алкокси;
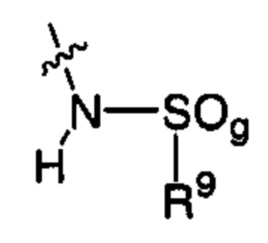
R9 представляет собой С1-С6алкил или арил; причем указанный С1-С6алкил необязательно содержит в качестве заместителя -NH2, -NH(С1-С6)алкил, -N(С1-С6)диалкил, -NH(C1-С6)алкилдиил-С1-С6алкокси, один, два или три атома фтора или хлора, гидрокси, C1-С6алкокси, арил, арилокси, -С(=O)-арил, -С(=O)С1-С6алкокси; и причем указанная арильная группа необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из С1-С6алкила, С1-С6алкокси, C1-С6алкилтио, атома фтора или хлора, гидроксильной группы, аминогруппы, -NH(С1-С6алкила), -N(C1-С6)диалкила и оксозаместителя;
g равен 1 или 2;
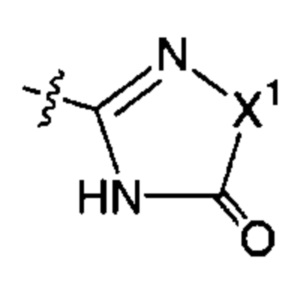
X1 представляет собой атом кислорода; атом серы или NH;
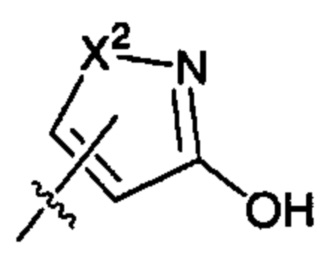
X2 представляет собой атом кислорода; атом серы; NH или N(CH3);
X3 представляет собой атом кислорода; атом серы; атом азота; атом углерода или С-ОН; и пунктирная линия представляет собой связь углерод-углерод или двойную связь углерод-углерод;
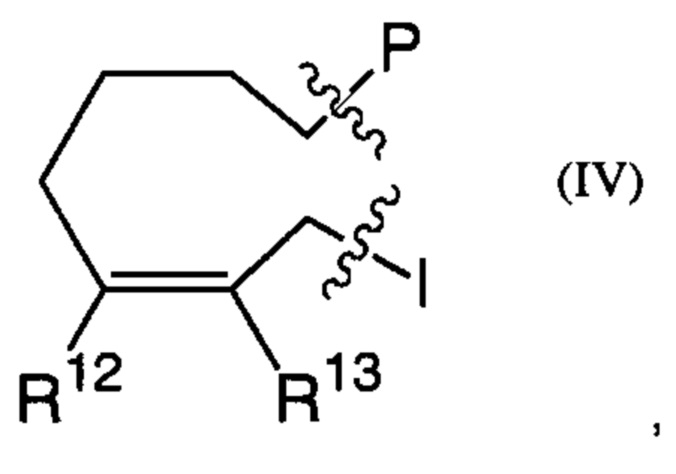
Е представляет собой группу, представленную общей формулой (III) или (IV):
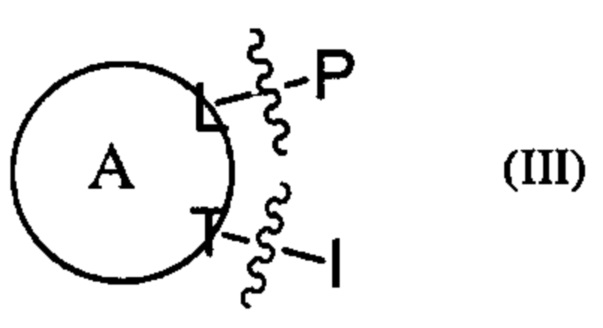
где
кольцо А представляет собой 5-членное или 6-членное карбоциклическое или гетероциклическое кольцо, содержащее по меньшей мере одну двойную связь; и каждый из L и Т независимо представляет собой атом кольца, при этом L и Т являются соседними по отношению друг к другу;
каждый из R12 и R13 независимо представляет собой атом водорода, атом фтора, гидрокси, -NH2, С1-С6алкил, С1-С6алкокси, -С(=O)-арил, -C(=O)C1-С6алкил, или -SO2(С1-С6алкил), или -SО2арил; причем любой из указанных C1-С6алкила, C1-С6алкокси или арила необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, C1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, С1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; или R12 и R13 объединены с образованием 5-членного или 6-членного кольца, которое необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, С1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси;
I представляет собой -(СН2)m-Y, где
m представляет собой целое число от 3 до 6, при условии, что m представляет собой целое число от 3 до 5, если Е представляет собой группу согласно общей формуле (III);
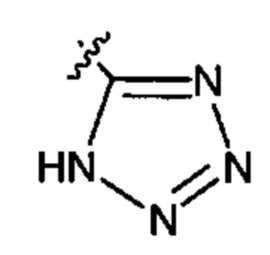
Y представляет собой группу:
 ,
,
где
каждый из R40, R41, R43, R44, R46 и R48 независимо представляет собой атом водорода, гидрокси, -NH2, -С1-С6алкил, -С3-С6циклоалкил, -С1-С6алкокси, -С(=О)арил или -C(=О)C1-С6алкил, причем любой из указанных С1-С6алкила, С3-С6циклоалкила, C1-С6алкокси или арила необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, C1-С6алкилкарбонилокси-, С1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; или R40 и R41 или R43 и R44 объединены с образованием 5-членного или 6-членного кольца, которые могут содержать один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, C1-С6алкилкарбонилокси-, С1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси;
каждый из R42, R45 и R47 независимо представляет собой -С1-С6алкил, причем указанный С1-С6алкил может содержать один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, С1-С6алкилкарбонилокси-, С1-С6алкоксикарбонилокси-, C1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; или R41 и R42; R44 и R45; или R46 и R47 объединены с образованием 5-членного или 6-членного кольца, которые могут содержать один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, С1-С6алкилкарбонилокси-, С1-С6алкоксикарбонилокси-, C1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси;
f представляет собой целое число от 0 до 6;
при условии, что
(i) если n равен 3, В представляет собой О или S, k равен 1, Е представляет собой группу согласно общей формуле (IV), и каждый из R12 и R13 представляет собой атом водорода;
или если n равен 5, 6, 7 или 8, В и k такие, как определено выше, Е представляет собой группу согласно общей формуле (IV) и каждый из R12 и R13 представляет собой атом водорода;
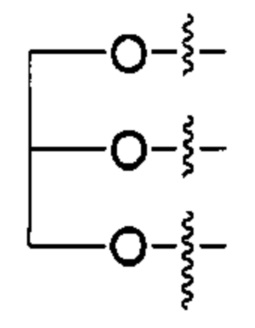
Р представляет собой группу:
-(СН2)3-O-(СН2)-Х81; -(CH2)5-O-(CH2)-X81; -(CH2)3-S-(CH2)-X81; -(CH2)5-S-(CH2)-X81;
-(CH2)5-O-X82; -(CH2)7-O-X82; -S-X82; -O-Х82; -(СН2)5-Х83 или -(СН2)7-Х83;
где
X81 представляет собой группу:
 ;
;  ;
;  ;
; 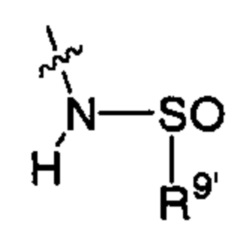 ;
;  или
или 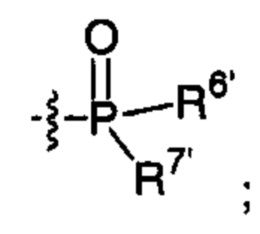
X82 представляет собой группу:
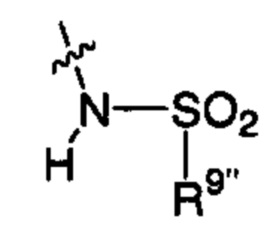
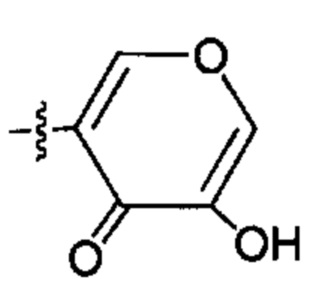
 ;
;  ;
; 
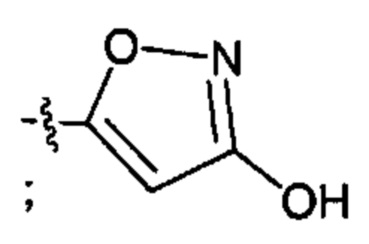 ;
;
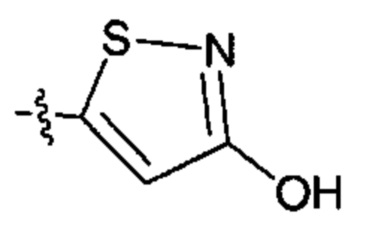 ;
; 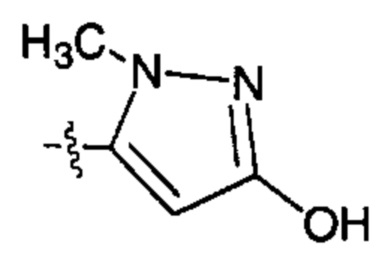 ;
;  ;
; 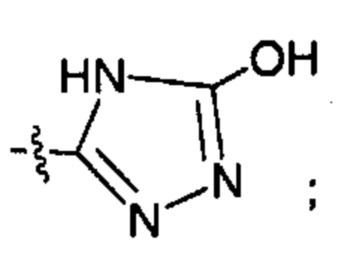
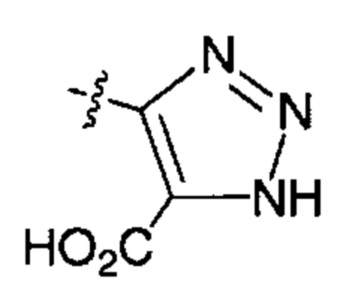 ;
; 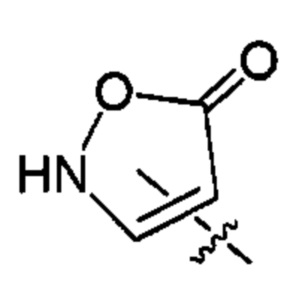 ;
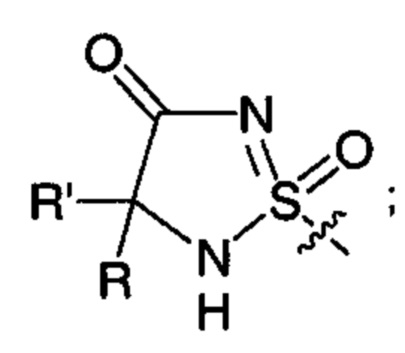
; 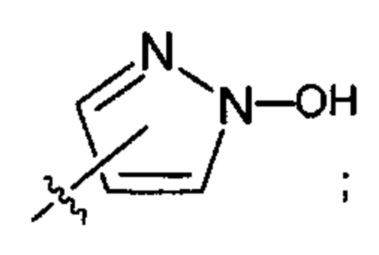
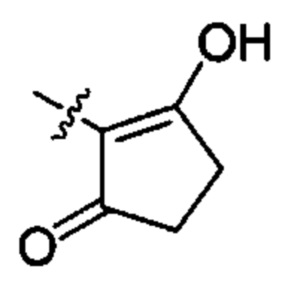
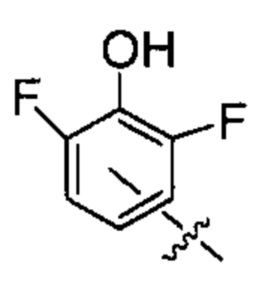 ;
; 
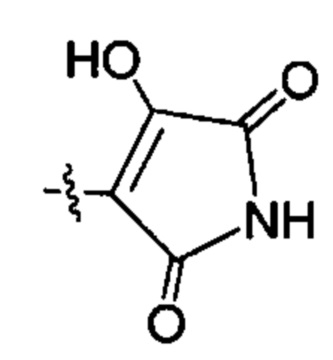 ;
;
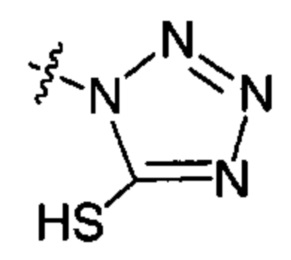 ;
; 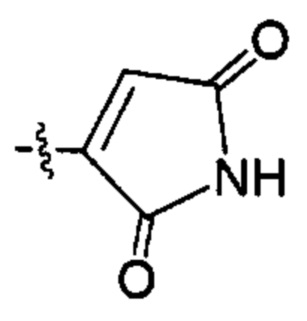 ;
; 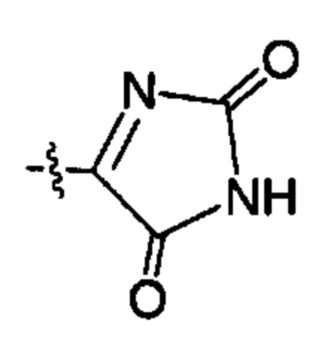 ;
; 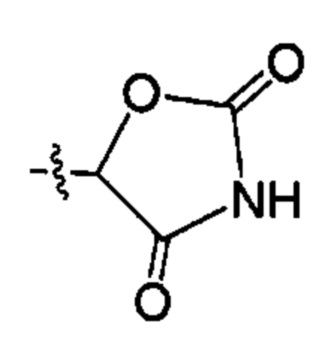 ;
;
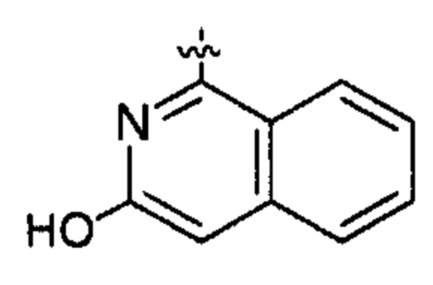 ;
; 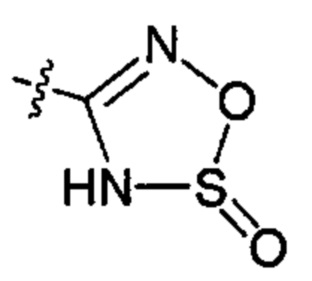 ;
; 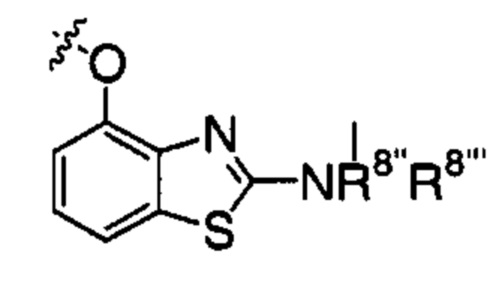 или
или 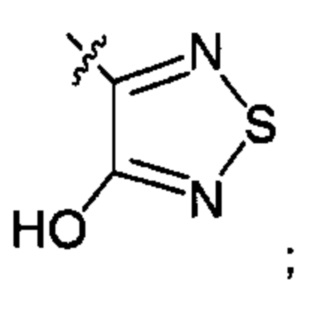
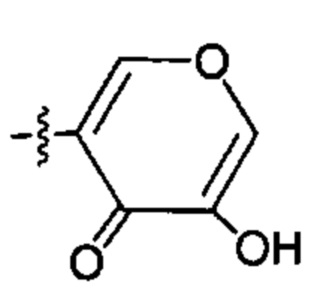
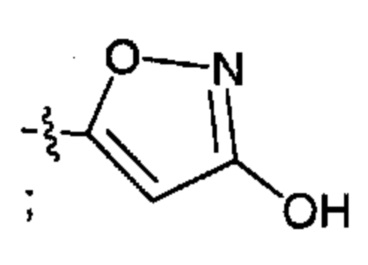
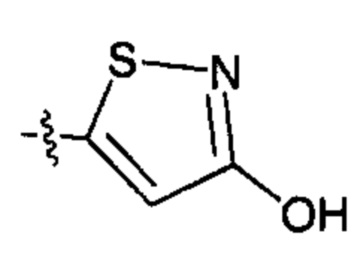
X83 представляет собой группу:
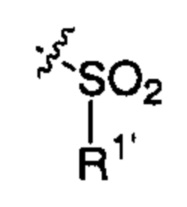 ;
; 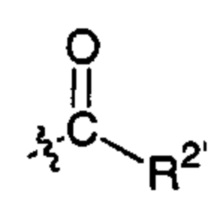 ;
; 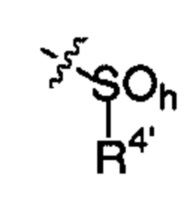 ;
;  ;
;  ;
; 
 ;
;  ;
; 
 ;
;
 ;
; 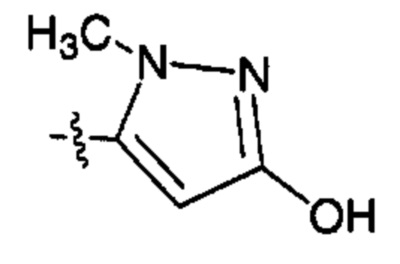 ;
; 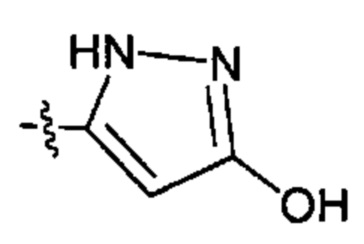 ;
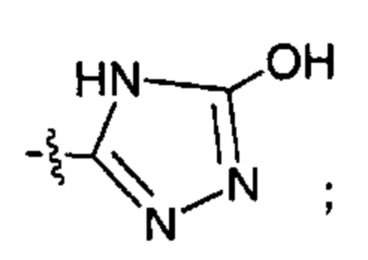
; 
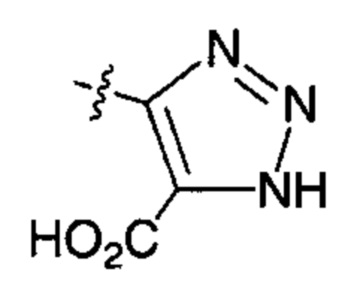 ;
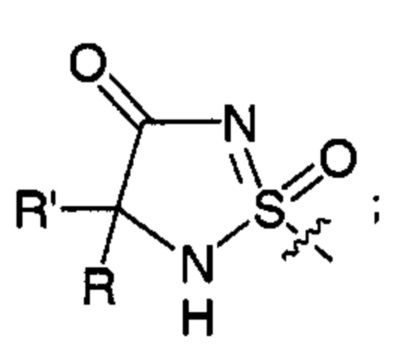
; 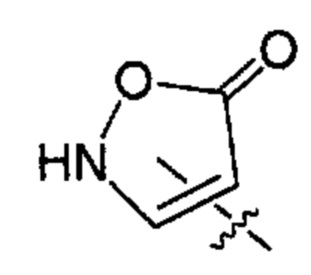 ;
; 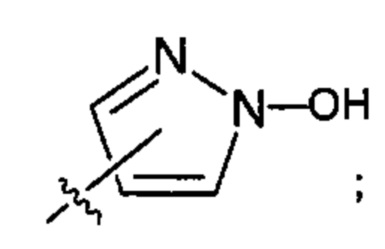
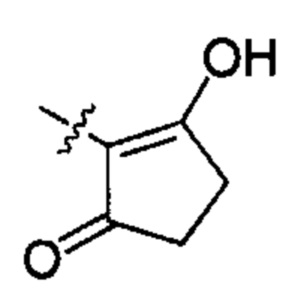
 ;
; 
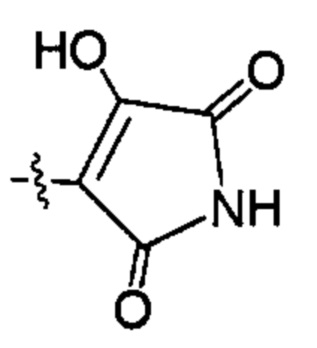 ;
;
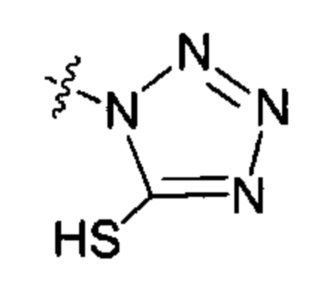 ;
; 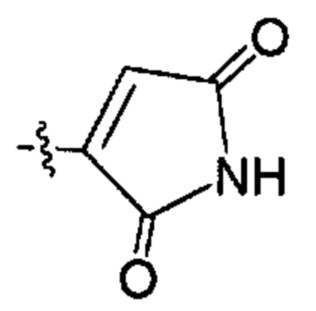 ;
; 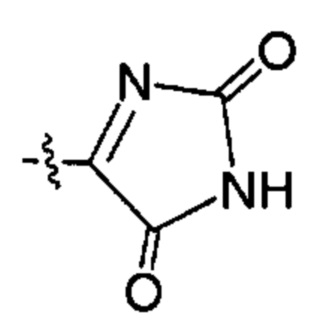 ;
; 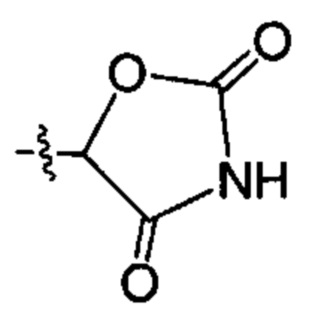 ;
;
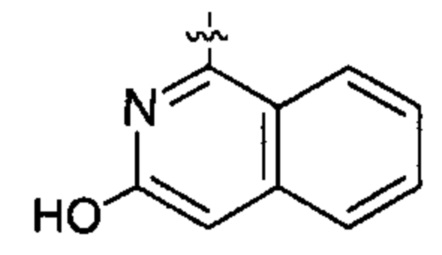 ;
; 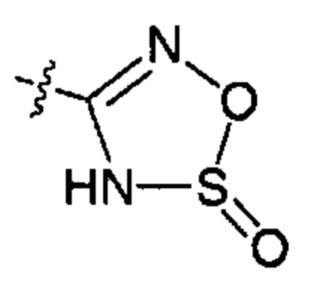 ;
;  или
или 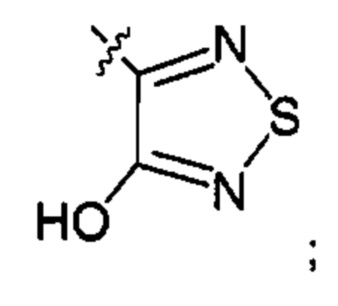
R и R' такие, как определено выше;
R1' такой, как R1, определенный выше;
R2' представляет собой -NHR3'; -OR22'; -(OCH2-CH2)i-R23; моно- или дисахарид, или их производное, которые присоединены к -С(О) посредством сложноэфирной связи через 1-О-, 3-O- или 6-O-положение сахарида; или выбран из группы, состоящей из:
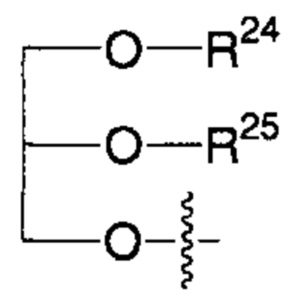
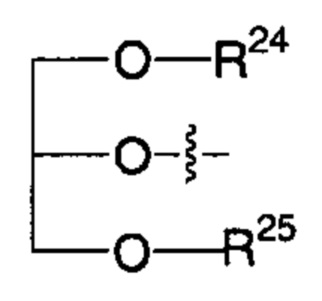
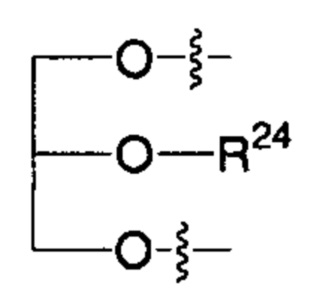
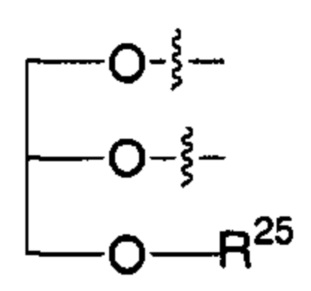
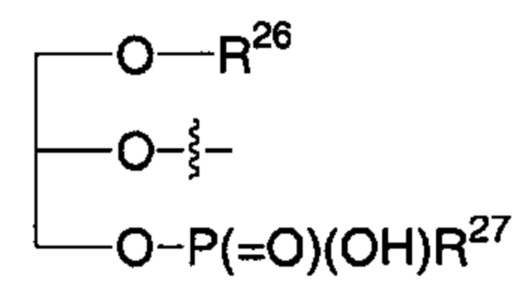
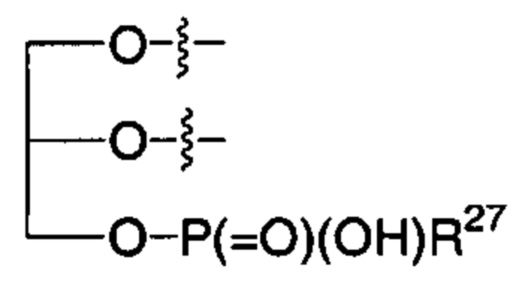 ,
,
где
R3' представляет собой (SO2R30); (OR31); -С1-С6алкандиил(SO2R32); или -С2-С6алкандиил(CO2H);
R22' представляет собой С3-С6циклоалкильную группу, которая необязательно содержит в качестве заместителя -NH2, -NH(С1-С6)алкил, -N(С1-С6)диалкил, -NH(С1-С6)алкилдиил-C1-С6алкокси, один, два или три атома (-ов) фтора или хлора, гидрокси или С1-С6алкокси;
R23 и i такие, как определено выше, при условии, что, если i=3, R23 не является -ОН;
R24, R25, R26 и R27 такие, как определено выше;
R4' такой, как определено для R4 выше; и h такой, как определено выше;
R6' и R7' такие, как определено для R6 и R7 выше;
R8'' и такие, как определено для R8 и R8' выше;
R9' такой, как определено для R9 выше; R9'' представляет собой арил, который необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из С1-С6алкила, С1-С6алкокси, C1-С6алкилтио, атома фтора или хлора, гидроксильной группы, аминогруппы, -NH(С1-С6алкил), -N(С1-С6)диалкила и оксозаместителя; и
(ii) соединения (А) и (В), изображенные ниже:
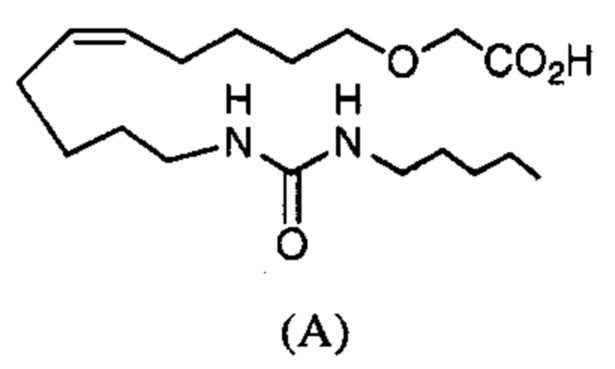 и
и 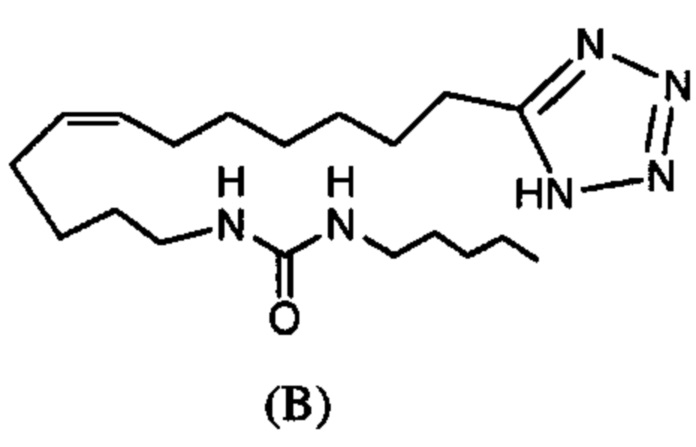 , исключены.
, исключены.
Соединения в общем описаны в настоящем документе с использованием стандартной номенклатуры. Для соединений, имеющих центры асимметрии, следует понимать, что если не указано иное, настоящее изобретение включает все их оптические изомеры и их смеси.
Соединения с двумя или более элементами асимметрии могут присутствовать в виде смесей диастереомеров. Помимо этого, соединения с двойными связями углерод-углерод могут существовать в Z- и Е-формах, и все изомерные формы соединений включены в настоящее изобретение, если не указано иное. Если соединение существует в различных таутомерных формах, такое соединение не ограничено каким-либо конкретным таутомером, а, наоборот, предполагается, что они включают все таутомерные формы. Также предполагается, что указанные соединения включают соединения, в которых один или более атомов заменены изотопом, то есть атомом, имеющим тот же атомный номер, но другое массовое число. В качестве общего примера и без ограничения, изотопы водорода включают тритий и дейтерий, а изотопы углерода включают 11С, 13С и 14С.
Соединения согласно формулам, представленным в настоящем описании, которые имеют один или более стереогенный (-ых) центр (-ов), имеют энантиомерный избыток по меньшей мере 50%. Например, такие соединения могут иметь энантиомерный избыток по меньшей мере 60%, 70%, 80%, 85%, 90%, 95% или 98%. В некоторых вариантах реализации соединения имеют энантиомерный избыток по меньшей мере 99%. Будет очевидно, что отдельные энантиомеры (оптически активные формы) могут быть получены путем асимметрического синтеза из оптически чистых предшественников, биосинтеза, например с применением модифицированного CYP102 (CYP ВМ-3), или путем разделения рацематов, например путем ферментативного разделения или разделения традиционными способами, такими как кристаллизация в присутствии разделяющего агента или хроматография, с использованием, например, колонки для хиральной ВЭЖХ.
Некоторые соединения описаны в настоящем документе с использованием общей формулы, которая включает переменные, такие как, например, Р, Е, I, В, R1-R54, Х-Х83 и Y. Если не указано иное, каждая переменная в такой формуле определена независимо от любой другой переменной, и любая переменная, которая встречается более одного раза в формуле, в каждом случае определена независимо. Таким образом, например, если показано, что группа замещена посредством 0-2 R*, указанная группа может быть незамещенной или может содержать в качестве заместителей до двух групп R*, и R* в каждом случае выбран независимо из определения R*. Также допустимы комбинации заместителей и/или переменных, только если в результате таких комбинаций получаются стабильные соединения, то есть соединения, которые могут быть выделены, охарактеризованы и протестированы на биологическую активность.
В контексте настоящего описания термины «содержащий», «включающий», «имеющий в своем составе», «характеризующийся» и их грамматические эквиваленты представляют собой предполагающие включение и открытые термины, которые не исключают дополнительных неуказанных элементов или стадий способов. Термин «содержащий» и т.п. следует интерпретировать как включающий более ограничивающий термин «состоящий из».
В контексте настоящего описания термин «состоящий из» исключает любой элемент, стадию или ингредиент, который не указан в пункте формулы.
При использовании в настоящем описании торговых наименований предполагается, что независимо включен состав продукта согласно указанному торговому наименованию, лекарственное средство-дженерик и активный (-ые) фармацевтический (-ие) ингредиент (-ы) продукта согласно указанному торговому наименованию.
В целом, если не указано иное, технические и научные термины, используемые в настоящем описании, имеют то же значение, которое обычно понимает специалист в области техники, к которой относится настоящее изобретение, и соответствуют терминам, используемым в общих учебниках и словарях.
«Фармацевтически приемлемая соль» соединения, раскрытого в настоящем описании, представляет собой соль кислоты или основания, которая в данной области техники в общем считается подходящей для применения в контакте с тканями человека или животных без избыточной токсичности или канцерогенности, и предпочтительно без раздражения, аллергической реакции или других проблем или осложнений. Такие соли включают соли, образованных минеральными и органическими кислотами и основными остатками, такими как амины, а также соли, образованные щелочами или органическими частями и кислотными остатками, таких как карбоновые кислоты.
Подходящие фармацевтические соли включают, но не ограничиваются ими, соли кислот, таких как хлористоводородная, фосфорная, бромистоводородная, яблочная, гликолевая, фумаровая, серная, сульфаминовая, сульфаниловая, муравьиная, толуолсульфоновая, метансульфоновая, бензолсульфоновая, этандисульфоновая, 2-гидроксиэтилсульфоновая, азотная, бензойная, 2-ацетоксибензойная, лимонная, винная, молочная, стеариновая, салициловая, глутаминовая, аскорбиновая, памовая, янтарная, фумаровая, малеиновая, пропионовая, гидроксималеиновая, иодистоводородная, фенилуксусная, алкановая, такая как уксусная, НООС-(СН2)n-СООН, где n представляет собой любое целое число от 0 до 6, то есть 0, 1,2, 3, 4, 5 или 6 и тому подобное. Аналогичным образом, фармацевтически приемлемые катионы включают, но не ограничиваются ими, натрий, калий, кальций, алюминий, литий и аммоний. Специалисты в данной области техники смогут определить другие фармацевтически приемлемые соли для соединений, представленных в настоящем описании. В общем, фармацевтически приемлемая соль кислоты или основания может быть синтезирована из исходного соединения, которое содержит основной или кислотный фрагмент, любые обычным химическим способом. Вкратце, такие соли могут быть получены путем реакции форм свободной кислоты или основания указанных соединений со стехиометрическим количеством подходящего основания или кислоты в воде или органическом растворителе, или их в смеси. Как правило, применение неводных сред, таких как эфир, этилацетат, этанол, изопропанол или ацетонитрил, является предпочтительным.
Будет очевидно, что каждое соединение формулы (I) может, но необязательно, присутствовать в форме гидрата, сольвата или нековалентного комплекса. Кроме того, в объем настоящего изобретения входят различные кристаллические формы и полиморфы.
Термин «заместитель» в контексте настоящего описания относится к молекулярному фрагменту, который ковалентно связан с атомом, находящимся в данной молекуле. Например, «заместитель кольца» может представлять собой фрагмент, такой как галоген, алкильная группа, галогеналкильная группа или другой заместитель, описанный в настоящем документе, который ковалентно связан с атомом, предпочтительно атомом кислорода или азота, который входит в состав кольца.
Термин «замещенный» в контексте настоящего описания означает, что любой один или более атомов водорода при указанном атоме заменен заместителем, выбранным из указанных заместителей, при условии, что нормальная валентность указанного атома не превышена, и что указанное замещение приводит к получению стабильного соединения, то есть соединения, которое может быть выделено, охарактеризовано, и его биологическая активность может быть протестирована. Если заместитель представляет собой оксо, то есть =O, 2 атома водорода при указанном атоме могут быть заменены. Оксогруппа, представляющая собой заместитель при ароматическом атоме углерода, приводит в превращению -СН- в -С(=O)- и потере ароматичности. Например, пиридильная группа, замещенная посредством оксо, представляет собой пиридон.
Выражение «необязательно замещенный» относится к группе, в которой один, два, три или более атома водорода заменены независимо друг от друга соответствующими заместителями.
В контексте настоящего описания термин «аминокислота» относится к любой органической кислоте, содержащей один или более аминозаместителей, например к α-, β- или γ-аминопроизводным алифатических карбоновых кислот. При используемом в настоящем описании упоминании полипептидов, например Xaa5, то есть Хаа1Хаа2Хаа3Хаа4Хаа5, где каждая из аминокислот с Xaa1 по Xaa5 независимо выбрана из аминокислот согласно определению, слева находится аминоконец, а справа находится карбоксиконец, в соответствии со стандартными правилами употребления данных терминов и договоренностями.
Термин «стандартная аминокислота» относится к двадцати существующим в природе аминокислотам, выбранным из группы, состоящей из глицина, лейцина, изолейцина, валина, аланина, фенилаланина, тирозина, триптофана, аспарагиновой кислоты, аспарагина, глутаминовой кислоты, глутамина, цистеина, метионина, аргинина, лизина, пролина, серина, треонина и гистидина, и включает все стереомерные изоформы, то есть их D,L-, D- и L-аминокислоты. Эти стандартные аминокислоты могут быть указаны в настоящем описании путем ссылки на их традиционные трехбуквенные или однобуквенные сокращения или сокращения согласно их обычному применению (см., например, Immunology-A Synthesis, 2nd Edition, Е.S. Golub, and D.R. Gren, Eds., Sinauer Associates, Sunderland Mass. (1991)).
Термин «нестандартная аминокислота» относится к не встречающимся в природе аминокислотам или химическим аналогам аминокислот, например α,α-дизамещенным аминокислотам, N-алкиламинокислотам, гомоаминокислотам, дегидроаминокислотам, ароматическим аминокислотам (отличным от фенилаланина, тирозина и триптофана) и орто-, мета- или пара-аминобензойной кислоте. Нестандартные аминокислоты также включают соединения, которые содержат аминную или карбоксильную функциональную группу, разделенные друг от друга с нахождением в положениях 1,3 или дальше, такие как β-аланин, γ-аминомасляная кислота, лактам Фрейдингера (Freidinger lactam), бициклический дипептид (BTD), аминометилбензойную кислоту и другие, хорошо известные в данной области техники. Могут применяться статиноподобные изостеры, гидроксиэтиленовые изостеры, изостеры с восстановленной амидной связью, тиоамидные изостеры, изостеры мочевины, карбаматные изостеры, тиоэфирные изостеры, виниловые изостеры и другие изостеры по амидной связи, известные в данной области техники. Применение аналогов или нестандартных аминокислот может улучшать стабильность и биологическое время полувыведения добавленного пептида, поскольку они более устойчивы к разрушениям в физиологических условиях. Специалист в данной области техники будет осведомлен о подобных типах замещений, которые могут быть сделаны.
Следующий неограничивающий перечень нестандартных аминокислот, которые могут быть использованы в качестве подходящих блоков для получения пептида, и их стандартные сокращения (в скобках) включает: α-аминомасляная кислота (Abu), L-N-метилаланин (Nmala), α-амино-α-метилбутират (Mgabu), L-N-метиларгинин (Nmarg), аминоциклопропан (Cpro), L-N-метиласпарагин (Nmasn), карбоксилат L-N-метиласпарагиновой кислоты (Nmasp), аминоизомасляная кислота (Aib), L-N-метилцистеин (Nmcys), аминонорборнил (Norb), L-N-метилглутамин (Nmgln), карбоксилат L-N-метилглутаминовой кислоты (Nmglu), циклогексилаланин (Chexa), L-N-метилгистидин (Nmhis), циклопентилаланин (Cpen), L-N-метилизолейцин (Nmile), L-N-метиллейцин (Nmleu), L-N-метиллизин (Nmlys), L-N-метилметионин (Nmmet), L-N-метилнорлейцин (Nmnle), L-N-метилнорвалин (Nmnva), L-N-метилорнитин (Nmorn), L-N-метилфенилаланин (Nmphe), L-N-метилпролин (Nmpro), L-N-метилсерин (Nmser), L-N-метилтреонин (Nmthr), L-N-метилтриптофан (Nmtrp), D-орнитин (Dorn), L-N-метилтирозин (Nmtyr), L-N-метилвалин (Nmval), L-N-метилэтилглицин (Nmetg), L-метил-трет-бутилглицин (Nmtbug), L-норлейцин (Nle), L-норвалин (Nva), α-метил-аминоизобутират (Maib), α-метил-γ-аминобутират (Mrabu), D-α-метилаланин (Dmala), α-метилциклогексилаланин (Mchexa), D-α-метиларгинин (Dmarg), α-метилциклопентилаланин (Mcpen), D-α-метиласпарагин (Dmasn), α-метил-α-нафтилаланин (Manap), D-α-метиласпартат (Dmasp), α-метилпеницилламин (Mpen), D-α-метилцистеин (Dmcys), N-(4-аминобутил)глицин (Nglu), D-α-метилглутамин (DMrln), N-(2-аминоэтил)глицин (Naeg), D-α-метилгистидин (Dmhis), N-(3-аминопропил)глицин (Norn), D-α-метилизолейцин (Dmile), N-амино-α-метилбутират (Nmaabu), D-α-метиллейцин (Dmleu), α-нафтилаланин (Anap), D-α-метиллизин (Dmlys), N-бензилглицин (Nphe), D-α-метилметионин (Dmmet), N-(2-карбамилэтил)глицин (Ngln), D-α-метилорнитин (Dmorn), N-(карбамилметил)глицин (Nasn), D-α-метилфенилаланин (Dmphe), N-(2-карбоксиэтил)глицин (Nglu), D-α-метилпролин (Dmpro), N-(карбоксиметил)глицин (Nasp), D-α-метилсерин (Dmser), N-циклобутилглицин (Ncbut), D-α-метилтреонин (Dmthr), N-циклогептилглицин (Nchep), D-α-метилтриптофан (Dmtrp), N-циклогексилглицин (Nchex), D-α-метилтирозин (Dmty), N-циклодецилглицин (Ncdec), D-α-метилвалин (Dmval), N-циклододецилглицин (Ncdod), D-N-метилаланин (Dnmala), N-циклооктилглицин (Ncoct), D-N-метиларгинин (Dnmarg), N-циклопропилглицин (Ncpro), D-N-метиласпарагин (Dnmasn), N-циклоундецилглицин (Ncund), D-N-метиласпартат (Dnmasp), N-(2,2-дифенилэтил)глицин (Nbhm), D-N-метилцистеин (Dnmcys), N-(3,3-дифенилпропил)глицин (Nbhe), D-N-метилглутамин (Dnmgln), N-(3-гуанидинопропил)глицин (Narg), D-N-метилглутамат (Dnmglu), N-(1-гидроксиэтил)глицин (Ntbx), D-N-метилгистидин (Dnmhis), N-(гидроксиэтил))глицин (Nser), D-N-метилизолейцин (Dnmile), N-(имидазолилэтил))глицин (Nhis), D-N-метиллейцин (Dnmleu), N-(3-индолилэтил)глицин (Nhtrp), D-N-метиллизин (Dnnilys), N-метил-γ-аминобутират (Nwrabu), N-метилциклогексилаланин (Nmchexa), D-N-метилметионин (Dnmmet), D-N-метилорнитин (Dnmorn), N-метилциклопентилаланин (Nmcpen), N-метилглицин (Nala), D-N-метилфенилаланин (Dnmphe), N-метиламиноизобутират (Nmaib), D-N-метилпролин (Dnmpro), N-(1-метилпропил)глицин (Nile), D-N-метилсерин (Dnmser), N-(2-метилпропил)глицин (Nleu), D-N-метилтреонин (Dnmthr), D-N-метилтриптофан (Dnmtrp), N-(1-метилэтил)глицин (Nval), D-N-метилтирозин (Dnmtyr), N-метилнафтилаланин (Nmanap), D-N-метилвалин (Dnmval), N-метилпеницилламин (Nmpen), уаминомасляная кислота (Gabu), N-(р-гидроксифенил)глицин (Nhtyr), L-/-бутилглицин (Tbug), N-(тиометил)глицин (Ncys), L-этилглицин (Etg), пеницилламин (Pen), L-гомофенилаланин (Hphe), L-α-метилаланин (Mala), L-α-метиларгинин (Marg), L-α-метиласпарагин (Masn), L-α-метиласпартат (Masp), L-α-метил-трет-бутилглицин (Mtbug), L-α-метилцистеин (Mcys), L-метилэтилглицин (Metg), L-α-метилглутамин (Mrln), L-α-метилглутамат (Mrlu), L-α-метилгистидин (Mhis), L-α-метилгомофенилаланин (Mhphe), L-α-метилизолейцин (Mile), N-(2-метилтиоэтил)глицин (Nmet), L-α-метиллейцин (Mleu), L-α-метиллизин (Mlys), L-α-метилметионин (Mmet), L-α-метилнорлейцин (Mnle), L-α-метилнорвалин (Mnva), L-α-метилорнитин (Morn), L-α-метилфенилаланин (Mphe), L-α-метилпролин (Mpro), L-α-метилсерин (Mser), L-α-метилтреонин (Mthr), L-α-метилтриптофан (Mtrp), L-α-метилтирозин (Mtyr), L-α-метилвалин (Mval), L-N-метилгомофенилаланин (Nmhphe), N-(N-(2,2-дифенилэтил)карбамилметил)глицин (Nnbhm), N-(N-(3,3-дифенилпропил)карбамилметил)глицин (Nnbhe), 1-карбокси-1-(2,2-дифенил-этиламино)циклопропан (Nmbc), L-O-метилсерин (Omser), L-O-метилгомосерин (Omhser).
Термин «алкил» относится к насыщенной углеводородной группе с неразветвленной или разветвленной цепью, которая содержит от 1 до 20 атомов углерода, предпочтительно от 1 до 10 атомов углерода, например н-октильной группе, в частности от 1 до 6, то есть 1,2, 3, 4, 5 или 6 атомов углерода, например метилу, этилу, пропилу изопропилу, н-бутилу, изобутилу, emop-бутилу, трет-бутилу, н-пентилу, изопентилу, н-гексилу или 2,2-диметилбутилу.
Термин «алкенил» относится к по меньшей мере частично ненасыщенной углеводородной группе с неразветвленной или разветвленной цепью, которая содержит от 2 до 21 атомов углерода, предпочтительно от 2 до 6 атомов углерода, то есть 2, 3, 4, 5 или 6 атомов углерода, например этенильной (винильной), пропенильной (аллильной) изопропенильной, бутенильной, этинильной, пропинильной, бутинильной, ацетиленильной, пропаргильной, изопренильной или гекс-2-енильной группе, или от 11 до 21 атомов углерода, то есть 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 атомов углерода, например углеводородной группе, содержащей цепь из метиленовых звеньев, в промежутке между которыми находится одна двойная связь, как, например, встречается в мононенасыщенных жирных кислотах, или углеводородной группе, содержащей полиены, в промежутке между которыми находится метилен, например углеводородной группе, содержащей два или более структурных звеньев -[СН=СН-СН2]-, как, например, встречается в полиненасыщенных жирных кислотах. Алкенильные группы содержат одну или более, предпочтительно 1, 2, 3, 4, 5 или 6, двойную (-ых) связь (-ей).
Термин «алкокси» относится к алкильной группе, соединенной одинарной связью с кислородом.
Термин «алкилтио» относится к алкильной группе, соединенной одинарной связью с серой.
Выражения «циклоалкил» и «карбоциклическое кольцо» относятся к насыщенной циклической углеводородной группе, которая содержит одно или более колец, предпочтительно 1 или 2, и содержит от 3 до 14 атомов углерода в кольце, предпочтительно от 3 до 10, в частности 3, 4, 5, 6 или 7 атомов углерода в кольце, примерами являются циклопропильная, циклобутильная, циклопентильная, спиро[4,5]деканильная, норборнильная, циклогексильная, декалинильная, бицикло[4.3.0]нонильная, тетралиновая или циклопентилциклогексильная группы.
Термин «арил» относится к ароматический группе, которая содержит одно или более колец, содержащих от 6 до 14 атомов углерода в кольце, предпочтительно от 6 до 10, в частности 6, атомов углерода в кольце.
Термин «гетероарил» относится к ароматической группе, которая содержит одно или более колец, содержащих от 5 до 14 атомов в кольце, предпочтительно от 5 до 10, в частности 5 или 6, атомов в кольце, и содержит один или более, предпочтительно 1, 2, 3 или 4, атомов кислорода, азота, фосфора или серы в кольце, предпочтительно О, S или N. Примерами являются пиридильная (например, 4-пиридильная) имидазолильная (например, 2-имидазолильная), фенилпирролильная (например, 3-фенилпирролильная), тиазолильная, изотиазолильная, 1,2,3-триазолильная, 1,2,4-триазолильная, оксадиазолильная, тиадиазолильная, индолильная, индазолильная, тетразолильная, пиразинильная, пиримидинильная, пиридазинильная, оксазолильная, изоксазолильная, триазолильная, тетразолильная, изоксазолильная, индазолильная, индолильная, бензимидазолильная, бензоксазолильная, бензизоксазолильная, бензтиазолильная, пиридазинильная, хинолинильная, изохинолинильная, пирролильная, пуринильная, карбазолильная, акридинильная, пиримидильная, 2,3'-бифурильная, пиразолильная (например, 3-пиразолильная) и изохинолинильная группы.
Выражение «гетероциклическое кольцо» относится к гетероарильной группе, определенной выше, циклоалкильной группе или карбоциклическому кольцу, определенным выше, в которых один или более (предпочтительно 1, 2 или 3) атомов углерода в кольце, каждый независимо, заменены атомом кислорода, азота, кремния, селена, фосфора или серы, предпочтительно атомом кислорода, серы или азота. Гетероциклическое кольцо предпочтительно содержит 1 или 2 кольца, содержащие от 3 до 10, в частности 3, 4, 5, 6 или 7 атомов в кольце, предпочтительно выбранных из С, О, N и S. Примерами являются азиридинильная, оксиранильная, тииранильная (thiiranyl), оксазиридинильная, диоксиранильная, азетидинильная, оксетанильная, тиетанильная, диазетидинильная, диоксетанильная, дитиетанильная, пирролидинильная, тетрагидрофуранильная, тиоланильная, фосфоланильная, силоланильная, азолильная, тиазолильная, изотиазолильная, имидазолидинильная, пиразолидинильная, оксазолидинильная, изоксазолидинильная, тиазолидинильная, изотиазолидинильная, диоксоланильная, дитиоланильная, пиперазинильная, морфолинильная, тиоморфолинильная, триоксанильная, азепанильная, оксепанильная, тиепанильная, гомопиперазинильная или уротропинильная группы.
Общий термин «кольцо» в контексте настоящего описания, если не указано иное, включает циклоалкильные группы или карбоциклические кольца, гетероциклические кольца, арильные группы и гетероарильные группы.
Термины «гало», «галоген» или «атом галогена» в контексте настоящего описания означают фтор, хлор, бром или иод, предпочтительно фтор и/или хлор.
Выражение «моно- или дисахарид и их производные» в контексте настоящего описания означает углеводород или сахар, принадлежащий к или полученный из группы моносахаридов или дисахаридов.
Примеры моно-, дисахаридов и производных включают глюкозу, 3-О-метилглюкозу, 1-дезоксиглюкозу, 6-дезоксиглюкозу, галактозу, маннозу, фруктозу, ксилозу, рибозу, целлобиозу, мальтозу, лактозу, гентиобиозу, сахарозу, трегалозу и маннитол, сорбитол и рибитол. Предпочтительно сахариды представляют собой сахариды в D-форме, например D-глюкозу, 3-О-метил-D-глюкозу, 1-дезокси-D-глюкозу или 6-дезокси-D-глюкозу, D-галактозу, D-маннозу.
В контексте настоящего описания выражение, определяющее пределы диапазона длины, такое как, например, «от 1 до 5», означает любое целое число от 1 до 5, то есть 1, 2, 3, 4 и 5. Другими словами, подразумевается, что любой диапазон, определенный двумя явно указанными целыми числами, включает и раскрывает любое целое число, определяющее указанные пределы и любое целое число, входящее в указанный диапазон.
Согласно настоящему изобретению соединение формулы (I) может представлять собой соединение, в котором Е представляет собой группу, представленную общей формулой (IV); один из R12 и R13 представляет собой атом водорода, а другой представляет собой атом фтора, гидрокси, -NH2, C1-С6алкил, С1-С6алкокси, -С(=O)-арил, -С(=O)С1-С6алкил, или -SO2(С1-С6алкил), или -SО2арил; причем любой из указанных C1-С6алкила, C1-С6алкокси или арила необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, C1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, С1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; или R12 и R13 объединены с образованием 5-членного или 6-членного кольца, которое необязательно содержит один, два или три заместителя, выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкил, -N(С1-С6)диалкила, C1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, С1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; и Р и I такие, как определено выше.
Согласно настоящему изобретению соединение формулы (I) также может представлять собой соединение, в котором Е представляет собой группу, представленную общей формулой (IV); каждый из R12 и R13 независимо представляет собой атом фтора, гидрокси, -NH2, С1-С6алкил, С1-С6алкокси, -С(=O)-арил, -C(=O)C1-С6алкил, или -SO2(C1-С6алкил), или -SО2арил; причем любой из указанных С1-С6алкила, С1-С6алкокси или арила необязательно содержит один, два или три заместителя, независимо выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, С1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, С1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; или R12 и R13 объединены с образованием 5-членного или 6-членного кольца, которое необязательно содержит один, два или три заместителя, выбранных из группы, состоящей из -NH2, -NH(С1-С6)алкила, -N(С1-С6)диалкила, C1-С6алкилкарбонилокси-, C1-С6алкоксикарбонилокси-, С1-С6алкилкарбонилтио-, C1-С6алкиламинокарбонила-, ди(С1-С6)алкиламинокарбонила-, атома фтора или хлора и гидрокси; и Р и I такие, как определено выше.
Предпочтительно соединение формулы (I) может представлять собой соединение, в котором Е представляет собой группу, представленную общей формулой (IV); I такой, как определено выше; и Р представляет собой группу: -(СН2)3-O-(СН2)-Х81; -(СН2)5-O-(СН2)-Х81; -(CH2)3-S-(CH2)-X81; -(CH2)5-S-(CH2)-X81; -(CH2)5-O-X82; -(CH2)7-O-X82; -S-X82; -O-Х82; -(СН2)5-Х83 или -(СН2)7-Х83; где X81, X82 и X83 такие, как определено выше.
В соединении согласно настоящему изобретению Р может представлять собой группу -(СН2)5-Х83 или -СН2)7-Х83; где X83 такой, как определено выше.
Соединение согласно настоящему изобретению может представлять собой соединение, в котором X83 представляет собой группу, выбранную из группы, состоящей из:
 ;
;  ;
;  ;
; 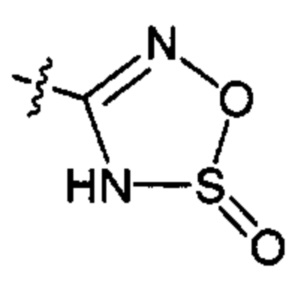 или
или 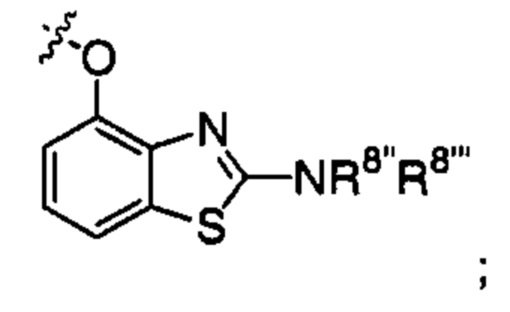
где R1', R2', R6', R7', R8'' и R8''' такие, как определено выше.
Предпочтительно соединение согласно настоящему изобретению может представлять собой соединение, в котором R1' представляет собой гидроксильную группу; и R2' представляет собой -NHR3 или группу
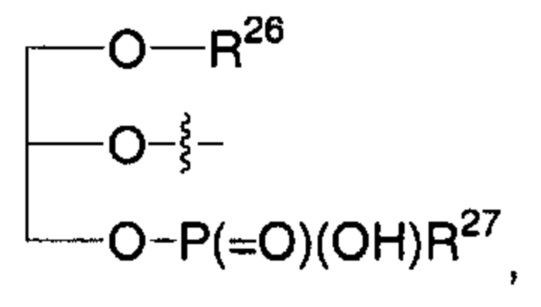
где
R3' представляет собой (SO230), R30 представляет собой -С1-С6алкил или фенил; R26 такой, как определено выше; R27 представляет собой -OCH2-[CH(NH2)(CO2H)], -O(CH2)2N(CH3)3 или 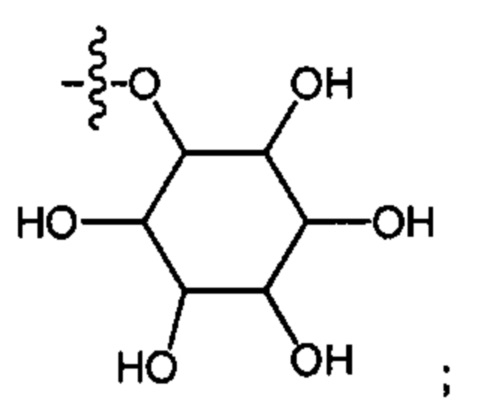
каждый из R6' и R7' независимо представляет собой гидроксильную группу; -O(С1-С6)алкильную группу или -O(СН2)O(С=O)(С1-С6)алкильную группу; и
R8'' представляет собой атом водорода; a R8''' представляет собой -С(=O)С1-С6алкил.
Соединение формулы (I) может также представлять собой соединение, в котором Е представляет собой группу, представленную общей формулой (III); и Р и I такие, как определено выше.
Соединение формулы (I) может представлять собой соединение, в котором Е представляет собой группу, представленную общей формулой (III); каждый из L и Т независимо представляет собой атом углерода, азота или серы; по меньшей мере один из L и Т представляет собой атом углерода; Р и I такие, как определено выше.
Предпочтительно каждый из L и Т независимо представляет собой атом углерода или азота, причем по меньшей мере один из L и Т представляет собой атом углерода. L и Т могут оба представлять собой атомы углерода.
Предпочтительно соединение формулы (I) может представлять собой соединение, в котором Е представляет собой
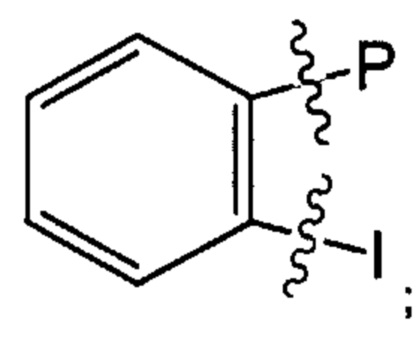 и
и
Р и I такие, как определено выше; предпочтительно Р представляет собой группу -(СН2)6-Х, -(СН2)7-Х, -(СН2)8-Х или -(СН2)9-Х; более предпочтительно Р представляет собой группу -(СН2)6-Х или -(СН2)9-Х; и наиболее предпочтительно Р представляет собой группу -(СН2)9-Х; где X такой, как определено выше; более предпочтительно X представляет собой
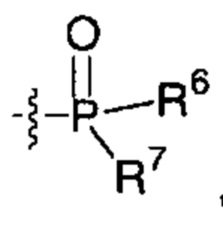 , где R6 и R7 такие, как определено выше; более предпочтительно каждый из R6 и R7 независимо представляет собой -O(СН2)O(С=O)(С1-С6)алкильную группу.
, где R6 и R7 такие, как определено выше; более предпочтительно каждый из R6 и R7 независимо представляет собой -O(СН2)O(С=O)(С1-С6)алкильную группу.
В соединении согласно настоящему изобретению I может представлять собой -(CH2)m-Y, где m равен 3; a Y представляет собой группу:
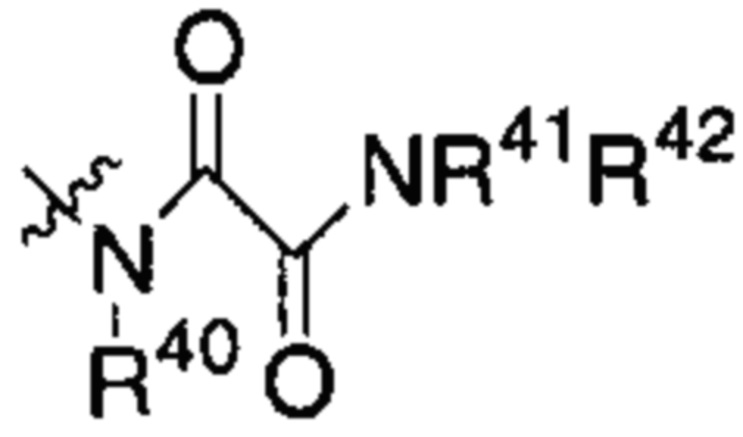 или
или 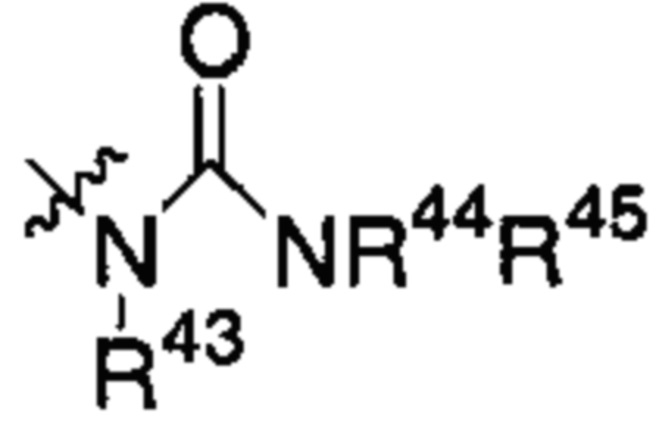
где
каждый из R40, R41, R43 и R44 представляет собой атом водорода; и каждый из R42 и R45 независимо представляет собой -C1-С6алкильную группу.
В соединении согласно настоящему изобретению, в котором Е представляет собой группе, представленную общей формулой (III); I предпочтительно представляет собой -(CH2)m-Y; m равен 4; и Y представляет собой группу:
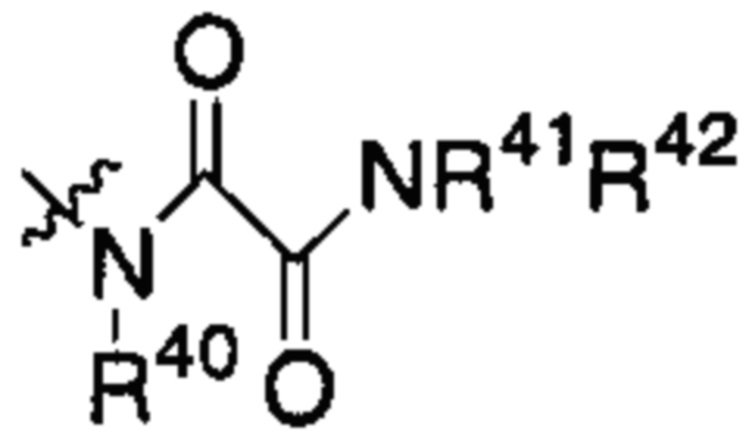 или
или 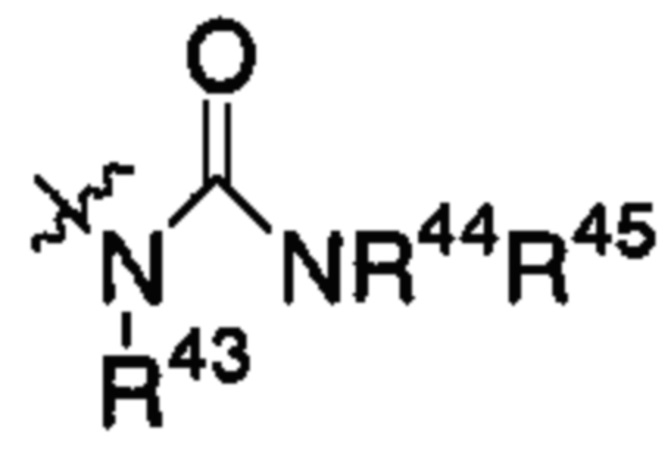
где
каждый из R40, R41, R43 и R44 представляет собой атом водорода; и каждый из R42 и R45 независимо представляет собой -C1-С6алкильную группу.
В соединении согласно настоящему изобретению R42 предпочтительно может представлять собой метильную группу; и R45 предпочтительно может представлять собой этильную группу.
В соединении согласно настоящему изобретению каждый из R24, R25 и R26 независимо может представлять собой атом водорода; -С(=O)(СН2)10СН3, -C(=O)(CH2)12CH3, -С(=O)(СН2)14СН3, -С(=O)(СН2)16СН3, -C(=O)(CH2)18CH3, -С(=О)(СН2)20СН3; -С(=O)(СН2)7СН=СН(СН2)3СН3, -С(=O)(СН2)7СН=СН(СН2)5СН3, -С(=O)(СН2)4СН=СН(СН2)8СН3, -С(=O)(СН2)7СН=СН(СН2)7СН3, -С(=O)(СН2)9СН=СН(СН2)5СН3, -С(=O)(СН2)11СН=СН(СН2)7СН3, -С(=O)(СН2)7СН=СНСН2СН=СН(СН2)4СН3, -С(=O)(СН2)7(СН=СНСН2)3СН3, -С(=O)(СН2)3(СН=СНСН2)4(СН2)3СН3, -С(=O)(СН2)3(СН=СНСН2)5СН3 или -С(=O)(СН2)2(СН=СНСН2)6СН3. Предпочтительно каждый из R24, R25 и R26 независимо может представлять собой атом водорода; -С(=O)(СН2)10СН3, -C(=O)(CH2)12CH3, -C(=O)(CH2)14CH3, -C(=O)(CH2)16CH3; -С(=O)(СН2)7СН=СН(СН2)5СН3, -С(=O)(СН2)7СН=СН(СН2)7СН3, -С(=O)(СН2)7СН=СНСН2СН=СН(СН2)4СН3, -С(=O)(СН2)7(СН=СНСН2)3СН3, -С(=O)(СН2)3(СН=СНСН2)4(СН2)3СН3, -С(=O)(СН2)3(СН=СНСН2)5СН3 или -С(=O)(СН2)2(СН=СНСН2)6СН3.
Соединение согласно настоящему изобретению может представлять собой соединение, выбранное из группы, состоящей из:

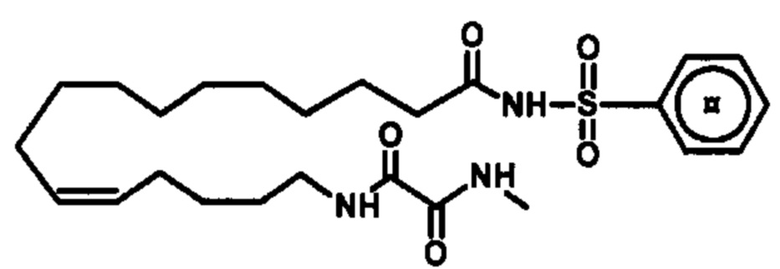
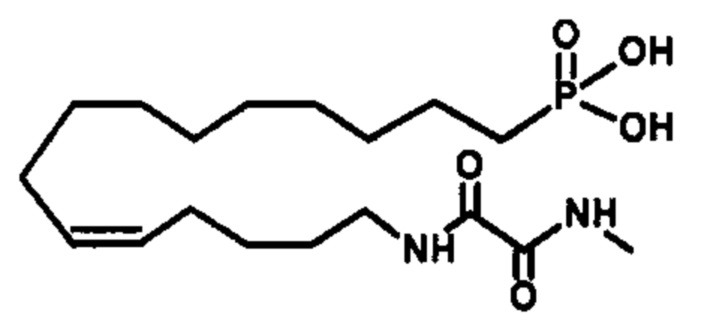
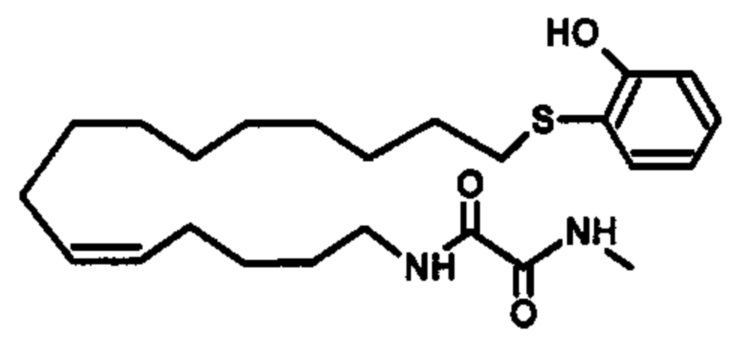
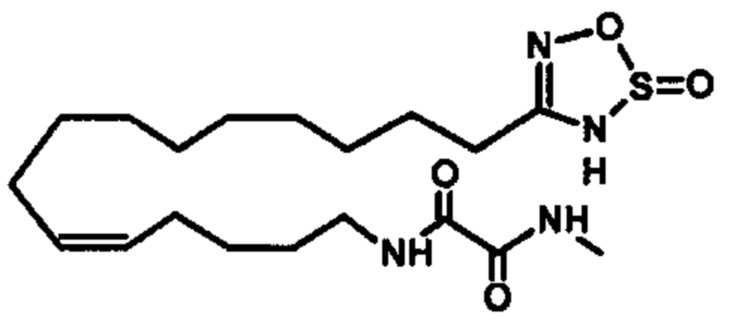
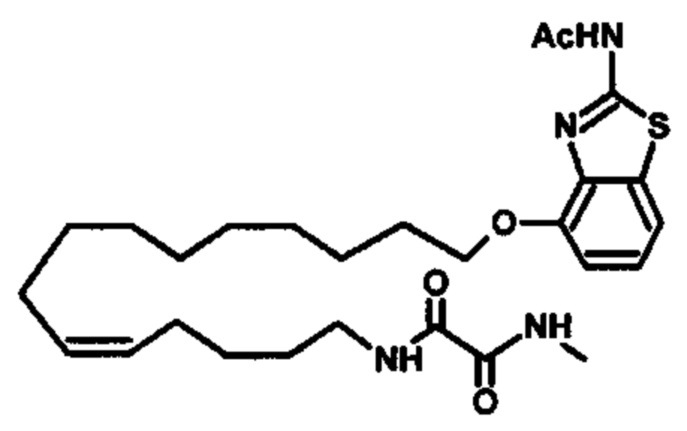
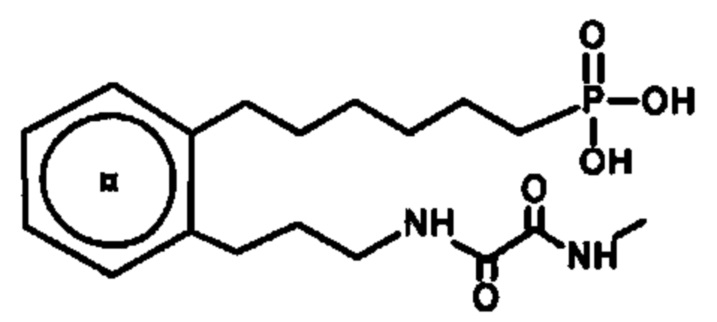
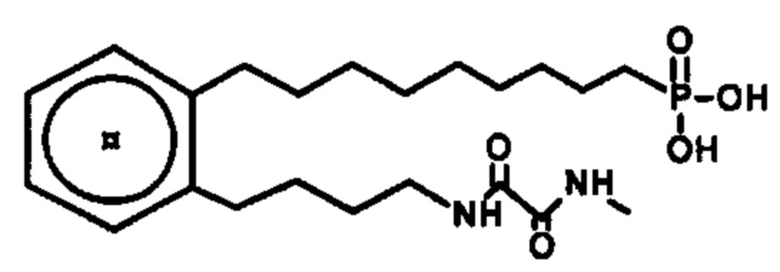
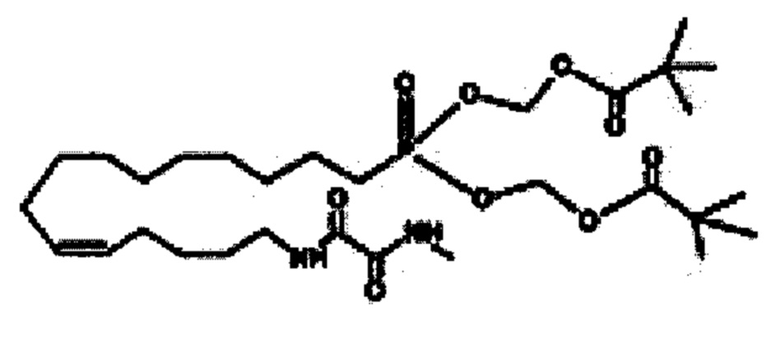 .
.
Особенно предпочтительно комбинировать предпочтительные варианты реализации отдельных общих групп формулы (I) любым возможным образом.
Специалисты в данной области техники легко поймут, что некоторые из аналогов ПНЖК n-3 общей формулы (I) согласно настоящему изобретению представляют собой «биоизостеры» встречающихся в природе эпоксиметаболитов, получаемых посредством ферментов цитохрома Р450 (CYP) из полиненасыщенных жирных кислот (ПНЖК) омега-3 (n-3). Биоизостер представляет собой соединение, получаемое в результате обмена атома или группы атомов на альтернативный, в широком смысле, атом или группу атомов с получением, тем самым, нового соединения с биологическими свойствами, аналогичными свойствам исходного соединения. Биоизостерия используется, например, медицинскими химиками для улучшения желаемых биологических или физических свойств соединения, например, для ослабления токсичности, изменения активности, изменения фармакокинетики и/или метаболизма соединения. Например, замена атома водорода атомом фтора в месте метаболического окисления соединения может предотвратить протекание такого метаболизма. Поскольку фтор аналогичен по размеру атому водорода, на общую топологию молекулы это существенно не влияет, и необходимая биологическая активность остается неизменной. Тем не менее, с заблокированным путем для метаболизма указанное соединение может иметь более длительное время полужизни. Другим примером является биоизостерная замена групп карбоновой кислоты, в результате которой получаются аналоги, демонстрирующие улучшенную биодоступность, улучшенное проникновение через гематоэнцефалический барьер, повышенную активность, лучшую химическую стабильность и/или селективность по отношению к мишени (см., например, учебник "The practice of medicinal chemistry", edited by Camille Georges Wermuth, 3rd edition, Academic Press, 2008, например, с. 303-310; Ballatore С. et al. "Carboxylic Acid (Bio)lsosteres in Drug Design", ChemMedChem 8, 385-395 (2013)). Кроме того, биоизостеризм также может быть использован для получения пролекарства соединения, то есть соединения, которое первоначально вводят субъекту или пациенту в неактивной (или менее активной) форме, а затем оно модифицируется in vivo в его активную форму путем обычных метаболических процессов, протекающих в организме. Например, конъюгация соединения с частями липидов и/или Сахаров позволила получить аналоги (пролекарства), демонстрирующие усиленную доставку лекарственного средства по сравнению с исходным соединением (см., например, Wong A. and Toth I. "Lipid, Sugar and Liposaccharide Based Delivery Systems", Current Medicinal Chemistry 8, 1123-1136 (2001)).
Аналоги ПНЖК n-3 общей формулы (I) согласно настоящему изобретению могут быть получены рядом способов, хорошо известных специалистам в области органического синтеза. Например, соединения согласно настоящему изобретению могут быть синтезированы в соответствии с представленными ниже общими схемами реакций 1 по 4 с использованием способов синтеза, известных в области синтетической органической химии или их вариантов, очевидных специалистам в данной области техники. Если не указано иное, все переменные, например n, k, R2 (обозначаемый также R2), R6, R7, R8, R41, R42, R44 и R45, имеют вышеуказанное определенное значение. В качестве исходных материалов можно использовать реагенты стандартного коммерческого класса без дополнительной очистки, или реагенты могут быть легко получены из таких исходных материалов рутинными способами, пециалистам в области органического синтеза будет понятно, что исходные материалы и условия реакций могут быть различными, включая дополнительные стадии, используемые для получения соединений, охватываемых настоящим изобретением.
Схема реакций 1
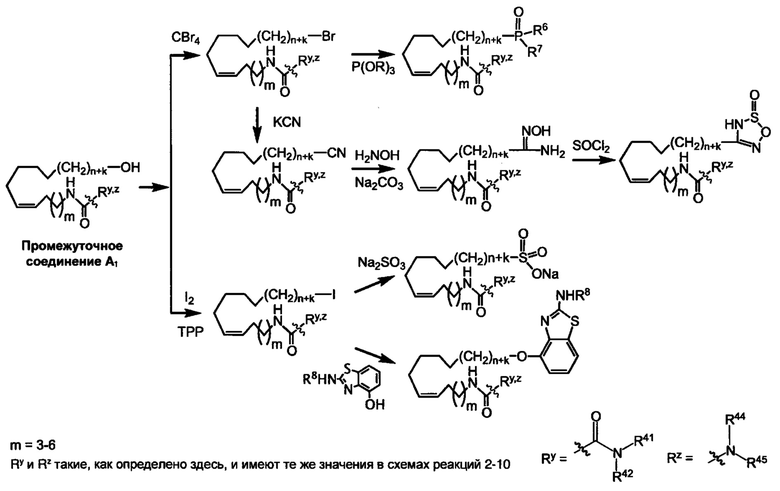
Схема реакций 2
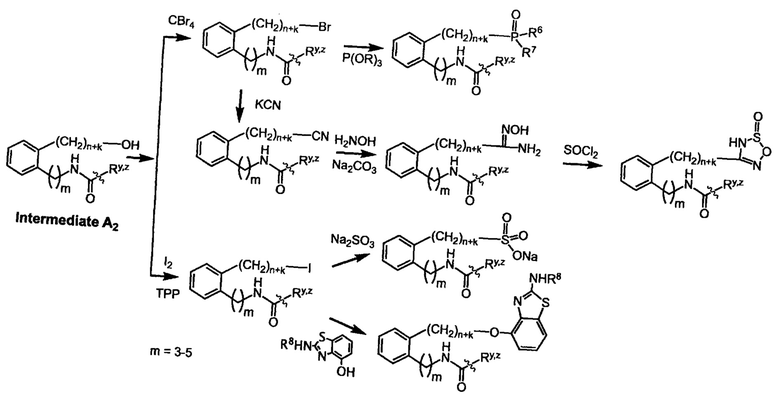
Схема реакций 3

Схема реакций 4
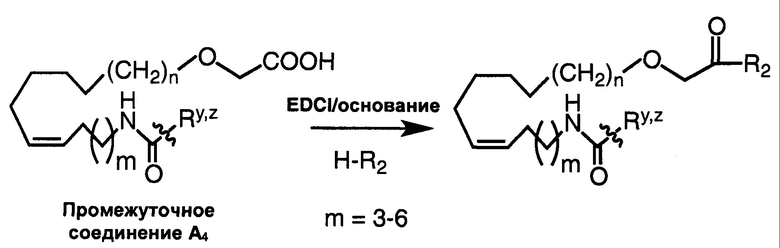
Схема реакций 5
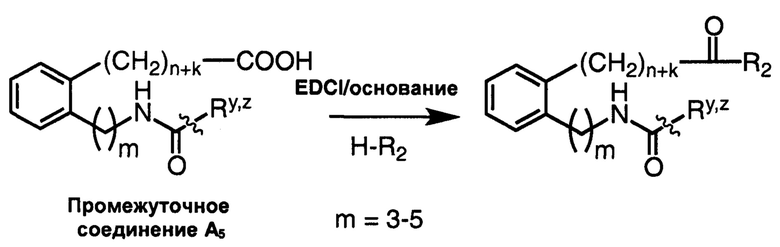
Указанные выше промежуточные соединения А1-А5 могут быть синтезированы, например, согласно представленным ниже общим схемам реакций 6-10 с использованием способов синтеза, известных в области синтетической органической химии или их вариантов, понятных специалистам в данной области техники.
Схема реакций 6
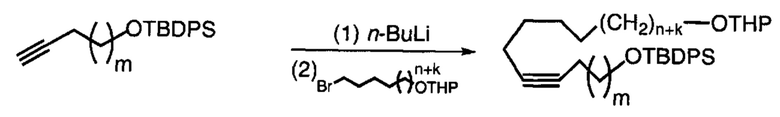


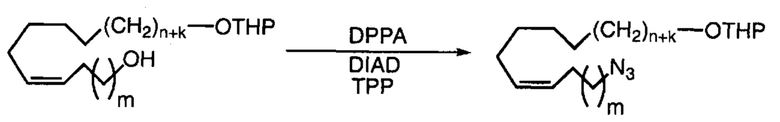
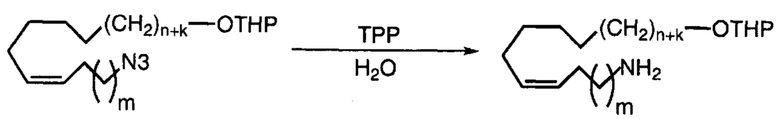
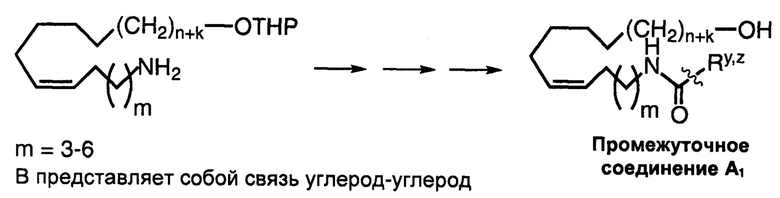
Схема реакций 7
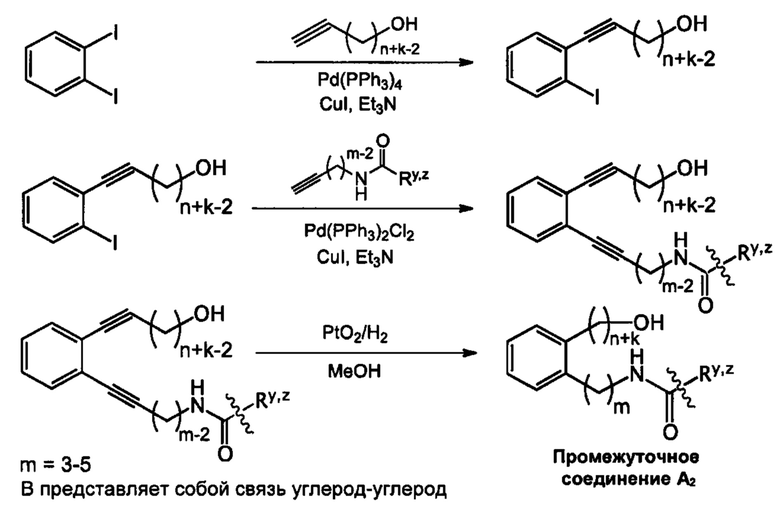
Схема реакций 8
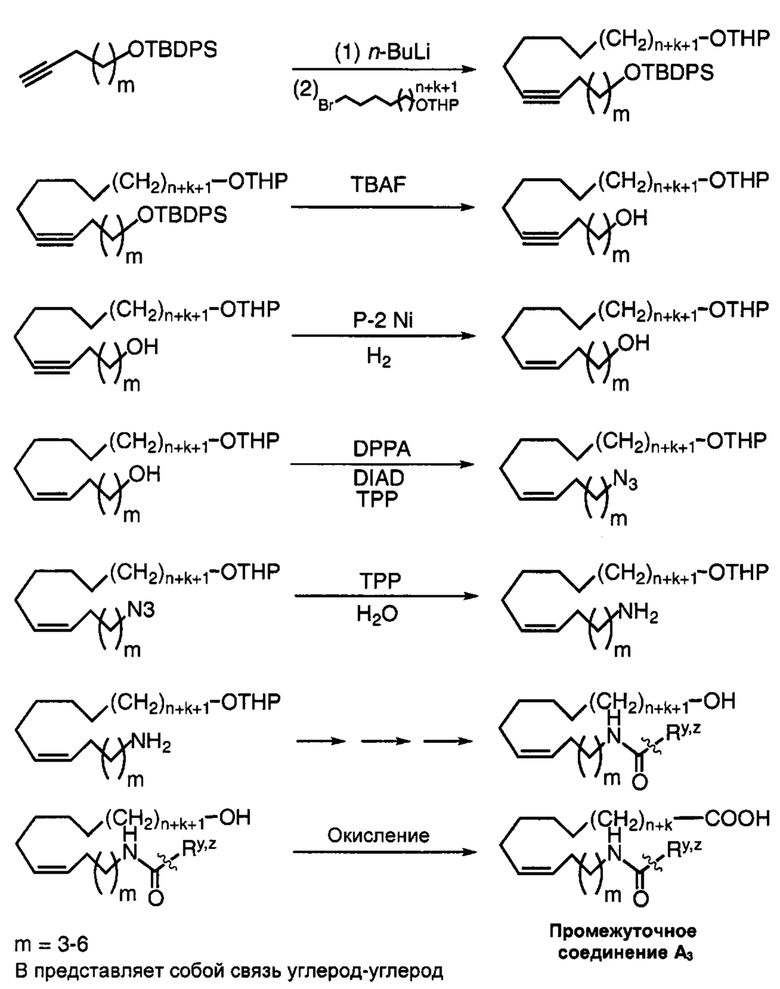
Схема реакций 9
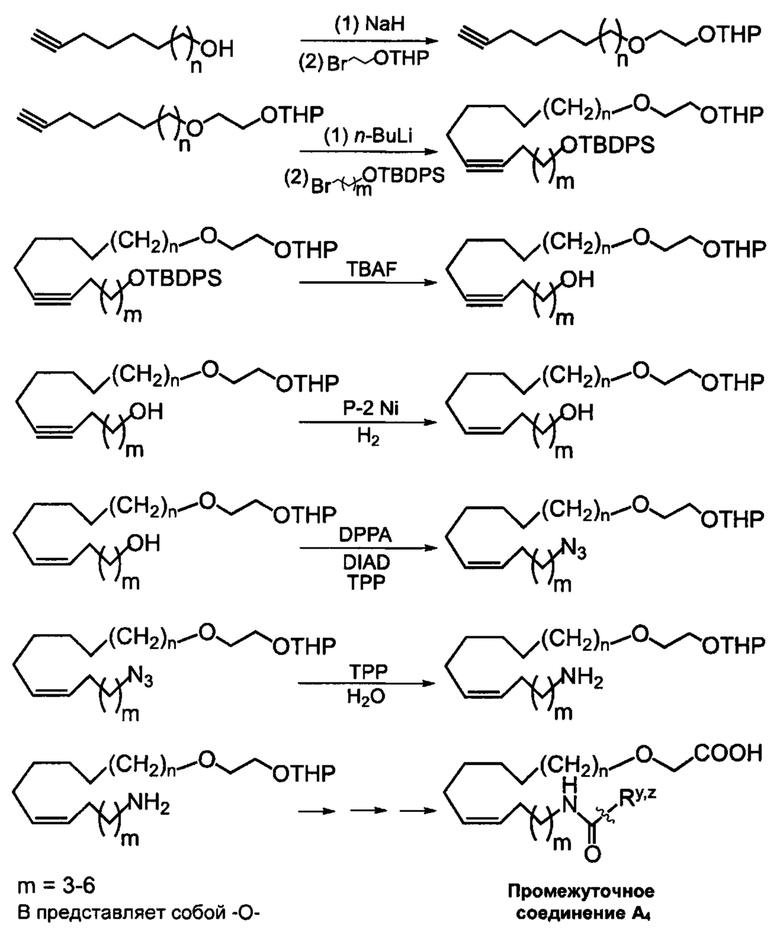
Схема реакций 10

Соединения формулы (I) согласно настоящему изобретению предпочтительно обладают улучшенными свойствами, в частности, меньшей токсичностью, меньшим взаимодействием с другими лекарственными средствами, улучшенной биодоступностью, в частности в отношении перорального введения, улучшенной метаболической стабильностью и улучшенной растворимостью. Например, соединения, предложенные в настоящем описании, обладают высокой кардиозащитной активностью в модели индуцируемой Ang II гипертензии и повреждения органов-мишеней на двойных трансгенных крысах.
Терапевтическое применение соединений формулы (I), их фармакологически приемлемых солей, сольватов или гидратов, а также составов и фармацевтических композиций находится в рамках объема настоящего изобретения. Настоящее изобретение также относится к применению таких соединений формулы (I) в качестве активных ингредиентов для получения лекарственных средств, а также к их применению и применению фармацевтической композиции согласно настоящему изобретению для лечения или предотвращения состояния и/или заболевания, связанных с воспалением, пролиферацией, гипертензией, коагуляцией, иммунной функцией, патологическим ангиогенезом или заболеванием сердца.
Соединение или фармацевтическая композиция согласно настоящему изобретению могут быть применены для лечения или предотвращения заболевания сердца. Заболевание сердца может быть выбрано из группы, состоящей из сердечной недостаточности, ишемической болезни сердца, инфаркта миокарда, острого и хронического воспалительного повреждения сердца, неадекватной гипертрофии сердца (maladaptive cardiac hypertrophy) и сердечной аритмии.
Предпочтительно соединение или фармацевтическая композиция согласно настоящему изобретению могут быть применены для лечения или предотвращения сердечных аритмий, включая желудочковую тахикардию и наджелудочковая аритмия. Более предпочтительно, соединение или фармацевтическая композиция согласно настоящему изобретению могут быть применены для лечения или предотвращения наджелудочковой аритмии, в частности для лечения или предотвращения фибрилляции предсердий.
Фармацевтические композиции согласно настоящему изобретению включают по меньшей мере одно соединение формулы (I) и, необязательно, одно или более веществ-носителей, например, циклодекстрины, такие как гидроксипропил-β-циклодекстрин, мицелл или липосом, вспомогательных веществ и/или адъювантов. Фармацевтические композиции могут дополнительно содержать, например, одно или более из воды, буферов, таких как, например, нейтральный солевой буферный раствор или фосфатно-солевой буферный раствор, этанол, минеральное масло, растительное масло, диметилсульфоксид, углеводы, такие как, например, глюкоза, манноза, сахароза или декстраны, маннитол, белки, адъюванты, полипептиды или аминокислоты, такие как глицин, антиоксиданты, хелатирующие агенты, такие как ЭДТА или глутатион, и/или консерванты. Кроме того, в композиции, предложенные в настоящем описании, могут, но необязательно, быть включены один или более других активных ингредиентов. Например, соединения согласно настоящему изобретению могут быть успешно применены в комбинации с антибиотиком, противогрибковым или противовирусным агентом, антигистаминным агентом, стероидным противовоспалительным лекарственным средством, противоревматическим лекарственным средством, модифицирующим течение заболевания, противовоспалительным лекарственным средством для лечения аутоиммунного заболевания, цитостатическим лекарственным средством, лекарственным средством с активностью, модулирующей активность гладкой мускулатуры, антигипертензивным лекарственным средством, бета-блокатором, лекарственным средством против аритмии, лекарственным средством для лечения сердечной недостаточности, антитромботическим лекарственным средством, антитромбоцитарным лекарственным средством или их смесью. Предпочтительно настоящее изобретение относится к комбинированному препарату или состоящему из частей набору, содержащим по меньшей мере одно соединение согласно настоящему изобретению и по меньшей мере одно лекарственное средство из группы, содержащей антигипертензивное лекарственное средство, бета-блокатор, лекарственное средство против аритмии, лекарственное средство для лечения сердечной недостаточности, антитромботическое лекарственное средство, антитромбоцитарное лекарственное средство, антиревматическое лекарственное средство и/или противовоспалительное лекарственное средство для лечения аутоиммунного заболевания.
Фармацевтические композиции может быть приготовлены для любого подходящего пути введения, включая, например, местное введение, такое как трансдермальное или глазное, пероральное, трансбуккальное, назальное, вагинальное, ректальное или парентеральное введение. Термин «парентеральный» в контексте настоящего описания включает подкожную, внутрикожную, внутрисосудистую, такую, например, внутривенную, внутримышечную, спинальную, внутричерепную, интратекальную, внутриглазную, периокулярную, интраорбитальную, внутрисуставную и внутрибрюшинную инъекции, а также любую подобную инъекцию или инфузию. В некоторых вариантах реализации предпочтительными являются композиции в форме, подходящей для перорального применения. Такие формы включают, например, таблетки, пастилки (troches), таблетки для рассасывания (lozenges), водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердых или мягкие капсулы, сиропы, или эликсиры. В рамках других вариантах композиции, предложенные в настоящем описании, могут быть приготовлены в виде лиофилизата. Состав для местного введения может быть предпочтительным для некоторых состояний, например, при лечении состояний кожи, таких как ожоги или зуд.
Композиции, предназначенные для перорального применения, могут дополнительно содержать один или более компонентов, таких как подслащивающие агенты, ароматизирующие агенты, окрашивающие агенты и/или консервирующие агенты, для создания привлекательных на вид и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с физиологически приемлемыми вспомогательными веществами, которые являются подходящими для получения таблеток. Такие вспомогательные вещества включают, например, инертные разбавители, такие как, например, карбонат кальция, карбонат натрия, лактозу, фосфат кальция или фосфат натрия, гранулирующие и разрыхляющие агенты, такие как, например, кукурузный крахмал или альгиновая кислота, связующие агенты, такие как, например, крахмал, желатин или аравийская камедь, и смазывающие агенты, такие как, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут не содержать покрытия, или они могут быть покрыты известными способами для обеспечения задержки разложения и всасывания в желудочно-кишечном тракте и тем самым обеспечения замедленного действия в течение более длительного периода времени. Например, может быть использован материал, обеспечивающий задержку во времени, такой как глицерилмоностеарат или глицерилдистеарат.
Составы для перорального применения могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, таким как, например, карбонат кальция, фосфат кальция или каолин, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, такой как, например, арахисовое масло, жидкий парафин или оливковое масло.
Водные суспензии содержат активный (-ые) ингредиент (-ы) в смеси со вспомогательными веществами, подходящими для получения водных суспензий. Такие вспомогательные вещества включают суспендирующие агенты, такие как, например, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидропропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; и диспергирующие или смачивающие агенты, такие как, например, существующие в природе фосфатиды, такие как лецитин, продукты конденсации алкиленоксида с жирными кислотами, такие как полиоксиэтиленстеарат, продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, такими как гептадексэтиленоксицетанол, продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гекситола, такие как полиоксиэтиленсорбитолмоноолеат, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гекситола, такие как полиэтиленсорбитанмоноолеат.Водные суспензии также могут один или более консервантов, например этил- или н-пропил-п-гидроксибензоат, один или более окрашивающих агентов, один или более ароматизирующих агентов и один или более подслащивающих агентов, таких как сахароза или сахарин.
Масляные суспензии могут быть приготовлены путем суспендирования активных ингредиентов в растительном масле, таком как, например, арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятных на вкус препаратов для перорального введения могут быть добавлены подслащивающие агенты, такие как указано выше, и/или ароматизирующие агенты. Такие суспензии могут быть сохранены путем добавления антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии путем добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и один или консервантов. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты представлены агентами, уже указанными выше. Также могут присутствовать дополнительные вспомогательные вещества, такие как подслащивающие, ароматизирующие и окрашивающие агенты.
Фармацевтические композиции также могут находиться в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как, например, оливковое масло или арахисовое масло, минеральное масло, такое как, например, жидкий парафин или их смесь. Подходящие эмульгирующие агенты включают существующие в природе смолы, такие как, например, аравийская камедь или трагакантовая камедь, существующие в природе фосфатиды, такие как, например, соевый лецитин, и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и гекситола, ангидридов, такие как, например, сорбитанмоноолеат, и продукты конденсации частичных сложных эфиров, полученных из жирных кислот и гекситола с этиленоксидом, такие как, например, полиоксиэтиленсорбитанмоноолеат. Эмульсия может также содержать один или более подслащивающих и/или ароматизирующих агентов.
Сиропы и эликсиры может быть приготовлены с подслащивающими агентами, такими как глицерин, пропиленгликоль, сорбит или сахароза. Такие составы могут также содержать один или более смягчающих агентов, консервантов, ароматизирующих агентов и/или окрашивающих агентов.
Соединения могут быть включены в составы для локального или местного введения, такого как местное нанесение на кожу или слизистые оболочки, такое как в глаз. Композиции для местного введения, как правило, содержат местный носитель, объединенный с активным (-ыми) агентом (-ами), с дополнительными необязательными компонентами или без них. Подходящие местные носители и дополнительные компоненты хорошо известны в уровне техники, и будет очевидно, что выбор носителя будет зависеть от конкретной физической формы и способа доставки. Местные носители включают воду; органические растворители, такие как спирты, такие как, например, этанол, или изопропиловый спирт, или глицерин; гликоли, такие как, например, бутилен, изопрен или пропиленгликоль; алифатические спирты, такие как, например, ланолин; смеси воды и органических растворителей и смеси органических растворителей, таких как спирт и глицерин; материалы на основе липидов, такие как жирные кислоты, ацилглицерины, включая масла, такие как, например, минеральное масло, и жиры натурального или синтетического происхождения, фосфоглицериды, сфинголипиды и воски; материалы на основе белка, такие как коллаген и желатин; материалы на основе кремния, как нелетучие, так и летучие; и материалы на основе углеводородов, такие как микрогубки и полимерные матрицы. Композиция может дополнительно содержать один или более компонентов, адаптированных для повышения стабильности или эффективности применяемого состава, такие как стабилизирующие агенты, суспендирующие агенты, эмульгирующие агенты, регуляторы вязкости, желирующие агенты, консерванты, антиоксиданты, агенты, способствующие проникновению через кожу, увлажнители и материалы, обеспечивающие замедленное высвобождение. Примеры таких компонентов описаны в источнике Martindale - The Extra Pharmacopoeia (Pharmaceutical Press, London, 1993) и Martin (ed.), Remington's Pharmaceutical Sciences. Составы могут содержать микрокапсулы, микрокапсулы гидроксиметилцеллюлозы или желатина, липосомы, микросферы альбумина, микроэмульсии, наночастицы или нанокапсулы.
Состав для местного применения может быть приготовлен в различных физических формах, включая, например, твердые вещества, пасты, кремы, пены, лосьоны, гели, порошки, водные жидкости, эмульсии, спреи, глазные капли и накожные пластыри. Физический внешний вид и вязкость таких форм может определяться присутствием и количеством эмульгатора (-ов) и регулятора (-ов) вязкости, присутствующих в составе. Твердые вещества, как правило, являются твердыми и нетекучими, и их часто готовят в виде брусков или стиков, или в форме частиц; твердые вещества могут быть непрозрачными или прозрачными и необязательно могут содержать растворители, эмульгаторы, увлажнители, смягчающие агенты, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые увеличивают или усиливают эффективность конечного продукта. Кремы и лосьоны часто похожи друг на друга, отличаясь главным образом по вязкости; и лосьоны, и кремы могут быть непрозрачными, полупрозрачными или прозрачными и часто содержат эмульгаторы, растворители и агенты, регулирующие вязкость, а также увлажнители, смягчающие агенты, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые увеличивают или усиливают эффективность конечного продукта. Гели могут быть получены с диапазоном вязкостей, от густого, или геля высокой вязкости, до жидкого, или геля низкой вязкости. Эти составы, подобно составам лосьонов и кремов, могут также содержать растворители, эмульгаторы, увлажнители, смягчающие агенты, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые увеличивают или усиливают эффективность конечного продукта. Жидкости имеют меньшую вязкость, чем кремы, лосьоны или гели, и часто не содержат эмульгаторов. Жидкие продукты для местного применения часто содержат растворители, эмульгаторы, увлажнители, смягчающие агенты, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые увеличивают или усиливают эффективность конечного продукта.
Подходящие эмульгаторы для применения в составах для местного применения включают, но не ограничиваются ими, ионные эмульгаторы, цетеариловый спирт, неионные эмульгаторы, такие как полиоксиэтиленолеиловый эфир, ПЭГ-40-стеарат, цетеарет-12, цетеарет-20, цетеарет-30, цетеаретовый спирт, ПЭГ-100-стеарат и глицерилстеарат. Подходящие агенты, регулирующие вязкость включают, но не ограничиваются ими, защитные коллоиды или неионные камеди, такие как гидроксиэтилцеллюлоза, ксантановая камедь, силикат магния-алюминия, диоксид кремния, микрокристаллический воск, пчелиный воск, парафин и цетилпальмитат. Гелевая композиция может быть получена путем добавления желирующего агента, такого как хитозан, метилцеллюлоза, этилцеллюлоза, поливиниловый спирт, поликватерниумы, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбомер или глицирризинат аммония. Подходящие поверхностно-активные вещества включают, но не ограничиваются ими, неионные, амфотерные, ионные и анионные поверхностно-активные вещества. Например, в составах для местного применения может быть использован один или более из диметиконсополиола, полисорбата 20, полисорбата 40, полисорбата 60, полисорбата 80, лаурамида ДЭА, кокамида ДЭА, и кокамида МЭА, олеилбетаина, кокамидопропилфосфатидил-ПГ-димония хлорида и лауретсульфата аммония.
Подходящие консерванты включают, но не ограничиваются ими, противомикробные агенты, такие как метилпарабен, пропилпарабен, сорбиновая кислота, бензойная кислота и формальдегид, а также физические стабилизаторы и антиоксиданты, такие как витамин Е, аскорбат натрия/аскорбиновая кислота и пропилгаллат. Подходящие увлажнители включают, но не ограничиваются ими, молочную кислоту и другие гидроксикислоты и их соли, глицерин, пропиленгликоль и бутиленгликоль. Подходящие смягчающие агенты включают ланолиновый спирт, ланолин, производные ланолина, холестерин, петролатум, изостеарилнеопентаноат и минеральные масла. Подходящие отдушки и окрашивающие агенты включают, но не ограничиваются ими, FD&C Red No. 40 и FD & С Yellow No. 5. Другие подходящие дополнительные ингредиенты, которые могут быть включены в состав для местного применения, включают, но не ограничиваются ими, абразивы, абсорбенты, агенты, препятствующие слипанию, антивспениватели, антистатики, вяжущие агенты, такие как, например, гамамелис (witch hazel), спирт и растительные экстракты, такие как экстракт ромашки, связующие агенты/ вспомогательные вещества, буферные агенты, хелатирующие агенты, пленкообразующие агенты, кондиционирующие агенты, пропелленты, замутнители, регуляторы рН и защитные агенты.
Примером подходящего носителя для приготовления состава для местного применения в виде геля является: гидроксипропилцеллюлоза (2,1%); 70/30 изопропиловый спирт/ вода (90,9%); пропиленгликоль (5,1%) и полисорбат80 (1,9%). Примером подходящего носителя для приготовления состава для местного применения в виде пены является: цетиловый спирт (1,1%); стеариловый спирт (0,5%); Кватерниум 52 (1,0%); пропиленгликоль (2,0%); этанол 95 PGF3 (61,05%); деионизированная вода (30,05%); Р75 углеводородный пропеллент (4,30%). Все проценты являются массовыми.
Типичные способы доставки композиций для местного применения включают нанесение с использованием пальцев; нанесение с использованием физического аппликатора, такого как салфетка (cloth), ткань (tissue), тампон (swab), стик или кисть; распыление, включая распыление распрыскивателя (mist), аэрозоля или пены; нанесения через капельницу; разбрызгивание; пропитка и ополаскивание (rinsing). Также могут быть использованы носители, обеспечивающие контролируемое высвобождение, и композиции могут быть приготовлены для трансдермального введения в виде трансдермального пластыря.
Фармацевтическая композиция может быть приготовлена в виде составов для ингаляций, включая спреи (sprays), распрыскиватели (mists) или аэрозоли (aerosols). Такие составы являются особенно подходящими для лечения астмы или других состояний, связанных с дыхательными путями. Для составов для ингаляции соединения, предложенные в настоящем описании, могут быть доставлены любыми ингаляционными способами, известными специалистам в данной области техники. Такие ингаляционные способы и устройства включают, но не ограничиваются ими, дозированные ингаляторы с пропеллентами, такими как CFC или HFA, или пропеллентами, которые являются физиологически и экологически приемлемыми. Другими подходящими устройствами являются ингаляторы, приводимые в действие дыханием, многодозовые ингаляторы сухих порошков и аэрозольные небулайзеры. Составы в виде аэрозолей для применения в рассматриваемом способе, как правило, включают пропелленты, поверхностно-активные вещества и сорастворители, и могут быть помещены в обычные емкости для аэрозолей, которые закрываются с помощью соответствующего дозирующего клапана.
Композиции для ингаляций могут содержать жидкие или порошкообразные композиции, содержащие активный ингредиент, которые подходят для пульверизации и интрабронхиального применения, или композиции в виде аэрозолей, вводимые с помощью устройства, дозирующего отмеренные дозы аэрозоля. Подходящие жидкие композиции включают активный ингредиент в водном, фармацевтически приемлемом растворителе для ингаляций, например, изотоническом солевом растворе или бактериостатической воде. Растворы вводят с помощью насоса или активируемого надавливанием дозатора распыляемого спрея или любыми другими обычными средствами, предназначенными для того, чтобы позволить или обеспечить попадание необходимого дозированного количества жидкой композиции в легкие пациента путем ингаляции. Подходящие составы, в которых указанный носитель представляет собой жидкость, для введения, в виде, например, спрея для носа или в виде капель для носа, включают водные или маслянистые растворы активного ингредиента.
Составы или композиции, подходящие для назального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частиц, например, в диапазоне от 20 до 500 микрон, который вводят таким же образом, как вводят нюхательный табак, то есть путем быстрого вдыхания через носовой проход из емкости с порошком, подносимой близко к носу. Подходящие порошкообразные композиции включают, в качестве иллюстрации, порошкообразные составы активных ингредиентов, тщательно смешанные с лактозой или другими инертными порошками, приемлемыми для внутрибронхиального введения. Порошкообразные композиции могут быть введены с помощью аэрозольного распылителя или заключены в разрушаемую капсула, которую пациент может вставить в устройство, которое прокалывает капсулу, и из нее выдувается порошок в устойчивый поток, подходящий для ингаляции.
Фармацевтические композиции также могут быть приготовлены в форме суппозиториев, таких как, например, для ректального введения. Такие композиции могут быть получены путем смешивания лекарственного средства с подходящим нераздражающим вспомогательным веществом, которое является твердым при обычных температурах и жидким при температуре в прямой кишке и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Подходящие вспомогательные вещества включают, например, масло какао и полиэтиленгликоли.
Фармацевтические композиции может быть приготовлены в виде составов с замедленным высвобождением, таких как, например, состав, такой как капсула, которая обеспечивает медленное высвобождение модулятора после введения. Такие составы обычно могут быть получены с использованием хорошо известной технологии и введены путем, например, пероральной, ректальной или подкожной имплантации или путем имплантации в желаемом участке-мишени. Носители для применения в таких составах являются биологически совместимыми и могут быть также биоразлагаемыми; предпочтительно состав обеспечивает относительно постоянный уровень высвобождения модулятора. Количество модулятора, содержащееся в составе с замедленным высвобождением, зависит от, например, места имплантации, скорости и ожидаемой продолжительности высвобождения, а также природы состояния, подлежащего лечению или предотвращению.
Для лечения повреждения сердца, в частности сердечных аритмий, доза биологически активного соединения согласно настоящему изобретению может изменяться в широких пределах и может быть скорректирована в соответствии с индивидуальными потребностями. Активные вещества согласно настоящему изобретению, как правило, вводят в эффективном количестве, например, в терапевтически эффективном количестве. Предпочтительные дозы находятся в диапазоне от примерно 0,1 мг до примерно 140 мг на килограмм массы тела в сутки, от примерно 0,5 мг до примерно 7 г на пациента в сутки. Суточная доза может быть введена в виде разовой дозы или в виде множества доз. Количество активного ингредиента, которое может быть объединено с материалами-носителями с получением единой лекарственной формы, будет варьироваться в зависимости от субъекта, подлежащего лечению, и конкретного способа введения. Единичные лекарственные формы обычно содержат от примерно 1 мг до примерно 500 мг активного ингредиента.
Следует понимать, однако, что конкретный уровень дозы для любой конкретного пациента будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояния здоровья, пол, диету, время введения, путь введения и скорость выведения, комбинацию лекарственных средств, то есть других лекарственных средств, используемых для лечения пациента, и тяжесть конкретного заболевания, подвергаемого терапии.
Предпочтительные соединения согласно настоящему изобретению будут иметь определенные фармакологические свойства. Такие свойства включают, но не ограничиваются ими, биодоступность при пероральном введении, такую, что предпочтительные пероральные лекарственные формы, описанные выше, могут обеспечить терапевтически эффективные уровни соединения in vivo.
Производные ПНЖК n-3, предложенные в настоящем описании, предпочтительно вводят пациенту, такому как, например, человек, перорально или парентерально, и они присутствуют по меньшей мере в одной биологической жидкости или ткани пациента. Соответственно, в настоящем изобретении также предложены способы лечения пациентов, страдающих состояниями и заболеваниями, связанными с воспалением, пролиферацией, гипертензией, коагуляцией, иммунной функцией, патологическим ангиогенезом или сердечно-сосудистыми заболеваниями, в том числе сердечными аритмиями. В контексте настоящего описания термин «лечение» включает любой тип лечения, модифицирующего заболевание, включая симптоматическое лечение, то есть лечение после появления симптомов. Тем не менее, лечение, модифицирующее заболевание, может включать введение до появления симптомов, чтобы по меньшей мере отсрочить или уменьшить тяжесть симптомов после их появления. Лечение, модифицирующее заболевание, также может быть терапевтическим, то есть после появления симптомов, чтобы уменьшить тяжесть и/или продолжительность симптомов. Лечение после появления симптомов может также просто включать остановку прогрессирования заболевания (стабильное заболевание). В некоторых вариантах реализации производные ПНЖК n-3, предложенные в настоящем описании, вводят профилактически, то есть до начала заболевания и/или симптомов, в идеале, но не обязательно, чтобы фактически предотвратить заболевания и/или симптомы. Следует понимать, что термины «профилактика» и «профилактический» в контексте настоящего изобретения просто описывают то, что соединение (-я) согласно настоящему изобретению вводят до появления симптомов. Профилактическое введение может представлять собой введение до появления симптомов, которые явным образом связаны с заболеванием, обсуждаемым в настоящем описании: производные ПНЖК n-3, предложенные в настоящем описании, могут, например, быть введены субъекту профилактически, когда у него или у нее проявляются определенные состояния, которые могут указывать на склонность к развитию одного из состояний или заболеваний, которые могут быть подвергнуты лечению одним из производных ПНЖК n-3 согласно настоящему изобретению. Такими состояниями-индикаторами являются, например, высокое кровяное давление или диабет. Такое профилактическое лечение называется первичной профилактикой. В другом варианте реализации ПНЖК n-3, предложенные в настоящем описании, могут быть введены субъекту профилактически, если он или она ранее страдал (-а) состоянием или заболеванием, которые могут быть подвергнуты лечению производными ПНЖК n-3 согласно настоящему изобретению, но в настоящее время у него (нее) не проявляются какие-либо симптомы. Такое профилактическое лечение называется вторичной профилактикой. Пациенты, получающие производные ПНЖК n-3 с целью первичной или вторичной профилактики считаются нуждающимися в таком лечении. Пациенты могут включать, но не ограничиваются ими, приматов, в частности людей, одомашненных животных-компаньонов, таких как собаки, кошки, лошади, и скот, такой как крупный рогатый скот, свиньи, овцы, и дозировки являются такими, как описано в настоящему документе.
Специалисту в данной области техники будет понятно, что существует широкое разнообразие состояний и заболеваний, на которые введение производных ПНЖК n-3 окажет положительное действие, и наиболее значимыми из них являются заболевания сердца.
В одном примере пациент, страдающий сердечными аритмиями, получает перорально две суточных дозы по 10 мг производного ПНЖК n-3, раскрытого в настоящем описании. В течение 6-месячного периода лечения заболевание указанного пациента не прогрессировало.
В другом примере пациент, ранее страдавший сердечными аритмиями, получал перорально одну суточную дозу 5 мг производного ПНЖК n-3, раскрытого в настоящем описании. В течение 6-месячного периода лечения у пациента не было данного заболевания.
Примеры состояний и заболеваний, связанных с пролиферацией, включают опухоли или неоплазмы, при которых пролиферация клеток происходит бесконтрольно и прогрессирующим образом. Некоторые такие бесконтрольно пролиферирующие клетки являются доброкачественными, а некоторые называются злокачественными и могут являться причиной гибели организма. Злокачественные новообразования, или рак, отличаются от доброкачественных новообразований тем, что, помимо того, что они демонстрируют агрессивную пролиферацию клеток, они могут поражать окружающие ткани и метастазировать. Более того, злокачественные новообразования характеризуются тем, что они демонстрируют большую потерю дифференциации (большую дедифференциацию) и более сильную большую потерю организации относительно друг друга и окружающих их тканей. Данное свойство также называется «анаплазия». Новообразования, подлежащие лечению посредством настоящего изобретения также включают солидные опухоли/злокачественные новообразования, то есть карциномы, местно-распространенные опухоли и саркомы мягких тканей человека. Карциномы включают злокачественные новообразования, имеющие свое происхождение из эпителиальных клеток, которые инфильтруют (поражают) окружающие ткани, и в результате образуется метастазирующий рак, включая метастазы в лимфатической системе. Аденокарциномы представляют собой карциномы, имеющие свое происхождение из железистой ткани или из которых образуются различимые железистые структуры. Другая большая категория видов рака включает саркомы, которые представляют собой опухоли, клетки которых встроены в фибриллярную или гомогенную субстанцию, такую как эмбриональная соединительная ткань. Настоящее изобретение также включает лечение рака миелоидной или лимфоидной систем, включая лейкозы, лимфомы и другие виды рака, которые обычно не присутствуют в виде опухолевой массы, а распространяются в сосудистой или лимфоретикулярной системам. Тип рака или опухолевых клеток, которые поддаются лечению согласно настоящему изобретению, включают, например, рак молочной железы, толстой кишки, легкого и предстательной железы, рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, колоректальный рак, полипы, связанные с колоректальными новообразованиями, рак поджелудочной железы и рак желчного пузыря, рак коры надпочечников, адренокортикотропный гормон (АКТГ)-продуцирующую опухоль, рак мочевого пузыря, рак головного мозга, включая внутренние опухоли головного мозга, нейробластомы, астроцитарные опухоли головного мозга, глиомы и метастатические вторжения опухолевых клеток в центральную нервную систему, саркому Юинга, рак головы и шеи, включая рак ротовой полости и рак гортани, рак почки, включая почечно-клеточную карциному, рак печени, рак легкого, включая мелкоклеточный и немелкоклеточный рак легких, злокачественный перитонеальный выпот, злокачественный плевральный выпот, рак кожи, включая меланому, опухолевое прогрессирование кератиноцитов кожи человека, плоскоклеточную карциному, базально-клеточную карциному и гемангиоперицитому, мезотелиому, саркому Калоши, рак кости, включая остеомы и саркомы, такие как фибросаркома и остеосаркома, рак женской репродуктивной системы, включая рак матки, рак эндометрия, рак яичников, рак яичников (зародышевых клеток) и солидные опухоли в фолликуле яичника, рак влагалища, рак вульвы и рак шейки матки; рак молочной железы (мелкоклеточный и протоковый), рак полового члена рак, ретинобластому, рак яичек, рак щитовидной железы, трофобластические новообразования и опухоли Вильмса.
Примеры состояний и заболеваний, связанных с воспалением и иммунной функцией, включают воспалительные расстройства, такие как острофазная реакция, местное и системное воспаление и воспаление, вызванное другими заболеваниями любого типа, этиологии или патогенеза, и вызванное воспалительными заболеваниями, примеры которых приведены ниже, и иммунологические расстройства, такие как гиперестезия, аутоиммунные расстройства, отторжение трансплантата при трансплантации, токсичность трансплантата, гранулематозное воспаление/ ремоделирование ткани, миастения, иммуносупрессия, заболевания иммунных комплексов, избыточная и недостаточная выработка антител и васкулит.В частности, примеры таких состояний и заболеваний включают воспалительные заболевания кишечника, включая болезнь Крона и язвенный колит (Stadnicki etal., Am. J. Physiol. Gastrointest Liver Physiol. 2005, 289(2), G361-6; Devani et ai, Am. J. Gastroenerol 2002, 97(8), 2026-32; Devani etal., Dig. Liv. Disease 2005, 37(9), 665-73), синдром раздраженного кишечника, энтероколит, заболевания печени, панкреатит, нефрит, цистит (интерстициальный цистит), увеит, ретинит, глаукому, отит среднего уха, периодонтит, воспалительные нарушения кожи, такие как псориаз, экзема, атопические заболевания, дерматит, зуд, ювенильный ревматоидный артрит или ревматоидный артрит, наступающий у взрослых, и подагрический артрит (Cassim et al., Pharmacol. Ther. 2002, 94, 1-34; Sharma et al., Exp. Toxic Pathol. 1994, 46, 421-433; Brechter et al., Arthr. Rheum. 2007, 56(3), 910-923), анкилозирующий спондилит, наступающую у взрослых или у детей болезнь Стилла (системный ювенильный идиопатический артрит), псориатический артрит, остеоартрит и отек, связанный с ожогами, растяжениями связок или переломом, отек головного мозга, закрытая черепно-мозговая травма, ангионевротический отек, васкулит, диабетическую васкулопатию, диабет типа I, диабетическую нефропатию, диабетическую невропатию, диабетическую ретинопатию, посткапиллярное сопротивление или диабетические синдромы, связанные с инсулитом (например, гипергликемию, диурез, протеинурию и повышенную экскрецию нитритов и калликреина), заболевания желчного пузыря, релаксанты гладких мышц для лечения спазмов желудочно-кишечного тракта или матки, рассеянный склероз, эпилепсию, боковой амиотрофический склероз, болезнь Альцгеймера, инсульт, болезнь Паркинсона, синдром системной воспалительной реакции (ССВР), ишемически-реперфузионное повреждение и атеросклероз (Raidoo et al., Immunopharmacol 1997, 36(2-3), 153-60; McLean et al., Cardiovasc. Res. 2000, 48, 194-210), септический шок, антигиповолемические и/или антигипотензивные агенты, головную боль, включая кластерную головную боль, мигрень, включая профилактическое и острое использование, закрытую черепно-мозговую травму, рак, сепсис, гингивит, остеопороз, доброкачественную гиперплазию предстательной железы, гиперактивный мочевой пузырь, фиброзные заболевания, такие как фиброз легких, фиброз почек, фиброз печени, прогрессирующий склероз и образование рецидивирующий стриктуры при болезни Крона (Goldstein et al., J. Biol. Chem. 1984, 259(14), 9263-8; Ricupero et al., J. Biol. Chem. 2000, 275(17), 12475-80; Romero et al., J. Biol. Chem. 2005, 15, 14378-14384), нарушения дыхательных путей при астме, атопическую или неатопическую астму, профессиональную астму, вызванный физической нагрузкой бронхоспазм, бронхит, пневмокониоз, включая алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз, хроническую обструктивную болезнь легких, включая, эмфизему, респираторный дистресс-синдром взрослых, пневмонию, аллергический ринит, вазомоторный ринит и плеврит, аутовоспалительные заболевания, такие как семейную средиземноморскую лихорадку (ССЛ), периодический синдром, связанный с рецептором фактора некроза опухолей (TRAPS, англ.: tumor-necrosis factor receptor associated periodic syndrome), мультисистемное воспалительное заболевание неонатального возраста (NOMID, англ.: neonatal onset multisystem inflammatory disease), семейный холодовой аутовоспалительный синдром (FCAS, англ.: familial cold autoinflammatory syndrome), включая семейную холодовую крапивницу (FCU, англ.: familial cold urticaria), синдром стерильного гнойного артрита, гангренозной пиодермии и акне (PAPA, англ.: pyogenic arthritis pyoderma gangrenosum acne) и болезнь Макла-Уэллса.
Примеры состояний и заболеваний, связанных с патологическим ангиогенезом, включают развитие опухолей и метастазирование, как описано выше, возрастную макулярную дегенерацию и диабетическую ретинопатию.
Примеры состояний и заболеваний, связанных с сердечно-сосудистыми заболеваниями, включают сердечную недостаточность, ишемическую болезнь сердца, инфаркт миокарда, острое и хроническое воспалительное повреждение сердца, неадекватную гипертрофию сердца и сердечные аритмии, включая желудочковую тахикардию, злокачественную желудочковую тахикардию и фибрилляцию предсердий, дилатационную кардиомиопатию, миокардит, гипертоническую болезнь сердца, воспалительную кардиомиопатию.
Предпочтительно способ предотвращения и/или лечения любого из вышеперечисленных состояний или заболевания включает введение субъекту, нуждающемуся в этом, по меньшей мере эффективного количества аналога ПНЖК n-3 согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению. Способ предотвращения или лечения указанных состояний или расстройств может, кроме того, характеризоваться тем, что активный аналог ПНЖК n-3 или композиция согласно настоящему изобретению предназначены для введения одним из указанных выше способов введения, предпочтительно перорально или путем инъекции.
Аналог ПНЖК n-3 согласно настоящему изобретению также может быть применен в качестве инструмента исследования. Например, мутантный конъюгат согласно настоящему изобретению может быть применен в качестве диагностического или лечебно-диагностического агента, благодаря чему такой диагностический агент может быть использован для диагностики заболеваний и состояний, на которые могут быть нацелены аналоги ПНЖК n-3 согласно настоящему изобретению, в терапевтических целях, раскрытых в настоящем описании. Например, для применения в качестве инструмента исследования аналог ПНЖК n-3 согласно настоящему изобретению может быть помечен изотопами, флуоресцентными или люминесцентными маркерами или любой другой аффинной меткой. Меченые соединения согласно настоящему изобретению являются, например, подходящими для применения для отображения местоположения рецепторов in vivo, in vitro и in situ (например, в срезах ткани посредством авторадиографии) и в качестве радиоактивных меток для визуализации методом позитронно-эмиссионной томографии (ПЭТ), однофотонной эмиссионной компьютерной томографии (ОФЭКТ) и тому подобного для характеристики таких рецепторов в живых субъектах или других материалах, например образцах тканей. Такие виды применения и их соответствующие условия известны специалистам в данной области техники.
Активность аналогов ПНЖК n-3 согласно настоящему изобретению может, например, быть определена в соответствующих исследованиях in vitro и/или in vivo. Например, биологическая активность аналогов ПНЖК n-3 согласно настоящему изобретению может быть определена с использованием установленной модели на клетках по Кангу (Kang) и Лифу (Leaf) (Proc Natl Acad Sci USA, 1994. 91(21): p. 9886-90), известной специалистам в данной области техники.
Краткое описание чертежей
Фиг. 1: Примеры аналогов ПНЖК n-3 согласно настоящему изобретению и их действие на установленную модель сердечной аритмии in vitro, в которой использованы спонтанно сокращающиеся кардиомиоциты новорожденных крыс (NRCMs, англ.: neonatal rat cardiomyocytes), по сравнению с эйкозапентаеновой кислотой (ЕРА) и 17,18-эпоксиэйкозатетраеновой кислотой (17,18-EEQ). Как показано, спонтанное сокращение клеток в исходных условиях уменьшалась при применении приведенных в качестве примера аналогов.
Следующие примеры служат для более полного описания способа применения описанного выше изобретения, а также для изложения наилучших вариантов, предусмотренных для осуществления различных аспектов настоящего изобретения. Понятно, что эти примеры никоим образом не служат для ограничения истинного объема настоящего изобретения, а наоборот, представлены в иллюстративных целях.
Примеры
Конкретные примеры получения соединений формулы (I) представлены в следующих примерах. Если не указано иное, все исходные материалы и реагенты представляют собой материалы и реагенты стандартного коммерческого класса и используются без дополнительной очистки или могут быть легко получены из таких материалов рутинными способами. Специалистам в области органического синтеза будет понятно, что исходные материалы и условия реакции могут быть разнообразными, включая использование дополнительных стадий для получения соединений, охватываемых настоящим изобретением. Предпочтительные способы включают, но не ограничиваются ими, способы, описанные ниже. Каждая из ссылок, приведенных в связи с описанным путем синтеза, тем самым включена в настоящее описание посредством ссылки.
Пример 1
Получение Промежуточное соединение 10
Стадия А. Синтез трет-бутилдифенил((15-((тетрагидро-2Н-пиран-2-ил)окси)пентадец-5-ин-1-ил)окси)силана (3):
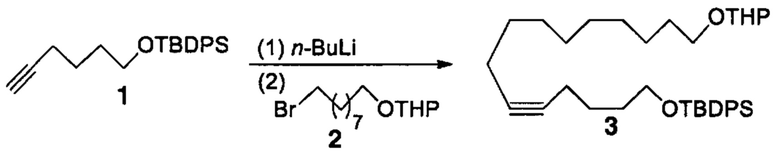
n-BuLi (2,5 М в гексане, 1 эквив.) добавляли по каплям к раствору соединения 1 (1 эквив.) в безводном ТГФ и свежепродистиллированном гексаметилфосфортриамиде (НМРА) (3:1) при -78°С. Реакционную смесь перемешивали при -78°С в течение 30 мин и при 0°С в течение 2 ч. Реакционную смесь повторно охлаждали до -78°С, и медленно добавляли соединение 2 (1,2 эквив.) в сухом ТГФ. Через 40 мин при -78°С и при к.т. В течение ночи (14 ч), реакцию гасили насыщенным раствором NH4Cl, добавляли воду, и реакционную смесь дважды подвергали экстракции посредством EtOAc. Объединенные органические экстракты дважды промывали водой сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Очистка посредством колоночной хроматографии на SiO2 с использованием смеси 2% EtOAc/гексан позволила получить 3 (89%) в виде бесцветного масла.
1Н ЯМР (500 МГц, CDCl3) δ 7,70-7,63 (m, 4Н), 7,47-7,30 (m, 6Н), 4,61-4,54 (m, 1Н), 3,92-3,82 (m, 1Н), 3,78-3,70 (m, 1Н), 3,67 (t, J=6,2 Гц, 1Н), 3,56-3,45 (m, 1Н), 3,44-3,33 (m, 1Н), 2,22-2,07 (m, 2Н), 1,90-1,39 (m, 10Н), 1,39-1,23 (m, 9Н), 1,04 (s, 9Н), 0,92-0,81 (m, 2Н); 13С ЯМР (125 МГц, CDCl3) δ 135,80 (4), 134,26 (2), 129,76 (2), 127,84 (4), 99,08, 80,67, 80,22, 67,90, 63,73, 62,57, 31,99, 31,05, 30,01, 29,75, 29,73, 29,41, 29,39, 29,13, 27,12 (3), 26,48, 25,82, 25,77, 19,97, 19,47, 19,02, 18,81.
Стадия В. Синтез 15-((тетрагидро-2Н-пиран-2-ил)окси)пентадец-5-ин-1-ола (4):
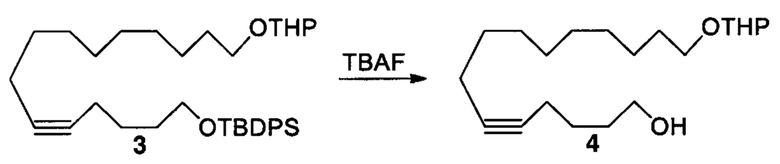
К раствору 3 в сухом ТГФ добавляли тетра-н-бутиламмоний фторид (TBAF, 1,0 М раствор в ТГФ, 1,3 эквив.). Через 39 ч ТГФ выпаривали, остаток суспендировали в воде и дважды подвергали экстракции посредством Et2O. Органические экстракты сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали с использованием хроматографической системы Teledyne Isco Combiflash® RF с получением спирта 4 (61%) в виде бесцветного масла.
1Н ЯМР (500 МГц, CDCl3) δ 4,57 (dd, J=4,5, 2,8 Гц, 1Н), 3,91-3,83 (m, 1Н), 3,72 (dt, J=9,5, 6,9 Гц, 1Н), 3,67 (t, J=6,4 Гц, 2Н), 3,54-3,44 (m, 1Н), 3,37 (dt, J=9,5, 6,7 Гц, 1Н), 2,19 (tt, J=6,9, 2,4 Гц, 2Н), 2,13 (tt, J=7,1, 2,4 Гц, 2Н), 1,89-1,77 (m, 1Н), 1,77-1,40 (m, 13Н), 1,40-1,24 (m, 10Н); 13С ЯМР (125 МГц, CDCl3) δ 98,98, 80,75, 79,96, 67,86, 62,50 (2), 32,03, 30,93, 29,90, 29,61, 29,26 (2), 29,01, 26,39, 25,67, 25,60 (2), 19,83, 18,90, 18,73.
Стадия С. Синтез 15-(тетрагидро-2Н-пиран-2-илокси)пентадец-5(Z)-ен-1-ола (5):
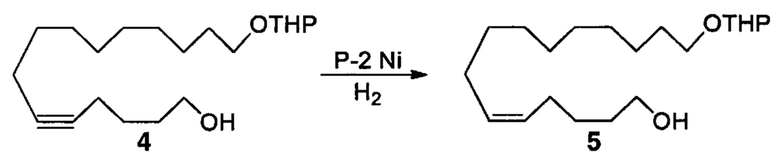
К суспензии Ni(OAc)2 (0,6 эквив.) в абсолютном этаноле в двухгорлой колбе в атмосфере Н2 (1 атм) добавляли NaBH4 (0,8 эквив.) одной порцией. Через 25 мин добавляли чистый (neat) перегнанный этилендиамин (EDA, 3 эквив.), а после него раствор соединения 4 в абсолютном EtOH. Через 2 ч реакционную смесь фильтровали через слой силикагеля. Указанный слой промывали EtOAc. Объединенные органические фильтраты концентрировали с получением олефина 5 (98%) в виде бесцветного масла.
ТСХ: 20% EtOAc/гексан, Rf~0,35. 1Н ЯМР (500 МГц, CDCl3) δ 5,41-5,31 (m, 2Н), 4,59-4,56 (m, 1Н), 3,89-3,85 (m, 1Н), 3,73 (dt, J=9,7, 6,9 Гц, 1Н), 3,65 (t, J=6,5 Гц, 2Н), 3,53-3,47 (m, 1Н), 3,38 (dt, J=9,7, 6,9 Гц, 1Н), 2,06 (dt, J=7,0, 6,5 Гц, 2Н), 2,01 (dt, J=7,0, 6,5 Гц, 2Н), 1,87-1,79 (m, 1Н), 1,75-1,68 (m, 1Н), 1,64-1,48 (m, 9Н), 1,46-1,38 (m, 2Н), 1,38-1,24 (m, 11Н); 13С ЯМР (125 МГц, CDCl3) δ 130,5, 129,6, 99,0, 67,9, 62,8 (2), 62,5, 32,6, 30,9, 29,9, 29,8(2), 29,7, 29,5, 27,4, 27,2, 26,4, 26,1, 25,6, 19,8.
Стадия D. Синтез 2-(15-азидопентадец-10(Z)-енилокси)тетрагидро-2Н-пирана (6):
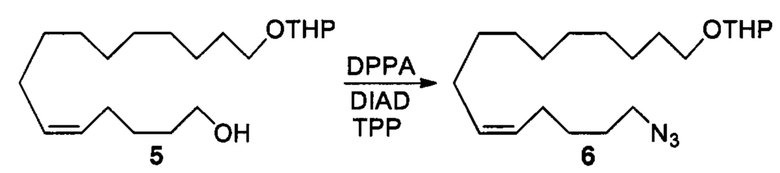
К раствору трифенилфосфина (ТРР, 1,2 эквив.) в сухом ТГФ при -25°С по каплям добавляли диизопропилазодикарбоксилат (DIAD, 1,2 эквив.). Десять минут спустя по каплям при той же температуре добавляли раствор спирта 5 в сухом ТГФ с получением суспензии желтого цвета. Через 30 мин реакционную смесь нагревали до 0°С, а затем по каплям добавляли дифенилфосфорилазид (DPPA, 1,2 эквив.). Реакционную смесь нагревали до к.т. и перемешивали. Через 16 ч реакционную смесь гасили посредством H2O и трижды подвергали экстракции посредством Et2O. Объединенные экстракты в эфире сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии на SiO2 с использованием 2% EtOAc/гексана в качестве элюента с получением 6 (>97%) в виде масла светло-желтого цвета. Аналитический образец дополнительно очищали с использованием препаративной ТСХ с получением соединения 6 в виде бесцветного масла.
ТСХ: 20% EtOAc/гексан, Rf~0,8. 1Н ЯМР (400 МГц, CDCl3) δ 5,43-5,28 (m, 2Н), 4,59-4,56 (m, 1Н), 3,91-3,84 (m, 1Н), 3,77-3,69 (m, 1Н), 3,54-3,46 (m, 1Н), 3,41-3,35 (m, 1Н), 3,27 (t, J=6,8 Гц, 2Н), 2,10-1,95 (m, 4Н), 1,88-1,78 (m, 1Н), 1,76-1,68 (m, 1Н), 1,65-1,48 (m, 6Н), 1,46-1,38 (m, 2Н), 1,38-1,24 (m, 14Н); 13С ЯМР (100 МГц, CDCl3) δ 130,9, 129,0, 99,0, 67,8, 62,4, 51,5, 31,0, 29,9, 29,8, 29,7, 29,6 (2), 29,5, 28,6, 27,4, 26,9, 26,8, 26,4, 25,7, 19,9.
Стадия Е. Синтез 15-(тетрагидро-2H-пиран-2-илокси)пентадец-5(Z)-ен-1-амина (7):
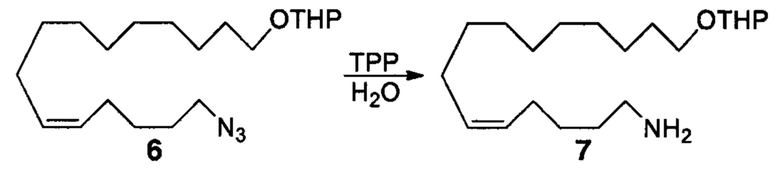
К раствору указанного выше неочищенного азида 6 в ТГФ при к. т.одной порцией добавляли трифенилфосфин (ТРР, 1,3 эквив.). Через 2 ч добавляли H2O, и полученную реакционную смесь перемешивали при к. т.Через 12 ч реакционную смесь разбавляли посредством EtOAc, а затем солевым раствором, и полученную двухфазную смесь трижды подвергали экстракции посредством EtOAc. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт растирали в Et2O и фильтровали через воронку из спеченного стекла (fritted funnel). Фильтрат концентрировали под вакуумом, и полученное неочищенное соединение 7 использовали на следующей стадии без дополнительной очистки. ТСХ: 5% MeOH/CH2Cl2, Rf~0,1.
Стадия F. Синтез N1-метил-N2-(15-(тетрагидро-2H-пиран-2-илокси)пентадец-5(Z)-енил)оксаламида (9):
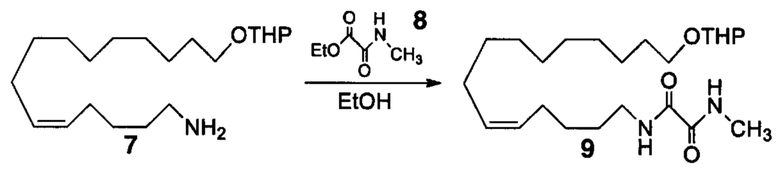
Согласно методике из литературы1, указанный выше неочищенный амин 7 и соединение 8 (1,2 эквив.) в безводном абсолютном этаноле нагревали при 85°С в запаянной пробирке. Через 15 ч реакционную смесь концентрировали под вакуумом, и полученный неочищенный продукт очищали посредством колоночной хроматографии на SiO2 с использованием смеси 25% EtOAc/гексан с получением соединения 9 (70%) в виде твердого вещества белого цвета, т. плавл. 69,9-70,2°С.
ТСХ: 50% EtOAc/гексан, Rf~0,65. 1Н ЯМР (500 МГц, CDCl3) δ 7,56-7,46 (ушир. s, 2Н), 5,42-5,28 (m, 2Н), 4,59-4,56 (m, 1Н), 3,91-3,84 (m, 1Н), 3,72 (dt, J=9,6, 6,9 Гц, 1Н), 3,54-3,46 (m, 1Н), 3,37 (dt, J=9,6, 6,7 Гц, 1Н), 3,30 (каж. q, J=6,9 Гц, 2Н), 2,91 (d, J=5,5 Гц, 3Н), 2,04 (dt, J=7,5, 7,0 Гц, 2Н), 1,98 (каж. q, J=7,0, 2Н), 1,88-1,78 (m, 1Н), 1,76-1,68 (m, 1Н), 1,64-1,47 (m, 7Н), 1,44-1,22 (m, 15Н); 13С ЯМР (125 МГц, CDCl3) δ 160,8, 159,9, 130,9, 129,1, 99,1, 67,9, 62,6, 39,8, 31,0, 29,9(2), 29,8, 29,7(2), 29,5, 29,0, 27,5, 27,1, 26,9, 26,5, 26,4, 25,7, 19,9.
Стадия G. Синтез N1-(15-гидроксипентадец-5(Z)-енил)-N2-метилоксаламида (10):
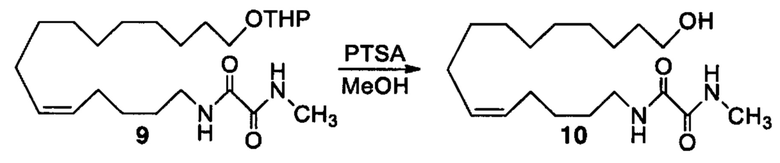
К раствору соединения 9 в метаноле добавляли п-толуолсульфоновую кислоту (PTSA, 0,07 эквив.). Через 2 ч растворитель выпаривали под вакуумом, и остаток повторно растворял в EtOAc. Пропускание неочищенного продукта через небольшой слой силикагеля с использованием EtOAc в качестве элюента позволило получить соединение 10 (>95%) в виде твердого вещества белого цвета, т. плавл. 115,4-115,7°С.
ТСХ: 50% EtOAc/гексан, Rf~0,25. 1Н ЯМР (400 МГц, CDCl3) δ 7,45 (ушир. s, 2Н), 5,42-5,28 (m, 2Н), 3,71-3,55 (m, 2Н), 3,31 (каж. q, J=6,8 Гц, 2Н), 2,91 (d, J=5,2 Гц, 3Н), 2,12-1,91 (m, 4Н), 1,61-1,52 (m, 6Н), 1,44-1,23 (m, 12Н); 13С ЯМР (125 МГц, CDCl3) δ 160,8, 159,9, 130,9, 129,1, 63,3, 39,8, 33,0, 29,8, 29,7, 29,6(2), 29,4, 29,0, 27,4, 27,1, 26,9, 26,4, 25,9.
Пример 2
Получение иллюстративного соединения С41
Стадия А. Синтез N1-(15-бромпентадец-5(Z)-енил)-N2-метилоксаламида (11):
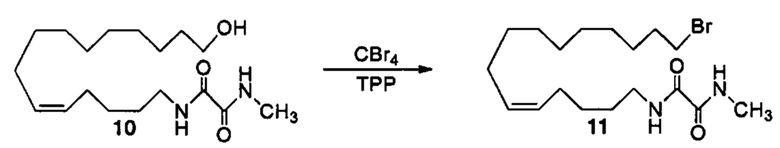
К раствору ТРР (745 мг, 1,2 эквив.) в CH2Cl2 (80 мл) в атмосфере аргона добавляли раствор общего промежуточного соединения 10 (740 мг, 2,37 ммоль, 1 эквив.) в CH2Cl2 (40 мл), а после него тетрабромид углерода (CBr4, 1,2 эквив., 942 мг) одной порцией. Через 24 ч реакционную смесь концентрировали под вакуумом, и очищали остаток посредством колоночной хроматографии на силикагеле с использованием смеси 20-25% EtOAc/гексан с получением соединения 11 (597 мг, 67%) в виде твердого вещества белого цвета, т. плавл. 77,5-77,6°С.
ТСХ: 50% EtOAc/гексан, Rf~0,7. 1Н ЯМР (400 МГц, CDCl3) δ 7,45 (ушир. s, 2Н), 5,42-5,27 (m, 2Н), 3,41 (t, J=6,8 Гц, 2Н), 3,31 (каж. q, J=6,8 Гц, 2Н), 2,91 (d, J=5,6 Гц, 3Н), 2,09-1,96 (m, 4Н), 1,85 (каж. квинтет, J=7,2 Гц, 2Н), 1,62-1,52 (m, 2Н), 1,47-1,37 (m, 4Н), 1,37-1,23 (m, 10Н); 13С ЯМР (100 МГц, CDCl3) δ 160,8,159,9, 130,9, 129,1, 39,8, 34,3, 33,0, 29,9, 29,6(2), 29,5, 29,0, 28,9, 28,4, 27,4, 27,1, 26,9, 26,4.
Стадия В. Синтез диметил-15-(2-(метиламино)-2-оксоацетамидо)пентадец-10(Z)-енилфосфоната (12):
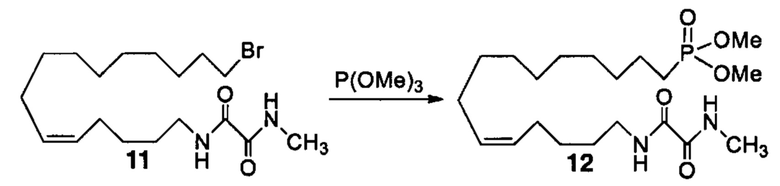
Раствор соединения 11 (375 мг, 1,1 ммоль) и триметилфосфита [Р(ОМе)3] (16 мл) в сухом ТГФ (16 мл) нагревали в запаянной пробирке при 120°С. Через 3 дня ТГФ выпаривали под вакуумом, и отгоняли Р(ОМе)3 при пониженном давлении. Неочищенное соединение 12 (240 мг, 54%) подвергали следующей реакции без дополнительной очистки. Аналитический образец очищали с помощью препаративной ТСХ.
ТСХ: 50% EtOAc/гексан, Rf~0,2. 1Н ЯМР (500 МГц, CDCl3) δ 7,48 (ушир. s, 2Н), 5,39-5,26 (m, 2Н), 3,72 (d, JP,H=10,5 Гц, 6Н), 3,30 (каж. q, J=7,0 Гц, 2Н), 2,90 (d, J=5,0 Гц, 3Н), 2,04 (каж. q, J=7,5 Гц, 2H), 1,98 (каж. q, J=7,5 Гц, 2Н), 1,81-1,67 (m, 2Н), 1,63-1,51 (m, 4Н), 1,43-1,21 (m, 14Н); 31Р ЯМР (202 МГц, CD3OD; отн. 85% H3PO4) δ 36,48 (s).
Стадия С. Синтез динатрий 15-(2-(метиламино)-2-оксоацетамидо)пентадец-10(Z)-енилфосфоната (С41):
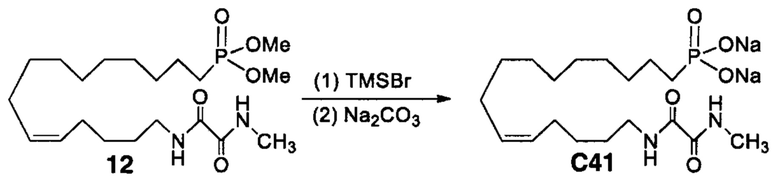
Следуя методике из литературы2, к раствору соединения 12 (150 мг, 0,371 ммоль) в безводном CH2Cl2 (10 мл) по каплям добавляли TMSBr (10 эквив., 0,5 мл) при 0°С. Через 75 мин реакцию гасили метанолом (5 мл), концентрировали под вакуумом, и остаток растирали с CH2Cl2 (2×10 мл). Остаток, т. плавл. 130,6-130,7°С, растворяли в водном растворе Na2CO3 (0,01 М, рН 10). К раствору добавляли биогранулы Bio-Rad™ SM-2 (20-50 меш, 5 г). После аккуратного перемешивания в течение 30 мин полученные гранулы собирали на воронке из спеченного стекла и промывали водой (20 мл). Далее использовали метанол для отделения соединения С41 от биогранул. Выпаривание метанола позволило получить соединение С41 (48 мг, 30%) в виде порошка белого цвета, т. плавл. 240°С (с разложением).
Свободная кислота соединения С41: 1Н ЯМР (500 МГц, CD3OD) δ 8,58 (ушир. s, 3Н), 5,44-5,24 (m, 2Н), 3,26 (каж. q, J=6,5 Гц, 2Н), 2,82 (s, 1Н), 2,81 (s, 2Н), 2,12-1,98 (m, 4Н), 1,88-1,72 (m, 2Н), 1,71-1,50 (m, 4Н), 1,47-1,24 (m, 14Н); 31Р ЯМР (202 МГц, CD3OD; отн. 85% H3PO4) δ 31,37 (s).
С41: 1Н ЯМР (500 МГц, CD3OD) δ 5,43-5,28 (m, 2Н), 3,26 (t, J=7,0 Гц, 2Н), 2,82 (s, 3Н), 2,14-1,95 (m, 4Н), 1,88-1,71 (m, 2Н), 1,69-1,42 (m, 4Н), 1,42-1,24 (m, 14Н).
Пример 2А
Получение иллюстративных соединений С52 и С53
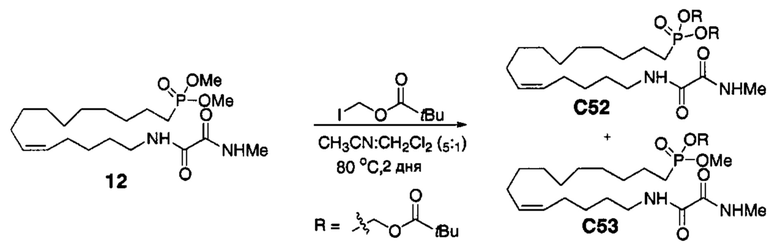
К перемешиваемому раствору диетилфосфоната 12 (1,0 ммоль, 0,418 г) в сухом CH3CN (10 мл) и CH2Cl2 (2 мл) комнатной температуры в атмосфере аргона добавляли пивалоилоксиметил иодид (POM-I; приобретен в Enamine LLC, Princeton Corporate Plaza, 7 Deer Park Drive, Ste. M-3, Monmouth Jet., NJ 08852 USA) (5,0 ммоль, 0,76 мл). Через 2 дня большая часть исходного фосфоната была израсходована (анализ методом ТСХ: 5% МеОН/CH2Cl2). Летучие вещества выпаривали под вакуумом, и неочищенный продукт очищали с помощью колоночной флэш-хроматографии на SiO2 с использованием градиента 1 -2% МеОН в CH2Cl2 с получением чистого моно-РОМ-сложного эфира С53 (20 мг, 4%) в виде масла и ди-РОМ-сложного эфира С52 с некоторыми примесями. Вторая очистка с использованием препаративной ТСХ (5% МеОН/CH2Cl2) позволила получить чистый ди-РОМ-сложный эфир С52 (21 мг, 3%) в виде масла.
С52. ТСХ: Rf~0,5, 5% MeOH/CH2Cl2; 1Н ЯМР (400 МГц, CDCl3) δ 7,46 (ушир. s, 2Н), 5,64 (d, JH-P=13,1 Гц, 4Н), 5,40-5,23 (m, 2Н), 3,28 (каж. q, J=7,0 Гц, 2Н), 2,88 (d, J=5,2 Гц, 3Н), 2,02 (каж. q, J=6,9 Гц, 2Н), 1,97 (каж. q, J=6,9 Гц, 2Н), 1,84-1,74 (m, 2Н), 1,64-1,49 (m, 4Н), 1,40-1,17 (m, 14Н), 1,21 (s, 18Н); 13С ЯМР (101 МГц, CDCl3) δ 176,86, 160,53, 159,64, 130,57, 128,83, 81,24 (d, 2JC-O-P=6,2 Гц), 39,52, 38,70, 30,40 (d, 2JC-C-P = 18,0 Гц), 29,64, 29,40, 29,27, 29,21, 29,02 (4JC-P = 1,4 Гц), 28,78, 27,20, 26,84, 26,82, 26,65, 26,23 (d, 1JC-Р = 84,0 Гц), 26,12, 21,91 (d, 3JC-P = 5,4 Гц).
C53. ТСХ: Rf~0,4, 5% MeOH/CH2Cl2; 1Н ЯМР (500 МГц, CDCl3) δ 7,48 (ушир. s, 2Н), 5,68 (d, JH-P = 13,2 Гц, 2Н), 5,43-5,27 (m, 2Н), 3,74 (d, JH-P = 11,2 Гц, 3Н), 3,32 (каж. q, J=6,9 Гц, 2Н), 2,92 (d, J=5,2 Гц, 3Н), 2,06 (каж. q, J=6,9 Гц, 2Н), 2,00 (каж. q, J=6,9 Гц, 2Н), 1,83-1,76 (m, 2Н), 1,64-1,51 (m, 4Н), 1,44-1,20 (m, 14Н), 1,21 (s, 9Н); 13С ЯМР (101 МГц, CDCl3) δ 177,00, 160,55, 159,67, 130,59, 128,84, 81,66 (d, 2JC-O-P = 6,0 Гц), 51,81 (d, 2JC-O-P = 7,2 Гц), 39,53, 38,72, 30,49 (d, 2JC-C-P = 17,5 Гц), 29,66, 29,42, 29,28, 29,22, 29,04 (d, 4JC-P = 1,3 Гц), 28,79, 27,20, 26,90, 26,83, 26,66, 25,83 (d, 1JC-P = 139,4 Гц), 26,14, 22,10 (d, 3JC-P = 5,4 Гц).
Пример 3
Получение иллюстративного соединения С38
Стадия А. Синтез N1-(15-цианопентадец-5(Z)-енил)-N2-метилоксаламида (13):
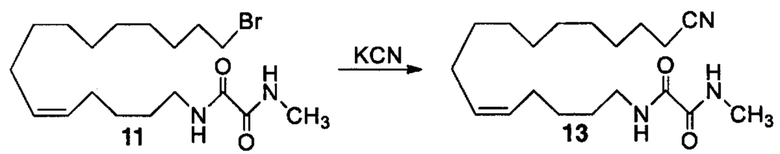
К раствору бромида 11 (550 мг, 1,47 ммоль) в ДМСО (30 мл) добавляли KCN (500 мг, 5 эквив.) одной порцией. Через 24 ч при к. т.реакционную смесь разбавляли водой (60 мл) и подвергали экстракции посредством EtOAc (20 мл × 3). Объединенные органические экстракты промывали водой (25 мл × 2), а затем солевым раствором (30 мл). Полученные экстракты сушили над безводным Na2SO4, фильтровали и затем концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии на SiO2 с использованием смеси 20-25% EtOAc/гексан с получением соединения 13 (490 мг, 99%) в виде порошка белого цвета, т. плавл. 88,8-88,9°С.
ТСХ: 50% EtOAc/гексан, Rf~0,55. 1Н ЯМР (400 МГц, CDCl3) δ 7,43 (ушир. s, 2Н), 5,44-5,23 (m, 2Н), 3,31 (каж. q, J=6,8 Гц, 2Н), 2,91 (d, J=5,2 Гц, 3Н), 2,34 (t, J=7,2 Гц, 2Н), 2,09-1,96 (m, 4Н), 1,71-1,61 (m, 2Н), 1,61-1,49 (m, 4Н), 1,49-1,36 (m, 4Н), 1,36-1,22 (m, 8Н); 13С ЯМР (100 МГц, CDCl3) δ 160,8, 159,9, 130,8, 129,1, 120,1, 39,8, 29,8, 29,6, 29,5, 29,4, 29,0, 28,9, 28,8, 27,4, 27,1, 26,9, 26,4, 25,6, 17,3.
Стадия В. Синтез N1-16-амино-16-(гидроксиимино)гексадец-5(Z)-енил-N2-метилоксаламида (14):
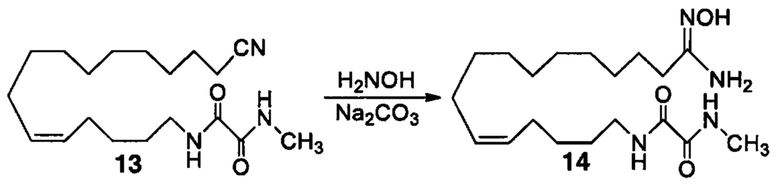
Следуя методике из литературы3, раствор нитрила 13 (100 мг, 0,311 ммоль), NH2OH⋅HCl (108 мг, 5 эквив.) и Na2CO3 (181 мг, 5,5 эквив.) в безводном метаноле (2 мл) нагревали в запаянной пробирке при 84°С. Через 2 дня реакционную смесь охлаждали до к.т., фильтровали и концентрировали под вакуумом. Остаток растирали с EtOAc (60 мл × 3), а затем с водой (70 мл). Полученный твердый остаток белого цвета (76 мг, 69%) использовали в следующей реакции без дополнительной очистки. Аналитический образец очищали посредством препаративной ТСХ (5% МеОН/CH2Cl2, Rf~0,35), т. плавл. 118,1-118,5°С.
1Н ЯМР (400 МГц, CD3OD) δ 5,35 (td, J=5,9, 4,6 Гц, 2Н), 3,25 (t, J=7,1 Гц, 2Н), 2,82 (s, 3Н), 2,12-1,98 (m, 6Н), 1,90 (s, 1Н), 1,56 (каж. квинтет, J=7,3 Гц, 4Н), 1,44-1,26 (m, 16Н); 13С ЯМР (100 МГц, CD3OD) δ 161,2, 160,4, 156,5, 130,1, 129,1, 39,19, 30,61, 29,63, 29,43, 29,38, 29,25, 29,12, 28,97, 28,67, 27,14, 26,94, 26,85, 26,58, 25,08.
Стадия С. Синтез N1-метил-N2-(15-(2-оксидо-3Н-1,2,3,5-оксатиадиазол-4-ил)пентадец-5(Z)-ен-1-ил)оксаламида (С38):
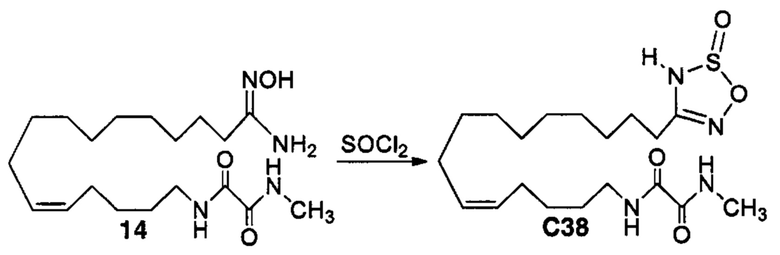
Следуя методике из литературы3, к раствору соединения 14 (74 мг, 0,21 ммоль) в ТГФ (4 мл) при 0°С добавляли пиридин (43,6 мкл, 2,6 эквив.), а затем раствор SOCl2 (20 мкл, 1,3 эквив.) в CH2Cl2 (1 мл). Через 1 ч 40 мин все летучие вещества удаляли под вакуумом, а остаток разбавляли водой (10 мл) и подвергали экстракции посредством EtOAc (15 мл × 5). Объединенные органические экстракты сушили над Na2SO4, фильтровали, концентрировали и очищали посредством препаративной ТСХ (10% МеОН/CH2Cl2) с получением С38 (55 мг, 63%) в виде твердого вещества белого цвета, т. плавл. 92,7-92,9°С.
ТСХ: 5% МеОН/CH2Cl2, Rf~0,6. 1Н ЯМР (500 МГц, CDCl3) δ 8,38 (s, 1Н), 7,50 (s, 2Н), 5,41-5,28 (m, 2Н), 3,41-3,21 (m, 2Н), 2,91 (d, J=5,2 Гц, 3Н), 2,62 (t, J=7,7 Гц, 2Н), 2,06 (каж. q, J=7,0 Гц, 4Н), 2,01 (каж. q, J=7,0 Гц, 4Н), 1,69 (каж. квинтет, J=7,7 Гц, 2Н), 1,63-1,55 (m, 3Н), 1,46-1,13 (m, 9Н); 13С ЯМР (100 МГц, CDCl3) δ 160,72, 159,91, 152,89, 130,89, 129,19, 39,95, 29,43, 29,32, 29,21, 29,12, 29,04, 28,97, 28,88, 27,08 (2), 26,88, 26,58, 26,53, 23,95.
Пример 4
Получение иллюстративного соединения С42
Стадия А. Синтез N1-(15-иодпентадец-5(Z)-ен-1-ил)-N2-метилоксаламида (15):
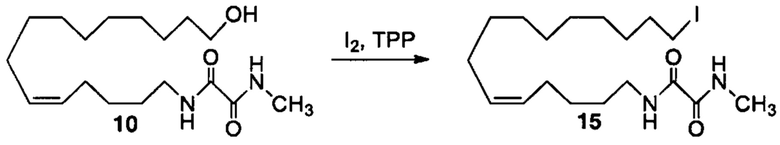
К раствору соединения 10 (1,80 г, 5,76 ммоль), ТРР (1,66 г, 1,1 эквив.) и имидазола (784 мг, 2 эквив.) в сухом ТГФ (180 мл) при 0°С добавляли I2 (1,75 г, 1,2 эквив.). Реакционной смеси давали возможность нагреться до к.т., и проводили ее перемешивание. Через 15 ч реакцию гасили насыщенным раствором NaHSO3, и дважды проводили промывку водой. Водную фазу повторно подвергали экстракции посредством EtOAc (20 мл × 2). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии на SiO2 с использованием смеси 20-25% EtOAc/гексан с получением соединения 15 (1,77 г, 70%) в виде твердого вещества белого цвета, т. плавл. 81,7°С. ТСХ: 50% EtOAc/гексан, Rf~0,65. 1Н ЯМР (CDCl3, 500 МГц) δ 7,43 (ушир. s, 2Н), 5,42-5,27 (m, 2Н), 3,31 (каж. q, J=6,9 Гц, 2Н), 3,19 (t, J=7,0 Гц, 2Н), 2,91 (d, J=5,2 Гц, 3Н), 2,05 (dt, J=7,5, 7,0 Гц, 2Н), 2,00 (каж. q, J=7,0 Гц, 2Н), 1,82 (каж. квинтет, J=7,2 Гц, 2Н), 1,63-1,48 (m, 2Н), 1,44-1,22 (m, 14Н); 13С ЯМР (125 МГц, CDCl3) δ 160,81, 159,94, 130,87, 129,12, 39,82, 33,80, 30,75, 29,93, 29,67, 29,63, 29,50, 29,06, 28,78, 27,48, 27,11, 26,94, 26,44, 7,68.
Стадия В. Синтез 15-(2-(метиламино)-2-оксоацетамидо)пентадец-10(Z)-ен-1-сульфоната натрия (С42):
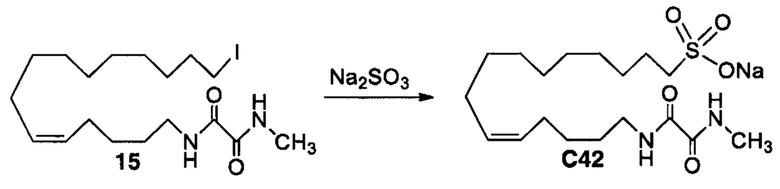
одид 15 (200 мг, 0,46 ммоль), Na2SO3 (231 мг, 4 эквив.), этанол (95%, 3 мл), циклогексен (0,93 мл, 20 эквив.) и воду (1,5 мл) нагревали при 85°С в запаянной пробирке. Через 4 дня реакционную смесь охлаждали до к.т., концентрировали под вакуумом, растворяли в Н2О и выделяли путем адсорбции на биогранулах Bio-Rad SM-2 Bio-Beads, как описано для соединения С41, с получением соединения С42 (51 мг, 27%) в виде твердого вещества грязно-белого цвета, т. плавл. 202-210°С (с разложением).
1Н ЯМР (500 МГц, ДМСО-d6) δ 8,86-8,55 (m, 2Н), 5,45-5,18 (m, 2Н), 3,18-2,99 (m, 2Н), 2,65 (d, J=5,9 Гц, 3Н), 2,34 (t, J=8,0 Гц, 2Н), 2,05-1,87 (m, 4Н), 1,60-1,35 (m, 4Н), 1,35-1,10 (m, 14Н); 13С ЯМР (100 МГц, ДМСО-d6) δ 161,26, 160,51, 130,34, 129,85, 52,20 (2), 39,23, 29,81, 29,70, 29,58, 29,59, 29,32, 29,10, 28,98, 27,28, 27,07, 26,94, 25,78.
Пример 5
Получение иллюстративного соединения С43
Синтез N1-(15-((2-ацетамидобензо[d]тиазол-7-ил)окси)пентадец-5(Z)-ен-1-ил)-N2-метилоксаламида (С43):
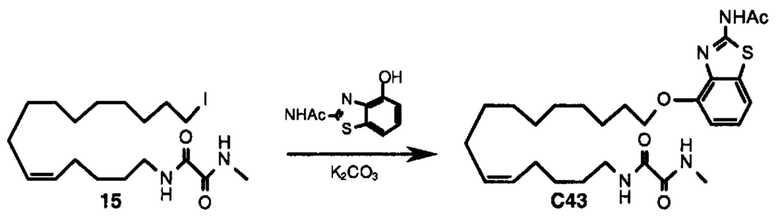
Запаянную пробирку, содержащую иодид 15 (200 мг, 0,458 ммоль), N-(4-гидроксибензо[d]тиазол-2-ил)ацетамид4 (122 мг, 1 эквив.) и К2СО3 (95 мг, 1,5 эквив.) нагревали при 85°С. Через 6 ч реакционную смесь охлаждали до к.т., разбавляли EtOAc (15 мл) и водой (15 мл) и подвергали экстракции посредством EtOAc (15 мл × 3).
Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток очищали на хроматографической системе Teledyne Isco Combiflash® RF (колонка с 1,2 г SiO2, элюирование смесью 50-60% EtOAc/гексан) с получением соединения С43 (68 мг, 29%) в виде твердого вещества коричневого цвета. Полученное коричневое твердое вещество растворяли в EtOH (1 мл) и подвергали обработке ультразвуком при к.т. в течение 5 минут. Аналог С43 осаждали в виде твердого вещества белого цвета после выдерживания и сушки под глубоким вакуумом.
ТСХ: 50% EtOAc/гексан, Rf~0,2. 1Н ЯМР (CDCl3, 500 МГц) δ 11,33 (ушир. s, 1Н), 7,85 (ушир. s, 1Н), 7,59 (ушир. s, 1Н), 7,40 (d, J=8,0 Гц,1Н), 7,24 (каж. t, J=8,0 Гц, 1Н), 6,89 (d, J=8,0 Гц, 1Н), 5,40-5,26 (m, 2Н), 4,13 (t, J=6,5 Гц, 2Н), 3,32 (каж. q, J=7,0 Гц, 2Н), 2,89 (d, J=5,0 Гц, 3Н), 2,24 (s, 3Н), 2,04 (каж. q, J=7,0 Гц, 2Н), 1,97 (каж. q, J=7,0 Гц, 2Н), 1,88-1,79 (m, 2Н), 1,62-1,51 (m, 2Н), 1,49-1,34 (m, 4Н), 1,34-1,17 (m, 10Н); 13С ЯМР (125 МГц, CDCl3) δ 169,20, 160,87, 160,15, 158,24, 151,58, 138,33, 133,73, 130,96, 129,07, 125,00, 113,63, 108,24, 69,00, 39,85, 29,83, 29,80, 29,70, 29,65, 29,50, 29,48, 29,02, 27,44, 27,07, 26,90, 26,53, 26,35, 23,59.
Пример 6
Получение иллюстративного соединения С48
Стадия А.
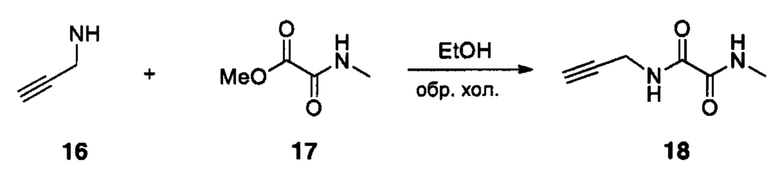
Раствор 16 (12 ммоль) и 17 (10 ммоль) в абсолютном EtOH (100 мл) нагревали с обратным холодильником. Через 12 ч реакционную смесь охлаждали до к. т.и концентрировали под вакуумом приблизительно до 20% первоначального объема, когда стало осаждаться соединение 18 в виде твердого вещества грязно-белого цвета. Полученное твердое вещество собирали путем фильтрования и использовали на следующей стадии без дополнительной очистки.
ТСХ: EtOAc/гексан (2:1), Rf~0,5; 1Н ЯМР (400 МГц, CDCl3) δ 2,26 (s, 1Н), 2,90 (d, J=5,2 Гц, 3Н), 4,06-4,13 (m, 2Н), 7,44 (ушир. s, 1Н), 7,68 (ушир. s, 1Н).
Стадия В.
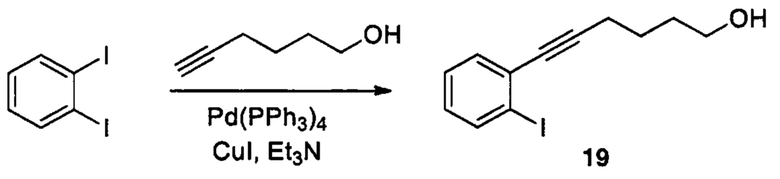
К раствору Pd(PPh3)4 (3 мольн. %, 350 мг) и Cul (5 мольн. %, 100 мг) в Et3N (40 мл) в атмосфере аргона добавляли раствор 1,2-дииодбензол (10 ммоль, 3,3 г) и 5-гексин-1-ол (10 ммоль, 980 мг) в Et3N (10 мл). Полученную реакционную смесь нагревали до 60°С в течение 12 ч, а затем охлаждали до к.т. и фильтровали через слой целита (Celite®). Фильтрат концентрировали под вакуумом, и остаток очищали с использованием хроматографической системы Teledyne Isco Combiflash® RF [колонка с 40 г SiO2, элюирование смесью EtOAc/гексан (1:2)] с получением соединения 19 (1,5 г, 50%) в виде масла бледно-желтого цвета.
ТСХ: EtOAc/гексан (1:2), Rf~0,2. 1Н ЯМР (500 МГц, CDCl3) δ 1,73-1,81 (m, 2Н), 1,82-1,88 (m, 2Н), 2,55 (t, J=7,0 Гц, 2Н), 3,76 (t, J=7,0 Гц, 2Н), 6,98 (dd, J=7,0, 8,0 Гц, 1Н), 7,29 (dd, J=7,0, 8,0 Гц, 1Н), 7,42 (d, J=7,5 Гц, 1Н), 7,84 (d, J=8,0 Гц, 1Н).
Стадия С.
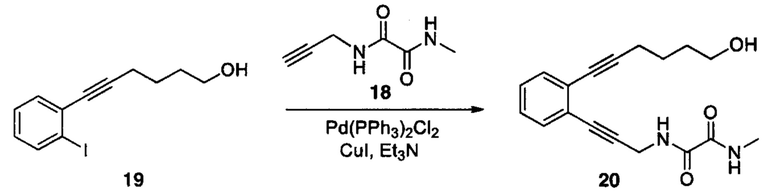
К раствору соединения 18 (1,66 ммоль, 232 мг), Pd(PPh3)2Cl2 (3 мольн. %, 35 мг) и Cul (5 мольн. %, 16 мг) в сухом CH3CN (15 мл) последовательно добавляли Et3N (16,6 ммоль, 2,3 мл) и спирт 19 (1,66 ммоль, 500 мг) в атмосфере аргона. После нагревания при 50°С в течение 12 ч реакционную смесь охлаждали до к. т.и фильтровали через слой целита (Celite®). Фильтрат концентрировали под вакуумом, и остаток очищали с использованием хроматографической системы Teledyne Isco Combiflash® RF [колонка с 40 г SiO2, элюирование смесью EtOAc/гексан (2:1)] с получением соединения 20 (362 мг, 70%) в виде масла бледно-желтого цвета.
ТСХ: EtOAc/гексан (2:1), Rf~0,15. 1Н ЯМР (500 МГц, CDCl3) d 1,68-1,78 (m, 2Н) 1,80-1,88 (m, 2Н), 2,53 (t, J=7,0 Гц, 2H), 2,92 (d, J=5,0 Гц, 3Н), 3,76 (t, J=6,5 Гц, 2H), 4,40 (d, J=6,0 Гц, 2H), 7,18-7,28 (m, 2Н), 7,36-7,44 (m, 2Н), 7,62 (ушир. s, 1Н), 8,24 (ушир. s, 1Н).
Стадия D.
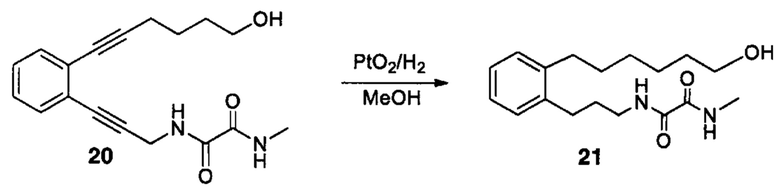
Смесь диина 20 (100 мг) и PtO2 (10 мг) в сухом МеОН (10 мл) встряхивали в гидрогенизирующем аппарате Парра в атмосфере Н2 (примерно 345 кПа (50 psi)). Через 12 ч реакционную смесь фильтровали через слой целита (Celite®), и фильтрат концентрировали под вакуумом с получением неочищенного соединения 21 в виде твердого вещества белого цвета, которое использовали на следующей стадии без дополнительной очистки.
Стадия Е.
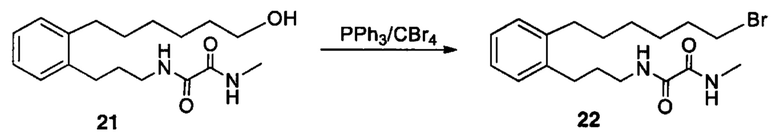
К раствору соединения 21 (0,32 ммоль, 100 мг) и CBr4 (0,48 ммоль, 160 мг) в CH2Cl2 (5 мл) добавляли PPh3 (0,38 ммоль, 100 мг) одной порцией при температуре 0°С. После перемешивания при к.т. в течение 12 ч растворитель упаривали под вакуумом, и остаток очищали с использованием хроматографической системы Teledyne Isco Combiflash® RF [колонка с 24 г SiO2, элюирование смесью EtOAc/гексан (2:1)] с получением бромида 22 (98 мг, 80%) в виде твердого вещества белого цвета.
ТСХ: EtOAc/гексан (4:1), Rf~0,7. 1Н ЯМР (400 МГц, CDCl3) δ 1,35-1,50 (m, 4Н), 1,54-1,62 (m, 2Н), 1,80-1,90 (m, 4Н), 2,58 (dd, J=8,0, 8,0 Гц, 2Н), 2,65 (dd, J=8,0, 8,0 Гц, 2Н), 2,91 (d, J=5,2 Гц, 3Н), 3,38 (dd, J=7,2, 7,2 Гц, 2Н), 3,40 (J=7,2, 7,2 Гц, 2Н), 7,10-7,16 (m, 4Н), 7,42 (ушир. s, 1Н), 7,47 (ушир. S, 1Н); 13С ЯМР (100 МГц, CDCl3) δ 26,4, 28,3, 29,0, 30,0, 30,8, 31,2, 32,7, 32,9, 34,2, 39,7, 126,3, 126,5, 129,3, 129,5, 138,8, 140,4, 160,0, 160,7.
Стадия F.
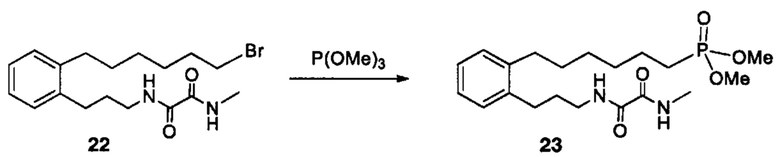
Смесь бромида 22 (0,54 ммоль, 200 мг) и Р(ОМе)3 (16,2 ммоль, 1,9 мл) нагревали с обратным холодильником в запаянной пробирке в течение 48 ч, затем охлаждали до к.т., и удаляли избыток Р(ОМе)3 под вакуумом. Остаток очищали посредством препаративной ТСХ с использованием смеси EtOAc/гексан/МеОН (2:1:0,3) с получением диметилфосфоната 23 (195 мг, 88%) в виде твердого вещества белого цвета. ТСХ: EtOAc/гексан/МеОН (2:1:0,3), Rf~0,3. 1Н ЯМР (400 МГц, CDCl3) δ 1,32-1,42 (m, 4Н), 1,50-1,76 (m, 6Н), 1,78-1,88 (m, 2Н), 2,53-2,58 (m, 2Н), 2,60-2,65 (m, 2Н), 2,89 (d, J=5,2 Гц, 3Н), 3,36 (dd, J=6,8, 6,8 Гц, 2H), 3,71 (d, JP-H=10,4 Гц, 6H), 7,08-7,12 (m, 4Н), 7,56 (ушир. s, 2Н).
Стадия G.
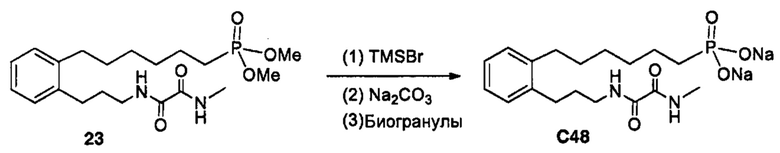
К раствору неочищенного двухзамещенного сложного эфира 23 (0,19 ммоль, 80 мг) в сухом CH2Cl2 (3 мл) по каплям добавляли TMSBr (2 ммоль, 260 мкл) в атмосфере аргона. Через 3 ч реакцию гасили посредством МеОН (2 мл). После перемешивания в течение еще 1 ч все летучие вещества удаляли под вакуумом, добавляли водный раствор Na2CO3 (0,5 М) для достижения рН~10. К полученному раствору добавляли биогранулы Bio-Rad™ SM-2 (20-50 меш, 5 г). После аккуратного перемешивания в течение 30 мин гранулы собирали на воронке из спеченного стекла и промывали водой (20 мл). Далее использовали метанол и EtOAc для отделения соединения от биогранул. Выпаривание органических промывочных вод позволило получить соединение С48 (37 мг, 45%) в виде твердого вещества грязно-белого цвета, т. плавл. > 300°С (с разложением).
1Н ЯМР (400 МГц, CD3OD) δ 1,34-1,66 (m, 10Н), 1,74-1,84 (m, 2Н), 2,58 (dd, J=8,0, 8,0 Гц, 2Н), 2,63 (dd, J=8,0, 8,0 Гц, 2Н), 2,81 (S, 3Н), 3,26-3,34 (m, 2Н), 7,02-7,12 (m, 4Н); 13С ЯМР (100 МГц, CD3OD) δ 24,4 (d, JC-P = 4,0 Гц), 24,9, 29,3, 29,5, 30,5, 30,6, 31,3, 31,6 (d, JC-P = 17,4 Гц), 32,4, 39,1, 125,4, 125,6, 128,7, 129,0, 138,9, 140,3, 160,3, 161,0; 31Р ЯМР (162 МГц, CD3OD; станд. 85% Н3РО4) δ 24,4.
Пример 7
Получение иллюстративного соединения С49
Стадия А.
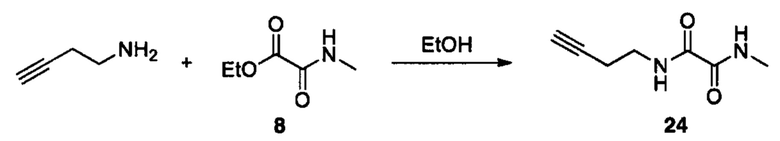
Неочищенное соединение 24 получали, точно следуя методике, описанной выше для получения гомолога 18, и использовали без дополнительной очистки.
Стадия В.
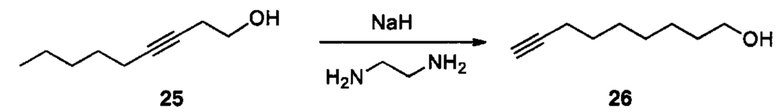
К этилендиамину (35 мл) добавляли NaH (60 масс. % в минеральном масле, 714 ммоль, 2,85 г) при 0°С одной порцией в атмосфере аргона. Полученную реакционную смесь перемешивали при к.т. в течение 1 ч, а затем при 60°С в течение 1 ч. После охлаждения до к.т. по каплям добавляли спирт 25 (17,85 ммоль, 2,84 мл). После окончания добавления реакционную смесь повторно нагревали до 60°С. Через 1 ч реакционную смесь охлаждали до 0°С и гасили 1 н. HCl. Органический слой подвергали экстракции эфиром (3×100 мл). Объединенные экстракты в эфире концентрировали под вакуумом, и остаток очищали с использованием хроматографической системы Teledyne Isco Combiflash® RF [колонка с 40 г SiO2, элюирование смесью EtOAc/гексан (1:5)] с получением 26 (1,4 г, 56%) в виде масла светло-желтого цвета.
Стадия С.
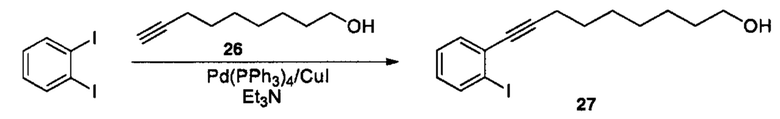
Реакцию кросс-сочетания с получением соединения 27 проводили, как описано для синтеза соединения 19.
Стадия D.
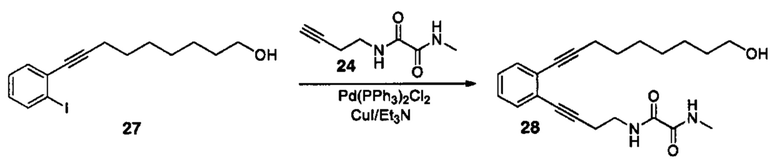
Следуя методике, используемой для получения соединения 20, иодид 27 и ацетилен 24 превращали в соединение 28, которое получали в виде твердого вещества бледно-желтого цвета.
ТСХ: EtOAc/гексан (2:1), Rf~0,1. 1Н ЯМР (400 МГц, CDCl3) δ 1,32-1,42 (m, 4Н), 1,46-1,66 (m, 6Н), 2,46 (t, J=6,8 Гц, 2 Н), 2,72 (t, J=6,8 Гц, 2 Н), 2,90 (d, J=5,2 Гц, 3Н), 3,58 (dd, J=5,2, 13,2 Гц, 2Н), 3,64 (t, J=6,4 Гц, 2Н), 7,15-7,22 (m, 2Н), 7,34-7,40 (m, 2Н), 7,46 (ушир. S, 1Н), 7,90 (ушир. s, 1Н).
Стадия Е.
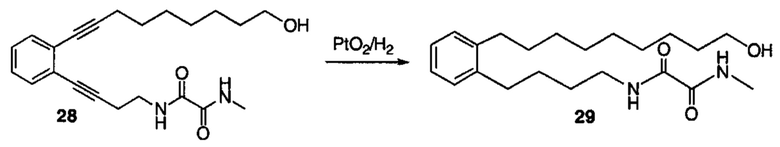
Следуя методике, используемой для получения соединения 21, диин 28 превращали в соединение 29, которое получали твердого вещества белого цвета.
ТСХ: EtOAc/гексан (2:1), Rf~0,15. 1Н ЯМР (400 МГц, CDCl3) δ 1,25-1,40 (m, 10Н), 1,50-1,65 (m, 8Н), 2,54-2,59 (m, 2Н), 2,60-2,65 (m, 2Н), 2,90 (d, J=5,2 Гц, 3Н), 3,30-3,38 (m, 2Н), 3,60-3,68 (m, 2Н), 7,08-7,14 (m, 4Н), 7,45 (ушир. s, 2Н).
Стадия F.
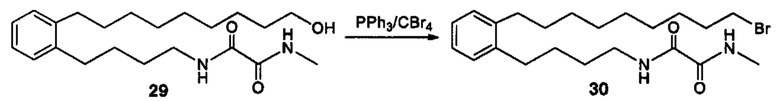
Следуя методике, используемой для получения соединения 22, спирт 29 превращали в соединение 30, которое получали твердого вещества белого цвета.
ТСХ: EtOAc/гексан (2:1), Rf~0,75. 1Н ЯМР (400 МГц, CDCl3) δ 1,22-1,48 (m, 12Н), 1,50-1,70 (m, 6Н), 1,80-1,90 (m, 2Н), 2,52-2,68 (m, 4Н), 2,89 (d, J=4,8 Гц, 3Н), 3,26-3,46 (m, 4Н), 7,08-7,16 (m, 4Н), 7,53 (ушир. S, 2Н); 13С ЯМР (100 МГц, CDCl3) δ 26,4, 28,4, 28,6, 29,0, 29,5, 29,6, 29,7, 29,9, 31,5, 32,3, 32,9, 33,0, 34,3, 39,8, 126,0, 126,2, 129,3, 129,4, 139,7, 140,7, 159,9, 160,8.
Стадия G.
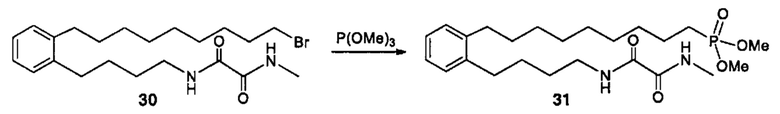
Следуя методике, используемой для получения соединения 23, бромид 30 превращали в соединение 31, которое получали твердого вещества белого цвета.
ТСХ: EtOAc/гексан/МеОН (1:1:0,2), Rf~0,2. 1Н ЯМР (400 МГц, CDCl3) δ 1,20-1,80 (m, 20Н), 2,56-2,70 (m, 4Н), 2,93 (s, 3Н), 3,30-3,42 (m, 2Н), 3,76 (d, JP-H = 10,0 Гц, 6Н), 7,08-7,18 (m, 4Н), 7,52 (ушир. s, 2Н).
Стадия Н.
Следуя методике, используемой для получения соединения С48, диметилфосфонат 31 превращали в динатриевую соль С49, которую получали твердого вещества белого цвета, т. плавл. > 300°С (с разложением).
1Н ЯМР (400 МГц, CD3OD) δ 1,25-1,40 (m, 10Н), 1,45-1,65 (m, 10Н), 2,56-2,66 (m, 4Н), 2,80 (S, 3Н), 3,25-3,30 (m, 2Н), 7,02-7,12 (m, 4Н); 13С ЯМР (100 МГц, CD3OD) δ 24,1 (d, JC-Р = 4,2 Гц), 24,8, 28,4, 28,7, 28,8, 29,2, 29,3, 29,4, 30,1, 31,3, 31,4 (d, JC-P = 17,4 Гц), 31,8, 32,2, 38,9, 125,4, 125,5, 128,8, 128,9,139,5, 140,1, 160,2, 161,0; 31Р ЯМР (162 МГц, CD3OD) d 24,6.
Пример 8
Получение иллюстративного соединения С50
Синтез N1-(16-фенилсульфонамидо-16-оксогексадец-5(Z)-ен-1-ил)-N2-метилоксаламида С50:
16-(2-(Метиламино)-2-оксоацетамидо)гексадец-11(Z)-еновую кислоту 32 получали согласно методике из литературы5. (Z)-16-(2-(метиламино)-2-оксоацетамидо)гексадец-11-еновую кислоту 32 (30 мг, 0,091 ммоль) и бензолсульфонамид 33 (13 мг, 0,091 ммоль) помещали в сухую круглодонную колбу в 5 мл безводного ДМФА в атмосфере аргона. Добавляли диметиламинопиридин (DMAP, 13 мг, 0,12, 1,2 эквив.) и 1-этил-3-(3-диметиламинопропил)карбодиимид (16 мг,0,12 ммоль; EDCl. HCl) в виде твердого вещества. После перемешивания в течение 12 ч при комнатной температуре реакционную смесь разбавляли водой (20 мл), и объединенные водные слои подвергали экстракции посредством EtOAc (3×20 мл), органические слои промывали водой (2×10 мл) и солевым раствором (10 мл). Объединенные органические экстракты сушили над Na2SO4, концентрировали при пониженном давлении, и остаток очищали посредством препаративной ТСХ с использованием 100% EtOAc в качестве элюента с получением амида (35 мг, 84%) в виде твердого вещества белого цвета.
ТСХ: 100% EtOAc, Rf: 0,30. 1Н ЯМР (CDCl3, 500 МГц): δ 8,05 (d, J=7,5 Гц, 2Н), 7,85 (bs, 1Н, NH), 7,65 (bs, 1Н, NH), 7,60 (t, J=7,5 Гц, 1Н), 7,55 (t, J=7,5 Гц, 2Н), 5,26-5,42 (m, 2Н), 3,28_3,35 (m, 2Н), 2,90 (s, 3Н), 2,36 (t, 2Н, J=7,3 Гц), 1,97-2,08 (m, 4Н), 1,51-1,64 (m, 4Н), 1,22-1,42 (m, 14Н). Т. плавл.: 72°С-73°С.
Пример 9
Получение иллюстративного соединения С44
Синтез (Z)-N1-(15-((2-гидроксифенил)тио)пентадец-5-ен-1-ил)-N2-метилоксаламида С44:
К суспензии (Z)-N1-(15-иодпентадец-5-ен-1-ил)-N2-метилоксаламид (15) (400 мг, 0,92 ммоль) и КНСО3 (1,2 эквив., 1,10 ммоль, 111 мг) в безводном ДМФА (3,5 мл) по каплям добавляли 2-меркаптофенол (1 эквив., 116 мг). Полученную реакционную смесь перемешивали в течение ночи при комнатной температуре. Примечание: Реакция протекала таким образом, что в ее начале была белая суспензия, а к следующему дню образовывался прозрачный раствор. После того, как реакция считалась завершенной по данным анализа методом ТСХ, ее гасили водой, проводили экстракцию этилацетатом (3×30 мл), сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенный продукт очищали с использованием хроматографической системы Teledyne Isco Combiflash® RF (колонка с 12 г SiO2, элюирование смесью 15-20% EtOAc/гексан) с получением указанного в заголовке фенола (317 мг,79%) в виде твердого вещества бледно-желтого цвета.
ТСХ: 50% EtOAc/гексан, Rf ≈ 0,65. 1Н ЯМР (CDCl3, 500 МГц) δ 7,46 (dd, J=7,5, 1,5 Гц, 2Н), 7,45-7,39 (ушир. s, 1Н), 7,29-7,22 (m, 1Н), 6,98 (dd, J=8,3, 1,3 Гц, 1Н), 6,87 (td, J=7,5, 1,3 Гц, 1Н), 6,78 (s, 1Н), 5,42-5,26 (m, 2Н), 3,31 (q, J=6,9 Гц, 2Н), 2,91 (d, J=5,2 Гц, 3Н), 2,72-2,65 (m, 2Н), 2,10-1,91 (m, 5Н), 1,62-1,49 (m, 5Н), 1,44-1,23 (m, 12Н); 13С ЯМР (125 МГц, CDCl3) δ 160,69, 159,81, 156,99, 135,93, 130,95,130,72, 128,96, 120,74, 119,37, 114,78, 39,68, 36,85, 29,77, 29,73, 29,52, 29,51, 29,34, 29,19, 28,91, 28,67, 27,32, 26,96, 26,79, 26,28. Т. плавл.: 62,4-62,7°С.
Список литературы
1. Meddad-Belhabich, N.; Aoun, D.;  , A.; Redeuilh, C; Dive, G.; Massicot, F.; Chau, F.; Heymans, F.; Lamouri, A. Design of new potent and selective secretory phospholipase А2 inhibitors. 6-Synthesis, structure-activity relationships and molecular modeling of 1-substituted-4-[4,5-dihydro-1,2,4-(4H)-oxadiazol-5-one-3-yl(methyl)]-functionaIized aryl piperazin/one/dione derivatives. Bioorg. Med. Chem. 2010, 18, 3588-3600.
, A.; Redeuilh, C; Dive, G.; Massicot, F.; Chau, F.; Heymans, F.; Lamouri, A. Design of new potent and selective secretory phospholipase А2 inhibitors. 6-Synthesis, structure-activity relationships and molecular modeling of 1-substituted-4-[4,5-dihydro-1,2,4-(4H)-oxadiazol-5-one-3-yl(methyl)]-functionaIized aryl piperazin/one/dione derivatives. Bioorg. Med. Chem. 2010, 18, 3588-3600.
2. Borbas, К.E.; Ling Kee, H.; Holten, D.; Lindsey, S.J. A compact water-soluble porphyrin bearing an iodoacetamido bioconjugatable site. Org. Biomol. Chem., 2008, 6, 187-194.
3. Ellingboe, J.W.; Lombardo, L.J.; Alessi, T.R.; Nguyen, Т.Т.; Guzzo, F.; Guinosso, C.J.; Bullington, J.; Browne, E.N.C; Bagli, J.F. Antihyperglycemic activity of novel naphthalenylmethyl-3H-1,2,3,5-oxathiadiazole 2-oxides. J. Med. Chem. 1993, 36, 2485-2493.
4. Thiel, O.R.; Bernard, C.; King, Т.; Dilmeghani-Seran, M.; Bostick, Т.; Larsen, R.D.; Margaret M. Faul, M.M. J. Org. Chem. 2008, 73, 3508-3515.
5. Falck, J.R.; Wallukat, G.; Puli, N.; Goli, M.; Arnold, C; Konkel, A.; Rothe, M.; Fischer, R.;  , D.N.; Schunck, W.H. 17(R),18(S)-epoxyeicosatetraenoic acid, a potent eicosapentaenoic acid (EPA) derived regulator of cardiomyocyte contraction: structure-activity relationships and stable analogues. J. Med. Chem. 2011, 54, 4109-4118.
, D.N.; Schunck, W.H. 17(R),18(S)-epoxyeicosatetraenoic acid, a potent eicosapentaenoic acid (EPA) derived regulator of cardiomyocyte contraction: structure-activity relationships and stable analogues. J. Med. Chem. 2011, 54, 4109-4118.
6. Y. Hamada et al. / Bioorg. Med. Chem. Lett. 18:1649-1653, 2008.
Пример 10
Определение биологических активностей отдельных приведенных в качестве примеров соединений согласно настоящему изобретению
Материалы и методы:
Структуры всех тестируемых соединений приведены на фиг. 1. Соединения включают аналоги, синтезированные, как описано в Примерах 2-9. ЕРА и 17,18-EEQ (приобретенные в компании Cayman Chemical) использовали в качестве контролей. Перед применением соединений, подлежащих тестированию, готовили их исходные растворы в этаноле со 1000-кратным разведением.
Для определения биологических активностей указанных новых соединений использовали установленные модели на клетках (Kang, J.X., and A. Leaf, Effects of long-chain polyunsaturated fatty acids on the contraction of neonatal rat cardiac myocytes. Proc Natl Acad Sci USA, 1994. 91(21): p. 9886-90.). Спонтанно сокращающиеся кардиомиоциты новорожденных крыс (NRCMs, англ.: neonatal rat cardiomyocytes) представляют собой модельную систему для исследования антиаритмических эффектов тестируемых соединений. Нерегулярные и асинхронные сокращения клеток в ответ на антиаритмические соединения in vitro служит эквивалентом фибрилляции сердца in vivo, обратное развитие которой может быть обеспечено посредством синтетических аналогов 17,18-ЕЕО/тестируемых соединений.
Выделение и культивирование NRCMs осуществляли, как описано ранее (Wallukat, G; Wollenberger, A. Biomed Biochim Acta. 1987; 78:634-639; Wallukat G, Homuth V, Fischer T, Lindschau C, Horstkamp B, Jupner A, Baur E, Nissen E, Vetter K, Neichel D, Dudenhausen JW, Haller H, Luft FC. J Clin Invest. 1999; 103: 945-952). Вкратце, новорожденных крыс линии Вистар (в возрасте 1-2 дня) умерщвляли в соответствии с рекомендациями Общества здравоохранения города Берлина (the Community of Health Service of the City of Berlin), и отделяли кардиомиоциты из измельченных желудочков 0,2% раствором неочищенного трипсина. Далее выделенные клетки культивировали в виде монослоев на дне (12,5 см2) колб фирмы Falcon в 2,5 мл среды Halle SM 20-I, уравновешенной увлажненным воздухом. Указанная среда содержала 10% инактивированной тепловым воздействием фетальной телячьей сыворотки (FCS) и 2 мкмоль/л фтордезоксиуридина (Serva, Heidelberg, Германия), используемого для предотвращения пролиферации немышечных клеток. NRCMs (2,4×106 клеток/колбу) культивировали при 37°С в инкубаторе. Через 5-7 дней NRCMs образовывали кластеры спонтанно сокращающихся клеток. Клетки в каждом кластере демонстрировали синхронное сокращение с частотой 120-140 ударов в минуту. В день эксперимента культуральную среду заменяли 2,0 мл свежей среды, содержащей сыворотку. Через два часа частоту сокращений контролировали при 37°С с использованием инвертированного микроскопа, снабженного нагревательной платформой. Для определения исходной частоты скорости выбирали 6-8 отдельных кластеров и подсчитывали число сокращений в течение 15 сек. После этого к культуре добавляли тестируемое соединение, и через 5 минут контролировали частоту сокращений тех же кластеров. На основании различий между исходной частоты сокращений и частоты сокращений, вызванной соединением, для отдельных кластеров рассчитывали хронотропные эффекты (Δ ударов/мин), и представляли их в виде значений среднего ± стандартная ошибка (СО). N представляет собой число кластеров, появившихся, в целом, из по меньшей мере трех независимых культур NRCM.
Результаты:
Результаты данных экспериментов представлены на фиг. 1. Все тестируемые соединения добавляли к NRCMs в конечной концентрации 30 нМ, и проводили измерения после 5 мин инкубирования; за исключением ЕРА, которую использовали в конечной концентрации 3,3 мкМ, и эффект определяли по истечении 30 мин инкубирования. В тех же условиях контроль, представляющий собой носитель (0,1% этанол), не проявил действия на частоту спонтанных сокращений.
Как показано на фиг. 1, протестированные синтетические аналоги демонстрировали отрицательный хронотропный эффект, аналогичный эффекту ЕРА и 17,18-EEQ. Таким образом, карбоксигруппа может быть заменена различными биоизостерами карбоновых кислот (С38, С41, С42, С43, С44, С49, С50, С52) без изменения отрицательного хронотропного эффекта этих синтетических аналогов. Поскольку соединение С44 продемонстрировало наименьшую активность (-7,5±4,5; n=12), складывается впечатление, что оно является наименее эффективным биоизостером карбоновой кислоты.
С38, С41, С42, С43, С44, С50 и С52 представляют собой примеры соединений согласно общей формуле (IV), заявленные в п. 1 формулы изобретения. Расположение двойной связи в этих соединениях согласуется с данными предыдущих исследований взаимосвязи структура-активность, которые показали, что двойная связь 11,12 является существенной для биологической активности 17,18-EEQ и ее агонистов (Falck JR, Wallukat G, Puli N, Goli M, Arnold C, Konkel A, Rothe M, Fischer R, Muller DN, Schunck WH. 17(R),18(S)-epoxyeicosatetraenoic acid, a potent eicosapentaenoic acid (EPA) derived regulator of cardiomyocyte contraction: structure-activity relationships and stable analogues. J Med Chem. 2011 Jun 23; 54(12):4109-18). C48 и C49 содержат ароматическую кольцевую структуру в той части молекулы, которая в другом случае содержит двойную связь 11,12. Отрицательные хронотропные эффекты соединений С48 и С49 демонстрируют, что соединения согласно общей формуле (III) из п. 1 формулы изобретения также являются биологически активными.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕТАБОЛИЧЕСКИ УСТОЙЧИВЫЕ АНАЛОГИ CYP-ЭЙКОЗАНОИДОВ ДЛЯ ЛЕЧЕНИЯ КАРДИОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2761438C2 |
| СОЕДИНЕНИЯ СУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ STAT5 | 2015 |
|
RU2707094C2 |
| СУЛЬФОНИЛМОЧЕВИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2739356C2 |
| СУЛЬФОНИЛМОЧЕВИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2795512C2 |
| ЛЕЧЕНИЕ ИЛИ ПРОФИЛАКТИКА ПРОЛИФЕРАТИВНЫХ СОСТОЯНИЙ | 2010 |
|
RU2705548C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРАЗИНА В КАЧЕСТВЕ ИНГИБИТОРОВ CSF-1R КИНАЗЫ | 2013 |
|
RU2642777C2 |
| ИНГИБИТОРЫ АРОМАТАЗЫ | 2010 |
|
RU2572244C2 |
| ПИРРОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2012 |
|
RU2631655C2 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2001 |
|
RU2265011C2 |
| НОВЫЕ СОЕДИНЕНИЯ КОНДЕНСИРОВАННОГО ИМИДАЗОЛА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ АГОНИСТОВ РЕЦЕПТОРА СВ2 | 2002 |
|
RU2312864C2 |
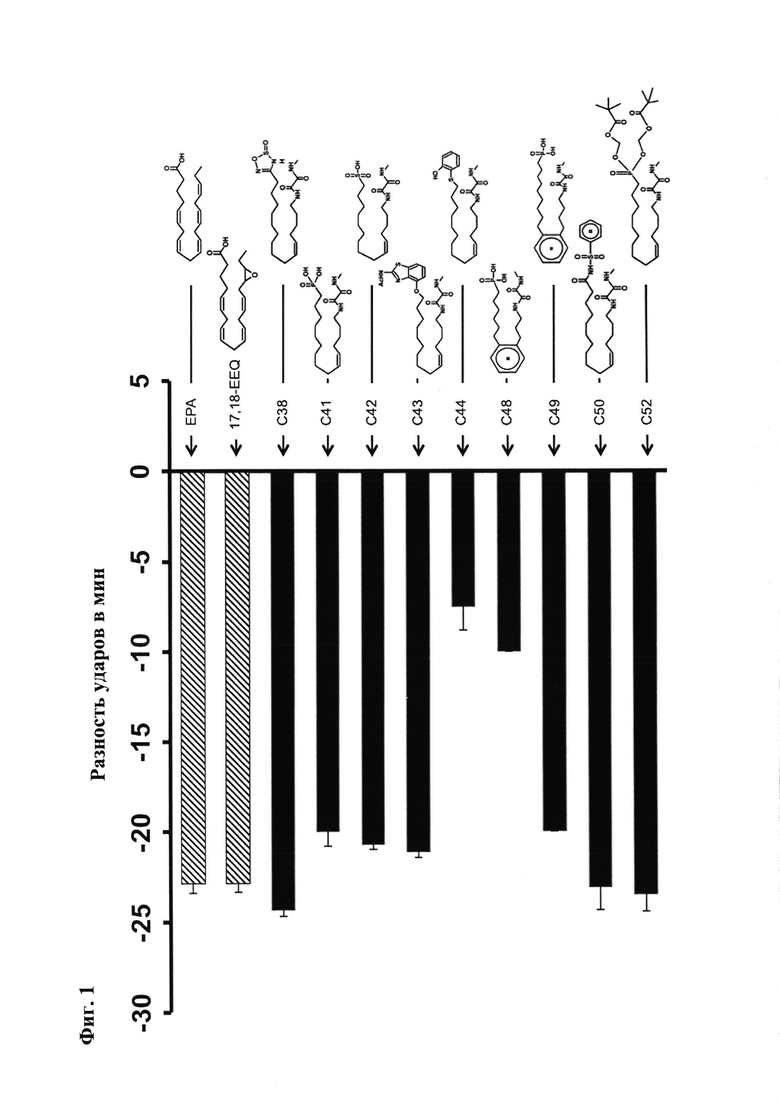
Изобретение относится к соединению общей формулы P-E-I (I) или его фармацевтически приемлемой соли, где P представляет собой группу, представленную общей формулой –(CH2)n-B-(CH2)k-X (II), где B представляет собой связь углерод-углерод; n равен 0 или представляет собой целое число от 3 до 8; и k равен 0 или 1; при условии, что, если n равен 0, k равен 1; X представляет собой группу, структура которой приведена в формуле изобретения, где R1 представляет собой гидроксильную группу; R2 представляет собой -NHR3; где R3 представляет собой (SO2R30); R30 представляет собой C6 арильную группу; R4 представляет собой фенил, замещенный –ОН; h равен 0; каждый из R6 и R7 независимо представляет собой гидроксильную группу; -O(C1-C6)алкильную группу или -O(C1-C6)алкилдиил-O(C=O)(C1-C6)алкильную группу; каждый из R8 и R8' независимо представляет собой атом водорода; –C(=O)C1-C6алкил; R9 представляет собой C1-C6алкил или С6арил; g равен 2; X1 представляет собой NH; E представляет собой группу, представленную общей формулой (III) или (IV), где каждый из R12 и R13 независимо представляет собой атом водорода; I представляет собой –(CH2)m-Y, где Y представляет собой группу (а), где каждый из R40 и R41 представляет собой атом водорода; R42 представляет собой метильную группу; m равен 3 или 4, при условии, что когда E представляет собой группу согласно общей формуле (IV), m равен 3; и где L и T оба представляют собой атом углерода. Соединения формулы (I) предназначены для лечения или предотвращения желудочковой аритмии или фибрилляции предсердий. Также соединения предназначены для лечения состояния или заболевания, на которые оказывает положительное действие введение производных полиненасыщенных жирных кислот (ПНЖК) омега-3 (n-3), при этом вводят нуждающемуся в этом пациенту по меньшей мере одно соединение формулы (I) в количестве, эффективном для лечения состояния или заболевания, при которых введение производных ПНЖК n-3 оказывает положительное действие. 7 н. и 6 з.п. ф-лы, 1 ил., 10 пр.
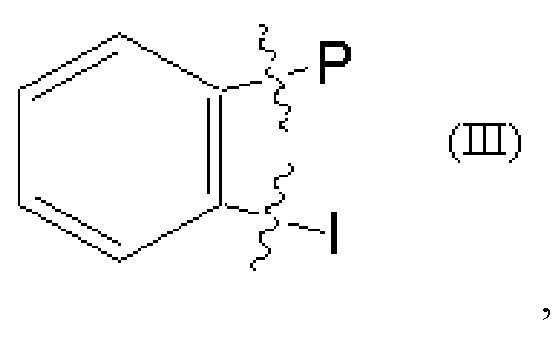
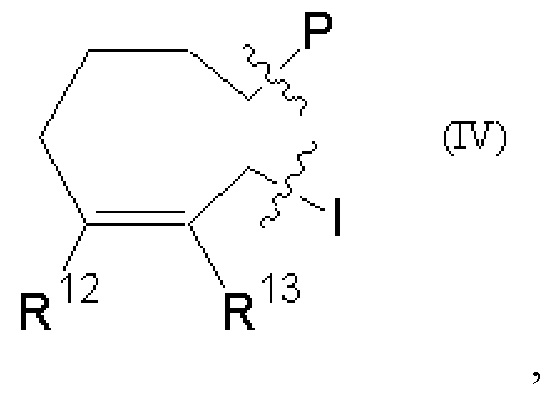
1. Соединение общей формулы (I):
P-E-I (I)
или его фармацевтически приемлемая соль,
где
P представляет собой группу, представленную общей формулой (II):
–(CH2)n-B-(CH2)k-X (II),
где
B представляет собой связь углерод-углерод;
n равен 0 или представляет собой целое число от 3 до 8; и
k равен 0 или 1; при условии, что, если n равен 0, k равен 1;
X представляет собой группу:
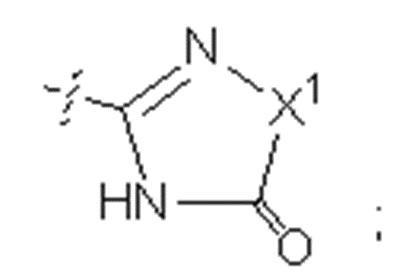
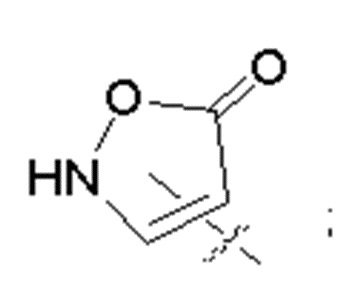

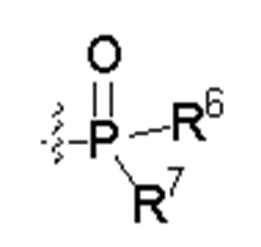 ;
; 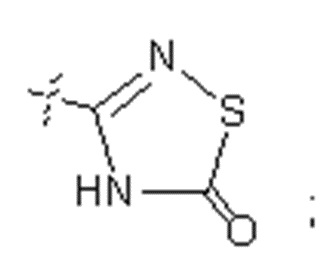
 ,
,
где
R1 представляет собой гидроксильную группу;
R2 представляет собой -NHR3;
где
R3 представляет собой (SO2R30);
R30 представляет собой C6 арильную группу;
R4 представляет собой
 ;
;
h равен 0;
каждый из R6 и R7 независимо представляет собой гидроксильную группу; -O(C1-C6)алкильную группу или -O(C1-C6)алкилдиил-O(C=O)(C1-C6)алкильную группу;
каждый из R8 и R8' независимо представляет собой атом водорода; –C(=O)C1-C6алкил;
R9 представляет собой C1-C6алкил или С6арил;
g равен 2;
X1 представляет собой NH;
E представляет собой группу, представленную общей формулой (III) или (IV):
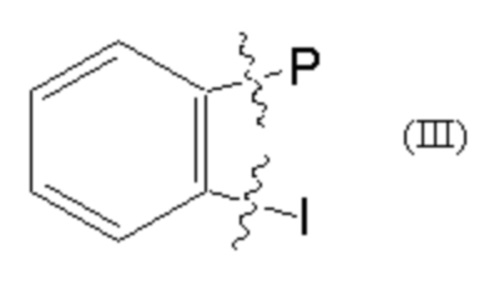
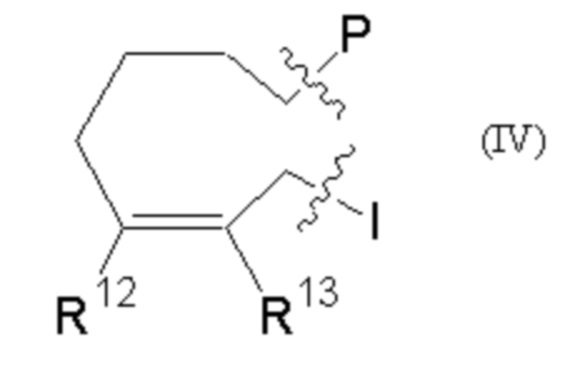 ,
,
где
каждый из R12 и R13 независимо представляет собой атом водорода;
I представляет собой –(CH2)m-Y,
где
Y представляет собой группу:
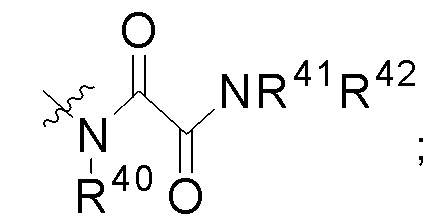
где
каждый из R40 и R41 представляет собой атом водорода; R42 представляет собой метильную группу;
m равен 3 или 4, при условии, что когда E представляет собой группу согласно общей формуле (IV), m равен 3;
и где
L и T оба представляют собой атом углерода.
2. Соединение по п. 1, отличающееся тем, что E представляет собой группу, представленную общей формулой (III); и P и I такие, как определено в п. 1.
3. Соединение по п. 2, отличающееся тем, что X представляет собой
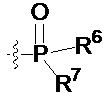 ; и R6 и R7 такие, как определено в п. 1.
; и R6 и R7 такие, как определено в п. 1.
4. Соединение по любому из пп. 1-3, где указанное соединение выбрано из группы, состоящей из:



5. Фармацевтическая композиция для лечения или предотвращения желудочковой аритмии или фибрилляции предсердий, содержащая терапевтически эффективное количество по меньшей мере одного соединения по любому из пп. 1-4 и, необязательно, вещество-носитель и/или адъювант.
6. Применение соединения по любому из пп. 1-4 для получения лекарственного средства для лечения или предотвращения желудочковой аритмии или фибрилляции предсердий.
7. Применение фармацевтической композиции по п. 5 для получения лекарственного средства для лечения или предотвращения желудочковой аритмии или фибрилляции предсердий.
8. Применение соединения по любому из пп. 1-4 для лечения или предотвращения желудочковой аритмии или фибрилляции предсердий.
9. Применение фармацевтической композиции по п. 5 для лечения или предотвращения желудочковой аритмии или фибрилляции предсердий.
10. Способ лечения состояния или заболевания, на которые оказывает положительное действие введение производных полиненасыщенных жирных кислот (ПНЖК) омега-3 (n-3), включающий:
введение нуждающемуся в этом пациенту по меньшей мере одного соединения по любому из пп. 1-4 в количестве, эффективном для лечения состояния или заболевания, при которых введение производных ПНЖК n-3 оказывает положительное действие.
11. Способ по п. 10, отличающийся тем, что указанный пациент страдает или страдал ранее сердечно-сосудистым заболеванием.
12. Способ по п. 11, отличающийся тем, что указанное сердечно-сосудистое заболевание представляет собой желудочковую аритмию или фибрилляцию предсердий.
13. Способ по п. 12, отличающийся тем, что пациенту вводят по меньшей мере 0,5 мг по меньшей мере одного соединения в сутки.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| JOHN R.FALCK et al | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| JOHN R.FALCK et al | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
Авторы
Даты
2020-08-24—Публикация
2015-01-21—Подача