Изобретение относится к области медицины и фармацевтики, а именно к гуминовым препаратам, и предназначено для повышения устойчивости печени к патологическим воздействиям и различным повреждениям, а также для усиления ее обезвреживающей функции.
Печень - это орган, в котором обмен веществ происходит наиболее активно среди других органов человека. Печень расположена между пищеварительной системой и системой кровообращения и защищает все тело от внешних воздействий. Кроме того, печень - очень важный орган, отвечающий за обмен веществ, детоксикацию, разложение, синтез и секрецию.
В частности, печень выполняет функцию управления энергетическим обменом, поэтому все питательные вещества, абсорбируемые из пищи, метаболизируются в вещества, которые могут производить энергию в печени и поставляться или накапливаться по всему телу, а также около 2000 видов ферментов, альбумина и жиров для свертывания крови, таких как сывороточные белки, желчные кислоты, фосфолипиды и факторы холестерина синтезируются, хранятся и распределяются в печени.
Кроме того, печень выполняет функцию выведения различных метаболитов в двенадцатиперстную кишку через желчный проток и иммунную функцию, которая играет важную роль в поддержании нашей жизни. Также, поскольку вещество ex vivo, попавшее в живой организм, однажды проходит через печень, печень имеет более высокий риск воздействия многих токсичных веществ в дополнение к питательным веществам, чем другие органы, поэтому вероятность повреждения очень высока.
Печень является органом с отличной регенеративной способностью, и если есть какое-то повреждение, она восстанавливается до нормального состояния в достаточной степени, но если повреждение сохраняется, часть ткани печени полностью разрушается, и функция печени также ухудшается, что затрудняет восстановление.
Когда такое повреждение печени становится хроническим, оно прогрессирует до фиброза, цирроза и рака печени независимо от причины. Фиброз, цирроз и рак печени - это заболевания, которые в настоящее время не имеют четкого лечения и смертность от таких заболеваний также высока. Следовательно, очень важно предотвращать и лечить повреждение печени до того, как повреждение печени станет хроническим, чтобы подавить прогрессирование до фиброза, цирроза или рака печени.
Заболевание печени не имеет субъективных симптомов на ранней стадии, при этом такие симптомы появляются только при тяжелой степени поражения печени, поэтому заболевание печени трудно обнаружить на ранней стадии. По этой причине заболевание печени занимает ведущее место среди причин смерти не только в России, но и в мире, а эффективных методов лечения и диагностики не существует.
Заболевание печени - одно из основных заболеваний в современной жизни, которое представляет собой проблему для современных людей, которые подвержены чрезмерному стрессу, курению, употреблению алкоголя и наркотиков. Следовательно, существует необходимость в разработке способа защиты печени, в частности, способа защиты печени с использованием натуральных продуктов с меньшими побочными эффектами или проблемами резистентности.
Известна многочисленная группа веществ, обладающих гепатопротекторным действием. К их числу, в частности, относятся различные вещества, улучшающие метаболические процессы в организме, например, витамины, ингибиторы перекисного окисления липидов, а также антигипоксанты (препараты эссенциале и др.). В качестве селективных гепатопротекторов в медицинской практике применяют некоторые препараты флавоноидной структуры (силибинин и др.), близкие по структуре к витаминам группы Р и растительные средства (Лив-52 и др.).
Недостатками большинства указанных веществ является узкий спектр действия, обусловленный значительным числом противопоказаний, недостаточная эффективность, сложная технология получения.
Одной из важнейших задач современной экспериментальной и клинической фармакологии является разработка и поиск новых средств для защиты печени, не имеющих таких проблем, как побочные эффекты или переносимость, или терапевтического агента или сухого функционального пищевого продукта для профилактики, улучшения или лечения заболеваний печени.
Известно, что гуминовые кислоты, фульвокислоты оказывают на любой живой организм мощное воздействие благодаря богатому составу. В них содержится полный набор аминокислот, макро- и микроэлементов, минералов, а также полисахариды природного происхождения, витамины, пептиды, жирные кислоты, полифенолы, кетоны, катехины и т.д. Всего более 70 полезных компонентов. Такой насыщенный состав объясняет положительные биологические эффекты гуминовой кислоты (см.https://fb.ru/article/288472/guminovyie-kislotvi-chto-eto-takoe-i-kak-oni-vliyavut-na-organizm).
Гуминовые кислоты способны стимулировать некоторые функции нейтрофилов человека. Для препаратов на основе гуминовых и гуминовоподобных веществ выявлена антивирусная активность, например, для симплексного вируса герпеса - HSV. Гуминовые соединения могут быть использованы в качестве микробиоцидов, профилактических средств против распространения ВИЧ/СПИД. Были исследованы цитотоксические и антивирусные свойства гуминовых кислот и фульвокислот, выделенных из угля и торфа. Исследования показали, что все изученные соединения были малотоксичными и обладали достаточно высоким ингибирующим эффектом в отношении ВИЧ-инфекции (А.И. ПОПОВ и др. Биологическая активность и биохимия гуминовых веществ. Часть 2. Медико-биологический аспект (обзор литературы). Вестник Российской Академии Наук, 2016/5, с. 9-15). Было показано, что Оксигумат повышает активность Th-1 клеток и уменьшает продукцию цитокинов Th-2 клетками [Mariette et al., 2002]. Наблюдаемая стимуляция пролиферации лимфоцитов человека была связана с повышением продукции ИЛ-2 и экспрессией ИЛ-2 рецепторов вместе с уменьшением количества ИЛ-10 под действием Оксигумата [Joone et al., 2003]. In vivo показано, что пероральный прием гуминовых веществ улучшает параметры врожденного иммунитета у экспериментальных животных: происходит усиление антибактериальной активности сыворотки крови, фагоцитарной активности, активности лизозима и бактериальной агглютинации [Sanmiguel et al., 2016]. Это делает гуминовые вещества потенциальными продуктами для разработки многомишеневых иммуноактивных микробицидов.
Исследования в области разработок новых биологически активных соединений показали, что гуминовые вещества различного генеза обладают иммуномодулирующим и противовоспалительным действиями, что позволяет использовать их для профилактики и лечения хронических дерматозов, атопических дерматитов, аллергических ринитов и других заболеваний, сопровождающихся воспалительными и аллергическими реакциями. Перспективным является применение гуминовых веществ как противогрибковых, противовирусных средств. Противовоспалительная активности гуминовых кислот изучена на моделях острого и хронического воспаления. Возможный механизм противовоспалительного действия объясняется способностью гуминовых кислот снижать генерацию кислородных радикалов и уменьшать потребление кислорода активированными фагоцитами (И.А. САВЧЕНКО и др. Биологическая активность гуминовых веществ: перспективы и проблемы их применения в медицине (обзор). Журнал Медиаль, №1 (23) апрель, 2019, с. 54-60, DOI: http://dx.doi.org/10.21145/2225-0026-2019-l-54-60).
Противовоспалительное действие гуминовых соединений связано с их способностью обратимо ингибировать избыточный синтез интерлейкина-ip гиперактивированными макрофагами, нивелировать усиленный выход нейтрофильных гранулоцитов из костномозгового депо в кровь, уменьшать потребление кислорода активированными фагоцитами с последующим снижением генерации кислородных радикалов, что в конечном счете приводит к уменьшению выраженности воспалительной реакции (Полуянова И.Е. Биологическая активность гуминовых веществ, получаемых из торфа, и возможности их использования в лечебной практике. Международные обзоры: клиническая практика и здоровье, №4, 2017, с. 114-122).
Ближайшим аналогом заявленного изобретения является патент RU 2372926 С1, из которого известно гепатопротекторное гуминовое средство, полученное путем обработки торфа 1,0%-ным раствором водного аммиака и 1,75%-ным раствором перекиси водорода в соотношении 1:5:5 при нагревании до 140°С при постоянном перемешивании с получением жидкой фазы. Жидкая фаза, являющаяся концентрированным маточным раствором, содержит не менее 45000 мг/л гуминовых кислот. Однако, указанное изобретение обеспечивает продукт, обладающий недостаточно высокой гепатозащитной активностью вследствие неполного извлечения гуминовых веществ из исходного сырья.
Задачей настоящего изобретения является получение гуминового средства, содержащего широкий спектр гуминовых веществ и обладающего гепатопротекторной активностью, без использования химических реагентов.
Техническим результатом заявленного изобретения является получение гепатопротекторного гуминового средства, содержащего широкий спектр гуминовых веществ и не имеющего химических примесей, которое может быть использовано в области медицины и фармацевтики.
Указанный технический результат достигается за счет того, что заявленное гуминовое средство, обладающее гепатопротекторной активностью, является коллоидным раствором, содержащим воду, гуминовые вещества, представляющие собой гуминовые и фульвокислоты и их соли, гидрохинон и хризин, причем размер коллоидных частиц находится в диапазоне от 30 нм до 10 мкм, масса гуминовых веществ составляет от 1 до 20 мас. %, гидрохинон содержится в количестве не превышающем 3 мас. % от массы гуминовых веществ, а хризин в количестве не превышающем 2% от массы гуминовых веществ.
Также, предлагается применение полученного гуминового средства для повышения устойчивости печени к патологическим воздействиям и различным повреждениям.
Примеры.
Пример 1. Получение заявленного гепатопротекторного гуминового средства (ГГС).
Для получения ГГС использовали предварительно измельченное сырье (леонардит, лигнин, уголь, торф, сапропель) в смеси с водой, которое помещали в ультразвуковую установку. Помещенную в ультразвуковую установку смесь гуминосодержащего сырья с водой нагревали до 30-80°С, и при достижении требуемой температуры производили обработку ультразвуком при давлении 0,05-0,8 МПа. После ультразвуковой обработки раствор охлаждали до комнатной температуры и фильтровали для отделения частиц с размером более 10 мкм. Полученное средство разбавляли водой до содержания гуминовых веществ, составляющего от 1 до 20 мас. %, при этом количество гидрохинона в составе средства не превышает 3 мас. % от массы гуминовых веществ и хризина не превышает 2 мас. % от массы гуминовых веществ. Размер коллоидных частиц находится в диапазоне от 30 нм до 10 мкм.
Исследование состава полученного средства проводили методом ГХ-МС на анализаторе «Хроматэк», состоящем из газового хроматографа «Хроматэк-Кристал 5000» и жидкостного дозатора ДАЖ-2М. Для идентификации дериватов использовали автоматическую базу поиска и идентификации данных хромато-масс-спектрометрии NIST17 MS Library.
Условия исследования:
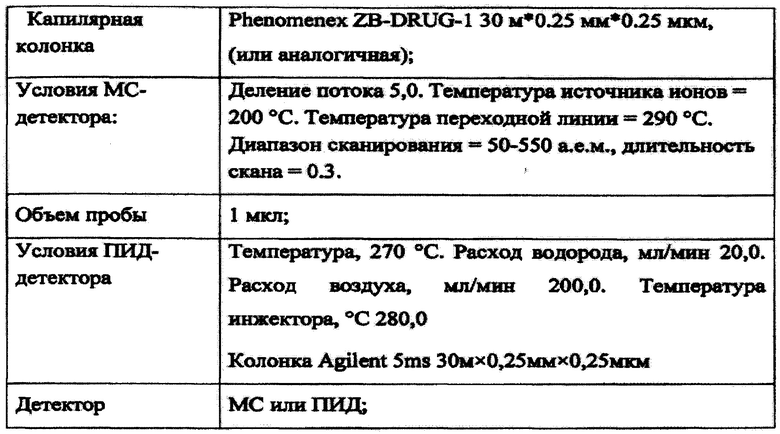
Результаты исследования приведены в табл.1
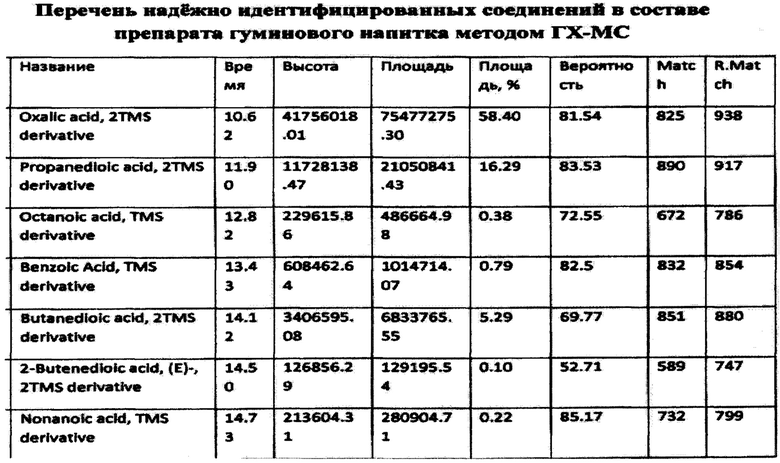
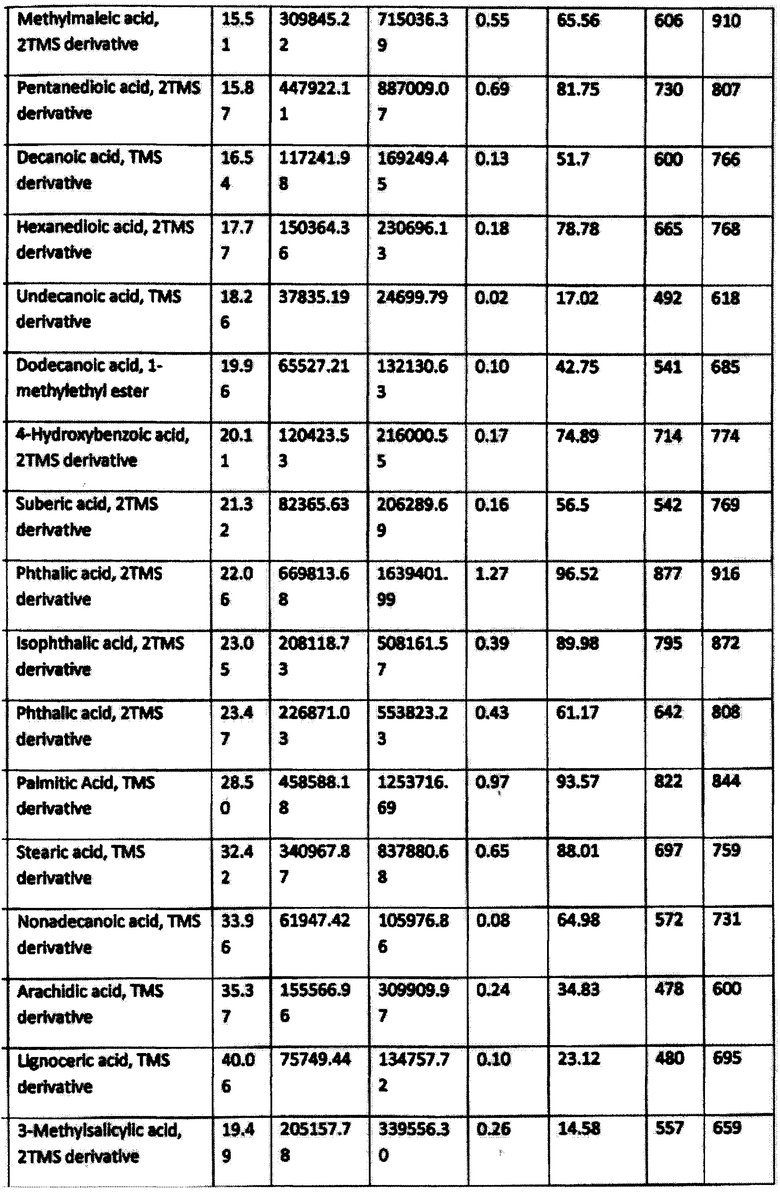
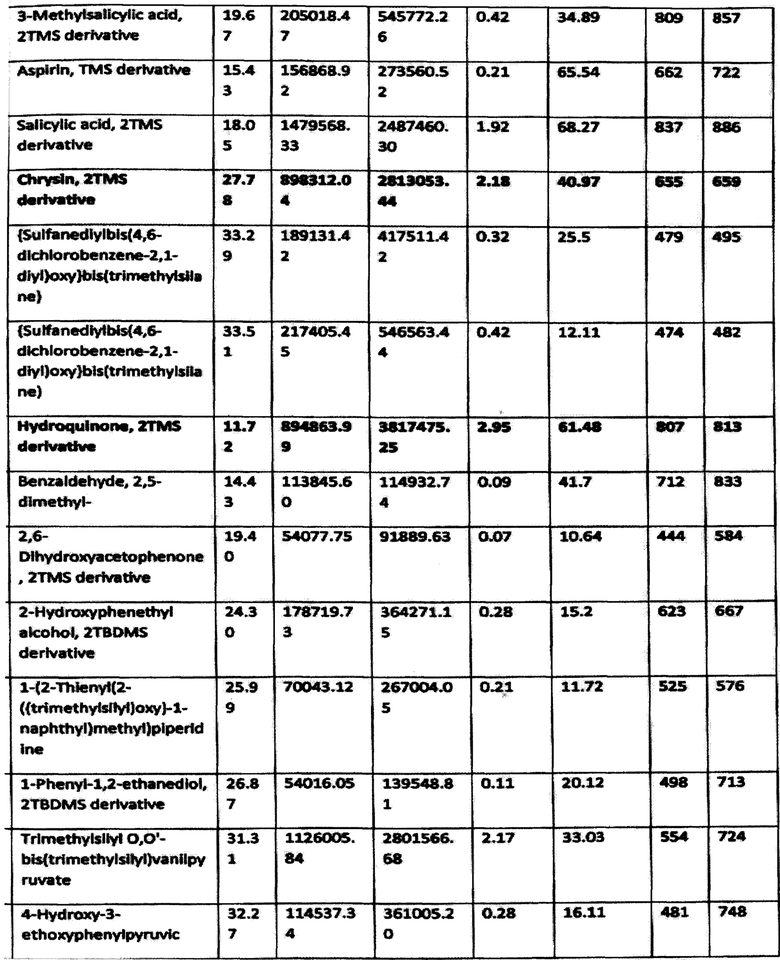

Согласно приведенным данным в состав заявленного средства, помимо гуминовых и фульвокислот, входят также фенольные производные, в частности гидрохинон, флаваноиды (хризин) и другие активные вещества. Следовательно, заявленное средство характеризуется широким спектром активных веществ.
Пример 2. Исследование на токсичность.
Определение показателей острой токсичности включало эксперименты на мышах. Животные распределялись по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по массе тела (±10%). Введение препарата осуществляли внутрижелудочно в возрастающих дозах по Литчфилду-Уилкоксону. Наивысшая доза была лимитирована максимально возможным объемом введения препарата. Для исследования каждой дозы препарата использовались группы по 10 животных разного пола. Период наблюдения составлял 14 суток. При введении препарата в дозах 4000-8000 мг/кг (по гуминовой кислоте) у животных выявлено изменение реакции на взятие в руки, изменение дыхания, двигательной активности, и тонуса мускулатуры, у некоторых животных наблюдалось изменение консистенции кала. При введении препарата в дозе до 4000 мг/кг (по гуминовой кислоте) все животные выжили, при введении препарата в концентрации 6000 мг/кг (по гуминовой кислоте) погибло 5 животных из 10, а при введении препарата в дозе 8000 мг/кг (по гуминовой кислоте) погибло 8 животных из 10. Выжившие животные удовлетворительно перенесли интоксикацию и по окончании действия препарата на протяжении 14 дней наблюдения, признаков отсроченного влияния не отмечено. Признаков пролонгированной клинической интоксикации отмечено не было. Динамика массы тела опытных животных не отличалась от контроля. По окончании периода наблюдения - на 14 день, был произведен забой выживших животных с целью определения возможных патологических изменений после однократного приема препарата. Осмотр опытной и контрольных групп показал, что все животные в них были нормально упитаны, имели правильное телосложение, гладкий и блестящий волосяной покров, блестящие, обычной окраски слизистые оболочки, чистые и опрятные естественные отверстия. При макроскопическом исследовании внутренних органов каких-либо особенностей не было выявлено. Анализ величин массовых коэффициентов не выявил каких-либо достоверных отличий между группами животных, получавшими разные дозы препарата. Таким образом, полученные результаты позволяют предположить, что полученные препарат можно отнести к V классу, т.е. практически нетоксичных лекарственных веществ.
Пример 3. Исследование гепатопротекторной активности заявленного средства (ГГС) при экспериментальном токсическом повреждении печени.
Исследования проводили на 47 белых аутбредных крысах самцах со средней массой тела 279,2±4,06 г, 5 групп - интактная (7 голов), контроль (10 голов) и 3 опытных (по 10 животных в каждой).
Четыреххлористый углерод (далее - тетрахлорметан, ТХМ) вводили животным контрольной и опытных групп в виде 50% масляного раствора после суточной пищевой депривации перорально однократно при помощи металлического желудочного зонда в дозе 320 мг/кг в объеме 0,064 мл ТХМ на 100 г массы тела. Контрольной группе животных после ТХМ никакие препараты не вводили. Животным опытных групп вводили ГГС по 1,0 мг/кг (1 группа), 5 мг/кг (2 группа) и 10 мг/кг (3 группа) внутримышечно через 24 ч после введения ТХМ с последующим ежедневным введением в тех же дозировках. Интактную группу никаким экспериментальным воздействиям не подвергали, одновременно с контрольной и опытными группами проводили забор крови и органов для исследований. На 7 сутки после введения ТХМ осуществляли эвтаназию путем передозировки хлороформного наркоза, производили забор крови и патологоанатомическую оценку состояния внутренних органов. Критериями оценки являлись показатели биохимического анализа крови: маркеры печеночного цитолиза и холестаза - аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (ACT), щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП); общие липиды, холестерин общий; креатинин, мочевина, общий белок, альбумины, фракции глобулинов (альфа, бета, гамма-глобулины).
Кроме того, на 6 сутки после введения ТХМ у животных интактной, контрольной и опытных групп проводили тест «открытое поле» для оценки общего клинического состояния и поведенческих реакций. Установлено, что у животных контрольной группы наблюдалось повышение активности щелочной фосфатазы на 7,5% при выраженном увеличении ГГТП в 3,21 раза, что является классическими признаками холестаза. Содержание липидов являлось достоверно увеличенным на 54,1%, холестерина на 79,4%, что может являться свидетельством билиарной обструкции. Содержание ACT и АЛТ достоверно увеличилось на 36,7% и 78,0%, при этом коэффициент де Ритиса составил 0,86, что в целом свидетельствует о развитии синдрома цитолиза гепатоцитов (Таблица 2). Снижение концентрации мочевины составило 38,9% и являлось достоверным по отношению к здоровым животным, что характеризует снижение способности печеночной ткани к дезаминированию. Выявлена тенденция к повышению содержания креатинина на 2,1%, что однако не может свидетельствовать о существенном нарушении функции почек. Наблюдалось незначительное снижение содержания общего белка на 4,3%, что свидетельствует о тенденции к нарушению белково-синтетической функции печени. Процентное количество альбуминов являлось сниженным на 9,4%, при этом выявлено повышение относительного содержания всех фракций глобулинов: α-глобулинов на 17,1%, β-глобулинов на 29,9%, γ-глобулинов на 12,0%, что свидетельствует о нарушении соотношения белковых фракций.
В целом, у животных контрольной группы выявлен комплекс классических маркеров острой дисфункции метаболических процессов, характерных для токсического гепатита.
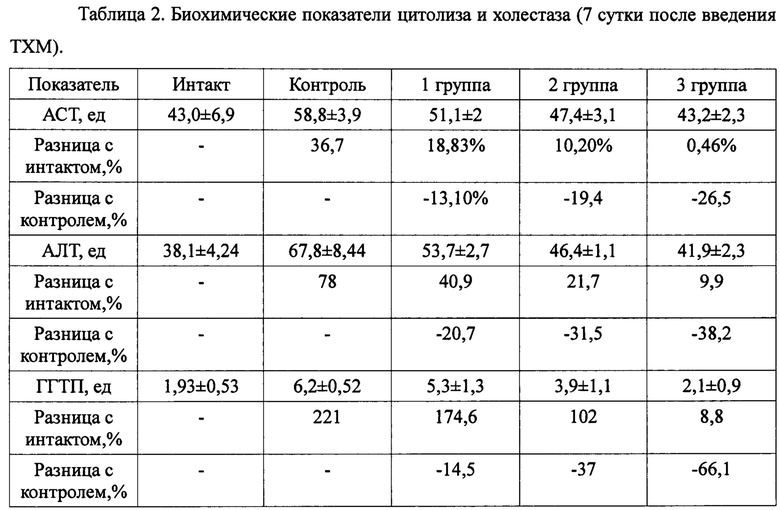
На фоне применения ГГС во всех опытных группах через 7 дней после введения ТХМ выявлено достоверное снижение ACT, АЛТ и ГГТП, что указывает о снижении выраженности холестаза и проявлений цитолиза.
Содержание общих липидов при сравнении с контролем снижалось на 33,7% (1 группа), 51,6% (2 группа), 78,9% (3 группа). Концентрация холестерина являлась более низкой по отношению к контролю, соответственно, на 21,3%, 32,4% и 46,9%. Таким образом, применение изучаемого средства способствовало значительному снижению содержания холестерина и общих липидов.
При проведении теста открытое поле на 6 сутки течения токсического гепатита выявлено наличие существенных изменений всех видов поведенческой активности в контрольной и опытных группах при сравнении со здоровыми животными интактной группы. Следует отметить, что дефекация в период проведения теста отсутствовала как у животных интактной группы, так и в контроле и всех 3-х опытных группах. В контрольной группе наблюдалось снижение горизонтальной активности (ГДА) на 23,5%, при этом повышалось количество вертикальных стоек (ВДА) в 2,9 раза, норковый рефлекс на 84,2%, груминг в 3,5 раза. Указанный комплекс изменений может свидетельствовать о снижении локомоторной активности (снижение горизонтальной активности) и повышении уровня тревожности, т.к. увеличение вертикальной активности указывает на повышение ориентировочной реакции, рост количества заглядываний в норки характеризует повышение спонтанной исследовательской деятельности.
В первой группе горизонтальная активность являлась сниженной как при сравнении с интактом (на 53,8%), так и по отношению к контрольным животным на 39,6%, вертикальная активность полностью отсутствовала. В данной опытной группе наблюдалось снижение норкового рефлекса на 42,9% при сравнении с контролем, однако показатель несколько превышал значения интактных животных на 5,3%. Количество актов груминга уменьшилось на 71,4% при сравнении с контролем. Данные изменения характеризуют снижение меры локомоции наряду со снижением уровня тревожности животных данной опытной группы.
На фоне применения заявленного ГГС во второй группе горизонтальная активность также являлась сниженной на 38,3% при сравнении с интактом и на 24,1% по отношению к контрольным животным. Наблюдалось снижение норкового рефлекса на 2,9% при сравнении с контролем, однако показатель превышал значения интактных животных в 1,5 раз. Количество актов груминга уменьшилось в 2 раза при сравнении с контролем. Данные изменения характеризуют тенденцию к предотвращению снижения локомоторной активности и снижение выраженности тревожности.
Применение заявленного ГГС в третьей группе сопровождалось незначительным уменьшением горизонтальной двигательной активности на 29,2% при сравнении с интактом и на 7,4% по отношению к контролю. Вертикальная активность являлась существенно сниженной по сравнению с контролем и интактом на 72,4% и 20,0% соответственно. При этом наблюдалось значительное повышение количества актов норкового рефлекса - в 2,51 раза по отношению к контролю и в 4,63 раза при сравнении с интактом. За период наблюдения в открытом поле груминг у животных данной опытной группы отсутствовал. Данный комплекс изменений характеризует незначительное угнетение локомоции при снижении уровня тревожности и повышении исследовательской активности животных.
При проведении патологоанатомических исследований установлено, что токсическое воздействие ТХМ на 7 сутки у животных контрольной группы проявлялось рядом специфических изменений. Печень рыхлой консистенции, желтовато-красного цвета, масса печени достоверно снижена на 11,3% по отношению к здоровым животным интактной группы, что подтверждает наличие деструктивных процессов в паренхиме печени и согласуется с данными биохимических исследований. У 50,0% животных в слизистой оболочке и подслизистой основе желудка в области малой кривизны выявлены массивные кровоизлияния площадью от 25 до 160 мм2, у 50% животных в слизистой оболочке желудка точечные язвы в количестве 3-9 шт. суммарной площадью не более 14,5 мм2. В брыжейке тонкого кишечника точечные кровоизлияния. Селезенка темно-бордового цвета, тимус с точечными кровоизлияниями. Сердце без визуально определяемой патологии, масса увеличена на 10,9%. Легкие алые, воздушность легочной ткани снижена, масса увеличена на 31,4% по отношению к интакту. Почки серовато-красные, масса увеличена на 8,3%, у 50% животных в мочевом пузыре содержалась моча желто-красноватого цвета, мутная, с хлопьями белка. В опытных группах выявлена тенденция к предотвращению снижения массы печени (в пределах 1,0-2,8%). Наблюдалась общая тенденция предотвращению увеличения массы почек, легких и сердца, других специфичных изменений по сравнению с интактными животными выявлено не было.
Указанные данные свидетельствуют о том, что при токсическом гепатите, вызываемом четыреххлористым углеродом, по большинству критериев заявленное ГГС является эффективным гепатопротекторным средством, одновременно обеспечивающим снижение выраженности маркеров цитолиза и холестаза, нормализацию липидного и белкового обмена и повышение синтетической функции печени. Следовательно, заявленное средство может использоваться в качестве гепатопротекторного средства, что подтверждает достижение заявленного технического результата.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДЕЗИНТОКСИКАЦИОННОЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2756354C1 |
| АДАПТОГЕННОЕ ГУМИНОВОЕ СРЕДСТВО | 2021 |
|
RU2775079C1 |
| АНТИКОАГУЛЯЦИОННОЕ ГУМИНОВОЕ СРЕДСТВО ДЛЯ УЛУЧШЕНИЯ РЕОЛОГИЧЕСКИХ СВОЙСТВ КРОВИ | 2020 |
|
RU2756364C1 |
| ПРОТИВОВИРУСНОЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2753609C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2756363C1 |
| ИММУНОМОДУЛИРУЮЩЕЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2756353C1 |
| АНТИБАКТЕРИАЛЬНОЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2753606C1 |
| Способ получения экстракта гуминовых веществ | 2019 |
|
RU2720308C1 |
| СПОСОБ ПРОФИЛАКТИКИ ЯЗВООБРАЗОВАНИЯ НА СЛИЗИСТОЙ ОБОЛОЧКЕ ЖЕЛУДКА | 2011 |
|
RU2481111C1 |
| Средство для нормализации обменных процессов при метаболических нарушениях у крупного рогатого скота | 2019 |
|
RU2731404C1 |
Изобретение относится к фармацевтической промышленности, а именно к средству, обладающему гепатопротекторной активностью. Средство, обладающее гепатопротекторной активностью, представляет собой коллоидный раствор, содержащий воду, гуминовые вещества, представляющие собой гуминовые и фульвокислоты и их соли, гидрохинон и хризин, причем размер коллоидных частиц находится в диапазоне от 30 нм до 10 мкм, масса гуминовых веществ составляет от 1 до 20 мас.%, гидрохинон содержится в количестве, не превышающем 3 мас.% от массы гуминовых веществ, а хризин в количестве, не превышающем 2% от массы гуминовых веществ. Вышеописанное гуминовое средство содержит широкий спектр гуминовых веществ и не имеет химических примесей, эффективно в качестве гепатопротекторного средства. 2 табл., 3 пр.
Средство, обладающее гепатопротекторной активностью, представляющее собой коллоидный раствор, содержащий воду, гуминовые вещества, представляющие собой гуминовые и фульвокислоты и их соли, гидрохинон и хризин, причем размер коллоидных частиц находится в диапазоне от 30 нм до 10 мкм, масса гуминовых веществ составляет от 1 до 20 мас.%, гидрохинон содержится в количестве, не превышающем 3 мас.% от массы гуминовых веществ, а хризин в количестве, не превышающем 2% от массы гуминовых веществ.
| СПОСОБ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ У КОРОВ | 2008 |
|
RU2372926C1 |
| Способ получения экстракта гуминовых веществ | 2019 |
|
RU2720308C1 |
| US 2019183760 A1, 20.06.2019 | |||
| ANCA HERMENEAN et all | |||
| Насос | 1917 |
|
SU13A1 |
| САВЧЕНКО И | |||
| А | |||
| и др | |||
| Биологическая | |||
Авторы
Даты
2022-01-10—Публикация
2021-04-13—Подача