Изобретение относится к области медицины, в частности к прогнозированию риска развития хронического пылевого бронхита у работников угледобывающей промышленности.
Хронический пылевой бронхит (ХПБ) - это особая форма воспаления бронхов в ответ на воздействие высоких концентраций угольно-породной пыли (УПП) с развитием диффузных атрофических и склеротических изменений, сопровождающихся нарушением моторики бронхов и формированием дыхательной недостаточности (Михайлова Н.Н., Захаренков В.В., Бугаева М.С. и др. Специфичность морфологических изменений в органах-мишенях, ассоциированных с воздействием на организм угольно-породной пыли и соединений фтора. В ж-ле: Медицина труда и пром. экология. - 2016. - №5. - С. 11-15; Казицкая А.С., Панев Н.И., Ядыкина Т.К. и др. Генетические и биохимические аспекты формирования профессионального хронического пылевого бронхита. В ж-ле: Медицина труда и пром. экология. - 2019. - Т. 59, №6. - С. 342-347). На эффективность очищения бронхов существенное влияние оказывают концентрация пыли в воздухе рабочей зоны, ее состав, дисперсность и плотность, а также растворимость в биологических субстратах (Бухтияров И.В., Головкова Н.П., Хелковский-Сергеев Н.А. Проблемы сохранения здоровья работников угольной промышленности: новые вызовы и новые решения. В ж-ле: Медицина труда и пром. экология. - 2017. - №12. - С. 1-6; Шпагина Л.А. Актуальные проблемы профессиональных заболеваний легких. В ж-ле: Сибирский научный мед. журнал. - 2017. - Т. 37, №1. - С. 55-60).
Ключевым механизмом патологической реакции на длительное угольно-пылевое воздействие является чрезмерная активация свободнорадикальных процессов (Шпагина Л.А., Котова О.С, Сараскина Л.Е., Ермакова М.А. Особенности клеточно-молекулярных механизмов профессиональной хронической обструктивной болезни легких. В ж-ле: Сибирское медицинское обозрение. - 2018. - №2. - С. 37-45; Жукова А.Г., Михайлова Н.Н., Сазонтова Т.Г. и др. Участие свободнорадикальных процессов в структурно-метаболических нарушениях ткани легких в динамике воздействия угольно-породной пыли и их адаптогенная коррекция. В ж-ле: Бюллетень экспериментальной биологии и медицины. - 2019. - Т. 168, №10. - С. 420-424). Показано, что длительное воздействие высоких концентраций угольно-породной пыли (УПП) на организм приводит к нарушению окислительно-восстановительного баланса в клетках за счет снижения активности ферментов антиоксидантной защиты (СОД, каталазы и глутатионпероксидазы) и повышения интенсивности окислительного стресса.
Работ, в которых описана генетическая изменчивость ферментов антиоксидантной защиты при ХПБ, пока немного. Среди ферментов антиоксидантной системы при ХПБ наиболее изучен полиморфизм генов семейства глутатион-8-трансфераз, обеспечивающих резистентность клеток и тканей к токсическим веществам и продуктам перекисного окисления липидов (Reszka Е., Wasowicz W., Gromadzinska J. Genetic polymorphism of xenobiotic metabolising enzymes, diet and cancer susceptibility. В ж-ле: British Journal of Nutrition. - 2006. - Vol.96, №4. - P. 609-19). Так, изучение делеционного полиморфизма GSTT1 показало, что обладатели GSTT1 «+», ответственного за нормальную выработку фермента, наиболее подвержены развитию ХПБ, а обладатели нулевого аллеля GSTTJ «-» резистентны к его формированию (Захаренков В.В., Гафаров Н.И., Панев Н.И и др. Распределение биохимических и молекулярно-генетических маркеров генов у работников угледобывающих предприятий Кузбасса, больных хроническим пылевым бронхитом. В ж-ле: Бюллетень ВСНЦ СО РАМН. - 2012. - №1 (83). - С. 93-97;
Казицкая А.С., Панев Н.И., Ядыкина Т.К. и др. Генетические и биохимические аспекты формирования профессионального хронического пылевого бронхита. В ж-ле: Медицина труда и пром. экология. - 2019. - Т. 59, №6. - С. 342-347).
Известен способ обнаружения индивидуальной предрасположенности к развитию пылевой патологии на основе анализа полиморфного локуса A313G гена GSTP1 (Ахмадишина Л.З., Корытина Г.Ф., Мингазова СР. и др. Роль полиморфизмов генов CYP1A1, ЕРНХ1, GSTM1, GSTT1 и GSTP1 в развитии хронических бронхитов профессионального генеза. В ж-ле: Экологическая генетика человека. - 2005. - Т.Ш, №1. - С. 11-17). Анализ полиморфного локуса A313G GSTP1 показал отклонение распределения частот генотипов от равновесия Харди-Вайнберга в группе больных профессиональным бронхитом (χ2=7,85; р=0,022), что было обусловлено увеличением встречаемости редких гомозигот GG и одновременным уменьшением доли гетерозигот AG (12,63% против ожидаемой 23,87%). При сравнении группы больных с контролем было установлено достоверное увеличение частоты генотипа GG в группе больных до 8,43% против 2,0% в контроле (χ2=:5,49; р=0,02; OR=4,62 СI95% 1,22-18,78). Высокая степень ассоциации GG генотипа с хроническим бронхитом профессионального генеза указывает на роль изменения активности глутатион-8-трансферазы Р1 в формировании патологических изменений в органах респираторной системы. Показано, что из всех типов глутатион-Б-трансфераз именно GSTP1 преимущественно экспрессируется в альвеолах, альвеолярных макрофагах и периферических бронхиолах легких и известен как один из легочных антиоксидантов (Autrup Н. Genetic polymorphisms in human xenobiotica metabolizing enzymes as susceptibility factors in toxic response. В ж-ле: Mutation Research. - 2000. - Vol. 464. - P. 65-76; Ishii Т., Matsuse Т., Igarashi H., Masuda M. et al. Tobacco smoke reduces viability in human lung fibroblasts: protective effect of glutathione S-transferase P1. В ж-ле: Am. J. Physiol. Lung. Cell. Mol. Physiol. - Jun. 2001. -Vol. 280. - P. 1189-1195).
Данный способ основан на исследовании молекулярно-генетических маркеров для оценки риска развития пылевой патологии у рабочих горнорудной промышленности и производства стройматериалов, но не может быть использован для прогнозирования риска развития ХПБ у работников угледобывающей промышленности.
Прототипом данного изобретения является способ прогнозирования риска развития хронического пылевого бронхита у работников угледобывающей промышленности, основанный на определении биохимических маркеров систем, участвующих в ответе на воспалительный процесс и развитие окислительного стресса. Определяют генетические маркеры систем: гаптоглобина (HP), группоспецифического компонента (GC), флуоресцентной эстеразы (EsD), кислой фосфатазы эритроцитов (АсР). Для каждого маркера определяют прогностический коэффициент (ПК) в баллах. Суммируют ПК всех маркеров с учетом знака, и при сумме ПК равной (+5) и выше баллов прогнозируют предрасположенность к развитию хронического пылевого бронхита, при сумме ПК (-5) и менее баллов прогнозируют резистентность к развитию хронического пылевого бронхита (Гафаров Н.И., Захаренков В.В., Панев Н.И., Ядыкина Т.К. и др. Способ прогнозирования хронического пылевого бронхита у работников угледобывающей промышленности. - Патент RU №2457490 С1, МПК G01N 33/48, 33/53, опубл. Бюл.№21, от 27.07.2012).
Недостатком этого способа является определение большого количества фенотипов методом электрофореза в полиакриламидном и крахмальном геле с последующим гистохимическим окрашиванием, что является трудоемким токсичным процессом и исключает возможность его широкого применения в медицинской практике, в частности при проведении предварительных и периодических медицинских осмотров работников угольной промышленности.
Назначением настоящего изобретения явилось исследование ассоциации полиморфных локусов генов антиоксидантной системы - rs4880 MnSOD и rs 1050450 GPX1 с предрасположенностью и резистентностью к развитию ХПБ у работников угольной промышленности для разработки способа прогнозирования риска развития хронического пылевого бронхита.
Назначение изобретения достигается способом молекулярно-генетического прогнозирования риска развития хронического пылевого бронхита у работников угледобывающей промышленности путем исследования крови с определением генетических маркеров. Проводят генотипирование полиморфных локусов генов ферментов антиоксидантной системы rs4880 MnSOD и rs 1050450 GPX1 путем полимеразной цепной реакции и при выявлении сочетания генотипов АА MnSOD и GG GPX1 прогнозируют генетическую предрасположенность к риску развития хронического пылевого бронхита, при выявлении одного из трех сочетаний генотипов GG/АА, АА/АА и AG/AA MnSOD/GPX1 прогнозируют резистентность к развитию хронического пылевого бронхита у работников угледобывающей промышленности.
Новизна способа.
- Проводят генотипирование полиморфных локусов генов ферментов антиоксидантной системы rs4880 MnSOD и rs 1050450 GPX1 путем полимеразной цепной реакции. Согласованное действие супероксиддисмутазы (SOD) и глутатионпероксидазы (GPX1) является важным условием эффективного защитного действия антиоксидантной системы от чрезмерной активации свободнорадикальных процессов (СРП) в организме.
- При выявлении сочетания генотипов A A MnSOD и GG GPX1 прогнозируют генетическую предрасположенность к риску развития хронического пылевого бронхита у работников угледобывающей промышленности, что связано со снижением активности ферментов антиоксидантной защиты SOD и GPX и чрезмерной активацией СРП в органах, в частности в легких.
- При выявлении одного из трех сочетаний генотипов GG/AA, AА/АА и AG/АА MnSOD/GPXI прогнозируют резистентность к развитию хронического пылевого бронхита у работников угледобывающей промышленности, что может быть связано с сохранением нормальной активности ферментов антиоксидантной защиты SOD и GPX и поддержанием окислительно-восстановительного баланса на физиологическом уровне.
Способ позволяет установить генетическую предрасположенность и резистентность к развитию ХПБ у рабочих угольной промышленности, дает возможность его широкого применения при проведении предварительных и периодических медицинских осмотров работников угольной промышленности, помогает определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий.
Согласованное действие SOD и GPX способствует детоксикации как митохондриальных, так и цитозольных активных форм кислорода, а нарушение активности этих ферментов приводит к накоплению токсичных уровней свободных радикалов в клетках. Генетические полиморфизмы генов MnSOD и GPX1 могут снижать активность антиоксидантных ферментов и, таким образом, способствовать нарушению окислительно-восстановительного баланса в клетках.
Способ осуществляется следующим образом. У всех обследуемых производят забор 3-5 мл крови из кубитальной вены в вакутейнер (К3Е) с этилендиаминуксусной кислотой (K3EDTA), которая предотвращает свертывание крови путем блокирования ионов кальция. ЭДТА не влияет на гематологические параметры. Выделение геномной ДНК из клеток периферической крови проводят способом фенол-хлороформной экстракции с последующим осаждением этанолом (Sambrook J., Fritsch E.F., Maniatis Т. Molecular cloning: a laboratory manual. - In 3 volumes. 2nd ed. NY.: Cold Spring Harbor Laboratory Press. - 1989; Sambrook J., Russell D.W. CSH Protoc. - 2006 -(1). - pdb. prot4455). Выделенную ДНК хранят при температуре -20°С. Генотипирование проводят с помощью полимеразной цепной реакции в режиме реального времени (Real-Time) с использованием конкурирующих TaqMan зондов комплементарных полиморфной последовательности ДНК на ДТпрайм-4 ООО «НПО ДНК-Технология», г. Москва. Тест-системы для молекулярно-генетического анализа были разработаны Институтом химической биологии и фундаментальной медицины СО РАН и синтезированы ООО «СибДНК» г. Новосибирск. Выявление у обследуемых генотипов - АА в локусе rs4880 MnSOD и GG в локусе rsl050450 GPXI, а также сочетание AA/GG MnSOD/GPXI позволяет прогнозировать генетическую предрасположенность к высокому риску развития ХПБ у работников угольной промышленности. Носительство одного из трех сочетаний генотипов генов MnSOD и GPX1: GG/AA, АА/АА и AG/AA свидетельствует о резистентности к формированию ХПБ.
С целью выявления ассоциации полиморфных локусов двух генов -rs4880 MnSOD и rsl050450 GPXI с риском развития ХПБ и с резистентностью к нему были обследованы рабочие основных профессий шахт юга Кузбасса (проходчики, горнорабочие очистного забоя, машинисты горных выемочных машин) в возрасте от 39 до 58 лет, средний стаж работы которых составил 24,14±4,67 лет. Обследовано 190 работников угольных шахт, среди которых 126 - с ранее установленным диагнозом ХПБ. Группу контроля (64 рабочих), обследуемую в рамках профилактического осмотра, составили лица без установленного диагноза, работающие в тех же санитарно-гигиенических условиях. Обследование пациентов проведено на базе клинического стационара Научно-исследовательского института комплексных проблем гигиены и профессиональных заболеваний.
Статистическая обработка данных проведена с использованием программного обеспечения ШМ SPSS Statistics 22 (лицензионный договор №20/604/3-1 от 22.04.2016). Для оценки различий в распределении генотипов у больных с ХПБ и у лиц контрольной группы рассчитывали значение χ2 Пирсона. Критическое значение уровня значимости различий р=0,05. Оценку значимости различий показателей проводили за счет вычисления величины относительных шансов (OR) и относительного риска (RR) с определением границ доверительного интервала (95% CI). Если OR больше 1, то это означает, что шансы обнаружить фактор риска больше в группе с наличием исхода (болезни). Если 95% CI не включает 1, то есть оба значения границ >1 или <1 делается вывод о статистической значимости выявленной связи между фактором и исходом при р<0,05.
В результате проведенного молекулярно-генетического исследования полиморфизмов генов MnSOD и GPX1 выявлены статистически значимые различия между больными с ХПБ и контрольной группой (табл. 1). Так, шанс обнаружить генотип АА гена MnSOD в группе с ХПБ в 2 раза выше, чем в контроле. Наличие мутации в гене MnSOD, связанное с заменой аминокислот: аланина на валин в позиции 16 (Ala16Val), не затрагивает активного центра фермента, но оказывает действие на фолдинг субъединиц и их контакт в димерной молекуле, что отражается на стабильности и активности фермента MnSOD. Такая мутация обусловливает понижение активности MnSOD. Изучение полиморфизма гена GPXI показало, что обладатели варианта GG, обусловливающего 10% потери ферментативной активности, наиболее подвержены развитию ХПБ. Шанс обнаружить данный генотип у лиц с пылевой патологией в 5 раз выше, чем в контроле (табл. 1).
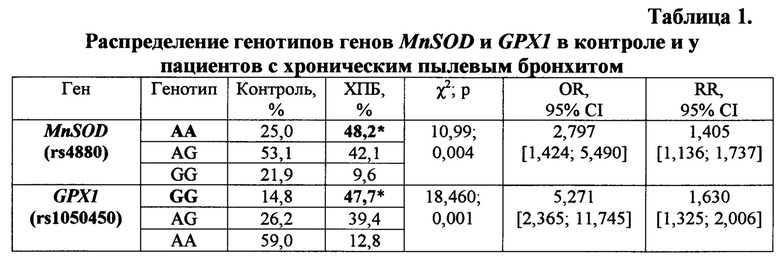
Далее определяли, есть ли достоверные различия по сочетаниям генотипов генов MnSODGPXI между больными и здоровыми лицами (табл. 2). Анализ показал, что сочетание генотипов AA/GG генов MnSODIGPXI статистически значимо связано с 15-кратным риском развития ХПБ (χ2 - 11,49; р<0,001; OR - 15,09 СГ95% 1,99-114,64; RR - 1,59 СI95% 1,362-1,849). Носителям сочетания генотипов AA/GG, имеющим высокий генетический риск развития хронического пылевого бронхита, следует рекомендовать смену места работы, назначить в динамике наблюдение за состоянием здоровья и программу профилактических мероприятий в случае наличия в анамнезе контакта с угольно-породной пылью.
Три сочетания полиморфных генотипов генов MnSODIGPXl: GG/AA (χ2 - 12,20; р<0,001; OR-0,059 СI95%0,007-0,481;RR-0,163 СГ95%0,026-1,039), АА/АА (χ2 - 8,91; р=0,003; OR - 0,209 СГ95% 0,069-0,632; RR - 0,456 СГ95% 0,219-0,950) и AG/AA (χ2 - 12,52; р<0,001; OR - 0,223 С195% 0,092-0,537; RR - 0,492 СГ95% 0,287-0,842) ассоциированы с резистентность к развитию хронического пылевого бронхита (табл. 2). Обследованные с генотипами устойчивости к развитию ХПБ могут быть допущены на профессии с высоким уровнем запыленности в угольной промышленности.
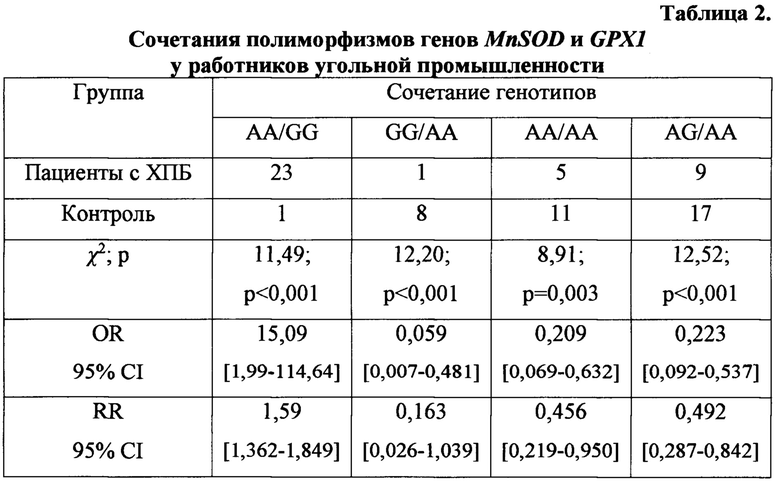
Примечание: представлены сочетания генотипов, имеющие статистически значимую связь с развитием болезни и резистентностью к ее формированию
Таким образом, на основе полученных результатов можно сделать вывод, что маркером генетической предрасположенности к развитию ХПБ является носительство генотипов АА в локусе rs4880 MnSOD и GG в локусе rsl050450 GPXI, а их сочетание - AA/GGMnSOD/GPXl свидетельствует о 15-кратном риске развития ХПБ. Носительство одного из трех сочетаний генотипов генов MnSOD и GPX1: GG/AA, АА/АА и AG/AA свидетельствует о резистентности к формированию ХПБ.
Пример 1.
Пациент Б., 48 лет, стаж работы во вредных условиях труда 15 лет, основные профессии - подземный проходчик и подземный электрослесарь. По данным санитарно-гигиенической характеристики концентрация УПП в воздухе рабочей зоны превышала ПДК в 12,5 раз. Не курит.
Жалобы: на кашель с небольшим количеством слизистой или слизисто-гнойной мокроты, на одышку смешанного характера при умеренной физической нагрузке, подъеме на 3-й этаж. Аускультативно: в легких жесткое дыхание, небольшое количество сухих свистящих хрипов, больше при форсированном выдохе. Спирография: ЖЕЛ - 80,6% (в % к допустимому), ОФВ1 - 70,8%. Рентгенография органов грудной клетки: диффузный пневмосклероз. Электрокардиография (ЭКГ) и эхокардиография (Эхо-КГ) -без существенной патологии.
Генотипирование по полиморфным локусам rs4880 MnSOD и rsl050450 GPX1 выявило:
- генотип АА MnSOD
- генотип GG GPXI
- носительство сочетания гомозиготных генотипов AA/GG генов MnSOD/GPXl, ассоциированное с высоким риском развития хронического пылевого бронхита. Для данного больного прогнозируют генетическую предрасположенность и 15-кратный риск развития хронического пылевого бронхита.
Заключительный клинический диагноз: Хронический профессиональный пылевой обструктивный бронхит. Диффузный пневмосклероз. Дыхательная недостаточность (ДН) 1 степени. Для данного шахтера высокий риск развития хронического пылевого бронхита реализовался.
Пример 2.
Пациент Н., 53 года, стаж работы во вредных условиях труда 28 лет, основная профессия - горнорабочий очистного забоя (ГРОЗ) подземный. Концентрация УПП в воздухе рабочей зоны превышала ПДК в разные годы до 5,6 раз. Курит 34 года (индекс курильщика - 22,1).
Жалобы: на кашель с небольшим количеством слизистой мокроты, на одышку смешанного характера при умеренной физической нагрузке, подъеме на 3-4-й этаж. Аускультативно: в легких жесткое дыхание, единичные сухие свистящие и жужжащие хрипы. Спирография: ЖЕЛ - 82,2%, ОФВ1 - 69,0%. Рентгенография органов грудной клетки: эмфизема легких, диффузный пневмосклероз.
Генотипирование по полиморфным локусам rs4880 MnSOD и rsl050450 GPX1 выявило:
- генотип АА MnSOD
- генотип GG GPX1
- носительство сочетания гомозиготных генотипов AA/GG генов MnSOD/GPXl, ассоциированное с высоким риском развития хронического пылевого бронхита. Для данного больного прогнозируют генетическую предрасположенность и 15-кратный риск развития хронического пылевого бронхита.
Заключительный клинический диагноз: Хронический профессиональный пылевой обструктивный бронхит. Эмфизема легких. Диффузный пневмосклероз. ДН 1 степени. Вторичная легочная гипертензия 1 степени. У данного шахтера высокий риск развития хронического пылевого бронхита реализовался.
Пример 3.
Пациент 3., 53 года, стаж работы во вредных условиях труда 10 лет, основные профессии: подземный проходчик и подземный электрослесарь. Запыленность угольно-породной пылью в концентрациях, превышающих ПДК - до 20 раз. Не курит.
Жалоб нет. Аускультативно: в легких везикулярное дыхание, хрипов нет.Спирография: ЖЕЛ - 105% (в % к допустимому), ОФВ1 - 101%. Рентгенография органов грудной клетки: умеренный (перибронхиальный) пневмосклероз.
Генотипирование по полиморфным локусам rs4880 MnSOD и rs1050450 GPX1 выявило:
- генотип АА MnSOD
- генотип GG GPX1
- носительство сочетания гомозиготных генотипов AA/GG генов MnSOD/GPXI, ассоциированное с высоким риском развития хронического пылевого бронхита. Для данного шахтера, на момент взятия образцов крови для генотипирования, риск развития хронического пылевого бронхита не реализовался.
Заключительный клинический диагноз: Сведений за профессиональное заболевание органов дыхания нет. Так как обследуемый пациент входит в группу высокого риска по формированию хронического пылевого бронхита, следует обратить особое внимание на проведение своевременных профилактических мероприятий и рекомендовать ему смену места работы или должности с исключением пылевого воздействия на организм.
Пример 4.
Пациент К., 52 года, стаж работы во вредных условиях труда 22 года, основная профессия - ГРОЗ подземный. По данным санитарно-гигиенической характеристики концентрация УПП в воздухе рабочей зоны превышала ПДК до 30 раз. Не курит.
При осмотре пульмонологом жалоб не предъявляет. Аускультативно: в легких везикулярное дыхание, хрипов нет. Спирография: ЖЕЛ - 90,7% (в % к допустимому), ОФВ1 - 107%. Рентгенография органов грудной клетки: изменений не выявлено.
Генотипирование по полиморфным локусам rs4880 MnSOD и rs 1050450 GPX1 выявило:
- генотип AG MnSOD
- генотип АА GPX1
- носительство сочетания генотипов AG/AA генов MnSOD/GPXl, ассоциированное с резистентностью к развитию хронического пылевого бронхита. Для данного пациента прогнозируют резистентность к развитию хронического пылевого бронхита.
Заключительный клинический диагноз: Данных за патологию органов дыхания (в т.ч. профессиональную) нет. Несмотря на высокий подземный стаж и значительное превышение ПДК по пыли у данного шахтера не развилась патология бронхолегочной системы.
Пример 5.
Пациент Р., 49 лет, стаж работы во вредных условиях составляет 27 лет, основная профессия - проходчик подземный. Запыленность УПП на рабочем месте в концентрациях, превышающих ПДК до 14 раз. Не курит.
Жалоб нет. Аускультативно: в легких везикулярное дыхание, хрипов нет.Спирография: ЖЕЛ - 117% (в % к допустимому), ОФВ1 - 106%. Рентгенография органов грудной клетки: умеренный (перибронхиальный) пневмосклероз.
Генотипирование по полиморфным локусам rs4880 MnSOD и (rsl050450) GPX1 выявило:
- генотип АА MnSOD
- генотип АА GPX1
- носительство сочетания гомозиготных генотипов АА/АА генов MnSOD/GPXl, ассоциированное с резистентностью к развитию хронического пылевого бронхита. Для данного пациента прогнозируют резистентность к развитию хронического пылевого бронхита.
Заключительный клинический диагноз: Данных за патологию органов дыхания (в том числе профессиональную) не выявлено.
Пример 6.
Пациент П., 49 лет, стаж работы во вредных условиях труда 22 года, основная профессия - ГРОЗ подземный. По данным санитарно-гигиенической характеристики концентрация УПП в воздухе рабочей зоны превышала ПДК в разные годы в 15 раз. Не курит.
Жалоб нет. Аускультативно: в легких везикулярное дыхание, хрипов нет. Спирография: ЖЕЛ - 109%, ОФВ1 - 115%. Рентгенография органов грудной клетки: умеренный (перибронхиальный) пневмосклероз.
Генотипирование по полиморфным локусам rs4880 MnSOD и rsl050450 GPX1 выявило:
- генотип GG MnSOD
- генотип АА GPX1
- носительство сочетания гомозиготных генотипов GG/AA генов MnSOD/GPXl, ассоциированное с резистентностью к развитию хронического пылевого бронхита. Для данного пациента прогнозируют резистентность к развитию хронического пылевого бронхита.
Заключительный клинический диагноз: Данных за патологию органов дыхания (в т.ч. профессиональную) не выявлено.
Приведенные примеры показывают, что с помощью разработанного нами способа с использованием молекулярно-генетического анализа полиморфных локусов rs4880 MnSOD и rs1050450 GPX1 можно выделять лиц, предрасположенных или устойчивых к развитию пылевого бронхита.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ХРОНИЧЕСКОГО ПЫЛЕВОГО БРОНХИТА У РАБОТНИКОВ УГЛЕДОБЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ | 2011 |
|
RU2457490C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ АНТРАКОСИЛИКОЗА У РАБОТНИКОВ УГЛЕДОБЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ | 2012 |
|
RU2482482C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ В УСЛОВИЯХ РАДИАЦИОННОГО ВОЗДЕЙСТВИЯ | 2012 |
|
RU2521393C2 |
| СПОСОБ ДИАГНОСТИКИ ПРЕДРАСПОЛОЖЕННОСТИ К ПРОФЕССИОНАЛЬНЫМ БОЛЕЗНЯМ ОРГАНОВ ДЫХАНИЯ | 2010 |
|
RU2472434C2 |
| Способ прогнозирования риска развития хронической ртутной интоксикации | 2016 |
|
RU2619552C1 |
| Способ прогнозирования развития аневризмы левого желудочка у больных, перенесших инфаркт миокарда, с учетом генетических факторов | 2022 |
|
RU2801684C1 |
| Способ прогнозирования риска развития хронической истинной экземы у женщин с учетом генетических факторов | 2021 |
|
RU2753274C1 |
| Способ прогнозирования повышенного риска развития хронической истинной экземы у мужчин с использованием данных о полиморфизме гена филаггрина | 2021 |
|
RU2750963C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ЭССЕНЦИАЛЬНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ | 2019 |
|
RU2703559C1 |
| Способ прогнозирования риска развития гипертонической болезни у мужчин по результатам генетического тестирования | 2023 |
|
RU2809912C1 |
Изобретение относится к области медицины. Предложен способ молекулярно-генетического прогнозирования риска развития хронического пылевого бронхита у работников угледобывающей промышленности. Проводят генотипирование полиморфных локусов генов ферментов антиоксидантной системы rs4880 MnSOD и rs1050450 GPX1 путем полимеразной цепной реакции. При выявлении сочетания генотипов АА MnSOD и GG GPX1 прогнозируют генетическую предрасположенность к риску развития хронического пылевого бронхита. При выявлении одного из трех сочетаний генотипов GG/AA, АА/АА и AG/AA MnSOD/GPX1 прогнозируют резистентность к развитию хронического пылевого бронхита у работников угледобывающей промышленности. Изобретение позволяет установить генетическую предрасположенность и резистентность к развитию хронического пылевого бронхита у рабочих угольной промышленности, дает возможность его широкого применения при проведении предварительных и периодических медицинских осмотров работников угольной промышленности, помогает определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий. 2 табл., 6 пр.
Способ молекулярно-генетического прогнозирования риска развития хронического пылевого бронхита у работников угледобывающей промышленности путем исследования крови с определением генетических маркеров, отличающийся тем, что проводят генотипирование полиморфных локусов генов ферментов антиоксидантной системы rs4880 MnSOD и rs1050450 GPX1 путем полимеразной цепной реакции и при выявлении сочетания генотипов АА MnSOD и GG GPX1 прогнозируют генетическую предрасположенность к риску развития хронического пылевого бронхита, при выявлении одного из трех сочетаний генотипов GG/AA, АА/АА и AG/AA MnSOD/GPX1 прогнозируют резистентность к развитию хронического пылевого бронхита у работников угледобывающей промышленности.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ХРОНИЧЕСКОГО ПЫЛЕВОГО БРОНХИТА У РАБОТНИКОВ УГЛЕДОБЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ | 2011 |
|
RU2457490C1 |
| РЕГУЛЯТОР СКОРОСТИ ВЕРЕТЕН ПРЯДИЛЬНОГО ВАТЕРА | 1935 |
|
SU47205A1 |
| ROGAN J.M | |||
| et al | |||
| Role of dust in the working environment in development of chronic bronchitis in British coal miners | |||
| British Journal of Industrial Medicine | |||
| Приспособление для склейки фанер в стыках | 1924 |
|
SU1973A1 |
| TEIMOORI B | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2022-03-22—Публикация
2021-06-02—Подача