Перекрестные ссылки на связанные заявки
Данная заявка заявляет приоритет Предварительной Патентной Заявки США с порядковым номером No. 61/775060 от 8 марта 2013 и Предварительной Патентной Заявки США No. 61/856390 от 19 июля 2013, которые включены в данный документ ссылкой в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способам биотехнологии и биопроизводства рекомбинантных белков.
УРОВЕНЬ ТЕХНИКИ
Клетки млекопитающих, содержащие нуклеиновую кислоту, которая кодирует рекомбинантный белок, часто используют для продуцирования терапевтически или коммерчески важных белков. Среди текущего разнообразия продуктовых линий, биотехнологические компании направляют усилия на разработку инновационных решений для гибкого и экономичного производства терапевтических белковых лекарственных веществ.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, по меньшей мере, частично на открытии того, что интегрированные непрерывные системы, которые включают две многоколоночные хроматографические системы, могут использоваться для непрерывного получения терапевтических белковых лекарственных веществ. С точки зрения данного открытия, в данном документе предлагаются интегрированные и непрерывные способы производства терапевтического белкового лекарственного вещества, которые включает получение жидкой культуральной среды, содержащей рекомбинантный терапевтический белок, который, по существу свободен от клеток, где жидкая культуральная среда подается в первую многоколоночную хроматографическую систему (MCCS1); захват рекомбинантного терапевтического белка в жидкой культуральной среде с использованием MCCS1, где элюат MCCS1, содержащий рекомбинантный терапевтический белок непрерывно подается во вторую многоколоночную хроматографическую систему (MCCS2); и очистку и доочистку рекомбинантного терапевтического белка с использованием MCCS2, где элюат из MCCS2 представляет собой терапевтическое белковое лекарственное вещество; и где способ является интегрированным и осуществляется непрерывно, начиная от жидкой культуральной среды до получения элюата из MCCS2, который представляет собой терапевтическое белковое лекарственное вещество. Также предлагаются системы, специально разработанные для осуществления любого из способов, описанных в данном документе. Например, в данном документе предлагаются системы биологического производства, которые включают: первую многоколоночную хроматографическую систему (MCCS), содержащую вход; и вторую MCCS, включающую выход, где первая и вторая MCCS находятся в жидкостном сообщении друг с другом, и где система производства сконфигурирована так, что жидкость может поступать на вход через первую и вторую MCCS, и покидать систему производства через выход.
В данном документе предлагаются интегрированные и непрерывные способы производства терапевтического белкового лекарственного вещества, которые включают: (i) получение жидкой культуральной среды, содержащей рекомбинантный терапевтический белок, который, по существу свободен от клеток, где жидкая культуральная среда подается в первую многоколоночную хроматографическую систему (MCCS1); (ii) захват рекомбинантного терапевтического белка в жидкой культуральной среде с использованием MCCS1, где элюат MCCS1, содержащий рекомбинантный терапевтический белок непрерывно подается во вторую многоколоночную хроматографическую систему (MCCS2); и (iii) очистку и доочистку рекомбинантного терапевтического белка с использованием MCCS2, где элюат из MCCS2 представляет собой терапевтическое белковое лекарственное вещество; и где способ является интегрированным и осуществляется непрерывно, начиная от жидкой культуральной среды до получения элюата из MCCS2, который представляет собой терапевтическое белковое лекарственное вещество. В некоторых воплощениях любого из способов, описанных в данном документе, жидкая культуральная среда выбирается из группы, состоящей из: жидкой культуральной среды, удаляемой из перфузионного биореактора, содержащего культуру клеток млекопитающего, которые секретируют рекомбинантный терапевтический белок, жидкой культуральной среды, удаляемой из подпитываемого биореактора, содержащего культуру клеток млекопитающего, которые секретируют рекомбинантный терапевтический белок, и осветленной жидкой культуральной среды из культуры бактериальных или дрожжевых клеток, которые секретируют рекомбинантный терапевтический белок.
В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 осуществляют, по меньшей мере, два различных типовых процесса. В некоторых воплощениях любого из способов, описанных в данном документе, применение MCCS1 или MCCS2, или их обеих, включает в себя переключение колонок. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 осуществляет типовые процессы захвата рекомбинантного терапевтического белка и инактивацию вирусов. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS2 осуществляет типовые процессы очистки и доочистки рекомбинантного терапевтического белка. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 использует, по меньшей мере, две хроматографические колонки. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 использует, по меньшей мере, две хроматографические мембраны. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 использует, по меньшей мере, одну хроматографическую колонку и, по меньшей мере, одну хроматографическую мембрану. В некоторых воплощениях любого из способов, описанных в данном документе, жидкая культуральная среда представляет собой жидкую культуральную среду, удаляемую из перфузионного биореактора, содержащего культуру клеток млекопитающего, которые секретируют рекомбинантный терапевтический белок.
В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 представляет собой первую периодическую противоточную хроматографическую систему (PCCS1). В некоторых воплощениях любого из способов, описанных в данном документе, PCCS1 включает четырехколоночную PCCS. В некоторых воплощениях любого из способов, описанных в данном документе, три из четырех колонок в четырехколоночной PCCS осуществляют типовой процесс захвата рекомбинантного терапевтического белка из жидкой культуральной среды. В некоторых воплощениях любого из способов, описанных в данном документе, захват осуществляется с использованием аффинной хроматографии, катионообменной хроматографии, анионообменной хроматографии или хроматографии на молекулярных ситах. В некоторых воплощениях любого из способов, описанных в данном документе, аффинную хроматографию осуществляют с использованием механизма захвата, выбранного из группы, состоящей из: механизма захвата со связыванием с протеином A, механизма захвата со связыванием с субстратом, механизма захвата со связыванием с антителом или антительным фрагментом, механизма захвата со связыванием с аптамером и механизма захвата со связыванием с кофактором. В некоторых воплощениях любого из способов, описанных в данном документе, аффинная хроматография осуществляется с использованием механизма захвата со связыванием с протеином-A, и рекомбинантный терапевтический белок представляет собой антитело или антительный фрагмент. В некоторых воплощениях любого из способов, описанных в данном документе, элюат, содержащий рекомбинантный терапевтический белок трех из четырех колонок в четырехколоночной PCCS, подается в четвертую колонку четырехколоночной PCCS. В некоторых воплощениях любого из способов, описанных в данном документе, четвертая колонка четырехколоночной PCCS осуществляет типовой процесс инактивации вирусов путем поддержания элюата, содержащего рекомбинантный терапевтический белок, при низком pH для вирусной инактивации. В некоторых воплощениях любого из способов, описанных в данном документе, четвертая колонка четырехколоночной PCCS поддерживает элюат, содержащий рекомбинантный терапевтический белок, при низком pH для вирусной инактивации в течение периода примерно от 10 минут примерно до 1,5 часов.
В некоторых воплощениях любого из способов, описанных в данном документе, MCCS2 представляет собой вторую периодическую противоточную хроматографическую систему (PCCS2). Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают регуляцию pH элюата из четвертой колонки четырехколоночной PCCS с использованием встроенного резервуара регуляции буфера перед тем, как элюат из четвертой колонки четырехколоночной PCCS подается в PCCS2. В некоторых воплощениях любого из способов, описанных в данном документе, хроматографическая система PCCS2 включает три хроматографические колонки и хроматографическую мембрану. В некоторых воплощениях любого из способов, описанных в данном документе, три хроматографические колонки в PCCS2 осуществляют типовой процесс очистки рекомбинантного терапевтического белка из элюата PCCS1 посредством катионообменной или анионообменной хроматографии. В некоторых воплощениях любого из способов, описанных в данном документе, элюат из трех хроматографических колонок в PCCS2 подается на хроматографическую мембрану в PCCS2. В некоторых воплощениях любого из способов, описанных в данном документе, хроматографическая мембрана в PCCS2 осуществляет типовую функцию доочистки рекомбинантного терапевтического белка, присутствующего в элюате из трех хроматографических колонок в PCCS2, посредством катионообменной или анионообменной хроматографии. В некоторых воплощениях любого из способов, описанных в данном документе, хроматографическая мембрана в PCCS2 осуществляет типовую функцию доочистки посредством катионообменной хроматографии. В некоторых воплощениях любого из способов, описанных в данном документе, элюат и смыв с хроматографической колонки представляет собой терапевтическое белковое лекарственное вещество. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно содержат включение в состав фармацевтической композиции терапевтического белкового лекарственного вещества.
В некоторых воплощениях любого из способов, описанных в данном документе, рекомбинантный терапевтический белок представляет собой антитело или антительный фрагмент, фермент, искусственно сконструированный белок или иммуногенный белок или белковый фрагмент. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают регуляцию ионной концентрации элюата из трех колонок в PCCS2 с использованием встроенной регуляции буфера перед тем, как элюат из трех колонок в PCCS2 подается на хроматографическую мембрану в PCCS2. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают применение буферной емкости (например, любой буферной емкости, описанной в данном документе) между PCCS1 и PCCS2. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают фильтрацию элюата из PCCS1 перед его подачей в PCCS2. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают фильтрацию жидкой культуральной среды перед ее подачей в MCCS1.
Также в данном документе предлагаются интегрированные и непрерывные способы производства терапевтического белкового лекарственного вещества, которые включают: (i) культивирование клеток млекопитающего, которые секретируют рекомбинантный терапевтический белок в перфузионном биореакторе, который содержит жидкую культуральную среду, где объем жидкой культуральной среды, которая, по существу свободна от клеток, непрерывно или периодически удаляется из перфузионного биореактора и подается в первую многоколоночную хроматографическую систему (MCCS1); (ii) захват рекомбинантного терапевтического белка в жидкой культуральной среде с использованием MCCS1, где элюат MCCS1, содержащий рекомбинантный терапевтический белок непрерывно подается во вторую многоколоночную хроматографическую систему (MCCS2); и (iii) очистку и доочистку рекомбинантного терапевтического белка с использованием MCCS2, где элюат из MCCS2 представляет собой терапевтическое белковое лекарственное вещество; и где способ является интегрированным и осуществляется непрерывно, начиная от жидкой культуральной среды до получения элюата из MCCS2, который представляет собой терапевтическое белковое лекарственное вещество.
В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 осуществляют, по меньшей мере, два различных типовых процесса. В некоторых воплощениях любого из способов, описанных в данном документе, применение MCCS1 или MCCS2, или их обеих, включает в себя переключение колонок. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 осуществляет типовые процессы захвата рекомбинантного терапевтического белка и инактивацию вирусов. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS2 осуществляет типовые процессы очистки и доочистки рекомбинантного терапевтического белка. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 использует, по меньшей мере, две хроматографические колонки. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 использует, по меньшей мере, две хроматографические мембраны. В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 и/или MCCS2 использует, по меньшей мере, одну хроматографическую колонку и, по меньшей мере, одну хроматографическую мембрану.
В некоторых воплощениях любого из способов, описанных в данном документе, MCCS1 представляет собой первую периодическую противоточную хроматографическую систему (PCCS1). В некоторых воплощениях любого из способов, описанных в данном документе, PCCS1 включает четырехколоночную PCCS. В некоторых воплощениях любого из способов, описанных в данном документе, три из четырех колонок в четырехколоночной PCCS осуществляют типовой процесс захвата рекомбинантного терапевтического белка из жидкой культуральной среды. В некоторых воплощениях любого из способов, описанных в данном документе, захват осуществляется с использованием аффинной хроматографии, катионообменной хроматографии, анионообменной хроматографии или хроматографии на молекулярных ситах. В некоторых воплощениях любого из способов, описанных в данном документе, аффинную хроматографию осуществляют с использованием механизма захвата, выбранного из группы, состоящей из: механизм захвата со связыванием с протеином A, механизм захвата со связыванием с субстратом, механизм захвата со связыванием с антителом или антительным фрагментом, механизм захвата со связыванием с аптамером и механизм захвата со связыванием с кофактором. В некоторых воплощениях любого из способов, описанных в данном документе, аффинная хроматография осуществляется с использованием механизма захвата со связыванием с протеином-A, и рекомбинантный терапевтический белок представляет собой антитело или антительный фрагмент. В некоторых воплощениях любого из способов, описанных в данном документе, элюат, содержащий рекомбинантный терапевтический белок трех из четырех колонок в четырехколоночной PCCS, подается в четвертую колонку четырехколоночной PCCS. В некоторых воплощениях любого из способов, описанных в данном документе, четвертая колонка четырехколоночной PCCS осуществляет типовой процесс инактивации вирусов путем поддержания элюата, содержащего рекомбинантный терапевтический белок, при низком pH для вирусной инактивации. В некоторых воплощениях любого из способов, описанных в данном документе, четвертая колонка четырехколоночной PCCS поддерживает элюат, содержащий рекомбинантный терапевтический белок, при низком pH для вирусной инактивации в течение периода примерно от 10 минут примерно до 1,5 часов.
В некоторых воплощениях любого из способов, описанных в данном документе, MCCS2 представляет собой вторую периодическую противоточную хроматографическую систему (PCCS2). Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают регуляцию pH элюата из четвертой колонки четырехколоночной PCCS с использованием встроенного резервуара регуляции буфера перед тем, как элюат из четвертой колонки четырехколоночной PCCS подается в PCCS2. В некоторых воплощениях любого из способов, описанных в данном документе, хроматографическая система PCCS2 включает три хроматографические колонки и хроматографическую мембрану. В некоторых воплощениях любого из способов, описанных в данном документе, три хроматографические колонки в PCCS2 осуществляют типовой процесс очистки рекомбинантного терапевтического белка из элюата PCCS1 посредством катионообменной или анионообменной хроматографии. В некоторых воплощениях любого из способов, описанных в данном документе, элюат из трех хроматографических колонок в PCCS2 подается на хроматографическую мембрану в PCCS2. В некоторых воплощениях любого из способов, описанных в данном документе, хроматографическая мембрана в PCCS2 осуществляет типовую функцию доочистки рекомбинантного терапевтического белка, присутствующего в элюате из трех хроматографических колонок в PCCS2, посредством катионообменной или анионообменной хроматографии. В некоторых воплощениях любого из способов, описанных в данном документе, хроматографическая мембрана в PCCS2 осуществляет типовую функцию доочистки посредством катионообменной хроматографии. В некоторых воплощениях любого из способов, описанных в данном документе, элюат и смыв с хроматографической колонки представляет собой терапевтическое белковое лекарственное вещество. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно содержат включение в состав фармацевтической композиции терапевтического белкового лекарственного вещества. В некоторых воплощениях любого из способов, описанных в данном документе, рекомбинантный терапевтический белок представляет собой антитело или антительный фрагмент, фермент, искусственно сконструированный белок или иммуногенный белок или белковый фрагмент.
Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают регуляцию ионной концентрации элюата из трех колонок в PCCS2 с использованием встроенной регуляции буфера перед тем, как элюат из трех колонок в PCCS2 подается на хроматографическую мембрану в PCCS2. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают применение буферной емкости (например, любой буферной емкости, описанной в данном документе) между PCCS1 и PCCS2. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают фильтрацию элюата из PCCS1 перед его подачей в PCCS2. Некоторые воплощения любого из способов, описанных в данном документе, дополнительно включают фильтрацию жидкой культуральной среды перед ее подачей в MCCS1.
Также, в данном документе предлагаются системы биологического производства, которые включают: первую многоколоночную хроматографическую систему (MCCS), включающую вход; и вторую MCCS, включающую выход, где первая и вторая MCCS находятся в жидкостном сообщении друг с другом, и где система производства сконфигурирована так, что жидкость может поступать на вход через первую и вторую MCCS, и покидать систему производства через выход. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают биореактор, где биореактор и вход находятся в жидкостном сообщении друг с другом, и где система производства сконфигурирована так, что жидкость, присутствующая в биореакторе, может проходить через вход. В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS или вторая MCCS, или они обе сконфигурированы для осуществления, по меньшей мере, двух отдельных типовых процессов. В некоторых воплощениях любой из систем, описанных в данном документе, применение MCCS1 или MCCS2, или их обеих, включает в себя переключение колонок.
В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS сконфигурирована для осуществления типовых процессов захвата рекомбинантного терапевтического белка и инактивации вирусов. В некоторых воплощениях любой из систем, описанных в данном документе, вторая MCCS сконфигурирована для осуществления типовых процессов очистки и доочистки рекомбинантного терапевтического белка. В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS или вторая MCCS, или они обе содержат, по меньшей мере, две хроматографические колонки. В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS или вторая MCCS, или они обе содержат, по меньшей мере, две хроматографические мембраны. В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS или вторая MCCS, или они обе содержат, по меньшей мере, одну хроматографическую колонку и, по меньшей мере, одну хроматографическую мембрану.
В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS представляет собой первую периодическую противоточную хроматографическую систему (PCCS1). В некоторых воплощениях любой из систем, описанных в данном документе, PCCS1 включает четырехколоночную PCCS. В некоторых воплощениях любой из систем, описанных в данном документе, три из четырех колонок в четырехколоночной PCCS способны к захвату рекомбинантного терапевтического белка из жидкой культуральной среды. В некоторых воплощениях любой из систем, описанных в данном документе, три из четырех колонок в четырехколоночной PCCS включают одну или несколько колонок аффинной хроматографии, колонку катионной хроматографии, колонку анионной хроматографии и колонку хроматографии на молекулярном сите. В некоторых воплощениях любой из систем, описанных в данном документе, три из четырех колонок в четырехколоночной PCCS включают одну или несколько колонок аффинной хроматографии, использующей механизма захвата, выбранный из группы, состоящей из: механизм захвата со связыванием с протеином A, механизм захвата со связыванием с субстратом, механизм захвата со связыванием с антителом или антительным фрагментом, механизм захвата со связыванием с аптамером и механизм захвата со связыванием с кофактором. В некоторых воплощениях любой из систем, описанных в данном документе, четвертая колонка четырехколоночной PCCS представляет собой резервуар или колонку, которая способна поддерживать элюат трех из четырех колонок четырехколоночной PCCS, содержащий рекомбинантный терапевтический белок, при низком pH для вирусной инактивации. В некоторых воплощениях любой из систем, описанных в данном документе, четвертая колонка четырехколоночной PCCS способна поддерживать элюат, содержащий рекомбинантный терапевтический белок трех из четырех колонок четырехколоночной PCCS при низком pH для вирусной инактивации в течение периода примерно от 10 минут примерно до 1,5 часов.
В некоторых воплощениях любой из систем, описанных в данном документе, вторая MCCS представляет собой вторую периодическую противоточную хроматографическую систему (PCCS2). Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают жидкостной трубопровод, расположенный между первой MCCS и второй MCCS. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают встроенный резервуар регуляции буфера, который имеет жидкостное сообщение с жидкостным трубопроводом, расположенным между первой MCCS и второй MCCS, aи сконфигурированный так, что буфер, содержащийся внутри встроенного резервуара регуляции буфера, вводится в жидкость, присутствующую в жидкостном трубопроводе, расположенном между первой MCCS и второй MCCS. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают фильтр, расположенный в жидкостном трубопроводе между первой MCCS и второй MCCS, и сконфигурированный так, что фильтр способен удалять твердые частицы из жидкости, присутствующей в жидкостном трубопроводе между первой MCCS и второй MCCS.
В некоторых воплощениях любой из систем, описанных в данном документе, хроматографическая система PCCS2 включает три хроматографические колонки и хроматографическую мембрану. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают жидкостной трубопровод, расположенный между тремя хроматографическими колонками в PCCS2 и хроматографической мембраной в PCCS2. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают встроенный резервуар регуляции буфера, который имеет жидкостное сообщение с жидкостным трубопроводом, расположенным между тремя хроматографическими колонками в PCCS2 и хроматографической мембраной в PCCS2, и сконфигурированный так, что буфер, содержащийся внутри встроенного резервуара регуляции буфера, вводится в жидкость, присутствующую в жидкостном трубопроводе, расположенном между тремя хроматографическими колонками в PCCS2 и хроматографической мембраной в PCCS2.
В некоторых воплощениях любой из систем, описанных в данном документе, три хроматографические колонки в PCCS2 способны к очистке рекомбинантного терапевтического белка посредством катионообменной или анионообменной хроматографии. В некоторых воплощениях любой из систем, описанных в данном документе, хроматографическая мембрана в PCCS2 представляет собой катионообменную хроматографическую мембрану.
Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают жидкостной трубопровод, расположенный между хроматографической мембраной в PCCS2 и выходом. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают фильтр, расположенный между хроматографической мембраной в PCCS2 и выходом, и сконфигурированный так, что фильтр способен удалять твердые частицы из жидкости, присутствующей в жидкостном трубопроводе между хроматографической мембраной в PCCS2 и выходом. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают насосную систему, которая находится в жидкостном сообщении со входом. В некоторых воплощениях любой из систем, описанных в данном документе, насосная система включает насос, который способен прокачивать жидкость ко входу. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают жидкостной трубопровод, расположенный между насосом и входом. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают фильтр, расположенный в жидкостном трубопроводе между насосом и входом, и сконфигурированный так, что фильтр способен удалять твердые частицы из жидкости, присутствующей в жидкостном трубопроводе между насосом и входом. Некоторые воплощения любой из систем, описанных в данном документе, дополнительно включают буферную емкость (например, буферную емкость, описанную в данном документе), расположенную в жидкостном трубопроводе между насосом и входом, которая сконфигурирована так, что буферная емкость находится в жидкостном сообщении с жидкостным трубопроводом между насосом и входом, и способна хранить любую жидкость, присутствующую в жидкостном трубопроводе, которая не способна войти во вход.
В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS и вторая MCCS располагаются на передвижной платформе (например, на устройстве, включающем одну или несколько структур, которые дают возможность передвижения). В некоторых воплощениях любой из систем, описанных в данном документе, первая MCCS располагается на первой передвижной платформе. В некоторых воплощениях любой из систем, описанных в данном документе, вторая MCCS располагается на второй передвижной платформе. В некоторых воплощениях любой из систем, описанных в данном документе, каждая из первой и второй передвижных платформ включает одну или несколько структур, которые дают возможность передвижения. В некоторых воплощениях любой из систем, описанных в данном документе, вся система располагается на передвижной платформе (например, на устройстве, включающем одну или несколько структур, которые дают возможность передвижения).
Также в данном документе предлагаются системы биологического производства, которые включают две или более подсистем, где каждая из двух или более подсистем включает: (i) первую многоколоночную хроматографическую систему (MCCS), содержащую вход; и (ii) вторую MCCS, включающую выход, где первая и вторая MCCS находятся в жидкостном сообщении друг с другом, и где система производства сконфигурирована так, что жидкость может поступать на вход через первую и вторую MCCS, и покидать систему производства через выход; где две или более подсистем сконфигурированы так, что каждая из них находится в жидкостном сообщении с единственным резервуаром, содержащим жидкость, и жидкость из единственного резервуара поступает на вход двух или более подсистем. В некоторых воплощениях систем, описанных в данном документе, каждая из двух или более подсистем располагается на своем собственной передвижной платформе. В некоторых воплощениях любой из систем, описанных в данном документе, передвижная платформа включает одну или несколько структур, которые дают возможность передвижения. В некоторых воплощениях любой из систем, описанных в данном документе, вся система располагается на передвижной платформе (например, на устройстве, включающем одну или несколько структур, которые дают возможность передвижения).
При использовании в данном документе, аритикль “a” перед существительным означает одно или несколько в отношении конкретного существительного. Например, выражение “клетка млекопитающего” означает “одну или несколько клеток млекопитающего”.
Термин “клетка млекопитающего” означает любую клетку из любого млекопитающего или выделенную из любого млекопитающего (например, человека, хомяка, мыши, зеленой мартышки, крысы, свиньи, коровы или кролика). Например, клетка млекопитающего может представлять собой иммортализованную клетку. В некоторых воплощениях, клетка млекопитающего представляет собой дифференцированную клетку. В некоторых воплощениях, клетка млекопитающего представляет собой недифференцированную клетку. В данном документе описаны частные примеры клеток млекопитающих. Дополнительные примеры клеток млекопитающих известны в данной области.
Термин “по существу свободна” означает композицию (например, жидкую культуральную среду), которая, по меньшей мере, или примерно на 90% свободна (например, по меньшей мере, или примерно на 95%, 96%, 97%, 98%, или по меньшей мере, или примерно на 99% свободна или примерно на 100% свободна) от конкретного вещества (например, от клеток млекопитающего).
Термин “0,5x объем” означает примерно 50% объема. Термин “0,6x объем” означает примерно 60% объема. Аналогично, 0,7x, 0,8x, 0,9x и 1x означает примерно 70%, 80%, 90% или 100% объема, соответственно.
Термин “культивирование” или “клеточное культивирование” означает поддержание или пролиферацию клетки млекопитающего при контролируемых физических условиях.
Термин “культура клеток млекопитающих” означает жидкую культуральную среду, содержащую множество клеток млекопитающих, которые поддерживаются или пролиферируют при контролируемых физических условиях.
Термин “жидкая культуральная среда” означает жидкость, которая содержит достаточно питательных веществ, чтобы дать клетке возможность (например, клетке млекопитающего) расти или пролиферировать in vitro. Например, жидкая культуральная среда может содержать одно или несколько веществ из следующих: аминокислоты (например, 20 аминокислот), пурин (например, гипоксантин), пиримидин (например, тимидин), холин, инозит, тиамин, филиевая кислота, биотин, кальций, ниацинамид, пиридоксин, рибофлавин, тимидин, цианокобаламин, пируват, липоевая кислота, магний, глюкоза, натрий, калий, железо, медь, цинк и бикарбонат натрия. В некоторых воплощениях, жидкая культуральная среда может содержать сыворотку из млекопитающего. В некоторых воплощениях, жидкая культуральная среда не содержит сыворотки или другого экстракта из млекопитающего (определенная жидкая культуральная среда). В некоторых воплощениях, жидкая культуральная среда может содержать следы металлов, гормоны роста млекопитающих и/или фактор роста млекопитающих. Другой пример жидкой культуральной среды представляет собой минимальную среду (например, среду, содержащую только неорганические соли, источник углерода и воду). В данном документе описаны частные примеры жидкой культуральной среды. Дополнительные примеры жидкой культуральной среды известны в данной области и коммерчески доступны. Жидкая культуральная среда может содержать любую плотность клеток млекопитающих. Например, при использовании в данном документе, объем жидкой культуральной среды, удаляемой из биореактора, может быть по существу свободен от клеток млекопитающих.
Термин “жидкая культуральная среда, свободная от компонента, выделенного из животного”, означает жидкую культуральную среду, которая не содержит никаких компонентов (например, белков или сыворотки), выделенных из млекопитающего.
Термин “жидкая культуральная среда, свободная от сыворотки”, означает жидкую культуральную среду, которая не содержит сыворотки млекопитающего.
Термин “жидкая культуральная среда, содержащая сыворотку”, означает жидкую культуральную среду, которая содержит сыворотку млекопитающего.
Термин “химически определенная жидкая культуральная среда” представляет собой термин из уровня техники и означает жидкую культуральную среду, в которой все химически компоненты известны. Например, химически определенная жидкая культуральная среда не содержит фетальную бычью сыворотку, бычий сывороточный альбумин или человеческий сывороточный альбумин, поскольку эти препараты, как правило, содержат комплексную смесь альбуминов и липидов.
Термин “жидкая культуральная среда, свободная от белка” означает жидкую культуральную среду, которая не содержит никакого белка (например, никакого детектируемого белка).
Термин “агитация” означает встряхивание или другое движение части жидкой культуральной среды в биореакторе. Это осуществляют, например, с целью увеличения концентрации растворенного O2 в жидкой культуральной среде в биореакторе. Агитация может осуществляться с использованием любого известного в данной области метода, например, с использованием прибора или двигательной системы. Приведенные в качестве примера устройства и методы, которые могут использоваться для осуществления агитации части жидкой среды в биореакторе, известны в данной области.
Термин “терапевтическое белковое лекарственное вещество” означает рекомбинантный белок (например, фрагмент иммуноглобулинового белка, сконструированный белокa или фермент), который достаточно очищен или выделен из контаминирующих белков, липидов и нуклеиновых кислот (например, контаминирующих белков, липидов и нуклеиновых кислот, присутствующих в жидкой культуральной среде, или из клетки-хозяинаl (например, из клетки млекопитающего, дрожжевой клетки или бактериальной клетки)) и из биологических контаминантов (например, вирусных и бактериальных контаминантов), и может быть включено в состав фармацевтического агента без какой-либо дополнительной очистки и/или стадии деконтаминации.
Термин “интегрированный способ” означает способ, который осуществляют с использованием структурных элементов, которые функционируют совместно для достижения специфического результата (например, получения терапевтического белкового лекарственного вещества из жидкой культуральной среды).
Термин “непрерывный способ” означает процесс, который непрерывно подает жидкость через, по меньшей мере, часть системы. Например, в любых приведенных в качестве примера системах непрерывного биологического производства, описанных в данном документе, жидкая культуральная среда, содержащая рекомбинантный терапевтический белок, непрерывно подается в систему, в то время как она функционирует, и терапевтическое белковое лекарственное вещество выводится из системы. В другом примере, непрерывный способ представляет собой способ, который непрерывно подает жидкую культуральную среду, содержащую рекомбинантный терапевтический белок, из биореактора через первую MCCS. Другой пример непрерывного способа представляет собой, который непрерывно подает жидкую культуральную среду, содержащую рекомбинантный терапевтический белок, из биореактора через первую и вторую MCCS. Дополнительные примеры включают способ, который непрерывно подает жидкую культуральную среду, содержащую рекомбинантный терапевтический белок, через первую MCCS, способ, который непрерывно подает жидкую культуральную среду, содержащую рекомбинантный терапевтический белок, через первую и вторую MCCS, или способ, который непрерывно подает жидкую культуральную среду, содержащую рекомбинантный терапевтический белок, через вторую MCCS.
Термин “иммуноглобулин” означает полипептид, содержащий аминокислотную последовательность, по меньшей мере, 15 аминокислот (например, по меньшей мере, 20, 30, 40, 50, 60, 70, 80, 90 или 100 аминокислот) иммуноглобулинового белка (например, последовательность вариабельного домена, каркасная последовательность или последовательность константного домена). Иммуноглобулин может, например, включать, по меньшей мере, 15 аминокислот легкой цепи иммуноглобулина, например, по меньшей мере, 15 аминокислот тяжелой цепи иммуноглобулина. Иммуноглобулин может представлять собой выделенное антитело (например, IgG, IgE, IgD, IgA, или IgM). Иммуноглобулин может представлять собой подкласс IgG (например, IgG1, IgG2, IgG3 или IgG4). Иммуноглобулин может представлять собой антительный фрагмент, например, Fab-фрагмент, F(ab′)2-фрагмент, или scFv-фрагмент. Иммуноглобулин также может представлять собой биспецифичное антитело или три-специфичное антитело или димерное, тримерное или мультимерное антитело или диатело, Аффитело®, или Нанотело®. Иммуноглобулин также может представлять собой сконструированный белок, содержащий, по меньшей мере, один иммуноглобулиновый домен (например, химерный белок). Частные примеры иммуноглобулинов описаны в данном документе и дополнительные примеры иммуноглобулинов известны в данной области.
Термин “белковый фрагмент” или “полипептидный фрагмент” означает часть полипептидной последовательности, длина которой составляет, по меньшей мере, или около 4 аминокислот, по меньшей мере, или около 5 аминокислот, по меньшей мере, или около 6 аминокислот, по меньшей мере, или около 7 аминокислот, по меньшей мере, или около 8 аминокислот, по меньшей мере, или около 9 аминокислот, по меньшей мере, или около 10 аминокислот, по меньшей мере, или около 11 аминокислот, по меньшей мере, или около 12 аминокислот, по меньшей мере, или около 13 аминокислот, по меньшей мере, или около 14 аминокислот, по меньшей мере, или около 15 аминокислот, по меньшей мере, или около 16 аминокислот, по меньшей мере, или около 17 аминокислот, по меньшей мере, или около 18 аминокислот, по меньшей мере, или около 19 аминокислот, или, по меньшей мере, или около 20 аминокислот или более чем 20 аминокислот. Фрагмент рекомбинантного белка может быть получен с использованием любого из способов, описанных в данном документе.
Термин “сконструированный белок” означает полипептид, который в естественном виде не кодируется эндогенной нуклеиновой кислотой, присутствующей внутри организма (например, млекопитающего). Примеры сконструированный белков включают ферменты (например, с одной или с несколькими аминокислотными заменами, делециями, вставками или добавлениями, которые приводят в результате к повышению стабильности и/или каталитической активности сконструированного фермента), химерные белки, антитела (например, двухвалентные антитела, трехвалентные антитела или диатело), и антиген-связывающие белки, которые содержат, по меньшей мере, одну рекомбинантную основную последовательность.
Термин “многоколоночная хроматографическая система” или “MCCS” означает систему суммарно состоящую из двух или более соединенных между собой или переключающихся хроматографических колонок и/или хроматографических мембран. Частный пример многоколоночной хроматографической системы представляет собой периодическую противоточную хроматографическую систему (PCC), содержащую суммарно две или более соединенных между собой или переключающихся хроматографических колонок и/или хроматографических мембран. Дополнительные примеры многоколоночных хроматографических систем описаны в данном документе и известны в данной области.
Термин “захват” означает стадию, осуществляемую для частичной очистки или выделения (например, по меньшей мере, или около 5%, например, по меньшей мере, или около 10%, 15%, 20%, 25%, 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или, по меньшей мере, около 95% чистоты по массе), концентрата и стабилизации рекомбинантного терапевтического белка из одного или нескольких других компонентов, присутствующих в жидкой культуральной среде или в разведенной культуральной среде (например, белки культуральной среды или один или несколько других компонентов (например, ДНК, РНК или другие белки), присутствующих или секретированных из клетки млекопитающего). Как правило, захват осуществляется с использованием смолы, которая связывает рекомбинантный терапевтический белок (например, через использование аффинной хроматографии). Частные методы захвата рекомбинантного терапевтического белка из жидкой культуральной среды или из разведенной жидкой культуральной среды описаны в данном документе, а другие методы известны в данной области. Рекомбинантный терапевтический белок может захватываться из жидкой культуральной среды с использованием, по меньшей мере, одной хроматографической колонки и/или хроматографической мембраны (например, любых хроматографических колонок и/или хроматографических мембран, описанных в данном документе).
Термин “очистка” означает стадию, осуществляемую для отделения рекомбинантного терапевтического белка от одной или нескольких других примесей (например, основной объем примесей) или от компонентов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок (например, белки жидкой культуральной среды или один или несколько других компонентов (например, ДНК, РНК, другие белки, эндотоксины, вирусы и т.д.), присутствующих в клетке млекопитающего или секретированных ей). Например, очистка может осуществляться во время или после исходной стадии захвата. Очистка может быть осуществлена с использованием смолы, мембраны или любой другой твердой подложки, которая связывается или с рекомбинантным терапевтическим белком или с контаминантами (например, посредством использования аффинной хроматографии, хроматографии гидрофобного взаимодействия, анионообменной или катионообменной хроматографии или хроматографии на молекулярных ситах). Рекомбинантный терапевтический белок может быть очищен из жидкости, содержащей рекомбинантный терапевтический белок, с использованием, по меньшей мере, одной хроматографической колонки и/или хроматографической мембраны (например, любых хроматографических колонок и/или хроматографических мембран, описанных в данном документе).
 O
O
Термин “доочистка” представляет собой термин из данной области техники и он означает стадию, осуществляемую для удаления оставшихся следовых или малых количеств контаминантов или примесей из жидкости, содержащей рекомбинантный терапевтический белок, то есть стадию близкую к получению конечной желаемой чистоты. Например, доочистка может осуществляться путем пропускания жидкости, содержащей рекомбинантный терапевтический белок, через хроматографическую колонку(и) или мембранный абсорбер(ы), которые селективно связываются или с целевым рекомбинантным терапевтическим белком, или с небольшими количествами контаминантов или примесей, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок. В таком примере элюат/фильтрат хроматографической колонки(колонок) или мембранного абсорбера(ов) содержит рекомбинантный терапевтический белок.
Термин “элюат/фильтрат” представляет собой термин из данной области техники и означает, что он выделен из хроматографической колонки или хроматографической мембраны, которая содержит детектируемое количество рекомбинантного терапевтического белка.
Термин “фильтрация” означает удаление, по меньшей мере, части (например, по меньшей мере, 80%, 90%, 95%, 96%, 97%, 98% или 99%) нежелательных биологических контаминантов (например, клетки млекопитающих, бактерии, дрожжевые клетки, вирусы или микобактерии) и/или твердых частиц (например, осажденные белки) из жидкости (например, жидкой культуральной среды или жидкости, присутствующей в любой из систем или процессов, описанных в данном документе).
Термин “секретированный белок” или “секретированный рекомбинантный белок” (например, рекомбинантный белок), который исходно содержал, по меньшей мере, одну последовательность сигнала секреции, когда он транслировался внутри клетки млекопитающего, и посредством, по меньшей мере, частично ферментативного отщепления последовательности сигнала секреции в клетке млекопитающего, секретируется, по меньшей мере, частично во внеклеточное пространство (например, в жидкую культуральную среду). Специалистам в данной области будет понятно, что для “секретированного” белка нет необходимости полностью диссоциировать из клетки, чтобы считаться секретированным белком.
Термин “перфузионный биореактор” означает биореактор, содержащий множество клеток (например, клеток млекопитающих) в первой жидкой культуральной среде, где культивирование клеток, присутствующих в биореакторе, включает периодическое или непрерывное удаление первой жидкой культуральной среды и в то же время или сразу после этого добавление по существу, такого же объема второй жидкой культуральной среды в биореактор. В некоторых примерах происходит постепенная замена (например, повышение или понижение) объема первой жидкой культуральной среды, удаляемой и добавляемой в течение конкретных периодов (например, период около 24 часов, период примерно от 1 минуты примерно до 24 часов или период выше чем 24 часа) во время периода культивирования (например, со скоростью повторной подачи культуральной среды на ежедневной основе). Фракция удаляемой или заменяемой среды может варьироваться каждый день в зависимости от конкретных культивируемых клеток, исходной плотности посева и клеточной плотности в конкретное время. “RV” или “объем реактора” означает объем культуральной среды, присутствующей в начале процесса культивирования (например, суммарный объем культуральной среды, присутствующей после посева).
Термин “подпитываемый биореактор” представляет собой термин из данной области техники и означает биореактор, содержащий множество клеток (например, клеток млекопитающих) в первой жидкой культуральной среде, где культивирование клеток, присутствующих в биореакторе, включает периодическое или непрерывное добавление второй жидкой культуральной среды к первой жидкой культуральной среде без существенного или значительного удаления первой жидкой культуральной среды или второй жидкой культуральной среды из биореактора. Вторая жидкая культуральная среда может быть такой же, как и первая жидкая культуральная среда. В некоторых примерах подпитываемой культуры вторая жидкая культуральная среда концентрируется из первой жидкой культуральной среды. В некоторых примерах подпитываемой культуры вторая жидкая культуральная среда добавляется в виде сухого порошка.
Термин “осветленная культуральная среда” означает жидкую культуральную среду, получаемую из бактериальной или дрожжевой клеточной культуры, которая по существу свободна (например, свободна, по меньшей мере, на 80%, 85%, 90%, 92%, 94%, 96%, 98% или 99%) от бактериальных или дрожжевых клеток.
Термин “типовой процесс” представляет собой термин, известный в данной области техники и он означает функциональную стадию, которая может осуществляться в способе производства терапевтического белкового лекарственного вещества из жидкой культуральной среды. Например, элементом процесса может быть фильтрация (например, удаление контаминирующих бактерий, дрожжей, вирусов или микобактерий и/или твердых частиц из жидкости, содержащей рекомбинантный терапевтический белок), захват, удаление эпитопной метки, очистка, поддержание или хранение, доочистка, вирусная инактивация, регуляция ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок, и удаление нежелательных солей.
“Специфическая производительность” или “SPR” представляет собой термин из данной области техники, который, при использовании в данном документе, относится к массе или ферментной активности рекомбинантного терапевтического белка, производимого на клетку млекопитающего в день. SPR для рекомбинантного терапевтического антитела обычно измеряется как масса/на клетку/в день. SPR для рекомбинантного терапевтического фермента обычно измеряется как единицы/на клетку/в день или (единицы/масса)/на клетку/в день.
“Объем производительности” или “VPR” представляет собой термин из данной области техники, который при использовании в данном документе, относится к массе или ферментной активности рекомбинантного терапевтического белка, производимого на объем культуры (например, на литр биореактора, колбы или объем пробирки) в день. VPR для рекомбинантного терапевтического антитела обычно измеряется как масса/на литр/в день. VPR для рекомбинантного терапевтического фермента обычно измеряется как единицы/на литр/в день или масса/на литр/в день.
“Передвижная платформа” представляет собой термин из данной области техники, который, при использовании в данном документе, относится к трехмерной твердой структуре, которая может функционировать в качестве платформы или опоры для системы, описанной в данном документе. Передвижная платформа может, если он содержит одну или несколько структур, которые позволяют движение (например, колеса, ролики или тому подобные), придавать мобильность системе или платформе или ее части. Частные примеры передвижных платформ описаны в данном документе. Дополнительные примеры передвижных платформ известны в данной области.
Если не определено иначе, то все технические и научные термины, использованные в данном документе, имеют тот же смысл, который вкладывается в них обычным специалистом области, к которой принадлежит настоящее изобретение. Материалы и методы описаны в данном документе для применения в настоящем изобретении; другие подходящие материалы и методы, известные в данной области, также могут использоваться. Материалы, методы и примеры являются иллюстративными и не предназначены для ограничения. Все публикации, патентные заявки, патенты, последовательности, занесения в базы данных и другие ссылки, упомянутые в данном документе, включены ссылкой в полном объеме. В случае противоречий, они будут урегулированы настоящим описанием изобретения, включающим определения.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания и чертежей, и из формулы изобретения.
Описание чертежей
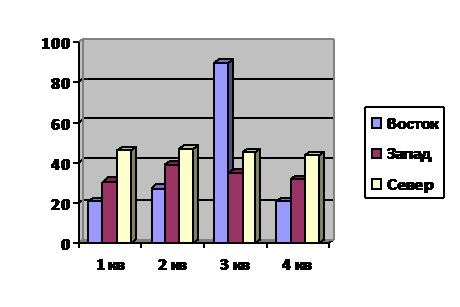
ФИГ. 1 представляет собой схематическое изображение, демонстрирующее типичную интегрированную систему, которая может использоваться для непрерывного получения рекомбинантного белкового лекарственного вещества.
ФИГ. 2 представляет собой диаграмму одиночной системы PCC, соединенной с перфузионным биореактором клеточных культур, которая может использоваться для захвата рекомбинантного терапевтического белка, присутствующего в среде клеточной культуры, получаемой из биореактора.
ФИГ. 3 представляет собой диаграмму цикла системы PCC, содержащей три хроматографические колонки. В начале цикла подпитывающий раствор загружают на колонку 1, и фильтрат сбрасывают до тех пор, пока не появится проскок продукта (стадия 1). В этой точке фильтрат из колонки 1 направляется в колонку 2 для захвата несвязанного рекомбинантного терапевтического белка из колонки 1 (стадия 2). После того как колонка 1 полностью загружена, подпитку направляется для загрузки на колонку 2, в то время как колонка 1 промывается, элюируется, регенерируется и повторно уравновешивается для следующего цикла (стадии 3 и 4). Колонка 2 теперь проходит через стадии 3-5, которые идентичны стадиям 1-3 для колонки 1. Наконец, колонка 3 проходит через стадии 5-6, аналогичные для колонок 1 и 2. После того, как три колонки завершили эти стадии, цикл начинается снова с колонкой 1.
ФИГ. 4 представляет собой схематическую диаграмму, демонстрирующую принцип переключения колонок на основе ΔУФ. T1 обозначает время, когда Уф достигает определенного порогового уровня. После достижения порогового уровня фильтрат из колонки 1 направляется на колонку 2, а не сбрасывается. T2 обозначает время, когда колонка насыщается продуктом. Значение УФ для обоих T1 и T2 специфичны для конкретного процесса.
ФИГ. 5A представляет собой график профиля клеточной плотности в течение времени в культуре биореактора, продуцирующей рекомбинантное терапевтическое антитело. Средняя клеточная плотность в культуре биореактора составляла 50-60×106 клеток/мл.
ФИГ. 5B представляет собой график объемной производительности с течением времени культуры биореактора, продуцирующей рекомбинантное терапевтическое антитело.
ФИГ. 6 представляет собой набор графиков, демонстрирующих процент извлечения, процент агрегации, эффективность (по сравнению с контролем), концентрацию остаточного протеина A (нг/мг), и концентрацию белка клетки-хозяина (нг/мг) в рекомбинантном терапевтическом белке, элюированном из одиночной системы PCC за суммарно 30 дней, 38 циклов одиночной PCC системы и 110 колоночных операций. Дисперсия, ассоциированная с тремя тИФА-анализами (извлечение, остаточный протеин A и белок клетки-хозяина), составила ±20%. Все представленные данные находятся внутри аналитической дисперсии.
ФИГ. 7A представляет собой график профиля клеточной плотности в течение времени в культуре биореактора, продуцирующей рекомбинантный терапевтический человеческий фермент. Средняя клеточная плотность в культуре биореактора через 19 дней составила 50-60×106 клеток/мл.
ФИГ. 7B представляет собой график объемной производительности с течением времени культуры биореактора, продуцирующей рекомбинантный терапевтический человеческий фермент. Два низких значения титра, определенные в районе 48-49 дней, как считается, вызваны аналитической дисперсией, поскольку в данный период не было никаких изменений в клеточной плотности, степени перфузии, или в метаболизме.
ФИГ. 8 представляет собой набор графиков, демонстрирующих процент извлечения, специфическую активность (единицы/мг), процент агрегации, эффективность (по сравнению с контролем), критическую характеристику качества (CQA) #1, CQA #2, CQA # 3, и CQA #4 в рекомбинантном терапевтическом человеческом ферменте, элюированном из одиночной PCC системы суммарно за 9 дней, 41 цикл одиночной PCC системы, и 164 колоночных операций. CQAs #3 и #4 имеют ограниченное количество точек данных, но представляют суммарную продолжительность процесса. Стандартное отклонение CQA находится в интервале 1-9%.
ФИГ. 9 представляет собой схематическое изображение двух систем производства PCCS, соединенных с перфузионным культуральным биореактором, которые приводят к получению непрерывного производства терапевтического белкового лекарственного вещества.
ФИГ. 10 представляет собой график профиля плотности жизнеспособных клеток в течение времени в культуре биореактора, продуцирующей рекомбинантное терапевтическое антитело. Средняя клеточная плотность в культуре биореактора составляла 50-60×106 клеток/мл.
ФИГ. 11 представляет собой график объемной производительности с течением времени культуры биореактора, продуцирующей рекомбинантное терапевтическое антитело.
ФИГ. 12 представляет собой график УФ-профиля в реальном времени колонок с захватом Протеином А в течение ограниченного временного интервала. Каждый третий пик каждых трех пиков представляет УФ-поглощение выхода колонки 1, каждый второй пик каждых трех пиков представляет УФ-поглощение выхода колонки 2, каждый первый пик каждых трех пиков представляет УФ-поглощение выхода колонки 3.
ФИГ. 13 представляет собой график УФ-профиля в реальном времени колонок Capto-S в течение ограниченного временного интервала. Черная пунктирная линия представляет Уф-поглощение подпитки, каждый третий пик каждых трех пиков представляет УФ-поглощение выхода колонки 1, каждый второй пик каждых трех пиков представляет УФ-поглощение выхода колонки 2, каждый первый пик каждых трех пиков представляет УФ-поглощение выхода колонки 3.
ФИГ. 14 представляет собой график УФ-профиля в реальном времени Sartobind Q-мембраны в течение ограниченного временного интервала.
ФИГ. 15 представляет собой электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия эталонного количества рекомбинантного моноклонального антитела (дорожка 1), и элюата системы две-PCC, полученного в дни продуцирования 1, 10, 15, 20, 25, 30 или 31 (дорожки 3-9, соответственно).
ФИГ. 16 представляет собой набор графиков, демонстрирующих концентрацию белка (мг/мл), процент агрегации, эффективность (по сравнению с контролем), концентрацию остаточного протеина A (нг/мг), и концентрацию белка клетки-хозяина (нг/мг) в продукте, элюированном из системы две-PCC в течение суммарно 31 и 25 партий двойной системы. Дисперсия, ассоциированная с агрегацией, и измерения остаточного протеина A были вызваны неоптимизированной операцией с Q-мембраной. Однако тенденции были сравнимы между периодическим и непрерывным процессами. Все результаты выше находятся внутри аналитической дисперсии.
Подробное описание
В данном документе предлагаются интегрированные полностью непрерывные способы производства терапевтического белкового лекарственного вещества. Эти способы включают, например, получение жидкой культуральной среды, содержащей рекомбинантный терапевтический белок, который по существу свободен от клеток, где жидкая культуральная среда подается в первую многоколоночную хроматографическую систему (MCCS1). Следующая стадия включает в себя захват рекомбинантного терапевтического белка в жидкой культуральной среде с использованием MCCS1. Следующие стадии включают в себя непрерывную подпитку элюата MCCS1, содержащий рекомбинантный терапевтический белок, во вторую многоколоночную хроматографическую систему (MCCS2); и очистку и доочистку белка с использованием MCCS2. Полученный в результате элюат из MCCS2 считается терапевтическим белковым лекарственным веществом. Способы интегрированы и могут осуществляться непрерывно, начиная от жидкой культуральной среды до получения элюата из MCCS2, который представляет собой терапевтическое белковое лекарственное вещество. Также в данном документе предлагаются системы биологического производства, которые также могут использоваться для осуществления этих методов.
Системы биологического производства
В настоящей спецификации предлагаются типичные системы биологического производства, применяемые для осуществления способов, описанных в данном документе. Например, применяемые системы могут включать первую многоколоночную хроматографическую систему (MCCS), которая включает вход, и вторую MCCS, которая включает выход. В данных системах первая и вторая MCCS находятся в жидкостном сообщении друг с другом. Системы также сконфигурированы так, что жидкость может проходить во вход черед первую и вторую MCCS и покидать систему производства через выход.
Системы, описанные в данном документе, обеспечивают эффективное по времени получение терапевтического лекарственного вещества из жидкой культуральной среды. Например, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) на выходе второй MCCS, может составлять, например, примерно от 4 часов примерно до 48 часов, включая, например, примерно от 4 часов примерно до 40 часов, примерно от 4 часов примерно до 35 часов, примерно от 4 часов примерно до 30 часов, примерно от 4 часов примерно до 28 часов, примерно от 4 часов примерно до 26 часов, примерно от 4 часов примерно до 24 часов, примерно от 4 часов примерно до 22 часов, примерно от 4 часов примерно до 20 часов, примерно от 4 часов примерно до 18 часов, примерно от 4 часов примерно до 16 часов, примерно от 4 часов примерно до 14 часов, примерно от 4 часов примерно до 12 часов, примерно от 6 часов примерно до 12 часов, примерно от 8 часов примерно до 12 часов, примерно от 6 часов примерно до 20 часов, примерно от 6 часов примерно до 18 часов, примерно от 6 часов примерно до 14 часов, примерно от 8 часов примерно до 16 часов, примерно от 8 часов примерно до 14 часов, примерно от 8 часов примерно до 12 часов, примерно от 10 часов примерно до 20 часов, примерно от 10 часов примерно до 18 часов, примерно от 10 часов примерно до 16 часов, примерно от 10 часов примерно до 14 часов, примерно от 12 часов примерно до 14 часов, примерно от 10 часов примерно до 40 часов, примерно от 10 часов примерно до 35 часов, примерно от 10 часов примерно до 30 часов, примерно от 10 часов примерно до 25 часов, примерно от 15 часов примерно до 40 часов, примерно от 15 часов примерно до 35 часов, примерно от 15 часов примерно до 30 часов, примерно от 20 часов примерно до 40 часов, примерно от 20 часов примерно до 35 часов или примерно от 20 часов примерно до 30 часов, включительно. В другом примере, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) на выходе второй MCCS составляет, например, более чем примерно 4 часа и менее чем примерно 40 часов, включительно, например, более чем примерно 4 часа и менее чем примерно 39 часов, примерно 38 часов, примерно 37 часов, примерно 36 часов, примерно 35 часов, примерно 34 часа, примерно 33 часа, примерно 32 часа, примерно 31 час, примерно 30 часов, примерно 29 часов, примерно 28 часов, примерно 27 часов, примерно 26 часов, примерно 25 часов, примерно 24 часа, примерно 23 часа, примерно 22 часа, примерно 21 час, примерно 20 часов, примерно 19 часов, примерно 18 часов, примерно 17 часов, примерно 16 часов, примерно 15 часов, примерно 14 часов, примерно 13 часов, примерно 12 часов, примерно 11 часов, примерно 10 часов, примерно 9 часов, примерно 8 часов, примерно 7 часов, примерно 6 часов, примерно 5 часов или примерно 4,5 часа, включительно.
Некоторые типичные системы не содержат буферной емкости. Другие системы могут содержать максимум 1, 2, 3, 4 или 5 буферных емкостей во всей системе. Любая из систем, описанных в данном документе, может содержать, например, максимум 1, 2, 3, 4 или 5 буферных емкостей во всей системе, где каждая буферная емкость сдержит терапевтический белок в течение суммарного периода времени, например, примерно от 5 примерно до 6 часов, включительно, например, примерно от 5 минут примерно до 5 часов, примерно до 4 часов, примерно до 3 часов, примерно до 2 часов, примерно до 1 часа, или примерно до 30 минут, включительно. Буферные емкости, описанные в данном документе, могут обладать емкостью, которая составляет от 1 мл примерно до 300 мл, включительно, примерно от 1 мл примерно до 280 мл, примерно до 260 мл, примерно до 240 мл, примерно до 220 мл, примерно до 200 мл, примерно до 180 мл, примерно до 160 мл, примерно до 140 мл, примерно до 120 мл, примерно до 100 мл, примерно до 80 мл, примерно до 60 мл, примерно до 40 мл, примерно до 20 мл, или примерно до 10 мл, включительно. Любая буферная емкость, расположенная в системе, так что жидкость входит в буферную емкость перед входом в MCCS1, может иметь способность, которая составляет примерно от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки MCCS1. Любая буферная емкость, расположенная в системе, так что жидкость входит в буферную емкость перед входом в MCCS2 (и после выхода из MCCS1), может иметь способность, которая составляет примерно от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки MCCS2.
Типовая система
Частный пример системы 1, применяемой в настоящем изобретении, представлен на ФИГ. 1. Система 1 включает первую MCCS, т.e., четырехколоночную PCCS 2, где три из четырех колонок 3, 4, и 5 в четырехколоночной PCCS 2 осуществляют типовой процесс захвата рекомбинантного терапевтического белка из жидкости, содержащей рекомбинантный терапевтический белок, из жидкости, содержащей рекомбинантный терапевтический (например, жидкая культуральная среда, которая по существу свободна от клеток млекопитающих), и одна из колонок 6 в PCCS 2 осуществляет типовой процесс инактивации вирусов, присутствующих в элюате из колонок 3, 4, и 5 в PCCS 2, содержащем рекомбинантный терапевтический белок. Колонки 3, 4, и 5 могут содержать смолу, которая применяет механизм захвата протеином А. Колонка 6 способна поддерживать жидкость при pH около 3,75 в течение около 1 часа. PCCS 1 также имеет вход 7. Вход 7 может представлять собой, например, отверстие, которое связывает вход жидкости в PCCS 1.
Система 1 также включает вторую MCCS, которая представляет собой PPCS 8, которая включает три хроматографические колонки 9, 10, и 11 и одну хроматографическую мембрану 12. Колонки 9, 10, и 11 в PCCS 8 могут содержать катионообменную смолу. Хроматографическая мембрана 12 в PCCS 8 может содержать катионообменную смолу. PCCS 8 также имеет жидкостной трубопровод 13, расположенный между колонками 9, 10, и 11 в PCCS 8 и хроматографической мембраной 12 в PCCS 8. PCCS 8 также содержит встроенный резервуар регуляции буфера 14, который находится в жидкостном сообщении с жидкостным трубопроводом 13, и который сконфигурирован так, буфер, содержащийся во встроенном резервуаре регуляции буфера 14, вводится в жидкость, присутствующую в трубопроводе 13. PCCS 8 также включает выход 15. Выход 15 может представлять собой, например, отверстие, которое дает возможность выхода жидкости из PCCS 8.
Система 1 может дополнительно включать жидкостной трубопровод 16, расположенный между PCC1 2 и PCC2 8. Система 1 также содержит встроенный резервуар регуляции буфера 17, который находится в жидкостном сообщении с жидкостным трубопроводом 16, и который сконфигурирован так, буфер, содержащийся во встроенном резервуаре регуляции буфера 17, вводится в жидкость, присутствующую в трубопроводе 16. Система 1 также может включать фильтр 18, расположенный в жидкостном трубопроводе 16, для фильтрации жидкости в жидкостном трубопроводе 16. Система 1 также может включать вторую буферную емкость 19, расположенную в жидкостном трубопроводе 16 и сконфигурированную для содержания любой жидкости в жидкостном трубопроводе 11, которая не может легко подаваться в PCCS 8.
Система 1 может дополнительно включать систему насосов 20, которая находится в жидкостном сообщении со входом 7. Система насосов 20 может включать насос 21 для прокачивания жидкости во вход 7. Система 1 также может включать жидкостной трубопровод 22, расположенный между насосом 21 и входом 7. Система 1 также может включать фильтр 23, расположенный в жидкостном трубопроводе 22, для фильтрации жидкости (например, жидкой культуральной среды), присутствующей в жидкостном трубопроводе 22. Система 1 также может включать буферную емкость 24, расположенную в жидкостном трубопроводе 22, сконфигурированную так, что буферная емкость 24 находится в жидкостном сообщении с жидкостным трубопроводом 22 и способна хранить любую жидкость, присутствующую в жидкостном трубопроводе 22, которая не способна поступить на вход 7.
Система 1 также может включать биореактор 25 и жидкостной трубопровод 26, расположенный между биореактором 25 и насосом 21. Система фильтрации 27 может располагаться в жидкостном трубопроводе 26 для фильтрации (например, для удаления клеток) из жидкой культуральной среды, присутствующей в жидкостном трубопроводе 26.
Дополнительные типовые структуры и признаки системы
Первая MCCS включает вход, через который жидкость (например, жидкая культуральная среда, которая по существу свободна от клеток) может проходить в первую MCCS. Вход может представлять собой любую структуру, известную в данной области для таких целей. Она может включать, например, резьбу, гофрировку или уплотнение, которое дает возможность жидкостному трубопроводу вставляться так, что после вставки жидкостного трубопровода во вход, жидкость будет поступать в первую MCCS через вход без значительной утечки жидкости из входа. Частные примеры входов, которые могут использоваться в настоящих системах, известны и понятны специалистам в данной области.
Первая MCCS
Первая MCCS включает, по меньшей мере, две хроматографические колонки, по меньшей мере, две хроматографические мембраны или, по меньшей мере, одну хроматографическую колонку и, по меньшей мере, одну хроматографическую мембрану и вход. Например, первая MCCS может включать суммарно четыре хроматографические колонки или три хроматографические колонки и одну хроматографическую мембрану, или любые другие типовые MCCS, описанные в данном документе, или имеют один или несколько типовых признаков MCCS (в любой комбинации), описанных в данном документе. Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), присутствующие в первой MCCS, могут иметь одну или несколько любых типовых форм, размеров, объемов (объем слоя), и/или типовых процессов, описанных в данном документе.
Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), присутствующие в первой MCCS, могут содержать одну или несколько любых типовых смол, описанных в данном документе или известных в данной области. Например, смола, содержащаяся в одной или в нескольких хроматографических колонках и/или хроматографических мембранах, присутствующих в первой MCCS, может представлять собой смолу, которая применяет механизм захвата (например, механизм захвата протеином A, механизм захвата протеином G, механизм захвата со связыванием с антителом или с антительным фрагментом, механизм захвата со связыванием с субстратом, механизм захвата со связыванием с кофактором, механизм захвата со связыванием с аптамером и/или механизм захвата со связыванием с меткой). Смола, содержащаяся в одной или в нескольких хроматографических колонках и/или в хроматографических мембранах первой MCCS, может представлять собой катионоообменную смолу, анионообменную смолу, смолу для молекулярного сита или смолу гидрофобного взаимодействия или любую их комбинацию. Дополнительные примеры смол, которые могут использоваться для очистки рекомбинантного терапевтического белка, известны в данной области и могут содержаться в одной или в нескольких хроматографических колонках и/или в хроматографических мембранах, присутствующих в первой MCCS. Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), присутствующие в первой MCCS, могут содержать одинаковые и/или различные смолы, (например, любая из смол, описанных в данном документе или известных в данной области для применения в очистке рекомбинантного белка).
Две или более хроматографических колонок и/или хроматографических смол, присутствующих в первой MCCS, могут осуществлять одну или несколько типовых процессов (например, захват рекомбинантного терапевтического белка, очистка рекомбинантного терапевтического белка, инактивация вирусов, регуляция ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок, фильтрация жидкости, содержащей рекомбинантный терапевтический белок). В частных примерах первая MCCS может осуществлять типовые процессы захвата рекомбинантного терапевтического белка из жидкости (например, жидкой культуральной среды) и инактивации вирусов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок. Первая MCCS может осуществлять любые комбинации из двух или более типовых процессов, описанных в данном документе или известных в данной области.
Хроматографические колонки и/или хроматографические мембраны, присутствующие в первой MCCS, могут быть соединены по отношению друг к другу путем механизма переключения (например, механизма переключения колонок). Первая MCCS также может включать один или несколько (например, два, три, четыре или пять) насосов (например, автоматизированных, например, автоматизированных перистальтических насоса). Процессы переключения колонок могут запускаться детектированием уровня рекомбинантного терапевтического белка, детектируемого с помощью УФ-поглощения, соответствующего определенному уровню рекомбинантного терапевтического белка в жидкости, проходящей через первую MCCS (например, ввод в и/или элюирование из одной или нескольких хроматографических колонок и/или хроматографических мембран в первой MCCS), конкретного объема жидкости (например, буфера), или конкретного затраченного времени. Переключение колонок, как правило, означает механизм, с помощью которого, по меньшей мере, две различные хроматографические колонки и/или хроматографические мембраны в MCCS (например, две или более различные хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS (например, в первой или во второй MCCS)) имеют возможность проходить через различные стадии (например, уравновешивание, загрузка, элюция или промывка) по существу одновременно во время, по меньшей мере, части процесса.
Первая MCCS может представлять собой Периодическую Противоточную хроматографическую систему (PCCS). Например, PCCS, которая представляет собой первую MCCS, может включать четыре хроматографические колонки, где первые три колонки осуществляют типовой процесс захвата рекомбинантного терапевтического белка из жидкости (например, из жидкой культуральной среды), и четвертая колонка PCCS осуществляет типовой процесс инактивации вирусов в жидкости, содержащей рекомбинантный терапевтический белок. PCCS, которая представляет собой первую MCCS, может применять механизм переключения колонок. Система PCC может применять модифицированную систему ÄKTA (GE Healthcare, Piscataway, NJ), способную прогонять до, например, четырех, пяти, шести, семи или восьми колонок или более.
Первая MCCS может быть оборудована: одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) УФ-мониторами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) клапанами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) pH-метрами, и/или одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) кондуктометрами. Первая MCCS также может быть оборудована операционной системой, которая применяет программное обеспечение (например, программное обеспечение на основе Unicorn, GE Healthcare, Piscataway, NJ) для телеметрии того, когда произойдет событие переключения колонок (например, на основе УФ-поглощения, объема жидкости или затраченного времени) и воздействия (включения триггера) на события переключения колонок. В примерах, где MCCS включает в себя один или несколько УФ-детекторов, УФ-детекторы необязательно могут размещаться на входе одной или нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) хроматографических колонок и/или хроматографических мембран в первой MCCS, и/или на выходе одной или нескольких хроматографических колонок и/или хроматографических мембран в первой MCCS.
Первая MCCS может дополнительно включать один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три, или двадцать четыре) встроенных резервуара регуляции буфера и/или буферных резервуара. В других примерах, первая MCCS может включать одну или несколько (например, два, три, четыре, пять, или шесть) буферных емкостей (например, любая из буферных емкостей описанных в данном документе), которые могут содержать жидкость, которая не может легко проходить в одну или несколько хроматографических колонок и/или хроматографических мембран в первой MCCS. Системы, описанные в данном документе могут содержать одну или несколько буферных емкостей (например, буферную емкость, описанную в данном документе) в первой и/или второй MCCS. Другие примеры систем, описанных в данном документе, не включают буферный танк в первой MCCS или во второй MCCS, или не включают буферный танк во всей системе. Другие примеры систем, описанных в данном документе, включают максимум одну, две, три, четыре или пять буферных емкостей (например, любую буферную емкость, описанную в данном документе) во всей системе.
Вторая MCCS
Вторая MCCS включает, по меньшей мере, две хроматографические колонки, по меньшей мере, две хроматографические мембраны или, по меньшей мере, одну хроматографическую колонку и, по меньшей мере, одну хроматографическую мембрану и выход. Например, вторая MCCS может включать суммарно четыре хроматографические колонки или три хроматографические колонки и одну хроматографическую мембрану, или любые другие типовые MCCS, описанные в данном документе, или имеют один или несколько типовых признаков MCCS (в любой комбинации), описанных в данном документе. Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), присутствующие во второй MCCS, могут иметь один или несколько признаков из следующих: любые типовые формы, размеры, объемы (объем слоя), и/или типовые процессы, описанные в данном документе. Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), могут содержать любую из типовых смол, описанных в данном документе или известных в данной области. Например, смола, содержащаяся в одной или в нескольких хроматографических колонках и/или хроматографических мембранах, присутствующих во второй MCCS, может представлять собой смолу, которая применяет механизм захвата (например, механизм захвата протеином A, механизм захвата протеином G, механизм захвата со связыванием с антителом или с антительным фрагментом, механизм захвата со связыванием с субстратом, механизм захвата со связыванием с кофактором, механизм захвата со связыванием с аптамером и/или механизм захвата со связыванием с меткой). Применяемые смолы включают, например, катионообменную смолу, анионообменную смолу, смолу для молекулярного сита и смолу гидрофобного взаимодействия. Дополнительные примеры смол известны в данной области. Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), присутствующие во второй MCCS, могут содержать одинаковые и/или различные смолы, (например, любая из смол, описанных в данном документе или известных в данной области для применения в очистке рекомбинантного белка).
Хроматографическая колонка(и) и/или хроматографическая мембрана(ы), присутствующие во второй MCCS, могут осуществлять один или несколько типовых процессов (например, любой из типовых процессов, описанных в данном документе или любую комбинацию типовых процессов, описанных в данном документе). В частных примерах вторая MCCS может осуществлять типовые процессы очистки рекомбинантного терапевтического белка из жидкости и доочистку рекомбинантного терапевтического белка, присутствующего в жидкости, содержащей рекомбинантный терапевтический белок. В частных примерах вторая MCCS может осуществлять типовые процессы очистки рекомбинантного терапевтического белка, присутствующего в жидкости, доочистку рекомбинантного терапевтического белка, присутствующего в жидкости, и фильтрацию жидкости, содержащей рекомбинантный терапевтический белок. В других частных примерах вторая MCCS может осуществлять типовые процессы очистки рекомбинантного терапевтического белка, присутствующего в жидкости, доочистку рекомбинантного терапевтического белка, присутствующего в жидкости, фильтрацию жидкости, содержащей рекомбинантный терапевтический белок, и регуляцию ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок. Вторая MCCS может осуществлять любую комбинацию из двух или более типовых процессов, описанных в данном документе или известных в данной области.
Хроматографические колонки и/или хроматографические мембраны, присутствующие во второй MCCS, могут быть соединены по отношению друг к другу путем механизма переключения (например, механизма переключения колонок). Вторая MCCS также может включать один или несколько (например, два, три, четыре или пять) насосов (например, автоматизированных, например, автоматизированных перистальтических насоса). Процессы переключения колонок могут запускаться детектированием уровня рекомбинантного терапевтического белка, детектируемого с помощью УФ-поглощения, соответствующего определенному уровню рекомбинантного терапевтического белка в жидкости, проходящей через вторую MCCS (например, ввод в и/или элюирование из одной или нескольких хроматографических колонок и/или хроматографических мембраны второй MCCS), конкретного объема жидкости (например, буфера), или конкретного затраченного времени.
Вторая MCCS может представлять собой Периодическую Противоточную Хроматографическую систему (PCCS). Например, PCCS, которая представляет собой вторую MCCS, может содержать три колонки, которые осуществляют типовой процесс очистки рекомбинантного терапевтического белка из жидкости, и хроматографическую мембрану, которая осуществляет типовой процесс доочистки рекомбинантного терапевтического белка, присутствующего в жидкости. Например, три колонки, которые осуществляют типовой процесс очистки рекомбинантного белка из жидкости, могут содержать, например, катионообменную смолу, и хроматографическая мембрана, которая осуществляет типовой процесс доочистки, может содержать катионообменную смолу. PCCS, которая представляет собой вторую MCCS, может применять механизм переключения колонок. Система PCC может применять модифицированную систему ÄKTA (GE Healthcare, Piscataway, NJ), способную прогонять,
например, до четырех, пяти, шести, семи или восьми колонок или более.
Вторая MCCS может быть оборудована: одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) УФ-мониторами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) клапанами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) pH-метрами, и/или одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) кондуктометрами. Вторая MCCS также может быть оборудована операционной системой, которая применяет программное обеспечение (например, программное обеспечение на основе Unicorn, GE Healthcare, Piscataway, NJ) для телеметрии того, когда произойдет событие переключения колонок (например, на основе УФ-поглощения, объема жидкости или затраченного времени) и воздействия на события переключения колонок. В примерах, где вторая MCCS включает один или несколько УФ-детекторов, УФ-детекторы необязательно могут размещаться на входе одной или нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) хроматографических колонок и/или хроматографических мембран во второй MCCS, и/или на выходе одной или нескольких хроматографических колонок и/или хроматографических мембран во второй MCCS.
Вторая MCCS может дополнительно включать один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три, или двадцать четыре) встроенных резервуара регуляции буфера и/или буферных резервуара. В других примерах, вторая MCCS может включать одну или несколько (например, две, три, четыре, пять, или шесть) буферных емкостей (например, любая из буферных емкостей, описанных в данном документе), которые могут содержать жидкость, которая не может легко проходить в одну или несколько хроматографических колонок и/или хроматографических мембран во второй MCCS.
Вторая MCCS включает выход, через который терапевтическое белковое лекарственное вещество может выходить из системы. Выход может включать, например, резьбу, гофрировку или уплотнение, которые дают возможность вставляться жидкостному трубопроводу, или выход может включать сосуд, сконструированный для содержания или хранения терапевтического белкового лекарственного вещества. Выход может содержать поверхность, которая может использоваться для герметизации стерильного сосуда или другого контейнера для хранения на выходе с целью дать возможность рекомбинантному белковому продукту протекать непосредственно в стерильный сосуд или в контейнер для хранения. Частные примеры выходов, которые могут использоваться в настоящих системах, известны и понятны специалистам в данной области.
Системы, описанные в данном документе также могут включать жидкостной трубопровод, расположенный между первой MCCS и второй MCCS. Любой из жидкостных трубопроводов, описанных в данном документе, может представлять собой, например, трубку, которая сделана, например, из полиэтилена, поликарбоната или пластика. Жидкостной трубопровод, расположенный между первой MCCS и второй MCCS, может дополнительно включать один или несколько из следующих компонентов в любой комбинации: один или несколько встроенных резервуаров регуляции буфера, которые находятся в жидкостном сообщении с жидкостным трубопроводом и располагаются так, что буфер, хранящийся внутри встроенного резервуара для регуляции буфера, добавляется к жидкости, присутствующей в жидкостном трубопроводе; буферная емкость (например, любая из буферных емкостей, описанных в данном документе), которая находится в жидкостном сообщении с жидкостным трубопроводом и располагается так, что она может содержать жидкость, присутствующую в жидкостном трубопроводе, которая не может легко подаваться во вторую MCCS; и один или несколько фильтров, которые располагаются в жидкостном трубопроводе так, что они способны к фильтрации (например, к удалению бактерий) жидкости, расположенной в жидкостном трубопроводе. Любой из встроенных резервуаров для регуляции буфера может содержать, например, объем примерно от 0,5 л до 50 л буфера (например, при температуре, равно или ниже 25°C, 15°C или 10°C).
Системы, описанные в данном документе, необязательно могут включать жидкостной трубопровод, расположенный между конечной хроматографической колонкой или хроматографической мембраной во второй MCCS и выходом. Системы, описанные в данном документе, могут дополнительно включать один или несколько фильтров в жидкостном сообщении с жидкостным трубопроводом, расположенным между конечной хроматографической колонкой или хроматографической мембраной во второй MCCS и выходом, так что фильтр может удалять, например, осажденный материал, твердые частицы или бактерии из жидкости, присутствующей в жидкостном трубопроводе, расположенном между хроматографической колонкой или хроматографической мембраной в конечной хроматографической колонке или хроматографической мембране во второй MCCS и выходом.
Некоторые примеры систем, предлагаемых в данном документе, также включают биореактор, который находится в жидкостном сообщении со входом первой MCCS. Любой из типовых биореакторов, описанных в данном документе или известных в данной области, может использоваться в настоящих системах.
Некоторые примеры систем, предлагаемых в данном документе, также включают систему насосов. Система насосов может включать один или несколько из следующих компонентов: один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять или десять) насосов (например, любой из насосов, описанных в данном документе или известных в данной области), один или несколько фильтров (например, два, три, четыре или пять) (например, любой из фильтров, описанных в данном документе или известных в данной области), один или несколько УФ-детекторов (например, два, три, четыре, пять, шесть, семь, восемь, девять или десять), и одну или несколько буферных емкостей (например, две, три, четыре, пять, шесть, семь, восемь, девять или десять) (например, любая из емкостей, описанных в данном документе или известных в данной области) Некоторые примеры систем, предлагаемых в данном документе, дополнительно включают жидкостной трубопровод, расположенный между насосом и входом в первой MCCS (например, любой из типовых жидкостных трубопроводов, описанных в данном документе или известных в данной области). В некоторых примерах, данный конкретный жидкостной трубопровод может включать один или несколько (например, два, три или четыре) насосов (например, любой из насосов, описанных в данном документе или известных в данной области) и/или одну или несколько (например, две, три или четыре) буферных емкостей (например, любая из типовых буферных емкостей, описанных в данном документе), где эти насос(ы) и/или буферная емкость(и) находятся в жидкостном сообщении в жидкостном трубопроводе.
Некоторые примеры систем, описанных в данном документе, дополнительно включают дополнительный жидкостной трубопровод, соединенный с жидкостным трубопроводом между насосом и входом, где один конец дополнительного жидкостного трубопровода имеет жидкостное сообщение с биореактором, а другой конец имеет жидкостное сообщение с жидкостным трубопроводом между насосом и входом. Данный дополнительный жидкостной трубопровод может включать фильтр, который способен удалять клетки из жидкой культуральной среды, удаляемой из биореактора (например, ATF-система сохранения клеток).
Система, предлагаемая в данном документе, дает возможность непрерывного получения терапевтического белкового лекарственного вещества. Например, системы, предлагаемые в данном документе, дают возможность процентного выхода рекомбинантного терапевтического белка (начиная от исходного материала, например, начиная от жидкой культуральной среды), составляющего выше чем примерно 70%, выше чем примерно 80%, выше чем примерно 82%, выше чем примерно 84%, выше чем примерно 86%, выше чем примерно 88%, выше чем примерно 90%, выше чем примерно 92%, выше чем примерно 94%, выше чем примерно 96%, или выше чем примерно 98%. Системы, описанные в данном документе, также могут приводить к получению процентного выхода рекомбинантного терапевтического белка (от исходного материала, например, исходной жидкой культуральной среды) примерно от 80% примерно до 90%, примерно от 82% примерно до 90%, примерно от 84% примерно до 90%, примерно от 84% примерно до 88%, примерно от 84% примерно до 94%, примерно от 82% примерно до 92%, или примерно от 85% примерно до 95%.
Системы, описанные в данном документе, также могут приводить в результате к получению терапевтического белкового лекарственного вещества, которое содержит концентрацию рекомбинантного терапевтического белка, которая составляет более чем примерно 1 мг/мл, более чем примерно 1,5 мг/мл, более чем примерно 2 мг/мл, более чем примерно 2,5 мг/мл, более чем примерно 3 мг/мл, более чем примерно 3,5 мг/мл, более чем примерно 4 мг/мл, более чем примерно 4,5 мг/мл, более чем примерно 5 мг/мл, более чем примерно 5,5 мг/мл, более чем примерно 6 мг/мл, более чем примерно 6,5 мг/мл, более чем примерно 7 мг/мл, более чем примерно 7,5 мг/мл, более чем примерно 8 мг/мл, более чем примерно 8,5 мг/мл, более чем примерно 9 мг/мл, более чем примерно 10 мг/мл, более чем примерно 12,5 мг/мл или более чем примерно 15 мг/мл. Как известно в данной области системы могут обеспечивать периодическую элюцию терапевтического белкового лекарственного вещества. Терапевтическое белковое лекарственное вещество может быть элюировано из любой из систем, описанных в данном документе, в течение периода времени продолжительностью примерно от 30 секунд примерно до 5 часов (например, примерно от 1 минут примерно до 4 часов, примерно от 1 минуты примерно до 3 часов, примерно от 1 минуты примерно до 2 часов, примерно от 1 минуты или примерно до 1.5 часов, примерно от 1 минуты примерно до 1 часа, примерно от 1 минут примерно до 30 минут) с частотой, например, примерно от 1 минуты примерно до 6 часов (например, примерно от 1 минуты примерно до 5 часов, примерно от 1 минуты примерно до 4 часов, примерно от 1 минуты примерно до 3 часов, примерно от 1 минуты до 2 часов, примерно от 1 минуты до 1 часа, или примерно от 1 минуты до 30 минут), в зависимости от, например, хроматографических колонок и/или хроматографических мембран, используемых в первой и во второй MCCS.
Системы, описанные в данном документе, также могут приводить в результате к чистому выходу рекомбинантного терапевтического белка в терапевтическое белковое лекарственное вещество, которые составляет, по меньшей мере, примерно, 5 г/день, по меньшей мере, примерно 6 г/день, по меньшей мере, примерно 7 г/день, по меньшей мере, примерно 8 г/день, по меньшей мере, примерно 9 г/день, по меньшей мере, примерно 10 г/день, по меньшей мере, примерно 11 г/день, по меньшей мере, примерно 12 г/день, по меньшей мере, примерно 13 г/день, по меньшей мере, примерно 14 г/день, по меньшей мере, примерно 15 г/день, по меньшей мере, примерно 16 г/день, по меньшей мере, примерно 17 г/день, по меньшей мере, примерно 18 г/день, по меньшей мере, примерно 19 г/день, по меньшей мере, примерно 20 г/день, по меньшей мере, примерно 25 г/день, по меньшей мере, примерно 30 г/день, по меньшей мере, примерно 35 г/день, или, по меньшей мере, примерно 40 г/день в течение продолжительного периода, составляющего, по меньшей мере, примерно 5 дней, по меньшей мере, примерно 10 дней, по меньшей мере, примерно 15 дней, по меньшей мере, примерно 20 дней, по меньшей мере, примерно 25 дней, по меньшей мере, примерно 30 дней, по меньшей мере, примерно 35 дней, по меньшей мере, примерно 40 дней, по меньшей мере, примерно 45 дней, по меньшей мере, примерно 50 дней, по меньшей мере, примерно 55 дней, по меньшей мере, примерно 60 дней, по меньшей мере, примерно 65 дней, по меньшей мере, примерно 70 дней, по меньшей мере, примерно 75 дней, по меньшей мере, примерно 80 дней, по меньшей мере, примерно 85 дней, по меньшей мере, примерно 90 дней, по меньшей мере, примерно 95 дней, по меньшей мере, примерно 100 дней, по меньшей мере, примерно 110 дней, по меньшей мере, примерно 120 дней, по меньшей мере, примерно 130 дней, по меньшей мере, примерно 140 дней, по меньшей мере, примерно 150 дней, по меньшей мере, примерно 160 дней, по меньшей мере, примерно 170 дней, по меньшей мере, примерно 180 дней, по меньшей мере, примерно 190 дней, по меньшей мере, примерно 200 дней, по меньшей мере, примерно 210 дней, по меньшей мере, примерно 220 дней, по меньшей мере, примерно 230 дней, по меньшей мере, примерно 240 дней, по меньшей мере, примерно 250 дней, по меньшей мере, примерно 260 дней, по меньшей мере, примерно 270 дней, по меньшей мере, примерно 280 дней, по меньшей мере, примерно 290 дней, по меньшей мере, примерно 300 дней, по меньшей мере, примерно 310 дней, по меньшей мере, примерно 320 дней, по меньшей мере, примерно 330 дней, по меньшей мере, примерно 340 дней, по меньшей мере, примерно 350 дней, или по меньшей мере, примерно 365 дней.
Системы, описанные в данном документе, также могут непрерывно получать рекомбинантное белковое лекарственное вещество, которое содержит рекомбинантный терапевтический белок, обладающий существенно улучшенной производительностью (по сравнению с другими белковыми рекомбинантными лекарственными веществами, полученными с использованием других способов или систем). Например, системы настоящего изобретения могут достигать специфической производительности (в рекомбинантном белковом лекарственном веществе), которая, по меньшей мере, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз, 110 раз, 120 раз, 130 раз, 140 раз, 150 раз, 160 раз, 170 раз, 180 раз, 190 раз или в 200 раз выше, чем специфическая производительность в рекомбинантном белковом лекарственном веществе, полученном с использованием других способов или систем (например, очистка на установке периодического действия или процесс, который не является интегрированным и/или непрерывным). Продуктивность в рекомбинантном белковом лекарственном веществе, достигаемая с помощью настоящих систем, может составлять, по меньшей мере, 10000 единиц/л, по меньшей мере, 15000 единиц/л, по меньшей мере, примерно 20000 единиц/л, по меньшей мере, примерно 25000 единиц/л по меньшей мере, примерно 30000 единиц/л, по меньшей мере, примерно 35000 единиц/л или по меньшей мере, примерно 40000 единиц/л (в первой и/или во второй жидкой культуральной среде). Продуктивность в рекомбинантном белковом лекарственном веществе, достигаемая с помощью настоящих систем, может составлять, по меньшей мере, 1 г/л, по меньшей мере, 1,5 г/л, по меньшей мере, 2 г/л, по меньшей мере, 2,5 г/л, по меньшей мере, 3,0 г/л, по меньшей мере, 4,0 г/л, по меньшей мере, 4,5 г/л, или, по меньшей мере, 5 г/л
Системы биологического производства с двумя или более подсистемами
Также предлагаются системы биологического производства, которые включают две или более подсистем, каждая из которых включает: (i) первую многоколоночную хроматографическую систему (MCCS), содержащую вход (например, любую из типовых первых MCCS, описанных в данном документе); и (ii) вторую MCCS, содержащую выход (например, любую из типовых вторых MCCS, описанных в данном документе), где первая и вторая MCCS находятся в жидкостном сообщении друг с другом и где система производства сконфигурирована так, что жидкость может поступать на вход через первую и вторую MCCS, и покидать систему производства через выход, где две или более подсистем сконфигурированы так, что каждая находится в жидкостном сообщении с одиночным резервуаром, содержащим жидкость (например, с биореактором), и жидкость из одиночного резервуара поступать на вход двух или более подсистем.
Каждая из подсистем может обеспечивать непрерывное и эффективное по затратам времени получение терапевтического лекарственного вещества из жидкой культуральной среды. Например, время, затраченное для каждой подсистемы между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) на выходе второй MCCS, может составлять, например, примерно от 4 часов примерно до 48 часов, включая, например, примерно от 4 часов примерно до 40 часов, примерно от 4 часов примерно до 35 часов, примерно от 4 часов примерно до 30 часов, примерно от 4 часов примерно до 28 часов, примерно от 4 часов примерно до 26 часов, примерно от 4 часов примерно до 24 часов, примерно от 4 часов примерно до 22 часов, примерно от 4 часов примерно до 20 часов, примерно от 4 часов примерно до 18 часов, примерно от 4 часов примерно до 16 часов, примерно от 4 часов примерно до 14 часов, примерно от 4 часов примерно до 12 часов, примерно от 6 часов примерно до 12 часов, примерно от 8 часов примерно до 12 часов, примерно от 6 часов примерно до 20 часов, примерно от 6 часов примерно до 18 часов, примерно от 6 часов примерно до 14 часов, примерно от 8 часов примерно до 16 часов, примерно от 8 часов примерно до 14 часов, примерно от 8 часов примерно до 12 часов, примерно от 10 часов примерно до 20 часов, примерно от 10 часов примерно до 18 часов, примерно от 10 часов примерно до 16 часов, примерно от 10 часов примерно до 14 часов, примерно от 12 часов примерно до 14 часов, примерно от 10 часов примерно до 40 часов, примерно от 10 часов примерно до 35 часов, примерно от 10 часов примерно до 30 часов, примерно от 10 часов примерно до 25 часов, примерно от 15 часов примерно до 40 часов, примерно от 15 часов примерно до 35 часов, примерно от 15 часов примерно до 30 часов, примерно от 20 часов примерно до 40 часов, примерно от 20 часов примерно до 35 часов или примерно от 20 часов примерно до 30 часов, включительно. В других примерах, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS (подсистемы) и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) на выходе второй MCCS (подсистемы) составляет, например, более чем примерно 4 часа и менее чем примерно 40 часов, включительно, например, более чем примерно 4 часа и менее чем примерно 39 часов, примерно 38 часов, примерно 37 часов, примерно 36 часов, примерно 35 часов, примерно 34 часа, примерно 33 часа, примерно 32 часа, примерно 31 час, примерно 30 часов, примерно 29 часов, примерно 28 часов, примерно 27 часов, примерно 26 часов, примерно 25 часов, примерно 24 часа, примерно 23 часа, примерно 22 часа, примерно 21 час, примерно 20 часов, примерно 19 часов, примерно 18 часов, примерно 17 часов, примерно 16 часов, примерно 15 часов, примерно 14 часов, примерно 13 часов, примерно 12 часов, примерно 11 часов, примерно 10 часов, примерно 9 часов, примерно 8 часов, примерно 7 часов, примерно 6 часов, примерно 5 часов или примерно 4,5 часа, включительно.
Некоторые типовые подсистемы систем не включают буферную емкость. Другие включают максимум 1, 2, 3, 4 или 5 буферных емкостей во всей подсистеме. Любая из подсистем может включать максимум 1, 2, 3, 4 или 5 буферных емкостей во всей подсистеме, где каждая буферная емкость сдержит терапевтический белок в течение суммарного периода времени, например, примерно от 5 примерно до 6 часов, включительно, например, примерно от 5 минут примерно до 5 часов, примерно до 4 часов, примерно до 3 часов, примерно до 2 часов, примерно до 1 часа или примерно до 30 минут, включительно. Буферные емкости, описанные в данном документе, могут обладать емкостью, которая составляет от 1 мл примерно до 300 мл, включительно, примерно от 1 мл примерно до 280 мл, примерно до 260 мл, примерно до 240 мл, примерно до 220 мл, примерно до 200 мл, примерно до 180 мл, примерно до 160 мл, примерно до 140 мл, примерно до 120 мл, примерно до 100 мл, примерно до 80 мл, примерно до 60 мл, примерно до 40 мл, примерно до 20 мл или примерно до 10 мл, включительно. Любая буферная емкость, расположенная в подсистеме, так что жидкость входит в буферную емкость перед входом в MCCS1 (подсистемы), может иметь емкость, которая составляет примерно от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10% или примерно до 5%, включительно, от загрузочного объема первой колонки первой MCCS (подсистемы). Любая буферная емкость, расположенная в подсистеме, так что жидкость входит в буферную емкость перед входом в MCCS2 (в любой из подсистем) (и после выхода жидкости из MCCS1 подсистемы), может иметь емкость, которая составляет примерно от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки второй MCCS (подсистемы).
Любая комбинация признаков (например, тип и количество хроматографических колонок, тип и количество хроматографических мембран, объем, размер, смола и типовые процессы, скорость потока, насосы, встроенные буферные регуляторы, УФ-детекторы, один или несколько фильтров и механизмы переключения колонок) первой и второй систем MCCS, описанных выше, может быть использована в первой MCCS и во второй MCCS в двух или более подсистемах. Например, первая MCCS и вторая MCCS в двух или более подсистемах могут быть по существу одинаковыми. В других примерах, две или более подсистем являются по существу одинаковыми, как описано в системах, описанных в Примерах.
Передвижные платформы
Любая из систем биологического производства, описанных в данном документе, может располагаться на передвижной платформе. Например, система, включающая, по меньшей мере, биореактор, первую MCCS и вторую MCCS, может располагаться на одиночной передвижной платформе. В других примерах систем, описанных в данном документе, первая MCCS может располагаться на первой передвижной платформе, а вторая MCCS может располагаться на второй передвижной платформе. Дополнительные примеры любой из систем, описанных в данном документе, включают первую MCCS и вторую MCCS, расположенные на одиночной передвижной платформе, или вся система располагается на одиночной передвижной платформе.
Некоторые примеры систем биологического производства, описанных в данном документе, включают две или более подсистем, каждая из которых включает: (i) первую многоколоночную хроматографическую систему (MCCS), содержащую вход (например, любую из типовых первых MCCS, описанных в данном документе); и (ii) вторую MCCS, содержащую выход (например, любую из типовых вторых MCCS, описанных в данном документе), где первая и вторая MCCS находятся в жидкостном сообщении друг с другом и где система производства сконфигурирована так, что жидкость может поступать на вход через первую и вторую MCCS, и покидать систему производства через выход, где две или более подсистем сконфигурированы так, что каждая находится в жидкостном сообщении с одиночным резервуаром, содержащим жидкость (например, с биореактором), и жидкость из одиночного резервуара поступать на вход двух или более подсистем. В таких системах, вся система может располагаться на передвижной платформе; резервуар и одна или несколько подсистем могут располагаться на одиночной передвижной платформе; каждая из двух или более подсистем располагается на своей собственной передвижной платформе; или две или более подсистем могут располагаться на одиночной передвижной платформе. В любой из систем, описанных в данном документе, резервуар (например, пластиковый пакет), буферная емкость (например, любая буферная емкость, описанная в данном документе), или биореактор, содержащий жидкую культуральную среду, содержащую рекомбинантный терапевтический белок, может располагаться на своей собственной передвижной платформе.
Частные примеры передвижных платформ включают два или более колеса, ролик, салазки или лыжи, то есть одну или несколько структур, которые позволяют движение. Специалисту в данной области понятно, что передвижные платформы могут состоять из твердого материала (например, дерева, металла или пластика). Подходящие передвижные платформы могут быть получены из Wunderlich-Malec (Minnetonka, MN) и Renfrow Brothers (Spartenburg, SC). В системах, которые применяют более чем одну передвижную платформу, они могут быть сконструированы для совмещения между собой (например, совмещения посредством защелки, поворотного ключа, завинчивания или устройства зажима).
Интегрированные и непрерывные способы производства терапевтического белкового лекарственного вещества
В данном документе предлагаются интегрированные и непрерывные способы производства терапевтического белкового лекарственного вещества. Эти способы включают получение жидкой культуральной среды, содержащей рекомбинантный терапевтический белок, который, по существу свободен от клеток, где жидкая культуральная среда подается в первую многоколоночную хроматографическую систему (MCCS1); захват рекомбинантного терапевтического белка в жидкой культуральной среде с использованием MCCS1, где элюат MCCS1, содержащий рекомбинантный терапевтический белок непрерывно подается во вторую многоколоночную хроматографическую систему (MCCS2); и очистку и доочистку рекомбинантного терапевтического белка с использованием MCCS2, где элюат из MCCS2 представляет собой терапевтическое белковое лекарственное вещество; и где способ является интегрированным и осуществляется непрерывно, начиная от жидкой культуральной среды до получения элюата из MCCS2, который представляет собой терапевтическое белковое лекарственное вещество.
Способы, описанные в данном документе, обеспечивают непрерывное и эффективное по затрате времени получение терапевтического лекарственного вещества из жидкой культуральной среды. Например, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) из второй MCCS, может составлять, например, примерно от 4 часов примерно до 48 часов, включая, например, примерно от 4 часов примерно до 40 часов, примерно от 4 часов примерно до 35 часов, примерно от 4 часов примерно до 30 часов, примерно от 4 часов примерно до 28 часов, примерно от 4 часов примерно до 26 часов, примерно от 4 часов примерно до 24 часов, примерно от 4 часов примерно до 22 часов, примерно от 4 часов примерно до 20 часов, примерно от 4 часов примерно до 18 часов, примерно от 4 часов примерно до 16 часов, примерно от 4 часов примерно до 14 часов, примерно от 4 часов примерно до 12 часов, примерно от 6 часов примерно до 12 часов, примерно от 8 часов примерно до 12 часов, примерно от 6 часов примерно до 20 часов, примерно от 6 часов примерно до 18 часов, примерно от 6 часов примерно до 14 часов, примерно от 8 часов примерно до 16 часов, примерно от 8 часов примерно до 14 часов, примерно от 8 часов примерно до 12 часов, примерно от 10 часов примерно до 20 часов, примерно от 10 часов примерно до 18 часов, примерно от 10 часов примерно до 16 часов, примерно от 10 часов примерно до 14 часов, примерно от 12 часов примерно до 14 часов, примерно от 10 часов примерно до 40 часов, примерно от 10 часов примерно до 35 часов, примерно от 10 часов примерно до 30 часов, примерно от 10 часов примерно до 25 часов, примерно от 15 часов примерно до 40 часов, примерно от 15 часов примерно до 35 часов, примерно от 15 часов примерно до 30 часов, примерно от 20 часов примерно до 40 часов, примерно от 20 часов примерно до 35 часов, или примерно от 20 часов примерно до 30 часов, включительно. В других примерах, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в MCCS1 и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) из MCCS2 составляет, например, более чем примерно 4 часа и менее чем примерно 40 часов, включительно, например, более чем примерно 4 часа и менее чем примерно 39 часов, примерно 38 часов, примерно 37 часов, примерно 36 часов, примерно 35 часов, примерно 34 часа, примерно 33 часа, примерно 32 часа, примерно 31 час, примерно 30 часов, примерно 29 часов, примерно 28 часов, примерно 27 часов, примерно 26 часов, примерно 25 часов, примерно 24 часа, примерно 23 часа, примерно 22 часа, примерно 21 час, примерно 20 часов, примерно 19 часов, примерно 18 часов, примерно 17 часов, примерно 16 часов, примерно 15 часов, примерно 14 часов, примерно 13 часов, примерно 12 часов, примерно 11 часов, примерно 10 часов, примерно 9 часов, примерно 8 часов, примерно 7 часов, примерно 6 часов, примерно 5 часов, или примерно 4,5 часа, включительно.
Некоторые типовые способы не применяют стадию удерживания (например, не использование резервуара (например, буферной емкости) во всем способе). Другие могут использовать максимум 1, 2, 3, 4 или 5 резервуаров (например, буферных емкостей) во всем способе. Любой из способов, описанных в данном документе, может использовать максимум 1, 2, 3, 4 или 5 резервуаров (например, буферных емкостей) во всем способе, где каждая буферная емкость только удерживает терапевтический белок в течение суммарного периода времени, например, примерно от 5 примерно до 6 часов, включительно, например, примерно от 5 минут примерно до 5 часов, примерно до 4 часов, примерно до 3 часов, примерно до 2 часов, примерно до 1 часа, или примерно до 30 минут, включительно. Любой из резервуаров (например, буферные емкости), используемых в способах, описанных в данном документе, может обладать емкостью, которая составляет от 1 мл примерно до 300 мл, включительно, примерно от 1 мл примерно до 280 мл, примерно до 260 мл, примерно до 240 мл, примерно до 220 мл, примерно до 200 мл, примерно до 180 мл, примерно до 160 мл, примерно до 140 мл, примерно до 120 мл, примерно до 100 мл, примерно до 80 мл, примерно до 60 мл, примерно до 40 мл, примерно до 20 мл, или примерно до 10 мл (включительно). Любой из резервуаров (например, буферные емкости), используемых в (любом из способов, описанных в данном документе) для удерживания жидкости перед ее поступлением в первую MCCS, может иметь способность, которая составляет, например, от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки первой MCCS. Любой из резервуаров (например, буферные емкости), используемых в (любом из способов, описанных в данном документе) для удерживания жидкости перед ее поступлением во вторую MCCS, (и после того, как жидкость покидает первую MCCS), может иметь способность, которая составляет, например, от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки второй MCCS.
Различные дополнительные аспекты этих способов описаны подробно ниже и могут использоваться без ограничения в любой комбинации в способах, предлагаемых в данном документе. Типовые аспекты предлагаемых способов описаны ниже; однако специалисту в данной области понятно, что в способы, описанные в данном документе, могут быть добавлены дополнительные стадии и могут использоваться другие материалы для осуществления любой из стадий способов, описанных в данном документе.
Жидкая культуральная среда
Жидкая культуральная среда, которая содержит рекомбинантный терапевтический белок, который по существу свободен от клеток, может быть выделена из любого источника. Например, жидкая культуральная среда может быть получена из рекомбинантной клеточной культуры (например, рекомбинантной бактериальной, дрожжевой клеточной культуры или из клеточной культуры клеток млекопитающих). Жидкая культуральная среда может быть получена из подпитываемой клеточной культуры (например, клеток млекопитающих) (например, подпитываемый биореактор, содержащий культуру клеток млекопитающих, которые секретируют рекомбинантный терапевтический белок) или из перфузионной клеточной культуры (например, клеток млекопитающих) (например, перфузионный биореактор, содержащий культуру клеток млекопитающих, которые секретируют рекомбинантный терапевтический белок). Жидкая культуральная среда также может представлять собой осветленную жидкую культуральную среду из бактериальных клеток, которые секретируют рекомбинантный терапевтический белок.
Жидкая культуральная среда, полученная из рекомбинантной клеточной культуры, может фильтроваться или осветляться с получением жидкой культуральной среды, которая по существу свободна от клеток и/или вирусов. Методы фильтрации или осветления жидкой культуральной среды с целью удаления клеток известны в данной области (например, 0,2-мкм фильтрация и фильтрация с использованием системы Переменного Тангенциального Потока (ATFTM)). Рекомбинантные клетки также могут удаляться из жидкой культуральной среды с использованием центрифугирования и удаления надосадочной жидкости, то есть жидкой культуральной среды, которая по существу свободна от клеток, или давая клеткам возможность гравитационного осаждения на дно контейнера (например, биореактора), содержащего жидкую культуральную среду и путем удаления жидкой культуральной среды (жидкая культуральная среда по существу свободна от клеток), которая удалена от осажденных рекомбинантных клеток.
Жидкая культуральная среда может быть получена из культуры рекомбинантных клеток (например, рекомбинантных бактериальных, дрожжевых или клеток млекопитающих), продуцирующих любой из рекомбинантных терапевтических белков, описанных в данном документе. Некоторые примеры любого из способов, описанных в данном документе, дополнительно включают стадию культивирования рекомбинантных клеток (например, рекомбинантных бактериальных, дрожжевых или клеток млекопитающих), которые продуцируют рекомбинантный терапевтический белок.
Жидкая культуральная среда может любой из описанных в данном документе или известных типов жидкой культуральной среды. Например, жидкая культуральная среда может быть выбрана из группы: жидкая культуральная среда, свободная от компонента, выделенного из животного, бессывороточная жидкая культуральная среда, содержащая сыворотку жидкая культуральная среда, химически определенная жидкая культуральная среда и свободная от белка жидкая культуральная среда. В любом из способов, описанных в данном документе, жидкая культуральная среда, полученная из культуры, может быть разбавлена путем добавления второй жидкости (например, буфера) перед ее подачей в первую MCCS (например, первая PCCS).
Жидкая культуральная среда, содержащая рекомбинантный терапевтический белок, которая по существу свободна от клеток, может храниться (например, при температуре ниже примерно 15°C (например, ниже примерно 10°C, ниже примерно 4°C, ниже примерно 0°C, ниже примерно -20°C, ниже примерно -50°C, ниже примерно -70°C, или ниже примерно -80°C) в течение, по меньшей мере, 1 дня (например, в течение, по меньшей мере, примерно 2 дней, по меньшей мере, примерно 5 дней, по меньшей мере, примерно 10 дней, по меньшей мере, примерно 15 дней, по меньшей мере, примерно 20 дней, или по меньшей мере, примерно 30 дней) перед подачей жидкой культуральной среды в первую MCCS (например, в первую PCCS). Альтернативно, в некоторых примерах жидкая культуральная среда подается в первую MCCS (например, в первую PCCS) непосредственно из биореактора (например, подается в первую MCCS (например, в первую PCCS) непосредственно из биореактора после стадии фильтрации или осветления).
Рекомбинантные терапевтические белки
Частные примеры рекомбинантных терапевтических белков, которые могут продуцироваться способами, предлагаемыми в данном документе, включают иммуноглобулины (включая иммуноглобулины с легкой цепью и с тяжелой цепью, антитела или антительные фрагменты (например, любые из антительных фрагментов, описанных в данном документе), ферменты (например, галоктозидазу (например, альфа-галактозидазу), Миозим или Церезим), белки (например, человеческий эритропоэтин, фактор некроза опухоли (TNF), или интерферон альфа или бета), или иммуногенные или антигенные белки или белковые фрагменты (например, белки для использования в вакцине). Рекомбинантный терапевтический белок может представлять собой сконструированный антиген-связывающий полипептид, который содержит, по меньшей мере, один остов многофункционального рекомбинантного белка (см., например, рекомбинантные антиген-связывающие белки, описанные в Gebauer et al., Current Opin. Chem. Biol. 13:245-255, 2009; и в Публикации Патентной Заявки США No. 2012/0164066 (включена в данный документ ссылкой в полном объеме)). Частные примеры рекомбинантных терапевтических белков, которые являются антителами, включают: панитумумаб, омализумаб, абаговомаб, абсиксимаб, актоксумаб, адалимумаб, адекатумумаб, афелимомаб, афутузумаб, алацизумаб, алацизумаб, алемтузумаб, алирокумаб, алтумомаб, аматуксимаб, аматуксимаб, анатумомаб, анрукинзумаб, аполизумаб, арситумомаб, атинумаб, тосилизумаб, базилизимаб, бектумомаб, белимумаб, бевацизумаб, бесилесомаб, безлотоксумаб, бисиромаб, канакинумаб, сертолизумаб, сетуксимаб, сиксутумумаб, даклизумаб, деносумаб, денсумаб, экулизумаб, эдреколомаб, эфализумаб, эфунгумаб, эпратузумаб, эртумаксомаб, этарацизумаб, фижитумумаб, голимумаб, ибритумомаб тиуксетан, иговомаб, имгатузумаб, инфликсимаб, инолимомаб, инотузумаб, лабетузумаб, лебрикизумаб, моксетумомаб, натализумаб, обинутузумаб, ореговомаб, паливизумаб, панитумумаб, пертузумаб, ранибизумаб, ритуксимаб, тоцилизумаб, тоситумомаб, тралокинумаб, тукотузумаб, трастузумаб, велтузумаб, залутумумаб и затуксимаб. Дополнительные примеры рекомбинантных терапевтических антител, которые могут быть получены способами, описанными в данном документе, известны в данной области. Дополнительные частные примеры рекомбинантных терапевтических белков, которые могут быть получены способами по настоящему изобретению, включают: алглюкозидазу альфа, ларонидазу, абатасепт, галсульфазу, лутропин альфа, антигемофильный фактор, агалзидазу бета, интерферон бета-1a, дарбепоэтин альфа, тенектеплазу, этанерцепт, фактор коагуляции IX, фолликулостимулирующий гормон, интерферон бета-1a, имиглюцеразу, дорназу альфа, эпоэтин альфа, инсулин или аналоги инсулина, меказемин, фактор VIII, фактор VIIa, антитромбин III, протеин C, человеческий альбумин, эритропоэитн, гранулоцит колониестимулирующий фактор, гранулоцит макрофаг колониестимулирующий фактор, интерлейкин-11, ларонидазу, идурсульфазу, галсульфазу, ингибитор α-1-протеиназы, лактазу, аденозин дезаминазу, тканевой активатор плазминогена, тиротропин альфа (например, Тироген®) и альтеплазу. Дополнительные примеры рекомбинантных белков, которые могут быть получены способами по настоящему изобретению, включают кислую α-глюкозидазу, алглюкозидазу альфа (например, Миозим® и Лумизим®), α-L-идуронидазу (например, Алдуразим®), идуронат сульфатазу, гепаран N-сульфатазу, галактоза-6-сульфатазу, кислую β-галактозидазу, β-глюкоронидазу, N-ацетилглюкозамин-1-фосфотрансферазу, α-N-ацетилгалактозаминидазу, кислую липазу, лизосомную кислую церамидазу, кислую сфингомиелиназу, β-глюкозидазу (например, Церезим® и Цередазу®), галактозилцерамидазу, α-галактозидазу-A (например, Фабразим®), кислую β-галактозидазу, β-галактозидазу, нейраминидазу, гексозаминидазу A, игексозаминидазу B.
Секретируемый растворимый рекомбинантный терапевтический белок может быть извлечен из жидкой культуральной среды (например, первой и/или второй жидкой культуральной среды) путем удаления или другого физического разделения жидкой культуральной среды от клеток (например, клеток млекопитающих). Разнообразие различных методов удаления жидкой культуральной среды от клеток (например, клеток млекопитающих) известно в данной области, включая например центрифугирование, фильтрацию, пипетирование и/или аспирацию. Секретированный рекомбинантный терапевтический белок может затем удаляться и дополнительно очищаться от жидкой культуральной среды с использованием множества биохимических методов, включающих разнообразные типы хроматографии (например, аффинной хроматографии, хроматографии на молекулярных ситах, катионообменной хроматографии или анионообменной хроматографии) и/или фильтрацию (например, фильтрацию по молекулярной массе).
Многоколоночные хроматографические системы
Способы, описанные в данном документе, включают применение одной или нескольких (например, двух, трех, четырех, пяти или шести) многоколоночных хроматографических систем (MCCS). MCCS может включать две или более хроматографические колонки, две или более хроматографические мембраны или комбинацию, по меньшей мере, одной хроматографической колонки и, по меньшей мере, одной хроматографической мембраны. В частных примерах, MCCS (например, первая и/или вторая MCCS, описанная в любом из способов данного документа) может включать четыре хроматографические колонки, три хроматографические колонки и хроматографическую мембрану, три хроматографические колонки, две хроматографические колонки, две хроматографические мембраны и две хроматографические колонки и одну хроматографическую мембрану. Дополнительные примеры комбинаций хроматографических колонок и/или хроматографических мембран для применения в MCCS (например, в первой и/или во второй MCCS) могут быть выбраны без ограничения специалистом в данной области. Индивидуальные хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS, могут быть идентичны (например, иметь одинаковую форму, объем, смолу, механизм захвата и типовой процесс), или могут быть различными (например, иметь одну или несколько различных форм, объемов, смол, механизмов захвата, и типовых процессов). Индивидуальные хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS (например, в первой и/или во второй MCCS), могут осуществлять одинаковые типовые процессы (например, типовой процесс захвата, очистки или доочистки) или различные типовые процессы (например, различные типовые процессы, выбранные, например, из захвата, очистки, доочистки, инактивации вирусов, регуляции ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок, и фильтрации).
Одна или несколько хроматографических колонок, которые могут присутствовать в MCCS (например, присутствуют в первой и/или во второй MCCS), могут иметь объем смолы, составляющий, например, по меньшей мере, примерно 2 мл, по меньшей мере, примерно 5 мл, по меньшей мере, примерно 10 мл, по меньшей мере, примерно 15 мл, по меньшей мере, примерно 20 мл, по меньшей мере, примерно 25 мл, по меньшей мере, примерно 30 мл, по меньшей мере, примерно 35 мл, по меньшей мере, примерно 40 мл, по меньшей мере, примерно 45 мл, по меньшей мере, примерно 50 мл, по меньшей мере, примерно 55 мл, по меньшей мере, примерно 60 мл, по меньшей мере, примерно 65 мл, по меньшей мере, примерно 70 мл, по меньшей мере, примерно 75 мл, по меньшей мере, примерно 80 мл, по меньшей мере, примерно 85 мл, по меньшей мере, примерно 90 мл, по меньшей мере, примерно 95 мл или, по меньшей мере, примерно, 100 мл. Одна или несколько хроматографических колонок, которые могут присутствовать в MCCS (например, присутствовать в первой и/или во второй MCCS), могут иметь объем смолы примерно от 2 мл примерно до 100 мл, примерно от 2 мл примерно до 90 мл, примерно от 2 мл примерно до 80 мл, примерно от 2 мл примерно до 70 мл, примерно от 2 мл примерно до 60 мл, примерно от 2 мл примерно до 50 мл, примерно от 5 мл примерно до 50 мл, примерно от 2 мл примерно до 45 мл, примерно от 5 мл примерно до 45 мл, примерно от 2 мл примерно до 40 мл, примерно от 5 мл примерно до 40 мл, примерно от 2 мл примерно до 35 мл, примерно от 5 мл примерно до 35 мл, примерно от 2 мл примерно до 30 мл, примерно от 5 мл примерно до 30 мл, примерно от 2 мл примерно до 25 мл, примерно от 5 мл примерно до 25 мл, примерно от 15 мл примерно до 60 мл, примерно от 10 мл примерно до 60 мл, примерно от 10 мл примерно до 50 мл, и примерно от 15 мл примерно до 50 мл. Одна или несколько хроматографических колонок в MCCS (например, в первой и/или во второй MCCS), используемых в любом из способов, описанных в данном документе, могут иметь по существу одинаковый объем смолы или могут иметь различные объемы смолы. Скорость потока, используемая для одной или нескольких хроматографических колонках в MCCS (например, в первой и/или во второй MCCS), может составлять, например, примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту).
Одна или несколько хроматографических колонок в MCCS (например, в первой и/или во второй MCCS) могут по существу иметь одинаковую форму или могут иметь по существу различные формы. Например, одна или несколько хроматографических колонок в MCCS (например, в первой и/или во второй MCCS) могут иметь форму округлого цилиндра или могут иметь по существу такую же форму как у овального цилиндра.
Одна или несколько хроматографических мембран, которые могут присутствовать в MCCS (например, присутствовать в первой и/или во второй MCCS), могут иметь объем слоя, составляющий, например, примерно от 1 мл примерно до 500 мл (например, примерно от 1 мл примерно до 475 мл, примерно от 1 мл примерно до 450 мл, примерно от 1 мл примерно до 425 мл, примерно от 1 мл примерно до 400 мл, примерно от 1 мл примерно до 375 мл, примерно от 1 мл примерно до 350 мл, примерно от 1 мл примерно до 325 мл, примерно от 1 мл примерно до 300 мл, примерно от 1 мл примерно до 275 мл, примерно от 1 мл примерно до 250 мл, примерно от 1 мл примерно до 225 мл, примерно от 1 мл примерно до 200 мл, примерно от 1 мл примерно до 175 мл, примерно от 1 мл примерно до 150 мл, примерно от 1 мл примерно до 125 мл, примерно от 1 мл примерно до 100 мл, примерно от 2 мл примерно до 100 мл, примерно от 5 мл примерно до 100 мл, примерно от 1 мл примерно до 80 мл, примерно от 2 мл примерно до 80 мл, примерно от 5 мл примерно до 80 мл, примерно от 1 мл примерно до 60 мл, примерно от 2 мл примерно до 60 мл, примерно от 5 мл примерно до 60 мл, примерно от 1 мл примерно до 40 мл, примерно от 2 мл примерно до 40 мл, примерно от 5 мл примерно до 40 мл, примерно от 1 мл примерно до 30 мл, примерно от 2 мл примерно до 30 мл, примерно от 5 мл примерно до 30 мл, примерно от 1 мл примерно до 25 мл, примерно от 2 мл примерно до 25 мл, примерно от 1 мл примерно до 20 мл, примерно от 2 мл примерно до 20 мл, примерно от 1 мл примерно до 15 мл, примерно от 2 мл примерно до 15 мл, примерно от 1 мл примерно до 10 мл, или примерно от 2 мл примерно до 10 мл.
Один или несколько (например, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три, или двадцать четыре) различных типов буфера могут применяться в течение применения двух или более MCCS в любом из способов, описанных в данном документе. Как известно в данной области, один или несколько типов буферов, используемых в двух или более MCCS, используемых в способах, описанных в данном документе, будет зависеть от смолы, присутствующей в колонках и/или в хроматографических мембранах двух или более MCCS (например, в первой и второй MCCS), рекомбинантного терапевтического белка и типового процесса (например, любого из типичных типовых процессов, описанных в данном документе), осуществляемого с помощью хроматографических колонок и/или хроматографических мембран двух или более MCCS. Объем и тип буфера, применяемого в процессе использования двух или более MCCS в любом из способов, описанных в данном документе, также могут определяться специалистом в данной области (например, обсуждаются более подробно ниже). Например, объем и тип буфера, применяемого во время использования двух или более MCCS в любом из способов, описанных в данном документе, могут быть выбраны с целью оптимизации в рекомбинантном белковом лекарственном продукте одного или нескольких компонентов из следующих: общий выход рекомбинантного терапевтического белка, активность рекомбинантного терапевтического белка, уровень чистоты рекомбинантного терапевтического белка, и удаление биологических контаминантов из жидкости, содержащей рекомбинантный терапевтический белок (например, отсутствие активных вирусов, микобактерий, дрожжей, бактерий или клеток млекопитающих).
Первая и/или вторая MCCS может представлять собой периодическую противоточную хроматографическую систему (PCCS). PCCS может, например, включать две или более хроматографических колонок (например, три колонки или четыре колонки), которые переключаются с целью получения возможности непрерывной элюции рекомбинантного терапевтического белка из двух или более хроматографических колонок. PCCS может включать две или более хроматографические колонки, две или более хроматографические мембраны или, по меньшей мере, одну хроматографическую колонку и, по меньшей мере, одну хроматографическую мембрану. Операции на колонках, как правило, состоят из стадий загрузки, промывки, элюирования и регенерации. В PCCS, множество колонок используется для прогона одинаковых стадий дискретно или непрерывно циклическим образом. Так как колонки функционируют серийно, то фильтрат и смыв с одной колонки захватывается другой колонкой. Уникальное свойство PCCS дает возможность загрузки смолы близко к ее статической способности связывания вместо динамической способности связывания, что является типичным в периодическом способе хроматографии. Пример метода переключения трех колонок, используемых в PCCS, содержащей три колонки, представлен на ФИГ. 3. Цикл определяется как полных колоночных операции, приводящие в результате к пулу элюции из каждой из трех колонок, используемых в методе переключения колонок. После завершения всех стадий в цикле цикл запускается снова. В результате непрерывных циклов и элюции, жидкость, входящая в PCCS, процессируется непрерывно, и элюат, содержащий рекомбинантный терапевтический белок, получают непрерывно.
Для перехода от одной стадии к другой в PCCS-цикле, таком как типовой цикл, как представлено на ФИГ. 3, применяется стратегия переключения колонок. Метод переключения колонок применяет две автоматические операции переключения на колонку в трех колонках в типовой системе PCCS, представленной на ФИГ. 3, первая из которых относится к исходному проскоку продукта, в то время как вторая соответствует насыщению колонки. Определение того, когда должно происходить переключение колонок, определяют путем отслеживания концентрации рекомбинантного терапевтического белка (например, отслеживание с помощью УФ) в элюате из каждой хроматографической колонки, присутствующей в PCCS. Например, переключение колонок может определяться с помощью любого устройства PAT, способного к внутреннему измерению концентрации продукта с управлением обратной связью. Устройство PAT способно в реальном времени осуществлять внутренние измерения концентрации продукта с регулированием с обратной связью.
На ФИГ. 4 изображен пример переключения колонок в типовой PCCS на основе различия в УФ-поглощении (ΔУФ) между подачей на входе и выходом из колонки. Например, во время загрузки колонки (Стадия 1; ФИГ. 3), контрольная система PCC определяет базовый уровень примесей, когда поглощение стабилизируется. После проскока продукта (Стадия 2; ФИГ. 3), появляется повышение УФ-сигнала на выходе, который выше порога примесей. В точке, когда -ΔУФ достигает определенного порогового значения (например, 3% проскока продукта), фильтрат из колонки 1 направляется на колонку 2 вместо сброса (t1; ФИГ. 4). Когда колонка 1 почти насыщается продуктом, и ΔУФ достигает определенного значения (t2; ФИГ. 4), то подача переключается на колонку 2. Стратегия переключения колонок, используемая в PCCS, дает возможность унифицированной загрузки колонок безотносительно к концентрации продукта при подаче и к емкости. Могут быть разработаны похожие переключения колонок на основе уровня рекомбинантного терапевтического белка, детектированного в элюате из каждой колонки. Как известно из уровня техники, переключения колонок также может разрабатываться на основе времени или количества жидкости (например, буфера), проходящей через одну или несколько хроматографических колонок и/или хроматографических мембран в первой или во второй MCCS.
В PCCS, время пребывания (RT) рекомбинантного терапевтического белка на каждой хроматографической колонке и/или хроматографической мембране, присутствующей в PCCS, может быть уменьшено без повышения размера колонки/мембраны, так как проскок из первой колонки/мембраны может захватываться на другой колонке/мембране в PCCS. Система непрерывного способа может разрабатываться для процессирования жидкой культуральной среды с любой степенью перфузии (D) с помощью различных объемов колонки/мембраны (V) и RT с использованием уравнения:
V=D * RT.
В одном или в нескольких типовых операциях, которые могут осуществляться с помощью, по меньшей мере, двух MCCS (например, первой и/или второй MCCS), используемых в способах, описанных в настоящем документе, включают, например, захват рекомбинантного терапевтического белка, инактивацию вирусов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок, очистку рекомбинантного терапевтического белка, доочистку рекомбинантного терапевтического белка, удерживание жидкости, содержащей рекомбинантный терапевтический белок (например, с использованием любой из типовых буферных емкостей, описанных в данном документе), фильтрацию или удаление твердых частиц и/или клеток из жидкости, содержащей рекомбинантный терапевтический белок, и регуляцию ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок.
Типовой процесс захвата может осуществляться с использованием одной или нескольких MCCS (например, первой и/или второй MCCS), который включает, по меньшей мере, одну хроматографическую колонку и/или хроматографическую смолу, например, применяет механизм захвата. Частные примеры механизмов захвата включают механизм захвата со связыванием с протеином A, механизм захвата со связыванием с антителом или антительным фрагментом, механизм захвата со связыванием с субстратом, механизм захвата со связыванием с аптамером, механизм захвата со связыванием с меткой (например, механизм захвата на основе связывания с поли-His-меткой) и механизм захвата со связыванием с кофактором. Захват также может осуществляться с использованием смолы, которая может использоваться для осуществления катионообменной хроматографии или анионообменной хроматографии, или хроматографии на молекулярных ситах. Частные примеры смол, которые могут использоваться для захвата рекомбинантного терапевтического белка, описаны в данном документе. Дополнительные примеры смол, которые могут использоваться для захвата рекомбинантного терапевтического белка, известны в данной области.
Типовой процесс инактивации вирусов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок, может осуществляться с использованием одной или нескольких MCCS (например, первой и/или второй MCCS), которые включают, например, хроматографическую колонку, хроматографическую мембрану или удерживающую емкость, которая способна к инкубации жидкости, содержащей рекомбинантный терапевтический белок при pH примерно от 3 до 5 (например, примерно от 3,5 примерно до 4,5, примерно от 3,5 примерно до 4,25, примерно от 3,5 примерно до 4,0, примерно от 3,5 примерно до 3,8, или примерно до 3,75) в течение периода, составляющего, по меньшей мере, 30 минут (например, периода примерно от 30 минут до 1,5 часов, периода примерно от 30 минут до 1,25 часов, периода примерно от 0,75 часов до 1,25часов, или периода, составляющего примерно 1 час).
Типовой процесс очистки рекомбинантного терапевтического белка может осуществляться с использованием одной или нескольких MCCS (например, первой и/или второй MCCS), который включает, например, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая содержит смолу, которая, например, применяет систему захвата. Частные примеры механизмов захвата включают механизм захвата со связыванием с протеином A, механизм захвата со связыванием с антителом или антительным фрагментом, механизм захвата со связыванием с субстратом, механизм захвата со связыванием с аптамером, механизм захвата со связыванием с меткой (например, механизм захвата на основе связывания с поли-His-меткой) и механизм захвата со связыванием с кофактором. Очистка также может осуществляться с использованием смолы, которая может использоваться для осуществления катионообменной хроматографии или анионообменной хроматографии или хроматографии на молекулярных ситах. Частные примеры смол, которые могут использоваться для захвата рекомбинантного терапевтического белка, описаны в данном документе. Дополнительные примеры смол, которые могут использоваться для очистки рекомбинантного терапевтического белка, известны в данной области.
Типовой процесс доочистки рекомбинантного белка может осуществляться с использованием одной или нескольких MCCS (например, первой и/или второй MCCS), который включает, например, хроматографическую колонку или хроматографическую мембрану, которая содержит смолу, которая может использоваться для осуществления катионообменной хроматографии или анионообменной хроматографии или хроматографии на молекулярных ситах. Частные примеры смол, которые могут использоваться для доочистки рекомбинантного терапевтического белка, описаны в данном документе. Дополнительные примеры смол, которые могут использоваться для доочистки рекомбинантного терапевтического белка, известны в данной области.
Типовой процесс удерживания жидкости, содержащей рекомбинантный терапевтический белок, может осуществляться с использованием MCCS (например, первой и/или второй MCCS), которая включает, по меньшей мере, один резервуар (например, буферную емкость) или максимально 1, 2, 3, 4 или 5 резервуаров (например, буферных емкостей) в первой и во второй MCCS вместе. Например, резервуар(ы) (например, буферная емкость(и)), которая может использоваться для достижения данного типового процесса, может иметь объем примерно от 1 мл примерно до 1 л (например, примерно от 1 мл примерно до 800 мл, примерно от 1 мл примерно до 600 мл, примерно от 1 мл примерно до 500 мл, примерно от 1 мл примерно до 400 мл, примерно от 1 мл примерно до 350 мл, примерно от 1 мл примерно до 300 мл, примерно от 10 мл примерно до 250 мл, примерно от 10 мл примерно до 200 мл, примерно от 10 мл примерно до 150 мл, и примерно от 10 мл примерно до 100 мл). Резервуар(ы) (например, буферная емкость(и)), используемых в способах, описанных в данном документе, может обладать емкостью, которая составляет, например, от 1 мл примерно до 300 мл, включительно, примерно от 1 мл примерно до 280 мл, примерно до 260 мл, примерно до 240 мл, примерно до 220 мл, примерно до 200 мл, примерно до 180 мл, примерно до 160 мл, примерно до 140 мл, примерно до 120 мл, примерно до 100 мл, примерно до 80 мл, примерно до 60 мл, примерно до 40 мл, примерно до 20 мл, или примерно до 10 мл (включительно). Любой из резервуаров (например, буферные емкости), используемых в (любом из способов, описанных в данном документе) для удерживания жидкости перед ее поступлением в первую MCCS, может иметь емкость, которая составляет, например, от 1 мл примерно до 100%, включительно, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки первой MCCS. Любой из резервуаров (например, буферные емкости), используемых для удерживания жидкости перед ее поступлением во вторую MCCS, (и после того, как жидкость покидает первую MCCS), может иметь емкость, которая составляет, например, от 1 мл примерно до 100%, включительно, например, примерно от 1 мл примерно до 90%, примерно до 80%, примерно до 70%, примерно до 60%, примерно до 50%, примерно до 40%, примерно до 30%, примерно до 20%, примерно до 10%, или примерно до 5%, включительно, от загрузочного объема первой колонки второй MCCS.
Резервуар(ы) (например, буферная емкость(и)), может удерживать жидкость, содержащую рекомбинантный терапевтический белок, в течение, по меньшей мере, 10 минут (например, по меньшей мере, 20 минут, по меньшей мере, 30 минут, по меньшей мере, 1 часа, по меньшей мере, 2 часа, по меньшей мере, 4 часов или, по меньшей мере, 6 часов). В других примерах резервуар(ы) (например, буферная емкость(и)) только удерживает терапевтический белок в течение суммарного периода времени, например, примерно от 5 минут и менее чем примерно 6 часов, включительно, например, примерно от 5 минут примерно до 5 часов, примерно до 4 часов, примерно до 3 часов, примерно до 2 часов, примерно до 1 часа, или примерно до 30 минут, включительно. Резервуар(ы) (например, буферная емкость(и)) может использоваться как для удерживания жидкости, так и для охлаждения (например, при температуре менее чем 25°C, менее чем 15°C, или менее чем 10°C) жидкости, содержащей рекомбинантный терапевтический белок. Резервуар может иметь любую форму, включая округлый цилиндр, овальный цилиндр или приблизительно прямоугольную герметичную и непроницаемую емкость.
Типовой процесс фильтрации жидкости, содержащей рекомбинантный терапевтический белок, может осуществляться с использованием MCCS (например, первой и/или второй MCCS), которая включает, например, фильтр или хроматографическую колонку или хроматографическую мембрану, которая содержит смолу для хроматографии на молекулярных ситах. Как известно в данной области, доступен широкий спектр субмикронных фильтров (например, фильтр с размером пор менее чем 1 мкм, менее чем 0,5 мкм, менее чем 0,3 мкм, примерно 0,2 мкм, менее чем 0,2 мкм, менее чем 100 нм, менее чем 80 нм, менее чем 60 нм, менее чем 40 нм, менее чем 20 нм, или менее чем 10 нм), которые способны удалять любой осажденный материал и/или клетки (например, осажденный не структурированный белок; осажденные нежелательные белки клетки-хозяина; осажденные липиды, бактериальные, дрожжевые, грибные клетки, микобактерии и/или клетки млекопитающих). Известно, что фильтры, имеющие размер пор примерно 0,2 мкм или менее чем 0,2 мкм, эффективно удаляют бактерии из жидкости, содержащей рекомбинантный терапевтический белок. Как известно в данной области, хроматографическая колонка или хроматографическая мембрана, содержащая смолу молекулярных сит, также может использоваться в MCCS (например, в первой и/или во второй MCCS) для осуществления типового процесса фильтрации жидкости, содержащей рекомбинантный терапевтический белок.
Типовые процессы регуляции ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок, может осуществляться с использованием MCCS (например, первой и/или второй MCCS), которая включает резервуар для регуляции буфера (например, встроенный резервуар для регуляции буфера), который добавляет новый буферный раствор в жидкость, которая содержит рекомбинантный терапевтический белок (например, между колонками внутри одиночной MCCS, или после последней колонки в предпоследней MCCS (например, в первой MCCS) и перед подачей жидкости, содержащей рекомбинантный терапевтический белок, в первую колонку следующей MCCS (например, второй MCCS). В данной области понятно, что встроенный резервуар для регуляции буфера может иметь любой размер (например, более чем 100 мл) и может содержать любой буферный раствор (например, буферный раствор, который имеет одно из следующих свойств: повышенное или пониженное pH по сравнению с жидкостью, содержащей рекомбинантный терапевтический белок, повышенную или пониженную ионную концентрацию (например, соли) по сравнению с жидкостью, содержащей рекомбинантный терапевтический белок, и/или повышенную или пониженную концентрацию агента, который конкурирует с рекомбинантным терапевтическим белком за связывание со смолой, присутствующей, по меньшей мере, в одной хроматографической колонке или, по меньшей мере, в одной хроматографической мембране в MCCS (например, в первой или во второй MCCS)).
Первая и/или вторая MCCS может осуществлять два или более типовых процесса. Например, первая и/или вторая MCCS каждая может осуществлять, по меньшей мере, следующие типовые процессы: захват рекомбинантного терапевтического белка и инактивацию вирусов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок; захват рекомбинантного терапевтического белка и инактивацию вирусов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок, и регуляцию ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок; очистку рекомбинантного терапевтического белка и доочистку рекомбинантного терапевтического белка; очистку рекомбинантного терапевтического белка, доочистку рекомбинантного терапевтического белка и фильтрацию жидкости, содержащей рекомбинантный терапевтический белок, или удаление осадков и/или твердых частиц из жидкости, содержащей рекомбинантный терапевтический белок; и очистку рекомбинантного терапевтического белка, доочистку рекомбинантного терапевтического белка, фильтрацию жидкости, содержащей рекомбинантный терапевтический белок, удаление осадков и/или твердых частиц из жидкости, содержащей рекомбинантный терапевтический, и регуляцию ионной концентрации и/или pH жидкости, содержащей рекомбинантный терапевтический белок.
Захват рекомбинантного терапевтического белка
Способы настоящего изобретения включают стадию захвата рекомбинантного терапевтического белка с использованием первой MCCS. Как может быть понятно из уровня техники, жидкая культуральная среда, содержащая рекомбинантный терапевтический белок, может непрерывно подаваться на первую MCCS с использованием множества различных средств. Например, жидкая культуральная среда может активно прокачиваться в первую MCCS, или жидкая культуральная среда может подаваться в первую MCCS с использованием гравитации. Жидкая культуральная среда может храниться в резервуаре (например, в удерживающей емкости) перед ее подачей в первую MCCS, или жидкая культуральная среда может активно прокачиваться из биореактора, содержащего культуру клеток (например, клеток млекопитающих, которые секретируют рекомбинантный терапевтический белок в культуральную среду), в первую MCCS.
Жидкая культуральная среда может подаваться (загружаться) в первую MCCS со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Жидкая культуральная среда, содержащая рекомбинантный терапевтический белок, может быть выделена из любого типового источника, описанного в данном документе или известного в данной области.
Некоторые примеры дополнительно включают необязательную стадию фильтрации жидкой культуральной среды перед ее подачей в первую MCCS. Может использоваться любой из типовых способов фильтрации жидкой культуральной среды или жидкости, содержащей рекомбинантный терапевтический белок, которые описаны в данном документе, или любой способ фильтрации, известный в данной области, для фильтрации жидкой культуральной среды, содержащей рекомбинантный терапевтический белок, перед ее подачей в первую MCCS.
В способах, описанных в данном документе, захват рекомбинантного терапевтического белка из жидкой культуральной среды осуществляют с использованием первой MCCS. В данной области понятно, что с целью достижения захвата рекомбинантного терапевтического белка, по меньшей мере, одна хроматографическая колонка или, по меньшей мере, одна хроматографическая мембрана в первой MCCS должна содержать смолу, которая использует механизм захвата (например, любой из типовых механизмов захвата, описанных в данном документе), или содержит смолу, способную осуществлять катионообменную хроматографию, анионообменную хроматографию или хроматографию на молекулярных ситах. Например, если рекомбинантный терапевтический белок представляет собой антитело или антительный фрагмент, то система захвата может представлять собой механизм захвата со связыванием с протеином A или механизм захвата со связыванием с антигеном (где захватывающий антиген специфично распознается рекомбинантным терапевтическим антителом или антительным фрагментом). Если рекомбинантный терапевтический белок представляет собой фермент, то механизм захвата может использовать антитело или антительный фрагмент, который специфично связывается с ферментом для захвата рекомбинантного терапевтического фермента, субстрат фермента для захвата рекомбинантного терапевтического фермента, кофактора фермента для захвата рекомбинантного терапевтического фермента, или, если рекомбинантный терапевтический фермент содержит метку, белок, металло-хелатирующий агент или антитело (или антительный фрагмент), который специфично связывается с меткой, присутствующей в рекомбинантном терапевтическом ферменте. Частные примеры смол, которые могут использоваться для захвата рекомбинантного терапевтического белка, описаны в данном документе, и дополнительные примеры смол, которые могут использоваться для захвата рекомбинантного терапевтического белка, известны в данной области. Один частный пример смолы, которая использует механизм захвата со связыванием с протеином A, представляет собой смолу MabSelect SuRe (GE Healthcare, Piscataway, NJ).
Типовые частные размеры и форма хроматографических колонок или хроматографических мембран, присутствующих в первой MCCS, которые могут использоваться для захвата рекомбинантного терапевтического белка, описаны в данном документе. Жидкая культуральная среда подаваемая (загружаемая) в первую MCCS, может содержать, например, примерно от 0,05 мг/мл примерно до 100 мг/мл рекомбинантного терапевтического белка (например, примерно от 0,1 мг/мл примерно до 90 мг/мл, примерно от 0,1 мг/мл примерно до 80 мг/мл, примерно от 0,1 мг/мл примерно до 70 мг/мл, примерно от 0,1 мг/мл примерно до 60 мг/мл, примерно от 0,1 мг/мл примерно до 50 мг/мл, примерно от 0,1 мг/мл примерно до 40 мг/мл, примерно от 0,1 мг/мл примерно до 30 мг/мл, примерно от 0,1 мг/мл примерно до 20 мг/мл, от 0,5 мг/мл примерно до 20 мг/мл, примерно от 0,1 мг/мл примерно до 15 мг/мл, примерно от 0,5 мг/мл примерно до 15 мг/мл, примерно от 0,1 мг/мл примерно до 10 мг/мл, или примерно от 0,5 мг/мл примерно до 10 мг/мл рекомбинантного терапевтического белка). Среднее время, требуемое для связывания рекомбинантного терапевтического белка со смолой, использующейся для осуществления типового процесса захвата, может составлять, например, примерно от 5 секунд примерно до 10 минут (например, примерно от 10 секунд примерно до 8 минут, примерно от 10 секунд примерно до 7 минут, примерно от 10 секунд примерно до 6 минут, примерно от 10 секунд примерно до 5 минут, примерно от 30 секунд примерно до 5 минут, примерно от 1 минуты примерно до 5 минут, примерно от 10 секунд примерно до 4 минут, примерно от 30 секунд примерно до 4 минут, или примерно от 1 минуты примерно до 4 минут).
Из уровня техники понятно, что с целью захвата рекомбинантного терапевтического белка с использованием хроматографической колонки или хроматографической мембраны, присутствующей в первой MCCS, необходимо осуществление последовательных хроматографических стадий загрузки, промывки, элюции и регенерации хроматографической колонки или хроматографической мембраны, присутствующей в первой MCCS. Любое из следующих типовых свойств: скоростей потока, объем буфера и/или продолжительность времени, отведенного на каждую последовательную хроматографическую стадию, описанную в данном документе, может использоваться в одной или в нескольких из этих различных последовательных хроматографических стадий загрузки, промывки, элюции и регенерации хроматографической колонки или хроматографической мембраны, присутствующей в первой MCCS, которые используются для захвата рекомбинантного терапевтического белка). Частные примеры скорости потока, объема буфера и/или продолжительности времени, отведенного на каждую последовательную хроматографическую стадию, которые могут использоваться для захвата в хроматографической колонке и/или в хроматографической мембране в первой MCCS (например, в первой системе PCC), предлагаются ниже. Кроме того, ниже описаны типовые буферы для элюции, которые могут использоваться в первой MCCS.
Первая MCCS, содержащая, по меньшей мере, одну хроматографическую колонку и/или хроматографическую мембрану, содержащую смолу, которая может осуществлять типовой процесс захвата (например, любая из описанных в данном документе типовых смол, которые могут использоваться для захвата), может загружаться жидкой культуральной средой, содержащей рекомбинантный терапевтический белок, с использованием загрузочных скоростей потока (скорости подачи), описанных выше. В некоторых примерах, одиночная хроматографическая колонка или одиночная хроматографическая мембрана, содержащая смолу, которая способна осуществлять типовой процесс захвата, загружается, например, примерно от 10 минут примерно до 90 минут (например, примерно от 15 минут примерно до 90 минут, примерно от 20 минут до 80 минут, примерно от 30 минут до 80 минут, примерно от 40 минут примерно до 80 минут, примерно от 50 минут примерно до 80 минут, и примерно от 60 минут до 80 минут). В некоторых примерах, где первая MCCS включает, по меньшей мере, две хроматографические колонки, которые содержат смолу, которая способна осуществлять типовой процесс захвата серийно, время, требуемое для последовательной загрузки двух хроматографических колонок составляет примерно от 50 минут примерно до 180 минут (например, примерно от 60 минут примерно до 180 минут, примерно от 70 минут до 180 минут, примерно от 80 минут до 180 минут, примерно от 90 минут примерно до 180 минут, примерно от 100 минут примерно до 180 минут, примерно от 110 минут примерно до 150 минут и примерно от 125 минут примерно до 145 минут).
После загрузки рекомбинантного терапевтического белка, по меньшей мере, на одну хроматографическую колонку или на хроматографическую мембрану в первой MCCS, которая содержит смолу, которая способна осуществлять типовой процесс захвата, по меньшей мере, одна хроматографическая колонка или хроматографическая мембрана промывается с использованием, по меньшей мере, одного промывочного буфера. Из уровня техники понятно, что, по меньшей мере, один (например, два, три или четыре) промывочный буфер предназначен для элюции всех белков, которые не являются рекомбинантными терапевтическими белками, по меньшей мере, из одной хроматографической колонки или хроматографической мембраны, не разрушая при этом взаимодействие рекомбинантного терапевтического белка со смолой.
Промывочный буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем используемого промывочного буфера (например, объединенный суммарный объем промывочного буфера, когда используется более чем один буфер) может составлять, например, примерно от 1X колоночного объема (КО) примерно до 15X КО (например, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от 1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 5X КО примерно до 11X КО, или примерно от 5X КО примерно до 10X КО). Суммарное время промывки может составлять, например, примерно от 2 минут примерно до 3 часов (например, примерно от 2 минут примерно до 2,5 часов, примерно от 2 минут примерно до 2 часов, примерно от 5 минут примерно до 1,5 часов, примерно от 10 минут примерно до 1,5 часов, примерно от 10 минут примерно до 1,25 часов, примерно от 20 минут примерно до 1,25 часов, or примерно от 30 минут примерно до 1 часа).
После промывки, по меньшей мере, одной хроматографической колонки или хроматографической мембраны в первой MCCS, которая содержит смолу, которая способна осуществлять типовой процесс захвата, рекомбинантный терапевтический белок элюируется из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны путем прохождения элюирующего буфера через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану в первой MCCS, которая содержит смолу, которая способна осуществлять типовой процесс захвата. Элюирующий буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая содержит смолу, которая способна осуществлять типовой процесс захвата, со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/мин примерно до 6 мл/в минуту, примерно от 1 мл/мин примерно до 5 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем используемого элюирующего буфера для элюции рекомбинантного терапевтического белка из каждой из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, содержащей смолу, которая способна осуществлять типовой процесс очистки может составлять, например, примерно от 1X колоночного объема (КО) примерно до 15X КО (например, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от 1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 5X КО примерно до 11X КО, или примерно от 5X КО примерно до 10X КО). Суммарное время элюции может составлять, например, примерно от 2 минут примерно до 3 часов (например, примерно от 2 минут примерно до 2,5 часов, примерно от 2 минут примерно до 2 часов, примерно от 2 минут примерно до 1,5 часов, примерно от 2 минут примерно до 1,25 часов, примерно от 2 минут примерно до 1 часа, примерно от 2 минут примерно до 40 минут, примерно от 10 минут примерно до 40 минут, примерно от 20 минут примерно до 40 минут). Частные примеры элюирующих буферов, которые могут использоваться в данных методах, будут зависеть от механизма захвата и/или от терапевтического белка. Например, элюирующий буфер может содержать различные концентрации соли (например, повышенную концентрацию соли), различные pH (например, повышенное или пониженное рН), или молекулу, которая будет конкурировать с рекомбинантным терапевтическим белком за связывание со смолой, которая способна осуществлять типовой процесс захвата. Примеры таких элюирующих буферов для каждого типового механизма захвата, описанного в данном документе, хорошо известны в данной области.
После элюции рекомбинантного терапевтического белка из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны в первой MCCS, которая содержит смолу, которая способна осуществлять типовой процесс захвата, и перед загрузкой следующего объема жидкой культуральной среды, по меньшей мере, на одну хроматографическую колонку или на хроматографическую мембрану, по меньшей мере, одна хроматографическая колонка или хроматографическая мембрана должна быть уравновешена с использованием регенерирующего буфера. Регенерирующий буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая содержит смолу, которая способна осуществлять типовой процесс захвата, со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/мин примерно до 6 мл/в минуту, примерно от 1 мл/мин примерно до 5 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем регенерирующего буфера, используемого для уравновешивания, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, содержащей смолу, которая способна осуществлять типовой процесс захвата, может составлять, например, примерно от 1X колоночного объема (КО) примерно до 15X КО (например, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от 1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 5X КО примерно до 11X КО, или примерно от 5X КО примерно до 10X КО).
В некоторых из способов, описанных в данном документе, первая MCCS включает резервуар, который удерживает жидкость, содержащую рекомбинантный терапевтический белок, при низком pH (например, при pH ниже 4,6, ниже 4,4, ниже 4,2, ниже 4, ниже 3,8, ниже 3,6, ниже 3,4, ниже 3,2, или ниже 3) в течение, например, примерно от 1 минуты до 1,5 часов (например, примерно 1 час), и инактивирует вирусы, присутствующие в жидкости, содержащей рекомбинантный терапевтический белок. Пример резервуара, который может использоваться для осуществления типового процесса инактивации вирусов, представляет собой перемешиваемая колба (например, 500-мл перемешиваемая колба, например, 500-мл перемешиваемая колба с программируемой пластиной для смешивания), которая способна удерживать жидкость, содержащую рекомбинантный терапевтический белок, например, в течение примерно от 1 минуты примерно до 1,5 часов, перед подачей жидкости, содержащей рекомбинантный терапевтический белок, во вторую MCCS. Резервуар, который используется для осуществления типового процесса инактивации вирусов, может представлять собой 500-мл перемешиваемую колбу с программируемой пластиной для смешивания (например, пластина для смешивания программируется для смешивания (например, для периодического смешивания) жидкости внутри резервуара, например, каждые 4 часа). Другой пример резервуара, который может использоваться для осуществления типового процесса инактивации вирусов, представляет собой пластиковый пакет (например, 500-мл пластиковый пакет), который способен удерживать жидкость, содержащую рекомбинантный терапевтический белок, в течение, например, примерно от 1 минуты до 1,5 часов перед подачей жидкости, содержащей рекомбинантный терапевтический белок, во вторую MCCS. В некоторых примерах, жидкость, содержащая рекомбинантный терапевтический белок, может уже иметь низкое pH (например, pH ниже 4,6, ниже 4,4, ниже 4,2, ниже 4, ниже 3,8, ниже 3,6, ниже 3,4, ниже 3,2, или ниже 3), когда она подается в резервуар, который используется для осуществления типового процесса вирусной инактивации. Специалисту в данной области понятно, что для осуществления типового процесса инактивации вирусов может использоваться множество других способов. например, УФ0облучение жидкости, содержащей рекомбинантный терапевтический белок, также может использоваться для осуществления типового процесса инактивации вирусов. Частные примеры резервуаров, которые могут использоваться для типового процесса инактивации вирусов, присутствующих в жидкости, содержащей рекомбинантный терапевтический белок, описаны в данном документе.
Первая MCCS может включать PCCS, содержащую четыре хроматографические колонки, где, по меньшей мере, три из четырех хроматографических колонок осуществляют типовой процесс захвата рекомбинантного белка из жидкой культуральной среды (например, с использованием первой MCCS, которая включает любую из, по меньшей мере, одной хроматографической колонки, которая содержит смолу, способную осуществлять типовой процесс захвата (например, любую из описанных в данном документе)). В этих примерах четыре колонки PCC могут осуществлять типовой процесс инактивации вирусов в жидкости, которая содержит рекомбинантный терапевтический белок (например, любая из типовых колонок, описанных в данном документе, которые также могут использоваться для достижения вирусной инактивации жидкости, содержащей рекомбинантный терапевтический белок).
Жидкость, содержащая рекомбинантный терапевтический белок, непрерывно элюируется из первой MCCS (например, первой системы PCC), и непрерывно подается во вторую MCCS. Процент рекомбинантного терапевтического белка, извлеченного в элюате первой MCCS (например, первой системы PCC) может представлять собой, например, по меньшей мере, 70%, по меньшей мере, 72%, по меньшей мере, 74%, по меньшей мере, 76%, по меньшей мере, 78%, по меньшей мере, 80%, по меньшей мере, 82%, по меньшей мере, 84%, по меньшей мере, 86%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, или, по меньшей мере, 98%). Элюат из первой MCCS (например, из первой системы PCC) может подаваться во вторую MCCS (например, во вторую систему PCC) с использованием множества средств, известных в данной области (например, гибкого трубопровода). Элюат первой MCCS (например, первой системы PCC) может подаваться во вторую MCCS (например, во вторую систему PCC) со скоростью потока, например, примерно от 0,2 мл/в минуту примерно до 25 мл/в минуту (например, примерно от 0,2 мл/в минуту примерно до 20 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 20 мл/в минуту, примерно от 0,2 мл/в минуту примерно до 15 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 15 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 10 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 6 мл/в минуту, примерно от 1 мл/в минуту примерно до 5 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 5 мл/в минуту примерно до 15 мл/в минуту, примерно от 15 мл/в минуту примерно до 25 мл/в минуту, или примерно от 1 мл/в минуту примерно до 15 мл/в минуту).
Некоторые способы, описанные в данном документе, могут дополнительно включать стадию регуляции ионной концентрации и/или pH элюата из первой MCCS (например, первой системы PCC) перед его подачей во вторую MCCS (например, во вторую систему PCC). Как описано в данном документе, ионная концентрация и/или pH элюата из первой MCCS (например, из первой системы PCC) могут регулироваться (перед его подачей во вторую MCCS) путем добавления к элюату (например, путем применения встроенного резервуара для регуляции буфера). Буфер может добавляться к элюату из первой MCCS со скоростью потока, составляющей, например, примерно от 0,1 мл/в минуту примерно до 15 мл/в минуту (например, примерно от 0,1 мл/в минуту примерно до 12,5 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 10 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 8 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 6 мл/в минуту, примерно от 0,1 мл/в минуту до 4 мл/в минуту, или примерно от 0,5 мл/в минуту примерно до 5 мл/в минуту).
Способы, описанные в данном документе, могут дополнительно включать стадию удерживания или хранения (и необязательно также охлаждения) элюата из первой MCCS перед его подачей из первой MCCS во вторую MCCS. Как описано в данном документе, стадия удерживания или хранения может осуществляться с использованием любого из резервуаров (например, резервных емкостей), описанных в данном документе.
Способы, описанные в данном документе, могут также включать стадию фильтрации элюата из первой MCCS перед подачей элюата во вторую MCCS. Любой из типовых фильтров или методов фильтрации, описанных в данном документе, могут использоваться для фильтрации элюата из первой MCCS перед тем, как элюат подается во вторую MCCS.
Доочистка и очистка рекомбинантного терапевтического белка
Способы, описанные в данном документе, включают стадию очистки и доочистки рекомбинантного терапевтического белка с использованием второй MCCS, где элюат из MCC2 представляет собой терапевтическое белковое лекарственное вещество. Вторая MCCS может включать, по меньшей мере, одну (например, две, три или четыре) хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка и, по меньшей мере, одну (например, две, три или четыре) хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка.
По меньшей мере, одна хроматографическая колонка или хроматографическая мембрана, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может сдержать смолу, которая применяет механизм захвата (например, любой из механизмов захвата, описанных в данном документе или известных в данной области), или смолу, которая может использоваться для осуществления анионообменной, катионообменной или хроматографии на молекулярных систах. По меньшей мере, одна хроматографическая колонка или хроматографическая мембрана, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка, может содержать смолу, которая может использоваться для осуществления анионообменной, катионообменной или хроматографии на молекулярных ситах (например, любую из типовых смол для осуществления анионообменной, катионообменной или хроматографии на молекулярных ситах, описанных в данном документе или известных в данной области).
Размер, форма и объем, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, и/или размер, форма и объем, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, и/или они может быть любая комбинация типовых размеров, форм и объемов хроматографических колонок или хроматографических мембран, описанных в данном документе. Специалисту в данной области понятно, что очистка или доочистка рекомбинантного терапевтического белка может включать, например, стадии загрузки, отмывки, элюции и уравновешивания, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типовой операции очистки или доочистки рекомбинантного терапевтического белка. Как правило, буфер для элюции выходя из хроматографической колонки или хроматографической мембраны, используемых для осуществления типовой стадии очистки, содержит рекомбинантный терапевтический белок. Как правило, буфер для загрузки и/или промывки, выходя из хроматографической колонки или хроматографической мембраны, использованного для осуществления типовой стадии доочистки, содержит рекомбинантный терапевтический белок.
Например, размер, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может иметь объем, составляющий, например, примерно от 2 мл примерно до 200 мл (например, примерно от 2 мл примерно до 180 мл, примерно от 2 мл примерно до 160 мл, примерно от 2 мл примерно до 140 мл, примерно от 2 мл примерно до 120 мл, примерно от 2 мл примерно до 100 мл, примерно от 2 мл примерно до 80 мл, примерно от 2 мл примерно до 60 мл, примерно от 2 мл примерно до 40 мл, примерно от 5,0 мл примерно до 40 мл, примерно от 2 мл примерно до 30 мл, примерно от 5,0 мл примерно до 30 мл, примерно от 2 мл примерно до 25 мл). Скорость потока жидкости, содержащей рекомбинантный терапевтический белок, после его загрузки на, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может составлять, например, примерно от 0,1 мл/в минуту примерно до 25 мл/в минуту (например, примерно от 0,1 мл/в минуту примерно до 12,5 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 10 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 8 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 6 мл/в минуту, примерно от 0,1 мл/в минуту до 4 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 3 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 2 мл/в минуту, или примерно от 0,2 мл/в минуту примерно до 4 мл/в минуту). Концентрация рекомбинантного терапевтического белка в жидкости, загруженной, по меньшей мере, на одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может составлять, например, примерно от 0,05 мг/мл примерно до 100 мг/мл рекомбинантного терапевтического белка (например, примерно от 0,1 мг/мл примерно до 90 мг/мл, примерно от 0,1 мг/мл примерно до 80 мг/мл, примерно от 0,1 мг/мл примерно до 70 мг/мл, примерно от 0,1 мг/мл примерно до 60 мг/мл, примерно от 0,1 мг/мл примерно до 50 мг/мл, примерно от 0,1 мг/мл примерно до 40 мг/мл, примерно от 0,1 мг/мл примерно до 30 мг/мл, примерно от 0,1 мг/мл примерно до 20 мг/мл, от 0,5 мг/мл примерно до 20 мг/мл, примерно от 0,1 мг/мл примерно до 15 мг/мл, примерно от 0,5 мг/мл примерно до 15 мг/мл, примерно от 0,1 мг/мл примерно до 10 мг/мл, или примерно от 0,5 мг/мл примерно до 10 мг/мл рекомбинантного терапевтического белка). Смола, по меньшей мере, в одной хроматографической колонке или в хроматографической мембране, используемой для осуществления типового процесса очистки, может представлять собой смолу, которая может использоваться для осуществления анионообменной или катионообменной хроматографии. Смола, по меньшей мере, в одной хроматографической колонке или в хроматографической мембране, которая используется для осуществления типового процесса очистки, может представлять собой катионообменную смолу (например, смола Capto-S, GE Healthcare Life Sciences, Piscataway, NJ).
После загрузки рекомбинантного терапевтического белка, по меньшей мере, на одну хроматографическую колонку или на хроматографическую мембрану во второй MCCS, которая может использоваться для осуществления типовой процесс очистки рекомбинантного терапевтического белка, по меньшей мере, одна хроматографическая колонка или хроматографическая мембрана промывается с использованием, по меньшей мере, одного промывочного буфера. Из уровня техники понятно, что, по меньшей мере, один (например, два, три или четыре) промывочный буфер предназначен для элюции всех белков, которые не являются рекомбинантными терапевтическими белками, по меньшей мере, из одной хроматографической колонки или хроматографической мембраны, не разрушая при этом взаимодействие рекомбинантного терапевтического белка со смолой или не элюируя как-либо по-другому рекомбинантный терапевтический белок.
Промывочный буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем используемого промывочного буфера (например, объединенный суммарный объем промывочного буфера, когда используется более чем один буфер) может составлять, например, примерно от 1X колоночного объема (КО) примерно до 15X КО (например, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от 1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 5X КО примерно до 11X КО, или примерно от 5X КО примерно до 10X КО). Суммарное время промывки может составлять, например, примерно от 2 минут примерно до 3 часов (например, примерно от 2 минут примерно до 2,5 часов, примерно от 2 минут примерно до 2 часов, примерно от 5 минут примерно до 1,5 часов, примерно от 10 минут примерно до 1,5 часов, примерно от 10 минут примерно до 1,25 часа, примерно от 20 минут примерно до 1,25 минут, примерно от 30 минут примерно до 1 часа, примерно от 2 минут примерно до 10 минут, примерно от 2 минут примерно до 15 минут или примерно от 2 минут до 30 минут).
После промывки, по меньшей мере, одной хроматографической колонки или хроматографической мембраны во второй MCCS, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, рекомбинантный терапевтический белок элюируется из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны путем прохождения элюирующего буфера через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану во второй MCCS, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка. Элюирующий буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/мин примерно до 6 мл/в минуту, примерно от 1 мл/мин примерно до 5 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем используемого элюирующего буфера для элюции рекомбинантного терапевтического белка из каждой из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может составлять, например, примерно от 1X колоночного объема (КО) примерно до 25X КО (например, примерно от 1X КО примерно до 20X КО, примерно от 15X КО примерно до 25X КО, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от 1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 5X КО примерно до 11X КО или примерно от 5X КО примерно до 10X КО). Суммарное время элюции может составлять, например, примерно от 2 минут примерно до 3 часов (например, примерно от 2 минут примерно до 2,5 часов, примерно от 2 минут примерно до 2 часов, примерно от 2 минут примерно до 1,5 часов, примерно от 2 минут примерно до 1,25 часов, примерно от 2 минут примерно до 1 часа, примерно от 2 минут примерно до 40 минут, примерно от 10 минут примерно до 40 минут, примерно от 20 минут примерно до 40 минут или примерно от 30 минут и до 1 часа). Частные примеры элюирующих буферов, которые могут использоваться в данных методах, будут зависеть от смолы и/или от терапевтического белка. Например, элюирующий буфер может содержать различные концентрации соли (например, повышенную концентрацию соли), различные pH (например, повышенное или пониженное рН), или молекулу, которая будет конкурировать с рекомбинантным терапевтическим белком за связывание со смолой. Примеры таких элюирующих буферов для каждого типового механизма захвата, описанного в данном документе, хорошо известны в данной области.
После элюции рекомбинантного терапевтического белка из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны во второй MCCS, которая может использоваться для типового процесса очистки рекомбинантного терапевтического белка, и перед загрузкой следующего объема жидкости, содержащей рекомбинантный терапевтический белок может загружаться, по меньшей мере, на одну хроматографическую колонку или на хроматографическую мембрану, по меньшей мере одна хроматографическая колонка или хроматографическая мембрана должна быть уравновешена с использованием регенерирующего буфера. Регенерирующий буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка со скоростью потока примерно от 0,2 мл/мин примерно до 25 мл/в минуту (например, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/мин примерно до 10 мл/в минуту, примерно от 0,5 мл/мин примерно до 6 мл/в минуту, примерно от 1 мл/мин примерно до 5 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем регенерирующего буфера, используемого для уравновешивания, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, содержащей смолу, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может составлять, например, примерно от 1X колоночного объема (КО) примерно до 15X КО (например, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от 1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 5X КО примерно до 11X КО, или примерно от 5X КО примерно до 10X КО). Концентрация рекомбинантного терапевтического белка в элюате, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, может составлять, например, примерно от 0,05 мг/мл примерно до 100 мг/мл рекомбинантного терапевтического белка (например, примерно от 0,1 мг/мл примерно до 90 мг/мл, примерно от 0,1 мг/мл примерно до 80 мг/мл, примерно от 0,1 мг/мл примерно до 70 мг/мл, примерно от 0,1 мг/мл примерно до 60 мг/мл, примерно от 0,1 мг/мл примерно до 50 мг/мл, примерно от 0,1 мг/мл примерно до 40 мг/мл, примерно от 0,1 мг/мл примерно до 30 мг/мл, примерно от 0,1 мг/мл примерно до 20 мг/мл, от 0,5 мг/мл примерно до 20 мг/мл, примерно от 0,1 мг/мл примерно до 15 мг/мл, примерно от 0,5 мг/мл примерно до 15 мг/мл, примерно от 0,1 мг/мл примерно до 10 мг/мл, или примерно от 0,5 мг/мл примерно до 10 мг/мл рекомбинантного терапевтического белка).
По меньшей мере, одна хроматографическая колонка или хроматографическая мембрана, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка может содержать смолу, которая может использоваться для осуществления катионообменной, анионообменной или хроматографии на молекулярных ситах. Из уровня техники понятно, что доочистка рекомбинантного терапевтического белка с использованием, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка во второй MCCS может включать, например, стадии загрузки, прогона и регенерации, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типовой операции доочистки рекомбинантного терапевтического белка. Например, когда стадии загрузки, прогона и регенерации используются для осуществления доочистки рекомбинантный терапевтический белок не связывается со смолой, по меньшей мере, в одной хроматографической колонке или в хроматографической мембране во второй MCCS, которая используется для осуществления доочистки рекомбинантного терапевтического белка, и рекомбинантный терапевтический белок элюируется из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны в стадиях загрузки и прогона, и стадия регенерация используется для удаления любых примесей из, по меньшей мере, одной хроматографической колонки или хроматографической мембраны перед тем как может загружаться дополнительная жидкость, содержащая рекомбинантный терапевтический белок, на, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану. Типовые скорости потока и объемы буферов, используемые в каждой стадии загрузки, прогона и регенерации, описаны ниже.
Размер, форма и объем, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка, и/или размер, форма и объем, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса очистки рекомбинантного терапевтического белка, и/или они может быть любая комбинация типовых размеров, форм и объемов хроматографических колонок или хроматографических мембран, описанных в данном документе. Например, размер, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка, может иметь объем, составляющий, например, примерно от 0,5 мл примерно до 200 мл (например, примерно от 0,5 мл примерно до 180 мл, примерно от 0,5 мл примерно до 160 мл, примерно от 0,5 мл примерно до 140 мл, примерно от 0,5 мл примерно до 120 мл, примерно от 0,5 мл примерно до 100 мл, примерно от 0,5 мл примерно до 80 мл, примерно от 0,5 мл примерно до 60 мл, примерно от 0,5 мл примерно до 40 мл, примерно от 5,0 мл примерно до 40 мл, примерно от 0,5 мл примерно до 30 мл, примерно от 5,0 мл примерно до 30 мл, примерно от 0,5 мл примерно до 25 мл, примерно от 0,2 мл примерно до 10 мл, или примерно от 0,2 мл примерно до 5 мл). Скорость потока жидкости, содержащей рекомбинантный терапевтический белок, после его загрузки на, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка, может составлять, например, примерно от 0,1 мл/в минуту примерно до 25 мл/в минуту (например, примерно от 0,1 мл/в минуту примерно до 12,5 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 10 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 8 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 6 мл/в минуту, примерно от 0,1 мл/в минуту до 4 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 3 мл/в минуту, примерно от 2 мл/в минуту и до 6 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 2 мл/в минуту, или примерно от 0,2 мл/в минуту примерно до 4 мл/в минуту). Суммарный объем жидкости, содержащей рекомбинантный терапевтический белок, загруженный, по меньшей мере, на одну хроматографическую колонку или на хроматографическую мембрану, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка, может составлять, например, примерно от 1 мл примерно до 250 мл (например, примерно от 1 мл примерно до 225 мл, примерно от 1 мл примерно до 200 мл, примерно от 1 мл примерно до 175 мл, примерно от 1 мл примерно до 150 мл, примерно от 100 мл примерно до 125 мл, примерно от 100 мл примерно до 150 мл, примерно от 1 мл примерно до 150 мл, примерно от 1 мл примерно до 125 мл, примерно от 1 мл примерно до 100 мл, примерно от 1 мл примерно до 75 мл, примерно от 1 мл примерно до 50 мл, или примерно от 1 мл примерно до 25 мл). Смола, по меньшей мере, в одной хроматографической колонке или хроматографической мембране, используемой для осуществления доочистки, может быть анионообменной или катионообменной смолой. Смола, по меньшей мере, в одной хроматографической колонке или в хроматографической мембране, которая используется для осуществления типового процесса доочистки, может представлять собой катионообменную смолу (например, Sartobind® Q смола, Sartorius, Goettingen, Germany).
После стадии загрузки, по меньшей мере, одна колонка или хроматографическая мембрана во второй MCCS, которая может использоваться для типового процесса доочистки рекомбинантного терапевтического белка, осуществляют стадию вытеснения (chase)(например, вытесняющий буфер проходит через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану для сбора рекомбинантного терапевтического белка, который по существу не связан, по меньшей мере, с одной хроматографической колонкой или хроматографической мембраной). В этих примерах вытесняющий может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану со скоростью потока примерно от 0,2 мл/в минуту примерно до 50 мл/в минуту (например, примерно от 1 мл/в минуту примерно до 40 мл/в минуту, примерно от 1 мл/в минуту примерно до 30 мл/в минуту, примерно от 5 мл/в минуту примерно до 45 мл/в минуту, примерно от 10 мл/в минуту примерно до 40 мл/в минуту, примерно от 0,2 мл/в минуту примерно до 20 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 20 мл/в минуту, примерно от 0,2 мл/в минуту примерно до 15 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 15 мл/в минуту, примерно от 0,5 мл/в минуту примерно до 10 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 14 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем используемого вытесняющего буфера может составлять, например, примерно от 1X колоночного объема (КО) примерно до 100X КО (например, примерно от 1X КО примерно до 90X КО, примерно от 1X КО примерно до 80X КО, примерно от 1X КО примерно до 70X КО, примерно от 1X КО примерно до 60X КО, примерно от 1X примерно до 50X КО, примерно от 1X КО примерно до 40X КО, примерно от 1X КО примерно до 30X КО, примерно от 1X КО примерно до 20X КО, примерно от 1X КО примерно до 15X КО, примерно от 5X КО примерно до 20X КО, примерно от 5 X КО примерно до 30X КО, примерно от 1X КО примерно до 14X КО, примерно от1X КО примерно до 13X КО, примерно от1X КО примерно до 12X КО, примерно от1X КО примерно до 11X КО, примерно от2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от4X КО примерно до 11X КО, примерно от2.5X КО примерно до 5.0X КО, примерно от5X КО примерно до 11X КО, или примерно от5X КО примерно до 10X КО). Суммарное время вытеснения может составлять, например, примерно от 1 минуты примерно до 3 часов (например, примерно от 1 минуты примерно до 2,5 часов, примерно от 1 минут примерно до 2 часов, примерно от 1 минут примерно до 1,5 часов, примерно от 2 минут примерно до 1,5 часов, примерно от 1 минут примерно до 1,25 часа, примерно от 2 минут примерно до 1,25 часов, примерно от 1 минуты примерно до 5 минут, примерно от 1 минут примерно до 10 минут, примерно от 2 минут примерно до 4 минут, примерно от 30 минут примерно до 1 часа, примерно от 2 минут примерно до 10 минут, примерно от 2 минут примерно до 15 минут, или примерно от 2 минут и до 30 минут). Объединенная концентрация рекомбинантного терапевтического белка, присутствующего в элюате, проходя через стадию загрузки и стадию вытеснения, может составлять, например, примерно от 0,1 мг/мл примерно до 100 мг/мл рекомбинантного белка (например, примерно от 0,1 мг/мл примерно до 90 мг/мл, примерно от 0,1 мг/мл примерно до 80 мг/мл, примерно от 0,1 мг/мл примерно до 70 мг/мл, примерно от 0,1 мг/мл примерно до 60 мг/мл, примерно от 0,1 мг/мл примерно до 50 мг/мл, примерно от 0,1 мг/мл примерно до 40 мг/мл, примерно от 2,5 мг/мл примерно до 7,5 мг/мл, примерно от 0,1 мг/мл примерно до 30 мг/мл, примерно от 0,1 мг/мл примерно до 20 мг/мл, от 0,5 мг/мл примерно до 20 мг/мл, примерно от 0,1 мг/мл примерно до 15 мг/мл, примерно от 0,5 мг/мл примерно до 15 мг/мл, примерно от 0,1 мг/мл примерно до 10 мг/мл, примерно от 0,5 мг/мл примерно до 10 мг/мл или примерно от 1 мг/мл примерно до 5 мг/мл рекомбинантного терапевтического белка).
После стадии вытеснения и перед загрузкой следующего объема жидкости, содержащей рекомбинантный терапевтический белок, по меньшей мере, на одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса доочистки, где по меньшей мере, одна хроматографическая колонка или хроматографическая мембрана должна регенерироваться с использованием регенерирующего буфера. Регенерирующий буфер может проходить через, по меньшей мере, одну хроматографическую колонку или хроматографическую мембрану, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка со скоростью потока примерно от 0,2 мл/мин примерно до 50 мл/в минуту (например, примерно от 1 мл/мин примерно до 40 мл/в минуту, примерно от 1 мл/мин примерно до 30 мл/в минуту, примерно от 5 мл/мин примерно до 45 мл/в минуту, примерно от 10 мл/мин примерно до 40 мл/в минуту, примерно от 0,2 мл/мин примерно до 20 мл/в минуту, примерно от 0,5 мл/мин примерно до 20 мл/в минуту, примерно от 0,2 мл/мин примерно до 15 мл/в минуту, примерно от 0,5 мл/в минуту и примерно до 15 мл/в минуту, примерно от 1 мл/в минуту примерно до 25 мл/в минуту, примерно от 1 мл/в минуту примерно до 15 мл/в минуту). Объем регенерирующего буфера, используемого для регенерации, по меньшей мере, одной хроматографической колонки или хроматографической мембраны, которая может использоваться для осуществления типового процесса доочистки, может составлять, например, примерно от 1X колоночного объема (КО) примерно до 500X КО (например, примерно от 1X КО примерно до 450X КО, примерно от 1X КО примерно до 400X КО, примерно от 1X КО примерно до 350X КО, примерно от 1X КО примерно до 300X КО, примерно от 1X примерно до 250X КО, примерно от 1X КО примерно до 200X КО, примерно от 1X КО примерно до 150X КО, примерно от 1X КО примерно до 100X КО, примерно от 1X КО примерно до 90X КО, примерно от 1X КО примерно до 80X КО, примерно от 1X КО примерно до 70X КО, примерно от 1X КО примерно до 60X КО, примерно от 1X примерно до 50X КО, примерно от 1X КО примерно до 40X КО, примерно от 1X КО примерно до 30X КО, примерно от 1X КО примерно до 20X КО, примерно от 1X КО примерно до 15X КО, примерно от 5X КО примерно до 20X КО, примерно от 5X КО примерно до 30X КО, примерно от 1X КО примерно до 14X КО, примерно от 1X КО примерно до 13X КО, примерно от1X КО примерно до 12X КО, примерно от 1X КО примерно до 11X КО, примерно от 2X КО примерно до 11X КО, примерно от 3X КО примерно до 11X КО, примерно от 4X КО примерно до 11X КО, примерно от 2,5X КО примерно до 5,0X КО, примерно от 5X КО примерно до 11X КО, или примерно от 5X КО примерно до 10X КО).
В других примерах одна или несколько хроматографических колонок и/или хроматографических мембран, используемых для осуществления типового процесса доочистки, содержат смолу, которая селективно связывает или удерживает примеси, присутствующие в жидкости, содержащей рекомбинантный терапевтический белок, и вместо стадии регенерации одной или нескольких колонок и/или мембран одна или несколько колонок и/или мембран заменяются на по существу аналогичные колонки и/или мембраны после того, как способность связывания смолы в одной или нескольких колонках или в хроматографической мембране не достигнет или существенно не приблизится к уровню насыщения.
В некоторых примерах данных способов вторая MCCS включает PCCS, содержащую три хроматографические колонки и одну хроматографическую мембрану, например, где три хроматографические колонки в PCCS осуществляют типовой процесс очистки рекомбинантного терапевтического белка (например, с использованием, по меньшей мере, одной хроматографической колонки, которая может использоваться для осуществления типового процесса очистки белка), и хроматографическая мембрана в PCCS осуществляет типовой процесс доочистки рекомбинантного терапевтического белка. В этих примерах хроматографическая мембрана в PCCS, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка, может быть любой из типов хроматографических мембран, описанных в данном документе, которые могут использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка. Любой из способов переключения колонок, описанных в данном документе, может использоваться для определения того, когда первые три хроматографические колонки и хроматографическая мембрана в PCCS в данном примере могут переключаться.
Некоторые воплощения данного примера могут дополнительно включать стадию регуляции ионной концентрации и/или pH элюата из трех хроматографических колонок в PCCS перед подачей элюата в хроматографическую мембрану в PCCS. Как описано в данном документе, ионная концентрация и/или pH элюата из трех хроматографических колонок в PCCS может регулироваться (перед подачей в хроматографическую мембрану в PCCS в данном примере)) путем добавления буфера к элюату из трех хроматографических колонок в PCCS (например, путем использования встроенного резервуара для регуляции буфера). Буфер может добавляться к элюату со скоростью потока, составляющей, например, примерно от 0,1 мл/в минуту примерно до 15 мл/в минуту (например, примерно от 0,1 мл/в минуту примерно до 12,5 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 10 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 8 мл/в минуту, примерно от 0,1 мл/в минуту примерно до 6 мл/в минуту, примерно от 0,1 мл/в минуту до 4 мл/в минуту, или примерно от 0,5 мл/в минуту примерно до 5 мл/в минуту).
Эти примеры могут дополнительно включать стадию удерживания или хранения элюата из трех хроматографических колонок в PCCS в данном примере перед подачей элюата в хроматографическую мембрану (в хроматографическую мембрану, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка). Как описано в данном документе, стадия удерживания или хранения может осуществляться с использованием любого из резервуаров (например, резервных емкостей), описанных в данном документе.
Эти примеры также могут включать стадию фильтрации элюата из хроматографической мембраны в типовой системе PCCS (элюат хроматографической мембраны, которая может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка). Любой из типовых фильтров или способов фильтрации, описанных в данном документе, могут использоваться для фильтрации элюата из хроматографической мембраны в данной типовой PCCS (элюат хроматографической мембраны, который может использоваться для осуществления типового процесса доочистки рекомбинантного терапевтического белка).
Из уровня техники понятно, что терапевтическое белковое лекарственное вещество может периодически элюироваться из второй MCCS с использованием любого из способов, описанных в данном документе. Например, любой из способов, описанных в данном документе, может элюировать терапевтическое белковое лекарственное вещество в течение периода времени продолжительностью примерно от 30 секунд примерно до 5 часов (например, примерно от 1 минут примерно до 4 часов, примерно от 1 минуты примерно до 3 часов, примерно от 1 минуты примерно до 2 часов, примерно от 1 минуты или примерно до 1,5 часов, примерно от 1 минуты примерно до 1 часа, примерно от 1 минут примерно до 30 минут) с частотой, например, примерно от 1 минуты примерно до 6 часов (например, примерно от 1 минуты примерно до 5 часов, примерно от 1 минуты примерно до 4 часов, примерно от 1 минуты примерно до 3 часов, примерно от 1 минуты до 2 часов, примерно от 1 минуты до 1 часа, или примерно от 1 минуты до 30 минут), в зависимости от, например, хроматографических колонок и/или хроматографических мембран, используемых в первой и во второй MCCS.
Методы культивирования
Некоторые из способов, описанных в данном документе, дополнительно включают стадию культивирования клеток (например, рекомбинантных клеток млекопитающих), которые секретируют рекомбинантный терапевтический белок, в биореакторе (например, в перфузионном или в подпитываемом биореакторе), который содержит жидкую культуральную среду, где объем жидкой культуральной среды, которая по существу свободна от клеток (например, клеток млекопитающих), непрерывно или периодически удаляется из перфузионного биореактора и подается в первую многоколоночную хроматографическую систему (MCCS1). Биореактор имеет объем, составляющий, например, примерно от 1 Л примерно до 10000 Л (например, примерно от 1 Л примерно до 50 Л, примерно от 50 Л примерно до 500 Л, примерно от 500 Л примерно до 1000 Л, от 500 Л примерно до 5000 Л, примерно от 500 Л примерно до 10000 Л, примерно от 5000 Л примерно до 10000 Л, примерно от 1 Л примерно до 10000 Л, примерно от 1 Л примерно до 8000 Л, примерно от 1 Л примерно до 6000 Л, примерно от 1 Л примерно до 5000 Л, примерно от 100 Л примерно до 5000 Л, примерно от 10 Л примерно до 100 Л, примерно от 10 Л примерно до 4000 Л, примерно от 10 Л примерно до 3000 Л, примерно от 10 Л примерно до 2000 Л или примерно от 10 Л примерно до 1000 Л). Количество жидкой культуральной среды в биореакторе может составлять, например, примерно от 0,5 Л примерно до 500 Л (например, примерно от 0,5 Л примерно до 25 Л, примерно от 25 Л примерно до 250 Л, примерно от 250 Л примерно до 500 Л, от 250 Л примерно до 2500 Л, примерно от 250 Л примерно до 5000 Л, примерно от 0,5 Л примерно до 5000 Л, примерно от 0,5 Л примерно до 4000 Л, примерно от 0,5 Л примерно до 3000 Л, примерно от 0,5 Л примерно до 3000 Л, примерно от 0,5 Л примерно до 2500 Л, примерно от 50 Л примерно до 2500 Л, примерно от 5 Л примерно до 50 Л, примерно от 5 Л примерно до 2000 Л, примерно от 5 Л примерно до 1500 Л, примерно от 5 Л примерно до 1000 Л или примерно от 5 Л примерно до 500 Л). Культивирование клеток может осуществляться, например, с использованием подпитываемого биореактора или перфузионного биореактора. Частные примеры и различные аспекты культивирования клеток (например, культивирование клеток млекопитающих) описаны ниже и могут использоваться в любой комбинации.
Клетки
Клетки, которые культивируют в некоторых из способов, описанных в данном документе, могут представлять собой бактерии (например, грам-отрицательные бактерии), дрожжи (например, Saccharomyces cerevisiae, Pichia pastoris, Hansenula polymorpha, Kluyveromyces lactis, Schizosaccharomyces pombe, Yarrowia lipolytica, или Arxula adeninivorans), или клетки млекопитающих. Клетка млекопитающего может представлять собой клетку, которая растет в суспензии или является адгезионной клеткой. Частные примеры клеток млекопитающих, которые могут культивироваться в любом из способов, описанных в данном документе, включают: Клетки яичника китайского хомяка (CHO) (например, клетки CHO DG44 или клетки CHO-K1s), Sp2.0, миеломные клетки (например, NS/0), B-клетки, гибридомные клетки, T-клетки, человеческие эмбриональные клетки почки (HEK) (например, HEK 293E и HEK 293F), Эпителиальные клетки африканской зеленой мартышки (Vero), и эпителиальные клетки Мадин-Дарби почки собаки (Коккер Спаниэль) (MDCK). В некоторых примерах, где культивируются адгезионные клетки, культура также может содержать множество микроносителей (например, микроносители, которые содержат одну или несколько пор). Дополнительные клетки млекопитающих, которые могут культивироваться в любом из способов, описанных в данном документе, известны в данной области.
Клетка млекопитающего может содержать рекомбинантную нуклеиновую кислоту (например, нуклеиновую кислоту, стабильно интегрированную в геном клетки млекопитающего), которая кодирует рекомбинантный терапевтический белок. Частные примеры рекомбинантных нуклеиновых кислот, которые кодируют типовые рекомбинантные терапевтические белки, описаны ниже, так как представляют собой рекомбинантные терапевтические белки, которые могут быть получены с использованием способов, описанных в данном документе. В некоторых примерах, клетка млекопитающего, которая культивируется в биореакторе (например, в любом из биореакторов, описанных в данном документе), была выделена из более крупных культур.
Нуклеиновая кислота, кодирующая рекомбинантный терапевтический белок, может вводиться в клетку млекопитающего с использованием широкого спектра способов, известных в молекулярной биологии и в молекулярной генетике. Частные примеры включают трансфекцию (например, липофекцию), трансдукцию (например, лентивирусную, аденовирусную или ретровирусную инфекцию) и электропорацию. В некоторых примерах, нуклеиновая кислота, которая кодирует рекомбинантный терапевтический белок, не стабильно интегрирована в хромосому клетки млекопитающего (транзиторная трансфекция), в то время как в других нуклеиновые кислоты являются интегрированными. Альтернативно или дополнительно, нуклеиновая кислота, кодирующая рекомбинантный терапевтический белок, может присутствовать в плазмиде и/или в искусственной хромосоме млекопитающего (например, в человеческой искусственной хромосоме). Альтернативно или дополнительно, нуклеиновая кислота может вводиться в клетку с использованием вирусного вектора (например, лентивирусный, ретровирусный или аденовирусный вектор). Нуклеиновая кислота может быть функционально связана с промоторной последовательностью (например, с сильным промотором, таким как промотор β-актина и CMV-промотор, или индуцируемый промотор). Вектор, содержащий нуклеиновую кислоту, также может, если целесообразно, содержать селектируемый маркер (например, ген, который придает клеткам млекопитающих устойчивость к гигромицину, пуромицину или неомицину).
В некоторых примерах, рекомбинантный терапевтический белок представляет собой секретируемый белок, который высвобождается клеткой млекопитающего во внеклеточное пространство (например, первая и/или вторая жидкая культуральная среда). Например, последовательность нуклеиновой кислоты, кодирующая растворимый терапевтический белок, может содержать последовательность, которая кодирует сигнальный пептид секреции на N- или на C-конце рекомбинантного терапевтического белка, который отщепляется с помощью фермента, присутствующего в клетках млекопитающего, и затем высвобождается во внеклеточное пространство (например, в первую и/или во вторую жидкую культуральную среду).
Культуральная среда
Жидкие культуральные среды известны в данной области. Жидкая культуральная среда (например, первая и/или вторая культуральная среда может снабжаться сывороткой млекопитающего (например, фетальной телячьей сывороткой и бычьей сывороткой), и/или гормоном роста или фактором роста (например, инсулином, трансферрином и эпидермальным фактором роста). Альтернативно или дополнительно, жидкая культуральная среда (например, первая и/или вторая культуральная среда) может быть жидкой культуральной средой определенного химического состава, может быть свободной от компонента, выделенного из животного, бессывороточной жидкой культуральной средой или может быть жидкой культуральной средой, содержащей сыворотку. Частные примеры жидкой культуральной среды с определенным химическим составом, свободной от компонента, выделенного из животного, бессывороточной жидкой культуральной среды или жидкой культуральной среды, содержащей сыворотку, являются коммерчески доступными.
Жидкая культуральная среда, как правило, содержит источник энергии (например, углевод, такой как глюкоза), необходимые аминокислоты (например, основной набор из двадцати аминокислот вместе с цистеином), витамины и/или другие органические соединения, требующиеся в низких концентрациях, свободные жирные кислоты и/или редкие элементы. Жидкая культуральная среда (например, первая и/или вторая жидкая культуральная среда) может, если это целесообразно, снабжаться, например, гормоном млекопитающего или фактором роста (например, инсулином, трансферрином или эпидермальным фактором роста), солями и буферами (например, солями кальция, магния и фосфатами), нуклеозидами и основаниями (например, аденозином, тимидином и гипоксантином), белками и тканевыми гидролизатами и/или любой комбинацией этих добавок.
В данной области известен широкий спектр различных жидких культуральных сред может использоваться для культивирования клеток (например, клеток млекопитающего) в любом из способов, описанных в данном документе. Компоненты среды, которые также могут использоваться в способах настоящего изобретения, включают в частности гидролизаты определенного химического состава (CD), например, CD пептон, CD полипептиды (две или более аминокислот), и CD факторы роста. Дополнительные примеры жидкой культуральной среды и компонентной среды известны в данной области.
Специалистам-практикам данной области будет понятно, что первая жидкая культуральная среда и вторая жидкая культуральная среда, описанные в данном документе, могут быть средами одного типа или средами различных типов.
Дополнительные свойства типовых биореакторов
Внутренняя поверхность любого из биореакторов, описанных в данном документе, может иметь, по меньшей мере, одно покрытие (например, по меньшей мере, одно покрытие из желатина, коллагена, поли-L-орнитина, полистирола и ламинина), и как известно в данной области, один или несколько портов для барботажа O2, CO2, и N2 в жидкой культуральной среде, и механизм перемешивания для агитации жидкой культуральной среды. Биореактор может включать культуральную среду в атмосфере с контролируемой влажностью (например, с влажностью выше чем 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, или 95%, или с влажностью 100%). Биореактор также может быть оборудован механическим устройством, которое способно удалять объем жидкой культуральной среды из биореактора, и необязательно фильтром внутри механического устройства, который удаляет клетки из жидкой культуральной среды во время процесса переноса жидкой культуральной среды из биореактора (например, система ATF).
Температура
Стадия культивирования клеток млекопитающих может осуществляться при температуре примерно от 31°C примерно до 40°C. Специалистам-практикам будет понятно, что температура может изменяться в конкретные моменты времени во время стадии культивирования, например, на ежечасной или ежедневной основе. Например, температура может изменяться или сдвигаться (например, повышаться или понижаться) примерно на один день, два дня, три дня, четыре дня, пять дней, шесть дней, семь дней, восемь дней, девять дней, десять дней, одиннадцать дней, двенадцать дней, четырнадцать дней, пятнадцать дней, шестнадцать дней, семнадцать дней, восемнадцать дней, девятнадцать дней, или примерно двадцать дней или более после исходного высевания клеток в биореактор (например, клеток млекопитающего). Например, температура может сдвигаться вверх (например, изменяться до или около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или до или около 20°C). Например, температура может сдвигаться вниз (например, изменение до или около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или до или около 20°C).
CO2
Стадия культивирования, описанная в данном документе, может дополнительно включать экспонирование жидкой культуральной среды в биореакторе с атмосферой, содержащей по большей мере или примерно 15% CO2 (например, по большей мере или примерно 14% CO2, 12% CO2, 10% CO2, 8% CO2, 6% CO2, 5% CO2, 4% CO2, 3% CO2, 2% CO2, или по большей мере или примерно 1% CO2).
Перфузионный биореактор
Стадия культивирования, описанная в данном документе, может осуществляться с использованием перфузионного биореактора. Культивирование клетки (например, клетки млекопитающего) в перфузионном биореакторе включает удаление из биореактора первой жидкой культуральной среды (например, содержащей любую концентрацию клеток млекопитающих, например, первый объем первой жидкой культуральной среды, который по существу свободен от клеток), и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды. Удаление и добавление может осуществляться одновременно или последовательно или в комбинации друг с другом. Кроме того, удаление и добавление может осуществляться непрерывно (например, со скоростью, с которой удаляют или заменяют объем, составляет от 0,1% до 800% (например, от 1% до 700%, от 1% до 600%, от 1% до 500%, от 1% до 400%, от 1% до 350%, от 1% до 300%, от 1% до 250%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80%, от 4% до 30%) объема биореактора или первой жидкой культуральной среды в течение любого данного периода времени (например, более 24-часового периода, более поступательно увеличивающегося периода примерно от 1 часа примерно до 24 часов, или более поступательно увеличивающегося периода, который выше чем 24 часа)) или периодически (например, один раз каждый третий день, один раз каждый следующий день, раз в день, дважды в день, три раза в день, четыре раза в день или пять раз в день), или любая их комбинация. В случае, где имеется периодичность, объем, который удаляют или заменяют (например, в течение примерно 24-часового периода, внутри поступательно увеличивающегося периода времени примерно от 1 часа примерно до 24 часов, или в течение поступательно увеличивающегося периода времени выше чем 24 часа) может составлять, например от 0,1% до 800% (например, от 1% до 700%, от 1% до 600%, от 1% до 500%, от 1% до 400%, от 1% до 300%, от 1% до 200%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80%, от 4% до 30%) объема биореактора или объема первой жидкой культуральной среды. Первый удаляемый объем первой жидкой культуральной среды и второй добавляемый объем второй жидкой культуральной среды может в некоторых случаях быть приблизительно одинаковым в течение около 24-часового периода (или, альтернативно, поступательно увеличивающегося период времени примерно от 1 часа примерно до 24 часов или поступательно увеличивающегося периода времени выше чем 24 часа) в течение всего или части периода культивирования. Как известно в данной области скорость, с которой удаляется первый объем первой жидкой культуральной среды (объем/на единицу времени), и скорость, с которой добавляется второй объем жидкой культуральной среды (объем/на единицу времени), может варьироваться Скорость, с которой удаляется первый объем первой жидкой культуральной среды (объем/на единицу времени), и скорость, с которой добавляется второй объем второй жидкой культуральной среды (объем/на единицу времени), может быть примерно одинаковым или может быть различным.
Альтернативно, удаляемый и добавляемый объем может изменяться (например, может поступательно повышаться) в течение каждого 24-часового периода (или альтернативно, поступательно увеличивающегося периода времени от 1 часа примерно до 24 часов или поступательно увеличивающегося периода времени выше чем 24 часа) во время периода культивирования. Например, удаляемый объем первой жидкой культуральной среды и добавляемый объем второй жидкой культуральной среды в течение каждого 24-часового периода (или альтернативно, поступательно увеличивающегося периода примерно от 1 часа и более 24 часов или поступательно увеличивающегося периода времени выше чем 24 часа) в течение периода культивирования может повышаться (например, поступательно или ступенчатое прирастание) в течение периода культивирования от объема, который составляет от 0,5% примерно до 20% объема биореактора или объема первой жидкой культуральной среды примерно до 25%, примерно до 150% объема биореактора или объема первой жидкой культуральной среды.
Специалисту-практику будет понятно, что первая жидкая культуральная среда и вторая жидкая культуральная среда могут быть средами одного типа. В других примерах, первая жидкая культуральная среда и вторая жидкая культуральная среда могут быть различными.
Первый объем первой жидкой культуральной среды может удаляться, например, с помощью механической системы, которая может удалять первый объем первой жидкой культуральной среды из биореактора (например, первый объем первой жидкой культуральной среды, который по существу свободен от клеток). Альтернативно или дополнительно, первый объем первой жидкой культуральной среды может удаляться путем стекания или гравитационного потока первого объема первой жидкой культуральной среды через стерильную мембрану с пороговым значением молекулярной массы, который исключает клетки (например, клетки млекопитающих).
Второй объем второй жидкой культуральной среды может добавляться к первой жидкой культуральной среде автоматически, например, с помощью перфузионного насоса.
В некоторых случаях, удаление первого объема первой жидкой культуральной среды (например, первого объема первой жидкой культуральной среды, которая по существу свободна от клеток млекопитающих) и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды не происходит с интервалом, по меньшей мере, 1 час (например, с интервалом 2 часа, с интервалом 3 часа, с интервалом 4 часа, с интервалом 5 часов, с интервалом 6 часов, с интервалом 7 часов, с интервалом 8 часов, с интервалом 9 часов, с интервалом 10 часов, с интервалом 12 часов, с интервалом 14 часов, с интервалом 16 часов, с интервалом 18 часов, с интервалом 24 часов, с интервалом 36 часов, с интервалом 48 часов, с интервалом 72 часов, с интервалом 96 часов, или после 96 часов) после посева клеток млекопитающих в биореактор.
Подпитываемый биореактор
Стадия культивирования, описанная в данном документе, может осуществляться с использованием подпитываемого биореактора. Культивирование клеток в подпитываемом биореакторе включает в течение большей части периода культивирования, добавление (например, периодическое или непрерывное добавление) к первой жидкой культуральной среде второго объема второй жидкой культуральной среды. Добавление второй жидкой культуральной среды может осуществляться непрерывно (например, со скоростью, которая добавляет объем от 0,1% до 300% (например, от 1% до 250%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80%, до от 4% до 30%) объема биореактора или первой жидкой культуральной среды в течение любого данного периода времени (например, в течение 24-часового периода, в течение поступательно увеличивающегося периода времени примерно от 1 часа примерно до 24 часов или в течение поступательно увеличивающегося периода времени выше чем 24 часа)) или периодически (например, в течение каждого третьего дня, один раз каждый следующий день, раз в день, дважды в день, три раза в день, четыре раза в день или пять раз в день), или любая их комбинация. В случае, где имеется периодичность, объем, который добавляют (например, в течение примерно 24-часового периода, внутри поступательно увеличивающегося периода времени примерно от 1 часа примерно до 24 часов, или в течение поступательно увеличивающегося периода времени выше чем 24 часа) может составлять, например от 0,1% до 300% (например, от 1% до 200%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% и от 4% до 30%) объема биореактора или объема первой жидкой культуральной среды. Второй добавляемый объем второй жидкой культуральной среды может в некоторых случаях быть приблизительно одинаковым в течение примерно каждого 24-часового периода (или, альтернативно, поступательно увеличивающегося периода времени примерно от 1 часа примерно до 24 часов или поступательно увеличивающегося периода времени выше чем 24 часа) в течение всего или части периода культивирования. Как известно в данной области скорость, с которой добавляется второй объем второй жидкой культуральной среды (объем/на единицу времени), может варьироваться в течение всего периода культивирования или в течение части периода культивирования. Например, добавляемый объем второй жидкой культуральной среды может изменяться (например, может поступательно повышаться) в течение каждого 24-часового периода (или альтернативно, поступательно увеличивающегося периода времени от 1 часа примерно до 24 часов или поступательно увеличивающегося периода времени выше чем 24 часа) во время периода культивирования. Например, добавляемый объем второй жидкой культуральной среды в течение каждого 24-часового периода (или альтернативно, поступательно увеличивающегося периода примерно от 1 часа и более 24 часов или поступательно увеличивающегося периода времени выше чем 24 часа) в течение периода культивирования может повышаться (например, поступательно или ступенчатым прирастанием) в течение периода культивирования от объема, который составляет от 0,5% примерно до 20% объема биореактора или объема первой жидкой культуральной среды примерно до 25%, примерно до 150% объема биореактора или объема первой жидкой культуральной среды. Скорость, с которой добавляется второй объем второй жидкой культуральной среды (объем/на единицу времени), может быть одинаковой в течение всего периода культивирования или в течение части периода культивирования.
Специалисту-практику будет понятно, что первая жидкая культуральная среда и вторая жидкая культуральная среда могут быть средами одного типа. В других примерах, первая жидкая культуральная среда и вторая жидкая культуральная среда могут быть различными. Второй объем второй жидкой культуральной среды может добавляться к первой жидкой культуральной среде автоматически, например, с помощью перфузионного насоса.
В некоторых случаях, добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды не происходит с интервалом, по меньшей мере, 1 час (например, с интервалом 2 часа, с интервалом 3 часа, с интервалом 4 часа, с интервалом 5 часов, с интервалом 6 часов, с интервалом 7 часов, с интервалом 8 часов, с интервалом 9 часов, с интервалом 10 часов, с интервалом 12 часов, с интервалом 14 часов, с интервалом 16 часов, с интервалом 18 часов, с интервалом 24 часов, с интервалом 36 часов, с интервалом 48 часов, с интервалом 72 часов, с интервалом 96 часов, или после 96 часов) после посева клеток млекопитающих в биореактор. Культуральная среда в подпитываемых культурах, как правило, собирается в конце периода культивирования и используется в лбом из способов, описанных в данном документе, однако культуральная среда в подпитываемых культурах также может собираться в один или в несколько моментов времени во время периода культивирования и использоваться в любом из способов, описанных в данном документе.
Специалистам-практикам будет понятно, что любой из различных параметров культивирования (например, контейнеры, объемы скорости или частота замены культурального объема, частота агитации, температуры, среды и концентрации CO2) могут использоваться в любой комбинации для осуществления данных способов. Кроме того, любые из клеток млекопитающих, описанных в данном документе, могут использоваться для продуцирования рекомбинантного белка.
Типовые преимущества
Способы, описанные в данном документе, могут приводить в результате к существенному повышению волюметрической продуктивности рекомбинантного терапевтического белка, присутствующего в терапевтическом белковом лекарственном веществе. Например, способы, описанные в данном документе, могут приводить в результате к повышению, по меньшей мере, в 2 раза, 3 раза, 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз и в 10 раз волюметрической продуктивности рекомбинантного терапевтического белка, присутствующего в терапевтическом белковом лекарственном веществе. Биологическая активность рекомбинантного терапевтического белка может быть оценена с помощью множества способов, известных в данной области, и будет зависеть от активности специфического рекомбинантного терапевтического белка. Например, биологическая активность рекомбинантного терапевтического белка, который является иммуноглобулином (например, антителом или антительным фрагментом) может быть определена путем измерения аффинности рекомбинантного терапевтического антитела при связывании со специфическим эпитопом (например, с помощью Biocore или конкурентных иммуноферментных анализов). Рекомбинантный терапевтический белок может быть ферментом (например, рекомбинантной галактозидазой, например, рекомбинантной альфа-галактозидазой) и биологическая активность может быть определена путем измерения активность рекомбинантного терапевтического фермента (например, определением константы каталитической скорости для рекомбинантного терапевтического фермента путем измерения снижения концентрации детектируемого субстрата или увеличения концентрации детектируемого продукта (например, с помощью спектрофотометрии или световой эмиссии). Например, биологическая активность рекомбинантной терапевтической галактозидазы может быть обнаружена измерением снижения уровня глоботриазилцерамида (GL-3)или галабиозилцерамида, или увеличения уровня церамид дигексозида или галактозы.
Способы, описанные в данном документе, могут привести к увеличению процента выхода рекомбинантного терапевтического белка (например, повышенного процента выхода рекомбинантного терапевтического белка, присутствующего в жидкой культуральной среде в терапевтическом белковом лекарственном веществе). Например, настоящие процессы могут дать процентный выход рекомбинантного терапевтического белка выше чем примерно 70%, выше чем примерно 80%, выше чем примерно 82%, выше чем примерно 84%, выше чем примерно 86%, выше чем примерно 88%, выше чем примерно 90%, выше чем примерно 92%, выше чем примерно 94%, выше чем примерно 96%, или выше чем примерно 98%. Настоящие процессы могут привести к проценту выхода от примерно 80% до 90%, от примерно 82% до 90%, от примерно 84% до 90%, от примерно 84% до примерно 88%, от 84% до примерно 94%, от примерно 82% примерно 92%, или от примерно 85% до примерно 95%.
Концентрация рекомбинантного терапевтического белка, присутствующего в терапевтическом белковом лекарственном веществе может быть более чем примерно 1 мг/мл, более чем примерно 1,5 мг/мл, более чем примерно 2 мг/мл, более чем примерно 2,5 мг/мл, более чем примерно 3 мг/мл, более чем примерно 3,5 мг/мл, более чем примерно 4 мг/мл, более чем примерно 4,5 мг/мл, более чем примерно 5 мг/мл, более чем примерно 5,5 мг/мл, более чем примерно 6 мг/мл, более чем примерно 6,5 мг/мл, более чем примерно 7 мг/мл, более чем примерно 7,5 мг/мл, более чем примерно 8 мг/мл, более чем примерно 8,5 мг/мл, более чем примерно 9 мг/мл, более чем примерно 10 мг/мл, более чем примерно 12,5 мг/мл, или более чем примерно 15 мг/мл.
Способы, описанные в данном документе, могут приводить в результате к чистому выходу рекомбинантного терапевтического белка в терапевтическое белковое лекарственное вещество, который составляет, по меньшей мере, примерно, 5 г/день, по меньшей мере, примерно 7 г/день, по меньшей мере, примерно 8 г/день, по меньшей мере, примерно 9 г/день, по меньшей мере, примерно 10 г/день, по меньшей мере, примерно 11 г/день, по меньшей мере, примерно 13 г/день, по меньшей мере, примерно 14 г/день, по меньшей мере, примерно 15 г/день, по меньшей мере, примерно 16 г/день, по меньшей мере, примерно 17 г/день, по меньшей мере, примерно 19 г/день, по меньшей мере, примерно 20 г/день, по меньшей мере, примерно 25 г/день, по меньшей мере, примерно 30 г/день, по меньшей мере, примерно 35 г/день, по меньшей мере, примерно 5 г/день, по меньшей мере, примерно 15 г/день, по меньшей мере, примерно 25 г/день, или, по меньшей мере, примерно 35 г/день в течение продолжительного периода, составляющего, по меньшей мере, примерно 6 дней, по меньшей мере, примерно 12 дней, по меньшей мере, примерно 18 дней, по меньшей мере, примерно 40 дней, по меньшей мере, примерно 10 дней, по меньшей мере, примерно 20 дней, по меньшей мере, примерно 30 дней, по меньшей мере, примерно 40 дней, по меньшей мере, примерно 45 дней, по меньшей мере, примерно 50 дней, по меньшей мере, примерно 55 дней, по меньшей мере, примерно 60 дней, по меньшей мере, примерно 65 дней, по меньшей мере, примерно 70 дней, по меньшей мере, примерно 75 дней, по меньшей мере, примерно 80 дней, по меньшей мере, примерно 85 дней, по меньшей мере, примерно 90 дней, по меньшей мере, примерно 95 дней, по меньшей мере, примерно 100 дней, по меньшей мере, примерно 110 дней, по меньшей мере, примерно 120 дней, по меньшей мере, примерно 130 дней, по меньшей мере, примерно 140 дней, по меньшей мере, примерно 150 дней, по меньшей мере, примерно 160 дней, по меньшей мере, примерно 170 дней, по меньшей мере, примерно 180 дней, по меньшей мере, примерно 190 дней, по меньшей мере, примерно 200 дней, по меньшей мере, примерно 210 дней, по меньшей мере, примерно 220 дней, по меньшей мере, примерно 230 дней, по меньшей мере, примерно 240 дней, по меньшей мере, примерно 250 дней, по меньшей мере, примерно 260 дней, по меньшей мере, примерно 270 дней, по меньшей мере, примерно 280 дней, по меньшей мере, примерно 290 дней, по меньшей мере, примерно 300 дней, по меньшей мере, примерно 310 дней, по меньшей мере, примерно 320 дней, по меньшей мере, примерно 330 дней, по меньшей мере, примерно 340 дней, по меньшей мере, примерно 350 дней или, по меньшей мере, примерно 365 дней.
Способы, представленные в данном документе могут дать значимо улучшенный удельный коэффициент производительности. Например, удельный коэффициент продуктивности достигнутый в рекомбинантном белковом лекарственном веществе составляет по меньшей мере, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз, 110 раз, 120 раз, 130 раз, 140 раз, 150 раз, 160 раз, 170 раз, 180 раз, 190 раз или в 200 раз выше, чем удельный коэффициент производительности, полученный с помощью другого процесса (например, периодического процесса очистки или процесса, который не является интегрированным и/или непрерывным). Продуктивность в рекомбинантном белковом лекарственном веществе, достигаемая с помощью настоящих процессов, может составлять, по меньшей мере, 10000 единиц/л, по меньшей мере, 15000 единиц/л, по меньшей мере, примерно 20000 единиц/л, по меньшей мере, примерно 25000 единиц/л по меньшей мере, примерно 30000 единиц/л, по меньшей мере, примерно 35000 единиц/л или по меньшей мере, примерно 40000 единиц/л (в первой и/или во второй жидкой культуральной среде). Продуктивность в рекомбинантном белковом лекарственном веществе, достигаемая с помощью настоящих способов, может составлять, по меньшей мере, 1 г/л, по меньшей мере, 1,5 г/л, по меньшей мере, 2 г/л, по меньшей мере, 2,5 г/л, по меньшей мере, 3,0 г/л, по меньшей мере, 4,0 г/л, по меньшей мере, 4,5 г/л, или, по меньшей мере, 5 г/л.
Способы, описанные в данном документе, обеспечивают непрерывное и эффективное по затратам времени получение терапевтического лекарственного вещества из жидкой культуральной среды. Например, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) на выходе второй MCCS, составляет, например, примерно от 4 часов примерно до 24 часов, включая, например, примерно от 48 часов примерно до 4 часов, примерно от 4 часов примерно до 4 часов, примерно от 40 часов примерно до 4 часов, примерно от 4 часов примерно до 6 часов, примерно от 35 часов примерно до 12 часов, примерно от 4 часов примерно до 8 часов, примерно от 30 часов примерно до 12 часов, примерно от 4 часов примерно до 6 часов, примерно от 28 часов примерно до 8 часов, примерно от 4 часов примерно до 14 часов, примерно от 26 часов примерно до 10 часов, примерно от 4 часов примерно до 16 часов, примерно от 10 часов примерно до 10 часов, примерно от 10 часов примерно до 14 часов, примерно от 40 часов примерно до 20 часов, примерно от 10 часов примерно до 16 часов, примерно от 35 часов примерно до 20 часов, примерно от 30 часов примерно до 8 часов, примерно от 10 часов примерно до 10 часов, примерно от 25 часов примерно до 12 часов, примерно от 15 часов примерно до 6 часов, примерно от 40 часов примерно до 8 часов, примерно от 15 часов примерно до 12 часов, примерно от 35 часов примерно до 18 часов, примерно от 14 часов примерно до 10 часов, примерно от 15 часов примерно до 22 часов, примерно от 30 часов примерно до 18 часов, примерно от 20 часов примерно до 14 часов, примерно от 40 часов примерно до 20 часов, примерно от 35 часов примерно до 4 часов, примерно от 20 часов примерно до 4 часов, примерно от 30 часов примерно до 4 часов, примерно от 18 часов примерно до 20 часов, примерно от 6 часов примерно до 16 часов, или примерно от 14 часов примерно до 12 часов, включительно. В других примерах, время, затраченное между подачей жидкости (например, жидкой культуральной среды), содержащей терапевтический белок, в первую MCCS и элюцией терапевтического белкового лекарственного вещества (содержащего терапевтический белок) на выходе второй MCCS составляет, например, более чем примерно 4 часа и менее чем примерно 40 часов, включительно, например, более чем примерно 4 часа и менее чем примерно 39 часов, примерно 38 часов, примерно 37 часов, примерно 36 часов, примерно 35 часов, примерно 34 часа, примерно 33 часа, примерно 32 часа, примерно 31 час, примерно 30 часов, примерно 29 часов, примерно 28 часов, примерно 27 часов, примерно 26 часов, примерно 25 часов, примерно 24 часа, примерно 23 часа, примерно 22 часа, примерно 21 час, примерно 20 часов, примерно 19 часов, примерно 18 часов, примерно 17 часов, примерно 16 часов, примерно 15 часов, примерно 14 часов, примерно 13 часов, примерно 12 часов, примерно 11 часов, примерно 10 часов, примерно 9 часов, примерно 8 часов, примерно 7 часов, примерно 6 часов, примерно 5 часов, или примерно 4,5 часа, включительно.
Настоящее изобретение дополнительно описано следующими примерами, которые не ограничивают рамки изобретения, описанные формуле изобретения.
ПРИМЕРЫ
Пример 1. Использование одиночной периодической противоточной хроматографической системы (PCCS) в непрерывном проточном процессировании рекомбинантного терапевтического белка
Набор исходных экспериментов провели для тестирования параметров, необходимых для успешного применения одиночной PCCS в непрерывном проточном процессировании рекомбинантного терапевтического белка.
Материалы и методы
Клеточная культура
Биореакторы с рабочим объемом 12 л (Broadley-James Corp., Irvine, CA) функционировали перфузионным способом с применением системы удерживания клеток ATF (Refine Technologies) с полиэфирсульфоновыми фильтрами 0,2 мкм. Микропористые распределители (20 мкм) использовали для газа O2 для поддержания установленного растворенного уровня O2, а распределители с просверленным отверстием (900 мкм) использовали для газа N2 для поддержания установленного уровня pCO2 в культуральной среде. Клеточную плотность в клеточной культуре отслеживали с помощью автономных измерений (Vi-CELL, Beckman Coulter, Brea, CA) и/или посредством подключенных емкостных зондов (Futura, Aber Instruments, Grand Island, NY).
В прогонах процесса клеточной культуры биореактора применяли химически определенные культуральные среды и клеточную линию яичника китайского хомяка (CHO), продуцирующую рекомбинантные терапевтические антитела или рекомбинантные терапевтические человеческие ферменты. Концентрация клеток в биореакторной культуре сразу же после инокуляции составляла 0,5×106 клеток/мл. Клеткам позволяли расти до 50-60×106 клеток/мл. После того, как клетки достигали данной плотности, инициировали методы удаления клеток для поддержания клеточной плотности в равновесном состоянии. Перфузию клеточной культуры начинали через 24 часа после инокуляции, в 1 реакторном объеме/в день, со скоростью перфузии, увеличенной пропорционально клеточной концентрации в культуре. Поддерживали равновесную клеточно-специфичную скорость перфузии на уровне 0,04-0,05 нл/на клетку в день. Растворенный O2 поддерживали выше 30% от насыщения воздухом. pH культуральной среды поддерживали от 6,8 до 6,95 добавлением карбоната натрия. Противопенистое средство (FoamAway, GIBCO, Grand Island, NY) использовали в жидкой культуральной среде для контроля уровней пены. Жидкая культуральная среда, полученная из биореакторов, закачивалась в одиночную систему PCC без дополнительной очистки.
Периодическая противоточная (PCC) хроматографическая система (PCCS)
PCCS, используемая в данных экспериментах представляла собой изготовленную по заказу систему ÄKTA (GE Healthcare, Piscataway, NJ), способную прогонять до четырех колонок. Система была оборудована пятью УФ-мониторами (UV-900), тремя насосами (P-900), множеством клапанов (PV-900, SV-908), одним pH-метром и одним кондуктометром (pH/C-903), и собственным программным обеспечением на основе Unicorn (GE Healthcare, Piscataway, NJ).
Кривые проскока
Кривые проскока белков требуются для определения соответствующей стратегии переключения колонок для одиночного PCCS. Для получения кривых проскока в условиях захвата, проводили эксперименты фронтальной загрузки. Емкость динамического связывания (dynamic binding capacity, DBC) оценивали как функцию времени пребывания с помощью уточненных профилей выхода и проскока, измеренных с помощью поглощения в УФ (280 нм). Размеры колонок 6 и 1 мл использовались для определения DBC для рекомбинантного терапевтического антитела и рекомбинантного терапевтического человеческого фермента, соответственно. Времена пребывания выбирают так, чтобы они были достаточно длительными для удовлетворения требованиям емкости связывания, в тоже время гарантируя, что время загрузки длиннее, чем остальные операции колонки (промывка, элюция, регенерация и т.п.). Соответственно скорость потока загрузки была скорректирована для достижения целевого времени пребывания 2,5 минуты для рекомбинантного терапевтического антитела и 4,8 минут для рекомбинантного терапевтического человеческого фермента.
Интеграция одиночной PCCS в биореактор
В PCCS время пребывания (RT) белка на колонке может быть снижено без увеличения размера колонки, потому что проскок из первой колонки в систему может быть захвачен на второй колонке системы. Уникальный признак используется для разработки непрерывного способа, так чтобы выход культуры могут быть обработан с любой степенью перфузии (D) путем варьирования объема колонки (V) и RT, как описано уравнением 1:
V=D * RT (1)
Для достижения непрерывного захвата рекомбинантного белка, первая одиночная PCCS напрямую соединена с биореактором, как показано на ФИГ. 2. Выход из биореактора/ATF прокачивали в 2-л пакет одноразового использования, служащий в качестве небольшой буферной емкости (Hyclone, Logan, UT), с использованием перистальтического насоса (Masterflex, Cole-Parmer, Vernon Hills, IL). 0,2-мкм фильтр (Millipack 40, Millipore, Billerica, MA) добавляли между биореактором и уравнительным резервуаром в качестве дополнительного стерильного барьера. Среды MabSelect SuRe (GE Healthcare, Piscataway, NJ) и хроматографическую для гидрофобных взаимодействий (HIC) на колонке XK16TM, 1,6-см × 6-см (GE Healthcare) использовали для захвата рекомбинантного терапевтического антитела и рекомбинантного человеческого фермента, соответственно). Эксплуатация каждой колонки включает стадии уравновешивания, загрузки, промывки, элюции и регенерации. Так как разработка одиночной PCCS в лабораторном масштабе не позволяла осуществить закрытое функционирование, к поточным образом технологическому потоку добавляли азид натрия.
Аналитические методы
Рекомбинантные терапевтические антитела
Собственные лабораторные анализы использовали для количественной оценки титра белков клетки-хозяина (HCP), агрегации, остаточного протеина А и эффективности рекомбинантных антител. Титр измеряли с использованием колонки с Протеином A (Applied Biosystems, Carlsbad, CA). Остаточный протеин A и HCP оценивали количественно с помощью тИФА с использованием антигена и полученных собственноручно антител. Агрегацию измеряли с помощью HPLC-SEC с использованием TSK-GEL, G3000SWXL, 7,8 мM × 30 см, 5-мкм колонка (TOSO HAAS, King of Prussia, PA). Эффективность рекомбинантного терапевтического антитела измеряли in vitro с помощью клеточного анализа.
Анализ активности рекомбинантного терапевтического человеческого фермента
Титр рекомбинантного терапевтического человеческого фермента в колоночной загрузке и элюате определяли измерением скорости гидролиза синтетического субстрата, связанного с p-нитрофенолом (pNP) (Sigma Aldrich, St. Louis, MO). Образцы (25-мкл) инкубировали с 225 мкл 40 мкM субстрата в течение 15 минут при 37°C. Реакцию гасили с использованием 250 мкл 0,3 M глицина, pH 10,5, и измеряли поглощение при 400 нм. Одну единицу активности определяли как количество рекомбинантного терапевтического фермента, требуемое для гидролиза одного микромоля субстрата до pNP в минуту при определенных аналитических условиях. Белковую концентрацию определяли с помощью RP-HPLC с использованием колонки POROS R2/H 2,1 × 30 мM (Applied Biosystems, Carlsbad, CA). Специфичную активность выражали в виде pNP (единиц)/мг белка
Собственные лабораторные анализы использовали для количественной оценки HCP, агрегации и чистоты HCP анализировали с помощью тИФА с использованием подходящих реагентов. В анализе агрегации (SEC-HPLC) использовали TSK-GEL, G3000SWXL, 7,8 мM × 30 см, 5-мкм колонку (TOSO HAAS, King of Prussia, PA), в то время как в анализе чистоты RP-HPLC использовали YMC Octyl 2 мм × 100 мM, 5-мкм колонку (Waters, Milford, MA).
Основная концепция одиночной PCCS
Операции на колонках, как правило, состоят из стадий загрузки, промывки, элюирования и регенерации. В одиночной PCCS, множество колонок используют для прогона одинаковых стадий дискретно и непрерывно циклическим образом. Так как колонки функционируют серийно, то фильтрат и смыв из одной колонки захватывается другой колонкой. Уникальное свойство PCC-систем позволяет загружать смолу близко к ее статической способности связывания вместо динамической способности связывания, что типично для периодического способа хроматографии. Исключительно для легкости иллюстрирования, 3-колоночная система используется для описания данного принципа PCCS-функционирования (ФИГ. 3). Цикл определяется как полные колоночные операции, в результате дающие три дискретных пула элюции. После завершения всех стадий в цикле цикл запускается снова. В результате, питающий поток непрерывно процессируется в функционирующей PCC-системе, при этом элюция рекомбинантного терапевтического белка из каждой колонки является дискретной и периодической.
Стратегия переключения колонки
Для продвижения от одной стадии к другой внутри цикла PCCS (ФИГ. 3), применяли стратегию переключения колонок. Существуют две автоматические операции переключения, требуемые на колонку в PCCS, первая из которых связана с проскоком исходного рекомбинантного терапевтического белка, тогда как вторая соответствует насыщению колонки. Одиночная PCCS, описанная в данном примере, функционирует с помощью контрольной стратегии, использующей динамический УФ-мониторинг. В общем, переключение колонок может определяться с помощью любого инструмента процессно-аналитической технологии (PAT), способного к внутреннему измерению концентрации рекомбинантного терапевтического белка с управлением обратной связью. Однако, PAT-инструмент, который функционирует в режиме реального времени, такой как УФ, идеален при обеспечении тригерного сигнала для переключения колонок.
ФИГ. 4 иллюстрирует принцип переключения колонок на основе различия УФ-поглощения (ΔUV) между входом подпитки и выходом колонки. Во время загрузки колонок (Стадия 1; ФИГ. 3), контрольная система PCC определяет порог примесей, когда поглощение стабилизируется. После того как прорывается рекомбинантный терапевтический белок (Стадия 2; ФИГ. 3), то появляется повышение УФ-сигнала на выходе, который выше порога примесей. В точке, когда ΔUV достигает определенного порогового значения (такого как 3% прорыва рекомбинантного терапевтического белка), фильтрат из колонки 1 направляется на колонку 2 вместо сброса (t1; ФИГ. 4). Когда колонка 1 почти насыщается рекомбинантным терапевтическим белком, и ΔUV достигает определенного значения (t2; ФИГ. 4), то подача переключается на колонку 2. Важное преимущество данной стратегии переключения колонок на основе ΔУФ заключается в том, что она позволяет осуществить унифицированную загрузку колонок безотносительно к концентрации рекомбинантного терапевтического продукта при подаче и безотносительно к емкости. Внутри обусловленного интервала стратегия является адекватной для сбора титра жизнеспособности, усиливая таким образом надежность системы.
Точное определение времени переключения колонок, которое основан на различии УФ-поглощения между подачей и выходом колонки, является одним из критических элементов стратегии контроля в реальном времени одиночной PCСS. Это требует синхронизации всех пяти УФ-детекторов (один на подаче т четыре детектора на выходе колонок) в узком интервале. УФ-детекторы калибровали с использованием 3%-раствора ацетона. Длину пути детектора регулировали вручную так, что все пять значений поглощения отличались друг от друга на 0,5%. Регуляция длины пути составила ≤10%.
Доказательство концепции с использованием рекомбинантного антитела
Клеточная культура
Модельное рекомбинантное терапевтическое антитело для данного исследования получали непрерывно в течение 70-дневного периода в 12 л перфузионном биореакторе в условиях, описанных в материалах и методах (ФИГ. 5). Скорость волюметрической продуктивности достигала 1 г/л в день между 30 и 40 днями, затем медленно снижалась по причинам, которые еще предстоит определить. Пиковая скорость волюметрической продуктивности была >5 раз выше, чем в подпитываемом процессе, с использованием той же клеточной линии, с значимым восходящим потенциалом для непрерывного процесса. Следует заметить, что целью исследования было продемонстрировать функциональность интегрированной непрерывной системы. Фактически, изменение скорости волюметрической продуктивности позволило осуществить тестирование надежности одиночного PCCS, и, в частности, его способность обработать вариабельность в титре на выходе.
В нисходящем направлении
В серийной хроматографии, максимальное DBC достигается путем увеличения времени пребывания (RT)b последующего увеличения размера колонки. В PCCS, RT может быть снижено без увеличения размера колонки, потому что проскок из первой колонки может быть захвачен на второй колонке. Это преимущество в PCCS позволяет использовать более мелкие размеры колонок и уменьшенное RT. Для того чтобы сделать процесс одиночного PCCS непрерывным, RT должно быть длиннее, чем объединенные периоды времени остальной части процесса (уравновешивание, отмывка, элюция, регенерация и т.п.). Следовательно, размер и количество колонок, используемых в PCCS для данного процесса, зависят от связывающей емкости смолы, которая диктует длительность стадии загрузки. Высокая емкость связывания смолы MabSelect SuReTM в процессе рекомбинантного антитела (50 г/л) приводит к стадии загрузки, которая длиннее, чем все оставшиеся стадии, что приводит к непрерывному захвату рекомбинантного терапевтического белка с помощью PCCS, содержащей три колонки. Эксперименты фронтальной загрузки были использованы для определения кривых проскока при различных временах пребывания для рекомбинантного антитела (данные не показаны), и время пребывания 2,5 минуты было найдено оптимальным.
Для тестирования ресурсной характеристики одиночной PCCS, выход биореактора непрерывно собирали в течение 30 дней, что соответствовало 38 циклам PCC, и 110 колоночным стадиям, без каких-либо указаний снижения эффективности в зависимости от времени. Постоянство непрерывного захвата на протяжении всего исследования оценивали на основании нескольких показателей, таких как хроматографический профиль, выделения и критических показатели качества (CQAs) рекомбинантного моноклонального антитела. УФ-профиль потока подачи был почти постоянным на протяжении всего периода прогона, и значения УФ на выходе из трех колонок воспроизводились в различных циклах. Выход продукта и пять CQA проанализированные для захваченного элюата, сравнивали между 3 колонками, а также по всему периоду непрерывного захвата выхода (ФИГ. 6). Эти результаты продемонстрировали реализуемость прямого непрерывного захвата рекомбинантного антитела из перфузионного биореактора, с получением согласованных показателей эффективности процесса и CQA в течение длительного периода времени.
Одиночный процесс PCCS сравнивали с существующей системой серийной хроматографии на одиночной колонке с точки зрения отпечатка предполагаемой хроматографической колонки и потребления первичного материала. В частности, уровень использования хроматографических сред был повышен на 20%, использование буфера было снижено на 25%, а индивидуальный размер колонок был уменьшен в 75 раз, в одиночной pCCS по сравнению с очисткой в периодическом режиме.
Доказательство концепции с использованием рекомбинантного фермента
Клеточная культура
Рекомбинантный терапевтический человеческий фермент для данного исследования получали непрерывным культивированием в течение 70-дневного периода в 12 л перфузионном биореакторе в условиях, описанных в материалах и методах (ФИГ. 7). Скорость волюметрической продуктивности достигала 0,4 г/л в день около 25 дня и оставалась устойчивой после этого с КО 16%, в основном связанной с изменчивостью анализа. По сравнению с предшествующим процессом изготовления и той же молекулы, данная волюметрическая производительность в ~40 раз выше, что является результатом синергического воздействия высокой плотности клеток и существенно повышенной удельной скорости продуцирования клеток.
В нисходящем направлении
Цель данного исследования заключалась в определении постоянства индикаторов эффективности захватывающей колонки, CQA захваченного элюата среди колонок и циклов, и надежность оборудования одиночной PCCS и стратегии контроля в течение длительного периода времени. С учетом того, что связывающая емкость HIC-захватывающей колонки была низкой (1 г/л смолы), время, требуемое для загрузки колонки, было короче, чем в случае всех остальных стадий способа (отмывка, элюция, регенерация и т.п.). Это привело к тому, что одиночная PCCS с 4 колонками, вместо 3 колонок, требовалась для непрерывной обработки собираемого продукта. Следовательно, одиночные 4-колоночная PCCS была разработана и использована для непрерывного захвата рекомбинантного человеческого фермента.
Исследование было разделено на две фазы. Первая фаза состояла из разработки метода, где ранее собранный выход подавали в одиночные PCCS из стерильного одноразового пакета. В ходе второй фазы одиночная PCCS напрямую интегрировалась с биореактором для непрерывного процессирования, как показано на ФИГ. 2. В первой фазе данного исследования одиночную PCCS эксплуатировали в течение 9 дней, 41 цикла одиночной PCCS или 164 колоночных стадий. УФ-профиль подачи был постоянным на протяжении всего периода прогона, и значения УФ на выходе из 4 колонок воспроизводились в различных циклах среди этих 4 колонок. Постоянство функционирования одиночной PCCS в ходе всего прогона демонстрировали анализом дополнительных индикторов эффективности колонки и CQA захваченного рекомбинантного терапевтического белка (ФИГ. 8). Проанализированные выход продукта и пять CQA были сравнимы между четырьмя колонками в течение периода 9 дней непрерывного захвата выхода.
В второй фазе данного исследования, рекомбинантный терапевтический белок прямо захватывали из перфузионного биореактора путем интеграции одиночной PCCS с биореактором, как показано на ФИГ. 2. Основная задача заключалась в демонстрации эффективности платформы непрерывного биопроцессирования с весьма сложным неантительным белком в течение длительного периода времени. Размер колонки и RT масштабировали согласно Уравнению 1 для достижения непрерывного захвата выхода биореактора. Интегрированную одиночную PCCS эксплуатировали непрерывно в течение 31 дня и 160 циклов одиночной PCCS, что соответствует 640 независимым колоночным стадиях, без каких-либо признаков снижения эффективности в зависимости от времени. УФ-профиль подачи, УФ-профили выхода 4 колонок и CQA были сопоставимы в течение всего срока функционирования PCCS. Так как данные были практически эквивалентны данным, полученным в первой фазе исследования, то временные профили не показаны.
В целом эти данные указывают на то, что одиночная PCCS может быть использована для обработки рекомбинантных терапевтических белков (как рекомбинантных терапевтических антител, так и рекомбинантных терапевтических человеческих ферментов), продуцируемых культурой клеток млекопитающих.
Пример 2. Использование двух периодических противоточных хроматографических систем (PCCS) в непрерывном проточном процессировании рекомбинантного белка
Была получена система, в которой использовали две различные PCCS, которая позволяла непрерывное биопроцессирование рекомбинантного терапевтического антитела из культуральной среды биореактора. Элюат системы, содержащий рекомбинантное терапевтическое антитело фактически готов для приготовления в виде фармацевтической композиции и представляет собой терапевтическое белковое лекарственное вещество вне лекарственной формы.
Материалы и методы
Клеточная культура
Биореактор с рабочим объемом 10 л (Broadley-James Corp., Irvine, CA) функционировал перфузионным способом с применением системы удерживания клеток ATF (Refine Technologies) с полиэфирсульфоновыми фильтрами 0,2-мкм. Порошковые оросители (20-мкм) использовали для газа O2 для поддержания установленного растворенного уровня O2, и оросители с просверленным отверстием (990-мкм) использовали для газа N2 для поддержания установленного уровня pCO2 в культуральной среде. Клеточную плотность в биореакторе отслеживали с помощью автономных измерений (Vi-CELL, Beckman Coulter, Brea, CA) и/или посредством подключенных емкостных зондов (Futura, Aber Instruments, Grand Island, NY).
В прогонах процесса клеточной культуры биореактора применяли химически определенную культуральную среду и клеточную линию CHO, продуцирующую рекомбинантное терапевтическое моноклональное антитело. После инокуляции биореакторы содержали в жидкой культуральной среде жизнеспособные клетки с концентрацией 0,5×106 клеток/мл. Клеткам давали возможность расти до клеточной плотности 30-40×106 клеток/мл. После того, как клетки достигали данной плотности, инициировали методы удаления клеток для поддержания клеточной плотности в равновесном состоянии. Перфузию начинали через 24-ч после инокуляции, и объем жидкой культуральной среды, удаленный и замещенный в биореакторе, повышали пропорционально клеточной концентрации. Поддерживали равновесную клеточно-специфичную скорость перфузии на уровне 0,04-0,05 нЛ/на клетку в день. Растворенный O2 поддерживали выше 30% насыщения воздуха в жидкой культуральной среде. pH жидкой культуральной среды поддерживали от 6,8 до 6, 95 посредством добавления карбоната натрия. Противопенистое средство (FoamAway, GIBCO, Grand Island, NY) использовали для контроля уровня пены в биореакторе. Жидкая культуральная среда, собранная из биореакторов, прокачивалась на две PCC системы без дополнительной очистки.
В нисходящем направлении
С целью разработки интегрированного и полностью непрерывного способа получения рекомбинантного белкового лекарственного вещества использовали (DS) две PCCS (PCCS1 и PCCS2) (ФИГ. 9). Каждая PCCS осуществляла множество операций дополнительно к возможности применения периодической противоточной хроматографии для непрерывных колоночных операций. Так как разработка PCCS в лабораторном масштабе не позволяла осуществить закрытое функционирование, то к технологическому потоку добавляли азид натрия поточным образом. Данное ограничение мелкомасштабной системы может быть успешно разрешено подходящей конструкцией крупномасштабной PCCS с выходом готового изделия.
Две периодические противоточные (PCC) хроматографические системы
Две PCCS, используемые в данном исследовании представляли собой модифицированные заказчиком ÄKTA (GE Healthcare, Piscataway, NJ), способные прогонять до четырех колонок. Каждая система была оборудована пятью УФ-мониторами (UV-900), тремя насосами (P-900), множеством клапанов (PV-908, SV-903), одним pH-метром и одним кондуктометром (pH/C-900), и собственным программным обеспечением на основе Unicorn (GE Healthcare, Piscataway, NJ).
Интеграция биореактора к PCCS1 и PCCS2
Выход из биореактора/ATF прокачивали в 2-л пакет одноразового использования, служащий в качестве небольшой буферной емкости (Hyclone, Logan, UT), с использованием перистальтического насоса (Masterflex, Cole-Parmer, Vernon Hills, IL). 0,2-мкм фильтр (Millipack 40, Millipore, Billerica, MA) добавляли между биореактором и уравнительным резервуаром в качестве дополнительного стерильного барьера. Хроматографические среды MabSelect SuRe (GE Healthcare, Piscataway, NJ) в колонке XK16TM, 1.6 см × 6 см использовали для захвата рекомбинантного терапевтического моноклонального антитела. Элюат из каждой колонки с Протеином А (pH 3,75) закачивали в 250 мл стеклянный резервуар с перемешиванием с временем пребывания 1 ч для осуществления стадии вирусной инактивации (VI). 0,2-мкм фильтр (Millipack 40, Millipore, Billerica, MA) добавляли между PCCS1 и PCCS2 для действия в качестве смешивающего устройства и барьера твердых частиц для нижележащих колонок.
Скорректированный загрузочный материал из PCCS1 дополнительно очищали на PCCS2 с помощью хроматографических колонок XK16TM, 1,1 см × 7 см (GE Healthcare) Capto S (GE Healthcare, Piscataway, NJ) в режиме связывания и элюции. В итоге элюат Capto S тонко очищали с помощью 7 мл мембраны SartoBind Q- (Sartorious XX), соединенной напрямую с выходами колонок Capto-S для получения рекомбинантного белкового лекарственного вещества. Дополнительно поточное разведение необходимые перед обеими загрузками на Capto-S и SartoBind Q-мембрану, осуществляли с помощью насосов PCCS1 и PCCS2, соответственно (ФИГ. 9). Каждая операция на колонке включала стадии уравновешивания, загрузки, промывки, элюции и регенерации. Sartobind Q-мембрана включала стадии уравновешивания, загрузки, отмывки, элюции и регенерации. Таблицы 1 и 2 демонстрируют параметры процесса для всех единичных операций, осуществленных с помощью PCCS1 и PCCS2, соответственно. ФИГ. 9 также демонстрируют скорость потока для жидкостей, закачанных через две PCCS.
Аналитические методы
Собственные лабораторные анализы использовали для количественной оценки титра белков клетки-хозяина (HCP), агрегации, остаточного протеина А и эффективности рекомбинантных мноклональных антител. Титр измеряли с использованием колонки с Протеином A (Applied Biosystems, Carlsbad, CA). Остаточный протеин A и HCP оценивали количественно с помощью тИФА с использованием антигена и полученных собственноручно антител. Агрегацию измеряли с помощью HPLC-SEC с использованием TSK-GEL, G3000SWXL, 7,8 мM × 30 см, 5-мкм колонка (TOSO HAAS, King of Prussia, PA). Эффективность рекомбинантного терапевтического моноклонального антитела измеряли с помощью in vitro клеточных анализов.
Стратегия переключения колонки
Для продвижения от одной стадии к другой внутри цикла PCCS (ФИГ. 3), применяли стратегию переключения колонок. Существуют две автоматические операции переключения, требуемые на колонку в каждой PCC, первая из которых связана с проскоком исходного рекомбинантного терапевтического белка, тогда как вторая соответствует насыщению колонки. PCC-система, описанная в данной работе, функционирует с помощью контрольной стратегии, использующей динамический УФ-мониторинг, а также времязависимое переключение. В общем, переключение колонок может определяться с помощью любого PAT-инструмента, способного к внутреннему измерению концентрации рекомбинантного терапевтического белка с управлением обратной связью.
ФИГ. 4 иллюстрирует принцип переключения колонок на основе различия УФ-поглощения (ΔUV) между входом подпитки и выходом колонки. Во время загрузки колонок (Стадия 1; ФИГ. 3), контрольная система PCC определяет порог примесей, когда поглощение стабилизируется. После того как прорывается рекомбинантный терапевтический белок (Стадия 2; ФИГ. 3), то появляется повышение УФ-сигнала на выходе, который выше порога примесей. В точке, когда ΔUV достигает определенного порогового значения (такого как 3% прорыва рекомбинантного терапевтического белка), фильтрат из колонки 1 направляется на колонку 2 вместо сброса (t1; ФИГ. 4). Когда колонка 1 почти насыщается рекомбинантным терапевтическим белком, и ΔUV достигает определенного значения (t2; ФИГ. 4), то подача переключается на колонку 2. Важное преимущество данной стратегии переключения колонок на основе ΔУФ заключается в том, что она позволяет осуществить унифицированную загрузку колонок безотносительно к концентрации рекомбинантного терапевтического белка при подаче и безотносительно к емкости. Внутри обусловленного интервала стратегия является адекватной для сбора титра жизнеспособности, усиливая таким образом надежность системы.
Как обсуждалось выше, точное определение времени переключения колонок, которое основано на различии УФ-поглощения между подачей и выходом колонки, является одним из критических элементов стратегии контроля PCС в реальном времени. Это требует синхронизации всех пяти УФ-детекторов (один на подаче т четыре детектора на выходе колонок) в узком интервале. УФ-детекторы калибровали с использованием 3%-раствора ацетона. Длину пути детектора регулировали вручную так, что все пять значений поглощения отличались друг от друга на 0,5%. Регуляция длины пути составила ≤10%.
Вторую стратегию, используемую для переключения колонок, осуществляли в отношении времени. Поскольку титр рекомбинантного терапевтического белка на протяжении 31 дня продуцирования был квазиустоявшимся, переключение колонок должно быть рассчитано на основании времени, которое затрачивается для предварительно определенного порога, а также на основании насыщения.
Результаты и обсуждение
Для тестирования ресурсной характеристики системы с двумя PCC, жидкую культуральную среду, собранную из биореактора, непрерывно очищали в течение 31 дня, что соответствовало 372 циклам очистки, или 25 производственным циклам системы с двумя PCC, без каких-либо указаний снижения эффективности в зависимости от времени. Постоянство непрерывного захвата на протяжении всего исследования оценивали на основании нескольких показателей, таких как хроматографический профиль, выходы продукта и критических показатели качества (CQAs) рекомбинантного терапевтического моноклонального антитела. УФ-профиль потока подачи был почти постоянным на протяжении всего периода прогона, и значения УФ на выходе из трех колонок воспроизводились в различных циклах. Эти подробности и воспроизводимость от цикла к циклу демонстрируются в снимке прогона хроматограммы, представленном на Фиг. 12-14. Выход продукта и пять CQA, проанализированные для захваченного элюата, сравнивали между 3 колонками, а также по всему периоду непрерывного захвата выхода (ФИГ. 16). Эти результаты продемонстрировали реализуемость прямого непрерывного захвата рекомбинантного терапевтического моноклонального антитела из перфузионного биореактора с использованием системы с двумя PCC, с получением согласованных показателей эффективности процесса и CQA в течение длительного периода времени. Модельное рекомбинантное терапевтическое моноклональное антитело использовали для исследования реализуемости платформы полностью непрерывного биопроцессирования с использованием интегрированной системы с двумя PCC.
Доказательство концепции с использованием MAb
Клеточная культура
Модельное рекомбинантное терапевтическое антитело для данного исследования получали непрерывно в течение 59-дневного периода в 12 л перфузионном биореакторе в условиях, описанных в материалах и методах. Волюметрическая продуктивность сохранялась в диапазоне 1,0-1,6 г/л с 10 дня по 59 день. Пиковая скорость волюметрической продуктивности была ~8 раз выше, чем в подпитываемом процессе, с использованием той же клеточной линии, с значимым восходящим потенциалом для непрерывного процесса путем оптимизации скорости перфузии и/или увеличения плотности клеток в устойчивом состоянии (ФИГ. 11 и 12). Следует заметить, что целью исследования было продемонстрировать функциональность интегрированной непрерывной системы. Фактически, изменение скорости волюметрической продуктивности позволило осуществить тестирование надежности PCC-систем, и, в частности, их способность обработать вариабельность в титре на выходе.
В нисходящем направлении
Основная задача заключалась в демонстрации эффективности платформы непрерывного биопроцессирования с рекомбинантным терапевтическим моноклональным антителом с использованием интегрированной системы с двумя PCC в течение длительного периода времени. Размер колонки/мембраны и время пребывания как для Протеина А, так и для катионообменной колонке масштабировали для достижения непрерывного процессирования выхода биореактора в лекарственное вещество (DS) вне лекарственной формы. Интегрированную систему эксплуатировали непрерывно в течение 31 дня, что соответствует 15 независимым партиям DS вне лекарственной формы (партия определяется как 1,25 дня процессирования, 15 Q-мембранных фильтратов или 0,8 г DS), без каких-либо признаков снижения эффективности в зависимости от времени. УФ-профиль подачи, УФ-профили выхода 3 колонок для захвата на протеине А и Capto-S, а также в виде фильтрата мембраны Sartobind Q, и CQA были постоянны в течение всего срока функционирования интегриррованного биореактора-PCC1-PCC2 (ФИГ. 12-14). Кроме того, все CQA для DS вне лекарственной формы были сопоставимы в течение всего срока функционирования pCC (ФИГ. 15 и 16). Преимущества использования интегрированной непрерывной системы с двумя PCC для получения рекомбинантного терапевтического моноклонального антитела по сравнению с существующими процессами очистки периодического действия включают увеличение волюметрической продуктивности, увеличение коэффициента использования хроматографических сред, снижение объема используемого буфера, и снижение объема индивидуального размера колонок.
Имплементация полностью непрерывной биологической производственной платформы
В настоящее время существует две доминирующие платформы для биофармацевтического производства: (1) перфузионные биореакторы, и подпитываемые биореакторы для выработки стабильных белков. В обоих случаях не ограничивающие примерные системы, описанные в данном документе, обеспечивают функционирование биореактора с последующими множественными периодическими единичными стадиями, включающими осветление, захват, доочистку хроматографией и стадии удерживания. Примерная полностью непрерывная технология производства описанная в Примере, предусматривает поточную выработку рекомбинантного терапевтического белка. Как продемонстрировано в данном Примере, эта примерная система в комбинации с клонами с высокой продуктивностью и химически определенными средами могут быть достигнута очень высокая плотность и волюметрическая продуктивность при функционировании в устойчивом состоянии. В результате, достаточный производительный потенциал может быть достигнут с меньшими биореакторами (<500 л) относительно традиционных процессов, при которых масштабы реакторов превышают 10000 литров. Применение устройства для отделения клеток ATF устраняет типовую стадию осветления. Наиболее важно, что прямая интеграция полностью непрерывного производства делает неактуальными танки для сбора выходящего продукта, и заменяет большую периодическую захватывающую колонку на в 2 раза более мелкие колонки, используемые в непрерывной системе. Более того, непрерывное процессирование собранной жидкой культуральной среды придает значимые преимущества в отношении качества рекомбинантного терапевтического белка. В частности, устранение стадий сбора и других стадий удерживания снижает экспонирование целевого рекомбинантного терапевтического белка ферментативной, химической и физической деградации, и тем самым уменьшает риски стабильности рекомбинантного терапевтического белка. В заключение следует отметить, что удачное развитие полностью непрерывной платформы биопроизводства в малом масштабе для изготовления рекомбинантных моноклональных антител открывает возможности для промышленной имплементации в большом масштабе. Эти данные демонстрируют, что примерная интегрированная, полностью непрерывная система биопроизводства дает уникальные преимущества по сравнению с традиционными подходами изготовления рекомбинантных терапевтических белков. Например, Таблицы 3 и 4 ниже перечисляют несколько преимуществ, обеспечиваемых типовым способом и системой, описанных в данном Примере.
Пример 3. Типовая система с двумя PCC, которая включает 500 л биореактор
Способ и система, описанные ниже, могут быть использованы для осуществления непрерывного биопроизводства рекомбинантного терапевтического белка, собираемого из культуры 500 л биореактора.
Материалы и методы
Клеточная культура
Биореакторы с рабочим объемом 500 л функционировал перфузионным способом с применением системы удерживания клеток ATF (Refine Technologies) с полиэфирсульфоновыми фильтрами 0,2 мкм. Микропористые распределители (20 мкм) использовали для газа O2 для поддержания установленного растворенного уровня O2, а распределители с просверленным отверстием (990 мкм) использовали для газа N2 для поддержания установленного уровня pCO2 в культуральной среде. Клеточную плотность в клеточной культуре отслеживали с помощью автономных измерений (Vi-CELL, Beckman Coulter, Brea, CA) и/или посредством подключенных емкостных зондов (Futura, Aber Instruments, Grand Island, NY).
Типовые преимущества двух систем PCC
(%)
(%)
(%)
(%)
(%)
В прогонах процесса клеточной культуры биореактора применяли химически определенные культуральные среды и клеточную линию яичника китайского хомяка (CHO), продуцирующую рекомбинантные антитела или рекомбинантные человеческие ферменты. Концентрация клеток в биореакторной культуре сразу же после инокуляции составляла 0,5×106 клеток/мл. Клеткам позволяли вырасти до 50-60×106 клеток/мл. После того, как клетки достигали данной плотности, инициировали методы удаления клеток для поддержания клеточной плотности в равновесном состоянии. Перфузию клеточной культуры начинали через 24 часа после инокуляции, в 1 реакторном объеме/в день, со скоростью перфузии, увеличенной пропорционально клеточной концентрации в культуре. Поддерживали равновесную клеточно-специфичную скорость перфузии на уровне 0,04-0,05 нл/на клетку в день. Растворенный O2 поддерживали выше 30% от насыщения воздухом. pH культуральной среды поддерживали от 6,8 до 6, 95 добавлением карбоната натрия. Противопенистое средство (FoamAway, GIBCO, Grand Island, NY) использовали в жидкой культуральной среде для контроля уровней пены. Жидкая культуральная среда, полученная из биоректоров, закачивалась в одиночную систему PCC без дополнительной очистки.
Периодические противоточные (PCC) хроматографические системы
PCC-системы, использованные в этих экспериментах, представляли собой изготовленную по заказу систему ÄKTA (GE Healthcare, Piscataway, NJ), способную прогонять вплоть до четырех колонок. Каждая система была оборудована пятью УФ-мониторами (UV-900), тремя насосами (P-900), множеством клапанов (PV-903, SV-900), одним pH-метром и одним кондуктометром (pH/C-908), и собственным программным обеспечением на основе Unicorn (GE Healthcare, Piscataway, NJ). Первая PCCS является четырехколоночной PCCS, в которой первые три колонки содержат смолу, связанную с протеином А и осуществляют типовой процесс захвата рекомбинантного терапевтического белка из жидкости, а четвертая колонка осуществляет типовой процесс инактивации вирусов, присутствующих в жидкости (например, удерживания жидкости в течение около 1 часа при pH 3,75). Вторая PCCS содержит свободные хроматографические колонки, которые осуществляют типовой процесс очистки рекомбинантного терапевтического белка (содержащего катионообменную смолу) и одну хроматографическую мембрану, которая осуществляет типовой процесс доочистки (содержащую катионообменную смолу). Удельные скорости потока и другие свойства первой и второй PCC-систем использовали для непрерывного продуцирования рекомбинантного белкового лекарственного вещества, как показано в Таблицах 5 и 6, соответственно.
Кривые проскока
Кривые проскока белков требуются для определения соответствующей стратегии переключения колонок для каждой системы PCC. Для получения кривых проскока в условиях захвата, проводили эксперименты фронтальной загрузки. Емкость динамического связывания (dynamic binding capacity, DBC) оценивали как функцию времени пребывания с помощью уточненных профилей выхода и проскока, измеренных с помощью поглощения в УФ (280 нм). Размеры колонок 6,0 и 1,0 мл использовались для определения DBC для рекомбинантных терапевтических антител и рекомбинантного терапевтического человеческого фермента, соответственно. Времена пребывания выбирают так, чтобы они были достаточно длительными для удовлетворения требованиям емкости связывания, в тоже время гарантируя, что время загрузки длиннее, чем остальные операции колонки (отмывка, элюция, регенерация и т.п.).
Интеграция одиночной PCC системы в биореактор
В PCC-системах время пребывания (RT) белка на колонке может быть снижено без увеличения размера колонки, потому что проскок из первой колонки в систему может быть захвачен на второй колонке системы. Уникальный признак используется для разработки непрерывного способа, так чтобы выход культуры могут быть обработан с любой степенью перфузии (D) путем варьирования объема колонки (V) и RT, как описано уравнением 1:
V=D * RT (1)
Для достижения непрерывного захвата рекомбинантного белка, первая одиночная PCCS напрямую соединена с биореактором, как показано на ФИГ. 2. Выход из биореактора/ATF прокачивали в 2-л пакет одноразового использования, служащий в качестве небольшого буферного сосуда (Hyclone, Logan, UT), с использованием перистальтического насоса (Masterflex, Cole-Parmer, Vernon Hills, IL). 0,2-мкм фильтр (Millipack 40, Millipore, Billerica, MA) добавляли между биореактором и уравнительным резервуаром в качестве дополнительного стерильного барьера. Колонку MabSelect SuRe (GE Healthcare, Piscataway, NJ) использовали захватом рекомбинантного терапевтического антитела и рекомбинантного терапевтического человеческого фермента, соответственно). Операции на каждой колонке включают стадии уравновешивания, загрузки, отмывки, элюции и регенерации. Так как разработка PCCS в лабораторном масштабе не позволяет осуществить замкнутую операцию, добавляли азид натрия к подключенному технологическому потоку.
Аналитические методы
Рекомбинантные антитела
Собственные лабораторные анализы использовали для количественной оценки белков клетки-хозяина (HCP), агрегации, остаточного протеина А и эффективности рекомбинантных антител. Титр измеряли с использованием колонки с Протеином A (Applied Biosystems, Carlsbad, CA). Остаточный протеин A и HCP оценивали количественно с помощью тИФА с использованием антигена и полученных собственноручно антител. Агрегацию измеряли с помощью HPLC-SEC с использованием TSK-GEL, G3000SWXL, 7,8 мM × 30 см, 5-мкм колонка (TOSO HAAS, King of Prussia, PA). Эффективность рекомбинантного антитела измеряли in vitro с помощью клеточного анализа.
Основная концепция одиночной PCC-системы
Операции на колонках, как правило, состоят из стадий загрузки, промывки, элюирования и регенерации. В каждой PCC-системе множество колонок будет использоваться для прогона одинаковых стадий дискретно и непрерывно циклическим образом. Так как колонки функционируют серийно, то фильтрат и смыв из одной колонки захватывается другой колонкой. Уникальное свойство PCC-систем позволяет загружать смолу близко к ее статической способности связывания вместо динамической способности связывания, что типично для периодического способа хроматографии. Для легкости иллюстрирования, 3-колоночная система используется для описания данного принципа функционирования PCC-системы (ФИГ. 3). Цикл определяется как полные колоночные операции, в результате дающие три дискретных пула элюции. После завершения всех стадий в цикле цикл запускается снова. В результате, питающий поток непрерывно процессируется в функционирующей PCC-системе, при этом элюция рекомбинантного терапевтического белка из каждой колонки является дискретной и периодической.
Стратегия переключения колонки
Для продвижения от одной стадии к другой внутри цикла PCC-системы (ФИГ. 3), применяли стратегию переключения колонок. Существуют две автоматические операции переключения, требуемые на колонку в PCC-системе, первая из которых связана с проскоком исходного рекомбинантного терапевтического белка, тогда как вторая соответствует насыщению колонки. Каждая одиночная PCC-система, описанная в данном примере, функционирует с помощью контрольной стратегии, использующей динамический УФ-мониторинг. В общем, переключение колонок может определяться с помощью любого инструмента процессно-аналитической технологии (PAT), способного к внутреннему измерению концентрации рекомбинантного терапевтического белка с управлением обратной связью. Однако, PAT-инструмент, который функционирует в режиме реального времени, такой как УФ, идеален при обеспечении тригерного сигнала для переключения колонок.
ФИГ. 4 иллюстрирует принцип переключения колонок на основе различия УФ-поглощения (ΔUV) между входом подпитки и выходом колонки. Во время загрузки колонок (Стадия 1; ФИГ. 3), контрольная система PCC определяет порог примесей, когда поглощение стабилизируется. После того как прорывается рекомбинантный терапевтический белок (Стадия 2; ФИГ. 3), то появляется повышение УФ-сигнала на выходе, который выше порога примесей. В точке, когда ΔUV достигает определенного порогового значения (такого как 3% прорыва рекомбинантного терапевтического белка), фильтрат из колонки 1 направляется на колонку 2 вместо сброса (t1; ФИГ. 4). Когда колонка 1 почти насыщается рекомбинантным терапевтическим белком, и ΔUV достигает определенного значения (t2; ФИГ. 4), то подача переключается на колонку 2. Важное преимущество данной стратегии переключения колонок на основе ΔУФ заключается в том, что она позволяет осуществить унифицированную загрузку колонок безотносительно к концентрации рекомбинантного терапевтического белка при подаче и безотносительно к емкости. Внутри обусловленного интервала стратегия является адекватной для сбора титра жизнеспособности, усиливая таким образом надежность системы.
Точное определение времени переключения колонок, которое основан на различии УФ-поглощения между подачей и выходом колонки, является одним из критических элементов стратегии контроля в реальном времени одиночной PCС-системы. Это требует синхронизации всех пяти УФ-детекторов (один на подаче т четыре детектора на выходе колонок) в узком интервале. УФ-детекторы калибровали с использованием 3%-раствора ацетона. Длину пути детектора регулировали вручную так, что все пять значений поглощения отличались друг от друга на 0,5%. Регуляция длины пути составила ≤10%.
Другие воплощения
Следует понимать, что хотя изобретение дано вместе с подробным описанием, представленное выше описание предназначено для иллюстрации и не ограничивает объем притязаний изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах представленной ниже формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНТЕГРИРОВАННОЕ НЕПРЕРЫВНОЕ ПРОИЗВОДСТВО ТЕРАПЕВТИЧЕСКИХ БЕЛКОВЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ | 2014 |
|
RU2662929C2 |
| СТЕРИЛЬНАЯ СМОЛА ДЛЯ ХРОМАТОГРАФИИ И ЕЕ ПРИМЕНЕНИЕ В СПОСОБАХ ПРОИЗВОДСТВА | 2019 |
|
RU2809157C2 |
| Способы стерильной хроматографии и производства | 2015 |
|
RU2679133C2 |
| СПОСОБЫ СТЕРИЛЬНОЙ ХРОМАТОГРАФИИ И ПРОИЗВОДСТВА | 2015 |
|
RU2786078C2 |
| СТЕРИЛЬНАЯ ХРОМАТОГРАФИЧЕСКАЯ СМОЛА И ЕЕ ПРИМЕНЕНИЕ В СПОСОБАХ ПРОИЗВОДСТВА | 2015 |
|
RU2679134C2 |
| СТЕРИЛЬНАЯ ХРОМАТОГРАФИЧЕСКАЯ СМОЛА И ЕЕ ПРИМЕНЕНИЕ В СПОСОБАХ ПРОИЗВОДСТВА | 2015 |
|
RU2805607C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ В СИСТЕМЕ ПОСЕВНЫХ ФЕРМЕНТЕРОВ (ВАРИАНТЫ) | 2015 |
|
RU2694327C2 |
| ПРОЦЕССЫ КУЛЬТИВИРОВАНИЯ В СИСТЕМЕ ПОСЕВНЫХ ФЕРМЕНТЕРОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2786997C2 |
| ИЗМЕРЕНИЕ АТРИБУТА КАЧЕСТВА ПРОДУКТА | 2020 |
|
RU2825307C1 |
| МНОГОМЕРНЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ И МОНИТОРИНГ ДЛЯ БИОПРОИЗВОДСТВА | 2019 |
|
RU2796576C2 |
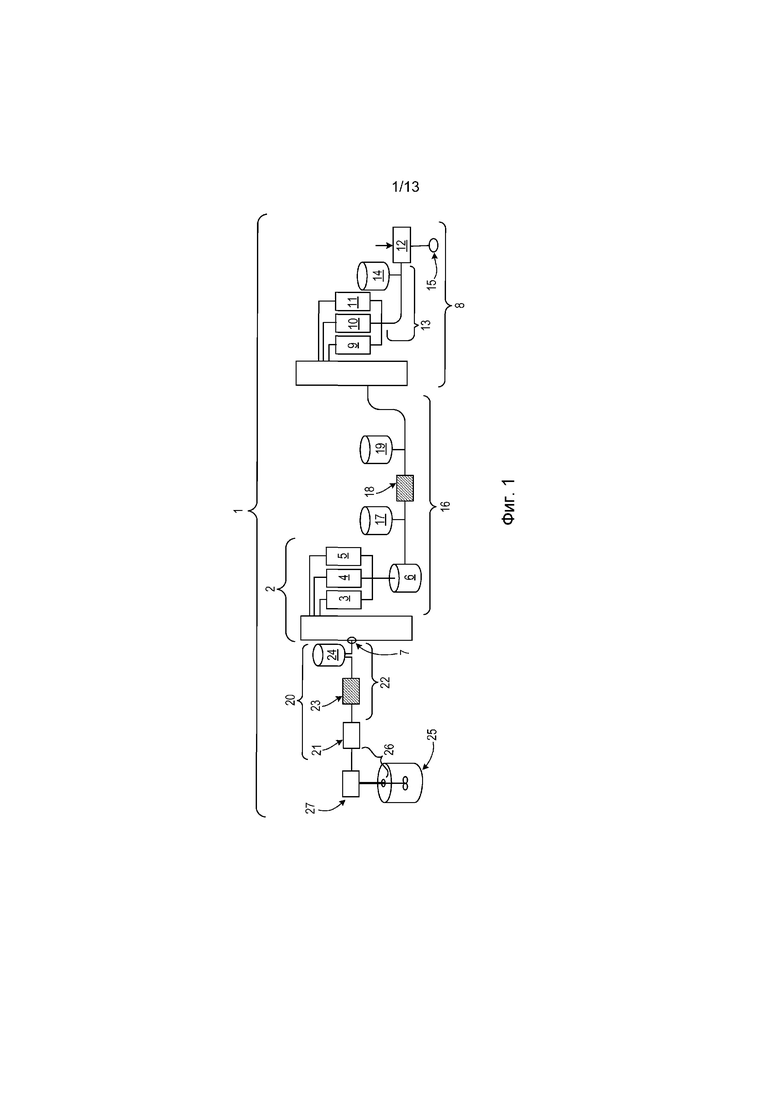
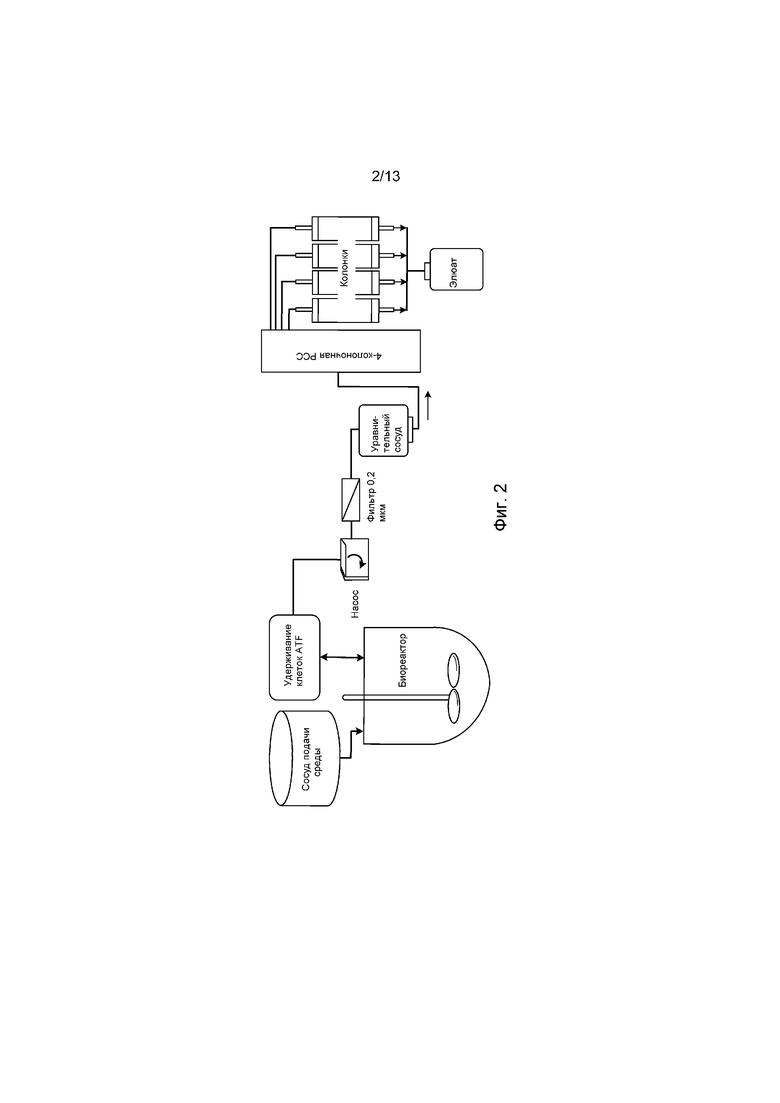
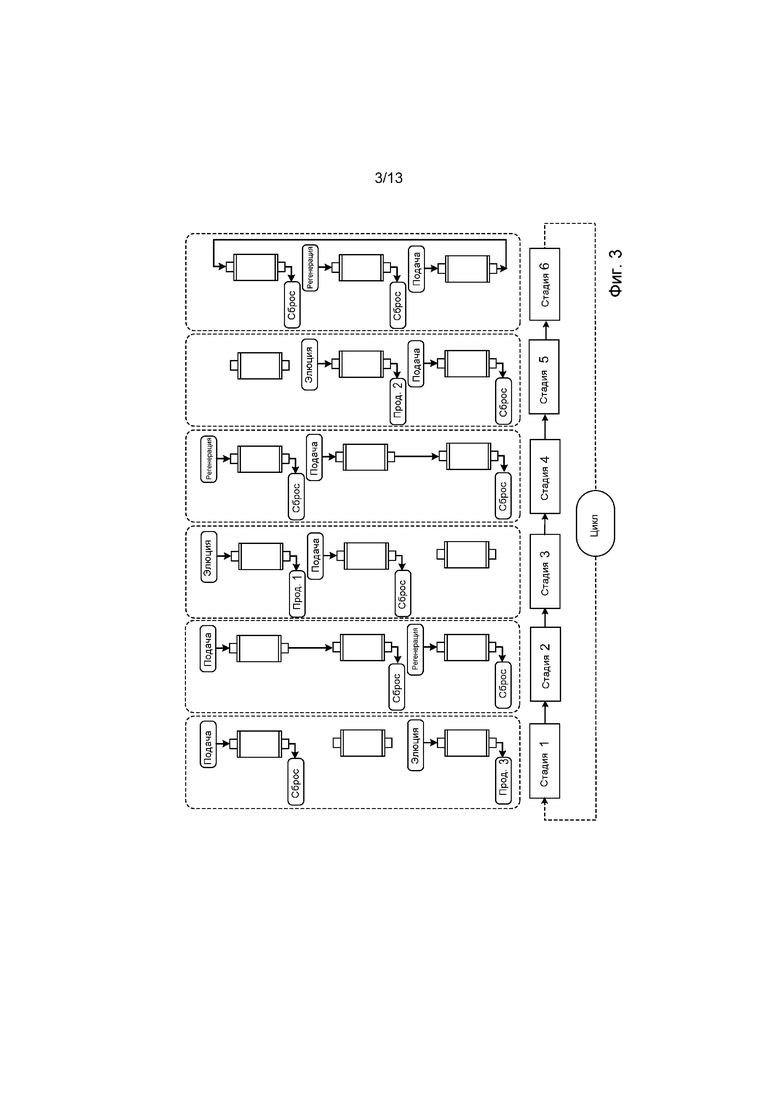
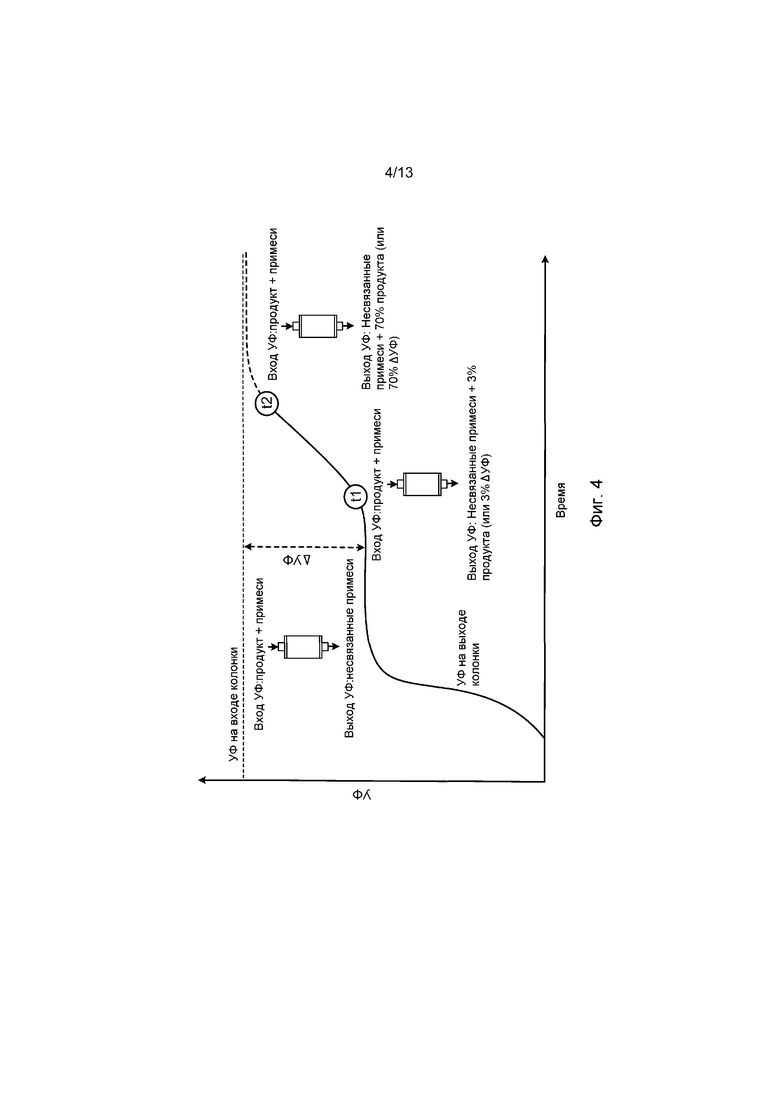
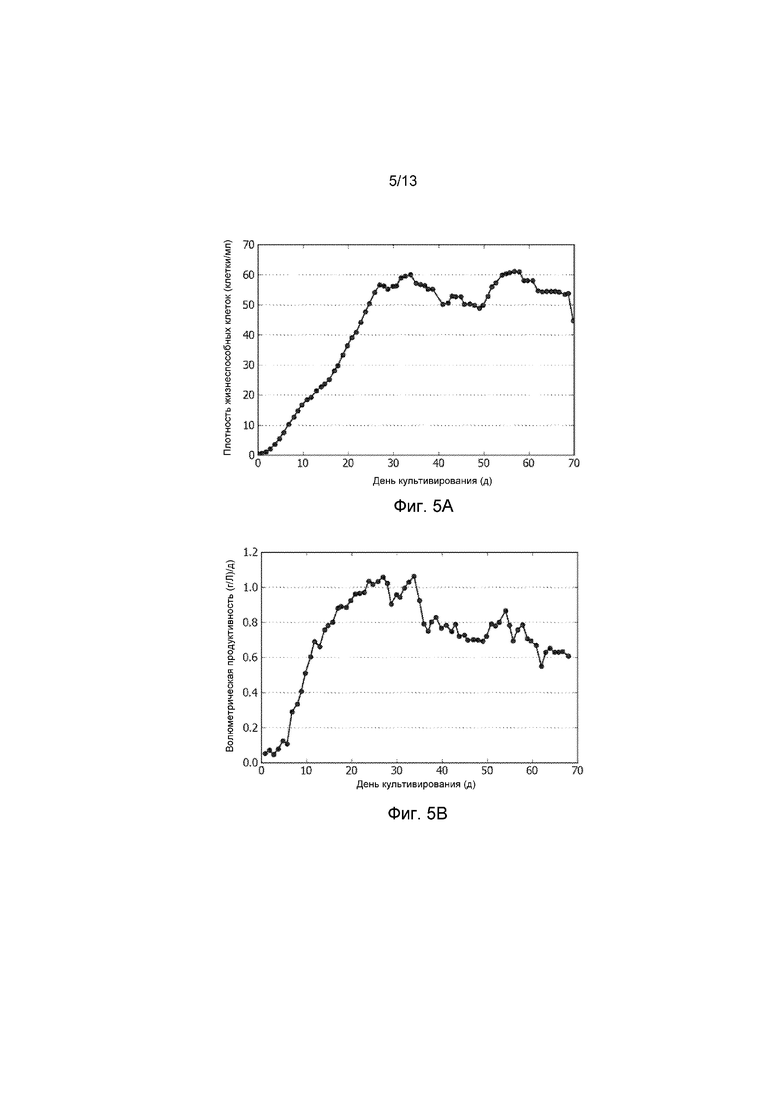
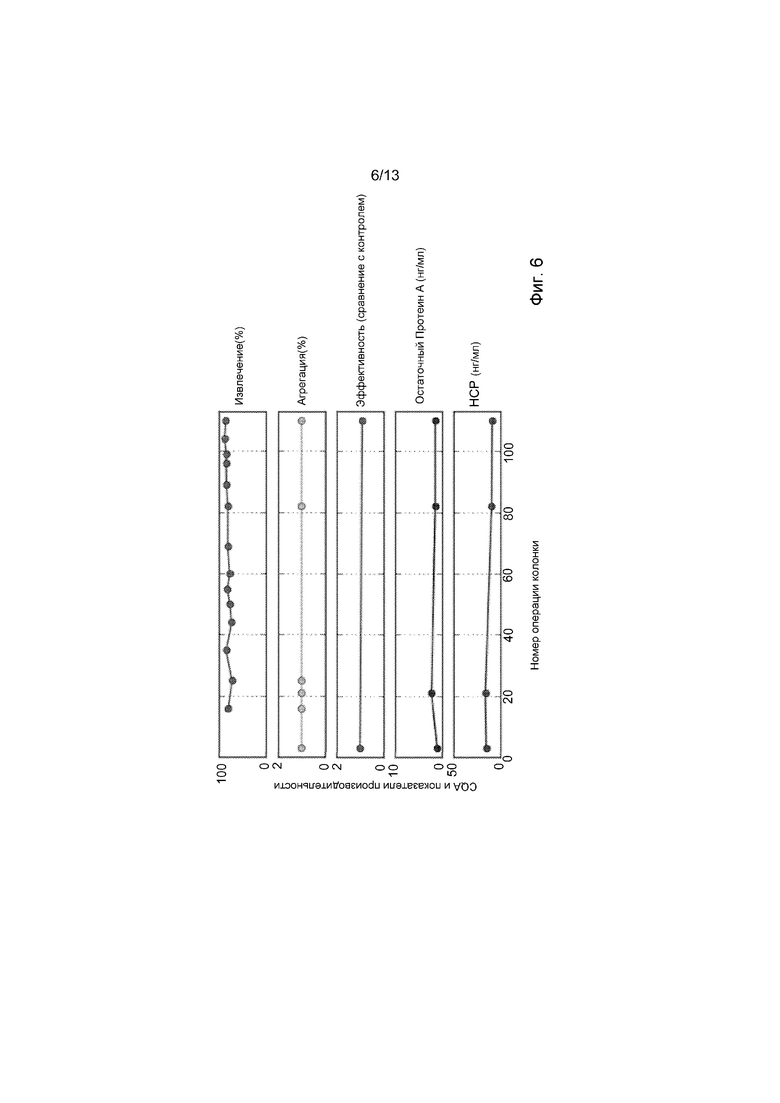
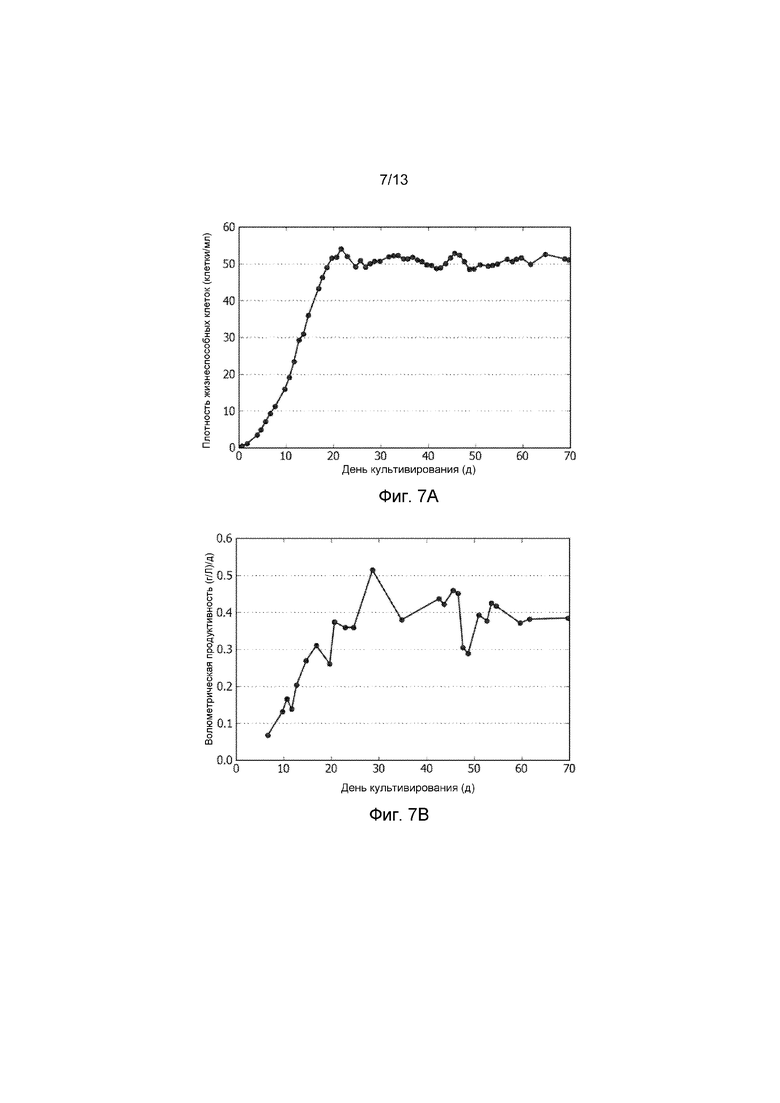
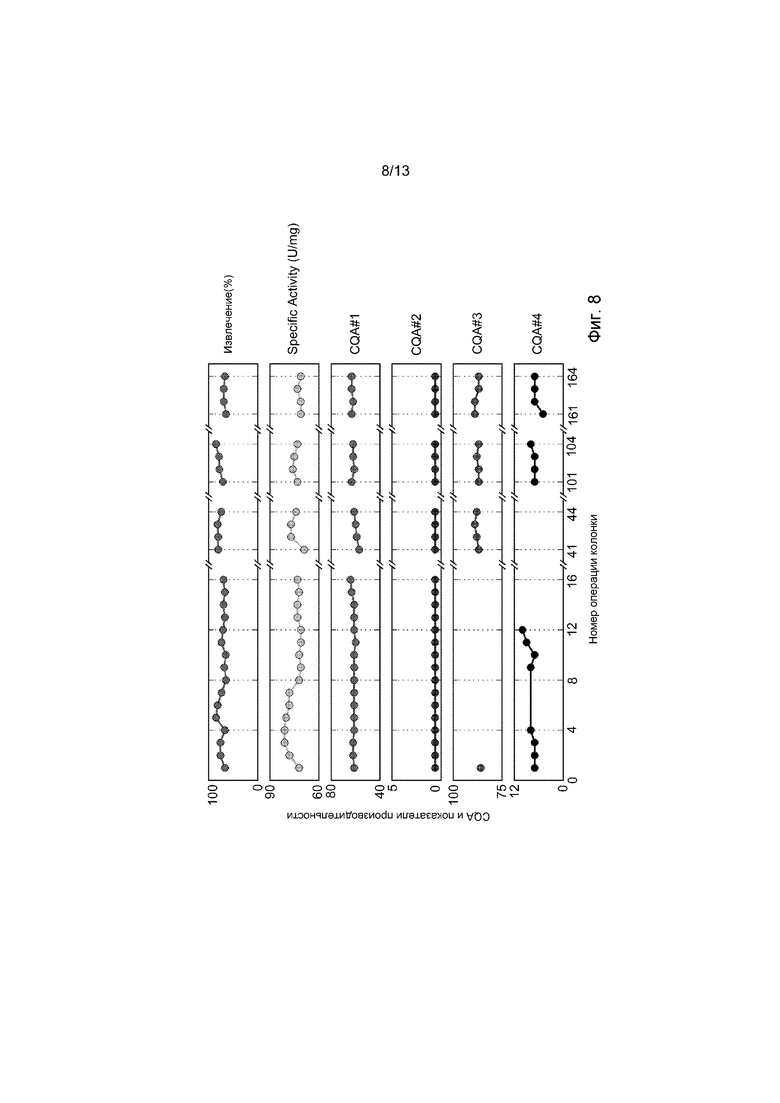
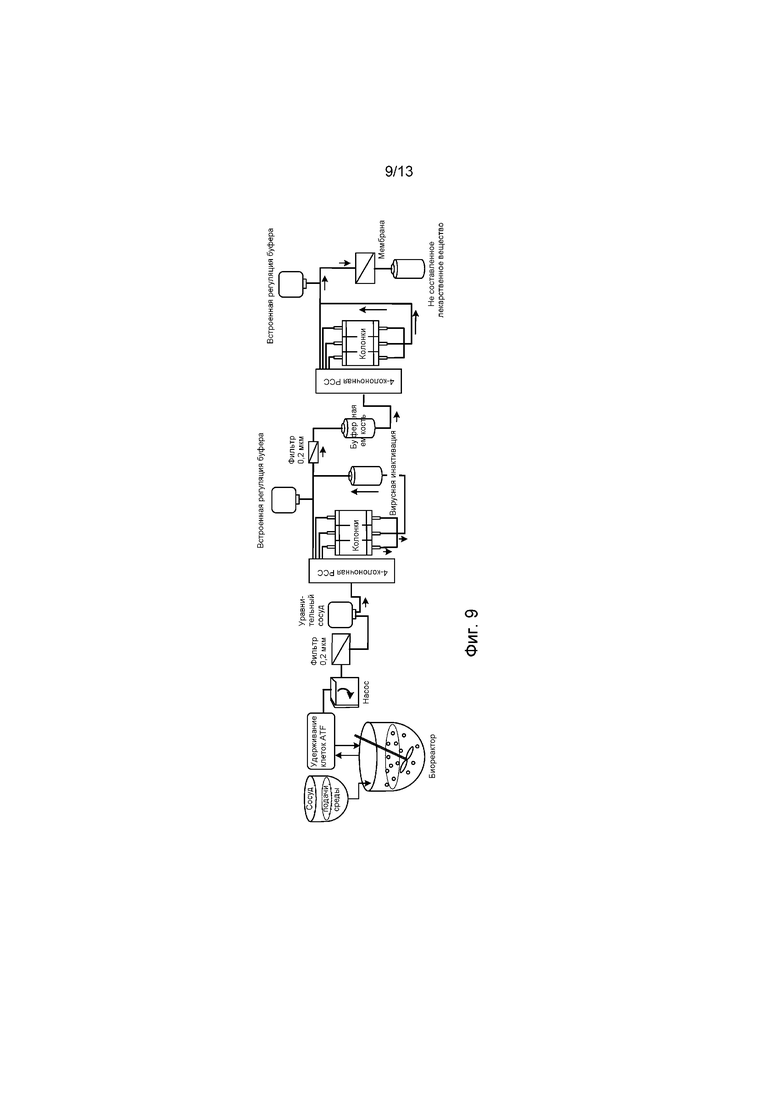
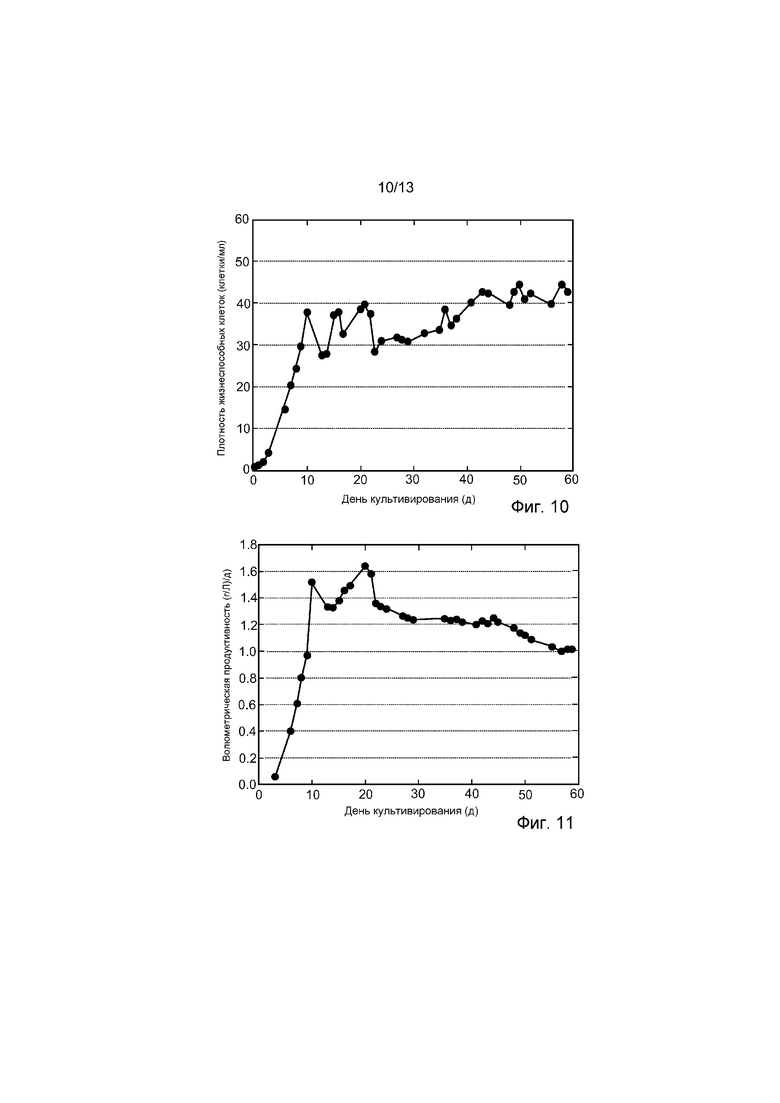
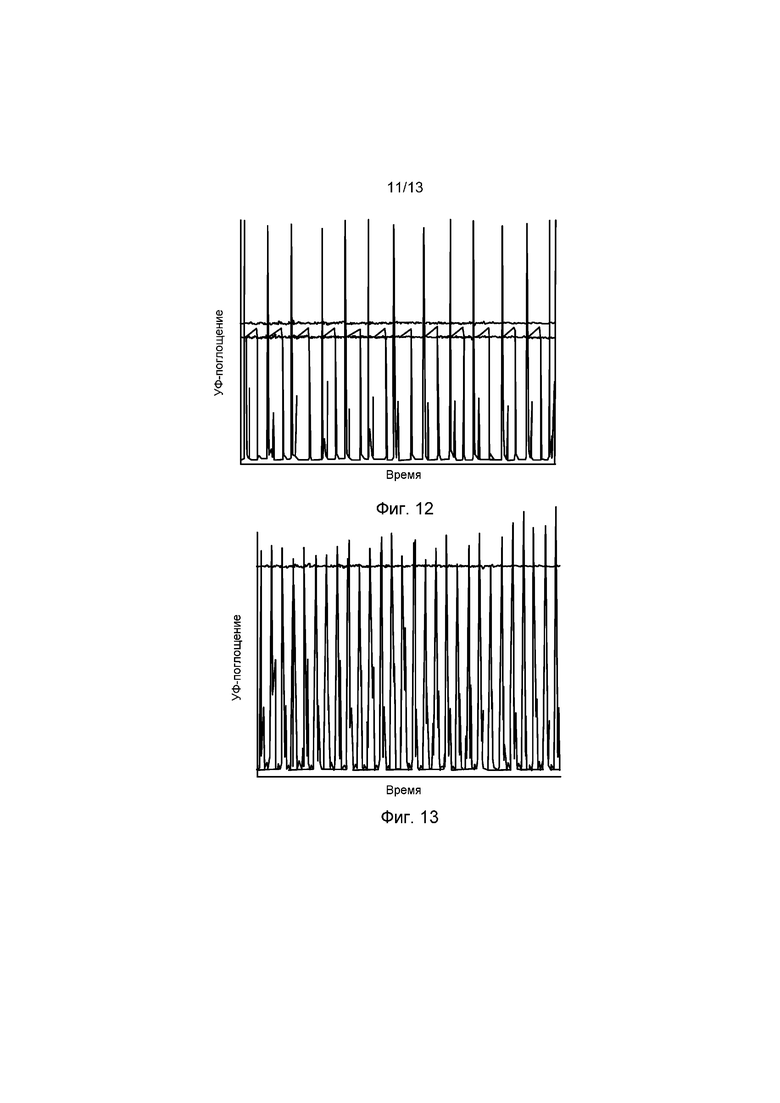
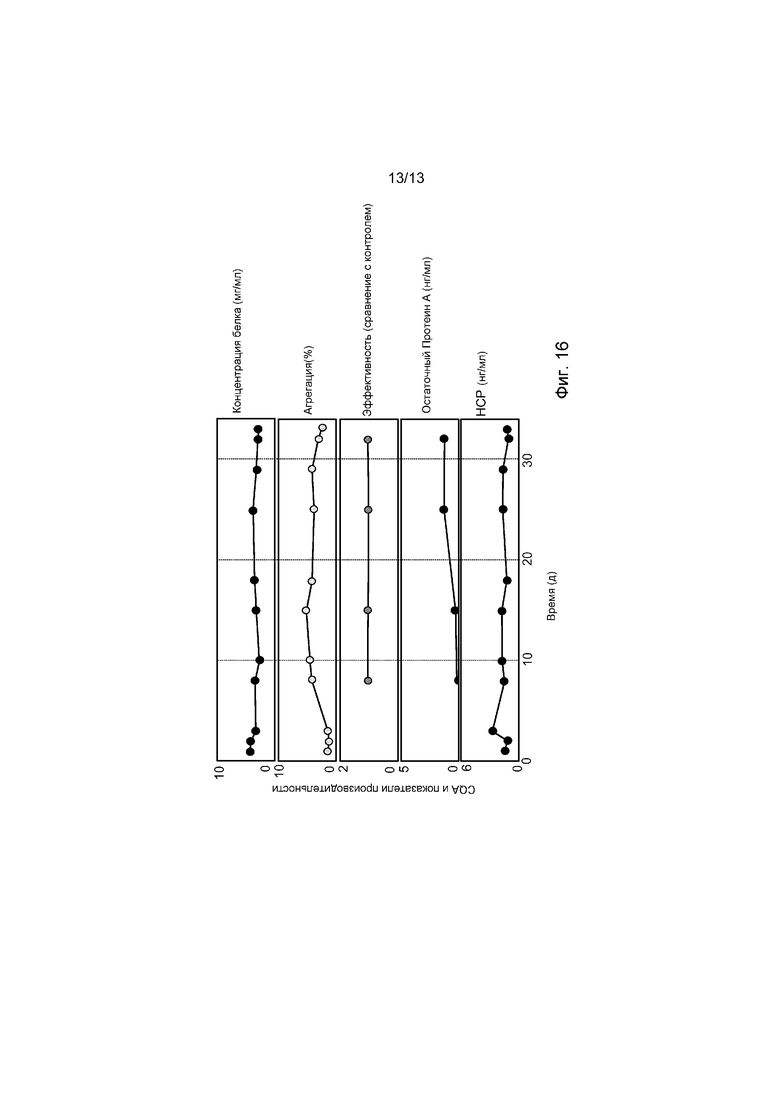
Изобретение относится к биотехнологии, в частности к производству терапевтических белков. В данном документе предлагаются интегрированные непрерывные способы биопроизводства для получения терапевтического белкового лекарственного вещества. Также предлагаются системы, которые способны к непрерывному получению терапевтического белкового вещества. 3 н. и 24 з.п. ф-лы, 16 ил., 6 табл., 2 пр.
1. Система биологического производства для получения рекомбинантного терапевтического белка в жидкости, включающая:
первую многоколоночную хроматографическую систему (MCCS1), содержащую вход; и
вторую многоколоночную хроматографическую систему (MCCS2), содержащую выход,
где MCCS1 и MCCS2 находятся в жидкостном сообщении друг с другом;
система биологического производства сконфигурирована так, что жидкость поступает на вход через MCCS1 и MCCS2 и покидает систему биологического производства через выход;
MCCS1 сконфигурирована для выполнения по меньшей мере типового процесса захвата рекомбинантного терапевтического белка смолой; и
MCCS2 сконфигурирована для выполнения по меньшей мере двух типовых процессов очистки и доочистки рекомбинантного терапевтического белка.
2. Система биологического производства по п. 1, дополнительно содержащая биореактор, где биореактор и вход находятся в жидкостном сообщении друг с другом и где система производства сконфигурирована так, что жидкость, присутствующая в биореакторе, может проходить через вход.
3. Система биологического производства по п. 1, в которой MCCS1 сконфигурирована для осуществления по меньшей мере двух отдельных типовых процессов.
4. Система биологического производства по п. 1, где применение MCCS1 или MCCS2 включает переключение колонок или применение MCCS1 и MCCS2 включает переключение колонок.
5. Система биологического производства по п. 3, где MCCS1 сконфигурирована для осуществления двух типовых процессов захвата рекомбинантного терапевтического белка и инактивации вирусов.
6. Система биологического производства по п.5, где MCCS1 содержит четыре колонки.
7. Система биологического производства по п.1, дополнительно содержащая насосную систему, которая находится в жидкостном сообщении с входом.
8. Система биологического производства для получения рекомбинантного терапевтического белка в жидкости, включающая две или более подсистемы, где каждая из двух или более подсистем включает:
(i) первую многоколоночную хроматографическую систему (MCCS1), содержащую вход; и
(ii) вторую многоколоночную хроматографическую систему (MCCS2), содержащую выход, где MCCS1 и MCCS2 находятся в жидкостном сообщении друг с другом и где система биологического производства сконфигурирована так, что жидкость поступает на вход через MCCS1 и MCCS2 и покидает систему биологического производства через выход;
где две или более подсистемы сконфигурированы так, что каждая из них находится в жидкостном сообщении с одиночным резервуаром, содержащим жидкость;
жидкость из одиночного резервуара поступает на вход двух или более подсистем;
MCCS1 в каждой из двух или более подсистем сконфигурирована для выполнения по меньшей мере типового процесса захвата рекомбинантного терапевтического белка смолой; и
MCCS2 в каждой из двух или более подсистем сконфигурирована для выполнения по меньшей мере двух типовых процессов очистки и доочистки рекомбинантного терапевтического белка.
9. Система биологического производства по п.6, где три из четырех колонок способны к захвату рекомбинантного терапевтического белка из жидкой культуральной среды.
10. Система биологического производства по п.9, в которой четвертая колонка из четырех колонок представляет собой резервуар, способный поддерживать элюат из трех колонок, содержащий рекомбинантный терапевтический белок, при pH от 3,0 до 5,0.
11. Система биологического производства по п.1, дополнительно содержащая жидкостной трубопровод, расположенный между MCCS1 и MCCS2.
12. Система биологического производства по п.11, дополнительно содержащая встроенный резервуар для регуляции буфера, который имеет жидкостное сообщение с жидкостным трубопроводом, расположенным между MCCS1 и MCCS2, и сконфигурированный так, что буфер, содержащийся внутри встроенного резервуара для регуляции буфера, вводится в жидкость, присутствующую в жидкостном трубопроводе, расположенном между MCCS1 и MCCS2.
13. Система биологического производства по п.11, дополнительно содержащая фильтр, расположенный в жидкостном трубопроводе между MCCS1 и MCCS2 и сконфигурированный так, что фильтр способен удалять твердые частицы из жидкости, присутствующей в жидкостном трубопроводе между MCCS1 и MCCS2.
14. Система биологического производства по п.10, где MCCS2 содержит три хроматографические колонки и хроматографическую мембрану.
15. Система биологического производства по п.14, дополнительно включающая жидкостный трубопровод, расположенный между тремя хроматографическими колонками в MCCS2 и хроматографической мембраной в MCCS2.
16. Система биологического производства по п. 15, дополнительно содержащая встроенный резервуар для регуляции буфера, который имеет жидкостное сообщение с жидкостным трубопроводом, расположенным между тремя хроматографическими колонками в MCCS2 и хроматографической мембраной в MCCS2, и сконфигурированный так, что буфер, содержащийся внутри встроенного резервуара для регуляции буфера, вводится в жидкость, присутствующую в жидкостном трубопроводе, расположенном между тремя хроматографическими колонками в MCCS2 и хроматографической мембраной в MCCS2.
17. Система биологического производства по п. 14, где три хроматографические колонки в MCCS2 способны к очистке рекомбинантного терапевтического белка посредством катионообменной или анионообменной хроматографии.
18. Система биологического производства по п. 14, где хроматографическая мембрана в MCCS2 представляет собой катионообменную хроматографическую мембрану.
19. Система биологического производства по п. 14, дополнительно содержащая жидкостный трубопровод между хроматографической мембраной в MCCS2 и выходом.
20. Система биологического производства по п. 19, дополнительно содержащая фильтр, расположенный между хроматографической мембраной в MCCS2 и выходом и сконфигурированный так, что фильтр способен удалять твердые частицы из жидкости, присутствующей в жидкостном трубопроводе между хроматографической мембраной в MCCS2 и выходом.
21. Система биологического производства по п. 7, где насосная система содержит насос, который способен прокачивать жидкость к входу.
22. Система биологического производства по п.21, дополнительно содержащая жидкостный трубопровод, расположенный между насосом и входом.
23. Система биологического производства по п.22, дополнительно содержащая фильтр, расположенный в жидкостном трубопроводе между насосом и входом и сконфигурированный так, что фильтр способен удалять твердые частицы из жидкости, присутствующей в жидкостном трубопроводе между насосом и входом.
24. Система биологического производства по п.8, где каждая из двух или более подсистем располагается на своей собственной передвижной платформе.
25. Система биологического производства по п.8, где вся система располагается на передвижной платформе.
26. Система биологического производства по п.1, где MCCS1 сконфигурирована для осуществления по меньшей мере двух отдельных типовых процессов.
27. Способ получения терапевтического белкового лекарственного вещества с использованием системы по любому из пп. 1-26.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| US 5423982 A (BIO-SEPRA, INC.), 13.06.1995 | |||
| US 7714112 B2 (GE HEALTHEARE BIO-SCIENCES AB), 11.05.2010 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ОЧИСТКИ ИНТЕРФЕРОНОВЫХ БЕЛКОВ С ПОМОЩЬЮ КАТИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2002 |
|
RU2274471C2 |
| WO 2009103791 A1, 27.08.2009. | |||
Авторы
Даты
2022-03-22—Публикация
2014-03-03—Подача