ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к бифидобактериям, которые являются одними из нескольких преобладающих поддающихся культивированию видов бактерий, присутствующих в кишечной микрофлоре человека.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Бифидобактерии считают пробиотиками, поскольку они представляют собой живые организмы, которые при приеме внутрь в достаточном количестве помимо базового питания оказывают полезные для здоровья эффекты. Для оказания пробиотического эффекта большое количество поступивших бифидобактерий должно достигнуть места их действия. Предполагаемое минимальное количество составляет 106-107 живых бифидобактерий на грамм содержимого кишечника (Bouhnik, Y., Lait 1993). В литературе имеются данные, демонстрирующие, что исследования in vivo, проведенные на взрослых и детях, свидетельствуют, что некоторые штаммы бифидобактерий способны выживать при прохождении через желудочно-кишечный тракт. Наблюдались существенные различия в способности различных штаммов бифидобактерий переносить присутствие кислоты и желчных солей, что указывало, что выживание является важным критерием для отбора потенциальных пробиотических штаммов.
Прием бифидобактерий внутрь может улучшать транзит пищи по желудочно-кишечному тракту и может предупреждать или способствовать лечению заболеваний, которые могут быть вызваны недостатком или нарушением микрофлоры, таким как инфекции желудочно-кишечного тракта (GIT), запор, синдром раздраженного кишечника (IBS), воспалительное заболевание кишечника (IBD) - болезнь Крона и язвенный колит, пищевые аллергии, диарея, вызванная антибиотиками, сердечно-сосудистые заболевания и некоторые виды рака (например, колоректальный рак).
Вирусные инфекции являются основной причиной заболеваемости и смертности. Вирус гриппа, риновирус (обычная простуда) и респираторный синцитиальный вирус (RSV) являются высокозаразными вирусами, которые у здоровых индивидуумов обычно успешно элиминируются благодаря надлежащему иммунному ответу организма-хозяина. Однако основной проблемой при указанных инфекциях является не исходный вирус, а вторичные инфекции, которые часто его сопровождают, например, бактериальные инфекции, вызывающие пневмонию, инфекция ткани синуса и тому подобные. Предрасположенные индивидуумы, такие как страдающие COPD (хроническая обструктивная болезнь легких) или астмой или ожирением, очень плохо отвечают на вирусные инфекции, и последующие вторичные инфекции являются серьезными и могут угрожать жизни таких индивидуумов.
Такие индуцированные вирусом осложнения ассоциированы с существенными затратами на медицинское обслуживание и значительным страданием. Разработка новых и эффективных видов лечения для этих осложнений будет целесообразна, поскольку существует неудовлетворенная значительная клиническая потребность. Введение кортикостероидов пациентам, пораженным вирусом гриппа, в частности пандемичным вирусом птичьего гриппа, продолжает вызывать разногласия, хотя и является относительно частым. Рутинное применение стероидов при инфекции вирусом гриппа не является идеальным, поскольку не снижает вирусной нагрузки, а также впоследствии подавляет элиминацию вторичных бактериальных инфекций (Yang et al, 2015).
На ранних стадиях инфекции в эпителиальных клетках легких происходит репликация вируса гриппа, риновируса и RSV, приводящая к активации вирусных сенсоров и высвобождению противовирусных интерферонов (IFN) I типа и III типа, а также хемокинов и цитокинов. Указанные провоспалительные медиаторы помогают элиминировать первичную инфекцию, однако IFN I типа также могут вызывать последущее повреждение (иммунопатология). Было показано, что ответы IFN I типа, такие как повышение уровня молекул IFN-α и IFN-β, напрямую коррелируют с увеличением заболеваемости и смертности на моделях инфекции, представляющей собой грипп (Davidson et al, 2014). Избыточное образование противовирусного IFN I типа и связанного с ним хемокина IP-10 подавляет надлежащий иммунный ответ, направленный на элиминацию вторичных инфекций (Nakamura et al, 2011; Shahangian et al, 2009; Li et al, 2012), таких как вызванные такими бактериальными агентами, как Streptococcus pneumonia, Moraxella catarrhalis и Haemophilus influenzae и даже Staphylococcus aureus (Hewitt et al, 2016). Указанные вторичные инфекции вызывают избыточную гибель клеток в легких. У предрасположенных индивидуумов это ведет к повреждению ткани легких и снижению функции легких, что вызывает серьезные осложнения и смертность в некоторых случаях, например у пациентов с COPD. Важно, что провоспалительная активация происходит только при ответах IFN I типа, вызывающих рекрутирование нейтрофилов, но не при ответах IFN III типа (Galani et al, 2017).
Однако IFN III типа, такие как IFN лямбда (IFN-λ) могут ограничивать вирусную репликацию, не индуцируя провоспалительных ответов или иммунопатологии (Davidson et al, 2016; Galani et al, 2017).
Таким образом, терапевтические агенты, способные ограничивать ответы IFN I типа и сопутствующий провоспалительный и повреждающий ткани ответ на вирусную инфекцию, при этом поддерживая надлежащие ответы IFN III типа и противовирусную защиту, будут значительным шагом вперед в контроле респираторных вирусных инфекций. Такое уменьшение иммунопатологии имеет ключевое значение для выживаемости хозяина и разрешения заболевания.
Важную роль в ранней противовирусной защите также могут играть другие врожденные сенсоры или иммунные медиаторы. Сурфактантный белок D (SP-D) может предотвращать проникновение вируса гриппа в эпителиальные клетки, что является компонентом ранней фазы инфекции. (Thiel et al, 1989; Sastry et al, 1993). И вновь, терапевтические агенты, которые могут индуцировать этот врожденный сенсор, способный связываться с вирусом и предотвращать инфицирование им эпителиальных клеток бронхов, будут значительным шагом вперед в лечении вирусов, таких как вирус гриппа, риновирус и RSV. Кроме того, ингибирование фактора некроза опухоли-альфа (TNF-α), важного провоспалительного цитокина, имеет значительный эффект на выраженность иммунопатологии легких и ингибирует инфильтрацию воспалительными клетками и ответы цитокинов. Показана корреляция TNF-α с заболеваемостью и смертностью у обезьян макак и у людей, инфицированных высоковирулентными вирусами гриппа. Когда TNF-α был подавлен, наблюдали снижение репликации вируса гриппа и увеличение выживаемости мышей, инфицированных вирусом гриппа (Shi et al, 2013). Ингибирование данного провоспалительного цитокина этанерцептом обеспечивает защиту против летальной инфекции вирусом гриппа H1N1 у мышей (Shi et al, 2013).
Терапевтические агенты, которые способны индуцировать IFN-λ и/или SP-D, будут играть роль в ранней элиминации первичной вирусной инфекции, в то же время снижая вероятность вторичных бактериальных инфекций, и будут значительным шагом вперед в контроле над ARDS (острый респираторный дистресс-синдром), астмой, ожирением и COPD.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В изобретении предложен штамм Bifidobacterium longum, имеющий регистрационный номер NCIMB 42020. Указанный штамм может быть в форме биологически чистой культуры.
Также предложен выделенный штамм Bifidobacterium longum NCIMB 42020.
Штамм может быть в форме жизнеспособных клеток и/или в форме нежизнеспособных клеток.
Штамм может быть выделен из кала или желудочно-кишечного тракта здоровых субъектов-людей.
Штамм может быть в форме бактериального бульона. В альтернативном варианте штамм находится в форме лиофилизированного порошка.
Штамм ослабляет ответ IP-10 на вирус. Это важно, поскольку IP-10 секретируется несколькими типами клеток в ответ на IFN-γ. Эти типы клеток включают моноциты и эндотелиальные клетки. IP-10 приписывают несколько ролей, включая роль хемоаттрактанта для моноцитов/макрофагов, Т-клеток, NK-клеток и дендритных клеток, а также облегчение адгезии Т-клеток к эндотелильным клеткам и выполнение роли маркера активации системы хозяина, индуцированной вирусом.
Штамм может усиливать ответ интерферона III типа на вирус, такой как ответ интерферона лямбда на вирус.
Штамм может подавлять ответ интерферона I типа на вирус, такой как ответ интерферона альфа на вирус и/или ответ интерферона бета на вирус.
Штамм может усиливать ответ сурфактантного белка D на вирус.
В изобретении также предложена композиция, содержащая штамм Bifidobacterium по изобретению.
Композиция может дополнительно содержать другой пробиотический материал и/или пребиотический материал.
Композиция может дополнительно содержать принимаемый внутрь носитель. Принимаемый внутрь носитель может представлять собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок. Принимаемый внутрь носитель может представлять собой пищевой продукт, такой как кислое молоко, йогурт, замороженный йогурт, мороженое, порошковое молоко, концентрированное молоко, мороженое, сырная паста, заправка или напиток.
Композиция может дополнительно содержать белок и/или пептид, в частности белки и/или пептиды, богатые глутамином/глутаматом, липид, углевод, витамин, минерал и/или микроэлемент.
Штамм Bifidobacterium может присутствовать в количестве, превышающем 106 CFU (колониеобразующих единиц) на грамм композиции.
Композиция может дополнительно содержать адъювант, лекарственное средство и/или биологическое соединение.
Композиция может быть адаптирована для введения в легкие или в нос. Например, композиция может быть в форме назального спрея. Вязкость композиции может составлять от 1 сП (сантипуаз) до 2000 сП.
Штамм Bifidobacterium или его композиция могут быть для применения в пищевых продуктах или в качестве лекарственного средства.
Штамм Bifidobacterium или его композиция могут быть для применения в профилактике и/или лечении нежелательной воспалительной активности.
Штамм Bifidobacterium или его активное производное, или фрагмент, или мутант или вариант, могут быть для применения в профилактике и/или лечении нежелательной воспалительной активности.
Штамм Bifidobacterium или его композиция могут быть для применения в изготовлении лекарственного средства для лечения астмы и/или аллергии, где лекарственное средство может быть в форме, подходящей для ингаляции.
Штамм Bifidobacterium или его композиция могут быть для применения в профилактике и/или лечении вирусной инфекции у субъекта.
Штамм Bifidobacterium или его композиция могут быть для применения в профилактике вторичной бактериальной инфекции, ассоциированной с респираторной вирусной инфекцией, у субъекта.
В некоторых случаях вирус представляет собой респираторный вирус, который может быть выбран из вируса гриппа, риновируса и респираторного синцитиального вируса.
У субъекта может быть диагностировано воспалительное заболевание легких.
В некоторых случаях субъект имеет повышенную предрасположенность к респираторной инфекции.
Субъект может представлять собой одного или более из пациента с ожирением, пациента с острым респираторным дистресс-синдромом (ARDS), пациента с астмой или пациента с хронической обструктивной болезнью легких (COPD).
В одном случае субъект является ребенком в возрасте младше 5 лет.
В другом случае субъект является пожилым человеком в возрасте старше 60 лет.
В изобретении также предложен способ профилактики или лечения вирусной инфекции у субъекта, включающий введение субъекту, которому это необходимо, эффективного количества штамма Bifidobacterium longum NCIMB 42020, или его активного производного, или фрагмента, или мутанта, или варианта.
Штамм Bifidobacterium longum NCIMB 42020 или его активное производное, или фрагмент, или мутант, или вариант может:
ослаблять ответ IP-10 на вирус;
усиливать ответ интерферона III типа на вирус, такой как ответ интерферона лямбда на вирус;
подавлять ответ интерферона I типа на вирус, такой как ответ интерферона альфа на вирус и/или ответ интерферона бета на вирус; и/или
усиливать ответ сурфактантного белка D на вирус.
Также предложена фракция клеточной стенки, выделенная из штамма Bifidobacterium longum NCIMB 42020.
Фракция клеточной стенки способна:
ослаблять ответ IP-10 на вирус;
усиливать ответ интерферона III типа на вирус, такой как ответ интерферона лямбда на вирус;
подавлять ответ интерферона I типа на вирус, такой как ответ интерферона альфа на вирус и/или ответ интерферона бета на вирус; и/или
усиливать ответ сурфактантного белка D на вирус.
В некоторых случаях вирус представляет собой респираторный вирус, который может быть выбран из вируса гриппа, риновируса и респираторного синцитиального вируса.
У субъекта может быть диагностировано воспалительное заболевание легких.
В некоторых случаях субъект имеет повышенную предрасположенность к респираторной инфекции.
Субъект может представлять собой одного или более из пациента с ожирением, пациента с острым респираторным дистресс-синдромом (ARDS), пациента с астмой или пациента с хронической обструктивной болезнью легких (COPD).
В одном случае субъект является ребенком в возрасте младше 5 лет.
В другом случае субъект является пожилым человеком в возрасте старше 60 лет.
Фракция клеточной стенки может иметь молекулярную массу более 100 кДа. Фракция клеточной стенки может иметь размер менее 0,45 мкм.
В одном воплощении фракция выделена путем разрушения Bifidobacterium longum и отделения фракции клеточной стенки от цитоплазматической фракции.
Также предложена фракция клеточной стенки, выделенная из штамма Bifidobacterium longum, для применения в профилактике или лечении респираторной вирусной инфекции у субъекта.
В изобретении также предложена фракция клеточной стенки, выделенная из штамма Bifidobacterium longum, для применения в профилактике вторичной бактериальной инфекции, ассоциированной с респираторной вирусной инфекцией, у субъекта.
Также предложен способ выделения фракции клеточной стенки Bifidobacterium longum, включающий стадии:
разрушения Bifidobacterium longum с образованием фракции клеточной стенки и цитоплазматической фракции; и
отделения фракции клеточной стенки от цитоплазматической фракции.
Разрушение Bifidobacterium longum может включать по меньшей мере одно из:
- обработки хелатирующим агентом;
- обработки ферментом; и
- воздействия силы сдвига.
Хелатирующий агент может представлять собой кальциевый хелатирующий агент, такой как этилендиаминтетрауксусная кислота (EDTA). Фермент может представлять собой гликозидгидролазу, такую как лизоцим. Альтернативно или дополнительно фермент может представлять собой муралитический фермент, такой как мутанолизин.
Силой сдвига можно воздействовать посредством ультразвука и/или давления, например, при помощи френч-пресса.
Разделение может включать центрифугирование.
В некоторых случаях после разделения фракцию клеточной стенки фильтруют для получения фракции размером менее 0,45 мкм.
Также предложена композиция, которая содержит фракцию клеточной стенки.
Композиция может дополнительно содержать другой пробиотический материал и/или пребиотический материал.
Композиция может дополнительно содержать принимаемый внутрь носитель. Принимаемый внутрь носитель может представлять собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок. Принимаемый внутрь носитель может представлять собой пищевой продукт, такой как кислое молоко, йогурт, замороженный йогурт, мороженое, порошковое молоко, концентрированное молоко, мороженое, сырная паста, заправка или напиток.
Композиция может дополнительно содержать белок и/или пептид, в частности белки и/или пептиды, богатые глутамином/глутаматом, липид, углевод, витамин, минерал и/или микроэлемент.
Композиция может дополнительно содержать адъювант, лекарственное средство и/или биологическое соединение.
Композиция может быть адаптирована для введения в легкие или в нос. Например, композиция может быть в форме назального спрея. Вязкость композиции может составлять от 1 до 2000 сП.
В изобретении предложен выделенный штамм Bifidobacterium longum NCIMB 42020 (АН0106).
В изобретении также предложен мутант или вариант выделенного штамма Bifidobacterium longum NCIMB 42020.
Выделенный штамм может быть в форме жизнеспособных клеток.
Выделенный штамм может быть в форме нежизнеспособных клеток.
В изобретении также предложена композиция, содержащая выделенный штамм Bifidobacterium longum NCIMB 42020.
Композиция может дополнительно содержать принимаемый внутрь носитель. Принимаемый внутрь носитель может представлять собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок. Принимаемый внутрь носитель может представлять собой пищевой продукт, такой как кислое молоко, йогурт, замороженный йогурт, порошковое молоко, концентрированное молоко, сырные пасты, заправки или напитки.
В одном воплощении штамм ослабляет ответ IP-10 на вирус.
В одном воплощении штамм усиливает ответ интерферона III типа на вирус.
В одном воплощении штамм подавляет ответ интерферона альфа на вирус.
В одном воплощении штамм подавляет ответ интерферона бета на вирус.
В одном случае штамм:
- ослабляет ответ IP-10 на вирус;
- усиливает ответ интерферона III типа на вирус;
- подавляет ответ интерферона альфа на вирус; и
- подавляет ответ интерферона бета на вирус.
Штамм может присутствовать в количестве, превышающем 106 CFU на грамм принимаемого внутрь носителя.
В изобретении также предложена композиция, содержащая выделенный штамм Bifidobacterium longum NCIMB 42020 и фармацевтически приемлемый носитель.
В изобретении также предложено применение штамма Bifidobacterium longum NCIMB 42020 в качестве пробиотического штамма.
В одном воплощении композиция может быть адаптирована для введения в легкие или в нос.
Следует принимать во внимание, что конкретный штамм по изобретению можно вводить животным (включая людей) в пероральной принимаемой внутрь форме в стандартном препарате, таком как капсулы, микрокапсулы, таблетки, гранулы, порошки, пастилки, пилюли, суппозитории, суспензии и сиропы. Подходящие композиции можно получать обычно применяемыми способами с применением стандартных органических и неорганических добавок. Количество активного ингредиента в композиции медицинского назначения может находиться на уровне, который будет оказывать желаемый терапевтический эффект.
Композиция может также включать бактериальный компонент, лекарственное средство и/или биологическое соединение.
Кроме того, вакцина, содержащая штаммы по изобретению, может быть получена с использованием любого подходящего способа и может включать фармацевтически приемлемый носитель или адъювант.
В изобретении также предложен штамм Bifidobacterium по изобретению или композиция по изобретению для применения в профилактике или лечении вирусной инфекции у субъекта.
В одном случае субъект представляет собой пациента с острым респираторным дистресс-синдромом (ARDS).
В другом случае субъект представляет собой пациента с астмой.
В следующем случае субъект представляет собой пациента с хронической обструктивной болезнью легких (COPD).
В изобретении также предложена фракция клеточной стенки, выделенная из Bifidobacterium longum NCIMB 42020, где фракция клеточной стенки ослабляет ответ IP-10 на вирус.
В одном случае фракция усиливает ответ интерферона III типа на вирус.
В одном случае фракция подавляет ответ интерферона альфа на вирус.
В одном случае фракция подавляет ответ интерферона бета на вирус.
В изобретении также предложена фракция клеточной стенки, выделенная из Bifidobacterium longum NCIMB 42020, где фракция клеточной стенки:
- ослабляет ответ IP-10 на вирус;
- усиливает ответ интерферона III типа на вирус;
- подавляет ответ интерферона альфа на вирус; и
- подавляет ответ интерферона бета на вирус.
В одном случае молекулярная масса фракции клеточной стенки составляет более 100 кДа.
В одном случае фракция клеточной стенки имеет размер менее 0,45 мкм.
В одном случае фракция клеточной стенки имеет молекулярную массу более 100 кДа и размер менее 0,45 мкм.
В изобретении также предложен способ профилактики или лечения вирусной инфекции у субъекта, включающий стадию введения фракции клеточной стенки, выделенной из Bifidobacterium longum NCIMB 42020.
В одном случае фракция клеточной стенки ослабляет ответ IP-10 на вирус.
В одном случае фракция усиливает ответ интерферона III типа на вирус.
В одном случае фракция подавляет ответ интерферона альфа на вирус.
В одном случае фракция подавляет ответ интерферона бета на вирус.
Также предложен способ профилактики или лечения вирусной инфекции у субъекта, включающий введение фракции клеточной стенки, выделенной из Bifidobacterium longum NCIMB 42020, где указанная фракция:
- ослабляет ответ IP-10 на вирус;
- усиливает ответ интерферона III типа на вирус;
- подавляет ответ интерферона альфа на вирус; и
- подавляет ответ интерферона бета на вирус.
В одном случае молекулярная масса фракции клеточной стенки составляет более 100 кДа.
В одном случае фракция клеточной стенки имеет размер менее 0,45 мкм.
В одном случае фракцию клеточной стенки вводят в композиции, подходящей для легочного или интраназального введения.
В одном случае субъект представляет собой пациента с острым респираторным дистресс-синдромом (ARDS).
В другом случае субъект представляет собой пациента с астмой.
В следующем случае субъект представляет собой пациента с хронической обструктивной болезнью легких (COPD).
Изобретение также включает мутанты и варианты депонированных штаммов. В данном описании термины мутант, вариант и генетически модифицированный мутант включают штамм, чьи генетические и/или фенотипические свойства изменены по сравнению с родительским штаммом. Вариант естественного происхождения включает спонтанные изменения избирательно отобранных целевых свойств. Намеренное изменение свойств родительского штамма осуществляют посредством стандартных (in vitro) генетических манипуляций, таких как разрушение гена, конъюгационный перенос и тому подобное. Генетическая модификация включает введение экзогенных и/или эндогенных последовательностей ДНК в геном штамма, например посредством встраивания в геном бактериального штамма при посредством векторов, включающих плазмидную ДНК, или бактериофагов.
Естественные или индуцированные мутации включают изменение по меньшей мере одного основания, такое как делеция, вставка, трансверсия или иные модификации ДНК, что может привести к изменению аминокислотной последовательности, кодируемой последовательностью ДНК.
Термины мутант, вариант и генетически модифицированный мутант также включают штамм, который претерпел генетические изменения, которые накапливаются в геноме со скоростью, которая по природе постоянна для всех микроорганизмов, и/или генетические изменения, возникающие в результате спонтаной мутации, и/или приобретение генов и/или потерю генов, которые произошли не в результате преднамеренной (in vitro) манипуляции с геномом, а в результате естественного отбора вариантов и/или мутантов, которые обеспечивают селективное преимущество, для поддержания выживаемости бактерии при воздействии давления окружающей среды, такого как антибиотики. Мутант может быть создан посредством намеренного (in vitro) встраивания в геном определенных генов, которые фундаментально не нарушают биохимическую функциональность организма, но чьи продукты можно применять для идентификации или отбора бактерии, например, по устойчивости к антибиотикам.
Специалисту в области техники понятно, что мутантные или вариантные штаммы могут быть идентифицированы посредством анализа гомологии последовательности ДНК с родительским штаммом. Штаммы, имеющие близкую идентичность последовательности с родительским штаммом без демонстрируемых фенотипических или поддающихся измерению функциональных различий, считают мутантными или вариантными штаммами. Штамм с идентичностью (гомологией) последовательности 99,5% или более с родительской последовательностью ДНК может считаться мутантом или вариантом. Гомологию последовательностей можно определять с применением он-лайн алгоритма поиска гомологии программы BLAST, доступ к которому можно получить по ссылке http://www.ncbi.nlm.nih,gov/BLAST/
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Описание, приведенное ниже в целях иллюстрации, со ссылкой на прилагающиеся графические материалы, позволит лучше понять изобретение.
На Фиг. 1 представлена столбчатая диаграмма, демонстрирующая профиль индуцирования IL-10 в РВМС (мононуклеарные клетки периферической крови) и в MDDC (дендритные клетки моноцитарного происхождения) после стимуляции in vitro повышающимися концентрациями (средней и высокой) штаммов В. longum 35624, АН1206, АН1362, 1714, BL1207 и АН0106;
На Фиг. 2 представлена столбчатая диаграмма, демонстрирующая профиль индуцирования EL-12p40 в РВМС и в MDDC после стимуляции in vitro повышающимися концентрациями (средней и высокой) штаммов В. longum 35624, АН1206, АН1362, 1714, BL1207 и АН0106;
На Фиг. 3 представлена столбчатая диаграмма, демонстрирующая профиль индуцирования TNF-α в РВМС и в MDDC после стимуляции in vitro повышающимися концентрациями (средней и высокой) штаммов В. longum 35624, АН1206, АН1362, 1714, BL1207 и АН0106;
На Фиг. 4 представлена столбчатая диаграмма, демонстрирующая профиль индуцирования EL-Iβ в РВМС и в MDDC после стимуляции in vitro повышающимися концентрациями (средней и высокой) штаммов В. longum 35624, АН1206, АН1362, 1714, BL1207 и АН0106;
На Фиг. 5 представлена столбчатая диаграмма ответа IP-10 на риновирус в присутствии В. longum АН0106;
На Фиг. 6(а) - 6(c) представлен ряд столбчатых диаграмм ответов интерферона лямбда (интерферона III типа), интерферона альфа и интерферона бета (интерфероны I типа) на риновирус в присутствии В. longum АН0106;
На Фиг. 7 представлена столбчатая диаграмма, где сравнивается ответ IP-10 на риновирус 16 в присутствии штаммов В. longum АН0106 или Staphylococcus aureus;
На Фиг. 8 представлена столбчатая диаграмма ответа IP-10 на LPS (липополисахарид) в присутствии штаммов В. longum АН0106 и 35624;
На Фиг. 9 представлена столбчатая диаграмма ответа TNF-α на LPS в присутствии штаммов В. longum АН0106 и 35624;
На Фиг. 10 представлен график вирусной репликации в легких в ответ на штаммы В. longum АН0106, В. longum 35624 и плацебо после инфицирования вирусом;
На Фиг. 11 представлен график выживаемости с течением времени после инфицирования штаммами В. longum АН0106, 35624 и плацебо;
На Фиг. 12 представлен ряд графиков цитокиновых ответов в полученной при бронхоальвеолярном лаваже жидкости (BAL) и ответов сурфактантного белка D в сыворотке на штаммы В. longum АН0106, 35624 и плацебо после инфицирования вирусом;
На Фиг. 13 показана тепловая карта различных биомаркеров, измеренных в BAL в ответ на штаммы В. longum АН0106, 35624 и плацебо после инфицирования вирусом; чем больше интенсивность полосы, тем выше индуцирование;
На Фиг. 14 представлен график количества макрофагов в BAL в ответ на штаммы В. longum АН0106, 35624 и плацебо после инфицирования вирусом;
На Фиг. 15 представлена схема процесса, использованного для выделения фракции клеточной стенки из Bifidobacterium longum АН0106;
На Фиг. 16(a) представлен график ответа IP-10 на риновирус человека (HRV16) в присутствии фракции клеточной стенки (осадок Bif АН0106) штамма АН0106 в дендритных клетках моноцитарного происхождения;
На Фиг. 16(b) представлен график ответа IFN-α на риновирус человека (HRV16) в присутствии фракции клеточной стенки (осадок Bif АН0106) штамма АН0106 в дендритных клетках моноцитарного происхождения;
На Фиг. 16(c) представлен график ответа IFN-β на риновирус человека (HRV16) в присутствии фракции клеточной стенки (осадок Bif АН0106) штамма АН0106 в дендритных клетках моноцитарного происхождения;
На Фиг. 17(a) представлена столбчатая диаграмма ответа IP-10 на риновирус человека (HRV16) в присутствии фракции клеточной стенки штамма UCC2003 по сравнению с фракцией клеточной стенки штамма АН0106 в дендритных клетках моноцитарного происхождения;
На Фиг. 17(b) представлена столбчатая диаграмма ответа IP-10 на интерферон бета (IFN-β) в присутствии фракции клеточной стенки штамма UCC2003 по сравнению с фракцией клеточной стенки штамма АН0106 в дендритных клетках моноцитарного происхождения;
На Фиг. 18(a) представлена столбчатая диаграмма ответа TNF-α на LPS в присутствии фракции клеточной стенки штамма UCC2003 по сравнению с фракцией клеточной стенки штаммов В. longum АН0106 и 35624 в дендритных клетках моноцитарного происхождения;
На Фиг. 18(b) представлена столбчатая диаграмма ответа TNF-α на Ро1у:IC в присутствии фракции клеточной стенки штамма UCC2003 по сравнению с фракцией клеточной стенки штаммов В. longum АН0106 и 35624 в дендритных клетках моноцитарного происхождения;
Фиг. 19(a) является иллюстрацией каскада аномального ответа на вирусную инфекцию; и
Фиг. 19(b) является иллюстрацией каскада ответа на вирусную инфекцию, опосредованного штаммом В. longum АН106 или фракцией клеточной стенки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Депонирование штамма Bifidobacterium longum АН0106 осуществили в национальной коллекции промышленных и морских бактерий (NCIMB) Ferguson Building, Craibstone Estate, Bucksburn, Aberdeen, AB21 9YA, Scotland, UK 2 августа 2012 с присвоением регистрационного номера NCIMB 42020.
В описании также упоминается Bifidobacterium longum NCIMB 41003 (штамм 35624®). Данный штамм описан в WO00/42168, содержание которого включено во всей полноте путем ссылки. Штамм депонирован в национальной коллекции промышленных и морских бактерий Ferguson Building, Craibstone Estate, Bucksburn, Aberdeen, AB21 9YA, Scotland, UK 13 января 1999.
Авторы изобретения обнаружили, что конкретный штамм бактерий способствует противовирусной защите и подавляет повреждающие провоспалительные ответы и особенно полезен для предупреждения и/или лечения ARDS, индуцированного вирусом, или индуцированных вирусом осложнений у пациентов с астмой и COPD.
ПРИМЕРЫ
Приведенные ниже примеры более подробно описывают и илюстрируют воплощения, входящие в объем изобретения. Примеры приведены только в целях иллюстрации и не должны рассматриваться как ограничивающие данное изобретение, поскольку в рамках изобретения возможны различные варианты, остающиеся в духе и в рамках изобретения.
Пример 1. Выделение Bifidobacterium longum NCIMB 42020
Штамм Bifidobacterium longum NCIMB 42020 выделяли из образцов кала здоровых людей.
В образцах кала проводили скрининг пробиотических бактериальных штаммов. Образцы переносили в пробирку для сбора, содержащую забуференный фосфатов физиологический раствор (PBS) с добавлением 0,05% цистеина-HCl). Затем растворы инкубировали в течение 10 минут. Образцы перемешивали на вортексе и высевали на селективный агар (агар MRS (Де Ман, Рогоза, Шарп) + 10% сахароза + мупироцин и конго красный + цистеин + мупироцин). Для фенотипического скрининга штаммов бактерий, экспрессирующих EPS (экзополисахарид), проводили скрининг на агаре с конго красным. Вкратце, 10 мл модифицированной бульонной среды Рогоза (+0,05% цистеин) инокулировали в аспетических условиях свежевыращенной колонией штамма бактерий и инкубировали в анаэробных условиях при 37°С до мутности (от приблизительно 16 до приблизительно 24 часов). Осуществляли в аспетических условиях посев штрихом бульонных культур на чашки с агаром с конго красным и инкубировали в анаэробных условиях при 37°С в течение 48 часов. Полагают, что EPS, продуцируемый как побочный продукт роста и/или метаболизма некоторых штаммов, предупреждает поглощение красителя конго красный, в результате чего колония имеет кремовую/белую окраску. Штаммы, продуцирующие меньше EPS, легко поглощают краситель конго красный, в результате чего колония имеет розовую/красную окраску. Штаммы, не продуцирующие EPS, окрашиваются в красный цвет и выглядят почти прозрачными на фоне красного агара.
Изолированные колонии брали с поверхности агара и делали посев тремя штрихами для подтверждения чистоты. Для определения предполагаемых видов бифидобактерий проводили микроскопическое исследование, окрашивание по Граму, исследование каталазы, фруктозо-6-фосфат фосфокетолазы и хранили изоляты в 40% глицерине при -80°С. Для подтверждения идентичности свежевыделенных штаммов проводили секвенирование межгенной спейсерной области 16S (IGS).
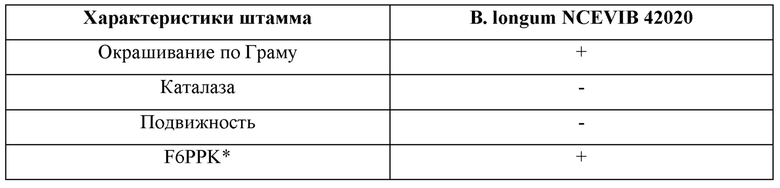
После выделения чистого штамма бифидобактерий, обозначенного как АН0106, его затем депонировали в NCIMB и обозначали как 42020. Исследовали микробиологические характеристики, которые обобщены ниже в Таблице 1. В. longum NCIMB 42020 представляет собой грам-положительную, каталаза-отрицательную бактерию плеоморфной формы, которая является положительной по фруктозо-6-фосфат фосфокетолазе, что подтверждает ее принадлежность бифидобактериям.
Таблица 1. Физико-химические характеристики В. longum NCIMB 42020
Для идентификации выделенных видов бифидобактерий проводили секвенирование межгенного спейсера (IGS) 16s-23s. Вкратце, ДНК выделяли из NCIMB 42020 с применением 100 мкл раствора для выделения и 25 мкл раствора для подготовки ткани (Sigma, набор XNAT2). Образцы инкубировали в течение 2 ч при комнатной температуре, затем 2 ч при 95°С и затем добавляли 100 мкл нейтрализующего раствора (Sigma, набор XNAT2). Раствор геномной ДНК подвергали количественному определению с применением спектрофотометра Nanodrop и хранили при 4°С. Проводили PCR (полимеразная цепная реакция) с применением праймеров IGS. Использовали пары праймеров IGS R 5'-CTGGTGCCAAGGCATCCA-3' (SEQ ID No. 1) и IGS L 5'-GCTGGATCACCTCCTTTCT-3' (SEQ ID No. 2). Условия циклов были следующими: 94°С в течение 4 мин (1 цикл), 94°С в течение 45 сек, 53°С в течение 45 сек и 72°С в течение 45 сек (28 циклов). Реакционная смесь для PCR содержала 21 мкл (100 нг) ДНК, смесь для PCR (Sigma, Red Taq), 0,025 нМ праймеров IGS L и R (MWG Biotech, Германия). Реакцию PCR проводили в термоциклере Biotherma. PCR-продукты (10 мкл) разделяли в 2% агарозном геле в ТАЕ (трис-ацетат-этилендиаминтетрауксусная кислота), окрашенном EtBr (бромистый этидий), вместе с маркером молекулярной массы (100 bp Ladder, Roche) для определения профиля IGS. PCR-продукты Bifidobacterium (одна полоса) очищали с применением набора для очистки PCR-продуктов Promega Wizard PCR purification. Очищенные PCR-продукты секвенировали с применением праймеров (выше) для межгенной спейсерной области. Для идентификации штамма по гомологии нуклеотидов осуществляли поиск отсеквенированных последовательностей в базе нуклеотидных последовательностей NCBI. Проводили стандартный поиск гомологии нуклеотидов полученных последовательностей ДНК при помощи поискового алгоритма BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). Обнаружили наилучшее совпадение с последовательностью и затем осуществили выравнивание последовательностей для сравнения с применением программы DNASTAR MegAlign. Последовательности приведены в перечне последовательностей (Таблица 2). Поиск в базе данных NCIMB показал, что NCIMB 42020 имеет уникальную последовательность IGS (Таблица 2), с наибольшей гомологией последовательностей с Bifidobacterium longum.
Таблица 2. Последовательность IGS В. lonsum NCIMB 42020 (SEQ ID No. 3).
TTGCTGGGATCACCTCCTTTTTACGGAGAATTCAGTCGGATGTTCGTCCGACGGTGTGCGCCCCGCGCGTCGCATGGTGCGATGGCGGCGGGGTTGCTGGTGTGGAAAACGTCGTTGGCTTTGCCCTGCCGGTCGTGCGGTGGGTGCGGGGTGGTATGGATGCGCTTTTGGGCTCCCGGATCGCCACCCCAGGCTTTTTGCCTGGCGCGATTCGATGCCCGTCGTGCCTGGGGGCCGGCCGTGTGCCGGCGCGATGGCGTGGCGGTGCGTGGTGGCTTGAGAACTGGATAGTGGACGCGAGCAAAACAAGGGTTTTTGAATCTTTGTTTTGCTGTTGATTTCGAATCGAACTCTATTGTTCGTTTCGATCGTTTTGTGATCATTTTTAGTGTGATGATTTGTCGTCCTGGGAATTTGCTAGAGGAATACTTGCGGGCCATGCACTTTCGTGGTGTGTGTTGCTTGCAAGGGCGTATGGTGGAGGCCTTGGCACCAGAA
Пример 2. Профиль цитокинов AH106 и сравнение с профилем других штаммов Bifidobacteria longum, потенциально полезных для здоровья.
Мононуклеарные клетки периферической крови (РВМС) выделяли у здоровых доноров при помощи центрифугирования в градиенте плотности. РВМС промывали и ресуспендировали в среде Игла в модификации Дюльбекко - Glutamax (DMEM) ТМ (Glutamax (заменитель глутамина) + пируват + 4,5 г/л глкозы (Gibco, кат.номер 10569-010), содержащей 10% эмбриональную телячью сыворотку (Sigma, кат. номер F4135) и 1% пенициллин/стрептомицин (Sigma, кат. номер Р0781). РВМС активировали различными дозами Bifidobacteria longum (высокой (общее количество бактерий:РВМС) (100:1) и средней (50:1)) в течение 24 ч в DMEM с добавками при 37°С, 5% CO2.
Для получения дендритных клеток моноцитарного происхождения: Мононуклеарные клетки периферической крови (РВМС) выделяли у здоровых доноров при помощи центрифугирования в градиенте плотности. Моноциты периферической крови человека выделяли с применением CD 14-положительного выделения с использованием системы MACS (сортировка магнитно-активированных клеток) (Miltenyi Biotec, 130-050-201). Клетки культивировали в среде cRPMI (Life Technologies, 21875-091) с 1000 Ед/мл интерлейкина 4 (Novartis) и 1000 Ед/мл гранулоцитарно-макрофагального колониестимулирующего фактора (PeproTech, 300-03) в течение 6 суток для дифференцировки их в дендритные клетки моноцитарного происхождения (MDDC). MDDC активировали различными дозами В. longum (высокой (общее количество бактерий:MDDC) (100:1) и средней (50:1)) в течение 24 ч в cRPMI при 37°С, 5% CO2. Секрецию цитокинов определяли с применением имеющихся в продаже наборов для определения цитокинов (MesoScale Discovery) согласно инструкциям производителя.
АН0106 индуцировал больше IL-10, IL-12p40, TNF-α, IL-Iβ как в РВМС, так и в MDDC по сравнению с другими штаммами бактерий (35624, АН1206, АН1362, 1714, BL1207), которые имели схожие друг с другом профили (Фиг. 1-4). АН106 является гораздо более мощным стимулятором цитокинов, чем другие В. longum, особенно известные противовоспалительные штаммы, такие как 35624 и 1714, что демонстрирует, что АН0106 задействует иммунную систему человека иным способом, нежели другие штаммы В. longum, и является в большей мере иммуностимулирующим.
Пример 3. Штамм АН0106 (благоприятно блокирует интерфероны 1 типа и в результате индуцирование IP-10 (провоспалительного хемокина) и повышает интерферон 3 типа IFN-λ в дендритных клетках моноцитарного происхождения).
Избыточный иммунный ответ дендритных клеток на вирусную инфекцию вызывает провоспалительные ответы в легких. IFN 1 типа могут стимулировать продукцию хемокина IP-10, который является хемоаттрактантом Thl клеток. Для определения возможного благоприятного противовирусного эффекта В. longum АН0106 на человеческие дендритные клетки моноцитарного происхождения, MDDC стимулировали посредством В. longum АН0106 перед воздействием на них риновируса человека 16 (HRV16) и затем отслеживали ответ IP-10 на HRV16. MDDC активировали либо посредством HRV16 (MOI (множественность заражения) 25:1) в течение 24 ч в cRPMI при 37°С, 5% CO2 после предварительного воздействия (1 ч) различных доз В. longum АН0106 (100:1, 50:1, 25:1, 10:1, 1:1), либо только HRV16. Исследовали секрецию цитокинов при помощи мультиплексной суспензионной тест-системы Bio-Plex (Bio-Rad Laboratories), позволяющей измерять IFN-α, IFN-β, IFN-λ и IP-10. Неожиданно обнаружили, что В. longum АН0106 ослаблял ответ IP-10 на RV дозозависимым образом (фиг. 5). Также неожиданным было, что совместная инкубация со штаммом В. longum АН0106 в более низких дозах приводила к усилению ответов интерферона III типа (интерферона лямбда), тогда как ответы интерферона альфа и бета подавлялись при более высоких дозах, аналогично ответу IP-10 (Фиг. 6). Указанные данные свидетельствуют что В. longum АН0106 изменяет иммунный ответ на риновирус, поддерживая защитный иммунный ответ, при этом ослабляя повреждающие ответы.
Пример 4. Не все грам-положительные бактериальные штаммы имеют тот же эффект.
Для определения, имеет ли другой грам-положительный бактериальный штамм благоприятный противовирусный эффект в отношении человеческих дендритных клеток моноцитарного происхождения, MDDC, стимулированные посредством Staphylococcus aureus, подвергали воздействию риновируса человека 16 (HRV16) и отслеживали ответ IP-10. Вкратце, MDDC стимулировали либо посредством HRV16 (MOI) 25:1) в течение 24 ч в cRPMI при 37°С, 5% CO2 после предварительного воздействия (1 ч) различными дозами Staphylococcus aureus (100:1, 50:1) в сравнении с В. longum АН0106 (100:1), либо только HRV16. Штамм Staphylococcus aureus не снижал секрецию дендритными клетками IP-10 в ответ на HRV16 (Фиг. 7).
Пример 5. Штамм АН0106 благоприятно блокирует TNF-α в дендритных клетках моноцитарного происхождения, так же, как и IP-10, но не все штаммы Bifidobacteria longum имеют тот же эффект.
В воспаленной слизистой секрецию IP-10 и TNF-α индуцирует не только сам вирус, но его продукцию могут индуцировать и другие лиганды TLR (toll-подобных рецепторов). Таким образом, на MDDC предварительно воздействовали В. longum АН0106 или В. longum 35624 перед воздействием на них LPS. Отслеживали ответ IP-10 и TNF- на LPS, агонист TLR-4. Вкратце, MDDC стимулировали либо посредством LPS (50 нг/мл) в течение 24 ч в cRPMI при 37°С, 5% CO2 после предварительного воздействия (1 ч) В. longum АН0106 или 35624 в дозе (100:1), либо посредством только LPS. Неожиданно обнаружили, что В. longum АН106 ослаблял ответ IP-10 и TNF-α на LPS, тогда как ответ IP-10 на LPS после воздействия В. longum 35624 снижался лишь незначительно (Фиг. 8), а В. longum 35624 в той же самой дозе повышал TNF-α (Фиг. 9). Этот результат является очень неожиданным, поскольку В. longum 35624 является хорошо известным противовоспалительным штаммом и гипотетически был наилучшим кандидатом. Некоторые результаты, полученные по цитокинам для В. longum АН0106, позволяли предположить, что он будет вызывать генерализованную иммуностимулирующую реакцию, но на практике В. longum АН0106 вызывал более выраженный и специфический иммунный ответ в данной клеточной системе.
Пример 6. Сравнение B. longum АН106 и В. longum 35624 в доклиническом исследовании на модели респираторной инфекции in vivo.
Авторы изобретения проверили эффективность штамма В. longum AH0106 в доклинических моделях, разработанных для демонстрации терапевтической пользы. Модели риновирусной инфекции у мышей не считаются хорошим суррогатом инфекции у человека, поскольку у мышей отсутствует ICAM, рецептор основной группы риновирусов, обеспечивающий их проникновение в клетку. Поэтому авторы изобретения использовали модель летального гриппа у мышей, описанную Bartlett et al, 2015, которая считается лучшей моделью. Для инфицирования мышей использовали штамм вируса гриппа H1N1 A/PR8/34 (100 PFU (бляшкообразующих единиц)/50 мкл).
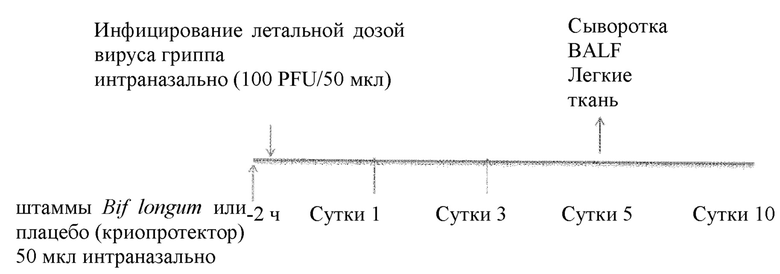
Штамм В. longum АН0106, штамм В. longum 35624 или плацебо вводили интраназально за 2 часа до, через 1 сутки и через 3 суток после инфицирования вирусом. Указанные штаммы вводили в дозе, где общее количество клеток составляло 1 × 109.
2 ч, сутки 1 и 3 введение контроля с растворителем (Группа 1), В. longum AH0106 (Группа 2) и фракции клеточной стенки В. longum 35624 (Группа 3) интраназально (в объеме 50 мкл).
Сутки 0 Введение летальной дозы вируса гриппа (PR8) интраназально (Группы 1-3).
Сутки 0-10 Контроль заболеваемости животных (масса тела, температура и клиническая оценка, Группы 1-3).
Сутки 5: Каждые сутки подвергали эвтаназии 5 животных из каждой группы для терминального взятия крови, забора органов и анализа. Сутки 5 (Группы 1-3).
Сутки 5: Забор BAL для определения цитокинов и клеточных инфильтратов. Забор ткани легких для количественного определения вирусного титра в легких посредством количественной PCR (половина всех долей легких).
Определение вирусного титра в ткани легких.
Выделенные доли легких подготавливали для количественного определения вирусной нагрузки в ткани легких при помощи количественной PCR. РНК получали с применением реагента TRI (Molecular Research Center) и затем обрабатывали ДНКазой (Invitrogen) во избежание контаминации геномной ДНК перед конвертированием РНК в кДНК (комплементарная ДНК) посредством обратной транскрипции с использованием Superscript III (Invitrogen). Количественное определение кДНК проводили при помощи PCR в реальном времени (iCycler; Bio-Rad) с использованием реагента SYBR Green (Stratagene) и нормализовали уровни экспрессии в образцах по GAPDH. Последовательности праймеров (прямого и обратного, соответственно) для белка М вируса гриппа PR8 были следующими: 5'-GGACTGCAGCGTAGACGCTT-3' (SEQ ID No. 4) и 5'CATCCTGTATATGAGGCCCAT-3' (SEQ ID No. 5).
Группы (1-3):
1. Воздействие плацебо - криопротектора, ресуспендированного в PBS.
2. Воздействие В. longum АН0106 109 клеток всего.
3. Воздействие В. longum 35624 109 клеток всего.
Количество мышей на группу (Группы 1-3) равно 5
Определение цитокинов и хемокинов.
Концентрации мышиных IL-Iβ, IL-2, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12p70, IL-12/IL-23p40, IL-13, IL-15, IL-16, IL-17A, IL-17A/F, IL-17C, IL-17E, IL-17F, IL-21, IL-22, IL-23, IL-30, IL-31, IL-33, IP-10, MIP3α, MIP-2, MIP-1β, MIP-1α, MCP-1, KC/GRO, TNF-α, VEGF, EPO, GM-CSF, IFN-γ как в сыворотке, так и в BAL определяли с применением имеющейся в продаже платформы U-PLEX Biomarker Group 1 Mouse 35-Plex (MesoScale Discovery) согласно инструкциям производителя; мышиный IL-28 (IFN-λ 2/3), мышиный G-CSF, мышиный TRAIL, мышиный AREG выявляли с применением наборов для ELISA (RayBiotech, Inc,); онкостатин М и мышиный сурфактантный белок D (SPD) определяли с применением наборов Quantikine компании R&D Systems согласно инструкциям производителя. IFN-α мыши в сыворотке и BAL определяли с применением набора mouse EFN alpha platinum ELISA (ThermoFisher scientific). Уровни интерферона-β (IFN-β) мыши в сыворотке и BAL определяли с применением наборов VeriKine Mouse Interferon Beta HS ELISA (PBL Assay Science).
Измерение клеточных инфильтратов в BAL.
Клетки выделяли из жидкости BAL и определяли общее количество клеток в полученной при бронхоальвеолярном лаваже жидкости (BAL) при помощи счетчика Coulter (IG Instrumenten-Gesellschaft AG, Basel, Switzerland). Дифференциальный подсчет клеток (подсчитывали 200 клеток/образец) проводили на основе стандартных морфологических и цитохимических критериев в цитологических препаратах, полученных путем центрифугирования, окрашенных раствором Diff-Quik (Dade Behring, Siemens Healthcare Diagnostics, Deerfield, IL).
Неожиданно обнаружили, что В. longum АН0106 защищал мышей лучше, чем штамм В. longum 35624. Оба штамма снижали вирусный титр до одинакового уровня (Фиг. 10), однако смертность снижалась больше у мышей, получавших В. longum АН0106 (Фиг. 11). Это улучшенное выживание было ассоциировано с пониженным ответом интерферона альфа и интерферона бета и усиленным ответом сурфактантного белка D (Фиг. 12). Кроме того, наблюдалось мощное индуцирование цитокинов и хемокинов у мышей, получавших АН0106 (Фиг. 13), ассоциированное с повышением макрофагов в BAL на 5 сутки (Фиг. 14). Указанный иммунный ответ способствовал улучшенной элиминации вируса, наблюдавшейся у животных, получавших В. longum АН0106, а начало процесса выздоровления вызывало приток макрофагов в легкие.
Пример 7. Получение осадка клеточной стенки
Сбор бактерий/отмывка
Способ
1. Эквивалент 250 мл исходной биомассы бактерий (общее количество клеток =1,5 × 1011) собирали путем центрифугирования (14000 об/мин, 4°С, 20 мин; ротор JA-20 (Avanti J-26 х Р Beckman Coulter). Бактериальный осадок промывали стерильным PBS, отбрасывали надосадочную жидкость и промывали снова (повторяли еще два раза).
2. В случае живых и неживых лиофилизированных бактерий (0,5 г порошка 3,0 × 1011 или общее количество клеток 1,5 × 1011) ресуспендировали в 50 мл и собирали путем центрифугирования (14000 об/мин, 4°С, 20 мин; ротор JA-20 (Avanti J-26 х Р Beckman Coulter). Бактериальный осадок промывали стерильным PBS, отбрасывали надосадочную жидкость и промывали снова (повторяли еще два раза).
3. В конце осадок ресуспендировали в 50 мл стерильного PBS и делили раствор, содержащий бактерии, на аликвоты по 25 мл.
Разрушение клеток
Задачей данной процедуры было получение фракции клеточной стенки из целых бактерий и удаление цитоплазматической фракции и других компонентов. Это включало одну или более стадий, выбранных из:
обработки хелатирующим агентом, возможно в сочетании с процедурой замораживания - оттаивания для предупреждения ДНКазной или протеазной активности при использовании ферментативной обработки для облегчения лизиса
ферментативной обработки гликозил-гидролазой и/или N-ацетилмурамидазой
прикладывания силы сдвига, такой как воздействие ультразвука или прикладывание высокого давления, например с применением френч-пресса
отделения фракции клеточной стенки от цитоплазматической фракции при помощи центрифугирования
фильтрации фракции клеточной стенки
Материалы:
EDTA (0,5 М Fluka) представляет собой хелатор для удаления ионов металлов (кальция или магния) для предупреждения ДНКазной или протеазной активности при использовании ферментов для лизиса клеточной стенки
Лизоцим (Sigma, 10 мг/мл) *не содержащий эндотоксинов, представляет собой гликозил-гидролазу, катализирующую гидролиз 1, 4-бета-связей между остатками N-ацетилмураминовой кислоты и N-ацетил-D-глюкозамина. Гидролиз нарушает целостность клеточной стенки бактерий, вызывая лизис бактерий.
Мутанолизин (10KU Sigma, разведенный в 1 мл H2O) представляет собой N-ацетилмурамидазу, которая представляет собой муралитический фермент, расщепляющий β-N-ацетилмурамил-(1→4)-N-ацетилглюкозаминную связь клеточной стенки бактерий. Такое расщепление нарушает целостность клеточной стенки бактерий, вызывая лизис бактерий.
Для облегчения лизиса наряду с воздействием ультразвука использовали стеклянные гранулы с размером частиц 90-150 мкм (VWR)
Способ:
1. В каждую 25 мл аликвоту добавить 250 мкл EDTA (0,5М матричный раствор, Fluka), таким образом, конечная концентрация EDTA составляет 5 мМ.
2. Заморозить аликвоты, помещая 2 аликвоты в жидкий азот до замораживания, затем разморозить аликвоты в воде; повторить эту процедуру дважды.
3. Каждую 25-мл аликвоту бактерий инкубируют с 250 мкл лизоцима (10 мг/мл) и 250 мкл мутанолизина (2,5 KU) в течение 1 часа при 37°С, периодически мягко перемешивая на вортексе. С этой стадии силу сдвига применяли для разрушения бактериальной клетки либо при помощи ультразвука, либо при помощи френч-пресса.
Воздействие ультразвука
непосредственно перед воздействием ультразвука к аликвотам бактерий добавляли половину чайной ложки автоклавированных стеклянных гранул с размером частиц 90-150 мкм (VWR).
обрабатывают ультразвуком 25 мл ресуспендированного бактериального материала за один прием, затем помещают на лед и обрабатывают ультразвуком другие аликвоты, с применением ультразвукового дезинтегратора (VibraCell SONICS) с зондом 50 мл. (Настройки: Мощность - 50, Частота - 60). Данную процедуру повторяют четыре раза в течение 10 минут на льду. После воздействия ультразвуком удаляют стеклянные гранулы, неразрушенные клетки и клеточный дебрис при помощи центрифугирования при 1000 об/мин в течение 10 мин при 4°С.
Высокое давление посредством френч-пресса
В альтернативном варианте бактериальные клетки разрушают при помощи давления 1500 фунтов на квадратный дюйм с переключающим клапаном в положении «high» (эквивалент 20000 фунтов на квадратный дюйм) при помощи френч-пресса (Thermo Electron Corporation FA-078A). Данную процедуру повторяют трижды на льду.
Воздействие силы сдвига с применением френч-пресса приводит к просветлению мутной суспензии бактериальных клеток после третьего прогона. После разрушения при помощи френч-пресса удаляют неразрушенные клетки и клеточный дебрис при помощи центрифугирования при 1000 об/мин в течение 10 мин при 4°С и сохраняют надосадочную жидкость, содержащую материал клеточной стенки и цитоплазматические фракции.
4. После воздействия силы сдвига (ультразвук или высокое давление) надосадочную жидкость, содержащую материал клеточной стенки и цитоплазматические фракции, сохраняли. Эту надосадочную жидкость центрифугировали в течение 20 мин при 14000 об/мин при 4°С для отделения материала клеточной стенки от цитоплазматического материала. Надосадочную жидкость отбрасывают.
5. Осадок, содержащий материал клеточной стенки, ресуспендируют в 5 мл PBS на 250 мл исходной бактериальной биомассы. Осадок материала клеточной стенки центрифугировали при 1000 об/мин в течение 10 минут для удаления черного остатка из осадка. Осадок, содержащий материал клеточной стенки, хранили при -80°С.
Центрифуги и роторы
Центрифуга Avanti J-E Beckman Coulter
Роторы: JA-20
Ультразвуковой дезинтегратор
VibraCell SONICS, Sonics and Materials
Зонд 435-09
Френч-пресс
Френч-пресс FA-078A
Ячейка FA-032 (40K стандартная) (стандартное давление френч-пресса 40000 фунтов на квадратный дюйм, ячейка вместимостью 35 мл, давление до 40000 фунтов на квадратный дюйм)
Гель-фильтрация с последующей ультрафильтрацией
Материалы:
мембранные фильтры из поливинилидендифторида (PVDF) (размер пор 0,45 мкм, Millipore, Bedford, MA)
приспособление для ультрафильтрации с MWCO (отсечение по молекулярной массе) 100 кДа (Millipore).
1. Ресуспендированный бактериальный осадок, содержащий материал клеточной стенки (5 мл), размораживают и фильтруют через мембранные фильтры из поливинилидендифторида (PVDF) (размер пор 0,45 мкм, Millipore, Bedford, MA; тщательно промытые PBS перед применением). Материал, проходящий через мембранный фильтр, не содержит интактных бактерий и представляет собой материал клеточной стенки с частицами размером менее 0,45 мкм. На данной стадии при пропускании через фильтр с размером пор 0,45 мкм получали 4 мл материала клеточной стенки. Из исходных 250 мл бактериальной культуры оставалось 4 мл суспендированного материала клеточной стенки.
2. Затем материал клеточной стенки с частицами размером менее 0,45 мкм подвергают ультрафильтрации.
а. Вначале промывают приспособление для ультрафильтрации 15 мл PBS, центрифугируют при 3500 × g при 4°С.
б. Берут экстракты бактериального осадка менее 0,45 мкм, загружают ~4 мл в приспособление для ультрафильтрации с MWCO 100 кДа.
в. Когда объем верхнего раствора (более 100 кДа) уменьшался, проводят диафильтрацию против PBS.
г. Материал, проходящий через фильтр с MWCO 100 кДа, сохраняют и хранят при -80°С.
д. Ретентат ресуспендируют в том же объеме PBS, какой добавляли в приспособление для ультрафильтрации (4 мл). Данный материал обозначают бактериальным осадком более 100 кДа. Итоговая масса полученной таким образом фракции клеточной стенки в сухом состоянии составляет 120 мг в 4 мл ретентата, что соответствует итоговой концентрации 30 мг фракции клеточной стенки на 1 мл.
е. Данную фракцию клеточной стенки концентрировали для улучшения растворимости для исследований in vitro и in vivo. Для получения более концентрированного материала с концентрацией больше 30 мг/мл, такой как 300 мг/мл (10х) или 150 мг/мл (5х) растворы клеточной фракции бактериального осадка более 100 кДа просто растворяют в объеме, который в 10 или в 5 раз меньше, чем объем исходного материала.
Пример 8. Фракция клеточной стенки АН0106 (благоприятно блокирует интерфероны 1 типа и в результате индуцирование IP-10 (провоспалительного хемокина) в дендритных клетках моноцитарного происхождения.
Для определения возможного благоприятного противовирусного эффекта фракции клеточной стенки, В. longum АН0106, полученной в Примере 7, инкубировали фракцию с человеческими MDDC, подвергнутыми воздействию HRV16, и отслеживали ответ интерферона 1 типа и IP-10. Для дендритных клеток, имеющих происхождение от моноцитов: Мононуклеарные клетки периферической крови (РВМС) выделяли у здоровых доноров при помощи центрифугирования в градиенте плотности. Моноциты периферической крови человека выделяли с применением CD14-положительной селекции с использованием системы MACS (Miltenyi Biotec, 130-050-201). Клетки культивировали в среде cRPMI (Life Technologies, 21875-091) с 1000 Ед/мл интерлейкина 4 (Novartis) и 1000 Ед/мл гранулоцитарно-макрофагального колониестимулирующего фактора (PeproTech, 300-03) в течение 6 суток для их дифференцировки в MDDC. Клетки культивировали в среде cRPMI (RPMI (Life Technologies, 21875-091) плюс 10% эмбриональной телячьей сыворотки (Sigma, кат.номер F4135) и 1% пенициллина/стрептомицина (Sigma, кат. номер Р0781).
MDDC стимулировали либо посредством HRV16 (MOI 25:1) в течение 24 ч в cRPMI при 37°С, 5% CO2 после предварительного воздействия (1 ч) фракции клеточной стенки В. longum АН0106 (30 мг/мл), либо только HRV16. Исследовали секрецию цитокинов при помощи мультиплексной суспензионной тест-системы Bio-Plex (Bio-Rad Laboratories) (IFN-α, IFN-β, IP-10).
Клеточная фракция штамма В. longum АН0106 ослабляла ответ IP-10 (Фиг. 16(a)), IFN-α (Фиг. 16(b)) и IFN-β (Фиг. 16(c)) на HRV16, что согласовалось с приведенными выше результатами для MDDC, стимулированных HRV16 после предварительного воздействия В. longum АН0106.
Пример 9. Не все виды бифидобактерий фракции клеточной стенки имеют тот же эффект.
С применением методики, описанной в Примере 4, также исследовали фракции клеточной стенки другого вида бифидобактерий, Bifidobacteria breve (Bif UCC2003), и не обнаружили аналогичных выраженных эффектов. Фракция Bif UCC2003 снижала продукцию IP-10 после вирусной стимуляции в 24-часовом исследовании, но не в такой степени, как фракция клеточной стенки В. longum АН0106 (Фиг. 17(a)).
Кроме того, в воспаленной слизистой секрецию IP-10 индуцирует не только сам вирус; продукцию IP-10 также могут индуцировать другие цитокины. Частью первичного противовирусного ответа организма-хозяина является образование таких цитокинов, как IFN-β. В частности, IFN-β является мощным индуктором IP-10. Таким образом, авторы изобретения изучали влияние фракции клеточной стенки на секрецию IP-10 в ответ на IFN-β (Фиг. 17(b)). MDDC стимулировали либо посредством IFN-β (200 нг/мл) в течение 24 ч в cRPMI при 37°С, 5% CO2 после предварительного воздействия (1 ч) фракций клеточной стенки (30 мг/мл), либо посредством только IFN-β. Фракция осадка клеточной стенки В. longum АН0106 подавляла секрецию IP-10 в ответ на указанные стимулы, тогда как фракция осадка клеточной стенки Bif UCC2003 совсем не снижала секрецию IP-10.
Пример 10. Фракция клеточной стенки штамма В. longum АН0106 имеет дополнительный благоприятный эффект (блокирует TNF-α) в дендритных клетках моноцитарного происхождения, что способствует уменьшению воспаления, но не все штаммы бифидобактерий имеют тот же эффект.
В воспаленной слизистой секрецию провоспалительного TNF-α индуцирует не только сам вирус, его продукцию могут индуцировать и другие лиганды TLR (toll-подобных рецепторов). Поэтому авторы изобретения изучали секрецию TNF-α в ответ на лиганды TLR Poly:IC (TLR-3) и LPS (TLR-4). MDDC предварительно подвергали воздействию клеточной стенки В. longum AH0106, В. longum 35624 и Bif UCC2003 перед воздействием LPS, агониста TLR-4 и отслеживали ответ IP-10 и TNF-α. MDDC активировали либо LPS - агонистом TLR-4, (50 нг/мл), либо Poly:IC - агонистом TLR-3 (5 мкг/мл) в течение 24 ч в cRPMI при 37°С, 5% CO2 после предварительного воздействия (1 ч) фракций клеточной стенки бифидобактерий в дозе 30 мг/мл, либо только агонистом TLR. Изучали секрецию TNF-α при помощи Quantikine ELISA (R&D systems). Фракция клеточной стенки В. longum АН106 ослабляла ответ TNF-α на LPS и Ро1у:IC, тогда как фракции клеточной стенки и В. longum 35624, и Bif UCC2003 в той же дозе повышали TNF-α (Фиг. 18а и 18b), что согласуется с результатами, полученными с целыми клетками штамма В. longum AH0106. Этот результат является очень неожиданным, поскольку В. longum 35624 является хорошо известным противовоспалительным штаммом, а В. longum AH0106 обеспечивал лучший ответ в данной системе.
Обсуждение
В заключение, как показано в Примерах 2-10, авторы изобретения продемонстрировали усиленный ответ интерферона III типа, что является благоприятным, и добавление фракции клеточной стенки AH0106 вызывает указанный желаемый ответ. В клетках, которые являются компонентом более позднего ответа иммунной системы человека (дендритных клетках) фракция клеточной стенки блокирует избыточный ответ интерферона 1 типа, который может приводить к повреждению клеток и вторичной инфекции. Такой направленный эффект благоприятен при инфекциях, вызванных вирусом гриппа, обычной простуде (риновирус) и RSV, вирусных осложнениях хронических респираторных заболеваний, таких как астма, COPD и ARDS, как у детей, так и у взрослых, а также у лиц с ожирением.
Каскадный ответ
Каскад аномального ответа на вирусную инфекцию проиллюстрирован на Фиг. 19(a).
Каскад ответа на вирусную инфекцию, опосредованный фракцией клеточной стенки АН0106, проиллюстрирован на Фиг. 19(b).
Основной противовирусный ответ контролируется IFN (интерферонами). Наиболее хорошо охарактеризованными интерферонами I типа являются IFN-α и IFN-β. Большинство типов клеток продуцируют IFN-β, тогда как гемопоэтические клетки, в частности плазмацитоидные дендритные клетки, являются основными производителями IFN-α (Ivashkiv and Donlin 2014). Как упоминалось ранее, ответы интерферонов I типа, таких как IFN-α и IFN-β, прямо коррелируют с увеличением заболеваемости и смертности на моделях с инфицированием вирусом гриппа (Davidson et al, 2014). Интерфероны 1 типа могут стимулировать продукцию IP-10 (также обозначаемого CXCL-10), хемокина который связывается с CXCR3, основной функцией является функция хемоаттрактанта Th1 клеток. Интерфероны лямбда (IFN1s, IFN III типа или IL-28 и IL-29) образуют более новый класс интерферонов, которые обладают гомологией, общими паттернами экспрессии и противовирусными функциями с интерферонами I типа (Lazear et al., 2015b; Wack et al., 2015). Они индуцируют нисходящий сигнальный путь, контролирующий экспрессию ISG и индуцирование противовирусных ответов, который удивительным образом схож с таковым у IFN I типа (Durbin et al, 2013; Mendoza et al, 2017). При этом интерфероны III типа играют важную роль в ограничении провоспалительных ответов или иммунопатологии.
IP-10 повышается в легких при инфекции вирусом гриппа (Ichikawa et al, 2013). Действительно, блокирование IP-10 с использованием моноклональных антител облегчает повреждение легких, индуцированное вирусом (Wang et al, 2013). IP-10 повышается в легких пациентов с ARDS, и показано, что он является важным фактором в патологии ARDS (Ichikawa et al, 2013).
SP-D играет важную роль во врожденной защите против гриппа, связываясь с богатыми маннозой гликанами на гликопротеинах HA/NA вируса (Hartshorn et al, 1997; Reading et al, 1997; Hartshorn et al, 2000). SP-D опосредует ряд противовирусных активностей in vitro, включая нейтрализацию инфективности вируса и подавление ферментативной активности вирусной NA, а мыши с дефицитом SP-D были больше подвержены инфекции вирусами гриппа с высоким уровнем гликозилирования. (Hartshorn et al, 1997; Reading et al, 1997; Tecle et al, 2007; LeVine et al, 2001; Vigerust et al, 2007; Hawgood et al, 2004). SP-D усиливает фагоцитоз и легочный клиренс RSV (LeVine et al, 2004).
Вторичные бактериальные инфекции являются основной проблемой, сопровождающей вирусную инфекцию. Вирусная и бактериальная ко-инфекция широко известна для вируса гриппа, риновируса и RSV. Основные бактериальные инфекции респираторного тракта включают Streptococcus pneumoniae, Moraxella catarrhalis и Haemophilus influenzae, однако было показано, что и Staphylococcus aureus также вызывает серьезные послевирусные инфекции (Hewitt et al, 2016). Вторичные бактериальные инфекции чаще всего возникают через 5-10 суток после первичных вирусных инфекций, что предполагает, что транзиторная иммуносуппрессия (первичный ответ) может быть ответственной за рост бактерий. Предложенный механизм синергии между вирусом гриппа и S. pneumoniae предполагает, что противовирусный ответ интерферона 1 типа (IFN-α/β), вызванный первичной инфекцией вируса гриппа, усиливает подверженность организма-хозяина вторичному бактериальному заражению за счет подавления антибактериального иммунитета (Nakamura et al, 2011; Shahangian et al, 2009; Li et al, 2012). Напротив, интерфероны III типа, такие как IFN-λ, способны ограничивать репликацию вируса, не подавляя элиминацию вторичных бактериальных инфекций, что имеет место после индуцирования IFN-α/β. Показано, что влияние ослабления передачи сигнала IFN-λ при помощи белка IFNLR1 Fc непосредственно перед бактериальным значительно заражением повышало бактериальную нагрузку в легких у животных по сравнению с контролем (Rich et al, 2017). Кроме того, дефицит SP-D был ассоциирован с усиленной колонизацией и инфекцией S. pneumoniae верхних и нижних дыхательных путей и более ранним началом и более длительной персистенцией бактериемии. Показано, что SP-D связывается и агглютинирует со Streptococcus pneumoniae in vitro (вторичный бактериальный инфицирующий агент, который представляет основную проблему при вторичных осложнениях у пациентов с астмой и COPD) (Jounblat et al, 2005).
Различные состояния, на которых резко отражается разрегулированный или аберрантный иммунный ответ на вирусную инфекцию, можно обобщить следующим образом: острый респираторный дистресс-синдром (ARDS), астма, включая астму детей, COPD, ожирение.
В мире острым респираторным дистресс-синдромом (ARDS) страдает большое количество людей, и он ассоциирован с очень высокой смертностью (30-50%). Респираторные вирусные инфекции (например, грипп) ассоциированы с ARDS.
Астма является хроническим воспалительным заболеванием дыхательных путей, обычно ассоциированным с гиперреактивностью и обструкцией дыхательных путей различной степени, которая часто разрешается спонтанно или в ходе лечения (WHO (Всемирная Организация Здравоохранения), 2007). Приблизительно от 80 до 85% осложнений астмы у детей, подростков и реже взрослых ассоциированы с вирусными инфекциями верхних отделов дыхательной системы, а на долю риновируса (RV) приходится ~60-70% таких вирус-ассоциированных осложнений. Вирусные инфекции тесно связаны с обструктивными заболеваниями у детей всех возрастов. RSV является основным агентом, вызывающим бронхиолит или круп, тогда как риновирус (RV) впоследствии чаще всего обнаруживается у детей со стерторозным дыханием. Тяжелое респираторное заболевание, вызванное любым из указанных вирусов, ассоцировано с последующим развитием астмы, и риск наиболее высок у маленьких детей со стерторозным дыханием с RV инфекциями (Jartti and Gern, 2017).
Ожирение ассоциировано с разрегулированным иммунным и воспалительным ответами. Влияние ожирения на возникновение астмы более выражено у женщин и у лиц, не страдающих алергией, при этом существует дозозависимое влияние увеличения индекса массы тела (BMI) на заболеваемость астмой. Становится все более очевидным, что ожирение ассоциировано с уникальным фенотипом астмы, который отличается более тяжелым заболеванием с вариабельным ответом на стандартную терапию астмы. Кроме того, во время пандемии гриппа A (H1N1) в 2009 обнаружили, что ожирение является фактором риска тяжелого гриппа, а у лиц с ожирением нарушена противовирусная защита от респираторных вирусов (Almond et al, 2013). Существуют данные, что такой неблагоприятный ответ обусловлен не самим вирусом, а природой иммунного ответа на RV (Steinke et al, 2016).
COPD является третьей ведущей причиной смертности в США. Фактически, COPD является единственной основной причиной смертности, доля которой повышается, и ожидается, что к 2030 году она будет третьей ведущей причиной смертности в развитых странах (уступая только заболеваниям сердца и инсульту). Она является следствием воспалительного повреждения дыхательных путей, вызывающего хронический бронхит и/или эмфизему. У пациентов с COPD осложнения может вызывать более широкий спектр вирусов, но и в данном случае полагают, что к ухудшению симптомов приводит не вирус, а иммунный ответ на вирус (Zhou et al, 2015).
Следует принимать во внимание, что штамм по изобретению можно вводить животным (включая человека) в пероральной принимаемой внутрь форме в стандартных лекарственных формах, таких как капсулы, микрокапсулы, таблетки, гранулы, порошки, троше, пилюли, суппозитории, суспензии и сиропы. Подходящие композиции можно получать обычно применяемыми способами с применением стандартных органических и неорганических вспомогательных веществ. Количество действующего вещества в медицинской композиции может находиться на уровне, который будет оказывать желаемый терапевтический эффект.
Композиция может также включать бактериальный компонент, лекарственное средство и/или биологическое соединение.
Кроме того, вакцина, содержащая штаммы по изобретению, может быть получена любым подходящим известным способом и может включать фармацевтически приемлемый носитель или адъювант.
Иммунная система человека играет важную роль в этиологии и патогенезе широкого спектра заболеваний человека. Гипер- и гипореактивность иммунной системы вызывает большинство патологических состояний или является их компонентом. Одна группа биологических соединений, под названием цитокины, является особенно важной для контролирования иммунных процессов. Нарушения этой хрупкой сети цитокинов все чаще ассоциируются со многими заболеваниями. Эти заболевания включают воспалительные расстройства, иммунодефицит, воспалительное заболевание кишечника, синдром раздраженного кишечника, рак (в частности, желудочно-кишечного тракта и иммунной системы), диарею, диарею, ассоциированную с антибиотиками, педиатрическую диарею, аппендицит, аутоиммунные расстройства, рассеянный склероз, болезнь Альцгеймера, ревматоидный артрит, целиакию, сахарный диабет, трансплантацию органов, бактериальные инфекции, вирусные инфекции, грибковые инфекции, заболевания периодонта, урогентиальное заболевание, заболевание, передающееся половым путем, HIV (вирус иммунодефицита человека) инфекцию, репликацию HIV, диарею, ассоциированную с HIV, травму, ассоциированную с операцией, метастатическое заболевание, индуцированное хирургическим вмешательством, сепсис, потерю веса, анорексию, контроль лихорадки, кахексию, заживление ран, язвы, барьерную функцию кишечника, аллергию, астму, респираторные расстройства, расстройства кровообращения, коронарную болезнь сердца, анемию, расстройства системы свертывания крови, заболевание почек, расстройства центральной нервной системы, заболевания печени, ишемию, расстройства питания, остеопороз, эндокринные расстройства, эпидермальные расстройства, псориаз и обыкновенные угри, но не ограничиваются перечисленными. Влияние на продуцирование цитокинов является специфическим для изученного пробиотического штамма. Так, можно отобрать конкретные пробиотические штаммы для нормализации уникального дисбаланса цитокинов, характерного для определенного типа заболевания. Подбор специфического для заболевания лечения можно осуществлять с использованием либо единственного штамма AN 1206, либо его мутантов или вариантов, либо набора этих штаммов.
Энтеральная флора важна для развития и надлежащего функционирования иммунной системы кишечника. Как показано в моделях на лишенных бактериальной флоры животных, в отсутствие энтеральной флоры иммунная система кишечника оказывается недостаточно развитой, а некоторые ее функциональные параметры сниженными, такие как фагоцитарная способность макрофагов и продукция иммуноглобулинов. Важность кишечной флоры в стимуляции неповреждающих иммунных ответов становится все более очевидной. Увеличение распространенности и тяжести аллергий в западных странах связывают с усилением гигиены и дезинфекции и параллельным снижением числа и спектра инфекционных агентов, с которыми встречается организм-хозяин. Такое отсутствие стимуляции иммунитета может позволить организму-хозяину реагировать на непатогенные, но являющиеся антигенами агенты, в результате чего развивается аллергия или аутоиммунитет. Намеренное употребление ряда непатогенных иммуномодулирующих бактерий обеспечит организм-хозяин необходимыми и надлежащими обучающими стимулами для правильного развития и контроля иммунной функции.
Термин воспаление используют для описания местной аккумуляции жидкости, белков плазмы и белых кровяных клеток в участке, где происходит длительное физическое повреждение, инфекция или где имеет место продолжающийся иммунный ответ. Контроль воспалительного ответа осуществляется на нескольких уровнях. Контролирующие факторы включают цитокины, гормоны (например, гидрокортизон), простагландины, реакционноспособные промежуточные соединения и лейкотриены. Цитокины представляют собой биологически активные белки с низкой молекулярной массой, задействованные в возникновении и регулировании иммунологического и воспалительного ответов, также регулирующие развитие, репарацию ткани и гемопоэз. Они обеспечивают средство коммуникации между самими лейкоцитами, а также клетками других типов. Большинство цитокинов являются плейотропными и проявляют множество биологически перекрывающихся активностей. Скорее, воспалительный ответ регулируют каскады и сети цитокинов, а не действие конкретного цитокина на конкретный тип клеток. Затухание воспалительного ответа приводит к понижению концентрации соответствующих активирующих сигналов и других воспалительных медиаторов, что приводит к прекращению воспалительного ответа. TNFα является ключевым провоспалительным цитокином, поскольку он запускает каскад цитокинов и биологических эффектов, что приводит к воспалительному состоянию. Таким образом, в настоящее время для лечения воспалительных заболеваний используются агенты, ингибирующие TNFα, например инфликсимаб.
Полагают, что провоспалительные цитокины играют главную роль в патогенезе многих воспалительных заболеваний, включая воспалительное заболевание кишечника (IBD). Существующие терапевтические средства для лечения IBD нацелены на снижение уровней этих провоспалительных цитокинов, включая IL-8 и TNFα. Такие терапевтические средства могут также играть важную роль в лечении системных воспалительных заболеваний, таких как ревматоидный артрит.
Штамм по данному изобретению может найти потенциальное применение в лечении ряда воспалительных заболеваний, особенно при применении в комбинации с другими противовоспалительными терапевтическими средствами, такими как нестероидные противовоспалительные средства (NSAID) или инфликсимаб.
Продуцирование многофункциональных цитокинов при различных типах опухолей позволяет предположить существование существенных воспалительных ответов у пациентов с опухолями. В настоящее время неясно, каким защитным эффектом против роста и развития опухолевых клеток in vivo обладает такой ответ. Однако указанные воспалительные ответы могут негативно влиять на организм хозяина-носителя опухоли. В регуляции продукции цитокинов и пролиферации клеток внутри опухоли и в нормальных тканях задействованы сложные взаимодействия цитокинов. Длительное время считалось, что потеря массы (кахексия) является единственной наиболее распространенной причиной смерти у пациентов с раком, и исходное истощение указывает на плохой прогноз. Для роста и распространения опухоли ей необходимо индуцировать формирование новых кровеносных сосудов и разрушать внеклеточный матрикс. Воспалительный ответ может играть важную роль в вышеуказанных механизмах, таким образом, способствуя ухудшению здоровья хозяина и прогрессированию опухоли. Благодаря противовоспалительным свойствам Bifidobacterium longum эти штаммы бактерий могут снижать скорость злокачественной трансформации клеток. Кроме того, кишечные бактерии могут продуцировать из поступающих с пищей соединений вещества с генотоксичной, канцерогенной и опухолестимулирующей активностью, и бактерии кишечника могут приводить к активации проканцерогенов в вещества, реагирующие с ДНК. Как правило, активность метаболизирующих ксенобиотики ферментов у видов Bifidobacterium низкая по сравнению с другими популяциями, обитающими в кишечнике, такими как бактероиды, эубактерии и клостридии. Таким образом, увеличение в кишечнике числа бактерий Bifidobacterium может благоприятно изменять уровни этих ферментов.
Большинство патогенных организмов поступают через поверхность слизистой. Эффективная вакцинация этих участков защищает от инвазии конкретных инфекционных агентов. До настоящего времени стратегии пероральной вакцинации были сфокусированы на применении ослабленных живых патогенных организмов или очищенных инкапсулированных антигенов. Пробиотические бактерии, конструированные для продуцирования антигенов инфекционного агента in vivo, могут стать привлекательной альтернативой, поскольку эти бактерии считаются безопасными для потребления человеком (статус GRAS).
Исследования на мышах показали, что потребление пробиотических бактерий, экспрессирующих чужеродные антигены, может вызывать защитные иммунные ответы. Ген, кодирующий фрагмент С столбнячного токсина (TTFC), экспрессировали в Lactococcus lactis и иммунизировали мышей пероральным способом. Данная система позволяла индуцировать достаточно высокий титр антител для защиты мышей от летального введения токсина. Помимо презентирования антигена, векторы на основе живых бактерий могут продуцировать in vivo биологически активные соединения, такие как иммуностимулирующие цитокины. L. lactis, секретирующие биологически активные IL-2 или IL-6 человека и TTFC, индуцировали в 10-15 раз более высокие титры IgG в сыворотке мышей при интраназальной иммунизации. Однако совместная экспрессия данных цитокинов в этом конкретном бактериальном штамме не повышала уровень общего IgA. Изучали также пригодность других бактериальных штаммов в качестве вакцин для нанесения на слизистые оболочки, таких как Streptococcus gordonii. Рекомбинантный S. gordonii, колонизирующий полость рта и влагалища мышей, индуцировал как антительный ответ слизистой, так и системный антительный ответ на антигены, экспрессируемые указанными бактериями. Таким образом, пероральная иммунизация с применением пробиотических бактерий в качестве векторов будет не только защищать организм хозяина от инфекции, но и может замещать иммунные стимулы, обычно вызываемые патогеном, таким образом, способствуя обучению иммунной системы хозяина.
Пребиотики
Введение пробиотических организмов осуществляют путем приема внутрь микроорганизма в подходящем носителе. Было бы предпочтительно обеспечивать среду, которая будет способствовать росту таких пробиотических штаммов в толстой кишке. Добавление одного или более чем одного из: олигосахаридов, полисахаридов или других пребиотиков усиливает рост молочнокислых бактерий в желудочно-кишечном тракте. Пребиотиками обозначают любые неживые компоненты пищи, которые специфически ферментируются в кишечнике резидентными бактериями, которые считаются полезными, например, бифидобактериями, лактобациллами. Типы пребиотиков могут включать такие, которые содержат фруктозу, ксилозу, сою, галактозу, глюкозу и маннозу. Комбинированное введение пробиотического штамма с одним или более чем одним пребиотическим соединением может усиливать рост вводимого пробиотика in vivo, в результате принося большую пользу здоровью, и обозначается синбиотическим.
Другие активные ингредиенты
Следует принимать во внимание, что пробиотические штаммы можно вводить профилактически или в качестве способа лечения, либо в отдельности, либо с другими пробиотическими и/или пребиотическими материалами, как описано выше. Кроме того, бактерии можно использовать как компонент профилактического или терапевтического режима, с использованием других активных материалов, таких как применяемые для лечения воспаления или других расстройств, особенно расстройств с иммунологическим компонентом. Такие комбинации можно вводить в составе единой композиции или в виде отдельных композиций, которые вводят в одно и то же или в разное время, с применением одного и того же или различных путей введения.
Фармацевтические композиции
Фармацевтическая композиция представляет собой композицию, которая содержит или состоит из терапевтически эффективного количества фармацевтически активного вещества. Она предпочтительно включает фармацевтически приемлемый носитель, разбавитель или эксципиенты (включая их комбинации). Приемлемые носители или разбавители для терапевтического применения хорошо известны в области фармакологии и описаны, например, в Remington's Pharmaceutical Sciences. Выбор фармацевтического носителя, эксципиента или разбавителя может зависеть от предполагаемого способа введения и стандартной фармацевтической практики. Фармацевтические композиции могут содержать в качестве носителя, эксципиента или разбавителя или в дополнение к ним любое(ые) подходящее(ие) связывающее(ие) вещество(а), смазывающее(ие) вещество(а), суспендирующий(ие) агент(ы), покрывающий(ие) агент(ы), солюбилизирующий(ие) агент(ы), пропеллент(ы).
Примеры фармацевтически приемлемых носителей включают, например, воду, солевые растворы, спирт, силикон, воска, вазелиновое масло, растительные масла, полиэтиленгликоли, пропиленгликоль, липосомы, сахара, желатин, лактозу, амилозу, стеарат магния, тальк, поверхностно-активные вещества, кремниевую кислоту, вязкий парафин, парфюмерное масло, моноглицериды и диглицериды жирных кислот, петролейноэфирные (petroethral) сложные эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Где это необходимо, фармацевтические композиции можно вводить посредством одного или более чем одного из: ингаляции, в форме суппозитория или пессария, местно в форме лосьона, раствора, крема, мази или присыпки, с применением кожного пластыря, перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах или овулах, либо в отдельности, либо в смеси с эксципиентами, или в форме эликиров, растворов или суспензий, содержащих корригент или краситель, или их можно вводить путем парентеральной инъекции, например, внутрикавернозной, внутривенной, внутримышечной или подкожной. Для парентерального введения композиции лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например достаточно солей или моносахаридов для обеспечения раствору изотоничности с кровью. Для трансбуккального или подъязычного введения композиции можно вводить в форме таблеток или пастилок, которые могут быть приготовлены стандартным способом.
Интраназальное введение можно осуществлять с применением назального спрея, раствора для промывания носа или непосредственного введения в нос.
Введение в легкие можно осуществлять в форме сухого порошка, ингаляцию которого осуществляют с применением ингалятора. В некоторых случаях композиция находится в форме аэрозоля. Аэрозоль может быть в форме раствора, суспензии, спрея, взвеси, пара, капель, частиц или сухого порошка, например с применением дозирующего ингалятора, содержащего HFA (гидрофторалкановый) пропеллент, дозирующего ингалятора, не содержащего HFA пропеллент, небулайзера, банки под давлением или распылителя непрерывного действия.
Композиция может быть разработана для инкапсулирования, удаления и/или инактивации вируса. В качестве альтернативы или дополнительно композиция может препятствовать дальнейшему инфицированию вирусом респираторного тракта.
Для облегчения доставки и удержания в респираторном тракте, например, в полости носа, композиция может иметь желаемую вязкость от 1 сантипуаз до 2000 сантипуаз, например, от 5 спз до 500 спз или от 5 спз до 300 спз. Для достижения желаемой вязкости можно использовать любое подходящее модифицирующее вязкость вещество. Такими веществами могут быть подходящие полимерные материалы естественного или синтетического происхождения, такие как гидроксипропилметилцеллюлоза.
В зависимости от различных систем доставки требования к композициям/составам могут быть различными. Например, фармацевтическая композиция по настоящему изобретению может быть изготовлена для доставки с применением мини-помпы или через слизистую, например в форме назального спрея или аэрозоля для ингаляции или раствора для приема внутрь, или парентерального введения, когда композицию изготавливают в инъекционной форме, для доставки, например, внутривенным, внутримышечным или подкожным способом. В альтернативном варианте композиция может быть разработана для доставки обоими способами.
Изобретение не ограничивается описанными выше воплощениями, детали которых могут варьировать.
Список литературы
Bouhnik, Y., Survie et effets chez l'homme des bacteries ingerees dans les laits fermentes. Lait 1993, 73; 241-247.
Yang JW., Fan LC, Miao XY., Мао В., Li MH., Lu HW., Liang S., Xu JF. Corticosteroids for the treatment of human infection with influenza virus: a systematic review and meta-analysis. Clin Microbiol Infect. 2015 Oct; 21(10):956-63.
Davidson S., Crotta S., McCabe TM., Wack A. Pathogenic potential of interferon αβ in acute influenza infection. Nat Commun. 2014 May 21; 5:3864.
Nakamura S., Davis KM., Weiser JN. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. J Clin Invest 2011; 121:3657-65.
Shahangian A., Chow EK., Tian X. et al. Type I IFNs mediate development of postinfluenza bacterial pneumonia in mice. J Clin Invest 2009; 119:1910-20.
Li W., Moltedo В., Moran TM. Type I interferon induction during influenza virus infection increases susceptibility to secondary Streptococcus pneumoniae infection by negative regulation of gammadelta T cells. J Virol 2012; 86:12304-12.
Hewitt R., Fame H., Ritchie A., Luke E., Johnston SL., Mallia P. The role of viral infections in exacerbations of chronic obstructive pulmonary disease and asthma. Ther Adv RespirDis. 2016 Apr; 10(2): 158-74. doi: 10.1177/1753465815618113.
Galani EE., Triantafyllia V., Eleminiadou EE., Koltsida O., Stavropoulos A., Manioudaki M., Thanos D., Doyle SE., Kotenko SV., Thanopoulou K., Andreakos E. Interferon-λ Mediates Non-redundant Front-Line Antiviral Protection against Influenza Virus Infection without Compromising Host Fitness. Immunity. 2017 May 16; 46(5):875-890.
Davidson S., McCabe TM., Crotta S., Gad HH., Hessel EM., Beinke S., Hartmann R., Wack A. IFN-λ is a potent anti-influenza therapeutic without the inflammatory side effects of IFN-a treatment. EMBO Mol Med. 2016 Sep 1; 8(9): 1099- 112.
Thiel, S., and Reid K. 1989 -Structures and functions associated with the group of mammalian lectins containing collagen-like sequences. FEBS Lett. 250:78.2.
Sastry, K., and Ezekowitz R.A. 1993. CoUectins: pattern recognition molecules involved in first line host defense. Curr. Opin. Immunol. 5:59.
Shi X., Zhou W., Huang H., Zhu H., Zhou P., Zhu H., Ju D. Inhibition of the inflammatory cytokine tumor necrosis factor-alpha with etanercept provides protection against lethal H1N1 influenza infection in mice. Crit. Care, 2013; 17(6); R301.
Bartlett NW1., Singanayagam A., Johnston SL. Mouse models of rhinovirus infection and airways disease. Methods Mol Biol. 2015; 1221: 181-8. doi: 10.1007/978-1-4939-1571-2_14.
Ivashkiv LB., and Donlin LT. Regulation of type I interferon responses. Nat Rev Immunol. 2014 Jan; 14(1): 36-49.
Lazear HM., Nice TJ., Diamond MS. Interferon-λ: Immune Functions at Barrier Surfaces and Beyond. Immunity, 2015 Jul 21; 43(1): 15-28.
Wack A., Terczynska-Fyla E., Hartmann R. Guarding the frontiers: the biology of the type III interferons. Nat Immunol. 2015 Aug; 16(8): 802-9.
Durbin RK., Kotenko SV., Durbin JE. Interferon induction and function at the muscol surface. Immunol Rev. 2013 Sep; 255(l): 25-39.
Mendoza JL., Schneider WM, Hoffmann HH., Vercauteren K., Jude KM., Xiong A., Moraga I., Horton TM., Glenn JS., de Jong YP., Rice СМ., Garcia KC. The IFN∧-IFN∧R1-IL-10RP Complex Reveals Structural Features Underlying Type III IFN Functional Plasticity. Immunity. 2017 Mar 21; 46(3): 379-392.
Ichikawa A., Kuba K., Morita M., Chida S., Tezuka H., Hara H., Sasaki Т., Ohteki Т., Ranieri VM., dos Santos CC, Kawaoka Y., Akira S., Luster AD., Lu В., Penninger JM., Uhlig S., Slutsky AS., Imai Y. CXCL10-CXCR3 enhances the development of neutrophil-mediated fulminant lung injury of viral and nonviral origin. Am J Respir Crit Care Med. 2013 Jan 1; 187(1):65-77.
Wei Wang., Penghui Yang., et al. Monoclonal antibody against CXCL-lO/JP-10 ameliorates influenza A (H1N1) virus induced acute lung injury. Cell Research (2013) 23:577-580.
Hartshorn KL., White MR., Shepherd V., Reid K., Jensenius JC, Crouch EC. Mechanisms of anti-influenza activity of surfactant proteins A and D: comparison with serum collectins. Am J Physiol 1997; 273: L1156-L1166.
Reading PC, Morey LS., Crouch EC, Anders EM. Collectin-mediated antiviral host defense of the lung: evidence from influenza virus infection of mice. J Virol 1997; 71: 8204-8212.
Hartshorn KL., White MR., Voelker DR., Coburn J., Zaner K., Crouch EC. Mechanism of binding of surfactant protein D to influenza A viruses: importance of binding to haemagglutinin to antiviral activity. Biochem J 2000; 351 (Pt 2): 449-458.
Tecle Т., White MR., Crouch EC, Hartshorn KL. Inhibition of influenza viral neuraminidase activity by collectins. Arch Virol 2007; 152: 1731-1742.
LeVine AM., Whitsett JA., Hartshorn KL., Crouch EC, Korfhagen TR. SP- D enhances clearance of influenza A virus from the lung in in vivo mouse models. J Immunol 2001; 167:5868-5873.
Vigerust DJ., Ulett KB., Boyd KL., Madsen J., Hawgood S., McCullers JA. N-linked glycosylation attenuates H3N2 influenza viruses. J Virol 2007; 81:8593-8600.
Hawgood S., Brown C, Edmondson J., Stumbaugh A., Allen L., Goerke J. et al. Pulmonary collectins modulate strain- specific influenza a virus infection and host responses. J Virol 2004; 78: 8565-8572.
LeVine AM(1)., Elliott J., Whitsett JA., Srikiatkhachorn A., Crouch E., DeSilva N., Korfhagen T. Surfactant protein-d enhances phagocytosis and pulmonary clearance of respiratory syncytial virus. Am J Respir Cell Mol Biol. 2004 Aug; 31(2): 193-9.
Rich H., Robinson KE., McHugh KJ., Clay ME., Alcorn JF. The role of interferon lambda during influenza, Staphylococcus aureus super-infection. J Immunol May 1, 2017, 198 (1 Supplement) 77.16.
Jounblat R., Clark H., Eggleton P., Hawgood S., Andrew PW., Kadioglu A. The role of surfactant protein D in the colonisation of the respiratory tract and onset of bacteraemia during pneumococcal pneumonia Respir Res. 2005 Oct 28; 6: 126.
World Health Organisation 2007. Global surveillance, prevention and control of chronic respiratory diseases, a comprehensive approach. (Editors Jean Bousquet and Nikolai Khaltaev).
Jartti Т., Gern JE. Role of viral infections in the development and exacerbation of asthma in children. J Allergy Clin Immunol. 2017 Oct; 140(4): 895-906.
Almond MH1., Edwards MR., Barclay WS., Johnston SL. Obesity and susceptibility to severe outcomes following respiratory viral infection. Thorax. 2013 Jul; 68(7): 684-6. doi: 10.1136/thoraxjnl-2012-203009.
Steinke JW., Borish L. Immune Responses in Rhinovirus-Induced Asthma Exacerbations. Curr Allergy Asthma Rep. 2016 Nov; 16(11): 78.
Zhou X., Li Q., Zhou X. Exacerbation of Chronic Obstructive Pulmonary Disease. Cell Biochem Biophys. 2015 Nov; 73(2): 349-55.
--->
SEQUENCE LISTING
<110> Alimentary Health Limited
<120> Bifidobacterium longum
<130> ALIM70/C/WO
<150> EP17158564.9
<151> 2017-02-28
<150> EP17158567.2
<151> 2017-02-28
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> DNA
<213> Bifidobacterium longum
<400> 1
ctggtgccaa ggcatcca 18
<210> 2
<211> 19
<212> DNA
<213> Bifidobacterium longum
<400> 2
gctggatcac ctcctttct 19
<210> 3
<211> 498
<212> DNA
<213> Bifidobacterium longum
<400> 3
ttgctgggat cacctccttt ttacggagaa ttcagtcgga tgttcgtccg acggtgtgcg 60
ccccgcgcgt cgcatggtgc gatggcggcg gggttgctgg tgtggaaaac gtcgttggct 120
ttgccctgcc ggtcgtgcgg tgggtgcggg gtggtatgga tgcgcttttg ggctcccgga 180
tcgccacccc aggctttttg cctggcgcga ttcgatgccc gtcgtgcctg ggggccggcc 240
gtgtgccggc gcgatggcgt ggcggtgcgt ggtggcttga gaactggata gtggacgcga 300
gcaaaacaag ggtttttgaa tctttgtttt gctgttgatt tcgaatcgaa ctctattgtt 360
cgtttcgatc gttttgtgat catttttagt gtgatgattt gtcgtcctgg gaatttgcta 420
gaggaatact tgcgggccat gcactttcgt ggtgtgtgtt gcttgcaagg gcgtatggtg 480
gaggccttgg caccagaa 498
<210> 4
<211> 20
<212> DNA
<213> Bifidobacterium longum
<400> 4
ggactgcagc gtagacgctt 20
<210> 5
<211> 21
<212> DNA
<213> Bifidobacterium longum
<400> 5
catcctgtat atgaggccca t 21
<---
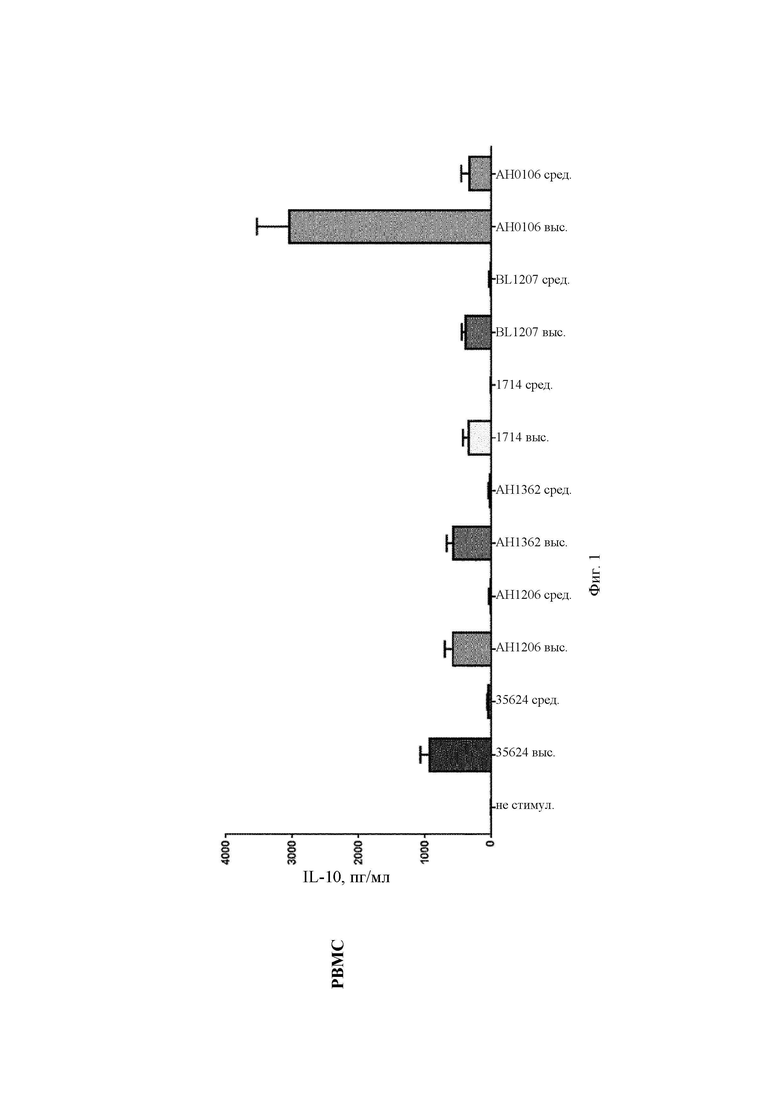
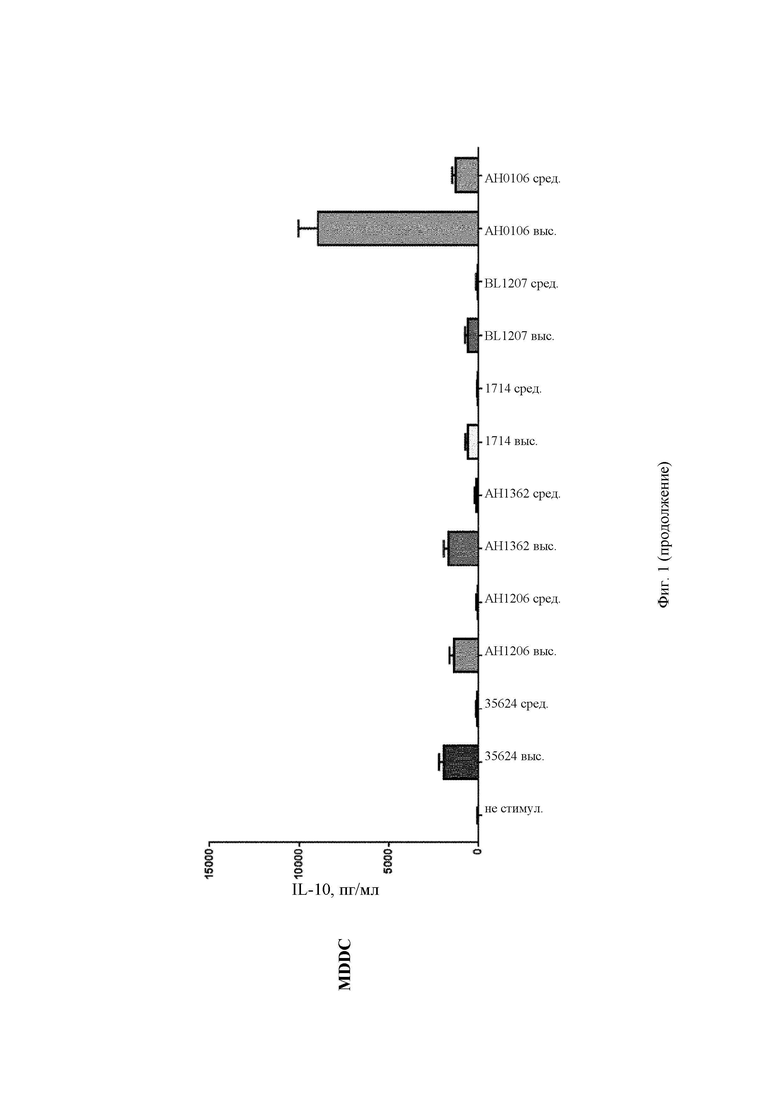
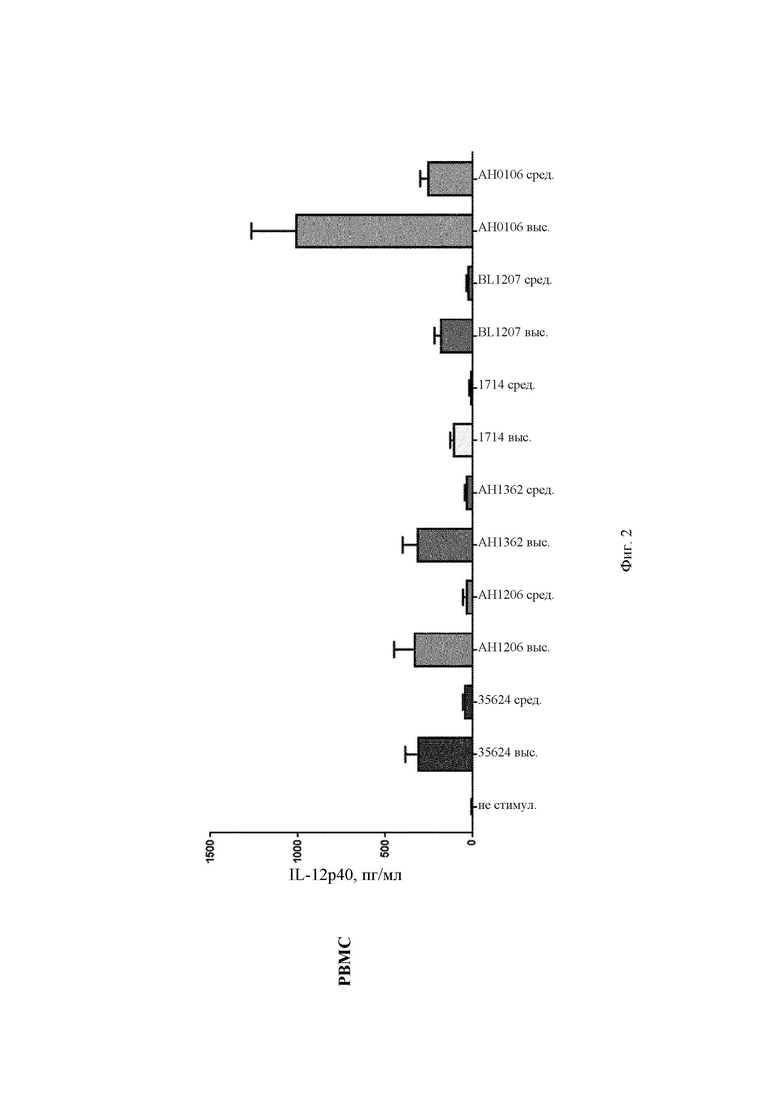
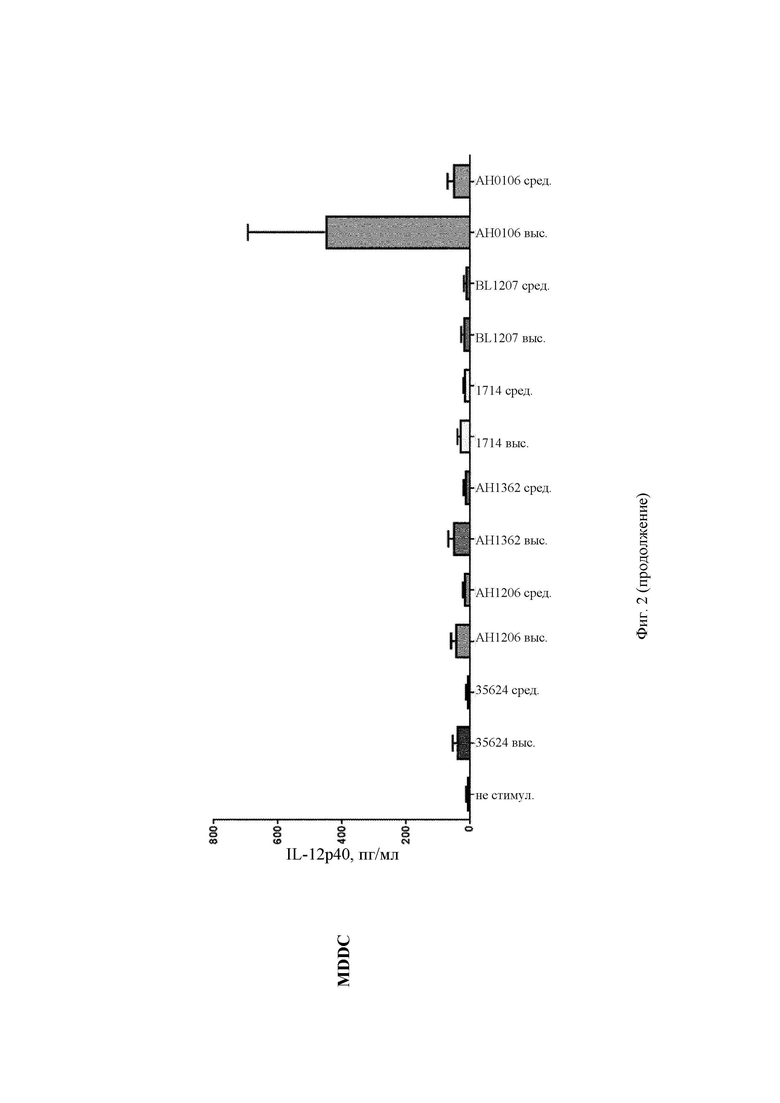
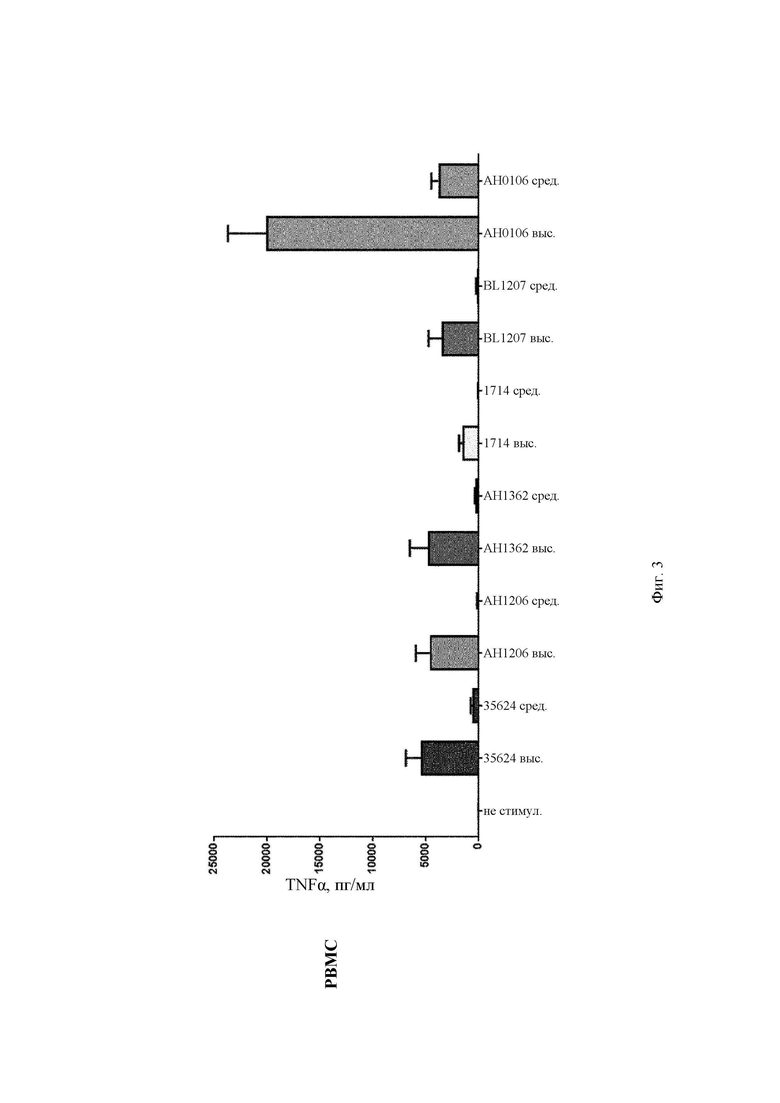
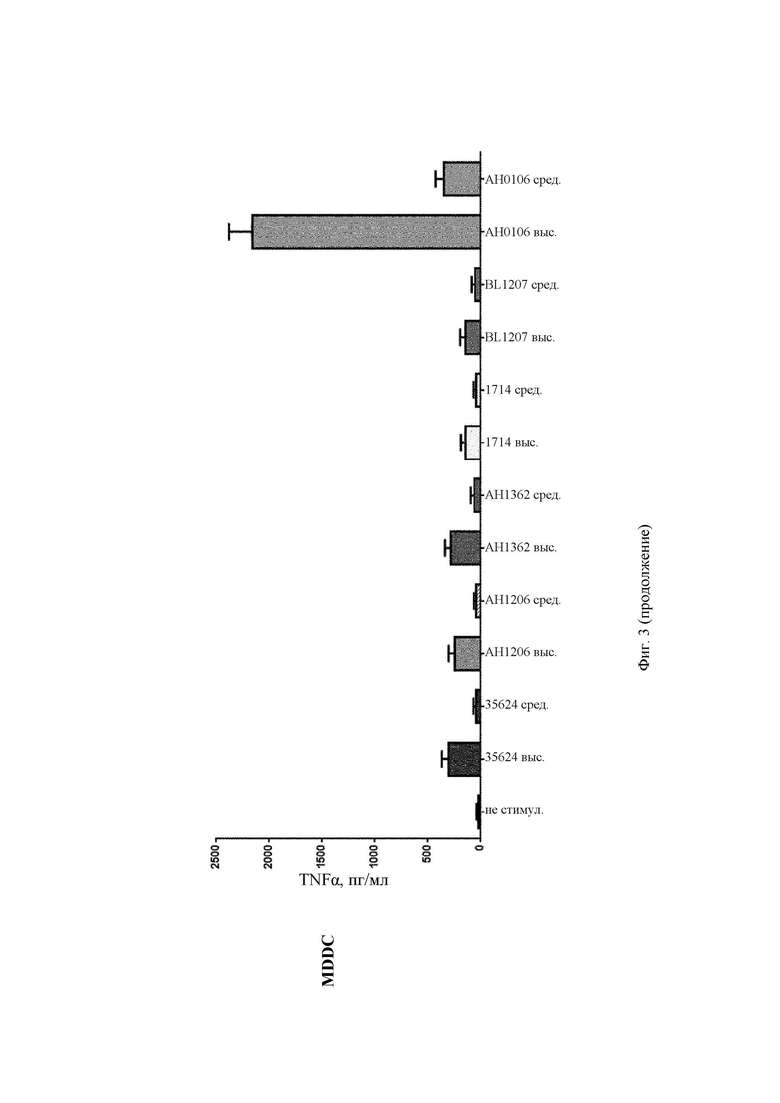
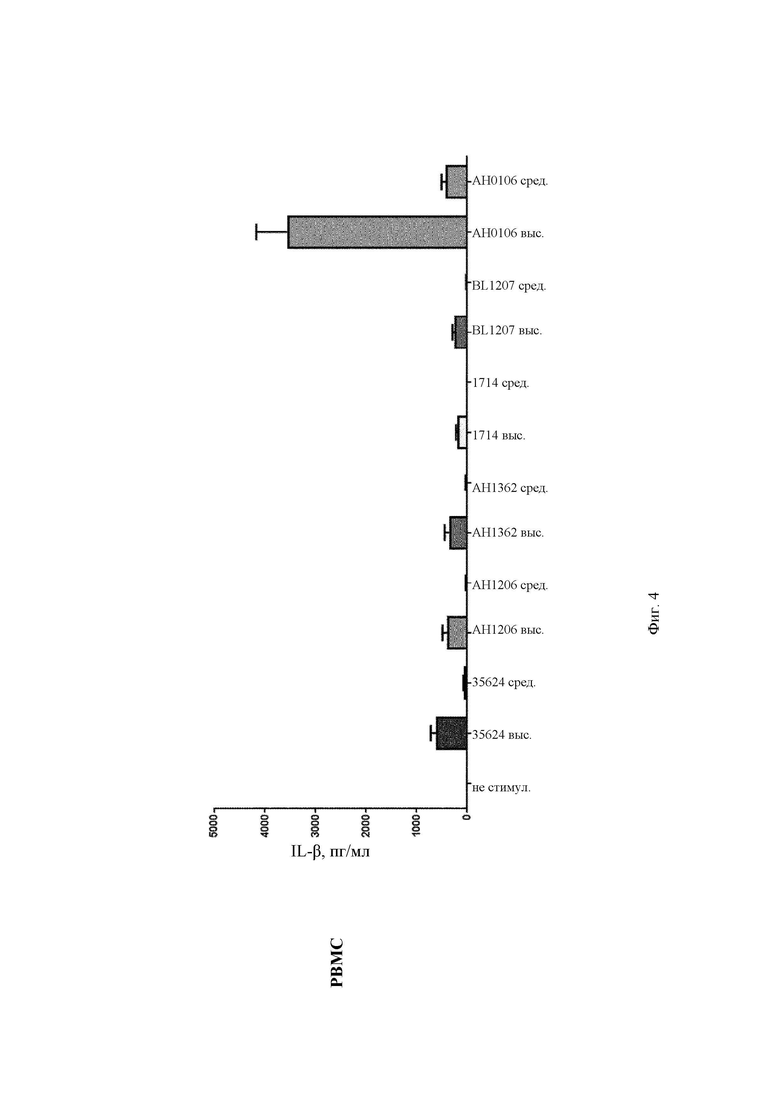
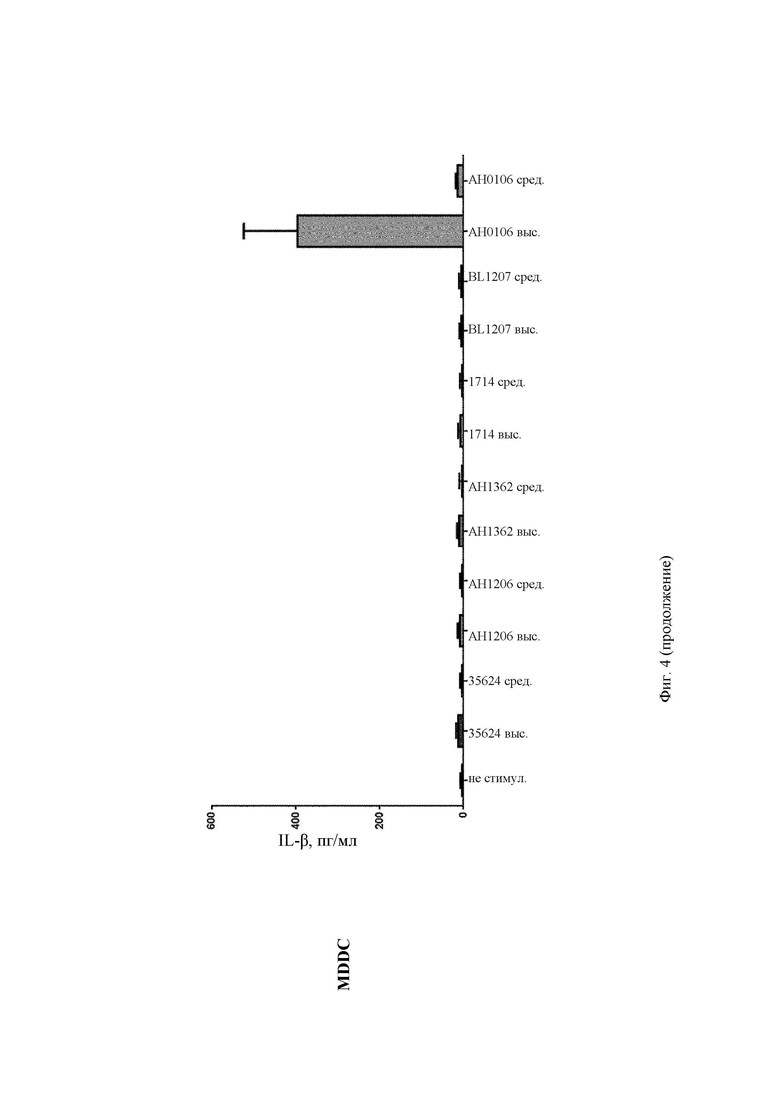
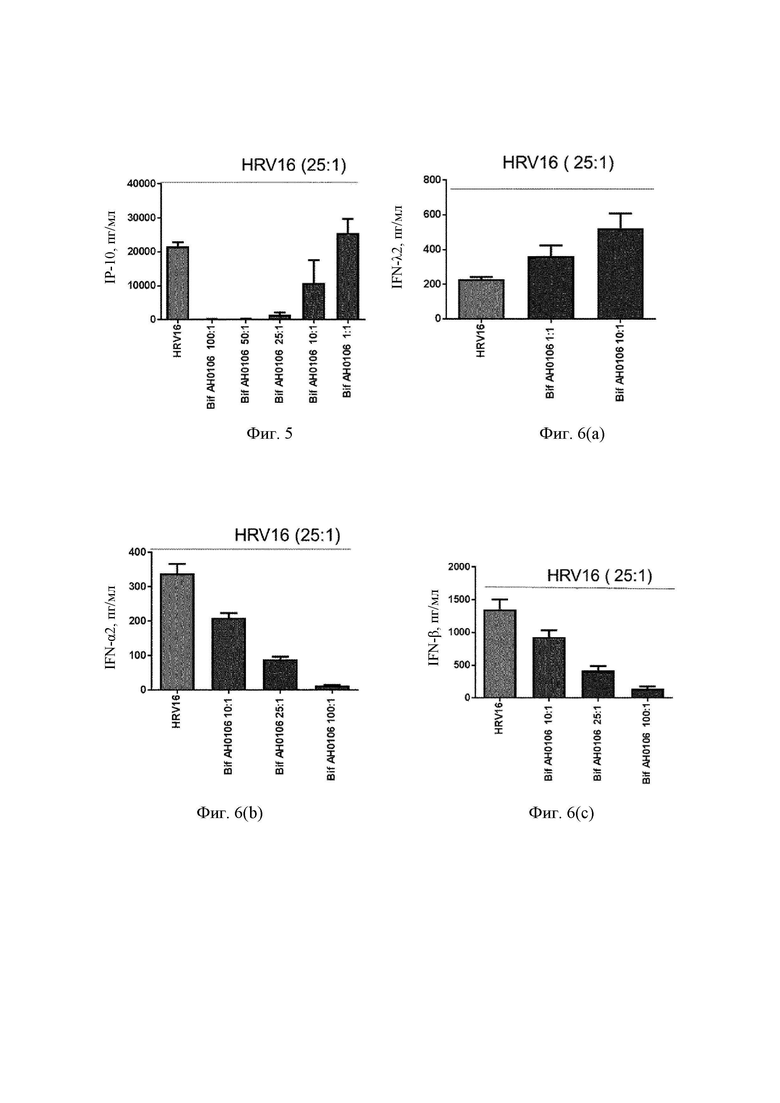
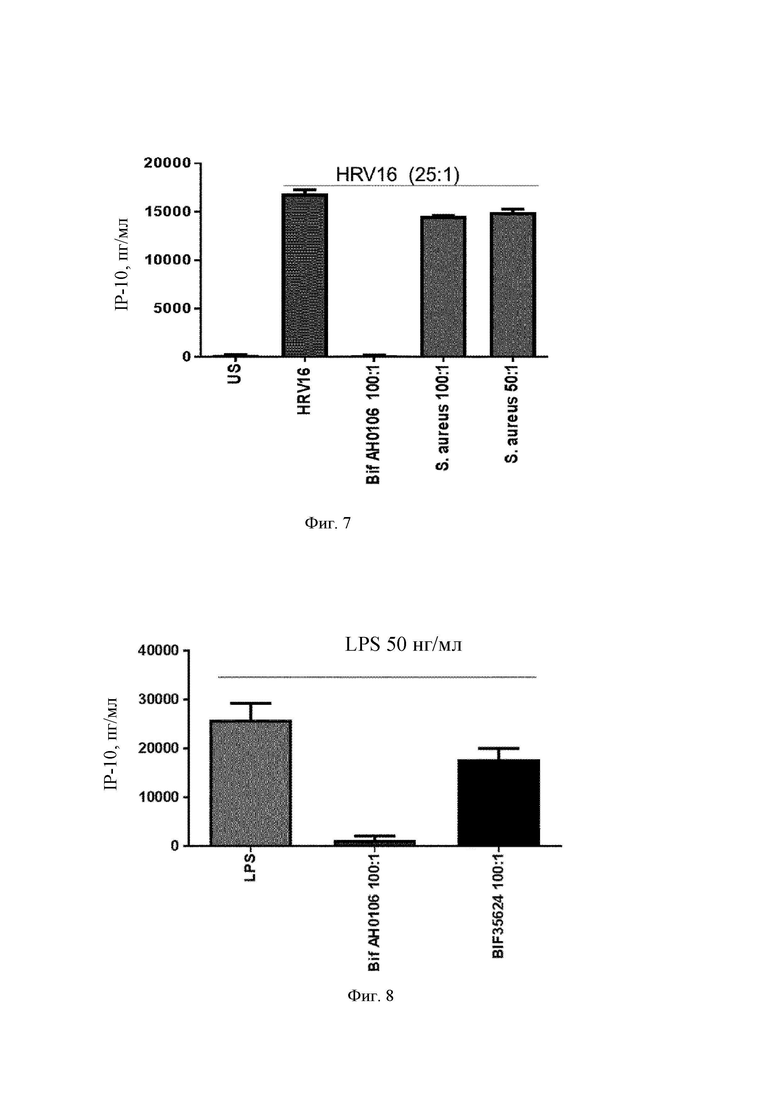
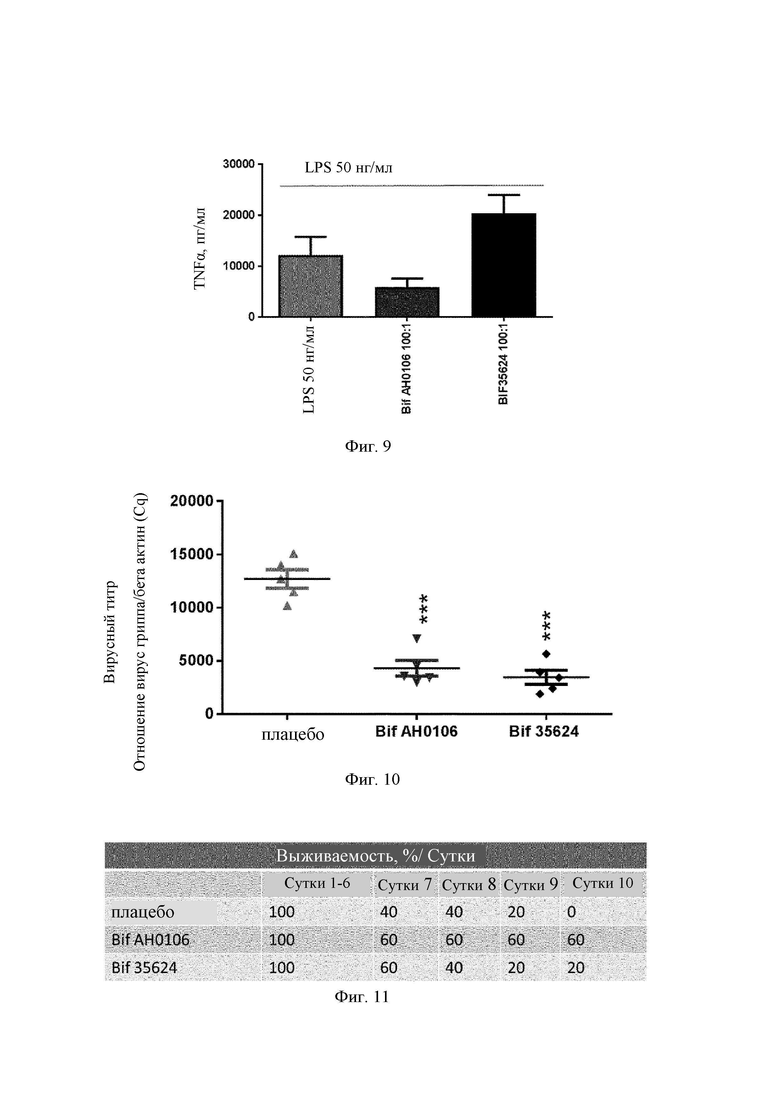
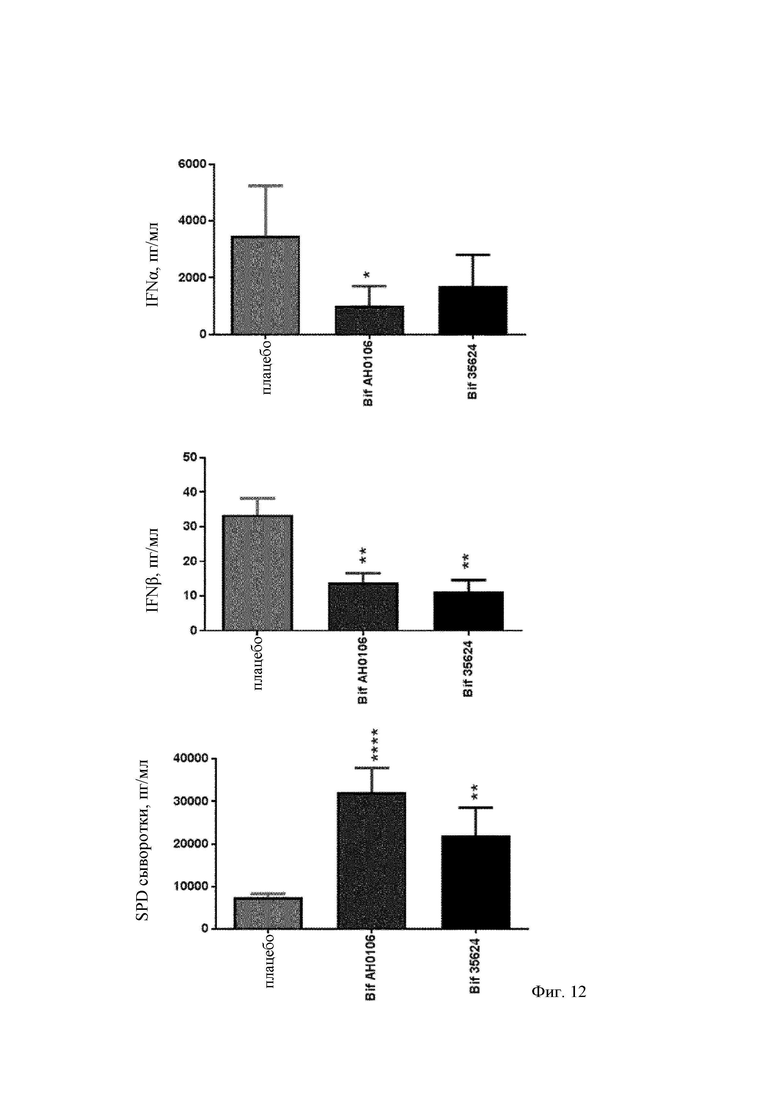
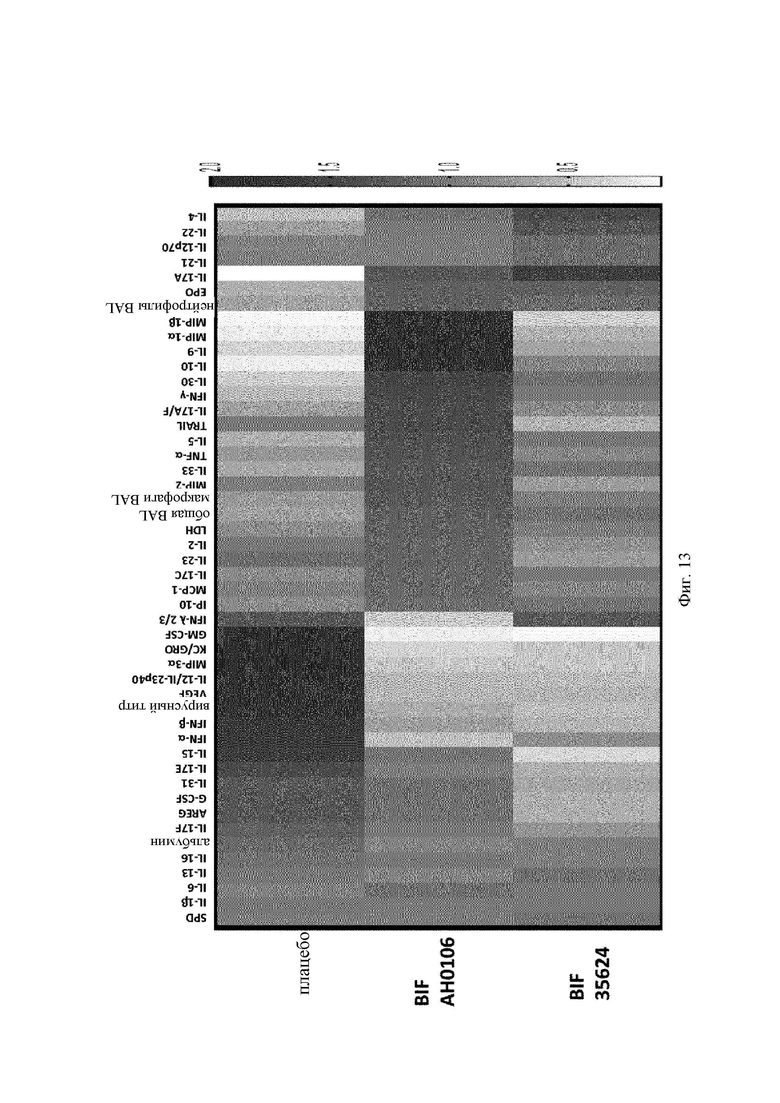
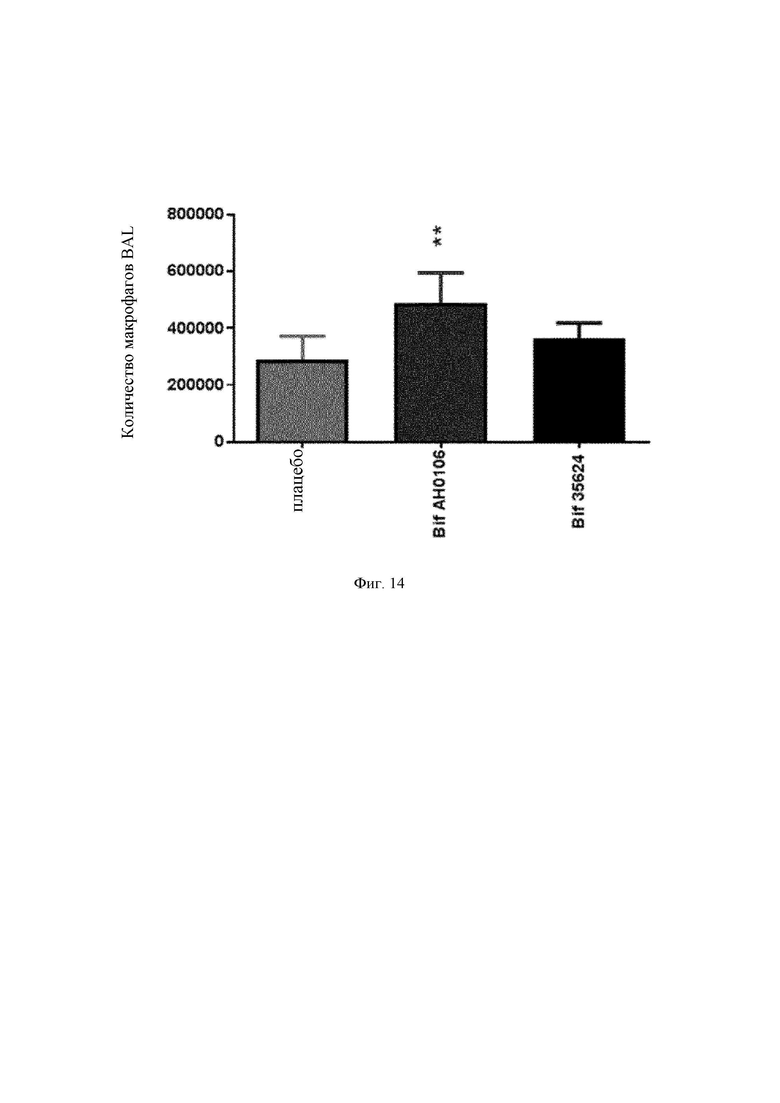
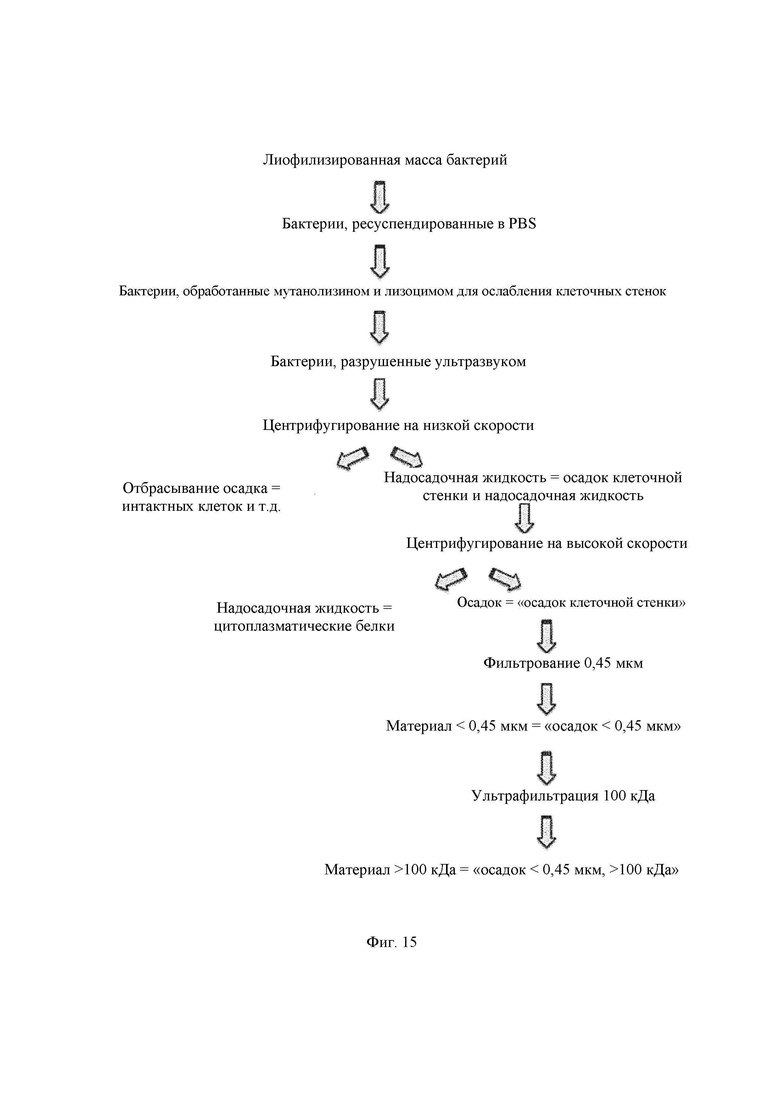
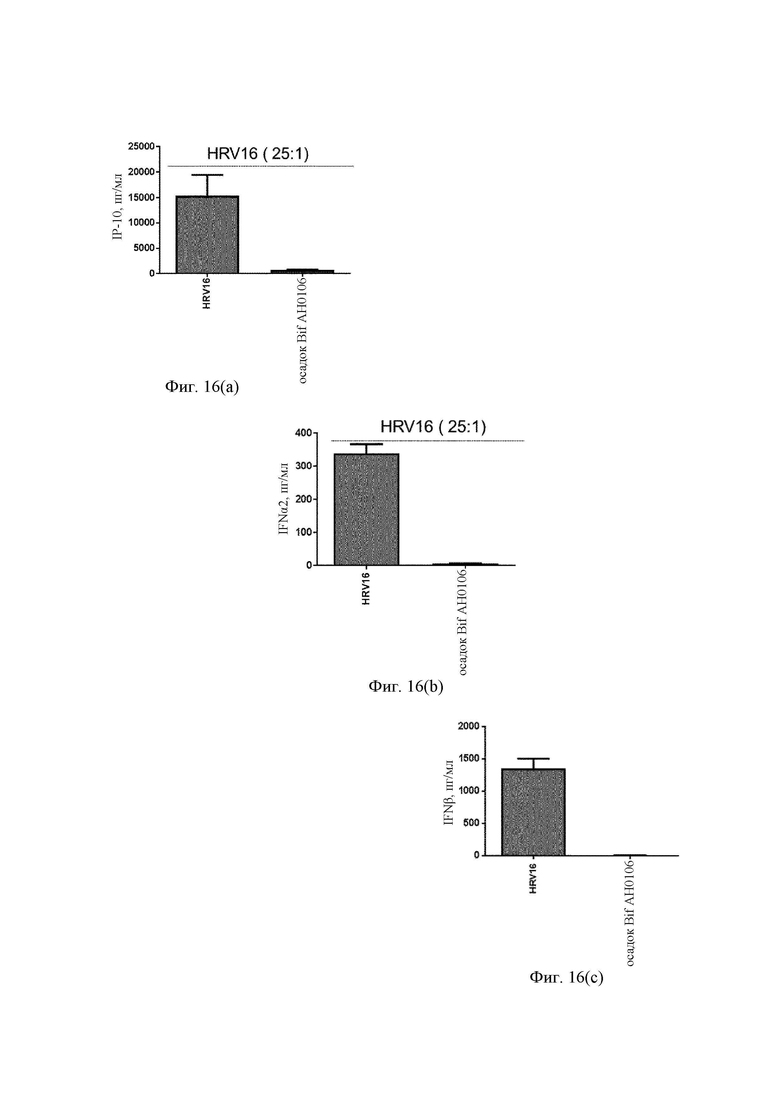
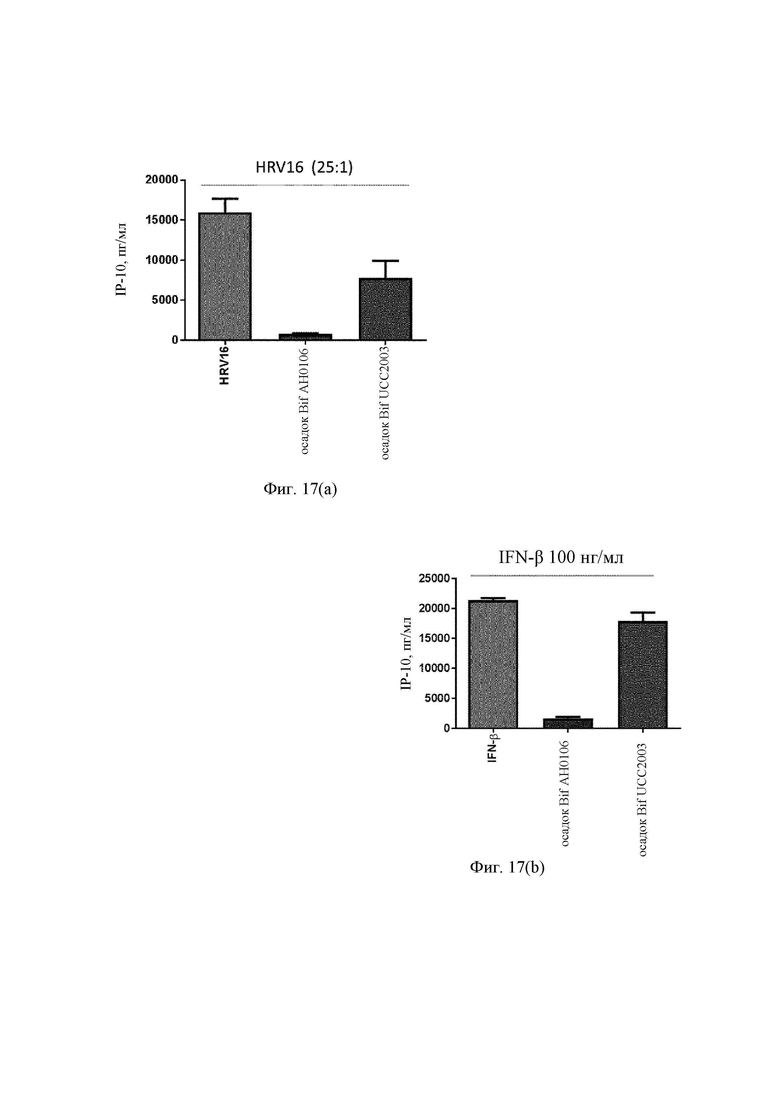
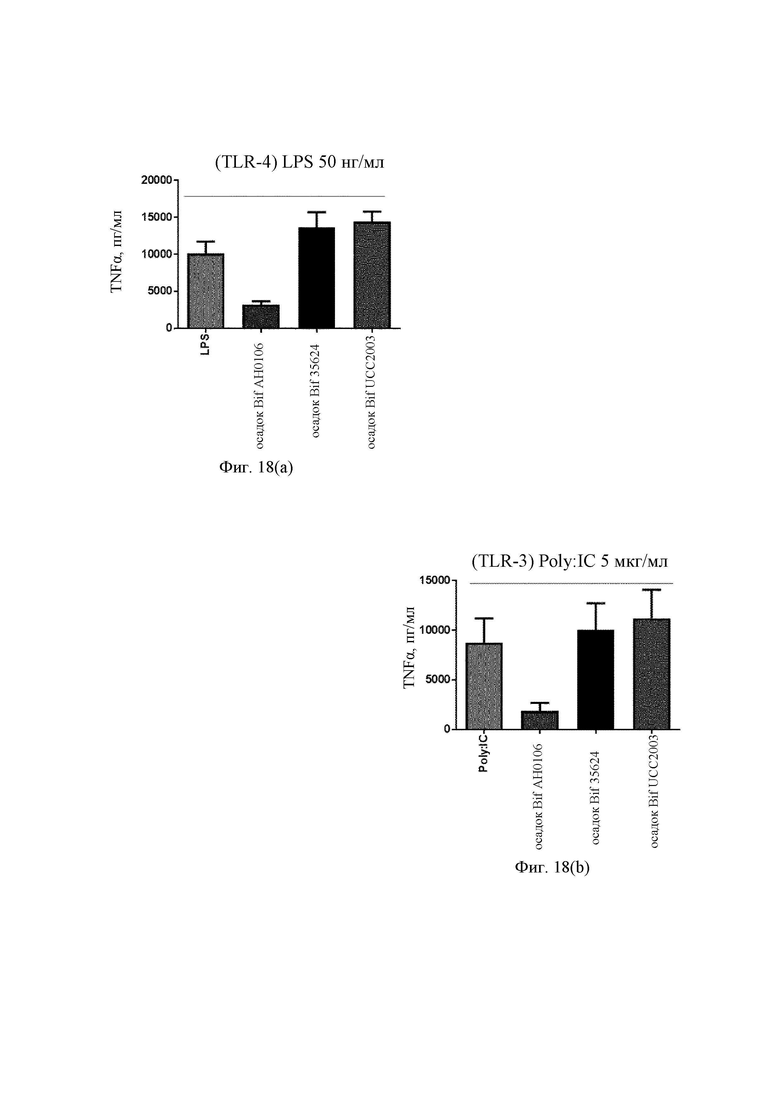
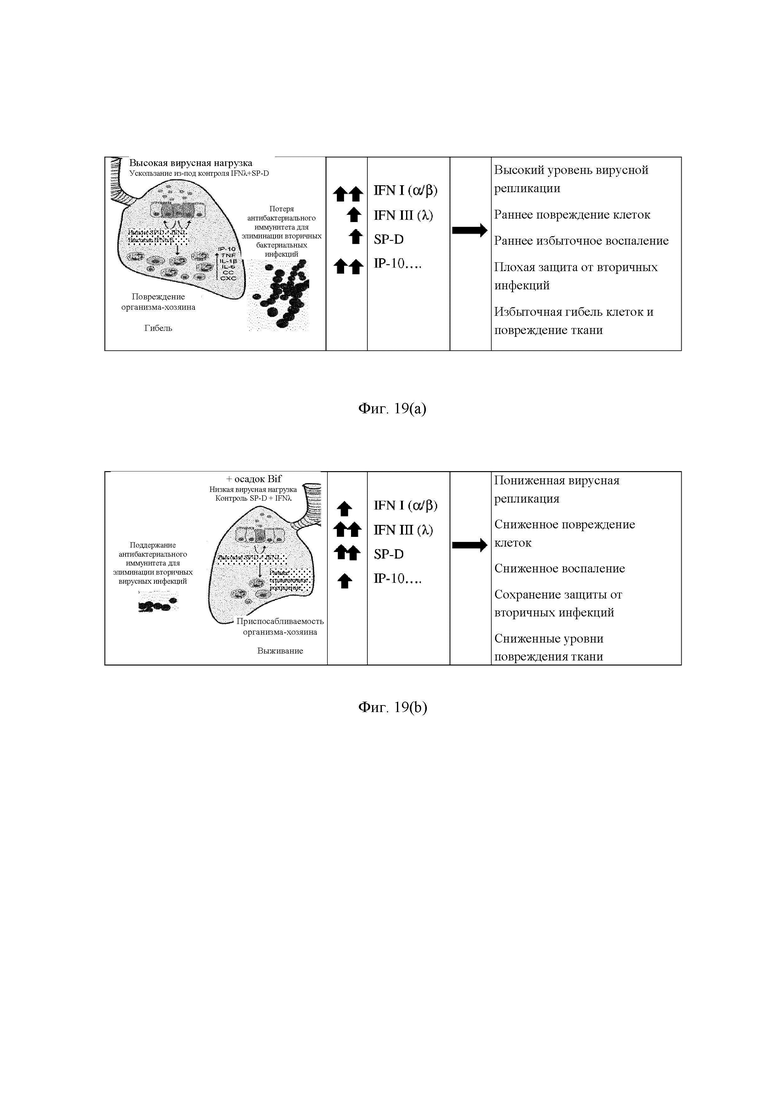
Изобретение относится к биотехнологии и пищевой промышленности. Выделенный штамм Bifidobacterium longum NCIMB 42020 полезен для лечения вирусных инфекций, в частности вирусных респираторных инфекций, таких как грипп, риновирус и RSV (респираторный синцитиальный вирус). Bifidobacterium longum NCIMB 42020 также полезен для элиминации вторичных бактериальных инфекций. 5 н. и 64 з.п. ф-лы, 19 ил., 1 табл., 10 пр.
1. Иммуностимулирующий штамм Bifidobacterium longum, имеющий регистрационный номер NCIMB 42020.
2. Штамм Bifidobacterium по п. 1, который находится в форме биологически чистой культуры.
3. Штамм Bifidobacterium по п. 1 или 2 в форме жизнеспособных клеток.
4. Штамм Bifidobacterium по любому из пп. 1-3 в форме нежизнеспособных клеток.
5. Штамм Bifidobacterium по любому из пп. 1-4, где Bifidobacterium выделены из кала.
6. Штамм Bifidobacterium по любому из пп. 1-5, который находится в форме бактериального бульона.
7. Штамм Bifidobacterium по любому из пп. 1-5, который находится в форме лиофилизированного порошка.
8. Штамм по любому из пп. 1-7, который ослабляет ответ IP-10 на вирус.
9. Штамм по любому из пп. 1-8, который усиливает ответ интерферона III типа на вирус.
10. Штамм по любому из пп. 1-9, который усиливает ответ интерферона лямбда на вирус.
11. Штамм по любому из пп. 1-10, который подавляет ответ интерферона I типа на вирус.
12. Штамм по любому из пп. 1-11, который подавляет ответ интерферона альфа на вирус.
13. Штамм по любому из пп. 1-12, который подавляет ответ интерферона бета на вирус.
14. Штамм по любому из пп. 1-13, который усиливает ответ сурфактантного белка D на вирус.
15. Иммуностимулирующая композиция, содержащая штамм Bifidobacterium по любому из пп. 1-14 и носитель, разбавитель и/или эксципиент.
16. Композиция по п. 15, дополнительно содержащая другой пробиотический материал.
17. Композиция по п. 15 или 16, дополнительно содержащая пребиотический материал.
18. Композиция по п. 15 или 16, дополнительно содержащая принимаемый внутрь носитель.
19. Композиция по п. 18, где принимаемый внутрь носитель представляет собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок.
20. Композиция по п. 18, где принимаемый внутрь носитель представляет собой пищевой продукт, такой как кислое молоко, йогурт, замороженный йогурт, мороженое, порошковое молоко, концентрированное молоко, мороженое, сырная паста, заправка или напиток.
21. Композиция по любому из пп. 15-20, дополнительно содержащая белок и/или пептид, в частности белки и/или пептиды, богатые глутамином/глутаматом, липид, углевод, витамин, минерал и/или микроэлемент.
22. Композиция по любому из пп. 15-21, где штамм Bifidobacterium присутствует в количестве более 106 CFU (колониеобразующих единиц) на грамм композиции.
23. Композиция по пп. 15-22, дополнительно содержащая адъювант.
24. Композиция по пп. 15-23, дополнительно содержащая лекарственное средство.
25. Композиция по пп. 15-24, дополнительно содержащая биологическое соединение.
26. Иммуностимулирующая композиция, содержащая штамм по любому из пп. 1-14, которая адаптирована для введения в легкие или в нос.
27. Композиция по п. 26 в форме назального спрея.
28. Композиция по п. 26 или 27, где вязкость композиции составляет от 1 сП до 2000 сП.
29. Штамм Bifidobacterium по любому из пп. 1-14 для применения в пищевых продуктах.
30. Композиция по любому из пп. 15-25 для применения в пищевых продуктах.
31. Штамм Bifidobacterium по любому из пп. 1-14 для применения в качестве лекарственного средства.
32. Композиция по любому из пп. 15-25 для применения в качестве лекарственного средства.
33. Штамм Bifidobacterium по любому из пп. 1-14 для применения в профилактике и/или лечении нежелательной воспалительной активности.
34. Композиция по любому из пп. 15-28 для применения в профилактике и/или лечении нежелательной воспалительной активности.
35. Штамм Bifidobacterium по любому из пп. 1-14 для применения в изготовлении лекарственного средства для лечения астмы и/или аллергии, где лекарственное средство может быть в форме, подходящей для ингаляции.
36. Композиция по любому из пп. 15-28 для применения в изготовлении лекарственного средства для лечения астмы и/или аллергии, где лекарственное средство может быть в форме, подходящей для ингаляции.
37. Штамм Bifidobacterium по любому из пп. 1-14 для применения в профилактике или лечении вирусной инфекции у субъекта.
38. Композиция по любому из пп. 15-28 для применения в профилактике или лечении вирусной инфекции у субъекта.
39. Штамм Bifidobacterium по любому из пп. 1-14 для применения в профилактике вторичной бактериальной инфекции, ассоциированной с респираторной вирусной инфекцией, у субъекта.
40. Композиция по любому из пп. 15-28 для применения в профилактике вторичной бактериальной инфекции, ассоциированной с респираторной вирусной инфекцией, у субъекта.
41. Штамм Bifidobacterium для применения по п. 37 или 39, где вирус представляет собой респираторный вирус.
42. Штамм Bifidobacterium для применения по п. 41, где респираторный вирус выбран из вируса гриппа, риновируса и респираторного синцитиального вируса.
43. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39, 41 и 42, где у субъекта диагностировано воспалительное заболевание легких.
44. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-43, где субъект имеет повышенную предрасположенность к респираторной инфекции.
45. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-44, где субъект имеет ожирение.
46. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-45, где субъект представляет собой пациента с острым респираторным дистресс-синдромом (ARDS).
47. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-46, где субъект представляет собой пациента с астмой.
48. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-47, где субъект представляет собой пациента с хронической обструктивной болезнью легких (COPD).
49. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-48, где субъект представляет собой ребенка в возрасте младше 5 лет.
50. Штамм Bifidobacterium longum для применения по любому из пп. 37, 39 и 41-48, где субъект представляет собой пожилого пациента в возрасте старше 60 лет.
51. Способ профилактики или лечения вирусной инфекции у субъекта, включающий введение субъекту, которому это необходимо, эффективного количества штамма Bifidobacterium longum NCIMB 42020.
52. Способ по п. 51, где штамм Bifidobacterium longum NCIMB 42020 ослабляет ответ IP-10 на вирус.
53. Способ по п. 51 или 52, где штамм Bifidobacterium longum NCIMB 42020 усиливает ответ интерферона III типа на вирус.
54. Способ по пп. 51-53, где штамм Bifidobacterium longum NCIMB 42020 усиливает ответ интерферона лямбда на вирус.
55. Способ по любому из пп. 51-54, где штамм Bifidobacterium longum NCIMB 42020 подавляет ответ интерферона I типа на вирус.
56. Способ по любому из пп. 51-55, где штамм Bifidobacterium longum NCIMB 42020 подавляет ответ интерферона альфа на вирус.
57. Способ по любому из пп. 51-56, где штамм Bifidobacterium longum NCIMB 42020 подавляет ответ интерферона бета на вирус.
58. Способ по любому из пп. 51-57, где штамм Bifidobacterium longum NCIMB 42020 усиливает ответ сурфактантного белка D на вирус.
59. Способ профилактики или лечения вторичной бактериальной инфекции у субъекта, включающий стадию введения фракции клеточной стенки, выделенной из Bifidobacterium longum NCIMB 42020.
60. Способ по любому из пп. 51-59, где вирус представляет собой респираторный вирус.
61. Способ по любому из пп. 51-60, где вирус выбран из вируса гриппа, риновируса и респираторного синцитиального вируса.
62. Способ по любому из пп. 51-61, где у субъекта диагностировано воспалительное заболевание легких.
63. Способ по любому из пп. 51-62, где субъект имеет повышенную предрасположенность к респираторной инфекции.
64. Способ по любому из пп. 51-63, где субъект имеет ожирение.
65. Способ по любому из пп. 51-64, где субъект представляет собой пациента с острым респираторным дистресс-синдромом (ARDS).
66. Способ по любому из пп. 51-65, где субъект представляет собой пациента с астмой.
67. Способ по любому из пп. 51-66, где субъект представляет собой пациента с хронической обструктивной болезнью легких (COPD).
68. Способ по любому из пп. 51-67, где субъект представляет собой ребенка в возрасте младше 5 лет.
69. Способ по любому из пп. 51-67, где субъект представляет собой пожилого человека в возрасте старше 60 лет.
Авторы
Даты
2022-03-23—Публикация
2018-02-28—Подача