Ссылка на родственные заявки
[0001] Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США № 62/417750, поданной 4 ноября 2016 года, которая настоящим полностью включена в настоящее описание посредством ссылки.
Предшествующий уровень техники настоящего изобретения
[0002] Аденоассоциированный вирус (AAV) представляет собой небольшой безоболочечный вирус, в котором упакован линейный одноцепочечный ДНК-геном. AAV принадлежит к семейству Parvoviridae и роду Dependovirus, поскольку продуктивное заражение посредством AAV происходит только в присутствии вируса-помощника, такого как, например, аденовирус или вирус герпеса. Даже в условиях отсутствия вируса-помощника AAV (2-го серотипа) может переходить в латентное состояние путем встраивания в хромосому 19q13.4 генома человека-хозяина. Это единственный ДНК-вирус млекопитающих, о котором известно, что он способен к сайт-специфическому встраиванию (Daya and Berns, Clinical Microbiology Reviews, pages 583–593 (2008)).
[0003] Для безопасного применения AAV в клинике AAV был подвергнут генетической модификации в нескольких местах его генома. Например, во многих вирусных векторах из генома AAV были удалены ген Rep, который необходим для репликации вируса, и элемент, необходимый для сайт-специфического встраивания. Такой рекомбинантный AAV (rAAV) существует во внехромосомном состоянии и обладает очень низкой эффективностью встраивания в геномную ДНК. Следовательно, снижена вероятность индуцируемого посредством rAAV случайного мутагенеза в клетке-хозяине, если не устранена полностью. Благодаря этим свойствам и отсутствию патогенности у rAAV был продемонстрирован большой потенциал в качестве вектора для генной терапии во многих аспектах доклинических и клинических применений. В клинике проходят испытания новые серотипы и самокомплементарные векторы. Наряду с этими продолжающимися разработками векторов постоянные усилия были сосредоточены на масштабируемых способах производства, с помощью которых можно эффективно создавать большие титры rAAV-векторов с высокой чистотой и эффективностью.
[0004] Исследование AAV также было сосредоточено на составах с AAV, предназначенных для введения людям. Понятно, что такие составы с AAV должны быть не только безопасными, стерильными и соответствовать критериям надлежащей производственной практики (GMP), эти составы также должны обладать и в большей степени высокой долгосрочной стабильностью AAV, минимизируя утрату активности AAV в ходе производства, процессов упаковки и хранения. Кроме того, составы должны предотвращать адсорбцию на поверхности емкостей, в которых упакованы и хранятся AAV, и оборудования, применяемого в ходе производства. Несмотря на то, что были предприняты большие усилия по разработке таких составов с AAV, все еще остается потребность в усовершенствованных составах с AAV.
Краткое раскрытие настоящего изобретения
[0005] Настоящее раскрытие относится к составам, совместимым для введения человеку, которые удовлетворяют описанные выше неудовлетворенные потребности. Преимущественно, в соответствии с некоторыми вариантами осуществления, составы пригодны для долгосрочного хранения AAV, минимизируя утрату активности AAV, и преимущественно предотвращают образование видимых частиц и предотвращают адсорбцию на поверхности емкостей, в которых упакованы и хранятся AAV, и оборудования, применяемого в ходе производства. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 до приблизительно 25 мМ буферного средства, от приблизительно 0 до приблизительно 150 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара или сахароспирта. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 50 мМ до приблизительно 150 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 30 мМ до менее чем приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 20 мМ до приблизительно 40 мМ фармацевтически приемлемой соли.
[0006] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит AAV (например, AAV8), от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% до приблизительно 10% (масса/объем) сахарозы, трегалозы, маннита или их комбинацию. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 30 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 20 мМ до приблизительно 40 мМ хлорида натрия.
[0007] В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0008] Согласно определенному аспекту, лиофилизированная фармацевтическая композиция по настоящему раскрытию является лиофилизированной из жидкого состава, содержащего: AAV (например, AAV8), от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80), от приблизительно 30 мМ до приблизительно 70 мМ глицина и от приблизительно 1% до приблизительно 10% (масса/объем) сахарозы, трегалозы, маннита или их комбинации. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 30 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 20 мМ до приблизительно 40 мМ хлорида натрия.
[0009] Дополнительно в настоящем документе представлены способы получения фармацевтической композиции, содержащей AAV. Согласно иллюстративным аспектам, способ предусматривает объединение в комбинацию от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80), от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы, трегалозы, маннита или их комбинации и AAV, таким образом получая фармацевтическую композицию, содержащую AAV. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 30 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 20 мМ до приблизительно 40 мМ хлорида натрия.
[0010] Настоящее раскрытие относится к способам лечения субъекта от нарушения, поддающегося лечению с помощью генной терапии. Согласно иллюстративным аспектам, способ предусматривает введение субъекту описываемой в настоящем документе фармацевтической композиции в количестве, эффективном для лечения нарушения.
[0011] В настоящем документе, помимо прочего, предложены способы хранения композиции, содержащей AAV. Согласно иллюстративным аспектам, способ предусматривает объединение в комбинацию от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80), от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы, трегалозы, маннита или их комбинации и AAV. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 30 мМ до менее чем приблизительно 100 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав содержит от приблизительно 20 мМ до приблизительно 40 мМ хлорида натрия.
[0012] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 20 мМ L-гистидина, приблизительно 70 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80) и приблизительно 5% (масса/объем) сахарозы. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0013] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 20 мМ L-гистидина, приблизительно 60 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 35 мМ трегалозы и приблизительно 110 мМ маннита. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0014] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 100 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0015] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 80 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0016] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 70 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0017] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 60 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0018] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 50 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0019] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 40 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0020] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 30 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0021] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 20 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0022] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 10 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0023] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV и приблизительно 10 мМ L-гистидина, приблизительно 0 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0024] Как правило, представленные в настоящем документе составы с AAV являются подходящими для фармацевтического введения. В соответствии с определенными вариантами осуществления, AAV представляет собой AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 или AAV10. В соответствии с определенными вариантами осуществления, AAV представляет собой AAV 2, AAV 5, AAV 8 или AAV 9. В соответствии с определенными вариантами осуществления, AAV представляет собой AAV8.
Подробное раскрытие настоящего изобретения
[0025] Настоящее раскрытие относится к составам, например, фармацевтическим композициям, совместимым для введения человеку или животному, которые также пригодны для долгосрочного хранения AAV и минимизации утраты активности AAV. Представленные в настоящем документе составы обладают преимуществом, поскольку составы предотвращают образование видимых частиц, а также предотвращают адсорбцию на поверхности емкостей, в которых упакованы и хранятся AAV, и предотвращают адсорбцию на оборудовании, применяемом в ходе производства. В соответствии с определенными вариантами осуществления, фармацевтические композиции, представленные в настоящем документе, сохраняют значительную активность AAV при хранении в течение продолжительных периодов времени. В соответствии с определенными вариантами осуществления, фармацевтические композиции, представленные в настоящем документе, уменьшают или замедляют разрушение и/или агрегацию.
[0026] В соответствии с определенными вариантами осуществления, настоящее изобретение относится к составам с AAV, содержащим терапевтически эффективное количество или терапевтически эффективную дозу AAV, фармацевтически приемлемую соль в субфизиологической - физиологической концентрации, один или несколько сахаров и/или сахароспиртов в стабилизирующей концентрации, неионогенное поверхностно-активное вещество, одно или несколько буферных средств, обеспечивающих нейтральный pH для состава, и, необязательно, аминокислоту, способствующую сохранению стабильности и облегчающую выделение AAV во время очистки и/или обработки. Как правило, представленные в настоящем документе составы с AAV являются подходящими для фармацевтического введения. В соответствии с определенными вариантами осуществления, AAV представляет собой AAV8.
[0027] В соответствии с определенными вариантами осуществления, композиция, которая содержит AAV, представляют собой дегидратированную композицию. В контексте настоящего документа дегидратированная композиция представляет собой композицию, которая включает воду в незначительном количестве, таком как 25% или менее, или 20% или менее, или 15% или менее, или 10% или менее, или 9% или менее, или 8% или менее, или 7% или менее, или 6% или менее, или 5% или менее, или 4% или менее, или 3% или менее, или 2% или менее, или 1% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера (KF). В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 3% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 2% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 1% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,9% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,8% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,7% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,6% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,5% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,4% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,3% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, дегидратированная композиция содержит 0,2% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. Для получения дегидратированной композиции можно применять любой удобный протокол, такой как повышение температуры композиции (например, нагревание), снижение давления, лиофилизация (также известная как сушка вымораживанием) и т.п. и их комбинации. Другие способы определения содержания влаги в композиции включают без ограничения потерю в массе при высушивании (LOD) (с помощью него измеряют количество воды и летучих веществ в образце при высушивании образца в определенных условиях), электролитические датчики (например, с использованием датчика P2O5), пьезоэлектрическую сорбцию, оксидные датчики, алюмооксидные датчики, абсорбционную спектроскопию и в ближней части инфракрасного диапазона (NIR).
[0028] Кроме того, было обнаружено, что снижение концентрации соли в лиофилизированном составе уменьшает остаточную влажность в лиофилизате и способствует формированию улучшенного лиофилизата.
[0029] Из-за низкого содержания воды в описанной выше лиофилизированной композиции лиофилизированная композиция может иметь форму твердого вещества. В некоторых случаях твердая лиофилизированная композиция представляет собой порошок. В некоторых случаях лиофилизированная композиция может облегчить хранение композиции в течение продолжительного периода времени (например, по сравнению с жидким составом той же композиции). Например, лиофилизированная композиция может быть стабильной при хранении композицией (например, лиофилизированной стабильной при хранении композицией), причем композиция остается практически стабильной в течение продолжительного периода времени. Под «стабильным» или «стабильным при хранении» или «практически стабильным» подразумевают композицию, которая не подвергается значительному разложению и/или у которой отсутствует значительная утрата активности в течение продолжительного периода времени. Например, стабильная при хранении композиция может не содержать значительных примесей, образующихся в результате разрушение композиции в течение продолжительного периода времени, как, например, 10% или менее примесей, или 9% или менее, или 8% или менее, или 7% или менее, или 6% или менее, или 5% или менее, или 4% или менее или 3% или менее, или 2% или менее, или 1% или менее продуктов разложения в течение продолжительного периода времени. В определенных случаях стабильная при хранении композиция содержит 5% или менее примесей в течение продолжительного периода времени. В некоторых случаях стабильная при хранении композиция практически сохраняет свою активность в течение продолжительного периода времени, например, сохраняет 100% своей активности или 99% или более, или 98% или более, или 97% или более, или 96% или более, или 95% или более, или 94% или более, или 93% или более, или 92% или более, или 91% или более, или 90% или более, или 85% или более, или 80% или более, или 75% или более своей активности в течение продолжительного периода времени. Например, стабильная при хранении композиция может сохранять 90% или более своей активности в течение продолжительного периода времени. В некоторых случаях стабильная при хранении композиция сохраняет 95% или более своей активности в течение продолжительного периода времени. Продолжительным периодом времени является такой период времени, как 1 неделя или более, или 2 недели или более, или 3 недели или более, или 1 месяц или более, или 2 месяца или более, или 3 месяца или более, или 4 месяца или более, или 6 месяцев или более, или 9 месяца или более, или 1 год или более, или 1,5 года (например, 18 месяцев) или более, или 2 года или более, или 2,5 года (например, 30 месяцев) или более, или 3 года или более, или 3,5 года (например, 42 месяца) или более, или 4 года или более, или 4,5 года (например, 54 месяца) или более или 5 лет или более. Например, продолжительный период времени может составлять 6 месяцев или более. В некоторых случаях продолжительный период времени составляет 9 месяцев или более. В некоторых случаях продолжительный период времени составляет 1 год (например, 12 месяцев) или более. В некоторых случаях продолжительный период времени составляет 1,5 года (например, 18 месяцев) или более. В некоторых случаях продолжительный период времени составляет 2 года (например, 24 месяца) или более. В соответствии с некоторыми вариантами осуществления, стабильная при хранении композиция является практически стабильной в течение продолжительного периода времени при температуре окружающей среды, такой как температура от 20 до 40°С, или от 25 до 35°С, или от 25 до 30°С. В некоторых случаях стабильная при хранении композиция является практически стабильной в течение продолжительного периода времени при температуре, ниже температуры окружающей среды, такой как температура от 0 до 20°C, или от 0 до 15°C, или от 0 до 10°C, или от 2 до 8°C.
[0030] Определения
[0031] Применяемый в контексте настоящего документа термин «AAV» обозначает аденоассоциированный вирус как в природных, так и в рекомбинантных формах (rAAV) и охватывает мутантные формы AAV. Термин AAV дополнительно включает без ограничения AAV 1-го типа, AAV 2-го типа, AAV 3-го типа, AAV 4-го типа, AAV 5-го типа, AAV 6-го типа, AAV 7-го типа, AAV 8-го типа, AAV 9-го типа, AAV 10-го типа, AAV птиц, AAV крупного рогатого скота, AAV собак, AAV лошадей, AAV овец, AAV приматов и AAV отличных от приматов животных. В соответствии с определенными вариантами осуществления, AAV представляет собой AAV8.
[0032] Фраза «фармацевтически приемлемый», применяемая в связи с описанными в настоящем документе композициями, относится к молекулярным частицам и другим ингредиентам таких композиций, которые являются физиологически переносимыми и обычно не вызывают неблагоприятных реакций при введении субъекту. Предпочтительно, термин «фармацевтически приемлемый» означает одобренный регуляторным органом федерального правительства или правительства штата или указанный в Фармакопее США или другой общепризнанной фармакопее для применения на млекопитающих и, в частности, на людях. «Фармацевтически приемлемая соль» представляет собой соль, которая может быть составлена в смесь или конъюгат для фармацевтического применения, включая, например, соли металлов (натрия, калия, магния, кальция и т.д.) и соли аммиака или органических аминов, которые безопасны для введения субъекту (например, человеку) в лекарственном составе (см., например, публикацию Berge, et al. “Pharmaceutical Salts,” J. Pharm. Sci. 1977; 66:1, которая включена в настоящий документ посредством ссылки во всей своей полноте и для всех целей). К подходящим «фармацевтически приемлемым солям» относятся без ограничения соли металлов, такие как соли натрия, калия и цезия; соли щелочноземельных металлов, такие как соли кальция и магния; соли органических аминов, такие как соли триэтиламина, гуанидина и N-замещенного гуанидина, соли ацетамидина и N-замещенного ацетамидина, пиридина, пиколина, этаноламина, триэтаноламина, дициклогексиламина и N,N’-дибензилэтилендиамина. К «фармацевтически приемлемым солям» (основных азотных центров) относятся без ограничения соли неорганических кислот, такие как гидрохлорид, гидробромид, сульфат, фосфат; соли органических кислот, такие как трифторацетатные и малеатные соли; сульфонаты, такие как метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, камфорсульфонат и нафталинсульфонат; соли аминокислот, такие как аргинат, аланинат, аспаргинат и глутамат; и соли углеводов, такие как глюконат и галактуронат. Выбор и применение фармацевтически приемлемых солей хорошо известно в настоящей области техники, например, см. публикацию Stahl and Wermuth, Pharmaceutical Salts: Properties, Selection, and Use, 2nd Revised edition, Wiley, Hoboken, N.J., которая включена в настоящий документ посредством ссылки во всей своей полноте и для всех целей. Неограничивающие примеры фармацевтически приемлемых солей включают без ограничения соли натрия, соли аммония, соли калия (например, хлорид натрия, аммония и калия; ацетат натрия, аммония и калия; цитрат натрия, аммония и калия; фосфат натрия, аммония и калия; фторид натрия, аммония и калия; бромид натрия, аммония и калия; и йодид натрия, аммония и калия).
[0033] Применяемый в контексте настоящего документа термин «физиологическая концентрация» соли обозначает концентрацию соли от приблизительно 100 до приблизительно 200 мМ фармацевтически приемлемой соли.
[0034] В контексте настоящего документа «субфизиологическая концентрация» соли обозначает концентрацию соли менее чем приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, субфизиологическая концентрация соли составляет менее чем приблизительно 80 мМ фармацевтически приемлемой соли. В соответствии с другим вариантом осуществления, субфизиологическая концентрация соли составляет менее чем приблизительно 70 мM, менее чем приблизительно 60 мМ, менее чем приблизительно 50 мМ, менее чем приблизительно 40 мМ, менее чем приблизительно 30 мМ, менее чем приблизительно 20 мМ, или менее чем приблизительно 10 мМ фармацевтически приемлемой соли.
[0035] Применяемые в контексте настоящего документа термины «лечить» или «лечение» статуса, нарушения или патологического состояния включают: (1) предупреждение, задержку или уменьшение частоты и/или вероятности появления по меньшей мере одного клинического или субклинического симптома статуса, нарушения или патологического состояния, развивающегося у субъекта, который может быть поражен статусом, нарушением или патологическим состоянием или предрасположен к развитию статуса, нарушения или патологического состояния, но еще не испытывает или у него не проявляются клинические или субклинические симптомы статуса, нарушения или патологического состояния; или (2) подавление статуса, нарушения или патологического состояния, т. е. купирование, уменьшение или замедление развития/прогрессирования заболевания или его рецидива или по меньшей мере одного его клинического или субклинического симптома; или (3) облегчение заболевания, т. е. индукцию регрессии статуса, нарушения или патологического состояния или по меньшей мере одного из его клинических или субклинических симптомов. Такие применяемые в контексте настоящего документа термины не обязательно подразумевают 100% или полное излечение. Скорее, существуют различные степени излечения, которые рядовые специалисты в настоящей области техники признают как наличие потенциальной пользы или терапевтического эффекта. Польза для подлежащего лечению пациента является либо статистически значимой, либо по меньшей мере ощутимой для пациента или для врача. В этом отношении способы лечения нарушения, например, нарушения свертываемости крови, по настоящему раскрытию могут обеспечить любой объем или любой уровень лечения. Кроме того, лечение, обеспечиваемое способом по настоящему раскрытию, может включать лечение одного или нескольких патологических состояний или симптомов или признаков подвергаемого лечению нарушения.
[0036] В контексте настоящего документа «терапевтически эффективное количество или доза» или «достаточное количество или доза» обозначает дозу, которая производит эффекты, с целью достижения которых ее вводят. Точная доза будет зависеть от цели лечения и может быть установлена специалистом в настоящей области с применением известных методик (см., например, публикации Lieberman, Pharmaceutical Dosage Forms (vols. 1-3, 1992); Lloyd, The Art, Science and Technology of Pharmaceutical Compounding (1999); Pickar, Dosage Calculations (1999); и Remington: The Science and Practice of Pharmacy, 20th Edition, 2003, Gennaro, Ed., Lippincott, Williams & Wilkins).
[0037] Термины «пациент» и «субъект» применяют взаимозаменяемо и применяют в их общепринятом смысле для обозначения живого организма, страдающего от или склонного к развитию патологического состояния, которое можно предупредить или вылечить путем введения композиции по настоящему раскрытию, и включает как людей, так и отличных от человека животных. Примеры субъектов включают без ограничения людей, шимпанзе и других видов высших и низших приматов; сельскохозяйственных животных, таких как крупный рогатый скот, овцы, свиньи, козы и лошади; домашних млекопитающих, таких как собаки и кошки; лабораторных животных, включая грызунов, таких как мыши, крысы и морские свинки; птиц, в том числе домашних, диких и охотничьих, такие как куры, индюки и другие куриные птицы, утки, гуси и т.п. Термин не обозначает конкретный возраст. Таким образом, интерес представляют взрослые, неполовозрелые и новорожденные.
[0038] В контексте настоящего документа «хранение» означает, что состав сразу не вводят субъекту после его приготовления, а хранят в течение некоторого времени в определенных условиях (например, при определенной температуре и т.д.) до его применения. Например, жидкую или лиофилизированную композицию можно хранить в течение нескольких дней, недель, месяцев или лет перед введением субъекту при различных температурах, например, в холодильнике (от 0 до 10°C) или при комнатной температуре (например, при температуре до 32°С).
[0039] Применяемый в контексте настоящего документа термин «приблизительно» обозначает примерный диапазон плюс или минус 10% от указанного значения. Например, формулировка «приблизительно 20%» охватывает диапазон 18-22%. В контексте настоящего документа «приблизительно» также включает точное количество. Следовательно, «приблизительно 20%» означает «приблизительно 20%», а также «20%».
[0040] Применяемый в контексте настоящего документа термин «и/или» обозначает и охватывает все возможные комбинации одного или нескольких связанных перечисленных элементов, а также отсутствие комбинаций при интерпретации в альтернативе («или»).
[0041] Применяемый в контексте настоящего документа термин «или» относится к любому одному представителю конкретного перечня, а также включает любую комбинацию представителей из этого перечня.
[0042] Применяемые в контексте настоящего документа формы единственного числа и аналогичные объекты отсылки в контексте описания настоящего раскрытия (особенно в контексте приведенной далее формулы изобретения) следует рассматривать как охватывающие формы как единственного, так и множественного числа, если в настоящем документе не указано иное или это явно не противоречит контексту. Термины «охватывающий», «имеющий», «включающий» и «содержащий» следует истолковывать как неограничивающие термины (т.е. означающие «включающий без ограничения»), если не указано иное.
[0043] Указание диапазонов значений в настоящем документе понимают лишь как служащее кратким способом индивидуального указания каждого отдельного значения, попадающего в диапазон, и каждой конечной точки, если в настоящем документе не указано иное, и каждое отдельное значение и конечная точка включены в настоящее описание, как если бы они были индивидуально указаны в настоящем документе.
[0044] Композиции и составы с AAV
[0045] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 до приблизительно 25 мМ буферного средства, от приблизительно 0 до приблизительно 150 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара или сахароспирта.
[0046] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 до приблизительно 25 мМ буферного средства, от приблизительно 50 до приблизительно 150 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара или сахароспирта.
[0047] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 до приблизительно 25 мМ буферного средства, от приблизительно 0 до менее чем 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара или сахароспирта.
[0048] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 до приблизительно 25 мМ буферного средства, от приблизительно 30 до менее чем 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара или сахароспирта.
[0049] В конкретных случаях композиция представляет собой стерильную композицию. Термин «стерильный» означает, что в композиции практически отсутствуют иммуногенные компоненты, так, например, практически полностью отсутствуют микробы (например, грибы, бактерии, вирусы, споровые формы и т.д.).
[0050] В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к жидкому составу. В соответствии с определенными вариантами осуществления, состав является лиофилизированным из жидкого состава.
[0051] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 5 мМ до приблизительно 25 мМ, от приблизительно 5 мМ до приблизительно 15 мМ, от приблизительно 10 мМ до приблизительно 20 мМ или от приблизительно 15 мМ до приблизительно 25 мМ буферного средства. Согласно иллюстративным аспектам, фармацевтическая композиция содержит приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ, приблизительно 8 мМ, приблизительно 9 мМ, приблизительно 10 мМ, приблизительно 11 мМ, приблизительно 12 мМ, приблизительно 13 мМ, приблизительно 14 мМ, приблизительно 15 мМ, приблизительно 16 мМ, приблизительно 17 мМ, приблизительно 18 мМ, приблизительно 19 мМ, приблизительно 20 мМ, приблизительно 21 мМ, приблизительно 22 мМ, приблизительно 23 мМ, приблизительно 24 мМ или приблизительно 25 мМ буферного средства.
[0052] Фармацевтически приемлемые буферные средства хорошо известны в данной области техники и включают без ограничения фосфатные буферы, гистидин, цитрат натрия, HEPES, трис, бицин, глицин, N-глицилглицин, ацетат натрия, карбонат натрия, глицилглицин, лизин, аргинин, фосфат натрия и их смеси. В соответствии с определенными вариантами осуществления, буфером является гистидин (например, L-гистидин).
[0053] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 5 мМ до приблизительно 25 мМ, от приблизительно 5 мМ до приблизительно 15 мМ, от приблизительно 10 мМ до приблизительно 20 мМ или от приблизительно 15 мМ до приблизительно 25 мМ L-гистидина. Согласно иллюстративным аспектам, фармацевтическая композиция содержит приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ, приблизительно 8 мМ, приблизительно 9 мМ, приблизительно 10 мМ, приблизительно 11 мМ, приблизительно 12 мМ, приблизительно 13 мМ, приблизительно 14 мМ, приблизительно 15 мМ, приблизительно 16 мМ, приблизительно 17 мМ, приблизительно 18 мМ, приблизительно 19 мМ, приблизительно 20 мМ, приблизительно 21 мМ, приблизительно 22 мМ, приблизительно 23 мМ, приблизительно 24 мМ или приблизительно 25 мМ L-гистидина. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит приблизительно 10 мМ L-гистидина. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит приблизительно 20 мМ L-гистидина.
[0054] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 0 мМ до приблизительно 150 мМ, от приблизительно 5 мМ до приблизительно 150 мМ, от приблизительно 5 мМ до приблизительно 100 мМ, от приблизительно 5 мМ до приблизительно 90 мМ, от приблизительно 5 мМ до приблизительно 80 мМ, от приблизительно 5 мМ до приблизительно 70 мМ, от приблизительно 5 мМ до приблизительно 60 мМ, от приблизительно 5 мМ до приблизительно 50 мМ, от приблизительно 5 мМ до приблизительно 40 мМ, от 5 мМ до приблизительно 30 мМ, от приблизительно 30 мМ до приблизительно 100 мМ, от приблизительно 30 мМ до приблизительно 90 мМ, от приблизительно 30 мМ до приблизительно 80 мМ, от приблизительно 30 мМ до приблизительно 70 мМ, от приблизительно 30 мМ до приблизительно 60 мМ, от приблизительно 30 мМ до приблизительно 50 мМ, от приблизительно 30 мМ до приблизительно 40 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от 50 мМ до приблизительно 120 мМ, от приблизительно 55 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 80 мМ, от приблизительно 70 мМ до приблизительно 100 мМ или от приблизительно 70 мМ до приблизительно 80 мМ фармацевтически приемлемой соли (определение которой приведено ранее). В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 70 мМ до приблизительно 90 мМ, от приблизительно 50 мМ до приблизительно 70 мМ или от приблизительно 20 мМ до приблизительно 40 мМ фармацевтически приемлемой соли. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 0 мМ до приблизительно 100 мМ, от приблизительно 0 мМ до приблизительно 80 мМ, от приблизительно 0 мМ до приблизительно 70 мМ, от приблизительно 0 мМ до приблизительно 60 мМ, от приблизительно 0 мМ до приблизительно 50 мМ, от приблизительно 0 мМ до приблизительно 40 мМ, от приблизительно 0 мМ до приблизительно 30 мМ, от приблизительно 0 мМ до приблизительно 20 мМ, от приблизительно 0 мМ до приблизительно 10 мМ, от приблизительно 0 мМ до приблизительно 5 мМ фармацевтически приемлемой соли. Согласно иллюстративным аспектам, фармацевтическая композиция содержит приблизительно 0 мМ, приблизительно 5 мМ, приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 55 мМ, приблизительно 60 мМ, приблизительно 65 мМ, приблизительно 70 мМ, приблизительно 75 мМ, приблизительно 80 мМ, приблизительно 85 мМ, приблизительно 90 мМ, приблизительно 95 мМ, приблизительно 100 мМ, приблизительно 105 мМ, приблизительно 110 мМ, приблизительно 115 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 135 мМ, приблизительно 140 мМ, приблизительно 145 мМ, или приблизительно 150 мМ фармацевтически приемлемой соли. В соответствии с другими вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ, от приблизительно 5 мМ до менее чем приблизительно 100 мМ, от приблизительно 10 мМ до менее чем приблизительно 100 мМ, от приблизительно 20 мМ до менее чем приблизительно 100 мМ, от приблизительно 30 мМ до менее чем приблизительно 100 мМ, от приблизительно 40 мМ до менее чем приблизительно 100 мМ, от приблизительно 50 мМ до менее чем приблизительно 100 мМ, от приблизительно 60 мМ до менее чем приблизительно 100 мМ или от приблизительно 70 мМ до менее чем приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 0 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 30 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 40 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 50 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 60 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 70 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 80 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой натриевую соль (например, хлорид натрия).
[0055] Преимущественно было обнаружено, что фармацевтические композиции, содержащие фармацевтически приемлемую соль в субфизиологической концентрации, формируют компактные лиофилизаты с более низким содержанием влаги и способствуют формирования улучшенного лиофилизата. В соответствии с определенными вариантами осуществления, субфизиологическая концентрация фармацевтически приемлемой соли приводит к образованию белых, компактных и гомогенных лиофилизатов. Следовательно, в соответствии с определенными вариантами осуществления, настоящее раскрытие относится к фармацевтическим композициям с низким содержанием соли, содержащей фармацевтически приемлемую соль в субфизиологической концентрации, например, менее чем приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с одним вариантом осуществления, представленный в настоящем документе состав с низким содержанием соли содержит менее чем приблизительно 100 мМ фармацевтической соли. В соответствии с определенными вариантами осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 80 мМ фармацевтической соли. В соответствии с определенными вариантами осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 70 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 60 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 50 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 40 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 30 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 20 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, представленная в настоящем документе фармацевтическая композиция с низким содержанием соли содержит менее чем приблизительно 10 мМ фармацевтической соли. В соответствии с другим вариантом осуществления, фармацевтическая композиция с низким содержанием соли содержит от приблизительно 30 мМ до приблизительно 60 мМ фармацевтически приемлемой соли. В соответствии с еще другими вариантами осуществления, фармацевтическая композиция с низким содержанием соли содержит приблизительно 0 мМ, приблизительно 5 мМ, приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 55 мМ, приблизительно 60 мМ, приблизительно 65 мМ, приблизительно 70 мМ, приблизительно 75 мМ, приблизительно 80 мМ, приблизительно 85 мМ, приблизительно 90 мМ, приблизительно 95 мМ или приблизительно 100 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 0 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 30 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 40 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 50 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 60 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 70 мМ фармацевтически приемлемой соли. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 80 мМ фармацевтически приемлемой соли. В соответствии с предпочтительным вариантом осуществления, фармацевтическая композиция с низким содержанием соли представляет собой лиофилизированный состав. В соответствии с предпочтительным вариантом осуществления, соль представляет собой натриевую соль (например, хлорид натрия).
[0056] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 0 мМ до приблизительно 150 мМ, от приблизительно 5 мМ до приблизительно 150 мМ, от приблизительно 5 мМ до приблизительно 100 мМ, от приблизительно 5 мМ до приблизительно 90 мМ, от приблизительно 5 мМ до приблизительно 80 мМ, от приблизительно 5 мМ до приблизительно 70 мМ, от приблизительно 5 мМ до приблизительно 60 мМ, от приблизительно 5 мМ до приблизительно 50 мМ, от приблизительно 5 мМ до приблизительно 40 мМ, от 5 мМ до приблизительно 30 мМ, от приблизительно 30 мМ до приблизительно 100 мМ, от приблизительно 30 мМ до приблизительно 90 мМ, от приблизительно 30 мМ до приблизительно 80 мМ, от приблизительно 30 мМ до приблизительно 70 мМ, от приблизительно 30 мМ до приблизительно 60 мМ, от приблизительно 30 мМ до приблизительно 50 мМ, от приблизительно 30 мМ до приблизительно 40 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от 50 мМ до приблизительно 120 мМ, от приблизительно 55 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 80 мМ, от приблизительно 70 мМ до приблизительно 100 мМ или от приблизительно 70 мМ до приблизительно 80 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 70 мМ до приблизительно 90 мМ, от приблизительно 50 мМ до приблизительно 70 мМ или от приблизительно 20 мМ до приблизительно 40 мМ хлорида натрия. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 0 мМ до приблизительно 100 мМ, от приблизительно 0 мМ до приблизительно 80 мМ, от приблизительно 0 мМ до приблизительно 70 мМ, от приблизительно 0 мМ до приблизительно 60 мМ, от приблизительно 0 мМ до приблизительно 50 мМ, от приблизительно 0 мМ до приблизительно 40 мМ, от приблизительно 0 мМ до приблизительно 30 мМ, от приблизительно 0 мМ до приблизительно 20 мМ, от приблизительно 0 мМ до приблизительно 10 мМ, от приблизительно 0 мМ до приблизительно 5 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 100 мМ, менее чем приблизительно 80 мМ, менее чем приблизительно 70 мМ или менее чем приблизительно 60 мМ хлорида натрия. В соответствии с другими вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до менее чем приблизительно 100 мМ, от приблизительно 5 мМ до менее чем приблизительно 100 мМ, от приблизительно 10 мМ до менее чем приблизительно 100 мМ, от приблизительно 20 мМ до менее чем приблизительно 100 мМ, от приблизительно 30 мМ до менее чем приблизительно 100 мМ, от приблизительно 40 мМ до менее чем приблизительно 100 мМ, от приблизительно 50 мМ до менее чем приблизительно 100 мМ, от приблизительно 60 мМ до менее чем приблизительно 100 мМ или от приблизительно 70 мМ до менее чем приблизительно 100 мМ хлорида натрия. Согласно иллюстративным аспектам, фармацевтическая композиция содержит приблизительно 0 мМ, приблизительно 5 мМ, приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 55 мМ, приблизительно 60 мМ, приблизительно 65 мМ, приблизительно 70 мМ, приблизительно 75 мМ, приблизительно 80 мМ, приблизительно 85 мМ, приблизительно 90 мМ, приблизительно 95 мМ, приблизительно 100 мМ, приблизительно 105 мМ, приблизительно 110 мМ, приблизительно 115 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 135 мМ, приблизительно 140 мМ, приблизительно 145 мМ или приблизительно 150 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 0 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 10 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 20 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 30 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 40 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 50 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 60 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 70 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 80 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 100 мМ хлорида натрия.
[0057] Также было обнаружено, что включение неионогенного поверхностно-активного вещества существенно снижает потери AAV на поверхностях и предотвращает формирование видимых частиц фармацевтических композиций. Следовательно, в соответствии с определенными вариантами осуществления, настоящее изобретение относится к фармацевтическим композициям, содержащим неионогенный детергент в стабилизирующей концентрации. Фармацевтически приемлемые неионогенные поверхностно-активные вещества, которые можно применять в составах, раскрытых в настоящем документе, известны в области фармацевтики и включают без ограничения полисорбат 80 (твин 80; PS80), полисорбат 20 (твин 20; PS20) и различные полоксамеры или плюроники, в том числе плюроник F-68 и BRIJ 35 или их смеси. В соответствии с предпочтительным вариантом осуществления, неионогенным поверхностно-активным веществом, применяемым в настоящих фармацевтических композициях, является полисорбат 80. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит Super Refined™ PS80, коммерчески доступный от Croda Health Care (Снейт, Великобритания).
[0058] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) или от приблизительно 0,0025% (масса/объем) до приблизительно 0,0075% (масса/объем) неионогенного поверхностно-активного вещества. Согласно иллюстративным аспектам, фармацевтическая композиция содержит приблизительно 0,001% (масса/объем), приблизительно 0,0015% (масса/объем), приблизительно 0,002% (масса/объем), приблизительно 0,0025% (масса/объем), приблизительно 0,003% (масса/объем), приблизительно 0,0035% (масса/объем), приблизительно 0,004% (масса/объем), приблизительно 0,0045% (масса/объем), приблизительно 0,005% (масса/объем), приблизительно 0,0055% (масса/объем), приблизительно 0,006% (масса/объем), приблизительно 0,0065% (масса/объем), приблизительно 0,007% (масса/объем), приблизительно 0,0075% (масса/объем), приблизительно 0,008% (масса/объем), приблизительно 0,0085% (масса/объем), приблизительно 0,009% (масса/объем), приблизительно 0,0095% (масса/объем), приблизительно 0,001% (масса/объем) неионогенного поверхностно-активного вещества. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества.
[0059] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) или от приблизительно 0,0025% (масса/объем) до приблизительно 0,0075% (масса/объем) полисорбата 80 (например, Super Refined™ PS80). Согласно иллюстративным аспектам, фармацевтическая композиция содержит приблизительно 0,001% (масса/объем), приблизительно 0,0015% (масса/объем), приблизительно 0,002% (масса/объем), приблизительно 0,0025% (масса/объем), приблизительно 0,003% (масса/объем), приблизительно 0,0035% (масса/объем), приблизительно 0,004% (масса/объем), приблизительно 0,0045% (масса/объем), приблизительно 0,005% (масса/объем), приблизительно 0,0055% (масса/объем), приблизительно 0,006% (масса/объем), приблизительно 0,0065% (масса/объем), приблизительно 0,007% (масса/объем), приблизительно 0,0075% (масса/объем), приблизительно 0,008% (масса/объем), приблизительно 0,0085% (масса/объем), приблизительно 0,009% (масса/объем), приблизительно 0,0095% (масса/объем), приблизительно 0,001% (масса/объем) PS80. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 0,005% (масса/объем) PS80.
[0060] Было обнаружено, что включение умеренных уровней (т.е. от приблизительно 1% до приблизительно 10%) одного или нескольких сахаров и/или сахароспиртов способствует поддержанию стабильности жидких и/или лиофилизированных составов. Например, сахар и/или сахароспирт обеспечивают лучшие свойства во время циклов замораживания/оттаивания. Следовательно, в соответствии с определенными вариантами осуществления, настоящее изобретение относится к фармацевтическим композициям, содержащим от приблизительно 2% до приблизительно 10% одного или нескольких сахаров и/или сахароспиртов. Можно использовать любой сахар, такой как моно-, ди- или полисахариды или водорастворимые глюканы, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, декстран, трегалозу, пуллулан, декстрин, циклодекстрин, растворимый крахмал, гидроксиэтилкрахмал и карбоксиметилцеллюлозу. В соответствии с конкретным вариантом осуществления, сахар представляет собой сахарозу, трегалозу или их комбинацию. В соответствии с определенными вариантами осуществления, трегалоза представляет собой дигидрат трегалозы. Сахароспирты определяют как углеводород, имеющий от приблизительно 4 до приблизительно 8 атомов углерода и гидроксильную группу. Неограничивающие примеры сахароспиртов, которые можно применять в фармацевтических композициях, представленных в настоящем документе, включают маннит, сорбит, инозит, галактит, дульцит, ксилит и арабит. В соответствии с определенными вариантами осуществления, в качестве сахароспиртовой добавки применяют маннит. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит как сахар, так и сахароспиртовую добавку.
[0061] Сахара и сахароспирты можно применять в отдельности или в комбинации. В соответствии с некоторыми вариантами осуществления сахар, сахароспирт или их комбинация будут присутствовать в состав в концентрации от приблизительно 1% до приблизительно 10% (масса/объем), от приблизительно 1% (масса/объем) до приблизительно 1,5% (масса/объем), от приблизительно 2,5% до приблизительно 7,5% (масса/объем) или от приблизительно 1% до приблизительно 5% (масса/объем). Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 1,0% (масса/объем), приблизительно 1,1% (масса/объем), приблизительно 1,2% (масса/объем), приблизительно 1,3% (масса/объем), приблизительно 1,4% (масса/объем), приблизительно 1,5% (масса/объем), приблизительно 1,6% (масса/объем), приблизительно 1,7% (масса/объем), приблизительно 1,8% (масса/объем), приблизительно 1,9% (масса/объем), приблизительно 2,0% (масса/объем), приблизительно 2,5% (масса/объем), приблизительно 3,0% (масса/объем), приблизительно 3,5% (масса/объем), приблизительно 4,0% (масса/объем), приблизительно 4,5% (масса/объем), приблизительно 5,0% (масса/объем), приблизительно 5,5% (масса/объем), приблизительно 6,0% (масса/объем), приблизительно 6,5% (масса/объем), приблизительно 7,0% (масса/объем), приблизительно 7,5% (масса/объем), приблизительно 8,0% (масса/объем), приблизительно 8,5% (масса/объем), приблизительно 9,0% (масса/объем), приблизительно 9,5% (масса/объем) или приблизительно 10% (масса/объем) сахара, сахароспирта или их комбинации. В соответствии с определенными вариантами осуществления, сахар представляет собой сахарозу, трегалозу или их комбинацию. В соответствии с определенными вариантами осуществления, трегалоза представляет собой дигидрат трегалозы.
[0062] В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 1% до приблизительно 10% (масса/объем), от приблизительно 1% (масса/объем) до приблизительно 1,5% (масса/объем), от приблизительно 2,5% до приблизительно 7,5% (масса/объем) или от приблизительно 1% до приблизительно 5% (масса/объем) сахарозы, трегалозы или их комбинации. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 1,0% (масса/объем), приблизительно 1,1% (масса/объем), приблизительно 1,2% (масса/объем), приблизительно 1,3% (масса/объем), приблизительно 1,4% (масса/объем), приблизительно 1,5% (масса/объем), приблизительно 1,6% (масса/объем), приблизительно 1,7% (масса/объем), приблизительно 1,8% (масса/объем), приблизительно 1,9% (масса/объем), приблизительно 2,0% (масса/объем), приблизительно 2,5% (масса/объем), приблизительно 3,0% (масса/объем), приблизительно 3,5% (масса/объем), приблизительно 4,0% (масса/объем), приблизительно 4,5% (масса/объем), приблизительно 5,0% (масса/объем), приблизительно 5,5% (масса/объем), приблизительно 6,0% (масса/объем), приблизительно 6,5% (масса/объем), приблизительно 7,0% (масса/объем), приблизительно 7,5% (масса/объем), приблизительно 8,0% (масса/объем), приблизительно 8,5% (масса/объем), приблизительно 9,0% (масса/объем), приблизительно 9,5% (масса/объем), или приблизительно 10% (масса/объем) сахарозы, трегалозы или их комбинации. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 1,3% (масса/объем) сахарозы, трегалозы или их комбинации. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 5% (масса/объем) сахарозы, трегалозы или их комбинации. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от 10 мМ до приблизительно 150 мМ, от приблизительно 30 мМ до приблизительно 40 мМ или от приблизительно 35 мМ до приблизительно 132 мМ сахарозы, трегалозы или их комбинации. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 55 мМ, приблизительно 60 мМ, приблизительно 65 мМ, приблизительно 70 мМ, приблизительно 75 мМ, приблизительно 80 мМ, приблизительно 85 мМ, приблизительно 90 мМ, приблизительно 95 мМ, приблизительно 100 мМ, приблизительно 110 мМ, приблизительно 120 мМ, приблизительно 130 мМ, приблизительно 140 мМ или приблизительно 150 мМ сахарозы, трегалозы или их комбинации. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 35 мМ сахарозы, трегалозы или их комбинации. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 132 мМ сахарозы, трегалозы или их комбинации. Согласно иллюстративным аспектам, трегалоза представляет собой дигидрат трегалозы.
[0063] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нM до приблизительно 100 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нM до приблизительно 100 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 5 нM до приблизительно 150 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 50 нM до приблизительно 150 мM. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой хлорид натрия.
[0064] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию дополнительно содержит глицин. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 30 мМ до приблизительно 70 мМ, от приблизительно 35 мМ до приблизительно 65 мМ глицина, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ глицина. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 55 мМ, приблизительно 60 мМ, приблизительно 65 мМ или приблизительно 70 мМ глицина. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию дополнительно содержит приблизительно 50 мМ глицина.
[0065] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию дополнительно содержит маннит. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит от приблизительно 50 мМ до приблизительно 150 мМ, от приблизительно 60 мМ до приблизительно 140 мМ, от приблизительно 70 мМ до приблизительно 130 мМ, от приблизительно 80 мМ до приблизительно 120 мМ или от приблизительно 90 мМ до приблизительно 110 мМ маннита. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит приблизительно 110 мМ маннита. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит глицин или маннит, но не одновременно глицин и маннит.
[0066] В соответствии с другими вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нM до приблизительно 100 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нM до приблизительно 100 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 5 нM до приблизительно 150 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 50 нМ до приблизительно 150 мM. В соответствии с конкретными вариантами осуществления сахар и/или сахароспирт представляет собой сахарозу, трегалозу, маннит и их комбинацию. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой хлорид натрия.
[0067] В соответствии с другими вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нM до приблизительно 100 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нM до приблизительно 100 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 5 нM до приблизительно 150 мM. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 50 нM до приблизительно 150 мM. В соответствии с определенными вариантами осуществления, неионогенное поверхностно-активное вещество представляет собой полисорбат 20, полисорбат 80, плюроник F-68, BRIJ 35 и их комбинацию. В соответствии с определенными вариантами осуществления, сахар и/или сахароспирт представляет собой сахарозу, трегалозу, маннит и их комбинацию. В соответствии с определенными вариантами осуществления, неионогенным поверхностно-активным веществом является PS80. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой хлорид натрия.
[0068] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, менее чем приблизительно 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нМ до менее чем приблизительно 100 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нМ до приблизительно 80 мМ, от приблизительно 0 нМ до приблизительно 70 мМ, от приблизительно 0 мМ до приблизительно 60 мМ, от приблизительно 0 мМ до приблизительно 50 мМ, от приблизительно 0 мМ до приблизительно 40 мМ, от 0 мМ до приблизительно 30 мМ, от приблизительно 0 мМ до приблизительно 20 мМ или от 0 мМ до приблизительно 10 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нМ до менее чем приблизительно 100 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нМ до приблизительно 80 мМ, от приблизительно 30 нМ до приблизительно 70 мМ, от приблизительно 30 мМ до приблизительно 60 мМ, от приблизительно 30 мМ до приблизительно 50 мМ или от приблизительно 30 мМ до приблизительно 40 мM. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой хлорид натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит глицин или маннит, но не одновременно глицин и/или маннит. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит глицин или маннит, но не одновременно глицин и маннит. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0069] В соответствии с другими вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, менее чем приблизительно 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нМ до менее чем приблизительно 100 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нМ до приблизительно 80 мМ, от приблизительно 0 нМ до приблизительно 70 мМ, от приблизительно 0 мМ до приблизительно 60 мМ, от приблизительно 0 мМ до приблизительно 50 мМ, от приблизительно 0 мМ до приблизительно 40 мМ, от 0 мМ до приблизительно 30 мМ, от приблизительно 0 мМ до приблизительно 20 мМ или от 0 мМ до приблизительно 10 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нМ до менее чем приблизительно 100 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нМ до приблизительно 80 мМ, от приблизительно 30 нМ до приблизительно 70 мМ, от приблизительно 30 мМ до приблизительно 60 мМ, от приблизительно 30 мМ до приблизительно 50 мМ или от приблизительно 30 мМ до приблизительно 40 мM. В соответствии с определенными вариантами осуществления, сахар и/или сахароспирт представляет собой сахарозу, трегалозу, маннит и их комбинацию. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой хлорид натрия. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0070] В соответствии с другими вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, менее чем приблизительно 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нМ до менее чем приблизительно 100 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 0 нМ до приблизительно 80 мМ, от приблизительно 0 нМ до приблизительно 70 мМ, от приблизительно 0 мМ до приблизительно 60 мМ, от приблизительно 0 мМ до приблизительно 50 мМ, от приблизительно 0 мМ до приблизительно 40 мМ, от 0 мМ до приблизительно 30 мМ, от приблизительно 0 мМ до приблизительно 20 мМ или от 0 мМ до приблизительно 10 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нМ до менее чем приблизительно 100 мМ. В соответствии с определенными вариантами осуществления, содержание фармацевтически приемлемой соли составляет от приблизительно 30 нМ до приблизительно 80 мМ, от приблизительно 30 нМ до приблизительно 70 мМ, от приблизительно 30 мМ до приблизительно 60 мМ, от приблизительно 30 мМ до приблизительно 50 мМ или от приблизительно 30 мМ до приблизительно 40 мM. В соответствии с определенными вариантами осуществления, неионогенное поверхностно-активное вещество представляет собой полисорбат 20, полисорбат 80, плюроник F-68, BRIJ 35 и их комбинацию. В соответствии с определенными вариантами осуществления, сахар и/или сахароспирт представляет собой сахарозу, трегалозу, маннит и их комбинацию. В соответствии с определенными вариантами осуществления, неионогенным поверхностно-активным веществом является PS80. В соответствии с определенными вариантами осуществления, фармацевтически приемлемая соль представляет собой хлорид натрия. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0071] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы.
[0072] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до менее чем приблизительно 100 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0073] Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию содержит аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 30 мМ до приблизительно 80 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0074] В соответствии с определенными вариантами осуществления, настоящее изобретение относится к фармацевтическим композициям с более низким содержанием соли, содержащим аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию дополнительно содержит от приблизительно 30 мМ до приблизительно 70 мМ глицина. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0075] В соответствии с определенными вариантами осуществления, настоящее изобретение относится к фармацевтическим композициям с более низким содержанием соли, содержащим аденоассоциированный вирус (AAV) и от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до менее чем приблизительно 100 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию дополнительно содержит от приблизительно 30 мМ до приблизительно 70 мМ глицина. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 80 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 70 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 60 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 50 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 40 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит менее чем приблизительно 30 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до приблизительно 80 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до приблизительно 70 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до приблизительно 60 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до приблизительно 50 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до приблизительно 40 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 0 мМ до приблизительно 30 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 30 мМ до приблизительно 80 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 30 мМ до приблизительно 70 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 30 мМ до приблизительно 60 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 30 мМ до приблизительно 50 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, фармацевтическая композиция содержит от приблизительно 30 мМ до приблизительно 40 мМ хлорида натрия. В соответствии с определенными вариантами осуществления, состав представляет собой жидкий состав. В соответствии с определенными вариантами осуществления, состав представляет собой лиофилизированный состав. В соответствии с определенными вариантами осуществления, фармацевтическая композиция с более низким содержанием соли представляет собой лиофилизированный состав.
[0076] Настоящее раскрытие также относится к фармацевтической композиции, содержащей аденоассоциированный вирус (AAV) и приблизительно 20 мМ L-гистидина, приблизительно 70 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80) и приблизительно 5% (масса/объем) сахарозы. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,5±0,2, и/или осмоляльность составляет приблизительно 300±10 мосмоль/кг.
[0077] Настоящее раскрытие дополнительно относится к фармацевтической композиции, содержащей аденоассоциированный вирус (AAV) и приблизительно 20 мМ L-гистидина, приблизительно 60 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 35 мМ трегалозы и приблизительно 110 мМ маннита. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2, и/или осмоляльность составляет приблизительно 390±10 мосмоль/кг. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2, и/или осмоляльность составляет приблизительно 290±10 мосмоль/кг.
[0078] Настоящее раскрытие дополнительно относится к фармацевтической композиции, содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 100 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2, и/или осмоляльность составляет приблизительно 400±10 мосмоль/кг.
[0079] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 80 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0080] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 70 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0081] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 60 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0082] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 50 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0083] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 40 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0084] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 30 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0085] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 20 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0086] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 10 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0087] Настоящее раскрытие дополнительно относится к фармацевтической композиции, которая может быть жидкой или лиофилизированной (например, лиофилизированной из жидкого состава), содержащей аденоассоциированный вирус (AAV) и приблизительно 10 мМ L-гистидина, приблизительно 0 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0±0,2.
[0088] Дополнительные компоненты
[0089] В соответствии с иллюстративными вариантами осуществления, составы или фармацевтические композиции по настоящему раскрытию содержат дополнительные фармацевтически приемлемые ингредиенты. Согласно иллюстративным аспектам, составы или фармацевтические композиции содержат любой один или комбинацию из следующих: подкисляющие средства, добавки, адсорбенты, аэрозольные пропелленты, средства для вытеснения воздуха, подщелачивающие средства, антиадгезивные средства, антикоагулянты, противомикробные консерванты, антиоксиданты, антисептики, основания, связующие, буферные средства, хелатирующие средства, покрывающие средства, красящие средства, осушители, детергенты, разбавители, дезинфицирующие средства, разрыхлители, диспергирующие средства, усиливающие растворение средства, красители, смягчающие вещества, эмульгаторы, стабилизаторы эмульсии, наполнители, пленкообразующие средства, усилители вкуса, ароматизаторы, усилители текучести, желирующие средства, гранулирующие средства, увлажнители, смазки, мукоадгезивы, мазевые основы, мази, маслянистые среды, органические основы, основы для пастилок, пигменты, пластификаторы, полирующие средства, консерванты, секвестранты, вещества, усиливающие проникновение в кожу, солюбилизирующие средства, растворители, стабилизирующие средства, основы для суппозиториев, поверхностно-активные средства, поверхностно-активные вещества, суспендирующие средства, подсластители, терапевтические средства, загустители, тонизирующие средства, снижающие токсичность средства, повышающие вязкость средства, водопоглощающие средства, смешивающиеся с водой сорастворители, умягчители воды или увлажняющие средства. В соответствии с некоторыми вариантами осуществления, составы или фармацевтические композиции по настоящему раскрытию содержат любой один или комбинацию из следующих компонентов: камедь, ацесульфам калия, ацетилтрибутилцитрат, ацетилтриэтилцитрат, агар, альбумин, спирт, дегидратированный спирт, денатурированный спирт, разбавленный спирт, алевритовая кислота, альгиновая кислота, сложные алифатические полиэфиры, оксид алюминия, гидроксид алюминия, стеарат алюминия, амилопектин, α-амилоза, аскорбиновая кислота, аскорбилпальмитат, аспартам, бактериостатическая вода для инъекций, бентонит, бентонитовая магма, бензалкония хлорид, бензетония хлорид, бензойная кислота, бензиловый спирт, бензилбензоат, бронополь, бутилированный гидроксианизол, бутилированный гидрокситолуол, бутилпарабен, бутилпарабен натрия, альгинат кальция, аскорбат кальция, карбонат кальция, цикламат кальция, двухосновный безводный фосфат кальция, двухосновный дегидрат фосфата кальция, трехосновный фосфат кальция, пропионат кальция, силикат кальция, сорбат кальция, стеарат кальция, сульфат кальция, полугидрат сульфата кальция, масло канолы, карбомер, диоксид углерода, карбоксиметилцеллюлоза кальция, карбоксиметилцеллюлоза натрия, β-каротин, каррагенан, касторовое масло, гидрогенизированное касторовое масло, катионный эмульгирующий воск, ацетат целлюлозы, ацетатфталат целлюлозы, этилцеллюлоза, микрокристаллическая целлюлоза, порошкообразная целлюлоза, силицированная микрокристаллическая целлюлоза, карбоксиметилцеллюлоза натрия, цетостеариловый спирт, цетримид, цетиловый спирт, хлоргексидин, хлорбутанол, хлоркрезол, холестерин, ацетат хлоргексидина, глюконат хлоргексидина, гидрохлорид хлоргексидина, дифтормонохлорэтан (HCFC), хлордифторметан, хлорфторуглероды (CFC), хлорфеноксиэтанол, хлороксиленол, твердые вещества кукурузного сиропа, безводная лимонная кислота, моногидрат лимонной кислоты, какао-масло, красители, кукурузное масло, хлопковое масло, крезол, м-крезол, о-крезол, п-крезол, кроскармеллоза натрия, кросповидон, цикламовая кислота, циклодекстрины, декстраты, декстрин, декстроза, безводная декстроза, диазолидинилмочевина, дибутилфталат, дибутилсебацат, диэтаноламин, диэтилфталат, дифторэтан (HFC), диметил-β-циклодекстрин, соединения циклодекстринового типа, такие как Captisol®, простой диметиловый эфир, диметилфталат, эдентат дикалия, эдентат динатрия, гидрофосфат динатрия, докузат кальция, докузат калия, докузат натрия, додецилгаллат, бромид додецилтриметиламмония, динатрийдентат кальция, эдоновая кислота, эглумин, этиловый спирт, этилцеллюлоза, этилгаллат, этиллаурат, этилмальтол, этилолеат, этилпарабен, этилпарабен калия, этилпарабен натрия, этилванилин, фруктоза, жидкая фруктоза, измельченная фруктоза, апирогенная фруктоза, порошкообразная фруктоза, фумаровая кислота, желатин, глюкоза, жидкая глюкоза, глицеридные смеси насыщенных растительных жирных кислот, глицерин, глицерилбегенат, глицерилмоноолеат, глицерилмоностеарат, самоэмульгирующийся глицерилмоностеарат, глицерилпальмитостеарат, глицин, гликоли, гликофурол, гуаровая камедь, гептафторпропан (HFC), гексадецилтриметиламмония бромид, фруктозный сироп, человеческий сывороточный альбумин, углеводороды (HC), разбавленная соляная кислота, гидрогенизированное растительное масло II типа, гидроксиэтилцеллюлоза, 2-гидроксиэтил-β-циклодекстрин, гидроксипропилцеллюлоза, низкозамещенная гидроксипропилцеллюлоза, 2-гидроксипропил-β-циклодекстрин, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, имидочевина, индигокармин, ионообменники, оксиды железа, изопропиловый спирт, изопропилмиристат, изопропилпальмитат, изотонический солевой раствор, каолин, молочная кислота, лактит, лактоза, ланолин, спирты ланолина, безводный ланолин, лецитин, алюмосиликат магния, карбонат магния, обычный карбонат магния, безводный карбонат магния, гидроксид карбоната магния, гидроксид магния, лаурилсульфат магния, оксид магния, силикат магния, стеарат магния, трисиликат магния, безводный трисиликат магния, яблочная кислота, солод, мальтит, раствор мальтита, мальтодекстрин, мальтол, мальтоза, маннит, триглицериды со средней длиной цепи, меглюмин, ментол, метилцеллюлоза, метилметакрилат, метилолеат, метилпарабен, метилпарабен калия, метилпарабен натрия, микрокристаллическая целлюлоза и карбоксиметилцеллюлоза натрия, минеральное масло, легкое минеральное масло, минеральное масло и спирты ланолина, масло, оливковое масло, моноэтаноламин, монтмориллонит, октилгаллат, олеиновая кислота, пальмитиновая кислота, парафин, арахисовое масло, вазелиновое масло, вазелиновые и ланолиновые спирты, фармацевтическая глазурь, фенол, сжиженный фенол, феноксиэтанол, феноксипропанол, фенилэтиловый спирт, ацетат фенилртути, борат фенилртути, нитрат фенилртути, полакрилин, полакрилин калия, полоксамер, полидекстроза, полиэтиленгликоль, полиэтиленоксид, полиакрилаты, блок-сополимеры из полиэтилена и полиоксипропилена, полиметакрилаты, простые полиоксиэтиленалкиловые эфиры, полиоксиэтиленовые производные касторового масла, сложные эфиры полиоксиэтиленсорбитола и жирных кислот, полиоксиэтиленстеараты, поливиниловый спирт, поливинилпирролидон, альгинат калия, бензоат калия, бикарбонат калия, бисульфит калия, хлорид калия, цитрат калия, безводный цитрат калия, гидрофосфат калия, метабисульфит калия, одноосновный фосфат калия, пропионат калия, сорбат калия, повидон, пропанол, пропионовая кислота, пропиленкарбонат, пропиленгликоль, пропиленгликоля альгинат, пропилгаллат, пропилпарабен, пропилпарабен калия, пропилпарабен натрия, протаминсульфат, рапсовое масло, раствор Рингера, сахарин, сахарин-аммоний, сахарин-кальций, сахарин-натрий, сафлоровое масло, сапонит, сывороточные белки, кунжутное масло, коллоидный кремнезем, коллоидный диоксид кремния, альгинат натрия, аскорбат натрия, бензоат натрия, бикарбонат натрия, бисульфит натрия, хлорид натрия, безводный цитрат натрия, дегидрат цитрата натрия, хлорид натрия, цикламат натрия, эдентат натрия, додецилсульфат натрия, лаурилсульфат натрия, метабисульфит натрия, двухосновный фосфат натрия, одноосновный фосфат натрия, трехосновный фосфат натрия, безводный пропионат натрия, пропионат натрия, сорбат натрия, крахмалгликолят натрия, стеарилфумарат натрия, сульфит натрия, сорбиновая кислота, сложные эфиры сорбита (сложные эфиры сорбита и жирных кислот), сорбит, 70% раствор сорбита, соевое масло, спермацетовый воск, крахмал, кукурузный крахмал, картофельный крахмал, клейстеризованный крахмал, стерилизуемый маисовый крахмал, стеариновая кислота, очищенная стеариновая кислота, стеариловый спирт, сахароза, сахара, сгущенный сахар, сахарная пудра, сахарные сферы, инвертированный сахар, Sugartab, желтый солнечного заката FCF, синтетический парафин, тальк, винная кислота, тартразин, тетрафторэтан (HFC), масло какао, тимеросал, диоксид титана, альфа-токоферол, токоферилацетат, сукцинат альфа-токофериловой кислоты, бета-токоферол, дельта-токоферол, гамма-токоферол, трагакант, триацетин, трибутилцитрат, триэтаноламин, триэтилцитрат, триметил-β-циклодекстрин, бромид триметилтетрадециламмония, трис-буфер, тринатриевый эдентат, ванилин, гидрогенизированное растительное масло I типа, вода, мягкая вода, жесткая вода, вода без диоксида углерода, апирогенная вода, инъекционная вода, стерильная вода для ингаляций, стерильная вода для инъекций, стерильная вода для орошения, разновидности воска, анионный эмульгирующий воск, карнаубский воск, катионный эмульгирующий воск, воск цетиловых эфиров, микрокристаллический воск, неионогенный эмульгирующий воск, воск для суппозиториев, белый воск, желтый воск, белый вазелин, шерстяной жир, ксантановая камедь, ксилит, зеин, пропионат цинка, соли цинка, стеарат цинка или любое вспомогательное вещество из публикации Handbook of Pharmaceutical Excipients, Third Edition, A. H. Kibbe (Pharmaceutical Press, London, UK, 2000), которая включена посредством ссылки во всей своей полноте. В публикации Remington’s Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980), которая включена посредством ссылки во всей своей полноте для всех предполагаемых целей, раскрыты различные компоненты, применяемые при составлении фармацевтически приемлемых композиций, и известные методики для их получения. В фармацевтических композициях предусмотрено применение любого общеизвестного средства, за исключением случаев, когда оно несовместимо с фармацевтическими композициями. В соответствии с иллюстративными вариантами осуществления, составы или фармацевтические композиции по настоящему раскрытию не содержат один описанный выше ингредиент или комбинацию из описанных выше ингредиентов. В соответствии с иллюстративными вариантами осуществления, составы или фармацевтические композиции по настоящему раскрытию не содержат ни один из таких ингредиентов. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию не содержит декстран. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию не содержит хлорид кальция.
[0090] pH
[0091] В соответствии с иллюстративными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию имеет физиологически совместимый pH. Следовательно, в соответствии с определенными вариантами осуществления, настоящее изобретение относится к составам с AAV, которые содержат буферное средство, подходящее для поддержания у состава нейтрального pH.
[0092] Согласно иллюстративным аспектам, pH фармацевтической композиции составляет от приблизительно 6,5 до приблизительно 9,0, от приблизительно 6,5 до приблизительно 8,0, от приблизительно 6,9 до приблизительно 7,7 или от приблизительно 7,0 до приблизительно 7,5. В соответствии с определенными вариантами осуществления, pH состава составляет приблизительно 6,5 или приблизительно 6,6, приблизительно 6,7, приблизительно 6,8, приблизительно 6,9, приблизительно 7,0, приблизительно 7,1, приблизительно 7,2, приблизительно 7,3, приблизительно 7,4, приблизительно 7,5, приблизительно 7,6, приблизительно 7,7, приблизительно 7,8, приблизительно 7,9, приблизительно 8,0, приблизительно 8,1, приблизительно 8,2, приблизительно 8,3, приблизительно 8,4, приблизительно 8,5, приблизительно 8,6, приблизительно 8,7, приблизительно 8,8, приблизительно 8,9 или приблизительно 9,0. Согласно иллюстративным аспектам, pH фармацевтической композиции составляет приблизительно 7,0 или приблизительно 7,5. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,0. В соответствии с определенными вариантами осуществления, pH фармацевтической композиции составляет приблизительно 7,5.
[0093] Осмоляльность
[0094] В соответствии с иллюстративными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию имеет осмоляльность от приблизительно 200 до приблизительно 400 мосмоль/кг, от приблизительно 250 до приблизительно 400 мосмоль/кг или от приблизительно 290 до приблизительно 390 мосмоль/кг. В соответствии с определенными вариантами осуществления, представленный в настоящем документе состав с AAV состав будет иметь осмоляльность, например, приблизительно 200 мосмоль/л, приблизительно 210 мосмоль/л, приблизительно 220 мосмоль/л, приблизительно 230 мосмоль/л, приблизительно 240 мосмоль/л, приблизительно 250 мосмоль/л, приблизительно 260 мосмоль/л, приблизительно 270 мосмоль/л, приблизительно 280 мосмоль/л, приблизительно 290 мосмоль/л, приблизительно 300 мосмоль/л, приблизительно 310 мосмоль/л, приблизительно 320 мосмоль/л, приблизительно 330 мосмоль/л, приблизительно 340 мосмоль/л, приблизительно 350 мосмоль/л, приблизительно 360 мосмоль/л, приблизительно 370 мосмоль/л, приблизительно 380 мосмоль/л, приблизительно 390 мосмоль/л или приблизительно 400 мосмоль/л. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию имеет осмоляльность от приблизительно 250 мосмоль/кг до приблизительно 400 мосмоль/кг. Согласно иллюстративным аспектам, фармацевтическая композиция по настоящему раскрытию имеет осмоляльность приблизительно 300±10 мосмоль/кг или приблизительно 380±10 мосмоль/кг. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию имеет осмоляльность приблизительно 300±10 мосмоль/кг. В соответствии с определенными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию имеет осмоляльность приблизительно 380±10 мосмоль/кг.
[0095] Примеры изменяющих тоничность средств, которые можно применять в составах, представленных в настоящем документе, включают без ограничения хлорид натрия, декстрозу, сахарозу, ксилит, фруктозу, глицерин, сорбит, маннит, трегалозу, хлорид калия, маннозу, хлорид кальция, хлорид магния и другие неорганические соли, другие сахара, другие сахароспирты и их комбинации. В соответствии с определенными вариантами осуществления, состав с AAV может содержать по меньшей мере одно изменяющее тоничность средство или по меньшей мере два, три, четыре, пять или более изменяющих тоничность средств.
[0096] AAV
[0097] В соответствии с иллюстративными вариантами осуществления, фармацевтическая композиция по настоящему раскрытию содержит AAV. AAV может относиться к любому серотипу AAV. Согласно иллюстративным аспектам, AAV относится к серотипу AAV1, к серотипу AAV2, к серотипу AAV3, к серотипу AAV4, к серотипу AAV5, к серотипу AAV6, к серотипу AAV7, к серотипу AAV8, к серотипу AAV9 или к серотипу AAV10. Согласно иллюстративным аспектам, AAV относится к серотипу AAV8.
[0098] В соответствии с определенными вариантами осуществления, представленных в настоящем документе составов, AAV представляет собой rAAV, который описан в публикации заявки на выдачу патента США № 2017/0233455 и предварительной заявке № 62/509616, обе из которых включены в настоящий документ посредством ссылки во всей своей полноте и для всех целей.
[0099] Согласно иллюстративным аспектам, фармацевтическая композиция содержит высокий титр продукта с AAV. Согласно иллюстративным аспектам, фармацевтическая композиция содержит по меньшей мере приблизительно 1010 вирусных частиц (вч), или по меньшей мере приблизительно 1011 вирусных частиц (вч), или по меньшей мере приблизительно 1012 вирусных частиц (вч), или по меньшей мере приблизительно 1013 вирусных частиц (вч). Согласно иллюстративным аспектам, фармацевтическая композиция содержит по меньшей мере приблизительно 1014 вирусных частиц (вч) или по меньшей мере приблизительно 1015 вирусных частиц (вч), например, по меньшей мере приблизительно 2×1015 вирусных частиц (вч), по меньшей мере приблизительно 5×1015 вирусных частиц (вч). Фармацевтическая композиция также содержит приблизительно 1010 векторных геномов (вг), или по меньшей мере приблизительно 1011 векторных геномов (вг), или по меньшей мере приблизительно 1012 векторных геномов (вг), или по меньшей мере приблизительно 1013 векторных геномов (вг). Согласно иллюстративным аспектам, фармацевтическая композиция содержит по меньшей мере приблизительно 1014 векторных геномов (вг) или по меньшей мере приблизительно 1015 векторных геномов (вг), например, по меньшей мере приблизительно 2×1015 векторных геномов (вг), по меньшей мере приблизительно 5×1015 векторных геномов (вг).
[00100] Способы производства и применения
[00101] Дополнительно в настоящем документе представлены способы получения фармацевтической композиции, содержащей AAV. Согласно иллюстративным аспектам, способ предусматривает объединение в комбинацию от приблизительно 5 мМ до приблизительно 25 мМ буферного средства, от приблизительно 50 мМ до приблизительно 150 мМ или менее чем приблизительно 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества, от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта и AAV, таким образом получая фармацевтическую композицию, содержащую AAV. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего от приблизительно 5 мМ до приблизительно 25 мМ буферного средства, от приблизительно 50 мМ до приблизительно 150 мМ или менее чем приблизительно 100 мМ фармацевтически приемлемой соли, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) неионогенного поверхностно-активного вещества, от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахара и/или сахароспирта, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 20 мМ буферного средства, приблизительно 70 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества и приблизительно 5% (масса/объем) сахара и/или сахароспирта, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 100 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 80 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 70 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 60 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 50 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 40 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 30 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 20 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 10 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ буферного средства, приблизительно 0 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 5% (масса/объем) сахара и/или сахароспирта и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 20 мМ буферного средства, приблизительно 60 мМ фармацевтически приемлемой соли, приблизительно 0,005% (масса/объем) неионогенного поверхностно-активного вещества, приблизительно 35 мМ сахара и/или сахароспирта и приблизительно 110 мМ маннита, и добавление AAV к композиции. В соответствии с определенными вариантами осуществления, водный раствор лиофилизируют.
[00102] Дополнительно в настоящем документе представлены способы получения фармацевтической композиции, содержащей AAV. Согласно иллюстративным аспектам, способ предусматривает объединение в комбинацию от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80), от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы и AAV, таким образом получая фармацевтическую композицию, содержащую AAV. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 50 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% (масса/объем) до приблизительно 10% (масса/объем) сахарозы или трегалозы, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 20 мМ L-гистидина, приблизительно 70 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80) и приблизительно 5% (масса/объем) сахарозы, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 100 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 80 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 70 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 60 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 50 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 40 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 30 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 20 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 10 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 10 мМ L-гистидина, приблизительно 0 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 5% (масса/объем) трегалозы и приблизительно 50 мМ глицина, и добавление AAV к композиции. Согласно иллюстративным аспектам, способ предусматривает получение композиции, например, водного раствора, содержащего приблизительно 20 мМ L-гистидина, приблизительно 60 мМ хлорида натрия, приблизительно 0,005% (масса/объем) полисорбата 80 (PS80), приблизительно 35 мМ трегалозы и приблизительно 110 мМ маннита, и добавление AAV к композиции. В соответствии с определенными вариантами осуществления, водный раствор лиофилизируют.
[00103] В соответствии с определенными вариантами осуществления, лиофилизацию применяют для получения дегидратированной композиции, а значит композиция (например, композиция, которая содержит AAV) является лиофилизированной композицией. В некоторых случаях лиофилизированная композиция представляет собой композицию, в которой вода была удалена из композиции с помощью сублимации, при которой вода в композиции претерпевает фазовый переход из твердого состояния в газообразное. Например, лиофилизированная композиция может представлять собой композицию, в которой вода была удалена из композиции путем ее замораживания (например, замораживания воды в композиции), а затем снижения давления, окружающего композицию, с тем, чтобы вода в композиции претерпела сублимацию. Как описано выше, лиофилизированная композиция может включать воду в незначительном количестве, как, например, 25% или менее, или 20% или менее, или 15% или менее, или 10% или менее, или 9% или менее, или 8% или менее, или 7% или менее, или 6% или менее, или 5% или менее, или 4% или менее, или 3% или менее, или 2% или менее, или 1% или менее, или 0,5% или менее, или 0,25% или менее, или 0,1% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера (KF). В соответствии с определенными вариантами осуществления, лиофилизированная композиция содержит 3% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, лиофилизированная композиция содержит 2% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, лиофилизированная композиция содержит 1% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера. В соответствии с определенными вариантами осуществления, лиофилизированная композиция содержит 0,5% или менее воды, согласно результатам измерения с помощью титрования по методу Карла Фишера.
[00104] Во время лиофилизации температура композиции может быть снижена, например, до температуры ниже точки замерзания воды в композиции. Например, температура композиции может быть снижена до 0°C или менее, или -5°C или менее, или -10°C или менее, или -15°C или менее, или -20°C или менее, или -25°C или менее, или 30°C или менее, или -35°C или менее, или -40°C или менее, или -45°C или менее, или -50°C или менее, или 55°C или менее, или -60°C или менее, или -65°C или менее, или -75°C или менее. В некоторых случаях, температуру композиции снижают до -20°C. В некоторых случаях, температуру композиции снижают до ≤-60°C (заданное значение -80°C).
[00105] В соответствии с определенными вариантами осуществления, давление, окружающее композицию, снижают ниже стандартного атмосферного давления. Например, давление, окружающее композицию можно снизить до 500 торр или менее, как, например, 250 торр или менее, или 100 торр или менее, или 50 торр или менее, или 10 торр или менее, или 1 торр или менее, или 500 миллиторр или менее, или 400 миллиторр или менее, или 300 миллиторр или менее, или 200 миллиторр или менее, или 100 миллиторр или менее, или 90 миллиторр или менее, или 80 миллиторр или менее, или 70 миллиторр или менее, или 60 миллиторр или менее, или 50 миллиторр или менее, или 40 миллиторр или менее, или 30 миллиторр или менее, или 20 миллиторр или менее, или 10 миллиторр или менее, или 5 миллиторр или менее, или 1 миллиторр или менее. В некоторых случаях, давление, окружающее композицию, снижают до 40-50 миллиторр или менее, и такое как 1,5-2 миллиторр.
[00106] В соответствии с некоторыми вариантами осуществления, лиофилизация также может включать повышение температуры композиции, тогда как давление, окружающее композицию, снижают. Например, температуру композиции можно повысить с минимальной температуры, которая описана выше, до температуры, превышающей минимальную температуру. В некоторых случаях температуру повышают для облегчения сублимации воды в композиции при пониженном окружающем давлении.
[00107] Варианты осуществления способа получения лиофилизированной композиции AAV также могут включать получение водного концентрата композиции, который впоследствии лиофилизируют.
[00108] Согласно иллюстративным аспектам, способ предусматривает размещение композиции, содержащей AAV, в стеклянную или пластиковую емкость, например, в стеклянный флакон или пластиковую пробирку. Согласно иллюстративным аспектам, стеклянная или пластиковая емкость представляет собой любую из известных в настоящей области техники, коммерчески доступных и/или описанных в настоящем документе (см., например, пример 3). Согласно иллюстративным аспектам, способ предусматривает размещение от приблизительно 0,1 мл до приблизительно 10 мл композиции, содержащей AAV, в стеклянную или пластиковую емкость. Согласно иллюстративным аспектам, способ предусматривает размещение от приблизительно 0,2 мл до приблизительно 6 мл (например, приблизительно 0,2 мл, приблизительно 0,3 мл, приблизительно 0,5 мл, приблизительно 5,6 мл) композиции, содержащей AAV, в стеклянную или пластиковую емкость. Способы получения фармацевтических композиций описаны в настоящем документе (см., например, примеры 1 и 2).
[00109] Внесение композиции в емкости может облегчить сохранение композиции в качестве стерильной композиции. Например, емкость может быть выполнена с возможностью сохранения композиции, содержащейся в емкости, в стерильной среде. Фактически, емкость может представлять собой герметично закрытую емкость, например, емкость может иметь герметичную пломбу, такую как водонепроницаемую и/или воздухонепроницаемую герметичную пломбу. Герметичную пломбу можно удалить с емкости для предоставления пользователю доступа к содержимому емкости. В некоторых случаях герметичная пломба может представлять собой хрупкую герметичную пломбу, или в других случаях герметичная пломба может быть выполнена с возможностью введения иглы, канюли или шприца во внутреннюю часть емкости без удаления герметичной пломбы с емкости. В некоторых случаях герметичная пломба, выполненная с возможностью обеспечения доступа во внутреннее пространство емкости без удаления герметичного покрытия с емкости, может облегчать сохранение содержимого емкости (например, композиции в емкости) в стерильной среде до введения композиции субъекту. К подходящим материалам для герметичной пломбы относятся, например, резиновые или полимерные покрытия, такие как без ограничения силиконовый каучук, натуральный каучук, бутадиен-стирольный каучук, этилен-пропиленовые сополимеры, полихлоропрен, полиакрилат, полибутадиен, полиуретан, бутадиен-стирол и т. п. и их комбинации. Например, в соответствии с определенными вариантами осуществления, герметичная пломба представляет собой перегородку, прокалываемую иглой, шприцем или канюлей. Герметичная пломба также может обеспечивать удобный доступ к образцу в емкости, а также защитный барьер, который перекрывает отверстие емкости. В некоторых случаях герметичная пломба представляет собой удаляемую герметичную пломбу, такую как резьбовая или защелкивающаяся крышка или другой подходящий герметизирующий элемент, который может быть применимым к отверстию емкости. Например, резьбовую крышку можно навинтить на отверстие до или после внесения образца в емкость.
[00110] В некоторых случаях емкость представляет собой емкость с единичной дозой. Емкость с единичной дозой относится к емкости, которая содержит одну или несколько стандартных доз для введения субъекту. В соответствии с некоторыми вариантами осуществления, емкость с единичной дозой включает заранее определенное количество рассматриваемой композиции, рассчитанное в количестве, достаточном для достижения требуемого эффекта у субъекта. В емкости с единичной дозой, подходящей для индивидуального введения точных доз, могут быть представлены определенные варианты осуществления композиций. Количество активной композиции, вводимой субъекту, может зависеть от подвергаемого лечению субъекта, тяжести заболевания и способа введения. Например, емкость с единичной дозой может содержать некоторый объем подлежащей введению композиции, которая описана в настоящем документе, в количестве, эффективном для достижения требуемого эффекта у подвергаемого лечению субъекта. В определенных случаях емкость с единичной дозой включает композицию, содержащую AAV в терапевтически эффективном количестве. В соответствии с определенными вариантами осуществления, емкость с единичной дозой представляет собой флакон. В некоторых случаях, флакон представляет собой герметично закрытый флакон (например, как описано выше в отношении герметично закрытой емкости).
[00111] Емкость может быть сформирована из любого подходящего материала, который совместим с AAV и другими компонентами композиции. Например, емкость может быть совместимой с твердым веществом емкостью, выполненной с возможностью содержать твердое вещество (например, лиофилизированную композицию). В некоторых случаях емкость представляет собой совместимую с жидкостью емкость, выполненную с возможностью содержать жидкость. Емкости также могут быть совместимыми с твердыми веществами и жидкостями, при этом емкость выполнена с возможностью содержать твердые вещества и жидкости. В некоторых случаях жидкость в емкости может быть водной жидкостью, и в этих случаях емкость может быть совместима с водными композициями. Под «совместимым» подразумевается, что емкость является практически инертной (например, не вступает в значительную реакцию с нею) по отношению к жидкости и/или композициям или другим компонентам, контактирующим с емкостью. Примеры подходящих материалов емкости включают без ограничения стекло и пластик. Например, емкость может состоять из стекла, такого как без ограничения силикатное стекло, боросиликатное стекло, натриевое боросиликатное стекло (например, PYREX), стекло из плавленого кварца, стекло из плавленого кремния и т.п. Другие примеры подходящих материалов емкости в случае данной емкости включают пластмассы, такие как без ограничения полипропилен, полиметилпентен, политетрафторэтилен (PTFE), простые перфторэфиры (PFE), фторированный этиленпропилен (FEP), перфторалкоксиалканы (PFA), полиэтилентерефталат (PET), полиэтилен (PE), полиэфирэфиркетон (PEEK), полистирол и т.п. В определенных случаях, как описано выше, емкость представляет собой флакон, и, в связи с этим, может представлять собой стеклянный флакон. Как описано выше, емкость может представлять собой герметично закрытую емкость и, в связи с этим, может представлять собой герметично закрытый стеклянный флакон.
[00112] Согласно иллюстративным аспектам, объем содержащей AAV композиции, размещенной в стеклянной или пластиковой емкости, составляет от приблизительно 0,1 мл до приблизительно 10 мл, от приблизительно 0,1 мл до приблизительно 5 мл, от приблизительно 0,2 мл до приблизительно 6 мл, от приблизительно 0,2 мл до приблизительно 5 мл, от приблизительно 0,25 мл до приблизительно 5 мл, от приблизительно 2 мл до приблизительно 5 мл, от приблизительно 2,5 мл до приблизительно 5 мл, от приблизительно 3 мл до приблизительно 5 мл, от приблизительно 4 мл до приблизительно 5 мл, от приблизительно 5 мл до приблизительно 10 мл, приблизительно 6 мл, приблизительно 9 мл или от приблизительно 7 мл до приблизительно 8 мл. Согласно иллюстративным аспектам, объем составляет приблизительно 0,1 мл, приблизительно 0,2 мл, приблизительно 0,25 мл, приблизительно 0,3 мл, приблизительно 0,4, приблизительно 0,5 мл, приблизительно 0,6 мл, приблизительно 0,7 мл, приблизительно 0,75 мл, приблизительно 0,8 мл, приблизительно 0,9 мл, приблизительно 1 мл, приблизительно 2 мл, приблизительно 2,5 мл, приблизительно 3 мл, приблизительно 4 мл, приблизительно 5 мл, приблизительно 5,5 мл, приблизительно 5,6 мл, приблизительно 6 мл, приблизительно 7 мл, приблизительно 7,5 мл, приблизительно 8 мл, приблизительно 9 мл или приблизительно 10 мл.
[00113] Согласно иллюстративным аспектам, содержащую AAV композицию хранят при температуре от приблизительно -80°C до приблизительно -10°C в течение по меньшей мере 1 месяца (например, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев). Согласно иллюстративным аспектам, содержащую AAV композицию хранят при температуре от приблизительно -60°C до приблизительно -20°C в течение по меньшей мере 1 месяца (например, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев). Согласно иллюстративным аспектам, содержащую AAV композицию хранят в течение 3, 4, 5 или 6 месяцев или дольше. Способы хранения композиции описаны в настоящем документе (см., например, примеры 1-3). Согласно иллюстративным аспектам, более 80% от исходного количества AAV (например, количество AAV в композиции до хранения) является эффективным после периода хранения (например, периода хранения, составляющего приблизительно 3 месяца, приблизительно 4 месяца, приблизительно 5 месяцев или приблизительно 6 месяцев или дольше). Согласно иллюстративным аспектам, более 90% от первоначального количества AAV является эффективным после периода хранения (например, периода хранения, составляющего приблизительно 3 месяца, приблизительно 4 месяца, приблизительно 5 месяцев или приблизительно 6 месяцев или дольше). Согласно иллюстративным аспектам, более 95% от первоначального количества AAV является эффективным после периода хранения (например, периода хранения, составляющего приблизительно 3 месяца, приблизительно 4 месяца, приблизительно 5 месяцев или приблизительно 6 месяцев или дольше). Согласно иллюстративным аспектам, биоэффективность AAV в конце периода хранения является практически такой же, что и биоэффективность AAV в начале периода хранения. Согласно иллюстративным аспектам, биоэффективность AAV в конце периода хранения увеличена относительно биоэффективности AAV в начале периода хранения. Согласно иллюстративным аспектам, внешний вид композиции в конце периода хранения является практически таким же, что и у композиции в начале периода хранения. Согласно иллюстративным аспектам, внешний вид композиции в конце периода хранения характеризуется отсутствием видимых частиц. Согласно иллюстративным аспектам, концентрация частиц в композиции в конце периода хранения является практически такой же, что и концентрация частиц в композиции в начале периода хранения. Согласно иллюстративным аспектам, концентрацию частиц в композиции в конце периода хранения определяют с помощью микропотоковой визуализации (MFI).
[00114] Настоящее раскрытие относится к способам лечения субъекта от нарушения, поддающегося лечению с помощью генной терапии. Согласно иллюстративным аспектам, способ предусматривает введение субъекту описываемой в настоящем документе фармацевтической композиции в количестве, эффективном для лечения нарушения. Согласно иллюстративным аспектам, нарушение представляет собой нарушение свертываемости крови (например, гемофилию A или B), и способ предусматривает введение субъекту фармацевтической композиции по настоящему раскрытию в количестве, эффективном для лечения нарушения свертываемости крови.
[00115] Согласно иллюстративным аспектам, способы предусматривают введение фармацевтической композиции путем парентерального введения. Термин «парентеральный» означает не через пищеварительный тракт, а каким-либо другим путем. Например, композиции, раскрытые в настоящем документе, можно составить для введения с помощью известных способов, таких как внутривенное введение (например, в виде струйного введения или путем непрерывной инфузии в течение определенного периода времени), внутримышечным, внутрибрюшинным, внутрицереброспинальным, подкожным, внутрисуставным, интрасиновиальным, интратекальным, пероральным, местным или ингаляционным путями. В соответствии с определенными вариантами осуществления, представленные в настоящем документе составы с AAV, можно вводить либо системно, либо локально. Системное введение включает без ограничения: пероральный, субдермальный, внутрибрюшинный, подкожный, трансназальный, подъязычный или ректальный пути введения. Местное введение включает без ограничения местный, подкожный, внутримышечный и внутрибрюшинный пути введения.
[00116] Способы введения AAV для генной терапии субъекта известны из уровня техники. См., например, публикацию Monahan, Gene therapy in an era of emerging treatment options for hemophilia B, J Thromb Haemost. 2015 Jun; 13(0 1): S151–S160.
[00117] Ресуспендированные композиции по настоящему изобретению субъекту можно вводить, например, путем инъекции или внутривенно. В соответствии с такими вариантами осуществления, перед введением субъекту ресуспендированной композиции твердую композицию, например, которую описано выше, можно объединить с жидкостью с получением жидкой композиции, подходящей для введения, например, путем инъекции или внутривенно. В некоторых случаях перед введением субъекту композиции твердую композицию можно объединить с водой (например, водой для инъекции, WFI) или буфером/буферным средством (например, которое описано выше) с получением водной композиции, подходящей для введения, например, путем инъекции или внутривенно. Например, лиофилизированную композицию можно ресуспендировать водой (например, водой для инъекции, WFI) или буфером/буферным средством (например, которое описано выше) с получением ресуспендированной дозированной единицы, подходящей для введения субъекту, например, путем инъекции или внутривенно.
[00118] В соответствии с определенными вариантами осуществления, ресуспендированная дозированная единица имеет pH, совместимый с физиологическими условиями. В некоторых случаях pH ресуспендированной дозированной единицы варьирует от 6 до 8. В некоторых случаях pH ресуспендированной дозированной единицы варьирует от 7 до 8. Например, pH ресуспендированной дозированной единицы может варьировать от 7 до 7,5. В некоторых случаях, pH ресуспендированной дозированной единицы составляет 7,0. В некоторых случаях, pH ресуспендированной дозированной единицы составляет 7,1. В некоторых случаях, pH ресуспендированной дозированной единицы составляет 7,2. В некоторых случаях, pH ресуспендированной дозированной единицы составляет 7,3. В некоторых случаях, pH ресуспендированной дозированной единицы составляет 7,4.
[00119] Ресуспендированная дозированная единица может включать предварительно определенный объем композиции по настоящему раскрытию, рассчитанный в количестве, достаточном для получения требуемого терапевтического эффекта у субъекта. Количество композиции, в ресуспендированной дозированной единице, которую вводят субъекту, может зависеть от подвергаемого лечению субъекта, тяжести заболевания и способа введения. Например, ресуспендированная дозированная единица может включать объем подлежащей введению композиции, которая раскрыта в настоящем документе, в терапевтически эффективном количестве.
[00120] При введении субъекту жидкая или ресуспендированная дозированная единица может включать такое терапевтически эффективное количество AAV, чтобы ресуспендированная дозированная единица доставляла от 1E+10 вч/мл до 5E+15 вч/мл или от 1E+10 кч/мл до 5E+15 кч/мл.
[00121] В соответствии с определенными вариантами осуществления, способ предусматривает введение субъекту жидкой или ресуспендированной дозированной единицы в соответствии со схемой лечения. Например, в некоторых случаях схема лечения подлежащему лечению субъекту может быть назначена лечащим врачом. В некоторых случаях схема лечения включает без ограничения введение пять раз в сутки, четыре раза в сутки, три раза в сутки, два раза в сутки, один раз в сутки, три раза в неделю, два раза в неделю, один раз в неделю, один раз в две недели, один раз в три недели, один раз в месяц, один раз в 5 недель, один раз в 6 недель, один раз в 7 недель, один раз в месяц и любые их комбинации.
[00122] В соответствии с некоторыми вариантами осуществления, схема лечения включает введение одной или нескольких доз в течение продолжительного периода времени. В определенных случаях индивидууму вводят однократную дозу (например, одну дозированную единицу), и после начальной дозы может следовать одна или несколько доз, которые вводят субъекту в последующее время. В некоторых случаях субъекту вводят более одной дозы (например, более одной дозированной единицы), и после начальных доз может следовать одна или несколько доз, которые вводят субъекту в последующее время. Например, субъекту можно ввести одну дозу (например, одну дозированную единицу), и после такой одной дозы может следовать одна доза, вводимая субъекту в последующее время. В последующие моменты времени можно вводить дополнительные однократные дозы. В других случаях субъекту можно ввести одну дозу (например, одну дозированную единицу), и после такой одной дозы могут следовать две дозы, которые вводят субъекту в последующее время. В последующие моменты времени можно вводить дополнительные однократные или многократные дозы.
[00123] В соответствии с определенными вариантами осуществления, ресуспендированные дозированные единицы по настоящему раскрытию можно вводить до, параллельно с или после других активных средств для лечения родственных или неродственных состояний, например, в комбинированной терапии. Примеры таких дополнительных средств терапии включают средства лучевой терапии, хирургические терапии и химиотерапии. Если их применяют одновременно с другими активными средствами, ресуспендированные дозированные единицы по настоящему раскрытию можно применять в том же или в другом составе. Например, параллельную терапию можно осуществлять путем введения ресуспендированной дозированной единицы и фармацевтической композиции, содержащей по меньшей мере одно отличное активное средство, такое как химиотерапевтическое средство, которые в комбинации обеспечивают терапевтически эффективную дозу в соответствии с конкретной схемой лечения. Введение отдельных фармацевтических композиций можно производить одновременно или в различные моменты времени (например, последовательно, в любом порядке, в один и тот же день или в разные дни) при условии, что у субъекта, проходящего такую терапию, комбинация этих веществ вызывает терапевтически эффективный эффект.
[00124] Следовательно, аспекты настоящего раскрытия дополнительно включают различные формы комбинированной терапии. В соответствии с определенными вариантами осуществления, способ по настоящему изобретению предусматривает введение терапевтически эффективного количества одного или нескольких дополнительных активных средств. Под комбинированной терапией поднимают, что композицию AAV (например, которая описана в настоящем документе) можно применять в комбинации с другим терапевтическим средством для лечения одного заболевания или патологического состояния. В соответствии с определенными вариантами осуществления, соединение по настоящему изобретению вводят одновременно с введением другого терапевтического средства, которое можно вводить в качестве компонента композиции, включающей соединение по настоящему изобретению, или в качестве компонента другой композиции. В соответствии с определенными вариантами осуществления, композицию, включающую соединение по настоящему раскрытию, вводят до или после введения другого терапевтического средства.
[00125] Приведенные далее примеры представлены лишь для иллюстрации настоящего изобретения, а не для ограничения его объема.
Примеры
Пример 1
[00126] В этом примере продемонстрированы результаты первоначальных исследований, которые привели к выбору для дальнейшего исследования трех составов.
[00127] Изготовляли шесть различных составов. Вкратце: одну партию, включающую преимущественно материал из пустых капсидов, разводили PBS/NaCl/сорбитным буфером с получением 180,8 г. В раствор вносили 0,005% твин-80 Super Refined от компании Croda для предупреждения чрезмерной потери материала в результате адсорбции. Этот раствор разделяли на 6 частей, каждая из которых содержала 30 г материала. Затем буферный раствор заменяли на один из шести буферов с помощью диализных кассет Slide-A-Lyzer и эту стадию проводили три раза со 100-кратным объемом. После трех стадий диализа каждый из диализированных растворов наливали в 2-мл флаконы с SiO2 (объем наполнения = 0,25 мл), а затем хранили при -20±2°C и ≤-60°C (заданное значение: -80°C) в течение до 6 месяцев и при 5±3°С в течение до 4 месяцев. В таблицах 1-6 описаны соответственно составы 1-6 (также называемые буферами 1-6 и образцами 1-6).
Таблица 1. Состав 1: PBS/NaCl/сорбитный буфер с полисорбатом 80 (PS80)
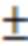 0,3
0,3
Таблица 2. Состав 2
Таблица 3. Состав 3
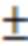 0,1
0,1
Таблица 4. Состав 4
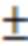 0,1
0,1
Таблица 5. Состав 5
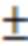 0,1
0,1
Таблица 6. Состав 6
[00128] Общий титр частиц (пустых + заполненных) тестировали с помощью общего ИФА частиц rAAV. Чистоту AAV и химическое разрушение тестировали с помощью SDS-PAGE (флуоресцентное окрашивание, 4-12% бис-трис-гель с красителем фламинго). Физическое разрушение (поврежденные капсиды или фрагменты) тестировали с помощью SEC и MFI. Также тестировали внешний вид и pH.
[00129] Составы, которые хранили при -20±2°C и ≤-60°C (заданное значение: -80°C), тестировали по MFI, внешнему виду, pH, общему ИФА частиц rAAV8, SDS-PAGE и SEC в моменты времени тестирования, указанные в таблице 7. «-» указывает на то, что образцы не были взяты.
Таблица 7. План исследования для образцов, хранившихся при -20±2°C и ≤-60°C (*заданное значение -80°C)
[00130] Составы, хранившиеся при 5±3°C, тестировали по MFI, внешнему виду, pH, общему ИФА частиц rAAV8, SDS-PAGE и SEC в моменты времени тестирования, указанные в таблице 8. «-» указывает на то, что образцы не были взяты.
Таблица 8. План исследования для образцов, хранившихся при +5±3°C
[00131] В таблице 9 приведены результаты тестирования внешнего вида, в котором классификация контроля частиц посредством инспекции невооруженным глазом была следующей: уровень А = частицы не различимы; уровень B = мелкие отдельные частицы, едва различимые; уровень C = мелкие отдельные частицы, легко различимые; уровень D = много мелких частиц, легко различимых; и уровень Е = частицы, различимые как превышающие или равные 1 мм.
Таблица 9. Внешний вид с хранением при +5±3°C, -20±2°C и ≤-60°C
[00132] Результаты анализа pH приведены в таблице 10. Не наблюдали никаких значительных сдвигов для значений pH после хранения при 5±3°C в течение до 4 месяцев и при -20±2°C и ≤-60°C в течение до 6 месяцев после их оттаивания.
Таблица 10. Общие значения pH при хранении при +5±3°C, -20±2°C и ≤-60°C
[00133] Результаты ИФА по определению титра AAV8 приведены в таблице 11. У всех результатов при хранении при 5±3°C, -20±2°C и ≤-60°C не наблюдали никаких значимых различий между шестью исследованными составами. Показаны гармонизированные результаты (рассчитанные с 0,44).
Таблица 11. Расчетные результаты ИФА по определению титра AAV8 с хранением при +5±3°C, -20±2°C и ≤-60°C
[00134] Измеряли проценты агрегатов, которые показаны в таблице 12. Более высокие значения агрегатов наблюдали в случае состава 3 на момент 0 месяцев и после хранения при 5±3°C и при ≤-60°C. У всех остальных буферов наблюдали колеблющиеся значения.
Таблица 12. Агрегаты [в %] с хранением при +5±3°C, -20±2°C и ≤-60°C
[00135] Результаты SDS-PAGE-анализов показаны в таблицах 13-18, где показаны результаты измерений через 0, 1, 2, 3, 4 и 6 месяцев. У всех образцов наблюдали стабильность во время хранения для всех температур, кроме буфера 1, у которого наблюдали дополнительный бэнд на уровне 163 кДа после 4 месяцев хранения при 5±3°C.
Таблица 13. Чистота и сводные данные со сроком хранения = 0 месяцев
Таблица 14А. Чистота и сводные данные со сроком хранения = 1 месяц при +5±3°C
Таблица 14В. Чистота и сводные данные со сроком хранения = 1 месяц при -20±2°C
Таблица 14С. Чистота и сводные данные со сроком хранения = 1 месяц при ≤-60°C
Таблица 15А. Чистота и сводные данные со сроком хранения = 2 месяца при +5±3°C
Таблица 15В. Чистота и сводные данные со сроком хранения = 2 месяца при -20±2°C
Таблица 15С. Чистота и сводные данные со сроком хранения = 2 месяца при ≤-60°C
Таблица 16А. Чистота и сводные данные со сроком хранения = 3 месяца при -20±2°C
Таблица 16В. Чистота и сводные данные со сроком хранения = 3 месяца при ≤-60°C
Таблица 17. Чистота и сводные данные со сроком хранения = 4 месяца при +5±3°C
Таблица 18А. Чистота и сводные данные со сроком хранения = 6 месяца при -20±2°C
Таблица 18В. Чистота и сводные данные со сроком хранения = 6 месяца при ≤-60°C
[00136] Полученные с помощью MFI результаты концентрации не видимых невооруженным глазом частиц материала показаны в таблицах 19-23. Этот анализ проводили для исследования образования не видимых невооруженным глазом частиц во время хранения материала AAV при 5±3°С в течение 4 месяцев и при -20±2°С и ≤-60°С в течение 6 месяцев.
Таблица 19. Сравнение частиц ≥10 мкм (количество/мл)
Таблица 20. Сравнение частиц ≥25 мкм (количество/мл)
Таблица 21. Концентрация частиц на момент 0 месяцев
Таблица 22. Концентрация частиц через 4 месяца при +5±3°C
Таблица 23. Концентрация частиц через 6 месяцев при -20±2°C и ≤-60°C
[00137] Результаты измерений осмоляльности приведены в таблице 24.
Таблица 24. Результаты измерения осмоляльности
[00138] В заключение следует отметить, что среди шести составов не было никаких значимых различий по ИФА по определению титра AAV8 через 4 месяца при 5±3°C и через 6 месяцев при -20±2°C и ≤-60°C. Внешний вид был согласованным у составов 2-5, в то время как в случае состава 1 наблюдали образования некоторого количества частиц и слегка желтый цвет наблюдали в случае состава 6. У всех составов, кроме состава 6 и контроля, наблюдали стабильность во время хранения для всех температур, что было протестировано с помощью SDS-PAGE (денситометрическим способом). Исходя из внешнего вида, данных анализа не видимых невооруженным глазом частиц (MFI) и значений осмоляльности, для дальнейшего исследования были выбраны составы 2, 3 и 4.
Пример 2
[00139] В этом примере продемонстрированы результаты дополнительного тестирования и дальнейшего исследования трех составов.
[00140] Составы 2, 3 и 4 (буферы 2, 3 и 4, образцы 2, 3 и 4) готовили так, как описано в примере 1. Вкратце: одну партию разводили PBS/NaCl/сорбитным буфером до общего объема 90 мл. В раствор вносили 0,005% PS80 Super Refined от Croda и делили на 3 аликвоты. Буфер заменяли на один из трех разных буферов или контрольный буфер с помощью диализных кассет Slide-A-Lyzer, и эту стадию повторяли в общей сложности 3 раза со 100-кратным объемом образца. 3 различными растворами заполняли 2-мл стеклянные флаконы Schott I типа со слоем SiO2 и хранили при описанных ниже температурах.
[00141] В этом примере «буфер 1» обозначает состав/буфер/образец 2 из примера 1, «буфер 2» обозначает состав/буфер/образец 4 из примера 1, «буфер 3» обозначает состав/буфер/образец 3 из примера 1, а «буфер 4» обозначает контрольный PBS/NaCl/сорбитный буфер. Для ясности в таблицах 25-28 описаны буферы 1-3 и контрольный PBS/NaCl/сорбитный буфера из данного примера.
Таблица 25. Буфер 1 (состав 2)
Таблица 26. Буфер 2 (состав 4)
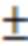 0,1
0,1
Таблица 27. Буфер 3 (состав 3)
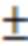 0,1
0,1
Таблица 28. Контрольный PBS/NaCl/сорбитный буфер
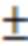 0,3
0,3
[00142] Осуществляли средне - долгосрочные исследования стабильности при ≤-60°C (заданное значение: -80°C) и при -20±2°C в течение вплоть до 5 месяцев (0, 1, 2, 3 и 5 месяцев) и при 5±3°C в течение вплоть до 4 месяцев (0, 1, 2 и 4 месяца). Составы хранили в 2-мл стеклянных флаконах Schott I типа со слоем SiO2. Каждый флакон заполняли 0,3 мл состава. Проводили аналитические тесты, результаты которых представлены в таблице 29, а в таблицах 30 и 31 указаны моменты времени тестирования для каждого анализа при указанных температурах хранения. «-» в таблице 30 или 31 означает, что образцы не были взяты.
Таблица 29. Аналитические пробы
4-12% бис-трис-гель с красителем фламинго)
Таблица 30. План исследования с хранением при -20±2°C и ≤-60°C (заданное значение: -80°C)
[ВЭЖХ со слабым анионообменником]
0,3 мл
Таблица 31. План исследования с хранением при +5±3°C
[ВЭЖХ со слабым анионообменником]
[00143] Результаты ИФА приведены в таблице 32. Из результатов ИФА по определению титра AAV8 была видна значительная потеря материала у буфера 4 (контроль) при хранении при 5±3°C. Сравните от 5,61×1012 [кч/мл] на момент 0 месяцев до 2,71×1012 спустя 4 месяца. Никаких дополнительных потерь не наблюдали для того же материала, хранящегося при -20±2°C и ≤-60°C. У буферов 1 и 2 не наблюдали никаких потерь материала. У буфера 3 наблюдали меньшее количество исходного материала, которое не уменьшалось во время хранения.
Таблица 32. ИФА по определению титра AAV8
-20±2°C
-20±2°C
-20±2°C
-20±2°C
≤-60°C
[00144] Результаты qPCR показаны в таблице 33. Все данные, полученные с помощью этого анализа, подтверждали результаты ИФА и анализа биоэффективности in vitro. У буфера 4 наблюдали большую величину отклонения в тесте.
Таблица 33. FIX-qPCR [вг/мл]
-20±2°C
-20±2°C
-20±2°C
-20±2°C
≤-60°C
[00145] Результаты измерений % агрегатов показаны в таблице 34. Снижение значений агрегатов наблюдали после хранения в течение 4 месяцев при 5±3°C. У буфера 4 наблюдали увеличение с 1,55% до 3,39% через 3 месяца и отсутствие агрегатов через 4 месяца. Буфер 3 достигал максимума, равного 6,64%, через 2 месяца при ≤-60°С, который падал до 3,25% через 3 месяца и 3,94% через 5 месяцев.
Таблица 34. Агрегаты [%]
-20±2°C
-20±2°C
-20±2°C
-20±2°C
≤-60°C
≤-60°C
≤-60°C
≤-60°C
[00146] Результаты анализа со слабым анионообменником (WAX), с помощью которого измеряли заполненные капсиды, не демонстрировали никаких значимых различий для всех моментов времени тестирования и температур хранения (таблица 35).
Таблица 35. Заполненные капсиды [%]
-20±2°C
-20±2°C
-20±2°C
-20±2°C
[00147] Результаты анализа биоэффективности in vitro показаны в таблице 36. Схожие колеблющиеся значения наблюдали для буфера 1, буфера 2 и буфера 3 в диапазоне отклонений результатов теста. У буфера 4 наблюдали сильное снижение после хранения при 5±3°С в течение 4 месяцев. Сопоставимые результаты были обнаружены в случае всех остальных буферов, моментов времени тестирования и температур.
Таблица 36. Биоэффективность in vitro [BPU]
-20±2°C
-20±2°C
-20±2°C
-20±2°C
[00148] Результаты анализа биоэффективности in vivo показаны в таблице 37. В результатах у буферов 1-3 видны колеблющиеся результаты в диапазоне отклонений результатов теста. У буфера 4 наблюдали снижение с 3,70 [МЕ/мл] на момент 0 месяцев до 1,33 [МЕ/мл] через 4 месяца при 5±3°C и увеличение с 3,79 [МЕ/мл] на момент 0 месяцев до 6,73 [МЕ/мл] через 4 месяца при≤-60°C. Результаты 7-го дня были аналогичны результатам 14-го дня. Результаты после 1 месяца хранения при температуре ≤-60°C принимали в качестве эталонного значения, представляющего 0 месяцев для всех температур хранения.
Таблица 37. Результаты по биоэффективности in vivo [МЕ/мл] на 14-й день
[МЕ/мл] при +5±3°C
14-й день
14-й день
14-й день
14-й день
14-й день
[МЕ/мл] при -20±2°C
14-й день
-20±2°C,
14-й день
-20±2°C,
14-й день
-20±2°C,
14-й день
-20±2°C,
14-й день
-20±2°C,
14-й день
[МЕ/мл] при ≤-60°C
≤-60°C,
14-й день
≤-60°C,
14-й день
≤-60°C,
14-й день
≤-60°C,
14-й день
≤-60°C,
14-й день
Таблица 38. Результаты по биоэффективности in vivo [МЕ/мл] на 7-й день
[МЕ/мл] при +5±3°C
7-й день
7-й день
7-й день
+5±3°C,
7-й день
+5±3°C,
7-й день
[МЕ/мл] при -20±2°C
7-й день
-20±2°C,
7-й день
-20±2°C,
7-й день
-20±2°C,
7-й день
-20±2°C,
7-й день
-20±2°C,
7-й день
[МЕ/мл] при ≤-60°C
≤-60°C,
7-й день
≤-60°C,
7-й день
≤-60°C,
7-й день
≤-60°C,
7-й день
≤-60°C,
7-й день
[00150] Результаты денситометрического анализа SDS-PAGE показаны в таблицах 39-44. Никаких дополнительных бэндов не наблюдали при хранении при 5±3°С в течение до 4 месяцев и при хранении при -20±2°С и ≤-60°С в течение до 5 месяцев.
Таблица 39. Чистота и сводные данные при хранении 0 месяцев
10 мкг/мл
L5-L7
L9-L11
L13-L15
L17-L19
Таблица 40. Чистота и сводные данные при хранении 1 месяц
10 мкг/мл
3
5
6
7
8
18
%
%
%
%
%
Таблица 41. Чистота и сводные данные при хранении 2 месяца
4
3
5
6
7
8
%
%
Таблица 42. Чистота и сводные данные при хранении 3 месяца
%
%
%
%
%
%
%
%
%
Таблица 43. Чистота и сводные данные при хранении 3 месяца
Таблица 44. Чистота и сводные данные при хранении 5 месяцев
3
5
6
7
8
[00151] Результаты тестирования внешнего вида приведены в таблице 45-48, в которой классификация контроля частиц посредством инспекции невооруженным глазом была следующей: уровень А = частицы не различимы; уровень B = мелкие отдельные частицы, едва различимые; уровень C = мелкие отдельные частицы, легко различимые; уровень D = много мелких частиц, легко различимых; и уровень Е = частицы, различимые как превышающие или равные 1 мм. Внешний вид всех образцов через 1 месяц при 5±3°C, -20±2°C и ≤-60°C (заданное значение: -80°C) представлял собой прозрачные, бесцветные растворы без видимых частиц (обозначено ниже и по всему описанию как «соответствует требованиям»).
Таблица 45. Внешний вид в течение 48 часов при +25±2°C
Таблица 46. Внешний вид в течение 4 месяцев при +5±3°C
вскоре после стерилизующего фильтрования
+5±3°C
критериев
с видимыми частицами
(2 волокна)
(2 волокна)
критериев
с видимыми частицами
(4 волокна)
>5 частиц)
Таблица 47. Внешний вид в течение 6 месяцев при -20±2°C
с видимыми частицами
(3 волокна)
(>5 частиц)
(>6 волокон)
частицами >10
с видимыми частицами
(2 волокна)
>5 частиц)
>10 частиц
частицами >10
Таблица 48. Внешний вид в течение 6 месяцев при ≤-60°C
стерилизующего фильтрования
-≤-60°C
месяц
месяца
месяца
месяцев
месяцев
(3 волокна)
(4 волокна)
(3 волокна)
(4 волокна)
(>5 волокон)
частицами >10
[00152] Значения pH для буферов/составов на момент времени 0 месяцев и спустя 1 месяц хранения при указанных температурах показаны в таблице 49.
Таблица 49. Значения pH через 1 месяц
[00153] Измерения полисорбата 80 (PS80) проводили после хранения в течение 5 месяцев при ≤-60°C. Результаты (показанные в таблице 50) подтверждали, что количество PS80 не уменьшалось после хранения в течение 5 месяцев при ≤-60°C.
Таблица 50. Полисорбат 80 (способ ВЭЖХ)
[00154] Исходя из данных, полученных в ходе этого исследования, не было обнаружено значимого различия в профиле стабильности AAV8 при составлении в любом из трех протестированных буферов/составов. Следовательно, все три их можно считать подходящими для хранения генотерапевтических продуктов на основе AAV8.
Пример 3
[00155] В этом примере продемонстрированы результаты дополнительного исследования двух составов в отношении их адсорбции на внутренних поверхностях различных флаконов и пробирок.
[00156] Буферы 1 (состав 2) и 2 (состав 4), описанные в примере 2, тестировали в отношении адсорбции на внутренних поверхностях разных флаконов и пробирок. Буфер 1 (1717,37×1011 кч/мл) и буфер 2 (1431,94×1011 кч/мл) разводили до целевой концентрации 1,1×1013 кч/мл и подвергали стерилизующему фильтрованию через фильтр PALL EKV. Образцы загружали в стеклянные флаконы объемом 2 мл и замораживали для дальнейшего применения. Затем материалы помещали во флаконы и пробирки так, как описано в таблице 51.
Таблица 51.
[00157] Образцы хранили при 25±2°C в течение 8 часов, а затем тестировали с помощью ИФА для определения титра PDTS/AAV8. Результаты анализа представлены в таблице 52.
Таблица 52
[кч/мл]
[00158] Из этих результатов видно, что из 2-мл флаконов с SiO2 можно было выделить более 90% исходного генотерапевтического материала. Не наблюдали никакой адсорбции, и не было обнаружено значимого различия между данными двумя тестируемыми буферами.
Пример 4
[00159] В этом примере продемонстрирована стабильность различных подтипов AAV в составе 4.
[00160] Получали подтипы AAV: AAV 2, AAV 5, AAV 8 и AAV 9 (University of Massachusetts at Worcester Medical School Vector Core Facility), и хранили в составе 4 (как описано в примерах 1-3), затем тестировали их в отношении внешнего вида для подтверждения отсутствия образовавшихся видимых частиц и с помощью ITR-qPCR для количественного определения векторного генома для дозирования в анализе биоэффективности in vitro. Каждый из этих подтипов AAV содержал кассетную вставку eGFP, кодирующую зеленый флуоресцентный белок (CB6-Pl-eGFP). Тестирование проводили в момент времени 0 и снова через 6 недель после хранения при +5±3°C.
[00161] Два миллилитровых образца, находящихся в PBS-буфере (1×PBS + 0,001% плюроник F+68), с концентрацией >5E+12 мкг/мл частиц AAV оттаивали при температуре окружающей среды и разводили до 4 мл (примерно >2,5Е+12 вг/мл) составом 4. Примерно 0,0025% полисорбата 80 из состава 4 предотвращало избыточную потерю материала в результате адсорбции (например, на внутренних поверхностях оборудования). Общий буфер каждого из образцов заменяли на состав 4 с помощью диализных кассет Slide-A-Lyzer® 10K, и эту стадию проводили три раза со 100-кратным объемом, причем диализ занимал минимум 4 часа для каждой стадии. После замены буфера составом 4 забирали образцы на начальном моменте времени тестирования 0 недель, а затем хранили их при +5±3°C в течение 6 недель.
[00162] Видимых частиц у различных подтипов AAV, хранящихся в составе 4, даже после хранения в течение 6 недель обнаружено не было (таблица 53). Таким образом, возможно, что вспомогательные вещества, наблюдаемые на момент времени 0, растворялись к 6 неделям.
Таблица 53. Внешний вид при хранении в составе 4 при +5±3°C
[00163] Хотя результаты выделения AAV2 были плохими, что может быть связано с отклонением результатов анализа ITR-qPCR (результаты анализа ITR-qPCR имеет отклонения результатов теста±0,5 log), другие подтипы AAV были стабильны в течение 6 недель тестирования. Применение состава 4 давало в результате неожиданную стабильность подтипа AAV8.
Таблица 54. ITR-qPCR [вг/мл] при хранении в составе 4 при +5±3°C
Пример 5
[00164] В этом примере продемонстрирована возможность лиофилизации составов с AAV, в частности, лиофилизации AAV в составе 4.
[00165] Состав 4 с AAV лиофилизировали и хранили сроком до 10 месяцев при +5±3°С. Вкратце: получали генотерапевтический материал, содержащий AAV8, и лиофилизировали его перед хранением во флаконах, содержащих лиофилизированный материал, при +5±3°C (контролировали с помощью системы Eurotherm, связанной с SIZ). В каждый момент времени тестирования (1, 2, 3, 6 и 10) содержимое одного флакона ресуспендировали с помощью 5,5 мл очищенной воды, а полученную жидкость разделяли на аликвоты в соответствии с таблицей 55. Лиофилизацию проводили два раза только с буфером «состав 4», а после этих экспериментов проводили лиофилизацию с активным генотерапевтическим материалом в составе 4. Флаконы с активным генотерапевтическим материалом размещали спереди, посередине или сзади на полке. Пространства между ними заполняли теми же стеклянными флаконами с SiO2, заполненными составом 4 без AAV.
Таблица 55. План исследования с хранением при +5±3°C
[ВЭЖХ со слабым анионообменником]
0,2 мл
[00166] Проводили измерения различных параметров до и после лиофилизации. Для каждого измерения в таблице 56 представлено среднее из трех измерений (передний, средний и задний образцы). Для тестируемых параметров не было обнаружено значимых различий, за исключением остаточной влажности. Остаточная влажность составляла 0,7% для образца спереди, где сушка происходила быстрее, чем сзади, где было обнаружено 3,6%. Флакон посередине содержал 3,7% остаточной влаги.
Таблица 56А. Различные параметры генотерапевтического материала после лиофилизации
14 дней [МЕ/мл]
(волокно с 2-3 мм)
Таблица 56В. Различные параметры генотерапевтического материала после лиофилизации, выделение [%]
Таблица 57. Различные параметры генотерапевтического материала после хранения в виде лиофилизатов сроком до 10 месяцев при +5±3°C
[BPU]
[%]
14 дней
Выделение [%]
полке в ходе
лиофилизации
материала
до лиофилизации
Посередине: прозрачный бесцветный раствор с 1 видимой частицей (волокно 2-3 мм),
Сзади: прозрачный бесцветный раствор без частиц
[00167] В заключение необходимо отметить, что в момент времени 10 месяцев получали выделение в размере 85%. В случае биоэффективности in vitro (выделение в размере 70% спустя 10 месяцев), а также биоэффективности in vivo (выделение в размере 65% спустя 6 месяцев) не наблюдали потери непосредственно после лиофилизации, но через 1 месяц хранения наблюдали небольшое их снижение. Тем не менее, к моменту времени 10 месяцев дополнительного снижения активности не наблюдали. Процентные значения заполненных капсидов, а также результаты для агрегатов были постоянными.
Пример 6
[00168] В этом примере продемонстрированы результаты дополнительного тестирования и дальнейшего исследования лиофилизированных составов.
[00169] Исследовали четыре различных состава с различными концентрациями NaCl с двумя различными скоростями лиофилизации (таблицы 58-61). Вкратце: программы лиофилизации различались по их динамике изменения температур от -55°С до +2°С во время первичной сушки. В одном цикле температуру повышали в течение периода, составлявшего 1,5 часа (программа 1), в то время как в другом цикле температуру повышали в течение 12 часов (программа 2).
Таблица 58. Состав 4
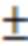 0,1
0,1
Таблица 59. Состав 7
 0,1
0,1
Таблица 60. Состав 8
 0,1
0,1
Таблица 61. Состав 9
 0,1
0,1
[00170] Генотерапевтический материал размораживали и объединяли в пул и 29,2 мл объединенного в пул материала помещали в диализные кассеты Slide-A-Lyzer® 10K. Буфер заменяли на состав 4, 7, 8 или 9, как описано выше. Все образцы подвергали диализу три раза в 100-кратном объеме в течение минимум трех часов. После диализа 5,5 мл каждого материала помещали в 10-мл флаконы с SiO2. Перед лиофилизацией на стеклянные флаконы устанавливали пробки для лиофилизации, не закрывая их. Лиофилизированные продукты хранили при +5±3°С в течение до 12 месяцев.
[00171] Чем ниже были значения концентрации NaCl, тем ниже была остаточная влажность (таблица 62).
Таблица 62. Результаты сравнения остаточной влажности [%] непосредственно после лиофилизации
Концентрация NaCl/
программа
[00172] Лиофилизированные продукты хранили при +5±3°С в течение периода, длительностью до двенадцати месяцев, и тестировали в отношении активности, общего титра частиц (пустых + заполненных), чистоту, разрушение и рН (таблицы 63 и 64). В каждый момент времени тестирования (0, 1, 3, 6 и 12 месяцев) содержимое одного флакона ресуспендировали с помощью 5,5 мл очищенной воды, а полученную жидкость разделяли на аликвоты в соответствии с таблицей 63. Образцы замораживали при ≤-60°C (заданное значение: -80°C) и проводили на них тесты. После лиофилизации не было обнаружено значимого различия значений, и было обнаружено, что все данные находятся в пределах допустимого для анализа отклонения.
Таблица 63. План исследования для образцов, хранившихся при +5±3°C
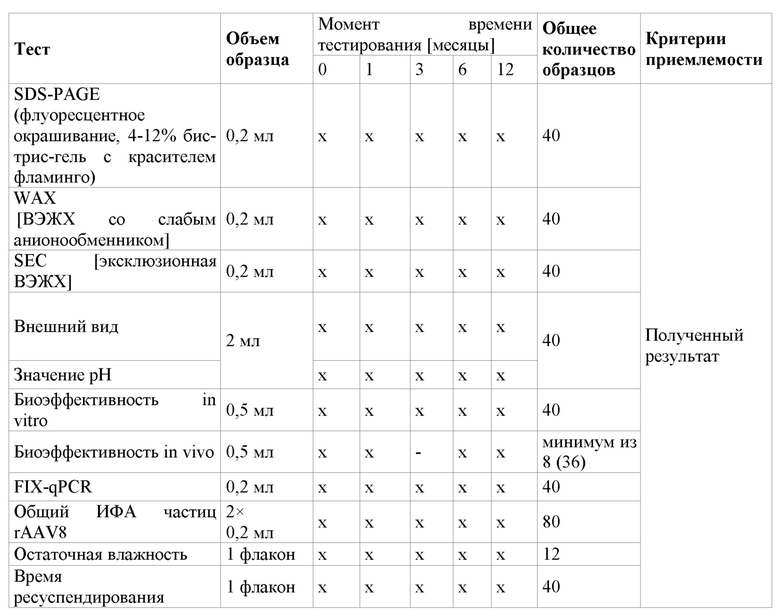
Таблица 64. Результаты программы 1
параметр
[00173] Таким образом, программа 1 была более агрессивной программой, но она давала более компактные и однородные лиофилизаты. Чем ниже была концентрация NaCl, тем ниже были значения остаточной влажности. Внешний вид соответствовал требованиям «прозрачному бесцветному раствору без видимых частиц» для исходного материала, а также для каждой концентрации NaCl после диализа, лиофилизации и ресуспендирования. В результатах измерения pH, ИФА частиц AAV8, FIX-qPCR и результатах анализа биоэффективности in vitro наблюдали схожие значения для каждой концентрации NaCl. Из результатов анализа WAX (процента заполненных капсидов) было видно отклонение результатов тестов в пределах 54-63% (таблица 69). Наблюдали увеличение количества агрегатов с 2,3% для необработанного исходного материала до 3,5% и 4,1% для подвергнутого диализу и лиофилизированного генотерапевтического материала. Лиофилизаты в случае каждой концентрации NaCl были белыми, компактными и однородными.
Пример 7
[00174] В данном примере продемонстрированы дополнительные составы.
[00175] Составы 10 и 11 были изготовлены так, как описано в примере 1.
Таблица 65. Состав 10
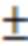 0,1
0,1
Таблица 66. Состав 11
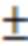 0,1
0,1
Пример 8
[00176] В данном примере продемонстрированы дополнительные составы.
[00177] Составы 12-15 были изготовлены так, как описано в примере 1.
Таблица 67. Состав 12
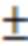 0,1
0,1
Таблица 68. Состав 13
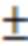 0,1
0,1
Таблица 69. Состав 14
 0,1
0,1
Таблица 70. Состав 15
 0,1
0,1
[00178] Все источники, включая публикации, заявки на выдачу патентов и патенты, упомянутые в настоящем документе, настоящим включены посредством ссылки в той же степени, как если бы каждый источник был отдельно и конкретно указан как включенный посредством ссылки и был изложен в настоящем документе во всей своей полноте.
[00179] Все описанные в настоящем документе способы можно выполнять в любом подходящем порядке, если в настоящем документе не указано иное или иное явно не противоречит контексту. Применение всех без исключения примеров или иллюстративных формулировок (например, «таких как»), представленных в настоящем документе, предназначено лишь для лучшего освещения настоящего раскрытия и не налагает ограничения на объем настоящего раскрытия, если не заявлено иное. Ни одну формулировку в описании не следует истолковывать как указывающую на любой незаявленный элемент как существенный для осуществления на практике настоящего раскрытия.
[00180] В настоящем документе описаны предпочтительные варианты осуществления настоящего раскрытия, в том числе наилучший известный авторам настоящего изобретения вариант для осуществления настоящего раскрытия. После прочтения предшествующего описания специалистам в настоящей области техники могут стать понятны варианты таких предпочтительных вариантов осуществления. Авторы изобретения предвидят, что специалисты в настоящей области техники будут использовать такие варианты в зависимости от обстоятельств, и авторы изобретения предполагают, что на практике настоящее раскрытие будет реализовано иначе, чем конкретно описано в настоящем документе. Соответственно, настоящее раскрытие включает все модификации и эквиваленты предмета изобретения, указанного в пунктах прилагаемой формулы изобретения, которые разрешены применимым правом. Кроме того, настоящим раскрытием охватывается любое сочетание вышеописанных элементов во всех возможных их вариантах, если в настоящем документе не указано иное или иное явно не противоречит контексту.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ АНТИТЕЛ ПРОТИВ CTLA-4 | 2006 |
|
RU2356579C1 |
| ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2719431C2 |
| КОМПОЗИЦИИ АНТИ-PD-1 АНТИТЕЛ | 2019 |
|
RU2772781C2 |
| СОСТАВ АНТИТЕЛА | 2015 |
|
RU2743681C2 |
| СОСТАВЫ НА ОСНОВЕ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ К IL-4/IL-13 | 2014 |
|
RU2690850C2 |
| Жидкая композиция антитела против TNF альфа | 2018 |
|
RU2756619C2 |
| ЖИДКИЙ СОСТАВ ПОЛИПЕПТИДОВ, СОДЕРЖАЩИХ FC-ДОМЕН ИММУНОГЛОБУЛИНА | 2011 |
|
RU2600847C2 |
| ЛИПОПЕПТИДНЫЕ КОМПОЗИЦИИ И РОДСТВЕННЫЕ СПОСОБЫ | 2010 |
|
RU2607526C2 |
| ВАКЦИННЫЕ СОСТАВЫ ПРОТИВ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА (HPV), СОДЕРЖАЩИЕ АЛЮМИНИЕВЫЙ АДЪЮВАНТ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2610174C2 |
| СОСТАВЫ АНТИТЕЛ К RSV И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2807524C2 |
В настоящем документе представлены жидкие и лиофилизированные фармацевтические композиции с аденоассоциированным вирусом. Согласно иллюстративным аспектам фармацевтические композиции содержат от приблизительно 5 мМ до приблизительно 25 мМ L-гистидина, от приблизительно 0 мМ до приблизительно 150 мМ хлорида натрия, от приблизительно 0,001% (масса/объем) до приблизительно 0,01% (масса/объем) полисорбата 80 (PS80) и от приблизительно 1% до приблизительно 10% (масса/объем) сахарозы, трегалозы или их комбинации с AAV. Согласно иллюстративным аспектам фармацевтические композиции дополнительно содержат глицин или маннит. Представлены способы получения фармацевтической композиции, содержащей AAV, способы лечения у субъекта нарушения свертываемости крови и способы хранения композиций с AAV. 5 н. и 48 з.п. ф-лы, 70 табл., 8 пр.
1. Фармацевтическая композиция для генной терапии, содержащая аденоассоциированный вирус (AAV) и буфер, содержащий:
(i) от 5 мМ до 25 мМ буферного средства, содержащего гистидин, аргинин или лизин;
(ii) от 50 мМ до 150 мМ фармацевтически приемлемой соли, содержащей соль натрия, соль аммония, соль калия или их комбинацию;
(iii) от 0,001% (масса/объем) до 0,01% (масса/объем) неионогенного поверхностно-активного вещества, содержащего полисорбаты, плюроники, полоксамеры, полиэфиры, или их комбинацию;
(iv) от 1% до 10% (масса/объем) сахара, сахароспирта или их комбинации; и
(v) воду до 100%.
2. Фармацевтическая композиция для лиофилизации и генной терапии, содержащая аденоассоциированный вирус (AAV) и буфер, содержащий:
(i) от 5 мМ до 25 мМ буферного средства, содержащего гистидин, аргинин или лизин;
(ii) от 30 мМ до 100 мМ фармацевтически приемлемой соли, содержащей соль натрия, соль аммония, соль калия или их комбинацию;
(iii) от 0,001% (масса/объем) до 0,01% (масса/объем) неионогенного поверхностно-активного вещества, содержащего полисорбаты, плюроники, полоксамеры, полиэфиры, или их
комбинацию;
(iv) от 1% до 10% (масса/объем) сахара, сахароспирта или их комбинации; и
(v) воду до 100%.
3. Фармацевтическая композиция по любому из предшествующих пунктов, причем буфер имеет pH от 6,9 до 7,7, необязательно, 7,0 или 7,5.
4. Фармацевтическая композиция по любому из предшествующих пунктов, причем буферное средство представляет собой L-гистидин.
5. Фармацевтическая композиция по п. 4, причем буфер содержит от 5 мМ до 25 мМ или от 10 мМ до 20 мМ L-гистидина.
6. Фармацевтическая композиция по п.1 или 2, причем фармацевтически приемлемая соль представляет собой соль натрия, соль аммония или соль калия.
7. Фармацевтическая композиция по любому из пп. 1 или 3-6, причем буфер содержит от 50 мМ до 120 мМ хлорида натрия.
8. Фармацевтическая композиция по любому из пп. 2-6, причем буфер содержит от 30 мМ до 80 мМ или от 30 мМ до 60 мМ хлорида натрия.
9. Фармацевтическая композиция по любому из пп. 1-8, причем буфер содержит от 60 мМ до 100 мМ или от 60 мМ до 80 мМ хлорида натрия.
10. Фармацевтическая композиция по любому из предшествующих пунктов, причем неионогенное поверхностно-активное вещество представляет собой PS80.
11. Фармацевтическая композиция по п. 10, причем буфер содержит от 0,0025% до 0,0075% (масса/объем) PS80.
12. Фармацевтическая композиция по любому из предшествующих пунктов, причем сахар представляет собой сахарозу, трегалозу или их комбинацию.
13. Фармацевтическая композиция по п. 12, причем буфер содержит от 1% (масса/объем) до 5% (масса/объем) сахарозы, трегалозы или их комбинации.
14. Фармацевтическая композиция по п. 12 или 13, причем трегалоза представляет собой дигидрат трегалозы.
15. Фармацевтическая композиция по любому из предшествующих пунктов, причем буфер дополнительно содержит глицин.
16. Фармацевтическая композиция по п. 15, причем буфер содержит от 35 мМ до 65 мМ глицина.
17. Фармацевтическая композиция по любому из предшествующих пунктов, причем буфер дополнительно содержит маннит.
18. Фармацевтическая композиция по п. 17, причем буфер содержит от 80 мМ до 120 мМ маннита.
19. Фармацевтическая композиция по любому из предшествующих пунктов, причем буфер не содержит декстран.
20. Фармацевтическая композиция по любому из предшествующих пунктов, причем буфер содержит глицин или маннит.
21. Фармацевтическая композиция по любому из пп. 10-20, причем PS80 представляет собой PS80 Super Refined™.
22. Фармацевтическая композиция по п. 1, причем буфер содержит:
(i) от 5 мМ до 25 мМ L-гистидина;
(ii) от 50 мМ до 150 мМ хлорида натрия;
(iii) от 0,001% (масса/объем) до 0,01% (масса/объем) полисорбата 20 или полисорбата 80 или их комбинации; и
(iv) от 1% до 10% (масса/объем) сахара, сахароспирта или их комбинации, и
(v) воду до 100%.
23. Фармацевтическая композиция по п. 2, причем буфер содержит:
(i) от 5 мМ до 25 мМ L-гистидина;
(ii) от 30 мМ до 100 мМ хлорида натрия;
(iii) от 0,001% (масса/объем) до 0,01% (масса/объем) полисорбата 20 или полисорбата 80 или их комбинации; и
(iv) от 1% до 10% (масса/объем) сахара, сахароспирта или их комбинации; и
(v) воду до 100%.
24. Фармацевтическая композиция по п. 22 или 23, причем буфер имеет pH от 6,9 до 7,7, необязательно, 7,0 или 7,5.
25. Фармацевтическая композиция по любому из пп. 22-24, причем буфер содержит от 10 мМ до 20 мМ L-гистидина.
26. Фармацевтическая композиция по любому из пп. 22, 24 или 25, причем буфер содержит от 50 мМ до 120 мМ хлорида натрия.
27. Фармацевтическая композиция по любому из пп. 23-26, содержащая от 30 мМ до 80 мМ, от 30 мМ до 60 мМ, от 60 мМ до 100 мМ, или от 60 до 80 мМ хлорида натрия.
28. Фармацевтическая композиция по любому из пп. 22-27, причем буфер содержит полисорбат 80.
29. Фармацевтическая композиция по п. 28, причем буфер содержит от 0,0025% до 0,0075% (масса/объем) полисорбата 80.
30. Фармацевтическая композиция по любому из пп. 22-29, причем сахар представляет собой сахарозу, трегалозу или их комбинацию.
31. Фармацевтическая композиция по любому из пп. 22-30, причем буфер содержит от 1% (масса/объем) до 5% (масса/объем) сахарозы, трегалозы или их комбинации.
32. Фармацевтическая композиция по любому из пп. 22-31, причем буфер содержит трегалозу, необязательно дигидрат трегалозы.
33. Фармацевтическая композиция по любому из пп. 22-32, причем буфер дополнительно содержит глицин, необязательно в концентрации от 35 мМ до 65 мМ.
34. Фармацевтическая композиция по п. 1 или 2, причем буфер содержит:
(i) 20 мМ L-гистидина,
(ii) 70 мМ хлорида натрия,
(iii) 0,005% (масса/объем) полисорбата 80 (PS80),
(iv) 5% (масса/объем) сахарозы, и
(v) воду до 100%.
35. Фармацевтическая композиция для генной терапии, содержащая аденоассоциированный вирус (AAV) и буфер, содержащий:
(i) 10 мМ L-гистидина,
(ii) 100 мМ хлорида натрия,
(iii) 0,005% (масса/объем) полисорбата 80 (PS80),
(iv) 5% (масса/объем) трегалозы,
(v) 50 мМ глицина, и
(vi) воду до 100%.
36. Фармацевтическая композиция для генной терапии, содержащая аденоассоциированный вирус (AAV) и буфер, содержащий:
(i) 10 мМ L-гистидина,
(ii) от 30 мМ до 100 мМ хлорида натрия,
(iii) 0,005% (масса/объем) полисорбата 80 (PS80),
(iv) 5% (масса/объем) трегалозы,
(v) 50 мМ глицина, и
(vi) воду до 100%.
37. Фармацевтическая композиция по любому из пп. 1-33 или 36, причем буфер содержит 80 мМ хлорида натрия.
38. Фармацевтическая композиция по любому из пп. 1-33 или 36, причем буфер содержит 70 мМ хлорида натрия.
39. Фармацевтическая композиция по любому из пп. 1-33 или 36, причем буфер содержит 60 мМ хлорида натрия.
40. Фармацевтическая композиция по любому из пп. 1-33 или 36, причем буфер содержит 50 мМ хлорида натрия.
41. Фармацевтическая композиция по любому из пп. 2-6, 8, 10-21, 23-25, 27-33 или 36, причем буфер содержит 40 мМ хлорида натрия.
42. Фармацевтическая композиция по любому из пп. 2-6, 8, 10-21, 23-25, 27-33 или 36, причем буфер содержит 30 мМ хлорида натрия.
43. Фармацевтическая композиция по п. 1 или 2, причем буфер содержит:
(i) 20 мМ L-гистидина,
(ii) 60 мМ хлорида натрия,
(iii) 0,005% (масса/объем) полисорбата 80 (PS80),
(iv) 35 мМ трегалозы,
(v) 110 мМ маннита, и
(vi) воду до 100%.
44. Фармацевтическая композиция по любому из предшествующих пунктов, причем буфер имеет pH от 6,9 до 7,7, необязательно, 7,0 или 7,5.
45. Фармацевтическая композиция по любому из предшествующих пунктов, причем AAV представляет собой AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 или
AAV10.
46. Фармацевтическая композиция по любому из предшествующих пунктов, причем AAV представляет собой AAV8.
47. Фармацевтическая композиция по любому из предшествующих пунктов, причем композиция является жидкой.
48. Фармацевтическая композиция по любому из предшествующих пунктов, причем композиция является лиофилизированной.
49. Фармацевтическая композиция по любому из предшествующих пунктов, причем композиция представлена в емкости с единичной дозой.
50. Фармацевтическая композиция по п. 49, причем емкость с единичной дозой представляет собой флакон.
51. Фармацевтическая композиция по п. 50, причем флакон представляет собой герметично закрытый стеклянный флакон.
52. Применение фармацевтической композиции по любому из пп. 1-51 для генной терапии у субъекта.
53. Применение по п. 52, причем генная терапия предусмотрена для лечения нарушения свертываемости крови.
| WO 2016154055 A1, 2016.09.29 | |||
| WRIGHT J F et al., Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation, MOLECULAR THERAPY: THE JOURNAL OF THE AMERICAN SOCIETY OF GENE THERAPY, ACADEMIC PRESS; NATURE PUBLISHING GROUP, US, Vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2022-03-29—Публикация
2017-11-03—Подача