Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармацевтических композиций антител. В частности, настоящее изобретение относится к композиции анти-PD-1 антитела и ее фармацевтическому получению и применению.
Предпосылки создания изобретения
Терапевтические средства на основе антител обычно вводят на регулярной основе и обычно используют дозу в несклько мг/кг, вводимую путем инъекции. Парентеральная доставка является обычным путем введения для терапевтического антитела. Для парентерального введения желательны относительно высокие концентрации композиций антител, чтобы минимизировать объем каждой дозы.
Разработка высококонцентрированных белковых композиций может быть сложной задачей из-за проблем, связанных с физической и химической стабильностью белка, изготовлением, хранением и доставкой белковой композиции. Повышенная вязкость композиций антител может вызывать проблемы, начиная от изготовления лекарственных средств и до доставки лекарственных средств пациенту. Были предприняты различные попытки для исследования эффекта уменьшающих вязкость агентов на высококонцентрированные водные содержащие белок композиции.
Было показано, что анти-PD-1 антитело полезно для лечения гиперпролиферативных расстройств, включая рак 1 типа. Существует потребность в стабильном, высококонцентрированном препарате на основе антител, включающем анти-PD-1 антитело, имеющем подходящую вязкость, который бы отвечал медицинской потребности пациентов, страдающих состояниями, опосредованными PD-1, такими как рак.
Сущность изобретения
Представлены композиции, включающие анти-PD-1 антитело и эксципиенты, способные снижать вязкость композиции, включающей антитело. Показано, что некоторые композиции эффективны для снижения вязкости. Предпочтительно, композиции, представленные в настоящей заявке, демонстрируют вязкостные свойства, подходящие для достижения концентраций больше чем 100 мг/мл для лекарственного продукта для применения в терапевтической лечении.
В настоящей заявке представлены фармацевтические композиции, которые поддерживают высокие концентрации биоактивного антитела в растворе и являются подходящими для парентерального введения, включая подкожную, внутривенную, внутримышечную, интраперитонеальную или внутрикожную инъекцию. Композиции включают анти-PD-1 антитело, дисахарид, буфер, хелатирующий агент и полисорбат. В некоторых вариантах осуществления pH композиции может быть между приблизительно 4,5 и 5,5. В некоторых вариантах осуществления композиция предпочтительно имеет вязкость в пределах от приблизительно 1 сантипуаз (сПз) до приблизительно 20 сПз. В некоторых вариантах осуществления предпочтительным путем введения является подкожная инъекция.
В некоторых вариантах осуществления композиция может включать или состоять по существу от приблизительно 100 мг/мл до приблизительно 200 мг/мл анти-PD-1 антитела, дисахарида, буфера, хелатирующего агента и полисорбата и имеет pH от приблизительно 4,5 до приблизительно 5,5. В некоторых вариантах осуществления композиция может состоять по существу из приблизительно 150 мг/мл анти-PD-1 антитела, дисахарида, буфера, хелатирующего агента и полисорбата и имеет pH приблизительно 5,0.
В некоторых вариантах осуществления композиция не включает антиоксидант. В некоторых вариантах осуществления композиция не включает метионин, такой как, например, без ограничения, L-метионин или его фармацевтически приемлемая соль. В некоторых вариантах осуществления композиция не включает аргинин.
В некоторых вариантах осуществления композиция может иметь вязкость менее чем приблизительно 50 сПз, менее чем приблизительно 40 сПз, менее чем приблизительно 30 сПз или менее чем приблизительно 20 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 5 до приблизительно 50 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 5 до приблизительно 40 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 5 до приблизительно 30 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 5 до приблизительно 20 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 10 до приблизительно 20 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 14 до приблизительно 16 сПз при 20°C. В некоторых вариантах осуществления композиция может иметь вязкость от приблизительно 14 сПз при 20°C.
В некоторых вариантах осуществления концентрация полисорбата может быть от приблизительно 0,01 до приблизительно 0,3 мг/мл. В некоторых вариантах осуществления концентрация полисорбата составляет приблизительно 0,2 мг/мл. В некоторых вариантах осуществления полисорбат представляет собой полисорбат 80.
В некоторых вариантах осуществления дисахарид может представлять собой трегалозу. В некоторых вариантах осуществления трегалоза представляет собой дигидрат трегалозы. В некоторых вариантах осуществления концентрация трегалозы может быть приблизительно 1 мг/мл до приблизительно 100 мг/мл. В некоторых вариантах осуществления концентрация трегалозы составляет приблизительно 84 мг/мл. В других вариантах осуществления концентрация трегалозы составляет приблизительно 50 мг/мл.
В других вариантах осуществления дисахаридный агент может представлять собой сахарозу. В некоторых вариантах осуществления концентрация сахарозы может быть от приблизительно 1 мг/мл до приблизительно 100 мг/мл. В некоторых вариантах осуществления концентрация сахарозы составляет приблизительно 50 мг/мл.
В некоторых вариантах осуществления буфер может представлять собой гистидиновый буфер. В некоторых вариантах осуществления концентрация гистидинового буфера может быть от приблизительно 1,0 до приблизительно 30 мМ. В некоторых вариантах осуществления концентрация гистидинового буфера составляет приблизительно 20 мМ гистидина.
В других вариантах осуществления буфер может представлять собой ацетатный буфер. В некоторых вариантах осуществления концентрация ацетатного буфера может быть от приблизительно 1,0 до приблизительно 30 мМ. В некоторых вариантах осуществления концентрация ацетатного буфера составляет приблизительно 20 мМ ацетата.
В некоторых вариантах осуществления хелатирующий агент может представлять собой EDTA, включая, например, без ограничения, динатрий EDTA и динатрий EDTA дигидрат. В некоторых вариантах осуществления концентрация EDTA может быть от приблизительно 0,01 до приблизительно 0,3 мг/мл. В некоторых вариантах осуществления концентрация EDTA может быть приблизительно 0,01 мг/мл, приблизительно 0,05 мг/мл, приблизительно 0,1 мг/мл, приблизительно 0,15 мг/мл, приблизительно 0,2 мг/мл, приблизительно 0,25 мг/мл или приблизительно 0,3 мг/мл. В некоторых вариантах осуществления концентрация EDTA составляет приблизительно 0,04, приблизительно 0,045 или приблизительно 0,05 мг/мл.
В некоторых вариантах осуществления концентрация антитела может составлять от приблизительно 100 мг/мл до приблизительно 150 мг/мл. В некоторых вариантах осуществления концентрация антитела может быть приблизительно 130 мг/мл, приблизительно 135 мг/мл и приблизительно 140 мг/мл. В некоторых вариантах осуществления концентрация антитела составляет приблизительно 150 мг/мл. В некоторых вариантах осуществления концентрация антитела составляет приблизительно 120 мг/мл.
В некоторых вариантах осуществления композиция может дополнительно включать аргинин. В некоторых вариантах осуществления концентрация аргинина составляет от приблизительно 25 мМ до приблизительно 300 мМ, предпочтительно приблизительно 50 мМ, приблизительно 100 мМ, приблизительно 150 мМ, приблизительно 200 мМ или приблизительно 250 мМ.
В некоторых вариантах осуществления композиция может дополнительно включать пролин. В некоторых вариантах осуществления концентрация пролина составляет от приблизительно 25 мМ до приблизительно 300 мМ, предпочтительно приблизительно 100 мМ или приблизительно 200 мМ.
В некоторых вариантах осуществления композиция по существу состоит из приблизительно 150 мг/мл анти-PD-1 антитела; приблизительно 20 мМ гистидинового буфера; приблизительно 84 мг/мл дигидрата трегалозы; приблизительно 0,2 мг/мл PS80; и приблизительно 0,05 мг/мл EDTA. В некоторых вариантах осуществления композиция имеет pH 5,0 +/- 0,5.
В некоторых вариантах осуществления композиция по существу состоит из приблизительно 150 мг/мл анти-PD-1 антитела; приблизительно 20 мМ гистидинового буфера; приблизительно 100 мМ аргинина HCl, приблизительно 50 мг/мл дигидрата трегалозы; приблизительно 0,2 мг/мл PS80; и приблизительно 0,05 мг/мл EDTA. В некоторых вариантах осуществления композиция имеет pH 5,0 +/- 0,5 и вязкость от приблизительно 10 сПз до приблизительно 16 сПз при 20°C. В некоторых вариантах осуществления композиция имеет вязкость приблизительно 15 сПз при 20°C.
В некоторых вариантах осуществления композиция по существу состоит из приблизительно 100 мг/мл, приблизительно 110 мг/мл, приблизительно 120 мг/мл, приблизительно 130 мг/мл, приблизительно 140 мг/мл, приблизительно 145 мг/мл, приблизительно 148 мг/мл, приблизительно 149 мг/мл, приблизительно 150 мг/мл, приблизительно 151 мг/мл или приблизительно 152 мг/мл антитела, приблизительно 20 мМ гистидинового буфера, приблизительно 84 мг/мл дигидрата трегалозы, приблизительно 0,2 мг/мл PS80, приблизительно 0,05 мг/мл EDTA, и композиция имеет pH 5,0 +/- 0,5. В некоторых вариантах осуществления композиция имеет вязкость от приблизительно 10 сПз до приблизительно 16 сПз при 20°C.
В некоторых вариантах осуществления композиция по существу состоит из приблизительно 100 мг/мл, приблизительно 110 мг/мл, приблизительно 120 мг/мл, приблизительно 130 мг/мл, приблизительно 140 мг/мл, приблизительно 145 мг/мл, приблизительно 148 мг/мл, приблизительно 149 мг/мл, приблизительно 150 мг/мл, приблизительно 151 мг/мл или приблизительно 152 мг/мл анти-PD-1 антитела, приблизительно 20 мМ гистидинового буфера, приблизительно 84 мг/мл трегалозы, приблизительно 0,2 мг/мл PS80, приблизительно 0,05 мг/мл EDTA, и композиция имеет pH 5,0 +/- 0,5.
В некоторых вариантах осуществления композиция по существу состоит из приблизительно 150 мг/мл анти-PD-1 антитела, приблизительно 20 мМ гистидинового буфера, приблизительно 84 мг/мл дигидрата трегалозы, приблизительно 0,2 мг/мл PS80, приблизительно 0,05 мг/мл EDTA, и композиция имеет pH 5,0 +/- 0,5.
В некоторых вариантах осуществления антитело может представлять собой человеческое антитело, гуманизированное антитело или химерное антитело. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело относится к подклассу IgG1, IgG2, IgG2Δa, IgG3, IgG4, IgG4Δb, IgG4Δc, IgG4 S228P, IgG4Δb S228P и IgG4Δc S228P человека. В некоторых вариантах осуществления антитело относится к изотипу IgG4 и включает стабилизированную шарнирную область, например S228P.
В некоторых вариантах осуществления антитело может представлять собой PF-06801591, ниволумаб, пембролизумаб, цемиплимаб или спартализумаб. В других вариантах осуществления антитело может представлять собой антиген-связывающую часть PF-06801591, ниволумаба, пембролизумаба, цемиплимаба или спартализумаба.
В некоторых вариантах осуществления антитело может включать вариабельную область тяжелой цепи (VH), включающую первую определяющую комплементарность область VH (CDR1), VH CDR2 и VH CDR3 последовательности VH, показанной в SEQ ID NO: 2; и/или вариабельную область легкой цепи (VL), включающую VL CDR1, VL CDR2 и VL CDR3 последовательности VL, показанной в SEQ ID NO: 3. В некоторых вариантах осуществления VH CDR1 включает аминокислотную последовательность, показанную в SEQ ID NO: 4, VH CDR2 включает аминокислотную последовательность, показанную в SEQ ID NO: 5, и VH CDR3 включает аминокислотную последовательность, показанную в SEQ ID NO: 6, VL CDR1 включает аминокислотную последовательность, показанную в SEQ ID NO: 7, VL CDR2 включает аминокислотную последовательность, показанную в SEQ ID NO: 8, и VL CDR3 включает аминокислотную последовательность, показанную в SEQ ID NO: 9.
В некоторых вариантах осуществления VH область включает аминокислотную последовательность, показанную в SEQ ID NO: 2, или вариант с одной или несколькими консервативными аминокислотными заменами в остатках, которые не находятся в CDR, и/или VL область включает аминокислотную последовательность, показанную в SEQ ID NO: 3, или ее вариант с одной или несколькими аминокислотными заменами в аминокислотах, которые не находятся в CDR. В некоторых вариантах осуществления антитело может включать аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности вариабельной области тяжелой цепи, показанной в SEQ ID NO: 2, и аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности вариабельной области легкой цепи, показанной в SEQ ID NO: 3. В некоторых вариантах осуществления антитело может включать последовательность вариабельной области тяжелой цепи, включающую аминокислотную последовательность, показанную в SEQ ID NO: 10, последовательность вариабельной области легкой цепи, включающую аминокислотную последовательность, показанную в SEQ ID NO: 11. В некоторых вариантах осуществления антитело включает VH область, продуцируемую вектором экспрессии с ATCC Accession No. PTA-121183. В некоторых вариантах осуществления антитело включает VL область, продуцируемую вектором экспрессии с ATCC Accession No. PTA-121182. В некоторых вариантах осуществления антитело представляет собой антитело, которое специфически связывается с PD-1 и конкурирует с и/или связывается с тем же PD-1 эпитопом, что и антитела, описанные в настоящей заявке.
В некоторых вариантах осуществления композиция по существу состоит из приблизительно 150 мг/мл PF-06801591, приблизительно 20 мМ гистидинового буфера, приблизительно 84 мг/мл дигидрата трегалозы, приблизительно 0,2 мг/мл PS80 и приблизительно 0,05 мг/мл EDTA; при этом композиция имеет pH 5,0 +/- 0,1 и не содержит никакого метионина или аргинина. В некоторых вариантах осуществления композиция по существу состоит из приблизительно 150 мг/мл ниволумаба, приблизительно 20 мМ гистидинового буфера, приблизительно 84 мг/мл дигидрата трегалозы, приблизительно 0,2 мг/мл PS80 и приблизительно 0,05 мг/мл EDTA; при этом композиция имеет pH 5,0 +/- 0,1 и не содержит никакого метионина или аргинина. В некоторых вариантах осуществления композиция по существу состоит из приблизительно 150 мг/мл пембролизумаба, приблизительно 20 мМ гистидинового буфера, приблизительно 84 мг/мл дигидрата трегалозы, приблизительно 0,2 мг/мл PS80 и приблизительно 0,05 мг/мл EDTA; при этом композиция имеет pH 5,0 +/- 0,1 и не содержит никакого метионина или аргинина.
В некоторых вариантах осуществления композиция может не быть лиофилизированной. В других вариантах осуществления композиция может быть лиофилизированной.
Также в настоящей заявке представлены способы для лечения состояния у субъекта, которые включают: введение субъекту, нуждающемуся в этом, эффективного количества фармацевтической композиции, описанной в настоящей заявке. В некоторых вариантах осуществления состояние представляет собой рак. В некоторых вариантах осуществления рак выбран из группы, состоящей из гастрального рака, саркомы, лимфомы, лейкоза, рака головы и шеи, назофарингеального рака, рака тимуса, эпителиального рака, эпителиального рака яичников, рака слюнной железы, рака печени, рака желудка, рака щитовидной железы, рака легкого (включая, например, без ограничения, немелкоклеточный рак легкого), рака яичников, рака фаллопиевых труб, рака молочной железы (включая, например, без ограничения, трижды отрицательный рак молочной железы), рака предстательной железы, эзофагеального рака, рака поджелудочной железы, глиомы, лейкоза, множественной миеломы, почечноклеточной карциномы, рака мочевого пузыря, цервикального рака, хориокарциномы, рака толстой кишки, колоректального рака, рака ротовой полости, рака кожи, перитонеального рака и меланомы. В некоторых вариантах осуществления субъект представляет собой ранее лечившегося взрослого пациента с местнораспространенной или метастатической меланомой, плоскоклеточным раком головы и шеи (SCHNC), карциномой яичника, саркомой или рецидивной или рефрактерной классической лимфомой Ходжкина (cHL). В некоторых вариантах осуществления рак может представлять собой платина-резистентный и/или платина-рефрактерный рак, такой как, например, платина-резистентный и/или рефрактерный рак яичников, платина-резистентный и/или рефрактерный рак молочной железы или платина-резистентный и/или рефрактерный рака легкого.
В некоторых вариантах осуществления фармацевтическую композицию анти-PD-1 антитела, представленную в настоящей заявке, вводят при дозе от приблизительно 25 мг до приблизительно 1000 мг, предпочтительно приблизительно 50 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг или приблизительно 800 мг. В некоторых вариантах осуществления композицию вводят при дозе от приблизительно 0,5 мг/кг до приблизительно 15 мг/кг, предпочтительно приблизительно 0,5 мг/кг, приблизительно 1,0 мг/кг, приблизительно 3,0 мг/кг, приблизительно 5,0 мг/кг или приблизительно 10 мг/кг. В некоторых вариантах осуществления композицию вводят один раз в 7, 14, 21 или 28 дней. В некоторых вариантах осуществления композицию вводят подкожно. В других вариантах осуществления композицию вводят внутривенно. В некоторых вариантах осуществления композицию вводят в виде одной 2 мл подкожной инъекции. В некоторых вариантах осуществления композицию вводят один раз в три недели. В некоторых вариантах осуществления композицию вводят один раз в четыре недели. В некоторых вариантах осуществления композицию вводят при дозе 300 мг подкожно. В некоторых вариантах осуществления композицию вводят в виде подкожной дозы 300 мг один раз в 28 дней.
Также в настоящей заявке представлены способы ингибирования роста или прогрессирования опухоли у субъекта, у которого имеется опухоль, включающие введение субъекту эффективного количества фармацевтической композиции, описанной в настоящей заявке.
Также в настоящей заявке представлены способы ингибирования или предотвращения метастазирования раковых клеток у субъекта, включающие введение субъекту, нуждающемуся в этом, эффективного количества фармацевтической композиции, описанной в настоящей заявке.
Также в настоящей заявке представлены способы индуцирования регрессии опухоли у субъекта, который имеет PD-1-экспрессирующую опухоль, включающие введение субъекту эффективного количества фармацевтической композиции, описанной в настоящей заявке.
В некоторых вариантах осуществления антитело, описанное в настоящей заявке, можно вводить субъекту парентерально. В некоторых вариантах осуществления субъектом является человек.
В некоторых вариантах осуществления способ может дополнительно включать введение эффективного количества по меньшей мере одного другого терапевтического средства. В некоторых вариантах осуществления терапевтическое средство представляет собой, например, кризотиниб, палбоциклиб, талазопариб, анти-CTLA4 антитело, анти-4-1BB антитело, анти-OX40 антитело, второе антитело к PD-1, CAR-T клетку или химиотерапевтическое средство.
Также в настоящей заявке представлены применения любой из фармацевтических композиций анти-PD-1 антител, представленных в настоящей заявке, в изготовлении лекарственного средства для лечения рака или для ингибирования роста или прогрессирования опухоли у субъекта, нуждающегося в этом.
Также представлены фармацевтические композиции анти-PD-1 антител для применения в лечении рака или для ингибирования роста или прогрессирования опухоли у субъекта, нуждающегося в этом. В некоторых вариантах осуществления рак представляет собой, например, без ограничения, гастральный рак, саркому, лимфому, лимфому Ходжкина, лейкоз, рак головы и шеи, рак тимуса, эпителиальный рак, рак слюнной железы, рак печени, рак желудка, рак щитовидной железы, рак легкого (включая, например, немелкоклеточную карциному легкого), рак яичников, рак молочной железы, рак предстательной железы, эзофагеальный рак, рак поджелудочной железы, глиому, лейкоз, множественную миелому, почечноклеточную карциному, рак мочевого пузыря, цервикальный рак, хориокарциному, рак толстой кишки, рак ротовой полости, рак кожи и меланому.
Также в настоящей заявке представлены способы для усиления иммуногенности или терапевтического эффекта вакцины для лечения рака у млекопитающего, в частности у человека, при этом такой способ включает введение млекопитающему, принимающему вакцину, эффективного количества композиции анти-PD-1 антитела, представленной в настоящем раскрытии.
Также в настоящей заявке представлены способы для лечения рака у млекопитающего, в частности у человека, при этом такой способ включает введение млекопитающему (1) эффективного количества вакцины, способной вызывать иммунный ответ против клеток рака, и (2) эффективного количества фармацевтической композици анти-PD-1 антитела, представленной в настоящем раскрытии. В некоторых вариантах осуществления композицию вводят в виде подкожной билатеральной дозы от приблизительно 125 до приблизительно 300 мг. В некоторых вариантах осуществления композицию вводят в виде подкожной билатеральной дозы 300 мг.
Краткое описание чертежей
Фиг. 1 представляет график сравнения вязкости композиций анти-PD-1 антител при различных значениях pH.
Фиг. 2 представляет график сравнения вязкости композиций анти-PD-1 антител при изменении концентраций аргинина HCl.
Фиг. 3 представляет график сравнения вязкости композициии анти-PD-1 антитела при различных значениях pH.
Фиг. 4 представляет график сравнения вязкости композиций анти-PD-1 антител при добавлении 100 мМ аргинина HCl, с пролином или без него.
Фиг. 5 представляет график сравнения вязкости композиций анти-PD-1 антител 7 и 8.
Фиг. 6 представляет график, показывающий гетерогенность гликанов в анти-PD-1 антителе mAb7.
Фиг. 7 представляет график, показывающий термические свойства различных анти-PD-1 антител в композиции 7.
Подробное описание изобретения
В настоящей заявке раскрыты композиции, имеющие пониженную вязкость. Предпочтительно, композиции стабильно поддерживают высокие концентрации биоактивного антитела в растворе и являются подходящими для парентерального введения, включая или подкожную, внутривенную, внутримышечную, интраперитонеальную или внутрикожную инъекцию.
Общие методы
При осуществлении настоящего изобретения на практике будут использоваться, если не указано иное, обычные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах компетенции специалистов в данной области. Такие методы полностью описаны в литературе, например, в Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995.
Определения
Следующие термины, если не указано иное, следует понимать как имеющие следующие значения: термин "выделенная молекула" (где молекула представляет собой, например, полипептид, полинуклеотид или антитело) представляет собой молекулу, которая в силу своего происхождения или источника, из которого она происходит, (1) не связана с природно-ассоциируемыми компонентами, которые сопутствуют ей в ее природном состоянии, (2) по существу не содержит других молекул из того же вида, (3) экспрессируется клеткой из другого вида, или (4) не встречается в природе. Таким образом, молекула, которая синтезируется химическим путем или экспрессируется в клеточной системе, отличной от клетки, из которой она происходит в естественных условиях, будет "выделенной" из естественно связанных с ней компонентов. Молекулу также можно сделать по существу свободной от естественно связанных компонентов путем выделения с использованием методов очистки, хорошо известных в данной области. Чистоту или гомогенность молекул можно определить рядом способов, хорошо известных в данной области. Например, анализ чистоты образца полипептида можно осуществить с использованием электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида с использованием методов, хорошо известных в данной области. Для некоторых целей можно обеспечить более высокое разрешение с использованием ВЭЖХ или других средств очистки, хорошо известных в данной области техники.
В контексте настоящей заявки термины "препарат" или "композиция", когда это относится к антителу, предназначены для описания антитела в комбинации с фармацевтически приемлемым эксципиентом, включающим по меньшей мере один регулятор тоничности, по меньшей мере один буфер, по меньшей мере один хелатирующий агент, по меньшей мере одно поверхностно-активное вещество, где pH имеет определенное выше значение.
Термины "фармацевтическая композиция" или "фармацевтический препарат" относятся к препаратам, которые находятся в такой форме, которая делает эффективной биологическую активность активных ингредиентов.
"Фармацевтически приемлемые эксципиенты" (носители, добавки) представляют собой такие вещества, которые можно безопасно вводить субъекту для обеспечения эффективной дозы используемого активного ингредиента. Термин "эксципиент" или "носитель" в контексте настоящей заявки относится к инертному веществу, которое обычно используется в качестве разбавителя, наполнителя, консерванта, связующего или стабилизатора для лекарственных средств. В контексте настоящей заявки термин "разбавитель" относится к фармацевтически приемлемому (безопасному и нетоксичному для введения человеку) растворителю и полезному в настоящем изобретении для получения жидких композиций. Примеры разбавителей включают, но не ограничиваются этим, стерильную воду и бактериостатическую воду для инъекций (BWFI).
“Антитело” представляет собой молекулу иммуноглобулина, способную к специфическому связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. В контексте настоящей заявки этот термин охватывает не только интактные поликлональные или моноклональные антитела, но также, если не указано иное, любую их антиген-связывающую часть, которая конкурирует с интактным антителом за специфическое связывание, слитые белки, включающие антиген-связывающую часть, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт распознавания антигена. Антиген-связывающие части включают, например, Fab, Fab’, F(ab’)2, Fd, Fv, доменные антитела (dAb, например, акульи и верблюжьи антитела), фрагменты, включающие определяющие комплементарность области (CDR), одноцепочечные вариабельные фрагменты антител (scFv), максиантитела, миниантитела, интраантитела, диатела, триатела, тетратела, v-NAR и bis-scFv и полипептиды, которые содержат по меньшей мере часть иммуноглобулина, которая является достаточной для придания специфических антиген-связывающих свойств полипептиду. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или их подкласс), и антитело необязательно должно быть какого-либо определенного класса. В зависимости от аминокислотной последовательности константной области тяжелых цепей иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно далее разделить на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелых цепей, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и пространственные конфигурации различных классов иммуноглобулинов хорошо известны.
“Вариабельная область” антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, отдельно или в комбинации. Как известно в данной области техники, каждая вариабельная область тяжелой и легкой цепей состоит из четырех каркасных областей (FR), соединенных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области, и вносит вклад в образование антиген-связывающего сайта антител. Если желательны варианты рассматриваемой вариабельной области, в частности с заменой аминокислотных остатков вне CDR (то есть в каркасной области), соответствующую аминокислотную замену, предпочтительно консервативную аминокислотную замену, можно идентифицировать путем сравнения рассматриваемой вариабельной области с вариабельными областями других антител, которые содержат последовательности CDR1 и CDR2 того же канонического класса, что и рассматриваемая вариабельная область (Chothia and Lesk, J Mol Biol 196 (4): 901-917, 1987).
В некоторых вариантах осуществления окончательное уточнение CDR и идентификацию остатков, составляющих сайт связывания антитела, осуществляют путем установления структуры антитела и/или установления структуры комплекса антитело-лиганд. В некоторых вариантах осуществления это можно осуществить любым из множества методов, известных специалистам в данной области техники, таких как рентгеновская кристаллография. В некоторых вариантах осуществления можно использовать различные методы анализа для идентификации или аппроксимации CDR областей. Примеры таких методов включают, но не ограничиваются этим, определение по Кабату, определение по Чотиа, определение методом AbM, контактное определение и конформационное определение.
Определение по Кабату является стандартом для нумерации остатков в антителе и обычно используется для идентификации CDR областей. См., например, Johnson & Wu, 2000, Nucleic Acids Res., 28: 214-8. Определение по Чотиа похоже на определение по Кабату, но определение по Чотиа учитывает положения определенных структурных петлевых областей. См., например, Chothia et al., 1986, J. Mol. Biol., 196: 901-17; Chothia et al., 1989, Nature, 342: 877-83. Для определения AbM-методом используют интегрированный набор компьютерных программ, созданных Oxford Molecular Group, которые моделируют структуру антител. См., например, Martin et al., 1989, Proc Natl Acad Sci (USA), 86:9268-9272; “AbM™, A Computer Program for Modeling Variable Regions of Antibodies,” Oxford, UK; Oxford Molecular, Ltd. AbM определение моделирует третичную структуру антитела из первичной последовательности с использованием комбинации информационных баз знаний и методов ab initio, таких как методы, описанные Samudrala et al., 1999, “Ab Initio Protein Structure Prediction Using a Combined Hierarchical Approach,” in PROTEINS, Structure, Function and Genetics Suppl., 3:194-198. Контактное определение основано на анализе имеющихся сложных кристаллических структур. См., например, MacCallum et al., 1996, J. Mol. Biol., 5:732-45. В другом подходе, указанном выше как "конформационное определение" CDRs, положения CDRs могут быть идентифицированы как остатки, которые вносят энтальпийный вклад в связывание антигена. См., например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166. Некоторые другие определения границ CDRs могут не находиться в строгом соответствии с одним из вышеперечисленных подходов, но, тем не менее, будут перекрываться по меньшей мере с частью CDRs по Кабату, хотя они могут быть сокращены или удлинены с учетом прогнозируемых или полученных экспериментальных данных, что конкретные остатки или группы остатков не оказывают существенного влияния на связывание с антигеном. В контексте настоящей заявки термин CDR может относиться к CDR, определенным с использованием любого подхода, известного в данной области, включая комбинации подходов. В способах, используемых в настоящем изобретении, можно использовать CDR, определенные с использованием любого из этих подходов. Для любого данного варианта осуществления, содержащего более одной CDR, CDR могут быть определены в соответствии с любым из определений по Кабату, по Чотиа, расширенным, AbM, контактным и/или конформационным определением.
Как известно в данной области, "константная область" антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, отдельно или в комбинации.
В контексте настоящей заявки термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифическими, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение "моноклональное" указывает на характер антитела как полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требующий получения антитела каким-либо конкретным методом. Например, моноклональные антитела для использования в соответствии с настоящим изобретением могут быть получены гибридомным методом, впервые описанным Kohler and Milstein, 1975, Nature 256: 495, или могут быть получены методами рекомбинантной ДНК, такими как описанные в патенте США № 4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, полученных с использованием методов, описанных, например, в McCafferty et al., 1990, Nature 348:552-554. В контексте настоящей заявки "гуманизированное" антитело относится к формам нечеловеческих (например, мышиных) антител, которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антиген-связывающие субпоследовательности антител), которые содержат минимальную последовательность, происходящую из нечеловеческого иммуноглобулина. Предпочтительно гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентные антитела), в которых остатки из CDR реципиента заменены остатками из CDR не являющегося человеческим антитела (донорное антитело), такого как мышиное, крысиное или кроличье, имеющего желаемую специфичность, аффинность и активность. Гуманизированное антитело может включать остатки, которых нет ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях, но которые включены для дальнейшего улучшения и оптимизации работы антитела.
“Человеческое антитело” представляет собой антитело, которое имеет аминокислотную последовательность, которая соответствует последовательности антитела, продуцируемой человеком и/или которая создана с использованием любого из методов для получения человеческого антитела, раскрытого в настоящей заявке. Это определение человеческого антитела специально исключает гуманизированное антитело, включающее антиген-связывающие остатки не относящегося к человеку вида.
В контексте настоящей заявки термин "человеческое антитело" предполагает включение антител, имеющих вариабельные и константные области, происходящие из последовательностей иммуноглобулинов зародышевой линии человека. Это определение человеческого антитела включает антитела, включающие по меньшей мере один полипептид человеческой тяжелой цепи или по меньшей мере один полипептид человеческой легкой цепи. Человеческие антитела по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов зародышевой линии человека (например, мутации, введенные методом неспецифического или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo), например в CDRs и особенно в CDR3. Однако термин "человеческое антитело" в контексте настоящей заявки не предполагает включение антител, в которых последовательности CDR, происходящие из зародышевой линии другого вида млекопитающих, такого как мышь, были привиты на человеческие каркасные последовательности.
Термин “химерное антитело” относится к антителам, в которых последовательности вариабельных областей происходят из одного вида, а последовательности константных областей происходят из другого вида, таким как антитело, в котором последовательности e вариабельных областей происходят из мышиного антитела, а последовательности константных областей происходят из человеческого антитела.
В контексте настоящей заявки "гуманизированное" антитело относится к формам не-человеческих (например мышиных) антител, которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антиген-связывающие субпоследовательности антител), которые содержат минимальную последовательность, происходящую из нечеловеческого иммуноглобулина. Предпочтительно, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR отличного от человека вида (донорное антитело), такого как мышь, крыса или кролик, с желаемой специфичностью, аффинностью и активностью. В некоторых случаях, остатки каркасной области (FR) Fv человеческого иммуноглобулина заменены соответствующими остатками от не относящегося к человеку вида. Кроме того, гуманизированное антитело может включать остатки, которые не встречаются ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях, но включены для дальнейшего улучшения и оптимизации функционирования антитела. Как правило, гуманизированное антитело будет включать по существу все из по меньшей мере одного, и типично двух вариабельных доменов, в которых все или по существу все из CDR областей соответствуют областям нечеловеческого иммуноглобулина, и все или по существу все из FR областей образованы из консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также будет включать по меньшей мере часть константной области или домена (Fc) иммуноглобулина, типично человеческого иммуноглобулина. Другие формы гуманизированных антител имеют одну или несколько CDR (CDR L1, CDR L2, CDR L3, CDR H1, CDR H2 или CDR H3), которые являются измененными относительно исходного антитела, которые также называют одной или несколькими CDR, “происходящими из” одной или нескольких CDR из исходного антитела.
В контексте настоящей заявки термин “mAb7” используется как относящийся к анти-PD-1 антителу, включающему аминокислотную последовательность вариабельной области тяжелой цепи и легкой цепи, показанную в SEQ ID NO: 2 и SEQ ID NO: 3, соответственно.
Аминокислотная последовательность вариабельной области тяжелой цепи mAb7:
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWINWVRQAPGQGLEWMGNIYPGSSLTNYNEKFKNRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARLSTGTFAYWGQGTLVTVSS (SEQ ID NO: 2)
аминокислотная последовательность вариабельной области легкой цепи mAb7:
DIVMTQSPDSLAVSLGERATINCKSSQSLWDSGNQKNFLTWYQQKPGQPPKLLIYWTSYRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQNDYFYPHTFGGGTKVEIK (SEQ ID NO: 3)
Генерирование и определение характеристик mAb7 описаны в Примерах заявки WO2016/092419, полное содержание которой включено в настоящую заявку посредством ссылки. В некоторых вариантах осуществления термин "mAb7" относится к иммуноглобулину, кодируемому (a) полинуклеотидом, кодирующим вариабельную область легкой цепи mAb7, который имеет депозитарный номер ATCC No. PTA-121182, и (b) полинуклеотидом, кодирующим mAb7 вариабельную область тяжелой цепи, который имеет депозитарный номер ATCC No. PTA-121183.
Термин "эпитоп" относится к той части молекулы, которая может распознаваться и связываться антителом на одном или нескольких антиген-связывающих участках антитела. Эпитопы часто состоят из поверхностных групп молекул, таких как аминокислоты или боковые цепи сахаров, и имеют определенные пространсветнные структурные характеристики, а также определенные характеристики заряда. В некоторых вариантах осуществления эпитоп может представлять собой белковый эпитоп. Белковые эпитопы могут быть линейными или конформационными. В линейном эпитопе все точки взаимодействия между белком и взаимодействующей молекулой (например, антителом) расположены линейно вдоль первичной аминокислотной последовательности белка. "Нелинейный эпитоп" или "конформационный эпитоп" включает несмежные полипептиды (или аминокислоты) в антигенном белке, с которым связывается антитело, специфическое в отношении этого эпитопа. Термин "антигенный эпитоп" в контексте настоящей заявки определяется как часть антигена, с которой антитело может специфически связываться, что можно определить любым методом, хорошо известным в данной области, например обычными иммуноанализами. После определения желаемого эпитопа на антигене можно генерировать антитела к этому эпитопу, например, с использованием методов, описанных в настоящем описании. Альтернативно, в процессе исследования генерация и определение характеристик антител могут дать информацию о желаемых эпитопах. На основе этой информации можно затем провести конкурентный скрининг антител на связывание с тем же эпитопом. Подход к достижению этого включает осуществление исследований конкуренции и перекрестной конкуренции для поиска антител, которые конкурируют или перекрестно конкурируют друг с другом за связывание с PD-1, например, антитела конкурируют за связывание с антигеном.
В контексте настоящей заявки термины "выделенное антитело" или "очищенное антитело" относятся к антителу, которое в силу своего происхождения или источника, из которого оно происходит, имеет одну-четыре из следующих характеристик: (1) не связано с природно ассоциированными компонентами, сопутствующими ему в его природном состоянии, (2) является свободным от других белков из того же вида, (3) экспрессируется клеткой из другого вида или (4) не присутствует в природе.
Антитело является "по существу чистым", "по существу гомогенным" или "по существу очищенным", когда по меньшей мере приблизительно 60-75% образца демонстрирует один вид антитела. По существу чистое антитело типично может составлять приблизительно 50%, 60%, 70%, 80% или 90% масс/масс образца антитела, более типично приблизительно 95%, и предпочтительно будет иметь чистоту более 99%. Чистоту или гомогенность антител можно определить различными способами, хорошо известными в данной области, такими как электрофорез в полиакриламидном геле или ВЭЖХ.
Термин "антитело" относится к антителу, которое связывается с мишенью и предотвращает или уменьшает биологический эффект этой мишени. В некоторых вариантах осуществления термин может означать антитело, которое препятствует мишени, например PD-1, с которой оно связывается, осуществлять биологическую функцию.
Антитело, которое “преимущественно связывается” или “специфически связывается” (используются взаимозаменяемо в настоящей заявке) с эпитопом, является термином, хорошо понятным в данной области, и способы для определения такого специфического или преимущественного связывания также хорошо известны в данной области. Молекула указывается как демонстрирующая “специфическое связывание” или “преимущественное связывание”, если она взаимодействует или вступает в ассоциацию с определенной клеткой или веществом более часто, более быстро, с большей продолжительностю и/или с большей аффинностью, чем с альтернативными клетками или веществами. Антитело “специфически связывается” или “преимущественно связывается” с мишенью, если оно с ней связывается с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем с другими веществами. Например, антитело, которое специфически или преимущественно связывается с эпитопом PD-1, представляет собой антитело, которое связывается с последовательностью этого эпитопа с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими последовательностями. Из этого определения также должно быть понятно, что, например, антитело (или фрагмент или эпитоп), которое специфически или преимущественно связывается с первой мишенью, может специфически или преимущественно связываться, или не связываться, со второй мишенью. Таким образом, “специфическое связывание” или “преимущественное связывание” необязательно требует (хотя может включать) эксклюзивное связывание. Как правило, но необязательно, "связывание" означает преимущественное связывание.
В контексте настоящей заявки "иммуноспецифическое" связывание антител относится к антиген-специфическому связывающему взаимодействию, которое происходит между антиген-связывающим сайтом антитела и специфическим антигеном, распознаваемым этим антителом (т.е. антитело взаимодействует с белком в ELISA или другом иммуноанализе и не взаимодействует определяемым образом с неродственными белками).
Термин "конкурировать", как он используется в настоящей заявке в отношении антитела, означает, что первое антитело или его антиген-связывающий фрагмент связывается с эпитопом образом, достаточно похожим на связывание второго антитела или его антиген-связывающего фрагмента, таким образом, результат связывания первого антитела с его когнатным эпитопом заметно уменьшается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернативно, может быть, хотя и необязательно, что связывание второго антитела с его эпитопом также заметно снижается в присутствии первого антитела. То есть, первое антитело может ингибировать связывание второго антитела с его эпитопом без ингибирования вторым антителом связывания первого антитела с его соответствующим эпитопом. Однако, когда каждое антитело заметно ингибирует связывание другого антитела с его когнатным эпитопом или лигандом в такой же, большей или меньшей степени, антитела называют "перекрестно конкурирующими" друг с другом за связывание с их соответствующим эпитопом(эпитопами). Как конкурирующие, так и перекрестно конкурирующие антитела охватываются настоящим изобретением. Независимо от механизма, посредством которого осуществляется такая конкуренция или перекрестная конкуренция (например пространственное затруднение, конформационное изменение или связывание с общим эпитопом или его частью), специалистам в данной области должно быть понятно на основании раскрытия, представленного в настоящей заявке, что такие конкурирующие и/или перекрестно конкурирующие антитела охвачены или могут быть полезны для способов, раскрытых в настоящем изобретении.
В контексте настоящей заявки термин “PD-1” относится к любой форме PD-1 и ее вариантам, которые сохраняют по меньшей мере часть активности PD-1. Если не указано иное, например при конкретном указании человеческого PD-1, PD-1 включает нативную последовательность PD-1 всех видов млекопитающих, например, человека, собаки, кошки, лошади и быка. Один иллюстративный человеческий PD-1 можно найти в виде Uniprot Accession Number Q15116 (SEQ ID NO: 1).
MQIPQAPWPV VWAVLQLGWR PGWFLDSPDR PWNPPTFSPA LLVVTEGDNA
TFTCSFSNTS ESFVLNWYRM SPSNQTDKLA AFPEDRSQPG QDCRFRVTQL PNGRDFHMSV VRARRNDSGT YLCGAISLAP KAQIKESLRA ELRVTERRAE
VPTAHPSPSP RPAGQFQTLV VGVVGGLLGS LVLLVWVLAV ICSRAARGTI
GARRTGQPLK EDPSAVPVFS VDYGELDFQW REKTPEPPVP CVPEQTEYAT
IVFPSGMGTS SPARRGSADG PRSAQPLRPE DGHCSWPL (SEQ ID NO: 1).
В контексте настоящей заявки “анти-PD-1 антитело” относится к антителу, которое способно ингибировать биологическую активность PD-1 и/или нисходящие события, опосредованные PD-1. Анти-PD-1 антитела охватывают антитела, которые блокируют, антагонизируют, подавляют или уменьшают (до любой степени, в том числе существенно) биологическую активность PD-1, включая нисходящие события, опосредованные PD-1, такие как связывание с PD-L1 и нисходящие сигналы, связывание с PD-L2 и нисходящие сигналы, ингибирование T-клеточной пролиферации, ингибирование T-клеточной активации, ингибирование секреции IFN, ингибирование секреции IL-2, ингибирование секреции TNF, индукция IL-10 и ингибирование противоопухолевых иммунных ответов. Для целей настоящего изобретения необходимо четко понимать, что термин “анти-PD-1 антитело” (взаимозаменяемо используемый с термином “антитело к PD-1”) охватывает все ранее определенные термины, названия и функциональные состояния и характеристики, в соответствии с чем PD-1 как таковой, биологическая активность PD-1 или последствия биологической активности по существу сводятся к нулю, уменьшаются или нейтрализуются в любой значимой степени. В некоторых вариантах осуществления анти-PD-1 антитело связывается с PD-1 и активирует противоопухолевый иммунный ответ. Примеры анти-PD-1 антител представлены в настоящей заявке.
Термин “идентичность” относится к проценту “идентичности” двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот. Процент идентичности обычно определяется путем выравнивания последовательностей для целей оптимального сравнения (например, в первую последовательность могут быть введены гэпы для наилучшего выравнивания со второй последовательностью) и сравнения аминокислотных остатков или нуклеотидов в соответствующих положениях. "Лучшее выравнивание" означает выравнивание двух последовательностей, которое дает наивысший процент идентичности. Процент идентичности определяется путем сравнения количества идентичных аминокислотных остатков или нуклеотидов в последовательностях (т.е. % идентичности=количество идентичных положений/общее количество положений × 100)
Определение процента идентичности между двумя последовательностями можно осуществить с использованием математического алгоритма, известного специалистам в данной области. Примером математического алгоритма для сравнения двух последовательностей является алгоритм Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-2268, с модификациями, как описано в Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Программы NBLAST и XBLAST Altschul, et al (1990) J. Mol. Biol. 215:403-410 включают такой алгоритм. Поиск нуклеотидов BLAST можно осуществить с использованием программы NBLAST, оценка=100, длина слова=12, для получения нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты по изобретению. Поиск белков BLAST можно осуществить с использованием программы XBLAST, оценка=50, длина слова=3, для получения аминокислотных последовательностей, гомологичных молекулам белка по настоящему изобретению. Для получения выравниваний с гэпами в целях сравнения можно использовать Gapped BLAST, как описано в Altschul et al. (1997) Nucliec Acids Res. 25: 3389-3402. В качестве альтернативы, PSI-Blast можно использовать для повторного поиска, который обнаруживает отдаленные взаимосвязи между молекулами (Id.). При использовании программ BLAST, Gapped BLAST и PSI-Blast можно использовать параметры соответствующих программ по умолчанию (например, XBLAST и NBLAST). См. http://www.ncbi.nlm.nih.gov. Другим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Майерса и Миллера, CABIOS (1989). Программа ALIGN (версия 2.0), которая является частью пакета программного обеспечения для выравнивания последовательностей GCG, включает такой алгоритм. Другие алгоритмы анализа последовательностей, известные в данной области, включают ADVANCE и ADAM, как описано в Torellis and Robotti (1994) Comput. Appl. Biosci., 10:3-5; и FASTA, описанный в Pearson and Lipman (1988) Proc. Natl. Acad. Sci. 85:2444-8. В FASTA ktup означает опцию управления, которая устанавливает чувствительность и скорость поиска.
В контексте настоящей заявки термин "лечение" означает подход для получения полезных или желательных клинических результатов. Для целей настоящего изобретения полезные или желательные клинические результаты включают, но не ограничиваются этим, один или более из следующего: уменьшение пролиферации (или разрушение) неопластических или раковых клеток, ингибирование метастазирования неопластических клеток, сокращение объема или уменьшение размера опухоли, ремиссия рака, уменьшение симптомов, вызванных раком, повышение качества жизни людей, страдающих от рака, уменьшение дозы других лекарственных средств, необходимых для лечения рака, замедление прогрессирования рака, излечивание рака и/или увеличение продолжительности жизни раковых пациентов.
В контексте настоящей заявки "эффективная доза" или "эффективное количество" лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для достижения любого одного или более полезных или желательных результатов. В более конкретных аспектах эффективное количество предотвращает, облегчает или ослабляет симптомы заболевания и/или увеличивает продолжительность жизни пациента, которого лечат. Для профилактического использования полезные или желательные результаты включают устранение или снижение риска, уменьшение тяжести или задержку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнений и промежуточных фенотипических проявлений, наблюдаемых при развитии заболевания. Для терапевтического использования полезные или желательные результаты включают клинические результаты, такие как уменьшение одного или более симптомов заболевания, такого как, например, рак, включающий, например, без ограничения, гастральный рак, саркому, лимфому, лимфому Ходжкина, лейкоз, рак головы и шеи, плоскоклеточный рак головы и шеи, рак тимуса, эпителиальный рак, рак слюнной железы, рак печени, рак желудка, рак щитовидной железы, рак легкого, рак яичника, рак молочной железы, рак предстательной железы, эзофагеальный рак, рак поджелудочной железы, глиому, лейкоз, множественную миелому, почечноклеточную карциному, рак мочевого пузыря, цервикальный рак, хориокарциному, рак толстой кишки, рак ротовой полости, рак кожи и меланому, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства и/или задержку прогрессирования рака у пациентов. Эффективную дозу можно вводить в виде одного или более введений. Для целей настоящего изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения либо непосредственно, либо опосредованно. Как понимается в клиническом контексте, эффективная доза лекарственного средства, соединения или фармацевтической композиции может достигаться, или не достигаться, в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективную дозу" можно рассматривать в контексте введения одного или нескольких терапевтических средств, и считается, что отдельное средство вводят в эффективном количестве, если в сочетании с одним или более другими средствами может быть достигнут или достигается нужный результат.
В контексте настоящей заявки термин "субъект" для целей лечения включает любого субъекта, и предпочтительно представляет собой субъекта, который нуждается в лечении целевого патологического состояния, например аутоиммунного заболевания. В целях профилактики, субъектом является любой субъект и предпочтительно субъект, который находится в группе риска или предрасположен к развитию целевого патологического состояния. Термин "субъект" предполагает включение живых организмов, например прокариот и эукариот. Примеры субъектов включают млекопитающих, например людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и отличных от человека трансгенных животных. В конкретных вариантах осуществления изобретения субъектом является человек.
В контексте настоящей заявки термины "полинуклеотид" или "нуклеиновая кислота", используемые в настоящей заявке взаимозаменяемо, означают полимерную форму нуклеотидов, как рибонуклеотидов, так и дезоксинуклеотидов, либо модифицированную форму любого типа нуклеотида, и может означать одноцепочечную или двухцепочечную форму. Последовательность "полинуклеотида" или "нуклеиновой кислоты" включает ее комплемент, если не указано иное. В контексте настоящей заявки термин "выделенный полинуклеотид" или "выделенная нуклеиновая кислота" означает полинуклеотид геномного, кДНК или синтетического происхождения или некоторую их комбинацию, при этом в силу своего происхождения или источника, из которого он происходит, выделенный полинуклеотид имеет одну-три из следующих характеристик: (1) не связан со всем или частью полинуклеотида, с которым "выделенный полинуклеотид" встречается в природе, (2) функционально связан с полинуклеотидом, с которым он не связан в природе, или (3) не встречается в природе как часть более крупной последовательности.
В контексте настоящей заявки термин "хелатирующий агент" представляет собой эксципиент, который может образовывать по меньшей мере одну связь (например, ковалентную, ионную или иную) с ионом металла. Хелатирующий агент обычно представляет собой мультидентатный лиганд, который можно использовать в композициях в качестве стабилизатора для образования комплекса с видами, которые в противном случае могли бы способствовать нестабильности.
В контексте настоящей заявки термин "буфер" относится к добавленной композиции, которая позволяет жидкой композиции антитела противостоять изменениям pH, типично путем действия компонентов ее кислотно-основного конъюгата. Когда указывают концентрацию буфера, подразумевается, что указанная концентрация представляет собой молярную концентрацию формы свободной кислоты или свободного основания буфера.
"Вязкость" в контексте настоящей заявки может означать "абсолютную вязкость" или "кинематическую вязкость". "Абсолютная вязкость", иногда называемая динамической или простой вязкостью, представляет собой величину, которая описывает сопротивление жидкости потоку. "Кинематическая вязкость" представляет собой соотношение абсолютной вязкости и плотности жидкости. Кинематическую вязкость часто определяют при характеристике резистивного потока жидкости с использованием капиллярного вискозиметра. Когда две жидкости равного объема помещают в одинаковые капиллярные вискозиметры, и они протекают под действием силы тяжести, вязкой жидкости требуется больше времени для протекания через капилляр, чем менее вязкой жидкости. Если одной жидкости требуется 200 секунд для полного протекания, а другой жидкости требуется 400 секунд, вторая жидкость будет в два раза более вязкой, чем первая по шкале кинематической вязкости. Если обе жидкости имеют одинаковую плотность, вторая жидкость в два раза более вязкая, чем первая, по шкале абсолютной вязкости. Величину кинематической вязкости определяют в L2/T, где L представляет собой длину, а T представляет собой время. Единицами измерения кинематической вязкости в системе СИ являются м2/сек. Обычно кинематическая вязкость выражается в сантистоксах, сСт, что эквивалентно мм2/сек. Величину абсолютной вязкости определяют в M/L/T, где M представляет собой массу, а L и T представляют собой длину и время соответственно. В системе СИ единицами измерения абсолютной вязкости являются Па⋅сек, что эквивалентно кг/м/сек. Абсолютную вязкость обыч®но выражают в сантипуазах, сПз, что эквивалентно миллиПаскаль-секунда, мПа⋅сек.
В контексте настоящей заявки термины "регулятор тоничности" или "модификатор тоничности" относятся к эксципиенту, который может регулировать осмотическое давление жидкой композиции антитела. В некоторых вариантах осуществления регулятор тоничности может регулировать осмотическое давление жидкой композиции антитела до изотонического, чтобы композиция антитела была физиологически совместима с клетками тканей тела субъекта. В других вариантах осуществления "регулятор тоничности" может способствовать повышению стабильности антител, описанных в настоящей заявке. "Изотоническая" композиция представляет собой композицию, которая имеет по существу такое же осмотическое давление, как у крови человека. Изотонические композиции обычно имеют осмотическое давление примерно от 250 до 350 мОсм. Термин "гипотонический" описывает композицию с осмотическим давлением ниже осмотического давления крови человека. Соответственно, термин "гипертонический" используется для описания композиции с осмотическим давлением, превышающим осмотическое давление крови человека. Изотоничность можно измерить с использованием осмометра давления пара или осмометра по точке замерзания, например. Регулятор тоничности может быть в энантиомерной (например, L- или D-энантиомер) или рацемической форме; в виде изомеров, таких как альфа или бета, включая альфа, альфа; или бета, бета; или альфа, бета; или бета, альфа; в форме свободной кислоты или свободного основания; в гидратированной форме (например, моногидрат) или в безводной форме.
В контексте настоящей заявки термин "полиол" относится к эксципиенту с множеством гидроксильных групп и включает сахара (редуцирующие и нередуцирующие сахара), сахарные спирты и сахарные кислоты.
В контексте настоящей заявки термин "поверхностно-активное вещество" относится к эксципиенту, который может изменять поверхностное натяжение жидкой композиции антитела. В некоторых вариантах осуществления поверхностно-активное вещество снижает поверхностное натяжение жидкой композиции антитела. В других вариантах осуществления "поверхностно-активное вещество" может способствовать повышению стабильности любого антитела в композиции. Поверхностно-активное вещество может уменьшать агрегацию сформулированного антитела и/или минимизировать образование частиц в композиции и/или уменьшать адсорбцию. Поверхностно-активное вещество может также улучшать стабильность антитела во время и после цикла замораживания/оттаивания.
В контексте настоящей заявки термин "сахарид" относится к классу молекул, которые являются производными многоатомных спиртов. Сахариды обычно называют углеводами, и они могут содержать различные количества сахарных (сахаридных) звеньев, например, моносахариды, дисахариды и полисахариды.
В контексте настоящей заявки термин "редуцирующий сахар" означает сахар, содержащий гемиацетальную группу, которая может восстанавливать ионы металлов или взаимодействовать ковалентно с лизином и другими аминогруппами в белках, а "нередуцирующий сахар" представляет собой сахар, который не обладает этими свойствами редуцирующего сахара.
"Лиопротектор" представляет собой молекулу, которая в комбинации с представляющим интерес белком значительно предотвращает или снижает физико-химическую нестабильность белка при лиофилизации и последующем хранении. Примеры лиопротекторов включают сахара и их соответствующие сахарные спирты; аминокислоту, такую как мононатрий глутамат или гистидин; метиламин, такой как бетаин; лиотропную соль, такую как сульфат магния; полиол, такой как трехатомные сахарные спирты или сахарные спирты с более высокой молекулярной массой, например глицерин, декстран, эритрит, глицерол, арабитол, ксилит, сорбит и маннит; пропиленгликоль; полиэтиленгликоль; Плюроникс®; и их комбинации. Дополнительные иллюстративные лиопротекторы включают глицерин и желатин, а также сахара, меллибиозу, мелецитозу, раффинозу, маннотриозу и стахиозу. Примеры редуцирующих сахаров включают глюкозу, мальтозу, лактозу, мальтулозу, изомальтулозу и лактулозу. Примеры нередуцирующих сахаров включают нередуцирующие гликозиды полигидроксисоединений, выбранные из сахарных спиртов и других многоатомных спиртов с прямой цепью. Предпочтительными сахарными спиртами являются моногликозиды, особенно те соединения, которые получают восстановлением дисахаридов, таких как лактоза, мальтоза, лактулоза и мальтулоза. Гликозидная боковая группа может быть глюкозидной или галактозидной. Дополнительными примерами сахарных спиртов являются глюцит, мальтит, лактит и изомальтулоза. Предпочтительными лиопротекторами являются нередуцирующие сахара трегалоза или сахароза.
Лиопротектор добавляют к предварительно лиофилизированной композиции в "лиопротекторном количестве", что означает, что после лиофилизации белка в присутствии лиопротекторного количества лиопротектора белок по существу сохраняет свою физико-химическую стабильность при лиофилизации и хранении.
В контексте настоящей заявки термин "фармацевтически приемлемый носитель" включает любое вещество, которое в комбинации с активным ингредиентом позволяет ингредиенту сохранять биологическую активность и не взаимодействует с иммунной системой субъекта. Примеры включают, но не ограничиваются этим, любые стандартные фармацевтические носители, такие как фосфатно-солевой буферный раствор, вода, эмульсии, такие как эмульсия масло/вода, и различные типы смачивающих агентов. Предпочтительными разбавителями для аэрозольного или парентерального введения являются фосфатно-солевой буферный раствор, нормальный (0,9%) физиологический раствор или 5% раствор декстрозы. Композиции, включающие такие носители, получают хорошо известными традиционными методами (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy, 20th Ed. Mack Publishing, 2000).
"Снижение заболеваемости" означает любое снижение степени тяжести (которое может включать уменьшение потребности и/или количества (например, воздействия) других лекарственных средств и/или терапий, обычно используемых для этого состояния. Как должно быть понятно специалистам в данной области, индивидуумы могут различаться, что касается их ответов на лечение, и, таким образом, например, "метод снижения заболеваемости" отражает введение анти-PD-1 антитела на основании разумного ожидания, что такое введение, вероятно, может вызвать такое снижение заболеваемости у этого конкретного индивидуума.
"Улучшение" означает уменьшение или улучшение одного или нескольких симптомов по сравнению с тем, когда не вводят анти-PD-1 антитело. "Улучшение" также включает сокращение или уменьшение продолжительности симптома.
Ссылка на "приблизительно" значения или параметра в настоящей заявке включает (и описывает) варианты осуществления, которые направлены на это значение или параметр как таковые. Например, описание, относящееся к "приблизительно X", включает описание "X". Числовые диапазоны включают числа, определяющие диапазон.
В тех случаях, когда аспекты или варианты осуществления изобретения описаны в терминах группы Маркуша или другой группировки альтернатив, настоящее изобретение охватывает не только всю группу, перечисленную в целом, но и каждого члена группы индивидуально и все возможные подгруппы основной группы, а также основную группу, в которой отсутствует один или несколько членов группы. Настоящее изобретение также предусматривает явное исключение одного или нескольких членов группы в заявленном изобретении.
При представлении элементов настоящего изобретения или его предпочтительных вариантов осуществления, артикли "a", "an", "the" и слово "указанный" предназначены для обозначения того, что существует один или несколько элементов. Термины "включающий", "включают", "включает", "включая" и "содержащий" предполагаются как инклюзивные и означают, что могут быть дополнительные элементы, отличные от перечисленных. Должно быть понятно, что если варианты осуществления описаны в настоящей заявке с использованием термина "включающий", также предусмотрены аналогичные варианты осуществления, описанные с использованием терминов "состоящий из" и/или "состоящий по существу из".
Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой принадлежит настоящее изобретение. В случае противоречия преимущество имеет настоящее описание, включая определения. В настоящем описании и формуле изобретения слово "включают" или варианты, такие как "включает" или "включающий", следует понимать как подразумевающие включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если иное не требуется по контексту, термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число.
В настоящей заявке описаны иллюстративные методы и материалы, однако, способы и материалы, подобные или эквивалентные тем, которые описаны в настоящей заявке, также можно использовать при осуществлении или испытании настоящего изобретения. Материалы, методы и примеры являются только иллюстративными и не предназначены для ограничения.
Композиции анти-PD-1 антител
В одном аспекте изобретение обеспечивает композицию, включающую анти-PD-1 антитело, которая имеет вязкость от приблизительно 1 сПз до приблизительно 25 сПз. В другом аспекте обеспечивается способ уменьшения вязкости анти-PD-1 антитело-содержащей композиции, при этом способ включает стадию добавления к композиции уменьшающего вязкость количества соединения, которое способно уменьшать вязкость водной композиции, включающей указанное анти-PD-1 антитело. Композиция может быть либо в водной, либо в лиофилизированной форме. В водной форме композиция может иметь вязкость не больше чем приблизительно 150 сПз, предпочтительно не больше чем приблизительно 120 сПз, предпочтительно не больше чем приблизительно 100 сПз, предпочтительно не больше чем приблизительно 90 сПз, предпочтительно не больше чем приблизительно 80 сПз, предпочтительно не больше чем приблизительно 70 сПз, предпочтительно не больше чем приблизительно 60 сПз, предпочтительно не больше чем приблизительно 50 сПз, предпочтительно не больше чем приблизительно 40 сПз, предпочтительно не больше чем приблизительно 30 сПз, предпочтительно не больше чем приблизительно 20 сПз, предпочтительно не больше чем приблизительно 10 сПз, предпочтительно не больше чем приблизительно 5 сПз. В некоторых вариантах осуществления композиция, включающая антитело, имеет вязкость в пределах от приблизительно 1 сПз до приблизительно 500 сПз, между приблизительно 1 сПз и 200 сПз, между приблизительно 1 сПз и приблизительно 150 сПз, между приблизительно 1 сПз и приблизительно 100 сПз, между приблизительно 1 сПз и приблизительно 90 сПз, между приблизительно 1 сПз и приблизительно 80 сПз, между приблизительно 1 сПз и приблизительно 70 сПз, между приблизительно 1 сПз и приблизительно 60 сПз, между приблизительно 1 сПз и приблизительно 50 сПз, между приблизительно 1 сПз и приблизительно 40 сПз, между приблизительно 1 сПз и приблизительно 30 сПз, между приблизительно 1 сПз и приблизительно 20 сПз или между приблизительно 1 сПз и приблизительно 10 сПз при 20°C. В некоторых вариантах осуществления композиция имеет вязкость приблизительно 120 сПз, приблизительно приблизительно 115 сПз, 110 сПз, приблизительно 105 сПз, приблизительно 100 сПз, приблизительно 95 сПз, приблизительно 90 сПз, приблизительно 85 сПз, приблизительно 80 сПз, приблизительно 75 сПз, приблизительно 70 сПз, приблизительно 65 сПз, приблизительно 60 сПз, приблизительно приблизительно 55 сПз, 50 сПз, приблизительно 45 сПз, приблизительно 40 сПз, приблизительно 35 сПз, приблизительно 30 сПз, приблизительно 25 сПз, приблизительно 20 сПз, приблизительно 15 сПз или приблизительно 10 сПз или приблизительно 5 сПз. В некоторых вариантах осуществления композиция имеет вязкость в пределах между 10 сПз и 50 сПз, между приблизительно 10 сПз и 100 сПз, между приблизительно 20 сПз и 60 сПз, между приблизительно 30 сПз и 60 сПз, между приблизительно 40 сПз и 60 сПз или между приблизительно 50 сПз и 60 сПз. В некоторых вариантах осуществления композиция в водной форме может иметь вязкость между приблизительно 1 сПз и 10 сПз. В некоторых вариантах осуществления композиция в водной форме может иметь вязкость между приблизительно 1 сПз и 15 сПз. В некоторых вариантах осуществления композиция в водной форме может иметь вязкость между приблизительно 1 сПз и 20 сПз.
Еще один аспект настоящего изобретения направлен на изделие, включающее контейнер, содержащий любую из композиций, описанных в настоящей заявке.
В некоторых вариантах осуществления композиция включает по меньшей мере одно анти-PD-1 антитело. В некоторых вариантах осуществления может присутствовать более чем одно антитело. Может присутствовать по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или более разных антител. Как правило, два или более разных антител имеют комплементарные активности, которые не оказывают отрицательного влияния друг на друга. Каждое из антител также можно использовать вместе с другими веществами, которые служат для усиления и/или дополнения эффективности антитела. Антитело может присутствовать в композиции при концентрации от приблизительно 0,1 до приблизительно 300 мг/мл. В некоторых вариантах осуществления концентрация антитела составляет приблизительно 0,5 мг/мл, приблизительно 1 мг/мл, приблизительно 2 мг/мл, приблизительно 2,5 мг/мл, приблизительно 3 мг/мл, приблизительно 3,5 мг/мл, приблизительно 4 мг/мл, приблизительно 4,5 мг/мл, приблизительно 5 мг/мл, приблизительно 5,5 мг/мл, приблизительно 6 мг/мл, приблизительно 6,5 мг/мл, приблизительно 7 мг/мл, приблизительно 7,5 мг/мл, приблизительно 8 мг/мл, приблизительно 8,5 мг/мл, приблизительно 9 мг/мл, приблизительно 9,5 мг/мл, приблизительно 10 мг/мл, приблизительно 11 мг/мл, приблизительно 12 мг/мл, приблизительно 13 мг/мл, приблизительно 14 мг/мл, приблизительно 15 мг/мл, приблизительно 16 мг/мл, приблизительно 17 мг/мл, приблизительно 18 мг/мл, приблизительно 19 мг/мл, приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 22 мг/мл, приблизительно 23 мг/мл, приблизительно 24 мг/мл, приблизительно 25 мг/мл, приблизительно 26 мг/мл, приблизительно 27 мг/мл, приблизительно 28 мг/мл, приблизительно 29 мг/мл, приблизительно 30 мг/мл, приблизительно 31 мг/мл, приблизительно 32 мг/мл, приблизительно 33 мг/мл, приблизительно 34 мг/мл, приблизительно 35 мг/мл, приблизительно 36 мг/мл, приблизительно 37 мг/мл, приблизительно 38 мг/мл, приблизительно 39 мг/мл, приблизительно 40 мг/мл, приблизительно 41 мг/мл, приблизительно 42 мг/мл, приблизительно 43 мг/мл, приблизительно 44 мг/мл, приблизительно 45 мг/мл, приблизительно 46 мг/мл, приблизительно 47 мг/мл, приблизительно 48 мг/мл, приблизительно 49 мг/мл, приблизительно 50 мг/мл, приблизительно 51 мг/мл, приблизительно 52 мг/мл, приблизительно 53 мг/мл, приблизительно 54 мг/мл, приблизительно 55 мг/мл, приблизительно 56 мг/мл, приблизительно 57 мг/мл, приблизительно 58 мг/мл, приблизительно 59 мг/мл, приблизительно 60 мг/мл, приблизительно 70 мг/мл, приблизительно 80 мг/мл, приблизительно 90 мг/мл, приблизительно 100 мг/мл, приблизительно 101 мг/мл, приблизительно 102 мг/мл, приблизительно 102,5 мг/мл, приблизительно 103 мг/мл, приблизительно 103,5 мг/мл, приблизительно 104 мг/мл, приблизительно 104,5 мг/мл, приблизительно 105 мг/мл, приблизительно 105,5 мг/мл, приблизительно 106 мг/мл, приблизительно 106,5 мг/мл, приблизительно 107 мг/мл, приблизительно 107,5 мг/мл, приблизительно 108 мг/мл, приблизительно 108,5 мг/мл, приблизительно 109 мг/мл, приблизительно 109,5 мг/мл, приблизительно 110 мг/мл, приблизительно 111 мг/мл, приблизительно 112 мг/мл, приблизительно 113 мг/мл, приблизительно 114 мг/мл, приблизительно 115 мг/мл, приблизительно 116 мг/мл, приблизительно 117 мг/мл, приблизительно 118 мг/мл, приблизительно 119 мг/мл, приблизительно 120 мг/мл, приблизительно 121 мг/мл, приблизительно 122 мг/мл, приблизительно 123 мг/мл, приблизительно 124 мг/мл, приблизительно 125 мг/мл, приблизительно 126 мг/мл, приблизительно 127 мг/мл, приблизительно 128 мг/мл, приблизительно 129 мг/мл, приблизительно 130 мг/мл, приблизительно 131 мг/мл, приблизительно 132 мг/мл, приблизительно 133 мг/мл, приблизительно 134 мг/мл, приблизительно 135 мг/мл, приблизительно 136 мг/мл, приблизительно 137 мг/мл, приблизительно 138 мг/мл, приблизительно 139 мг/мл, приблизительно 140 мг/мл, приблизительно 141 мг/мл, приблизительно 142 мг/мл, приблизительно 143 мг/мл, приблизительно 144 мг/мл, приблизительно 145 мг/мл, приблизительно 146 мг/мл, приблизительно 147 мг/мл, приблизительно 148 мг/мл, приблизительно 149 мг/мл, приблизительно 150 мг/мл, приблизительно 151 мг/мл, приблизительно 152 мг/мл, приблизительно 153 мг/мл, приблизительно 154 мг/мл, приблизительно 155 мг/мл, приблизительно 156 мг/мл, приблизительно 157 мг/мл, приблизительно 158 мг/мл, приблизительно 159 мг/мл, приблизительно 160 мг/мл, приблизительно 170 мг/мл, приблизительно 180 мг/мл, приблизительно 190 мг/мл, приблизительно 200 мг/мл, приблизительно 201 мг/мл, приблизительно 202 мг/мл, приблизительно 202,5 мг/мл, приблизительно 203 мг/мл, приблизительно 203,5 мг/мл, приблизительно 204 мг/мл, приблизительно 204,5 мг/мл, приблизительно 205 мг/мл, приблизительно 205,5 мг/мл, приблизительно 206 мг/мл, приблизительно 206,5 мг/мл, приблизительно 207 мг/мл, приблизительно 207,5 мг/мл, приблизительно 208 мг/мл, приблизительно 208,5 мг/мл, приблизительно 209 мг/мл, приблизительно 209,5 мг/мл, приблизительно 210 мг/мл, приблизительно 211 мг/мл, приблизительно 212 мг/мл, приблизительно 213 мг/мл, приблизительно 214 мг/мл, приблизительно 215 мг/мл, приблизительно 216 мг/мл, приблизительно 217 мг/мл, приблизительно 218 мг/мл, приблизительно 219 мг/мл, приблизительно 220 мг/мл, приблизительно 221 мг/мл, приблизительно 222 мг/мл, приблизительно 223 мг/мл, приблизительно 224 мг/мл, приблизительно 225 мг/мл, приблизительно 226 мг/мл, приблизительно 227 мг/мл, приблизительно 228 мг/мл, приблизительно 229 мг/мл, приблизительно 230 мг/мл, приблизительно 231 мг/мл, приблизительно 232 мг/мл, приблизительно 233 мг/мл, приблизительно 234 мг/мл, приблизительно 235 мг/мл, приблизительно 236 мг/мл, приблизительно 237 мг/мл, приблизительно 238 мг/мл, приблизительно 239 мг/мл, приблизительно 240 мг/мл, приблизительно 241 мг/мл, приблизительно 242 мг/мл, приблизительно 243 мг/мл, приблизительно 244 мг/мл, приблизительно 245 мг/мл, приблизительно 246 мг/мл, приблизительно 247 мг/мл, приблизительно 248 мг/мл, приблизительно 249 мг/мл, приблизительно 250 мг/мл, приблизительно 251 мг/мл, приблизительно 252 мг/мл, приблизительно 253 мг/мл, приблизительно 254 мг/мл, приблизительно 255 мг/мл, приблизительно 256 мг/мл, приблизительно 257 мг/мл, приблизительно 258 мг/мл, приблизительно 259 мг/мл, приблизительно 260 мг/мл, приблизительно 270 мг/мл, приблизительно 280 мг/мл, приблизительно 290 мг/мл или приблизительно 300 мг/мл.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, pH может быть в пределах приблизительно pH 4,0-6,0, предпочтительно между приблизительно pH 5,0 и любым из значений приблизительно pH 4,5, приблизительно 4,6, приблизительно 4,7, приблизительно 4,8, приблизительно 4,9, приблизительно 5,0, приблизительно 5,1, приблизительно 5,2, приблизительно 5,3, приблизительно 5,4 или приблизительно 5,5. Более предпочтительно, когда pH находится в пределах, выбранных между любыми из значений приблизительно pH 4,9, 5,0 или 5,1. В некоторых вариантах осуществления pH равен pH 5,0 +/- 0,5. Значения pH в этих пределах обеспечивают композицию с более низкими значениями вязкости.
В некоторых вариантах осуществления композиция может включать аргинин. В некоторых вариантах осуществления аргинин представляет собой аргинин гидрохлорид или аргинин HCl. [Bryan: хотя Композиция 7 не содержит аргинин, мы включили ее в качестве альтернативы. То же применимо и к другим эксципиентам и т.д., не присутствующим в композиции 7, но включенным в настоящее описание]. Концентрация аргинина может находиться в пределах от приблизительно 0,1 миллимоль (мМ) до приблизительно 200 мМ. В некоторых вариантах осуществления концентрация аргинина составляет от приблизительно 10 мМ до приблизительно 150 мМ, от приблизительно 50 мМ до приблизительно 130 мМ, от приблизительно 80 мМ до приблизительно 120 мМ или от приблизительно 90 мМ до приблизительно 110 мМ. В некоторых вариантах осуществления концентрация аргинина составляет приблизительно 1 мМ, приблизительно 2 мМ, приблизительно 3 мМ, приблизительно 4 мМ, приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ, приблизительно 8 мМ, приблизительно 9 мМ, приблизительно 10 мМ, приблизительно 11 мМ, приблизительно 12 мМ, приблизительно 13 мМ, приблизительно 14 мМ, приблизительно 15 мМ, приблизительно 16 мМ, приблизительно 17 мМ, приблизительно 18 мМ, приблизительно 19 мМ, приблизительно 20 мМ, приблизительно 21 мМ, приблизительно 22 мМ, приблизительно 23 мМ, приблизительно 24 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 55 мМ, приблизительно 60 мМ, приблизительно 65 мМ, приблизительно 70 мМ, приблизительно 75 мМ, приблизительно 80 мМ, приблизительно 85 мМ, приблизительно 90 мМ, aприблизительно 95 мМ, приблизительно 100 мМ, приблизительно 105 мМ, приблизительно 110 мМ, приблизительно 115 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 135 мМ, приблизительно 140 мМ, приблизительно 145 мМ, приблизительно 150 мМ, приблизительно 155 мМ, приблизительно 160 мМ, приблизительно 165 мМ, приблизительно 170 мМ, приблизительно 175 мМ, приблизительно 180 мМ, приблизительно 185 мМ, приблизительно 190 мМ, приблизительно 195 мМ или приблизительно 200 мМ. В некоторых вариантах осуществления концентрация аргинина составляет 100 мМ.
В некоторых вариантах осуществления регулятор тоничности может включать полиол, сахарид, углевод, соль, такую как хлорид натрия или их смеси. Полиол может иметь молекулярную массу, которая, например, без ограничения, меньше чем приблизительно 600 кДа (например, в пределах от приблизительно 120 до приблизительно 400 кДа) и может представлять собой, например, без ограничения, маннит, трегалозу, сорбит, эритрит, изомальт, лактит, мальтит, ксилит, глицерин, лактит, пропиленгликоль, полиэтиленгликоль, инозит или их смеси. Сахарид или углевод может представлять собой, например, без ограничения, моносахарид, дисахарид или полисахарид или смеси любых из вышеперечисленных. Сахарид или углевод может представлять собой, например, без ограничения, фруктозу, глюкозу, маннозу, сахарозу, сорбозу, ксилозу, лактозу, мальтозу, сахарозу, декстран, пуллулан, декстрин, циклодекстрины, растворимый крахмал, гидроксиэтилкрахмал, водорастворимые глюканы или их смеси. Регулятор тоничности может включать сахарид, такой как, например, без ограничения, редуцирующий сахар или нередуцирующий сахар, или их смеси. Регулятор тоничности может включать сахарид, который представляет собой нередуцирующий сахар, такой как, например, без ограничения, сахароза, трегалоза и их смеси.
Концентрация регулятора тоничности в композиции находится в пределах от приблизительно 1 мг/мл до приблизительно 300 мг/мл, от приблизительно 1 мг/мл до приблизительно 200 мг/мл или от приблизительно 1 мг/мл до приблизительно 100 мг/мл. Предпочтительно концентрация регулятора тоничности в композиции составляет приблизительно 0,5 мг/мл, приблизительно 1 мг/мл, приблизительно 2 мг/мл, приблизительно 2,5 мг/мл, приблизительно 3 мг/мл, приблизительно 3,5 мг/мл, приблизительно 4 мг/мл, приблизительно 4,5 мг/мл, приблизительно 5 мг/мл, приблизительно 5,5 мг/мл, приблизительно 6 мг/мл, приблизительно 6,5 мг/мл, приблизительно 7 мг/мл, приблизительно 7,5 мг/мл, приблизительно 8 мг/мл, приблизительно 8,5 мг/мл, приблизительно 9 мг/мл, приблизительно 9,5 мг/мл, приблизительно 10 мг/мл, приблизительно 11 мг/мл, приблизительно 12 мг/мл, приблизительно 13 мг/мл, приблизительно 14 мг/мл, приблизительно 15 мг/мл, приблизительно 16 мг/мл, приблизительно 17 мг/мл, приблизительно 18 мг/мл, приблизительно 19 мг/мл, приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 22 мг/мл, приблизительно 23 мг/мл, приблизительно 24 мг/мл, приблизительно 25 мг/мл, приблизительно 26 мг/мл, приблизительно 27 мг/мл, приблизительно 28 мг/мл, приблизительно 29 мг/мл, приблизительно 30 мг/мл, приблизительно 31 мг/мл, приблизительно 32 мг/мл, приблизительно 33 мг/мл, приблизительно 34 мг/мл, приблизительно 35 мг/мл, приблизительно 36 мг/мл, приблизительно 37 мг/мл, приблизительно 38 мг/мл, приблизительно 39 мг/мл, приблизительно 40 мг/мл, приблизительно 41 мг/мл, приблизительно 42 мг/мл, приблизительно 43 мг/мл, приблизительно 44 мг/мл, приблизительно 45 мг/мл, приблизительно 46 мг/мл, приблизительно 47 мг/мл, приблизительно 48 мг/мл, приблизительно 49 мг/мл, приблизительно 50 мг/мл, приблизительно 51 мг/мл, приблизительно 52 мг/мл, приблизительно 53 мг/мл, приблизительно 54 мг/мл, приблизительно 55 мг/мл, приблизительно 56 мг/мл, приблизительно 57 мг/мл, приблизительно 58 мг/мл, приблизительно 59 мг/мл, приблизительно 60 мг/мл, приблизительно 65 мг/мл, приблизительно 70 мг/мл, приблизительно 75 мг/мл, приблизительно 80 мг/мл, приблизительно 81 мг/мл, приблизительно 82 мг/мл, приблизительно 83 мг/мл, приблизительно 84 мг/мл, приблизительно 85 мг/мл, приблизительно 86 мг/мл, приблизительно 87 мг/мл, приблизительно 88 мг/мл, приблизительно 89 мг/мл, приблизительно 90 мг/мл, приблизительно 91 мг/мл, приблизительно 92 мг/мл, приблизительно 93 мг/мл, приблизительно 94 мг/мл, приблизительно 95 мг/мл, приблизительно 96 мг/мл, приблизительно 97 мг/мл, приблизительно 98 мг/мл, приблизительно 99 мг/мл, приблизительно 100 мг/мл, приблизительно 101 мг/мл, приблизительно 102 мг/мл, приблизительно 103 мг/мл, приблизительно 104 мг/мл, приблизительно 105 мг/мл, приблизительно 106 мг/мл, приблизительно 107 мг/мл, приблизительно 108 мг/мл, приблизительно 109 мг/мл, приблизительно 110 мг/мл, приблизительно 111 мг/мл, приблизительно 112 мг/мл, приблизительно 113 мг/мл, приблизительно 114 мг/мл, приблизительно 115 мг/мл, приблизительно 116 мг/мл, приблизительно 117 мг/мл, приблизительно 118 мг/мл, приблизительно 119 мг/мл, приблизительно 120 мг/мл, приблизительно 121 мг/мл, приблизительно 122 мг/мл, приблизительно 123 мг/мл, приблизительно 124 мг/мл, приблизительно 125 мг/мл, приблизительно 126 мг/мл, приблизительно 127 мг/мл, приблизительно 128 мг/мл, приблизительно 129 мг/мл, приблизительно 130 мг/мл, приблизительно 131 мг/мл, приблизительно 132 мг/мл, приблизительно 133 мг/мл, приблизительно 134 мг/мл, приблизительно 135 мг/мл, приблизительно 136 мг/мл, приблизительно 137 мг/мл, приблизительно 138 мг/мл, приблизительно 139 мг/мл, приблизительно 140 мг/мл, приблизительно 141 мг/мл, приблизительно 142 мг/мл, приблизительно 143 мг/мл, приблизительно 144 мг/мл, приблизительно 145 мг/мл, приблизительно 146 мг/мл, приблизительно 147 мг/мл, приблизительно 148 мг/мл, приблизительно 149 мг/мл или приблизительно 150 мг/мл.
Поверхностно-активное вещество может представлять собой, например, без ограничения, полисорбат, полоксамер, тритон, додецилсульфат натрия, лаурилсульфат натрия, натрий октилгликозид, лаурил-сульфобетаин, миристил-сульфобетаин, линолеил-сульфобетаин, стеарил-сульфобетаин, лаурил-саркозин, миристил-саркозин, линолеил-саркозин, стеарил-саркозин, линолеил-бетаин, миристил-бетаин, цетил-бетаин, лауроамидопропил-бетаин, кокамидопропил-бетаин, линолеамидопропил-бетаин, миристамидопропил-бетаин, пальмидопропил-бетаин, изостеарамидопропил-бетаин, миристамидопропил-диметиламин, пальмидопропил-диметиламин, изостеарамидопропил-диметиламин, метилкокоилтаурат натрия, динатрий метилолеоилтаурат, дигидроксипропил PEG 5 линолеаммоний хлорид, полиэтиленгликоль, полипропиленгликоль и их смеси. Поверхностно-активное вещество может представлять собой, например, без ограничения, полисорбат 20, полисорбат 21, полисорбат 40, полисорбат 60, полисорбат 61, полисорбат 65, полисорбат 80, полисорбат 81, полисорбат 85, PEG3350 и их смеси. В некоторых вариантах осуществления поверхностно-активное вещество представляет собой полисорбат 80 (PS80).
Концентрация поверхностно-активного вещества, как правило, находится в пределах от приблизительно 0,01 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 5,0 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 2,0 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 1,0 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 0,5 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 0,4 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 0,3 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 0,2 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 0,15 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 0,1 мг/мл или от приблизительно 0,01 мг/мл, до приблизительно 0,05 мг/мл. Более предпочтительно концентрация поверхностно-активного вещества составляет приблизительно 0,5 мг/мл, приблизительно 0,05 мг/мл приблизительно 0,06 мг/мл приблизительно 0,07 мг/мл приблизительно 0,08 мг/мл, приблизительно 0,09 мг/мл приблизительно 0,1 мг/мл приблизительно 0,11 мг/мл приблизительно 0,12 мг/мл приблизительно 0,13 мг/мл приблизительно 0,14 мг/мл приблизительно 0,15 мг/мл приблизительно 0,16 мг/мл приблизительно 0,17 мг/мл приблизительно 0,18 мг/мл приблизительно 0,19 мг/мл, приблизительно 0,2 мг/мл. В некоторых вариантах осуществления концентрация поверхностно-активного вещества составляет 0,2 мг/мл.
Буфер может представлять собой, например без ограничения, ацетат, гистидин, сукцинат, глюконат, цитрат, уксусную кислоту, фосфат, фосфорную кислоту, аскорбат, винную кислоту, малеиновую кислоту, глицин, лактат, молочную кислоту, аскорбиновую кислоту, имидазол, бикарбонат и угольную кислоту, янтарную кислоту, бензоат натрия, бензойную кислоту, глюконат, эдетат, ацетат, малат, имидазол, трис, фосфат и их смеси. В некоторых вариантах осуществления буфер представляет собой гистидиновый буфер, где гистидин может включать либо L-гистидин, либо D-гистидин, сольватированную форму гистидина, гидратированную форму (например, моногидрат) гистидина, соль гистидина (например, гистидин гидрохлорид) или безводную форму гистидина, или их смесь. Предпочтительно буфер представляет собой ацетатный буфер, где ацетат может включать ацетат натрия, уксусную кислоту или их смесь.
Концентрация буфера может находиться в пределах от приблизительно 0,1 миллимоль (мМ) до приблизительно 100 мМ. Предпочтительно, концентрация буфера составляет от приблизительно 0,5 мМ до приблизительно 50 мМ, более предпочтительно от приблизительно 1 мМ до приблизительно 30 мМ, более предпочтительно от приблизительно 1 мМ до приблизительно 18 мМ, еще более предпочтительно от приблизительно 1 мМ до приблизительно 15 мМ. Предпочтительно, концентрация буфера составляет приблизительно 1 мМ, приблизительно 2 мМ, приблизительно 3 мМ, приблизительно 4 мМ, приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ, приблизительно 8 мМ, приблизительно 9 мМ, приблизительно 10 мМ, приблизительно 11 мМ, приблизительно 12 мМ, приблизительно 13 мМ, приблизительно 14 мМ, приблизительно 15 мМ, приблизительно 16 мМ, приблизительно 17 мМ, приблизительно 18 мМ, приблизительно 19 мМ, приблизительно 20 мМ, приблизительно 21 мМ, приблизительно 22 мМ, приблизительно 23 мМ, приблизительно 24 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ или приблизительно 50 мМ. В некоторых вариантах осуществления концентрация буфера составляет приблизительно 190 мМ, приблизительно 200 мМ, приблизительно 210 мМ, приблизительно 220 мМ, приблизительно 230 мМ, приблизительно 240 мМ, приблизительно 250 мМ, приблизительно 260 мМ, приблизительно 270 мМ, приблизительно 280 мМ, приблизительно 290, приблизительно 300 мМ, приблизительно 310 мМ или приблизительно 320 мМ.
В некоторых вариантах осуществления хелатирующий агент может быть выбран из группы, состоящей из аминополикарбоновых кислот, гидроксиаминокарбоновых кислот, N-замещенных глицинов, 2-(2-амино-2-оксоктил)аминоэтансульфоновой кислоты (BES), дефероксамина (DEF), лимонной кислота, ниацинамида и дезоксихолатов и их смесей. В некоторых вариантах осуществления хелатирующий агент выбран из группы, состоящей из этилендиаминтетрауксусной кислоты (EDTA), диэтилентриаминпентауксусной кислоты 5 (DTPA), нитрилотриуксусной кислоты (NTA), N-2-ацетамидо-2-иминодиуксусной кислоты (ADA), бис(аминоэтил)гликолевого эфира, N,N,N',N'-тетрауксусной кислоты (EGTA), транс-диаминоциклогексантетрауксусной кислоты (DCTA), глутаминовой кислоты и аспарагиновой кислоты, N-гидроксиэтилиминодиуксусной кислоты (HIMDA), N, N-бис-гидроксиэтилглицина (бицин) и N- (трисгидроксиметилметил) 10 глицина (трицин), глицилглицина, дезоксихолата натрия, этилендиамина; пропилендиамина; диэтилентриамина; триэтилентетраамина (триен), этилендиаминтетраацето EDTA; динатрий EDTA, EDTA, кальций EDTA щавелевой кислоты, малата, лимонной кислоты, моногидрата лимонной кислоты и тринатрий цитрата дигидрата, 8-гидроксихинолата, аминокислот, гистидина, цистеина, метионина, пептидов, полипептидов и белков и их смесей. В некоторых вариантах осуществления хелатирующий агент выбран из группы, состоящей из солей EDTA, включая дикалий эдетат, динатрий эдетат, кальций динатрий эдетат, эдетат натрия, тринатрий эдетат и эдетат калия; и подходящей солью дефероксамина (DEF) является дефероксамин мезилат (DFM), или их смесей. Хелатирующие агенты, используемые в изобретении, могут присутствовать, когда это возможно, в форме свободной кислоты или свободного основания или в форме соли соединения, также в виде безводной, сольватированной или гидратированной формы соединения или соответствующей соли. После растворения в растворе при заданном pH и при такой же концентрации этилендиаминтетрауксусной кислоты (EDTA) различные солевые формы, формы свободной кислоты, гидратированные или безводные формы EDTA, содержащие натрий и воду, считаются эквивалентными хелатирующими агентами. Например, 0,0500 г/л динатрий EDTA дигидрата (FW: 372,3), 0,0393 г/л EDTA (FW: 292,3), 0,0452 г/л динатрий EDTA (FW: 336,2), 0,0481 г/л тринатрий EDTA (FW: 358,2), 0,0511 г/л тетранатрий EDTA (FW: 380,2), 0,0422 г/л Sнатрий EDTA (FW: 314,2) и 0,0446 г/л натрий EDTA гидрат (FW: 332,3), которые все содержат 134,4 мкМ EDTA, считаются эквивалентными хелатирующими агентами.
Наиболее предпочтительным хелатирующим агентом является EDTA, например, без ограничения, динатрий EDTA, кальций EDTA или динатрий EDTA дигидрат.
Особенно предпочтительным является динатрий EDTA, поскольку он обеспечивает композицию с повышенной стабильностью антитела и/или устойчивостью к агрегации.
Концентрация хелатирующего агента, как правило, находится в пределах от приблизительно 0,01 мг/мл до приблизительно 50 мг/мл, от приблизительно 1 мг/мл до приблизительно 10,0 мг/мл, от приблизительно 5 мг/мл до приблизительно 15,0 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 1,0 мг/мл или от приблизительно 0,03 мг/мл до приблизительно 0,5 мг/мл. Более предпочтительно, концентрация хелатирующего агента, как правило, находится в пределах от приблизительно 0,01 мМ до приблизительно 2,0 мМ, от приблизительно 0,01 мМ до приблизительно 1,5 мМ, от приблизительно 0,01 мМ до приблизительно 0,5 мМ, от приблизительно 0,01 мМ до приблизительно 0,4 мМ, от приблизительно 0,01 мМ до приблизительно 0,3 мМ, от приблизительно 0,01 мМ до приблизительно 0,2 мМ, от приблизительно 0,01 мМ до приблизительно 0,15 мМ, от приблизительно 0,01 мМ до приблизительно 0,1 мМ, от приблизительно 0,01 мМ до приблизительно 0,09 мМ, от приблизительно 0,01 мМ до приблизительно 0,08 мМ, от приблизительно 0,01 мМ до приблизительно 0,07 мМ, от приблизительно 0,01 мМ до приблизительно 0,06 мМ, от приблизительно 0,01 мМ до приблизительно 0,05 мМ, от приблизительно 0,01 мМ до приблизительно 0,04 мМ, от приблизительно 0,01 мМ до приблизительно 0,03 мМ, от приблизительно 0,01 мМ до приблизительно 0,02 мМ или от приблизительно 0,05 мМ до приблизительно 0,01 мМ. Предпочтительно концентрация хелатирующего агента может быть приблизительно 0,01 мг/мл, 0,02 мг/мл, 0,03 мг/мл, приблизительно 0,04 мг/мл, приблизительно 0,05 мг/мл, приблизительно 0,06 мг/мл, приблизительно 0,07 мг/мл, приблизительно 0,10 мг/мл, приблизительно 0,20 мг/мл. Более предпочтительно концентрация хелатирующего агента составляет приблизительно 0,04 мг/мл, приблизительно 0,041 мг/мл, приблизительно 0,042 мг/мл, приблизительно 0,043 мг/мл, приблизительно 0,044 мг/мл, приблизительно 0,045 мг/мл, приблизительно 0,046 мг/мл, приблизительно 0,047 мг/мл, приблизительно 0,048 мг/мл, приблизительно 0,049 мг/мл, приблизительно 0,05 мг/мл, приблизительно 0,051 мг/мл, приблизительно 0,052 мг/мл, приблизительно 0,053 мг/мл, приблизительно 0,054 мг/мл, приблизительно 0,055 мг/мл или приблизительно 0,056 мг/мл. Наиболее предпочтительно, концентрация хелатирующего агента составляет приблизительно 0,05 мг/мл.
Хелатирующие агенты могут снижать образование восстановленных форм кислорода, уменьшать образование кислотных форм (например, дезамидирование), уменьшать агрегацию антител и/или уменьшать фрагментацию антител и/или уменьшать окисление антител в композициях по настоящему изобретению. Такие хелатирующие агенты могут уменьшать или предотвращать деградацию антитела, которое сформулировано по сравнению с описанным антителом без защиты хелатирующим агентом.
Если не указано иное, указанные концентрации представляют собой концентрации в условиях окружающей среды, т.е. при 25°C и атмосферном давлении.
В предпочтительных вариантах осуществления композиция не содержит антиоксиданта. Например, предпочтительные варианты представленных композиций не содержат метионин, тиосульфат натрия, каталазу или платину.
В некоторых вариантах осуществления композиция может содержать антиоксидант. В некоторых вариантах осуществления антиоксидант выбран из группы, включающей метионин, тиосульфат натрия, каталазу и платину.
Концентрация антиоксиданта, как правило, находится в пределах от приблизительно 0,01 мг/мл до приблизительно 50 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 10,0 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 5,0 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 1,0 мг/мл или от приблизительно 0,01 мг/мл до приблизительно 0,02 мг/мл. Предпочтительно концентрация антиоксиданта может составлять приблизительно 0,01 мг/мл, 0,02 мг/мл, 0,03 мг/мл, приблизительно 0,04 мг/мл, приблизительно 0,05 мг/мл, приблизительно 0,06 мг/мл, приблизительно 0,07 мг/мл, 0,08 мг/мл, 0,09 мг/мл, приблизительно 0,10 мг/мл, 0,11 мг/мл, 0,12 мг/мл, 0,13 мг/мл, приблизительно 0,14 мг/мл, приблизительно 0,15 мг/мл, приблизительно 0,16 мг/мл, приблизительно 0,17 мг/мл, 0,18 мг/мл, 0,19 мг/мл приблизительно 0,20 мг/мл, приблизительно 0,25 мг/мл, 0,3 мг/мл, 0,4 мг/мл, 0,5 мг/мл, 0,6 мг/мл, 0,7 мг/мл, 0,8 мг/мл, 0,9 мг/мл, 1,0 мг/мл. Наиболее предпочтительно, концентрация антиоксиданта составляет приблизительно 0,01 мг/мл.
В некоторых вариантах осуществления композици может включать консервант. Предпочтительно консервант выбран из Фенола, м-крезола, бензилового спирта, бензалконийхлорида, бенетонийхлорида, феноксиэтанола и метилпарабена.
Концентрация консерванта, как правило, находится в пределах от приблизительно 0,001 мг/мл до приблизительно 50 мг/мл, от приблизительно 0,005 мг/мл до приблизительно 15,0 мг/мл, от приблизительно 0,008 мг/мл до приблизительно 12,0 мг/мл или от приблизительно 0,01 мг/мл до приблизительно 10,0 мг/мл. Предпочтительно, концентрация консерванта может быть приблизительно 0,1 мг/мл, 0,2 мг/мл, 0,3 мг/мл, приблизительно 0,4 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, 0,8 мг/мл, 0,9 мг/мл приблизительно 1,0 мг/мл, 2,0 мг/мл, 3,0 мг/мл, приблизительно 4,0 мг/мл, приблизительно 5,0 мг/мл, приблизительно 6,0 мг/мл, приблизительно 7,0 мг/мл, 8,0 мг/мл, 9,0 мг/мл приблизительно 9,1 мг/мл, приблизительно 9,2 мг/мл, 9,3 мг/мл, 9,4 мг/мл, 9,5 мг/мл, 9,6 мг/мл, 9,7 мг/мл, 9,8 мг/мл, 9,9 мг/мл, 10,0 мг/мл. Наиболее предпочтительно, концентрация консерванта составляет приблизительно 0,1 мг/мл или 9,0 мг/мл.
В некоторых вариантах осуществления композиция не содержит антиоксиданта.
В некоторых вариантах осуществления композиция не содержит консерванта.
В некоторых вариантах осуществления антитело включает константную область тяжелой цепи, такую как, например, костантная область IgG, IgM, IgD, IgA и IgE; и любых изотипов, таких как IgG1, lgG2, IgG3 и IgG4. Предпочтительно, антитело представляет собой IgG2 или IgG4 антитело. В некоторых вариантах осуществления антитело включает константную область IgG4, включающую следующие мутации (Armour et al., 2003, Molecular Immunology 40 585-593): E233F234L235 в P233V234A235 (IgG4Δc) E233F234L235, где нумерация указана в соответствии с диким типом IgG4. Еще в одном варианте осуществления Fc представляет собой человеческий IgG4, включающий мутацию E233F234L235 в P233V234A235 с делецией G236 (IgG4Δb). В некоторых вариантах осуществления Fc представляет собой любой человеческий IgG4 Fc (IgG4, IgG4Δb или IgG4Δc), содержащий стабилизирующую шарнирную область мутацию S228 в P228 (Aalberse et al., 2002, Immunology 105, 9-19).
В некоторых вариантах осуществления антитело может быть выбрано из группы, состоящей из моноклональных антител, поликлональных антител, фрагментов антител (например, Fab, Fab', F(ab')2, Fv, Fc, ScFv etc.), химерных антител, биспецифических антител, гетероконъюгированных антител, одноцепочечных (ScFv), их мутантов, слитых белков, включающих часть антитела (например, доменное антитело), гуманизированных антител, человеческих антител и любой другой модифицированной конфигурации молекулы иммуноглобулина, которая включает сайт распознавания антигена требуемой специфичности, включая варианты гликозилирования антител, варианты аминокислотных последовательностей антител и ковалентно модифицированные антитела. Антитело может быть мышиного, крысиного, человеческого или любого другого происхождения (включая химерные или гуманизированные антитела). В некоторых вариантах осуществления антитело может быть человеческим, но более предпочтительно гуманизированным. Предпочтительно, антитело является выделенным, более предпочтительно оно является по существу чистым. Когда антитело представляет собой фрагмент антитела, оно предпочтительно сохраняет функциональные характеристики исходного антитела, т.е. лиганд-связывающую и/или антагонистическую или агонистическую активность.
Иллюстративные анти-PD-1 антитела включают, но не ограничиваются этим, например: ниволумаб (OPDIVO®, ONO-4538, BMS-936558, MDX1106, Bristol-Myers Squibb Company), пембролизумаб (KEYTRUDA®, MK-3475, ламбролизумаб, Merck & Co., Inc.), BCD100 (BIOCAD Biopharmaceutical Company), BGB-A317 (BeiGene Ltd./Celgene Corporation), CBT-501 (CBT Pharmaceuticals), GLS-010 (Harbin Gloria Pharmaceuticals Co., Ltd.), IBI308 (Innovent Biologics, Inc.), AMP-224 (GlaxoSmithKline plc), BI 754091 (Boehringer Ingelheim GmbH), PDR001 (Novartis AG), MEDI0680 (AstraZeneca PLC), PDR001 (Novartis AG), PF-06801591 (aka RN888) (Pfizer Inc.), описанное как mAb7 в международной патентной публикации № WO2016/092419, раскрытие которой включено в настоящую заявку посредством ссылки во всей полноте, REGN2810 (Regeneron Pharmaceuticals, Inc.), SHR-1210 (Incyte Corporation), TSR-042 (Tesaro, Inc.), AGEN2034 (Agenus Inc.), JNJ-63723283 (Johnson & Johnson), MGD013 (MacroGenics, Inc.), ANA011 (AnaptysBio, Inc.), ANB011 (AnaptysBio, Inc.), AUNP-12 (Pierre Fabre Medicament S.A.), ENUM 244C8 (Enumeral Biomedical Holdings, Inc.), hAb21 (Stainwei Biotech, Inc.), J43 (Transgene S.A.), JTX-4014 (Jounce Therapeutics, Inc.), MCLA-134 (Merus B.V.), PRS-332 (Pieris AG), SHR-1316 (Atridia Pty Ltd.), STI-A1010 (Sorrento Therapeutics, Inc.), STI-A1110 (Les Laboratoires Servier) и XmAb20717 (Xencor, Inc.).
BGB-A317 (трислелизумаб), находящийся в стадии разработки компанией BeiGene Ltd., представляет собой гуманизированное IgG4, моноклональное антитело, имеющее сконструированную Fc область (т.е., где способность связываться с Fc гамма рецептором I специально устранена). BGB-A317 связывается с PD-1 и ингибирует связывание PD-1 с PD-L1 и PD-L2.
В одном или нескольких вариантах осуществления антагонист, связывающийся с осью PD-1, выбран из PF-06801591, ниволумаба, пембролизумаба, спартализумаба и BGB-A317.
В конкретном аспекте анти-PD-1 антитело представляет собой PF-06801591 (Pfizer Inc., регистрационный номер CAS 2029210-61-3). В другом конкретном аспекте анти-PD-1 антитело представляет собой ниволумаб (OPDIVO®, MDX-1106, регистрационный номер CAS 946414-94-4). В другом конкретном аспекте анти-PD-1 антитело представляет собой цемиплимаб (LIBTAYO®, также известный как REGN2810, Regeneron Pharmaceuticals, Inc. и sanofi-aventis U.S. LLC, регистрационный номер CAS 1801342-60-8). В другом конкретном аспекте анти-PD-1 антитело представляет собой ниволумаб (OPDIVO®, MDX-1106, регистрационный номер CAS 946414-94-4). В другом конкретном аспекте анти-PD-1 антитело представляет собой спартализумаб (PDR001, Novartis, регистрационный номер CAS 1935694-88-4). В другом конкретном аспекте связывающийся с PD-1 антагонист представляет собой антитело, включающее VH область, продуцируемую вектором экспрессии с номером доступа ATCC PTA-121 183, и имеющее VL область, продуцируемую вектором экспрессии с номером доступа ATCC PTA-1 21 182, также известное как mAb7 или mAb15 (Rinat Neuroscience, Pfizer Inc.), как описано в настоящей заявке.
В конкретном аспекте анти-PD-1 антитело включает вариабельную область тяжелой цепи, включающую:
(a) CDR1, включающую аминокислотную последовательность, показанную в SEQ ID NO: 4 (GYTFTSYWIN);
(b) CDR2, включающую аминокислотную последовательность, показанную в SEQ ID NO: 5 (NIYPGSSLTNYNEKFKN); и
(c) CDR3, включающую аминокислотную последовательность, показанную в SEQ ID NO: 6 (LSTGTFAY).
В некоторых вариантах осуществления антитело может представлять собой анти-PD-1 антитело, включающее вариабельную область легкой цепи, включающую:
(a) CDR1, включающую аминокислотную последовательность, показанную в SEQ ID NO: 7 (KSSQSLWDSGNQKNFLT);
(b) CDR2, включающую аминокислотную последовательность, показанную в SEQ ID NO: 8 (WTSYRES); и
(c) CDR3, включающую аминокислотную последовательность, показанную в SEQ ID NO: 9 (QNDYFYPHT).
В некоторых вариантах осуществления антитело может представлять собой анти-PD-1 антитело, включающее три CDR из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, показанную в SEQ ID NO: 2.
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWINWVRQAPGQGLEWMGNIYPGSSLTNYNEKFKNRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARLSTGTFAYWGQGTLVTVSS (SEQ ID NO: 2)
В некоторых вариантах осуществления антитело может представлять собой анти-PD-1 антитело, включающее три CDR из вариабельной области легкой цепи, включающей аминокислотную последовательность, показанную в SEQ ID NO: 3.
DIVMTQSPDSLAVSLGERATINCKSSQSLWDSGNQKNFLTWYQQKPGQPPKLLIYWTSYRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQNDYFYPHTFGGGTKVEIK (SEQ ID NO: 3)
В некоторых вариантах осуществления анти-PD-1 антитело может включать вариабельную область тяжелой цепи, включающую аминокислотную последовательность, по меньшей мере на приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности, включающей аминокислотную последовательность, показанную в SEQ ID NO. 2, и/или вариабельную область легкой цепи, включающую аминокислотную последовательность, по меньшей мере на приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности, включающей аминокислотную последовательность, показанную в SEQ ID NO. 3, где антитело специфически связывается с человеческим PD-1.
В некоторых вариантах осуществления анти-PD-1 антитело может включать вариабельную область тяжелой цепи, включающую аминокислотную последовательность, включающую аминокислотную последовательность, показанную в SEQ ID NO: 2, и/или может включать вариабельную область легкой цепи, включающую аминокислотную последовательность, включающую аминокислотную последовательность, показанную в SEQ ID NO: 3.
В некоторых вариантах осуществления анти-PD-1 антитело может представлять собой антитело, включающее аминокислотные последовательности, показанные в SEQ ID NO: 2 и 3.
В некоторых вариантах осуществления анти-PD-1 антитело может включать область тяжелой цепи, включающую аминокислотную последовательность, по меньшей мере на приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности, включающей аминокислотную последовательность, показанную в SEQ ID NO: 10, и/или область легкой цепи, включающую аминокислотную последовательность, по меньшей мере на приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности, включающей аминокислотную последовательность, показанную в SEQ ID NO: 11, где антитело специфически связывается с человеческим PD-1.
Последовательность тяжелой цепи
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWINWVRQAPGQGLEWMGNIYPGSSLTNYNEKFKNRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARLSTGTFAYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO: 10)
Последовательность легкой цепи
DIVMTQSPDSLAVSLGERATINCKSSQSLWDSGNQKNFLTWYQQKPGQPPKLLIYWTSYRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQNDYFYPHTFGGGTKVEIKRGTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 11)
В некоторых вариантах осуществления анти-PD-1 антитело может включать область тяжелой цепи, включающую аминокислотную последовательность, включающую аминокислотную последовательность, показанную в SEQ ID NO: 10, и/или может включать область легкой цепи, включающую аминокислотную последовательность, включающую аминокислотную последовательность, показанную в SEQ ID NO: 11. В некоторых вариантах осуществления C-концевой лизин последовательности тяжелой цепи, показанной в SEQ ID NO: 10, может быть отщеплен; т.е. в последовательности тяжелой цепи может отсутствовать C-концевой лизин.
В некоторых вариантах осуществления анти-PD-1 антитело может представлять собой антитело, включающее аминокислотные последовательности, показанные в SEQ ID NO: 10 и 11.
В некоторых вариантах осуществления анти-PD-1 антитело может конкурировать за связывание PD-1 с анти-PD-1 антителом, определенным в настоящей заявке. Анти-PD-1 антитело может конкурировать за связывание PD-1 с антителом, включающим вариабельную область тяжелой цепи, включающую аминокислотную последовательность, включающую аминокислотную последовательность, показанную в SEQ ID NO: 2, и/или вариабельную область легкой цепи, включающую аминокислотную последовательность, включающую аминокислотную последовательность, показанную в SEQ ID NO: 3.
В некоторых вариантах осуществления анти-PD-1 антитело может представлять собой моноклональное антитело, mAb7, которое специфически связывается с человеческим PD-1. Антитело mAb7 описано в заявке WO2016/092419, содержание которой включено в настоящую заявку посредством ссылки во всей полноте. Аминокислотные последовательности тяжелой цепи и вариабельных областей легкой цепи mAb7 показаны в SEQ ID NO: 2 и 3, соответственно. CDR части антитела mAb7 (включая CDR по Чотиа и Кабату) схематически показаны в Таблице 1 WO2016/092419. Антитело mAb7 является высокоэффективным в блокировании биологической активности PD-1.
В некоторых вариантах осуществления анти-PD-1 антитело также может включать фрагмент или область антитела mAb7. В одном варианте осуществления фрагмент представляет собой легкую цепь антитела mAb7, включающую аминокислотную последовательность, показанную в SEQ ID NO: 11 в настоящей заявке. В другом варианте осуществления фрагмент представляет собой тяжелую цепь антитела mAb7, включающую аминокислотную последовательность, показанную в SEQ ID NO: 10 в настоящей заявке. Еще в одном варианте осуществления фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела mAb7. Еще в одном варианте осуществления фрагмент содержит одну или несколько CDR из легкой цепи и/или тяжелой цепи антитела mAb7, включающих аминокислотные последовательности, показанные в SEQ ID NO: 11 и 10, соответственно, в настоящей заявке.
В некоторых вариантах осуществления антитело может включать одну или несколько (одну, две, три, четыре, пять или шесть) CDR, происходящих из антитела mAb7. В некоторых вариантах осуществления CDR могут представлять собой CDR по Кабату, CDR по Чотиа или комбинацию CDR по Кабату и Чотиа (называемые в настоящей заявке "расширенными" или "комбинированными" CDR). В некоторых вариантах осуществления полипептиды включают любую из конфигураций CDR (включая комбинации, варианты и т.д.), описанных в настоящей заявке.
В некоторых вариантах осуществления настоящего изобретения C-концевой лизин тяжелой цепи любого из анти-PD-1 антител, описанных в настоящей заявке, делетирован. В различных случаях тяжелая и/или легкая цепь анти-PD-1 антител, описанных в настоящей заявке, необязательно может включать сигнальную последовательность.
В других вариантах осуществления антитело может быть выбрано из анти-PD-1 антитела, известного в данной области техники, такого как антитела, описанные, например, без ограничения, в любом из следующих патентов США №№ 8354509, 9084776, 9492540, 9492539, 9387247, 8779105, 8952136 и 8709416. Антитело может связываться с тем же эпитопом, что и анти-PD-1 антитело, известное в данной области техники, и/или может конкурировать за связывание с PD-1 с таким антителом.
В соответствии с еще одним аспектом настоящего изобретения, обеспечивается композиция, включающая или состоящая по существу из:
от приблизительно 140 мг/мл до приблизительно 160 мг/мл антитела,
от приблизительно 10,0 мМ до приблизительно 30,0 мМ гистидинового буфера,
от приблизительно 40 мг/мл до приблизительно 100 мг/мл трегалозы,
от приблизительно 0,01 до приблизительно 0,3 мг/мл полисорбата 80 (PS80) и
от приблизительно 0,01 до приблизительно 0,1 мг/мл динатрий EDTA,
где указанная композиция имеет pH, выбранный из диапазона между приблизительно pH 4,5 и любым из приблизительно pH 5,5 или, в качестве альтернативы, из диапазона между приблизительно pH 4,5 и любым из значений pH приблизительно 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9
В соответствии с предпочтительным вариантом осуществления, композиция включает или по существу состоит из любого количества приблизительно 90 мг/мл, приблизительно 100 мг/мл, приблизительно 110 мг/мл, приблизительно 120 мг/мл, приблизительно 130 мг/мл, приблизительно 140 мг/мл или приблизительно 150 мг/мл антитела,
приблизительно 20 мМ гистидинового буфера,
приблизительно 84 мг/мл трегалозы,
приблизительно 0,2 мг/мл PS80 и
приблизительно 0,05 мг/мл динатрий EDTA,
где указанная композиция имеет pH, выбранный из диапазона между приблизительно pH 5,0 и любым из значений pH приблизительно 5,0, 5,2, 5,5 или 5,8, или, в качестве альтернативы, из диапазона между приблизительно pH 4,5 и любым из значений pH приблизительно 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4 или 5,5, и где указанное антитело включает последовательность вариабельной области тяжелой цепи, включающую аминокислотную последовательность, показанную в SEQ ID NO. 2, и последовательность вариабельной области легкой цепи, включающую аминокислотную последовательность, показанную в SEQ ID NO. 3.
В соответствии с предпочтительным вариантом осуществления, композиция включает или по существу состоит из любого количества приблизительно 120 мг/мл, приблизительно 130 мг/мл, приблизительно 140 мг/мл, приблизительно 150 мг/мл, приблизительно 160 мг/мл, приблизительно 170 мг/мл или приблизительно 180 мг/мл антитела,
приблизительно 20 мМ гистидинового буфера,
приблизительно 84 мг/мл трегалозы,
приблизительно 0,2 мг/мл PS80 и
приблизительно 0,05 мг/мл динатрий EDTA,
где указанная композиция имеет pH приблизительно pH 5,0, +/- 0,5, и где указанное антитело включает последовательность вариабельной области тяжелой цепи, включающую аминокислотную последовательность, показанную в SEQ ID NO. 2, и последовательность вариабельной области легкой цепи, включающую аминокислотную последовательность, показанную в SEQ ID NO. 3. В некоторых вариантах осуществления объем используемой дозы составляет приблизительно 0,5 мл, приблизительно 1 мл, приблизительно 2 мл, приблизительно 3 мл, приблизительно 4 мл, приблизительно 5 мл, приблизительно 6 мл, приблизительно 7 мл, приблизительно 8 мл, приблизительно 9 мл, приблизительно 10 мл, приблизительно 11 мл, приблизительно 12 мл, приблизительно 13 мл, приблизительно 14 мл, приблизительно 15 мл, приблизительно 16 мл, приблизительно 17 мл, приблизительно 18 мл, приблизительно 19 мл, приблизительно 20 мл, приблизительно 21 мл, приблизительно 22 мл, приблизительно 23 мл, приблизительно 24 мл, приблизительно 25 мл, приблизительно 26 мл, приблизительно 27 мл, приблизительно 28 мл, приблизительно 29 мл, приблизительно 30 мл, приблизительно 31 мл, приблизительно 32 мл, приблизительно 33 мл, приблизительно 34 мл, приблизительно 35 мл, приблизительно 36 мл, приблизительно 37 мл, приблизительно 38 мл, приблизительно 39 мл, приблизительно 40 мл, приблизительно 41 мл, приблизительно 42 мл, приблизительно 43 мл, приблизительно 44 мл, приблизительно 45 мл, приблизительно 46 мл, приблизительно 47 мл, приблизительно 48 мл, приблизительно 49 мл или приблизительно 50 мл.
В некоторых вариантах осуществления обеспечивается композиция, которая является лиофилизированной и/или которую подвергали лиофилизации. В некоторых вариантах осуществления обеспечивается композиция, которая не является лиофилизированной и которую не подвергали лиофилизации.
В некоторых вариантах осуществления концентрация антитела представляет собой любую концентрацию приблизительно 100 мг/мл, приблизительно 105 мг/мл, приблизительно 110 мг/мл, приблизительно 115 мг/мл, приблизительно 120 мг/мл, приблизительно 125 мг/мл, приблизительно 130 мг/мл, приблизительно 135 мг/мл, приблизительно 140 мг/мл, приблизительно 145 мг/мл, приблизительно 150 мг/мл, приблизительно 155 мг/мл или приблизительно 160 мг/мл.
В соответствии с более предпочтительным аспектом настоящего изобретения, обеспечивается композиция в соответствии с любым из вышеописанных аспектов или вариантов осуществления для получения лекарственного средства для лечения гиперпролиферативного расстройства, например такого как рак, у субъекта.
В некоторых вариантах осуществления рак выбран из одного или нескольких из гастрального рака, саркомы, лимфомы, лимфомы Ходжкина, лейкоза, рака головы и шеи, плоскоклеточного рака головы и шеи, рака тимуса, эпителиального рака, рака слюнной железы, рака печени, рака желудка, рака щитовидной железы, рака легкого, рака яичников, рака молочной железы, рака предстательной железы, эзофагеального рака, рака поджелудочной железы, глиомы, лейкоза, множественной миеломы, почечноклеточной карциномы, рака мочевого пузыря, цервикального рака, хориокарциномы, рака толстой кишки, рака ротовой полости, рака кожи и меланомы.
В соответствии с еще одним вариантом осуществления изобретения, обеспечивается композиция в соответствии с любым из вышеописанных аспектов или вариантов осуществления для получения лекарственного средства для лечения гиперпролиферативного расстройства, например такого как рак, у субъекта.
В соответствии с предпочтительным вариантом осуществления, композицию можно вводить непосредственно в кровоток, в мышцу, в ткань, в жировую ткань или во внутренний орган. Подходящие пути парентерального введения включают подкожное, внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, интракраниальное, внутримышечное, внутрикостное и внутрикожное введение. Подходящие устройства для парентерального введения включают игольчатые (включая микроиглы, микроинъекции, растворимые иглы и другие методы образования микропор), инъекторы, безыгольные инъекторы и методы инфузии.
В некоторых вариантах осуществления схема введения лекарственного средства включает введение дозы лекарственного средства один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в десять недели, один раз в пятнадцать недель, один раз в двадцать недель, один раз в двадцать пять недель или один раз в двадцать шесть недель. В некоторых вариантах осуществления анти-PD-1 антитело вводят один раз в месяц, один раз в два месяца, один раз в три месяца, один раз в четыре месяца, один раз в пять месяцев или один раз в шесть месяцев. В некоторых вариантах осуществления схема введения лекарственного средства включает введение дозы лекарственного средства один раз в четыре или восемь недель.
В некоторых вариантах осуществления объем дозы находится на уровне меньше чем или равном приблизительно 3 мл, приблизительно 2,5 мл, приблизительно 2 мл, приблизительно 1,5 мл, приблизительно 1 мл, приблизительно 0,75 мл, приблизительно 0,5 мл, приблизительно 0,25 мл или приблизительно 0,1 мл.
В некоторых вариантах осуществления объем дозы составляет приблизительно 20 мл, приблизительно 19 мл, приблизительно 18 мл, приблизительно 17 мл, приблизительно 16 мл, приблизительно 15 мл, приблизительно 14 мл, приблизительно 13 мл, приблизительно 12 мл, приблизительно 11 мл, приблизительно 10 мл, приблизительно 9 мл, приблизительно 8 мл, приблизительно 7 мл, приблизительно 6 мл, приблизительно 5 мл, приблизительно 4 мл, приблизительно 3 мл, приблизительно 2 мл или приблизительно 1 мл. Альтернативно, объем дозы составляет приблизительно 20,5 мл, приблизительно 19,5 мл, приблизительно 18,5 мл, приблизительно 17,5 мл, приблизительно 16,5 мл, приблизительно 15,5 мл, приблизительно 14,5 мл, приблизительно 13,5 мл, приблизительно 12,5 мл, приблизительно 11,5 мл, приблизительно 10,5 мл, приблизительно 9,5 мл, приблизительно 8,5 мл, приблизительно 7,5 мл, приблизительно 6,5 мл, приблизительно 5,5 мл, приблизительно 4,5 мл, приблизительно 3,5 мл, приблизительно 2,5 мл, приблизительно 1,5 мл или приблизительно 0,5 мл. Альтернативно, объем дозы составляет приблизительно 900 микролитров, приблизительно 800 микролитров, приблизительно 700 микролитров, приблизительно 600 микролитров, приблизительно 500 микролитров, приблизительно 400 микролитров, приблизительно 300 микролитров, приблизительно 200 микролитров или приблизительно 100 микролитров, альтернативно приблизительно 950 микролитров, приблизительно 850 микролитров, приблизительно 750 микролитров, приблизительно 650 микролитров, приблизительно 550 микролитров, приблизительно 450 микролитров, приблизительно 350 микролитров, приблизительно 250 микролитров, приблизительно 150 микролитров или приблизительно 50 микролитров. В некоторых вариантах осуществления объем дозы меньше чем или равен приблизительно 2,0 мл.
В соответствии с предпочтительным вариантом осуществления, концентрация антитела может находиться в пределах от приблизительно 0,1 до приблизительно 200 мг/мл. Предпочтительно, концентрация антитела составляет приблизительно 100 мг/мл, приблизительно 101 мг/мл, приблизительно 102 мг/мл, приблизительно 103 мг/мл, приблизительно 104 мг/мл, приблизительно 105 мг/мл, приблизительно 106 мг/мл, приблизительно 107 мг/мл, приблизительно 108 мг/мл, приблизительно 109 мг/мл или приблизительно 110 мг/мл, приблизительно 111 мг/мл, приблизительно 112 мг/мл, приблизительно 113 мг/мл, приблизительно 114 мг/мл, приблизительно 115 мг/мл, приблизительно 116 мг/мл, приблизительно 117 мг/мл, приблизительно 118 мг/мл, приблизительно 119 мг/мл, приблизительно 120 мг/мл, приблизительно 121 мг/мл, приблизительно 122 мг/мл, приблизительно 123 мг/мл, приблизительно 124 мг/мл, приблизительно 125 мг/мл, приблизительно 126 мг/мл, приблизительно 127 мг/мл, приблизительно 128 мг/мл, приблизительно 129 мг/мл, приблизительно 130 мг/мл, приблизительно 131 мг/мл, приблизительно 132 мг/мл, приблизительно 133 мг/мл, приблизительно 134 мг/мл, приблизительно 135 мг/мл, приблизительно 136 мг/мл, приблизительно 137 мг/мл, приблизительно 138 мг/мл, приблизительно 139 мг/мл, приблизительно 140 мг/мл, приблизительно 141 мг/мл, приблизительно 142 мг/мл, приблизительно 143 мг/мл, приблизительно 144 мг/мл, приблизительно 145 мг/мл, приблизительно 146 мг/мл, приблизительно 147 мг/мл, приблизительно 148 мг/мл, приблизительно 149 мг/мл или приблизительно 150 мг/мл. Наиболее предпочтительно, концентрация антитела составляет от приблизительно 100 мг/мл до приблизительно 180 мг/мл и может быть выбрана из группы, включающей приблизительно 100 мг/мл, приблизительно 105 мг/мл, приблизительно 110 мг/мл, приблизительно 115 мг/мл, приблизительно 120 мг/мл, приблизительно 125 мг/мл, приблизительно 130 мг/мл, приблизительно 135 мг/мл, приблизительно 140 мг/мл, приблизительно 145 мг/мл, приблизительно 150 мг/мл, приблизительно 155 мг/мл, приблизительно 160 мг/мл, приблизительно 165 мг/мл, приблизительно 170 мг/мл, приблизительно 175 мг/мл или приблизительно 180 мг/мл.
В соответствии с предпочтительным вариантом осуществления, доза содержит количество антитела меньше чем или равное приблизительно 50 мг, приблизительно 51 мг, приблизительно 52 мг, приблизительно 53 мг, приблизительно 54 мг, приблизительно 55 мг, приблизительно 56 мг, приблизительно 57 мг, приблизительно 58 мг, приблизительно 59 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 460 мг, приблизительно 470 мг, приблизительно 480 мг, приблизительно 490 мг, приблизительно 500 мг, приблизительно 510 мг, приблизительно 520 мг, приблизительно 530 мг, приблизительно 540 мг, приблизительно 550 мг, приблизительно 560 мг, приблизительно 570 мг, приблизительно 580 мг, приблизительно 590 мг, приблизительно 600 мг, приблизительно 610 мг, приблизительно 620 мг, приблизительно 630 мг, приблизительно 640 мг, приблизительно 650 мг, приблизительно 660 мг, приблизительно 670 мг, приблизительно 680 мг, приблизительно 690 мг, приблизительно 700 мг, приблизительно 710 мг, приблизительно 720 мг, приблизительно 730 мг, приблизительно 740 мг, приблизительно 750 мг, приблизительно 760 мг, приблизительно 770 мг, приблизительно 780 мг, приблизительно 790 мг, приблизительно 800 мг, приблизительно 810 мг, приблизительно 820 мг, приблизительно 830 мг, приблизительно 850 мг, приблизительно 850 мг, приблизительно 860 мг, приблизительно 870 мг, приблизительно 880 мг, приблизительно 890 мг, приблизительно 900 мг, приблизительно 910 мг, приблизительно 920 мг, приблизительно 930 мг, приблизительно 940 мг, приблизительно 950 мг, приблизительно 960 мг, приблизительно 970 мг, приблизительно 980 мг, приблизительно 990 мг или приблизительно 1000 мг.
В соответствии с некоторыми вариантами осуществления, доза содержит количество антитела, которое составляет приблизительно 1 мкг/кг, приблизительно 10 мкг/кг, приблизительно 20 мкг/кг, приблизительно 25 мкг/кг, приблизительно 50 мкг/кг, приблизительно 100 мкг/кг, приблизительно 200 мкг/кг, приблизительно 250 мкг/кг, приблизительно 500 мкг/кг, приблизительно 1 мг/кг, приблизительно 2 мг/кг, приблизительно 3 мг/кг, приблизительно 4 мг/кг, приблизительно 5 мг/кг, приблизительно 6 мг/кг, приблизительно 7 мг/кг, приблизительно 8 мг/кг, приблизительно 9 мг/кг, приблизительно 10 мг/кг или приблизительно 11 мг/кг (массы тела субъекта, для которого предполагается введение этой дозы). В некоторых вариантах осуществления доза содержит приблизительно 20 мкг/кг, приблизительно 25 мкг/кг, приблизительно 50 мкг/кг, приблизительно 100 мкг/кг, приблизительно 200 мкг/кг, приблизительно 250 мкг/кг, 1 мг/кг, приблизительно 2 мг/кг, приблизительно 3 мг/кг, приблизительно 4 мг/кг, приблизительно 5 мг/кг, приблизительно 6 мг/кг, приблизительно 7 мг/кг, приблизительно 8 мг/кг, приблизительно 9 мг/кг или приблизительно 10 мг/кг.
Режимы дозирования могут зависеть от характера фармакокинетического распада, которого желает достичь практикующий врач. Например, в некоторых вариантах осуществления предполагается введение от одного до четырех раз в неделю. Можно использовать даже менее частое введение. В некоторых вариантах осуществления дозу вводят один раз в 1 неделю, раз в 2 недели, раз в 3 недели, раз в 4 недели, раз в 5 недель, раз в 6 недель, раз в 7 недель, раз в 8 недель, раз в 9 недель, раз в 10 недель, раз в 15 недель, раз в 20 недель, раз в 25 недель или реже. В некоторых вариантах осуществления дозу вводят раз в месяц, раз в 2 месяца, раз в 3 месяца, раз в 4 месяца, раз в 5 месяцев, раз в 6 месяцев или реже. Прогресс этой терапии легко контролировать, используя обычные методы и анализы. Режим дозирования может меняться со временем.
Для целей настоящего изобретения подходящая дозировка лекарственного средства будет зависеть от используемого антитела, типа и тяжести заболевания, подлежащего лечению, от того, вводится ли средство в профилактических или терапевтических целях, от предыдущей терапии, истории болезни пациента и от ответа на препарат и суждения лечащего врача. Обычно врач будет вводить лекарственное средство вплоть до достижения дозировки, при которой достигается желаемый результат. Дозировки можно определить эмпирически. Например, субъектам вводят возрастающие дозы для оценки эффективности лекарственного средства.
Доза и/или частота введения могут варьироваться в ходе лечения. Эмпирические соображения, такие как период полувыведения антитела, обычно влияют на определение дозировки. Частота введения может определяться и корректироваться в ходе лечения и, как правило, но не обязательно, зависит от лечения и/или подавления, и/или улучшения, и/или задержки одного или нескольких симптомов гиперпролиферативного заболевания. Некоторым субъектам может потребоваться более одной дозы. Частота введения может определяться и корректироваться во время курса терапии. Например, без ограничения, что касается повторных введений в течение нескольких дней или дольше, в зависимости от заболевания и его тяжести лечение продолжают до тех пор, пока не произойдет желаемое подавление симптомов или пока не будут достигнуты достаточные терапевтические уровни для лечения рака.
Введение лекарственного средства, включающего композицию, может быть непрерывным или периодическим, в зависимости, например, от физического состояния реципиента, от того, является ли цель введения терапевтической или профилактической, а также от других факторов, известных квалифицированным специалистам. Введение лекарственного средства, включающего композицию, может быть по существу непрерывным в течение заранее выбранного периода времени или может осуществляться в виде серии вводимых с определенными интервалами доз.
Предпочтительно введение представляет собой парентеральное введение, предпочтительно выбранное из внутривенного, внутриартериального, интраперитонеального, интратекального, интравентрикулярного, интрауретрального, интрастернального, интракраниального, внутримышечного, внутрикостного, внутрикожного и подкожного введения. Предпочтительно лекарственное средство находится в стерильной стандартной лекарственной форме для парентерального введения.
Следующие ниже примеры предлагаются только для иллюстративных целей и никоим образом не предназначены для ограничения объема настоящего изобретения. Действительно, различные модификации изобретения в дополнение к тем, которые показаны и описаны в настоящей заявке, будут очевидными для специалистов в данной области техники на основании предшествующего описания и подпадают под объем прилагаемой формулы изобретения. Примеры в WO 2016/092419 приведены для иллюстрации антител для использования в настоящем изобретении. Полное содержание WO 2016/092419 включено в настоящую заявку посредством ссылки.
ПРИМЕРЫ
Методы
Этот раздел, относящийся к методам, кратко описывает методы, используемые в следующих Примерах 1-6.
Вязкость композиций антител измеряли на устройстве m-VROC на чипе, где разность давления коррелирует с динамической вязкостью раствора. Измерения осуществляли при различных скоростях потока и скоростях сдвига. Размер образца был приблизительно 70-100 мкл. Аликвоты загружали в 100 мкл шприц Гамильтона и соединяли с m-VROC чипом. Измерения осуществляли в трех повторах при 20°C.
Для определения стабильности при замораживании/оттаивании анти-PD-1 антитело при 100-150 мг/мл подвергали условиям от -20°C до 2-8°C в течение 5 циклов. Стабильность антитела оценивали на основании pH, концентрации и SEC.
Для определения стабильности при взбалтывании анти-PD-1 антитело при высокой концентрации оценивали после 24 часов взбалтывания при 300 об/мин и температуре окружающей среды и при свете в отвесном положении. Стабильность оценивали на основании pH, концентрации и SEC.
pH Стабильность высококонцентрированных композиций антител измеряли в соответствии с фармакопейным методом USP <791> и фармакопейным методом EP 2.2.3 с использованием подходящего, должным образом стандартизированного потенциометрического устройства (pH-метр Thermo Scientific Orion Star A111), способного воспроизводить значения pH до 0,02 pH единиц с использованием индикаторного электрода, чувствительного к активности водород-ионов, стеклянного электрода и подходящего референсного электрода (Комбинированный pH Микроэлектрод Thermo Scientific Orion™ PerpHecT™ ROSS™). Двух- или трехточечную калибровку при 22,5-25,4°C осуществляли в день использования для проверки стандартизации pH-метра, образцы уравновешивали при температуре окружающей среды в течение по меньшей мере 30 минут, и значения до 0,01 единиц pH регистрировали после стабилизации показаний pH в течение по меньшей мере 60 секунд.
Общие концентрации белка измеряли спектроскопически с использованием устройства SoloVPE (C Technologies Inc.) на основе переменной длины пути и закона Бера-Ламберта (A=clε, где A=поглощение, c=концентрация, l=длина пути и ε = коэффициент экстинкции/молярный коэффициент поглощения в мг мл-1 см-1). Для анти-PD-1 антитела mAb7 используемое значение ε составляет 1,62 мг мг мг мл-1 см-1. Для ниволумаба значение ε составляет 1,68 мг мг мг мл-1 см-1. Для пембролизумаба используемое значение ε составляет 1,42 мг мг мл-1 см-1. Образцы уравновешивали до температуры окружающей среды, добавляли в сосуд для образцов (C Tech Inc. # OC0009-1-P50) и вставляли в держатель для сосудов на платформе окна обнаружения. Для каждого образца чистый фибрет (# OC0002-P50) устанавливали в гнездо для фибрета и считывали угол наклона при 280 нм (поправка на рассеяние при 320 мм).
Образование соединений с более высокой молекулярной массой (HMMS) анализировали методом эксклюзионной хроматографии (SEC) на системе ВЭЖХ Agilent. 50 мкг белка разделяли на основании гидродинамического объема на колонке YMC-Pack Diol-200 (Waters, кат. № DL20S053008WT), поддерживаемой при 30±2°C с использованием изократического градиента (20 мМ фосфата натрия, 400 мМ хлорида натрия, pH 7,2) при 0,75 мл/мин. Виды с разной молекулярной массой элюировали и определяли по УФ-поглощению при 280 нм.
Гетерогенность заряда и стабильность антител при высокой концентрации к дезамидированию и фрагментации количественно оценивали с использованием визуализированного капиллярного изоэлектрического фокусирования (iCE), которое разделяет виды белков на основе их разницы зарядов (значение pI) в градиенте pH. Образцы разбавляли в смеси до конечной концентрации 0,3 мг/мл белка, 0,01 мг/мл pI маркера 6.14 (Protein Simple, part no. 102220), 0,01 мг/мл pI маркера 9/50 (Protein Simple, part no. 101996), 4% Pharmalyte pH 3-10 (GE part no. 17-0456-01), 0,25% метилцеллюлозы (Protein Simple, part no. 101876)) и 2 М мочевины (Sigma-Aldrich, part no. U4883). Образцы вводили в картриджную колонку cIEF, покрытую фторуглеродом (Protein Simple, part no. 101701), установленную в устройстве Protein simple iCE3, фокусировали в капиллярной колонке под высоким напряжением (≤3000 В) и отслеживали в системе видеодетекции колонки в реальном времени (WCID) на фиксированной длине волны 280 нм. Полученные электрофореграммы анализировали с использованием соответствующего программного обеспечения для определения значений pI и площадей пиков для каждого вида.
Невидимые невооруженным глазом частицы анализировали с использованием визуализации микропотока (MFI). Перед любым анализом образца для проверки пригодности системы использовали 15 мкм Duke latex стандарта. Между каждым анализом использовали промывку водой. Кроме того, перед анализом осуществляли холостой анализ воды, чтобы убедиться, что показатели фона подходят для тестирования. Данные представляли как средние кумулятивные количества на мл. Кроме того, отслеживали каналы нескольких размеров, чтобы предоставить информацию о количестве частиц в каждом размерном диапазоне.
Пример 1. Влияние буфера и pH на вязкость
Этот пример иллюстрирует влияние pH на вязкость в высококонцентрированной композиции анти-PD-1 антитела.
Для получения композиции антитела, анти-PD-1 антитело mAb7 подвергали процедуре буферного обмена в 20 мМ Гистидина pH 5,5, 20 мМ Гистидина pH 6,0, 20 мМ Гистидина pH 6,5, 20 мМ Гистидина pH 7,0, 20 мМ Ацетата pH 5,0 и 20 мМ Ацетата pH 6,0 путем постоянного повторения процедуры разбавления буфером с последующим концентрированием до приблизительно 160 мг/мл до завершения буферного обмена. Целевая конечная концентрация всех образцов была 160 мг/мл.
Концентрацию белка, вязкость и pH измеряли для всех образцов. Результаты представлены в Таблице 1 и на Фиг. 1. Результаты демонстрируют, что композиции с более низким pH имеют значительно более низкую вязкость. Кроме того, при одинаковом pH композиции на основе гистидина и ацетата имеют одинаковую вязкость.
(мг/мл)
Пример 2. Оценка аргинина
Этот пример иллюстрирует влияние изменяющихся концентраций аргинина на вязкость анти-PD-1 антитела.
Для оценки влияния аргинина на вязкость анти-PD-1 антитело mAb7 формулировали в композицию с 20 мМ Ацетата pH 5,0, 50 г/л сахарозы, 0,05 г/л Na2EDTA дигидрата и 0,2 г/л PS80 путем диализа (без PS80) с использованием кассет для диализа MWCO 20 кДа, концентрирования до приблизительно 200 мг/мл анти-PD-1 антитела с использованием 50 кДа центрифужных фильтров Amicon и впрыскивания в высокой концентрации PS80. Композиции с меняющимися концентрациями аргинина получали путем добавления высококонцентрированного раствора аргинина гидрохлорида (HCl).
Концентрацию белка и pH измеряли для всех образцов. Результаты представлены в Таблице 2 и на Фиг. 2. Показана вязкость композиций анти-PD-1 антител с 0, 50, 100, 150, 200 и 250 мМ аргинина в диапазоне концентраций анти-PD-1 антитела (Таблица 2, Фиг. 2). Результаты демонстрируют, что добавление 50 мМ аргинина уменьшает вязкость высококонцентрированных композиций анти-PD-1 антител. Кроме того, постепенное увеличение концентрации аргинина до 250 мМ еще больше уменьшает вязкость.
(мг/мл)
Пример 3. Оценка аргинин-содержащих композиций
Этот пример иллюстрирует влияние дополнительных эксципиентов на вязкость и стабильность анти-PD-1 антитела.
Для получения аргинин-содержащих композиций антител анти-PD-1 антитело mAb7 было сформулировано в каждую из композиций 1-6 (Таблица 3) путем включения mAb7 в каждую композицию методом диализа (без PS80) с использованием кассет для диализа MWCO 20 кДа, концентрирования до 150-200 мг/мл анти-PD-1 антитела с использованием 50 кДа Amicon центрифужных фильтров и впрыскивания в высокой концентрации PS80.
Композиции 1, 2 и 3 оценивают для определения влияния pH в аргинин-содержащих композициях. Таблица 4 и Фиг. 3 представляют вязкость композиций 1, 2 и 3 в диапазоне концентраций анти-PD-1. Результаты демонстрируют, что в композициях, содержащих 150 мМ аргинина, снижение pH от 5,5 до 4,5 существенно уменьшает вязкость.
(мг/мл)
Композиции 4, 5 и 6 оценивали для определения влияния добавления пролина к композициям, содержащим 100 мМ Аргинина при pH 5,0. Таблица 5 и Фиг. 4 представляют вязкость композиций 4, 5 и 6 в диапазоне концентраций анти-PD-1 антитела. Результаты демонстрируют, что нет существенной разницы в вязкости высококонцентрированных композиций анти-PD-1 антител, содержащих 0, 100 или 200 мМ пролина.
(мг/мл)
Стабильность композиций 1, 2, 3, 4 и 5 при 150 мг/мл анти-PD-1 антитела определяли путем помещения образцов в условия определения стабильности при 5°C, 25°C и 40°C. Стабильность белка оценивали на основании агрегации (SEC), заряженных изоформ (iCE), концентрации и pH. Таблицы 6, 7, 8, 9 и 10 представляют термостабильность композиций 1, 2, 3, 4 и 5, соответственно.
Термостабильность композиции 1
Термостабильность композиции 2
Термостабильность композиции 3
Термостабильность композиции 4
Термостабильность композиции 5
Для всех композиций 1-5 через 10 недель (10W) (4 недели (4W) для композиций 4 и 5), что касается видов, отличающихся по заряду, и агрегатов (HMMS), никаких существенных изменений при 5°C и 25°C не было. При 40°C композиция 1 (pH 4,5) имела существенное увеличение щелочных видов, тогда как композиции 2, 3, 4 и 5 (pH > 4,5) имели увеличение кислотных видов. Увеличение агрегатов (HMMS) было схожим для всех композиций после хранения при 40°C, однако такое увеличение считается приемлемым для жидких композиций с предполагаемыми условиями хранения 5°C.
Пример 4. Оценка трегалоза-содержащих композиций
Этот пример иллюстрирует эффект трегалозы на стабильность и вязкость композиций анти-PD-1 антител.
Дигидрат трегалозы оценивали в качестве стабилизатора в композициях без аргинина и в аргинин-содержащих композициях (Таблица 11).
дигидрат
HCl
Для получения трегалоза-содержащих композиций антител анти-PD-1 антитело mAb7 подвергали процедуре буферного обмена в 20 мМ гистидина и 50 г/л дигидрата трегалозы с использованием тангенциальной поточной фильтрации с использованием 50 кДа ультрафильтрационных картриджей. Концентрацию анти-PD-1 антитела mAb7 повышали с использованием ультрафильтраци, с последующим добавлением эксципиентов, используя высококонцентрированные растворы и разбавление при необходимости. Анти-PD-1 антитело mAb7 формулировали в композицию 7 при следующих концентрациях: 104 мг/мл, 154 мг/мл, 174 мг/мл и 200 мг/мл. Анти-PD-1 антитело mAb7 формулировали в композицию 8 при следующих концентрациях: 150 мг/мл, 170 мг/мл и 200 мг/мл. Вязкость измеряли как описано выше. Результаты представлены в Таблице 12 и на Фиг. 5.
Вязкость трегалоза-содержащих композиций
(мг/мл)
Вязкость композиции 7, содержащей 104 мг/мл, 154 мг/мл, 174 мг/мл и 200 мг/мл mAb7, составляет 5,3, 16,9, 32,5 и 67,6 сПз, соответственно, при 20°C. Вязкость композиции 8, содержащей 150 мг/мл, 170 мг/мл и 200 мг/мл mAb7, составляет 14,1, 25,0 и 54,4 сПз, соответственно, при 20°C.
Результаты демонстрируют, что композиция 8 (содержащая аргинин) имеет более низкую вязкость, чем композиция 7 при концентрациях анти-PD-1 антитела ≥ 175 г/л. Вязкость композиции 7 и 8 при приблизительно 150 мг/мл была одинаковой (Фиг. 5).
Стабильность композиций анти-PD-1 антитела 7 и 8 оценивали при 5°C, 25°C и 40°C. Композицию 7 испытывали с использованием 100 мг/мл и 150 мг/мл анти-PD-1 антитела, а композицию 8 с использованием 150 мг/мл анти-PD-1 антитела. Образцы помещали в условия 5°C, 25°C и 40°C и стабильность оценивали путем измерения агрегации (SEC), изоформ, отличающихся по заряду (iCE), концентрации, pH и частиц, невидимых невооруженным глазом (MFI), как описано выше. Результаты представлены в Таблицах 13-21 (NT=не испытывали).
Таблицы 13, 14 и 15 представляют термостабильность для композиции 7 при 150 мг/мл анти-PD-1 при 5°C, 25°C и 40°C, соответственно.
Термостабильность композиции 7 (150 мг/мл) при 5°C
Термостабильность композиции 7 (150 мг/мл) при 25°C
Термостабильность композиции 7 (150 мг/мл) при 40°C
Таблицы 16, 17 и 18 представляют термостабильность для композиции 7 при 10 мг/мл анти-PD-1 при 5°C, 25°C и 40°C, соответственно.
Термостабильность композиции 7 (100 мг/мл) при 5°C
Термостабильность композиции 7 (100 мг/мл) при 25°C
Термостабильность композиции 7 (100 мг/мл) при 40°C
Таблицы 19, 20 и 21 представляют термостабильность для композиции 8 при 150 мг/мл анти-PD-1 при 5°C, 25°C и 40°C, соответственно.
Термостабильность композиции 8 (150 мг/мл) при 5°C
Термостабильность композиции 8 (150 мг/мл) при 25°C
Термостабильность композиции 8 (150 мг/мл) при 40°C
Общее содержание ≥ 10мкм (частиц/мл)
Общее содержание ≥ 25мкм (частиц/мл)
Никаких существенных изменений, что касается концентрации белка, pH или частиц, невидимых невооруженным глазом, не наблюдали для всех композиций при всех условиях испытаний (Таблицы 13-21). Кроме того, никаких существенных изменений агрегации или видов, отличающихся по заряду, при 5°C или 25°C не наблюдали. Количество агрегатов (HMMS) и кислотных видов увеличивалось для всех композиций после хранения при 40°C, однако увеличение является одинаковым во всех композициях, и относительное увеличение считается приемлемым для жидких композиций с предполагаемыми условиями хранения 5°C.
Эти результаты демонстрируют, что композиция 7, содержащая 150 мг/мл анти-PD-1 антитела mAb7, 20 мМ гистидина, 84 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,0-5,1 является стабильной после 14 недель(14W) хранения при 5°C или 25°C (Таблицы 13 и 14). Эти результаты также демонстрируют, что композиция 7, содержащая 100 мг/мл анти-PD-1 антитела mAb7, 20 мМ гистидина, 84 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,0-5,1 является стабильной после 14 недель хранения при 5°C или 25°C (Таблицы 16 и 17). Эти результаты также демонстрируют, что композиция 8, содержащая 150 мг/мл анти-PD-1 антитела mAb7, 20 мМ гистидина, 100 мМ аргинина, 50 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,0 является стабильной после 6 недель(6W) хранения при 5°C или 25°C (Таблицы 19 и 20).
Стабильность при замораживании-оттаивании и встряхивании композиции 7 при 100 и 150 мг/мл анти-PD-1 и композиции 8 при 150 мг/мл анти-PD-1 определяли, подвергая композиции стрессовым условиям либо 5 циклам замораживания/оттаивания (FT), либо встряхиванию (AG) в течение 24 часов. Результаты представлены в Таблице 22.
Стабильность композиции 7 (100 мг/мл и 150 мг/мл) и композиции 8 после замораживания/оттаивания и встряхивания
(150 мг/мл)
(100 мг/мл)
Аналогичные низкие уровни образования агрегатов после воздействия стрессовых условий либо путем замораживания/оттаивания, либо встряхивания наблюдали для композиции 7 и композиции 8, т.е. 0,6%, (Таблица 22).
Эти результаты демонстрируют, что композиция 7, содержащая 100 или 150 мг/мл анти-PD-1 антитела mAb7, 20 мМ гистидина, 84 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,0-5,1 является стабильной после 5 циклов замораживания/оттаивания или 24 часов встряхивания. Композиция 8, содержащая 150 мг/мл анти-PD-1 антитела mAb7, 20 мМ гистидина, 100 мМ аргинина HCl, 50 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата, 0,2 мг/мл PS80, pH 5,0), также является стабильной после 5 циклов замораживания/оттаивания или 24 часов встряхивания.
Пример 5. Паттерн гликозилирования анти-PD-1 антитела mAb7
Этот пример иллюстрирует паттерн гликозилирования анти-PD-1 антитела mAb7.
Пептидное картирование методом ЖХ/МС подтвердило один сайт N-гликозилирования, расположенный на пептиде тяжелой цепи, содержащем N294ST консенсусную последовательность. N294ST консенсусная последовательность по существу полностью занята. Профиль N-связанных олигосахаридов, наблюдаемый для mAb7, демонстрирует два основных N-гликана, G0F и G1F, которые оба представляют собой биантенарные структуры комплексного типа с фукозилированным ядром. Кроме того, менее распространенные N-гликаны, соответствующие усеченным и/или афукозилированным биантенарным структурам комплексного типа, структурам с высоким содержанием маннозы Man5, и сиалилированным, имеющим фукозилированное ядро биантенарным комплексного типа олигосахаридам, также определены и идентифицированы.
Профилирование N-связанных олигосахаридов mAb7 включало 2-аминобензамид (2-AB)-мечение N-связанных олигосахаридов, высвобождаемых пептид-N-гликозидазой F (PNGaseF). 2-AB-меченные N-связанные олигосахариды разделяли жидкостной хроматографией, основанной на гидрофильных взаимодействиях (HILIC), с детекцией флуоресценции и установлением структуры методом масс-спектрометрии. Гетерогенность гликанов в mAb7 показана на графике Фиг. 6.
Пример 6. Оценка анти-PD-1 антител в композиции 7
Этот пример оценивает возможность использования композиции 7 с KEYTRUDA® (пембролизумаб) и OPDIVO® (ниволумаб).
Пембролизумаб и ниволумаб каждый формулировали в 20 мМ гистидинового буфера, 84 мг/мл дигидрата трегалозы, pH 5,0. Высококонцентрированный полисорбат 80 и динатрий EDTA дигидрат вводили в образцы для получения конечной композиции 20 мМ гистидина, 84 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,0 (композиция 7). Все композиции затем фильтровали с использованием 0,22 мкм PES фильтров и разбавляли до требуемых концентраций с использованием раствора не содержащей белка композиции 7.
Пембролизумаб формулировали в композицию 7 при 129, 150, 175 и 193 мг/мл. Ниволумаб формулировали в композицию 7 при 125, 148 и 179 мг/мл. Вязкость при 20°C измеряли, как описано выше. Результаты представлены в Таблице 23.
Вязкость анти-PD-1 антител в композиции 7
Результаты демонстрируют, что вязкости как функция концентрации белка пембролизумаба и ниволумаба в композиции 7 сопоставимы с вязкостью анти-PD-1 антитела mAb7 в композиции 7 (Таблица 12).
Термостабильность пембролизумаба, ниволумаба и анти-PD-1 антитела mAb7 в композиции 7 оценивали путем измерения температуры плавления методом дифференциальной сканирующей калориметрии. Все три антитела разбавляли до 1 мг/мл с использованием раствора не содержащей белка композиции 7 перед анализом. Термическое сканирование осуществляли от 10°C до 110°C при скорости изменения температуры 100°C/час. Термограммы показаны на Фиг. 7, и начало теплового развертывания (Tначала) и температуры плавлени (Tm1,m,2) показаны в Таблице 24.
Термические свойства анти-PD-1 антител в композиции 7
Результаты определения термостабильности демонстрируют, что пембролизумаб, ниволумаб и анти-PD-1 антитело mAb7 в композиции 7 имеют сопоставимые термические профили, температуры начала плавления и температуры плавления.
Стабильность пембролизумаба и ниволумаба при 150 мг/мл в композиции 7 оценивали при 40°C в течение 2 недель путем определения агрегации (SEC), отличающихся по заряду изоформ (iCE), концентрации, чистоты методом электрофореза в восстановительном капиллярном геле (rCGE) и pH. Результаты представлены в Таблицах 25 и 26.
Термостабильность композиции 7 (150 мг/мл пембролизумаба) при 40°C
Термостабильность композиции 7 (150 мг/мл ниволумаба) при 40°C
Эти результаты демонстрируют, что композиция 7, содержащая 150 мг/мл пембролизумаба, 20 мМ гистидина, 84 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,0-5,1 является стабильной после 2 недель хранения при 40°C. Эти результаты также демонстрируют, что композиция 7, содержащая 150 мг/мл ниволумаба, 20 мМ гистидина, 84 мг/мл дигидрата трегалозы, 0,05 мг/мл динатрий EDTA дигидрата и 0,2 мг/мл PS80, при pH 5,1-5,2 является стабильной после 2 недель хранения при 40°C.
Все ссылочные документы, цитируемые в настоящей заявке, включая патенты, патентные заявки, статьи, справочники и т.п., а также ссылки, цитируемые в них, включены в настоящую заявку посредством посредством ссылки во всей их полноте. В случае, если один или несколько включенных литературных источников и подобных материалов отличаются от настоящей заявки или противоречат ей, включая, но не ограничиваясь этим, определенные термины, использование терминов, описанные методы и т.п., преимущество имеет настоящая заявка.
Вышеприведенное описание и примеры подробно описывают некоторые конкретные варианты осуществления изобретения и описывают лучший способ, предусмотренный авторами изобретения. Однако должно быть понятно, что независимо от того, насколько подробно вышеизложенное может быть представлено в тексте, изобретение может быть осуществлено на практике различными путями, и изобретение следует рассматривать в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Pfizer Inc.
<120> КОМПОЗИЦИИ АНТИ-PD-1 АНТИТЕЛ
<130> PC72395A
<150> 62/807,912
<151> 2019-02-20
<150> 62/639,587
<151> 2018-03-07
<160> 11
<170> PatentIn version 3.5
<210> 1
<211> 288
<212> Белок
<213> Homo sapiens
<400> 1
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 2
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность гуманизированного антитела
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Ser Ser Leu Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ser Thr Gly Thr Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 3
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность гуманизированного антитела
<400> 3
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Trp Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Thr Ser Tyr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Phe Tyr Pro His Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> последовательность мышиной CDR с созревшей аффинностью
<400> 4
Gly Tyr Thr Phe Thr Ser Tyr Trp Ile Asn
1 5 10
<210> 5
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> последовательность мышиной CDR с созревшей аффинностью
<400> 5
Asn Ile Tyr Pro Gly Ser Ser Leu Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 6
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> последовательность мышиной CDR с созревшей аффинностью
<400> 6
Leu Ser Thr Gly Thr Phe Ala Tyr
1 5
<210> 7
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> последовательность мышиной CDR с созревшей аффинностью
<400> 7
Lys Ser Ser Gln Ser Leu Trp Asp Ser Gly Asn Gln Lys Asn Phe Leu
1 5 10 15
Thr
<210> 8
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> последовательность мышиной CDR с созревшей аффинностью
<400> 8
Trp Thr Ser Tyr Arg Glu Ser
1 5
<210> 9
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> последовательность мышиной CDR с созревшей аффинностью
<400> 9
Gln Asn Asp Tyr Phe Tyr Pro His Thr
1 5
<210> 10
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность гуманизированного антитела
<400> 10
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Ser Ser Leu Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ser Thr Gly Thr Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 11
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность гуманизированного антитела
<400> 11
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Trp Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Thr Ser Tyr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Phe Tyr Pro His Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Gly Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
115 120 125
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
130 135 140
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
145 150 155 160
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
165 170 175
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
180 185 190
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
195 200 205
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| КОМБИНИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ | 2020 |
|
RU2829637C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛА К PD-L1 И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2766590C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ АНТИТЕЛ ПРОТИВ TIGIT, ОТДЕЛЬНО И В КОМБИНАЦИИ С АНТИТЕЛАМИ ПРОТИВ РЕЦЕПТОРА 1 ПРОГРАММИРУЕМОЙ СМЕРТИ (PD-1), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2820576C2 |
| АНТИ-GDF15 АНТИТЕЛА, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2795457C2 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ К БЕЛКУ ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТКИ-1 (PD-1) | 2014 |
|
RU2723050C2 |
| ИНГИБИТОРЫ ПУТИ IL-4/IL-13 ДЛЯ ПОВЫШЕННОЙ ЭФФЕКТИВНОСТИ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2836467C2 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1, ИНГИБИТОРА ТИРОЗИНКИНАЗЫ VEGFR/FGFR/RET И ИНГИБИТОРА CBP/БЕТА-КАТЕНИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2020 |
|
RU2838452C1 |
| Способы лечения рака с помощью анти-PD-1-антител и анти-CTLA4-антител | 2019 |
|
RU2825835C2 |
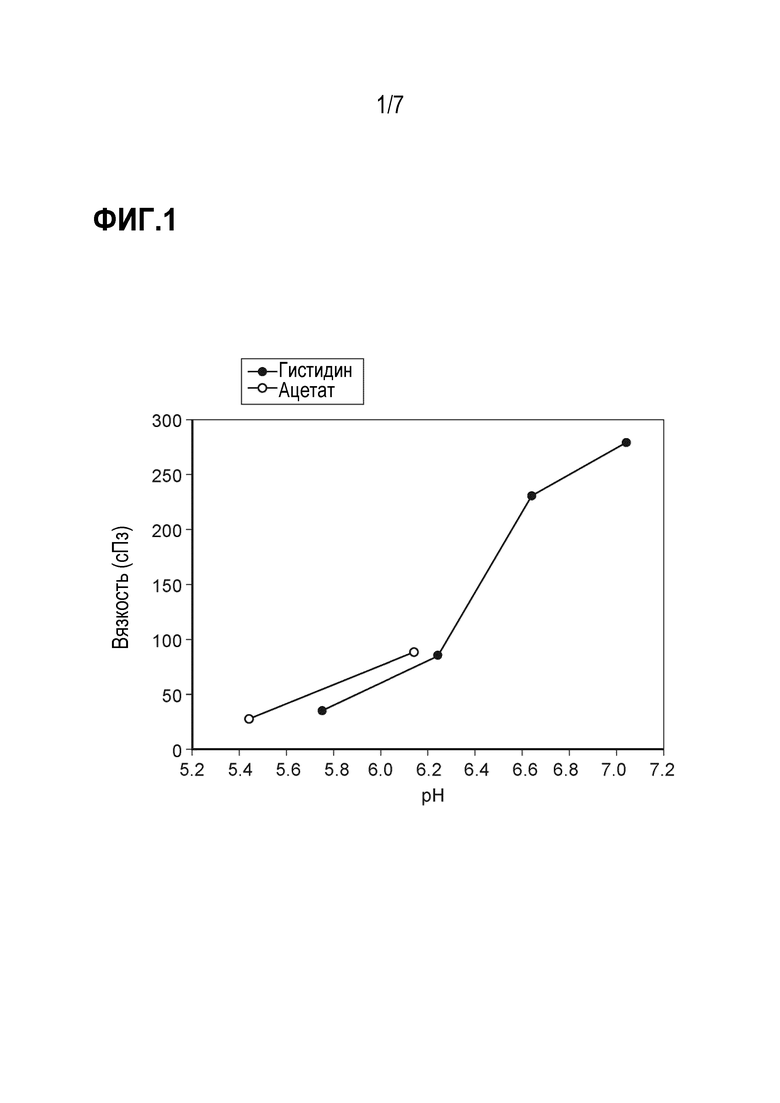
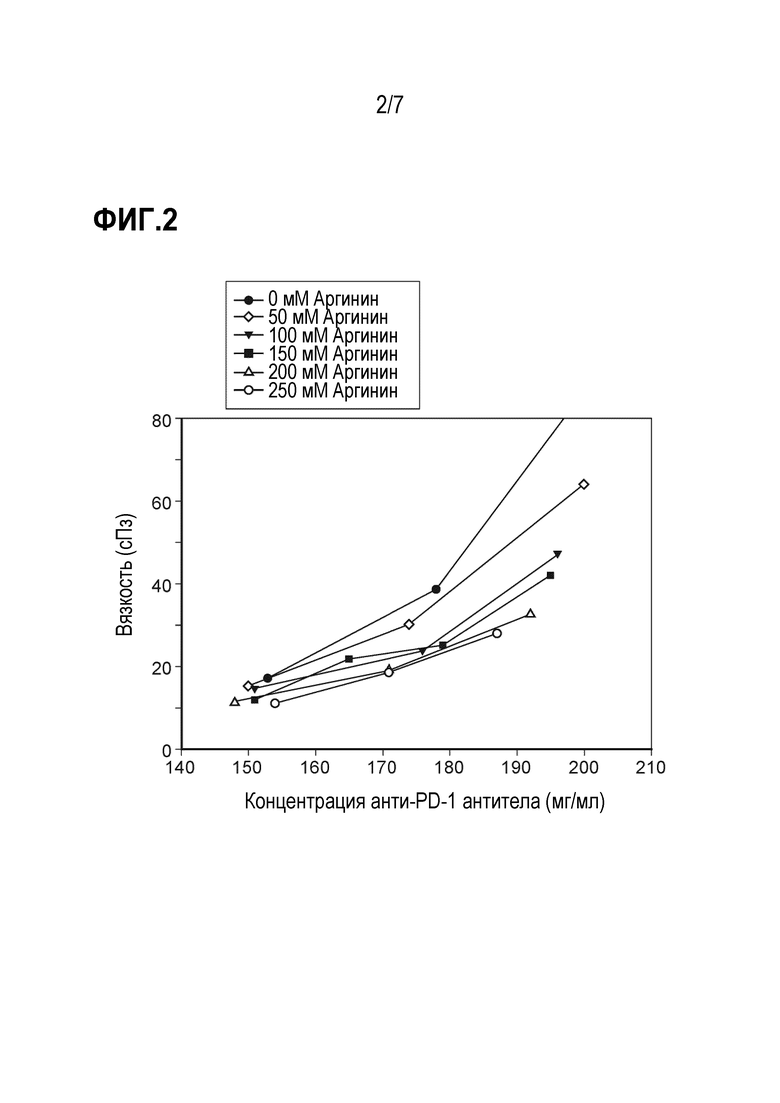
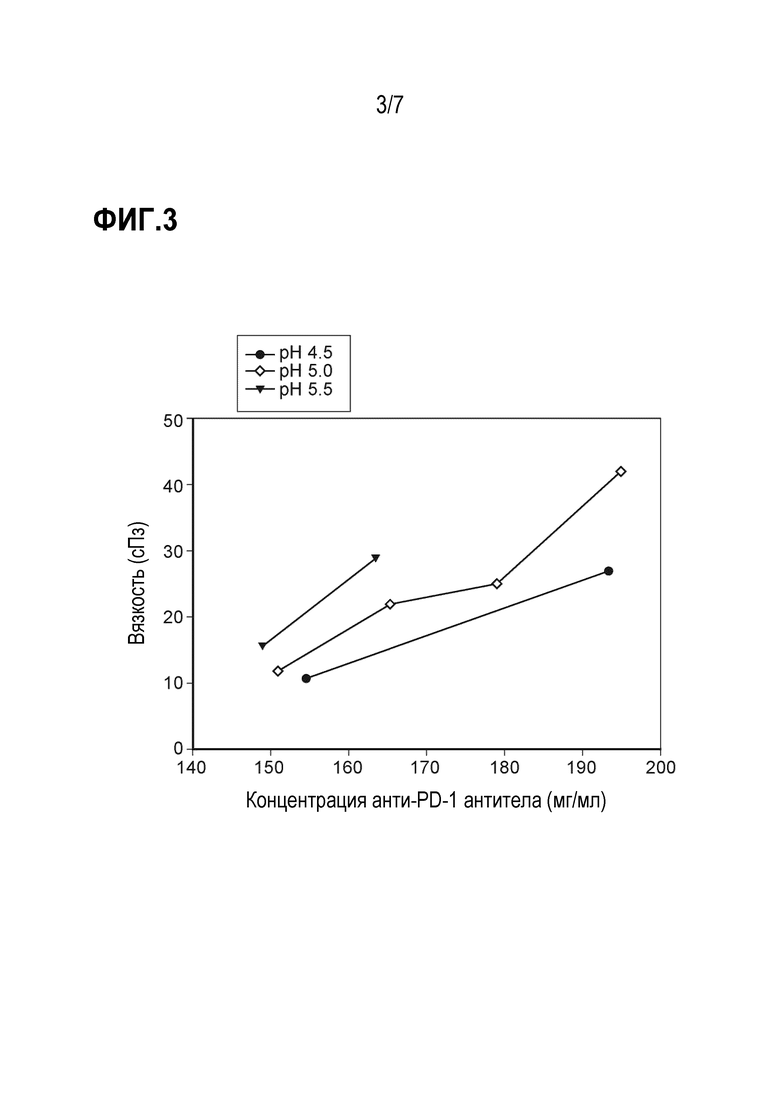
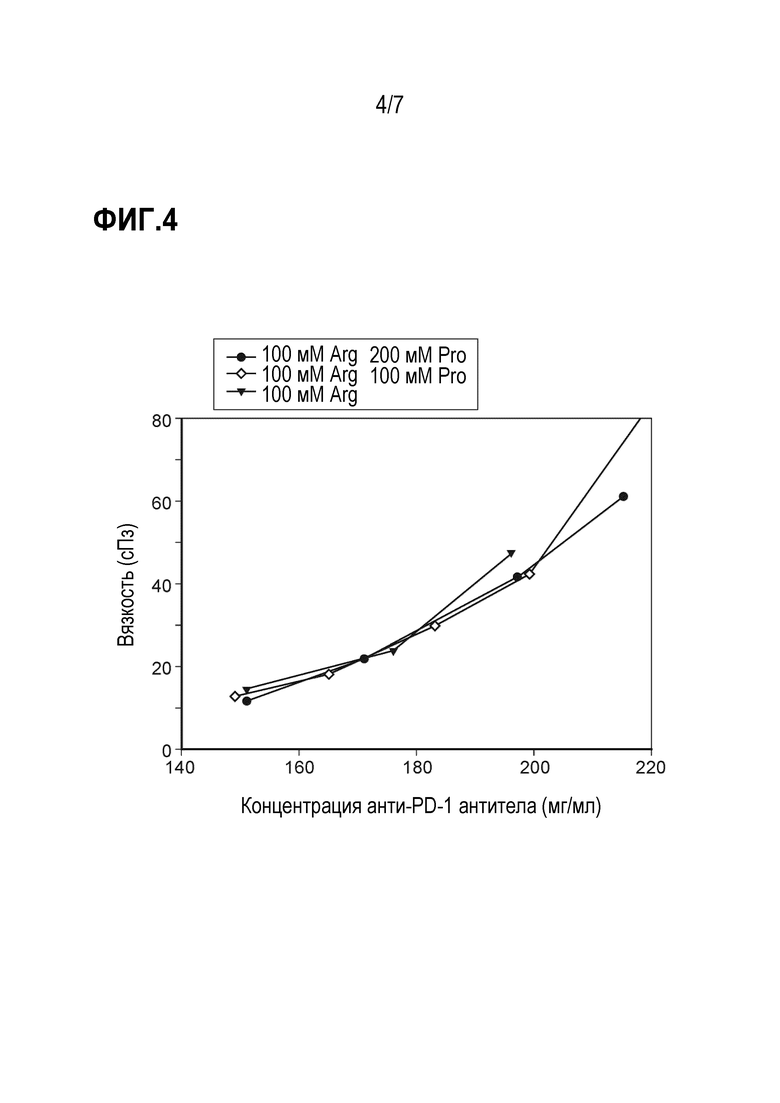
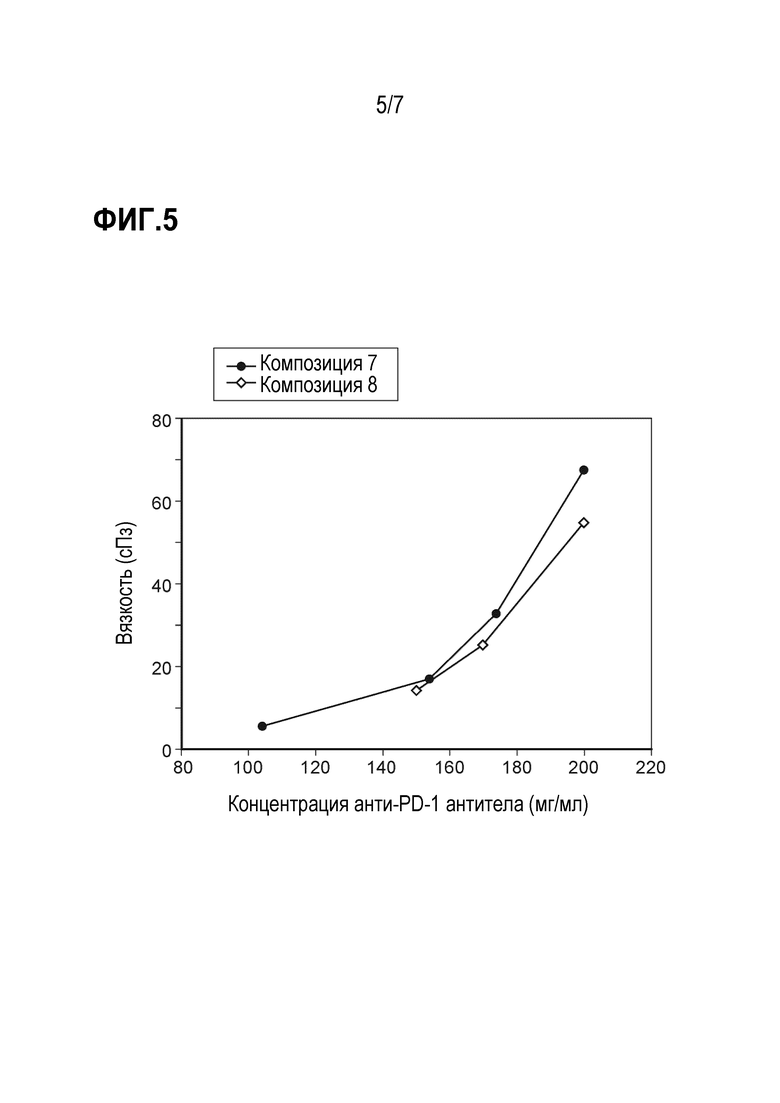
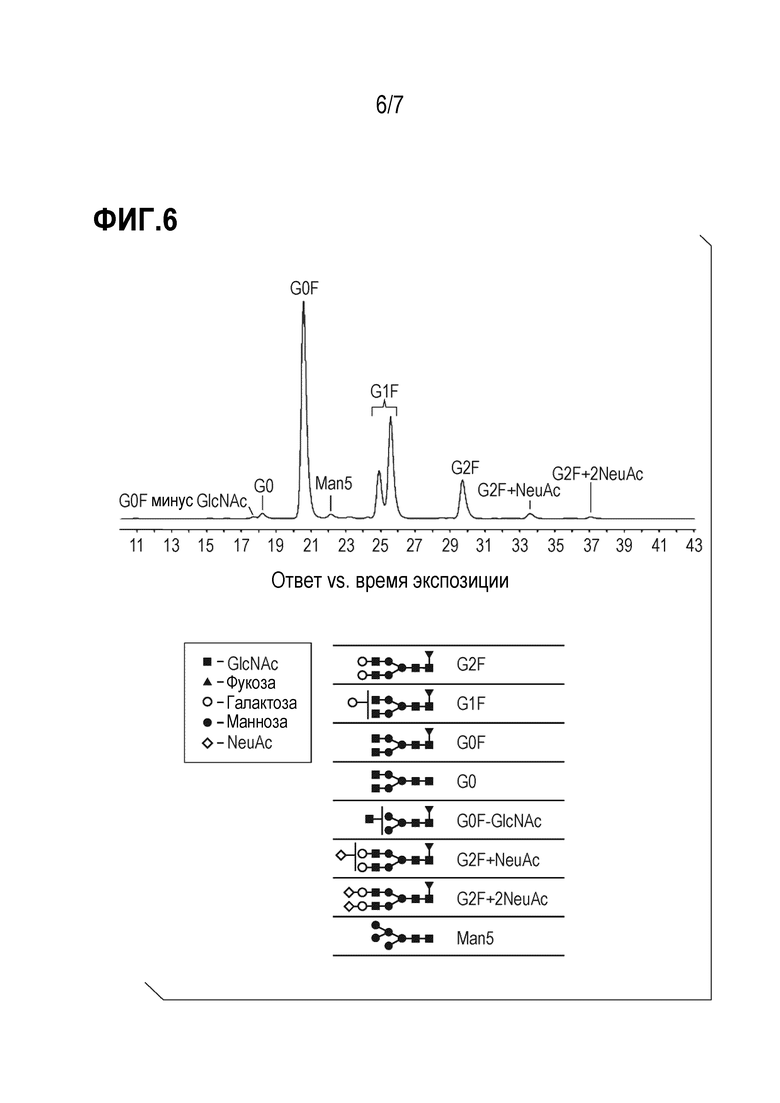
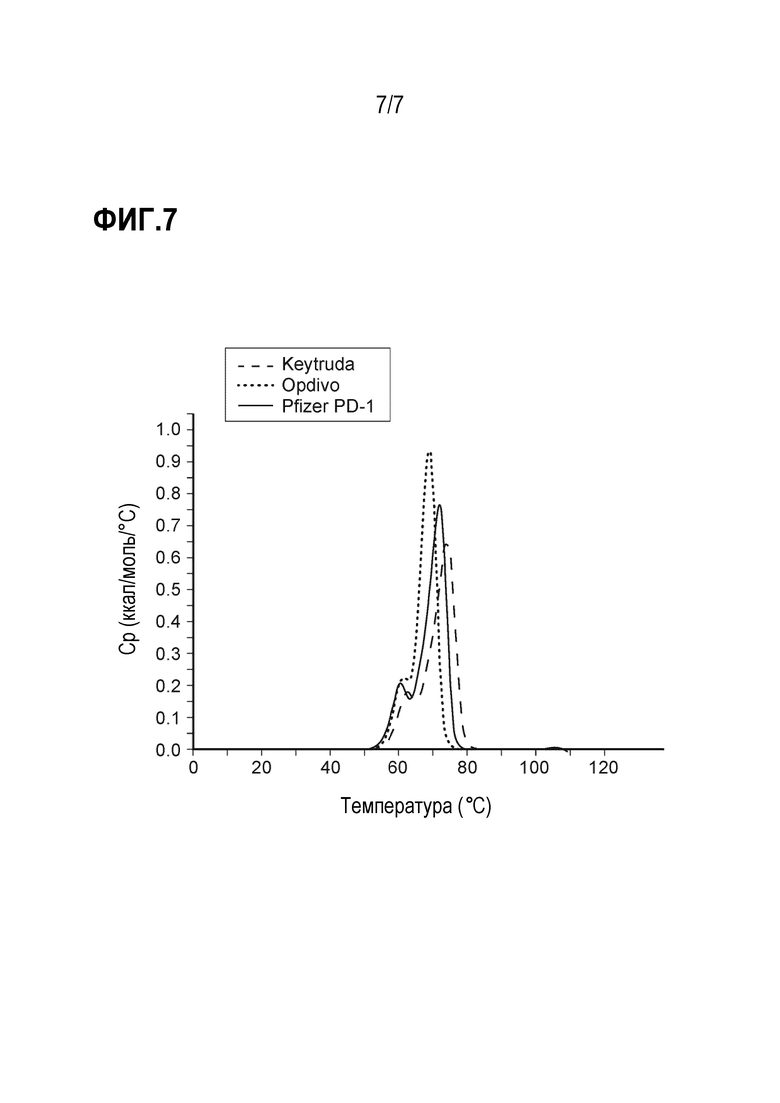
Группа изобретений относится к лечению рака. Фармацевтическая композиция для лечения рака включает 150 мг/мл анти-PD-1 антитела; 20 мМ гистидинового буфера; 84 мг/мл трегалозы; 0,2 мг/мл PS80 и 0,045 или 0,05 мг/мл EDTA, где указанная фармацевтическая композиция имеет pH 5,0 +/- 0,5. Также раскрыт другой вариант выполнения фармацевтической композиции. Группа изобретений обеспечивает композицию с высокой концентрацией антитела и сниженной вязкостью. 2 н. и 26 з.п. ф-лы, 7 ил., 26 табл., 6 пр.
1. Фармацевтическая композиция для лечения рака, включающая или состоящая из:
приблизительно 150 мг/мл анти-PD-1 антитела;
приблизительно 20 мМ гистидинового буфера;
приблизительно 84 мг/мл трегалозы;
приблизительно 0,2 мг/мл PS80; и
приблизительно 0,045 или приблизительно 0,05 мг/мл EDTA,
где указанная фармацевтическая композиция имеет pH 5,0 +/- 0,5.
2. Фармацевтическая композиция по п. 1, где вязкость композиции находится между приблизительно 10 сП и приблизительно 18 сП при 20°C.
3. Фармацевтическая композиция по п. 2, где вязкость композиции составляет приблизительно 15 сП при 20°C.
4. Фармацевтическая композиция по п. 1, где 0,045 мг/мл EDTA рассчитывается на основе молекулярной массы дигидрата Na2EDTA, и 0,050 мг/мл EDTA рассчитывается на основе молекулярной массы Na2EDTA, и каждый соответствует 0,13 нМ EDTA.
5. Фармацевтическая композиция по п. 4, где вязкость композиции находится между приблизительно 10 сП и приблизительно 18 сП при 20°C.
6. Фармацевтическая композиция по п. 5, где вязкость композиции составляет приблизительно 15 сП при 20°C.
7. Фармацевтическая композиция по любому из пп. 1-6, где EDTA включает динатрий EDTA, динатрий EDTA дигидрат или комбинацию динатрий EDTA и динатрий EDTA дигидрата.
8. Фармацевтическая композиция по любому из пп. 1-7, где антитело представляет собой человеческое или гуманизированное моноклональное антитело.
9. Фармацевтическая композиция по любому из пп. 1-8, где антитело представляет собой IgG4 антитело.
10. Фармацевтическая композиция по п. 9, где антитело представляет собой IgG4 S228P антитело.
11. Фармацевтическая композиция по любому из пп. 1-10, где антитело включает вариабельную область тяжелой цепи (VH), включающую первую определяющую комплементарность область VH (CDR1), VH CDR2 и VH CDR3 последовательности VH, показанной в SEQ ID NO: 2; и/или вариабельную область легкой цепи (VL), включающую VL CDR1, VL CDR2 и VL CDR3 последовательности VL, показанной в SEQ ID NO: 3.
12. Фармацевтическая композиция по п. 11, где VH CDR1 включает аминокислотную последовательность, показанную в SEQ ID NO: 4, VH CDR2 включает аминокислотную последовательность, показанную в SEQ ID NO: 5, и VH CDR3 включает аминокислотную последовательность, показанную в SEQ ID NO: 6, VL CDR1 включает аминокислотную последовательность, показанную в SEQ ID NO: 7, VL CDR2 включает аминокислотную последовательность, показанную в SEQ ID NO: 8, и VL CDR3 включает аминокислотную последовательность, показанную в SEQ ID NO: 9.
13. Фармацевтическая композиция по любому из пп. 1-10, где антитело включает аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности вариабельной области тяжелой цепи, показанной в SEQ ID NO: 2, и аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности вариабельной области легкой цепи, показанной в SEQ ID NO: 3.
14. Фармацевтическая композиция по любому из пп. 1-10, где антитело включает вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность, показанную в SEQ ID NO: 2, или вариант с одной или несколькими консервативными аминокислотными заменами в остатках, которые не находятся в CDR, и/или вариабельную область легкой цепи (VL), включающую аминокислотную последовательность, показанную в SEQ ID NO: 3, или ее вариант с одной или несколькими аминокислотными заменами в аминокислотах, которые не находятся в CDR.
15. Фармацевтическая композиция по любому из пп. 1-14, где антитело включает тяжелую цепь, включающую аминокислотную последовательность, показанную в SEQ ID NO: 10, с или без C-концевого лизина SEQ ID NO: 10; и легкую цепь, включающую аминокислотную последовательность, показанную в SEQ ID NO: 11.
16. Фармацевтическая композиция по п. 15, где антитело демонстрирует гликозилирование по Asn294, включающее G0F и G1F в качестве основных видов гликанов.
17. Фармацевтическая композиция по п. 16, где гликозилирование дополнительно включает в качестве минорных видов гликанов усеченные и/или афукозилированные комплексного типа биантенарные структуры, структуру с высоким содержанием маннозы Man5 и сиалилированные фукозилированные по ядру комплексного типа биантенарные олигосахариды.
18. Фармацевтическая композиция по любому из пп. 1-17, где фармацевтическая композиция является лиофилизированной или нелиофилизированной.
19. Фармацевтическая композиция по любому из пп. 1, 4 или 8-18, где фармацевтическая композиция имеет вязкость от приблизительно 10 до приблизительно 18 сП при 20°C.
20. Фармацевтическая композиция по любому из пп. 1-8, где антитело представляет собой PF-06801591, ниволумаб, пембролизумаб, цемиплимаб или спартализумаб или антиген-связывающую часть любого из вышеперечисленных.
21. Фармацевтическая композиция для лечения рака, включающая:
150 мг/мл анти-PD-1 антитела, где антитело включает тяжелую цепь, включающую аминокислотную последовательность, показанную в SEQ ID NO: 10, с или без C-концевого лизина SEQ ID NO: 10; и легкую цепь, включающую аминокислотную последовательность, показанную в SEQ ID NO: 11;
20 мМ гистидинового буфера;
84 мг/мл трегалозы;
0,2 мг/мл PS80; и
0,045 или 0,05 мг/мл EDTA,
где указанная фармацевтическая композиция имеет pH 5,0 +/- 0,1 и имеет вязкость от 10 до 18 сП при 20°C.
22. Фармацевтическая композиция по п. 21, где 0,045 мг/мл EDTA рассчитывается на основе молекулярной массы дигидрата Na2EDTA, и 0,050 мг/мл EDTA рассчитывается на основе молекулярной массы Na2EDTA, и каждый соответствует 0,13 нМ EDTA.
23. Фармацевтическая композиция по п. 21 или 22, где EDTA включает динатрий EDTA, динатрий EDTA дигидрат или комбинацию динатрий EDTA и динатрий EDTA дигидрата.
24. Фармацевтическая композиция по любому из пп. 21-23, где трегалоза представляет собой дигидрат трегалозы.
25. Фармацевтическая композиция по любому из пп. 21-24, где фармацевтическая композиция не включает антиоксидант.
26. Фармацевтическая композиция по п. 25, где антиоксидант представляет собой L-метионин или его фармацевтически приемлемую соль.
27. Фармацевтическая композиция по любому из пп. 21-24, где фармацевтическая композиция не включает метионин.
28. Фармацевтическая композиция по любому из пп. 21-27, где фармацевтическая композиция не включает аргинин.
| US 20160159905 A1, 09.06.2016 | |||
| КОМПОЗИЦИЯ АНТИТЕЛ ПРОТИВ CTLA-4 | 2006 |
|
RU2356579C1 |
| WO 2015048520 A1, 02.04.2015 | |||
| СТАБИЛЬНАЯ КОМПОЗИЦИЯ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕГОСЯ С HER2 РЕЦЕПТОРАМИ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2589691C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО (Н14.18) НА ОСНОВАНИИ АНТИТЕЛА 14.18 МЫШИ, СВЯЗЫВАЮЩЕЕСЯ С GD2, И ЕГО СЛИЯНИЕ С IL-2 | 2003 |
|
RU2366664C2 |
| Харкевич Д.А | |||
| Фармакология: Учебник, 2010, 10-е издание, стр.73. | |||
Авторы
Даты
2022-05-25—Публикация
2019-03-04—Подача