Изобретение относится к медицине, а именно к онкологии, и может быть использовано для прогнозирования отрицательного/положительного ответа (исхода) у пациенток III и IV стадийспорадического рака яичников после первой линии комбинированной химиотерапии (препараты платины-паклитаксел)с первичной или интервальной циторедукцией.
Среди онкологических заболеваний органов женской репродуктивной системы распространенный рак яичников (далее - РЯ) является первой по значимости причиной смертности, удельный вес составляет 5,5% [Каприн А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена -филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2020. 252 с].РЯ в 75% случаев диагностируется на III-IV стадиях, поэтому прогноз крайне неблагоприятен, и в странах Европейского Союза пятилетняя выживаемость составляет 30% [Рак яичников. http://www.oncology.ru/specialist/epidemiology/malignant/C56/].
Стандартной схемой первой линии химиотерапии больных с распространенным раком яичников III и IV стадий, проводимой в комбинации с циторедуктивной операцией, является внутривенное введение таксанов (паклитаксел, доцетаксел) с платиносодержащими препаратами (цисплатин, карбоплатин), которые являются важными и эффективными противоопухолевыми цитостатиками для начальной терапии злокачественных опухолей яичников[Рак яичников/ рак маточной трубы/ первичный рак брюшины. Клинические рекомендации Минздрава РФ. МКБ 10: С48/ C56/ С57. 2019]. В зависимости от состояния пациенток проводят первичную операцию по удалению опухоли с последующей химиотерапией, или интервальную (после 2-3 циклов индукционной химиотерапии) в случае пациенток с тяжелым соматическим статусом или крайней выраженностью распространенности опухолевого процесса.После операции таким пациенткам проводится дополнительно 3-4 курса ХТ[Клинические рекомендации. «Рак яичников/ рак маточной трубы/ первичный рак брюшины» 2020. Ассоциация онкологов России. С48.0, С48.1, С48.2, С56, С57; Тюляндина А.С., Румянцев А.А., Морхов К.Ю., Нечушкина В.М., Тюляндин С.А. Ретроспективный анализ отдаленных результатов применения первичной циторедукции и предоперационной химиотерапии на первом этапе лечения больных IIIC-IV стадий рака яичника // Злокачественные опухоли 2018; 3:86-94].
После проведения первой линии ХТ (6 циклов) проводится оценка объективного эффекта по критериям оценки ответа солидных опухолей (ResponseEvaluationCriteriaInSolidTumors -RECIST1.1) [EisenhauerEA, TherasseP, BogaertsJ, SchwartzLH, SargentD, FordR, DanceyJ, ArbuckS, GwytherS, MooneyM, RubinsteinL, ShankarL, DoddL, KaplanR, LacombeD, VerweijJ.Newresponseevaluationcriteriainsolidtumours: revisedRECISTguideline (version 1.1). Eur J Cancer. 2009в].
Эпителиальный рак яичников (РЯ) характеризуется высокой чувствительностью к химиотерапии (XT). В большинстве случаев опухоль является чувствительной к производным платины и, рецидив наступает спустя год или более после первой линии ХТ [Oronsky, B., Ray, C.M., Spira, A.I. etal. A brief review of the management of platinum-resistant-platinum-refractory ovarian cancer. Med Oncol 34, 103 (2017). https://doi.org/10.1007/s12032-017-0960-z].В 75-85% случаев наблюдается полный или частичный ответ на терапию первой линии [Ulm M, Ramesh AV, McNamara KM, Ponnusamy S, Sasano H, Narayanan R. Therapeutic advances in hormone-dependent cancers: focus on prostate, breast and ovarian cancers. EndocrConnect. 2019 Feb 1;8(2):R10-R26. doi: 10.1530/EC-18-0425].Но у многих пациенток возникает резистентность во время лечения или вскоре после первой линии комбинированной химиотерапии. Зачастую применение противоопухолевых препаратов сопряжено с тяжелыми побочными эффектами. Идентификация молекулярных маркеров химиочувствительности и химиорезистентности существенно повысит эффективность противоопухолевой терапии, а разработка маркеров химиочувствительности новообразований поможет снизить затраты на терапию за счет более обоснованного использования дорогостоящих лекарств [Е.Н. Имянитов, В.М. Моисеенко. Применение молекулярно-генетического анализа для выбора противоопухолевой терапии. Вопросы онкологии.2008. Т.54. №2. Стр. 121-132].
Хотя по всему миру ведутся исследования по идентификации факторов устойчивости злокачественных опухолей яичников ктаксанам, платиносодержащей терапии или их комбинации, в настоящее время не известны молекулярные механизмы, лежащие в основе различий ответа опухоли первичных пациентов с распространенным раком яичников на лечение первой линии терапии и нет соответствующих биологических маркеров.
Предшествующий уровень техники настоящего изобретения
Для 25-15% пациенток терапия первой линии заведомо неэффективна, что ухудшает дальнейшее лечение и качество жизни.
Известен способ для прогноза эффективности лечения РЯ (паклитаксел, циклофосфамид, бевацизумаб, циторедукция), основанный на определении в биологических жидкостях (кровь, моча, слюна, опухолевые выпоты) помимо СА 125 и НЕ 4 уровня экспрессии полипептида ММР9 (GenBankAccessionNumber: NP_004985-2), связывающегося с микрочастицами, содержащими аннексин 5. Повышенные значения служат маркерами рецидива (WO2018143896 (A1) - 2018-08-09).
Существенным ограничением способа является невозможность предсказать ответ на первую линию терапии до лечения и неизвестна его эффективность в отношении платиновых препаратов.
Известен способ прогнозирования эффективности лечения рака яичников препаратами платины (цисплатин, карбоплатин, оксалиплатин, сатраплатин) на основе определения в опухолевых клетках аномальной экспрессии ряда генов(US 2006/0019268 A1 от 26.01.2006). Повышенный уровень экспрессии АРОЕ является маркером резистентности опухоли к препаратам платины. Эксперименты выполнялись на клеточных моделях (6 пар чувствительных и резистентных к цисплатину штаммов культур клеток карциномы яичников человека).
Однако, существенным недостатком является то, что оценка экспрессии генов проводилась на модельных системах и не известно, сохраняются ли выявленные закономерности invivo у пациенток в условиях проведения первой линии комбинированной ХТ. Нет данных об изоформах АРОЕ в исследованных культурах клеток.
Известен способ диагностики и прогноза ответа РЯ в ходе комбинированной адьювантной и неоадьювантной химиотерапии, основанный на определении числа копий и экспрессии генов в локусе MECOM: EVI1 (ectopicviralintegrationsite 1) и MDS1 (Myelodysplasiasyndrome- 1) в опухолевой ткани (US2015/0024956A1 от 22.01.2015).Белковый продукт гена является фактором транскрипции, вовлеченным во множество сигнальных путей как для коэкспрессии, так и для коактивации генов клеточного цикла. Пациенты были стратифицированы по типу ответа на первую линию терапии на два класса: 288 человек с полным ответом,121 пациентка с неполным ответом, включающим частичный ответ, стабилизацию и прогрессию опухоли. На основании экспрессии генов EVI1 и MDS1 в опухолевой ткани и амплификации локуса MECOM, ассоциированного с резистентностью к химиотерапии эпителиального рака яичников, предсказывается ответ на лечение первой линии. Дается заключение, что в случае выявления амплификации MECOM локуса терапия должна быть более интенсивной. Авторы использовали информацию об экспрессии и амплификации генов опухоли эпителиального рака яичников 524 пациенток из базы данных CancerGenomeAtlas (TCGA) из NationalInstituteHealth (NIH).
Существенным ограничением данного изобретения является то, что выборка представляла собой смешанную группу, включающую больных с ранними (13%) и поздними стадиями (87%) заболевания. Имеются существенные недостатки, связанные с материалом исследования, это: 1- инвазивность при взятии образца ткани; 2 - в опухоли часто присутствуют клетки разных клонов, которые отличаются между собой по профилю экспрессии и метилирования генов; 3-показатели экспрессии генов зависят от качества выделенной РНК и доли злокачественных клеток в образце; 4- невозможно предсказать ответ на лечение до операции, т.е. в случае неоадьювантной терапии пациент сразу получает препараты по стандартной схеме.
Большое число исследований показало, что индивидуальная реакция на лечение зависит от вариаций в последовательности молекул ДНК.
В декабре 2014 года Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) был одобрен тест BRACAnalysisCDx™ , разработанный компанией MyriadGenetics, для назначения препарата Lynparza™M (олапариб, PARP -ингибитор) пациенткам с диагнозом РЯ дополнительно к стандартной терапии. Он основан на определении мутаций в генах BRCA1 и BRCA2 в геномной ДНК, полученной из образцов цельной крови, собранных в ЭДТА вакутейнеры. Однонуклеотидые мутации, а также небольшие вставки и делеции, идентифицируют с помощью полимеразной цепной реакции (ПЦР) и секвенированием по Сэнгеру. Наличие мутаций является критерием для выявления пациенток, которым назначение PARP -ингибитора увеличит период ремиссии и повысит эффективность лечения (FDA ApprovalOrder, December 19, 2014. http://www.accessdata.fda.gov/cdrh_docs/pdf14/P140020a.pdf).
Специальные разделы персонализованной медицины - фармакогенетика и фармакогеномика изучают наследственные факторы, лежащие в основе вариабельности индивидуальной чувствительности к лекарственным препаратам (M.Whirl-Carrillo, E.M. McDonagh, J. M. Hebert, L. Gong, K. Sangkuhl, C.F. Thorn, R.B. Altmanand T.E. Klein. "PharmacogenomicsKnowledgeforPersonalizedMedicine" ClinicalPharmacology&Therapeutics (2012) 92(4): 414-417).
В 2000 году создана онлайн-база знаний по фармакогеномике (PharmGKB,https://www.pharmgkb.org/), финансируемая Национальным институтом здравоохранения и Национальным институтом общих медицинский наук США. Основная цель - сбор информации о влиянии аллельных вариантов генов на фармакологический ответ пациентов. Она включает результаты как широкомасштабных многоцентровых полногеномных исследований, так и отдельных исследовательских групп.
На основании данных, включенных на настоящий момент в эту базу, наиболее изученными в отношении оценки ответа на лечение (безрецидивный период, общая выживаемость)после проведения первой линии стандартной комбинированной химиотерапии являются гены, вовлеченные в процессы репарации ДНК, метаболизм лекарственных препаратов и, в частности, влияющих на фармакокинетику платиновых соединений, эндотелиальные и эпителиальные факторы роста эндотелия сосудов, их рецепторы.Это варианты rs11615 и rs3212986 генов репарации ERCC1 и rs1799793 (ERCC2),rs6413432 гена CYP2E1(член семейства цитохрома P450 ферментов, метаболизирующих лекарственные средства), rs1142345 гена TPMT (тиопурин-S-метилтрансфераза, ген биотрансформацииксенобиотиков), rs1695 GSTP1 (глютатион-S-трансфераза, фермент детоксикацииксенобиотиков) [TzvetkovMV, BehrensG, O'BrienVP, HohlochK, BrockmöllerJ, BenöhrP.Pharmacogeneticanalysesofcisplatin-inducednephrotoxicityindicatearenoprotectiv eeffectofERCC1 polymorphisms. Pharmacogenomics. 2011 Oct;12(10):1417-27. doi: 10.2217/pgs.11.93; Khrunin A, Ivanova F, Moisseev A, Khokhrin D, Sleptsova Y, Gorbunova V, Limborska S. Pharmacogenomics of cisplatin-based chemotherapy in ovarian cancer patients of different ethnic origins. Pharmacogenomics. 2012 Jan;13(2):171-8. doi: 10.2217/pgs.11.140;Khrunin AV, Moisseev A, Gorbunova V, Limborska S. Genetic polymorphisms and the efficacy and toxicity of cisplatin-based chemotherapy in ovarian cancer patients. Pharmacogenomics J. 2010 Feb;10(1):54-61. doi: 10.1038/tpj.2009.45;Yan L, Shu-Ying Y, Shan K, Yip BH, Rong-Miao Z, Na W, Hai-Yan S. Association between polymorphisms of ERCC1 and survival in epithelial ovarian cancer patients with chemotherapy. Pharmacogenomics. 2012 Mar;13(4):419-27. doi: 10.2217/pgs.11.181; Yan L, Shu-Ying Y, Shan K, Yip BH, Rong-Miao Z, Na W, Hai-Yan S. Association between polymorphisms of ERCC1 and survival in epithelial ovarian cancer patients with chemotherapy. Pharmacogenomics. 2012 Mar;13(4):419-27. doi: 10.2217/pgs.11.181; Lambrechts S, Lambrechts D, Despierre E, Van Nieuwenhuysen E, Smeets D, Debruyne PR, Renard V, Vroman P, Luyten D, Neven P, Amant F, Leunen K, Vergote I; Belgian and Luxembourg Gynaecological Oncology Group (BGOG). Genetic variability in drug transport, metabolism or DNA repair affecting toxicity of chemotherapy in ovarian cancer.BMC PharmacolToxicol. 2015 Feb 27;16:2. doi: 10.1186/s40360-015-0001-5; Liblab S, Vusuratana A, Areepium N. ERCC1, XRCC1, and GSTP1 Polymorphisms and Treatment Outcomes of Advanced Epithelial Ovarian Cancer Patients Treated with Platinum-based Chemotherapy. AsianPacJCancerPrev. 2020 Jul 1;21(7):1925-1929. doi: 10.31557/APJCP.2020.21.7.1925].
Результаты ассоциации генотипа АА rs11615 ERCC1 с плохим ответом на лечение отличаются в исследованиях, проводимых в европейских и азиатских центрах, что может быть обусловлено этническими особенностями обследованных пациенток.
На эффективность терапии первой линии при РЯ выявлено влияние полиморфизмов rs3795247 ZNF100,rs7950311 TRIM5,rs2549714, rs6674079[JohnattySE, TyrerJP, KarS, etal.Genome-wide Analysis Identifies Novel Loci Associated with Ovarian Cancer Outcomes: Findings from the Ovarian Cancer Association Consortium. Clin Cancer Res. 2015 Dec 1;21(23):5264-76. doi: 10.1158/1078-0432.CCR-15-0632], rs9369421 VEGFA[He YJ, Winham SJ, Hoskins JM, Glass S, Paul J, Brown R, Motsinger-Reif A, McLeod HL. Carboplatin/taxane-induced gastrointestinal toxicity: a pharmacogenomics study on the SCOTROC1 trial. Pharmacogenomics J. 2016 Jun;16(3):243-8. doi: 10.1038/tpj.2015.52]; rs1649942 NRG3[Huang RS, Johnatty SE, et al. Platinum sensitivity-related germline polymorphism discovered via a cell-based approach and analysis of its association with outcome in ovarian cancer patients. Clin Cancer Res. 2011 Aug 15;17(16):5490-500. doi: 10.1158/1078-0432.CCR-11-0724], rs2849380 BCL2[McWhinney-Glass S, Winham SJ, Hertz DL, Yen Revollo J, Paul J, He Y, Brown R, Motsinger-Reif AA, McLeod HL; Scottish Gynaecological Clinical Trials Group. Cumulative genetic risk predicts platinum/taxane-induced neurotoxicity. Clin Cancer Res. 2013 Oct 15;19(20):5769-76. doi: 10.1158/1078-0432.CCR-13-0774].
Известен способ прогнозирования эффективности лечения рака яичников цисплатином в комбинации с циклофосфамидом на основе определения полиморфизмов rs1142345 гена ТРМТ (тиопурин-S-метилтрансфераза, ген биотрансформацииксенобиотиков) и/или rs3219484 гена MUTYH (mutY ДНК гликозилаза) (RU 2582968 C2 от 27.04.2016).У носителей этих аллелей значительно снижена функция ферментов, участвующих в метаболизме лекарственных препаратов и репарации оксидативных повреждений ДНК соответственно. Критерием эффективности лечения являлось увеличение времени жизни без прогрессирования и/или снижение риска развития тяжелой нейтропении. У пациенток определяют аллельные варианты полиморфизма rs1142345 гена ТРМТ и/или полиморфизма rs3219484 гена MUTYH и в зависимости от аллельного статуса одного или обоих указанных полиморфизмов прогнозируют эффективность лечения цисплатином. Благоприятный прогноз определяется наличием у пациента двух аллелей дикого типа полиморфизма rs1142345 гена ТРМТ (генотип АА) и/или комбинации из аллелей дикого и мутантного типов полиморфизма rs3219484 гена MUTYH (генотип GA). В исследование были включены русские женщины (104 человека) 23-65 лет с эпителиальным раком яичников, независимо от стадии заболевания и режима химиотерапии.
Ограничением данного способа является неоднородность выборки пациенток, взятых в исследование. У 20% пациенток диагностированы I и II стадии заболевания. Ранние стадии сами по себе являются благоприятным прогнозом. Также лечение проводилось цисплатином с циклофосфамидом. В настоящее время общепринятым является назначение платиновых препаратов с таксанами.
Известно влияние полиморфизма генов репарации ERCC1, XRCC1 и GSTP1 на эффективность терапии первой линии эпителиального рака яичников [LiblabS, VusuratanaA, AreepiumN.ERCC1, XRCC1, andGSTP1 PolymorphismsandTreatmentOutcomesofAdvancedEpithelialOvarianCancerPatientsTreatedwithPlatinum-basedChemotherapy.AsianPacJCancerPrev. 2020 Jul 1;21(7):1925-1929. doi: 10.31557/APJCP.2020.21.7.1925]. Ученые из Таиланда обнаружили, что гомозиготы A/AofERCC1C8092A (rs 3212986) преобладают среди резистентных к препаратам платины пациенток (75%/16,7% Р=0,046), а также обнаружили ассоциацию с анемией для генотипа A/GGSTP1 (rs1695) (81.8% vs 46.3%, p =0.036).
В 2014 г выполнен ассоциативный анализ SNPrs698 гена ADH1C (алкогольдегидрогеназа 1 С) на полный ответ опухоли РЯ после лечения платиносодержащими препаратами [KhruninAV, KhokhrinDV, MoisseevAA, GorbunovaVA, LimborskaSA. Pharmacogenomic assessment of cisplatin-based chemotherapy outcomes in ovarian cancer.Pharmacogenomics. 2014 Feb;15(3):329-37. doi: 10.2217/pgs.13.237. PMID: 24533712]. Ген ADH1C кодирует гамма-субъединицу фермента алкоголь-дегидрогеназы 1 класса, который метаболизирует широкий спектр субстратов, включая этанол, ретинол, гидроксистероиды, продукты перекисного окисления липидов. Однонуклеотидная замена в 8 экзоне гена приводит к замене аминокислоты (Ile350Val) и ослаблению функции фермента. Согласно данным авторов, генотип СТ ассоциирован с пониженной вероятностью полного ответа при лечении больных эпителиальным раком яичников цисплатином и циклофосфамидом по сравнению с генотипами СС+ТТ. Химиотерапию проводили по схеме CP: внутривенное введение цисплатин 100 мг/м2 + циклофосфамид 600 мг/м2 каждые 3 недели, на фоне противорвотных средств (дексаметазон + блокаторы 5-НТ3-рецепторов) и водной нагрузки. Для всех пациенток проведено 6 циклов химиотерапии. В анализ было включено 80 женщин, из которых у 36 наблюдался полный ответ, у 32 - частичный ответ, для 8 - стабилизация и у 4 пациенток наблюдалась прогрессия. В работе оценивалась связь генетического маркера с полным ответом опухоли на лечение.
Существенным ограничением работы является то, что группы сформированы из пациенток с разными стадиями заболевания. Известно, что ранние стадии заболевания являются хорошим прогоностическим фактором для РЯ. Второе ограничение: химиотерапия проводилась по схеме CP: внутривенное введение цисплатин+ циклофосфамид. В настоящее время общепринятой является схема лечения на основе платиновых препаратов и таксанов. Третье ограничение - группа пациенток включала как наследственный, так и спорадический РЯ.
Из известных технических решений наиболее близким по назначению и технической сущности к заявляемому объекту является способ идентификации пациентов с диагнозом серозная аденокарцинома III и IV стадии заболевания с повышенным риском неполного ответа после проведения первой линии адьювантной комбинированной химиотерапии на основе платиносодержащих препаратов, предусматривающий определение наличия в геноме пациента аллельного полиморфизма гена STAT3 (белковый продукт - фактор транскрипции), который ассоциируется с плохим ответом на лечение[Permuth-WeyJ, FulpWJ, ReidBM, ChenZ, GeorgeadesC, ChengJQ, MaglioccoA, ChenDT, Lancaster JM. STAT3 polymorphisms may predict an unfavorable response to first-line platinum-based therapy for women with advanced serous epithelial ovarian cancer. IntJCancer. 2016 Feb 1;138(3):612-9. doi: 10.1002/ijc.29799].Сравнивались две группы в зависимости от ответа на первую линию терапии. Полный ответ (361 женщина) означал исчезновение всех симптомов болезни при осмотре через 4 недели после окончания лечения. Вторая группа с неполным ответом (102 женщины) включала пациенток с частичной регрессией опухоли, стабилизацией и прогрессией заболевания. Для каждого SNP была применена модель логистической регрессии для предсказания вероятности плохого ответа на лечение. Наиболее значимая ассоциация показана для rs 62075772 [OR (95% CI): 2,42 (1,47-3,98), p = 0,0005] гена STAT3(белковый продукт - фактор транскрипции). Носительницы генотипов минорного аллеля G (GA+GG), у которых диагностированы III и IV стадии заболевания, имели меньшую вероятность полного ответа по сравнению с гомозиготными носительницами мажорного аллеля АА (р=0,08). Авторы заключают, что STAT3 генотип идентифицирует пациенток с повышенным риском неполного ответа, для которых предпочтительно применять новую терапевтическую комбинацию со STAT3 ингибитором.
Однако, пациентки, которым проводилась неоадьювантная терапия, были исключены из анализа. Не вычленялись спорадические раки от наследственно обусловленных, полиморфизм АРОЕ не учитывался.
Несмотря на то , что накоплено много знаний о полиморфных вариантах генов, влияющих на эффективность лечения рака яичников (РЯ) платиносодержащими препаратами в комбинации с таксанами, на сегодняшний день до начала лечения невозможно дать точный индивидуальный прогноз результативности первой линии стандартной терапии спорадического РЯ, и в клинической практике нет тестов для выявления предикативных маркеров, основанных на фармакогенетических разработках, позволяющих предсказать, каким будет индивидуальный ответ на стандартную терапию первой линии.
Полученный нами опыт позволяет определять риск отрицательного ответа (стабилизация или прогрессия) или положительного (полный ответ, частичный ответ) на первую линию терапии пациенток с распространенным РЯ на основе определения полиморфных вариантов генов метаболизма методом полимеразной цепной реакции с последующим определением длин фрагментов рестрикции ампликонов (ПЦР/ПДРФ анализ).(Kondrashova TV, Neriishi K, Ban S, Ivanova TI, Krikunova LI, Shentereva NI, Smirnova IA, Zharikova IA, Konova MV, Taira S, Tsyb AF. Frequency ofhemochromatosis gene (HFE) mutations in Russian healthy women and patients withestrogendependent cancers. BiochimBiophysActa. 2006 Jan;1762(1):59-65; Ivanova T.I., Krikunova L.I., Ryabchenko N.I., et al. Association of the apolipoprotein E 2 allele with concurrent occurrence of endometrial hyperplasia and endometrial carcinoma . Oxidative Medicine and Cellular Longevity. - 2015. - Vol. 2015. - P. e 593658; Иванова Т.И., Сыченкова Н.И., Хорохорина В.А., Рябченко Н.И., Иванов С.А., Крикунова Л.И. Ассоциация аллеля Е4 (rs429358) гена аполипопротеина Е (АРОЕ) с серозной аденокарциномой яичников. // Вопросы онкологии. 2017. Т.63. №4. С.627-631; Иванова Т.И., Крикунова Л.И., Рябченко Н.И., Мкртчян Л.С., Хорохорина В.А., Ионцева С.А. Способ определения риска развития рака тела матки. Патент на изобретение № 2558059. 27.07.2015.(Бюл.№21); Т.I. Ivanova, A. L. Potapov, D. V. Zemskova, V. A. Khorokhorina, P. V. Shegai, S. A. Ivanov, and A. D. Kaprin. Evaluation of the association of rs4680 COMT polymorphism and clinical parameters of the tumor in colorectal cancer (a Pilot Study). Bull ExpBiol Med. 2020. V. 170. № 2. P. 254-257; Иванова Т. И., Сыченкова Н.И., Хорохорина В. А., Шинкаркина А.П., Конова М.В., Мурзаева А.В., Крикунова Л.И., Шегай П.В., Иванов С.А. Полиморфизм rs429358 АРОЕ у пациенток с диагнозом рак яичников. База данных №2020621162 от 08.07.2020; Иванова Т. И., Сыченкова Н.И., Хорохорина В. А., Шинкаркина А.П., Мурзаева А.В., Крикунова Л.И., Шегай П.В., Иванов С.А. Полиморфизм rs7412 APOE у пациенток с диагнозом рак яичников. База данных № 2020621180 от 10.07.2020].
В соответствии с нашими данными обнаружено, что у пациенток с диагнозом распространенный РЯ, у которых отсутствуют часто встречающиеся мутации в генах BRCA1/2, имеющих любой из генотипов, в которых присутствует аллель АРОЕ -ε4(ε4/ε4; ε3/ε4; ε2/ε4), прогнозируют высокую вероятность отрицательного ответа на первую линию комбинированной ХТ. Известно, что аполипопротеин Е (АРОЕ) - липопротеин плазмы с широким спектром действия: регулирует обмен липидов, холестерина, функции макрофагов, влияет на пролиферацию Т-клеток, модулирует воспалительные и оксидативные процессы, участвует в процессах канцерогенеза. Показана экспрессия во многих тканях, в том числе в яичниках и макрофагах, причем уровень экспрессии значительно повышен в клетках злокачественных опухолей [Huang Y, Mahley RW.Apolipoprotein E: structure and function in lipid metabolism, neurobiology, and Alzheimer's diseases. Neurobiol Dis. 2014 Dec;72 Pt A:3-12. doi: 10.1016/j.nbd.2014.08.025; The Human Protein Atlas. https://www.proteinatlas.org/search/APOE]. Показано, что экспрессия АРОЕ ассоциирована с изменениями генов сигнального пути Notch, который играет важную роль как в развитии, так и в ответе на лечение пациенток с распространенным РЯ [US Preventive Services Task Force, Grossman DC, Curry SJ, Owens DK, Barry MJ, Davidson KW, Doubeni CA, Epling JW Jr, Kemper AR, Krist AH, Kurth AE, Landefeld CS, Mangione CM, Phipps MG, Silverstein M, Simon MA, Tseng CW. Screening for Ovarian Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2018 Feb 13;319(6):588-594. doi: 10.1001/jama.2017.21926].
Варианты гена APOE определяются двумя однонуклеотидными полиморфизмами (SNP): rs429358 и rs7412, и известны как аллели ε2, ε3 и ε4, которые определяют 6 генотипов: ε3ε3, ε3ε4, ε2ε3, ε2ε4, ε4ε4 и ε2ε2. Наиболее распространенным вариантом является аллель ε3. Гаплотип ε4 характеризуется совместными позициями аргининов 158 и 112 в аминокислотной последовательности белка АРОЕ, обусловленным однонуклеотидным полиморфизмом (SNP rs429358) в соответствующем кодоне: T (тимин) или C (цитозин). Генотип Т/Т - референтный, Т/С - гетерозигота, С/С - гомозиготный генотип по минорному аллелю.В случае ε3 в 112 аминокислотной последовательности белка - цистеин, обусловленный наличием тимина (Т) (Фиг.1).
Техническим результатом изобретения является оценка прогноза ответа опухоли на комбинированную ХТ для пациенток со спорадическим РЯ III и IV стадий и выбор оптимальной тактики лечения на основе идентификации генетического маркера.
Технический результат достигается тем, что также как и в известном способе у пациенток с эпителиальным РЯ III и IV стадий для предсказывания отрицательного или положительного ответа выделяют геномную ДНК, выявляют генный полиморфизм и
определяют ответ после проведения первой линии комбинированной химиотерапии платиносодержащими препаратами.
Особенностью изобретения является то, что у пациенток со спорадическим РЯ (отрицательный статус BRCA мутаций) до лечения выявляют полиморфные аллели АРОЕ-ε2, АРОЕ-ε3, АРОЕ-ε4, и если генотип содержит:
- аллель АРОЕ-ε4, то прогнозируют отрицательный ответна первую линию комбинированной ХТ;
- аллель АРОЕ-ε3ε3, то прогнозируют положительный ответ на первую линию комбинированной ХТ.
Новизна и изобретательский уровень данного изобретения заключается в том, что в уровне техники отсутствуют сведения о способах определения ответа пациенток на первую линию комбинированной ХТ (платиносодержащие препараты, таксаны, циторедукция) спорадического рака яичников, на основе определения генотипов, несущих аллели ε3, ε4, ε2 гена АРОЕ.
Изобретение иллюстрируется подробным описанием, клиническим примером и иллюстрациями, на которых изображено:
Фиг.1 - аллели ε3, ε4, ε2 гена АРОЕ.
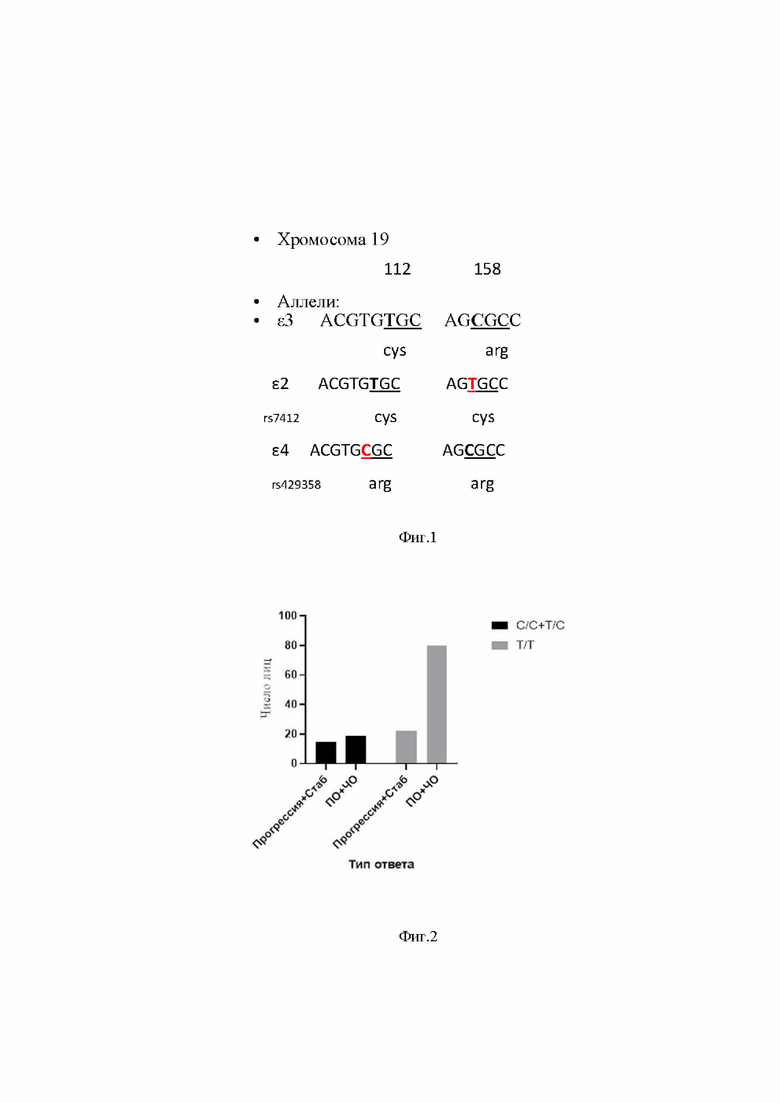
Фиг.2 - распределение генотипов, содержащих аллель ε4 (С/С+Т/С) и без него (Т/Т) среди пациенток, ответивших и не ответивших на первую линию комбинированной ХТ спорадического РЯ.
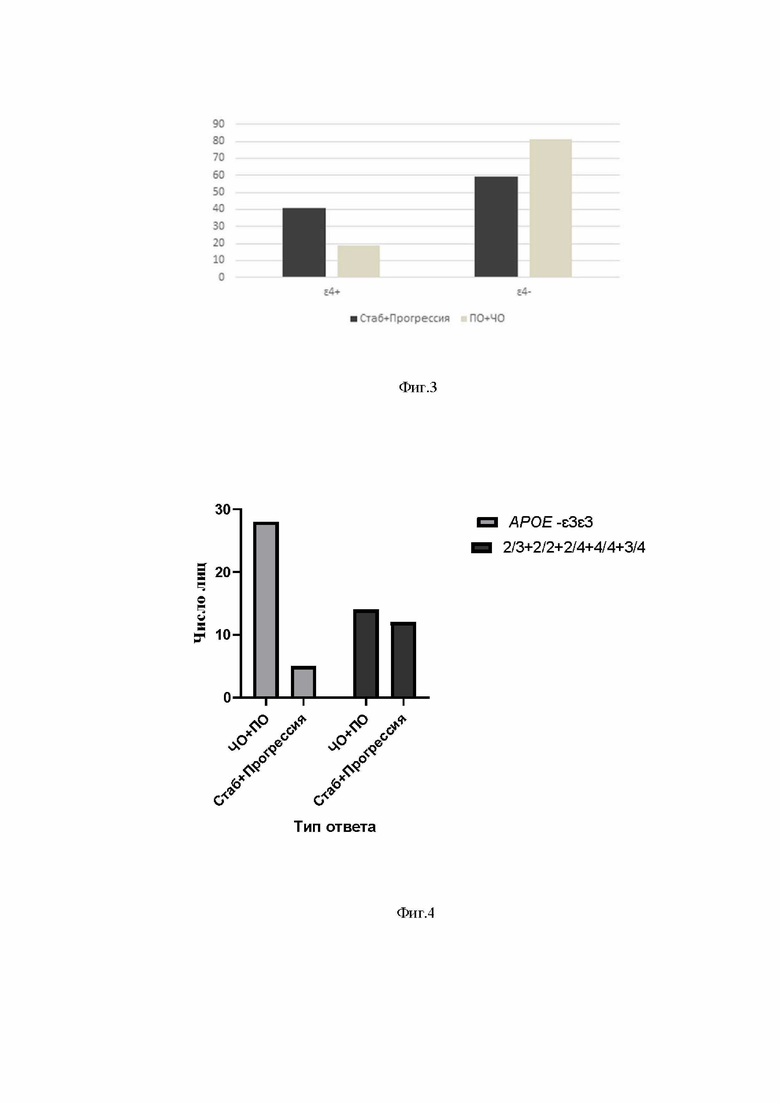
Фиг. 3 - частота лиц с генотипами АРОЕ (ε4+ содержащие аллель и ε4- без аллеля) в группах с отрицательным (Стаб+Прогрессия) и общим ответом (ПО+ЧО).
Фиг. 4 - распределение генотипов АРОЕ-ε3ε3 среди пациенток со спорадическим РЯ по типу ответа опухоли на первую линию комбинированной ХТ в комбинации с субоптимальной и неоптимальной циторедукцией.
Способ осуществляют следующим образом.
У пациенток с распространенным РЯ берут периферическую кровь. Образцы крови забирают в вакутейнеры с этилендиаминуксусной калиевой солью (К2ЭДТА) и хранят при температуре минус 20°С. Геномную ДНК выделяют с помощью набора «WizardGenomic DNA PurificationKit» («Promega») в соответствии с протоколом производителя. Для определения концентрации выделенной ДНК используют спектрофотометр NanoDrop1000.Критерием хорошего качества очистки выделенной ДНК служит величина А260/А280 =1,8 (отношение абсорбции при длинах волн 260 и 280 нм).
Определяют мутации по 8 наиболее распространенным точкам: 5382insC,
4154delA,
300T>G (C61G),
185 del AG,
3819delGTAA,
3875delGTCT,
2080delA гена BRCA1,
6174 delTBRCA2.
Исследование проводят методом аллель-специфичной ПЦР в реальном времени c использованием наборов фирмы “Биолинк”, на амплификаторе ’’StepOnePlus’’ (AppliedBiosystems, CША). Для верификации положительных образцов используют секвенирование по Сэнгеру.
Генотипирование АРОЕ осуществляют с помощью полимеразной цепной реакции (ПЦР) с последующей обработкой специфической рестриктазой (Cfo 1) и определением длин фрагментов рестрикции ПЦР/ПДРФ. В ПЦР реакцию берут 25 мкл реакционной смеси, состоящей из 50 нг ДНК, 0,5 мкмолей каждого праймера (прямой праймер GAGACGCGGGCACGGCTGTCC; обратный праймер GCACGCGGCCCTGTTCCACC, http://genome.cse.ucsc.edu/) , 0,2 ммолей дезоксинуклеотидтрифосфатов, 0,2 Ед на реакцию ХотСтарТагПолимеразы (Qiagen) c однократным буфером и Q-буфером(Qiagen).
Программа амплификации (термоциклерMastercyclerNexus, Eppendorf):
95°C - 15 мин
94°C - 30 с
67°C - 30 с
72°C - 1 мин
со 2 по 4 29 циклов
72°C - 10 мин
Ампликоны APOE (310 пар оснований) рестрицировали Cfo1 (Promega). Замена Т (тимин) на С (цитозин) ведет к образованию сайта рестрикции:
5'…G CG↓C…3'
3'…C↑GC G…5'
Проводят переваривание при 37°C в течение 5 часов в объеме 10 мкл реакционной смеси, содержащей 4 мкл ампликона, 1 мкл х10 буфера В (Promega), 1 мкг БСА, 1 ЕД фермента CfoI. Продукты рестрикции фракционировали посредством электрофореза в 8% полиакриламидном геле.
Аллель АРОЕ -ε4 имеет 5 полос, соответствующие 72, 48, 39, 35 и 32 парам оснований. Аллель АРОЕ-ε2 на электрофореграмме имеет 4 полосы, соответствующие 91, 83, 39 и 32 парам оснований. Аллель АРОЕ-ε3 характеризуется 5 полосами, соответствующими 91, 49, 39, 36 и 32 парам оснований (Фиг. 2). Затем, по сочетанию аллелей определяют генотипы у женщин с распространенным РЯ, по которым судят о степени риска плохого ответа на первую линию комбинированной химиотерапии.
Первую линию комбинированной химиотерапии (6 курсов) проводили с первичной или интервальной циторедукцией по схеме: паклитаксел 175 мг/м2 в/в инфузия, карбоплатин AUC 5-6 в/в в 1-й день 21-дневного курса, или паклитаксел 175 мг/м2 в/в, цисплатин 60 мг/м2 в/в в 1-й день 21-дневного курса.
После проведения первой линии ХТ (6 циклов) провели оценку объективного эффекта по критериям RECIST1.1 (ResponseEvaluationCriteriaInSolidTumors).
Исследование проводят путем сравнения частот генотипов и аллелей между группами с общим ответом на лечение (полный ответ + частичный ответ) и с плохим ответом (стабилизация +прогрессия) у пациенток с подтвержденным отрицательным статусом мутаций по 8 наиболее распространенным в России точкам генов BRCA1 и BRCA 2.
Статистический анализ проводят стандартными методами с помощью пакета программ «WinSTAT 2003.1», интегрированного в Exel,SnpstatsSoft (http://bioinfo.iconcologia.net/snpstats/start.htm) и МedCalc, версия 14.8.1. При сравнении частот генотипов применялся точный двусторонний критерий Фишера. С целью выяснения взаимосвязей между первичным ответом на лечение и аллельным вариантом АРОЕ -ε4 (С) выполнялся анализ логистической регрессии. С помощью ROC (ReceiverOperatorCharacteristic) анализа проводят оценку прогностической значимости параметров, ассоциированных с плохим ответом на лечение. Определяют показатель прогностической эффективности AUC (AreaUnderCurve) - площадь под ROC кривой. Значение 0,5 демонстрирует непригодность потенциального маркера.
Прогностическую значимость аллеля АРОЕ -ε4(С) и генотипа ε3ε3 оценивают также по показателю отношения шансов (OR) -критерий, отражающий степень сопряженности признаков при 95% доверительном интервале (ДИ).
При OR=1 отсутствует связь между генотипом и ответом на лечение. При OR>1, генетический маркер сопряжен с неблагоприятным ответом. При OR<1 маркер сопряжен с положительным ответом на первую линию терапии.
Примеры реализации способа.
Пример 1. Определение предиктивного значения аллеля АРОЕ-ε4 и генотипов, несущих аллель АРОЕ-ε4 (С) в оценке повышенного риска неблагоприятного ответа на первую линию терапии среди пациенток со спорадическим распространенным РЯ.
Повышенный шанс неблагоприятного ответа на лечение РЯ определяют генотипы, несущие аллель АРОЕ-ε4 rs429358, C112Arg: Е4/Е3, или Е4/Е4, или Е2/Е4 гена АРОЕ.
Возможность использования предложенного способа для определения прогноза повышенного риска отрицательного ответа на первую линию комбинированной ХТ с первичной или интервальной циторедукцией среди пациенток с распространенным спорадическим РЯ подтверждает анализ результатов наблюдений 136 пациенток в возрасте от 17 до 72 лет (медиана 56 лет). Для всех пациенток по данным биопсии диагностирован распространенный РЯ III и IV стадии по FIGO (InternationalFederationofGynecology&Obstetrics) классификации, и подтвержден отрицательный статус по 8 распространенным в России мутациям BRCA1/2 генов. Подавляющее большинство составляли эпителиальные раки (98,5%, 134 человек), среди которых – серозная аденокарцинома(93%, 127 человек). Первая линия комбинированной химиотерапии (6-8 курсов) проводилась с первичной или интервальной циторедукцией по схеме: паклитаксел 175 мг/м2 в/в инфузия, карбоплатин AUC 5-6 в/в в 1-й день 21-дневного курса, или паклитаксел 175 мг/м2 в/в, цисплатин 60 мг/м2 в/в в 1-й день 21-дневного курса.
При осмотре через 4 неделипосле проведенного курса ХТ группа, показавшая общий ответ на лечение (полный ответ + частичный ответ), включала99 человек (средний возраст ± стандартное отклонение: 53,4±11,08 лет), с неблагоприятным ответом (стабилизация+прогрессия - 37 человек (средний возраст ± стандартное отклонение:54,8±14,42).Показатели эффективности лечения оценивали по критериям оценки эффекта в солидных опухолях (RECIST:ResponseEvaluationCriteriaInSolidTumors) на основании данных КТ, либо МРТ, либо УЗИ, а также по повышению уровня маркера СА125.
За полный ответ принималось исчезновение всех измеряемых очагов, за неполный ответ - уменьшение на 30% суммы наибольших диаметров измеряемых очагов, за прогрессирование заболевания - увеличение на 20% суммы наибольших диаметров измеряемых очагов. Если изменения не соответствовали ни одному из перечисленных критериев, то определяли стабилизацию заболевания.
По возрасту группы значимо не отличались между собой (Р=0,298; двусторонний критерий Манн-Уитни). Определялись частоты по ε2/ε3/ε4 гаплотипамаполипопротеина Е (АРОЕ). Исследование проводилось путем сравнения частот генотипов и аллелей между группами с общим ответом на лечение (полный ответ + частичный ответ) и с неблагоприятным ответом (стабилизация +прогрессия). При сравнении частот генотипов применялся точный двусторонний критерий Фишера. Распределение генотипов, несущих аллель АРОЕ -ε4 (С)среди пациенток, ответивших и не ответивших на первую линию комбинированной ХТ спорадического РЯ приведено в таблице 1 (Фиг. 2, Фиг. 3). В качестве референтного аллеля используют аллель T.
Распределение генотипов с аллелем АРОЕ -ε4 в группах больных с распространенным спорадическим РЯ, давших общий ответ (полная регрессия опухоли+частичная регрессия) и не ответивших (прогрессия +стабилизация) на первую линию химиотерапии
T/C+C/C
Число генотипов (%)
T/T
Число генотипов (%)
Показатели прогностической эффективности генотипов, несущих аллель АРОЕ -ε4, указаны в таблице 2.
Показатели предиктивной эффективности генотипов, несущих аллель АРОЕ -ε4
Прогрессия
Число генотипов (%)
Частичный ответ
Число гентипов (%)
Распределение аллеля АРОЕ -ε4 среди пациенток, ответивших и не ответивших на первую линию комбинированной ХТ спорадического РЯ приведено в таблице 3, а в таблице 4 указаны показатели предиктовной эффективности аллеля АРОЕ -ε4 (С).
Распределение аллеля АРОЕ -ε4 (С) в группах больных с распространенным спорадическим РЯ, давших общий ответ (полная регрессия опухоли+частичная регрессия) и не ответивших (прогрессия +стабилизация) на первую линию химиотерапии
Таблица 4.
Показатели предиктивной эффективности аллеля АРОЕ -ε4 (С)
Прогрессия
Число аллелей (%)
Частичный ответ
Число аллелей (%)
1.243 - 5.122
0.305-0.618
0.696- 0.804
Выводы.
При распространенном спорадическом РЯ аллель АРОЕ -ε4 (С) rs429358 значимо сопряжен с неблагоприятным ответом на лечение первой линии комбинированной ХТ (Р=0,014), шанс отрицательного ответа увеличен в 2,57 раза (OR=2,57; 95% ДИ [1.243 - 5,122]).
При распространенном спорадическом РЯ генотипы АРОЕ 4/4+3/4+2/4 (T/C+C/C) значимо (Р=0,0126) сопряжены с неблагоприятным ответом на лечение первой линии, шанс плохого ответа увеличен в 3 раза (OR=3,03; 95% ДИ [1.32 - 6.88]).
Пример 2. Определение предиктивного значения генотипов, несущих аллель АРОЕ -ε2 (rs7412, Т) в оценке повышенного риска неблагоприятного ответа на первую линию терапии среди пациенток со спорадическим распространенным РЯ.
Число пациенток с генотипами АРОЕ, несущими аллель ε2, составляло 19 человек (14%). Большинство лиц этот аллель не имели (117 человек). По возрасту группы значимо не отличались между собой (Р=0,66, Крускалл-Уоллес тест).
Распределение генотипов с аллелем АРОЕ -ε2 в группах пациенток с распространенным спорадическим РЯ, давших общий ответ (полная регрессия опухоли+частичная регрессия)и не ответивших (прогрессия +стабилизация) на первую линию химиотерапии показано в таблице 5. Частота пациенток с аллелем ε2 в группах с плохим и положительным ответом одинакова и составляла 14% (5/37 и 14/99) (Таблица 6), различия статистически не значимы (Р>0,999).
Распределение генотипов с аллелем АРОЕ -ε2 в группах больных с распространенным спорадическим РЯ, давших общий ответ (полная регрессия опухоли+частичная регрессия) и не ответивших (прогрессия + стабилизация) на первую линию химиотерапии
С/Т+Т/Т
Число генотипов (%)
С/С
Число генотипов (%)
Показатели ассоциации генотипов, несущих аллель АРОЕ -ε2, с ответом на лечение первой линии комбинированной химиотерапии
Прогрессия
Число генотипов (%)
Частичный ответ
Число гентипов (%)
(95% Доверительный интервал)
(0.35 - 2.83)
Вывод. Генотипы с аллелем АРОЕ ε2 не ассоциированы с ответом опухоли на первую линию комбинированной ХТ и не являются соответствующим маркером.
Пример 3. Результаты применения логистической регрессии для выявления вероятности прогноза первичного ответа по наличию аллеля АРОЕ ε4. Зависимая переменная - первичный ответ на лечение: общий ответ (полная регрессия+частичная регрессия) или отрицательный ответ (стабилизация+прогрессия).
Среди обследованных пациенток РЯ с III и IV стадиями заболевания для 95 человек известен статус циторедукции: среди тех, у кого выявлен плохой первичный ответ неоптимальная операция проведена у 8 человек, субоптимальная - у 9 и оптимальная - у 1 пациентки. В группе с общим ответом неоптимальная операция проведена у 4 женщин, у 34 - оптимальная и у 39 - субоптимальная. Объем произведенной циторедукции является известным прогностическим фактором РЯ. При оценке объема первичной циторедукции оптимальной считается та, у которой оставшиеся максимальные размеры опухоли не превышают 1 см; субоптимальной циторедукции соответствовал размер оставшихся опухолевых масс 1-2 см и в случае превышения 2 см - объем операции считался неоптимальным. Анализ логистической регрессии на модели -2 Log Правдоподобие с предикторами АРОЕ ε4 (1 или 0) и вид циторедукции (0,1,2) выявил статистически значимую повышенную вероятность неблагоприятного ответа у носительниц аллеля АРОЕ ε4. Результаты логистической регрессии представлены в таблице 7. По величине AUC (площадь под ROC кривой, AreaUnderCurve) равным 0,839 тест имеет высокую прогностическую ценность. Показатель AUC только для одного предиктора (вид циторедукции) меньше и равен 0,770. В ROC анализе принято считать, что маркер является хорошим классификатором при AUC больше 7.
Результаты применения логистической регрессии для выявления вероятности прогноза первичного ответа при учете двух предикторов: наличие аллеля АРОЕ ε4 и вид циторедукции
(оптимальная, субоптимальная и неоптимальная)
95% ДИ
0,750-0,907
1,50-16,70
2,73-31,25
Примечание: OR отношение шансов, ДИ доверительный интервал.
Выведено уравнение модели, с помощью которого рассчитывается вероятность неблагоприятного ответа (P), ориентируясь на наличие или отсутствие аллеляАРОЕ ε4 и вид циторедукции:
Р= 
Р= 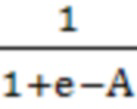
A =logit(p)= константа + коэффициент + коэффициент
+ коэффициент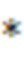 циторедукция
циторедукция
Для носительниц аллеля АРОЕ ε4, которым проведена неоптимальная операция вероятность отрицательного первичного ответа равна 0,85. У лиц, у которых этот аллель отсутствует, вероятность плохого ответа равна 0,53.
При субоптимальной циторедукции вероятность отрицательного первичного ответа для носительниц АРОЕε4 в четыре раза выше по сравнению с теми, у которых нет данного аллеля, и равна 0,39 и 0,11 соответственно. В случае оптимальной операции вероятность плохого ответа у носительниц АРОЕ ε4 равна 0,07и 0,01 у тех лиц, у которых его нет.
Выводы. Аллель АРОЕ ε4 увеличивает прогностическую значимость модели предсказания первичного отрицательного ответа при комбинированной ХТ в сочетании с неоптимальной и субоптимальной циторедукцией. По величине AUC (0,839) тест имеет высокую прогностическую ценность.
Пример 4
Анализ распределения генотипа АРОЕ -ε3ε3 среди больных с распространенным спорадическим РЯ, показавших ответ (полная регрессия опухоли+частичная регрессия) и не ответивших (прогрессия +стабилизация) на первую линию химиотерапии, у которых операция проводилась в субоптимальном или неоптимальном режиме.
Возможность использования предложенного способа для определения прогноза положительного ответа на первую линию комбинированной ХТ с первичной или интервальной циторедукцией среди пациенток с распространенным спорадическим РЯ подтверждает анализ результатов наблюдений 59 пациенток в возрасте от 22 до 72 лет (медиана 56 лет). Был произведен анализ значимости полиморфизма АРОЕ в ответе на лечение первой линии в группе пациенток со спорадическим распространенным РЯ, у которых операция проводилась в субоптимальном или неоптимальном режиме. Доля пациенток, которым циторедукция выполнялась в неоптимальном объеме, составляла 19% (11/59). Исследовалось распределение референтного генотипа АРОЕ -ε3ε3 и остальных пяти генотипов (ε2ε3+ε2ε2+ε3ε4+ε4ε4+ε2ε4) в двух подгруппах пациенток в зависимости от типа ответа опухоли: общий ответ (полный ответ+частичный ответ) и отрицательный ответ (стабилизация+прогрессия). Данные приведены в таблицах 3 и 4. Среди носительниц генотипов АРОЕ -ε3ε3 численность группы с общим ответом превышала более чем в пять раз число лиц с отрицательным ответом. Доли пациенток с генотипом АРОЕ -ε3ε3 составляли 67% (28/42) в группе с общим ответом и 29 % (5/17) в группе с отрицательным ответом (Таблица 8). Различия в распределении генотипов между группами статистически значимы (Р=0,0203). Фиг.4 демонстрирует большее число генотипов АРОЕ -ε3ε3 среди пациенток со спорадическим РЯ, показавших общий ответ опухоли на первую линию комбинированной ХТ в комбинации с субоптимальной и неоптимальной циторедукцией.
Распределение генотипа АРОЕ -ε3ε3 среди больных с распространенным спорадическим РЯ, показавших ответ (полная регрессия опухоли+частичная регрессия) и не ответивших (прогрессия +стабилизация) на первую линию химиотерапии
Число генотипов (%)
Число генотипов (%)
В таблице 9 приведены показатели предиктивной эффективности генотипа АРОЕ -ε3ε3 в отношении благоприятного ответа на лечение ХТ первой линии спорадического РЯ у больных III и IV стадий с субоптимальной и неоптимальной циторедукцией.
Показатели предиктивной эффективности генотипа АРОЕ -ε3ε3
Частичный ответ
Число гентипов (доля среди лиц данной категории)
Прогрессия
Число генотипов (доля среди лиц данной категории)
(0,067-0,718)
(0.691-0.934)
(0.288- 0.645)
Вывод: Благоприятный ответ злокачественной опухоли яичников на первую линию комбинированной ХТ в комбинации с субоптимальной и неоптимальной циторедукцией определяется наличием у пациентки двух аллелей ε3 АРОЕ. Генотип АРОЕ -ε3ε3 имеет шанс положительного ответа на лечение почти в 5 раз выше по сравнению с другими генотипами АРОЕ (95% ДИ: 1.32 - 13.74).
Пример 5
Результаты применения логистической регрессии для выявления вероятности прогноза первичного ответа по наличию генотипов АРОЕ ε3ε3 . Зависимая переменная - первичный ответ на лечение: общий ответ (полная регрессия+частичная регрессия) или отрицательный ответ (стабилизация+прогрессия).
Среди обследованных пациенток с диагнозом РЯ III и IV стадий заболевания для 95 человек известен статус циторедукции. Объем произведенной циторедукции является известным прогностическим фактором РЯ. При оценке объема первичной циторедукции оптимальной считается та, у которой оставшиеся максимальные размеры опухоли не превышают 1 см; субоптимальной циторедукции соответствовал размер оставшихся опухолевых масс 1-2 см и в случае превышения 2 см - объем операции считался неоптимальным. Анализ логистической регрессии на модели -2 Log Правдоподобие с предикторами АРОЕ ε3ε3 (1 или 0) и вид циторедукции (0,1,2) выявил статистически значимую повышенную вероятность положительного ответа у носительниц генотипа АРОЕ ε3ε3. Результаты логистической регрессии представлены в таблице 10. По величине AUC (площадь под ROC кривой, AreaUnderCurve) равным 0,859 тест имеет высокую прогностическую ценность.
Результаты применения логистической регрессии для выявления вероятности прогноза первичного ответа при учете двух предикторов: наличие генотипа АРОЕ ε3ε3 и вид циторедукции ( оптимальная, субоптимальная и неоптимальная)
циенты
95% ДИ
0,773-0,922
0,023-0,437
2,939-45,537
Примечание: OR отношение шансов, ДИ доверительный интервал.
Выведено уравнение модели, с помощью которого рассчитывается вероятность неблагоприятного ответа (P), ориентируясь на наличие или отсутствие генотипа АРОЕ ε3ε3 и вид циторедукции.
Р= 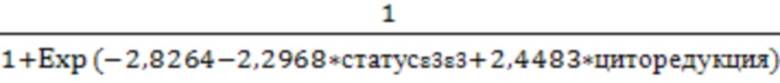
Р= 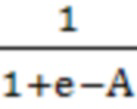
A =logit(p)= константа + коэффициент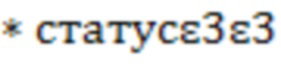 + коэффициент
+ коэффициент циторедукция
циторедукция
Для носительниц генотипа АРОЕ ε3ε3, которым проведена неоптимальная операция вероятность отрицательного первичного ответа равна 0,44. У лиц, у которых этот генотип отсутствует, вероятность неблагоприятного ответа выше в два раза и равна 0,89.
При субоптимальной циторедукции вероятность неблагоприятного первичного ответа для носительниц АРОЕε3ε3 почти в 6 раз ниже по сравнению с теми, у которых нет данного генотипа, и равна 0,07 и 0,40 соответственно. В случае оптимальной операции вероятность отрицательного ответа у носительниц генотипа АРОЕ ε3ε3 менее 0,01, а у тех, у кого он отсутствует, - 0,05.
Выводы. Генотип АРОЕ ε3ε3 понижает вероятность неблагоприятного прогноза первичного ответа злокачественной опухоли яичников после первой линии комбинированной ХТ с циторедукцией и увеличивает прогностическую значимость модели предсказания первичного ответа при комбинироаванной ХТ. По величине AUC (0,859) тест имеет высокую прогностическую ценность.
Подтверждение достижения технического результата
Представленный нами способ по сравнению с прототипом позволяет расширить прогноз отрицательного ответа на первую линию адьювантной и неоадьювантной комбинированной ХТ с циторедукцией у пациенток с распространенным РЯ.
Полученный результат подтвержден наблюдениями 136 женщин со спорадическим распространенным РЯ III и IV стадии по ФИГО классификации, среди которых у 37 человек наблюдался отрицательный ответ (Стабилизация+Прогрессирование) и у 99 обнаружен общий ответ (Частичный+Полный ответ).
Сравнение результатов анализа генетических показателей оценки развития ответа на первую линию терапии по предлагаемому способу и прототипу показывает эффективность аллеля АРОЕ -ε4 в прогнозе отрицательного ответа, а генотипа ε3ε3в прогнозе положительного ответа для пациенток со спорадическим РЯ III и IV стадии, которым проводилась комбинированная неоадьювантная или адьювантная химиотерапия таксанами и платиносодержащими препаратами.
В группе пациенток с отрицательным ответом на лечение уровень значимости превышения частоты аллеля АРОЕ -ε4 по сравнению с группой лиц, показавших общий ответ на ХТ, высокий (Р=0,0162), а шанс плохого ответа у носительниц генотипов с АРОЕ -ε4 повышен почти в 3 раза (OR=2,87; 95% CI 1.27 - 6.40) (Пример 1. Таблицы 1-4, Фиг. 2, 3). Это указывает на значимую ассоциацию аллеля АРОЕ -ε4 с отрицательным ответом на комбинированную ХТ в адьювантном и неоадьювантном режиме и его роль в отсутствии положительного ответа на первую линию комбинированной ХТ. Примеры 1 и 3 доказывают, что предлагаемый способ при лечении спорадического распространенного РЯ прогнозирует развитие неблагоприятного ответа на комбинированную ХТ в адьювантном и неоадьювантном режиме. Среди носительниц генотипов АРОЕ -ε3ε3 численность группы с общим ответом превышала более чем в пять раз число лиц с отрицательным ответом. Различия в распределении генотипов между группами статистически значимы (Р=0,0203), шанс положительного прогноза ответа на лечение в 4,8 раз выше по сравнению с другими генотипами АРОЕ (95% ДИ: 1.32 - 13.74). Примеры 4 и 5 доказывают, что предлагаемый способ при лечении спорадического распространенного РЯ прогнозирует развитие общего ответа на комбинированную ХТ в комбинации с субоптимальной и неоптимальной циторедукцией.
Клинические примеры.
Пример 1
Пациентка А. 55 лет, поступила в гинекологическое отделение МРНЦ им. А.Ф. Цыба - Филиал ФГБУ "НМИЦ Радиологии" Минздрава России с диагнозом: Рак яичников IV aст, с T3cN0M1a Асцит. Карциноматоз брюшины. Гидроторакс слева.
При поступлении обследована: СА 125 - 17353,5 Ед/мл. СКТ: образование левого яичника до 9см в диаметре. КТ- признаки карциноматоза брюшины малого таза, инфильтрация большого сальника. Асцит. Жидкость в левой плевральной полости.
В отделении проведено комбинированное лечение (3 курса ПХТ + хирургическое лечение + 3 курса ПХT). На первом этапе проводилось 3 курса неоадьювантной ПХТ, далее - интервальная циторедуктивная операция (лапаротомия: экстирпация матки с придатками, оментэктомия, тазовая перитонэктомия. Остаточная опухоль > 2cм).
Гистологическое заключение - в левом яичнике инвазивный рост серозной аденокарциномы highgrade с признаками терапевтического патоморфоза I степени по Г.А. Лавниковой. На поверхности маточных труб, тела матки с прорастанием в параметрий и толщу миометрия и на поверхности брюшины рост серозной аденокарциномы. В большом сальнике инвазивный рост серозной аденокарциномы.
После операции проведено 3 курса адьювантной ПХТ. Химиотерапия проводилась по схеме: паклитаксел 175 мг/м2 в 1-й день + цисплатин 60 мг/м2 в 1-й день; цикл 21 день.
У пациентки был выявлен негативный BRCA статус и генотип АРОЕ ε3ε4. Носительство аллеля ε4 указывает на высокий риск неполного ответа. На основании этого женщина включена в группу риска по неполному ответу на первую линию комбинированной ХТ. Оценка объективного ответа подтвердила прогноз.
После завершения лечения СА 125 - 72,5 Ед/мл. По данным СКТ образования на брюшине прежних размеров.
Заключение: стабилизация.
Пример 2
Пациентка Б., 34 года, поступила в гинекологическое отделение МРНЦ им. А.Ф. Цыба - Филиал ФГБУ "НМИЦ Радиологии" Минздрава России с диагнозом: Рак яичников IVb ст. cT3cN0M1b. Метастатическое поражение печени. Асцит.
При обследовании выявлено увеличение опухолевых маркеров СА 125 -1000 Ед\мл. По данным МРТ органов малого таза - выявлены кистозно-солидные образования обоих яичников до 6см, выпот в малом тазу, карциноматоз брюшины малого таза. По данным ПЭТ- метастатическое поражение брюшины с поражением паренхимы левой доли печени до 3 см.
Проведено комбинированное лечение (хирургическое лечение + 6 курсов ПХТ). Циторедуктивная операция произведена в объеме: экстирпация матки с придатками, оментэктомия, тазовая перионэктомия. Остаточная опухоль >2см. В последующем проведено 6 курсов адьювантной ПХТ по схеме: Паклитаксел 175 мг/м2 в 1-й день + цисплатин 60 мг/м2 в 1-й день; цикл 21 день.
Гистологическое заключение: в обоих яичниках инвазивный рост серозной аденокарциномы highgrade; в большом сальнике, брюшине – серозная аденокарцинома highgrade.
У женщины был выявлен негативный BRCA статус и генотип АРОЕ ε3ε3. Наличие гомозиготного генотипа АРОЕ ε3ε3 указывает на высокую вероятность положительного ответа на первую линию комбинированной ХТ. Оценка объективного ответа подтвердила прогноз.
При обследовании через 4 недели: СА 125 - 34,51 Ед/мл. По данным МРТ и СКТ признаков опухолевого поражения органов малого таза нет.
Заключение - полная регрессия.
Пример 3
Пациентка Г, 57 лет, поступила в гинекологическое отделение МРНЦ им. А.Ф. Цыба - Филиал ФГБУ "НМИЦ Радиологии" Минздрава России с диагнозом: Рак яичников IVb ст. cT3N0M1b. Асцит Карциноматоз брюшины. Метастатическое поражение большого сальника и передней брюшной стенки. Метастазы в правом легком. Экссудативный плеврит.
СА 125 - 3210 Ед\мл. СКТ - очаговое поражение нижней доли правого легкого, жидкость в плевральных полостях. МРТ органов малого таза - образования обоих яичников, карциноматоз брюшины, метастатическое поражение большого сальника.
В отделении проведено комбинированное лечение (4 цикла ПХТ+операция+2 цикла ПХТ). Схема ПХТ: паклитаксел 175 мг/м + карбоплатин 6 AUC в 1-й день; цикл 21 день. Хирургическое лечение выполнено в объеме: лапаротомия, циторедуктивная операция экстирпация матки с придатками, оментэктомия. Остаточная опухоль > 2 см.
Гистологическое заключение: в яичниках, большом сальнике инвазивный рост серозной аденокарциномы highgrade.
После 6 курса у пациентки выявлено прогрессирование заболевания на фоне проведения ПХТ. Отмечено увеличение опухолевых маркеров, увеличение асцита, экссудативного плеврита, увеличение метастатических очагов на брюшине.
У женщины был выявлен негативный BRCA статус и генотип АРОЕ ε3ε4.Носительство аллеля ε4 указывает на высокий риск неполного ответа, поэтому пациентка включена в группу риска по неполному ответу на первую линию комбинированной ХТ. Оценка объективного ответа подтвердила прогноз.
Заключение: прогрессирование заболевания.
Таким образом, предикативные показатели аллеля АРОЕ -ε4 (С) rs429358 и генотипа ε3ε3 по предлагаемому способу достаточно высоки и значимы, что доказывает возможность его применения для выявления среди пациенток со спорадическим распространенным РЯ лиц с повышенным шансом отрицательного ответа на комбинированную ХТ в адьювантном и неоадьювантном режиме.
Предлагаемый способ позволяет быстро получить неинвазивным способом значимый критерий для оценки прогноза риска развития отрицательного ответа на комбинированную ХТ в адьювантном и неоадьювантном режиме для пациенток со спорадическим распространенным РЯ, что является полезным дополнением к диагностическому комплексу при скрининге больных в предоперационный период и индивидуализирует подход к лечению пациенток РЯ.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗА ОБЪЕМА ЦИТОРЕДУКТИВНОЙ ОПЕРАЦИИ У БОЛЬНЫХ РАСПРОСТРАНЕННЫМ РАКОМ ЯИЧНИКОВ ПОСЛЕ ЗАВЕРШЕНИЯ ТРЕТЬЕГО КУРСА НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ | 2017 |
|
RU2671409C2 |
| Способ прогнозирования эффективности неоадъювантной химиотерапии у больных с диссеминированными формами рака яичников | 2017 |
|
RU2637410C1 |
| Способ определения эффективности химиотерапии препаратами платины при раке яичников III-IV стадии | 2020 |
|
RU2738167C1 |
| Способ прогнозирования степени вероятности возможности выполнения оптимальной циторедуктивной операции у больных с диссеминированными формами рака яичников | 2017 |
|
RU2637399C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕЦИДИВИРОВАНИЯ СЕРОЗНОЙ КАРЦИНОМЫ ЯИЧНИКОВ | 2020 |
|
RU2749361C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ДЛИТЕЛЬНОСТИ БЕЗРЕЦИДИВНОГО ИНТЕРВАЛА ПОСЛЕ ЗАВЕРШЕНИЯ ПЕРВИЧНОГО ЛЕЧЕНИЯ БОЛЬНЫХ РАКОМ ЯИЧНИКОВ | 2018 |
|
RU2676702C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА РАСПРОСТРАНЕННОГО РАКА ЯИЧНИКОВ ПОСЛЕ АДЪЮВАНТНОЙ ХИМИОТЕРАПИИ ПО СХЕМЕ АР | 2018 |
|
RU2699561C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДЕФИЦИТА ЖЕЛЕЗА У БОЛЬНЫХ РАКОМ ЯИЧНИКОВ | 2023 |
|
RU2800104C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО ЗАБОЛЕВАНИЯ ЦИСПЛАТИНОМ | 2014 |
|
RU2582968C2 |
| Способ лечения перитонеального канцероматоза при раке яичников | 2021 |
|
RU2745478C1 |
Изобретение относится к биотехнологии и медицине. Предложен способ оценки первичного ответа на проводимую комбинированную химиотерапию до лечения, для чего выявляют полиморфные аллели АРОЕ - ɛ2, АРОЕ - ɛ3, АРОЕ - ɛ4. Способ позволяет быстро получить неинвазивным способом значимый критерий для оценки прогноза риска развития отрицательного ответа на комбинированную ХТ для пациенток со спорадическим распространённым раком яичников, что является полезным дополнением к диагностическому комплексу при скрининге больных в предоперационный период и индивидуализирует подход к лечению пациенток с раком яичников. 4 ил., 10 табл., 3 пр.
Способ оценки первичного ответа на проводимую комбинированную химиотерапию спорадического рака яичников III и IV стадий, включающий проведение первой линии комбинированной химиотерапии платиносодержащими препаратами с выделением геномной ДНК и определением генного полиморфизма, отличающийся тем, что до лечения выявляют полиморфные аллели АРОЕ - ɛ2, АРОЕ - ɛ3, АРОЕ - ɛ4, и если генотип содержит:
аллель АРОЕ - ɛ4, то прогнозируют отрицательный ответ на первую линию комбинированной ХТ;
аллель АРОЕ - ɛ3ɛ3, то прогнозируют положительный ответ на первую линию комбинированной ХТ.
| WO 2020176846 A2, 03.09.2020 | |||
| Т.И.ИВАНОВА et al | |||
| Полиморфизм АРОЕ и показатели оксидативного статуса плазмы у больных раком яичников | |||
| Материалы Первого Международного Форума онкологии и радиологии | |||
| Москва, 23-28 сентября 2018, 1171 | |||
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ПРИМЕНЕНИЕМ ЛИПОСОМАЛЬНОГО ИРИНОТЕКАНА И ИНГИБИТОРА PARP ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2760185C2 |
Авторы
Даты
2022-04-01—Публикация
2021-07-21—Подача