Изобретение относится к области медицины, онкологии и может быть использовано для прогнозирования эффективности неоадъювантной химиотерапии у больных с диссеминированными формами рака яичников.
Ввиду крайне агрессивного течения рака яичников (РЯ) III-IV стадия заболевания устанавливается у большинства пациенток. Летальность на первом году с момента установления диагноза составляет 23,7% [1]. По современным представлениям патогенез РЯ представляет собой сложный процесс, поскольку в нем задействовано большинство известных в настоящее время сигнальных путей, и это приводит к затруднению при выборе мишеней для воздействия. В соответствии с данными, представленными в мультицентровом исследовании Verhaak R.V. et al. (2013), серозные низкодифференцированные карциномы составляют до 80% всех эпителиальных злокачественных опухолей яичника [2].
Система прогнозирования при диссеминированном РЯ окончательно не разработана, также до сих пор дискутируется вопрос о последовательности химиотерапии и циторедуктивной операции. Возможность выполнения оптимальной циторедукции в настоящее время рассматривается как наиболее значимый прогностический фактор для больных РЯ. При отсутствии условий для выполнения оптимальной первичной циторедуктивной операции у больных диссеминированным РЯ возможно проведение неоадъювантной химиотерапии (НАХТ), что в последующем связано с возможностью выполнения большего процента оптимальных циторедукций, меньшей кровопотерей, лучшим качеством жизни [3, 4].
Анализ уже предложенных ранее способов оценки эффективности неоадъювантной химиотерапии при РЯ выявил ряд работ, в которых авторы предлагают определять тот или иной показатель в сыворотке крови, однако способов определения эффективности на основании комплекса клинических и молекулярно-генетических параметров не обнаружено,
В другой работе (2015) Де ла Абородригес X. и Санчес-Ровира П. предложили определять уровень экспрессии рецептора ангиотензина II типа 1 в качестве предиктора эффективности комбинированной терапии РЯ с использованием бевацизумаба. Метод предполагает взятие биологического образца (ткани опухоли) до лечения и оценку в нем экспрессии данного белка, а также сравнение ее с контрольным уровнем. Повышенный уровень экспрессии указывает на то, что пациентка должна реагировать на данное лечение [заявка на патент 2013131168/15, дата публикации заявки 20.01.2015]. Метод понятен и прост в исполнении, имеет предиктивную ценность, однако бевацизумаб (моноклональные гуманизированные антитела к VEGF) достаточно редко используется в комбинированных схемах НАХТ у больных РЯ.
В работе Городновой Т.В. (2014) на примере 160 больных с диссеминированными формами РЯ был проведен многокомпонентный сравнительный анализ эффективности НАХТ у больных - носительниц мутаций в гене BRCA1/2 в сравнении с BRCA-негативными пациентками. Наличие мутации BRCA1 538insC, 415delA и 185del AG может использоваться в качестве предикторного маркера, ассоциированного с выраженным патоморфологическим ответом, повышенным процентом выполнения оптимальных циторедукций (до 71%) и повышенным процентом полных клинических ответов при включении в схему лечения платиносодержащей НАХТ [5]. Ограниченность применения этой технологии обусловлена тем, что больные с герминогенными мутациями гена BRCA1 составляют не более 9-12% от всех больных РЯ.
В 2005 году Avril N. с соавторами в качестве предиктора эффективности НАХТ предложили использовать FDG-позитронно-эмиссионную томографию. Метод заключается в том, что пациентке до НАХТ, после первого и третьего цикла НАХТ (больных получали не более трех циклов НАХТ) выполняли количественную FDG-позитронно-эмиссионную томографию органов брюшной полости и малого таза, оценивали метаболический ответ опухоли на терапию. Метаболический ответ после 1 курса НАХТ четко коррелировал с эффективностью НАХТ в целом [6]. К недостаткам метода можно отнести его малую доступность вследствие необходимости применения сложного и дорогостоящего оборудования и необходимость выполнения хотя бы одного цикла НАХТ.
Наиболее близким к предлагаемому является способ, предложенный Сидоренко Ю.С. с соавторами (2010), в котором проводят оценку эффекта неодъювантной химиотерапии по уровню плазминогена и плазмина в опухолевой ткани. Далее по соотношению первого ко второму авторы предлагают оценивать клинический эффект: при повышении этого показателя прогнозировать наступление клинического эффекта от проводимого лечения, а в случае снижения показателя, либо его неизмененности, прогнозировать отсутствие клинического эффекта. Способ позволяет выявить пациенток с эффектом от лечения и хорошим прогнозом и больных без эффекта, с плохим прогнозом, которым необходимо агрессивное адъювантное лечение, позволяет определить индивидуальную чувствительность или резистентность злокачественной опухоли больных к конкретным схемам химиотерапии [патент РФ №238339, опубликован 10.03.2010]. Однако недостатком способа является определение показателей в динамике (на этапах до и после НАХТ), таким образом, обоснование схем химиотерапии определяется не всегда своевременно, а после апробации эмпирически выбранного лечения.
Таким образом, все представленные способы обладают рядом существенных недостатков, их показатели нуждаются в дополнительном подтверждении, валидации высокотехнологичными методами, либо не в полной мере отвечают на поставленные вопросы, вследствие того, что выявленные маркеры не могут быть рассмотрены в качестве предикторов. Предикторы могут быть рекомендованы только для весьма ограниченной группы больных РЯ.
Новый технический результат - повышение точности, информативности и доступности способа.
Для решения поставленной задачи в способе прогнозирования эффективности неоадъювантной химиотерапии у больных с диссеминированными формами рака яичников путем определения предикторного маркера, ассоциированного с выраженным патоморфологическим ответом, причем в качестве предикторных маркеров используют объем асцитической жидкости до лечения, а также уровни белков-компонентов системы ИФР - IGF-I и РАРР-А в опухолевой ткани и в асците до начала лечения, далее рассчитывают значение регрессионной функции F по формуле:
F=-27,4-28,6⋅Х1+13,8⋅Х2+44,9⋅Х3-7,46⋅Х4,
где
X1 - количество асцитической жидкости до лечения (1 - до 1000 мл; 2 - в количестве 1000 мл и более);
Х2 - уровень металлопротеиназы РАРР-А в ткани опухоли в нг/мг белка;
Х3 - уровень IGF-I в асцитической жидкости в нг/мг белка;
Х4 - уровень металлопротеиназы РАРР-А в асцитической жидкости в нг/мг белка, далее определяют значение вероятности наступления клинического ответа Р по формуле:
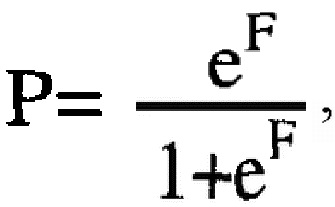
где
е - основание натурального логарифма, равное 2,718,
и при значении Р≥0,5 констатируют эффективную НАХТ, а при значении Р<0,5 его отсутствие.
Данные существенные признаки не выявлены в научно-медицинской литературе. Способ апробирован на базе клиники НИИ онкологии Томского НИМЦ РАН. Данное техническое решение соответствует критериям «новизна», «изобретательский уровень», «промышленно применимо».
Способ осуществляют следующим образом. Количество асцита определяют клинически по данным ультразвукового исследования, лапароцентеза. Для получения бесклеточной фракции аликвоту (около 10 мл) асцитической жидкости центрифугируют при 4°С и 3000 об/мин в течение 10 минут. Жидкую фракцию отбирают, замораживают и хранят при -20°С до выполнения исследований. Для получения осветленных гомогенатов ткань опухоли (около 100 мг) гомогенизируют в жидком азоте, затем ресуспендируют в 300 мкл 50 мМ трис-НСl-буфера (рН 7.5). Гомогенат центрифугируют в течение 60 мин при 10000 g и 4°С. В образцах осветленных гомогенатов опухолей и бесклеточной части асцитической жидкости определяют тотальный пул IGF-I и РАРР-А с использованием наборов для иммуноферментного анализа. Содержание белка в осветленном гомогенате и асцитической жидкости определяют по методу Лоури. Результаты выражают в нг/мг белка.
Такой подход к прогнозированию эффективности НАХТ у больных с диссеминированным РЯ обусловлен рядом предпосылок.
На клеточных линиях показано, что химиорезистентность при РЯ может быть ассоциирована с экспрессией белков системы инсулиноподобных факторов роста (ИФР) или компонентами ИФР-опосредованного сигнального пути. Гиперэкспрессия рецептора ИФР первого типа и фосфатидилинозитол-3-киназы ассоциирована с платинорезистеностью клеточных линий РЯ [7]. Показано, что клеточная линия РЯ, резистентная к таксанам, имела высокий уровень ИФР-II, а снижение уровня ИФР-II восстанавливало чувствительность клеток к таксанам [8]. В связи с доступностью асцита для исследования и высоким уровнем экспрессии отдельных маркеров в ней представляется перспективным исследование белков экссудата с диагностической и прогностической целью. Ранее было показано, что высокий уровень IGFBP-3 до химиотерапии и высокий уровень ИФР-II после химиотерапии в асците у больных раком яичников коррелировал с низкой общей выживаемостью [9]. Белок, ассоциированный с беременностью - (pregnancy-associated plasma protein - РАРР-А), является металлопротеиназой и принимает активное участие в гидролизе белков системы IGFs. В работе Bold (2011) показано, что в клеточной линии овариального рака с генетически детерминированной повышенной экспрессией РАРР-А наблюдалась усиленная клеточная пролиферация, повышенная васкуляризация и клеточная инвазия в Матригель по сравнению с аналогичной клеточной линией с низкой экспрессией РАРР-А [10]. Ранее была выявлена более высокая экспрессия РАРР-А в перитонеальных метастазах рака яичника по сравнению с первичной опухолью [11]. По-видимому, опухолевые клетки РЯ с повышенной экспрессией РАРР-А обладают не только повышенной способностью к метастазированию по сравнению с клетками рака с низкой экспрессией РАРР-А, но и устойчивостью к традиционным химиопрепаратам. Таким образом, хотя белки системы ИФР ранее не изучались в качестве предикторов НАХТ, существуют объективные предпосылки для их исследования при раке яичников.
В настоящее время получены данные о различном молекулярном профиле низкодифференцированных серозных аденокарцином с малым (до 200 мл) и большим (свыше 1000 мл) объемом асцита. Эти различия в основном касались экспрессии генов и соответствующих протеинов, ассоциированных с регуляцией иммунного ответа. Для пациенток с серозными низкодифференцированными аденокарциномами яичников (наиболее часто встречающийся тип РЯ) количество асцита на момент выполнения первичного хирургического вмешательства ассоциировали с частотой выполнения оптимальных циторедукций и общей выживаемостью [12]. По-видимому, количество асцита связано и с химиорезистентностью.
Информативность отобранных критериев обусловлена существованием множественных корреляционных связей между параметрами системы ИФР в опухоли и асците у больных РЯ (Табл. 1). Данные получены на 50 больных с диссеминированными формами РЯ.
*Примечание: в таблице приведены коэффициенты корреляции Спирмена только с уровнем значимости р<0,05. Все корреляционные взаимосвязи получены на основе 50 парных измерений показателя в опухоли и асците.
Объем асцитической жидкости определяли у больной клинически, по данным ультразвукового исследования и лапароцентеза. Опухолевую ткань забирали при выполнении диагностической лапароскопии. Из асцита получали бесклеточную фракцию, аликвотировали и немедленно замораживали. Ткань опухоли замораживали и хранили в жидком азоте. Затем в асците определяли уровень IGF-I и РАРР-А, а в ткани опухоли - уровень РАРР-А. Уровень значимости регрессионной модели (р) составил 0,047. Эффективность НАХТ в данном способе будет оцениваться как наличие объективного клинического ответа по критериям RECIST (больные имели частичный или полный клинический ответ) либо его отсутствие, в случае если у больной прогнозируется стабилизация или прогрессирование. При этом в данном способе использовалась следующая схема химиотерапии: паклитаксел 175 мг/м2+карбоплатин AUC 6 в 1-й день каждые 3 нед., 3 курса. В исследование были включены больные с серозными и эндометриоидными карциномами низкой степени дифференцировки III-IVA стадии по FIGO BRCA-негативные (у всех больных приводилось определение мутации BRCA I 5382ins С, BRCA I 185delAG, BRCA I T300G, BRCA 14153 delA, BRCA 2 6174delT). Оценку качества полученной модели проводили на 12 больных РЯ, не включенных в основную выборку. Чувствительность составила 92%, специфичность - 83%.
Достигнутые показатели чувствительности и специфичности свидетельствуют о высокой информативности заявляемого способа. Выделение группы больных диссеминированным РЯ, характеризующейся высокой вероятностью неэффективности НАХТ, позволяет индивидуализировать тактику лечения больных РЯ, избежать назначения потенциально неэффективных схем химиотерапии. Применение данного способа позволяет снизить риск индуцированной химиорезистентности.
Клинические примеры
Пример 1. Больная Р., 57 лет, обратилась в Томский НИИ онкологии, где по результатам комплексного обследования у нее был диагностирован РЯ, стадия Т3сТ×Мо, канцероматоз брюшины, асцит. Было проведено обследование согласно предлагаемому способу. Для этого проводилась оценка объема асцитической жидкости, в ней определяли уровень инсулиноподобного фактора I типа (IGF-I) и металлопротеиназы РАРР-А. В образце ткани опухоли, полученной при выполнении диагностической лапароскопии, определяли уровень РАРР-А. Объем асцитической жидкости составил 2 литра (категория 2-1000 мл и более). Уровень IGF-I в асцитической жидкости составил 0,41 нг/мг белка, а экспрессия РАРР-А не выявлялась. В осветленном гомогенате опухоли экспрессия РАРР-А также отсутствовала. Значение регрессионной функции составило: F=-66,19. Значение вероятности наступления клинического ответа (Р) составило 0,64, т.е. более 0,5. Данный клинический случай был классифицирован как случай с высокой вероятностью эффекта от НАХТ. Больной назначена НАХТ в объеме 3 курсов по схеме доцетаксел + карбоплатин. После окончания терапии клинический эффект по критериям RECIST расценен как частичная регрессия. В последующем больной была выполнена оптимальная циторедукция. Период динамического наблюдения за больной составил 32 месяца, рецидивов не выявлено.
Пример 2. Больная З., 56 лет, обратилась в Томский НИИ онкологии, где по результатам комплексного обследования у нее был диагностирован рак яичников, стадия T3bN1M0. Канцероматоз брюшины. Асцит. Было проведено обследование согласно предлагаемому способу. Для этого проводилась оценка объема асцитической жидкости, в ней определяли уровень инсулиноподобного фактора I типа (IGF-I) и металлопротеиназы РАРР-А. В образце ткани опухоли, полученной при выполнении диагностической лапароскопии, определяли уровень РАРР-А. Объем асцитической жидкости составил 5 литров (категория 2-1000 мл и более). Уровень IGF-I в асцитической жидкости составил 4,47 нг/мг белка, а экспрессия РАРР-А не выявлялась. В осветленном гомогенате опухоли экспрессия РАРР-А составила 0,22 нг/мг белка. Значение регрессионной функции составило: F=118,4. Значение вероятности наступления клинического ответа (Р) составило менее 0,5. Данный клинический случай был классифицирован как случай с низкой вероятностью эффекта от НАХТ, однако вследствие невозможности выполнения оптимальной циторедукции больной назначена НАХТ. Использование препаратов 1-линии XT в неоадъювантном режиме сопровождалось увеличением размеров опухоли более чем на 25%. Эффект от НАХТ расценен как прогрессирование. В последующем пациентке была выполнена циторедуктивная операция в неоптимальном объеме, с размером остаточных опухолевых масс более 2 см. В адъювантном режиме схема химиотерапии изменена на оксалиплатин + циклофосфан (2 курса), а далее гемцитабин + доцетаксел (6 курсов).
Таким образом, предлагаемый способ позволяет с высокой эффективностью прогнозировать эффективность неоадъювантного лечения у больных с диссеминированными формами РЯ, индивидуализировать тактику лечения больных и оптимизировать назначение химиотерапевтических препаратов в адъювантном режиме. Применение данного способа позволяет снизить риск индуцированной химиорезистентности.
Источники информации:
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2014 году. - М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2015. - 235 с.
2. Verhaak R.G.W., Tamayo P., Yang J-Y. et al. Prognostically relevant gene signatures of high-grade serous ovarian carcinoma // J. Clin. Invest.- 2013. - Vol. 123 (1). - P. 517-525.
3. Morimoto A., Nagao S., Kogiku A., et al. A preoperative low cancer antigen 125 level (<25.8 mg/dL) is useful criterion to determine the optimal timing of interval debulking surgery following neoadjuvant chemotherapy in epithelial ovarian cance // Jpn. J. Clin. Oncol. - 2016. pii:hyw029 (Epub ahead of print).
4. Weinberg L.E., Rodriguez G., Hurteau J.A. The role of neoadjuvant chemotherapy in treating advanced epithelial ovarian cancer// Journal of Surgical Oncology. - 2010. - Vol. 101. - P. 334-343.
5. Городнова Т.В. Оценка эффективности неоадъювантной платиносодержащей химиотерапии у больных распространенным раком яичников носительниц мутаций в гене BRCA1/2: автореф. дис… канд. мед. наук. / Т.В. Городнова. - Спб, 2014. - 23 с.
6. Avril N., Sassen S., Schmalfeldt В., et al. Prediction of response to neoadjuvant chemotherapy by sequential F-18-fluorodeoxyglucose positron emission tomography in patients with advanced-stage ovarian cancer // J. Clin. Oncol. - 2005. - Vol. 23(30). - P. 7445-7453.
7. Eckstein N., Servan K., Hilderbrandt B. et al. Hyperactivation of the insulin-like growth factor receptor I signaling pathway is an essential event for cisplatin resistance of ovarian cancer cells // Cancer Res. - 2009. - Vol. 69(7). - P. 29996-3003.
8. Huang G.S., Brouwer-Visser J., Ramirez M.J. et al. Insulin-like growth factor 2 expression modulates taxol resistance and is a candidate biomarker for reduced disease-free survival in ovarian cancer. // Clin. Cancer Res. - 2010. - Vol. 16 (11). - P. 2999-3010.
9. Slipicevic A., Oy G.F., Askidt I.C. et al. diagnostic and prognostic role of the insulin growth factor pathway members insulin-like growth factor-II and insulin-like growth factor binding protein-3 in serous effusions // Hum. Pathol. - 2009. - Vol. 40(4). - P. 527-537.
10. Bold H.B., Conover C.A. Overexpression of pregnancy-associated plasma protein-A in ovarian cancer. Endocrinology. 2011; 152(4): 1470-1478.
11. Юнусова H.B., Кондакова И.В., Коломиец Л.А., Виллерт А.Б. Система инсулиноподобных факторов роста при метастазировании рака яичников: связь с р45 SER β-катенином // Молекулярная медицина.-2015.-М4.-С.17-22.
12. Feigenberg Т., Clarke В., Virtanen С. Molecular profiling and clinical outcome of high-Grade serous ovarian cancer presenting with low-versus high-volume ascites // ВMR International. - 2014, - Article ID367103.
Приложение
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования степени вероятности возможности выполнения оптимальной циторедуктивной операции у больных с диссеминированными формами рака яичников | 2017 |
|
RU2637399C1 |
| Способ определения эффективности химиотерапии препаратами платины при раке яичников III-IV стадии | 2020 |
|
RU2738167C1 |
| СПОСОБ ПРОГНОЗА ОБЪЕМА ЦИТОРЕДУКТИВНОЙ ОПЕРАЦИИ У БОЛЬНЫХ РАСПРОСТРАНЕННЫМ РАКОМ ЯИЧНИКОВ ПОСЛЕ ЗАВЕРШЕНИЯ ТРЕТЬЕГО КУРСА НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ | 2017 |
|
RU2671409C2 |
| Способ оценки первичного ответа на проводимую комбинированную химиотерапию спорадического рака яичников III и IV стадий | 2021 |
|
RU2769543C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА ЯИЧНИКОВ, ВАРИАНТОВ ЕГО МЕТАСТАЗИРОВАНИЯ И РЕЦИДИВИРОВАНИЯ | 2015 |
|
RU2582939C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С BRCA-АССОЦИИРОВАННЫМ ТРИЖДЫ НЕГАТИВНЫМ МЕСТНОРАСПРОСТРАНЕННЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2023 |
|
RU2814578C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕЦИДИВИРОВАНИЯ СЕРОЗНОЙ КАРЦИНОМЫ ЯИЧНИКОВ | 2020 |
|
RU2749361C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ДЛИТЕЛЬНОСТИ БЕЗРЕЦИДИВНОГО ИНТЕРВАЛА ПОСЛЕ ЗАВЕРШЕНИЯ ПЕРВИЧНОГО ЛЕЧЕНИЯ БОЛЬНЫХ РАКОМ ЯИЧНИКОВ | 2018 |
|
RU2676702C2 |
| Способ прогнозирования пятилетней безметастатической выживаемости у больных раком молочной железы на основе экспрессии генов белков YKL-39 и CCL18 | 2017 |
|
RU2659676C1 |
| Способ прогнозирования риска опухолевой прогрессии у больных раком яичников | 2023 |
|
RU2816339C1 |
Изобретение относится к области медицины, а именно к онкологии, и может быть использовано для прогнозирования эффективности неоадъювантной химиотерапии (НАХТ) у больных диссеминированным раком яичников. Определяют объем асцитической жидкости, уровень инсулиноподобного фактора I типа (IGF-I) и металлопротеиназы РАРР-А в асцитической жидкости до лечения, а также уровень РАРР-А в гомогенате опухоли, рассчитывают значение регрессионой функции F по формуле: F=-27,4-28,6⋅Х1+13,8⋅Х2+44,9⋅Х3 -7,46⋅Х4, где X1 - количество асцитической жидкости до лечения (1 - в количестве до 1000 мл; 2 - в количестве 1000 мл и более); Х2 - уровень металлопротеиназы РАРР-А в ткани опухоли в нг/мг белка; Х3 - уровень IGF-I в асцитической жидкости в нг/мг белка; Х4 - уровень металлопротеиназы РАРР-А в асцитической жидкости в нг/мг белка. Затем рассчитывают вероятность Р наступления клинического ответа на НАХТ по формуле: 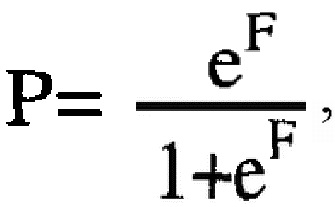 где е - основание натурального логарифма =2,718, и при значении Р≥0,5 констатируют эффект от НАХТ, при значении Р<0,5 - отсутствие эффективности НАХТ. 1 табл., 2 пр.
где е - основание натурального логарифма =2,718, и при значении Р≥0,5 констатируют эффект от НАХТ, при значении Р<0,5 - отсутствие эффективности НАХТ. 1 табл., 2 пр.
Способ прогнозирования эффективности неоадъювантной химиотерапии у больных с диссеминированными формами рака яичников путем определения предикторного маркера, ассоциированного с выраженным патоморфологическим ответом, отличающийся тем, что в качестве предикторных маркеров используют объем асцитической жидкости до лечения, а также уровни белков-компонентов системы ИФР - IGF-I и РАРР-А в опухолевой ткани и в асците до начала лечения, далее рассчитывают значение регрессионной функции F по формуле:
F=-27,4-28,6⋅X1+13,8⋅X2+44,9⋅X3-7,46⋅X4,
где
X1 - количество асцитической жидкости до лечения (1 - до 1000 мл; 2 - в количестве 1000 мл и более);
X2 - уровень металлопротеиназы РАРР-А в ткани опухоли в нг/мг белка;
X3 - уровень IGF-I в асцитической жидкости в нг/мг белка
X4 - уровень металлопротеиназы РАРР-А в асцитической жидкости в нг/мг белка,
далее определяют значение вероятности наступления клинического ответа P по формуле:
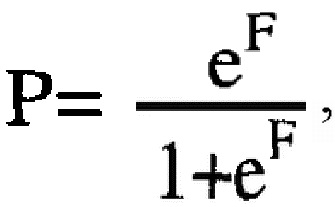
где
е - основание натурального логарифма, равное 2,718,
и при значении P≥0,5 констатируют эффективную НАХТ, а при значении P<0,5 его отсутствие.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ЯИЧНИКОВ | 2008 |
|
RU2383339C1 |
| И.Б | |||
| Панкратова и др | |||
| Ультразвуковая оценка эффективности неоадъювантной химиотерапии рака яичников на первом этапе комбинирваннного лечения | |||
| Радиация и риск, 2010, т.19, N4, стр | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| П.А | |||
| Гервас и др | |||
| Влияние полиморфизма генов апоптоза и репарации на эффективность неоадъювантной химиотерапии злокачественных новообразований | |||
| Сибирский онкологический журнал, 2009, N4 (34), стр | |||
| Механический грохот | 1922 |
|
SU41A1 |
Авторы
Даты
2017-12-04—Публикация
2017-02-02—Подача