Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области медицины и может использоваться для предварительной идентификации генетических маркеров, имеющих прогностическую ценность в определении эффективности применения препаратов платины в противоопухолевой химиотерапии.
Предшествующий уровень техники настоящего изобретения
Цисплатин (цис-диаминдихлорплатина (II)) и его аналоги являются одними из наиболее активных препаратов, применяющихся в лечении злокачественных заболеваний (см., например, Kelland L. The resurgence of platinum-based cancer chemotherapy. Nat. Rev. Cancer. 7 (8), 573-84 (2007); Muggia F. Platinum compounds 30 years after the introduction of cisplatin: implications for the treatment of ovarian cancer. Gynecol Oncol. 112 (1), 275-81 (2009); Hogberg T. Chemotherapy: Current drugs still have potential in advanced ovarian cancer. Nat. Rev. Clin. Oncol. 7 (4), 191-93 (2010)). Однако их использование осложняется развитием у больных различных побочных действий (Rabik СА, Dolan ME. Molecular mechanisms of resistance and toxicity associated with platinating agents. Cancer. Treat. Rev. 33 (1), 9-23 (2007)). Кроме того, имеют место и значительные вариации в чувствительности самих опухолей. Будучи трудно прогнозируемыми, и те, и другие требуют идентификации прогностических маркеров, которые могли бы помочь в выявлении пациентов, у которых лечение препаратами платины будет малоэффективным. Результаты многочисленных исследований свидетельствуют в пользу того, что причиной наблюдаемых различий в реакциях пациентов на лечение могут быть вариации в последовательностях молекул ДНК (см. например, Evans WE, McLeod HL. Pharmacogenomics - drug disposition, drug targets, and side effects. N. Engl. J. Med. 348 (6), 538-48 (2003); Eichelbaum M, Ingelman-Sundberg M, Evans WE. Pharmacogenomics and individualized drug therapy. Annu. Rev. Med. 57, 119-37 (2006); Ma Q, Lu AY. Pharmacogenetics, pharmacogenomics, and individualized medicine. Pharmacol. Rev. 63 (2), 437-59 (2011)).
Ряд полиморфизмов в генах репарации ДНК (ERCC1, 8092 С>А и 19007 T>С; ERCC2, Asp312Asn и Lys751Gln) и глутатион-S-трансфераз (например, GSTP1, Ile105Val) были ассоциированы с эффективностью и токсичностью содержащих платину режимов химиотерапии (см., например, Shimoyama S. Pharmacogenetics of fluoropyrimidine and cisplatin. A future application to gastric cancer treatment. J. Gastroenterol. Hepatol. 24 (6), 970-81 (2009); Marsh S. Pharmacogenomics of taxane/platinum therapy in ovarian cancer. Int. J. Gynecol. Cancer. 19 (Suppl 2), 30-34 (2009)). Однако, хотя эти полиморфизмы уже тестировались во многих исследованиях и до сих пор занимают верхние позиции в списке генов, полиморфизм которых является наиболее часто анализируемым (см., например, Yu W, Gwinn M, Clyne M, Yesupriya A, Khoury M J. A Navigator for Human Genome Epidemiology. Nat. Genet. 40 (2), 124-5 (2008); HuGE Navigator: An integrated, searchable knowledge base of genetic associations and human genome epidemiology (http://hugenavigator.net/HuGENavigator/home.do)), их значимость в качестве маркеров ответа на лечение препаратами платины все еще окончательно не определена. Эта неопределенность, по меньшей мере частично, может быть обусловлена различиями в наборах препаратов, используемых в лечении наряду с соединениями платины. Еще одной причиной может быть участие дополнительных генов. Уместность этого предположения становится очевидной при обращении к результатам исследований метаболизма цисплатина и его аналогов. Не будучи пролекарствами, которые требовали бы специфических реакций активации (Jung Y, Lippard SJ. Direct cellular responses to platinum-induced DNA damage. Chem. Rev. 107 (5), 1387-407 (2007)), препараты платины имеют сложноорганизованный метаболический цикл, каждый из участков которого может влиять на конечный результат. Поэтому для идентификации генетических вариантов, ассоциированных с индивидуальными различиями в реакциях на лечение, необходимо использование комплексных подходов.
Одной из основных тенденций современной химиотерапии является выработка индивидуального подхода к подбору лекарственных препаратов, направленного на повышение эффективности и ограничение токсичности лечения. Практическую реализацию этого подхода связывают с идентификацией и использованием молекулярно-генетических маркеров, на основании анализа которых было бы возможным вычленение из общей массы конкретных групп пациентов. В том числе и тех, для которых рассматриваемая терапия может быть неэффективной или сопровождаться тяжелыми побочными явлениями.
Фармакогенетические исследования в химиотерапии уже дали практические результаты, относящиеся к целому ряду препаратов, при решении о назначении которых врач теперь, в принципе, может исходить и из результатов генетического тестирования полиморфных локусов определенных генов. Имеющиеся данные исследований свидетельствуют о потенциальной значимости полиморфизма отдельных генов для химиотерапии препаратами платины. Однако в большинстве из них до сих пор делается акцент на анализе нескольких полиморфизмов в нескольких генах, а центральное место в этом списке предпочтений у исследователей занимают полиморфизмы генов глутатион-S-трансфераз и белков репарации ДНК (главным образом GSTP1, GSTM1, GSTT1, ERCC1, ERCC2).
Например, из международной патентной публикации WO 01/36686 известен способ определения эффективности терапевтического режима для лечения рака путем выявления однонуклеотидного полиморфизма в гене тимидилат-синтазы.
Наиболее близким аналогом настоящего изобретения является раскрытый в международной патентной публикации WO 2010/014651 способ идентификации пациента с повышенным риском развития токсичности в ответ на ведение цисплатина, предусматривающий определение наличия в геноме пациента аллельного профиля с однонуклеотидным полиморфизмом (SNP), который ассоциируется с пониженной активностью чувствительного к кальцию рецептора, и заключение о том, что указанный пациент характеризуется повышенным риском, если наблюдается указанный профиль SNP. Однако этот способ оценивает токсичность только лишь по отношению к печени, а также не учитывает полиморфизмы rs1142345 гена ТРМТ и rs3219484 гена MUTYH, что не позволяет осуществить объективный прогноз времени жизни без прогрессирования и снижения риска развития тяжелой нейтропении у субъекта.
Несмотря на то что знания о генах, влияющих на эффективность и токсичность препаратов платины, значительно эволюционировали, фармакогенетические маркеры (геномные полиморфизмы), которые могли бы быть введены в клиническую практику, в большинстве своем все еще не обнаружены. Таким образом, остается нерешенной проблема индивидуализации использования препаратов платины в противоопухолевой химиотерапии.
Раскрытие настоящего изобретения
Целью настоящего изобретения является изучение взаимосвязи между геномным полиморфизмом и результатом лечения больных злокачественным заболеванием, получавших химиотерапию на основе цис-диаминдихлорплатины (II) - цисплатина.
Сущность способа в соответствии с настоящим изобретением состоит в том, что у пациентов определяют геномные полиморфизмы rs1142345 гена ТРМТ (тиопурин-S-метилтрансферазы) и rs3219484 гена MUTYH (аденин-ДНК-гликозилазы гетеродуплексов). В том случае, если у пациента rs1142345 гена ТРМТ присутствует в гомозиготном по аллелю дикого типа состоянии (генотип АА), то интервал времени жизни до прогрессирования у него длиннее, чем у обладателей гетерозиготного генотипа (генотип AG). Если у пациента выявляют rs3219484 гена MUTYH в гетерозиготном состоянии, т.е. он является обладателем генотипа GA, то для него очень мала вероятность развития тяжелой нейтропении (в сравнении с обладателями гомозиготного по аллелю дикого типа генотипа GG).
Итак, настоящее изобретение относится к способу прогнозирования эффективности лечения злокачественного заболевания у субъекта цисплатином, отличающемуся тем, что у указанного субъекта определяют аллельные варианты полиморфизма rs1142345 гена ТРМТ и/или полиморфизма rs3219484 гена MUTYH и в зависимости от аллельного статуса одного или обоих указанных полиморфизмов прогнозируют эффективность лечения цисплатином, причем благоприятный прогноз определяется наличием у пациента двух аллелей дикого типа полиморфизма rs1142345 гена ТРМТ (генотип АА) и/или комбинации из аллелей дикого и мутантного типов полиморфизма rs3219484 гена MUTYH (генотип GA).
В соответствии с одним из наиболее предпочтительных вариантов осуществления указанного способа эффективность лечения цисплатином проявляется увеличением времени жизни без прогрессирования и/или снижением риска развития тяжелой нейтропении у субъекта.
В соответствии с одним из наиболее предпочтительных вариантов осуществления указанного способа злокачественным заболеванием у субъекта является рак яичников.
Выявление у пациентов геномных полиморфизмов rs3219484 и/или rs1142345 проводят в образцах ДНК, выделенных из крови стандартным методом, основанным на использовании протеиназы К с последующей фенолхлороформной экстракцией (см., например, Milligan BG. Total DNA isolation. In: Molecular genetic analysis of populations Hoelzel AR (Ed.), Oxford University Press, London, UK, 29-60 (1998)). Идентификацию аллельных вариантов полиморфных локусов в образцах ДНК больных осуществляют с использованием ДНК-микрочипов «DNA repair single nucleotide polymorphisms detection test» фирмы Asper Biotech (Эстония), предназначенных для одновременного генотипирования 228 однонуклеотидных замен (SNP) в 106 генах.
Для оценки взаимосвязей между клиническими параметрами и генотипами применяют пермутационный точный тест, двухсторонний точный тест Фишера и тест хи-квадрат. При расчете отношений шансов генотип «дикого» типа используют в качестве эталонного генотипа (для обеспечения расчетов в случае пустых ячеек добавляют 0,5 к каждой из них). Строят кривые выживаемости по методу Каплан-Мейера. Сравнение кривых выживаемости осуществляют с использованием log-rank теста Мантеля-Кокса. Для расчета относительных рисков прогрессирования и смерти, ассоциированных с различными полиморфизмами, выполняют регрессионный анализ Кокса, в том числе с поправкой на вариант химиотерапии (адъювантный, охватывающий пациентов с полностью удаленной опухолью, и неадъювантный - все остальные пациенты). Различия считают статистически значимыми при P<0,00022 (с учетом поправки на число протестированных полиморфных локусов). Статистическую обработку данных проводят с использованием программного обеспечения, например, выбранного из группы без ограничения IBM SPSS Statistics (версия 19, SPSS, Inc., IBM Company, IBM Corporation, Armonk, NY, USA), GraphPad InStat (версия 3.00, GraphPad Software, San Diego, CA, USA) и PowerMarker (версия 3.0) (см., например, Liu K, Muse SV. PowerMarker: an integrated analysis environment for genetic marker analysis. Bioinformatics. 21 (9), 2128-2129 (2005)).
Корреляция между полиморфизмом и выживаемостью
Выраженную взаимосвязь между генотипом и временем жизни без прогрессирования отмечают для полиморфных локусов генов NQO1 (rs1131341 и rs1800566) и ТРМТ (rs1142345). При этом во всех трех случаях интервал времени до прогрессирования длиннее у пациентов с гомозиготным генотипом «дикого» типа, чем у обладателей соответствующего гетерозиготного генотипа или гомозиготного «мутантного» генотипа (см. таблицу 1).
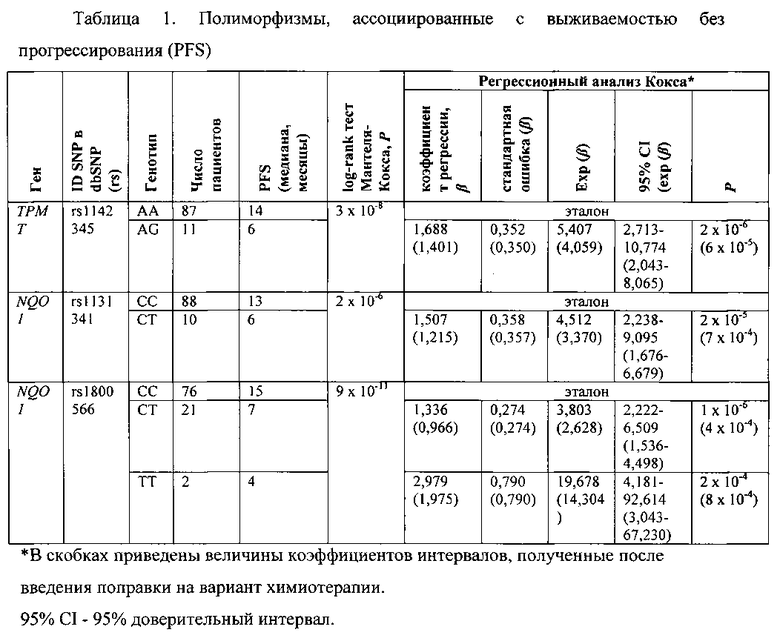
Однако после включения в анализ в качестве ковариаты варианта химиотерапии, строго коррелирующего со временем до прогрессирования, взаимосвязь между NQO1 генотипами и временем жизни больных без прогрессирования утрачивалась. В то же время ассоциация между ТРМТ SNP и временем жизни без прогрессирования оставалась значимой (см. таблицу 1).
SNP в гене NQO1 были ассоциированы и с различиями в общей выживаемости больных. Однако, как и в случае выживаемости без прогрессирования, ассоциации становились незначимыми после введения поправки на вариант химиотерапии.
Корреляция между полиморфизмом и токсичностью
Для исследования взаимосвязи между генотипом и побочными эффектами химиотерапии пациентов объединяют в группы, условно соответствующие хорошей и плохой переносимости. С этих позиций нейтропению 3-4 степени, анемию 2-4 степени, нейропатию 0-1 степени, рвоту 3-4 степени, а также любую степень тромбоцитопении, ототоксичности и нефротоксичности рассматривают как клинически значимые и на основании этого составляют группы плохой переносимости лечения. Статистически значимые различия в токсичности между пациентами, получающими лечение в адъювантном режиме, и остальными пациентами не выявляются.
В результате сравнения распределений генотипов полиморфных локусов в группах пациентов выявляют шесть SNP, ассоциированных с токсичностью химиотерапии: нейтропенией, анемией и нефротоксичностью (статистически значимые ассоциации между полиморфизмами и другими зарегистрированными побочными действиями химиотерапии - ототоксичностью, тромбоцитопенией, рвотой и нейротоксичностью - не обнаруживаются). При этом четыре из них ассоциируются с развитием тяжелой (3-4 степени) нейтропении (см. таблицу 2).
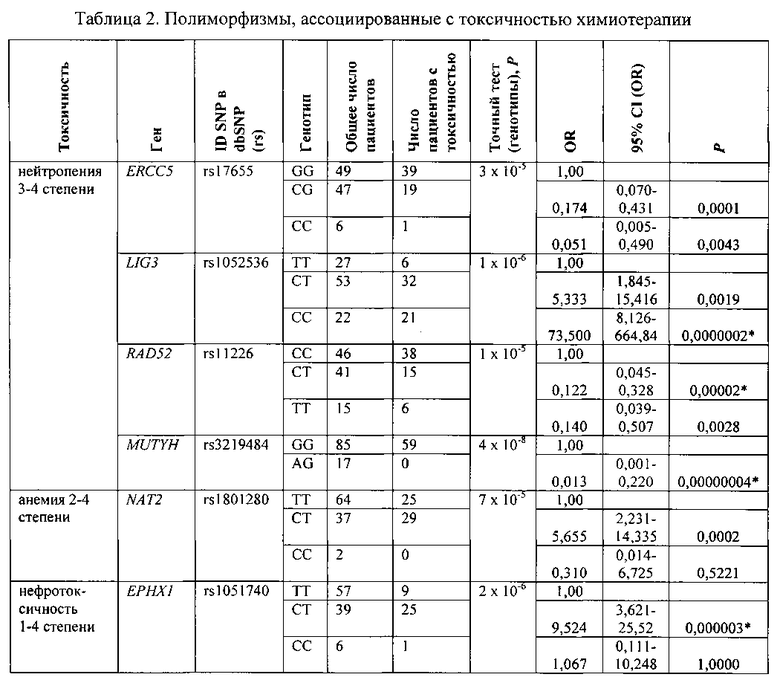

Наиболее мощную ассоциацию демонстрирует SNP rs3219484, локализующийся в гене MUTYH (см. таблицу 2). Он представлен лишь двумя генотипами, и пациенты с гетерозиготным генотипом имеют очень низкий (фактически не зарегистрированный в рамках исследования) риск развития тяжелой нейтропении: отношение шансов [OR]=0,013, 95% доверительный интервал [CI] 0,000-0,220. Анализ сочетаний генотипов не выявляет комбинаций, которые имели бы более высокие (в величинах OR), чем GG генотипы SNP rs3219484, шансы развития тяжелой нейтропении. Последнее может быть следствием довольно высокого уровня неравновесия по сцеплению (D′=0,8-1,0) между SNP rs3219484 и другими SNP. Вместе с тем этот анализ позволяет выявить подгруппу больных, у которых нейтропения 3-4 степени развивалась чаще, чем во всей группе. Эти больные наряду с генотипом «дикого» типа GG по локусу rs3219484 имеют «мутантный» гомозиготный генотип СС по локусу rsl052536 (ген LIG3). У 95% из них (21 из 22 больных) фиксируют тяжелую нейтропению.
Пример осуществления настоящего изобретения
Для реализации способа в соответствии с настоящим изобретением проводили исследование, в которое включали русских женщин 23-65 лет с эпителиальным раком яичников, независимо от стадии, ранее не получавших химиотерапию или лучевую терапию и не имеющих тяжелых сопутствующих заболеваний (например, неконтролируемую артериальную гипертонию, сахарный диабет, инфаркт миокарда или инсульт давностью менее 6 месяцев, психические расстройства, другие опухоли и т.д.). Перед началом химиотерапии больные подписывали информированное согласие и сдавали кровь для генетического анализа. Оценку этнической принадлежности больных осуществляли по результатам анкетирования, при котором учитывали этническую принадлежность предков двух последних поколений. Химиотерапию проводили по схеме CP: цисплатин 100 мг/м2 + циклофосфамид 600 мг/м2 каждые 3 недели, на фоне противорвотных средств (дексаметазон + блокаторы 5-НТ3-рецепторов) и водной нагрузки. Для всех пациенток планировали проведение 6 циклов химиотерапии. Лечение прекращали раньше в случае прогрессирования или тяжелых побочных явлений. Во время каждого курса оценивали побочные явления химиотерапии по стандартным критериям Национального института рака, версия 2.0 (регистрировали нефротоксичность, ототоксичность, нейротоксичность, нейтропению, тромбоцитопению, анемию и рвоту). После каждых 2 циклов проводили оценку объективного эффекта химиотерапии (ремиссии опухоли). Пациентки, у которых достигался полный эффект, после завершения химиотерапии переходили на этап динамического наблюдения, включавший контрольные обследования каждые 3 месяца. В случае прогрессирования или развития тяжелых побочных явлений пациенткам назначали химиотерапию 2-й линии (вне рамок исследования).
Всего в исследование включали 104 пациентки с раком яичников. Средний возраст пациенток составлял 52 года (возрастной диапазон от 23 до 65 лет). Большинство из них (72 женщины) имели III стадию заболевания. I, II и IV стадии рака яичников регистрировали у 14, 6 и 10 больных соответственно. Всего проводили 506 циклов химиотерапии, и 60 больных получили все запланированные 6 циклов лечения. Для 21 пациентки (случаи радикальной операции и нормального уровня маркера CA-125) химиотерапию проводили в адъювантном режиме, в том числе для всех 14 женщин с I стадией, 5 из 6 женщин со II стадией и 2 - с III стадией заболевания. Оценку времени до прогрессирования и выживаемости осуществляли у 100 больных: 4 больных выпали из-под наблюдения менее чем через 6 месяцев от начала химиотерапии. На момент анализа прогрессирование регистрировали у 75 больных и 57 из них умерли. Медиана времени до прогрессирования составляла 12 месяцев, медиана общей выживаемости - 55 месяцев. Непосредственная эффективность химиотерапии (частоты ремиссий) могла быть оценена лишь у 80 больных: у 21 женщины из 104 исходно включенных были проведены радикальные хирургические вмешательства, и на момент начала химиотерапии следов остаточного заболевания у них не обнаруживалось; еще три пациентки оказались недоступными для оценки эффекта. Всего регистрировали 36 полных ремиссий, 32 частичных ремиссии, 8 случаев стабилизации и 4 случая прогрессирования.
У 10 из 228 генотипированных SNP отмечали ассоциации с одним или несколькими оцениваемыми клиническими эффектами химиотерапии.
Обсуждение
Таким образом, в соответствии с настоящим изобретением исследовали ассоциации между SNP в более чем 100 генах и исходами лечения у больных злокачественным заболеванием, получавших химиотерапию на основе цисплатина. Подобно другим похожим панелям для генотипирования список тестированных генов охватывает гены-кандидаты, вовлеченные в ключевые, с позиций реализации клеточного ответа на лекарственные воздействия, метаболические и сигнальные пути (см., например, Dai Ζ, Рарр АС, Wang D, Hampel H, Wolfgang S. Genotyping panel for assessing response to cancer chemotherapy. BMC. Med. Genomics. 1, 24 (2008); Deeken J. The Affymetrix DMET platform and pharmacogenetics in drug development. Curr. Opin. Mol. Ther. 11 (3), 260-68 (2009); Sissung TM, English ВС, Venzon D, Figg WD, Deeken JF. Clinical pharmacology and pharmacogenetics in a genomics era: the DMET platform. Pharmacogenomics. 11 (1), 89-103 (2010)), в том числе и многие из генов, задействованных в метаболизме цисплатина (Platinum pathway http://www.pharmgkb.org/pathway/PA150642262). Хотя такие панели, в целом, могут уступать подходам, основанным на полногеномном анализе полиморфизма, они являются полезными для целей фармакогентического тестирования, поскольку знания о полиморфных вариантах даже наиболее исследованных генов остаются довольно фрагментарными (см., например, Dai Ζ, Рарр АС, Wang D, Hampel H, Wolfgang S. Genotyping panel for assessing response to cancer chemotherapy. BMC. Med. Genomics. 1, 24 (2008)). Весьма показательным, в этом отношении, примером могут служить недавно описанные ассоциации между SNP в генах тиопурин-S-метилтрансферазы (ТРМТ) и катехол-O-метилтрансферазы (СОМТ) и ототоксичностью химиотерапии на основе цисплатина у детей, которые были обнаружены с использованием микрочипа, разработанного для анализа генетической вариации в 220 генах-кандидатах, вовлеченных в метаболизм различных лекарственных средств (см. Ross CJ, Katzov-Eckert H, Dubé MP et al. Genetic variants in TPMT and COMT are associated with hearing loss in children receiving cisplatin chemotherapy. Nat. Genet. 41 (12), 1345-49 (2009)).
В настоящем исследовании ассоциаций между полиморфизмом генов ТРМТ и СОМТ и ототоксичностью найдено не было. Это обстоятельство может быть как минимум следствием меньшей частоты встречаемости связанного с цисплатином ухудшения слуха у взрослых по сравнению с детьми (см., например, Li Y, Womer RB, Silber JH. Predicting cisplatin ototoxicity in children: the influence of age and the cumulative dose. Eur. J. Cancer. 40 (16), 2445-51 (2004)). В то же время была выявлена ассоциация между полиморфизмом ТРМТ, в частности SNP rs1142345, и временем жизни без прогрессирования у больных из русской группы. Ген ТРМТ кодирует цитозольный фермент тиопурин-S-метилтрансферазу, физиологическая роль которого до сих пор остается неясной (Fotoohi АК, Coulthard SA, Albertioni F. Thiopurines: factors influencing toxicity and response. Biochem. Pharmacol. 79 (9), 1211-20 (2010)). Известно только, что этот фермент способен катализировать метилирование атомов серы в составе ароматических и гетероциклических соединений, используя S-аденозил-метионин в качестве донора метильных групп. Эта реакция занимает особое место в метаболизме таких известных противоопухолевых препаратов, как 6-меркаптопурин и 6-тиогуанин, так как фактически приводит к дезактивации этих соединений и блокированию образованию токсичных тиогуаниновых нуклеотидов (Fotoohi AK, Coulthard SA, Albertioni F. Thiopurines: factors influencing toxicity and response. Biochem. Pharmacol. 79 (9), 1211-20 (2010)). Было высказано предположение, что подобным же образом ТРМТ может инактивировать и продукты взаимодействия цисплатина с пуринами, влияя тем самым на общее содержание высокотоксичных для клетки поперечных сшивок (см. Ross CJ, Katzov-Eckert H, Dubé MP et al. Genetic variants in TPMT and COMT are associated with hearing loss in children receiving cisplatin chemotherapy. Nat. Genet. 41 (12), 1345-49 (2009)). Это предположение было сформулировано на основе результатов анализа встречаемости нефункциональных ТРМТ аллелей, включающих, в том числе, кодируемый вышеупомянутым SNP rs1142345 (ТРМТ*3С, Tyr240Cys), обнаруженных лишь у индивидуумов с зафиксированным снижением слуха. Исходя из этих данных, следовало бы ожидать, что те участвующие в исследовании в соответствии с настоящим изобретением пациенты, которые имели низкофункциональный по локусу rs1142345 генотип AG, должны были бы характеризоваться лучшими показателями выживаемости без прогрессирования. Однако такой корреляции, являвшейся бы следствием увеличения общего содержания продуктов взаимодействия цисплатина с пуринами, в исследовании в соответствии с настоящим изобретением не наблюдали. Более того, интервал времени жизни без прогрессирования у обладателей генотипа AG был существенно короче того, который был зарегистрирован у больных с функционально полноценным генотипом АА.
В дополнение к полиморфизмам, ассоциированным с результатами лечения, был также выявлен целый ряд локусов, аллельный статус которых коррелировал с побочными действиями химиотерапии. Наиболее значимая ассоциация имела место между SNP rs3219484 в гене MUTYH и риском развития тяжелой нейтропении (p=4×10-8). Этот ген кодирует ДНК-гликозилазу, участвующую в репарации повреждений ДНК, вызванных активными формами кислорода, в частности, в удалении аденина, внедряемого полимеразой напротив окисленного гуанина - 7,8-дигидро-8-оксигуанина. Такое спаривание является промутагенным, так как, будучи не репарированным, в следующем цикле репликации приводит к мутации, замене исходной пары CG на AT (см. Markkanen Ε, Dorn J, Hübscher U. MUTYH DNA glycosylase: the rationale for removing undamaged bases from the DNA. Front. Genet. 4, 18 (2013)). Обнаруженная ассоциация может быть отражением существенной роли окислительного стресса (генерации активных форм кислорода) в индуцируемой цисплатином цитотоксичности. С другой стороны, достаточно высокий уровень неравновесия по сцеплению (D′=0.8-1.0) между SNP rs3219484 и SNP rs11226 в гене RAD52 и rs17655 в гене ERCC5 может указывать и на вклад MUTYH в репарацию повреждений ДНК, наносимых самим цисплатином (ДНК-аддукты) (см. Jansson K, Alao JP, Viktorsson K, Warringer J, Lewensohn R, Sunnerhagen P. A role for Myhl in DNA repair after treatment with strand-breaking and crosslinking chemotherapeutic agents. Environ. Mol. Mutagen. 54 (5), 327-37 (2013)).
Таким образом, способ в соответствии с настоящим изобретением обеспечивает тестирование полиморфизма генов и идентификацию пациентов, назначение режима на основе цисплатина которым может быть малоэффективным или будет сопровождаться развитием тяжелых побочных реакций. Применение способа в соответствии с настоящим изобретением обеспечивает выявление вариаций, которые могут стать основой для индивидуализации использования препаратов платины в противоопухолевой химиотерапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки первичного ответа на проводимую комбинированную химиотерапию спорадического рака яичников III и IV стадий | 2021 |
|
RU2769543C2 |
| СПОСОБ ВЫЯВЛЕНИЯ СУРРОГАТНЫХ МАРКЕРОВ МУТАЦИЙ ГЕНОВ ВАРИАБЕЛЬНЫХ УЧАСТКОВ ТЯЖЕЛЫХ ЦЕПЕЙ ИММУНОГЛОБУЛИНОВ ПРИ ХРОНИЧЕСКОМ ЛИМФОЛЕЙКОЗЕ | 2023 |
|
RU2824086C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ СЕПСИСА ИЛИ ПНЕВМОНИИ У БОЛЬНЫХ ОСТРЫМ МИЕЛОИДНЫМ ЛЕЙКОЗОМ | 2024 |
|
RU2832525C1 |
| УЛУЧШЕННЫЙ СПОСОБ И НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ ТЯЖЕСТИ И ПРОГРЕССИРОВАНИЯ ПЕРИОДОНТАЛЬНОГО ЗАБОЛЕВАНИЯ | 2011 |
|
RU2664431C2 |
| ГЕНЕТИЧЕСКИЕ ПОЛИМОРФИЗМЫ ПРИ ВОЗРАСТНОЙ ДЕГЕНЕРАЦИИ ЖЕЛТОГО ПЯТНА | 2010 |
|
RU2546008C2 |
| ГЕНЕТИЧЕСКИЕ ПОЛИМОРФИЗМЫ ПРИ ВОЗРАСТНОЙ ДЕГЕНЕРАЦИИ ЖЕЛТОГО ПЯТНА | 2010 |
|
RU2577726C2 |
| Способ прогнозирования риска развития COVID-19 у больных гемобластозами | 2022 |
|
RU2783422C1 |
| Способ оценки риска тяжелой формы акне на основе определения экспрессии генов IL1RN и IL10 | 2020 |
|
RU2739890C1 |
| Способ идентификации генетических полиморфизмов, влияющих на метаболизм противоопухолевых препаратов, с использованием биологических микрочипов | 2018 |
|
RU2697096C1 |
| VEGF ПОЛИМОРФИЗМ И АНТИ-АНГИОГЕНЕЗНАЯ ТЕРАПИЯ | 2008 |
|
RU2482491C2 |
Изобретение относится к медицине, в частности к способу прогнозирования эффективности лечения злокачественного заболевания у субъекта цисплатином. Способ состоит в том, что у пациентов определяют аллельные варианты полиморфизмов rs1142345 гена ТРМТ и rs3219484 гена MUTYH и в зависимости от аллельного статуса одного или обоих указанных полиморфизмов прогнозируют эффективность лечения цисплатином, где благоприятный прогноз определяется наличием у пациента двух аллелей дикого типа полиморфизма rs1142345 гена ТРМТ (генотип АА) и/или комбинации из аллелей дикого и мутантного типов полиморфзма rs3219484 гена MUTYH (генотип GA). Осуществление изобретения обеспечит выявление вариаций, которые могут стать основой для индивидуализации использования препаратов платины в противоопухолевой терапии. 2 з.п. ф-лы, 2 табл.
1. Способ прогнозирования эффективности лечения злокачественного заболевания у субъекта цисплатином, отличающийся тем, что у указанного субъекта определяют аллельные варианты полиморфизма rs1142345 гена ТРМТ и/или полиморфизма rs3219484 гена MUTYH и в зависимости от аллельного статуса одного или обоих указанных полиморфизмов прогнозируют эффективность лечения цисплатином, причем благоприятный прогноз определяется наличием у пациента двух аллелей дикого типа полиморфизма rs1142345 гена ТРМТ (генотип АА) и/или комбинации из аллелей дикого и мутантного типов полиморфизма rs3219484 гена MUTYH (генотип GA).
2. Способ по п. 1, отличающийся тем, что эффективность лечения цисплатином проявляется увеличением времени жизни без прогрессирования и/или снижением риска развития тяжелой нейтропении у субъекта.
3. Способ по п. 1 или 2, отличающийся тем, что злокачественным заболеванием у субъекта является рак яичников.
| US 2014147516 А1, 29.05.2014 | |||
| WO2010014651 A1, 04.02.2010 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2016-04-27—Публикация
2014-07-16—Подача