ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к композициям, содержащим даптомицин и по меньшей мере одну аминокислоту, способам получения таких композиций и их применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Липопептиды представляют класс мощных противоинфекционных лекарственных средств, проявляющих высокоэффективное антибактериальное действие против бактерий, обладающих множественной лекарственной устойчивостью, такое как противогрибковое действие. На рынке имеется множество разнообразных липопротеидных лекарственных средств, таких как даптомицин, предназначенных для борьбы с инвазивными и зачастую угрожающими жизни инфекциями.
Даптомицин является первым циклическим липопептидным антибиотиком, одобренным FDA в 2003 г для лечения инфекций, вызванных грамположительными патогенами, включая штаммы, устойчивые к метициллину и ванкомицину. Благодаря уникальному механизму действия, отличающемуся от других антимикробных агентов, существующих на рынке, даптомицин способен обходить механизмы резистентности, выработавшиеся у многих устойчивых штаммов, а принимая во внимание, что случаи устойчивости к даптомицину в клинике описываются редко, данное лекарственное средство приобрело очень важное значение в современной клинической практике.
Даптомицин (Формула I) содержит деканоильную боковую цепь, присоединенную к N-концу пептида из 13 аминокислот, где десять из аминокислот образуют циклическую структуру, а три другие образуют цепь.
Циклическая часть молекулы связана с боковой цепью посредством эфирной связи между С-концевой карбоксильной группой кинуренина и четвертым остатком (треонином).
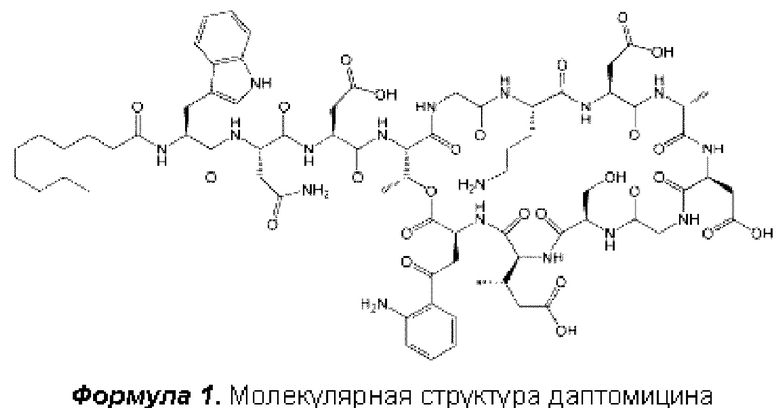
Согласно литературным данным, даптомицин подвержен гидролитической деградации и известно, что он разрушается при транспептидировании аспартила по остатку asp-9 в слабокислых растворах.
Согласно Kirsch et al. Pharmaceutical Research, 1989, Muangsiri et al., International Journal of Pharmaceutics, 2005, и Muangsiri et al., Journal of Pharmaceutical Sciences, 2001, данный путь деградации включает образование сукцинимидного производного (ангидродаптомицина), образующегося в результате атаки карбонильного углерода боковой цепи Asp9 и последующего обратимого образования двух изомеров аспарагиновой кислоты, образующихся в результате гидратации ангидродаптомицина сукцинимида.
Kirsch et al. Pharmaceutical Research, 1989 и Muangsiri et al., Journal of Pharmaceutical Sciences, 2001, на с. 1067 дополнительно указывают, что существуют неизвестные параллельные пути потери даптомицина, которые предположительно включают дезаминирование аспарагинила, гидролиз эфирных связей и/или расщепление пептидной связи.
Пути деградации даптомицина в кислых, нейтральных и щелочньк условиях известны как гидролиз эфирных связей, имеющий место в щелочных условиях, транспептидирование аспартила как преобладающий путь в диапазоне значений рН 3-6 и неизвестный путь деградации, имеющий место при низких значениях рН. Помимо рН-зависимого образования примесей, дополнительным фактором, вызывающим деградацию даптомицина, является температура.
В настоящее время даптомицин имеется в продаже в форме лиофилизированного порошка для внутривенного введения (Cubicin® и Cubicin RF®).
Согласно инструкции по применению Cubicin®, единственным вспомогательным ингредиентом является гидроксид натрия, который применяется для доведения рН. При этом, как указано в инструкции по применению, Cubicin® следует хранить в прохладном месте при температуре от 2°C до 8°C и избегать воздействия повышенных температур.
С другой стороны, согласно инструкции по применению Cubicin RF® поставляют в виде лиофилизированного порошка, содержащего 500 мг даптомицина и 713 мг сахарозы, а также гидроксид натрия, используемый для доведения рН. После растворения рН раствора составляет 6,8. Cubicin RF® следует хранить при температуре от 20°C до 25°C, с допустимыми колебаниями температуры от 15°C до 30°C.
В заявке WO 2011063419 описаны порошковые композиции даптомицина, содержащие даптомицин, сахар, такой как сахароза или глицин.
WO 2014041425 описывает лиофилизированные препараты даптомицина, содержащие вспомогательное вещество, которое может представлять собой фармацевтически приемлемый антиокислитель, фармацевтически приемлемую органическую кислоту или ее фармацевтически приемлемую соль, фармацевтически приемлемое производное глюкозы или ее фармацевтически приемлемую соль или их комбинацию.
WO 2014045296 относится к препаратам, содержащим даптомицин и токоферила фосфата гидролизат.
WO 2013103801 описывает порошковые препараты, содержащие даптомицин и полиэтиленгликоль.
WO 2016098009 относится к лиофилизированным композициям, содержащим даптомицин и консервант.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предложены стабильные фармацевтические композиции, содержащие даптомицин и по меньшей мере одну аминокислоту или ее фармацевтически приемлемую соль или производное.
Согласно данному изобретению, предложены стабильные фармацевтические композиции, содержащие даптомицин и по меньшей мере одну аминокислоту, выбранную из аланина, аргинина, аспарагина, гистидина, изолейцина, лизина, орнитина, фенилаланина, пролина, треонина, триптофана и тирозина или их фармацевтически приемлемой соли или производного.
В одном аспекте изобретения композиции даптомицина содержат две или более аминокислоты, или их фармацевтически приемлемых соли или производных.
В следующем аспекте изобретения композиции даптомицина по данному изобретению содержат две или более аминокислоты, или их фармацевтически приемлемых соли или производных. Согласно еще одному аспекту, по меньшей мере одна аминокислота из двух или более аминокислот выбрана из аланина, аргинина, аспарагина, гистидина, изолейцина, лизина, орнитина, фенилаланина, пролина, треонина, триптофана и тирозина или их фармацевтически приемлемой соли или производного.
В одном аспекте данного изобретения композиция даптомицина содержит по меньшей мере N-ацетил-D-аланин.
В одном аспекте данного изобретения композиции даптомицина содержат по меньшей мере гистидин или его фармацевтически приемлемую соль или производное.
В следующем аспекте данного изобретения фармацевтически приемлемая соль представляет собой гистидина гидрохлорид.
Согласно еще одному аспекту композиции даптомицина по изобретению содержат вторую аминокислоту, выбранную из аланина, аргинина, аспарагина, изолейцина, лизина, орнитина, фенилаланина, пролина, треонина, триптофана и тирозина или их фармацевтически приемлемой соли или производного. В следующем аспекте композиции даптомицина по изобретению содержат вторую аминокислоту, выбранную из аргинина или орнитина. Согласно еще одному аспекту, указанная вторая аминокислота представляет собой аргинин.
В фармацевтических композициях по данному изобретению молярное отношение даптомицина к по меньшей мере одной аминокислоте или ее фармацевтически приемлемой соли или производному составляет от приблизительно 1:0,5 до приблизительно 1:6 или от приблизительно 1:2 до приблизительно 1:5 или от приблизительно 1:3 до приблизительно 1:5.
В одном аспекте изобретения композиции даптомицина содержат три или более аминокислоты, выбранные из гистидина, аргинина и лизина или гистидина, пролина и аланина, или пролина, аланина и аспарагина, или гистидина, фенилаланина и триптофана или их фармацевтически приемлемых солей. В следующем аспекте данного изобретения три или более аминокислоты, или их фармацевтически приемлемые соли выбраны из гистидина гидрохлорида, фенилаланина и триптофана.
В следующем аспекте концентрация даптомицина в композициях по данному изобретению составляет от приблизительно 0,5 мг/мл до приблизительно 500 мг/мл.
Согласно еще одному аспекту концентрация даптомицина в композициях по данному изобретению составляет от приблизительно 20 мг/мл до приблизительно 400 мг/мл.
Согласно еще одному аспекту концентрация даптомицина в композициях по данному изобретению составляет от приблизительно 50 мг/мл до приблизительно 300 мг/мл.
В другом аспекте композиции по данному изобретению дополнительно содержат органическую кислоту. Согласно следующему аспекту органическая кислота выбрана из группы, состоящей из аконитовой кислоты, трикарбоновой кислоты, метансульфоновой кислоты, фумаровой кислоты, глицериновой кислоты, гликолевой кислоты, глюконовой кислоты, малеиновой кислоты, уксусной кислоты, пиколиновой кислоты, муравьиной кислоты, уксусной кислоты, яблочной кислоты, лимонной кислоты, винноуксусной кислоты, янтарной кислоты и молочной кислоты. Согласно следующему аспекту, композиции по данному изобретению содержат органическую кислоту, выбранную из группы, состоящей из муравьиной, уксусной, яблочной, лимонной, винноуксусной, янтарной и молочной кислоты.
Фармацевтические композиции по данному изобретению имеют молярное отношение даптомицина к органической кислоте от приблизительно 0,5:1 до приблизительно 1:6, например, приблизительно 0,5:1, приблизительно 0,5:2, приблизительно 0,5:3, приблизительно 0,5:4, приблизительно 0,5:5, приблизительно 0,5:6, приблизительно 1:1, приблизительно 1:2, приблизительно 1:3, приблизительно 1:4, приблизительно 1:5 или приблизительно 1:6.
Данное изобретение охватывает композиции, описанные выше, дополнительно содержащие кальций. Согласно одному аспекту, кальций в таких композициях выбран из группы, состоящей из хлорида кальция (CaCl2), двухводного хлорида кальция, шестиводного хлорида кальция, цитрата кальция, Ca-α-D-гептаглюконата или ацетата кальция. Согласно еще одному аспекту, композиция даптомицина по данному изобретению содержит двухводный хлорид кальция или шестиводный хлорид кальция.
Фармацевтические композиции по данному изобретению имеют молярное отношение даптомицина к кальцию от приблизительно 1:1 до приблизительно 1:3, например, приблизительно 1:1, приблизительно 1:2 или приблизительно 1:3.
Дополнительно обнаружили, что добавление полиэтиленгликолей (ПЭГ), например, ПЭГ 400 или ПЭГ 600, полипропиленгликоля (PPG), полисорбатов (PS), таких как PS 20 или PS 80, спиртов, таких как этанол или изобутиловый спирт, или их смесей, приблизительно до 3% об./об. препарата существенно снижает время растворения твердых препаратов.
В одном воплощении композиции даптомицина по данному изобретению дополнительно содержат кальций и полиэтиленгликоли (ПЭГ), например, ПЭГ 400 или ПЭГ 600, полипропиленгликоль (PPG), полисорбаты (PS) такие как PS 20 или PS 80.
В одном аспекте композиции даптомицина по данному изобретению дополнительно содержат двухводный хлорид кальция или шестиводный хлорид кальция и полипропиленгликоль (PPG).
В одном аспекте композиции даптомицина по данному изобретению дополнительно содержат двухводный хлорид кальция или шестиводный хлорид кальция и полипропиленгликоль (PPG).
В следующем аспекте предложена композиция даптомицина, содержащая по меньшей мере одну аминокислоту, двухводный хлорид кальция или шестиводный хлорид кальция и полипропиленгликоль (PPG).
В следующем аспекте предложена композиция даптомицина, содержащая две аминокислоты, двухводный хлорид кальция или шестиводный хлорид кальция и полипропиленгликоль (PPG).
В следующем аспекте предложена композиция даптомицина, содержащая L-His или его фармацевтически приемлемую соль, L-аргинин, хлорид кальция и полипропиленгликоль (PPG).
Дополнительно обнаружили, что добавление циклодекстринов, таких как гидроксипропил-β-циклодекстрин или сульфобутиловый эфир β-циклодекстрина, в молярном отношении даптомицина к циклодекстрину от приблизительно 1:0,1 до приблизительно 1:1, например, от 1:0,1 до приблизительно 1:0,5, также улучшает время растворения твердых препаратов.
В одном аспекте предложена композиция даптомицина, содержащая кальций и циклодекстрины, такие как гидроксипропил-β-циклодекстрин или сульфобутиловый эфир β-циклодекстрина. В следующем аспекте изобретения композиция даптомицина содержит две аминокислоты, хлорид кальция и гидроксипропил-β-циклодекстрин или сульфобутиловый эфир β-цикподекстрина. Кроме того, композиции по данному изобретению могут дополнительно содержать один или более чем один фармацевтически приемлемый эксципиент, такой как антиокислители, поверхностно-активные вещества, липиды, сахара, аминосахара, комплексообразующие вещества, консерванты, стабилизаторы, объемообразующие вещества, буферы, разбавители, несущие среды, растворители и связывающие вещества.
В одном аспекте данного изобретения аминосахар представляет собой меглумин.
Фармацевтические композиции по данному изобретению имеют молярное отношение даптомицина к аминосахару, такому как меглумин, от приблизительно 1:1 до приблизительно 1:3, такое как приблизительно 1:1, приблизительно 1:2 или приблизительно 1:3.
Данное изобретение охватывает композиции, описанные выше, которые являются твердыми. Согласно одному аспекту композиции даптомицина по изобретению являются лиофилизированными, высушенными распылением или высушенными в псевдоожиженном слое.
Предложенные в данном описании препараты можно хранить при комнатной температуре (25°C), при температуре ниже комнатной, такой как приблизительно 20°C, приблизительно 15°C, приблизительно 10°C, и в холодном месте, например, при 2-8°C.
Фармацевтические композиции по данному изобретению содержат от приблизительно 200 мг/мл до приблизительно 400 мг/мл даптомицина, где фармацевтическая композиция содержит две аминокислоты, выбранные из аланина, аргинина, аспарагина, гистидина, гистидина гидрохлорида, изолейцина, лизина, N-ацетил-D-аланина, орнитина, фенилаланина, пролина, треонина, триптофана и тирозина или их фармацевтически приемлемой соли или производного; где молярное отношение даптомицина к каждой аминокислоте составляет от приблизительно 1:0,5 до приблизительно 1:6; где фармацевтическая композиция содержит кальций; где молярное отношение даптомицина к кальцию составляет от приблизительно 1:1 до приблизительно 1:3.
Согласно одному аспекту фармацевтические композиции по изобретению содержат даптомицин, кальций, гистидин и аргинин в молярном отношении приблизительно 1:1:3:4.
Согласно еще одному аспекту фармацевтические композиции по изобретению дополнительно содержат полипропиленгликоль в количестве от приблизительно 0,1% до приблизительно 3% об./об.
В следующем аспекте данное изобретение относится к фармацевтическим композициям, содержащим полипропиленгликоль в количестве приблизительно 0,5% об./об.
В следующем аспекте фармацевтическая композиция по изобретению содержит полипропиленгликоль в количестве приблизительно 0,25% об./об.
В одном аспекте данного изобретения композиции получают способом, при котором берут раствор даптомицина и по меньшей мере одной аминокислоты, доводят рН такого раствора до значений от приблизительно 3 до приблизительно 9 при помощи подходящего вещества для доведения рН и лиофилизируют такую композицию или высушивают распылением, или высушивают в псевдоожиженном слое с получением твердой композиции.
В одном аспекте данного изобретения композиции получают способом, при котором берут раствор даптомицина и по меньшей мере одной аминокислоты, доводят рН такого раствора до значений от приблизительно 4 до приблизительно 7 при помощи подходящего вещества для доведения рН и лиофилизируют такую композицию или высушивают распылением, или высушивают в псевдоожиженном слое с получением твердой композиции.
В следующем аспекте способ по данному изобретению дополнительно включает стадию растворения твердой композиции при помощи подходящего растворителя/разбавителя.
В еще одном аспекте способ по данному изобретению дополнительно включает стадию разбавления при помощи подходящего растворителя/разбавителя.
Кроме того, в данном изобретении предложена фармацевтическая композиция для применения в лечении микробных инфекций, в частности, вызванная грамположительными организмами.
Наконец, в одном аспекте данного изобретения предложена фармацевтическая композиция для применения в лечении инфекций кожи и мягких тканей (cSSTI), инфекций, вызванных наличием Staphylococcus aureus в крови (бактериемия).
Другие объекты, признаки и преимущества данного изобретения станут очевидны, исходя из следующего подробного описания и примеров. При этом следует понимать, что подробное описание и примеры, раскрывающие конкретные воплощения изобретения, приведены исключительно в иллюстративных целях и не предназначены для ограничения объема изобретения каким-либо образом.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Авторы данного изобретения обнаружили и описали в данном документе стабильные и фармацевтически приемлемые композиции даптомицина.
Неожиданно обнаружили, что при составлении препаратов даптомицина по данному изобретению образование продуктов деградации замедляется и, следовательно, такие препараты стабильны с химической и физической точки зрения и допускают более гибкие условия хранения и обращения.
Термин «стабильный» в данном документе относится к фармацевтическим препаратам, содержащим даптомицин, имеющим достаточную стабильность для того, чтобы их можно было применять в качестве фармацевтического продукта.
Описанные препараты демонстрируют приемлемую стабильность с точки зрения сохранения эффективности и активности даптомицина, позволяют избежать нежелательной деградации активного вещества до нежелательных родственных примесей и сохранять требуемый в фармацевтике внешний вид.
Под терминами «фармацевтическая композиция» или «фармацевтически приемлемая композиция» в данном описании понимают композицию, которая подходит для применения в ветеринарии, а также для фармацевтического применения у человека, где такая композиция является в целом безопасной, относительно нетоксичной и не вызывает неприемлемых побочных эффектов, и содержит фармацевтически приемлемые эксципиенты, например, растворители, носители, антиокислители, поверхностно-активные вещества, липиды, сахара, аминокислоты, органические кислоты, комплексообразующие вещества, консерванты, стабилизаторы, объемообразующие вещества, буферы, разбавители, несущие среды, разбавители и связывающие вещества, без ограничения.
В данном описании термины «фармацевтическая композиция», «фармацевтический препарат», «композиция» и «препарат» используют взаимозаменяемо.
В данном описании под термином «аминокислота» понимают аминокислоту, а также ее фармацевтически приемлемые соли и производные.
«Фармацевтически приемлемый» применительно к эксципиентам, не ограничивающимся растворителями, носителями, антиокислителями, поверхностно-активными веществами, липидами, сахарами, аминосахарами, органическими кислотами, комплексообразующими веществами, консервантами, стабилизаторами, объемообразующими веществами, буферами, разбавителями, несущими средами, разбавителями и связывающими веществами, в данном описании означает, что они могут применяться в изготовлении фармацевтических композиций, которые в целом являются нетоксичными и не являются нежелательными ни с биологической, ни с иной точки зрения, кроме того, они не вызывают неприемлемой потери фармакологической активности указанного лекарственного средства и приемлемы для применения в лечении людей и/или животных.
Выражение «терапевтически эффективное количество» соединения даптомицин в данном описании относится к вводимому пациенту количеству даптомицина, которое является достаточным для получения терапевтического ответа по одному или более чем одному симптому заболевания, лечение которого осуществляют.
«Вещество для доведения рН» представляет собой вещество, способное изменять, т.е. увеличивать или снижать рН раствора, например, кислоту, основание или их соль.
В данном описании термин «приблизительно» обозначает ±10% от указанного численного значения или диапазона.
В данном описании термин «целевое значение рН» обозначает ±0,1 от указанного численного значения или диапазона.
Производные аминокислот в данном изобретении обозначают любое производное аминокислоты, получаемое в результате реакции аминогруппы, карбоксильной группы функциональной группы боковой цепи или замещения любого атома водорода гетероатомом.
Аминосахара в данном изобретении обозначают химические соединения, которые имеют углеводный остов, в котором одна из гидроксильных групп замещена аминогруппой или заменена аминогруппой. Производные аминосодержащих сахаров, такие как N-ацетил глюкозамин, также являются частью данной группы.
Препараты по данному изобретению демонстрируют значительно более низкий уровень примесей в начальный момент времени, при определении методом ВЭЖХ, а также в другие моменты времени при хранении в типичных условиях, по сравнению с композицией даптомицина не содержащей аминокислот, хранящейся в таких же условиях.
Полученные результаты дополнительно показывают, что увеличение количества примесей со временем существенно замедляется при хранении композиций по изобретению в типичных условиях хранения.
Стабильные фармацевтические композиции даптомицина по данному изобретению обладают достаточной стабильностью, чтобы их можно было хранить в типичных условиях при удобной температуре, когда типичный диапазон температуры хранения составляет от 2°C до 30°C в течение надлежащего периода времени.
Продемонстрировали, что фармацевтически приемлемые препараты даптомицина по данному изобретению стабильны в течение срока хранения в типичных условиях, включая периоды времени приблизительно 7 дней (1 неделя), приблизительно 14 дней (2 недели), приблизительно 30 дней (1 месяц), приблизительно 60 дней (2 месяца), приблизительно 150 дней (5 месяцев), приблизительно 180 дней (6 месяцев), приблизительно 12 месяцев (1 год) и более при температурах приблизительно 25°C (комнатная температура), температуре ниже комнатной и в холодном месте, например, при приблизительно 2-8°C.
Предпочтительно, препараты по данному изобретению хранят при комнатной температуре, например, 25°C.
В одном воплощении данного изобретения стабильные и фармацевтически приемлемые композиции даптомицина содержат по меньшей мере одну аминокислоту или ее фармацевтически приемлемую соль или производное.
Согласно данному изобретению, предложенные стабильные фармацевтические композиции содержат даптомицин и по меньшей мере одну аминокислоту, выбранную из аланина, аргинина, аспарагина, гистидина, гистидина гидрохлорида, изолейцина, лизина, N-ацетил-D-аланина, орнитина, фенилаланина, пролина, треонина, триптофана и тирозина или их фармацевтически приемлемой соли или производного.
В одном аспекте изобретения композиции даптомицина по данному изобретению содержат две или более аминокислоты, или их фармацевтически приемлемых соли или производных.
Препараты по данному изобретению содержат терапевтически эффективное количество даптомицина, где терапевтически эффективное количество включает концентрации, варьирующие от приблизительно 0,5 мг/мл до приблизительно 500 мг/мл, от приблизительно 20 мг/мл до приблизительно 400 мг/мл, от приблизительно 50 мг/мл до приблизительно 300 мг/мл, такие концентрации как приблизительно 0,5 мг/мл, приблизительно 1 мг/мл, приблизительно 3 мг/мл, приблизительно 5 мг/мл, приблизительно 10 мг/мл, приблизительно 15 мг/мл, приблизительно 20 мг/мл, приблизительно 25 мг/мл, приблизительно 30 мг/мл, приблизительно 35 мг/мл, приблизительно 40 мг/мл, приблизительно 50 мг/мл, приблизительно 60 мг/мл, приблизительно 70 мг/мл, приблизительно 80 мг/мл, приблизительно 90 мг/мл, приблизительно 100 мг/мл, приблизительно 110 мг/мл, приблизительно 120 мг/мл, приблизительно 130 мг/мл, приблизительно 140 мг/мл, приблизительно 150 мг/мл, приблизительно 160 мг/мл, приблизительно 170 мг/мл, приблизительно 180 мг/мл, приблизительно 190 мг/мл, приблизительно 200 мг/мл, приблизительно 210 мг/мл, приблизительно 220 мг/мл, приблизительно 230 мг/мл, приблизительно 240 мг/мл, приблизительно 250 мг/мл, приблизительно 260 мг/мл, приблизительно 270 мг/мл, приблизительно 280 мг/мл, приблизительно 290 мг/мл, приблизительно 300 мг/мл, приблизительно 350 мг/мл, приблизительно 400 мг/мл, приблизительно 450 мг/мл и приблизительно 500 мг/мл.
Согласно изобретению, препараты можно растворять с помощью подходящих разбавителей.
Кроме того, для получения более низких терапевтически эффективных концентраций даптомицина композиции по изобретению можно дополнительно разбавлять подходящими разбавителями.
«Разбавители», представляющие интерес, являются фармацевтически приемлемыми, безопасными и нетоксичными для введения человеку, и подходят для растворения или дополнительного разбавления препарата.
Примеры разбавителей включают стерильную воду для инъекций, бактериостатическую воду для инъекций (BWFI), стерильный физиологический раствор (0,9% хлорид натрия), раствор Рингера или раствор декстрозы.
Препараты даптомицина, описанные в данном документе, предназначены для введения путем инъекции, например, подкожной, внутрикожной, внутривенной, внутримышечной, внутрисуставной, интрасиновиальной, внутригрудинной, внутриоболочечной, внутриочаговой, внутричерепной инъекции, или путем инфузии.
Изобретение также охватывает применения фармацевтических препаратов даптомицина по данному изобретению для лечения заболеваний, вызванных грамположительными бактериями, таких как осложненные инфекции кожи и мягких тканей (cSSTI), инфекции, вызванные наличием Staphylococcus aureus в крови (бактериемия), включая правосторонний инфекционный эндокардит (RIE).
Такие применения включают введение пациенту терапевтически эффективного количества препаратов по данному изобретению или введение пациенту терапевтически эффективного количества препарата, приготовленного из фармацевтического препарата по данному изобретению.
Способы
Композиции по данному изобретению получали, беря жидкий раствор даптомицина и одной аминокислоты или беря жидкий раствор даптомицина и двух или более аминокислот, доводя рН таких растворов подходящим веществом для доведения рН до желаемого значения рН, перенося такие растворы во флаконы для достижения требуемого количества даптомицина на флакон и лиофилизации.
После лиофилизации определяли количество примесей в начальный момент времени при помощи ВЭЖХ и затем флаконы загружали в климатические камеры, в которых поддерживали различные условия хранения, такие как 60°C, 25°C/60%RH и 40°C/75%RH.
Для определения образования примесей и стабильности даптомицина в препаратах по данному изобретению, флаконы вынимали из климатических камер в различные моменты времени, такие как 45 часов, 1 месяц, 2 месяца и т.д. и анализировали при помощи ВЭЖХ.
Анализ препаратов по данному изобретению можно осуществлять при помощи методов, известных в области техники, таких как ВЭЖХ, включая ВЭЖХ, описанную в WO 2011063419, или газовую хроматографию.
ПРИМЕРЫ


Пример 1
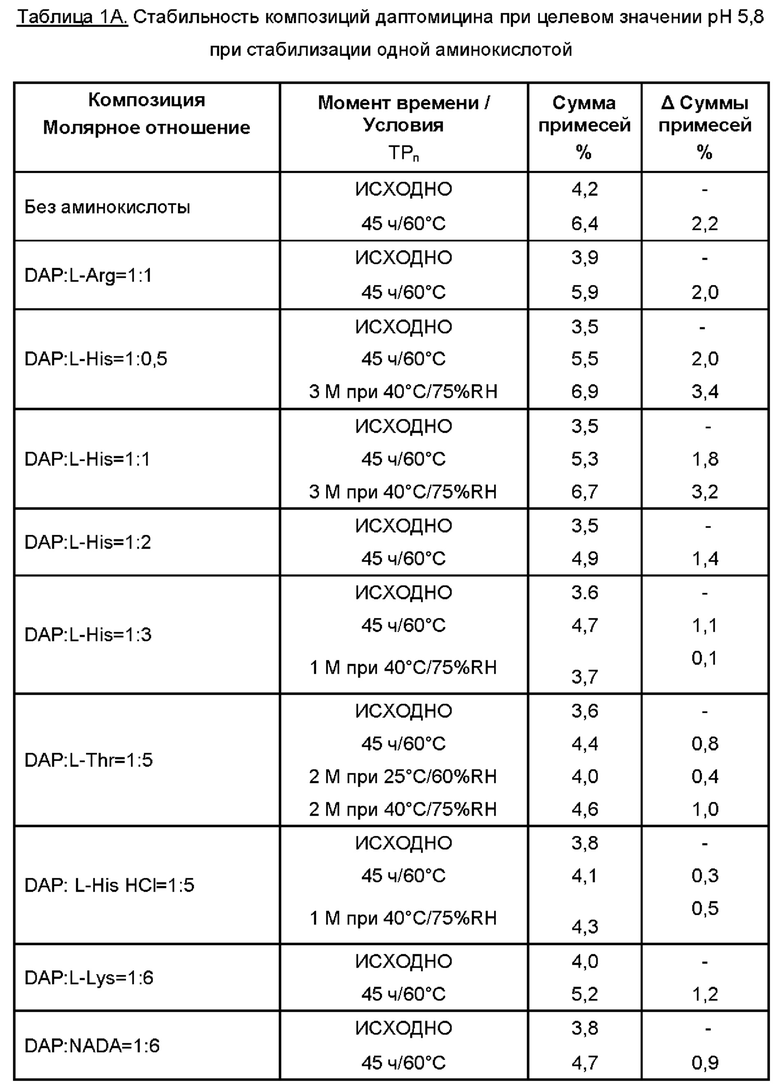
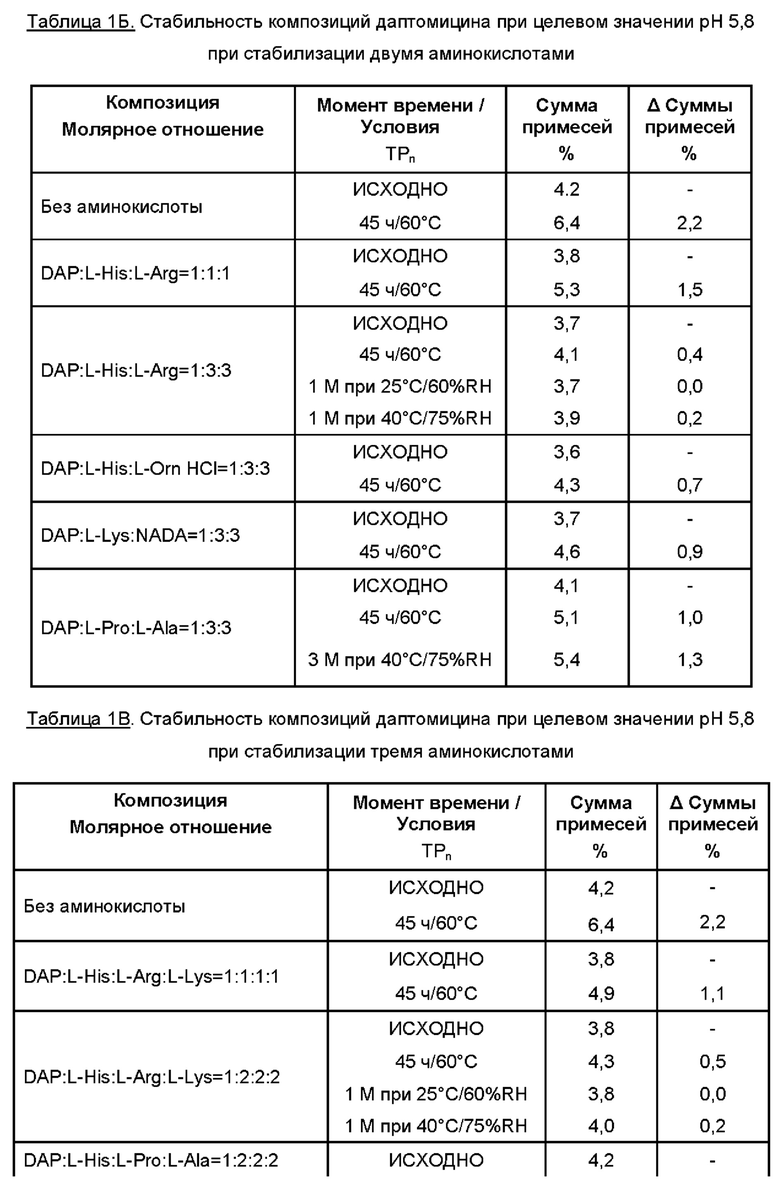
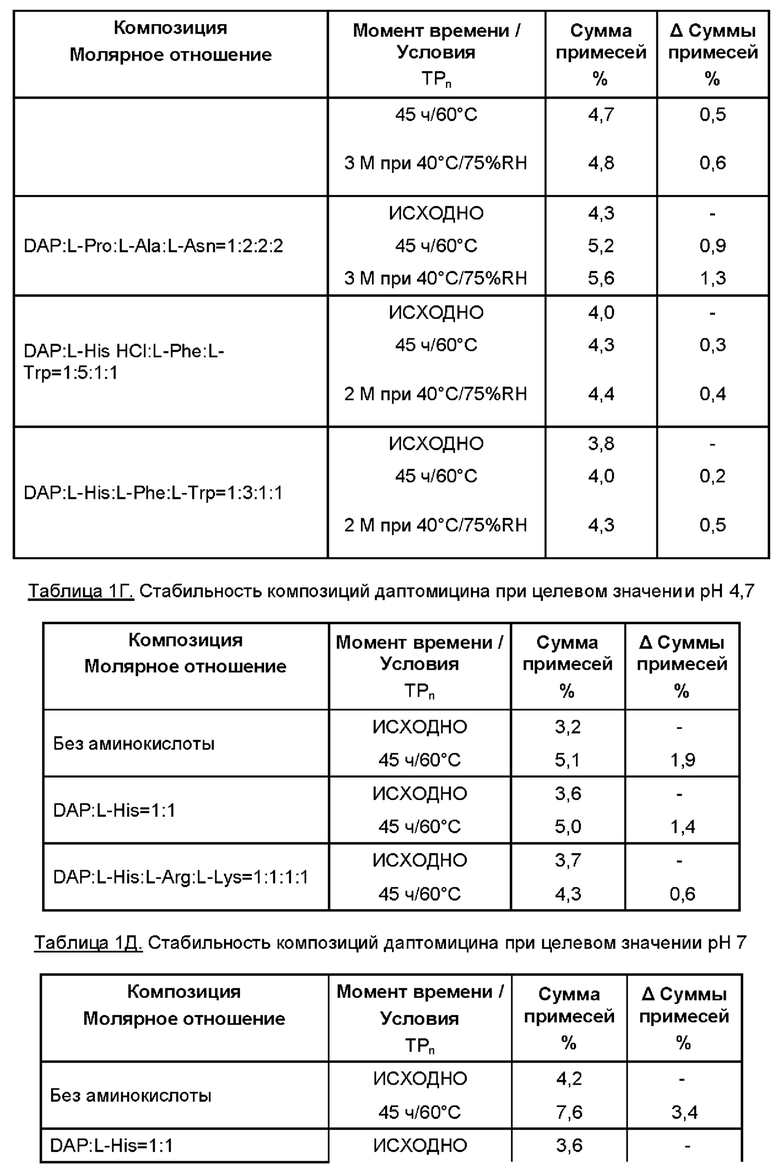
Даптомицин (6,773 г, с учетом результатов определения безводного основания даптомицина 100,3% и содержания воды 3,1%) добавляли в раствор требуемой аминокислоты или двух, или более аминокислот в WFI. Молярное отношение даптомицина к одной аминокислоте или к каждой из отдельных аминокислот при добавлении двух или более аминокислот варьировало от приблизительно 1:0,5 до приблизительно 1:6, например, 1:0,5, 1:1, 1:2, 1:3, 1:4, 1:5 и 1:6.
Затем содержимое перемешивали, защищая от атмосферного воздуха, с применением магнитной мешалки. Доводили рН при помощи 5М раствора NaOH. Затем раствор переносили в мерную колбу и добавляли WFI для достижения объема 50 мл.
Раствор перемешивали для обеспечения гомогенности, фильтровали через 0,2 мкм фильтр, переносили во флаконы и лиофилизировали.
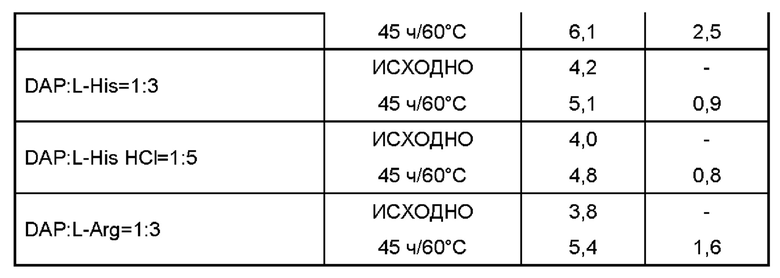
Пример 2
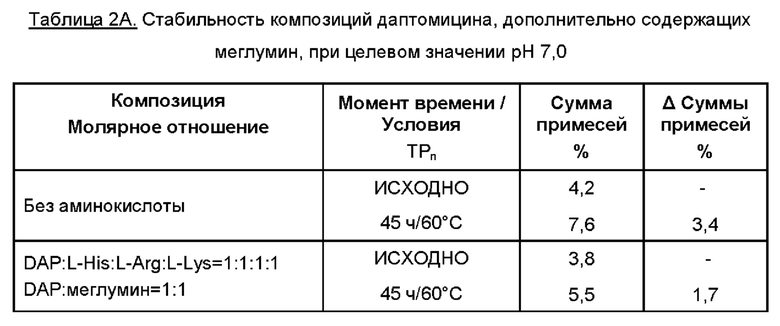
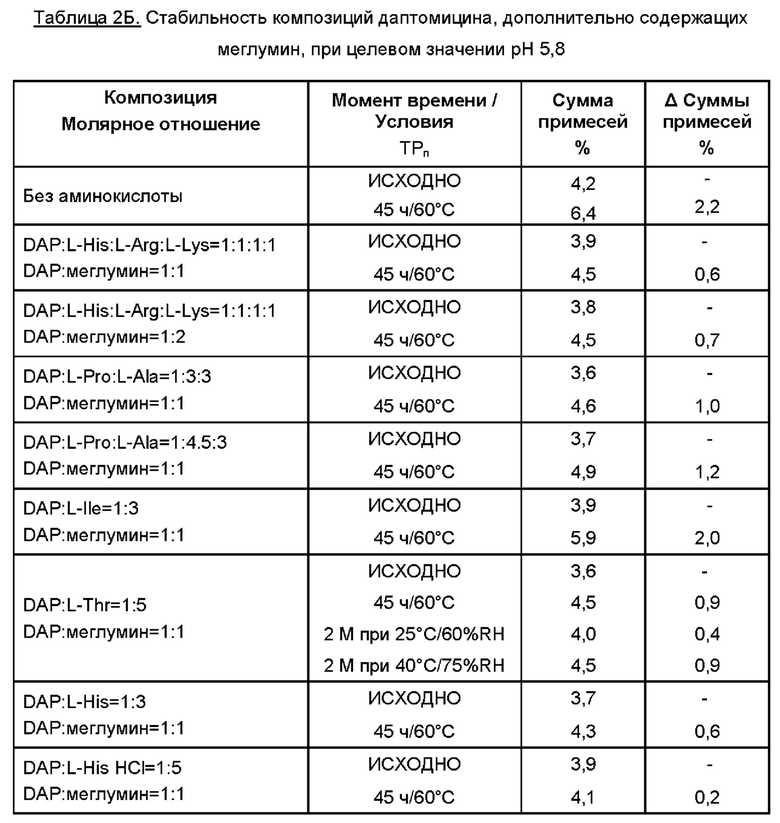
К 35 мл WFI добавляли меглумин. Затем растворяли требуемую аминокислоту (одну или две, или более аминокислот). К раствору добавляли даптомицин (6,773 г, с учетом результатов определения безводного основания даптомицина 100,3% и содержания воды 3,1%).
Молярное отношение даптомицина к одной аминокислоте или к каждой из отдельных аминокислот при добавлении двух или более аминокислот варьировало от приблизительно 1:0,5 до приблизительно 1:6, например, 1:0,5, 1:1, 1:2, 1:3, 1:4, 1:4,5, 1:5 и 1:6.
Молярное отношение даптомицина к меглумину варьировало от приблизительно 1:1 до приблизительно 1:3, например, 1:1, 1:2 и 1:3.
Затем содержимое перемешивали, защищая от атмосферного воздуха с применением магнитной мешалки. Доводили рН при помощи 5М раствора NaOH.
Затем раствор переносили в мерную колбу и добавляли WFI для достижения объема 50 мл. Раствор перемешивали для обеспечения гомогенности, фильтровали через 0,2 мкм фильтр, переносили во флаконы и лиофилизировали.
Пример 3
К 35 мл WFI добавляли аминокислоту (одну или более). Затем добавляли требуемую органическую аминокислоту. К раствору добавляли даптомицин (6,773 г, с учетом результатов определения безводного основания даптомицина 100,3% и содержания воды 3,1%).
Молярное отношение даптомицина к одной аминокислоте или к каждой из отдельных аминокислот при добавлении двух или более аминокислот варьировало от приблизительно 1:0,5 до приблизительно 1:6, например, 1:0,5, 1:1, 1:2, 1:3, 1:4, 1:4,5, 1:5 и 1:6.
Затем содержимое перемешивали, защищая от атмосферного воздуха с применением магнитной мешалки. Доводили рН при помощи 5М раствора NaOH. Затем раствор переносили в мерную колбу и добавляли WFI для достижения объема 50 мл. Раствор перемешивали для обеспечения гомогенности, фильтровали через 0,2 мкм фильтр, переносили во флаконы и лиофилизировали.
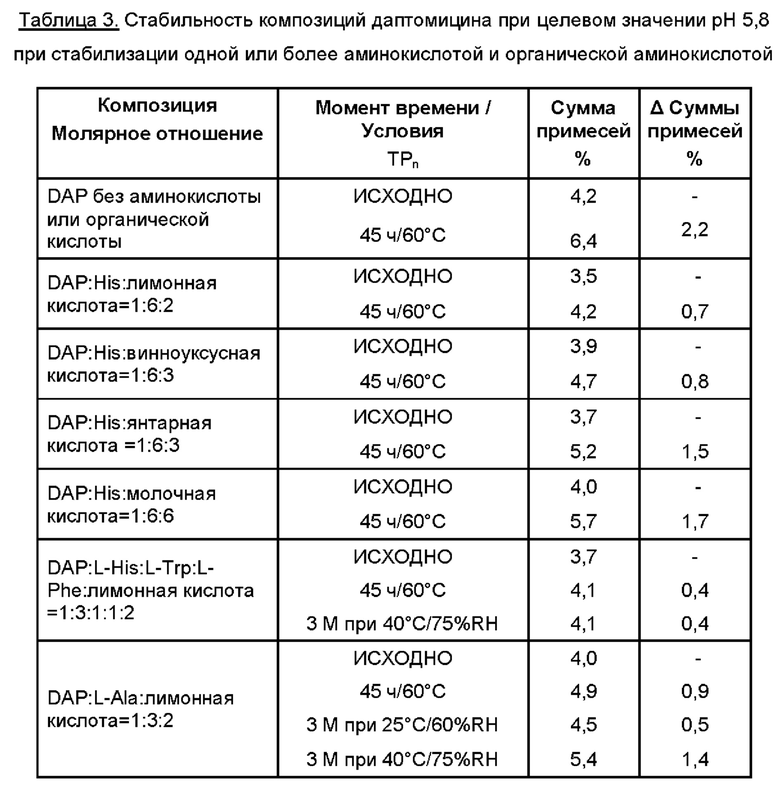
Пример 4
К 35 мл WFI добавляли аминокислоты. Затем добавляли выбранный источник кальция. К раствору добавляли даптомицин (6,773 г, с учетом результатов определения безводного основания даптомицина 100,3% и содержания воды 3,1%).
Затем содержимое перемешивали, защищая от атмосферного воздуха, с применением магнитной мешалки. Доводили рН при помощи 5М раствора HCl. Затем раствор переносили в мерную колбу и добавляли WFI для достижения объема 50 мл. Раствор перемешивали для обеспечения гомогенности, фильтровали через 0,2 мкм фильтр, переносили во флаконы и лиофилизировали.
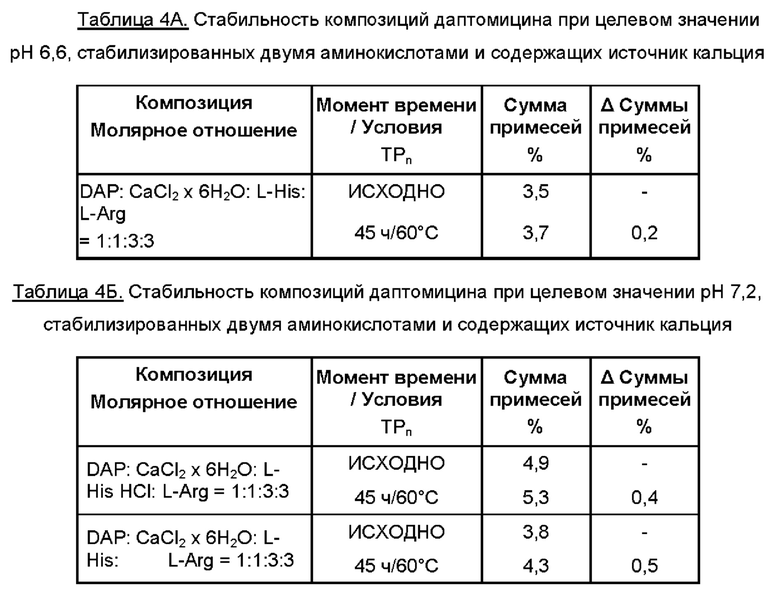
Пример 5
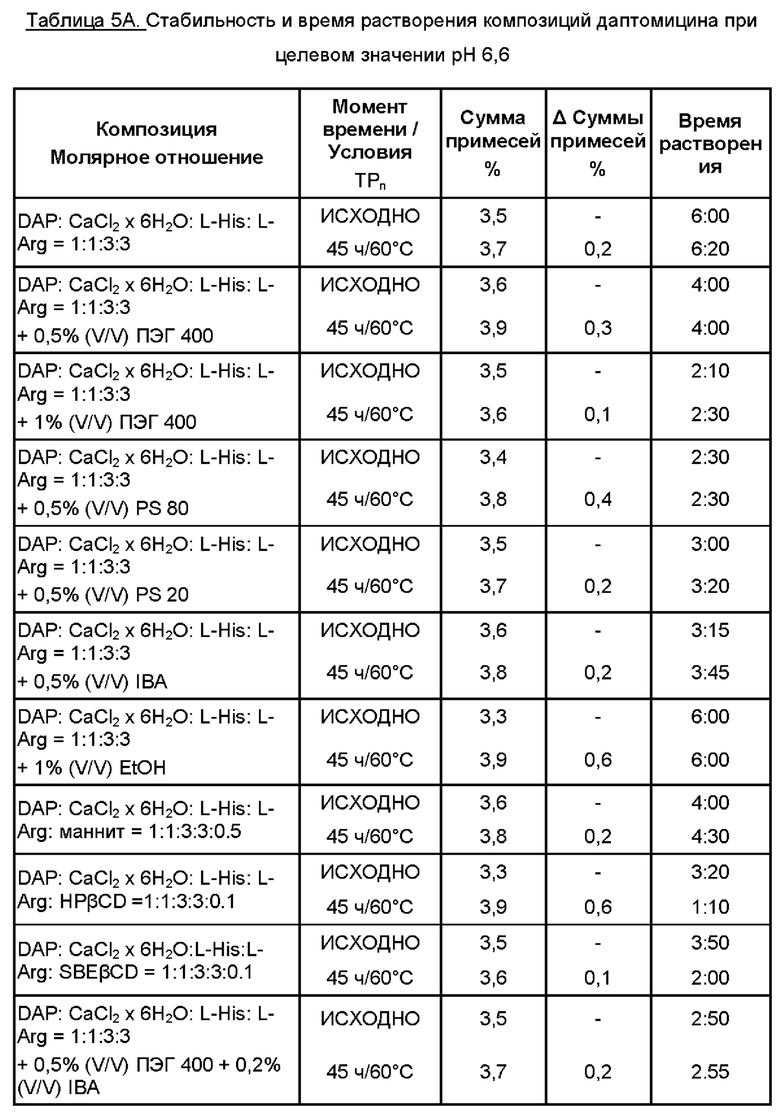
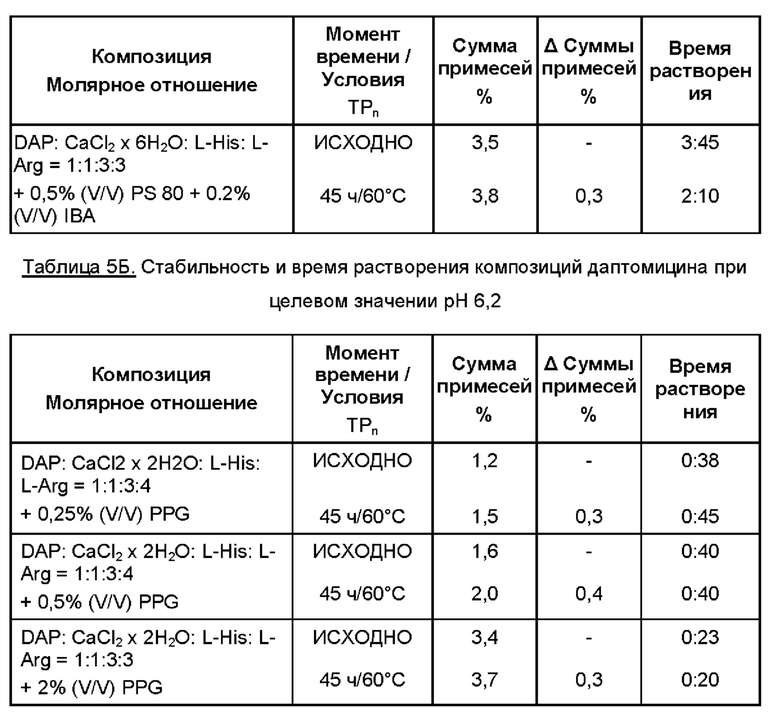
Препараты по данному изобретению, будучи стабильными, имели различное время растворения, доходившее до 15 минут. Для уменьшения времени растворения добавляли различные эксципиенты. Результаты приведены в Таблицах 5А и 5Б.
К 35 мл WFI добавляли аминокислоты. Затем добавляли выбранный источник кальция и выбранный эксципиент для улучшения времени растворения. К раствору добавляли даптомицин (6,773 г, с учетом результатов определения безводного основания даптомицина 100,3% и содержания воды 3,1%).
Затем содержимое перемешивали, защищая от атмосферного воздуха, с применением магнитной мешалки. Доводили рН до целевого значения при помощи 5М раствора HCl. Затем раствор переносили в мерную колбу и добавляли WFI для достижения объема 50 мл. Раствор перемешивали для обеспечения гомогенности, фильтровали через 0,2 мкм фильтр, переносили во флаконы и лиофилизировали.
Время растворения, представленное в Таблицах 5А и 5Б, измеряли после лиофилизации (исходно) и после испытания стабильности, когда содержимое флаконов растворяли при помощи 10,0 мл WFI.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ УЛУЧШЕНИЯ ПЕРОРАЛЬНОГО ВСАСЫВАНИЯ ПРОТИВОМИКРОБНЫХ СРЕДСТВ | 2001 |
|
RU2282462C2 |
| СТАБИЛЬНЫЕ ВОДНЫЕ КОМПОЗИЦИИ БЕЛКА MIA/CD-RAP | 2011 |
|
RU2588658C2 |
| ВОДНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАНТРОЛЕН | 2016 |
|
RU2729043C2 |
| СПОСОБ КОНТРОЛЯ РЕАКЦИИ МОДИФИКАЦИИ ПОЛИПЕПТИДА | 2009 |
|
RU2532850C2 |
| ЛИОФИЛИЗИРОВАННЫЙ ПРЕПАРАТ ЦИТОТОКСИЧЕСКИХ ДИПЕПТИДОВ | 2012 |
|
RU2597154C2 |
| ЛИПОПЕПТИДНЫЕ КОМПОЗИЦИИ И РОДСТВЕННЫЕ СПОСОБЫ | 2010 |
|
RU2607526C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ВКЛЮЧАЮЩИЙ АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА EGF | 2004 |
|
RU2381036C2 |
| Композиция, содержащая высококонцентрированный ингибитор альфа-1-протеиназы, и способ ее приготовления | 2019 |
|
RU2813136C1 |
| СПОСОБ ОЧИСТКИ ЛИПОПЕПТИДА (ВАРИАНТЫ), АНТИБИОТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ОЧИЩЕННОГО ЛИПОПЕПТИДА (ВАРИАНТЫ) | 2001 |
|
RU2311460C9 |
| ЖИДКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ОЛИГОПЕПТИДЫ И ЭТЕРИФИЦИРОВАННЫЙ ЦИКЛОДЕКСТРИН | 2003 |
|
RU2322254C2 |
Данное изобретение относится к лиофилизированным композициям, содержащим даптомицин и по меньшей мере две аминокислоты, способам получения таких композиций и их применению. 2 н. и 13 з.п. ф-лы, 5 пр., 12 табл.
1. Лиофилизированная, высушенная распылением или высушенная в псевдоожиженном слое фармацевтическая композиция для лечения заболеваний, вызванных грамположительными бактериями, содержащая даптомицин и по меньшей мере две аминокислоты или их производных, выбранных из аланина, аргинина, аспарагина, гистидина, лизина, орнитина, фенилаланина, пролина, триптофана и N-ацетил-D-аланина или их фармацевтически приемлемой соли.
2. Фармацевтическая композиция по п. 1, где одна аминокислота из указанных по меньшей мере двух аминокислот представляет собой гистидин или его фармацевтически приемлемую соль или производное.
3. Фармацевтическая композиция по п. 2, где соль представляет собой гистидина гидрохлорид.
4. Фармацевтическая композиция по п. 2, где вторая аминокислота или ее производное из указанных по меньшей мере двух аминокислот или их производных выбрана из аланина, аргинина, аспарагина, изолейцина, лизина, орнитина, фенилаланина, пролина, треонина, триптофана, тирозина и N-ацетил-D-аланина или их фармацевтически приемлемой соли.
5. Фармацевтическая композиция по п. 2, где вторая аминокислота из по меньшей мере двух аминокислот представляет собой аргинин или его фармацевтически приемлемую соль.
6. Фармацевтическая композиция по любому из предыдущих пунктов, где молярное отношение даптомицина к по меньшей мере одной аминокислоте или ее фармацевтически приемлемой соли или производному составляет от 1:0,5 до 1:6.
7. Фармацевтическая композиция по любому из предыдущих пунктов, где молярное отношение даптомицина к по меньшей мере одной аминокислоте или ее фармацевтически приемлемой соли или производному составляет от 1:3 до 1:5.
8. Фармацевтическая композиция по любому из предыдущих пунктов, дополнительно содержащая органическую кислоту, выбранную из лимонной кислоты, винной кислоты, янтарной кислоты и молочной кислоты.
9. Фармацевтическая композиция по п. 1, где дополнительно содержащая меглумин.
10. Фармацевтическая композиция по любому из предыдущих пунктов, дополнительно содержащая кальций.
11. Фармацевтическая композиция по любому из предыдущих пунктов, где молярное отношение даптомицина к кальцию составляет от 1:1 до 1:3, например 1:1, 1:2 или 1:3.
12. Фармацевтическая композиция по любому из предыдущих пунктов, дополнительно содержащая полиэтиленгликоль (ПЭГ), такой как ПЭГ 400 или ПЭГ 600, полипропиленгликоль (PPG), полисорбаты (PS) такие как PS 20 или PS 80, спирты, такие как этанол или изобутиловый спирт, или их смеси, до 3% об./об.
13. Фармацевтическая композиция по любому из предыдущих пунктов, дополнительно содержащая циклодекстрины, выбранные из гидроксипропил-β-циклодекстрина или сульфобутилового эфира β-циклодекстрина, в молярном отношении даптомицина к циклодекстрину от 1:0,1 до 1:1, например, от 1:0,1 до 1:0,5.
14. Способ изготовления композиций по любому из предыдущих пунктов, в котором берут раствор даптомицина и по меньшей мере двух аминокислот или их производных, доводят рН такого раствора до значений от 3 до 9 при помощи подходящего вещества для доведения рН и лиофилизируют такую композицию или высушивают распылением, или высушивают в псевдоожиженном слое с получением твердой композиции.
15. Фармацевтическая композиция по любому из пп. 1-20 для применения в лечении инфекций кожи и мягких тканей (cSSTI) и инфекций, вызванных наличием Staphylococcus aureus в крови (бактериемия).
| WO 2011063419 A2, 2011.05.26 | |||
| WO 2011062676 A1, 2011.05.26 | |||
| WO 2012112319 A1, 23.08.2012 | |||
| WO 2014041425 A1, 2014.03.20 | |||
| WO 2016098009 A1, 2016.06.23. |
Авторы
Даты
2022-04-15—Публикация
2018-08-28—Подача