Область изобретения
Настоящее изобретение находится в области техники медицинского питания и более предпочтительно относится к питательным композициям для применения в лечении и восстановлении после травматического повреждения головного мозга и симптомов, ассоциированных с ним.
Предшествующий уровень техники изобретения
Травматическое повреждение головного мозга (ЧМТ (TBI)) представляет собой форму приобретенного повреждения головного мозга. ЧМТ является серьезным медицинским состоянием, которое может развиться после того, как головной мозг подвергнется существенному внешнему физическому воздействию. ЧМТ является лидирующей причиной инвалидизации и смерти у людей до 45 с приблизительно 10 миллионами новых случаев каждый год во всем мире.
В соответствии с диагностическими критериями, описанными в “Diagnostic and Statistical Manual of Mental Disorders (DSM-5) ЧМТ имеет одну или более из следующих характеристик: изменение уровня сознания; расстройства памяти; спутанность ассоциированная с дефицитом ориентации; неврологические признаки, такие как повреждение головного мозга, наблюдаемое при нейровизуализации, появление новых или ухудшение судорожных расстройств, дефицит полей зрения и гемипарез. Тогда как такие симптомы могут развиться непосредственно после повреждения, другие могут развиться с течением времени в соответствии с анатомическими изменениями неврологических субстратов после повреждения.
Первичная фаза ЧМТ описывает немедленное повреждение ткани головного мозга из-за контузии или кислородного голодания вызванного глобальным объемным воздействием. Первичное повреждение ЧМТ может быть уменьшено только посредством улучшенной профилактики. Вторичное повреждение начинается после травмы и лежит в основе функциональных дефицитов, ассоциированных с ЧМТ. Оно развивается позднее посредством таких механизмов, как реперфузионное повреждение, отсроченный отек коры, нарушение гематоэнцефалического барьера (ГЭБ (BBB)), глютаминергическое перевозбуждение и локальный дисбаланс электролитов. Такие нарушения сами по себе приводят к нейродегенерации, опосредованной реактивными формами кислорода (ROS), посредством высвобождения кальция, токсичности глютамата, перекисного окисления липидов и митохондриальной дисфункции. Такое вторичное повреждение может развиться в головном мозге рядом с областью исходного предполагаемого повреждения, давая потенциал неожиданного распространения зоны повреждения в течение месяцев после повреждения. В настоящее время не существует методов лечения для противодействия таким нежелательным исходам. Следовательно, разработка эффективных терапевтических вмешательств для защиты головного мозга и обеспечения восстановления после ЧМТ является особенно неотложным делом.
Выжившие после ЧМТ могут испытывать широкий диапазон дефицитов, и сенсомоторные, а также когнитивные нарушения являются обычными последствиями такого повреждения. Сенсомоторное повреждение включает элементы пареза, постурального дисбаланса и нарушений походки, и ранние острые нарушения стартл-рефлексов. ЧМТ может приводить к брадикинезии, патологическому раскачиванию и нарушенному времени реакции. Ранее нарушение баланса является предшественником ухудшения исхода после ЧМТ. Сенсомоторные проблемы могут улучшиться с течением времени, хотя в зависимости от тяжести дефицита могут сохраняться до первых 1-2 лет после травмы. В когнитивных областях нарушения наблюдают в памяти, внимании и скорости обработки информации, более тяжелые ЧМТ вызывают более выраженные и длительные дефициты, чем легкая или умеренная ЧМТ. Адекватное лечение ЧМТ для предотвращения таких длительных эффектов еще недоступно.
Множество липидных смесей используют в производстве пищевых продуктов для улучшения функции головного мозга. Немедленная (внутривенная инфузия) больших количеств DHA непосредственно после ЧМТ может уменьшить нежелательные явления ЧМТ в отношении функции головного мозга в моделях на животных. Считают, что только минимальные количества DHA поступают в головной мозг в сутки и что любое добавление DHA может быть только полезным, когда его вводят в течение нескольких часов после события.
В WO2006/118665 описан способ уменьшения агрегации белка в головном мозге млекопитающего посредством увеличения уровня эндогенных кетонов с использованием, так называемой, кетогенной диеты. Пациенты с ЧМТ, которые голодали или придерживались кетогенно-подобной диеты для минимизации гипергликемии демонстрировали достоверно более низкий уровень глюкозы и концентрацию лактата в плазме, повышенный уровень β-гидроксибутирата и лучший баланс азота в моче по сравнению с пациентами на стандартном питании.
Считают, что кетогенная диета (КД (KD)) приводит к адаптивным изменениям метаболизма энергии в головном мозге, которые увеличивают резервы энергии. Считают, что это помогает нейронам оставаться стабильными перед лицом увеличенных энергетических потребностей, и может оказывать нейропротективный эффект. При кетогенной диете потребление углеводов ограничено. Классическая кетогенная диета включает количество липидов (по массе), которое около 4 раз выше массы суммы белков и перевариваемых углеводов. Жирные кислоты используют в качестве основного источника энергии. Они используются посредством окисления жирных кислот в митохондриях клетки. Головной мозг обычно энергоснабжается исключительно глюкозой, липиды в форме липопротеинов плазмы, как таковые, не пересекают гематоэнцефалический барьер в достаточной степени. Печень может использовать длинноцепочечные жирные кислоты, чтобы синтезировать три кетоновых тела β-гидроксибутират, ацетоацетат и ацетон. Такие кетоновые тела могут в определенных условиях входить в головной мозг и действовать как заместитель глюкозы. Кроме того, среднецепочечные жирные кислоты октановая (C8) и гептановая (C7) кислоты могут проходить через гематоэнцефалический барьер и использоваться головным мозгом. Когда глюкоза и кетоновые тела одновременно поступают к нейронам, глюкоза будет, несомненно, предпочтительным источником энергии. Поэтому классическая кетогенная диета имеет большой избыток липидов и едва ли вообще перевариваемые углеводы. Обычно степень кетогенности значительно снижается, когда количество перевариваемых углеводов в питании увеличивается.
Кетогенная диета со среднецепочечными триглицеридами (MCTKD) представляет собой ее вариант. Оригинальная диета MCT, разработанная в 1970х получает 60% калорий из масла MCT. Более того, потребление такого количества масла MCT вызывает спазмы в животе, диарею и рвоту, что является серьезным недостатком для ее применения. Диета является, как кетогенная диета, неприятной по вкусу, что затрудняет возможность ее придерживаться. Кроме того, последствия для здоровья диеты с высоким содержанием жира для жизни могут быть значительными.
Диета с низким гликемическим индексом является другим вариантом. Гликемический индекс классифицирует углеводы по их способности повышать глюкозу крови по шкале от 0-100. Диета с низким гликемическим индексом позволяет большее потребление перевариваемых углеводов, но углеводы ограничены таковыми с низким гликемическим индексом (обычно рассматривается гликемический индекс 55 или менее). На практике питание с низким ГИ не индуцирует кетогенного состояния и людям часто тяжело ее придерживаться.
Модифицированная диета Аткинса (MAD) является другим, более либеральным вариантом традиционной кетогенной диеты, главным образом ограниченной в количестве перевариваемых углеводов. Тогда как кетогенная диета обычно дается в кетогенном соотношении 4:1 или 3:1, которое является соотношением количества жира к общим количествам белка и перевариваемых углеводов, MAD содержит соотношение около 1:1, которое допускает потребление большего количества белка и углеводов и требует меньше потребления жира. Однако недостатком MAD является то, что для пациентов на MAD тяжело выполнять и потреблять достаточно жира, чтобы оставаться в кетозе.
WO 2015/034812 относится к кетогенной диете и ее применению для лечения критически больных. В нем упоминается, что кетогенная диета содержит 3-4 г жира на грамм белка и углеводов в комбинации, но длительная приверженность является проблемой. Это остается неизменным, но фокусируется на использовании углеводов в качестве основного источника калорий для критически больных, так как поднимает несколько сопутствующих проблем. В их свете уровень углеводов снижается. Диета включает долю жира, включающую DHA, EPA и MCT, которые поставляют 50-80% калорий, белковую долю, которая поставляет 10-35% калорий, и где любые углеводы в диете ограничены 0-10% калорий. В примере 1 обеспечивают энтеральную композицию с 100 г каждого из жира и белка.
В WO 2012/113415 описаны композиции для злокачественного рака головного мозга и опухолей головного мозга. Он относится к KetoCal® который является питательно полной, коммерчески доступной 4:1 кетогенной формулой. Указанное кетогенное соотношение находится в соответствии со сравнительными данными, представленными в примерах и таблице 1 ниже.
В Mayumi Prins et al. “The collective therapeutic potential of cerebral ketone metabolism in traumatic brain injury” J. Lipid Research vol. 55 no. 12 (2014) p. 2450-2457 описан метаболизм кетонов головного мозга при ЧМТ. В нем упоминаются коммерчески доступные кетогенные формулы, такие как Bioserv F5848 (3:1), Bioserve F6666 (4:1) и Teklad 96355 (4:1).
В соответствии задачей изобретения является обеспечение диетического и питательного вмешательства, которое не страдает от вышеупомянутых недостатков кетогенной диеты у пациентов, страдающих от ЧМТ, и также обеспечивает улучшенное восстановление после ЧМТ.
Сущность изобретения
Авторы изобретения отметили, что энтеральное (предпочтительно пероральное) введение питательной композиции, включающей (a) липид, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества (i) докозагексаеновой кислоты (22:6; DHA) и необязательно эйкозапентаеновой кислоты (20:5; EPA), и (ii) среднецепочечные триглицериды (MCT), предпочтительно по меньшей мере 2 масс% C8 и C10 MCT, на основании массы жирных кислот; и указанная питательная композиция (d) имеет кетогенное массовое соотношение от 1,4:1 до 3:1, предпочтительно от 1,8:1 до 2,7:1, более предпочтительно от 1,8:1 до 2,5:1, для применения в лечении травматического повреждения головного мозга (ЧМТ). Питательная композиция является успешной в улучшении восстановления субъекта млекопитающего (предпочтительно человека), страдающего от травматического повреждения головного мозга. Следовательно, композиция по изобретению может быть использована в лечении и восстановлении после травматического повреждения головного мозга (ЧМТ), где питательную композицию вводят энтерально, предпочтительно перорально.
Питательная композиция предпочтительно имеет гликемический индекс ниже 69, предпочтительно ниже 65, белковая фракция присутствует в массовом количестве по меньшей мере 15 масс% композиции, предпочтительно по меньшей мере 16-25 масс% композиции, более предпочтительно 17-21 масс% композиции, и композиция предпочтительно включает по меньшей мере фрукто-олигосахариды. В одном варианте осуществления изобретения композиция более предпочтительно также включает целлюлозу, в таком случае целлюлоза и фрукто-олигосахариды предпочтительно присутствуют в массовом соотношении от 2:1 до 1:2.
В предпочтительном варианте осуществления изобретения композиция включает терапевтически эффективные количества (i) докозагексаеновой кислоты (22:6; DHA) и эйкозапентаеновой кислоты (20:5; EPA), предпочтительно в количестве 1-5 масс% суммы DHA и EPA, и (ii) среднецепочечные триглицериды (MCT), предпочтительно по меньшей мере 5 масс% суммы C8, C10 и C12 MCT, на основании массы жирных кислот; и указанная питательная композиция имеет кетогенное массовое соотношение от 1,8:1 до 2,5:1, где указанная композиция имеет гликемический индекс ниже 65, и где белковая фракция предпочтительно присутствует в массовом количестве 17-21 масс% композиции, и композиция предпочтительно включает по меньшей мере фрукто-олигосахариды, более предпочтительно целлюлозу и фруктоолигосахариды, наиболее предпочтительно в массовом соотношении от 2:1 до 1:2.
Сделана ссылка на модель ЧМТ в экспериментальной части. Эффекты энтерального (перорального) вмешательства с помощью пищевой композиции по изобретению (‘Kone’) на обучение и пространственную память, (новый объект) распознавание и тревогу, и двигательный баланс и настороженность оценивали в модели ЧМТ на мышах. Вмешательство оказалось успешным для каждого из указанных аспектов, которые оказались как-либо скомпрометированы в контексте ЧМТ.
Изобретение дополнительно относится к способу для перехода на и/или поддержания кетогенного метаболизма, включающему введение питательной композиции, включающей (a)-(i), (a)-(ii) и (b), как описано выше, пациенту, страдающему от травматического повреждения головного мозга и/или симптомов, связанных с травматическим повреждением головного мозга.
Чертежи
Настоящее изобретение будет обсуждаться более подробно ниже, со ссылками на приложенные чертежи, в которых:
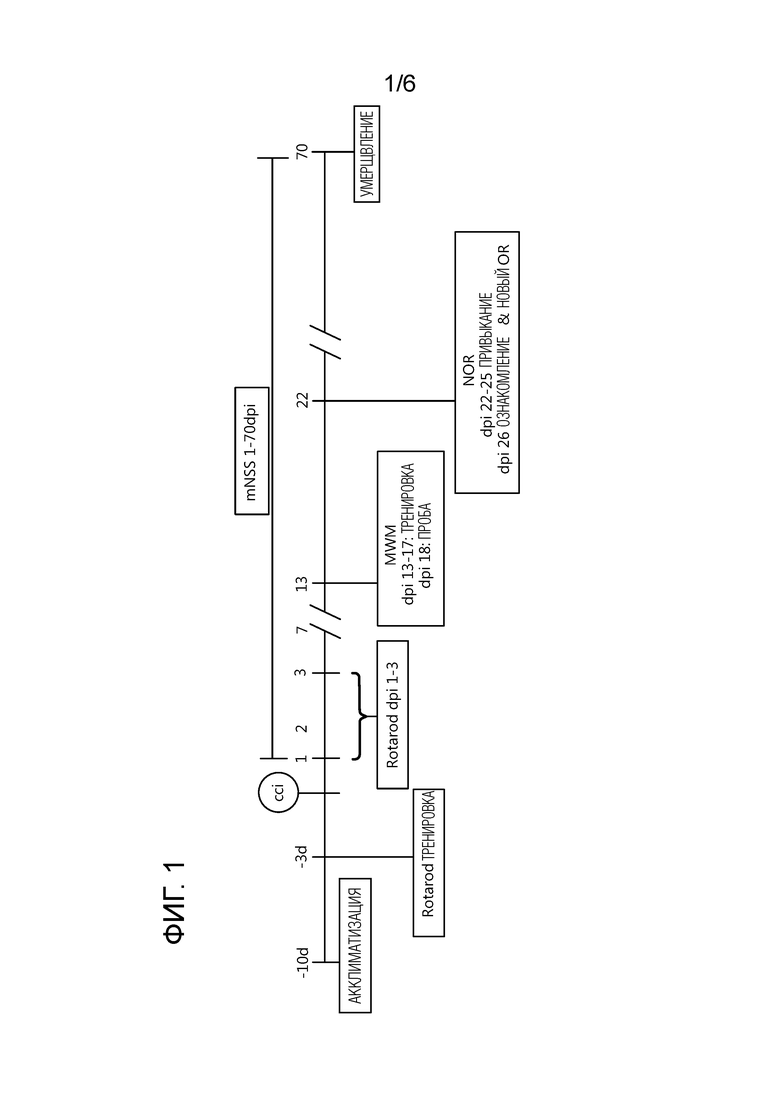
На фиг. 1 изображено расписание экспериментов, проводимых в эксперименте 1, где мышей C57Bl6 делили на 4 экспериментальные группы 1) контрольная группа, подвергнутая краниотомии и получавшая контрольную диету (кранио контроль), 2) группа, подвергнутая контролируемому кортикальному повреждению (CCI), модели ЧМТ (лечение ЧМТ) и получавшая контрольную диету (CCI контроль), 3) группа, которая подверглась лечению ЧМТ и получает диету FortasynConnect, включающую DHA, EPA, UMP, холин, фолиевую кислоту, селен, фосфолипиды и витамины B6, B12, C и E (CCI-FC) и 4) группа, которая подверглась лечению ЧМТ и получает модифицированную кетогенную диету в соответствии с изобретением (CCI-Kone).
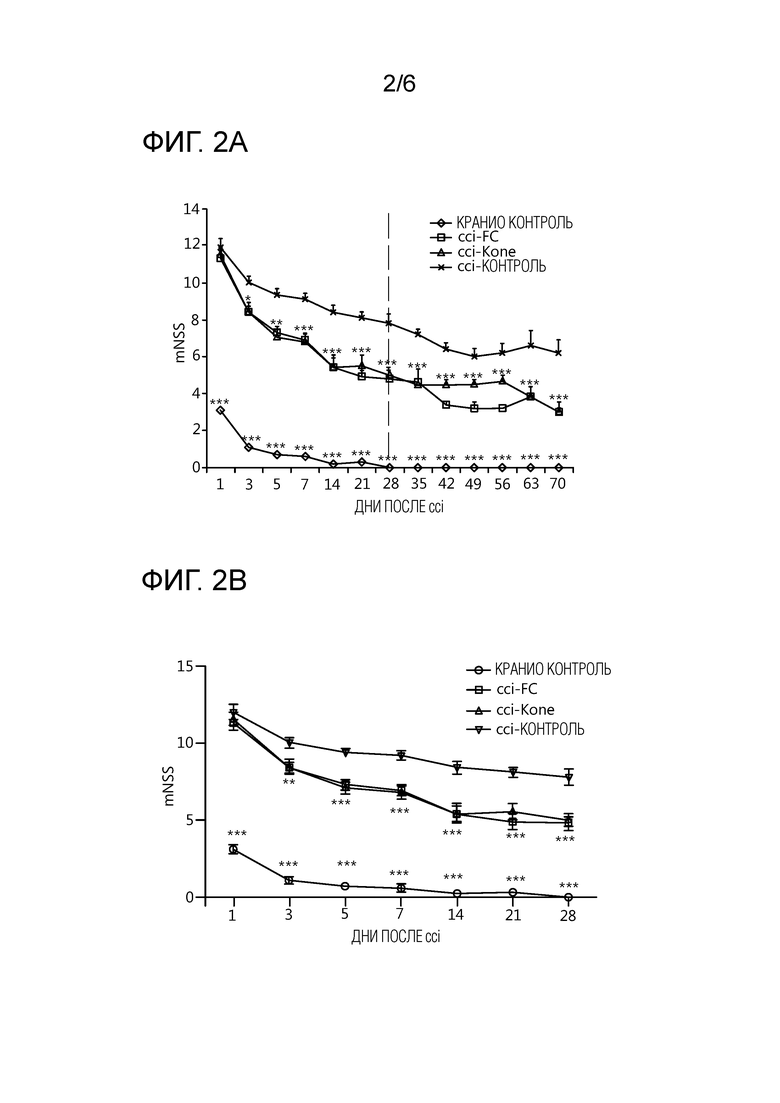
На фиг. 2A показана модифицированная неврологическая шкала тяжести (mNSS) 4 различных групп лечения мышей эксперимента 1 в течение периода 70 дней после ЧМТ или контрольного вмешательства. На фиг. 2B показана mNSS с дня 1 до дня 28 после ЧМТ или контрольного вмешательства в указанных 4 группах животных. Нейроповеденческий исход, оцененный с использованием mNSS, показал значительное улучшение для CCI-FC и CCI-Kone леченных животных относительно CCI контрольной группы. Отметили улучшения уже через 3 дня после травмы, продолжающиеся в течение всего исследования. * p<0,05; **p<0,01; ***p<0,001 относительно CCI-контрольных животных.
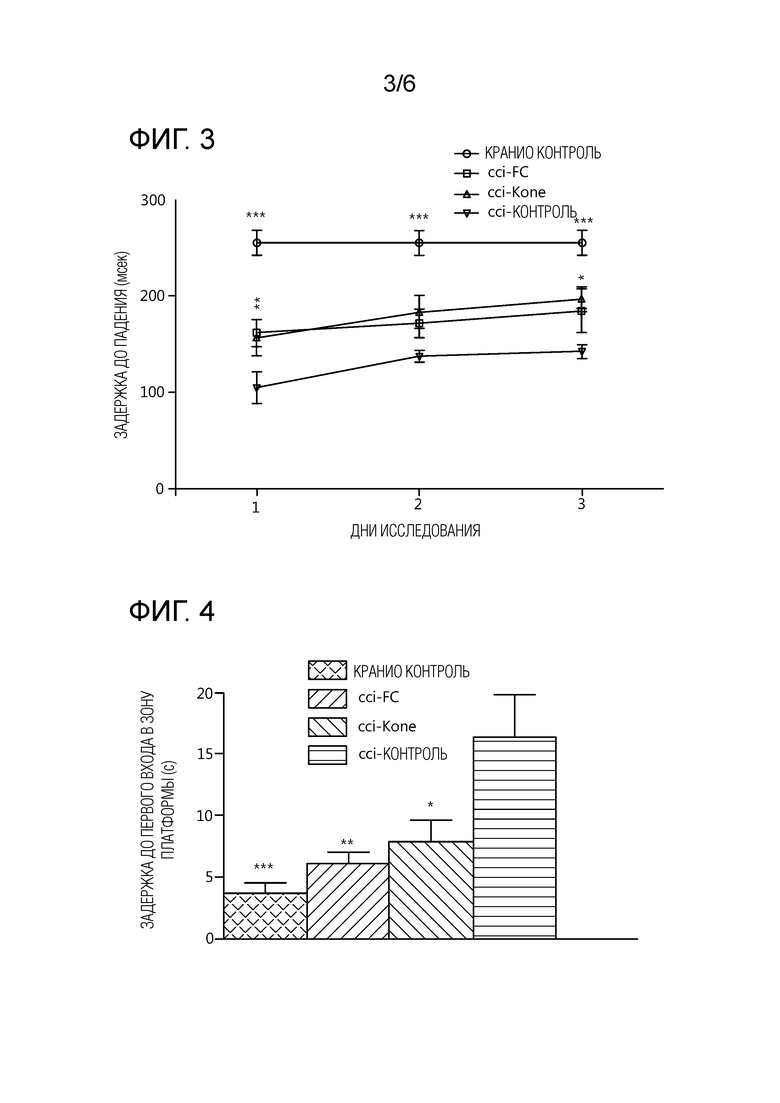
На фиг. 3 показана задержка до падения в миллисекундах (мсек) с Rotarod в 3 дня тестирования в 4 группах животных. Лечение CCI-FC и CCI-Kone уменьшало ухудшения, индуцированные повреждением в тесте Rotarod, который проводили у пострадавших животных в первые 3 дня после повреждения. *p<0,05; ***p<0,001 vs. CCI-контрольных животных.
На фиг. 4 показана средняя задержка до первого входа в зону платформы в секундах в водном лабиринте Морриса (Morris Water Maze (MWM)) в 4 группах лечения. В тесте WMW дефицит, индуцированный повреждением, выявленный в пробном исследовании, устранялся Kone и FC-дополненными диетами в группах CCI-Kone и CCI-FC соответственно.
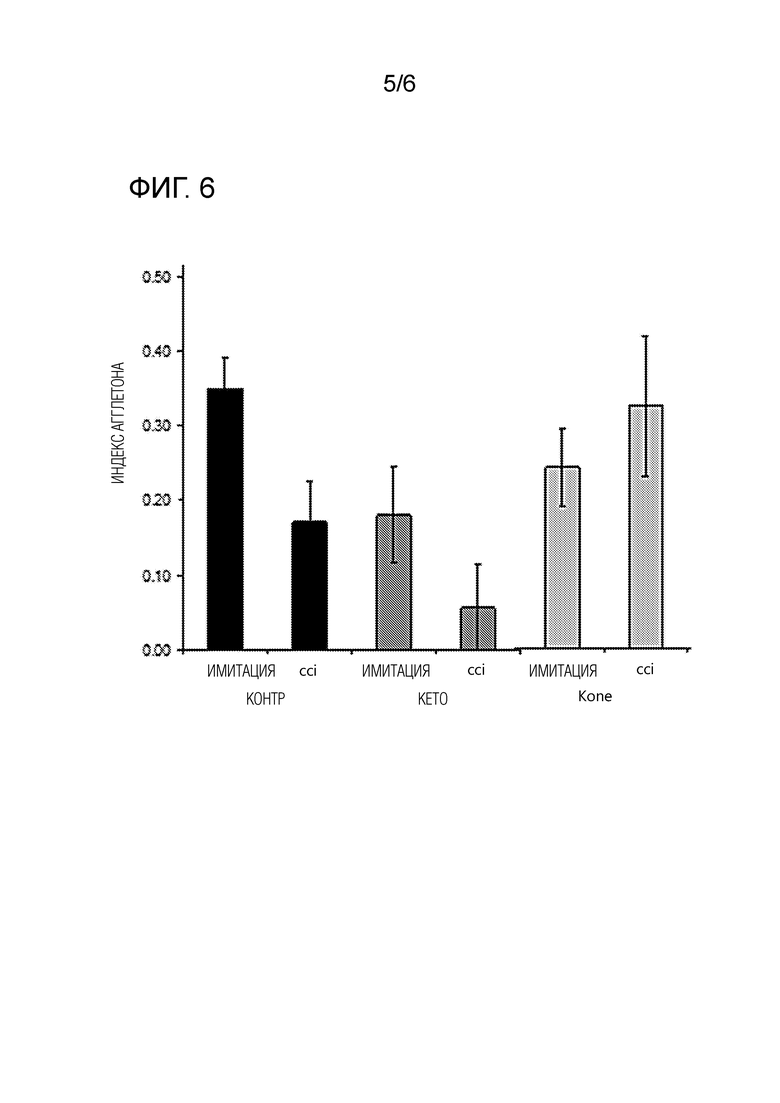
На фиг. 5 показаны результаты теста распознавания нового объекта в эксперименте 2, который проводили в 6 различных группах мышей C57Bl6. Мышей сначала делили на краниотомию (имитация) и мышей, которые подверглись ЧМТ (CCI), и после вмешательства распределяли на следующие группы по диетам 1) контрольная диета (контроль), 2) кетогенная диета, включающая 73 масс% липидов (кето) или 3) модифицированная кетогенная диета по изобретению (Kone). Контрольное лечение не улучшало распознавание нового объекта, тогда как проведение CCI вызывало множественные нарушения в исследуемом поведении, которые существенно уменьшались в группе CCI, получавшей Kone (CCI-Kone). Различия между группами тестировали с помощью одностороннего ANOVA *P<0,05.
На фиг. 6 показано для животных эксперимента 2, что вмешательство CCI приводило к нарушению исследовательского поведения и пространственного распознавания у мышей, эффекту, который уменьшался при лечении Kone в группе CCI-Kone.
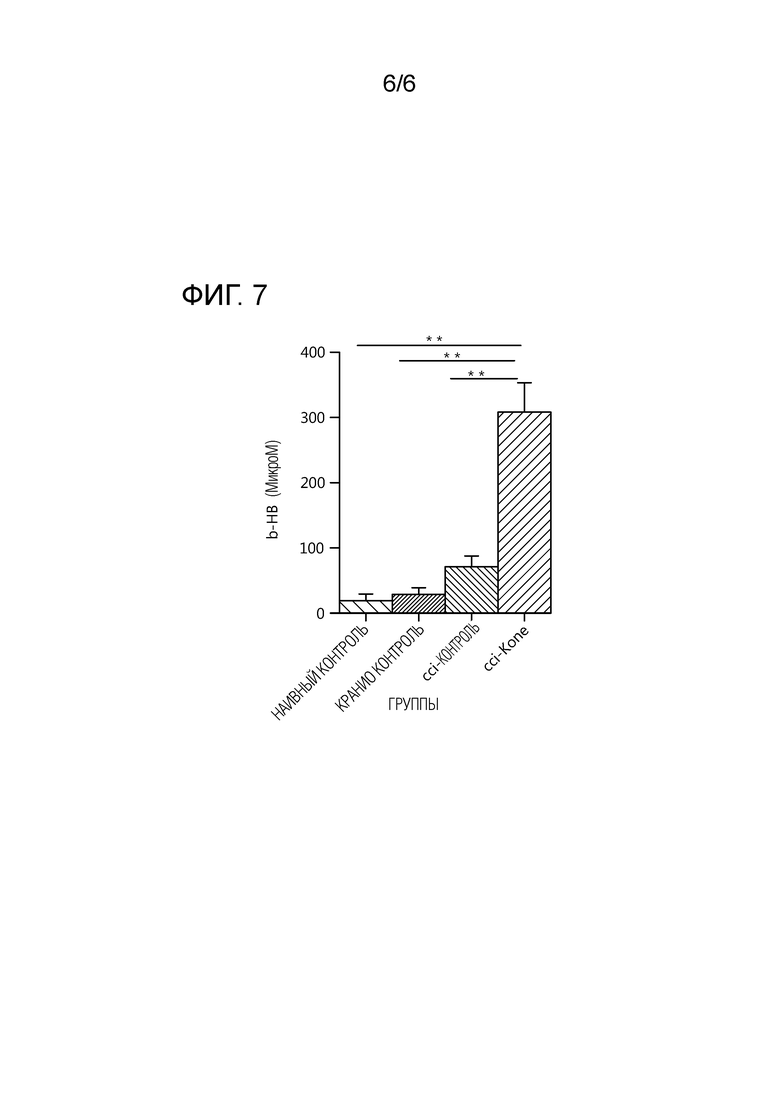
На фиг. 7 нанесены уровни в плазме бета-гидроксибутирата (b-HB), которые были более высокими в группе CCI-Kone по сравнению с другими группами (наивный контроль, кранио-контроль и CCI-контроль): ** p < 0,01.
Список предпочтительных вариантов осуществления изобретения
1. Энтеральная питательная композиция, включающая (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества:
- (i) DHA и необязательно EPA, и
- (ii) среднецепочечные триглицериды, предпочтительно по меньшей мере 2 масс% C8 и C10 средней цепи на основании массы жирных кислот;
и где композиция имеет кетогенное массовое соотношение от 1,4:1 до 3:1,
для применения в лечении травматического повреждения головного мозга (ЧМТ).
2. Энтеральная питательная композиция для применения в соответствии с вариантом 1, где гликемический индекс композиции ниже 69, предпочтительно ниже 65.
3. Энтеральная питательная композиция для применения в соответствии с вариантами 1 или 2, где (c) белковая фракция имеет содержание аминокислот с разветвленной цепью предпочтительно включающих по меньшей мере 10 масс% свободного лейцина на основании массы белковой фракции.
4. Энтеральная питательная композиция для применения по любому из предшествующих вариантов, включающая менее чем 2 масс% ALA на основании массы жирных кислот.
5. Энтеральная питательная композиция для применения по предшествующим вариантам, где лечение ЧМТ включает увеличение скорости восстановления после ЧМТ.
6. Энтеральная питательная композиция для применения по предшествующим вариантам, где лечение ЧМТ включает улучшение сенсомоторного восстановления после ЧМТ.
7. Энтеральная питательная композиция для применения по предшествующим вариантам, где лечение ЧМТ включает улучшение когнитивного восстановления после TBI.
8. Энтеральная питательная композиция для применения по предшествующим вариантам, где лечение ЧМТ включает улучшение пространственной памяти после ЧМТ.
9. Энтеральная питательная композиция для применения по предшествующим вариантам, где композиция является зондовым питанием.
10. Применение энтеральной питательной композиции, включающей (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества (i) DHA и необязательно EPA, (ii) среднецепочечные триглицериды, предпочтительно по меньшей мере 2 масс% C8 и C10 среднецепочечных триглицеридов на основании массы жирных кислот, и где композиция имеет кетогенное массовое соотношение от 1,4:1 до 3,0:1, в получении продукта для лечения ЧМТ.
11. Способ лечения травматического повреждения головного мозга (ЧМТ), включающий введение энтеральной питательной композиции, включающей (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества (i) DHA и необязательно EPA, и (ii) среднецепочечные триглицериды, предпочтительно по меньшей мере 2 масс% C8 и C10 среднецепочечных триглицеридов на основании массы жирных кислот, и где композиция имеет кетогенное массовое соотношение от 1,4:1 до 3,0:1.
12. Энтеральная питательная композиция, включающая (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает:
- (i) DHA и необязательно EPA, и
- (ii) среднецепочечные триглицериды, предпочтительно по меньшей мере 2 масс% C8 и C10 среднецепочечных триглицеридов на основании массы жирных кислот,
и где композиция (d) имеет кетогенное массовое соотношение от 1,4:1 до 3,0:1.
13. Энтеральная питательная композиция по варианту 12, где гликемический индекс композиции ниже 69, предпочтительно ниже 65.
14. Энтеральная питательная композиция по вариантам 12 или 13, где (c) белковая фракция имеет содержание аминокислот с разветвленной цепью предпочтительно включая по меньшей мере 10 масс% свободного лейцина на основании массы белковой фракции.
15. Энтеральная питательная композиция по любому из вариантов 12-14, включающая менее чем 2 масс % ALA на основании массы жирных кислот.
Описание вариантов осуществления изобретения
Авторы изобретения обнаружили, что композиция по изобретению является эффективной в лечении ЧМТ и улучшает восстановление после ЧМТ и нейроповеденческие симптомы, ассоциированные с ней.
Способ и применение по изобретению включает введение композиции, как описано ниже, млекопитающему, нуждающемуся в этом, предпочтительно человеку, нуждающемуся в этом, страдающему от ЧМТ или страдающему от когнитивного и/или сенсомоторного повреждения, вторичного по отношению к ЧМТ.
В предпочтительном аспекте композицию по изобретению вводят по меньшей мере вскоре после диагностики ЧМТ, предпочтительно начиная в течение 2 часов после постановки диагноза ЧМТ. В предпочтительном аспекте введение или применение композиции предписывается в течение по меньшей мере 5 дней, более предпочтительно по меньшей мере 7 дней еще более предпочтительно по меньшей мере 14, наиболее предпочтительно по меньшей мере 1 месяц, особенно по меньшей мере 3 месяцев.
В одном варианте осуществления изобретения композицию используют в качестве единственного питания. В предпочтительном варианте осуществления изобретения композиция обеспечивает от 10% до 30% суточного энергопотребления, более предпочтительно от 15% до 25%.
В одном предпочтительном варианте осуществления изобретения пациент, страдающий от ЧМТ или восстанавливающийся после ЧМТ, имеет кетостатус или состояние кетоза. В одном аспекте изобретения композиция может быть использована как часть кетогенной диеты.
В одном аспекте изобретение относится к композиции, как описано ниже, для применения в профилактике и/или лечении состояний, характеризуемых нарушенной функцией головного мозга в результате индуцированной ЧМТ дисфункции головного мозга, т.е. у пациента, страдающего от или восстанавливающегося после ЧМТ.
В одном аспекте изобретение относится к композиции, как описано ниже, для применения в профилактике и/или лечении сенсомоторных нарушений и/или когнитивных нарушений у пациента, страдающего от последствий ЧМТ или восстанавливающегося после ЧМТ.
Альтернативно, изобретение относится к применению композиции, как описано ниже, в получении композиции для лечения ЧМТ и когнитивных и/или сенсомоторных симптомов после ЧМТ.
В одном аспекте изобретение включает энтеральную питательную композицию, включающую (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества:(i) DHA и необязательно EPA, и (ii) среднецепочечные триглицериды, предпочтительно по меньшей мере 2 масс% C8 и C10 средней цепи на основании массы жирных кислот; и где композиция имеет кетогенное массовое соотношение от 1,4:1 до 3:1, для применения в лечении травматического повреждения головного мозга (ЧМТ). В одном аспекте изобретение включает композицию, включающую терапевтически эффективные количества (i) докозагексаеновой кислоты (22:6; DHA) и необязательно эйкозапентаеновой кислоты (20:5; EPA), и (ii) среднецепочечные триглицериды (MCT), предпочтительно по меньшей мере 2 масс% C8 и C10 MCT на основании массы жирных кислот, и (iii) LA и ALA предпочтительно в массовом соотношении в диапазоне от 8:1 до 12:1; (b) белковую фракцию, включающую по меньшей мере 10 масс% свободного лейцина на основании массы белковой фракции и (c) фракцию перевариваемых углеводов, включающих углеводы с низким гликемическим индексом, предпочтительно, галактозу и изомальтозу; и где (d) указанная питательная композиция имеет кетогенное соотношение от 1,4:1 до 3:1.
На всем протяжении заявки следующая терминология и сокращения могут быть использованы:
Среднецепочечные триглицериды (MCT) представляют собой тип жира, обнаруживаемого в небольшом количестве пищевых продуктов, таких как кокосовое масло и пальмоядровое масло. MCT определяют как линейные или разветвленные, предпочтительно линейные, насыщенные карбоновые кислоты, имеющие шесть (C6:0), семь (C7:0), восемь (C8:0), девять (C9:0), десять (C10:0), одиннадцать (C11:0) или двенадцать (C12:0) атомов углерода.
Классическая кетогенная диета включает количество липидов (по массе), которое обычно составляет 4-крат от массы суммы белков и перевариваемых углеводов. В контексте изобретения так называемое кетогенное (массовое) соотношение представляет собой массовое соотношение количества липида к комбинированным массовым количествам белка и перевариваемых углеводов в композиции. Композиция по изобретения предпочтительно характеризуется массовым соотношением от 1,4:1 до 3:1, более предпочтительно от 1,6:1 до 2.9:1, более предпочтительно от 1,8:1 до 2,7:1, более предпочтительно от 1,8:1 до 2,5:1, наиболее предпочтительно от 2:1 до 2,5:1. В предпочтительном варианте осуществления изобретения диета по изобретению имеет кетогенное массовое соотношение около 2,3:1. С вышеупомянутыми (под)диапазонами кетогенных соотношений по изобретению композиция по изобретению предпочтительно включает содержание липидов, которое составляет по меньшей мере в два раза содержания углеводов по массе.
Гликемический индекс (ГИ) продукта варьируется от 0-100 постпрандиального эффекта на уровень глюкозы крови. Стандартом для балла 100 является чистая глюкоза. По шкале 1-100, баллы пищевой композиции обычно расцениваются специалистом в области техники как низкие и баллы от 59 до 56 умеренные.
Травматическое повреждение головного мозга относится к повреждению головного мозга в результате внешней механической силы. ЧМТ может возникать в результате падений, огнестрельных ран, спортивных травм, несчастных случаев на строительстве и автомобильных аварий, среди других причин. Как очевидно, травматическое повреждение головного мозга является наиболее преобладающим повреждением солдат в сражениях (например, среди Американских войск в Ираке и Афганистане). Жертвы ЧМТ могут страдать от ряда физических, когнитивных, социальных, эмоциональных и/или поведенческих расстройств после повреждения. Основное воздействие происходит в результате непосредственной потери нервных клеток, преимущественно представляющей собой некротическую смерть, за которой обычно следует волна вторичных повреждающих каскадов, включая эксайтотоксичность, окислительный стресс, митохондриальную дисфункцию, нарушение гематоэнцефалического барьера и воспаление. В соответствии с диагностическими критериями, описанными в “Diagnostic and Statistical Manual of Mental Disorders (DSM-5), ЧМТ имеет одну или более из следующих характеристик: изменение уровня сознания; нарушение памяти; дезориентация, ассоциированная с нарушениями ориентации; неврологические признаки, такие как повреждение головного мозга, наблюдаемое при нейровизуализации, развитие или ухудшение эпилепсии, дефицит полей зрения и гемипарез.
На поведенческом уровне выжившие после ЧМТ имеют большой диапазон нарушений; сенсомоторные нарушения являются обычным последствием такого повреждения, включая элементы пареза, постуральной неустойчивости, нарушение походки и раннее острое нарушение стартл-рефлекса. Такие сенсомоторные нарушения после ЧМТ могут быть оценены с использованием модифицированной неврологической шкалы тяжести (mNSS), Rotarod и анализа походки, как дополнительно объясняется ниже.
ЧМТ также часто приводит к дефицитам когнитивных доменов, таких как память, внимание и скорость обработки информации. Пространственная память после ЧМТ может быть оценена у мышей с использованием водного лабиринта Морриса (MWM), изменения памяти оценивают посредством распознавания визуального объекта, память с использованием теста распознавания нового объекта. Пространственная память и распознавание могут быть оценены с использованием изменений Y лабиринта. Кроме того, выжившие после ЧМТ часто имеют отсроченное развитие повышенной тревожности, возбуждения и также растормаживания поведения. Поведенческое ингибирование и тревожность оценивали с использованием приподнятого циркулярного лабиринта с частичными стенками у мышей.
Модифицированная оценка неврологической тяжести (mNSS) представляет собой протокол, используемый для оценки двигательной способности, баланса и настороженности в эксперименте. Вмешательство с композицией по изобретению приводило к улучшенной моторной активности, балансу и настороженности после ЧМТ. В одном аспекте изобретения лечение ЧМТ включает лечение и/или улучшение сенсомоторных нарушений после ЧМТ. Сенсомоторное восстановление представляет собой способность чувствовать движения, прикосновение и положение тела или конечностей и создавать адаптивные, планируемые координированные движения.
Водный лабиринт Морриса (MWM) представляет собой поведенческий тест, используемый для оценки обучения и пространственной памяти грызунов, которые должны обнаружить погруженную платформу с использованием дистальных стимулов. Было обнаружено, что обучение и пространственная память поражаются в случае ЧМТ. В одном аспекте изобретения лечение композицией по изобретению в модели ЧМТ приводит к улучшенному прохождению MWM. В другом варианте осуществления изобретения вмешательство с терапевтическими уровнями композиции по изобретению приводило к улучшенному обучению и пространственной памяти у пациента, страдающего от ЧМТ.
Тест распознавания нового объекта основан на врожденной склонности грызунов исследовать новые объекты в их окружении, и относится к оценке памяти распознавания. Успешное распознавание проявлялось исследованием нового объекта. Тогда как память распознавания нарушена у мышей после ЧМТ, вмешательство с помощью композиции по изобретению приводило к улучшенным результатам теста NOR и улучшенному распознаванию. В одном аспекте изобретения лечение терапевтическими уровнями композиции по изобретению приводит к улучшению памяти распознавания у пациентов, страдающих от ЧМТ.
Изменения в Y лабиринте представляют собой поведенческий тест для оценки желания грызунов изучать новое окружение. Грызуны обычно предпочитают исследовать новое ответвление лабиринта, скорее, чем возвращаться в таковое, ранее посещенное. Вмешательство с помощью композиции по изобретению приводило к улучшению изучающего поведения мышей. В одном аспекте изобретения лечение терапевтической дозой композиции по изобретению проводит к улучшению пространственной памяти и пространственного распознавания у пациентов, страдающих от ЧМТ.
Тест Catwalk проводили с использованием системы CatWalk, представляющей собой чувствительное средство для анализа походки, которое способно распознавать небольшой моторный дефицит у животного способом, независимым от наблюдателя. Вмешательство с помощью композиции по изобретению приводило к значительным улучшениям нарушений походки после ЧМТ.
Настоящее изобретение обеспечивает способ лечения травматического повреждения головного мозга у млекопитающего посредством введения терапевтически эффективного количества питательной композиции млекопитающему в течение терапевтически эффективного временного периода после повреждения так, чтобы уменьшить вторичное повреждение головного мозга у млекопитающего и лечить травматическое повреждение головного мозга у указанного млекопитающего.
В одном аспекте изобретения лечение включает улучшение скорости восстановления после ЧМТ.
В одном варианте осуществления изобретения способ лечения ЧМТ улучшает неврологические функции и функции головного мозга после ЧМТ. В дополнительном варианте осуществления изобретения настоящий способ, продукт, применение или композиция улучшают восстановление после ЧМТ.
В одном варианте осуществления изобретения лечение улучшает одно или более сенсомоторное восстановление после ЧМТ, когнитивное восстановление после ЧМТ, поведение после ЧМТ и пространственную память после ЧМТ.
В одном аспекте изобретения лечение улучшает сенсомоторное восстановление после ЧМТ.
В одном аспекте изобретения лечение улучшает когнитивное восстановление после ЧМТ.
В одном аспекте изобретения лечение улучшает поведенческие характеристики после ЧМТ.
В дополнительном аспекте изобретения лечение улучшает пространственную память после ЧМТ.
В дополнительном варианте осуществления настоящего метода продукт, применение или композиция для применения обеспечивают образование кетоновых тел, в частности ацетоацетата, бета-гидроксибутирата и ацетона, где уровень кетоновых тел в плазме достаточен для обеспечения терапевтического эффекта у пациентов, страдающих от ЧМТ. В предпочтительном варианте осуществления изобретения концентрация в плазме суммы всех кетоновых тел не превышает 5 мM. Концентрации в плазме бета-гидроксибутирата предпочтительно выше чем 200 мкM, более предпочтительно выше чем 250 мкM.
В одном аспекте изобретения композиция предназначена в качестве полноценного питания, в одном варианте осуществления изобретения в качестве зондового питания.
В одном аспекте изобретения настоящий способ, продукт, применение композиции для применения предназначены для применения в качестве энтеральной композиции, предпочтительно для перорального введения. В одном аспекте композиция может находиться в жидкой форме, в форме напитка.
В одном варианте осуществления изобретения настоящий способ, продукт, применение или композиция для применения обеспечивают дополнение кетоновых тел и их предшественников не вызывая кетоз. В одном аспекте изобретения способ, продукт, применение или композиция для применения предназначены для применения в качестве пищевой добавки один раз в сутки, два раза в сутки или три раза в сутки.
Дополнительные подробности композиции по изобретению обеспечены в настоящем описании ниже. Делается ли ссылка на композицию по изобретению или только композицию, это в равной степени относится к комбинации и продукту по изобретению, а также к их применению в композиции для применения по изобретению, применении по изобретению и способе по изобретению. Сходным образом ссылки на способ по изобретению в равной степени применяются к композиции для применения и применению к композиции для применения и применению по изобретению и наоборот.
Продукт, композиция или комбинация обычно представляет собой энтеральную композицию, т.е. предпочтительно предназначенную для перорального введения. Его предпочтительно вводят в жидкой форме. Предпочтительно композиция включает воду, в которой дополнительные компоненты растворены или суспендированы. В предпочтительном варианте осуществления изобретения энтеральную композицию по изобретению легко вводить через зонд, т.е. она имеет низкую вязкость и низкую плотность, ее рН нейтральный, имеет хорошую стабильность при хранении и не разрушается, не аггломерирует и не осаждается. Предпочтительно энтеральная композиция по изобретению обеспечивает полную питательную композицию.
В одном варианте осуществления изобретения (d) кетогенное соотношение продукта, композиции или комбинации по изобретению предпочтительно характеризуется кетогенным соотношением от 1,4:1 до 3:1, более предпочтительно от 1,6:1 до 2,9:1, более предпочтительно от 1,8:1 до 2,7:1, более предпочтительно от 1,8:1 до 2,5:1, наиболее предпочтительно от 2:1 до 2,5:1. В предпочтительном варианте осуществления изобретения диета по изобретению обеспечивает кетогенное массовое соотношение около 2.3:1. В рамках вышеупомянутых (суб)диапазонов кетогенных соотношений по изобретению, композиция по изобретению предпочтительно включает содержание липидов, которое по меньшей мере в два раза выше содержания перевариваемых углеводов по массе. В одном варианте осуществления изобретения способ лечения ЧМТ включает пероральное введение продукта, композиции или комбинации, включающей липидную фракцию, млекопитающему, нуждающемуся в этом.
Липидная фракция
Подходящие источники липидов для обеспечения липидной фракции (a) по изобретению представляют собой пищевые ингредиенты, например, таковые, полученные из яиц, молока, овощей или растительных материалов, морских организмов, как рыба или водоросли, натуральные или мутированные организмы или липиды, полученные модификацией натуральных липидов, обработанных липидов из таких источников, такие как экстракты, изоляты, межэстерифицированные липиды и подобные, синтетические соединения или их комбинации.
В одном варианте осуществления изобретения липидная фракция предпочтительно составляет до 85% общего количества калорий композиции, комбинации или продукта по изобретению, более предпочтительно до 80% общего количества калорий, более предпочтительно до 75% калорий, более предпочтительно до 70% калорий, предпочтительно до 65% калорий. В одном варианте осуществления изобретения липидная фракция предпочтительно обеспечивает от 55 до 85% калорий, более предпочтительно от 55 до 80% калорий, более предпочтительно от 55 до 75% калорий, еще более предпочтительно от 55 до 70% калорий. Остаток калорий обычно обеспечивают перевариваемыми углеводами и белками. Это основано на допущении, что липиды, углеводы и белки дают приблизительно 9, 4 и 4 ккал/г, соответственно, 3 вместе составляя всю калорийность композиции.
ω-3 LC-PUFA
Способ, продукт, композиция или комбинация по изобретению предпочтительно включает терапевтически эффективные количества (i) по меньшей мере одной омега-3 длинноцепочечной полиненасыщенной жирной кислоты (LC-PUFA; имеющей длину цепи 18 и более атомов углерода), выбираемой из группы, состоящей из докозагексаеновой кислоты (22:6, n-3; DHA), и эйкозапентаеновой кислоты (20:5 n-3; EPA). Предпочтительно настоящая композиция, продукт или комбинация включает по меньшей мере DHA.
LCPUFA предпочтительно обеспечивают в виде триглицеридов, диглицеридов, моноглицеридов, свободных жирных кислот или их солей или сложных эфиров, фосфолипидов, лизофосфолипидов, эфиров глицерина, липопротеинов, церамидов, гликолипидов или их комбинаций. Предпочтительно настоящий продукт, композиция или комбинация включают по меньшей мере DHA в форме триглицерида. Подходящие источники ω-3 LCPUFA и/или DHA включают масло тунца, (другой) рыбий жир, DHA-обогащенные алкильные эфиры, масло водорослей, яичный желток или фосфолипиды, обогащенные ω-3 LCPUFA например, фосфатидилсерин-DHA. Предпочтительно, продукт, композиция или комбинация по изобретению включает рыбий жир, обеспечивающий омега-3 LCPUFA. Другим особенно подходящим источником омега-3 LCPUFA является масло водорослей.
В отношении продукта, композиции, комбинации или способа доля ω-3 LCPUFA (по меньшей мере DHA, предпочтительно DHA и EPA) всех жирных кислот в способе, продукте или композиции составляет предпочтительно 1-40%, более предпочтительно 1-30 масс%, более предпочтительно 1-15 масс%, более предпочтительно 1-10 масс%, еще более предпочтительно 1-6 масс%, наиболее предпочтительно 1-3 масс% всей липидной фракции. В предпочтительном варианте осуществления изобретения количество длинноцепочечных полиненасыщенных жирных кислот, также имеющих количество углеродов более чем 20 составляет по меньшей мере 2 г на 100 г жирных кислот, предпочтительно 3-50 г на 100 г жирных кислот, более предпочтительно 4-35 г на 100 г жирных кислот, наиболее предпочтительно 5-20 г на 100 г жирных кислот.
В отношении суточной дозировки, настоящий способ предпочтительно включает введение 400-5000 мг DHA+EPA в сутки, более предпочтительно 500-4500 мг DHA+EPA в сутки, еще более предпочтительно 1000-4000 мг DHA+EPA в сутки, наиболее предпочтительно 1500-3000 мг в сутки. DHA предпочтительно вводят в количестве 200-4500 мг в сутки, более предпочтительно 500-4000 мг в сутки, наиболее предпочтительно 750-3250 мг в сутки. EPA предпочтительно вводят в количестве 200-4500 мг в сутки, более предпочтительно 500-4000 мг в сутки, наиболее предпочтительно 750-3250 мг в сутки.
ALA
Предпочтительно, чтобы содержание альфа-линоленовой кислоты [18:3n-3, ALA] в композиции поддерживалось на низком уровне. Тогда как продукты, используемые в лечении болезни Альцгеймера, упоминают ‘нормальный’ уровень ALA или выше, чем 3 масс% всей фракции жирных кислот, т.е. около 5 масс%, обнаружено, что концентрация ALA предпочтительно поддерживается на уровне менее чем 2,0 масс%, более предпочтительно менее 1,5 масс%, особенно ниже 1,0 масс%, рассчитанные по массе всех жирных кислот. Предпочтительно, чтобы композиция включала по меньшей мере 0,5 масс% ALA, рассчитанное по массе жирных кислот. В исследованиях на животных, указанных в примерах, уровни составляют около 1,5 г на 100 г жирных кислот.
В одном варианте осуществления изобретения концентрация линолевой кислоты [18:2n-6, LA] также существенно снижается до количества < 15 г/100 г жирных кислот и даже менее чем 10 масс%. Концентрации LA предпочтительно составляют по меньшей мере 1 масс% жирных кислот.
Массовые соотношения LA:ALA предпочтительно находятся в диапазоне от 4:1 до 15:1, более предпочтительно от 7:1 до 12:1, еще более предпочтительно от 8:1 до 12:1, наиболее предпочтительно от 8.5:1 до 10:1.
В одном варианте осуществления изобретения массовое соотношение ω-3/ω-6 в композиции по изобретению находится предпочтительно в диапазоне от 0,3:1 до 7:1, предпочтительно в диапазоне от 1,4:1 до 5,9:1, более предпочтительно в диапазоне от 3:1 до 5,5:1, наиболее предпочтительно от 3:1 до 5:1, в частности менее чем 5:1. Количество ω-6 LCPUFA предпочтительно составляет менее чем 50 масс%, предпочтительно от 5 до 40 масс%, более предпочтительно от 8 до 30 масс% жирных кислоты в композиции.
Среднецепочечные триглицериды (MCT)
Предпочтительно, чтобы композиция, комбинация или продукт по изобретению включал (ii) MCT. MCT дают больше кетонов, чем обычный жир (который состоит главным образом из LCT), включение больших количеств MCT в диету позволяет пациентам оставаться в кетозе, потребляя относительно большие количества белка и углеводов. MCT конвертируются в печени в бета-гидроксибутират и ацетоацетат и, следовательно, легко доступны для кетолиза в головном мозге. В одном варианте осуществления изобретения композиция содержит по меньшей мере 1,0 масс%, предпочтительно по меньшей мере 1,5 масс%, более предпочтительно по меньшей мере 2,0 масс% жирных кислот из менее чем 14 атомов углерода. В предпочтительном варианте осуществления изобретения фракция MCT включает по меньшей мере 2 масс%, более предпочтительно по меньшей мере 2,5 масс% C8:0 (каприловая или октаноевая кислота) и C10:0 (капровая или деканоевая кислота) MCT на основании общего количества жирных кислот, более предпочтительно по меньшей мере 3,0 масс%, более предпочтительно по меньшей мере 3,5 масс% еще более предпочтительно по меньшей мере 4,0%. В дополнительном предпочтительном варианте осуществления изобретения фракция MCT включает по меньшей мере 5 масс% C8 и C10 и C12 (лауриновая или додекаеновая кислота) MCT на основании количества жирных кислот, более предпочтительно по меньшей мере 5,5 масс%, более предпочтительно по меньшей мере 6 масс% и еще более предпочтительно по меньшей мере 6,5 масс%, наиболее предпочтительно 7 масс% на основании количества жирных кислот. Композиция по изобретению предпочтительно включает от 1 до 10 масс% MCT, предпочтительно композиция включает 5-10 масс% MCT на основании массы жирных кислот. В одном варианте осуществления изобретения сумма массы среднецепочечных жирных кислот C6:0+C7:0+C8:0 выше суммы по массе C9:0 и C10:0 и составляет менее чем 2:1, более предпочтительно менее чем 1,8:1, более предпочтительно менее чем 1,6:1, еще более предпочтительно менее чем 1.4:1.
Насыщенные жирные кислоты
В одном варианте осуществления изобретения количество насыщенных жирных кислот (SFA), имеющих длину углеродов от 10 до 24, составляет менее чем 50 г на 100 г жирных кислот, предпочтительно 5-45 г на 100 г жирных кислоты, более предпочтительно от 5 до 30 г на 100 г жирных кислот и наиболее предпочтительно 5-15 г на 100 г жирных кислот. В предпочтительном варианте осуществления изобретения фракция насыщенных жирных кислот обогащена пальмитиновой кислотой (C16:0), где ‘обогащенная’ определяют как образующая более чем 30 мас% фракции SFA. В предпочтительном варианте осуществления изобретения фракция SFA включает по меньшей мере 50 масс% пальмитиновой кислоты на основании фракции SFA, более предпочтительно по меньшей мере 65%, еще более предпочтительно по меньшей мере 70 масс% фракции SFA. В одном варианте осуществления изобретения жирные кислоты фракции SFA образуют по меньшей мере 40 масс% общей фракции липидов, предпочтительно по меньшей мере 45 масс%, еще более предпочтительно по меньшей мере 50 масс%. В дополнительном варианте осуществления изобретения фракция SFA образует по меньшей мере 20 масс%, более предпочтительно по меньшей мере 25 масс% питательной композиции. В одном варианте осуществления изобретения количество C16:0 и C18:0 жирных кислот составляет от 50 до 85 масс% фракции SFA, предпочтительно от 60 до 80 масс%, еще более предпочтительно от 70 до 75 масс%.
В одном варианте осуществления изобретения количество мононенасыщенных жирных кислот (MUFA) составляет от 30 до 65 г на 100 г жирных кислот. В предпочтительном варианте осуществления изобретения липидная фракция включает олеиновую кислоту. Иными словами фракция MUFA предпочтительно включает или даже является олеиновой кислотой.
Фосфолипиды
Настоящая композиция предпочтительно включает по меньшей мере один фосфолипид в количестве от 0,01 до 1 грамма на 100 мл, более предпочтительно от 0,05 до 0,5 грамм на 100 мл, наиболее предпочтительно от 80 до 600 мг на 100 мл. В одном варианте осуществления изобретения композиция включает 0,01-10 масс%, предпочтительно 0,1-8 масс% фосфолипидов, более предпочтительно 1-6 масс% фосфолипидов, на основании общей массы липидов. Фракция фосфолипидов предпочтительно по меньшей мере частично, более предпочтительно полностью, представлена лецитином, предпочтительно соевым лецитином. Следовательно, предпочтительно, чтобы композиция включала лецитин, предпочтительно соевый лецитин в количестве для обеспечения вышеупомянутого содержания фосфолипидов.
Белковая фракция
Композиция включает белковую фракцию (c). Белок включает все белковоподобные материалы, включая интактный и (частично) гидролизованный белок, пептиды и аминокислоты. Любой источник белка, подходящий для использования в питательной композиции, может включаться в композицию по изобретению. Предпочтительные источники белка включают молочные белки, такие как сыворотка, казеин, растения (бобы, сою, люпин, амарант, картофель, семена, зерновые и др.), рыбу, креветки, животные белковоподобные материалы, яйца и грибы. Предпочтительно, чтобы белковая фракция включала белок из по меньшей мере 2 источников.
В предпочтительном варианте осуществления изобретения белковая фракция включает казеин и/или сыворотку, предпочтительно казеин. В одном варианте осуществления изобретения белковая фракция включает от 50 до 95 масс% казеина и/или сыворотки, предпочтительно казеина.
В одном варианте осуществления изобретения белковая фракция предпочтительно обеспечивает до 25% общего количества калорий композиции на основании суммы белков и аминокислот в белковой фракции, более предпочтительно до 15% общего количества калорий, более предпочтительно до 11% калорий, более предпочтительно до 10% калорий, еще более предпочтительно до 8% калорий. В предпочтительном варианте осуществления изобретения белковая фракция обеспечивает от 8 до 25% калорий композиции, более предпочтительно от 9 до 15% калорий, более предпочтительно от 10 до 12% калорий.
В предпочтительном варианте осуществления изобретения белковая фракция присутствует в массовом количестве по меньшей мере 15 масс% композиции, предпочтительно по меньшей мере 16-25 масс% композиции, более предпочтительно 17-21 масс% композиции.
В одном варианте осуществления изобретения белковая фракция включает свободные аминокислоты с разветвленной цепью, такие как валин, лейцин и изолейцин. В более предпочтительном варианте осуществления изобретения белковая фракция включает аминокислоту с разветвленной цепью лейцин в свободной форме. Белковая фракция предпочтительно включает по меньшей мере 15 масс% указанных аминокислот с разветвленной цепью, более предпочтительно от 15 до 35 масс%, еще более предпочтительно от 16 до 30 масс%, особенно 17-25 масс%, на основании общего содержания белка. Такие аминокислоты предпочтительно обеспечивают в свободной форме. Предпочтительно белковая фракция включает по меньшей мере 10 г аминокислот с разветвленной цепью на 100 г белковой фракции, предпочтительно по меньшей мере 15 г аминокислот с разветвленной цепью на 100 г белковой фракции, предпочтительно 15-35 г аминокислот с разветвленной цепью на 100 г белковой фракции, более предпочтительно по меньшей мере 20 г аминокислот с разветвленной цепью на 100 г белковой фракции, еще более предпочтительно по меньшей мере 25 г аминокислот с разветвленной цепью на 100 г белковой фракции. В одном варианте осуществления изобретения белковая фракция включает до 30 г аминокислот с разветвленной цепью на 100 г белковой фракции. Предпочтительно аминокислоты с разветвленной цепью находятся в свободной форме, т.е. не часть белковой или пептидной последовательности. Предпочтительно аминокислоты с разветвленной цепью включают по меньшей мере лейцин в его свободной форме. На 100 г белка количество свободного лейцина обычно составляет от 5 до 15 г, еще более предпочтительно количество лейцина составляет от 10 до 15 г в свободной форме. В одном варианте осуществления изобретения общее количество L-лейцина, обеспеченного в белковой фракции, предпочтительно составляет до по меньшей мере 7 масс%, предпочтительно по меньшей мере 8 масс%, более предпочтительно 9-20 масс% на основании общей фракции белка. В контексте изобретения термины ‘лейцин’ и ‘L-лейцин’ используются взаимозаменяемо. В одном варианте осуществления изобретения количество свободного лейцина к общему количеству лейцина в белковой фракции составляет от 1:15 до 1:1, более предпочтительно от 1:10 до 1:2.
В одном варианте осуществления изобретения предпочтительно, чтобы белковая фракция включала относительно большое количество кетогенных аминокислот, таких как лизин и лейцин, которые могут быть преобразованы в кетоновые тела, и относительно низкое количество глюкогенных аминокислот, которые могут быть метаболически преобразованы в глюкозу посредством глюконеогенеза, таких как глютамин, глютамат, аланин, глицин и серин. В одном варианте осуществления изобретения массовое соотношение [лизин+лейцин] к [глютамат+глютамин+аланин+глицин+серин] составляет предпочтительно по меньшей мере 0,5, например в диапазоне от 0,5 до 10. Считают, что высокое соотношение кетогенных аминокислот к сумме глюкогенных аминокислот помогает поддерживать кетогенный характер композиции, комбинации или продукта по изобретению.
Фракция углеводов
Композиция по изобретению включает фракцию углеводов (b), предпочтительно настоящая композиция включает перевариваемые углеводы. Композиция также может включать неперевариваемые углеводы или пищевые волокна или питательные волокна. В предпочтительном варианте осуществления изобретения фракция углеводов включает (целлюлозу и) фрукто-олигосахариды, в этом случае оба присутствуют предпочтительно в массовом соотношении от 2:1 до 1:2.
Перевариваемые углеводы
Обычно любые перевариваемые углеводы, которые известны в области техники как подходящие для применения в питательных композициях, могут быть использованы. Предпочтительно, перевариваемые углеводы выбирают из перевариваемых полисахаридов (например, крахмал, мальтодекстрин), перевариваемых моносахаридов (например, глюкоза, фруктоза, галактоза), и перевариваемых дисахаридов (например, лактоза, сахароза, изомальтоза). Предпочтительно, композиция включает перевариваемые углеводы, богатые одним или более из не-глюкозных и не-фруктозных сахаридов, таких как манноза, галактоза, ксилулоза, ксилоза, глюкозамин и сиаловая кислота. В предпочтительном варианте осуществления изобретения композиция по изобретению включает одним или более углеводов с низким гликемическим индексом, выбираемых из палатинозы, трегалозы, лактозы, галактозы и изомальтулозы. В предпочтительном варианте осуществления изобретения композиция, комбинация или продукт по изобретению включает галактозу и изомальтулозу. Углеводы с низким ГИ представляют собой углеводы, имеющие ГИ 55 или менее.
В предпочтительном варианте осуществления изобретения углеводная фракция композиции включает от около 70 до 100 масс% углеводов с низким гликемическим индексом, более предпочтительно от 80 до 95 масс%, более предпочтительно от 85 до 95 масс%.
Количество галактозы составляет предпочтительно от около 25 масс% до 45 масс% фракции углеводов, более предпочтительно от около 30 масс% до 40 масс% фракции углеводов и в еще более предпочтительном варианте осуществления изобретения от около 35 масс% до 40 масс% фракции углеводов. Количество изомальтулозы в одном варианте осуществления изобретения предпочтительно составляет от около 55 масс% до 75 масс% фракции углеводов.
Количество глюкозы или быстро перевариваемых полимеров глюкозы составляет предпочтительно менее 10 масс% фракции углеводов, более предпочтительно менее 5 масс% фракции углеводов, еще более предпочтительно менее 1 масс% фракции углеводов.
В одном варианте осуществления изобретения фракция перевариваемых углеводов предпочтительно обеспечивает до 5% общего количества калорий композиции, более предпочтительно до 8% общего количества калорий, более предпочтительно до 10% калорий, более предпочтительно до 15% калорий, еще более предпочтительно до 20% калорий. Фракция перевариваемых углеводов композиции обеспечивает по меньшей мере 1% калорий композиции, более предпочтительно по меньшей мере 2%.
В одном варианте осуществления изобретения гликемический индекс (ГИ) композиции составляет менее 70, предпочтительно менее 65, предпочтительно менее 60, более предпочтительно менее 55. В предпочтительном аспекте гликемический индекс составляет от 65 до 55, где гликемический индекс основан на глюкозе как контрольном значении, составляющем 100.
Витамины
В одном варианте осуществления изобретения настоящая комбинация включает по меньшей мере один комплекс витаминов B. Витамин В выбирают из группы витамина B1 (тиамин), витамина B2 (рибофлавин), витамина B3 (ниацин или ниацинамид), витамина B5 (пантотеновая кислота), витамина B6 (пиридоксин, пиридоксаль или пиридоксамин, или пиридоксина гидрохлорид), витамина B7 (биотин), витамина B9 (фолиевая кислота или фолат), и витамина B12 (различные кобаламины). Функциональные эквиваленты охватываются этими терминами.
В одном варианте осуществления изобретения по меньшей мере один витамин B выбирают из группы витамина B6, витамина B12 и витамина B9. Предпочтительно настоящая композиция включает по меньшей мере два, выбираемые из группы, состоящей из витамина B6, витамина B12 и витамина B9. В частности, хорошие результаты были достигнуты с комбинацией витаминов B, включающих или состоящих из витамина B6, витамина B12 и витамина B9. Витамин B, предпочтительно витамин B6, B9 и/или B12, необходимо вводить в терапевтически эффективной дозе.
При присутствии в питательной композиции или лекарственном препарате, витамин B6 предпочтительно присутствует в количестве для обеспечения суточной дозировки в диапазоне от 0,1 до 100 мг, в частности в диапазоне от 0,5 до 25 мг, более предпочтительно в диапазоне от 0,5 до 5 мг. Настоящая композиция предпочтительно включает 0,1-100 мг витамина B6 на 100 г (жидкого) продукта, более предпочтительно 0,5-5 мг витамина B6 на 100 г (жидкого) продукта, более предпочтительно 0,5-5 мг витамина B6 на 100 г (жидкого) продукта.
При присутствии в питательной композиции или лекарственном препарате витамин B12 предпочтительно присутствует в количестве для обеспечения суточной дозировки в диапазоне от 0,5 до 100 мкг, в частности в диапазоне от 1 до 10 мкг, более предпочтительно в диапазоне от 1,5 до 5 мкг. Настоящая композиция предпочтительно включает 0,5-100 мкг витамина B12 на 100 г (жидкого) продукта, более предпочтительно 1-10 мкг витамина B12 на 100 г (жидкого) продукта, более предпочтительно 1,5-5 мкг витамина B12 на 100 г (жидкого) продукта. Термин ‘витамин B12’ включает все эквиваленты кобаламина, известные в области техники.
При присутствии в питательной композиции или лекарственном препарате, витамин B9 (фолиевая кислота) предпочтительно присутствует в количестве для обеспечения суточной дозировки в диапазоне от 50 до 5000 мкг, в частности в диапазоне от 100 до 1000 мкг, более предпочтительно в диапазоне от 200 до 800 мкг. Настоящая композиция предпочтительно включает 50-5000 мкг фолиевой кислоты на 100 г (жидкого) продукта, более предпочтительно 100-1000 мкг фолиевой кислоты на 100 г (жидкого) продукта, более предпочтительно 200-800 мкг фолиевой кислоты на 100 г (жидкого) продукта. Фолаты включают фолиевую кислоту, фолиновую кислоту, метилированные, метенилированные и формилированные формы фолатов, их соли или эфиры, а также их производные с одной или более глютаминовой кислотой и все в восстановленной или окисленной форме.
Композиция по изобретению предпочтительно включает, если есть, менее чем 100 мг, более предпочтительно менее чем 50 мг, более предпочтительно менее чем 25 мг эквивалентов уридина, рассчитанных как уридин, на 100 г (жидкого) продукта. Альтернативно, способ применения по изобретению предпочтительно включает менее чем 50 мг, более предпочтительно менее чем 25 мг эквивалентов уридина, рассчитанных как уридин, на суточную дозу. В одном варианте осуществления изобретения нет определяемых количеств уридина и UMP.
Композиция по изобретению предпочтительно включает, если есть, менее чем 50 мг, более предпочтительно менее чем 25 мг эквивалентов холина, выбираемых из холина, соли холина и/или эфира холина, рассчитанного как холин, на 100 г (жидкого) продукта.
В одном варианте осуществления изобретения композиция рассматривается как не включающая уридин, монофосфат уридина (UMP) и холин.
В одном варианте осуществления изобретения композиция по изобретению не включает витамины B6, B9 и B12, витамины C и E, и селен за пределами руководств FSMP.
В одном варианте осуществления изобретения композиция, комбинация или продукт по изобретению включает на 100 грамм продукта 5-9 г белка, 0,8-4 г пищевых волокон, 1,2-1,8 г перевариваемых углеводов, имеющих значение гликемического индекса менее чем 70, 15-24 г липидов, включающих 3-20 масс% масла из продуктов моря, 10-30 масс% масел MCT и остаток липидной фракции, образованный из растительных масел, где соотношение липидов к сумме белков и перевариваемых углеводов составляет 1,4-3:1. В одном аспекте указанный продукт подходит для применения у пациента, страдающего от ЧМТ, где пациент имеет возраст 6 лет или старше.
В одном варианте осуществления изобретения продукт или композиция включает на 100 мл 1,3-1,9 г белка, где белковая фракция включает 10-15 г лейцина на 100 г белка, 0,6-1,0 г перевариваемых углеводов, имеющих значение гликемического индекса менее 65, 5-7 г липидов, где липидная фракция включает 5-50 масс% масла из продуктов моря, 4-30 масс% масла MCT и растительных масел, 0,4 до 4 г пищевых волокон, 0,3-0,5 г минералов, следовых элементов и витаминов, где массовое соотношение липидов к сумме белков и перевариваемых углеводов составляет 1,4:1-3:1. В одном аспекте, указанная композиция или продукт подходят для применения у пациента, страдающего от ЧМТ, где указанный пациент имеет возраст менее 6 лет.
Композиции, как описано выше, могут быть использованы в качестве питательной терапии, питательной поддержки, в качестве медицинского питания, в качестве питания для специальных медицинских целей или в качестве пищевой добавки. Такой продукт может потребляться в один, два или три приема пищи в сутки во время восстановления и/или реабилитации после травматического повреждения головного мозга. Обычный размер порции составляет 125 мл. Композиции, как описано выше, могут альтернативно быть использованы в качестве полноценного питания в качестве медицинского питания, в качестве питания для специфических медицинских целей или в качестве зондового питания.
Примеры
Для более полного понимания настоящего описания, сделаны ссылки на следующие примеры, принимаемые в сочетании с сопутствующими чертежами.
Пример 1 - Исследование нейропротективных эффектов в мышиной модели травматического повреждения головного мозга
Эффекты композиции, включающей липидную фракцию, включающую модифицированную кетогенную диету по изобретению, представленные в таблице 1, оценивали в экспериментальной модели травматического повреждения головного мозга. Использовали взрослых 10-12 недельных самцов мышей C57BL/6, весом 22-27 г (Charles River Laboratories, Harlow, UK. Мышей размещали в группах по четверо в стандартных клетках, обеспеченных обогащенными объектами, в 12 ч цикле день/ночь, и давали пищу и воду по потребности. Потребление пищи и массу тела отслеживали ежедневно. Все процедуры на животных были одобрены Animal Welfare and Ethical Review Body, в Queen Mary University Лондона и UK штаб-квартирой, в соответствии с указаниями ЕС 2010/63/EU.
Модель ЧМТ контролируемого кортикального воздействия (CCI) использовали в настоящем исследовании. Коротко, через 1 неделю периода акклиматизации мышей анестезировали с использованием смеси кетамина (50 мг/кг) и медетомидина (0,5 мг/кг) в стерильном солевом растворе, вводили интраперитонеально (и.п.). Мышей помещали в стереотакстическую рамку и проводили срединное продольное рассечение для открытия черепа. Правую латеральную краниотомию проводили с использованием пневматической дрели, 2,0 мм позади брегмы и 2,5 мм латеральнее срединной линии. CCI повреждение индуцировали с использованием следующих условий: 3 мм ударный наконечник со скоростью 3 м/с, глубина 2,2 мм и время воздействия 100 мс, применяли с использованием PCI3000 Precision Cortical Impactor™ (Hatteras Instruments, Inc., US). Контрольная группа подвергалась только краниотомии (кранио контроль). После повреждения лоскут черепа помещали обратно и кожу сшивали. Мышам позволяли восстановиться в инкубаторе (37°C) до того, как они полностью просыпались и активизировались. Бупренорфин (0,05 мг/кг) вводили подкожно (п/к) и использовали до операции для предварительного обезболивания и после операции каждые 12 ч в течение 3 дней после ЧМТ.
После повреждения мышей рандомизировали на три ЧМТ группы и кормили ежедневно свежей контрольной диетой (CCI-контроль’; n=10), комбинированной диетой с большим количеством питательных веществ Fortasyn® Connect (FC) (‘CCI-FC’; n=10) или модифицированной кетогенной диетой с большим количеством питательных веществ (CCI-Kone, n=11) в течение 70 дней. В таблице 1 представлены ингредиенты и профили жирных кислот контрольного, FC и модифицированного кетогенного (Kone) питания. Группу краниотомии ежедневно кормили контрольной диетой (только краниотомия; n=10). Диеты рецептировались Nutricia Research, Nutricia Advanced Medical Nutrition (Utrecht, The Netherlands) и производились и гранулировались Ssniff (Soest, Germany). Питание хранили при - 20°C до использования, для предотвращения окисления липидов, и свежее питание давали животным ежедневно. Стабильность питания в таких условиях ранее подтверждали (Cansev et al., 2015). Не наблюдали значимых различий по среднему потреблению пищи в сутки и набору массы тела (между группами на всем протяжении эксперимента).
Таблица 1A. Питательная композиция контрольного, FC и модифицированного кетогенного питания по изобретению (Kone) в граммах на 100 г питания.
Таблица 1B. Профили жирных кислоты контрольного, FC и модифицированного кетогенного питания по изобретению (Kone) в процентах по массе на основании общего количества жирных кислот
Тестирование поведения
После хирургического вмешательства поведенческие действия животных отслеживали в течение времени. Протокол, содержащий список поведенческих тестов, представлен схематически на фиг. 1. Коротко для всех животных тяжесть по неврологической шкале с использованием 10 индивидуальных тестов (таблица 2) тестировали с дня 1 до 70 дня после вмешательства для оценки двигательных способностей, баланса и настороженности. Всех животных тренировали на Rotarod в течение 3 последовательных дней до хирургического вмешательства с последующей оценкой состояния Rotarod в дни 1, 2 и 3 после вмешательства для оценки двигательной координации, двигательного планирования и баланса. Оценку ходьбы по лестнице проводили для оценки походки в дни 1 и 2 после вмешательства. Животных тренировали в водном лабиринте Морриса для оценки дефицита памяти, ассоциированного с пространственным обучением, в дни 13-17 после вмешательства, и в день 18 проводили пробное исследование, где измеряли время для мыши на повторное обнаружение квадранта в водном лабиринте, где ранее присутствовала платформа.
Таблица 2 Тесты шкалы неврологической тяжести и их соответствующие функциональные оценки.
Все группы животных продемонстрировали уменьшение ухудшений, индуцированных ЧМТ, оцененных с помощью интегрированной шкалы mNSS в течение 70 дней после травмы, но статистически значимое улучшение наблюдали у животных получавших CCI-Kone и CCI-FС уже на 3 день после травмы, по сравнению с группой CCI на контрольном питании. Значительные различия в неврологической шкале между контрольным питанием CCI и CCI-Kone и CCI-FC группами поддерживались до конца исследования (Фиг. 2A). Контрольные животные с краниотомией демонстрировали только транзиторные неврологические нарушения, которые разрешались в течение первой недели. На фиг. 2B показано наблюдение за теми же животными в первые 28 дней после вмешательства. Из нее очевидно, что животные, получавшие CCI-FC и CCI-Kone, все имели существенно лучшую неврологическую оценку по сравнению с животными, получавшими контроль CCI. ** p<0,01 и *** p<0,001 относительно CCI-контроль.
Тест Rotarod, проводимый в первые 3 дня после повреждения (dpi), выявил лучшее сохранение состояния у животных, получавших и CCI-Kone и CCI-FC (фиг. 3). Среднее время задержки до падения с Rotarod в мсек было достоверно выше у животных CCI-Kone и CCI-FC, по сравнению с животными в CCI-контрольной группе. Группа с контрольной краниотомией показала минимальные нарушения координации и баланса по сравнению с CCI-группами. ** p<0,01 и *** p<0,001 относительно CCI-контроля.
Пространственную память после ЧМТ оценивали с использованием водного лабиринта Морриса (MWM), теста, широко используемого в исследованиях ЧМТ для определения нарушений гиппокамп-зависимого пространственного обучения и памяти. CCI приводило к нарушению усвоения такой задачи, как видели в контрольной группе CCI, имеющей достоверно более высокую задержку первого входа в зону платформы, по сравнению с животными, получавшими и CCI-FC и CCI-Kone. Как проиллюстрировано на фиг. 4, пробное исследование выявило крупные нарушения после CCI, которые полностью устранялись лечением FC- или Kone дополненной диетой. * p<0,05, ** p<0,01 и *** p<0,001 по сравнению с CCI-контролем.
Пример 2 - Сравнение с классической кетогенной диетой в лечении ЧМТ
В сходных условиях, как описано для примера 1, 3 группы из 20 мышей рандомизировали на три группы с диетическим вмешательством, которые получали свежее контрольное питание (ctrl n=20), контрольную кетогенную диету (keto, в таблице 3 представлены характеристики контрольной кетогенной диеты, Ketocal 4:1 неароматизированная, Nutricia N.V. The Netherlands) или модифицированной кетогенной диеты с множеством питательных веществ по изобретению (Kone). Каждую группу из 20 мышей делили на группу (n=10) которая подвергалась краниотомии (имитация) и группу, которая подвергалась ЧМТ вмешательству (CCI). После операции мышей кормили предписанной диетой по потребности в течение 70 дней.
Таблица 3 Питательные характеристики классической кетогенной диеты, используемой в эксперименте 2 в граммах на 100 г питания.
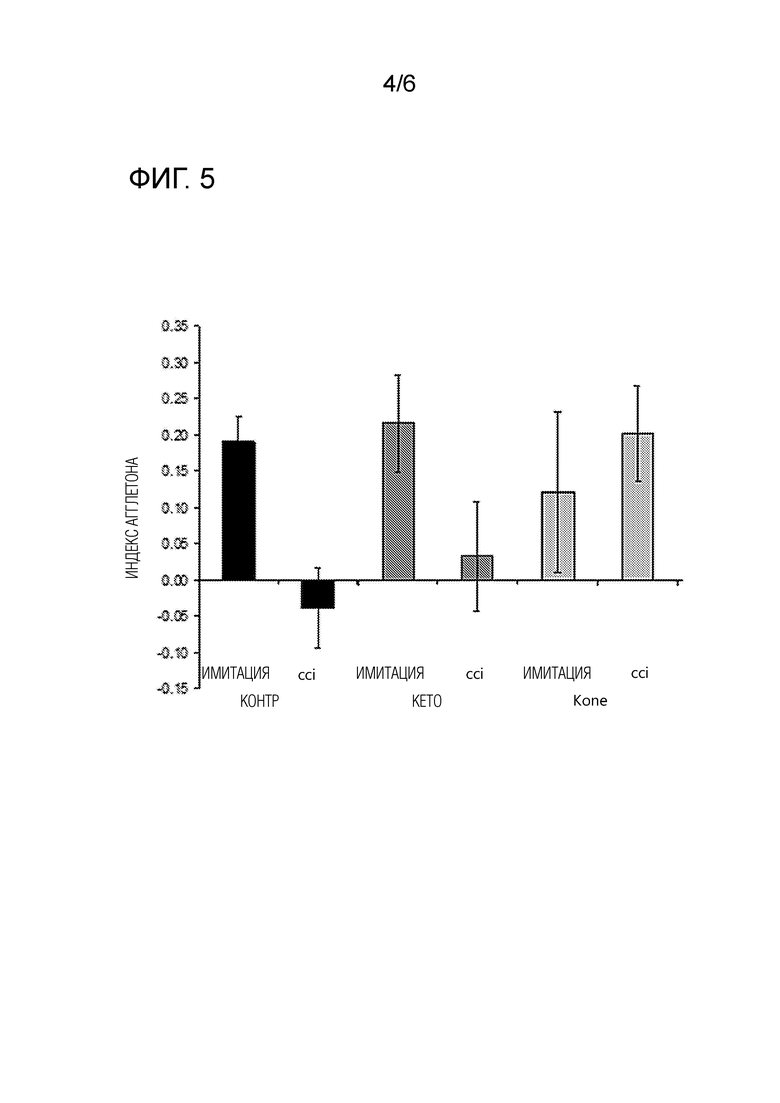
Через 22-25 дней после вмешательства животных тренировали в тесте распознавания нового объекта, где пустую непрозрачную коробку использовали в качестве открытого файла и делали знакомой с 2 идентичными объектами, расположенными в этой области. Оценка такой естественной тенденции позволяла определить, способно ли животное различить знакомый объект и новый. В течение фазы приобретения два идентичных объекта (A и B) помещали в симметричном положении в области поля в течение 5 мин. Такие объекты были подходящим образом тяжелыми и высокими, чтобы гарантировать, что мыши никогда не смогут их сдвинуть или вскарабкаться на них. Через двадцать четыре часа после этой фазы приобретения, один из двух объектов (или A или B, случайно) замещали новым (C), и эксплоративное поведение животного снова оценивали в течение 5 мин. После каждой сессии все объекты тщательно очищали с помощью 70% этанола для исключения распознавания по запаху. Изучение объекта определяли как подъем на объект или обнюхивание его с расстояния менее чем 2 см, и/или прикосновение к нему носом. Успешное распознавание проявлялось предпочтительным изучением нового объекта. Время, проведенное с любым из нового и знакомого объектов, измеряли для оценки памяти распознавания, когда отсутствие любого различия в исследовании двух объектов может быть интерпретировано, как дефицит памяти. Результаты этого теста распознавания нового объекта показаны на фиг. 5. Результаты выражаются как индекс Агглетона: [время около нового объекта - время около знакомого объекта]/[время около нового объекта+время около знакомого объекта], мера относительного времени, проведенного для исследования нового объекта. Как проиллюстрировано на фиг. 5 контрольное лечение (имитация) не изменяло распознавания нового объекта (контрольные мыши проводили наибольшую долю времени с новым объектом), тогда как лечение CCI индуцировало выраженные нарушения, которые частично устранялись в CCI-Keto группе и полностью устранялись в CCI-Kone группе, получавшей диету Kone.
Через 45 дней после вмешательства изменения Y-лабиринта использовали для оценки изучающего поведения и пространственной памяти. Лабиринт состоял из трех идентичных ветвей, разделенных углом 120° и построенных из черного органического стекла. Каждая ветвь была 8×30 x 15 см и они различались единственно по присутствию специфических визуальных знаков (треугольник, квадрат или круг). Одну ветвь случайно выбирали в качестве “начальной” ветви. В первом исследовании, продолжавшемся в течение 5 мин, каждую мышь помещали в начальную ветвь и одну из двух оставшихся ветвей случайно блокировали для ограничения доступа. Наоборот, во время второго исследования, продолжавшегося 2 мин, все ветви лабиринта были открыты. Эти два исследования разделяли 2 мин интервалом, во время которого мышь возвращали в ее клетку. Время, проведенное в каждой из ветвей, измеряли во время двух периодов исследования. Между исследованиями лабиринт тщательно очищали с использованием 70% раствора этанола и затем сушили. Индекс предпочтительного различения рассчитывали по Агглетону: [время в новой ветви - время в знакомой ветви]/[время в новой ветви+время в знакомой ветви]. Как проиллюстрировано на фиг. 6, контрольная краниотомия (имитация) не нарушала изучающего поведения, тогда как CCI вызывала серьезные нарушения в изучающем поведении в Y-лабиринте, которые не устранялись в CCI-Keto группе, и полностью устранялись в CCI-Kone группе, получавшей Kone диету. Лечение терапевтическими уровнями композиции по изобретению приводило к улучшению пространственного распознавания и пространственной памяти после ЧМТ.
На фиг. 7 показаны уровни в плазме бета-гидроксибутирата (h-BH) для различных групп. Для оценки уровня бета-гидроксибутирата (b-HB) в образцах плазмы мышей, колориметрический набор для анализа бета-Гидроксибутирата (Sigma-Aldrich) использовали в соответствии с инструкциями производителя. Коротко, образцы плазмы центрифугировали для удаления крупных обломков, но образцы не депротеинизировали. На образец, 25 мкл плазмы переносили в 96-луночные планшеты. Затем получали мастерсмесь, содержащую аналитический буфер с 3-гидроксибутиратдегидрогеназой и субстратом фермента. Для коррекции основы, отдельную мастерсмесь получали без смеси b-HB фермента. Такие мастерсмеси затем добавляли в 96-луночный планшет, содержащий плазму, и инкубировали при комнатной температуре в течение 30 минут. Впоследствии уровни b-HB определяли посредством измерения ОП при 450 нм с использованием мультимодального счетчика планшетов FlexStation III. Для каждого эксперимента измеряли стандартную кривую b-HB. Содержание B-HB определяли посредством вычитания исходной ОП из измерений ОП образца, с использованием стандартной кривой концентрации b-HB. Диета Kone показала уровни b-HB в плазме 300 мкМ, тогда как все контрольные группы имели существенно более низкие (** p <0,01).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОТРАВМЫ | 2012 |
|
RU2749191C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОТРАВМЫ | 2012 |
|
RU2622999C2 |
| ЛИНОЛЕВАЯ КИСЛОТА ИЛИ АЛЬФА-ЛИНОЛЕНОВАЯ КИСЛОТА ДЛЯ ПРИМЕНЕНИЯ С ЦЕЛЬЮ УМЕНЬШЕНИЯ КОГНИТИВНЫХ НАРУШЕНИЙ/СНИЖЕНИЯ НЕЙРОГЕНЕЗА, ИНДУЦИРОВАННЫХ СТРЕССОМ В РАННЕМ ПЕРИОДЕ ЖИЗНИ | 2017 |
|
RU2741495C2 |
| ПРЕПАРАТ ДЛЯ ПРИМЕНЕНИЯ АСПАРТАТА И ВИТАМИНА В12 ИЛИ БИОТИНА ДЛЯ РЕГУЛЯЦИИ КЕТОНОВЫХ ТЕЛ | 2005 |
|
RU2633071C2 |
| ДЕТСКОЕ ПИТАНИЕ ДЛЯ УЛУЧШЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ В МЕМБРАНАХ КЛЕТОК МОЗГА | 2011 |
|
RU2692627C2 |
| ДЕТСКОЕ ПИТАНИЕ ДЛЯ УЛУЧШЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ В МЕМБРАНАХ КЛЕТОК МОЗГА | 2011 |
|
RU2560861C2 |
| ДЕТСКОЕ ПИТАНИЕ ДЛЯ УЛУЧШЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ В МЕМБРАНАХ КЛЕТОК МОЗГА | 2011 |
|
RU2692920C2 |
| ДЕТСКОЕ ПИТАНИЕ ДЛЯ УЛУЧШЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ В МЕМБРАНАХ КЛЕТОК МОЗГА | 2011 |
|
RU2559113C2 |
| КОМБИНАЦИЯ СИНБИОТИКОВ ДЛЯ УЛУЧШЕНИЯ МОЗГОВОЙ ДЕЯТЕЛЬНОСТИ | 2013 |
|
RU2630905C2 |
| КЕТОГЕННАЯ ДИЕТА | 2007 |
|
RU2433748C2 |
Группа изобретений относится к лечебному питанию и касается питательной композиции, которая может быть использована в лечении и восстановлении после травматического повреждения головного мозга (TBI) и симптомов, ассоциированных с ним, а также к применению такой композиции и способу лечения с ее использованием. Предлагаемая энтеральная питательная композиция включает (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества: (i) DHA и необязательно EPA и (ii) 1-10% мас.% среднецепочечных триглицеридов на основании массы жирных кислот, где содержание C8 и C10 среднецепочечных триглицеридов составляет по меньшей мере 2 мас.% на основании массы жирных кислот; при этом композиция имеет кетогенное массовое соотношение от 1,8:1 до 2,7:1. Предлагается применение такой композиции в получении продукта для лечения травматического повреждения головного мозга, а также способ лечения TBI, включающий введение пациенту указанной энтеральной питательной композиции. Использование указанной выше кетогенной питательной композиции обеспечивает существенное улучшение неврологических функций и функций головного мозга после TBI. 3 н. и 7 з.п. ф-лы, 3 табл., 2 пр., 8 ил.
1. Применение энтеральной питательной композиции в получении продукта для лечения травматического повреждения головного мозга (TBI), где композиция включает (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества:
- (i) DHA и необязательно EPA и
- (ii) 1-10% мас.% среднецепочечных триглицеридов на основании массы жирных кислот, где содержание C8 и C10 среднецепочечных триглицеридов составляет по меньшей мере 2 мас.% на основании массы жирных кислот;
и где композиция имеет кетогенное массовое соотношение от 1,8:1 до 2,7:1.
2. Применение по п.1, где гликемический индекс композиции составляет менее 69, предпочтительно менее 65.
3. Применение по п.1 или 2, где (c) белковая фракция имеет содержание аминокислот с разветвленной цепью, предпочтительно включая по меньшей мере 10 мас.% свободного лейцина на основании массы белковой фракции.
4. Применение по любому из предшествующих пунктов, где композиция включает менее чем 2 мас.% ALA на основании массы жирных кислот.
5. Применение по любому из предшествующих пунктов, где композиция является зондовым питанием.
6. Способ лечения травматического повреждения головного мозга (TBI), включающий введение энтеральной питательной композиции, содержащей (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает терапевтически эффективные количества (i) DHA и необязательно EPA и (ii) 1-10 мас.% среднецепочечных триглицеридов на основании массы жирных кислот, где содержание C8 и C10 среднецепочечных триглицеридов составляет по меньшей мере 2 мас.% на основании массы жирных кислот и где композиция имеет кетогенное массовое соотношение от 1,8:1 до 2,7:1.
7. Энтеральная питательная композиция, включающая (a) липидную фракцию, (b) фракцию перевариваемых углеводов и (c) белковую фракцию, где липидная фракция включает:
- (i) DHA и необязательно EPA и
- (ii) 1-10 мас.% среднецепочечных триглицеридов на основании массы жирных кислот, где содержание C8 и C10 среднецепочечных триглицеридов составляет по меньшей мере 2 мас.% на основании массы жирных кислот,
и где композиция (d) имеет кетогенное массовое соотношение от 1,8:1 до 2,7:1.
8. Энтеральная питательная композиция по п.7 где гликемический индекс композиции составляет менее 69, предпочтительно менее 65.
9. Энтеральная питательная композиция по п.7 или 8, где (c) белковая фракция имеет содержание аминокислот с разветвленной цепью, предпочтительно включающей по меньшей мере 10 мас.% свободного лейцина на основании массы белковой фракции.
10. Энтеральная питательная композиция по любому из пп. 7-9, включающая менее чем 2 мас.% ALA на основании массы жирных кислот.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОТРАВМЫ | 2012 |
|
RU2622999C2 |
| MAYUMI L | |||
| PRINS et al | |||
| The collective therapeutic potential of cerebral ketone metabolism in traumatic brain injury | |||
| Journal of Lipid Research, 2014, V | |||
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ получения мочевин нафталинового ряда | 1914 |
|
SU2450A1 |
| [онлайн], [найдено 22.10.2021] | |||
| Найдено в PubMed, PMID: 24721741DOI: | |||
Авторы
Даты
2022-04-29—Публикация
2018-07-12—Подача