Настоящее изобретение относится к режиму дозирования модулятора или агониста рецептора S1P в курсе лечения пациентов с воспалительным или аутоиммунным заболеванием или расстройством, например, рассеянным склерозом (РС).
Рассеянный склероз - главная причина неврологической беспомощности взрослых молодых людей и является наиболее распространенным демиелинизирующим расстройством центральной нервной системы. Доступные типы лечения, например, интерфероном-β и глатирамером ацетатом, проявляют умеренную эффективность и незначительное воздействие на прогрессирование беспомощности. Эти биологические агенты вводят парентерально и они ассоциированы, например, с реакциями в месте инъекции и лихорадочными симптомами, например, напоминающими грипп. Таким образом, в медицине существует острая потребность в безопасном и эффективном пероральном лечении рассеянного склероза.
Среди больных рассеянным склерозом, подвергающихся лечению, значительное число продолжает испытывать болезнь в активной форме или испытывать побочные эффекты, среди которых симптомы, напоминающие грипп, немедленно наступающие после инъекции реакции и реакции в месте инъекции. В результате существенная часть популяции пациентов остается необработанной, в том числе многие пациенты с активной стадией заболевания. Такие пациенты с РС либо получали современное лечение, но прекратили его из-за непереносимости, побочных эффектов или осознаваемого отсутствия эффективности, либо не начали какой-либо терапии из-за связанных с нею побочных эффектов, боязни самостоятельно проводить инъекции, боязни игл, или полагают, что современные доступные варианты лечения недостаточно эффективны, чтобы их проводить. Таким образом, имеется неудовлетворенная потребность в эффективных новых способах лечения РС, которые ограничивают или уменьшают возможность нежелательных проявлений или побочных эффектов.
Модуляторы рецептора S1P являются соединениями, которые вызывают сигнал в качестве агонистов по одному или нескольким рецепторам сфингозин-1-фосфата, например, с рецептора S1P1 пo рецептор S1P5. Связывание агониста с рецептором S1P может привести, например, к диссоциации внутриклеточных гетеротримерных G-белков на Gα-GTP и Gβγ-GTP, и/или к повышенному фосфорилированию занятого агонистом рецептора и активации расположенных ниже по цепи сигнальных метаболических цепей/киназ.
Модуляторы рецептора S1P являются полезными соединениями для получения лекарственного средства для лечения различных состояний у млекопитающих, особенно у людей. Например, эффективность трансплантации показана на моделях крыс (трансплантации кожи, сердца, печени, тонкой кишки), собак (трансплантации почек) и обезьян (трансплантации почек). Из-за присущей им иммуномодулирующей способности, модуляторы рецептора S1P также полезны для лечения воспалительных и аутоиммунных заболеваний. Лечение таких заболеваний обычно требует продолжительного применения лекарственного средства и поддержания соответствующего режима его применения на протяжении лечения.
Финголимод для перорального введения представляет первое соединение нового класса терапевтических средств, называемых модуляторами рецепторов сфингозин-1-фосфата. Полагают, что финголимод снижает число лимфоцитов, циркулирующих в кровяном русле, путем частичного обратимого их захвата в лимфатических узлах. Соответственно, количество активированных достигающих мозга лимфоцитов снижается, в результате снижая воспалительное разрушение. Это новый механизм действия в случае РС.
Эффективность FTY720 в лечении рассеянного склероза показана на людях (например, в работах Mehling M. и др., Neurology, 71(16), 2008, сс. 1261-1267; Kappos L, Antel J, Comi G, Montalban X, O'Connor P, Polman CH, Haas T, Korn AA, Karlsson G, Radue EW; N Engl. J Med, 355(11), 2006, с. 1124-1140).
Введение модулятора рецептора S1P, например, финголимода, может индуцировать побочные эффекты, например, кратковременное снижение сердечного ритма и сердечного проведения в начале лечения. В частности было описано, что введение 1,25 мг FTY720 может индуцировать снижение сердечного ритма примерно на 8 ударов/мин (Robert Schmouder, Denise Serra, Yibin Wang, John M. Kovarik, John DiMarco, Thomas L. Hunt и Marie-Claude Bastien. J. Clin. Pharmacol. 46, 2006, с. 895).
Ввиду такого возможного побочного проявления введение соединения пациентам должно проводиться под полным и постоянным медицинским контролем для подтверждения, что сердечный ритм поддерживается на приемлемом уровне и нет высокого уровня предсердно-желудочкового блокирования. Возможно, пациентам придется остаться в больнице, что осложняет лечение и повышает стоимость лечения. Наличие побочных эффектов во время медикаментозного лечения может привести к госпитализации пациента или продлению имеющейся госпитализации.
Такие возможные проявления могут заставить пациентов прервать лечение, самостоятельно сменить рекомендованный режим дозирования или применять лекарственное средство нерегулярно, без какой-либо медицинской поддержки или рекомендации на такие действия. Хотя первостепенное значение для лечения воспалительного или аутоиммунного заболевания, например рассеянного склероза, имеет то обстоятельство, что медикамент принимают на протяжении длительного периода времени, иногда на протяжении всей жизни пациента, адекватный режим лечения лекарственным средством сохраняется на протяжении такого длительного периода времени.
Таким образом, имеется потребность в снижении или контроле возможных побочных эффектов, которые могут быть получены при введении такого модулятора рецептора S1P, хотя введение дозировки, достаточной для лечения или предупреждения заболевания, для которого соединение вводят на протяжении требуемого периода лечения.
Точнее, имеется потребность в разработке эффективного лечения воспалительного или аутоиммунного заболевания или расстройства, например, рассеянного склероза, для большой популяции пациентов с рассеянным склерозом, включая пациентов, которые могут быть более уязвимы или более чувствительны к указанным возможным побочным эффектам, для большой популяции пациентов с рассеянным склерозом, включая пациентов, которые могут быть более уязвимы или более чувствительны к указанным возможным побочным эффектам, пациентам, которых никогда не лечили или у которых никогда не диагностировали воспалительного или аутоиммунного заболевания или расстройства.
Кроме того, необходимо облегчить пациентам соблюдение режима.
Краткое описание изобретения
Неожиданно было установлено, что путем введения модулятора рецептора S1P или агониста, например, финголимода, согласно специфическому режиму дозирования или способу лечения по настоящему изобретению, возможно эффективное лечение пациента во время контролирования, снижения проявления заболевания или облегчения возможных побочных проявлений, например, побочных эффектов, которые могут быть ассоциированы с введением такого соединения.
Дополнительная польза заключается в том, что режим дозирования и способы лечения по настоящему изобретению позволяют назначать модулятор или агонист рецептора S1P, например, финголимод, пациентам, которые в ином случае могут отказываться от применения или которые могли быть не проинструктированы по поводу применения такого медикамента. В частности, они допускают лечение пациентов с воспалительным или аутоиммунным заболеванием или расстройством, например, рассеянным склерозом, для которых соотношение риск/польза в противном случае может быть наименее благоприятным. Такими пациентами являются, например, пациенты, чувствительные к одному или нескольким заболеваниям или расстройствам, поражающим сердце или сердечный ритм, респираторные функции, глаза, функции печени, или имеющие эти заболевания или расстройства. Это также касается пациентов, которые претерпели прерывание лечения или переход на поддерживающий режим дозирования из-за нерабочего дня, например, праздника, занимающего более 10 суток.
Кроме того, режим дозирования и способы лечения по настоящему изобретению применимы в отношении пациентов, которые уже подвергались лечению воспалительного или аутоиммунного заболевания, например, при лечении рассеянного склероза, а также пациентов, которые никогда не подвергались лечению или у которых не диагностировано воспалительное или аутоиммунное заболевание, в случае которого ранее потреблялся модулятор или агонист рецептора S1P.
Режим дозирования по настоящему изобретению - это режим лечения модулятором или агонистом рецептора S1P, который позволяет управлять режимом терапевтического дозирования рецептора S1P, достигаемого при контролируемых или минимальных побочных эффектах, которые при иных обстоятельствах могут быть ассоциированы с терапией модулятором рецептора S1P.
Другая польза, предусматриваемая настоящим изобретением заключается в обеспечении терапевтического режима для воспалительного или аутоиммунного заболевания, например, рассеянного склероза, который может быть персонифицирован, например, адаптирован по определенному профилю подвергаемого лечению пациента и/или по состоянию заболевания у этих пациентов таким образом, что это заболевание лечат (или снимают тяжесть заболевания), при этом побочные проявления, которые иначе могут быть ассоциированы с введением указанного модулятора или агониста рецептора S1P, находятся под контролем, снижаются или упраздняются. Например, терапевтический режим по настоящему изобретению может быть персонифицирован в отношении другого заболевания или расстройства, которому может быть подвержен пациент, с помощью других медикаментов, которые он может получать, например, в зависимости от наличия сердечного заболевания или расстройства.
Модуляторы или агонисты рецептора S1P
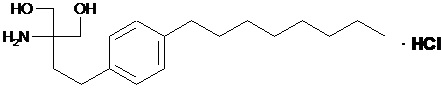
Согласно настоящему изобретению специфическими модуляторами рецептора S1P по настоящему изобретению являются 2-амино-2-тетрадецил-1,3-пропандиолы. Примером модулятора рецептора S1P является финголимод (FTY720), т.e. 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол в свободной форме или в форме фармацевтически приемлемой соли, например, гидрохлорида:
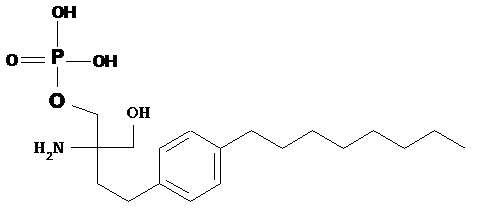
Другим специфическим модулятором рецептора S1P по настоящему изобретению является фосфорилированное производное FTY720, также называемое финголимод-фосфатом:
Предпочтительно модулятор или агонист рецептора S1P по настоящему изобретению, например, финголимод в свободной форме, в форме фармацевтически приемлемой соли или финголимод-фосфата, вводят перорально.
Режим дозирования
Ранее было указано, что настоящее изобретение предусматривает новый режим дозирования и способ лечения воспалительного или аутоиммунного заболевания или расстройства для пациента, нуждающегося в этом, включающий введение указанному пациенту модулятора или агониста рецептора S1P, например, финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, таким образом, что заболевание лечат или снижают тяжесть заболевания, наряду с тем, что побочные проявления, которые возможно, ассоциированы с введением указанного модулятора или агониста рецептора S1P, контролируются, ограничиваются, снижаются или упраздняются. Например, предусмотрен способ лечения воспалительного или аутоиммунного заболевания или расстройства у пациента, нуждающегося в этом, включающий введение указанному пациенту модулятора или агониста рецептора S1P, например, финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, таким образом, что симптомы заболевания снижены или упразднены, наряду с тем, что побочные проявления, которые возможно ассоциированы с введением указанного модулятора или агониста рецептора S1P, контролируются, ограничиваются, снижаются или упраздняются.
Согласно описанному в настоящем изобретении предусмотрен способ введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом, предназначенный для лечения воспалительного или аутоиммунного заболевания или расстройства, ограничения ассоциированные с ними симптомов или прогрессирования заболевания, например, рассеянного склероза, у пациента, нуждающемуся в этом. В частности настоящее изобретение относится к способу лечения РРРС, ограничению симптомов, ассоциированных с ним, или прогрессирования заболевания у пациента, нуждающегося в этом.
Согласно настоящему изобретению понятие «лечение» относится и к профилактическому, и к превентивному лечению, а также к радикальному или модифицирующему болезнь лечению, включая лечение пациентов с риском заражения этим заболеванием или расстройством или подозреваемых в начале развития этого заболевания или расстройства, а также пациентов, которые заболели или у которых были диагностированы заболевания или расстройства.
Аутоиммунные заболевания или расстройства по настоящему изобретению предпочтительно являются хроническими длительно протекающими заболеваниями, например, рассеянным склерозом (РС), например, рецидивирующе-ремиттирующим рассеянным склерозом (РРРС) или первичным прогрессирующим рассеянным склерозом (ППРС), например, РРРС. РС может быть в нескольких формах с новыми симптомами, происходящими или в виде отдельных приступов (рецидивирующие формы), или в виде постепенного накопления на протяжении времени (прогрессирующие формы).
Режимы дозирования и способы лечения по настоящему изобретению особенно адаптированы для рассеянного склероза, например, РРРС.
Согласно описанному в настоящем изобретении, лечение рассеянного склероза относится к снижению частоты клинических проявлений или к отсрочке накопления физической беспомощности, индуцированной рассеянным склерозом, но ими перечень не ограничивается. Лечение рассеянного склероза также может относиться к ограничению симптомов заболевания.
Согласно описанному в настоящем изобретении, симптомы или расстройства, ассоциированные с рассеянным склерозом, охватывают неврологические симптомы, физическую и когнитивную беспомощность и нервно-психиатрические расстройства.
Согласно описанному в настоящем изобретении, побочные проявления относятся к какому-либо вредному изменению в состоянии здоровья, которые происходят у пациента, подвергаемого лечению, или на протяжении определенного периода времени после завершения лечения. Контролирование побочных проявлений относится к ограничению появления, исхода, последствий или воздействия таких проявлений таким образом, что здоровье пациента не подвергается риску, или лечение может быть продолжено без ухудшения общего состояния здоровья пациента. Побочные проявления необязательно относятся к самому лекарственному средству, они также могут быть связаны с воспалительным или аутоиммунным заболеванием или расстройством, из-за которого пациента подвергают лечению, или из-за другого заболевания или расстройства, которое имеется у пациент дополнительно.
По настоящему изобретению снижение побочных проявлений относится к снижению проявлений, например, побочных эффектов, до уровня, который обеспечивает пациенту безопасность, например, не требует специфического лечения и/или специфического медицинского ухода, госпитализации или медицинского мониторинга. Например, снижение побочных проявлений относится к снижению проявлений до уровня, приемлемого для соблюдения больным режима и схемы лечения.
По настоящему изобретению ограничение побочных проявлений относится к ограничению числа или распространения побочных проявлений, например, побочных эффектов, у пациента до числа или распространения побочных проявлений, которые приемлемы для пациента, например, которые не требуют специфического лечения и/или определенного медицинского ухода, госпитализации или медицинского мониторинга. Например, ограничение побочных проявлений относится к ограничению числа или наличия побочных проявлений до числа или наличия, приемлемых для безопасности пациента и/или его уступчивости в отношении режима.
Мониторинг возможных побочных проявлений может проводиться согласно описанному в настоящем изобретении выше. Например, он может проводиться путем офтальмологического осмотра, дерматологического осмотра, легочными функциональными пробами, рентгеном и/или КТ грудной клетки, амбулаторным мониторингом и/или эхокардиографией. В одном из вариантов осуществления настоящего изобретения мониторинг и описание побочных проявлений включает мониторинг и описание брадикардии, обморочного или предобморочного состояния, тяжелых инфекций, токсичности печени и отека желтого пятна.
Согласно описанному в настоящем изобретении, пациентом, которого лечат финголимодом (FTY720), является пациент, получающий финголимод (FTY720), его фосфатное производное (т.e. финголимод-фосфат) или его фармацевтически приемлемую соль, для лечения воспалительного или аутоиммунного заболевания или расстройства по настоящему изобретению, например, РС, например, РРРС.
Согласно описанному в настоящем изобретении, пациентом, нуждающимся в назначении финголимода, является пациент с воспалительным или аутоиммунным заболеванием или расстройством по настоящему изобретению, например, пациент с РС.
Пациентами, которых лечили финголимодом (FTY720), и пациентами, нуждающимися в назначении финголимода, могут быть пациенты, которых никогда не лечили от воспалительного или аутоиммунного заболевания или расстройства, например, пациенты, которых никогда не лечили с целью лечения или предупреждения РС, а также пациенты, которые ранее подвергались одному или нескольким лечениям воспалительного или аутоиммунного заболевания или расстройства, например, пациенты, которых один или несколько раз лечили от РС.
Эффективность модулятора S1P по настоящему изобретению для лечения рассеянного склероза может быть оценена по медицинским стандартам и критериям, известным специалистам. Например, она может быть оценена по частоте рецидивов рассеянного склероза за год.
Например, доза модулятора или агониста S1P по настоящему изобретению может рассматриваться в качестве эффективной для лечения заболевания или ослабления симптомов, ассоциированных с ним, например, для лечения рассеянного склероза, если частота рецидивов снижается более чем на 45%, например, более чем на 50%, например, более чем на 60%.
В другом варианте осуществления настоящего изобретения эффективность модулятора или агониста S1P по настоящему изобретению для лечения рассеянного склероза оценивают по прогрессированию недееспособности, используя, например, расширенную шкалу оценки степени инвалидизации Куртцке (РШСИ). Расширенная шкала оценки степени инвалидизации Куртцке (РШСИ) представляет способ количественной оценки инвалидности при рассеянном склерозе. РШСИ количественно оценивает инвалидность по восьми функциональным системам (ФС) и позволяет неврологам давать оценку функциональной системы (ОФС) в каждой из них. Например, дозирование модулятора или агониста рецептора S1P по настоящему изобретению может расцениваться в качестве эффективного для лечения заболевания или снижения симптомов, ассоциированных с ним, например, для лечения рассеянного склероза, если прогрессирование беспомощности пациента отсрочивается по меньшей мере на 25%, например, по меньшей мере на 30%, например по меньшей мере на 32%.
Эффективность режима дозирования по настоящему изобретению также может быть оценена путем измерения повреждений мозга, например, сканированием с помощью магнитно-резонансной визуализации.
Мониторинг
Настоящее изобретение предусматривает режим дозирования и способ лечения воспалительного или аутоиммунного заболевания или расстройства у пациента, нуждающегося в этом, включающий введение указанному пациенту терапевтически эффективного количества модулятора или агониста рецептора S1P, причем указанный способ включает стадии:
i) мониторинга пациента на протяжении определенного периода времени после первого введения указанного модулятора или агониста рецептора S1P, и
ii) необязательно прерывания введения указанного модулятора или агониста рецептора S1P и/или модификации режима лечения и/или введения второго лекарственного средства, которое смягчает указанные возможные побочные проявления.
Такой режим дозирования частично адаптирован для введения финголимода, например, пациенту с рассеянным склерозом.
Кроме того, в настоящем изобретении предусмотрен модулятор или агонист рецептора S1P, например, FTY720, его фосфатное производное или его фармацевтически приемлемая соль, для применения в лечении воспалительного или аутоиммунного заболевания или расстройства, например рассеянного склероза, причем указанное лечение включает стадии:
i) мониторинга пациента на протяжении определенного периода после первого введения указанного модулятора или агониста рецептора S1P, и
ii) необязательно прерывания введения указанного модулятора или агониста рецептора S1P и/или модификации режима лечения и/или введения второго лекарственного средства, которое смягчает указанные возможные побочные проявления.
В одном из вариантов осуществления настоящего изобретения предусматривают FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в лечении рассеянного склероза, причем указанное лечение включает стадии:
i) мониторинга пациента на протяжении определенного периода после первого введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли, и
ii) необязательно прерывания введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли, и/или модификации режима лечения, и/или введения второго лекарственного средства, которое смягчает указанные возможные побочные проявления.
Настоящее изобретение дополнительно относится к модулятору или агонисту рецептора S1P, например FTY720, его фосфатному производному или его фармацевтически приемлемой соли, для применения в способе для лечения воспалительного или аутоиммунного заболевания или расстройства, например рассеянного склероза, причем указанный способ включает стадии:
i) мониторинга пациента на протяжении определенного периода после первого введения указанного модулятора или агониста рецептора S1P, и
ii) необязательно прерывания введения указанного модулятора или агониста рецептора S1P и/или модификации режима лечения и/или введения второго лекарственного средства, которое смягчает указанные возможные побочные проявления.
В одном из вариантов осуществления настоящее изобретение относится к FTY720, его фосфатному производному или его фармацевтически приемлемой соли для применения в способе лечения рассеянного склероза, причем указанное лечение включает стадии:
i) мониторинга пациента на протяжении определенного периода после первого введения указанного модулятора или агониста рецептора S1P, и
ii) необязательно прерывания введения указанного модулятора или агониста рецептора S1P и/или модификации режима лечения и/или введения второго лекарственного средства, которое смягчает указанные возможные побочные проявления.
По настоящему изобретению действие, предпринятое на стадии ii), зависит от результатов, полученных на стадии i).
Если модулятор или агонист рецептора S1P выбран из финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, стадия модификации режима лечения может состоять из введения суточной дозировки лекарственного средства, которая нижи примерно 0,5 мг, и затем повышения дозировки до суточной дозировки примерно 0,5 мг. Суточная дозировка лекарственного средства затем может быть поэтапно повышена, например, титрованием. Она может также состоять из введения суточной дозировки лекарственного средства, превышающей 0,5 мг, например, суточной дозировки примерно 1,0 мг или примерно 1,25 мг.
В одном из вариантов осуществления настоящего изобретения, например, если модулятор или агонист рецептора S1P выбран из финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, стадия модификации режима лечения может состоять из удлинения периода между последовательными введениями медикамента.
Согласно настоящему изобретению предусмотрен мониторинг пациента, т.e. специфический мониторинг пациентов, которых лечат модулятором или агонистом рецептора S1P, например, финголимодом (FTY720), его фосфатным производным или его фармацевтически приемлемой солью, для контроля, ограничения или упразднения возможных побочных проявлений, причем указанный мониторинг проводят до и/или во время введения медикамента.
Мониторинг пациента по настоящему изобретению включает:
a) мониторинга инфекций или инвазий, например, вирусных инфекций, на протяжении введения указанного модулятора или агониста рецептора S1P, и/или
б) проведения офтальмологического осмотра.
Мониторинг пациента может дополнительно включать одну или несколько стадий:
в) мониторинга частоты сердечных сокращений у пациента по меньшей мере на протяжении первых часов после первого введения указанного модулятора или агониста рецептора S1P,
г) наблюдения за пациентом на протяжении первых часов после первого введения указанного модулятора или агониста рецептора S1P, мониторинга частоты сердечных сокращений у пациента,
д) проведения тестов на функционирование печени,
е) проведения дерматологических осмотров,
ж) проведения легочных функциональных проб.
Мониторинг пациента может дополнительно включать одну или несколько стадий:
з) проведения клинического анализа крови,
и) подсчета лимфоцитов и/или регистрация ключевых параметров крови,
к) мониторинга и/или регистрации жизненных показателей, например частоты сердечных сокращений, кровяного давления, например, артериального кровяного давления,
л) мониторинга и/или регистрации расстройства сердца,
м) мониторинга и/или регистрации других побочных проявлений или побочных эффектов.
Настоящее изобретение также предусматривает режим дозирования и способ контроля, снижения или упразднения возможных побочных проявлений, ассоциированных с лечением пациента с воспалительным или аутоиммунным заболеванием или расстройством модулятором или агонистом рецептора S1P, включающие введение указанному пациенту терапевтически эффективного количества указанного модулятора или агониста рецептора S1P, причем указанный способ включает
i) мониторинг пациента, согласно описанному в настоящем изобретении выше, и
ii) необязательно прерывание введения указанного модулятора или агониста рецептора S1P и/или модификацию режима лечения.
В одном из вариантов осуществления настоящего изобретения мониторинг пациента по настоящему изобретению может включать одну или несколько из следующих стадий, необязательно все стадии из числа следующих:
- клинический анализ крови,
- подсчет лимфоцитов,
- анализ ферментов печени,
- мониторинг и/или регистрация жизненных показателей, например, частоты сердечных сокращений, кровяного давления, например, артериального кровяного давления,
- историю анализа вирусной инфекции или вирусной серологии, например, касающуюся ветряной оспы,
- мониторинг и/или регистрация инфекций или инвазий, например, вирусных инфекций,
- дерматологические осмотры,
- офтальмологические осмотры,
- проведения легочных функциональных проб,
- мониторинг и/или регистрация расстройства сердца,
- мониторинг и/или регистрация ключевых параметров крови,
- мониторинг и/или регистрация тестов на функционирование печени,
- мониторинг и/или регистрация других побочных проявлений или побочных эффектов.
Предпочтительно мониторинг пациента по настоящему изобретению включает одну или несколько из следующих стадий, необязательно все стадии:
- клинический анализ крови,
- анализ ферментов печени,
- офтальмологические осмотры и
- историю анализа вирусной инфекции или вирусной серологии, например, касающуюся ветряной оспы,
- мониторинг и/или регистрация инфекций или инвазий, например, вирусной инфекции.
Мониторинг пациента может дополнительно включать:
- постановку электрокардиограммы (ЭКГ), например, в начале введения медикамента, и/или
- вакцинирование пациента до начала введения, например, против вируса varicella zoster (varicella zoster virus - VZV).
Согласно описанному в настоящем изобретении, мониторинг пациента по настоящему изобретению может включать описанные выше стадии мониторинга или также дополнительные стадии.
В одном из вариантов осуществления настоящего изобретения мониторинг пациента включает стадии:
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций,
- проведения офтальмологических осмотров,
и необязательно дополнительно включает стадии:
- мониторинга и/или регистрации расстройства сердца для определенной категории пациентов, и/или
- проведения дерматологических осмотров.
В другом варианте осуществления настоящего изобретения мониторинг пациента включает стадии:
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций,
- офтальмологических осмотров,
- мониторинга и/или регистрации расстройств сердца, например, для определенной категории пациентов,
- тестов на функционирование печени,
и необязательно дополнительно включает стадии:
- дерматологических осмотров.
В еще одном из вариантов осуществления настоящего изобретения мониторинг пациента включает стадии:
- мониторинга частоты сердечных сокращений у пациента,
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций,
- проведения офтальмологических осмотров,
и необязательно дополнительно включает стадии:
- проведения дерматологических осмотров.
В еще одном из вариантов осуществления настоящего изобретения мониторинг пациента включает стадии:
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций,
- проведения офтальмологического осмотра в первые 1-10 суток после начала введения,
- наблюдения пациентов по меньшей мере в течение 6 ч после введения первой дозы,
и необязательно дополнительно включает стадии:
- проведения дерматологических осмотров.
Мониторинг пациентов может дополнительно включать стадию мониторинга и/или регистрации тестов на функционирование печени в том случае, когда сформировавшиеся у пациентов симптомы указывают на дисфункцию печени.
В предпочтительном варианте осуществления настоящего изобретения предусматривают способ, предписывающий финголимод (FTY720), его фосфатное производное или его фармацевтически приемлемую соль пациенту, нуждающемуся в этом, таким образом, чтобы ограничить возможные побочные проявления до или во время введения финголимода, причем указанный способ включает мониторинг пациента, согласно описанному в настоящем изобретении выше.
Например, способ предписания финголимода может включать одну или несколько следующих стадий:
- проведения подсчета лимфоцитов,
- мониторинга и/или регистрации жизненных показателей, например, кровяного давления, например, артериального кровяного давления,
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций,
- проведения дерматологических осмотров,
- проведения офтальмологических осмотров,
- проведения анализов функции легких,
- мониторинга и/или регистрации расстройств сердца,
- мониторинга и/или регистрации ключевых параметров крови, например, уровня ALT в сыворотке,
- проведения анализов функции печени,
- мониторинга и/или регистрации других побочных проявлений или побочных эффектов,
причем каждую указанную стадию проводят в течение определенного периода времени до и/или на протяжении периода введения лекарственного средства.
Специфический и регулярный мониторинг подвергаемых лечению пациентов может состоять из одной или нескольких следующих стадий:
- проведения подсчета лимфоцитов,
- мониторинга и/или регистрации жизненных показателей, например, кровяного давления, например, артериального кровяного давления,
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций,
- проведения дерматологических осмотров,
- проведения офтальмологических осмотров,
- проведения анализов функции легких,
- мониторинга и/или регистрации расстройства сердца,
- мониторинга и/или регистрации ключевых параметров крови, например, уровня сывороточной ALT,
- проведения анализов функции печени,
- мониторинга и/или регистрации других побочных проявлений или побочных эффектов,
причем каждую указанную стадию проводят в течение определенного периода времени до и/или на протяжении периода введения лекарственного средства.
Каждая стадия может выполняться согласно приведенному ниже описанию.
Предпочтительно мониторинг пациента может включать одну или несколько из следующих стадий:
- мониторинга и/или регистрации инфекций или инвазий, например, вирусных инфекций, при проведении терапии FTY720,
- офтальмологических осмотров, согласно описанному в настоящем изобретении,
- мониторинга и/или регистрации расстройства сердца для определенной категории пациентов,
- проведения тестов на функционирование печени в случае развития у пациентов симптомов, свидетельствующих о дисфункции печени,
и необязательно дополнительно включает стадии
- дерматологических осмотров.
Разные стадии мониторинга пациента по настоящему изобретению проводят в определенный период времени после введения первой дозы.
Эти стадии могут быть выполнены согласно описанному в настоящем изобретении.
В одном из вариантов осуществления настоящего изобретения подвергаемы лечению пациентов подвергают мониторингу под контролем медиков на протяжении определенного периода после введения первой дозы, в течение первых 1-10 ч после первого введения модулятора или агониста рецептора S1P, например, финголимода, его фосфатного производного или его фармацевтически приемлемой соли, в течение по меньшей мере 6 ч после введения первой дозы.
Согласно настоящему изобретению одну или несколько стадий, например, мониторинга и/или регистрации расстройства сердца, проводят по меньшей мере 4 ч после введения первой дозы, например, по меньшей мере в течение 6 ч после введения первой дозы, или по меньшей мере 8 ч после введения первой дозы, например, от 3 до 8 ч после введения первой дозы, например, от 4 до 6 ч после введения первой дозы, например, от 4 до 6 ч после введения первой дозы. Предпочтительно мониторинг и/или регистрацию расстройства сердца проводят примерно 6 ч после введения первой дозы. Стадия мониторинга и/или регистрации расстройства сердца может состоять из наблюдений пациентов на протяжении периода после введения первой дозы, например, на протяжении по меньшей мере 4 ч после введения первой дозы, например по меньшей мере в течение 6 ч после введения первой дозы, или по меньшей мере 8 ч после введения первой дозы.
По настоящему изобретению расстройства сердца, которые подвергают мониторингу и/или регистрации, включают, но ими перечень не ограничивается, брадикардию и высокого уровня предсердно-желудочковое блокирование.
По настоящему изобретению к инфекциям, которые регистрируют и подвергают мониторингу, относятся, например, вирусные инфекции, например, инфекция вируса varicella zoster (VZV), инфекция вируса гриппа, инфекция вируса герпеса, инфекция нижних дыхательных путей, например, бронхит и пневмония.
В одном из вариантов осуществления настоящего изобретения мониторинг инфекций или инвазий проводят в течение первых трех месяцев после введения первой дозы, например, в течение первых двух месяцев после введения первой дозы. В другом варианте осуществления настоящего изобретения мониторинг инфекций или инвазий проводят на протяжении периода введения медикамента.
Перед началом введения модулятора или агониста рецептора S1P пациента могут проверить на историю инфекций, например, вирусной инфекции, в частности ветряной оспы. Если серологический анализ отрицательный, пациент может быть провакцинирован, например, против вируса varicella zoster или вируса гриппа.
Мониторинг или регистрация инфекций или инвазий, например вирусных инфекций, могут быть проведены медицинскими методами, доступными, например, за счет клинического анализа крови и/или подсчета лимфоцитов.
По настоящему изобретению офтальмологический осмотр предпочтительно включает сравнение и/или мониторинг нарушений остроты зрения, например появление отека желтого пятна.
В одном из вариантов осуществления настоящего изобретения осмотры глаз включают по меньшей мере один параметр из следующих: история болезни глаз, острота зрения, дилатационная офтальмоскопия, оптическая когерентная томография (ОКТ), осмотр глазного дна. Такие исследования предпочтительно проводятся офтальмологом.
По настоящему изобретению офтальмологический осмотр может быть проведен после инициации введения модулятора или агониста рецептора S1P, например, после начала терапии с помощью FTY720, например, в первые 1-12 месяцев, например, 2-10 месяцев, например, 2-6 месяцев, например, 2-5 месяцев, например, 3-4 месяцев. Дополнительные офтальмологические осмотры могут быть проведены в соответствии с потребностью, исходя из симптомов пациента, например, с интервалами, определенными офтальмологом.
Согласно настоящему изобретению, офтальмологический осмотр может включать стадии:
1) выяснения истории болезни глаз пациента, подвергаемого лечению, до начала лечения с помощью FTY720,
2) проведения офтальмологических осмотров, выполняемых согласно описанному выше, например, через 3-4 месяца после начала лечения с помощью FTY720, предпочтительно выполняемых офтальмологом, и необязательно
3) проведения дополнительных офтальмологических осмотров, выполняемых исходя из симптомов пациента, например, с интервалами, определенными офтальмологом.
Офтальмологический осмотр также может быть проведен до начала введения модулятора или агониста рецептора S1P, например, до начала терапии FTY720. Этот вариант осуществления настоящего изобретения частично адаптирован по специфическим категориям пациентов, например, в случае пациентов с заболеваниями или расстройствами глаз, и/или в истории болезни которых имеется диабет или увеит.
Согласно настоящему изобретению дерматологический осмотр может включать анализ появления, например, новообразований, злокачественных поражений кожи, меланомы, плоскоклеточной карциномы, базальноклеточной карциномы. Дерматологический скрининг может проводиться до или вскоре после начала терапии. В одном из вариантов осуществления настоящего изобретения дерматологические скрининги проводят ежегодно у пациента, получающего модулятор или агонист рецептора S1P, например, FTY720, его фосфатное производное или его фармацевтически приемлемую соль.
Дерматологический скрининг может проводиться врачом, например, дерматологом. В другом варианте осуществления настоящего изобретения такой скрининг проводят чаще, например, самим пациентом.
По настоящему изобретению проведения легочных функциональных проб могут проводиться спирометрически, с помощью легочных функциональных проб, например, FEV1, FVC, FEF25-75%, DLCO, диффузионной способности оксида углерода или высокоразрешающей компьютерной томографии (ВРКТ) грудной клетки.
В одном из вариантов осуществления настоящего изобретения легочную функциональную пробу (ЛФП) проводят от нескольких часов до нескольких суток после первого введения, например, в день первого введения, например, от 2 до 12 ч после первого введения лекарственного средства, например от 2 дo 8 ч после первого введения лекарственного средства, например, от 2 до 6 ч после первого введения лекарственного средства, например, через 6 ч после первого введения лекарственного средства. Вторая ЛФП может быть выполнена через несколько суток после первого введения лекарственного средства, например, от 2 до 10 суток после первого введения лекарственного средства, например, от 3 до 8 суток после первого введения лекарственного средства, например, примерно через неделю после первого введения лекарственного средства.
В одном из вариантов осуществления настоящего изобретения уровень ферментов печени, например, сывороточной ALT, оценивают во время инициации терапии и необязательно периодически впоследствии. Непрерывную оценку особенно адаптируют в случае пациентов, у которых сформировались симптомы, свидетельствующие о дисфункции печени.
Согласно настоящему изобретению могут быть проведены тесты на функционирование печени для определенной категории пациентов, например, пациентов, у которых сформировались симптомы, свидетельствующие о дисфункции печени, например, тошнота, рвота, боль в животе, анорексия или желтуха.
Согласно настоящему изобретению мониторинг и/или регистрация тестов на функционирование печени может включать какую-либо одну из стадий:
1) выявления уровня фермента печени, например, сывороточной ALT, у подвергаемого лечению пациента перед первым введением модулятора или агониста рецептора S1P, например, FTY720, его фосфатного производного или его фармацевтически приемлемой соли, и введения первой дозы только в том случае, если уровень аланинаминотрансферазы (alanine aminotransferase - ALT) превышает не более чем в два раза верхнюю границу нормального диапазона (ULN),
2) идентификации уровня фермента печени, например, сывороточной ALT, у находящегося на лечении пациента и прерывания терапии у пациентов с желтухой или повышением уровня фермента печени более чем в 5 раз относительно верхней границы нормального диапазона (ULN).
Мониторинг пациента по настоящему изобретению может включать стадию осмотра пациента в течение первых 1-10 ч после первого введения модулятора или агониста рецептора S1P, например, финголимод, его фосфатное производное или его фармацевтически приемлемую соль, например, первых 2-8 ч после первого введения, например, первых 3-9 ч после первого введения, например, первых 2-8 ч после первого введения, например, первых 4-7 ч после первого введения, например, первых 6 ч, например, первых 5 ч, например, первых 4 ч после первого введения указанного модулятора или агониста рецептора S1P, например, финголимод, его фосфатного производного или его фармацевтически приемлемой соли. Например, мониторинг пациента по настоящему изобретению может включать стадию осмотра пациента по меньшей мере через 2 ч после первого введения указанного модулятора или агониста рецептора S1P, например, финголимода, его фосфатного производного или его фармацевтически приемлемой соли, например, по меньшей мере через 4 ч после первого введения, например, по меньшей мере 6 ч после первого введения.
По настоящему изобретению предусматривают способ лечения воспалительного или аутоиммунного заболевания или расстройства у пациента, нуждающегося в этом, включающий введение указанному пациенту терапевтически эффективного количества модулятора или агониста рецептора S1P, причем специфические параметры пациента проверяют до инициации указанного лечения, и в случае необходимости, режим лечения приспосабливают и/или вводят второе лекарственное средстве, которое смягчает возможные побочные проявления.
Настоящее изобретение дополнительно относится к модулятору или агонисту рецептора S1P, например FTY720, его фосфатному производному или его фармацевтически приемлемой соли, для применения в способе лечения воспалительного или аутоиммунного заболевания или расстройства, например рассеянного склероза, причем указанный способ включает стадии проверки специфических параметров пациента до инициации указанного лечения, и, в случае необходимости, адаптации режима лечения и/или введения второго лекарственного средства, которое смягчает возможные побочные проявления.
Указанные параметры выбирают из признаков инфекций или инвазий (например, вирусных инфекций), остроты зрения, наличия болезни глаз, ферментов печени, кровяного давления, анализа крови (например, клинического анализа крови), электрокардиограммы (ЭКГ), функции легких, наличия кожных заболеваний или расстройств и функции печени.
В одном из вариантов осуществления настоящего изобретения эти параметры выбраны из признаков инфекций или инвазий (например, вирусных инфекций), остроты зрения, ферментов печени, кровяного давления и необязательно частоты сердечных сокращений.
Например, ЭКГ проводят до инициации введения указанного модулятора или агониста рецептора S1P.
Эти параметры также могут проверяться на протяжении времени лечения указанным модулятором или агонистом рецептора S1P.
В еще одном из вариантов осуществления настоящего изобретения предусматривают:
1 - способ введения пациенту, нуждающемуся в этом, модулятора или агониста рецептора S1P, например, финголимода, его фосфатного производного или его фармацевтически приемлемой соли, включающий стадии:
а) выяснения истории глазных заболеваний у пациента, подвергаемого лечению, до начала лечения указанным модулятором или агонистом рецептора S1P,
б) проведения офтальмологических осмотров, выполняемых по приведенному выше описанию настоящего изобретения, например, через 3-4 месяца после начала лечения указанным модулятором или агонистом рецептора S1P, предпочтительно выполненных офтальмологом, и необязательно
в) проведения офтальмологических осмотров, выполняемых, основываясь на симптомах пациента, например, с интервалами, установленными офтальмологом.
2 - способ лечения воспалительного или аутоиммунного заболевания или расстройства (например, рассеянного склероза), и ограничения проявления симптомов, ассоциированных с ними, или снижения тяжести заболевания, у пациента, нуждающемуся в этом, включающий стадии a.), б.) и в.) согласно указанному выше.
3 - модулятор или агонист рецептора S1P, например, FTY720, его фосфатное производное или его фармацевтически приемлемая соль, для применения в способе лечения воспалительного или аутоиммунного заболевания или расстройства, например, рассеянного склероза, причем указанный способ включает стадии a), б) и в) согласно указанному выше.
4 - модулятор или агонист рецептора S1P, например FTY720, его фосфатное производное или его фармацевтически приемлемая соль, для применения в лечении воспалительного или аутоиммунного заболевания или расстройства, например, рассеянного склероза, причем указанное лечение включает стадии a.), б.) и в.) согласно указанному выше.
5 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в способе лечения рассеянного склероза, причем указанное лечение включает стадии:
a') выяснения истории глазных заболеваний у пациента, подвергаемого лечению, до начала лечения FTY720, его фосфатным производным или его фармацевтически приемлемой солью,
а) проведения офтальмологических осмотров, выполняемых по приведенному выше описанию настоящего изобретения, например, через 3-4 месяца после начала лечения FTY720, его фосфатным производным или его фармацевтически приемлемой солью, предпочтительно выполненных офтальмологом, и необязательно
б) проведения офтальмологических осмотров, выполняемых, основываясь на симптомах пациента, например, с интервалами, установленными офтальмологом.
6 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в лечении рассеянного склероза, причем указанное лечение включает стадии a'), b') и c') согласно описанному выше.
В одном из вариантов осуществления настоящего изобретения предусматривают
7 - способ введения модулятора или агониста рецептора S1P, например, финголимода, его фосфатного производного или его фармацевтически приемлемой соли, пациенту, нуждающемуся в этом, включающий стадии:
г) идентификации уровня фермента печени, например, сывороточной ALT, у подвергаемого лечению пациента до первого введения указанного модулятора или агониста рецептора S1P, и введение первой дозы только в том случае, если уровень ALT не превышает > 2x ULN, и
д) идентификации уровня фермента печени, например, сывороточной ALT, у подвергаемого терапии пациента, и прерывания терапии у пациентов с желтухой или повышением фермента печени > 5x ULN.
8 - Способ лечения воспалительного или аутоиммунного заболевания или расстройства (например, рассеянного склероза) и ограничения симптомов, ассоциированных с ним, или снижения тяжести заболевания у пациента, нуждающегося в таком лечении, включающий стадии г) и д) согласно описанному выше.
9 - модулятор или агонист рецептора S1P, например FTY720, его фосфатное производное или его фармацевтически приемлемую соль, для применения в способе лечения воспалительного или аутоиммунного заболевания или расстройства, например рассеянного склероза, причем указанный способ включает стадии г) и д) согласно описанному выше.
10 - модулятор или агонист рецептора S1P, например FTY720, его фосфатное производное или его фармацевтически приемлемую соль, для применения в лечении воспалительного или аутоиммунного заболевания или расстройства, например рассеянного склероза, причем указанное лечение включает стадии г) и д) согласно описанному выше.
11 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в способе лечения рассеянного склероза, причем указанный способ включает стадии:
г) идентификации уровня фермента печени, например, сывороточной ALT, у подвергаемого лечению пациента до первого введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли и введение первой дозы только при условии, что уровень ALT не превышает > 2x ULN, и
д) идентификации уровня фермента печени, например сывороточной ALT, у подвергаемого лечению пациента, и прерывания терапии у пациентов с желтухой или повышением фермента печени > 5x ULN.
12 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль гидрохлорид FTY720, для применения в лечении рассеянного склероза, причем указанное лечение включает стадии г) и д), согласно описанному выше.
13 - В еще одном из вариантов осуществления настоящего изобретения предусматривают способ введения модулятора или агониста рецептора S1P, например, FTY720, его фосфатного производного или его фармацевтически приемлемой соли, пациенту, нуждающемуся в этом, и получения сопутствующей терапии бета-блокатором, включающий стадии:
е) измерения частоты сердечных сокращений и/или кровяного давления пациента, подвергаемого лечению, до начала лечения указанным модулятором или агонистом рецептора S1P,
ж) или измерения частоты сердечных сокращений каждые 3-5 ч, например, каждые 4 ч, в течение последующих по меньшей мере 6 ч, и/или проведения ЭКГ 3-6 ч, например, 4-6 ч, после дозирования, и
з) проведения адекватного лечения, если симптомы, связанные с брадисистолической мерцательной аритмией, наблюдают на стадии ж), например, введения атропина или изопреналина.
В одном из вариантов осуществления настоящего изобретения этот способ относится к способу введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, соли FTY720 гидрохлорида, пациенту с рассеянным склерозом.
14 - Способ лечения воспалительного или аутоиммунного заболевания или расстройства (например рассеянного склероза), и ограничения симптомов, ассоциированных с ним, или снижения тяжести заболевания, у пациента, нуждающегося в этом, включающий стадии е), ж) и з) согласно описанному выше.
15 - Модулятор или агонист рецептора S1P, например, FTY720, его фосфатное производное или его фармацевтически приемлемая соль, для применения в способе лечения воспалительного или аутоиммунного заболевания или расстройства, например, рассеянного склероза, причем указанный способ включает стадии е), ж) и з) согласно описанному выше.
16 - Модулятор или агонист рецептора S1P, например, FTY720, его фосфатное производное или его фармацевтически приемлемая соль, для применения в лечении воспалительного или аутоиммунного заболевания или расстройства, например, рассеянного склероза, причем указанное лечение включает стадии е.), ж.) и з.) согласно описанному выше.
17 - FTY720, его фосфатное производное или его фармацевтически приемлемая соль, например, соль FTY720 гидрохлорид, для применения в способе лечения рассеянного склероза, причем указанный способ включает стадии:
е') измерения частоты сердечных сокращений и/или кровяного давления у пациента, подвергаемого лечению, до начала лечения с помощью FTY720, его фосфатного производного или его фармацевтически приемлемой соли,
ж') или измерения частоты сердечных сокращений каждые 3-5 ч, например, каждые 4 ч, затем в течение по меньшей мере 6 ч, и/или проведения ЭКГ от 3 дo 6 ч, например, от 4 дo 6 ч после дозирования, и
з') проведения адекватного лечения, если симптомы, связанные с брадисистолической мерцательной аритмией, наблюдают на стадии ж), например, введения атропина или изопреналина.
18 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в лечении рассеянного склероза, причем указанное лечение включает стадии е'.), ж'.) и з'.) согласно описанному выше.
В еще одном из вариантов осуществления настоящего изобретения предусматривают
19 - способ введения модулятора или агониста рецептора S1P, например FTY720, его фосфатного производного или его фармацевтически приемлемой соли, пациенту, нуждающемуся в этом, включающий стадии:
и) наблюдения за пациентом после введения первой дозы в течение наблюдаемого периода, согласно описанному в настоящем изобретении выше, например, в течение по меньшей мере 6 ч,
к) измерения частоты сердечных сокращений у пациента после завершения этого периода,
л) или высвобождения пациента в случае, если частота сердечных сокращений составляет > 40 ударов в мин, или 40-60 ударов в мин в случае, когда эта величина не является наименьшей частотой сердечных сокращений, измеренной на протяжении периода наблюдения длительностью 6 ч; или поддержания пациента на соответствующей схеме.
Такой способ в высокой степени адаптирован для пациентов с сохраняющейся низкой частотой сердечных сокращений (например, ниже 50), или для тех, которые принимают бета-блокаторы, или для тех, у которых имеется высокий уровень предсердно-желудочкового блокирования или симптом дисфункции синусового узла.
В одном из вариантов осуществления настоящего изобретения этот способ относится к введению FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, соли FTY720 гидрохлорид, пациенту с рассеянным склерозом.
Настоящее изобретение также предусматривает:
20 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в лечении рассеянного склероза, причем указанное лечение включает стадии и), к) и л) согласно описанному выше.
21 - FTY720, его фосфатное производное или его фармацевтически приемлемую соль, например, соль FTY720 гидрохлорид, для применения в способе лечения рассеянного склероза, причем указанное лечение включает стадии и), к) и л) согласно описанному выше.
В определенных случаях, например, если у пациентов проявляются симптомы, ассоциированные с брадисистолической мерцательной аритмией, которые не заканчиваются к концу 6-часового наблюдения, 2 суточная доза также может вводиться с периодом наблюдения таким же, что и при первом введении согласно описанному выше.
Период наблюдения, описанный в настоящем изобретении выше, например, 6-часовое наблюдение, также может быть выполнен в том случае, когда пациент возобновляет применение модулятора или агониста рецептора S1P, например, FTY720, его фосфатного производного или его фармацевтически приемлемой соли, после прерывания применения лекарственного средства более чем на 4 суток, например, более чем на 6 суток, например, более чем на 8 суток, например, более чем на 10 суток, например, более чем на 12 суток, например, более чем на 14 суток, например, более чем на 18 суток, например, более чем на 21 сутки.
В другом варианте осуществления настоящего изобретения предусмотрен способ введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом, наряду с тем, что контролирование, ограничение или упразднение возможных побочных проявлений, ассоциированных или связанных с таким введением, причем пациентов с возможным риском проявления таких проявлений выявляют до введения лекарственного средства, и специфический и регулярный мониторинг подвергаемых лечению пациентов проводится, например, квалифицированным врачом.
Пациенты при возможно повышенном риске могут быть пациентами, выбранными из пациентов, у которых имеются глазные заболевания или расстройства, пациентами, демонстрирующими высокий уровень ALT, пациентами с дисфункцией печени, пациентами с гипертонией и пациентами, с сердечной недостаточностью или аритмией. Это также может относиться к пациентам с астмой, например, умеренной астмой, и/или к пациентам с диабетом.
В другом варианте осуществления настоящее изобретение может относиться к беременным женщинам.
Согласно описанному в настоящем изобретении заболевания или расстройства глаз относятся к заболеваниям или расстройствам, поражающим глаза, например, к увеиту и диабету.
К пациентам с высоким уровнем ALT относятся пациенты, у которых уровень ALT в два раза или более превышает ULN, например, до инициации лечения с помощью FTY720.
К пациентам с расстройствами сердца относятся те пациенты, у которых имеется одно или несколько расстройств, выбранных из высокого уровня предсердно-желудочкового блокирования, синдрома дисфункции синусового узла, ишемической болезни сердца, застойной сердечной недостаточности и аритмии. Например, это касается пациентов с брадисистолической мерцательной аритмией или риском ее развития, пациентов с высоким уровнем предсердно-желудочкового блокирования или с синдромом дисфункции синусового узла, пациентов с историей болезни, включающей случаи обмороков, или пациентов, подвергаемых лечению бета-блокаторами или средствами от аритмии, например, лекарственными средствами от аритмии.
Согласно настоящему изобретению предусмотрен специфический мониторинг пациентов, подвергаемых лечению модулятором или агонистом рецептора S1P, например FTY720, его фосфатным производным или его фармацевтически приемлемой солью, причем указанные пациенты с воспалительным или аутоиммунным заболеванием или расстройством, например, рассеянным склерозом, включающий одну или несколько из следующих стадий:
i) период наблюдения, например, по меньшей мере 6-часовой, например, от 4 дo 6 ч, на протяжении которого или в конце которого проверяют частоту сердечных сокращений, согласно описанному в настоящем изобретении,
ii) ежегодный осмотр кожи, начиная с введения первой дозы, согласно описанному в настоящем изобретении,
iii) регулярный анализ фермента печени, например, сывороточной ALT, согласно описанному в настоящем изобретении,
iv) офтальмологические осмотры от 2 дo 12 месяцев, например, от 3 дo 4 месяцев, начиная с введения первой дозы, согласно описанному в настоящем изобретении,
v) регулярный контроль зрительной функции у пациента, согласно описанному в настоящем изобретении.
Настоящее изобретение также предусматривает способ введения модулятора или агониста рецептора S1P, например, финголимода в форме FTY720, его фосфатного производного или его фармацевтически приемлемой соли, пациентам с воспалительным или an аутоиммунным заболеванием или расстройством, например, с рассеянным склерозом, включающий:
a) выполнение какой-либо одной из следующих стадий:
i) периода наблюдения, например, по меньшей мере 6-часового, например, от 4 дo 6 ч, на протяжении которого или в конце которого проверяют частоту сердечных сокращений, согласно описанному в настоящем изобретении,
ii) ежегодный осмотр кожи, начиная с введения первой дозы, согласно описанному в настоящем изобретении,
iii) регулярный анализ фермента печени, например, сывороточной ALT, согласно описанному в настоящем изобретении,
iv) офтальмологические осмотры от 3 дo 4 месяцев, начиная с введения первой дозы, согласно описанному в настоящем изобретении,
v) регулярный контроль зрительной функции у пациента, согласно описанному в настоящем изобретении;
и
б) при необходимости прерывание введения финголимода, основываясь на результатах одной или нескольких указанных выше стадий, или замена режима лечения и/или введение второго лекарственного средства. Стадия б) может соответствовать появлению побочных проявлений. Второе лекарственное средство может быть лекарственным средством, которое смягчает указанные возможные побочные проявления.
Прерывание введения финголимода, замена режима лечения и/или введения второго лекарственного средства может быть в случае какого-либо из следующих состояний: брадикардии или нарушений предсердно-желудочкового проведения, отека желтого пятна или другого нарушения зрения, рака кожи, измененных функций печени или повреждения печени, инфекций или гипертонии. Длительность прерывания определяется врачом.
Прерывание введения финголимода, замена режима лечения и/или введения второго лекарственного средства также может быть в случае, если число лимфоцитов у пациента становится ниже нормы или становится ниже 200/мл.
Например, стадия a) может включать один или несколько этапов:
i) мониторинг частоты сердечных сокращений у пациента,
ii) мониторинг инфекций или инвазий, например, вирусных инфекций, и
iii) проведение офтальмологических осмотров в первые 1-10 суток после начала введения.
Терапевтические дозировки
В предпочтительном варианте осуществления настоящего изобретения способы введения FTY720, его фосфатного производного или его фармацевтически приемлемой соли, согласно описанному выше в настоящем изобретении, особенно методы лечения воспалительного или аутоиммунного заболевания или расстройства, ограничивающие симптомы, ассоциированные с ними или прогрессирующие в связи с ними, например, рассеянного склероза, у пациента, нуждающегося в этом, включают введение суточной дозировки FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, FTY720 гидрохлорида, не более чем 0,5 мг, например, примерно 0,5 мг.
В одном из вариантов осуществления настоящего изобретения предусмотрено соединение, выбранное из финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, например, финголимода гидрохлорида, для применения в лечении или предупреждении воспалительного или аутоиммунного заболевания, в соответствии с чем указанное соединение вводят пациенту таким образом, что побочные проявления, ассоциированные с введением указанного соединения, контролируются, ограничиваются или упраздняются. Например, суточная дозировка финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, например финголимода гидрохлорида, не превышает 0,5 мг, например, составляет примерно 0,5 мг.
В одном из вариантов осуществления настоящего изобретения предусмотрен способ лечения рассеянного склероза, контроля или ограничения симптомов, ассоциированных с ним, или снижения тяжести указанного заболевания у пациента, нуждающегося в этом, включающий введение суточной дозировки финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, например, финголимода гидрохлорида, причем указанная суточная дозировка не превышает 0,5 мг, например, составляет примерно 0,5 мг, и в котором дополнительно у пациента имеется астма (например, умеренная астма), заболевание или расстройство, поражающее глаза, или в истории болезни имеются заболевания или расстройства глаз (например, пораженных увеитом или диабетом), высокого уровня предсердно-желудочковое блокирование, синдром дисфункции синусового узла, дисфункция печени или гипертония.
В другом варианте осуществления настоящего изобретения предусматривают способ лечения рассеянного склероза, контроля или ограничения симптомов, ассоциированных с ним, или снижения тяжести указанного заболевания пациенту, нуждающемуся в этом, включая введение суточной дозировки финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, например, финголимода гидрохлорида, причем указанная суточная дозировка не превышает 0,5 мг, например, составляет примерно 0,5 мг, причем пациентом является беременная женщина.
В еще одном из вариантов осуществления настоящего изобретения предусмотрен способ лечения рассеянного склероза, ограничивающий симптомы, ассоциированные с ним, или снижающий тяжесть указанного заболевания у пациента, нуждающегося в этом, включающий введение суточной дозировки финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, например, финголимода гидрохлорида, причем указанная суточная дозировка не превышает 0,5 мг, например, составляет примерно 0,5 мг, причем пациенты являются пациентами с рассеянным склерозом, которые никогда ранее не подвергались лечению от этого заболевания, т.е. пациенты de novo.
По настоящему изобретению адаптация режима лечения может включать снижение дозировки или увеличение времени между двумя последовательными введениями модулятора или агониста рецептора S1P, например, финголимода, его фосфатного производного или его фармацевтически приемлемой соли. Например, режим лечения может включать введение 0,25 мг финголимода, его фосфатного производного или его фармацевтически приемлемой соли дважды в сутки. Он также может состоять из поэтапного повышения дозирования лекарственного средства на протяжении первого периода введения до суточной дозировки 0,5 мг или 1,25 мг, например, адаптируя поэтапное введение, например, титрование.
Настоящее изобретение относится к способу лечения рассеянного склероза, включающему:
(a) введение варьирующей дозы лекарственного средства, выбранного из группы, состоящей из финголимод (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, пациенту, нуждающемуся в этом,
(б) мониторинг побочных проявлений, возникающих у указанного пациента,
(в) мониторинг снижения или упразднения симптомов, ассоциированных с рассеянным склерозом, и
(г) определение оптимальной дозы для указанного пациента.
Суточная доза лекарственного средства может быть не более 0,5 мг.
В другом варианте осуществления настоящего изобретения суточная доза лекарственного средства составляет более 0,5 мг, например, составляет более 1,00 мг, например, примерно 1,25 мг, например, примерно 1,5 мг.
В настоящем изобретении также предусматривают модулятор или агонист рецептора S1P, например FTY720, его фосфатное производное или его фармацевтически приемлемую соль, для применения в способе лечения воспалительного или аутоиммунного заболевания, например рассеянного склероза, причем указанный способ включает:
(a) введение варьирующей дозы указанного модулятора или агониста рецептора S1P пациенту, нуждающемуся в этом,
(б) мониторинг побочных проявлений, возникающих у указанного пациента,
(в) мониторинг снижения или упразднения симптомов, ассоциированных с указанным воспалительным или аутоиммунным заболеванием, и
(г) определение оптимальной дозы для указанного пациента.
Этот способ в высокой степени адаптирован в отношении FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, соли FTY720 гидрохлорида, для лечения рассеянного склероза.
Если модулятор или агонист рецептора S1P выбран из FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, FTY720 гидрохлорида, и заболевание является рассеянным склерозом, суточная доза лекарственного средства может не превышать 0,5 мг.
В другом варианте осуществления настоящего изобретения модулятор или агонист рецептора S1P выбран из FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, соли FTY720 гидрохлорида, и суточная доза превышает 0,5 мг, например, составляет примерно 1,00 мг, например, примерно 1,25 мг, например, примерно 1,5 мг.
В еще одном из вариантов осуществления настоящего изобретения предусмотрен персонализированный способ лечения воспалительного или аутоиммунного заболевания или расстройства, например, рассеянного склероза, для пациента, нуждающегося в этом, включающий введение указанному пациенту терапевтически эффективного количества модулятора или агониста рецептора S1P,
причем указанный способ включает:
(a) введение варьирующей дозы указанного лекарственного средства пациенту,
(б) мониторинг побочных проявлений, имеющихся у указанного пациента,
(в) мониторинг снижения или упразднения симптомов, ассоциированных с рассеянным склерозом, и
(г) определение оптимальной дозы для указанного пациента,
причем указанный режим адаптирован для лечения указанного заболевания или расстройства и контроля, снижения или устранения возможных побочных проявлений, ассоциированных с введением указанного модулятора или агониста рецептора S1P.
Приведенные выше стадии от (a) дo (г) также могут применяться в способе определения персонализированного режима терапевтического лечения лекарственным средством, выбранным из группы, состоящей из финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, для пациента с воспалительным или аутоиммунным заболеванием, например, рассеянным склерозом.
Настоящее изобретение также направлено на соединение, выбранное из FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, FTY720 гидрохлорид, для применения в способе лечения воспалительного или аутоиммунного заболевания или расстройства у пациента, нуждающегося в этом, причем указанный способ персонализирован, например, адаптирован для лечения указанного заболевания или расстройства по специфическому профилю таким образом, что побочные проявления, ассоциированные с введением указанного модулятора или агониста рецептора S1P, находятся под контролем, снижены или упразднены. В этом случае подвергаемый лечению пациент может быть выбран из пациентов, которые никогда не подвергались лечению от такого заболевания или расстройства, пациентов с сердечной недостаточностью или с аритмией, или с риском развития этих расстройств, пациентов с астмой, пациентов с глазными заболеваниями или расстройствами, дисфункцией печени или гипертонией.
Настоящее изобретение предусматривает соединение, выбранное из FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, FTY720 гидрохлорида, для применения в лечении пациентов с воспалительным или аутоиммунным заболеванием или расстройством, например, рассеянным склерозом, причем соединение вводят по типу введения, описанному выше.
Настоящее изобретение также предусматривает соединение, выбранное из FTY720, его фосфатного производного или его фармацевтически приемлемой соли, например, FTY720 гидрохлорид, для применения в лечении пациентов с воспалительным или аутоиммунным заболеванием или расстройством, например, рассеянным склерозом, причем соединение вводят на протяжении мониторинга пациента согласно описанному выше.
Комбинация
В другом варианте осуществления настоящего изобретения модулятор рецептора S1P, например, финголимод (FTY720), его фосфатное производное или его фармацевтически приемлемая соль, например, финголимод гидрохлорид, вводят вместе со вторым лекарственным средством, которое снижает возможное побочное проявление, ассоциированное с введением финголимода.
Такое второе лекарственное средство может вводиться только в том случае, если имеется побочное проявление, например, побочный эффект, или если его интенсивность или частота повышается до уровня, который более не является допустимым, например, описанного в настоящем изобретении выше.
Второе лекарственное средство может быть выбрано из группы, состоящей из лекарственных средств, которые лечат или предупреждают отек желтого пятна, противораковых агентов (например, химиотерапевтических агентов), противоинфекционных агентов, гипотензивных лекарственных средств, агентов от брадикардии и их смесей.
К примерам второго лекарственного средства относятся, но ими перечень не ограничивается, блокатор кальциевого канала (например, дилтиазем), атенолол, валсартан.
Если модулятор или агонист рецептора S1P по настоящему изобретению, например финголимод (FTY720), его фосфатное производное или его фармацевтически приемлемую соль, например, финголимод гидрохлорид, вводят вместе со вторым лекарственным средством, которое смягчает возможные побочные проявления, ассоциированные с введением финголимода, суточная дозировка указанного модулятора или агониста рецептора S1P может быть выше 0,5 мг, например, может быть выше 1,00 мг, например, выше 1,25 мг, например, примерно 1,5 мг.
Например, предусмотрена комбинация, например, набор, содержащий модулятор или агонист рецептора S1P по настоящему изобретению, например, финголимод (FTY720), его фосфатное производное или его фармацевтически приемлемую соль, например, финголимод гидрохлорид, и второе лекарственное средство, которое выбрано из группы, состоящей из противораковых агентов, противоинфекционных агентов, антимикробных агентов, противовирусных лекарственных средств и гипотензивных лекарственных средств, в соответствии с чем дозировка указанного модулятора или агониста рецептора S1P превышает 0,5 мг, например, составляет примерно 1,25 мг.
Настоящее изобретение также предусматривает специфический режим дозирования FTY720 для лечения воспалительного или аутоиммунного заболевания или расстройства, ограничения симптомов, ассоциированных с указанным заболеванием или расстройством, или их прогрессирования, например рассеянного склероза, для пациента, нуждающегося в этом, включающий введение указанному пациенту суточной дозировки финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, который приводит к снижению числа лимфоцитов в периферической крови примерно до 70-75%, например, примерно 73%, 75% или 76%.
В другом варианте осуществления настоящего изобретения предусматривают специфический режим дозирования FTY720 для лечения воспалительного или аутоиммунного заболевания или расстройства, ограничения симптомов, ассоциированных с указанным заболеванием или расстройством, или их прогрессирования, например рассеянного склероза, для пациента, нуждающемуся в этом, включающий введение указанному пациенту суточной дозировки финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, который приводит к снижению числа лимфоцитов в периферической крови до уровня, достаточно низкого для получения терапевтического эффекта в отношении заболевания наряду с контролем, ограничением или упразднением частоты возникновения инфекций. Предпочтительно такая суточная дозировка не превышает 0,5 мг финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, например, соли гидрохлорида.
Применение режима дозирования по настоящему изобретению в лечении заболеваний и состояний, согласно описанному выше, может быть продемонстрировано с помощью стандартных животных и клинических тестов, например, в соответствии со способами, описанными в настоящем изобретении.
Пример 1
Исследование: две разные суточные дозировки финголимода (0,5 мг и 1,25 мг) вводят перорально пациентам с рецидивирующе-ремиттирующим рассеянным склерозом (РРРС) в течение 24 месяцев.
1292 пациентов с РРРС из 172 центров 18 стран рандомизируют для перорального получения финголимода в дозе 0,5 мг/сутки или 1,25 мг/сутки, или 30 мкг интерферона бета1-а внутримышечно раз в неделю. Пациенты, рандомизированные по финголимоду, получают инъекции плацебо раз в неделю, и пациенты, рандомизированные по интерферону бета1-a, получают таблетку плацебо один раз в сутки.
Ежемесячно оценивают клиническое состояние пациентов на протяжении 3 месяцев, и затем раз в три месяца. Оценку по расширенной шкале оценки степени инвалидизации Куртцке (РШСИ) проводят каждые три месяца, по шкале MS Functional Composite (MSFC) каждые 6 месяцев и ежегодно проводят магнитно-резонансное исследование (МРИ). Проводят мониторинг путем офтальмологического осмотра, дерматологического осмотра, легочных функциональных проб, рентгена и/или КТ грудной клетки, амбулаторного мониторинга и эхокардиографии.
Участникам, которые заканчивают курс лечения длительностью 1 год, предлагают необязательную фазу продления. Те, кто рандомизирован по финголимоду, продолжают принимать назначенную дозу, а тех, которые находятся в группе интерферона бета1-а, рандомизируют по 2 дозам финголимода.
Результаты
Наблюдают снижение рецидивов в обеих группах применения финголимода по сравнению с интерфероном бета1-а. Для пониженной дозы наблюдают снижение рецидивов на 52% по сравнению с интерфероном бета1-а и снижение на 38% при повышенной дозе. Результаты в обеих группах применения финголимода статистически значимы в высокой степени относительно интерферона бета1-а, но статистически не отличаются друг от друга.
бета1-а
0,5 мг/сутки
1,25 мг/сутки
рецидивов за год
Доля пациентов, не показавших рецидивов, составляет 83% при применении финголимода против 69% в группе применения интерферона бета1-а.
MRI поражение действия показывает снижение в обеих группах применения финголимода в ряде новых или заново усиливающихся T2 повреждений и числа гадолиний-усиливающихся T1 повреждений через 12 месяцев.
К наблюдаемым побочным эффектам относятся брадикардия и предсердно-желудочковое блокирование, а также инфекции, включая 3 инфекции вируса герпеса.
Пример 2
Исследование: пациентов с умеренной астмой делят на 3 когорты по 12 пациентов в каждой. В каждой когорте 12 пациентов рандомизируют по FTY720 (0,5 мг, 1,25 мг и 2,5 мг в когортах 1, 2 и 3, соответственно) или плацебо в соотношении 3:1, в итоге 9 пациентов лечат FTY720 на каждом уровне дозирования и 9 пациентов получают плацебо.
Исследование состоит из периода скрининга от 12 до 26 суток, базового уровня и периода лечения длительностью 10 суток с последующей заключительной оценкой исследования (осуществленной через 1-7 суток после последней дозы).
Проводят два скрининговых визита, первоначальный скрининговый визит и второй визит на 7 сутки (+/- 1 сутки). Первоначальный скрининговый визит (визит 1) применяют для начала мониторинга легочной функциональной пробы (ЛФП) для оценки приемлемости для исследования и для получения значимой исходной информации и согласия, основанного на получении информации. ЛФП проводят по сигналу точного времени, близкому к 6-часовой временной точке после дозирования на 1 сутки. На -7 сутки опять проводят ЛФП в установленное время. Агонист β2 краткого действия применяют до лечения исследуемым медикаментом и также регистрируют на протяжении данного периода длительностью 14 суток.
Пациенты возвращаются в клинику за одни или двое суток перед дозированием для исходных оценок. Профилирование ЛФП оценивают по 7 временным точкам на протяжении визита и проводят исходные оценки. В 1 сутки пациентов рандомизируют в соотношении 3:1 к FTY720 или плацебо и оценивают профиль ЛФП по 8 временным точкам (а именно до дозирования, затем на 1, 2, 3, 4, 5, 6 и 12 ч после дозирования). Оценки легочной функциональной пробы (ЛФП) также проводят на 2, 3, 7 сутки (все отдельные временные точки оценивают примерно в то же точное время, что и 6-часовые ЛФП после дозирования на 1 сутки) и 10 сутки (7 временных точек, а именно до дозирования и затем через 1, 2, 3, 4, 5 и 6 ч после дозирования). В каждый из дней проведения оценок ЛФП, после последней за день оценки ЛФП следует тест на обратимость. Применение агониста β2 краткого действия также регистрируют на протяжении периода лечения до 11 суток включительно (24 ч после последней дозы).
Образцы крови берут за 1 сутки перед дозированием и через 1, 2, 4, 6, 8, 12, 16 и 24 ч после дозирования, на 2, 3 и 7 сутки 6 ч после дозирования и на 10 сутки перед дозированием и на 1, 2, 4 и 6 ч после дозирования.
Оценки безопасности включают медицинские осмотры, мониторинг ЭКГ, жизненных показателей, спирометрических оценок, стандартных клинических лабораторных оценок (гематологических, химического состава крови, анализа мочи), побочных проявлении и тяжелых побочных проявлений.
Только половина каждой когорты лечения, максимум из 6 пациентов, позволяет начать лечение в какие-либо данные сутки по причинам безопасности. По меньшей мере 1 сутки (24 ч) разделяют начальное дозирование пациентов первой группы от дозирования второй группы (и по меньшей мере 1 дополнительные сутки разделяют вторую группу от какой-либо из последующих групп, требуемую для пополнения каждой когорты).
Измеряют величину и длительность воздействия FTY720 на FEV1 и другие легочные функциональные пробы (FVC, FEF25-75% и FEV1/FVC).
Результаты
Величину бронхоконстрикции первоначально оценивают по установленной по базовой линии FEV1 AUC0-6h на 1 сутки. Главную переменную ФД выражают в виде соотношения AUEC FEV1 по 6-часовому профилю ЛФП на 1 сутки, разделенные той же переменной по базовой линии (сутки -1).
Главную переменную ФД исследуют по логарифмической шкале с помощью линейной модели, выверенной по (log-трансформированной) базовой линии FEV1 AUC0-6ч и группы лечения в качестве фиксированных эффектов. Среднюю геометрическую скорректированную по исходному уровню величину FEV1 AUC0-6ч получают из модели для каждой группы лечения; среднее геометрическое соотношение между каждой группой FTY720 и плацебо также получают наряду с их 95% CI, и преобразуют назад для получения среднего геометрического процента изменения от плацебо и его 95% CI.
Подсчитывают дополнительные переменные ФД: скорректированную по исходному уровню величину FEV1 AUC0-6ч на 10 сутки и скорректированную по исходному уровню величину FEV1 Emax1-6ч на 1 и 10 сутки. Переменные Emax выражают в виде соотношения между 1 сутками (или 10 сутками) и -1 сутками, относительно минимума из 6 оценок, предусмотренных с 1 по 6 ч после дозирования. Такие переменные определяют для FEV1, а также для других параметров ЛФП (FVC, FEF25-75% и FEV1/FVC) и анализируют, используя ту же модель, что и для основной конечной точки ФД.
Зависящие от времени параметры ЛФП исследуют на 1 сутки по 12-часовому профилю и на 10 сутки по 6-часовому профилю. Процент изменения от времени-сопоставляемого исходного уровня по пробам FEV1, FVC, FEF25-75% и FEV1/FVC суммируют средствами описательной статистикой по каждому визиту/временной точке. Анализируют трансформированное в логарифм соотношение времени-сопоставляемого исходного уровня, раздельно по каждому после исходного визиту/временной точке, с помощью линейной модели, скорректированной по согласованной по времени трансформированной в логарифм исходной величине и группы лечения в качестве фиксированного эффекта. Для каждой группы FTY720 получают оценку среднего отличия лечения относительно плацебо и его 95% CI получают из модели и преобразуют обратно для получения среднего геометрического процента изменения от плацебо и его 95% CI. Не проводят согласования для величин Р для различных тестирований.
Результаты показывают, что суточная дозировка 0,5 мг FTY720 безопасна и переносима пациентами с умеренной астмой.
Изобретение относится к области медицины, а именно к неврологии и иммунологии, и предназначено для лечения рассеянного склероза. Способ лечения рассеянного склероза у пациента, нуждающегося в этом, включает введение перорально указанному пациенту суточной дозы 0,5 мг лекарственного средства, выбранного из финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли. Кроме того, способ включает выявление истории болезни глаз пациента, подвергаемого лечению, до начала лечения финголимодом (FTY720), его фосфатным производным или его фармацевтически приемлемой солью, а также проведение офтальмологических осмотров, выполняемых через 3-4 месяца после начала лечения FTY720, его фосфатным производным или его фармацевтически приемлемой солью, предпочтительно офтальмологом, причем указанные обследования включают проверку и/или мониторинг появления отека желтого пятна. Использование изобретения позволяет повысить эффективность и безопасность лечения рассеянного склероза у пациента. 1 з.п. ф-лы, 2 пр.
1. Способ лечения рассеянного склероза у пациента, нуждающегося в этом, включающий введение перорально указанному пациенту суточной дозы 0,5 мг лекарственного средства, выбранного из финголимода (FTY720), его фосфатного производного или его фармацевтически приемлемой соли, причем указанный способ включает стадии:
а) выявления истории болезни глаз пациента, подвергаемого лечению, до начала лечения финголимодом (FTY720), его фосфатным производным или его фармацевтически приемлемой солью,
b) проведения офтальмологических осмотров, выполняемых через 3-4 месяца после начала лечения FTY720, его фосфатным производным или его фармацевтически приемлемой солью, предпочтительно офтальмологом, причем указанные обследования включают проверку и/или мониторинг появления отека желтого пятна, и, необязательно,
c) проведения дополнительных офтальмологических осмотров, выполняемых исходя из симптомов пациента с интервалами, определенными офтальмологом.
2. Способ по п.1, где рассеянный склероз представляет собой рецидивирующе-ремиттирующий рассеянный склероз.
| WO 2008000419 A1, 03.01.2008 | |||
| HORGA A | |||
| et al., FTY720 (fingoimod) for relapsing multiple sclerosis | |||
| Expert Rev Neurother., 2008, 8(5):699-714 | |||
| WO 2005112970 A2, 01.12.2005 | |||
| KAPPOS L et al., Oral fingolimod (FTY720) for relapsing multiple sclerosis | |||
| N Engl J Med., 2006, 355(11):1124-40 | |||
| HUTCHISON S et al., An investigation of the impact of the |
Авторы
Даты
2022-07-14—Публикация
2010-09-20—Подача