Настоящее изобретение относится к усовершенствованиям назальных композиций и к способу их использования.
Несмотря на то, что следующее описание относится почти исключительно к назальной композиции противозастойного средства и к способу ее применения, специалисты в данной области примут во внимание, что настоящее изобретение можно использовать для любой назальной композиции, используемой для какой-либо цели.
Известно назальное введение для доставки лекарственного средства пациенту для местного или системного эффекта. Примерами обыкновенно назально доставляемых лекарственных средств являются противозастойные средства и лечение аллергии. Композиции лекарственных средств типично имеют форму жидкого спрея или капель, содержащих по меньшей мере одно терапевтически активное средство, которое наносят через распыление или размещение капель в назальной полости пользователя с использованием подходящего дозатора, такого как пипетка или капельница.
Носовая полость покрыта тонкой слизистой, которая имеет хорошее кровоснабжение. Молекула лекарственного средства может быть быстро перенесена из носовой полости через один эпителиальный слой слизистой и непосредственно в системную циркуляцию крови пациента без печеночного и кишечного метаболизма. Это позволяет терапевтически активному средству оказывать быстрый эффект на организм пациента и предоставляет путь введения, альтернативный пероральному введению или другим формам введения. Проблема, связанная с назальным введением композиций лекарственных средств в жидкой форме, состоит в том, что жидкость может вытекать из носовой полости пациента под действием силы тяжести и нормального назального клиренса (т.е. через назальную секрецию или деятельность реснитчатого эпителия) прежде, чем произойдет его абсорбция через слизистую носа.
В попытке преодолеть вышеуказанную проблему, проведены начальные исследования, которые показывают, что применение одного мукоадгезивного фармацевтического раствора с противозастойным средством, содержащимся в нем, имеет более сильный и более длительный эффект у субъектов с круглогодичным аллергическим ринитом, чем стандартный коммерчески доступный раствор противозастойного средства без мукоадгезивного раствора, содержащегося в нем (Tzachev et al. - Br J Clin Phamacol. Jan 2002: 53(1): 107-109 - «Comparison of the clinical efficacy of standard and mucoadhesive based nasal decongestants»). Однако разработка любого лекарственного средства с фиксированным составом и мукоадгезивного носителя вероятно является дорогостоящей и требует времени. Следовательно, все еще сохраняется потребность в разработке коммерчески доступной назальной композиции, которая преодолевает проблемы известного уровня техники.
Следовательно, цель настоящего изобретения состоит в том, чтобы предоставить усовершенствованную назальную композицию.
Цель настоящего изобретения состоит в том, чтобы предоставить способ использования усовершенствованной назальной композиции.
Еще одна дополнительная цель настоящего изобретения состоит в том, чтобы предоставить комбинированное лечение для назального применения и способ его использования.
Еще одна дополнительная цель настоящего изобретения состоит в том, чтобы предоставить набор частей для назальной композиции и способ ее использования.
Согласно первому аспекту настоящего изобретения, предоставлена назальная композиция, указанная назальная композиция содержит или состоит из первой части композиции в форме жидкости для назального нанесения пациенту при использовании и второй части композиции в форме порошка для назального нанесения пациенту при использовании, указанную первую и вторую части композиции наносят пациенту, при необходимости, отдельно или вместе.
Заявители обнаружили, что предоставление второй порошковой части композиции продлевает время контакта первой жидкой части композиции в носовой полости со слизистой носа, тем самым увеличивая эффективность переноса жидкости через слизистую носа при использовании. Это в свою очередь увеличивает эффект какого-либо средства или терапевтического средства, который может содержаться в первой жидкой части композиции. Полагают, что способ действия частей композиции является результатом замедления клиренса первой жидкой части композиции второй порошковой частью композиции из-за создания слабых и/или временных связей между одним или несколькими компонентами первой и второй частей композиции и/или между одним или несколькими компонентами первой и второй частей композиции и слизистой носа.
Таким образом, в одном из вариантов осуществления предусмотрена вторая часть композиции с такими дозой, временем между доставкой первой и второй частей композиции и/или устройством первой и второй частей композиции, чтобы вторая часть композиции усовершенствовала мукоадгезивное действие первой части композиции относительно того, как если бы первую часть композиции давали саму по себе.
Предпочтительно изменение качеств и/или концентрации второй части композиции можно использовать для того, чтобы изменять мукоадгезивное действие первой части композиции, тем самым делая клиренс первой жидкой части композиции из носовой полости относительно более быстрым или более медленным.
В одном из вариантов осуществления первая жидкая часть композиции содержит или состоит из любых или любой комбинации из одного или нескольких терапевтически активных средств, лекарственного средства, стероида, фармацевтического препарата, противозастойного средства, средства для лечения аллергии, растительного средства, гомеопатического средства, пищевой добавки, пробиотика, дилятатора дыхательных путей и/или тому подобного.
Неограничивающие примеры противозастойных средств и неограничивающие примеры их концентраций, которые можно использовать для первой жидкой части композиции, включают ксилометазолин (т.е. 0,05% мас./мас.), оксиметазолин (т.е. 0,025-0,05% мас./мас.) и т.п.
Пример антигистаминного средства, которое можно использовать для первой жидкой части композиции, представляет собой азеластин (и неограничивающие примеры концентрации представляют собой 0,1% или 0,15% мас./мас.) и т.п.
Неограничивающие примеры назальных стероидов, которые можно использовать для первой жидкой части композиции, включают мометазона фуроат (и неограничивающий пример концентрации представляет собой 0,05% мас./мас.), флутиказона пропионат (и неограничивающий пример концентрации представляет собой 88-440 мкг на дозу), флутиказона фуроат (и неограничивающий пример концентрации представляет собой 88-440 мкг на дозу).
Пример антимускаринового средства, которое можно использовать для первой жидкой части композиции, включает ипратропия бромид (и неограничивающий пример концентрации составляет 34-500 мкг на дозу).
Пример комбинации антигистаминного средства и назального стероида, которую можно использовать для первой жидкой части композиции, включает азеластин и флутиказона пропионат.
Дозы первой жидкой части композиции типично соответствуют рекомендованным руководствам по использованию лекарственных средств для пациента, о котором идет речь, состояния заболевания и/или состояния, подлежащего лечению.
Первую жидкую часть композиции можно вносить в носовую полость пациента в форме жидкого спрея или в виде капель с использованием подходящего назального дозатора, например, такого как дозатор назального спрея, назальная пипетка, назальная капельница и/или тому подобное.
Вторую порошковую часть композиции можно вносить в носовую полость пациента в результате вдыхания пользователем назального порошка с использованием подходящего назального дозатора, такого как, например, сжимаемая бутылка и/или тому подобное. Пример возможного назального аппликатора для порошковой композиции раскрыт в EP1368090, включенном в настоящий документ посредством ссылки. Дозатор порошка типично содержит деформируемую бутылку, содержащую порошкообразную композицию и вмещающую погружную трубку. Приложение сжимающего усилия к бокам бутылки с использованием противоположных пальцев пользователя, увеличивает внутреннее давление в бутылке по сравнению с атмосферным давлением. Это ведет к потоку воздуха, который канализируют из бутылки через погружную трубку. Этот поток воздуха увлекает порошкообразный материал, высвобождая ограниченное количество порошкообразного материала из бутылки.
Предпочтительно дозирующий аппарат для первой и/или второй частей композиции дозирует предварительно определенную дозу жидкости и порошка, соответственно, тем самым контролируя дозу частей композиции для пользователя.
Предпочтительно доза первой и/или второй частей композиции представляет собой фармацевтически эффективные и/или приемлемые дозы.
В одном из вариантов осуществления вторая порошковая часть композиции содержит или состоит из каких-либо из или какой-либо комбинации из порошка целлюлозы, порошка гидроксипропилметилцеллюлозы (HPMC), одного или нескольких терапевтически активных средств, фармацевтических средств, стероида, лекарственного средства, сигнального средства, дилятаторов дыхательных путей, растительных средств, гомеопатического средства, пробиотиков, пищевых добавок и/или тому подобного, например, такого как какие-либо из или какая-либо комбинация из лекарственного средства, противозастойного средства, средства для лечения аллергии и/или тому подобного. Она также может содержать конкретный катализатор и/или усилитель пролекарственного средства, содержащегося в первой жидкой композиции.
Предпочтительно HPMC представляет собой сухой порошок и типично является инертной.
Термин «терапевтически активное средство», используемый в настоящем документе, типично представляет собой какое-либо активное вещество, подходящее для назального введения, или его неактивное пролекарственное средство, подлежащее последующей активации.
Термин «гомеопатический» или «растительный» используют в настоящем документе для обозначения продуктов, получаемых из натуральных растительных или минеральных источников.
В одном из вариантов осуществления терапевтическое, гомеопатическое и/или растительное средство может иметь одно или несколько из следующих свойств: антибактериальное, противогрибковое, противовирусное, антибиотическое, иммуномодулирующее, противовоспалительное свойства, свойство против бессонницы, свойство, усиливающее когнитивную функцию, или свойство, которое влияет на функцию сердечнососудистой системы, и/или тому подобное.
Конкретные терапевтически активные средства могут включать какие-либо из или какую-либо комбинацию из: аспирина, изопринозина, ацикловира, зверобоя продырявленного, экстракта валерианы, экстракта гинкго билоба, витаминов, чеснока, лайма имбиря, эллаговой кислоты, эхинацеи, пыльцы шведских цветов, скорлупы черного ореха, лимонного сорго, полыни, экстракта косточек грейпфрута, брокколи, пищеварительных ферментов, гиалуроновой кислоты, астрагала, плодов шиповника, горечавки, зверобоя, каштана конского, женьшеня, зеленого чая, фосфатидилсерина, фосфатидилхолина, цитрусовых, пикногенола, кофеина, кверцетина, кофермента Q10, тысячелистника, чайного дерева, сока нони, липазы, фруктоолигосахарида, инулина, чернушки посевная или аллицина, любой мяты, куркумы и/или тому подобного.
Термин «фармацевтическое средство», как используют в настоящем документе, относится к средству, которое доступно только по рецепту или для использования которого необходимо одобрение эффекта, токсичности и допуск на рынок от Medicines and Healthcare Products Regulatory Agency.
В одном из вариантов осуществления вторая часть композиции содержит или состоит из гидроксиметилцеллюлозы (HPMC), инертного порошка целлюлозы и/или тому подобного. HPMC или порошок целлюлозы остается в виде порошка до тех пор, пока не попадает в носовую полость пациента, в которой он незамедлительно превращается в гелеобразный материал при введении, поскольку взаимодействует влагой, присутствующей в носовому ходу.
В одном из вариантов осуществления вторая часть композиции содержит или состоит из порошка целлюлозы с присутствием или без присутствия одного или нескольких других средств, терапевтически активных средств, сигнальных средств, дилятаторов дыхательных путей, конкретного катализатора и/или усилителя пролекарственного средства, содержащегося в первой жидкой композиции и/или тому подобное.
Предпочтительно вторая часть композиции содержит или состоит из значительной доли порошка целлюлозы или порошка HPMC в ней. Кроме того, предпочтительно вторая часть композиции содержит по меньшей мере 50% HPMC или порошка целлюлозы, предпочтительно по меньшей мере 60, 70, 80, 90, 95, 97 или 99% порошка HPMC или целлюлозы по общей массе второй части композиции.
Предпочтительно доза второй части композиции составляет между приблизительно 1 мг и 10 мг на ноздрю пациента. Кроме того, предпочтительно доза составляет между приблизительно 2,5 мг и 7,5 мг, между приблизительно 3 и 7 мг, между приблизительно 4 и 6 мг или приблизительно 5 мг на ноздрю пациента.
Первую и/или вторую часть композиции типично дают в таких временных масштабах, которые рекомендует практикующий медик и/или до эрадикации состояния, подлежащего лечению.
В одном из вариантов осуществления вторая часть композиции представляет собой HPMC порошковую композицию как изложено в EP1824450, включенном в настоящий документ посредством ссылки.
Порошок HPMC или целлюлозы имеет вязкость приблизительно 10-20 Па×с (паскаль в секунду) во 2% водном растворе при 20°C, предпочтительно приблизительно 13-17 Па×с, более предпочтительно 14-16 Па×с и наиболее предпочтительно 15 Па×с. Вязкость типично измеряют с использованием вискозиметра Уббелоде.
Предпочтительно вторая композиция относится, продаваемому под торговым названием NASALEZE®, NoAL®, NASVAL, BOOTS ALLERGY BARRIER, ALERBLOCK или другими названиями в качестве лицензированных владельцами торговых марок Naslaeze International Ltd. Продукты под этими торговыми названиями стандартно используют в качестве изолирующих средств для того, чтобы изолировать контаминанты и микробы и предотвратить их проникновение на слизистую носа пациента. В настоящем изобретении продукты используют новым путем в качестве закупоривающих средств для того, чтобы закупоривать жидкость, внесенную в носовую полость до или после ее введения.
В одном из вариантов осуществления вторая часть композиции содержит какие-либо из или какую-либо комбинацию из бихромата калия; загустителя, такого как камедь или крахмал; разрыхлителя, такого как гликолят натрия или сшитый повидон, разделительного средства, такого как стеарат магния; эмульгирующего средства, поверхностно-активного средства, средств против спекания, гранулирующих средств, консервантов, красящих веществ и/или тому подобного.
В одном из вариантов осуществления вторая часть композиции содержит сигнальное или ароматизирующее средство, которое может предоставлять пациенту приятную сенсорную обратную связь при использовании, что позволяет пациенту распознавать, что имело место введение второй части композиции. Сигнальное средство может включать какие-либо из или какую-либо комбинацию из мяты, ментола, мяты колосовой, любой мяты, куркумы, лимона, лайма, перечной мяты, эвкалипта, лаванды, цитрусовых, клубники, капсаицина и/или тому подобного.
В одном из вариантов осуществления сигнальное средство содержит вплоть до 50% второй части композиции, предпочтительно вплоть до 40%, 30%, 20%, 10%, 5%, 2%, 1%, 0,5% или 0,25% по общей массе композиции.
В одном из вариантов осуществления вторую часть композиции вводят пациенту до или прямо перед введением первой части композиции.
В одном из вариантов осуществления первую часть композиции вводят пациенту до или прямо перед введением второй части композиции.
В одном из вариантов осуществления первую часть композиции и вторую часть композиции вводят одновременно или по существу одновременно.
Предпочтительно первую и вторую части композиции, независимо от порядка, в котором их вводят, вводят последовательно одну за другой, и предпочтительно незамедлительно друг после друга. Более предпочтительно, вторую часть композиции вводят последней или второй в последовательности.
В одном из вариантов осуществления первую и вторую части композиции вводят меньше чем через или через 5 минут друг после друга; предпочтительно меньше чем через или через 2 минуты друг после друга; более предпочтительно меньше чем через или через 1 минуту друг после друга; и еще более предпочтительно меньше чем через или через 30 секунд друг после друга, 20 секунд, 10 секунд, 5 секунд, 1 секунду друг после друга.
В одном из вариантов осуществления композиция может содержать или состоять из третьей части композиции и/или одной или нескольких дополнительных частей композиции в дополнение к первой и второй частям композиции. Третью и/или дополнительные части композиции можно вводить назально в любом требуемом порядке с первой и второй частями композиции, хотя предпочтительно вторую часть композиции вводят последней в последовательности. Третью и/или дополнительные части композиции можно вводить незамедлительно до, между или после первой и второй частей композиции, в течение предварительно определяемого периода времени после этого, по существу одновременно и/или тому подобное. Пример третьей части композиции, которую можно давать в комбинации с первой частью композиции, представляет собой использование антигистаминного средства с назальным кортикостероидом, таким как, например, азеластин и флутиказона пропионат.
В одном из вариантов осуществления композиция состоит из первой части композиции и второй части композиции за исключением какой-либо другой части композиции.
В одном из вариантов осуществления первая часть композиции, вторая часть композиции и/или третья и/или дополнительные части композиции представляют собой отдельные, независимо применяемые части композиции, которые не смешивают вместе или не вступают в контакт друг с другом до внесения в носовую полость пациента.
Композицию по настоящему изобретению можно использовать для того, чтобы обеспечивать местный эффект в носовому ходу пациента, или она может быть абсорбирована в кровоток и использована для того, чтобы обеспечивать системный эффект у пациента, при необходимости.
Согласно одному независимому аспекту по настоящему изобретению, предоставлена назальная композиция, указанная назальная композиция содержит первую часть композиции для назального нанесения пациенту при использовании и по меньшей мере вторую часть композиции для назального нанесения пациенту при использовании, указанную первую и вторую части композиции наносят отдельно или вместе, при необходимости, вторая часть композиции устроена с тем, чтобы увеличивать мукоадгезию одного или нескольких компонентов первой композиции слизистой носа пациента при использовании.
Предпочтительно первая часть композиции имеет форму жидкости.
Предпочтительно вторая часть композиции имеет форму порошка.
По одному из аспектов по настоящему изобретению предусмотрена комбинированная назальная терапия, указанная комбинированная назальная терапия содержит первую часть композиции в форме жидкости для назального нанесения пациенту при использовании и вторую часть композиции в форме порошка для назального нанесения пациенту при использовании, указанные первую и вторую части композиции наносят отдельно или вместе, при необходимости.
По одному из аспектов по настоящему изобретению предусмотрен набор частей для назальной композиции, указанный набор частей содержит первую часть композиции в форме жидкости для назального нанесения пациенту при использовании и вторую часть композиции в форме порошка для назального нанесения пациенту при использовании, указанные первую и вторую части композиции наносят отдельно или вместе, при необходимости.
По одному из аспектов по настоящему изобретению предусмотрен способ лечения пациента с использованием назальной композиции. Лечение может быть эффективным для заболеваний, связанных с дыхательными путями, аллергическими заболеваниями, ринитом, верхними дыхательными путями, нижними дыхательными путями пациента, в качестве противозастойного средства, риновирусом, простудой и/или тому подобным.
По одному из аспектов по настоящему изобретению предусмотрена композиция для изготовления лекарственного средства для лечения заболевания или расстройства, связанного с дыхательными путями, аллергических заболеваний, ринитом, верхними дыхательными путями, нижними дыхательными путями пациента, указанная назальная композиция содержит или состоит из первой части композиции в форме жидкости для назального нанесения пациенту при использовании и вторая часть композиции в форме порошка для назального нанесения пациенту при использовании, указанную первую и вторую части композиции наносят пациенту отдельно или вместе, при необходимости.
Далее описан вариант осуществления настоящего изобретения со ссылкой на сопроводительные фигуры, на которых:
на фиг. 1a и 1b приведено наглядное представление в разрезе, выполненном через носовую полость пациента и верхние дыхательные пути 1, иллюстрирующее состояние после использования только AFRIN® (распространяет Merck Consume Care, Inc) с содержащимся в нем противозастойным активным средством оксиметазолин, показанным с помощью номера позиции 2, и состояние после использования AFRIN®+NoAL® (поставляет Nasaleze Ltd) в комбинации, показанной с помощью номера позиции 4, соответственно. Более темная штриховка номера позиции 4 показывает закупоривающий эффект, создаваемый посредством использования NoAL® в комбинации с AFRIN® по сравнению с использованием только AFRIN®;
на фиг. 2 представлена упрощенная иллюстрация дизайна исследования, которое проводили для того, чтобы показать эффекты у 40 пациентов, использованных в клиническом исследовании;
на фиг. 3 представлена упрощенная иллюстрация распределения возрастов и полов пациентов, использованных в клиническом исследовании, представленном на фиг. 2;
на фиг. 4 представлен график, показывающий значения базовой максимальной скорости выдоха через нос (PNIF) (л/мин) в сутки 1, 8 и 15 исследования;
на фиг. 5 представлен график, показывающий значения максимальной скорости выдоха через нос (PNIF) (л/мин) после инсуффляции оксиметазона в A. сутки 1 и B. сутки 8;
на фиг. 6 представлены оценки VAS для зуда в носу/чихания в сутки 1, 8 и 15 исследования;
В одном центре проводили клиническое исследование для того, чтобы определять эффективность назальной композиции, которая основана на последовательном нанесении двух коммерчески доступных частей композиции. Первая часть композиции имеет форму существующего коммерчески доступного неадгезивного противозастойного жидкого состава и вторая часть композиции имеет форму существующего коммерчески доступного порошка, содержащего целлюлозу, чтобы определять, если вторая часть композиции может «закупоривать» неадгезивный противозастойный состав на месте внутри носовой полости пациента.
Предложенный принцип действия содержащего целлюлозу порошка состоит в том, что при контакте содержащего целлюлозу порошка со слизистой носа пациента, порошок превращается в адгезивный гель, который замедляет назальный клиренс первой части композиции при последующем улучшении терапевтически активного противозастойного средства, содержащегося в первой части композиции.
Способ
Первая используемая часть композиции представляла собой противозастойный жидкий продукт, называемый AFRIN® (распространяет Merck Consume Care, Inc), с содержащимся в нем противозастойным активным средством оксиметазолин 0,05%. Вторая используемая часть композиции представляла собой микронизированный порошок метилцеллюлозы, называемый NoAL (поставляет Nasaleze Ltd), лицензированный для лечения аллергического ринита. Первую и вторую части композиции пациент вводил в свою носовую полость незамедлительно друг после друга. Схема дозирования составляла 1 вдув/впрыск AFRIN, незамедлительно после чего следовал 1 вдув/впрыск NoAL, раз в сутки в течение 7 суток и затем только.
Двойное слепое рандомизированное исследование с плацебо включало 40 пациентов, страдающих круглогодичным аллергическим ринитом от умеренно-тяжелого до тяжелого, при выраженном назальном застое. Нарушенная функция назального барьера входит в аллергический ринит, что ведет к персистирующему воспалению и клиническим симптомам, среди которых назальный застой играет важную роль. Исследование осуществляли вне сезона пыления, между ноябрем и январем. Критерии включения также включали положительную скарификационную пробу (папула диаметром >3 мм) по меньшей мере на один из панели круглогодичных аллергенов. Критерии исключения охватывали индивидуумов с сезонным аллергическим ринитом или назальным полипозом; пациентов с серьезными хроническими сопутствующими заболеваниями; с гриппоподобными симптомами в течение последних 30 суток; беременных или лактирующих женщин и индивидуумов, неспособных давать информированное согласие, исключали.
Половину пациентов (20 пациентов) отбирали случайным образом для введения композиции группы 1, которое представляло собой введение AFRIN (назальный спрей оксиметазолина, 0,05%) и NoAL (порошок целлюлозы), и половину пациентов (20 пациентов) отбирали случайным образом для введения композиции группы 2, которое представляло собой введение AFRIN (оксиметазолин) и плацебо в форме порошка лактозы, как показано на фиг. 2. Композиции группы 1 и группы 2 вводили пациентам в сутки 1 и пациентов тестировали в сутки 1 после введения композиции, в сутки 8 и в сутки 15. Пациенты вводили композиции группы 1 и группы 2 регулярно ежедневно между сутками 1 и сутками 8. Средства экстренной терапии назначали только пациентам между сутками 8 и сутками 15 с плацебо и без дальнейшего получения оксиметазолина и NoAL.
Среди пациентов, участвовавших в исследовании, 10 пациентов группы 1 составляли мужчины и 10 пациентов группы 1 составляли женщины; 7 пациентов группы 2 составляли мужчины и 13 пациентов группы 2 составляли женщины. Возрастной диапазон пациентов группы 1 составлял 18-49 лет, при среднем возрасте 36 лет и медианном возрасте 36 лет. Возрастной диапазон пациентов группы 2 составлял 21-48 лет, при среднем возрасте 33 года и медианном возрасте 33 года, как показано на фиг. 3.
Параметры, измеряемые в исследовании у каждого пациента в сутки 1, 8 и 15, включали максимальную скорость выдоха через нос (PNIF) с использованием измерителей PNIF (In-Check Nasal, Clement Clarke International Ltd, Harlow, Essex, UK), которая представляет собой меру дыхательной функции; сахариновый тест; и субъективные симптомы измеряли с использованием визуальной аналоговой шкалы (VAS) и оценок симптомов от 0 до 3 в дневниках. Общий дискомфорт из-за симптомов аллергического ринита регистрировали во время визитов на 10-см VAS в диапазоне от «нет назальных симптомов» на 0 см до «наихудшие назальные симптомы» на 10 см. Пациенты также оценивали свою заложенность, ринорею, зуд и чихание с помощью оценки симптома между 0 (нет) и 3 (наихудший). По ним вычисляли общую оценку назальных симптомов (TNSS). PNIF, л/мин, измеряли в сутки 1 непосредственно перед введением лекарственного средства и через 1, 5, 15, 30, 60, 120, 180, 240, 300 и 360 минут после этого и анализировали площади под кривыми. Схожие измерения PNIF выполняли в сутки 8 и одно измерение выполняли в сутки 15. Сахариновый тест представляет собой меру назального мукоцилиарного клиренса и включает размещение небольшой частицы сахарина приблизительно в 1 см позади переднего конца нижней носовой раковины. При наличии нормального мукоцилиарного действия, сахарин будет сметен назад в носоглотку пациента и пациент почувствует сладкий вкус. Невозможность пациента обнаруживать сладкий вкус в пределах 10-20 минут обозначает задержку мукоцилиарного клиренса.
Статистический анализ
Значения PNIF распределялись по нормальному закону и различия внутри групп анализировали с использованием критерия Стьюдента для парных данных и между группами критерия Стьюдента для непарных данных. Поскольку число раз, когда пациенты прибегали к средству экстренной терапии, не было распределено по нормальному закону, эти результаты приведены в виде медианы (диапазон 25-75%), а групповые различия оценивали с использованием U-критерия Манна-Уитни. Все критерии были двусторонними и задавали порог для статистической значимости P<0,05.
Результаты
Из 40 пациентов, участвовавших в исследовании, 2 выпали из группы тестируемого лечения, 1 из-за несоблюдения и другой из-за головной боли; и 2 выпали из группы плацебо, 1 из-за сопутствующего заболевания и другой из-за тяжелой реакции на кошку. Остальные 36 пациентов совершили все 3 посещения и были включены в конечный анализ.
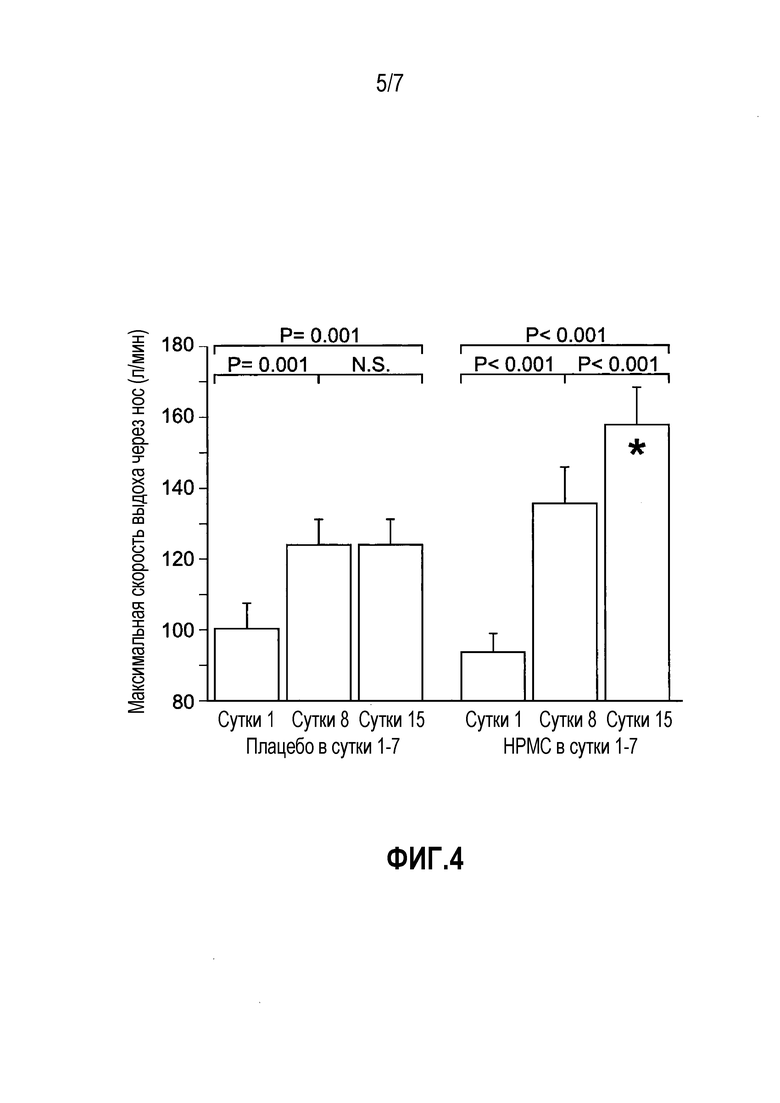
На фиг. 4 представлен график средних значений PNIF в начале исследования (сутки 1), после 7 суток лечения с использованием порошка HPMC или плацебо (сутки 8) и после дополнительных 7 суток только экстренного лечения (сутки 15). Каждая группа содержит результаты от 18 индивидуумов. Уровни значимости вычисляли с использованием критерия Стьюдента для парных данных. * обозначает, что базовая PNIF у пациентов, которых лечили HPMC, на 15 сутки была значительно (P=0,014) выше, чем таковая у пациентов, которых лечили плацебо. Значение вычисляли с использованием критерия Стьюдента для непарных данных.
Результаты в группе HPMC демонстрировали 26% (P<0,001) в PNIF в сутки 8 и дополнительно 21% увеличение P<0,001) в сутки 15. Общее увеличение PNIF между сутками 1 и 15 составляло 53% (P<0,001). В группе плацебо имело место 24% в PNIF (P<0,001) в сутки 8, но без дополнительного увеличения в сутки 15. Отсутствовала значительная разница между группами в сутки 1 и 8, но PNIF в группе HPMC была на 26% выше (P=0,014), чем таковая в группе плацебо в сутки 15.
На фиг. 5 представлены значения PNIF после инсуффляции оксиметазолина в A. сутки 1 и B. сутки 8. Точки представляют собой пациентов, которых лечили HPMC, и точки с крестами представляют собой группу плацебо. Каждая группа содержит результаты от 18 индивидуумов. Уровни значимости вычисляли с использованием критерия Стьюдента для непарных данных. И в те, и в другие сутки эффекты оксиметазолина были выше у пациентов, также вдыхавших HPMC, по сравнению с группой плацебо. В сутки 1 площадь под кривой (AUC) для 360 минут наблюдений за оксиметазолином была на 20% больше у пациентов, принимавших HPMC, по сравнению с теми, которые принимали плацебо (56,366 +/- 14,910 л×мин/мин против 46,818 +/-12,080 л×мин/мин, P=0,042). В сутки 8 AUC для оксиметазолина была на 23% больше в группе HPMC, чем в группе плацебо (60,855 +/- 13691 л×мин/мин против 49,350 +/- 11211 л×мин/мин, P=0,009).
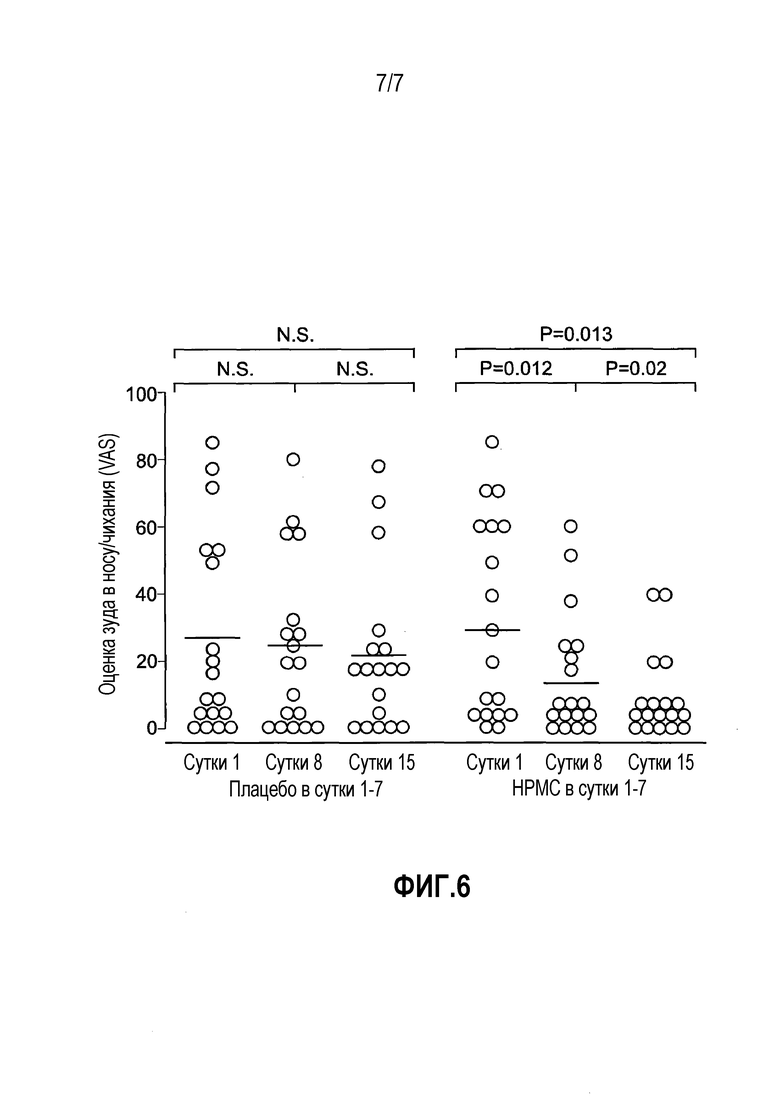
На фиг. 6 представлены VAS оценки зуда в носу/чихания в сутки 1, 8 и 15 исследования. Темные точки представляют собой пациентов, которых лечили плацебо, а светлые точки представляют собой пациентов, которых лечили HPMC. Каждая группа содержит результаты от 18 индивидуумов. Уровни значимости вычисляли с использованием критерия Стьюдента для парных данных. Статистические значимые различия между группами отсутствовали.
VAS оценки от пациентов в сутки 1, 8 и 15 для заложенности носа, ринореи, зуда/чихания и общих назальных симптомов представлены в таблице 1.
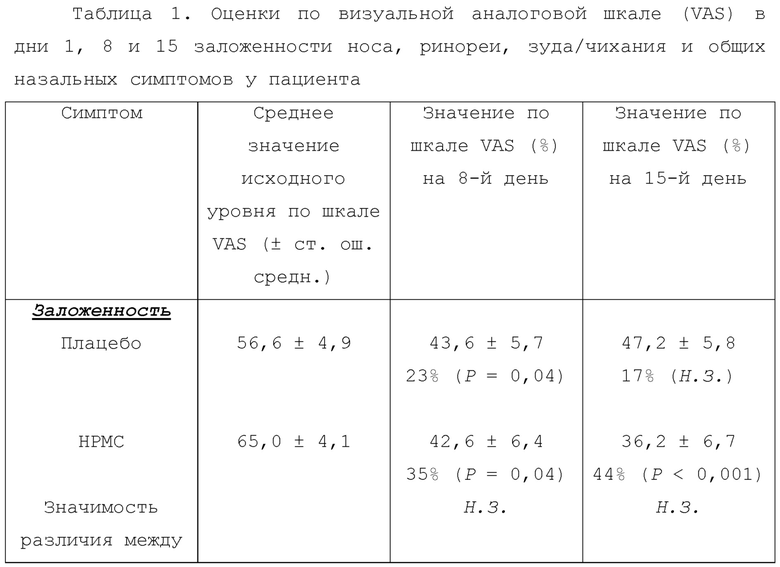

В группе плацебо имели место значительные улучшения в заложенности носа, ринореи и общих назальных симптомах в сутки 8, но небольшое или нулевое дополнительное улучшение после этого. В группе лечения HPMC имели место схожие улучшения этих параметров в сутки 8. Однако в этой группе оказалось, что эти улучшения продолжались вплоть до суток 15. При использовании общих назальных симптомов улучшение между сутками 8 и 15 было статистически значимым (P=0,006). Статистически значимые различия между группами отсутствовали. Схожий паттерн результатов получали при анализе дневников пациентов в сутки 1, 8 и 15 исследования.
Особого внимания заслуживает зуд в носу/чихание. Значительное улучшение этого симптома в группе плацебо отсутствовало. Однако в группе лечения HPMC имели место значительные улучшения 56% (P=0,012) и 74% (P=0,013) в сутки 8 и 15, соответственно. Также улучшение между сутками 8 и 15 было статистически значимым (P=0,02). Однако различия между группами лечения не достигли статистической значимости, главным образом, из-за числа пациентов, дававших низкие оценки зуда/чихания во все момент времени (см. фиг. 6).
Медианное число (при размахе 25 и 75%) раз, когда пациенты прибегали к экстренному лечению, впрыскам оксиметазолина, в течение суток 8-15 исследования, составляло 8,5 (1-15,5) для группы HPMC и 16 (11,5-16) для группы плацебо. Имела место широкая вариабельность между пациентами, которые делали невозможной статистическую значимость различий между группами (P=0,076). Однако 13 из 18 пациентов, которые принимали плацебо в сутки 1-7, принимали больше чем 2 впрыска оксиметазолина в сутки по сравнению только с 5 пациентами, которых лечили HPMC (P=0,04, точный критерий Фишера).
Заключение об исследовании демонстрирует, что использование микронизированного порошка метилцеллюлозы (HPMC) усиливало противозастойный эффект назального оксиметазолина у пациентов с круглогодичным аллергическим ринитом. Одна неделя регулярного лечения назальным оксиметазолином и HPMC увеличивала носовую проходимость, и этот эффект сохранялся в течение по меньшей мере еще одной недели после прекращения. Этот сохраняющийся эффект может быть результатом HPMC усиления мукозального барьера при аллергическом рините.
Заявители предполагают, что имеют место два возможных механизма, посредством которых HPMC может действовать для того, чтобы усиливать эффект терапии оксиметазолином. Первый является чисто физическим. Поскольку HPMC инсуффлировали непосредственно после оксиметазолина, формирование гелевого слоя поверх противозастойного средства вероятно будет снижать его клиренс со слизистой носа и тем самым увеличивать его эффективность. Такой эффект будет возникать даже при первой дозе, как наблюдали в сутки 1 исследования. Посредством второго механизма HPMC создает улучшенный барьер для проникновения аллергена в слизистую носа. В долгосрочной перспективе это снижает эпизоды воспаления барьера слизистой, тем самым снижая назальную реактивность. Об этой активности свидетельствует, в частности, увеличенная базовая PNIF, индекс заложенности носа, вплоть до 15 суток в группе лечения HPMC.
Несмотря на то, что исследование проводили только в отношении пациентов, страдающих круглогодичным аллергическим ринитом, результаты исследования подсказывают, что схожий эффект может быть обнаружен у пациентов, страдающих от других дыхательных и/или аллергических жалоб.





Изобретение относится к области фармацевтики и медицины, а именно к способу лечения ринита, включающему введение комбинации, содержащей или состоящей из первой части в форме жидкого противозастойного средства с 0,05% мас./мас. активного агента оксиметазолина и второй части, содержащей или состоящей из порошка гидроксипропилметилцеллюлозы (HPMC), при этом обе части предназначены для назального нанесения пациенту, где после указанной первой части, введенной пациенту, следует введение второй части комбинации, при этом схема дозирования комбинации представляет собой один вдув или впрыск первой части комбинации, после чего следует один вдув или впрыск второй части комбинации один раз в сутки в течение 7 суток, при этом первую часть комбинации и вторую часть комбинации не вводят в течение суток 8-15. Технический результат заключается в продлении времени контакта первой жидкой части комбинации в полости носа со слизистой оболочкой носа и увеличении эффективности переноса жидкости через слизистую носа при использовании второй порошковой части, благодаря чему повышается эффективность терапевтического средства, содержащегося в первой жидкой части, а также в сохранении эффекта в течение недели после прекращения лечения при заявленном режиме дозирования. 10 з.п. ф-лы, 6 ил., 1 табл., 1 пр.
1. Способ лечения ринита, включающий введение комбинации, содержащей или состоящей из первой части в форме жидкого противозастойного средства с 0,05% мас./мас. активного агента оксиметазолина, и второй части, содержащей или состоящей из порошка гидроксипропилметилцеллюлозы (HPMC), при этом обе части предназначены для назального введения пациенту, где после указанной первой части, введенной пациенту, следует введение второй части комбинации, при этом схема дозирования комбинации представляет собой один вдув или впрыск первой части комбинации, после чего следует один вдув или впрыск второй части комбинации один раз в сутки в течение 7 суток, при этом первую часть комбинации и вторую часть комбинации не вводят в течение суток 8-15.
2. Способ по п. 1, где вторая часть содержит по меньшей мере 50% HPMC или где вторая часть содержит по меньшей мере 60, 70, 80, 90, 95 или 99% порошка HPMC по общей массе второй части.
3. Способ по п. 1, где порошок HPMC имеет вязкость 10-20 Па×с в 2% водном растворе при 20°C или где порошок HPMC имеет вязкость 13-17 Па×с, 14-16 Па×с или 15 Па×с.
4. Способ по п. 1, где вторая часть содержит какие-либо из или какую-либо комбинацию из бихромата калия; загустителя, камеди, крахмала; разрыхлителя, гликолята натрия, сшитого повидона, разделительного средства, стеарата магния; эмульгирующего средства, поверхностно-активного средства, средств против спекания, гранулирующих средств, консервантов или красящего вещества, сигнального или ароматизирующего средства, которое может обеспечивать пациенту приятную сенсорную обратную связь при использовании.
5. Способ по п. 4, где сигнальное средство включает какие-либо из или какую-либо комбинацию из мяты, ментола, мяты колосовой, любой мяты, куркумы, лимона, лайма, перечной мяты, эвкалипта, лаванды, цитрусового или капсаицина.
6. Способ по п. 5, где сигнальное средство содержит вплоть до 50% второй части или где сигнальное средство содержит вплоть до 40%, 30%, 20%, 10%, 5%, 2%, 1%, 0,5% или 0,25% по общей массе второй части.
7. Способ по п. 1, где первая часть комбинации представляет собой AFRIN®.
8. Способ по п. 1, где вторая часть комбинации представляет собой NoAL®.
9. Способ по любому из пп. 1-6, где ринит представляет собой аллергический ринит.
10. Способ по п. 1, где первую часть комбинации вводят в носовую полость пациента в форме жидкого спрея или в виде капель с использованием подходящего назального дозатора, и вторую часть комбинации вводят в форме порошка в носовую полость через носовое вдыхание пациентом.
11. Способ по п. 1, где доза второй части комбинации составляет между 1 мг и 10 мг на ноздрю пациента, или где доза второй части комбинации составляет между 2,5 мг и 7,5 мг, между 3 и 7 мг, между 4 и 6 мг или 5 мг на ноздрю пациента.
| WO 2006040596 A2, 20.04.2006 | |||
| US 2007104791 A1, 10.05.2007 | |||
| US 2004209852 A1, 21.10.2004 | |||
| ЗАХАРЖЕВСКАЯ Т | |||
| В | |||
| и др | |||
| Эффективность и безопасность назального спрея "Назаваль" в профилактике и лечении персистирующего аллергического ринита // Российский аллергологический журнал | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| - N | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| - С | |||
| Машина для разделения сыпучих материалов и размещения их в приемники | 0 |
|
SU82A1 |
Авторы
Даты
2022-10-06—Публикация
2015-06-08—Подача