Настоящая патентная заявка испрашивает приоритет согласно предварительной заявке на патент Индии № 3174/MUM/2013, поданной 4 октября 2013 года, полное содержание которой включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящая патентная заявка относится к способу лечения аллергического ринита у субъекта (предпочтительно человека) путем введения комбинации мометазона или его соли и олопатадина или его соли.
УРОВЕНЬ ТЕХНИКИ
Аллергический ринит является медицинским термином, относящимся к воспалению и раздражению слизистой оболочки носа. Аллергический ринит, как правило, возникает, когда аллерген, такой как пыльца, пыль или перхоть животных (частицы отшелушившейся кожи и волос), вдыхается субъектом с чувствительной иммунной системой. Аллергический ринит может вызывать дополнительные симптомы, такие как ринорея (обильные выделения из носа), чихание, зуд в носу, заложенность носа и обструкция, кашель, головня боль, утомление и недомогание. Симптомы могут варьировать по тяжести между людьми.
Для лечения аллергического ринита доступны многие способы лечения, такие как, например, антигистаминные препараты (например, цетиризин и лоратадин), стероиды (например, триамцинолон), противоотечные средства и антагонисты рецепторов лейкотриена (например, монтелукаст). Указанные средства лечения, как правило, вводят перорально или назально.
Олопатадина гидрохлорид - антигистаминное средство, которое химически описывается как (Z)-11-[3-(диметиламино)пропилиден]-6,11-дигидродибенз[b, e]оксепин-2-уксусной кислоты гидрохлорид и описано в патентах США № 4871865 и 4923892. В США он является коммерчески доступным в виде назального спрея PATANASE®, который содержит 0,6% масс./об. олопатадина (в виде основания) в нестерильном водном растворе. Олопатадина гирохлорид показан для облегчения симптомов сезонного аллергического ринита (САР) у взрослых и детей 6 лет и старше.
Мометазона фуроат представляет собой глюкокортикостероид, применяемый местно для уменьшения воспаления кожи или дыхательных путей. В США мометазона фуроата моногидрат является коммерчески доступным в виде назального спрея NASONEX®, показанного для (i) лечения назальных симптомов аллергического ринита у пациентов ≥ 2 лет, (ii) лечения заложенности носа, связанной с сезонным аллергическим ринитом у пациентов ≥ 2 лет, (iii) профилактики сезонного аллергического ринита у пациентов ≥ 12 лет и (iv) лечения назальных полипов у пациентов ≥ 18 лет. Он доступен в виде дозы 50 мкг в распыляющем дозирующем устройстве с ручным насосом, содержащем водную суспензию мометазона фуроата моногидрата, эквивалентного 0,05% масс./масс. мометазона фуроата (рассчитан на безводной основе).
В международной публикации № WO 2011/141929 описан водный раствор назального спрея, содержащий флутиказон и олопатадин.
В патенте США № 6127353 описана фармацевтическая композиция мометазона фуроата моногидрата.
В патентах США № 7977376 и 8399508 описана лекарственная форма олопатадина гидрохлорида для местного применения.
В международной публикации № WO 2011/008923 описана схема применения назального спрея, содержащего олопатадин, у детей.
В международной публикации № WO 1995/020393 описано применение мометазона фуроата для лечения заболеваний дыхательных путей и легких.
В международной публикации № WO 2010/025236 описана комбинация назального стероида и назального антигистаминного средства для лечения вирусных инфекций верхних дыхательных путей, инфекций верхних дыхательных путей и простуды.
Остается необходимость в удобных для применения и эффективных способах лечения аллергического ринита.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к комбинации мометазона или его соли и олопатадина или его соли с фиксированной дозой и ее применению для лечения ринита у субъекта, нуждающегося в указанном лечении. Авторы изобретения неожиданно обнаружили, что мометазона фуроат и олопатадина гидрохлорид оказывают синергическое действие при лечении аллергического ринита и являются более эффективными и обеспечивают лучшее терапевтические значение, чем лечение только одним каким-либо активным ингредиентом.
Согласно варианту реализации, настоящее изобретение относится к способу лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту эффективного количества фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль. Предпочтительно композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день. Каждое впрыскивание предпочтительно содержит мометазон или его соль и олопатадин или его соль в массовом отношении от примерно 1:5 до примерно 1:60, например, в массовом отношении от примерно 1:12 до примерно 1:53, от примерно 1:13,3 до примерно 1:50 или от примерно 1:18 до примерно 1:40 (в расчете на эквивалентную массу свободного основания олопатадина). Согласно одному варианту реализации изобретения, фармацевтическая композиция с фиксированной дозой представляет собой суспензию, при этом мометазон или его соль присутствует в виде частиц, и олопатадин или его соль присутствует в растворенном виде.
Другой вариант реализации относится к способу лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту эффективного количества фармацевтической композиции с фиксированной дозой, содержащей мометазона фуроата моногидрат и олопатадина гидрохлорид. Согласно одному предпочтительному варианту реализации изобретения, композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день. Каждое впрыскивание фармацевтической композиции может содержать олопатадина гидрохлорид, эквивалентный примерно 300 мкг, примерно 450 мкг, примерно 600 мкг, примерно 750 мкг или примерно 900 мкг олопатадина, и примерно 12,5 мкг, примерно 25 мкг, примерно 37,5 мкг, примерно 50 мкг или примерно 62,5 мкг мометазона фуроата. Согласно одному варианту реализации, каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и примерно 25 мкг мометазона фуроата. Согласно другому варианту реализации, каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и примерно 50 мкг мометазона фуроата.
Аллергический ринит в контексте настоящего изобретения включает, но не ограничивается указанными, воспаление и раздражение слизистой оболочки носа и связанные с ними назальные и/или неназальные симптомы. Аллергический ринит включает, например, персистирующий аллергический ринит, круглогодичный аллергический ринит, сезонный аллергический ринит, хронический ринит, медикаментозный ринит, вазомоторный ринит, инфекционный ринит, вегетативный ринит, гормональный ринит, ринит, вызванный лекарственным средством, атрофический ринит и вкусовой ринит. Предпочтительно аллергический ринит выбран из круглогодичного аллергического ринита, персистирующего аллергического ринита, сезонного аллергического ринита и связанных с ними назальных и/или неназальных симптомов.
В контексте настоящего изобретения назальные и/или неназальные симптомы, связанные с аллергическим ринитом, включают, например, чихание, зуд в носу, ринорею (насморк или обильные выделения из носа), заложенность носа, кашель, глазной прурит, избыточное слезоотделение, головную боль, утомление и недомогание.
Другой вариант реализации настоящего изобретения относится к способу лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту эффективного количества фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:12 до примерно 1:53, при этом (i) композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю один или два раза в день, и (ii) каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и от примерно 25 мкг до примерно 50 мкг мометазона фуроата. Согласно одному варианту реализации, композицию вводят в течение примерно 1 недели. Согласно другому аспекту варианта реализации, композицию вводят в течение примерно 2 недель.
Еще один вариант реализации изобретения относится к способу лечения аллергического ринита у субъекта, представляющего собой человека, нуждающегося в указанном лечении, включающему назальное введение указанному человеку фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль, при этом (i) композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю один или два раза в день в течение по меньшей мере 1 или 2 недель, и (ii) каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и от примерно 25 мкг до примерно 50 мкг мометазона фуроата. Согласно одному варианту реализации изобретения, суммарный показатель тяжести назальных симптомов (TNSS) у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения снижается по меньшей мере на 40%, предпочтительно по меньшей мере на 50% по сравнению с исходным уровнем. Согласно другому варианту реализации изобретения, суммарный показатель тяжести глазных симптомов (TOSS) у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения снижается по меньшей мере на 30%, предпочтительно по меньшей мере на 40% по сравнению с исходным уровнем.
Согласно одному варианту реализации, субъект страдает персистирующим аллергическим ринитом и получает лечение в течение 4 или 6 недель.
Согласно другому варианту реализации, у субъекта наблюдается положительная инъекционная кожная проба на аллерген. Альтернативно, у субъекта также может наблюдаться положительный анализ крови на аллергию.
Согласно еще одному варианту реализации, способ включает отсутствие у указанного субъекта через 1 или 2 недели лечения значительных побочных эффектов, связанных с лечением.
Другой вариант реализации относится к способу лечения сезонного аллергического ринита и/или назальных симптомов, связанных с сезонным аллергическим ринитом, у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту синергической комбинации, содержащей мометазона фуроат и олопатадина гидрохлорид, при этом комбинация представлена в виде фармацевтической композиции, содержащей мометазона фуроат и олопатадина гидрохлорид в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:13,3 до примерно 1:53,2 (в расчете на эквивалентную массу свободного основания олопатадина).
Согласно дополнительным вариантам реализации, способы лечения аллергического ринита у субъекта (например, человека), описанные в настоящей заявке, включают назальное введение указанному субъекту фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль, в соответствии с одной из следующих схем:
a) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю один раз в день в течение периода, составляющего по меньшей мере 1 неделю;
b) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю один раз в день в течение периода, составляющего по меньшей мере 1 неделю;
c) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю два раза в день в течение периода, составляющего по меньшей мере 1 неделю;
d) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю два раза в день в течение периода, составляющего по меньшей мере 1 неделю;
e) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю один раз в день в течение периода, составляющего 2 недели;
f) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю один раз в день в течение периода, составляющего 2 недели;
g) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю два раза в день в течение периода, составляющего 2 недели; или
h) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю два раза в день в течение периода, составляющего 2 недели.
Согласно аспекту изобретения, композицию вводят в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта (например, человека) по меньшей мере один раз в день в течение периода, составляющего 1 неделю или 2 недели. Согласно другому аспекту варианта реализации, каждое впрыскивание композиции содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и от примерно 25 мкг до примерно 50 мкг мометазона фуроата. Предпочтительно каждое впрыскивание композиции содержит примерно 665 мкг олопатадина гидрохлорида (что эквивалентно примерно 600 мкг олопатадина) и примерно 25 мкг или примерно 50 мкг мометазона фуроата. Согласно еще одному аспекту варианта реализации, суммарный показатель тяжести назальных симптомов (TNSS) у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения снижается по меньшей мере на 40% или по меньшей мере на 50% по сравнению с исходным уровнем. Согласно другому аспекту варианта реализации изобретения, суммарный показатель тяжести глазных симптомов (TOSS) у человека через 1 или 2 недели лечения снижается по меньшей мере на 30% или по меньшей мере на 40% по сравнению с исходным уровнем. Согласно еще одному аспекту варианта реализации, у указанного человека через 1 или 2 недели лечения не наблюдается значительных побочных эффектов, связанных с лечением. Согласно еще одному аспекту варианта реализации, субъект, представляющий собой человека, представляет собой пациента, у которого наблюдается положительная инъекционная кожная проба на аллерген.
Другой вариант реализации изобретения относится к применению мометазона или его соли и олопатадина или его соли в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:12 до примерно 1:53 для изготовления фармацевтической композиции с фиксированной дозой для лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении. Предпочтительно, композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта один или два раза в день. Согласно одному аспекту, фармацевтическая композиция с фиксированной дозой представляет собой суспензию, в которой мометазон или его соль присутствует в виде частиц, и олопатадин или его соль присутствует в растворенном виде. Согласно другому аспекту варианта реализации изобретения, композицию вводят в течение периода, составляющего примерно 1 или 2 недели. Суммарный показатель тяжести назальных симптомов (TNSS) у субъекта, представляющего собой человека, через 1 или 2 недели лечения предпочтительно снижается по меньшей мере на 40% или по меньшей мере на 50% по сравнению с исходным уровнем. Суммарный показатель тяжести глазных симптомов (TOSS) у субъекта, представляющего собой человека, через 1 или 2 недели лечения предпочтительно снижается по меньшей мере на 30% или по меньшей мере на 40% по сравнению с исходным уровнем. Согласно еще одному аспекту варианта реализации, у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения не наблюдается значительных побочных эффектов, связанных с лечением. Согласно еще одному аспекту варианта реализации изобретения, субъект, представляющий собой человека, представляет собой пациента, у которого наблюдается положительная инъекционная кожная проба на аллерген.
Другой вариант реализации изобретения относится к фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль в массовом отношении от примерно 1:5 до примерно 1:60 для применения для лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, при этом указанную композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день. Согласно одному аспекту фармацевтическая композиция с фиксированной дозой представляет собой суспензию, при этом мометазон или его соль присутствует в виде частиц (например, имеющих средний размер от примерно 1 до примерно 20 мкм или от примерно 1 до примерно 15 мкм), и олопатадин или его соль присутствует в растворенном виде.
Композицию можно вводить в течение периода, составляющего примерно 1 неделю, 2 недели, 4 недели, 6 недель или 8 недель. Суммарный показатель тяжести назальных симптомов (TNSS) у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения предпочтительно снижается по меньшей мере на 40% или по меньшей мере на 50% по сравнению с исходным уровнем. Суммарный показатель тяжести глазных симптомов (TOSS) у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения предпочтительно снижается по меньшей мере на 30% или по меньшей мере на 40% по сравнению с исходным уровнем. Согласно другому аспекту варианта реализации изобретения, у указанного субъекта, представляющего собой человека, через 1 или 2 недели лечения не наблюдают значительных побочных эффектов, связанных с лечением. Согласно другому аспекту варианта реализации изобретения, субъект, представляющий собой человека, представляет собой пациента, у которого наблюдается положительная инъекционная кожная проба на аллерген.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой гистограмму, показывающую эффект контроля с использованием физиологического раствора, овальбуминового контроля, олопатадина гидрохлорида (эквивалентного 50 мкг основания олопатадина), мометазона фуроата (10 мкг) и комбинации мометазона фуроата (10 мкг) и олопатадина гидрохлорида (эквивалентного 50 мкг основания олопатадина) на ответ у морских свинок, проявляющийся чиханием, как описано в Примере 1.
Фигура 2 представляет собой гистограмму, показывающую эффект контроля с использованием физиологического раствора, овальбуминового контроля, олопатадина гидрохлорида (эквивалентного 50 мкг основания олопатадина), мометазона фуроата (10 мкг) и комбинации мометазона фуроата (10 мкг) и олопатадина гидрохлорида (эквивалентного 50 мкг основания олопатадина) на общее количество клеток в назальном смыве морских свинок, как описано в Примере 1.
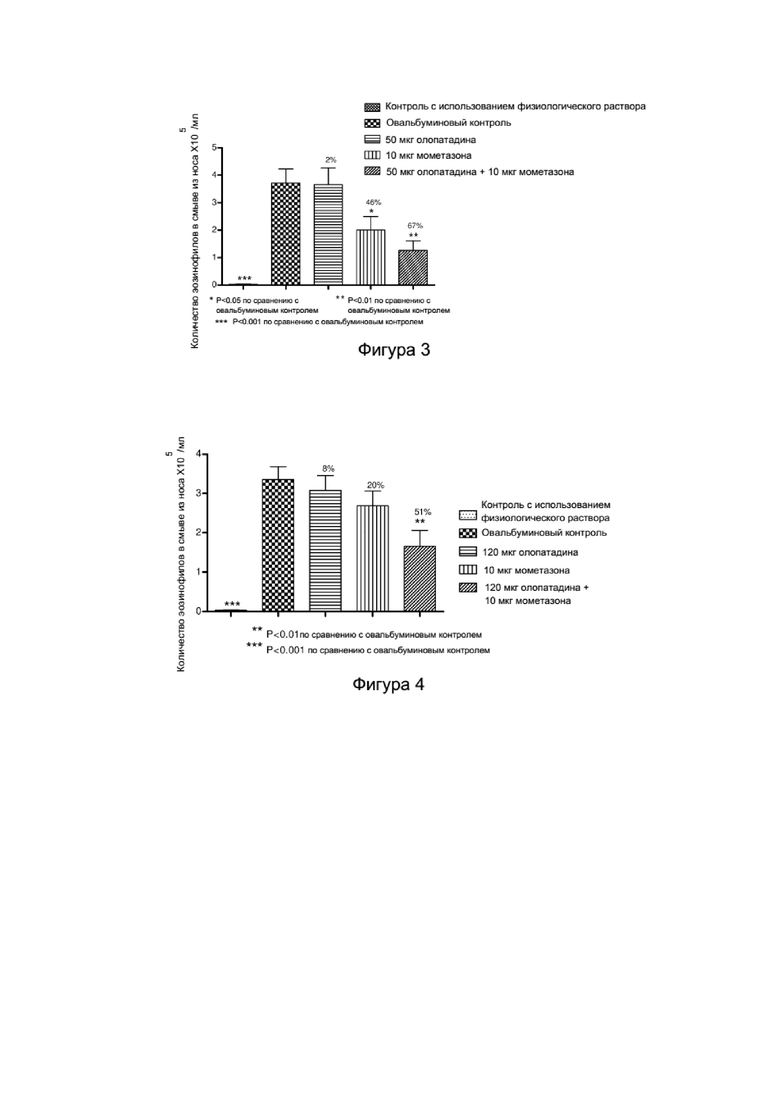
Фигура 3 представляет собой гистограмму, показывающую эффект контроля с использованием физиологического раствора, овальбуминового контроля, олопатадина гидрохлорида (эквивалентного 50 мкг основания олопатадина), мометазона фуроата (10 мкг) и комбинации мометазона фуроата (10 мкг) и олопатадина гидрохлорида (эквивалентного 50 мкг основания олопатадина) на количество эозинофилов в назальном смыве морских свинок, как описано в Примере 1.
Фигура 4 представляет собой гистограмму, показывающую эффект контроля с использованием физиологического раствора, овальбуминового контроля, олопатадина гидрохлорида (эквивалентного 120 мкг основания олопатадина), мометазона фуроата (10 мкг) и комбинации мометазона фуроата (10 мкг) и олопатадина гидрохлорида (эквивалентного 120 мкг основания олопатадина) на количество эозинофилов в назальном смыве морских свинок, как описано в Примере 2.
Фигура 5 представляет собой гистограмму, показывающую эффект контроля с использованием физиологического раствора, овальбуминового контроля, олопатадина гидрохлорида (эквивалентного 120 мкг основания олопатадина), мометазона фуроата (10 мкг) и комбинации мометазона фуроата (10 мкг) и олопатадина гидрохлорида (эквивалентного 120 мкг основания олопатадина) на общее количество клеток в назальном смыве морских свинок, как описано в Примере 2.
Фигура 6 представляет собой гистограмму, показывающую эффект контроля с использованием физиологического раствора, овальбуминового контроля, олопатадина гидрохлорида (эквивалентного 120 мкг основания олопатадина), мометазона фуроата (10 мкг) и комбинации мометазона фуроата (10 мкг) и олопатадина гидрохлорида (эквивалентного 120 мкг основания олопатадина) на ответ, проявляющийся чиханием, у морских свинок, как описано в Примере 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Далее следуют определения терминов, используемых в настоящей заявке. В случае несоответствия между определением, приведенным в настоящей заявке, и определением, приведенным ранее в предварительной заявке, согласно которой испрашивается приоритет в настоящей заявке, определение, приведенное в настоящей заявке, имеет преимущественную силу.
Термин «эффективное количество» или «терапевтически эффективное количество» означает количество активного ингредиента, которое при введении субъекту для лечения аллергического ринита обеспечивает предполагаемый терапевтический благоприятный эффект у субъекта. Термин «активный ингредиент» (используемый взаимозаменяемо с термином «активный» или «активное вещество» или «лекарственное средство») при использовании в настоящей заявке включает мометазон или его соль и олопатадин или его соль.
Термин «соль» или «фармацевтически приемлемая соль» означает такие соли, которые по результатам тщательной медицинской проверки подходят для применения в контакте с тканями человека и низших животных и не вызывают чрезмерной токсичности, раздражения и аллергических реакций, в соответствии с благоприятным соотношением польза/риск, и являются эффективными при их предполагаемом применении. Примеры солей присоединения кислот включают, но не ограничиваются указанными, следующие соли: гидрохлорид, гидробромид, сульфат, бисульфат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, мезилат, цитрат, малеат, фумарат, фуроат, сукцинат, тартрат, аскорбат, глюкогептонат, лактобионат и лаурилсульфат. Примеры солей щелочных или щелочноземельных металлов включают, но не ограничиваются указанными, соли натрия, кальция, калия и магния. Предпочтительно соль мометазона представляет собой мометазона фуроат (например, мометазона фуроата моногидрат), и соль олопатадина представляет собой олопатадина гидрохлорид.
При использовании в настоящей заявке, термин «мометазон и его соль» также включает гидраты мометазона и его солей, такие как моногидрат, например, мометазона фуроата моногидрат.
Все ссылки на массу или массовое соотношение, включая ссылки в отношении олопатадина или его соли или олопатадина или его солей, приведены в расчете на эквивалентную массу свободного основания олопатадина, если иное специально не указано.
Термин «лечить» или «лечение» при использовании в настоящей заявке также включает профилактику, ослабление, предотвращение, облегчение или подавление расстройства.
Термин «синергический» или «синергическое действие» при использовании в настоящей заявке относится к комбинации, обеспечивающей эффект, превышающий эффект, ожидаемый от суммы эффектов отдельных компонентов указанной комбинации. Термин «синергический» или «синергическое действие» в отношении комбинации мометазона или его соли с олопатадином или его солью, которая используется для лечения аллергического ринита (например, в виде фармацевтической композиции, комбинированного продукта или набора в соответствии с изобретением), относится к эффективности лечения аллергического ринита, превышающей эффективность, ожидаемую от суммы эффектов ее отдельных компонентов. Преимущества синергических комбинаций согласно настоящему изобретению включают, но не ограничиваются указанными, повышенную эффективность по сравнению с каждым из ингредиентов при их использовании по отдельности, снижение требуемой дозы одного или более активных ингредиентов комбинации, снижение побочных эффектов одного или более активных соединений комбинации и/или улучшение переносимости одного или более активных ингредиентов у субъекта, нуждающегося в лечении аллергического ринита.
Термин «фармацевтически приемлемые наполнители» означает любой из компонентов фармацевтической композиции, отличный от активных агентов, и который одобрен органами контроля или считается в целом безопасным для применения у человека или животных.
Термин «субъект» включает млекопитающих типа человека и других животных, таких как домашние животные (например, домашние питомцы, включая кошек и собак) и недомашние животные (например, дикие животные). Предпочтительно субъект представляет собой человека. Пациент, представляющий собой человека, может быть любого возраста. Согласно одному варианту реализации, возраст субъекта, представляющего собой человека, составляет по меньшей мере 2 года, по меньшей мере 12 лет или по меньшей мере 18 лет. Согласно другому варианту реализации изобретения, возраст субъекта, представляющего собой человека, составляет от 18 до 65 лет.
Термин «аллергический ринит» при использовании в настоящей заявке относится к аллергическому и/или воспалительному заболеванию слизистой оболочки носа и включает, но не ограничивается указанными, воспаление и раздражение слизистой оболочки носа и связанные с ними назальные и/или неназальные симптомов. Как правило, аллергический ринит включает персистирующий аллергический ринит, круглогодичный аллергический ринит, сезонный аллергический ринит, хронический ринит, медикаментозный ринит, вазомоторный ринит, инфекционный ринит, вегетативный ринит, гормональный ринит, вызванный лекарственным средством ринит, атрофический ринит и вкусовой ринит. Предпочтительно аллергический ринит включает круглогодичный аллергический ринит, персистирующий аллергический ринит, сезонный аллергический ринит и связанные с ними назальные и/или неназальные симптомы. Более предпочтительно аллергический ринит включает сезонный аллергический ринит и связанные с ним назальные и/или неназальные симптомы.
В контексте настоящего изобретения назальные и/или неназальные симптомы, связанные с аллергическим ринитом, включают, например, чихание, зуд в носу, ринорею (насморк или обильные выделения из носа), заложенность носа, кашель, глазной прурит, избыточное слезоотделение, головную боль, утомление и недомогание.
Способы лечения
Настоящее изобретение относится к применению комбинации мометазона или его соли и олопатадина или его соли с фиксированной дозой для лечения аллергического ринита у субъекта, нуждающегося в указанном лечении. Авторы изобретения неожиданно обнаружили, что мометазона фуроат и олопатадина гидрохлорид оказывают синергическое действие при лечении аллергического ринита, и их комбинация является более эффективной и обеспечивает лучшее терапевтическое значение по сравнению с лечением только каким-либо одним активным ингредиентом.
Согласно варианту реализации настоящее изобретение относится к способу лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту эффективного количества фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль. Предпочтительно композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день. Каждое впрыскивание может содержать мометазон или его соль и олопатадин или его соль в массовом отношении от примерно 1:5 до примерно 1:60, от примерно 1:10 до примерно 1:55 или от примерно 1:12 до примерно 1:53 или от примерно 1:13,3 до примерно 1:50. Предпочтительно массовое отношение мометазона или его соли к олопатадину или его соли варьирует от примерно 1:18 до примерно 1:40 или от примерно 1:24 до примерно 1:26,6. Согласно варианту реализации, фармацевтическая композиция с фиксированной дозой представляет собой суспензию, в которой мометазон или его соль присутствует в виде частиц, и олопатадин или его соль присутствует в растворенном виде.
Другой вариант реализации изобретения относится к способу лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту эффективного количества фармацевтической композиции с фиксированной дозой, содержащей мометазона фуроата моногидрат и олопатадина гидрохлорид. Композицию можно вводить назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день. Каждое впрыскивание фармацевтической композиции может содержать олопатадина гидрохлорид, эквивалентный примерно 300 мкг, примерно 450 мкг, примерно 600 мкг, примерно 750 мкг или примерно 900 мкг олопатадина, и примерно 12,5 мкг, примерно 25 мкг, примерно 37,5 мкг, примерно 50 мкг или примерно 62,5 мкг мометазона фуроата. Согласно одному варианту реализации, каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и примерно 25 мкг мометазона фуроата. Согласно другому варианту реализации изобретения, каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и примерно 50 мкг мометазона фуроата. Предпочтительно каждое впрыскивание содержит примерно 665 мкг олопатадина гидрохлорида (что эквивалентно примерно 600 мкг олопатадина) и примерно 25 мкг или примерно 50 мкг мометазона фуроата.
Другой вариант реализации относится к способу лечения аллергического ринита у субъекта, нуждающегося в указанном лечении, включающему назальное введение человеку фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:12 до примерно 1:53 или от примерно 1:13,3 до примерно 1:50 или от примерно 1:18 до примерно 1:40, при этом указанную композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю один или два раза в день. Каждое впрыскивание может содержать олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и от примерно 25 мкг до примерно 50 мкг мометазона фуроата. Согласно одному аспекту варианта реализации, композицию вводят в течение примерно 1 недели. Согласно другому аспекту варианта реализации, композицию вводят в течение примерно 2 недель.
Еще один вариант реализации изобретения относится к способу лечения аллергического ринита у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль, при этом указанную композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю один или два раза в день в течение по меньшей мере 1 или 2 недель. Каждое впрыскивание может содержать олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и от примерно 25 мкг до примерно 50 мкг мометазона фуроата. Согласно одному варианту реализации, суммарный показатель тяжести назальных симптомов (TNSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 40% или предпочтительно по меньшей мере на 50% по сравнению с исходным уровнем. Согласно другому аспекту варианта реализации, суммарный показатель тяжести глазных симптомов (TOSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 30% или предпочтительно по меньшей мере на 40% по сравнению с исходным уровнем.
В контексте настоящего изобретения, оценка по шкале общей тяжести назальных симптомов (TNSS) включает сумму баллов для заложенности носа, ринореи, зуда и чихания на момент окончания лечения (например, через 1 или 2 недели) по сравнению с исходным уровнем. Дополнительная оценка по шкале общей тяжести глазных симптомов (TOSS) включает зуд в глазах, повышенное слезообразование/слезоточивость глаз и покраснение глаз на момент окончания лечения по сравнению с исходным уровнем.
Другой вариант реализации представляет собой способ лечения аллергического ринита у субъекта, при этом у указанного субъекта наблюдается положительная инъекционная кожная проба на аллерген. Инъекционную кожную пробу можно поставить путем прокола кожи иглой или булавкой, содержащей небольшое количество поллинозного аллергена. Согласно одному варианту реализации, указанному субъекту до введения комбинации олопатадина и мометазона, описанной в настоящей заявке, проводят инъекционную кожную пробу, которая приводит к образованию папулы диаметром по меньшей мере на 3 мм больше по сравнению с отрицательным контролем, таким как физиологический раствор.
Способы лечения, описанные в настоящей заявке, можно применять у субъектов, при этом субъекты, у которых, например, через 1 или 2 недели лечения наблюдаются какие-либо значительные побочные эффекты, связанные с лечением, отсутствуют.
Связанные с лечением побочные эффекты в контексте настоящего изобретения могут включать, но не ограничиваются указанными, нарушения со стороны глаз (например, конъюнктивит), нарушения со стороны желудочно-кишечного тракта (например, вздутие живота, диарею, диспепсию, дисфагию и язву желудка, гемороидальное кровотечение, гиперхлоргидрию, тошноту и рвоту и зубную боль), общие расстройства (например, утомляемость, местную припухлость, периферический отек, боль и лихорадку), инфекции и инфестации (например, ротовой герпес и инфекцию верхних дыхательных путей), травмы, отравления и осложнения, вызванные проведением процедур согласно исследованию, нарушения со стороны скелетной мускулатуры и соединительной ткани (например, артралгию), нарушения со стороны нервной системы (например, нарушение внимания, головокружение, дисгевзию и головную боль), нарушение со стороны репродуктивной системы и молочной железы (например, дисменорею), нарушения со стороны дыхательной системы, органов грудной клетки и средостения (например, пересохшее горло, затрудненное дыхание, носовое кровотечение, заложенность носа, дискомфорт в носу, кровотечение в дыхательных путях, ринорею, раздражение глотки и кашлевой синдром верхних дыхательных путей), нарушения со стороны кожи и подкожной ткани (например, сыпь и крапивницу).
Другой вариант реализации относится к способу лечения сезонного аллергического ринита и/или назальных симптомов, связанных с сезонным аллергическим ринитом, у субъекта (например, человека), нуждающегося в указанном лечении, включающему назальное введение указанному субъекту синергической комбинации, содержащей мометазона фуроат и олопатадина гидрохлорид, при этом комбинация представлена в виде фармацевтической композиции, содержащей мометазона фуроат и олопатадина гидрохлорид в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:13,3 до примерно 1:53,2 (в расчете на эквивалентную массу свободного основания олопатадина).
Синергические эффекты комбинации мометазона фуроата и олопатадина гидрохлорида можно оценить различными способами. Один способ оценки эффективности агента для лечения аллергического ринита представляет собой модель вызванного овальбумином ринита у морских свинок. В таких моделях эффект лечения исследуют на животных, которым проводят сенсибилизацию и стимуляцию овальбумином с последующим подробным анализом их ответа, проявляющегося чиханием, с помощью плетизмографии всего тела и подсчета общего числа эозинофилов в образце смыва из носа.
Фармацевтическую композицию с фиксированной дозой, содержащую мометазон или его соль и олопатадин или его соль, можно вводить указанному субъекту в соответствии с одной из следующих схем:
a) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю один раз в день в течение периода, составляющего по меньшей мере 1 неделю;
b) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю один раз в день в течение периода, составляющего по меньшей мере 1 неделю;
c) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю два раза в день в течение периода, составляющего по меньшей мере 1 неделю;
d) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю два раза в день в течение периода, составляющего по меньшей мере 1 неделю;
e) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю один раз в день в течение периода, составляющего 2 недели;
f) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю один раз в день в течение периода, составляющего 2 недели;
g) композицию вводят назально в виде 1 впрыскивания в каждую ноздрю два раза в день в течение периода, составляющего 2 недели; или
h) композицию вводят назально в виде 2 впрыскиваний в каждую ноздрю два раза в день в течение периода, составляющего 2 недели.
Согласно аспекту изобретения, композицию вводят в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день в течение периода, составляющего 1 неделю или 2 недели. Согласно другому аспекту варианта реализации изобретения, каждое впрыскивание композиции содержит олопатадина гидрохлорид, эквивалентный примерно 600 мкг олопатадина, и от примерно 25 мкг до примерно 50 мкг мометазона фуроат. Предпочтительно каждое впрыскивание композиции содержит примерно 665 мкг олопатадина гидрохлорида (что эквивалентно примерно 600 мкг олопатадина) и примерно 25 мкг или примерно 50 мкг мометазона фуроата.
Согласно еще одному аспекту варианта реализации, суммарный показатель тяжести назальных симптомов (TNSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 40% или по меньшей мере на 50% по сравнению с исходным уровнем. Согласно еще одному аспекту варианта реализации изобретения, суммарный показатель тяжести глазных симптомов (TOSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 30% или по меньшей мере 40% по сравнению с исходным уровнем. Согласно еще одному аспекту варианта реализации изобретения, у указанного субъекта через 1 или 2 недели лечения не наблюдается значительных побочных эффектов, связанных с лечением. Согласно еще одному аспекту варианта реализации изобретения, указанный субъект представляет собой пациента, у которого наблюдается положительная инъекционная кожная проба на аллерген.
Другой вариант реализации изобретения относится к применению мометазона или его соли и олопатадина или его соли в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:12 до примерно 1:53 для изготовления фармацевтической композиции с фиксированной дозой для лечения аллергического ринита у субъекта, нуждающегося в указанном лечении, при этом указанную композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта один или два раза в день. Согласно одному варианту реализации изобретения, фармацевтическая композиция с фиксированной дозой представляет собой суспензию, при этом мометазон или его соль присутствует в виде частиц, и олопатадин или его соль присутствует в растворенном виде.
Согласно другому аспекту варианта реализации, композицию вводят в течение периода, составляющего примерно 1 или 2 недели. Согласно еще одному аспекту варианта реализации изобретения, суммарный показатель тяжести назальных симптомов (TNSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 40% или по меньшей мере на 50% по сравнению с исходным уровнем. Согласно другому аспекту варианта реализации изобретения, суммарный показатель тяжести глазных симптомов (TOSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 30% или по меньшей мере на 40% по сравнению с исходным уровнем. Согласно еще одному аспекту варианта реализации изобретения, у указанного субъекта через 1 или 2 недели лечения не наблюдается значительных побочных эффектов, связанных с лечением. Согласно еще одному аспекту варианта реализации изобретения, у указанного субъекта наблюдается положительная инъекционная кожная проба на аллерген.
Другой вариант реализации относится к фармацевтической композиции с фиксированной дозой, содержащей мометазон или его соль и олопатадин или его соль в массовом отношении от примерно 1:5 до примерно 1:60 или от примерно 1:12 до примерно 1:53, для применения для лечения аллергического ринита у субъекта, нуждающегося в указанном лечении, при этом указанную композицию вводят назально в виде 1 или 2 впрыскиваний в каждую ноздрю указанного субъекта по меньшей мере один раз в день. Согласно еще одному аспекту, фармацевтическая композиция с фиксированной дозой представляет собой суспензию, при этом мометазон или его соль присутствует в виде частиц (например, имеющих средний размер от примерно 1 до примерно 20 мкм или от примерно 1 до примерно 15 мкм), и олопатадин или его соль присутствует в растворенном виде. Согласно еще одному аспекту варианта реализации изобретения, композицию вводят в течение периода, составляющего примерно 1 или 2 недели. Согласно еще одному варианту реализации изобретения, суммарный показатель тяжести симптомов ринита (TNSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 40% или по меньшей мере на 50% по сравнению с исходным уровнем. Согласно еще одному аспекту варианта реализации изобретения, суммарный показатель тяжести глазных симптомов (TOSS) у указанного субъекта через 1 или 2 недели лечения снижается по меньшей мере на 30% или по меньшей мере на 40% по сравнению с исходным уровнем. Согласно еще одному варианту реализации изобретения, у указанного субъекта через 1 или 2 недели лечения не наблюдается значительных побочных эффектов, связанных с лечением. Согласно еще одному аспекту варианта реализации изобретения, субъект представляет собой пациента, у которого наблюдается положительная инъекционная кожная проба на аллерген.
Композицию можно вводить в течение периода, составляющего примерно 1 неделю, 2 недели, 4 недели, 6 недель или 8 недель.
В контексте настоящего изобретения фармацевтическая композиция с фиксированной дозой, содержащая мометазон или его соль, олопатадин или его соль, предпочтительно представлена в виде назального спрея в контейнере с одним или более фармацевтически приемлемыми наполнителями (например, хелатирующими агентами, консервантами, буфером, поверхностно-активными веществами, изотоническим агентом, корригирующими вкус агентами, суспендирующими агентами, увлажнителями, антиоксидантами и разбавителями) и набором, обеспечивающим рекомендации по применению и введению указанной композиции. Фармацевтическая композиция может, например, быть представлена в виде любой из лекарственных форм, описанных в международной патентной заявке № PCT/IB2014/064251, поданной 4 сентября 2014 года, или патентной заявке № 14/483837, поданной 11 сентября 2014 года, обе из которых включены в настоящую заявку посредством ссылки.
Фармацевтическую композицию можно вводить назально с помощью устройства назального спрея (например, устройства, способного доставлять аэрозоль в ноздри субъекта для местного воздействия на слизистую оболочку носа).
Следующие примеры предложены для обеспечения возможности осуществления изобретения на практике специалистом в данной области техники и приведены исключительно в качестве иллюстрации и не ограничивают объем настоящего изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Эффект мометазона и олопатадина и их комбинации на модели вызванного овальбумином ринита у самцов морских свинок.
Самцов морских свинок линии Dunkin Hartley активно сенсибилизировали путем подкожной инъекции 1,5 мг овальбумина и 20 мг геля гидроксида алюминия на 0 и 7 день. Морским свинкам проводили интраназальную сенсибилизацию с помощью 2% овальбумина с 14 по 17 день. На 28 день животным проводили интраназальную стимуляцию 6% овальбумином.
Разделение животных на группы
Активно сенсибилизированных животных во время эксперимента рандомно распределяли в одну из следующих 5 групп (см. Таблицу 1).
A: Контроль с использованием физиологического раствора (лечение носителем / стимуляция физиологическим раствором),
B: Овальбуминовый контроль (лечение носителем / стимуляция овальбумином),
C: 50 мкг олопатадина гидрохлорида (в расчете на эквивалентную массу свободного основания олопатадина) (лечение 50 мкг олопатадина гидрохлорида / стимуляция овальбумином),
D: 10 мкг мометазона фуроата (лечение 10 мкг мометазона фуроата / стимуляция овальбумином) и
E: Комбинация (лечение 10 мкг мометазона фуроата + 50 мкг олопатадина гидрохлорида (в расчете на эквивалентную массу свободного основания олопатадина) / стимуляция овальбумином).
Введение соединения
10 мкг мометазона фуроата вводили интраназально за 24 часа и за 1 час до конечной стимуляции овальбумином. Олопатадина гидрохлорид вводили интраназально за 1 час до конечной стимуляции овальбумином. Объем дозирования составлял 40 мкл на животное. Группа контроля с использованием физиологического раствора и группа овальбуминового контроля получали носитель (40 мкл, 0,1% Твин 80 в дистиллированной воде).
Таблица 1
Группы животных
Оценка in vivo
Измерение ответа, проявляющегося чиханием
Ответ, проявляющийся чиханием, определяли с использованием плетизмографии всего тела (Buxco Research Systems, США) в течение 50 минут после конечной стимуляции физиологическим раствором или овальбумином.
Смыв из носа
Назальный смыв получали через 4 часа после стимуляции животных физиологическим раствором или овальбумином на 28 день. Животным проводили анестезию избыточной дозой уретана, обнажали трахею и осуществляли назальный смыв с использованием 2 мл предварительно нагретого нормального физиологического раствора. Назальный смыв собирали для подсчета общего числа клеток с использованием гемоцитометра. Назальный смыв центрифугировали и клеточный осадок ресуспендировали в 15 мкл сыворотки морских свинок и использовали для получения мазков. Стекла окрашивали красителем Лейшмана и проводили вручную дифференцированный подсчет 100 клеток на основе их стандартной морфологии.
Расчеты
Общее число эозинофилов в каждом образце смыва из носа рассчитывали с использованием формулы:

Процентное подавление эозинофилов рассчитывали с использованием следующей формулы:

Анализ данных
Статистическую обработку данных проводили с использованием однофакторного дисперсионного анализа с последующим использованием критериев множественного сравнения Даннетта.
Результаты
Монотерапия с использованием мометазона фуроата приводила к значительному подавлению общего числа клеток и эозинофилов в назальном смыве, но была не эффективна в подавлении ответа, проявляющегося чиханием. Монотерапия с использованием олопатадина гидрохлорида не приводила к значительному подавлению какого-либо из параметров в настоящей модели. Использование комбинации мометазона фуроата и олопатадина гидрохлорида приводило к синергическому эффекту в отношении подавления ответа, проявляющегося чиханием (Фигура 1), клеточной инфильтрации в назальном смыве (Фигура 2) и назальной эозинофилии (Фигура 3) по сравнению с соответствующими группами, получающими монотерапевтическое лечение (см. Таблицу 2).
Таблица 2
Суммарные эффекты комбинации мометазона фуроата и олопатадина гидрохлорида на модели вызванного овальбумином ринита у морских свинок.
гического раствора
(ОГ)
(МФ)
(ОГ и МФ)
(мкг на животное)
(0-50 мин)
* P<0,05 по сравнению с овальбуминовым контролем, ** P<0,01 по сравнению с овальбуминовым контролем,
*** P<0,001 по сравнению с овальбуминовым контролем
Применение комбинации мометазона фуроата и олопатадина гидрохлорида приводило к повышенному благоприятному эффекту по сравнению с отдельными монотерапевтическими схемами лечениями. Комбинация мометазона фуроата и олопатадина гидрохлорида оказывала синергическое действие при лечении аллергического ринита в настоящей модели.
ПРИМЕР 2
Эффект мометазона и олопатадина и их комбинации на модели вызванного овальбумином ринита у самцов морских свинок.
Повторяли способ, описанный в Примере 1, за исключением того, что использовали 120 мкг олопатадина гидрохлорида (в расчете на эквивалентную массу свободного основания олопатадина). Во время эксперимента использовали группы животных, перечисленные в Таблице 3, ниже.
Таблица 3
Группы животных
Соединение вводили так же, как в Примере 1, за исключением того, что дозу вводили в объеме 60 мкл/животное. Группа контроля с использованием физиологического раствора и группа овальбуминового контроля получали носитель (60 мкл, 0,1% твин 80 в дистиллированной воде). Оценки in vivo проводили так же, как в Примере 1.
Результаты
Монотерапевтическое лечение мометазоном приводило к значительному подавлению общего числа клеток и эозинофилов в назальном смыве, но не являлось эффективным в подавлении ответа, проявляющегося чиханием. Монотерапевтическое лечение олопатадином не вызывало значительного подавления какого-либо параметра в настоящей модели. Комбинация мометазона и олопатадина оказывала синергическое действие в подавлении назальной эозинофилии, клеточной инфильтрации в смыве из носа и ответа, проявляющегося чиханием, по сравнению с соответствующими монотерапевтическими схемами лечения (см. Фигуры 4-6 и Таблицу 4).
Таблица 4
Суммированные эффекты комбинации мометазона и олопатадина на модели вызванного овальбумином ринита у морских свинок
(МФ)
(ОГ и МФ)
(мкг на животное)
10 (МФ)
(0-50 мин)
чихания в процентах
* P<0,05 по сравнению с овальбуминовым контролем, ** P<0,01 по сравнению с овальбуминовым контролем,
*** P<0,001 по сравнению с овальбуминовым контролем
Применение комбинации мометазона фуроата и олопатадина гидрохлорида приводило к повышенному благоприятному эффекту по сравнению с отдельными монотерапевтическими схемами лечения. Использование комбинации мометазона и олопатадина приводило к синергическому эффекту в настоящей модели ринита у морских свинок.
ПРИМЕР 3
Клиническое исследование назального спрея, содержащего комбинацию мометазона и олопатадина с фиксированной дозой, у пациентов, представляющих собой людей
Исследование представляло собой одноцентровое двойное слепое рандомизированное сравнительное исследование в параллельных группах с двойной имитацией в камере воздействия факторов окружающей среды (Environmental Exposure Chamber, EEC) для оценки эффективности, безопасности и переносимости (i) двух назальных спреев, содержащих продукты комбинации фиксированных доз, содержащие мометазона фуроат и голопатадина идрохлорид, (ii) назального спрея, содержащего комбинацию фиксированных доз азеластина гидрохлорида и флутиказона пропионата (DYMISTA®), (iii) назального спрея, содержащего олопатадин (PATANASE®), и (iv) назального спрея, содержащего плацебо, у пациентов, страдающих сезонным аллергическим ринитом (САР).
Основные задачи
• Оценить эффективность двух концентраций назального спрея, содержащего комбинацию с фиксированной дозой (КФД), содержащую мометазона фуроат и олопатадина гидрохлорид, по сравнению с назальным спреем, содержащим плацебо.
• Оценить сравнительную эффективность (i) двух схем введения продуктов, содержащих КФД-назальный спрей, содержащий мометазона фуроат и олопатадина гидрохлорид, (ii) спрея для носа, содержащего комбинацию с фиксированной дозой азеластина гидрохлорида и флутиказона пропионата (DYMISTA®), и (iii) назального спрея, содержащего олопатадин (PATANASE®).
• Сравнить эффективность (i) назального спрея, содержащего комбинацию с фиксированной дозой, содержащую азеластина гидрохлорид и флутиказона пропионат, и (ii) назального спрея, содержащего олопатадин, по сравнению с назальным спреем, содержащим плацебо.
• Сравнить начало действия препарата, определенное как «первый момент времени после начала лечения, в который лекарственное средство вызывает значительное снижение текущего значения по шкале TNSS по сравнению с лечением плацебо, наблюдаемое в течение длительного времени с указанного момента времени», у групп, получающих лечение активным веществом, после введения первой дозы.
• Сравнить значение EEC-опросника по качеству жизни (QoLQ) и переносимость и приемлемость для комбинации фиксированных доз мометазона фуроата и олопатадина гидрохлорида при введении один раз в день и комбинации фиксированных доз мометазона фуроата и олопатадина гидрохлорида при введении два раза в день.
• Оценить сравнительную безопасность у различных групп лечения.
Объем выборки
Для исследования в целом рандомизировали по 36 пациентов на группу лечения. Общее число рандомизированных субъектов в пяти группах составляло 180.
Популяция пациентов
В исследование были включены субъекты, страдающие сезонным аллергическим ринитом, требующим лечения интраназальными антигистаминными средствами и/или интраназальными стероидами, в течение последних двух лет.
Основные критерии отбора субъектов
1. Пациенты любого пола возрастом ≥ 18 и ≤ 65 лет, включительно;
2. Пациент с известной историей болезни сезонного аллергического ринита (в течение по меньшей мере 2 лет), у которого наблюдается положительная инъекционная кожная проба (диаметр папулы по меньшей мере на 3 мм больше по сравнению с контролем с использованием физиологического раствора) на один из местно-распространенных аллергенов;
3. Пациенты, способные понимать и подписывать информированное согласие в письменной форме, которое должно быть получено до начала скринингового исследования; и
4. Пациенты, готовые соблюдать требования протокола.
Схема исследования
Пациентов рандомно распределяли для лечения в следующие пять групп лечения в отношении 1:1:1:1:1 в одном центре проведения исследования:
1. Комбинация фиксированных доз 665 мкг олопатадина гидрохлорида и 25 мкг мометазона фуроата, два раза в день (BID)
2. Комбинация фиксированных доз 665 мкг олопатадина гидрохлорида и 50 мкг мометазона фуроат, один раз в день (QD)
3. Назальный спрей DYMISTA® (137 мкг азеластина гидрохлорида + 50 мкг флутиказона пропионата), два раза в день (BID)
4. Назальный спрей PATANASE® (665 мкг олопатадина гидрохлорид), два раза в день (BID)
5. Назальный спрей, содержащий плацебо
Для настоящего исследования использовали схему с двойной имитацией, включающую четыре маскированных флакона с назальным спреем (два вечерних введения дозы и два утренних введения дозы) (см. Таблицу A).
Таблица A
Лечебное введение с использованием четырех маскированных флаконов с назальным спреем
Настоящее исследование включало пять посещений центра проведения исследования и 12-дневный период введения доз на дому (и 2 дня введения доз в центре проведения исследования – в общем 14 дней введения дозы). Конечные точки оценки эффективности регистрировали вне сезона аллергии в EEC-учреждении. После исходного скринингового визита (1 посещения) пациенты, которые удовлетворяли всем критериям исследования (включая основные критерии для включения в исследование: положительная инъекционная кожная проба (SPT) и 2-летняя история болезни аллергического ринита (АР) на аллерген амброзии), подвергались дальнейшему скринингу/вводному этапу в EEC (2 посещение). Во время сеанса в EEC пациентов подвергали воздействию пыльцы амброзии в концентрации 3500±500 частиц/м3 в течение 6 часов. Пациенты использовали электронный дневник (ePDAT™) для регистрации глазных и назальных симптомов каждые 30 минут в EEC. Пациенты, удовлетворявшие минимальному требуемому значению по шкале TNSS, составляющему 6/12, включая балл для заложенности носа, составляющий по меньшей мере 2, в двух последовательных записях в дневнике, продолжали принимать участие в исследовании. При 3 посещении на следующий день (1 день) пациенты, которые удовлетворяли минимальным критериям, возвращались в EEC для последующего второго сеанса в EEC. Пациентов подвергали воздействию аллергена в течение примерно 10 часов во время указанного посещения. Во время первых 6 часов пациенты использовали электронный дневник для регистрации оценок симптомов каждые 30 минут и должны были удовлетворять минимальному требуемому баллу симптома для продолжения участия в исследовании. Пациентов, удовлетворявших минимальному требуемому баллу симптома, рандомизировали в группу, получающую одно из пяти исследуемых лекарственных средств после 6 часов в EEC. После введения дозы (примерно в полдень), пациентов просили записать оценку симптомов через 5 минут, 10 минут, 15 минут, 25 минут, 30 минут, 45 минут, 60 минут и затем каждые 30 минут в течение оставшегося времени посещения. Оценку симптомов в EEC после лечения использовали для определения начала действия исследуемых схем лечения. Пациентов затем отправляли домой с исследуемым лекарственным средством для продолжения введения дозы BID на дому, начиная с вечерней дозы в 1 день. Пациенты продолжали введение дозы на дому в течение периода, составляющего 12 дней. Через 12 дней (2–13 день) введения дозы на дому пациенты возвращались в EEC на 14 день (4 посещение) для 6-часового вводного EEC-сеанса после лечения. Пациентам вводили утреннюю дозу исследуемого лекарственного средства за один час до входа в EEC. Симптомы оценивали каждые 30 минут в EEC. Пациенты принимали последнюю дозу исследуемого лекарственного препарата в полночь того же дня и возвращались на следующее утро (15 день, 5 посещение) для 6-часового EEC-сеанса. В течение 6-часового периода пациенты использовали электронный дневник для регистрации оценок симптомов каждые 30 минут. Помимо регистрации назальных и глазных симптомов электронный дневник использовали для заполнения EEC-опросников по качеству жизни (EEC-QoLQ) на 2, 3, 4 и 5 посещение и приемлемости и переносимости на 5 посещение. 5 посещение было конечным посещением исследования.
Вводный этап
Удовлетворение следующим критериям в каждой из двух последовательных регистраций в дневнике пациента во вводное посещение: минимальное значение по шкале TNSS - 6 из 12, включая балл для заложенности носа, составляющий по меньшей мере 2.
Рандомизация
• Для перехода к лечебному посещению (3 посещение) пациенты должны были удовлетворять таким же критериям при обоих вводных посещениях с 3-часовым исследованием в камере.
• Для лечебного посещения (3 посещение) минимальное значение TNSS составляло 6 из 12 (включая балл для заложенности носа, составляющий по меньшей мере 2).
Формы лекарственного средства
В исследовании использовали следующие лекарственные формы исследуемого продукта:
Исследуемый продукт 1 (ИП-1)
Назальный спрей, содержащий мометазона фуроата моногидрат и олопатадина гидрохлорид (25 мкг + 600 мкг)
Каждое впрыскивание приводило к доставке мометазона фуроата моногидрата, эквивалентного 25 мкг мометазона фуроата, и олопатадина гидрохлорида, эквивалентного 600 мкг олопатадина.
Исследуемый продукт 2 (ИП-2)
Назальный спрей, содержащий мометазона фуроата моногидрат и олопатадина гидрохлорид (50 мкг + 600 мкг)
Каждое впрыскивание приводило к доставке мометазона фуроата моногидрата, эквивалентного 50 мкг мометазона фуроата, и олопатадина гидрохлорида, эквивалентного 600 мкг олопатадина.
Схема введения дозы
1. Исследуемые продукты
• ИП-1: Назальный спрей, содержащий комбинацию фиксированных доз олопатадина гидрохлорида (665 мкг) и мометазона фуроата (25 мкг): по 2 впрыскивания в каждую ноздрю осуществляли два раза в день (BID) в течение двух недель.
• ИП-2: Назальный спрей, содержащий комбинацию фиксированных доз олопатадина гидрохлорида (665 мкг) и мометазона фуроата (50 мкг): по 2 впрыскивания в каждую ноздрю осуществляли один раз в день (QD) в течение двух недель
2. Препараты сравнения
• Назальный спрей, содержащий олопатадина гидрохлорид (PATANASE® 0,6%): по 2 впрыскивания в каждую ноздрю осуществляли два раза в день в течение двух недель.
• Назальный спрей DYMISTA® (азеластина гидрохлорид + флутиказона пропионат) 137 мкг / 50 мкг: по 1 впрыскиванию в каждую ноздрю осуществляли два раза в день в течение двух недель.
• Назальный спрей, содержащий плацебо (на основе носителя исследуемого продукта): по 2 впрыскивания в каждую ноздрю осуществляли два раза в день в течение двух недель.
Основные критерии оценки (Клинические конечные точки)
• Изменение среднего значения суммарного показателя тяжести симптомов ринита (TNSS) после лечения относительно исходного уровня для комбинации фиксированных доз мометазона фуроата и олопатадина гидрохлорида по сравнению с плацебо. Среднее значение по шкале TNSS рассчитывали для 6 часов в EEC после лечения на 5 посещение (с 18 до 24 после первого введения дозы на 14 день), за исходный уровень принимали значение по шкале TNSS в EEC на 3 посещение (в течение 6 часов до первого введения дозы).
• Изменение среднего значения TNSS после лечения относительно исходного уровня для двух схем введения комбинации фиксированных доз мометазона фуроата и олопатадина гидрохлорида по сравнению с референтными продуктами: назальным спреем DYMISTA® и назальным спреем PATANASE®. Среднее значение по шкале TNSS рассчитывали для 6 часов в EEC после лечения на 5 посещение (с 18 до 24 часов после первого введения дозы на 14 день), за исходный уровень принимали значение по шкале TNSS в EEC на 3 посещение (в течение 6 часов до первого введения дозы).
• Изменение среднего значения по шкале TNSS после лечения для двух схем введения комбинации фиксированных доз мометазона фуроата и олопатадина гидрохлорида, назального спрея DYMISTA® и назального спрея PATANASE® относительно исходного уровня. Среднее значение по шкале TNSS после лечения рассчитывали для 6 часов в EEC после лечения на 4 посещение (с 1 до 7 часов после первого введения дозы на 14 день), за исходный уровень принимали значение по шкале TNSS в EEC на 2 посещение (в течение 6 часов).
• Изменение среднего значения по шкале TNSS после лечения относительно исходного уровня для двух схем введения комбинации фиксированных доз мометазона фуроата и олопатадина гидрохлорида по сравнению с референтными продуктами: назальным спреем DYMISTA® и назальным спреем PATANASE®. Среднее значение TNSS рассчитывали для 12 часов в EEC после лечения (при 4 посещении с 1 до 7 часов после первого введения дозы на 14 день и на 5 посещение с 18 до 24 часов после первого введения дозы на 14 день), за исходный уровень принимали значение по шкале TNSS в EEC на 2 посещение и 3 посещение (в течение 12 часов до первого введения дозы).
• Начало действия для каждой схемы лечения комбинацией фиксированных доз мометазона фуроата и олопатадина гидрохлорида, DYMISTA® и PATANASE® оценивали путем сравнения изменения значения по шкале TNSS после лечения относительно исходного уровня между каждой схемой лечения активным веществом и плацебо в каждую точку времени после первого сеанса лечения. Изменение относительно исходного уровня значения по шкале TNSS рассчитывали в каждую точку времени после введения первой лечебной дозы согласно исследованию в EEC на 3 посещение (т.е. за последние четыре часа в EEC на 3 посещение), где исходный уровень (3 посещение) определяли как среднее от последних двух временных точек до введения дозы.
• Изменение среднего значения общей оценки симптомов (TSS), оценок отдельных назальных симптомов (NSS, четырех назальных симптомов, включающих ринорею, прурит, чихание и заложенность носа) и TOSS после лечения относительно исходного уровня для 6 часов в EEC на 5 посещение, за исходный уровень принимали 3 посещение (в течение 6 часов до первого введения дозы).
• Изменение среднего значения общей оценки симптомов (TSS) после лечения, оценок отдельных назальных симптомов (NSS, четырех назальных симптомов, включающих ринорею, прурит, чихание и заложенность носа) и TOSS относительно исходного уровня для 6 часов в EEC на 4 посещение, за исходный уровень принимали 2 посещение (в течение 6 часов в EEC).
• Изменение среднего значения общей оценки симптомов (TSS), оценок отдельных назальных симптомов (NSS, четырех назальных симптомов, включающих ринорею, прурит, чихание и заложенность носа) и TOSS после лечения относительно исходного уровня для 12 часов в EEC на 4 посещение и 5 посещение, за исходный уровень принимали 12-часовой период в EEC до введения дозы на 2 посещение и 3 посещение.
• EEC-QoLQ для всех групп лечения путем сравнения 1) пре-EEC-QoLQ на исходном уровне (2 посещение и пре-EEC на 4 посещение; 2) пост-EEC на исходном уровне (2 посещение) и пост-EEC на 4 посещение; 3) через 6 часов в EEC на 3 посещение (до первого введения дозы) и пост-EEC на 5 посещение.
• Ретроспективная оценка переносимости и приемлемость для групп лечения по сравнению с плацебо после EEC на 5 посещение.
Результаты
В Таблице B показано суммарное изменение значения по шкале TNSS после лечения относительно исходного уровня для 6 часов в EEC (популяция ITT).
Таблица B
(Референтный продукт)
(Референтный продукт)
(2 недели)
В Таблице C показаны суммарные результаты измерения значения по шкале TNSS после лечения для 12 часов в EEC (популяция ITT) относительно исходного уровня. (Данные для NASONEX в Таблице C получены из его этикетки, одобренной Управлением по контролю за продуктами питания и лекарственными средствами США).
Таблица C
(Референтный продукт)
(Референтный продукт)
* NASONEX® (назальный спрей, содержащий мометазона фуроат), этикетка, одобренная Управлением по контролю за продуктами питания и лекарственными средствами США (19 января 2011 года)
В Таблице D показаны суммарные результаты измерения значения по шкале TOSS после лечения для 12 часов в EEC (популяция ITT) относительно исходного уровня.
Таблица D
(Референтный продукт)
(Референтный продукт)
Результаты исследования показывают, что комбинация мометазона фуроата и олопатадина гидрохлорида при назальном введении пациенту, представляющему собой человека, обеспечивает эффективное лечение сезонного аллергического ринита и клинически значимое снижение как связанных с ним назальных и неназальных симптомов. Величина облегчения симптомов по шкале TNSS была клинически значимой (т.е. различие между исследуемыми продуктами и плацебо составляло более 2 единиц, что в целом считается клинически значимым различием). Исследуемый продукт 1 обеспечивал общее улучшенное купирование симптомов с более быстрым началом действия по сравнению с референтными продуктами (PATANASE® и DYMISTA®).
ПРИМЕР 4
II фаза клинического исследования назального спрея, содержащего комбинацию фиксированных доз мометазона и олопатадина,
у пациентов, представляющих собой людей.
Исследование представляло собой двойное слепое рандомизированное сравнительное исследование с параллельными группами для оценки эффективности, безопасности и переносимости двух различных концентраций и схем введения назального спрея, содержащего комбинацию фиксированных доз мометазона фуроата и олопатадина гидрохлорида, по сравнению с назальным спреем, содержащим плацебо, и отдельными монотерапевтическими лекарственными формами назального спрея, содержащего олопатадина гидрохлорид, и назального спрея, содержащего мометазона фуроат, у субъектов (12 лет и старше), страдающих сезонным аллергическим ринитом (САР).
Основные задачи
• Сравнить эффективность назального спрея, содержащего мометазона фуроат и олопатадина гидрохлорид, при введении один раз в день и назального спрея, содержащего мометазона фуроат и олопатадина гидрохлорид, при введении два раза в день с назальным спреем, содержащим плацебо, и с монотерапевтическим лечением отдельными составляющими в такой же дозировке и в таком же носителе в течение 14 дней лечения согласно исследованию.
• Сравнить начало действия назального спрея, содержащего мометазона фуроат и олопатадина гидрохлорид, при введении один раз в день и назального спрея, содержащего мометазона фуроат и олопатадина гидрохлорид, при введении два раза в день с плацебо и с монотерапевтическим лечением отдельными составляющими в такой же дозировке и в таком же носителе после введения первой дозы исследуемого лекарственного средства.
• Оценить безопасность и переносимость в отдельных группах лечения.
Таблица E
Исследуемые продукты и их введение
(665 мкг + 25 мкг)
(665 мкг + 50 мкг)
Объем выборки:
В целом в исследование было включено примерно 1106 рандомизированных субъектов (по 158 субъектов на группу лечения).
Основные критерии отбора субъекта:
1. Возраст ≥ 12, включительно, пол любой.
2. Документированная история болезни САР (в течение по меньшей мере 2 лет, предшествующих посещению скринингового обследования) с обострениями (клиническими проявлениями активных симптомов), у которого наблюдается документированная положительная SPT (диаметр папулы по меньшей мере на 5 мм больше по сравнению с контрольной папулой) на аллерген мексиканского можжевельника.
3. Ретроспективная оценка по шкале TNSS для 12 часов составляет ≥ 8 из 12 возможных баллов, и балл заложенности носа составляет ≥ 2 для утреннего введения при скрининговом визите (посещение 1).
Схема исследования:
Субъектов рандомизировали для проведения лечения в следующие семь групп лечения в отношении 1:1:1:1:1:1:1 в нескольких центрах проведения исследования.
Для настоящего исследования использовали схему с двойной имитацией, включающую два идентичных флакона спрея для носа (одна утренняя [У] доза и одна вечерняя [В] доза) (Таблица F). Схема с двойной имитацией применялась для обеспечения приемлемого слепого исследования, учитывая что сравниваемые схемы лечения варьировали по частоте введения дозы (BID по сравнению с QD).
Таблица F
Лечебное введение с использованием двух идентичных флаконов назального спрея
(по 2 впрыскивания в каждую ноздрю, в целом 4 впрыскивания из каждого флакона в день)
(В)
25 мкг мометазона фуроата, два раза в день (BID)
50 мкг мометазона фуроата, один раз в день (QD)
Настоящее исследование включало четыре посещения центра проведения исследования. После исходного скринингового визита (посещение 1) субъекты, удовлетворявшие всем критериям отбора исследования, проходили односторонне слепой вводный плацебо-период в течение 7-10 дней. После завершения вводного периода подходящих для участия в исследовании субъектов, удовлетворявших критериям рандомизации, включали в исследование и рандомно распределяли в одну из семи групп лечения. Субъектам прописывали лечение в соответствии с перечнем рандомизации. Рандомизированным субъектам требовалось пройти 2-недельный (14-дневный) период лечения в соответствии с протоколом для оценки эффективности и безопасности прописанного лечения.
Основные критерии оценки (клинические конечные точки):
Первичная конечная точка
• Изменение относительно исходного уровня среднего значения rTNSS для 12 часов, записанного субъектом (ретроспективная оценка TNSS), для У и В введения в течение 14-дневного периода лечения.
Вторичные конечные точки
• Изменение среднего значения iTNSS для 12 часов, записанного субъектом (текущая оценка TNSS), для У и В введения в течение 14-дневного периода лечения относительно исходного уровня.
• Изменение среднего значения rTOSS для 12 часов, записанного субъектом (ретроспективная TOSS), для У и В введения в течение 14-дневного периода лечения относительно исходного уровня.
• Начало действия для каждой схемы лечения оценивали путем сравнения изменения значения iTNSS после лечения относительно исходного уровня между лечением каждым активным веществом и плацебо в определенные точки времени (до введения первой дозы (пре-доза), через 15 мин, 30 мин, 45 мин, 60 мин, 90 мин, 120 мин, 150 мин, 180 мин, 210 мин и 240 мин) после первого сеанса лечения согласно исследованию в течение 4 часов.
• Изменение относительно исходного уровня значения опросника по качеству жизни при риноконъюнктивите (RQLQ) на 15 день между группами лечения для субъектов с нарушенным качеством жизни на исходном уровне, что определяли по значению RQLQ, составляющему 3,0 или более, при рандомизирующем посещении (RV) (популяция RQLQ).
Третичные критерии эффективности
Назальные симптомы:
• Изменение относительно исходного уровня значения rTNSS, записанного субъектом для У введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения iTNSS, записанного субъектом для У введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения rTNSS, записанного субъектом для В введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения iTNSS, записанного субъектом для В введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня балла ретроспективных отдельных назальных симптомов, записанного субъектом, в течение 14-дневного периода лечения (У, В и среднее для У и В).
• Изменение относительно исходного уровня балла текущих отдельных назальных симптомов, записанного субъектом, в течение 14-дневного периода лечения (У, В и среднее для У и В).
• Изменение относительно исходного уровня среднего значения rTNSS и iTNSS, записанного субъектом для У и В введения, для каждого дня.
• Изменение относительно исходного уровня значения rTNSS и iTNSS, записанного субъектом для У введения, для каждого дня.
• Изменение относительно исходного уровня значения rTNSS и iTNSS, записанного субъектом для В введения, для каждого дня.
Глазные симптомы:
• Изменение относительно исходного уровня среднего значения iTOSS, записанного субъектом (текущее значение TOSS) для У и В введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения rTOSS, записанного субъектом для У введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения iTOSS, записанного субъектом для У введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения rTOSS, записанного субъектом для В введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня значения iTOSS, записанного субъектом для В введения, в течение 14-дневного периода лечения.
• Изменение относительно исходного уровня балла ретроспективных отдельных глазных симптомов, записанного субъектом, в течение 14-дневного периода лечения (У, В и среднее для У и В).
• Изменение относительно исходного уровня балла текущих отдельных глазных симптомов, записанного субъектом, в течение 14-дневного периода лечения (У, В и среднее для У и В).
• Изменение относительно исходного уровня среднего значения rTOSS и iTOSS, записанного субъектом для У и В введения, для каждого дня.
• Изменение относительно исходного уровня значения rTOSS и iTOSS, записанного субъектом для У введения, для каждого дня.
• Изменение относительно исходного уровня значения rTOSS и iTOSS, записанного субъектом для В введения, для каждого дня.
Неназальные симптомы оценивали схожим образом с вышеприведенной оценкой глазных симптомов.
Оцененное врачом значение по шкале назальных симптомов (PNSS) и опросника по качеству жизни при риноконъюнктивите (RQLQ):
• Оцененное врачом значение по шкале назальных симптомов (PNSS) и оцененные врачом отдельные назальные симптомы на 15 день (4 посещение).
• Отдельные поля RQLQ на 15 день (4 посещение) для RQLQ-популяции (определенной как популяция субъектов с нарушенным качеством жизни на исходном уровне).
• RQLQ на 15 день (4 посещение) для полной выборки пациентов для анализа (FAS).
Несмотря на то, что изобретение было описано в настоящей заявке со ссылкой на конкретные варианты реализации, необходимо понимать, что указанные варианты реализации приведены исключительно для иллюстрации принципов и способов применения настоящего изобретения. Таким образом, необходимо понимать, что возможно множество модификаций указанных иллюстративных вариантов реализации изобретения.
Все публикации, патенты и патентные заявки, цитированные в настоящей заявке, включены в настоящую заявку посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно включены в настоящую заявку посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ АЛЛЕРГИЧЕСКОГО РИНИТА С ИСПОЛЬЗОВАНИЕМ КОМБИНАЦИИ МОМЕТАЗОНА И ОЛОПАТАДИНА | 2014 |
|
RU2686670C2 |
| ЛЕЧЕНИЕ АЛЛЕРГИЧЕСКОГО РИНИТА У СУБЪЕКТОВ ДЕТСКОЙ ВОЗРАСТНОЙ КАТЕГОРИИ С ПРИМЕНЕНИЕМ КОМБИНАЦИИ МОМЕТАЗОНА И ОЛОПАТАДИНА | 2019 |
|
RU2798030C2 |
| КОМБИНАЦИЯ ЛЕВОКАБАСТИНА И ФЛУТИКАЗОНА ФУРОАТА ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ И/ИЛИ АЛЛЕРГИЧЕСКИХ СОСТОЯНИЙ | 2013 |
|
RU2652352C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ФИКСИРОВАННОЙ ДОЗОЙ, СОДЕРЖАЩАЯ МОМЕТАЗОН И ОЛОПАТАДИН | 2014 |
|
RU2687551C2 |
| НАЗАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2380090C2 |
| НАЗАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2373925C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РИНИТА | 2010 |
|
RU2502519C2 |
| УСОВЕРШЕНСТВОВАНИЕ НАЗАЛЬНЫХ КОМПОЗИЦИЙ И СПОСОБ ИХ ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2781144C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПОЛИПОЗА НОСА ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2014 |
|
RU2674680C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОТИВОАЛЛЕРГИЧЕСКОГО И ПРОТИВОВОСПАЛИТЕЛЬНОГО ДЕЙСТВИЯ ДЛЯ ИНТРАНАЗАЛЬНОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2736082C1 |


Группа изобретений относится к области медицины, а именно к аллергологии и оториноларингологии, и предназначена для лечения аллергического ринита и/или связанных с ним назальных симптомов. Способ лечения аллергического ринита и/или связанных с ним назальных симптомов у человека, нуждающегося в указанном лечении, включает назальное введение указанному человеку эффективного количества фармацевтической композиции, содержащей мометазона фуроат и олопатадин или его соль. Композицию вводят назально в виде 1-го или 2-х впрыскиваний в каждую ноздрю указанного человека по меньшей мере один раз в день, при этом каждое впрыскивание содержит мометазона фуроат и олопатадин или его соль в массовом отношении от 1:12 до 1:53, в расчете на эквивалентную массу свободного основания олопатадина. Указанный мометазона фуроат представлен в виде частиц, а олопатадин или его соль представлен в растворенном виде. Указанное введение обеспечивает облегчение одного или более симптомов, связанных с аллергическим ринитом, быстрее, чем назальное введение в виде двух впрыскиваний 665 мкг одного олопатадина гидрохлорида два раза в день. Также представлено применение указанной фармацевтической композиции для лечения аллергического ринита у человека, нуждающегося в указанном лечении. Использование группы изобретений позволяет ускорить облегчение симптомов аллергического ринита и/или связанных с ним назальных симптомов у человека, нуждающегося в указанном лечении, и, соответственно, повысить эффективность лечения. 2 н. и 14 з.п. ф-лы, 6 ил., 10 табл., 4 пр.
1. Способ лечения аллергического ринита и/или связанных с ним назальных симптомов у человека, нуждающегося в указанном лечении, включающий назальное введение указанному человеку эффективного количества фармацевтической композиции, содержащей мометазона фуроат и олопатадин или его соль, при этом (i) композицию вводят назально в виде 1-го или 2-х впрыскиваний в каждую ноздрю указанного человека по меньшей мере один раз в день, (ii) каждое впрыскивание содержит мометазона фуроат и олопатадин или его соль в массовом отношении от 1:12 до 1:53, в расчете на эквивалентную массу свободного основания олопатадина, (iii) мометазона фуроат представлен в виде частиц, а олопатадин или его соль представлен в растворенном виде, и (iv) указанное введение обеспечивает облегчение одного или более симптомов, связанных с аллергическим ринитом, быстрее, чем назальное введение в виде двух впрыскиваний 665 мкг одного олопатадина гидрохлорида два раза в день.
2. Способ по п. 1, отличающийся тем, что каждое впрыскивание содержит 25 мкг или 50 мкг мометазона фуроата.
3. Способ по любому из пп. 1, 2, отличающийся тем, что указанная соль олопатадина представляет собой олопатадина гидрохлорид.
4. Способ по п. 3, отличающийся тем, что каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный 600 мкг олопатадина.
5. Способ по любому из пп. 1-4, отличающийся тем, что указанную композицию вводят в виде 1-го впрыскивания в каждую ноздрю два раза в день.
6. Способ по любому из пп. 1-5, отличающийся тем, что указанную композицию вводят в виде 2-х впрыскиваний в каждую ноздрю два раза в день.
7. Способ по любому из пп. 1-6, отличающийся тем, что аллергический ринит представляет собой круглогодичный аллергический ринит и/или связанные с ним симптомы.
8. Способ по любому из пп. 1-6, отличающийся тем, что аллергический ринит представляет собой сезонный аллергический ринит и/или связанные с ним симптомы.
9. Применение фармацевтической композиции, содержащей мометазона фуроат и олопатадин или его соль в массовом отношении от 1:12 до 1:53, в расчете на эквивалентную массу свободного основания олопатадина, для лечения аллергического ринита у человека, нуждающегося в указанном лечении, при этом (i) указанную композицию вводят назально в виде 1-го или 2-х впрыскиваний в каждую ноздрю указанного человека по меньшей мере один раз в день, (ii) мометазона фуроат представлен в виде частиц, а олопатадин или его соль представлен в растворенном виде, и (iii) указанное введение обеспечивает облегчение одного или более симптомов, связанных с аллергическим ринитом, быстрее, чем назальное введение в виде двух впрыскиваний 665 мкг одного олопатадина гидрохлорида два раза в день.
10. Применение по п. 9, отличающееся тем, что указанная соль олопатадина представляет собой олопатадина гидрохлорид.
11. Применение по п. 10, отличающееся тем, что каждое впрыскивание содержит олопатадина гидрохлорид, эквивалентный 600 мкг олопатадина.
12. Применение по любому из пп. 9-12, отличающееся тем, что каждое впрыскивание содержит 25 мкг или 50 мкг мометазона фуроата и 665 мкг олопатадина гидрохлорида.
13. Применение по любому из пп. 9-12, отличающееся тем, что указанную композицию вводят в виде 1-го впрыскивания в каждую ноздрю два раза в день.
14. Применение по любому из пп. 9-12, отличающееся тем, что указанную композицию вводят в виде 2-х впрыскиваний в каждую ноздрю два раза в день.
15. Применение по любому из пп. 9-14, отличающееся тем, что аллергический ринит представляет собой круглогодичный аллергический ринит и/или связанные с ним симптомы.
16. Применение по любому из пп. 9-14, отличающееся тем, что аллергический ринит представляет собой сезонный аллергический ринит и/или связанные с ним симптомы.
| US 2004097474 A1, 20.05.2004 | |||
| US 2011257115 A1, 20.10.2011 | |||
| KR 101304341 B1, 11.09.2013 | |||
| KAGAWA Y | |||
| et al | |||
| Synergetic effects of prednisiline and olopatadine on atopic dermatitis model of hairless mice | |||
| Pharmacology, 2010, 85(5):286-94, реферат. |
Авторы
Даты
2023-07-11—Публикация
2014-10-03—Подача