Область техники
Настоящее изобретение относится к фармацевтической композиции с пролонгированным высвобождением, содержащей ацеклофенак, и способу ее приготовления.
Настоящая заявка испрашивает приоритет и преимущество патентной заявки Кореи № 10-2019-0044335, поданной в ведомство по интеллектуальной собственности Кореи 16 апреля 2019 г., полное содержание которой включено в данный документ посредством ссылки.
Предшествующий уровень техники
Ацеклофенак (2-[(2,6-дихлорфенил)амино]-фенилацетоксиуксусная кислота) является известным соединением, имеющим приведенную ниже химическую структурную формулу, а также является противовоспалительным болеутоляющим средством на основе фенилуксусной кислоты, которое демонстрирует превосходную эффективность в отношении не только хронического заболевания сустава, такого как ревматоидный артрит, остеоартроз или анкилозирующий спондилоартрит, но и зубной боли, постоперационной или послеродовой боли и т. п.
[Химическая формула]

Данное лекарственное средство обладает превосходным эффектом блокирования выработки простагландинов благодаря легкому проникновению в очаги воспаления, такие как суставы, по сравнению с противовоспалительными болеутоляющими средствами, такими как напроксен и диклофенак, и таким образом демонстрирует превосходный терапевтический эффект. В то же время, нормальное блокирующее действие выработки простагландина в слизистой оболочке желудка настолько слабое, что данное лекарственное средство уменьшает расстройства желудочно-кишечного тракта и поэтому подходит для длительного использования, и данное лекарственное средство обладает такими свойствами, как предотвращение обострения ревматоидного артрита, остеоартроза и т. п., так как оно главным образом подавляет выработку интерлейкина-1, разрушающего хрящи в суставах, стимулируя выработку гликозаминогликана, который является компонентом суставного хряща.
Ацеклофенак легко растворим в органических растворителях и относительно нерастворим в воде. При приеме внутрь ацеклофенак быстро всасывается в желудочно-кишечном тракте и распределяется с высокими концентрациями в почках, мочевом пузыре, печени, щитовидной железе и т. п. и в низкой концентрации в глазах, мозге, подкожной жировой ткани и т. п. Начало действия при пероральном приеме составляет не более 30 минут, фактическое время для достижения максимальной концентрации в крови составляет примерно от 1,5 до 2,5 часов, и срок действия составляет примерно 12 часов. При пероральном приеме ацеклофенака 46 - 75 % введенного лекарственного средства на момент достижения максимальной концентрации в крови (Tmax) присутствует в виде ацеклофенака, и после Tmax происходит экстенсивный метаболизм, при этом среди 9 метаболитов основными метаболитами являются 4-гидроксиацеклофенак, 4-гидроксидиклофенак и диклофенак, а остальные 6 метаболитов обычно присутствуют в количестве 1 - 2 %, хотя имеются индивидуальные особенности.
Ацеклофенак проникает в организм в качестве пролекарственной формы препарата, а затем метаболизируется в 4-гидроксиацеклофенак, 5-гидроксиацеклофенак, 4-гидроксидиклофенак, 5-гидроксидиклофенак и другие метаболиты, причем среди них диклофенак и 4-гидроксидиклофенак, которые являются основными активными метаболитами, показывают эффективность.
Впоследствии примерно 70 % и примерно 20 % ацеклофенака и его метаболитов в организме выводится с мочой и калом, соответственно, причем известно, что 4-гидроксидиклофенак и 4-гидроксиацеклофенак выводятся с высокой скоростью с мочой, которая является основным путем выведения, и скорость экскреции (период полувыведения) составляет примерно 4 часа.
Клинические характеристики ацеклофенака включают: 1) пригодность при ревматоидном артрите или остеоартрозе, так как ацеклофенак блокирует выработку интерлейкина-1, разрушающего суставной хрящ, и стимулирует выработку гликозаминогликана, который является компонентом суставного хряща; 2) минимизацию желудочно-кишечных расстройств, так как ацеклофенак оказывает незначительное воздействие на нормальную выработку простагландинов в слизистой оболочке желудка; и 3) сильно выраженные эффекты блокировки выработки простагландина в очагах поражения, так как лекарственное средство проникает в воспаленные органы и ткани, такие как суставы, в высокой концентрации.
В предшествующем уровне техники ацеклофенак разработан и коммерчески доступен в форме таблетки или растворимой мягкой капсулы, причем 100 мг ацеклофенака предназначены для применения в форме капсулы или таблетки дважды в день. Тем не менее, несмотря на то что ацеклофенак следует принимать в течение длительного времени в связи с особенностями пациентов с мышечноскелетными болями, лекарственная форма, назначаемая один раз в день, не разработана, что причиняет неудобства пациентам, которым назначен препарат ацеклофенака в течение длительного времени, с учетом рекомендаций по введению лекарственных средств и комплаентности пациентов.
В этом отношении в корейском патенте № 1076648 (патентный документ 1), корейском патенте № 1050076 (патентный документ 2) и корейском патенте № 1234254 (патентный документ 3) раскрыты двухслойные таблетки ацеклофенака с пролонгированным высвобождением, которые способны сохранять эффективность в течение 24 часов при достижении быстрой фармакологической активности.
Препараты, согласно патентным документам 1–3, представляют собой двухслойные таблетированные лекарственные формы, состоящие из слоя с быстрым высвобождением, в котором действующее вещество быстро высвобождается, и слоя с пролонгированным высвобождением, в котором действующее вещество высвобождается постепенно, и отличаются тем, что лечебный эффект сохраняется в течение 24 часов при быстром достижении эффективной концентрации в крови на начальном этапе приема лекарственного препарата. Кроме того, препараты демонстрируют превосходные фармакокинетические эффекты сопоставимые с существующей таблеткой ацеклофенака, принимаемой два раза в день.
Тем не менее, в случае препаратов согласно патентным документам 1–3, если 500 000 таблеток или более выпускаются серийно для коммерческого использования, возникает неожиданная проблема, при которой эффект слипания приводит к сложности изготовления таблеток и отклонению от средней массы. Кроме того, была обнаружена проблема, при которой геометрические формы некоторых препаратов разрушались после длительной дистрибуции.
Описание
Техническая задача
Чтобы уменьшить вышеуказанные проблемы препаратов в предшествующем уровне техники было разработано настоящее изобретение, и его цель состоит в том, чтобы обеспечить новую двухслойную таблетку ацеклофенака с пролонгированным высвобождением, которая не создает трудностей даже в том случае, когда производство представляет собой непрерывное серийное производство, обладает превосходной стабильностью даже при длительном хранении и демонстрирует необходимый фармакологический эффект, даже когда принята один раз в день.
Техническое решение
Для достижения вышеуказанной цели двухслойная таблетка ацеклофенака с пролонгированным высвобождением согласно данному изобретению содержит: слой с быстрым высвобождением, содержащий ацеклофенак, вспомогательное вещество и скользящее вещество; и слой с пролонгированным высвобождением, содержащий ацеклофенак, вспомогательное вещество, солюбилизатор, вещество, замедляющее высвобождение, и скользящее вещество, при этом массовое отношение ацеклофенака, содержащегося в слое с быстрым высвобождением и слое с пролонгированным высвобождением, может составлять от 1 : 1 до 1,5 : 1, более предпочтительно от 1,1 : 1 до 1,3 : 1.
В этом случае в качестве скользящего вещества может быть выбрано и использовано скользящее вещество из известных скользящих веществ, но желательно использовать стеарилфумарат натрия или смесь стеарилфумарата натрия и коллоидного диоксида кремния, так как он не препятствует растворению действующего вещества.
В то же время несмотря на то, что содержание скользящего вещества предпочтительно составляет от 2 до 6 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением, когда содержание скользящего вещества превышает 6 масс.% от общей массы таблетки, скорость растворения может снизиться, а когда содержание скользящего вещества не превышает 2 масс.%, сыпучесть препарата в процессе изготовления таблеток может быть плохой.
В качестве солюбилизатора можно использовать один или смесь из двух и более, выбранных из группы, состоящей из полоксамера, токоферилполиэтиленгликольсукцината, лабразола, лабрафила, лапрафака (laprafac), полисорбата, касторового масла, транскутола, лаурилсульфата натрия, полиэтиленгликоля, Макрогол 15 гидроксистеарата, СолюплюсаR и ГелюцираR.
Так как ацеклофенак является плохо растворимым лекарственным средством, биодоступность может быть увеличена, если вышеуказанный солюбилизатор или известный эквивалентный ему материал включен в основной состав лекарственного средства при приготовлении. Тем не менее в случае, если содержание солюбилизатора чрезмерно высокое, при серийном производстве может возникнуть проблема сложности изготовления таблеток из-за эффекта слипания.
Таким образом, предпочтительно, чтобы солюбилизатор входил в состав в количестве от 0,5 до 1,5 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением. Если солюбилизатор входит в состав в количестве менее 0,5 масс.% растворение ацеклофенака может не быть достигнуто в достаточной степени, а если содержание превышает 1,5 масс.%, может возникнуть сложность изготовления таблеток из-за эффекта слипания.
В качестве замедляющего высвобождение вещества могут быть использованы известные вещества с пролонгированным высвобождением, тем не менее из них желательно использовать одно или смесь двух и более из группы, состоящей из гидроксипропилметилцеллюлозы, этилцеллюлозы, полиэтиленгликоля, поливинилового спирта, карбомера, ксантановой камеди и Коллидона SR. Можно поддерживать постоянную скорость растворения действующего вещества, особенно когда используется смесь гидроксипропилметилцеллюлозы, обладающей вязкостью от 75 000 до 140 000 мПа·с, и карбомера в соотношении от 10 : 1 до 20 : 1.
В этом случае предпочтительно, чтобы замедляющее высвобождение вещество входило в состав в количестве от 15 до 30 масс.% от общей массы части с пролонгированным высвобождением, причем, когда замедляющее высвобождение вещество включают в количестве менее 15 масс.%, эффект замедленного высвобождения может уменьшаться, а также могут возникать побочные эффекты в связи с чрезмерным увеличением концентрации в крови. В то же время, когда содержание превышает 30 масс.%, скорость растворения лекарственного средства оказывается настолько мала, что фармакологическое действие может ухудшиться.
В качестве вспомогательного вещества можно использовать одно или смесь двух и более, выбранных из группы, состоящей из микрокристаллической целлюлозы, лактозы, маннита, целлюлозы в порошке, коллоидного диоксида кремния и алюмосиликата магния, а содержание вспомогательного вещества может быть скорректировано надлежащим образом с учетом содержания лекарственного средства, вспомогательного вещества или наполнителя и/или размера таблетки.
В то же время двухслойная таблетка ацеклофенака с пролонгированным высвобождением может дополнительно содержать один или два, или более разрыхлителей, выбранных из группы, состоящей из кроскармеллозы натрия, натрия гликолята крахмала, прежелатинизированного крахмала и кросповидона, для быстрого разрушения и быстрого раннего вымывания слоя с быстрым высвобождением.
В этом случае несмотря на то, что предпочтительно, чтобы разрыхлитель входил в состав в количестве от 1 до 3 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением, когда разрыхлитель входит в состав в количестве менее, чем 1 масс.%, трудно ожидать эффект, получаемый посредством добавления разрыхлителя, причем даже содержание более чем 3 масс.% нежелательно, так как эффект незначительный по сравнению с увеличением таблетки по весу.
Кроме того, двухслойная таблетка ацеклофенака с пролонгированным высвобождением дополнительно содержит одно или два, или более связующих веществ, выбранных из группы, состоящей из гидроксипропилцеллюлозы, повидона, ацетат-полиэтиленгликолевого привитого сополимера и сополимера полиэтилена и винилацетата.
Содержание связующего вещества корректируют с учетом общей массы препарата. В частности, предпочтительно, чтобы связующее вещество включали в количестве от 3 до 5 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением, причем, когда содержание не превышает 3 масс.%, может ухудшиться стабильность препарата, а когда содержание превышает 5 масс.%, возможен отрицательный эффект, такой как отсроченное растворение лекарственного средства.
Предпочтительно, чтобы слой с быстрым высвобождением и слой с пролонгированным высвобождением приготавливали способом влажного гранулирования, так как, если указанные слои приготавливают методом сухого гранулирования или методом прямого таблетирования, внутри некоторых таблеток образуется газ, вследствие чего в некоторых случаях форма таблетки была признана разрушенной.
Полезные эффекты
Двухслойная таблетка ацеклофенака с пролонгированным высвобождением, согласно настоящему изобретению, отличается проявлением быстрой фармакологической активности, а значит проявлением немедленных анальгезирующего и противовоспалительного действий, а также поддержанием постоянной концентрации лекарственного средства в организме даже при однократном приеме в день и тем самым получением долгосрочного эффекта. Кроме того, не возникает проблема сложности изготовления таблеток, которая имеет место при серийном производстве в предшествующем уровне техники, а также двухслойная таблетка ацеклофенака с пролонгированным высвобождением обладает превосходной стабильностью без деформации по форме даже при длительном хранении.
Описание чертежей
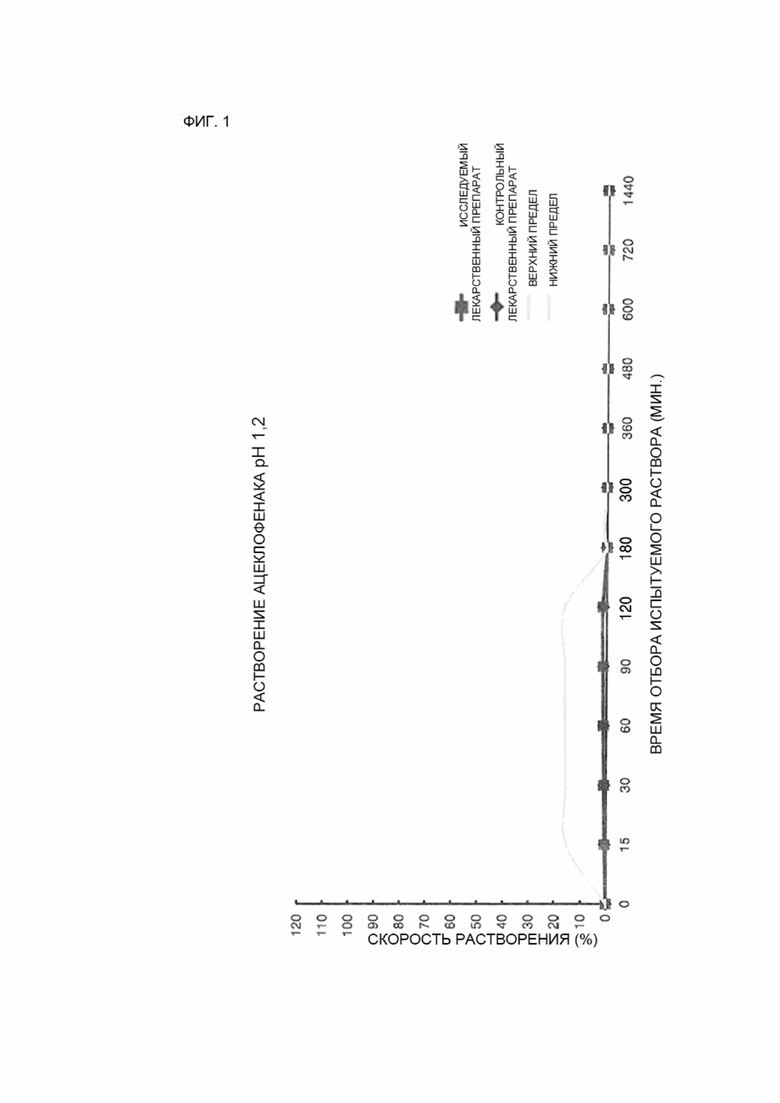
ФИГ. 1 показывает сравнение средних величин профилей растворимости исследуемого лекарственного препарата и контрольного лекарственного препарата в условиях среды растворения с pH 1,2.
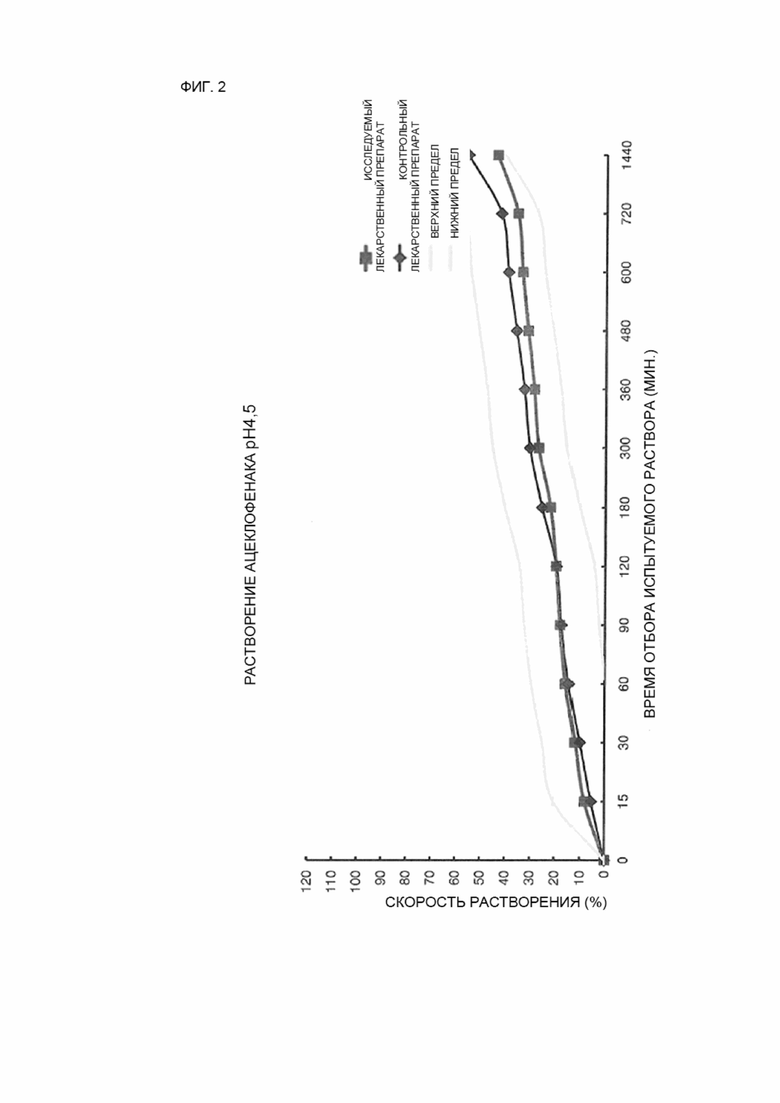
ФИГ. 2 показывает сравнение средних величин профилей растворимости исследуемого лекарственного препарата и контрольного лекарственного препарата в условиях среды растворения с pH 4,5.
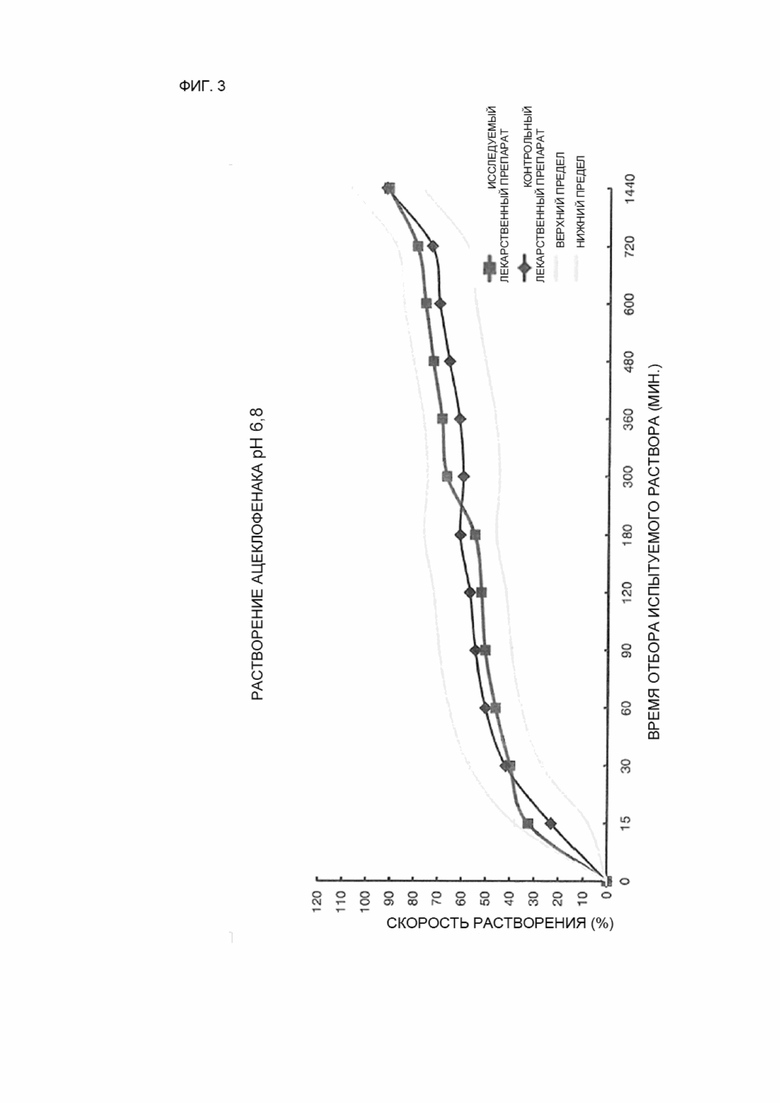
ФИГ. 3 показывает сравнение средних величин профилей растворимости исследуемого лекарственного препарата и контрольного лекарственного препарата в условиях среды растворения с pH 6,8.
ФИГ. 4 показывает сравнение концентраций в крови исследуемого лекарственного препарата и контрольного лекарственного препарата после перорального введения натощак.
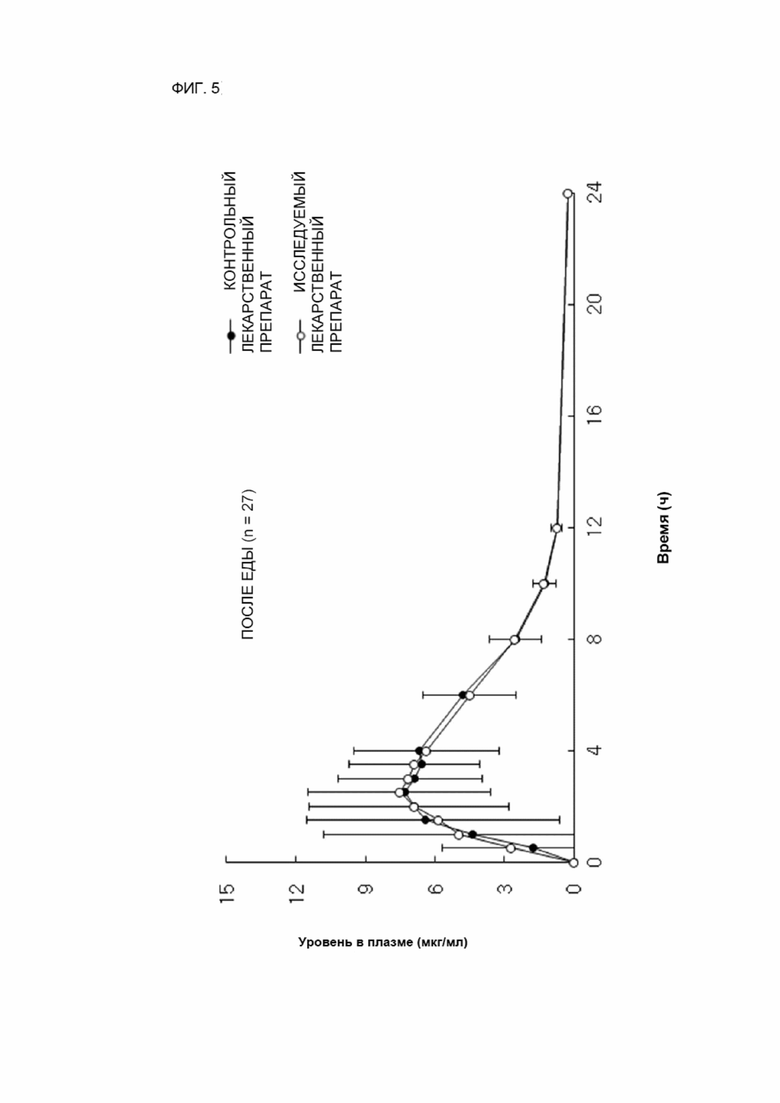
ФИГ. 5 показывает сравнение концентраций в крови исследуемого лекарственного препарата и контрольного лекарственного препарата после перорального введения при условии после еды.
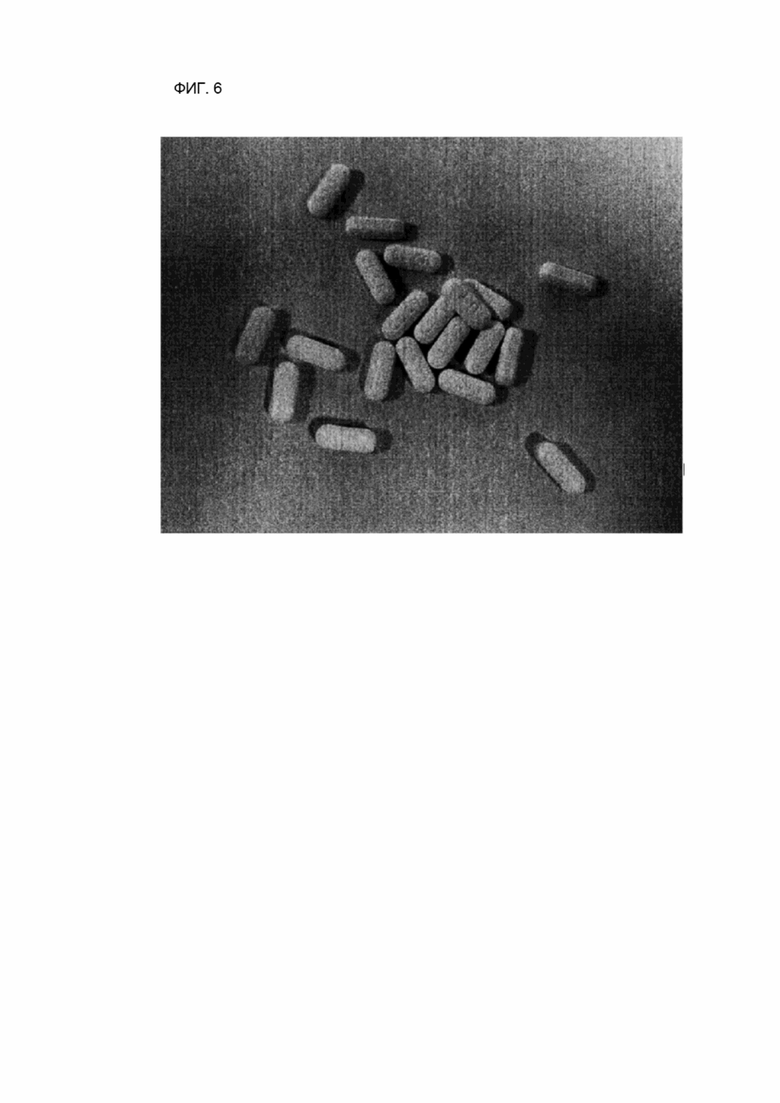
ФИГ. 6 показывает изображение геометрических форм лекарственных форм после того, как исследуемый лекарственный препарат хранился в условиях при 40 °C и режиме 75 % усиления относительной влажности в течение 2 недель.
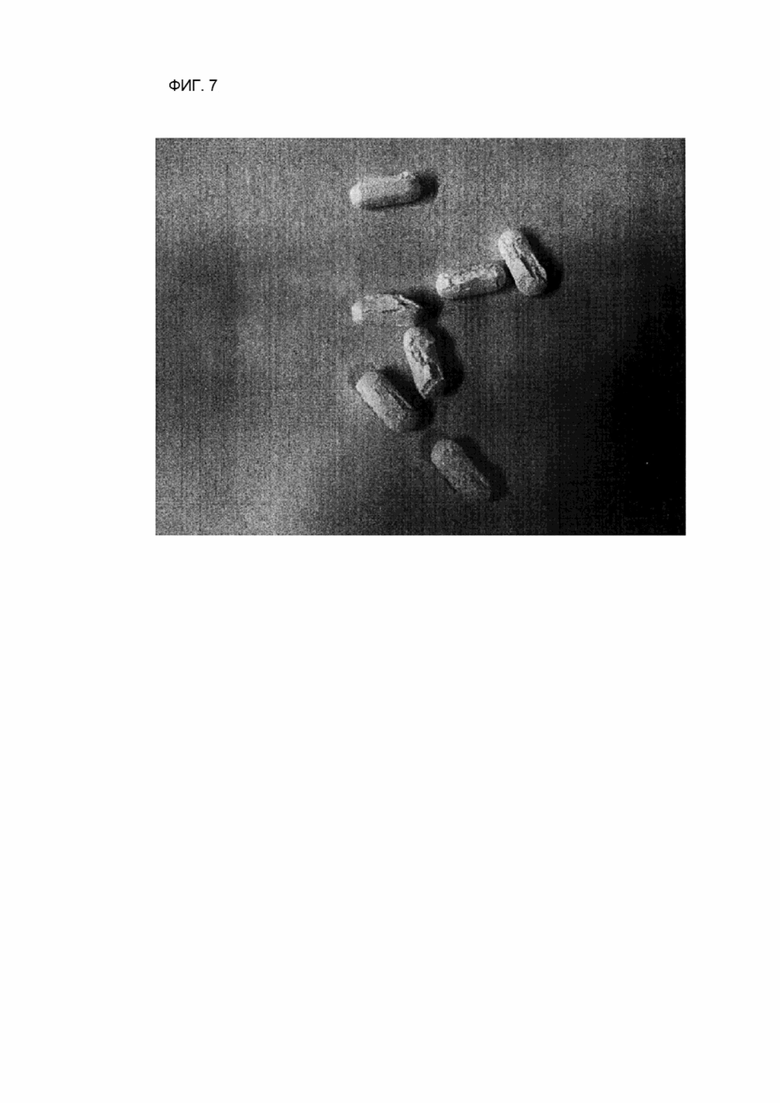
ФИГ. 7 показывает изображение геометрических форм некоторых рассыпавшихся лекарственных форм после того, как контрольный лекарственный препарат хранился в условиях при 40 °C и режиме 75 % усиления относительной влажности в течение 2 недель.
Принципы изобретения
Термины, используемые в описании и формуле изобретения, не следует толковать как ограниченные обычным или словарным значением, а следует толковать с учетом значения и представления, которое соответствует технической сущности изобретения, исходя из положения о том, что изобретатель вправе соответствующим образом определять понятие термина для того, чтобы описать его/ее собственное изобретение наилучшим образом. Соответственно, так как варианты, раскрытые в настоящем описании, и каждый пример являются только наиболее предпочтительным примером варианта осуществления настоящего изобретения и не представляют собой всей технический сущности настоящего изобретения, следует понимать, что на дату подачи настоящей заявки возможны различные аналоги и измененные примеры, которые могут заменять данные варианты.
В контексте настоящего документа и в объеме формулы изобретения «общая масса двухслойной таблетки ацеклофенака с пролонгированным высвобождением» относится к общей массе непокрытой оболочкой таблетки относительно двухслойной таблетки с пролонгированным высвобождением, таблетированной до получения нужного слоя с быстрым высвобождением и слоя с пролонгированным высвобождением, и не включает массу слоя пленочного покрытия.
Термины «приблизительно» или «по существу» и т. п., используемые по ходу изложения описания настоящей заявки, используются с соответствующей числовой величиной или применяются в качестве значения, близкого к числовой величине, если предполагается определенная производственная и существенная допустимая погрешность в упомянутом значении, и используются, чтобы препятствовать незаконному использованию недобросовестными правонарушителями раскрытых материалов, включающих числовую величину, показанную в качестве точной или абсолютной величины, чтобы облегчить понимание настоящей заявки.
В ходе изложения описания настоящей заявки термин «их смесь(и)», включенный в формулу типа Маркуша, означает по меньшей мере одну смесь или комбинацию, выбранную из группы, состоящей из составляющих элементов, описанных в формуле типа Маркуша, и означает включение одного или нескольких выбранных из группы, состоящей из составляющих элементов.
В ходе изложения описания настоящей заявки условное обозначение «A и/или B» означает «A или B, или как A, так и B».
Здесь и далее настоящее изобретение будет раскрыто подробнее.
Двухслойная таблетка ацеклофенака с пролонгированным высвобождением согласно настоящему изобретению отличается проявлением соответствующего фармакологического эффекта одновременно с исправлением недостатков одноразового препарата ацеклофенака с пролонгированным высвобождением в предшествующем уровне техники.
Вышеупомянутые патентные документы 1–3 раскрывают препарат ацеклофенака с пролонгированным высвобождением, усовершенствованный так, чтобы обеспечивать соответствующий фармакологический эффект даже при однократном приеме в день вместо препарата ацеклофенака, принимаемого два раза в день в предшествующем уровне техники.
Тем не менее, были обнаружены неожиданные проблемы в процессе выпуска данным заявителем продукта в соответствии с патентом.
Во-первых, возникал эффект слипания, если сотни тысяч или больше таблеток непрерывно таблетировали в одно время для производства и выпуска продукта. Такой эффект усугублялся по мере того как увеличивалось число изготавливаемых таблеток, а после того, как производилось примерно 600 000 таблеток, становилось невозможным производить больше таблеток, и поэтому и нет выбора, кроме как останавливать производство, очищать оборудование, а затем повторно запускать процесс производства с самого начала.
Во-вторых, если продукт хранят в течение нескольких месяцев или более в процессе дистрибуции после выпуска продукта, есть проблема в том, что формы некоторых таблеток разрушаются, а значит возникает брак.
Таким образом для того, чтобы уменьшить вышеуказанные проблемы, данный заявитель повторил исследования, при этом переделывая лекарственную форму с самого начала, и установил, что причиной эффекта слипания был масляный компонент солюбилизатора. Таким образом, были предприняты попытки значительно уменьшить содержание солюбилизатора, но так как ацеклофенак является плохо растворимым лекарственным средством, возникла проблема сниженной растворимости, когда содержание солюбилизатора снижали по сравнению с разработанной лекарственной формой, и поэтому наблюдалось последствие, когда биодоступность оказывалась ниже, чем та, что у препарата с пролонгированным высвобождением в предшествующем уровне техники.
Таким образом, после удаления солюбилизатора из препарата с пролонгированным высвобождением в предшествующем уровне техники, данный заявитель предпринял попытку приготовить продукт путем увеличения доли, которую составляет содержание лекарственного средства в слое с быстрым высвобождением, по сравнению с той, которая у слоя с пролонгированным высвобождением, но, когда солюбилизатор был полностью исключен, было обнаружено, что биодоступность плохо растворимого лекарственного препарата ацеклофенака является недостаточно высокой.
Таким образом, при помощи повторного исследования данный заявитель смог определить содержание солюбилизатора, которое не вызывает проблемы слипания даже в том случае, если препарат таблетируют до получения нужного 1 миллиона или более таблеток, осуществляя тем самым настоящее изобретение, основанное на этом.
В отличие от изобретений в предшествующем уровне техники, раскрытых в патентных документах 1–3, настоящее изобретение не предусматривает солюбилизатор в слое с быстрым высвобождением, а предусматривает солюбилизатор с меньшим содержанием, чем то, что у изобретения в предшествующем уровне техники, в слое с пролонгированным высвобождением. Кроме того, так как содержание солюбилизатора было снижено по сравнению с обычными изобретениями, низкая растворимость восполнялась включением в слой с быстрым высвобождением более высокой доли ацеклофенака, чем та, что в слое с пролонгированным высвобождением.
Тем не менее, это само по себе показало результат того, что лекарственный препарат недостаточно вымывался или ухудшался эффект пролонгированного высвобождения, так что данный заявитель попытался изменить вспомогательное вещество так, чтобы минимизировать проблему растворения. В результате повторных исследований было обнаружено, что необходимый профиль растворения обнаруживался, когда конкретное содержание стеарилфумарата натрия или смеси стеарилфумарата натрия и коллоидного диоксида кремния входил в состав за счет замены скользящего вещества.
В то же время, состав двухслойной таблетки ацеклофенака с пролонгированным высвобождением, согласно настоящему изобретению, может определяться путем пересмотра типов и содержаний замедляющего высвобождение вещества и разрыхлителя связующего вещества. Предпочтительный пример осуществления настоящего изобретения показал, что характеристики растворения в динамике по времени оставались почти такими же, как те, что у одноразового препарата ацеклофенака с пролонгированным высвобождением, выпускаемого данным заявителем, причем биодоступность была тоже равнозначной.
При этом в отличие от лекарственной формы ацеклофенака с пролонгированным высвобождением в предшествующем уровне техники эффект слипания не возникал даже в том случае, если производили 1 миллион или более таблеток, таким образом, можно было стабильно производить таблетки, причем явление отклонения массы уменьшалось.
Кроме того, гранулы слоя с быстрым высвобождением и слоя с пролонгированным высвобождением были приготовлены способом влажного гранулирования за счет замены способа приготовления типа прямого таблетирования в предшествующем уровне техники. В результате исчезло явление разрушения геометрической формы из-за образования газа внутри лекарственной формы, и в отличие от изобретения в предшествующем уровне техники было обнаружено, что стабильность является превосходной даже при длительном хранении.
Здесь и далее двухслойная таблетка ацеклофенака с пролонгированным высвобождением согласно настоящему изобретению и способ ее изготовления будут подробно раскрыты со ссылкой на примеры и сравнительные примеры. Однако примеры согласно настоящему изобретению можно модифицировать до получения нужных различных других форм, и это не следует трактовать так, чтобы ограничивать объем настоящего изобретения примерами, раскрытыми ниже. Примеры согласно настоящему изобретению представлены для более полного описания настоящего изобретения для среднего специалиста в данной области техники.
<Способ изготовления двухслойной таблетки ацеклофенака с пролонгированным высвобождением>
Двухслойную таблетку ацеклофенака с пролонгированным высвобождением согласно настоящему изобретению изготавливают путем приготовления слоя с быстрым высвобождением и слоя с пролонгированным высвобождением способом влажного гранулирования и затем таблетирования слоев до получения нужной двухслойной отдельной таблетки. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением согласно настоящему изобретению изготавливается в соответствии со способом изготовления согласно статье приготовления Общих Требований для Фармацевтических Препаратов Корейской фармакопеи, и может быть изготовлена посредством этапов, приведенных ниже в качестве предпочтительного иллюстративного способа изготовления.
Приготовление гранул слоя с быстрым высвобождением
Раствор связующего вещества приготовляли путем растворения связующего вещества в растворителе. Затем ацеклофенак, вспомогательное вещество и разрыхлитель равномерно предварительно перемешивают, предварительную смесь добавляют в раствор связующего вещества, чтобы смешать, гранулировать и затем высушить полученную смесь. Затем приготавливают гранулы с быстрым высвобождением путем добавления туда разрыхлителя и скользящего вещества и постперемешивания полученной смеси.
Приготовление гранул слоя с пролонгированным высвобождением
Раствор связующего вещества приготавливают путем растворения связующего вещества в растворителе. Затем основной ингредиент, вспомогательное вещество, солюбилизатор и вещество, замедляющее высвобождение, были равномерно предварительно перемешаны, предварительную смесь добавили в раствор связующего вещества, чтобы смешать, гранулировать и затем высушить полученную смесь. Затем гранулы слоя с пролонгированным высвобождением приготавливают путем постперемешивания полученного продукта со скользящим веществом.
Изготовление двухслойной таблетки
Не покрытую оболочкой таблетку изготавливают посредством таблетирования полученных гранул слоя с быстрым высвобождением и гранул слоя с пролонгированным высвобождением с использованием таблетировочной машины для двухслойных таблеток, а затем покрывают пленкой с использованием покрывающего агента.
<Способ изготовления двухслойной таблетки ацеклофенака с пролонгированным высвобождением>
В соответствии с вышеуказанным способом изготовления двухслойные таблетки с пролонгированным высвобождением согласно каждому примеру и сравнительному примеру были изготовлены с использованием составов, показанных в приведенной ниже Таблице 1.
[Таблица 1]
Испытание на пригодность к растворению
Испытание на пригодность к растворению сначала проводили на двухслойных таблетках ацеклофенака в соответствии с составами, показанными в Таблице 1, чтобы подтвердить действительно ли таблетки вымываются в достаточной степени. Признак, который определяет пригодность, имеет место в случаях, когда 80 % или более действующего вещества вымывается в течение 12 часов в условиях 900 мл среды растворения с pH 6,8, которую перемешивали вращательным движением 50 раз в минуту в соответствии со вторым способом (способом с использованием лопастной мешалки) испытания на растворимость согласно Корейской фармакопее. Результаты испытаний на пригодность к растворению показаны в следующей Таблице 2.
[Таблица 2]
Как показано в Таблице 2, примеры 1–4 сочли пригодными, так как 80 % или более ацеклофенака вымывались в течение 12 часов.
Тем не менее, в случае сравнительного примера 1 обнаружили, что растворение ухудшилось. Чтобы уменьшить проблему трудности изготовления таблеток, выяснили, что это связано с тем, что растворимость действующего вещества в слое с быстрым высвобождением уменьшалась за счет уменьшения содержания полоксамера, который является солюбилизатором, в сравнении со способом в предшествующем уровне техники.
Из вышеприведенных результатов, можно видеть, что желательно массовое отношение по меньшей мере от 1 : 1 до 1,5 : 1 для содержания ацеклофенака в слое с быстрым высвобождением и слое с пролонгированным высвобождением. Кроме того, в результате дополнительных проведенных данным заявителем экспериментов, когда ацеклофенак в слое с быстрым высвобождением и слое с пролонгированным высвобождением входил в состав при массовом отношении от 1,1 : 1 до 1,3 : 1, наблюдался профиль растворения, соответствующий тому, что у контрольного лекарственного препарата в предшествующем уровне техники, который был оптимальным.
<Приготовление контрольного лекарственного препарата>
Контрольный лекарственный препарат ацеклофенака с пролонгированным высвобождением (сравнительный пример 2) приготовлен способом в предыдущем уровне техники, раскрытым в патентном документе 3. Конкретные составы показаны в приведенной ниже таблице 3.
[Таблица 3]
высвобождением
вещество
высвобождением
высвобождение
<Тестовый пример 1> Испытание на растворимость in vitro
Сравнительное испытание скоростей растворения проводили путем обработки каждой из 12 таблеток в условиях различных сред растворения, имеющих pH 1,2, 4,5 и 6,8, с использованием примера 2 в качестве исследуемого лекарственного препарата и сравнительного примера 2 в качестве контрольного лекарственного препарата.
Условия испытания на растворимость
Условия испытания, используемые в тесте на растворимость, заключаются в следующем.
Проба: 36 таблеток исследуемого лекарственного препарата (пример 2), 36 таблеток контрольного лекарственного препарата (сравнительный пример 2)
Среда растворения: pH 1,2, pH 4,5 и pH 6,8 в методе испытания на растворимость согласно Корейской фармакопее
Объем среды растворения: 900 мл, температура испытания: 37±0,5 °C
Метод испытания: второй метод испытания на растворимость (способ с использованием лопастной мешалки) согласно Корейской фармакопее, 50 оборотов в минуту
Отбор проб: 10 мл среды растворения отбирают в каждый момент отбора пробы и фильтруют с помощью фильтра 0,45 мкм для получения испытуемого раствора, а после отбора пробы каждой среды растворения к ней добавляют равное количество свежей среды растворения в целях калибровки.
Устройство для анализа: ВЭЖХ
Результаты сравнительного испытания на растворение
12 таблеток каждого из исследуемых лекарственных препаратов и контрольного лекарственного препарата исследовались в условиях среды растворения с pH 1,2, 4,5 и 6,8, и средние значения скоростей растворения исследуемого лекарственного препарата и контрольного лекарственного препарата сравнивались с использованием кривых зависимостей и представлены на ФИГ. 1–3.
Результаты и обсуждение
В результате испытания на растворимость исследуемого лекарственного препарата (пример 2) и контрольного лекарственного препарата (сравнительный пример 2) достаточное растворение не было достигнуто в условиях среды растворения с низким pH, с pH 1,2 и pH 4,5, что обусловлено особенностями растворимости ацеклофенака, таким образом, было сложно определить, эквивалентны ли исследуемый лекарственный препарат и контрольный лекарственный препарат.
Тем не менее, в результате измерения скорости растворения в условиях среды растворения с pH 6,8 погрешность между средней величиной скорости растворения исследуемого лекарственного препарата и средней величиной скорости растворения контрольного лекарственного препарата не превышала 10 % в контрольный момент времени, когда скорости растворения ацеклофенака исследуемого лекарственного препарата и контрольного лекарственного препарата составляли 85 % или более в течение 1440 минут, и средняя величина скорости растворения ацеклофенака контрольного лекарственного препарата составляла 30 %, 60 % или 80 %, таким образом, было установлено, что профили растворения исследуемого лекарственного препарата и контрольного лекарственного препарата, соответствуют друг другу.
<Тестовый пример 2> Испытание in vivo
Условия приема лекарственного средства натощак
25 здоровых мужчин были разделены на две группы таким образом, чтобы можно было ввести и сравнить исследуемый лекарственный препарат и контрольный лекарственный препарат, и после этого исследовали и сравнивали биодоступность натощак. Исследуемый лекарственный препарат и контрольный лекарственный препарат принимали внутрь с 240 мл воды приблизительно в 6:00 до полудня после голодания по 10 часов или более. Участникам исследования запрещалось принимать какое-либо количество пищи по крайней мере в течение 4 часов после приема лекарственного препарата. Участникам исследования разрешалось пить воду по мере необходимости, кроме как в течение 1 часа до и 2 часов после введения лекарственного препарата. После того, как вводили исследуемый лекарственный препарат и контрольный лекарственный препарат каждой группе, измеряли концентрацию в крови через равные промежутки времени.
Условия после еды
27 здоровых мужчин были разделены на две группы таким образом, чтобы можно было ввести и сравнить исследуемый лекарственный препарат и контрольный лекарственный препарат, и после этого исследовали и сравнивали биодоступность в условиях после еды. Исследуемый лекарственный препарат и контрольный лекарственный препарат принимали внутрь с 240 мл воды приблизительно в 6:00 до полудня после завтрака с высоким содержанием жира/высококалорийного, включающего стакан молока. Участники исследования начинали предоставленный завтрак за 30 минут до введения лекарственного препарата. Участники исследования завершали завтрак за 30 минут или менее, и лекарственный препарат вводили приблизительно через 30 минут после начала завтрака. Участникам исследования запрещалось принимать какое-либо количество пищи по крайней мере в течение 4 часов после приема лекарственного препарата. Участникам исследования разрешалось пить воду по мере необходимости, кроме как в течение 1 часа до и 2 часов после введения лекарственного препарата. После того, как вводили исследуемый лекарственный препарат и контрольный лекарственный препарат каждой группе, измеряли концентрацию в крови через равные промежутки времени.
Результаты и обсуждение
Результаты тестов in vivo натощак и после еды показаны на ФИГ. 4 и 5. Согласно результатам, показанным на ФИГ. 4 и 5, было установлено, что биодоступность каждого из исследуемого лекарственного препарата и контрольного лекарственного препарата эквивалентна при условиях как натощак, так и после еды.
<Тестовый пример 3> Исследование препарата и стабильности при хранении
Так как было продемонстрировано, что исследуемый лекарственный препарат фармакокинетически эквивалентен двухслойной таблетке ацеклофенака с пролонгированным высвобождением согласно настоящему изобретению в тестовых примерах 1 и 2, было проведено сравнительное испытание, чтобы определить, действительно ли могут быть исправлены проблемы ограничений слипания во время серийного производства и проблемы пониженной стабильности при долгосрочном хранении, которые возникли у контрольного лекарственного препарата в предшествующем уровне техники.
Оценка сыпучести гранул
Оценка сыпучести проводилась для предварительной проверки таблетируемости исследуемого лекарственного препарата и контрольного лекарственного препарата.
Сначала для исследуемого лекарственного препарата и контрольного лекарственного препарата были приготовлены гранулы с быстрым высвобождением и с пролонгированным высвобождением в соответствии с каждым составом, а затем гранулы с быстрым высвобождением и с пролонгированным высвобождением просто смешали. Далее провели оценку сыпучести для смешанных гранул исследуемого лекарственного препарата и контрольного лекарственного препарата. Оценка сыпучести проводилась путем измерения угла естественного откоса, которое обычно применяется в уровне техники.
Угол естественного откоса каждой гранулы был измерен с помощью устройства измерения угла естественного откоса (GTB, ERWEKA GmbH), и результаты показаны в приведенной ниже Таблице 4.
[Таблица 4]
Как показано в Таблице 4, гранулы исследуемого лекарственного препарата имели угол естественного откоса 32°, и когда гранулы приготавливали с применением способов и устройств, обычно применяемых на уровне техники, ожидалась высокая таблетируемость в отсутствие каких-нибудь проблем. Напротив, было показано, что в случае контрольного лекарственного препарата угол естественного откоса имел значение до 43°, таким образом, было обнаружено, что, вероятно, масляный компонент создавал проблемы в условиях процесса приготовления.
Сравнение технической возможности проблем таблетирования во время серийного производства
После того, как было произведено 600 000 или более таблеток контрольного лекарственного препарата возникли проблемы таблетирования в связи с наличием проблемы слипания, поэтому имелась цель проследить, возникли ли проблемы, когда изготовили 1 500 000 таблеток каждого из исследуемого лекарственного препарата (пример 2) и контрольного лекарственного препарата (сравнительный пример 2), и результаты показаны в приведенной ниже Таблице 5.
[Таблица 5]
Как показано в Таблице 5, в случае контрольного лекарственного препарата проблема слипания была явно выражена со времени производства от 500 000 до 1 000 000 таблеток, и материалы-полуфабрикаты прилипали к устройству, делая невозможным непрерывное изготовление таблеток. Напротив, в случае исследуемого лекарственного препарата проблема слипания не возникала, и таблетируемость была превосходной до тех пор, пока не произвели 1 500 000 таблеток.
Измерение физических свойств изготовленных таблеток
В контрольный момент времени, когда около 500 000 таблеток, которые не вызвали проблем изготовления таблеток, были таблетированы при использовании как исследуемого лекарственного препарата, так и контрольного лекарственного препарата, было отобрано 100 опытных таблеток из числа каждого из исследуемого лекарственного препарата и контрольного лекарственного препарата, и были измерены прочность на истирание, твердость и отклонение от средней массы таблеток. Результаты измерений показаны в приведенной ниже Таблице 6.
[Таблица 6]
(кп)
Как показано в Таблице 6, в случае исследуемого лекарственного препарата прочность на истирание составляла 1 % или менее, твердость составляла 13,5 кп, а отклонение от средней массы составляло 5,6 %, причем было обнаружено, что исследуемый лекарственный препарат обладал превосходными физическими свойствами по сравнению с контрольным лекарственным препаратом.
Сравнение стабильности при длительном хранении
После того, как исследуемый лекарственный препарат (пример 2) и контрольный лекарственный препарат (сравнительный пример 2) хранились при 40 °C и режиме 75 % усиления относительной влажности в течение 2 недель, фиксировали геометрические формы лекарственной формы. В случае исследуемого лекарственного средства формы таблеток оставались стабильно поддерживаемыми, как показано на ФИГ. 6, но в случае контрольного лекарственного препарата в связи с образованием газа возникало повреждение таблетки у некоторых отдельно взятых таблеток, как показано на ФИГ. 7.

Изобретение относится к области медицины, а именно к фармакологии, и предназначено для получения двухслойной таблетки ацеклофенака с пролонгированным высвобождением. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением включает слой с быстрым высвобождением, содержащий ацеклофенак, вспомогательное вещество и скользящее вещество, а также слой с пролонгированным высвобождением, содержащий ацеклофенак, вспомогательное вещество, солюбилизатор, вещество, замедляющее высвобождение, и скользящее вещество. При этом солюбилизатор не содержится в слое с быстрым высвобождением. Компоненты используются в заявленных количествах. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением обеспечивает достижение быстрого фармакологического эффекта и получение долгосрочного эффекта даже при однократном приеме в день, а также не вызывает трудностей даже при непрерывном серийном производстве и обладает превосходной стабильностью при длительном хранении. 9 з.п. ф-лы, 7 ил., 6 табл., 6 пр.
1. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением, содержащая:
слой с быстрым высвобождением, содержащий ацеклофенак, вспомогательное вещество и скользящее вещество, и
слой с пролонгированным высвобождением, содержащий ацеклофенак, вспомогательное вещество, солюбилизатор, вещество, замедляющее высвобождение, и скользящее вещество, где
массовое отношение ацеклофенака, содержащегося в слое с быстрым высвобождением и в слое с пролонгированным высвобождением, составляет от 1:1 до 1,5:1,
связующее вещество содержится в количестве от 3 до 5 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением,
разрыхлитель содержится в количестве от 1 до 3 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением,
солюбилизатор не содержится в слое с быстрым высвобождением, и
скользящее вещество является стеарилфумаратом натрия или смесью стеарилфумарата натрия и коллоидного диоксида кремния,
замедляющее высвобождение вещество содержится в количестве от 15 до 30 масс.% от общей массы части с пролонгированным высвобождением.
2. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой скользящее вещество содержится в количестве от 2 до 6 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением.
3. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой солюбилизатор является одним или смесью из двух и более, выбранных из группы, состоящей из полоксамера, токоферилполиэтиленгликольсукцината, лабразола, лабрафила, лапрафака, полисорбата, касторового масла, транскутола, лаурилсульфата натрия, полиэтиленгликоля, Макрогол 15 гидроксистеарата, СолюплюсаR и ГелюцираR.
4. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой солюбилизатор содержится в количестве от 0,5 до 1,5 масс.% от общей массы двухслойной таблетки ацеклофенака с пролонгированным высвобождением.
5. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой замедляющее высвобождение вещество является одним или смесью двух и более, выбранных из группы, состоящей из гидроксипропилметилцеллюлозы, этилцеллюлозы, поливинилового спирта, карбомера, ксантановой камеди и Коллидона SR.
6. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой замедляющее высвобождение вещество является смесью гидроксипропилметилцеллюлозы, обладающей вязкостью от 75000 до 140000 мПа, и карбомера в соотношении 10:1 до 20:1.
7. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой вспомогательное вещество является одним или смесью двух и более, выбранных из группы, состоящей из микрокристаллической целлюлозы, лактозы, маннита, целлюлозы в порошке и алюмосиликата магния.
8. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, где двухслойная таблетка ацеклофенака с пролонгированным высвобождением содержит один или два, или более разрыхлителей, выбранных из группы, состоящей из кроскармеллозы натрия, натрия гликолята крахмала, прежелатинизированного крахмала и кросповидона.
9. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, где двухслойная таблетка ацеклофенака с пролонгированным высвобождением содержит одно или два, или более связующих веществ, выбранных из группы, состоящей из гидроксипропилцеллюлозы, повидона, ацетат-полиэтиленгликолевого привитого сополимера и сополимера полиэтилена и винилацетата.
10. Двухслойная таблетка ацеклофенака с пролонгированным высвобождением по п. 1, в которой слой с быстрым высвобождением и слой с пролонгированным высвобождением приготовлены способом влажного гранулирования.
| ПРЕПАРАТ АЦЕКЛОФЕНАКА С МЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ, ОКАЗЫВАЮЩИЙ БЫСТРОЕ БОЛЕУТОЛЯЮЩЕЕ И ПРОТИВОВОСПАЛИТЕЛЬНОЕ ДЕЙСТВИЕ, ОБЕСПЕЧИВАЮЩИЙ ОПТИМАЛЬНОЕ ФАРМАКОЛОГИЧЕСКОЕ И КЛИНИЧЕСКОЕ ДЕЙСТВИЕ ПРИ ПРИЕМЕ ОДИН РАЗ В ДЕНЬ | 2011 |
|
RU2540471C2 |
| СОДЕРЖАЩИЕ АЦЕКЛОФЕНАК ПЕРОРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2009 |
|
RU2493843C2 |
| KR 20120116545 A, 23.10.2012 | |||
| KR 20120083276 A, 25.07.2012 | |||
| KR 20110106005 A, 28.09.2011. | |||
Авторы
Даты
2022-10-17—Публикация
2020-03-16—Подача