ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] По настоящей заявке испрошен приоритет в соответствии с § 119(e) раздела 35 Свода законов США на основании предварительной заявки на патент США №62/450455, поданной 25 января 2017 года, и предварительной заявки на патент США №62/619165, поданной 19 января 2018 года, содержание каждой из которых включено в настоящую заявку во всей полноте посредством ссылок.
ОБЛАСТЬ ТЕХНИКИ
[002] Настоящее изобретение относится к способам и композициям для лечения рака с применением диарильного макроцикла в комбинации с по меньшей мере одним другим противораковым терапевтическим средством, таким как ингибитор EGFR.
УРОВЕНЬ ТЕХНИКИ
[003] EGFR экспрессируется при некоторых солидных злокачественных образованиях, включая НМРЛ, ПРГШ, злокачественную глиому и колоректальный рак, и, как известно, нарушенная или дерегулированная активность EGFR связана со множеством онкогенных процессов. Рак легких остается ведущей причиной смертности от рака в промышленно развитых странах. Раковые заболевания, которые возникают в легких, делятся на два основных типа, немелкоклеточный рак легкого и мелкоклеточный рак легкого, в зависимости от того, как клетки выглядят под микроскопом. Немелкоклеточный рак легкого (плоскоклеточная карцинома, аденокарцинома и крупноклеточная карцинома), в целом, медленнее распространяется в другие органы по сравнению с мелкоклеточным раком легкого. Примерно в 75 процентах случаев рак легкого классифицируют как немелкоклеточный рак легкого (например, аденокарциномы), а в оставшихся 25 процентах как мелкоклеточный рак легкого. У пациентов с распространенным заболеванием химиотерапия обеспечивает слабое благоприятное действие в отношении выживаемости, но при этом вызывает значительную токсичность, что подчеркивает потребность в терапевтических агентах, которые специфически действуют на важные генетические нарушения, которые управляют ростом опухоли (Schiller J H et al., N Engl J Med, 346: 92-98, 2002).
[004] Мутации, приводящие к повышенной экспрессии (называемой повышающей регуляцией) или избыточной активности EGFR, связаны с различными формами рака, включая рак легкого, рак анального канала и мультиформную глиобластому. Мутации, амплификации или нарушения регуляции EGFR или членов этого семейства задействованы примерно в 30% от всех случаев эпителиального рака. Таким образом, мутации EGFR были выявлены при нескольких типах рака и дали толчок развитию противораковых терапевтических средств, направленных на EGFR, основанному на двух подходах: (1) направленные моноклональные антитела (mAB), которые предотвращают связывание лигандов с EGFR, и (2) низкомолекулярные ингибиторы тирозинкиназ (TKI), которые блокируют внутриклеточную каталитическую активность рецепторов. Протеинкиназы являются ключевыми регуляторами роста, пролиферации и выживания клеток. В раковых клетках накапливаются генетические и эпигенетические изменения, которые приводят к нарушенной активации путей сигнальной трансдукции, которые управляют злокачественными процессами (Manning, G.; Whyte, D. B.; Martinez, R.; Hunter, T.; Sudarsanam, S. The protein kinase complement of the human genome. Science 2002, 298, 1912-1934). Фармакологическое ингибирование этих сигнальных путей представляет собой многообещающий способ вмешательства при направленной терапии рака (Sawyers, C. Targeted cancer therapy. Nature 2004, 432, 294-297).
[005] Низкомолекулярные TKI HER первого поколения включают гефитиниб (Iressa®) и эрлотиниб (Tarceva®), оба из которых обратимо связываются с EGFR. Гефитиниб показан во всех линиях лечения распространенного НМРЛ, имеющего мутации EGFR в опухоли, а эрлотиниб показан для лечения распространенного НМРЛ после проведения предшествующей химиотерапии, но разрабатывается для использования во всех линиях лечения НМРЛ с положительным статусом мутации EGFR. Указанные новые лекарственные средства обратимо и направленно действуют на киназный домен EGFR.
[006] Низкомолекулярные TKI второго поколения были разработаны в качестве необратимых ингибиторов EGFR, которые необратимо связываются с киназным доменом EGFR, предпочтительно с цистеином 797 в EGFR. Несмотря на наличие начального ответа, у пациентов с мутациями EGFR часто развивается приобретенная устойчивость в среднем в течение примерно 12 месяцев. В общее определение пациентов с приобретенной устойчивостью включены пациенты, которым ранее проводили монотерапию с использованием EGFR-TKI (например, гефитиниба или эрлотиниба); и которые удовлетворяют какому-либо одному или обоим из следующих критериев: опухоль, которая содержит мутацию EGFR, которая заведомо связана с восприимчивостью к лекарственному средству (т.е. G719X, делеция экзона 19, L858R, L861Q), или объективное клиническое благоприятное действие после лечения с использованием EGFR-TKI; системное прогрессирование заболевания согласно критериям RECIST, известным в данной области техники, при текущем лечении, направленном на EGFR, в течение по меньшей мере 24 недель.
[007] Несмотря на успешные результаты ингибиторов EGFR первого и второго поколения при направленной терапии НМРЛ, продолжительность клинического ответа ограничена неизбежным развитием приобретенной лекарственной устойчивости. Помимо первичных мутаций EGFR (связанных с восприимчивостью к эрлотинибу и гефитинибу) примерно у половины пациентов с приобретенной устойчивостью к EGFR-TKI появляется вторичная мутация EGFR (T790M) в АТФ-связывающем кармане тирозинкиназы, которая может изменять аффинность рецепторов в пользу АТФ. Указанные вторичные мутации сохраняют передачу сигнала в раковых клетках через мутантный EGFR, это позволяет предположить, что у части пациентов с приобретенной устойчивостью к EGFR-TKI рост и пролиферация опухоли сохраняют зависимость от EGFR. Другие механизмы первичной или приобретенной устойчивости включают повышающую регуляцию обходных сигнальных систем (таких как AXL, MET, ERBb2 и т.д.), активирующие мутации в последующих путях (PI3K, AKT, MEK, RAF), низкий уровень мРНК или полиморфизм проапоптотического белка BIM, запуск программы транскрипции EMT и фенотипических изменений или инициирование повышенного уровня PD-L1 в опухоли (Morgillo F, Della Corte CM, Fasano M, et al. Mechanisms of resistance to EGFR-targeted drugs: lung cancer. ESMO Open 2016;1: e000060).
[008] В области медицины существует значительная потребность в приемлемом способе лечения рака, опосредованного EGFR. Комбинационные способы лечения могут быть многообещающими как дополнение к стратегиям направленной монотерапии, отмеченных выше в качестве терапии первой линии, и для преодоления невосприимчивости, возникающей у устойчивых форм рака.
КРАТКОЕ ОПИСАНИЕ
[009] Было обнаружено, что комбинация ингибитора EGFR и тройного ингибитора FAK, SRC и JAK2 обеспечивает устойчивый ответ при раковых заболеваниях, опосредованных EGFR.
[010] Согласно одному из аспектов в изобретении предложен способ лечения рака у животного-хозяина, включающий стадию введения животному-хозяину терапевтически эффективного количества соединения, которое ингибирует FAK, SRC и JAK2, в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента. В некоторых вариантах реализации дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[011] Согласно другому аспекту в изобретении предложено соединение, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемая соль для применения в лечении рака у пациента в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента. В некоторых вариантах реализации дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[012] Согласно другому аспекту в изобретении предложено применение соединения, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемой соли для получения лекарственного средства, содержащего терапевтически эффективное количество соединения, для лечения рака у пациента в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента. В некоторых вариантах реализации дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[013] Согласно другому аспекту в изобретении предложена композиция, содержащая соединение, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемую соль в терапевтически эффективном количестве, для применения в лечении рака у пациента в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента. В некоторых вариантах реализации дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[014] Согласно другому аспекту в изобретении предложено лекарственное средство, содержащее соединение, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемую соль совместно с ингибитором EGFR или его фармацевтически приемлемой солью в виде фиксированной или свободной комбинации.
[015] Согласно другому аспекту в изобретении предложена синергическая композиция соединения, которое ингибирует FAK, SRC и JAK2, и ингибитора EGFR, где два компонента вступают в контакт друг с другом в участке-мишени.
[016] Согласно другому аспекту в изобретении предложена синергическая композиция соединения, которое ингибирует FAK, SRC и JAK2, и ингибитора EGFR, где два компонента вступают в контакт друг с другом только в организме человека.
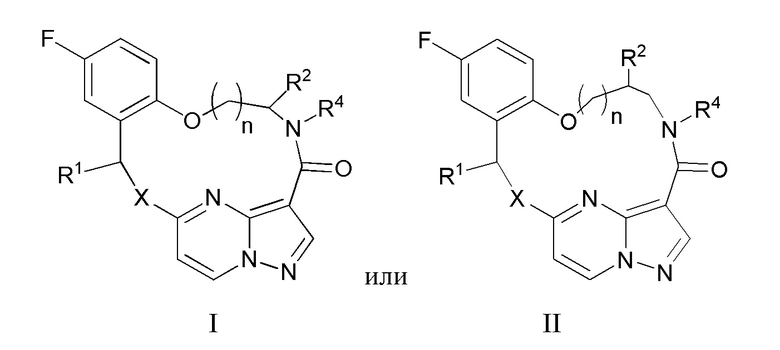
[017] В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
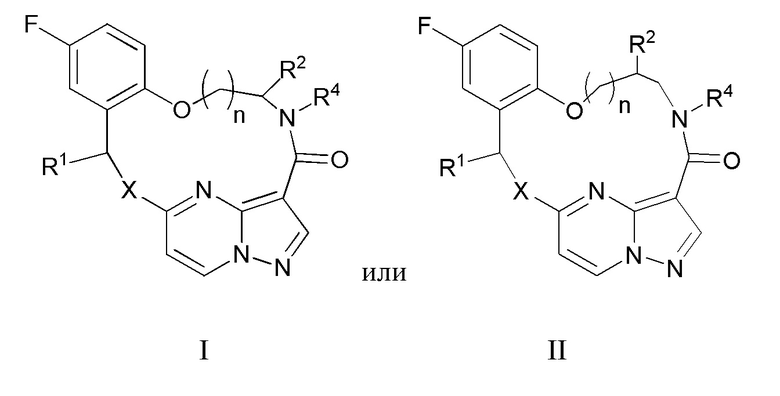
[018] где
[019] X представляет собой NR3 или CHR3;
[020] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, -NHC(O)NH2, -NHC(O)NHC1-C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1-C6 алкил, -NHC(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, -NHC(O)OC1-C6 алкил, -N(C1-C6 алкил)C(O)OC1-C6 алкил, - NHS(O)(C1-C6 алкил), NHS(O)2(C1-C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), -NHS(O)NH2, -NHS(O)2NH2, -N(C1-C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, -NHS(O)NH(C1-C6 алкил), -NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, -NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, -C(O)OC1-C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, -SC1-C6 алкил, -S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), -S(O)N(C1-C6 алкил)2,-S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, -C3-C6 циклоалкил или 3-7-членный гетероциклоалкил;
[021] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[022] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1-C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[023] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[024] n равен 0 или 1;
[025] или представляет собой фармацевтически приемлемую соль указанных соединений.
[026] В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I-a или II-a
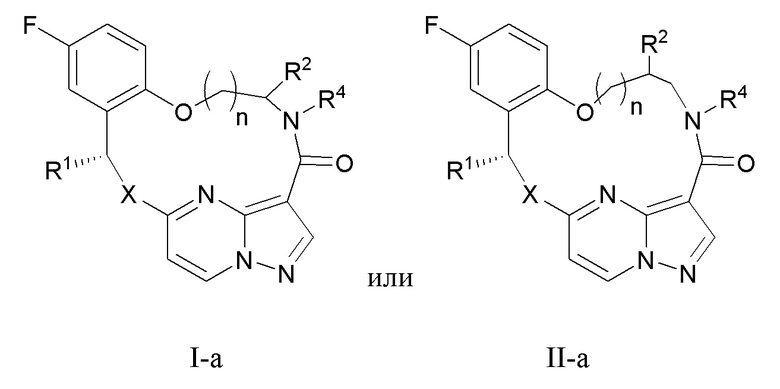
[027] где
[028] X представляет собой NR3 или CHR3;
[029] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, -NHC(O)NH2, -NHC(O)NHC1-C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1-C6 алкил, -NHC(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, -NHC(O)OC1-C6 алкил, -N(C1-C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), -NHS(O)2(C1-C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), -NHS(O)NH2, -NHS(O)2NH2, -N(C1-C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2,-S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[030] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[031] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1-C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[032] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[033] n равен 0 или 1;
[034] или представляет собой фармацевтически приемлемую соль указанных соединений.
[035] В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I-b или II-b
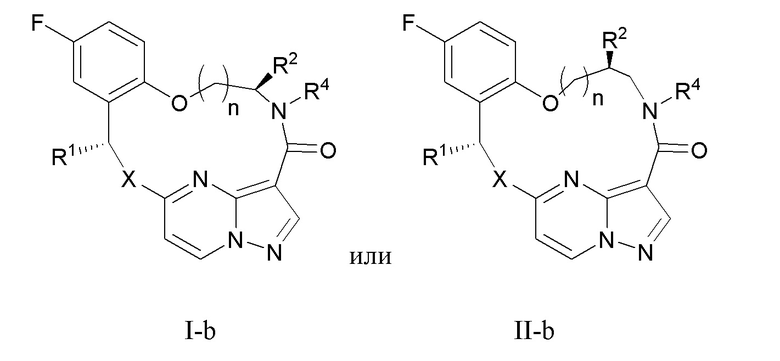
[036] где
[037] X представляет собой NR3 или CHR3;
[038] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, -NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, - NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2,-S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[039] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[040] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1-C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[041] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[042] n равен 0 или 1;
[043] или представляет собой фармацевтически приемлемую соль указанных соединений.
[044] В некоторых вариантах реализации описанных выше аспектов соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу
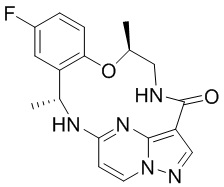 ,
, 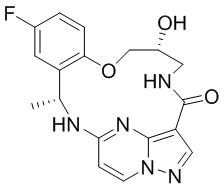 или
или 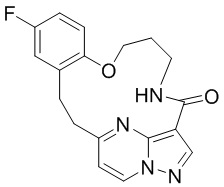
[045] или представляет собой фармацевтически приемлемую соль указанных соединений.
[046] В некоторых вариантах реализации описанных выше аспектов ингибитор EGFR представляет собой антитело или низкомолекулярный ингибитор. В некоторых вариантах реализации описанных выше аспектов ингибитор EGFR представляет собой антитело. В некоторых вариантах реализации описанных выше аспектов антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб. В некоторых вариантах реализации описанных выше аспектов ингибитор EGFR представляет собой низкомолекулярный ингибитор. В некоторых вариантах реализации описанных выше аспектов низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб, WZ 3146, WZ 4002, WZ 8040 или их фармацевтически приемлемые соли.
[047] Дополнительные варианты реализации, отличительные признаки и преимущества изобретения будут понятны из последующего подробного описания и при реализации изобретения. Соединения согласно настоящему изобретению могут быть описаны в рамках вариантов реализации в любом из следующих пронумерованных пунктов. Следует понимать, что любые варианты реализации, описанные в настоящем документе, можно применять совместно с любыми другими вариантами реализации, описанными в настоящем документе, если эти варианты реализации не противоречат друг другу.
[048] 1. Способ лечения рака у животного-хозяина, включающий стадию введения животному-хозяину терапевтически эффективного количества соединения, которое ингибирует FAK, SRC и JAK2, в комбинации с терапевтическим эффективным количеством по меньшей мере одного дополнительного противоракового агента.
[049] 2. Способ по п.1, отличающийся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
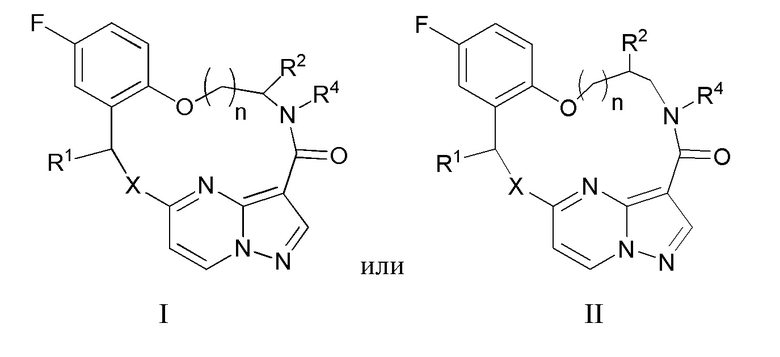
[050] где
[051] X представляет собой NR3 или CHR3;
[052] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, - N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2,-S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[053] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[054] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[055] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[056] n равен 0 или 1;
[057] или представляет собой фармацевтически приемлемую соль указанных соединений.
[058] 3. Способ по п.п. 1 или 2, отличающийся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[059] или его фармацевтически приемлемую соль.
[060] 4. Способ по п.п. 1-3, отличающийся тем, что указанный рак выбран из группы, состоящей из АККЛ, НМРЛ, нейробластомы, воспалительной миофибробластической опухоли, почечноклеточной карциномы взрослых, детской почечноклеточной карциномы, рака молочной железы, ER+ рака молочной железы, трижды негативного рака молочной железы, аденокарциномы толстой кишки, глиобластомы, мультиформной глиобластомы, анапластического рака щитовидной железы, холангиокарциномы, рака яичников, колоректального рака, воспалительной миофибробластической опухоли, ангиосаркомы, эпителиоидной гемангиоэндотелиомы, внутрипеченочной холангиокарциномы, рака щитовидной железы, шпицоидных новообразований, саркомы, астроцитомы, низкозлокачественной глиомы мозга, секреторной карциномы молочной железы, аналогичной карциномы молочной железы, острого миелоидного лейкоза, врожденной мезобластической нефромы, врожденных фибросарком, Ph-подобного острого лимфобластного лейкоза, карциномы щитовидной железы, плоскоклеточного рака головы и шеи, детской глиомы, ХМЛ, рака предстательной железы, плоскоклеточной карциномы легкого, серозной цистаденокарциномы яичников, кожной меланомы, рака предстательной железы, устойчивого к кастрации, лимфомы Ходжкина, серозного и светлоклеточного рака эндометрия, рака полости рта, рака эндометрия, эндокринного рака, рака кожи, рака желудка, рака пищевода, рака гортани, рака поджелудочной железы, рака толстой кишки, рака мочевого пузыря, рака кости, рака шейки матки, рака матки, рака яичек, рака прямой кишки, рака почки, рака печени и рака легкого.
[061] 5. Способ по любому из п.п. 1-4, отличающийся тем, что указанный рак представляет собой немелкоклеточный рак легкого, метастатический немелкоклеточный рак легкого, плоскоклеточный рак головы и шеи, метастатический плоскоклеточный рак головы и шеи, колоректальный рак, метастатический колоректальный рак, рак поджелудочной железы или метастатический рак поджелудочной железы.
[062] 6. Способ по п.4, отличающийся тем, что указанный рак представляет собой немелкоклеточный рак легкого.
[063] 7. Способ по п.4, отличающийся тем, что указанный рак представляет собой колоректальный рак.
[064] 8. Способ по п.4, отличающийся тем, что указанный рак представляет собой рак поджелудочной железы.
[065] 9. Способ по п.4, отличающийся тем, что указанный рак представляет собой трижды негативный рак молочной железы.
[066] 10. Способ по любому из п.п. 1-9, отличающийся тем, что указанный дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[067] 11. Способ по любому из п.п. 1-10, отличающийся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR или низкомолекулярный ингибитор EGFR.
[068] 12. Способ по любому из п.п. 1-10, отличающийся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR.
[069] 13. Способ по п.13, отличающийся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[070] 14. Способ по любому из п.п. 1-10, отличающийся тем, что указанный дополнительный противораковый агент представляет собой низкомолекулярный ингибитор EGFR.
[071] 15. Способ по п.14, отличающийся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[072] 16. Способ по любому из п.п. 1-9, отличающийся тем, что указанный дополнительный противораковый агент представляет собой гефитиниб или его фармацевтически приемлемую соль.
[073] 17. Способ по любому из п.п. 1-9, отличающийся тем, что указанный дополнительный противораковый агент представляет собой осимертиниб или его фармацевтически приемлемую соль.
[074] 18. Способ по любому из п.п. 1-9, отличающийся тем, что указанный дополнительный противораковый агент представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[075] 18a. Способ по любому из п.п. 1-9, отличающийся тем, что указанный дополнительный противораковый агент представляет собой икотиниб или его фармацевтически приемлемую соль.
[076] 19. Соединение, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемая соль для применения в лечении рака у пациента в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента.
[077] 20. Соединение по п.19, отличающееся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
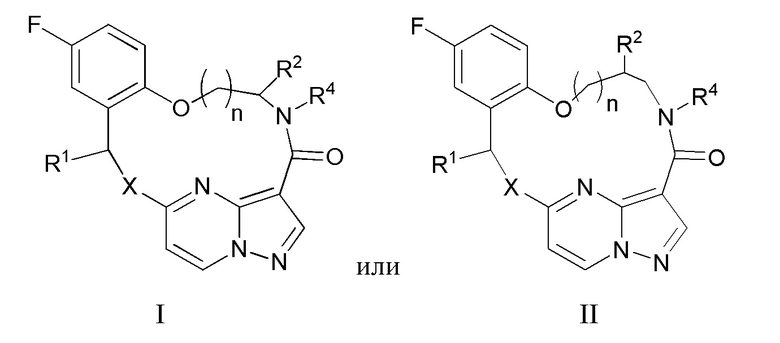
[078] где
[079] X представляет собой NR3 или CHR3;
[080] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, - N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, - NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2, -S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[081] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[082] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[083] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[084] n равен 0 или 1;
[085] или представляет собой фармацевтически приемлемую соль указанных соединений.
[086] 21. Соединение по п.19, отличающееся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[087] или его фармацевтически приемлемую соль.
[088] 22. Соединение по любому из п.п. 19-21, отличающееся тем, что указанный рак выбран из группы, состоящей из АККЛ, НМРЛ, нейробластомы, воспалительной миофибробластической опухоли, почечноклеточной карциномы взрослых, детской почечноклеточной карциномы, рака молочной железы, ER+ рака молочной железы, трижды негативного рака молочной железы, аденокарциномы толстой кишки, глиобластомы, мультиформной глиобластомы, анапластического рака щитовидной железы, холангиокарциномы, рака яичников, колоректального рака, воспалительной миофибробластической опухоли, ангиосаркомы, эпителиоидной гемангиоэндотелиомы, внутрипеченочной холангиокарциномы, рака щитовидной железы, шпицоидных новообразований, саркомы, астроцитомы, низкозлокачественной глиомы мозга, секреторной карциномы молочной железы, аналогичной карциномы молочной железы, острого миелоидного лейкоза, врожденной мезобластической нефромы, врожденных фибросарком, Ph-подобного острого лимфобластного лейкоза, карциномы щитовидной железы, плоскоклеточного рака головы и шеи, детской глиомы, ХМЛ, рака предстательной железы, плоскоклеточной карциномы легкого, серозной цистаденокарциномы яичников, кожной меланомы, рака предстательной железы, устойчивого к кастрации, лимфомы Ходжкина, серозного и светлоклеточного рака эндометрия, рака полости рта, рака эндометрия, эндокринного рака, рака кожи, рака желудка, рака пищевода, рака гортани, рака поджелудочной железы, рака толстой кишки, рака мочевого пузыря, рака кости, рака шейки матки, рака матки, рака яичек, рака прямой кишки, рака почки, рака печени и рака легкого.
[089] 23. Соединение по любому из п.п. 19-21, отличающееся тем, что указанный рак представляет собой немелкоклеточный рак легкого.
[090] 24. Соединение по любому из п.п. 19-21, отличающееся тем, что указанный рак представляет собой колоректальный рак.
[091] 25. Соединение по любому из п.п. 19-21, отличающееся тем, что указанный рак представляет собой рак поджелудочной железы.
[092] 26. Соединение по любому из п.п. 19-21, отличающееся тем, что указанный рак представляет собой трижды негативный рак молочной железы.
[093] 27. Соединение по любому из п.п. 19-21, отличающееся тем, что указанный рак представляет собой плоскоклеточный рак головы и шеи.
[094] 28. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[095] 29. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR или низкомолекулярный ингибитор EGFR.
[096] 30. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR.
[097] 31. Соединение по п.30, отличающееся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[098] 32. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой низкомолекулярный ингибитор EGFR.
[099] 33. Соединение по п.32, отличающееся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[0100] 34. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой гефитиниб или его фармацевтически приемлемую соль.
[0101] 35. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой осимертиниб или его фармацевтически приемлемую соль.
[0102] 36. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[0103] 36a. Соединение по любому из п.п. 19-27, отличающееся тем, что указанный дополнительный противораковый агент представляет собой икотиниб или его фармацевтически приемлемую соль.
[0104] 37. Применение соединения, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемой соли для получения лекарственного средства, содержащего терапевтически эффективное количество соединения, для лечения рака у пациента в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента.
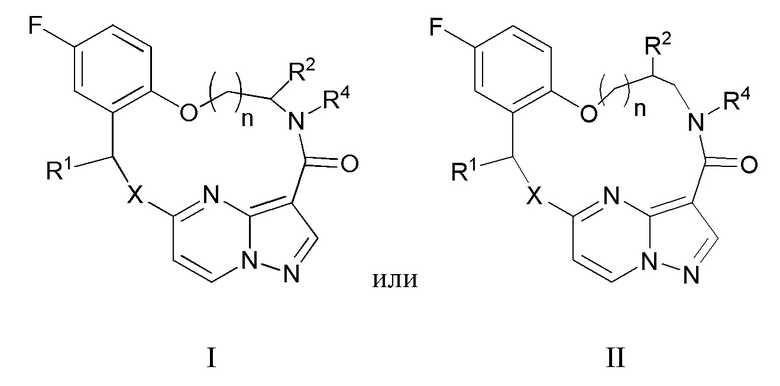
[0105] 38. Применение по п.37, отличающееся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
[0106] где
[0107] X представляет собой NR3 или CHR3;
[0108] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2, -S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[0109] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[0110] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[0111] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[0112] n равен 0 или 1;
[0113] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0114] 39. Применение по п.37, отличающееся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[0115] или его фармацевтически приемлемую соль.
[0116] 40. Применение по любому из п.п. 37-39, отличающееся тем, что указанный рак выбран из группы, состоящей из АККЛ, НМРЛ, нейробластомы, воспалительной миофибробластической опухоли, почечноклеточной карциномы взрослых, детской почечноклеточной карциномы, рака молочной железы, ER+ рака молочной железы, трижды негативного рака молочной железы, аденокарциномы толстой кишки, глиобластомы, мультиформной глиобластомы, анапластического рака щитовидной железы, холангиокарциномы, рака яичников, колоректального рака, воспалительной миофибробластической опухоли, ангиосаркомы, эпителиоидной гемангиоэндотелиомы, внутрипеченочной холангиокарциномы, рака щитовидной железы, шпицоидных новообразований, саркомы, астроцитомы, низкозлокачественной глиомы мозга, секреторной карциномы молочной железы, аналогичной карциномы молочной железы, острого миелоидного лейкоза, врожденной мезобластической нефромы, врожденных фибросарком, Ph-подобного острого лимфобластного лейкоза, карциномы щитовидной железы, плоскоклеточного рака головы и шеи, детской глиомы, ХМЛ, рака предстательной железы, плоскоклеточной карциномы легкого, серозной цистаденокарциномы яичников, кожной меланомы, рака предстательной железы, устойчивого к кастрации, лимфомы Ходжкина, серозного и светлоклеточного рака эндометрия, рака полости рта, рака эндометрия, эндокринного рака, рака кожи, рака желудка, рака пищевода, рака гортани, рака поджелудочной железы, рака толстой кишки, рака мочевого пузыря, рака кости, рака шейки матки, рака матки, рака яичек, рака прямой кишки, рака почки, рака печени и рака легкого.
[0117] 41. Применение по любому из п.п. 37-40, отличающееся тем, что указанный рак представляет собой немелкоклеточный рак легкого.
[0118] 42. Применение по любому из п.п. 37-40, отличающееся тем, что указанный рак представляет собой колоректальный рак.
[0119] 43. Применение по любому из п.п. 37-40, отличающееся тем, что указанный рак представляет собой рак поджелудочной железы.
[0120] 44. Применение по любому из п.п. 37-40, отличающееся тем, что указанный рак представляет собой трижды негативный рак молочной железы.
[0121] 45. Применение по любому из п.п. 37-40, отличающееся тем, что указанный рак представляет собой плоскоклеточный рак головы и шеи.
[0122] 46. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[0123] 47. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR или низкомолекулярный ингибитор EGFR.
[0124] 48. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR.
[0125] 49. Применение по п.48, отличающееся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[0126] 50. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой низкомолекулярный ингибитор EGFR.
[0127] 51. Применение по п.50, отличающееся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[0128] 52. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой гефитиниб или его фармацевтически приемлемую соль.
[0129] 53. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой осимертиниб или его фармацевтически приемлемую соль.
[0130] 54. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[0131] 54a. Применение по любому из п.п. 37-45, отличающееся тем, что указанный дополнительный противораковый агент представляет собой икотиниб или его фармацевтически приемлемую соль.
[0132] 55. Композиция, содержащая соединение, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемую соль в терапевтически эффективном количестве, для применения в лечении рака у пациента в комбинации с терапевтически эффективным количеством по меньшей мере одного дополнительного противоракового агента.
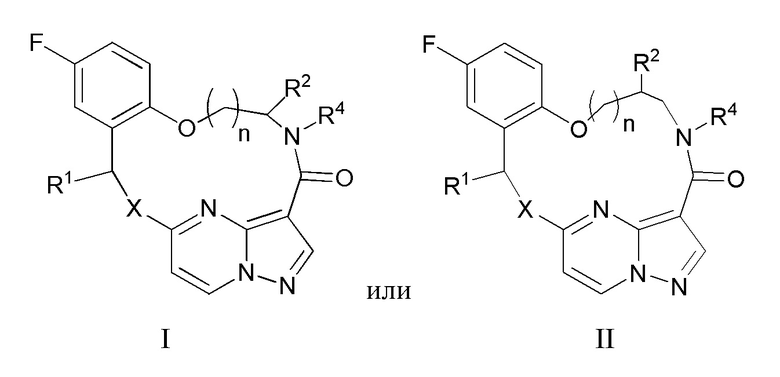
[0133] 56. Композиция по п.55, отличающаяся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
[0134] где
[0135] X представляет собой NR3 или CHR3;
[0136] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2, -S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[0137] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[0138] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[0139] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[0140] n равен 0 или 1;
[0141] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0142] 57. Композиция по п.55, отличающаяся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[0143] или его фармацевтически приемлемую соль.
[0144] 58. Композиция по любому из п.п. 55-57, отличающаяся тем, что указанный рак выбран из группы, состоящей из АККЛ, НМРЛ, нейробластомы, воспалительной миофибробластической опухоли, почечноклеточной карциномы взрослых, детской почечноклеточной карциномы, рака молочной железы, ER+ рака молочной железы, трижды негативного рака молочной железы, аденокарциномы толстой кишки, глиобластомы, мультиформной глиобластомы, анапластического рака щитовидной железы, холангиокарциномы, рака яичников, колоректального рака, воспалительной миофибробластической опухоли, ангиосаркомы, эпителиоидной гемангиоэндотелиомы, внутрипеченочной холангиокарциномы, рака щитовидной железы, шпицоидных новообразований, саркомы, астроцитомы, низкозлокачественной глиомы мозга, секреторной карциномы молочной железы, аналогичной карциномы молочной железы, острого миелоидного лейкоза, врожденной мезобластической нефромы, врожденных фибросарком, Ph-подобного острого лимфобластного лейкоза, карциномы щитовидной железы, плоскоклеточного рака головы и шеи, детской глиомы, ХМЛ, рака предстательной железы, плоскоклеточной карциномы легкого, серозной цистаденокарциномы яичников, кожной меланомы, рака предстательной железы, устойчивого к кастрации, лимфомы Ходжкина, серозного и светлоклеточного рака эндометрия, рака полости рта, рака эндометрия, эндокринного рака, рака кожи, рака желудка, рака пищевода, рака гортани, рака поджелудочной железы, рака толстой кишки, рака мочевого пузыря, рака кости, рака шейки матки, рака матки, рака яичек, рака прямой кишки, рака почки, рака печени и рака легкого.
[0145] 59. Композиция по любому из п.п. 55-58, отличающаяся тем, что указанный рак представляет собой немелкоклеточный рак легкого.
[0146] 60. Композиция по любому из п.п. 55-58, отличающаяся тем, что указанный рак представляет собой колоректальный рак.
[0147] 61. Композиция по любому из п.п. 55-58, отличающаяся тем, что указанный рак представляет собой рак поджелудочной железы.
[0148] 62. Композиция по любому из п.п. 55-58, отличающаяся тем, что указанный рак представляет собой трижды негативный рак поджелудочной железы.
[0149] 63. Композиция по любому из п.п. 55-58, отличающаяся тем, что указанный рак представляет собой плоскоклеточный рак головы и шеи.
[0150] 64. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой ингибитор EGFR или его фармацевтически приемлемую соль.
[0151] 65. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR или низкомолекулярный ингибитор EGFR.
[0152] 66. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой антитело к EGFR.
[0153] 67. Композиция по п.66, отличающаяся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[0154] 68. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой низкомолекулярный ингибитор EGFR.
[0155] 69. Композиция по п.68, отличающаяся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[0156] 70. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой гефитиниб или его фармацевтически приемлемую соль.
[0157] 71. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой осимертиниб или его фармацевтически приемлемую соль.
[0158] 72. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[0159] 72a. Композиция по любому из п.п. 55-63, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой икотиниб или его фармацевтически приемлемую соль.
[0160] 73. Лекарственное средство, содержащее соединение, которое ингибирует FAK, SRC и JAK2, или его фармацевтически приемлемую соль совместно с ингибитором EGFR или его фармацевтически приемлемой солью в фиксированной или свободной комбинации.
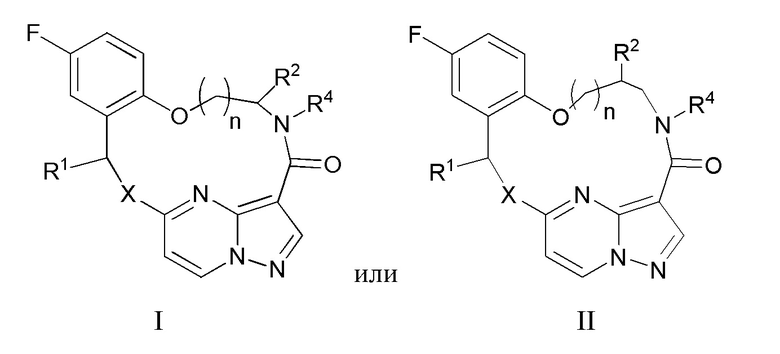
[0161] 74. Лекарственное средство по п.73, отличающееся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
[0162] где
[0163] X представляет собой NR3 или CHR3;
[0164] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2, -S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[0165] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[0166] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[0167] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[0168] n равен 0 или 1;
[0169] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0170] 75. Лекарственное средство по п.73, отличающееся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[0171] или его фармацевтически приемлемую соль.
[0172] 76. Лекарственное средство по любому из п.п. 73-75, отличающееся тем, что указанное лекарственное средство обеспечивает синергическое действие в отношении рака, выбранного из группы, состоящей из АККЛ, НМРЛ, нейробластомы, воспалительной миофибробластической опухоли, почечноклеточной карциномы взрослых, детской почечноклеточной карциномы, рака молочной железы, ER+ рака молочной железы, трижды негативного рака молочной железы, аденокарциномы толстой кишки, глиобластомы, мультиформной глиобластомы, анапластического рака щитовидной железы, холангиокарциномы, рака яичников, колоректального рака, воспалительной миофибробластической опухоли, ангиосаркомы, эпителиоидной гемангиоэндотелиомы, внутрипеченочной холангиокарциномы, рака щитовидной железы, шпицоидных новообразований, саркомы, астроцитомы, низкозлокачественной глиомы мозга, секреторной карциномы молочной железы, аналогичной карциномы молочной железы, острого миелоидного лейкоза, врожденной мезобластической нефромы, врожденных фибросарком, Ph-подобного острого лимфобластного лейкоза, карциномы щитовидной железы, плоскоклеточного рака головы и шеи, детской глиомы, ХМЛ, рака предстательной железы, плоскоклеточной карциномы легкого, серозной цистаденокарциномы яичников, кожной меланомы, рака предстательной железы, устойчивого к кастрации, лимфомы Ходжкина, серозного и светлоклеточного рака эндометрия, рака полости рта, рака эндометрия, эндокринного рака, рака кожи, рака желудка, рака пищевода, рака гортани, рака поджелудочной железы, рака толстой кишки, рака мочевого пузыря, рака кости, рака шейки матки, рака матки, рака яичек, рака прямой кишки, рака почки, рака печени и рака легкого.
[0173] 77. Лекарственное средство по любому из п.п. 73-76, отличающееся тем, что указанный рак представляет собой немелкоклеточный рак легкого.
[0174] 78. Лекарственное средство по любому из п.п. 73-76, отличающееся тем, что указанный рак представляет собой колоректальный рак.
[0175] 79. Лекарственное средство по любому из п.п. 73-76, отличающееся тем, что указанный рак представляет собой рак поджелудочной железы.
[0176] 80. Лекарственное средство по любому из п.п. 73-76, отличающееся тем, что указанный рак представляет собой трижды негативный рак молочной железы.
[0177] 81. Лекарственное средство по любому из п.п. 73-76, отличающееся тем, что указанный рак представляет собой плоскоклеточный рак головы и шеи.
[0178] 82. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный ингибитор EGFR представляет собой антитело или низкомолекулярный ингибитор.
[0179] 83. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный ингибитор EGFR представляет собой антитело.
[0180] 84. Лекарственное средство по п.83, отличающееся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[0181] 85. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный ингибитор EGFR представляет собой низкомолекулярный ингибитор.
[0182] 86. Лекарственное средство по п.85, отличающееся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[0183] 87. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный ингибитор EGFR представляет собой гефитиниб или его фармацевтически приемлемую соль.
[0184] 88. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный ингибитор EGFR представляет собой осимертиниб или его фармацевтически приемлемую соль.
[0185] 89. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный ингибитор EGFR представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[0186] 89a. Лекарственное средство по любому из п.п. 73-81, отличающееся тем, что указанный дополнительный противораковый агент представляет икотиниб или его фармацевтически приемлемую соль.
[0187] 90. Синергическая композиция соединения, которое ингибирует FAK, SRC и JAK2, и ингибитора EGFR, где два компонента вступают в контакт друг с другом в участке-мишени.
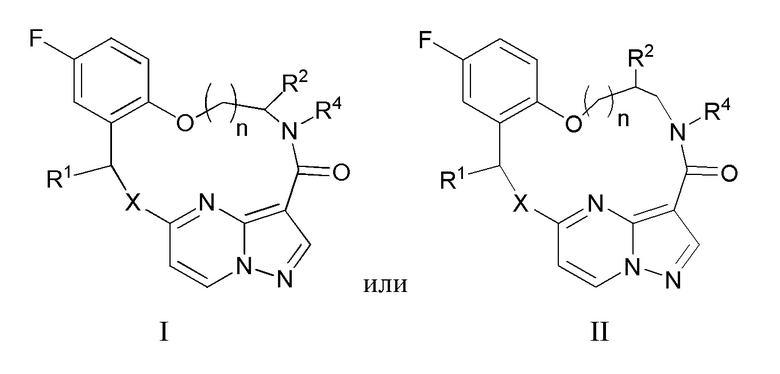
[0188] 91. Синергическая композиция по п.90, отличающаяся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
[0189] где
[0190] X представляет собой NR3 или CHR3;
[0191] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2,-S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[0192] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[0193] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[0194] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[0195] n равен 0 или 1;
[0196] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0197] 92. Синергическая композиция по п.90, отличающаяся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[0198] или его фармацевтически приемлемую соль.
[0199] 93. Синергическая композиция по любому из п.п. 90-92, отличающаяся тем, что указанный участок-мишень представляет собой рак или раковую клетку.
[0200] 94. Синергическая композиция по любому из п.п. 90-92, отличающаяся тем, что указанный участок-мишень представляет собой рак, выбранный из группы, состоящей из АККЛ, НМРЛ, нейробластомы, воспалительной миофибробластической опухоли, почечноклеточной карциномы взрослых, детской почечноклеточной карциномы, рака молочной железы, ER+ рака молочной железы, трижды негативного рака молочной железы, аденокарциномы толстой кишки, глиобластомы, мультиформной глиобластомы, анапластического рака щитовидной железы, холангиокарциномы, рака яичников, колоректального рака, воспалительной миофибробластической опухоли, ангиосаркомы, эпителиоидной гемангиоэндотелиомы, внутрипеченочной холангиокарциномы, рака щитовидной железы, шпицоидных новообразований, саркомы, астроцитомы, низкозлокачественной глиомы мозга, секреторной карциномы молочной железы, аналогичной карциномы молочной железы, острого миелоидного лейкоза, врожденной мезобластической нефромы, врожденных фибросарком, Ph-подобного острого лимфобластного лейкоза, карциномы щитовидной железы, плоскоклеточного рака головы и шеи, детской глиомы, ХМЛ, рака предстательной железы, плоскоклеточной карциномы легкого, серозной цистаденокарциномы яичников, кожной меланомы, рака предстательной железы, устойчивого к кастрации, лимфомы Ходжкина, серозного и светлоклеточного рака эндометрия, рака полости рта, рака эндометрия, эндокринного рака, рака кожи, рака желудка, рака пищевода, рака гортани, рака поджелудочной железы, рака толстой кишки, рака мочевого пузыря, рака кости, рака шейки матки, рака матки, рака яичек, рака прямой кишки, рака почки, рака печени и рака легкого.
[0201] 95. Синергическая композиция по любому из п.п. 90-93, отличающаяся тем, что указанный рак представляет собой немелкоклеточный рак легкого.
[0202] 96. Синергическая композиция по любому из п.п. 90-93, отличающаяся тем, что указанный рак представляет собой колоректальный рак.
[0203] 97. Синергическая композиция по любому из п.п. 90-93, отличающаяся тем, что указанный рак представляет собой рак поджелудочной железы.
[0204] 98. Синергическая композиция по любому из п.п. 90-93, отличающаяся тем, что указанный рак представляет собой трижды негативный рак молочной железы.
[0205] 99. Синергическая композиция по любому из п.п. 90-93, отличающаяся тем, что указанный рак представляет собой плоскоклеточный рак головы и шеи.
[0206] 100. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный ингибитор EGFR представляет собой антитело или низкомолекулярный ингибитор.
[0207] 101. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный ингибитор EGFR представляет собой антитело.
[0208] 102. Синергическая композиция по п.101, отличающаяся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[0209] 103. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный ингибитор EGFR представляет собой низкомолекулярный ингибитор.
[0210] 104. Синергическая композиция по п.103, отличающаяся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[0211] 105. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный ингибитор EGFR представляет собой гефитиниб или его фармацевтически приемлемую соль.
[0212] 106. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный ингибитор EGFR представляет собой осимертиниб или его фармацевтически приемлемую соль.
[0213] 107. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный ингибитор EGFR представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[0214] 107a. Синергическая композиция по любому из п.п. 90-99, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой икотиниб или его фармацевтически приемлемую соль.
[0215] 108. Синергическая композиция соединения, которое ингибирует FAK, SRC и JAK2, и ингибитора EGFR, где два компонента вступают в контакт друг с другом только в организме человека.
[0216] 109. Синергическая композиция по п.90, отличающаяся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
[0217] где
[0218] X представляет собой NR3 или CHR3;
[0219] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2, -S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[0220] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[0221] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[0222] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[0223] n равен 0 или 1;
[0224] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0225] 110. Синергическая композиция по п.108, отличающаяся тем, что указанное соединение, которое ингибирует FAK, SRC и JAK2, представляет собой соединение формулы
 ,
,  или
или 
[0226] или его фармацевтически приемлемую соль.
[0227] 111. Синергическая композиция по любому из п.п. 108-110, отличающаяся тем, что указанный ингибитор EGFR представляет собой антитело к EGFR или низкомолекулярный ингибитор EGFR.
[0228] 112. Синергическая композиция по п.111, отличающаяся тем, что указанный ингибитор EGFR представляет собой антитело.
[0229] 113. Синергическая композиция по п.112, отличающаяся тем, что указанное антитело представляет собой цетуксимаб, нецитумумаб или панитумумаб.
[0230] 114. Синергическая композиция по п.111, отличающаяся тем, что указанный ингибитор EGFR представляет собой низкомолекулярный ингибитор.
[0231] 115. Синергическая композиция по п.114, отличающаяся тем, что указанный низкомолекулярный ингибитор представляет собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли.
[0232] 116. Синергическая композиция по п.114, отличающаяся тем, что указанный ингибитор EGFR представляет собой гефитиниб или его фармацевтически приемлемую соль.
[0233] 117. Синергическая композиция по п.114, отличающаяся тем, что указанный ингибитор EGFR представляет собой осимертиниб или его фармацевтически приемлемую соль.
[0234] 118. Синергическая композиция по п.114, отличающаяся тем, что указанный ингибитор EGFR представляет собой эрлотиниб или его фармацевтически приемлемую соль.
[0235] 119. Синергическая композиция по п.114, отличающаяся тем, что указанный дополнительный противораковый агент представляет собой икотиниб или его фармацевтически приемлемую соль.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0236] На ФИГ. 1a показана жизнеспособность клеток PC9 в % при использовании различных доз ингибитора EGFR гефитиниба, соединения 1 и гефитиниба совместно с соединением 1.  гефитиниб;
гефитиниб;  соединение 1;
соединение 1;  гефитиниб+соединение 1.
гефитиниб+соединение 1.
[0237] На ФИГ. 1b приведен показатель аддитивности (CI) при использовании ингибитора EGFR гефитиниба и соединения 1 в клетках PC9. CI=0,685.
[0238] На ФИГ. 2a показана жизнеспособность клеток PC9 в % при использовании различных доз ингибитора EGFR осимертиниба, соединения 1 и осимертиниба совместно с соединением 1.  осимертиниб;
осимертиниб;  соединение 1;
соединение 1;  осимертиниб+соединение 1.
осимертиниб+соединение 1.
[0239] На ФИГ. 2b приведен показатель аддитивности (CI) при использовании ингибитора EGFR осимертиниба и соединения 1 в клетках PC9. CI=0,600.
[0240] На ФИГ. 3a показана жизнеспособность клеток H1975 в % при использовании различных доз ингибитора EGFR гефитиниба, соединения 1 и гефитиниба совместно с соединением 1.  гефитиниб;
гефитиниб;  соединение 1;
соединение 1;  гефитиниб+соединение 1.
гефитиниб+соединение 1.
[0241] На ФИГ. 3b приведен показатель аддитивности (CI) при использовании ингибитора EGFR гефитиниба и соединения 1 в клетках H1975. CI=0,845.
[0242] На ФИГ. 4a показана жизнеспособность клеток H1975 в % при использовании различных доз ингибитора EGFR осимертиниба, соединения 1 и осимертиниба совместно с соединением 1.  осимертиниб;
осимертиниб;  соединение 1;
соединение 1;  осимертиниб+соединение 1.
осимертиниб+соединение 1.
[0243] На ФИГ. 4b приведен показатель аддитивности (CI) при использовании ингибитора EGFR осимертиниба и соединения 1 в клетках H1975. CI=0,612.
[0244] На ФИГ. 5a показаны изображения образованных колоний клеток PC9 для контроля, ингибитора EGFR гефитиниба, соединения 1 и комбинации гефитиниба с соединением 1.
[0245] На ФИГ. 5b графически представлена площадь образованных колоний клеток PC9 в % для контроля, ингибитора EGFR гефитиниба, соединения 1 и комбинации гефитиниба с соединением 1. (A) контроль; (B) гефитиниб; (C) соединение 1; (D) гефитиниб+соединение 1.
[0246] На ФИГ. 6a показаны изображения образованных колоний клеток PC9 для контроля, ингибитора EGFR осимертиниба, соединения 1 и комбинации осимертиниба с соединением 1.
[0247] На ФИГ. 6b графически представлена площадь образованных колоний клеток PC9 в % для контроля, ингибитора EGFR осимертиниба, соединения 1 и комбинации осимертиниба с соединением 1. (A) контроль; (B) осимертиниб; (C) соединение 1; (D) осимертиниб+соединение 1.
[0248] На ФИГ. 7a показаны изображения образованных колоний клеток H1975 для контроля, ингибитора EGFR гефитиниба, соединения 1 и комбинации гефитиниба с соединением 1.
[0249] На ФИГ. 7b графически представлена площадь образованных колоний клеток H1975 в % для контроля, ингибитора EGFR гефитиниба, соединения 1 и комбинации гефитиниба с соединением 1. (A) контроль; (B) гефитиниб; (C) соединение 1; (D) гефитиниб+соединение 1.
[0250] На ФИГ. 8a показаны изображения образованных колоний клеток H1975 для контроля, ингибитора EGFR осимертиниба, соединения 1 и комбинации осимертиниба с соединением 1.
[0251] На ФИГ. 8b графически представлена площадь образованных колоний клеток H1975 в % для контроля, ингибитора EGFR осимертиниба, соединения 1 и комбинации осимертиниба с соединением 1. (A) контроль; (B) осимертиниб; (C) соединение 1; (D) осимертиниб+соединение 1.
[0252] На ФИГ. 9 показано антипролиферативное действие соединения 1, осимертиниба или комбинации соединения 1 с осимертинибом в клетках NCI-H1975.  соединение 1, IC50=4000 нМ;
соединение 1, IC50=4000 нМ;  осимертиниб, IC50 (частичная) = 13,4 нМ;
осимертиниб, IC50 (частичная) = 13,4 нМ;  соединение 1 (1 мкМ) + осимертиниб, IC50=100 нМ;
соединение 1 (1 мкМ) + осимертиниб, IC50=100 нМ;  соединение 1 (3 мкМ) + осимертиниб, IC50=3 нМ.
соединение 1 (3 мкМ) + осимертиниб, IC50=3 нМ.
[0253] На ФИГ. 10 показано антипролиферативное действие соединения 1, эрлотиниба или комбинации соединения 1 с эрлотинибом в клетках NCI-H1975.  соединение 1, IC50=4000 нМ;
соединение 1, IC50=4000 нМ;  эрлотиниб, IC50=6236 нМ;
эрлотиниб, IC50=6236 нМ;  соединение 1 (1 мкМ) + эрлотиниб, IC50=5000 нМ;
соединение 1 (1 мкМ) + эрлотиниб, IC50=5000 нМ;  соединение 1 (3 мкМ) + эрлотиниб, IC50=1000 нМ.
соединение 1 (3 мкМ) + эрлотиниб, IC50=1000 нМ.
[0254] На ФИГ. 11 показаны изображения геля, которые демонстрируют, что соединение 1 зависящим от дозы образом ингибировало фосфорилирование паксиллина.
[0255] На ФИГ. 12 показано ингибирование сигнальных путей STAT3, ERK и AKT соединением 1, осимертинибом (AZD9291), эрлотинибом, соединением 1+осимертиниб (AZD9291) и соединением 1+эрлотиниб в 1 мкМ концентрации.
ПОДРОБНОЕ ОПИСАНИЕ
[001] Перед дальнейшим описанием настоящего изобретения следует понимать, что данное изобретение не ограничено конкретными описанными вариантами реализации, так как они, безусловно, могут варьироваться. Также следует понимать, что терминология, используемая в настоящем документе, предназначена исключительно для описания конкретных вариантов реализации и не является ограничивающей, таким образом, объем настоящего изобретения ограничен только прилагаемой формулой изобретения.
[002] Если отсутствуют иные определения, то все технические и научные термины, используемые в настоящем документе, имеют значения, общепринятые специалистами в области техники, к которой принадлежит изобретение. Содержание всех патентов, опубликованных заявок и других публикаций, на которые ссылаются в настоящем документе, включено в настоящую заявку во всей полноте посредством ссылок. Если определение, приведенное в данном разделе, противоречит или иным образом не согласуется с определением, приведенным в патенте, заявке или другой публикации, включенной в настоящий документ посредством ссылки, то определение, приведенное в данном разделе, является предпочтительным по сравнению с определением, включенным в настоящий документ посредством ссылки.
[003] В настоящем документе и прилагаемой формуле изобретения формы единственного числа включают множественное число, если по контексту явным образом не следует иное. Кроме того, следует отметить, что формула изобретения может быть составлена таким образом, чтобы исключать какие-либо необязательные элементы. Таким образом, данное утверждение служит в качестве предпосылки для использования таких исключающих терминов, как «исключительно», «только» и т.д., при цитировании заявленных элементов или для использования «отрицательного» ограничения.
[004] В настоящем документе термины «включающий», «состоящий» и «содержащий» используют в открытом, неограничивающем значении.
[005] Для более краткого описания некоторые количественные выражения, приведенные в настоящем документе, описаны без использования термина «примерно». Следует понимать, что независимо от того, используется термин «примерно» в явной форме или нет, каждая величина, приведенная в настоящем документе, относится к фактически указанному значению, а также приблизительному значению данной величины, которое может быть обоснованно предложено специалистом в данной области техники, включая эквиваленты и приближения, связанные с условиями эксперимента и/или измерения данной величины. Если выход указан в процентах, то указанный выход относится к массе вещества, для которого указан выход, отнесенной к максимальному количеству этого вещества, которое может быть получено в конкретных стехиометрических условиях. Концентрации, которые указаны в процентах, относятся к массовым отношениям, если не указано иное.
[006] Если отсутствуют иные определения, то все технические и научные термины, используемые в настоящем документе, имеют значения, общепринятые специалистами в области техники, к которой принадлежит изобретение. Несмотря на то, что для реализации или исследования настоящего изобретения можно применять любые способы и материалы, схожие или эквивалентные тем, что описаны в настоящем документе, предпочтительные способы и материалы описаны далее. Содержание всех публикаций, указанных в настоящем документе, включено посредством ссылки для раскрытия и описания способов и/или материалов, в отношении которых цитируются публикации.
[007] Если специально не отмечено иное, способы и техники согласно предложенным вариантам реализации, в общем случае, проводили согласно традиционным методикам, хорошо известным в данной области техники и описанным в различных общих и более узких справочных материалах, которые цитируются и обсуждаются в настоящем описании. См., например, Loudon, Organic Chemistry, четвертое издание, New York: Oxford University Press, 2002, стр. 360-361, 1084-1085; Smith and March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, пятое издание, Wiley-Interscience, 2001.
[008] Химические названия соединений, описанных в настоящем документе, в общем случае, получали с использованием коммерчески доступных программ ACD/Name 2014 (ACD/Labs) или ChemBioDraw Ultra 13.0 (Perkin Elmer).
[009] Следует понимать, что определенные отличительные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов реализации, также могут быть предложены в виде комбинации в одном варианте реализации. И наоборот, различные отличительные признаки изобретения, которые для краткости описаны в контексте одного варианта реализации, также могут быть предложены по отдельности или в виде любой подходящей подкомбинации. Все комбинации вариантов реализации, относящихся к химическим группам, представленным переменными, конкретным образом включены в настоящее изобретение и описаны в настоящем документе так же, как и в случае, если бы любая и каждая комбинация была описана отдельно в явной форме, при условии, что указанные комбинации описывают соединения, которые являются стабильными (т.е. соединения, которые можно выделять, описывать и изучать на предмет биологической активности). Кроме того, все подкомбинации химических групп, перечисленных в вариантах реализации, описывающих указанные переменные, также конкретным образом включены в настоящее изобретение и описаны так же, как и в случае, если бы любая и каждая указанная подкомбинация химических групп была отдельно в явной форме описана в настоящем документе.
[010] В настоящем документе термин «терапевтически эффективное количество» относится к такому количеству активного соединения или фармацевтического агента, которое обеспечивает биологический или медицинский ответ у пациента, включая облегчение симптомов заболевания или нарушения, подвергающегося лечению. Согласно одному из аспектов терапевтически эффективное количество представляет собой количество, которое может излечивать или облегчать заболевание или симптомы. Конкретная терапевтически эффективная доза для любого конкретного пациента зависит от ряда факторов, включая нарушение, подвергающееся лечению, и тяжесть нарушения; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и рацион пациента; время введения, способ введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, используемые в комбинации или одновременно с конкретным применяемым соединением; и т.д. Типовая доза находится в диапазоне от примерно 0,1 мг до 1 г в день или от примерно 1 мг до 50 мг в день или от примерно 50 до 250 мг в день или от примерно 250 мг до 1 г в день. Общую дневную дозировку можно вводить в виде одной или нескольких раздельных стандартных дозировок (например, BID, TID, QID).
[0256] В настоящем документе термин «заболевание» включает, но не ограничивается ими, рак, боль, псориаз, ревматоидный артрит, истинную полицитемию, эссенциальную тромбоцитопению, язвенный колит и миелоидную метаплазию с миелофиброзом.
[0257] В настоящем документе термин «рак» включает, но не ограничивается ими, АККЛ, рак легкого, такой как немелкоклеточный рак легкого (НМРЛ), включая аденокарциному, плоскоклеточную карциному легкого, крупноклеточную карциному и крупноклеточные нейроэндокринные опухоли, мелкоклеточный рак легкого (МРЛ), нейробластому, воспалительную миофибробластическую опухоль, почечноклеточную карциному взрослых, детскую почечноклеточную карциному, рак молочной железы, такой как трижды негативный рак молочной железы, трижды позитивный рак молочной железы, ER+ рак молочной железы и рак молочной железы с повышенной экспрессией HER2, аденокарциному толстой кишки, глиобластому, мультиформную глиобластому, рак щитовидной железы, такой как анапластический рак щитовидной железы, холангиокарциному, рак яичников, рак желудка, такой как аденокарцинома желудка, колоректальный рак (КРР), воспалительную миофибробластическую опухоль, ангиосаркому, эпителиоидную гемангиоэндотелиому, внутрипеченочную холангиокарциному, папиллярный рак щитовидной железы, шпицоидные новообразования, саркому, астроцитому, низкозлокачественную глиому мозга, секреторную карциному молочной железы, аналогичную карциному молочной железы, острый миелоидный лейкоз, врожденную мезобластическую нефрому, врожденные фибросаркомы, Ph-подобный острый лимфобластный лейкоз, карциному щитовидной железы, рак кожи, такой как кожная меланома, плоскоклеточный рак головы и шеи (ПРГШ), детскую глиому, ХМЛ, рак предстательной железы, серозную цистаденокарциному яичников, кожную меланому, рак предстательной железы, устойчивый к кастрации, лимфому Ходжкина и серозный и светлоклеточный рак эндометрия. Следует понимать, что термин «рак» включает первичные раковые заболевания или первичные опухоли и метастатические раковые заболевания или метастатические опухоли, например, метастатический НМРЛ, метастатический КРР, метастатический рак поджелудочной железы, метастатический рак молочной железы с повышенной экспрессией HER2, метастатическую колоректальную карциному с экспрессией EGFR, метастатический ПРГШ и т.д. Следует понимать, что термин «рак» включает раковые заболевания, при которых происходит повышающая регуляция определенных генов или генетических мутаций в определенных генах, которые могут приводить к прогрессированию заболевания, такая как повышающая регуляция рецепторов эпидермального фактора роста.
[0258] В настоящем документе термин «ингибитор EGFR» включает, но не ограничивается ими, любые соединения или агенты, известные в данной области техники, которые ингибируют рецептор эпидермального фактора роста (EGFR, также известный как ErbB-1 или HER-1). Следует понимать, что ингибитор EGFR включает агенты направленного действия, которые обладают специфичностью в отношении EGFR или направленно действуют на другие формы рака, при которых происходит экспрессия EGFR. Следует понимать, что соединение или агент, которое(-ый) ингибирует EGFR, может представлять собой биологическую молекулу, такую как антитело (например, моноклональное антитело или mAb), низкомолекулярное лекарственное средство/ингибитор или агент направленного действия. Примеры подходящих ингибиторов EGFR включают, но не ограничиваются ими, афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб, WZ 3146, WZ 4002, WZ 8040 и их фармацевтически приемлемые соли. См., например, патент США №6002008, патент США №7019012, патент США №6251912, WO 02/50043, WO 2004/074263, WO 2005/037824, WO 2008150118 (в частности, соединение согласно примеру 36, 1-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)-пиперидин-1-ил)проп-2-ен-1-он или его соли, полученные с кислотными добавками, такие как описано в WO 2011155793).
Химические определения
[0259] В настоящем документе термин «алкил» включает цепь атомов углерода, которая необязательно является разветвленной и содержит от 1 до 20 атомов углерода. Кроме того, следует понимать, что в определенных вариантах реализации алкил предпочтительно может иметь ограниченную длину, включая C1-C12, C1-C10, C1-C9, C1-C8, C1-C7, C1-C6 и C1C4. Для иллюстрации, указанные конкретные алкильные группы с ограниченной длиной, включая C1-C8, C1-C7, C1-C6 и C1-C4 и т.д., можно называть «низшими алкилами». Иллюстративные алкильные группы включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, 2-пентил, 3-пентил, неопентил, гексил, гептил, октил и т.д. Алкил может быть замещенным или незамещенным. Типовые группы-заместители включают циклоалкил, арил, гетероарил, гетероалициклические группы, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галоген, карбонил, оксо (=O), тиокарбонил, O-карбамил, N-карбамил, O-тиокарбамил, N-тиокарбамил, C-амидо, N-амидо, C-карбокси, O-карбокси, нитро или амино или группы, такие как описано в различных вариантах реализации, предложенных в настоящем документе. Следует понимать, что «алкил» может быть объединен с другими группами, такими как те, что предложено выше, с образованием функционализированного алкила. Например, комбинацию «алкильной группы», такой как описано в настоящем документе, с «карбокси»-группой можно называть «карбоксиалкильной» группой. Другие неограничивающие примеры включают гидроксиалкил, аминоалкил и т.д.
[0260] В настоящем документе термин «алкенил» включает цепь атомов углерода, которая необязательно является разветвленной и содержит от 2 до 20 атомов углерода, а также включает по меньшей мере одну углерод-углеродную двойную связь (т.е. C=C). Следует понимать, что в определенных вариантах реализации алкенил предпочтительно может иметь ограниченную длину, включая C2-C12, C2-C9, C2-C8, C2-C7, C2-C6 и C2-C4. Для иллюстрации, указанные конкретные алкенильные группы с ограниченной длиной, включая C2-C8, C2-C7, C2-C6 и C2-C4, можно называть низшими алкенилами. Алкенил может быть незамещенным или замещенным, как описано для алкила или описано в различных вариантах реализации, предложенных в настоящем документе. Иллюстративные алкенильные группы включают, но не ограничиваются ими, этенил, 1-пропенил, 2-пропенил, 1-, 2- или 3-бутенил и т.д.
[0261] В настоящем документе термин «алкинил» включает цепь атомов углерода, которая необязательно является разветвленной и содержит от 2 до 20 атомов углерода, а также включает по меньшей мере одну углерод-углеродную тройную связь (т.е. C≡C). Следует понимать, что в определенных вариантах реализации каждый алкинил предпочтительно может иметь ограниченную длину, включая C2-C12, C2-C9, C2-C8, C2-C7, C2-C6 и C2-C4. Для иллюстрации, указанные конкретные алкинильные группы с ограниченной длиной, включая C2-C8, C2-C7, C2-C6 и C2-C4, можно называть низшими алкинилами. Алкинил может быть незамещенным или замещенным, как описано для алкила или описано в различных вариантах реализации, предложенных в настоящем документе. Иллюстративные алкинильные группы включают, но не ограничиваются ими, этинил, 1-пропинил, 2-пропинил, 1-, 2- или 3-бутинил и т.д.
[0262] В настоящем документе термин «арил» относится к содержащим только атомы углерода моноциклическим или конденсированным полициклическим группам, содержащим от 6 до 12 атомов углерода, имеющим полностью сопряженные системы пи-электронов. Следует понимать, что в определенных вариантах реализации арил предпочтительно может иметь ограниченный размер, такой как C6-C10 арил. Иллюстративные арильные группы включают, но не ограничиваются ими, фенил, нафталинил и антраценил. Арильная группа может быть незамещенной или замещенной, как описано для алкила или описано в различных вариантах реализации, предложенных в настоящем документе.
[0263] В настоящем документе термин «циклоалкил» относится к 3-15-членной состоящей только из атомов углерода моноциклической кольцевой, включая состоящее только из атомов углерода 5-членное/6-членное или 6-членное/6-членное конденсированное бициклическое кольцо, или полициклической конденсированной кольцевой («конденсированная» система колец означает, что каждое кольцо в системе имеет общую пару расположенных по соседству атомов углерода с другим кольцом в системе) группе, где одно или более колец могут содержать одну или более двойных связей, но циклоалкил не включает полностью сопряженную систему пи-электронов. Следует понимать, что в определенных вариантах реализации циклоалкил предпочтительно может иметь ограниченный размер, такой как C3-C13, C3-C9, C3-C6 и C4-C6. Циклоалкил может быть незамещенным или замещенным, как описано для алкила или описано в различных вариантах реализации, предложенных в настоящем документе. Иллюстративные циклоалкильные группы включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, адамантил, норборнил, норборненил, 9H-флуорен-9-ил и т.д. Иллюстративные примеры циклоалкильных групп в графическом представлении включают следующие структуры в виде соответствующих связанных фрагментов:
[0264] В настоящем документе термин «гетероциклоалкил» относится к моноциклической или конденсированной кольцевой группе, содержащей в кольце(-ах) от 3 до 12 атомов, среди которых по меньшей мере один атом представляет собой гетероатом, такой как азот, кислород или сера, а оставшиеся атомы представляют собой атомы углерода. Гетероциклоалкил необязательно может содержать 1, 2, 3 или 4 гетероатома. Гетероциклоалкил также может содержать одну или более двойных связей, включая двойные связи с атомом азота (например, C=N или N=N), но не содержит полностью сопряженную систему пи-электронов. Следует понимать, что в определенных вариантах реализации гетероциклоалкил предпочтительно может иметь ограниченный размер, такой как 3-7-членный гетероциклоалкил, 5-7-членный гетероциклоалкил и т.д. Гетероциклоалкил может быть незамещенным или замещенным, как описано для алкила или описано в различных вариантах реализации, предложенных в настоящем документе. Иллюстративные гетероциклоалкильные группы включают, но не ограничиваются ими, оксиранил, тианарил, азетидинил, оксетанил, тетрагидрофуранил, пирролидинил, тетрагидропиранил, пиперидинил, 1,4-диоксанил, морфолинил, 1,4-дитианил, пиперазинил, оксепанил, 3,4-дигидро-2H-пиранил, 5,6-дигидро-2H-пиранил, 2H-пиранил, 1,2,3,4-тетрагидропиридинил и т.д. Иллюстративные примеры гетероциклоалкильных групп в графическом представлении включают следующие структуры в виде соответствующих связанных фрагментов:
[0265] В настоящем документе термин «гетероарил» относится к моноциклической или конденсированной кольцевой группе, содержащей от 5 до 12 атомов в кольце, включая один, два, три или четыре гетероатома в кольце, выбранных из азота, кислорода и серы, где оставшиеся атомы в кольце представляют собой атомы углерода, а также содержащей полностью сопряженную систему пи-электронов. Следует понимать, что в определенных вариантах реализации гетероарил предпочтительно может иметь ограниченный размер, такой как 3-7-членный гетероарил, 5-7-членный гетероарил и т.д. Гетероарил может быть незамещенным или замещенным, как описано для алкила или описано в различных вариантах реализации, предложенных в настоящем документе. Иллюстративные гетероарильные группы включают, но не ограничиваются ими, пирролил, фуранил, тиофенил, имидазолил, оксазолил, тиазолил, пиразолил, пиридинил, пиримидинил, хинолинил, изохинолинил, пуринил, тетразолил, триазинил, пиразинил, тетразинил, хиназолинил, хиноксалинил, тиенил, изоксазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, бензимидазолил, бензоксазолил, бензтиазолил, бензизоксазолил, бензизотиазолил и карбазолил и т.д. Иллюстративные примеры гетероарильных групп в графическом представлении включают следующие структуры в виде соответствующих связанных фрагментов:
[0266] В настоящем документе «гидрокси» или «гидроксил» относится к группе -OH.
[0267] В настоящем документе «алкокси» относится к -O-(алкильной) или -O-(незамещенной циклоалкильной) группе. Типовые примеры включают, но не ограничиваются ими, метокси, этокси, пропокси, бутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.д.
[0268] В настоящем документе «арилокси» относится к -O-арильной или -O-гетероарильной группе. Типовые примеры включают, но не ограничиваются ими, фенокси, пиридинилокси, фуранилокси, тиенилокси, пиримидинилокси, пиразинилокси и т.д.
[0269] В настоящем документе «меркапто» относится к группе -SH.
[0270] В настоящем документе «алкилтио» относится к -S-(алкильной) или -S-(незамещенной циклоалкильной) группе. Типовые примеры включают, но не ограничиваются ими, метилтио, этилтио, пропилтио, бутилтио, циклопропилтио, циклобутилтио, циклопентилтио, циклогексилтио и т.д.
[0271] В настоящем документе «арилтио» относится к -S-арильной или -S-гетероарильной группе. Типовые примеры включают, но не ограничиваются ими, фенилтио, пиридинилтио, фуранилтио, тиенилтио, пиримидинилтио и т.д.
[0272] В настоящем документе «галоген-» или «галоген» относится к фтору, хлору, брому или йоду.
[0273] В настоящем документе «циано» относится к группе -CN.
[0274] Термин «оксо» представляет собой атом кислорода в карбониле. Например, циклопентил, замещенный оксо, представляет собой циклопентанон.
[0275] В настоящем документе «связь» относится к ковалентной связи.
[0276] Термин «замещенный» означает, что указанная группа или фрагмент содержит один или более заместителей. Термин «незамещенный» означает, что указанная группа не содержит заместители. Если термин «замещенный» используют для описания структурной системы, это означает, что замещение может происходить по любому доступному с точки зрения валентности положению в системе. В некоторых вариантах реализации «замещенный» означает, что указанная группа или фрагмент содержит один, два или три заместителя. В других вариантах реализации «замещенный» означает, что указанная группа или фрагмент содержит один или два заместителя. В других вариантах реализации «замещенный» означает, что указанная группа или фрагмент содержит один заместитель.
[0277] В настоящем документе «необязательный» или «необязательно» означает, что описываемое далее событие или условие может, но не обязано, происходить или выполняться, и описание включает случаи, где событие или условие происходит (выполняется), и случаи, в которых оно не происходит (не выполняется). Например, «где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на C1-C6 алкил» означает, что алкил может, но не обязан, содержаться при любом из C1C6 алкила, C2-C6 алкенила, C2-C6 алкинила, C3-C6 циклоалкила, 3-7-членного гетероциклоалкила, C6-C10 арила или моно- или бициклического гетероарила в результате замены атома водорода на алкильную группу, и описание включает ситуации, где C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил замещен алкильной группой, и ситуации, где C1-C6 алкил, C2-C6 алкенил, C2C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил не замещен алкильной группой.
[0278] В настоящем документе «независимо» означает, что описываемое далее событие или условие следует рассматривать отдельно от других схожих событий или условий. Например, в случае, где несколько эквивалентных водородных групп необязательно замещены на другую группу, описанную в условии, использование «независимо необязательно» означает, что в каждом случае атом водорода в группе может быть замещен на другую группу, где группы, которые заменяют каждый из атомов водорода, могут быть одинаковыми или различными. Или, например, если существует несколько групп, все из которых могут быть выбраны из набора возможных вариантов, то использование «независимо» означает, что каждая из групп может быть выбрана из набора возможных вариантов отдельно от любой другой группы, и группы, выбранные в соответствии с данным условием, могут быть одинаковыми или различными.
[0279] В настоящем документе термин «фармацевтически приемлемая соль» относится к солям, противоионы которых можно применять в фармацевтических средствах. Общее описание см. в S.M. Berge, et al., “Pharmaceutical Salts,” J. Pharm. Sci., 1977, 66, 1-19. Предпочтительными фармацевтически приемлемыми солями являются те, которые являются фармакологически эффективными и подходят для использования в контакте с тканями субъектов, не вызывая избыточную токсичность, раздражение или аллергический ответ. Соединение, описанное в настоящем документе, может содержать достаточно кислую группу, достаточно основную группу, оба типа функциональных групп или более чем одну группу каждого типа и, соответственно, может взаимодействовать с рядом неорганических или органических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Указанные соли включают:
[0280] (1) соли присоединения кислоты, которые могут быть получены в результате взаимодействия исходного соединения в форме свободного основания с неорганическими кислотами, такими как хлороводородная кислота, бромоводородная кислота, азотная кислота, фосфорная кислота, серная кислота и перхлорная кислота и т.д., или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, (D)- или (L)-яблочная кислота, малеиновая кислота, метансульфокислота, этансульфокислота, п-толуолсульфокислота, салициловая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота и т.д.; или
[0281] (2) соли, полученные при замещении кислотного протона, присутствующего в исходном соединении на ион металла, например, ион щелочного металла, ион щелочно-земельного металла или ион алюминия; или при координации с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, триметамин, N-метилглюкамин и т.д.
[0282] Фармацевтически приемлемые соли хорошо известны специалистам в данной области техники, и любая из указанных фармацевтически приемлемых солей может рассматриваться в рамках вариантов реализации, описанных в настоящем документе. Примеры фармацевтически приемлемых солей включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, метилсульфонаты, пропилсульфонаты, безилаты, ксилолсульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, γ-гидроксибутираты, гликоляты, тартраты и манделаты. Списки других подходящих фармацевтически приемлемых солей можно найти в Remington's Pharmaceutical Sciences, 17е издание, Mack Publishing Company, Easton, Pa., 1985.
[0283] Предполагается, что на любых формулах, изображенных в настоящем документе, представлено соединение данной структурной формулы, а также его различные варианты или формы. Например, предполагается, что формулы, приведенные в настоящем документе, включают рацемические формы или один или более энантиомеров, диастереомеров или геометрических изомеров или их смесь. Кроме того, предполагается, что любые формулы, приведенные в настоящем документе, также относятся к гидратам, сольватам или полиморфам указанного соединения или их смесям. Например, следует понимать, что соединения, изображенные на структурной формуле, содержащей символ « », включают оба стереоизомера атома углерода, при котором расположен символ «
», включают оба стереоизомера атома углерода, при котором расположен символ « », в частности, обе связи «
», в частности, обе связи « » и «
» и « » включены в определение «
» включены в определение « ». Например, в некоторых типовых вариантах реализации определенные соединения, предложенные в настоящем документе, могут быть описаны формулой
». Например, в некоторых типовых вариантах реализации определенные соединения, предложенные в настоящем документе, могут быть описаны формулой
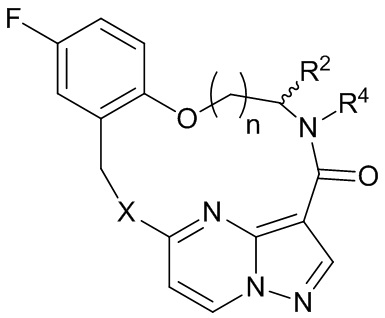 ,
,
[0284] и следует понимать, что данная формула описывает соединения, имеющие обе стереохимические конфигурации соответствующего атома углерода, конкретно для этого примера
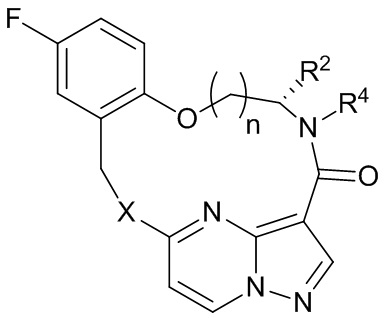 и
и 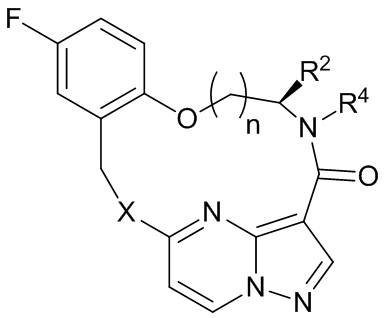 .
.
Варианты реализации
[0285] В некоторых вариантах реализации способы, описанные в настоящем документе, относятся к способу лечения рака, включающему введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества соединения, которое ингибирует FAK, SRC и JAK2, в комбинации с ингибитором EGFR. Следует понимать, что ингибитор представляет собой любое вещество, которое понижает или подавляет активность другого вещества, такого как рецептор клеточной поверхности (т.е. рецепторная тирозинкиназа) или киназа (т.е. нерецепторная тирозинкиназа). Определение «ингибитора» хорошо известно специалистам в данной области техники, и следует понимать, что в настоящем документе общий термин «ингибитор» используют в привычном и общепринятом значении. Следует понимать, что «соединение, которое ингибирует FAK, SRC и JAK2» представляет собой соединение, которое обладает аффинностью в отношении всех трех биологических мишеней FAK, SRC и JAK2.
[0286] Семейство янус-киназ (JAK), которое включает JAK1, JAK2, JAK3 и TYK2, представляет собой цитоплазматические нерецепторные тирозинкиназы, требуемые для физиологической передачи сигналов цитокинов и факторов роста (Quintas-Cardama A, et al., Nat. Rev. Drug Discov. 2011, 10(2), 127). Нарушение регуляции путей JAK/STAT происходит при различных патологических заболеваниях человека, включая рак (JAK2) и ревматоидный артрит (JAK1, JAK3). Мутацию приобретения функции JAK2 (JAK2V617F) часто обнаруживают у пациентов с МПН (Levine RL, et al. Cancer Cell 2005, 7, 387). Мутация псевдокиназного домена JH2 в JAK2 приводит к конститутивной киназной активности. Клетки, содержащие мутацию JAK2V617F, приобретают способность цитокин-независимого роста и часто становятся опухолевыми, что является достаточно веским основанием для разработки ингибиторов JAK для направленной терапии. Кроме того, гиперактивация пути JAK2/сигнальных трансдукторов и активаторов транскрипции 3 (JAK2/STAT3) отвечает за аномальную дифференцировку дендритных клеток и накопление иммуносупрессорных миелоидных клеток при раке (Nefedova Y, et al. Cancer Res 2005, 65, 9525). При сенесцентных опухолях с нулевым статусом Pten активация пути JAK2/STAT3 создает иммуносупрессорную микросреду в опухоли, которая способствует росту опухоли и появлению устойчивости к химическому воздействию (Toso A, et al. Cell Reports 2014, 9, 75). Гибриды гена JAK2 с генами TEL(ETV6) (TEL-JAK2) и PCM1 были найдены у пациентов с лейкозом (Lacronique V, et al. Science 1997, 278, 5341, 1309-12. Reiter A, et al. Cancer Res. 2005, 65, 7, 2662-7). Сообщалось, что уровень сигнального пути JAK/STAT3 в результате нарушения увеличивается в клетках устойчивого к ингибиторам EGFR немелкоклеточного рака легкого (НМРЛ) с мутантным EGFR, и ингибирование JAK2 позволяет преодолевать приобретенную устойчивость к ингибиторам EGFR, что является основанием для проведения комбинационной терапии с использованием ингибиторов JAK и EGFR для лечения EGFR-зависимого НМРЛ (Gao SP, et al. Sci Signal. 2016, 9 (421):ra33). Сигнальная система JAK/STAT3 усиливает характерные раковые процессы в опухоли и ее среде, включая пролиферацию, выживание, ангиогенез, метаболизм опухоли, и при этом подавляет противоопухолевый иммунитет (Buchert M, et al. Oncogene, 2016, 35, 939-951). Ингибирование цитокин-зависимой активации пути JAK/STAT3 ингибиторами JAK также может обеспечивать возможность независимого лечения других зависимых от онкогенов раковых клеток, которые приобрели лекарственную устойчивость. Фокальную амплификацию гена JAK2 наблюдали после химиотерапии трижды негативного рака молочной железы (ТНРМЖ) в группе опухолей с амплификацией 9p24, это позволяет предположить его роль в онкогенности и устойчивости к химическому воздействию (Balko JM, et al. Sci Transl Med. 2016, 8(334):ra53).
[0287] c-Src представляет собой нерецепторную тирозинкиназу. У человека семейство Src (SFK) включает восемь членов (Src, Fyn, Yes, Lyn, Lck, Hck, Blk и Fgr), имеющих молекулярную массу 52-62 кДа. Дерегуляция Src и членов его семейства происходит при многих типах рака. Src является ключевым нижележащим трансдуктором множества RTK, включая EGFR, HER2 и c-Met. Активация передачи сигнала Src задействована при приобретении устойчивости к направленной антиэндокринной терапии, терапии рецепторных тирозинкиназ, традиционной химиотерапии и лучевой терапии (Zhang S, et al Trends Pharmacol Sci. 2012, 33, 122). SRC может усиливать передачу сигнала от рецепторов факторов роста множеством механизмов, включая участие в сигнальных путях, требуемых для синтеза ДНК, контролирование обновления рецепторов, реорганизацию актинового цитоскелета, миграцию, адгезию, инвазию, подвижность и выживаемость (Bromann PA, Oncogene 2004, 23, 7957-7968). Значительная роль Src в событиях, связанных с прогрессированием опухоли, таких как эпителиально-мезенхимальный переход (EMT) и развитие метастазов, были описаны при взаимодействии с высокоактивным геном-супрессором, N-myc-регулируемым геном 1 (NDRG1), который регулирует миграцию раковых клеток за счет ингибирования активности Src (Liu W, et al. Oncotarget. 2015, 6: 35522-35541). Несмотря на то, что при использовании ингибиторов EGFR удалось добиться значительных успешных результатов у большинства пациентов с НМРЛ, имеющих мутации, активирующие EGFR, часть пациентов с мутациями EGFR не восприимчива к EGFR-TKI. Считается, что устойчивость к ингибиторам EGFR включает активацию SRC и запуск эпителиально-мезенхимального перехода (EMT). Первичная устойчивость к EGFR-TKI связана с повышенным уровнем экспрессии CRIPTO1. CRIPTO1 активирует SRC и ZEB1 для ускорения EMT посредством понижающей регуляции микроРНК-205 (miR-205). Недавно сообщалось, что саракатиниб, селективный ингибитор SRC, может восстанавливать чувствительность клеточных линий, устойчивых к ингибиторам ALK, это демонстрирует терапевтическое значение ингибирования SRC для преодоления устойчивости к ингибиторам ALK (Crystal AS, et al. Science 2014, 346, 1480-1486).
[0288] Киназа фокальных контактов (FAK) представляет собой нерецепторную тирозинкиназу массой 125 кДа и играет значительную роль в адгезии, выживании, подвижности, метастазах, ангиогенезе, лимфангиогенезе, функции стволовых раковых клеток, микросреде опухоли и эпителиально-мезенхимальном переходе (EMT) (Golubovskaya VM, Front Biosci (Landmark ред.).; 19: 687-706). Ядерная FAK контролирует транскрипцию хемокинов, Treg и уклонение от противоопухолевого иммунитета, и низкомолекулярный ингибитор FAK киназы VS-4718 вызывает истощение Treg и усиливает опосредованный CD8+ T-клетками противоопухолевый ответ (Serrels A, et al, Cells 2015, 163, 160-173). Таким образом, ингибиторы FAK могут запускать опосредованное иммунной системой обращение опухоли вспять. Гиперактивация FAK происходит при протоковой аденокарциноме поджелудочной железы (PDAC), что коррелирует с созданием иммуносупрессорной опухолевой микросреды (TME). Направленное воздействие на киназу фокальных контактов делает рак поджелудочной железы восприимчивым к иммунотерапии контрольных точек за счет ослабления фиброзной и иммуносупрессорной TME при PDAC в мышиных моделях (Jiang H, et al. Nat Med. 2016, Jul 4 [предварительная электронная публикация]).
[0289] Было обнаружено, что соединения, описанные в настоящем документе, неожиданно являются ингибиторами всех трех FAK, SRC и JAK2, и их можно применять в комбинации с ингибитором EGFR для лечения рака у пациента, нуждающегося в указанном лечении. В некоторых вариантах реализации комбинация соединения, которое ингибирует FAK, SRC и JAK2, с ингибитором EGFR может обеспечивать синергический ответ у пациента, нуждающегося в лечении рака. В некоторых вариантах реализации способы лечения рака включают введение комбинации терапевтически эффективного количества соединения, которое ингибирует FAK, SRC и JAK2, и терапевтически эффективного количества ингибитора EGFR. В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, и ингибитор EGFR включают в один состав. В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, и ингибитор EGFR вводят одновременно. В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, и ингибитор EGFR включены в отдельные составы, и их вводят одновременно. В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, и ингибитор EGFR включены в отдельные составы, и их вводят последовательно. В некоторых вариантах реализации последовательное введение соединения, которое ингибирует FAK, SRC и JAK2, и ингибитора EGFR можно проводить путем начального введения соединения, которое ингибирует FAK, SRC и JAK2, и последующего введения ингибитора EGFR. В некоторых вариантах реализации последовательное введение соединения, которое ингибирует FAK, SRC и JAK2, и ингибитора EGFR можно проводить путем начального введения ингибитора EGFR и последующего введения соединения, которое ингибирует FAK, SRC и JAK2.
[0290] В некоторых вариантах реализации соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу I или II
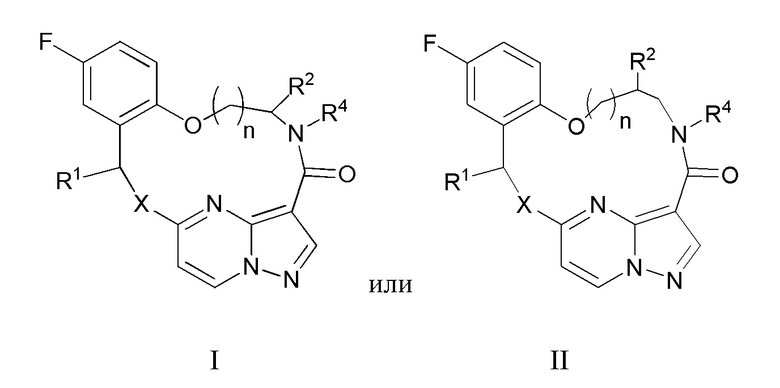
[0291] где
[0292] X представляет собой NR3 или CHR3;
[0293] каждый из R1 и R2 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C6-C10 арил, -OR5, C(O)OR5 или C(O)NR5R6; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2-C6 алкиниле, C3-C6 циклоалкиле и C6-C10 ариле независимо необязательно замещен на дейтерий, галоген, -OH, -CN, -OC1-C6 алкил, NH2, NH(C1-C6 алкил), N(C1-C6 алкил)2, -NHC(O)C1-C6 алкил, -N(C1C6 алкил)C(O)C1-C6 алкил, NHC(O)NH2, NHC(O)NHC1C6 алкил, -N(C1-C6 алкил)C(O)NH2, -N(C1-C6 алкил)C(O)NHC1C6 алкил, NHC(O)N(C1-C6 алкил)2, N(C1-C6 алкил)C(O)N(C1-C6 алкил)2, NHC(O)OC1-C6 алкил, N(C1C6 алкил)C(O)OC1-C6 алкил, -NHS(O)(C1-C6 алкил), NHS(O)2(C1C6 алкил), -N(C1-C6 алкил)S(O)(C1-C6 алкил), -N(C1C6 алкил)S(O)2(C1-C6 алкил), NHS(O)NH2, -NHS(O)2NH2, N(C1C6 алкил)S(O)NH2, -N(C1-C6 алкил)S(O)2NH2, NHS(O)NH(C1-C6 алкил), NHS(O)2NH(C1-C6 алкил), -NHS(O)N(C1-C6 алкил)2, NHS(O)2N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)2NH(C1-C6 алкил), -N(C1-C6 алкил)S(O)N(C1-C6 алкил)2, -N(C1-C6 алкил)S(O)2N(C1-C6 алкил)2, CO2H, C(O)OC1-C6 алкил, -C(O)NH2, C(O)NH(C1-C6 алкил), -C(O)N(C1-C6 алкил)2, SC1-C6 алкил, S(O)C1-C6 алкил, -S(O)2C1-C6 алкил, -S(O)NH(C1-C6 алкил), -S(O)2NH(C1-C6 алкил), S(O)N(C1C6 алкил)2, -S(O)2N(C1-C6 алкил)2, -P(C1-C6 алкил)2, -P(O)(C1-C6 алкил)2, C3C6 циклоалкил или 3-7-членный гетероциклоалкил;
[0294] R3 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или моно- или бициклический гетероарил; где каждый атом водорода в C1-C6 алкиле, C2-C6 алкениле, C2C6 алкиниле, C3-C6 циклоалкиле, 3-7-членном гетероциклоалкиле, C6-C10 ариле или моно- или бициклическом гетероариле независимо необязательно замещен на дейтерий, галоген, C1-C6 алкил, C1-C6 галогеналкил или -OR5;
[0295] R4 представляет собой H, C1-C6 алкил или 3-7-членный гетероциклоалкил, где каждый атом водорода в C1C6 алкиле или 3-7-членном гетероциклоалкиле независимо необязательно замещен на галоген, -OH, -CN, -OC1-C6 алкил, NH2, -NH(C1-C6 алкил), N(C1-C6 алкил)2, CO2H, C(O)OC1C6 алкил, -C(O)NH2, -C(O)NH(C1-C6 алкил), C(O)N(C1-C6 алкил)2, C3-C6 циклоалкил или моноциклический 5-7-членный гетероциклоалкил;
[0296] каждый R5 и R6 независимо представляет собой H, дейтерий, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, 3-7-членный гетероциклоалкил, C6-C10 арил или гетероарил; и
[0297] n равен 0 или 1;
[0298] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0299] В некоторых вариантах реализации R1 представляет собой H или C1-C6 алкил. В некоторых вариантах реализации R1 представляет собой H или метил. В некоторых вариантах реализации R1 представляет собой H. В некоторых вариантах реализации R1 представляет собой метил. В некоторых вариантах реализации R2 представляет собой H. В некоторых вариантах реализации R2 представляет собой C1-C6 алкил. В некоторых вариантах реализации R2 представляет собой метил. В некоторых вариантах реализации R2 представляет собой -OR5. В некоторых вариантах реализации R2 представляет собой -OR5, где R5 представляет собой H. В некоторых вариантах реализации X представляет собой NR3. В некоторых вариантах реализации X представляет собой CHR3. В некоторых вариантах реализации R3 представляет собой H. В некоторых вариантах реализации R4 представляет собой H. В некоторых вариантах реализации n равен 0. В некоторых вариантах реализации n равен 1.
[0300] Макроциклические соединения, которые, как было показано в настоящем документе, являются высокоактивными низкомолекулярными многоцелевыми ингибиторами киназ, обладающими активностью в отношении FAK, SRC и JAK2, включают, но не ограничиваются ими, (7S,13R)-11-фтор-7,13-диметил-6,7,13,14-тетрагидро-1,15-этенопиразоло[4,3-f][1,4,8,10]бензоксатриазациклотридецин-4(5H)-он (также называемый в настоящем документе «соединение 1»), представленный формулой
 ,
,
(7R,14R)-12-фтор-7-гидрокси-14-метил-5,6,7,8,14,15-гексагидро-4H-1,16-этенопиразоло[4,3-g][1,5,9,11]бензоксатриазациклотетрадецин-4-он (также называемый в настоящем документе «соединение 2»), представленный формулой
 и
и
12-фтор-5,6,7,8,14,15-гексагидро-4H-1,16-этенопиразоло[4,3-g][1,5,9]бензоксадиазациклотетрадецин-4-он (также называемый в настоящем документе «соединение 3»), представленный формулой
 .
.
[0301] Соединения 1-3 обладают свойствами, включая противоопухолевые свойства, которые фармакологически проявляются в результате ингибирования рецепторных и нерецепторных протеинкиназ. Соединения 1-3 описаны в международной патентной публикации WO2015/112806, содержание которой включено в настоящую заявку посредством ссылки в части, касающейся получения соединений 1, 2 и 3.
[0302] В некоторых вариантах реализации описанных выше аспектов соединение, которое ингибирует FAK, SRC и JAK2, имеет формулу
 ,
,  или
или 
[0303] или представляет собой фармацевтически приемлемую соль указанных соединений.
[0304] Следует понимать, что рак может представлять собой любой рак, который может быть обусловлен или связан с EGFR, повышающей регуляцией EGFR или любой мутацией EGFR, включая, но не ограничиваясь ими, АККЛ, НМРЛ, нейробластому, воспалительную миофибробластическую опухоль, почечноклеточную карциному взрослых, детскую почечноклеточную карциному, рак молочной железы, ER+ рак молочной железы, трижды негативный рак молочной железы, аденокарциному толстой кишки, глиобластому, мультиформную глиобластому, анапластический рак щитовидной железы, холангиокарциному, рак яичников, колоректальный рак, воспалительную миофибробластическую опухоль, ангиосаркому, эпителиоидную гемангиоэндотелиому, внутрипеченочную холангиокарциному, рак щитовидной железы, шпицоидные новообразования, саркому, астроцитому, низкозлокачественную глиому мозга, секреторную карциному молочной железы, аналогичную карциному молочной железы, острый миелоидный лейкоз, врожденную мезобластическую нефрому, врожденные фибросаркомы, Ph-подобный острый лимфобластный лейкоз, карциному щитовидной железы, плоскоклеточный рак головы и шеи, детскую глиому, ХМЛ, рак предстательной железы, плоскоклеточную карциному легкого, серозную цистаденокарциному яичников, кожную меланому, рак предстательной железы, устойчивый к кастрации, лимфому Ходжкина, серозный и светлоклеточный рак эндометрия, рак полости рта, рак эндометрия, эндокринный рак, рак кожи, рак желудка, рак пищевода, рак гортани, рак поджелудочной железы, рак толстой кишки, рак мочевого пузыря, рак кости, рак шейки матки, рак матки, рак яичек, рак прямой кишки, рак почки, рак печени и рак легкого.
[0305] В некоторых вариантах реализации в настоящем изобретении предложены способы лечения заболевания у пациента, которому ранее проводили лечение одним или более терапевтическими агентами. В некоторых вариантах реализации пациенту ранее проводили лечение одним или более химиотерапевтическими агентами. В других вариантах реализации пациенту ранее проводили лечение одним или более химиотерапевтическими агентами, и у него развилась приобретенная устойчивость к лечению. В других вариантах реализации пациенту ранее проводили лечение одним или более химиотерапевтическими агентами, и у него развилась устойчивость по «обходному пути» к лечению. В других вариантах реализации пациенту ранее проводили лечение одним или более химиотерапевтическими агентами, и у него развилась устойчивость по «обходному пути» к лечению, регулируемая FAK, SRC или JAK2.
[0306] Другие химиотерапевтические агенты, которыми пациента могли лечить перед лечением одним или более соединениями, описанными в настоящем документе, включают, но не ограничиваются ими, ингибиторы киназ, адренокортикоиды и кортикостероиды, алкилирующие агенты, пептидные и пептидомиметические ингибиторы сигнальной трансдукции, антиандрогены, антиэстрогены, андрогены, акламицин и производные акламицина, эстрогены, антиметаболиты, соединения платины, амантины, растительные алкалоиды, митомицины, дискодермолиды, микротрубочковые ингибиторы, эпотилоны, воспалительные и провоспалительные агенты, аналоги пурина, аналоги пиримидина, камптотецины и доластатины.
[0307] Следует понимать, что ингибитор EGFR для применения в комбинационной терапии, описанной в настоящем документе, может представлять собой любой ингибитор EGFR, такой как определено в настоящем документе. Подходящие примеры ингибиторов EGFR включают антитела к EGFR или низкомолекулярные ингибиторы EGFR. В некоторых вариантах реализации ингибитор EGFR может представлять собой афатиниб, бригатиниб, цетуксимаб, канертиниб (CI-1033), дакомитиниб, эрлотиниб, гефитиниб, HKI 357, икотиниб, лапатиниб, осимертиниб, наквотиниб, назартиниб, нецитумумаб, нератиниб, олмутиниб, панитумумаб, пелитиниб, PF-06747775, роцилетиниб, вандетаниб или их фармацевтически приемлемые соли. В некоторых вариантах реализации ингибитор EGFR может представлять собой цетуксимаб, нецитумумаб или панитумумаб.
Фармацевтические композиции
[0308] Для задач лечения фармацевтические композиции, содержащие соединения, описанные в настоящем документе, могут дополнительно содержать одно или более фармацевтически приемлемых вспомогательных веществ. Фармацевтически приемлемое вспомогательное вещество представляет собой вещество, которое является нетоксичным и по иным биологическим причинам подходит для введения субъекту. Указанные вспомогательные вещества улучшают введение соединений, описанных в настоящем документе, и совместимы с активным ингредиентом. Примеры фармацевтически приемлемых вспомогательных веществ включают стабилизаторы, смазывающие вещества, поверхностно-активные вещества, разбавители, антиоксиданты, связывающие вещества, красители, объемообразующие агенты, эмульгаторы или модификаторы вкуса. В предпочтительных вариантах реализации фармацевтические композиции согласно изобретению представляют собой стерильные композиции. Фармацевтические композиции можно получать способами смешения, известными или доступными для специалистов в данной области техники.
[0309] В изобретение также включены стерильные композиции, включая композиции, удовлетворяющие национальным и местным регламентам, регулирующим указанные композиции.
[0310] Фармацевтические композиции и соединения, описанные в настоящем документе, могут быть получены в виде растворов, эмульсий, суспензий или дисперсий в подходящих фармацевтических растворителях или носителях или в виде пилюль, таблеток, пастилок, суппозиториев, порционных пакетиков, драже, гранул, порошков, порошков для перерастворения или капсул совместно с твердыми носителями согласно традиционным способам, известным в области получения различных лекарственных форм. Фармацевтические композиции согласно изобретению можно вводить подходящим способом доставки, таким как пероральный, парентеральный, ректальный, интраназальный, местный или внутриглазной способ или путем ингаляции. Предпочтительно композиции предназначены для внутривенного или перорального введения.
[0311] Для перорального введения соединения согласно изобретению могут быть обеспечены в твердой форме, такой как таблетка или капсула, или в виде раствора, эмульсии или суспензии. Для получения пероральных композиций соединения согласно изобретению можно включать в состав для достижения дозировки, например, от примерно 0,1 мг до 1 г в день или от примерно 1 мг до 50 мг в день или от примерно 50 до 250 мг в день или от примерно 250 мг до 1 г в день. Пероральные таблетки могут включать активный(-е) ингредиент(-ы) в смеси с совместимыми фармацевтически приемлемыми вспомогательными веществами, такими как разбавители, разрыхлители, связывающие вещества, смазывающие вещества, подсластители, вкусоароматические добавки, красители и консерванты. Подходящие инертные наполнители включают карбонаты натрия и кальция, фосфаты натрия и кальция, лактозу, крахмал, сахар, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит и т.д. Типовые жидкие пероральные вспомогательные вещества включают этанол, глицерин, воду и т.д. Крахмал, поливинилпирролидон (PVP), натрия крахмал гликолят, микрокристаллическая целлюлоза и альгиновая кислота являются типовыми разрыхлителями. Связывающие вещества могут включать крахмал и желатин. Смазывающие вещества, если они присутствуют, могут представлять собой стеарат магния, стеариновую кислоту или тальк. При желании на таблетки можно наносить покрытие из материала, такого как глицерилмоностеарат или глицерилдистеарат, для задержки всасывания в желудочно-кишечном тракте или можно наносить кишечнорастворимое покрытие.
[0312] Капсулы для перорального введения включают твердые и мягкие желатиновые капсулы. Для получения твердых желатиновых капсул активный(-е) ингредиент(-ы) можно смешивать с твердым, полутвердым или жидким разбавителем. Мягкие желатиновые капсулы можно получать путем смешения активного ингредиента с водой, маслом, таким как арахисовое масло или оливковое масло, жидким парафином, смесью моно- и диглицеридов короткоцепочечных жирных кислот, полиэтиленгликолем 400 или пропиленгликолем.
[0313] Жидкие составы для перорального введения могут иметь форму суспензий, растворов, эмульсий или сиропов или могут быть лиофилизированными или представлены в виде сухого продукта для перерастворения в воде или другом подходящем носителе перед использованием. Указанные жидкие композиции могут необязательно содержать: фармацевтически приемлемые вспомогательные вещества, такие как суспендирующие агенты (например, сорбит, метилцеллюлоза, альгинат натрия, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия и т.д.); неводные носители, например, масло (например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, этиловый спирт или вода; консерванты (например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота); увлажнители, такие как лецитин; и, при желании, вкусоароматические добавки или красители.
[0314] Для парентерального использования, включая внутривенный, внутримышечный, интраперитонеальный, интраназальный или подкожный способы, агенты согласно изобретению могут быть обеспечены в стерильных водных растворах или суспензиях, забуферизованных до соответствующего pH и изотоничности, или в парентерально приемлемых маслах. Подходящие водные носители включают раствор Рингера и изотонический хлорид натрия. Указанные формы могут быть получены в виде форм с однократной дозировкой, таких как ампулы или сменные устройства для инъекций, в формах для многократного дозирования, таких как пробирки, из которых можно отбирать соответствующую дозу, или в твердой форме или предварительном концентрате, которую(-ый) можно использовать для получения инъекционного состава. Иллюстративные дозы для инфузии находятся в диапазоне от примерно 1 до 1000 мкг/кг/минута агента в смеси с фармацевтическим носителем в течение периода в диапазоне от нескольких минут до нескольких дней.
[0315] Для интраназального, ингаляционного или перорального введения предложенные фармацевтические композиции можно вводить, например, с использованием распыляемого состава, также содержащего подходящий носитель. Предложенные композиции могут быть предназначены для ректального введения в виде суппозитория.
[0316] Для местного введения соединения согласно настоящему изобретению предпочтительно получают в виде кремов или мазей или в схожих носителях, подходящих для местного введения. В случае местного введения предложенные соединения можно смешивать с фармацевтическим носителем в концентрации от примерно 0,1% до примерно 10% лекарственного средства в носителе. В другом режиме введения агентов согласно изобретению можно применять состав в виде пластыря для осуществления чрескожной доставки.
Примеры
Химические вещества и реагенты
[0317] Соединения 1, 2 и 3 получали согласно способам, описанным в WO2015/112806, в частности, см. примеры 90, 93 и 103 в данной публикации. Содержание WO2015/112806 включено в настоящую заявку посредством ссылки в части, касающейся получения соединений 1, 2 и 3.
[0318] Гефитиниб приобретали в Tocris Bioscience. Осимертиниб (AZD9291) приобретали в Selleck Chemicals. Лекарственные вещества получали в виде маточных растворов в диметилсульфоксиде (ДМСО) с концентрацией 10-100 ммоль/л и хранили при -20°C. Дальнейшее разбавление проводили в питательной среде до достижения конечной концентрации перед использованием. Антитела к фосфо-EGFR (Tyr1068), фосфо-EGFR (Tyr845), фосфо-STAT3 (Tyr705), фосфо-AKT (Ser473), фосфо-ERK1/2 (Thr202/Tyr204), фосфо-паксиллину (Tyr118), фосфо-YAP1 (Ser127), фосфо-TRKB и β-актину приобретали в Cell Signaling Technology (Beverly, MA). Фосфо-YAP1 (Tyr357) приобретали в Abcam (Cambridge, UK). Козьи антикроличьи антитела IRDye 800CW и козьи антимышиные антитела IRDye 800CW приобретали в LI-COR Biosciences.
[0319] Клеточные линии
[0320] Клетки аденокарциномы легких человека PC-9, имеющие делецию экзона 19 в EGFR (E746-A750), были предоставлены F. Hoffmann-La Roche Ltd. с разрешения Dr. Mayumi Ono (Kyushu University, Fukuoka, Japan). Клетки аденокарциномы легкого человека H1975, имеющие сенсибилизирующую L858R и устойчивую T790M мутации, приобретали в Американской коллекции типовых культур (ATCC). Все клеточные линии выдерживали в RPMI (среда Мемориального института Розуэлл Парк) 1640, дополненной 1% пенициллина/стрептомицина/глутамина (Gibco) и 10% эмбриональной бычьей сывороткой (ЭБС) (Gibco) при 5% CO2, 37°C, в инкубаторе для клеточных культур и проводили стандартные исследования для определения загрязнения микоплазмой.
Исследования in vitro
Пример 1: Исследование жизнеспособности клеток
[0321] Клетки высеивали в 96-луночные планшеты до достижения следующих плотностей: 2×103, 3×103 и 4×103, и инкубировали в течение 24 часов. Затем обрабатывали клетки последовательно разбавленными лекарственными соединениями, которые вводили в дозах, как правило, соответствующих 1/8, 1/4, 1/2, 5/8, 3/4, 7/8, 1, 1,5 и 2 от значений IC50. После 72-часовой инкубации в среду в лунках добавляли 0,5 мг/мл реагента MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид для полуавтоматизированного колориметрического анализа на основе тетразолия) (Sigma Aldrich) в течение 2 часов при 37°C, кристаллы формазана в жизнеспособных клетках растворяли с использованием 100 мкл ДМСО и проводили спектрофотометрическую количественную оценку на анализаторе микропланшетов (Varioskan Flash Thermo Electron) при длине волны поглощения 550 нм. Затем вычисляли относительную выживаемость путем деления количества клеток в лунках, обработанных лекарственным средством, на количество клеток в контрольных лунках. Затем анализировали данные эффективности комбинации лекарственных средств способом Чоу и Талалая (Chou and Talalay) (см. Chou TC. Drug combination studies and their synergy quantification using the Chou-Talalay method. Cancer research. 2010;70:440-6). Значения показателя аддитивности (CI) <1, =1 и >1 обозначают синергию, аддитивный эффект и антагонизм, соответственно.
[0322] Результаты, отражающие жизнеспособность клеток PC9 в % при использовании ингибитора EGFR (гефитиниба или осимертиниба), соединения 1 и ингибиторов EGFR совместно с соединением 1, показаны на фиг. 1a и 2a. Результаты, отражающие соответствующие показатели аддитивности (CI), показаны на фиг. 1b и 2b.
[0323] Результаты, отражающие жизнеспособность клеток H1975 в % при использовании ингибитора EGFR (гефитиниба или осимертиниба), соединения 1 и комбинации ингибиторов EGFR с соединением 1, показаны на фиг. 3a и 4a. Результаты, отражающие соответствующие показатели аддитивности (CI), показаны на фиг. 3b и 4b.
Пример 2: Исследование образования колоний
[0324] Клетки помещали в шестилуночные планшеты в количестве 1000 клеток/лунка в RPMI, 10% ЭБС. Клетки выращивали в течение 24 часов, затем заменяли среду на RPMI, 1% ЭБС, содержащую или не содержащую ингибиторы. Через 72 часа удаляли среду и заменяли ее на свежую среду, не содержащую ингибиторы, и оставляли на 10 дней. После завершения эксперимента удаляли среду и промывали клетки фосфатным буферным раствором (ФБР). Фиксировали колонии и одновременно окрашивали 0,5% кристаллическим фиолетовым в 10% этаноле в течение 15 минут. Откачивали краситель и промывали лунки деионизированной водой до получения прозрачного фона. Затем фотографировали лунки. Для полуколичественного определения кристаллический фиолетовый экстрагировали из колоний с использованием 0,5% раствора Triton X-100 в течение ночи и измеряли поглощение при 570 нм.
[0325] Результаты, представленные в виде изображений образованных колоний клеток PC9 для контроля, ингибитора EGFR (гефитиниба или осимертиниба), соединения 1 и комбинации ингибиторов EGFR с соединением 1 показаны на фиг. 5a и 6a. Результаты, на которых графически представлена площадь образованных колоний в %, показаны на фиг. 5b и 6b.
[0326] Результаты, представленные в виде изображений образованных колоний клеток H1975 для контроля, ингибитора EGFR (гефитиниба или осимертиниба), соединения 1 и комбинации ингибиторов EGFR с соединением 1 показаны на фиг. 7a и 8a. Результаты, на которых графически представлена площадь образованных колоний в %, показаны на фиг. 7b и 8b.
Пример 3. Ферментное исследование ингибирования киназ 1
[0327] Оценку ингибирования киназ FAK, SRC и JAK2 в ферментном исследовании проводили в Eurofins с использованием панели Eurofins KinaseProfiler™. Все соединения получали в виде рабочих растворов с 50x конечной исследуемой концентрацией в 100% ДМСО. При необходимости, более концентрированные маточные растворы разбавляли вручную до 50x с использованием 100% ДМСО. Соединения, поставляемые в виде порошков, перерастворяли до получения 10 мМ маточного раствора в 100% ДМСО, после чего дополнительно разбавляли до 50x. Требуемый объем 50x маточного раствора исследуемого соединения добавляли в исследуемую лунку, после чего добавляли реакционную смесь, содержащую фермент и субстрат. Реакцию запускали путем добавления АТФ в 10 мкМ концентрации. Предварительную инкубацию соединения со смесью фермент/субстрат перед добавлением АТФ не проводили. Обработку данных проводили при помощи специально созданного аналитического программного обеспечения для внутреннего пользования. Результаты выражены как остаточная активность киназы относительно контроля с ДМСО в процентах. Ее вычисляли по следующей формуле: (средний результат в образце - средний результат пустого опыта)/средний результат контроля.
Таблица 1.
Пример 4. Ферментное исследование ингибирования киназы 2
[0328] IC50 ингибирования киназ определяли в Reaction Biology Corporation (www.reactionbiology.com, Malvern, PA) согласно способам, описанным по ссылке (Anastassiadis T, et al Nat Biotechnol. 2011, 29, 1039). Специфические пары киназа/субстрат, а также требуемые кофакторы получали в реакционном буфере: 20 мМ Hepes pH 7,5, 10 мМ MgCl2, 1 мМ ЭГТА, 0,02% Brij35, 0,02 мг/мл БСА, 0,1 мМ Na3VO4, 2 мМ DTT, 1% ДМСО (подробное описание отдельных компонентов киназной реакционной смеси см. в дополнительной таблице 2). Соединения вводили в реакционную смесь, затем через ~ 20 минут добавляли смесь АТФ (Sigma, St. Louis MO) и 33P АТФ (Perkin Elmer, Waltham MA) до достижения конечной концентрации 10 мкМ. Взаимодействие проводили при комнатной температуре в течение 120 минут, затем наносили пятна реакционных смесей на бумагу для ионообменного фильтрования P81 (Whatman Inc., Piscataway, NJ). Несвязанный фосфат удаляли путем обильной промывки фильтров 0,75% фосфорной кислотой. После вычитания фона, определенного в контрольных реакционных смесях, содержащих неактивный фермент, данные киназной активности выражали как остаточную киназную активность в исследуемых образцах в процентах относительно реакционных смесей с носителем (диметилсульфоксид). При помощи Prism (программное обеспечение GraphPad Software) получали значения IC50 и проводили подстановку в кривые.
Таблица 2
Пример 5. Исследование пролиферации клеток рака легкого NCI-H1975:
[0329] Пять тысяч клеток NCI-H1975 на лунку высеивали в 384-луночный белый планшет в течение 24 часов, а затем обрабатывали соединением 1, AZD9291(осимертиниб) или эрлотинибом, соединением 1 в концентрации 1 мМ или 3 мМ совместно с AZD9291 или эрлотинибом в различных концентрациях в течение 72 часов (37°C, 5% CO2). Пролиферацию клеток измеряли в исследовании обнаружения АТФ на основе люциферазы CellTiter-Glo (Promega) согласно протоколу производителя. IC50 определяли при помощи программного обеспечения GraphPad Prism (GraphPad, Inc., San Diego, CA). Результаты сведены на фигуре 9 и фигуре 10. Несмотря на то, что в клеточной линии рака легкого NCI-H1975 происходит эндогенная экспрессия двойных мутаций EGFR L858R/T790M, необратимый ингибитор EGFR третьего поколения AZD9291 демонстрировал только частичное ингибирование пролиферации клеток. Авторы исследовали синергическое действие соединения 1 в комбинации с эрлотинибом или AZD9291 в отношении пролиферации клеток NCI-H1975. Соединение 1 по отдельности обеспечивало только частичное ингибирование NCI-H1975 в высокой концентрации (IC50 4 мкМ). Сильную синергию наблюдали для комбинации AZD9291 и соединения 1. AZD9291 с высокой активностью ингибировало NCI-H1975, где IC50 составляла 3 нМ, в присутствии соединения 1 в 3 мкМ концентрации (фигура 9). Комбинация приводила к значительно более полному подавлению пролиферации клеток по сравнению с введением только AZD9291. Вследствие наличия мутации T790M в клеточной линии NCI-H1975 эрлотиниб был не восприимчив к ингибированию пролиферации клеток NCI-H1975, и его значение IC50 улучшалось от 6236 нМ до 1000 нМ при использовании соединения 1 в 3 мкМ концентрации (фигура 10).
Пример 6. Иммуноблоттинг в исследованиях фосфорилирования клеточных киназ
[0330] Клетки НМРЛ NCI-H1975 (содержащие двойные мутации EGFR L858R/T790M) выращивали в среде RPMI, дополненной 10% эмбриональной бычьей сывороткой и 100 Ед/мл пенициллина/стрептомицина. Полмиллиона клеток на лунку высеивали в 24-луночный планшет в течение 24 часов, а затем обрабатывали соединением 1, эрлотинибом или AZD9291 или комбинацией соединения 1 с эрлотинибом или AZD9291 в течение 4 часов. Собирали клетки после обработки и проводили лизис в буфере RIPA (50 мМ Tris, pH 7,4, 150 мМ NaCl, 1% NP-40, 0,5% деоксихолат, 0,1% ДСН), дополненном 10 мМ ЭДТА, 1X ингибиторами протеазы и фосфатазы Halt (Thermo Scientific). Лизаты белков (примерно 20 мкг) разделяли на предварительно отлитых 4-12% Bolt Bis-Tris гелях с использованием подвижного буфера MES (Life Technologies), переносили на нитроцеллюлозные мембраны с использованием системы Trans-Blot Turbo Transfer System (Bio-Rad) и детектировали при помощи антител, направленно действующих на фосфорилированный EGFR и общий EGFR (Sigma), фосфорилированный паксиллин и общий паксиллин (Cell Signaling Technology), фосфорилированный STAT3 и общий STAT3 (Cell Signaling Technology), фосфорилированный AKT и общий AKT (Cell Signaling Technology), фосфорилированный ERK (Cell Signaling Technology) и тубулин (Sigma). Антитела, как правило, инкубировали в течение ночи при 4°C при осторожном перемешивании, после чего промывали и инкубировали совместно с соответствующими вторичными антителами, конъюгированными с HRP. Мембраны инкубировали совместно с хемилюминесцентным субстратом в течение 5 минут при комнатной температуре (SuperSignal West Femto, Thermo Scientific). Хемилюминесцентные изображения получали в системе визуализации C-DiGit Imaging System (LI-COR Biosciences). Результаты приведены на фигуре 11 и фигуре 12. Соединение 1 не ингибировало фосфорилирование EGFR и зависящим от дозы образом ингибировало фосфорилирование субстрата SRC/FAK паксиллина в клетках NCI-H1975 (фигура 11). В 1 мкМ концентрации соединение 1 обеспечивало минимальное ингибирование фосфорилирования EGFR, AKT и ERK и в значительной степени ингибировало фосфорилирование STAT3 и паксиллина. В 1 мкМ концентрации AZD9291 в значительной степени ингибировал фосфорилирование EGFR, AKT и ERK и обеспечивал минимальное ингибирование фосфорилирования STAT3 и паксиллина. В 1 мкМ концентрации эрлотиниб обеспечивал минимальное ингибирование фосфорилирования EGFR, AKT, ERK, STAT3 и паксиллина. Комбинация соединения 1 и AZD9291 в значительной степени ингибировала фосфорилирование EGFR, AKT, ERK, STAT3 и паксиллина, что обеспечивало синергическое антипролиферативное действие в отношении клеток NCI-H1975.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИРАЛЬНЫЕ ДИАРИЛЬНЫЕ МАКРОЦИКЛЫ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2728579C2 |
| ХИРАЛЬНЫЕ ДИАРИЛЬНЫЕ МАКРОЦИКЛЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ ПРОТЕИНКИНАЗ | 2016 |
|
RU2732405C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ РАКА, СОДЕРЖАЩАЯ СОЕДИНЕНИЕ НА ОСНОВЕ НАФТОХИНОНА И ИНГИБИТОР ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2021 |
|
RU2830359C1 |
| КОМПОЗИЦИИ НА ОСНОВЕ ИНГИБИТОРА SHP2 И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2805355C2 |
| БЕНЗО[b]ТИОФЕНОВЫЕ АГОНИСТЫ STING ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2771811C2 |
| СПОСОБ УСИЛЕНИЯ АНТИТЕЛОЗАВИСИМОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТИ | 2011 |
|
RU2627660C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[2,3-b]ПИРИДИНА, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ АНТИАПОПТИЧЕСКИХ БЕЛКОВ Bcl-2 | 2011 |
|
RU2567857C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| БИ- И ПОЛИЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА И ИЗОХИНОЛИНОНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ RHO-КИНАЗЫ | 2009 |
|
RU2532481C2 |
| ИНГИБИТОРЫ EZH2 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704445C2 |
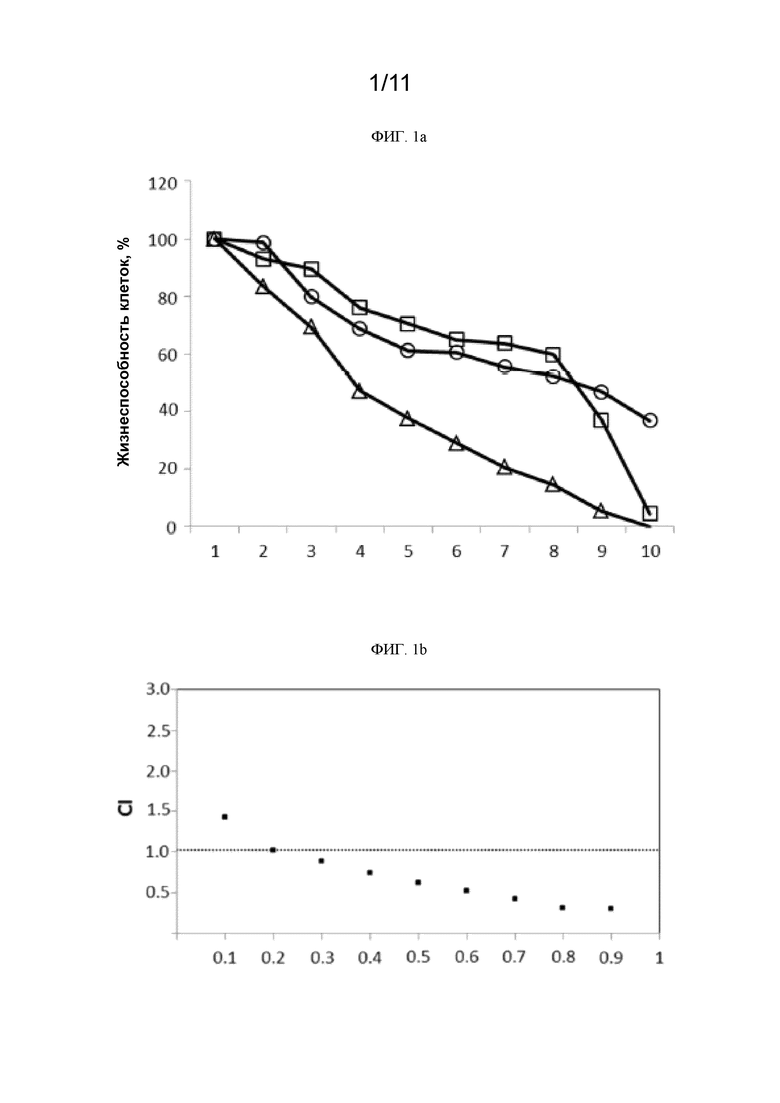
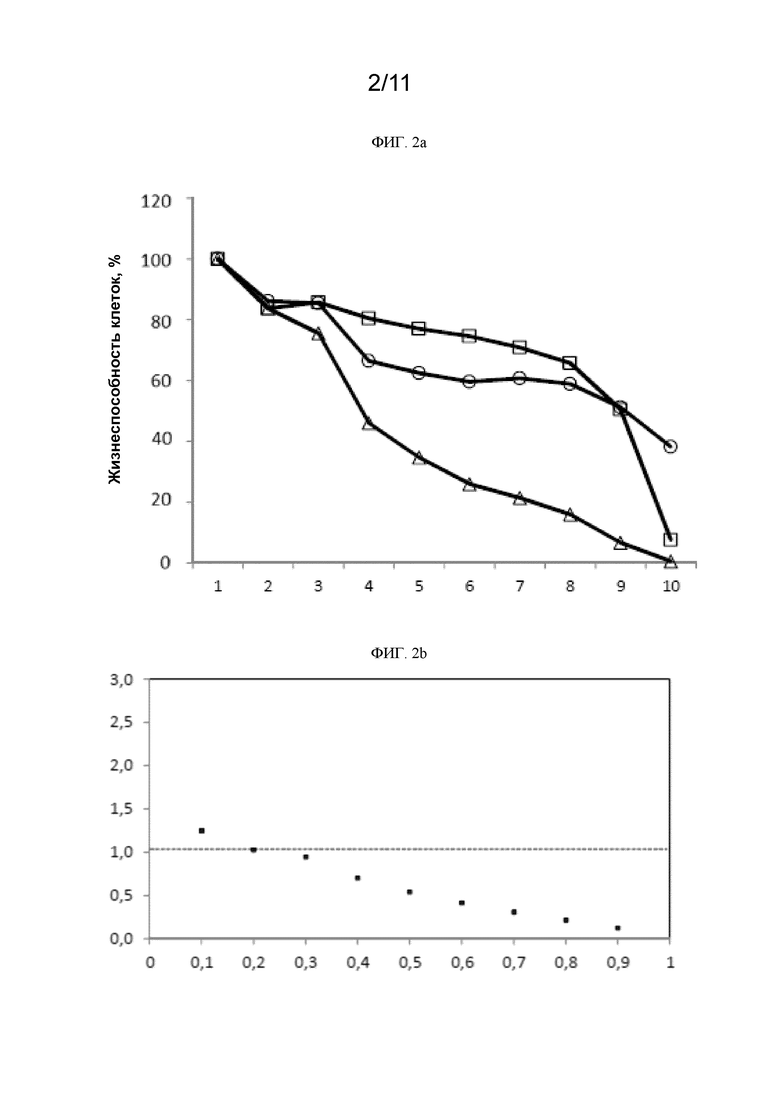
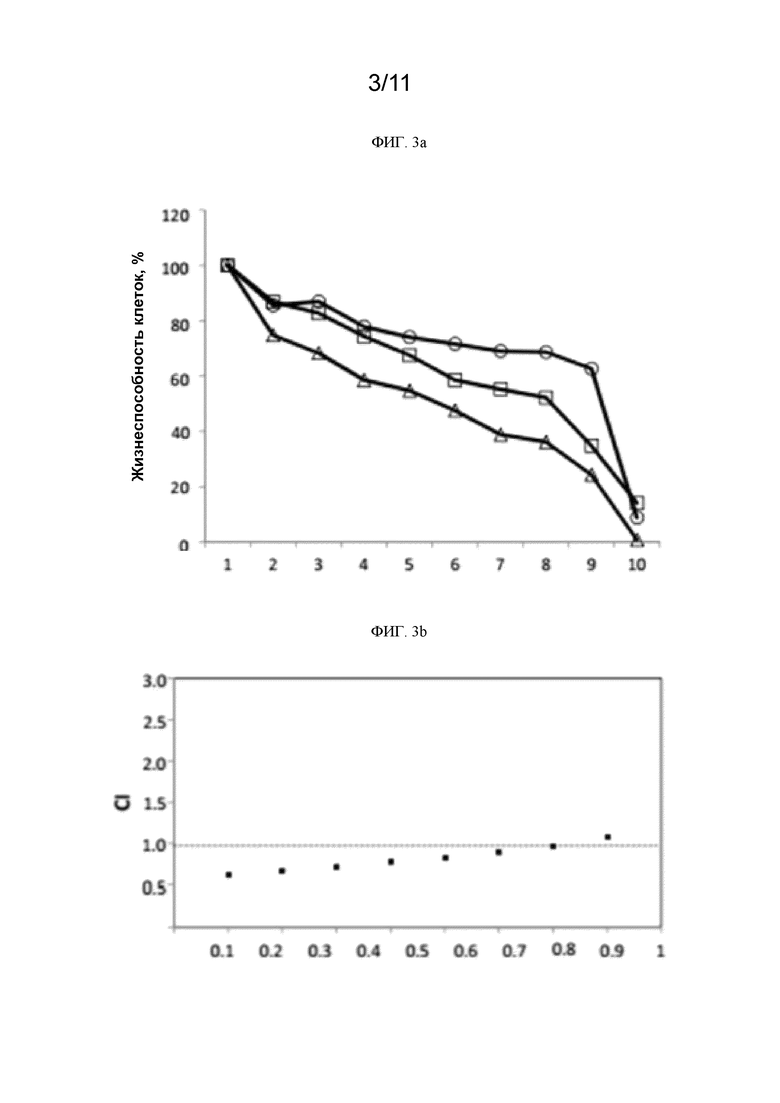
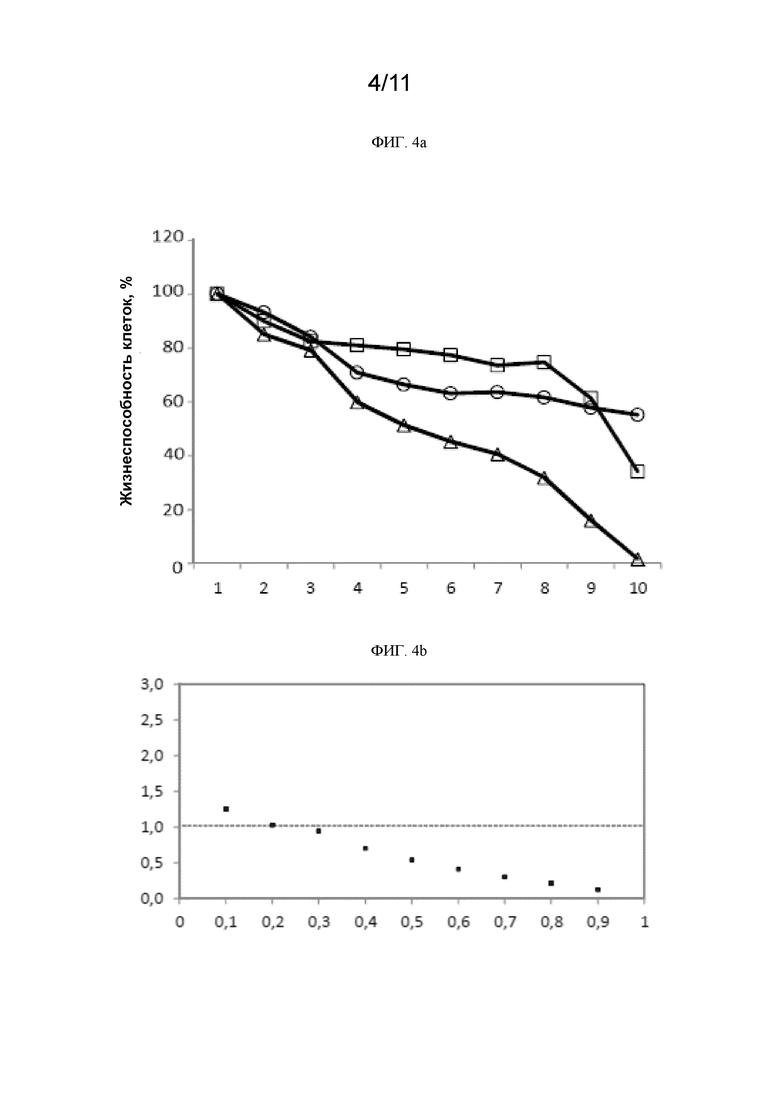
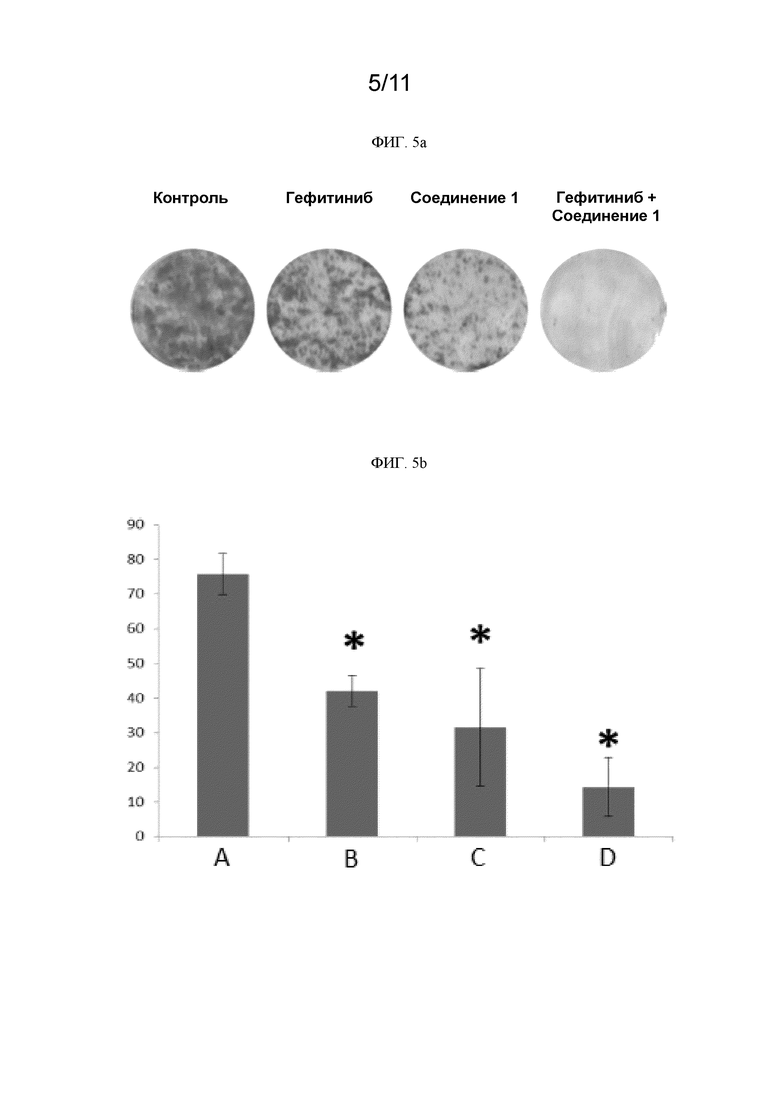
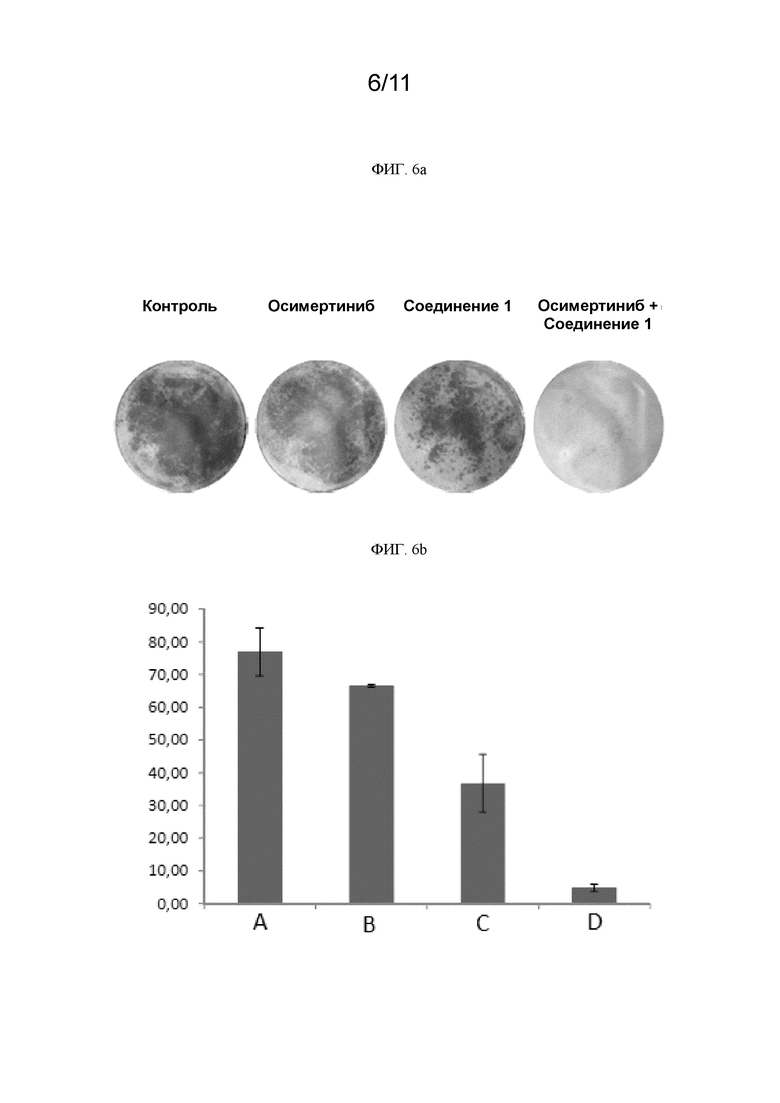
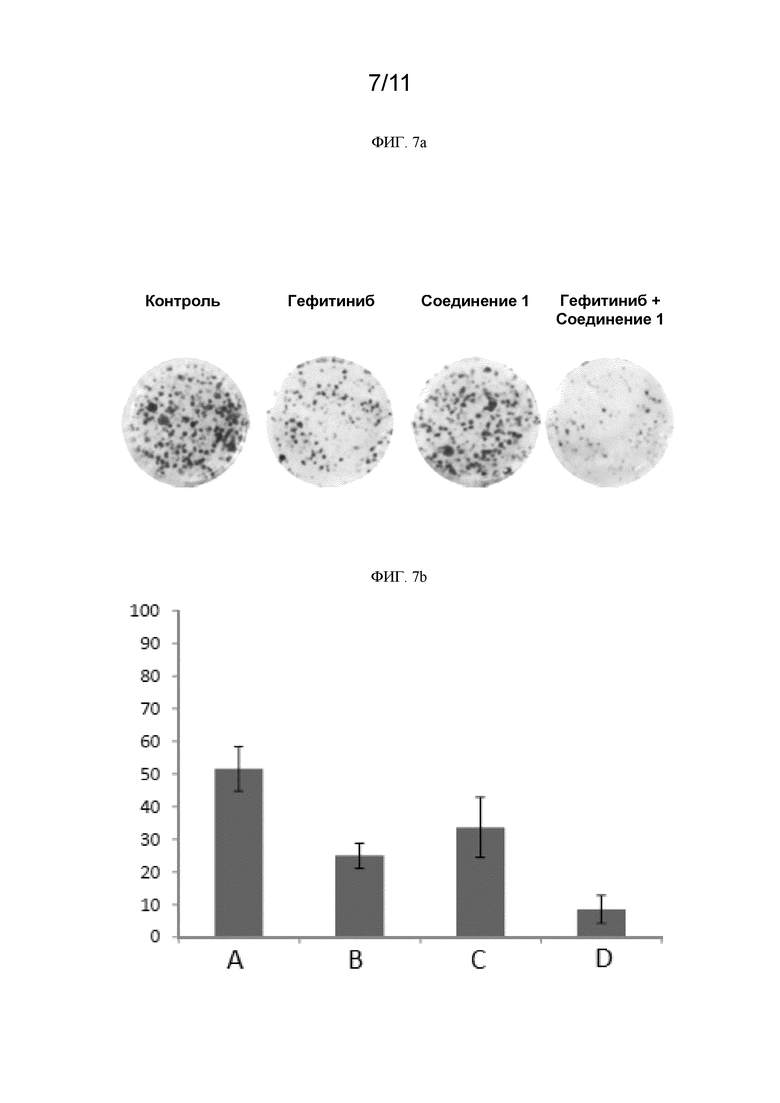
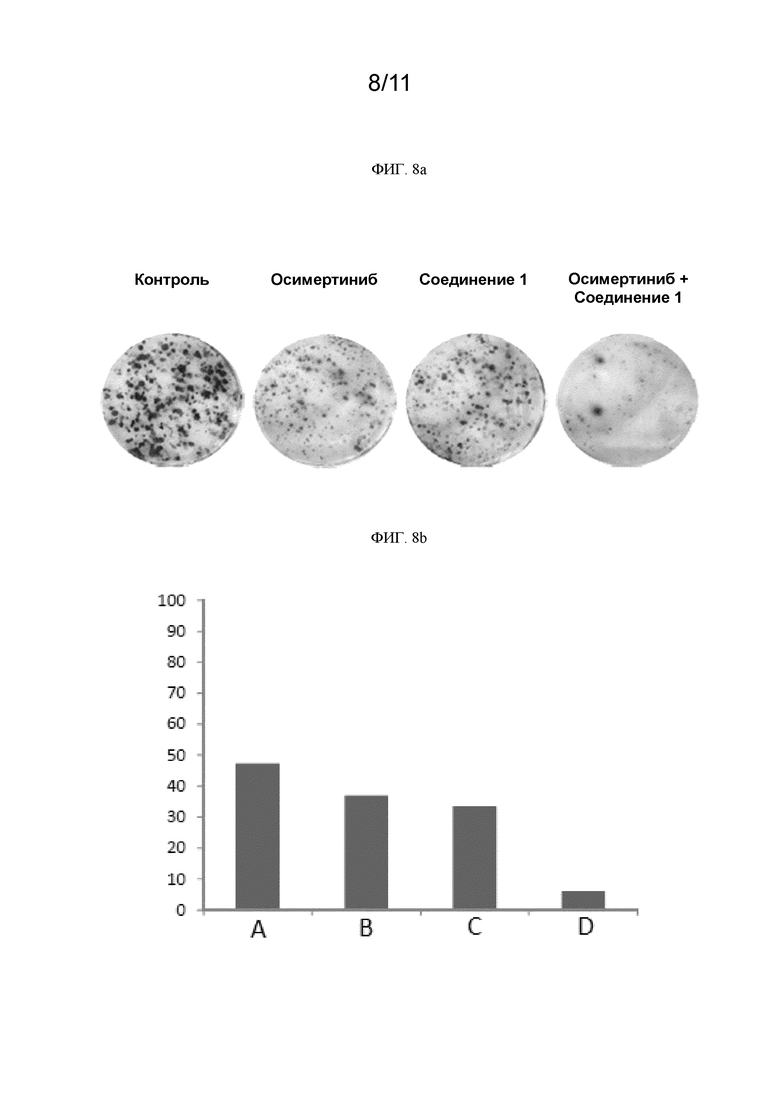
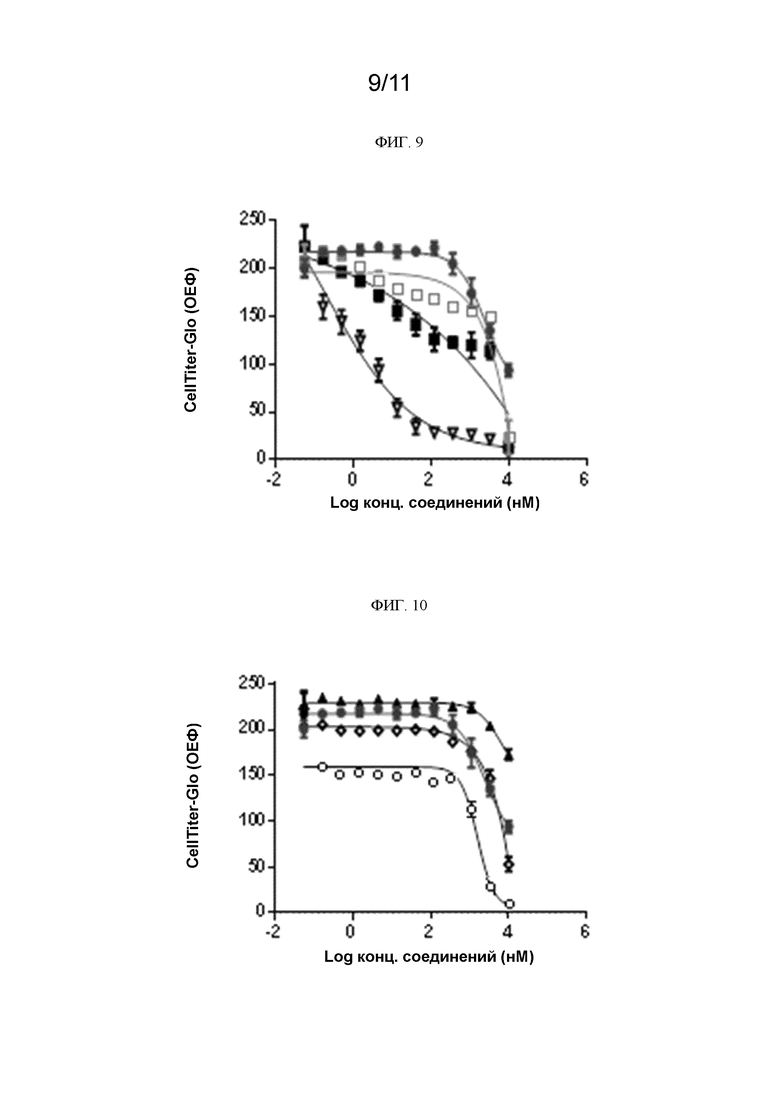
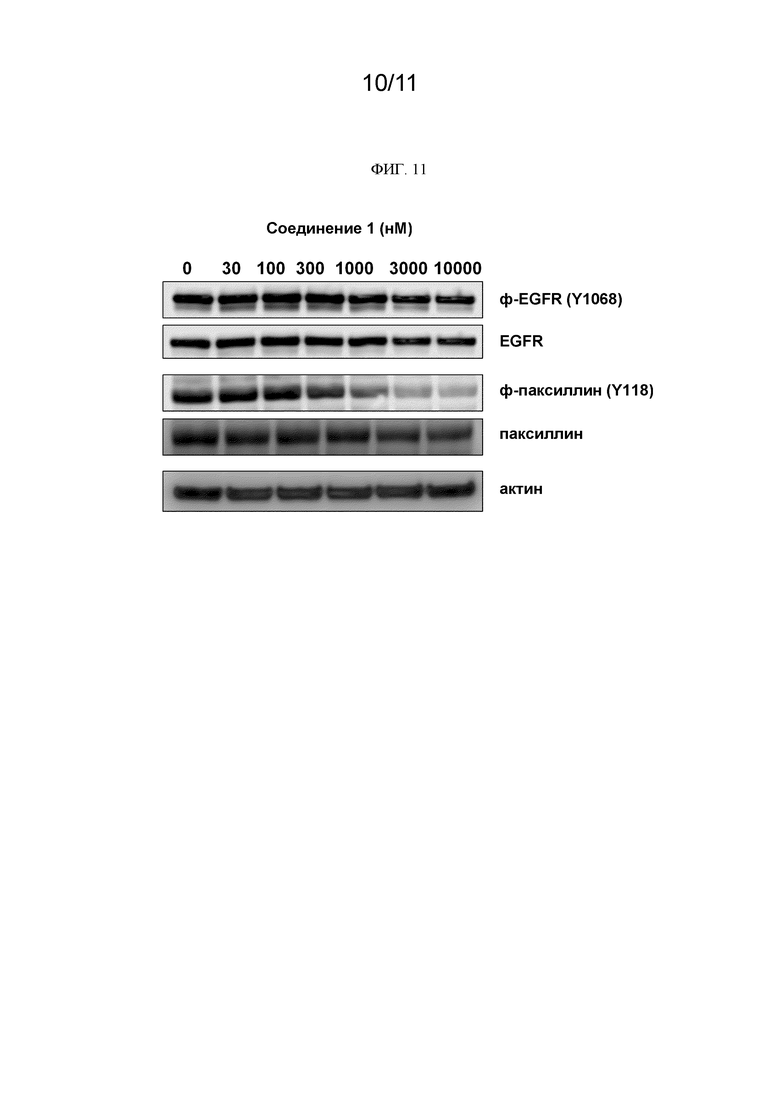
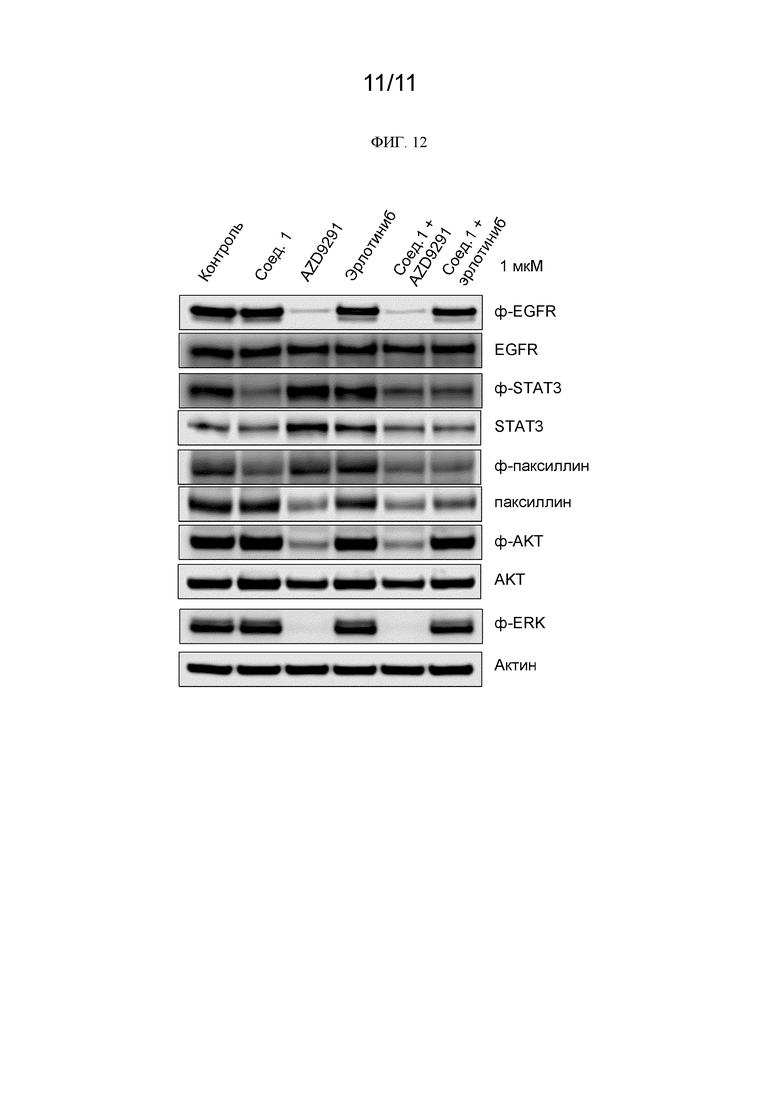
Настоящее изобретение относится к способу лечения рака у пациента, нуждающегося в лечении. Способ включает введение пациенту терапевтически эффективного количества соединения, имеющего формулу
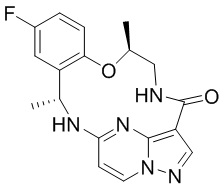 ,
,
или его фармацевтически приемлемой соли в комбинации с терапевтически эффективным количеством ингибитора EGFR или его фармацевтически приемлемой соли, где ингибитор EGFR представляет собой осимертиниб или его фармацевтически приемлемую соль и где рак представляет собой рак легкого. Изобретение обеспечивает синергический ответ у пациента, нуждающегося в лечении рака. 10 з.п. ф-лы, 20 ил., 2 табл., 6 пр.
1. Способ лечения рака у пациента, нуждающегося в лечении, включающий введение пациенту терапевтически эффективного количества соединения, имеющего формулу
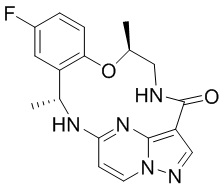 ,
,
или его фармацевтически приемлемой соли в комбинации с терапевтически эффективным количеством ингибитора EGFR или его фармацевтически приемлемой соли,
где ингибитор EGFR представляет собой осимертиниб или его фармацевтически приемлемую соль и
где рак представляет собой рак легкого.
2. Способ по п.1, отличающийся тем, что рак легкого представляет собой немелкоклеточный рак легкого (НМРЛ), аденокарциному, плоскоклеточную карциному легкого, крупноклеточную карциному, крупноклеточную нейроэндокринную опухоль или мелкоклеточный рак легкого (МРЛ).
3. Способ по п.1, отличающийся тем, что рак легкого представляет собой немелкоклеточный рак легкого.
4. Способ по п.1, в котором введение представляет собой пероральное введение.
5. Способ по п.1, в котором указанное соединение или его фармацевтически приемлемую соль вводят в количестве от 0,1 мг до 1 г в день.
6. Способ по п.1, в котором указанное соединение или его фармацевтически приемлемую соль вводят в количестве от 50 мг до 250 мг в день.
7. Способ по п.1, в котором ингибитор EGFR или его фармацевтически приемлемую соль вводят в количестве от 50 мг до 250 мг в день.
8. Способ по п.1, в котором указанное соединение и ингибитор EGFR получены по отдельности и их вводят в одно и то же время.
9. Способ по п.1, в котором указанное соединение и ингибитор EGFR вводят последовательно.
10. Способ по п.9, в котором указанное соединение вводят первым, а ингибитор EGFR вводят вторым.
11. Способ по п.9, в котором ингибитор EGFR вводят первым, а указанное соединение вводят вторым.
| WO 2015112806 A2, 30.07.2015 | |||
| US 2013034495 A1, 07.02.2013 | |||
| US 2013143895 A1, 06.06.2013 | |||
| US 2017002023 A1, 05.01.2017 | |||
| Трапецеидальная борона | 1925 |
|
SU3640A1 |
Авторы
Даты
2022-11-30—Публикация
2018-01-25—Подача