ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Заявляемое изобретение относится к области химической технологии органических соединений и может найти промышленное применение при получении новых функциональных светопреобразующих и светоизлучающих органических материалов в оптике и оптоэлектронике, обладающих как эффективным поглощением света в видимой части спектра, так и эффективной фотолюминесценцией в длинноволновом диапазоне спектра (от желтого до красного) в сочетании с высокой термической стабильностью. Более конкретно, изобретение относится к получению новых органических люминесцентных материалов, представляющих собой несимметричные молекулы донорно-акцепторного типа на основе электронодонорного трифениламина, или его алкил-,или алкокси-производных, cвязанного через π-сопряженный тиофеновый фрагмент с концевой электроноакцепторной группой различной природы.
УРОВЕНЬ ТЕХНИКИ
В рамках заявляемого изобретения к несимметричным донорно-акцепторным молекулам относятся органические соединения, которые имеют один электронодонорный трифениламиновый, или диалкилтрифениламиновый, или диалкокситрифениламиновый фрагмент, связанный через π-сопряжённый тиофеновый спейсер (π-спейсер) с N-алкил- или N-фенилроданиновыми, N-алкил- или N-фенилдицианороданиновыми, дицианоинданоновыми, алкил- или фенилцианэфирными и 4-метил-, 4-метокси- или 4-нитрофенилакрилонитрильными электроноакцепторными группами.
Исторически, подобная концепция использования производных трифениламина различной архитектуры, связанных через π-сопряженный через тиофеновый спейсер с электроноакцепторными заместителями, применялась в первую очередь при разработке новых функциональных материалов для органической фотовольтаики (J. Am. Chem. Soc., 2006, 128, 10, 3459–3466) и в основном была ориентирована на получение симметричных тризамещенных звездообразных производных трифениламина (Faraday Discuss., 2014,174, 313-339). Однако синтез звездообразных молекул относительно сложен, что в результате приводит к высокой стоимости конечных соединений и устройств на их основе. Подобных недостатков лишены аналогичные, но несимметричные донорно-акцепторные молекулы, характеризующиеся простым синтезом, что делает этот класс соединений более перспективным для практического применения (Phys. Chem. Chem. Phys. 2010, 12, 11715–11727; Chem. Commun. 2012, 48, 8907–8909).
К наиболее близким по строению к заявляемым несимметричным люминесцентным донорно-акцепторным молекулам можно отнести схожие соединения, имеющие также трифениламин в качестве электронодонорного фрагмента, тиофен в качестве π-спейсера, но дициановинильные группы в качестве электроноакцепторного фрагмента. Подобные несимметричные молекулы впервые были опубликованы в работах (Phys. Chem. Chem. Phys. 2010, 12, 11715–11727; Chem. Commun. 2012, 48, 8907–8909), где в первой работе были описаны их оптические свойства, а в более поздней работе они были использованы в качестве компонента активного слоя фотовольтаических ячеек.
Дальнейшее развитие подобных несимметричных донорно-акцепторных материалов описано в работе (Adv. Funct. Mater. 2017, 1704039; международная заявка WO2019057196, дата публикации 28.03.2019), где такие несимметричные молекулы изучались с позиции светоизлучающих материалов, направленных, в первую очередь, на дальнейшее практическое применение в системах биологической визуализации в качестве люминесцентного контраста для комбинированной трансмиссионно-эмиссионной томографии. В данной работе авторы, также использовали упомянутые дициановинильные электроноакцепторные группы, но варьировали заместители на трифениламиновых фрагментах.
В патентах RU2667362C2 (дата публикации 19.09.2018) и RU2694209C1 (дата публикации 09.07.2019) раскрываются схожие несимметричные молекулы, но с фенильным и п-фторфенильным заместителем при дициановинильной группе, вместо атома водорода. Однако люминесцентные свойства таких материалов не были изучены и описаны.
Близкая к ранним публикациям молекулярная архитектура, но с использованием индандионовых электроноакцепторных групп вместо исходных дициановинильных была также описана в работе (ChemPlusChem 2016, 81, 637–645).
Стоит отметить, что люминесцентные свойства молекул во всех упомянутых выше работах, не были изучены вовсе или изучены частично, только в разбавленных растворах. Однако, хорошо известно, что оптические характеристики органических материалов в их растворах могут кардинально отличаться от их свойств в блоке или полимерной матрице, т.е. в том виде как они реально используются в большинстве оптоэлектронных устройств. Таким образом, реальный потенциал для практического применения упомянутых выше несимметричных люминесцентных донорно-акцепторных остается неизвестным. Кроме того, примеров соединений с аналогичным строением и обладающих сразу комплексом важных для практического применения свойств (высокий квантовый выход фотолюминесценции в полимерной матрице с излучением и поглощением в широком спектральном диапазоне, высокая термическая стабильность и т.п.) нет.
Как правило, синтез таких соединений основан на проведении реакции конденсации Кнёвенагеля между малононитрилом и полученным заранее альдегидом (Chem. Commun. 2012, 48, 8907–8909; международная заявка WO2019057196, дата публикации 28.03.2019):

Однако, подобные несимметричные люминесцентные донорно-акцепторные молекулы с N-алкил- или N-фенилроданиновыми, N-алкил- или N-фенилдицианороданиновыми, дицианоинданоновыми, алкил- или фенилцианэфирными и 4-метил-, 4-метокси- или 4-нитрофенилакрилонитрильными электроноакцепторными группами, а также метод их получения не описаны. Получение подобных молекул в условиях реакции конденсации Кёвенагеля является не совсем тривиальной задачей, т.к. может быт сопряжен с рядом сложностей, вызванных различной реакционной способностью исходных альдегидных субстратов и прекурсоров электроноакцепторных групп, стерических факторов при их взаимодействии и химической стабильностью в условиях реакции. Помимо этого, упомянутые выше методики синтеза подобных молекул отличаются своей нетехнологичностью, т.к. используют хлорсодержащие органические растворители и дополнительные компоненты для катализа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема, на решение которой направлено заявляемое изобретение, является расширение ассортимента несимметричных люминесцентных донорно-акцепторных молекул.
Технический результат, достигаемый при реализации заявляемого изобретения, заключается в получении новых люминесцентных донорно-акцепторных молекул и материалов на их основе, обладающих эффективным поглощением света в полимерных полистирольных матрицах в диапазоне от 470 до 620 нм, высокими значениями квантового выхода фотолюминесценции от 20 до 50% в диапазоне от желтой (560 нм) до красной (710 нм) области спектра, а также высокой термической устойчивостью.
В данной заявке предлагается расширение ассортимента несимметричных люминесцентных донорно-акцепторных молекул путем использования новых электроноакцепторных групп, таких как N-алкил- или N-фенилроданиновых, N-алкил- или N-фенилдицианороданиновых, дицианоинданоновых, алкил- или фенилцианэфирных и 4-метил-, 4-метокси- или 4-нитрофенилакрилонитрильных электроноакцепторных групп.
Существенной особенностью заявляемого способа получения несимметричных люминесцентных донорно-акцепторных молекул является его более высокая технологичность вследствие использования пиридина как в качестве растворителя, так и катализатора данной реакции.
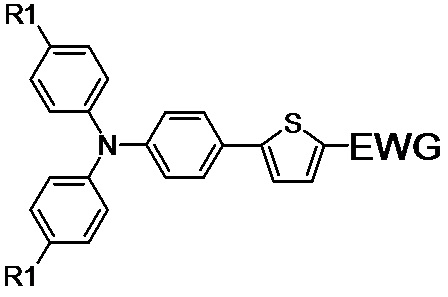
Для решения технической проблемы были получены различные несимметричные донорно-акцепторные молекулы общей формулы (I):
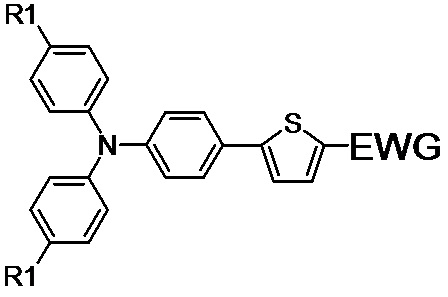 (I),
(I),
где R1 обозначает Н или заместитель, выбранный из ряда: линейные С1-С12, или разветвлённые С3-С20, алкильные группы; линейные С1-С12 или разветвлённые С3-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода;
EWG обозначает электроноакцепторные группы, выбранный из ряда:
N-алкил- или N-фенил- производное 2-тиоксо-1,3-тиазолидин-4-она общей формулы (II-a):
 (II-a),
(II-a),
N-алкил- или N-фенил- производное 2-(дицианометилен)-1,3-тиазолидин-4-она общей формулы (II-b):
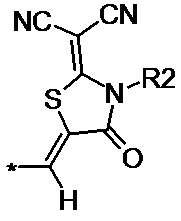 (II-b),
(II-b),
алкил- или фенил- производное цианоацетата общей формулы (II-c):
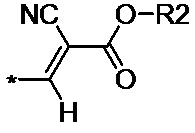 (II-c),
(II-c),
4-метилфенил-, 4-метоксифенил- или 4-нитрофенил- производное ацетонитрила общей формулы (II-d):
 (II-d),
(II-d),
производное 3-(дицианометилен)индан-1-она общей формулы (II-e):
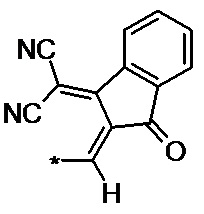 (II-e),
(II-e),
где R2 линейные С1–С6, или разветвленные С3–С12 алкильные, или циклические ароматические фенильные группы; R3 – метил-, метокси- или нитрозаместители.
Оптические свойства новых несимметричных люминесцентных донорно-акцепторных молекул могут варьироваться в широких пределах в зависимости от выбранной электроноакцепторной группы EWG. Это может быть проиллюстрировано, например, как спектрами поглощения, так и их спектрами люминесценции в полистирольных полимерных матрицах (Фиг. 1) по Примерам 2-5, 7. Некоторые оптические характеристики люминесцентных несимметричных донорно-акцепторных молекул, а также их термическая стабильность приведены в Таблице 1 по Примерам 2-9. Как видно из приведенных спектральных данных, заявленные новые несимметричные донорно-акцепторные молекулы обладают интенсивным спектром поглощения в интервале от 470 до 620 нм. Полистирольные полимерные пленки, полученные с добавлением несимметричных донорно-акцепторных молекул, демонстрируют эффективное испускание в широком спектральном диапазоне от желтой (560 нм) до красной (710 нм) области спектра с высокими значениями квантовых выходов фотолюминесценции, от 20 и до 50%. Под высоким квантовым выходом в рамках данного изобретения подразумевается квантовый выход фотолюминесценции не менее 20%. Варьирование как донорных фрагментов, так и различных электроноакцепторных групп, представленное в рамках заявляемого изобретения, позволяет тонко настраивать комплекс физико-химических свойств получаемых на их основе материалов. Приведенные данные являются только примерами, и не ограничивают характеристик заявленных несимметричных люминесцентных донорно-акцепторных молекул.
Также одной из отличительных особенностей заявленных несимметричных донорно-акцепторных молекул является их высокая термическая стабильность, определяемая в рамках данного изобретения как температура потери 5% первоначальной массы при нагревании вещества в инертной атмосфере. Данная температура для различных частных случаев составляет не менее 300оС, преимущественно 340оС. Данные термогравиметрического анализа (ТГА) для Примеров 2-9 приведены в Таблице 1. Приведенные данные являются только примерами и не ограничивают характеристик заявленных несимметричных донорно-акцепторных молекул.
Техническая проблема также решается путем разработки эффективной схемы синтеза новых несимметричных люминесцентных донорно-акцепторных молекул, сводящейся к получению необходимых альдегидов, общего вида (III), с дальнейшим проведением реакции конденсации Кнёвенагеля (J. March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, McGraw-Hill, New York, NY: 1968, pp. 693, 697-698).
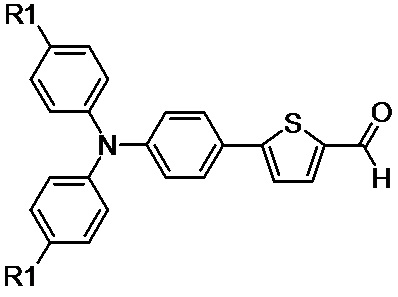 (III)
(III)
Таким образом, ключевой стадией для получения предложенных несимметричных люминесцентных донорно-акцепторных молекул является проведение реакции конденсации между альдегидом, выбранным из ряда соединений общей формулы (III) и различными прекурсорами EWG, имеющими активные метиленовые группы, выбранным из ряда (IVa-e):
 (IV-a);
(IV-a);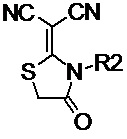 (IV-b);
(IV-b);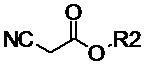 (IV-c);
(IV-c); 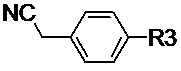 (IV-d);
(IV-d);
 (IV-e),
(IV-e),
где R2 линейные С1–С6, или разветвленные С3–С12 алкильные, или циклические ароматические фенильные группы; R3 – метил-, метокси- или нитрозаместители.
В контексте данного изобретения реакция конденсации Кнёвенагеля между альдегидом, выбранным из ряда соединений общей формулы (III), и прекурсором EWG, выбранным из ряда соединений (IVa-e), приводит к замещению карбонильной группы в альдегиде с образованием несимметричной люминесцентной донорно-акцепторной молекулы общей формулы (I). Общую схему реакции можно представить следующим образом:
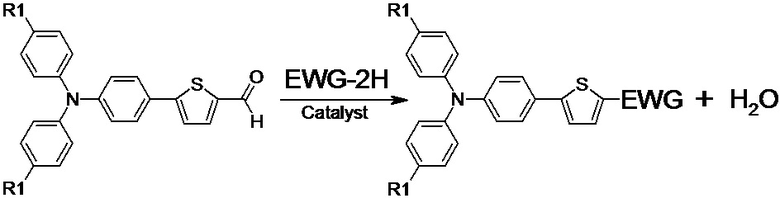
В частности, реакцию конденсации Кнёвенагеля между альдегидом и метиленовым субстратом проводят в различных органических растворителях или их смесях, например, в толуоле, хлорбензоле, тетрагидрофуране, дихлорэтане, хлороформе, пиридине в присутствие основного катализатора в реакционной среде. В качестве катализатора, могут быть использованы различные основания, например, органические (триэтиламин, пиридин, пиперидин, этилат натрия и др.) или неорганические (ацетат аммония, гидроксиды металлов, например, NaOH, KOH, KOH, оксиды, Al2O3 и др., соли) основания, а также их смеси с кислотами Льюиса (AlCl3, TiCl4). Предпочтительно использовать пиридин, поскольку в этом случае, он выполняет функцию как растворителя, так и катализатора. Температурный диапазон проведения реакции в этом случае варьируется от +20 до +150 ºС, предпочтительно проведение реакции при температуре от +80 до +150 ºС, поскольку проведение реакции при повышенных температурах способствует увеличению скорости реакции и повышению выхода целевого продукта. Для этого нагревание реакционной смеси можно проводить как традиционным способом, так и с использованием микроволнового излучения. Предпочтительно нагревание реакции за счёт микроволнового излучения, поскольку в этом случае нагревание происходит более равномерно, без перегрева реакционной массы, что ведёт к уменьшению побочных продуктов и снижению времени реакции.
После окончания реакции продукт конденсации выделяют по известным методикам. Например, добавляют воду и органический растворитель. Органическую фазу отделяют, промывают водой до нейтральной реакции и высушивают, после чего растворитель упаривают. В качестве органического растворителя может быть использован любой не смешивающийся или ограниченно смешивающийся с водой растворитель, например, выбранный из ряда эфиров: диэтиловый эфир, метилтретбутиловый эфир, или выбранный из ряда ароматических соединений: бензол, толуол, ксилол, или выбранный из ряда хлорорганических соединений: дихлорметан, хлороформ, четырёххлористый углерод, хлорбензол. Также для выделения могут использоваться смеси органических растворителей. Выделение продукта можно производить и без применения органических растворителей, например, отгонкой растворителей из реакционной смеси, или любым другим известным методом. Предпочтительным является выделение продукта отгонкой растворителя с последующей очисткой.
Очистку целевого продукта проводят любым известным методом, например, препаративной колоночной хроматографией в адсорбционном или эксклюзионом режиме, перекристаллизацией, дробным осаждением, дробным растворением или их любой комбинацией.
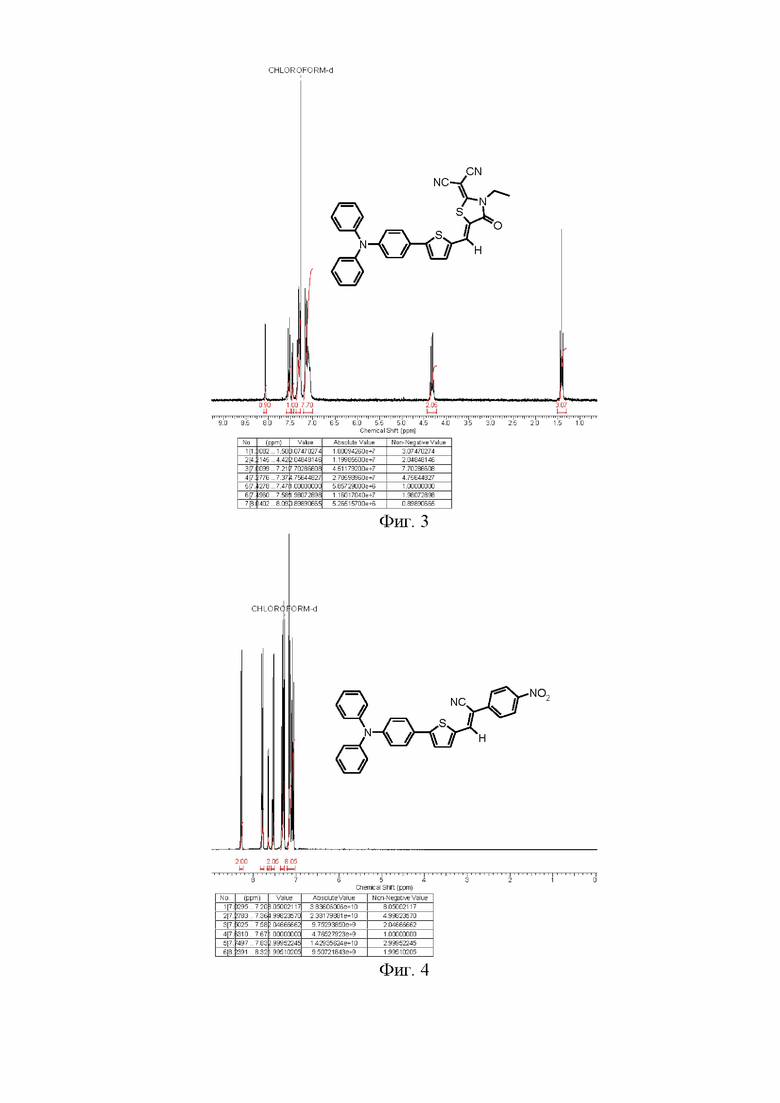
Чистоту и строение полученных несимметричных донорно-акцепторных молекул подтверждают совокупностью данных физико-химического анализа, полученных с помощью таких методов, как хроматографические, спектроскопические, масс-спектрометрические. Наиболее предпочтительным подтверждением чистоты и структуры донорно-акцепторных молекул являются ЯМР-спектры на ядрах 1Н (см. Фиг. 3-4).
Исходные альдегиды, выбранные из ряда соединений общей формулы (III), для синтеза несимметричных люминесцентных донорно-акцепторных молекул получают в две стадии, используя для этого набор реакций органического и металлорганического синтеза. Конкретный пример получения исходного альдегида общей формулы (III), где R1=H, проиллюстрирован ниже (см. Пример 1).
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ РЕАЛИЗАЦИЮ ИЗОБРЕТЕНИЯ
На Фиг.1 в качестве иллюстрации представлены спектры поглощения и люминесценции в полистирольных полимерных матрицах несимметричных донорно-акцепторных молекул по Примерам 2-5, 7.
На Фиг.2 в качестве иллюстрации высокой термической стабильности представлены кривые ТГА в инертной атмосфере несимметричных донорно-акцепторных молекул по Примерам 2-5, 7.
На Фиг.3 представлен 1H ЯМР спектр соединения по Примеру 2.
На Фиг.4 представлен 1H ЯМР спектр соединения по Примеру 7.
Изобретение может быть проиллюстрировано нижеприведёнными примерами синтеза несимметричных люминесцентных донорно-акцепторных молекул (см. Пример 1 и Таблицу 1 c Примерами 3-9). При этом использовали коммерчески доступные реагенты и растворители без дополнительной очистки: 4-бромтрифениламин, тиофен, магний (Mg), бис(дифенилфосфино)ферроцен]дихлорпаладий (2) (Pd(dppf)Cl2), 1.6 М раствор н-бутиллитий (n-BuLi) в гексане, N,N-диметилформамид, N-этилдицианороданин и др. Дополнительные реагенты и вещества были получены, используя описанные в литературе методики. Все реакции, если не оговорено особо, проводили в атмосфере аргона.
Получение альдегидов общей формулы (III), где R1=H для синтеза несимметричных люминесцентных донорно-акцепторных молекул.
Пример 1. Синтез альдегида (3) общей формулы (III), где R1 равно H был осуществлён согласно приведённой ниже схеме:

Получение соединения 2. 4-(дифениламино)фенилтиофен (2) был получен путем реакции кросс-сочетания в условиях Кумады: к раствору 5.52 г (17.0 ммоль) трифениламина монобромида (1) и 83 мг (0.1 ммоль) Pd(dppf)Cl2 в 35 мл сухого ТГФ медленно при перемешивании прикапали 37 мл раствора тиофенмагнийбромида (1eq) в ТГФ, полученного in situ, при охлаждении в инертной атмосфере. После чего температуру реакционной смеси в течении 1 часа увеличили до комнатной с последующим перемешиванием в течение 8 часов. После окончания реакции реакционную смесь вылили в 150 мл дистиллированной воды и экстрагировали диэтиловым эфиром. Органическую фазу отмывали дистиллированной водой и сушили над безводным Na2SO4. Растворитель был отогнан в вакууме и чистый продукт (4.62 г, 83 %) был получен после очистки на хроматографической колонке с силикагелем (элюент гексан:толуол 12:1). 1H ЯМР (250 MГц, CDCl3, δ, м.д.): 7.00-7.17 (перекрывающиеся сигналы, 9H), 7.21-7.32 (перекрывающиеся сигналы, 6H), 7.49 (д, 2Н, J = 8.55 Hz).
Получение соединения 3. 5-[4-(дифениламино)фенил]тиофен-2-карбальдегид 3 был получен следующим образом: 1.6 M раствор н-бутиллитий в гексане (10.4 мл, 16.7 ммоль) был медленно добавлен к раствору соединения 2 (5.43 г, 16.7 ммоль) в 160 мл сухого ТГФ при -78 ºС в инертной атмосфере. После чего перемешивание при температуре -78 ºС было продолжено в течении 1 часа. Затем к реакционной массе добавили одну порцию 1.22 г (16.7 ммоль) безводного N,N-диметилформамида при температуре -78 ºС. После чего температуру реакционной смеси в течении 1 часа увеличили до комнатной. После окончания реакции реакционную смесь вылили в 250 мл дистиллированной воды и экстрагировали диэтиловым эфиром. Органическую фазу отмывали дистиллированной водой и сушили над безводным Na2SO4. Растворитель был отогнан в вакууме и чистый продукт (5.10 г, 87 %) был получен после очистки на хроматографической колонке с силикагелем (элюент дихлорметан:гексан 10:1). 1H ЯМР (250 MГц, CDCl3, δ, м.д.): 7.03-7.20 (перекрывающиеся сигналы, 8H), 7.26-7.36 (перекрывающиеся сигналы, 5H), 7.53 (д, 2H, J = 8.55 Hz), 7.72 (д, 2H, J = 3.97 Hz), 9.87 (c, 1H).
Получение несимметричных люминесцентных донорно-акцепторных молекул.
Пример 2. Общая методика способа получения несимметричных люминесцентных донорно-акцепторных молекул общей формулы (I) посредством реакций конденсации Кнёвенагеля между альдегидом, выбранным из ряда соединений общей формулы (III), и
N-этилдицианороданином, выбранным из ряда соединений общей формулы (IV), приведена ниже на примере полученного выше альдегида (Соединение 3, Пример 1), где R1=H, R2= линейная C2 алкильная группа, общей формулы (IV-b):

Раствор альдегида (3) из Примера 1 (0.80 г, 2.3 ммоль) и N-этилдицианороданина (0.65 г, 3.4 ммоль) в 24 мл сухого пиридина подвергался микроволновому облучению при кипении в течение 8 часов. После завершения реакции реакционную массу упаривали от пиридина на вакууме и чистый продукт (0.86 г, 72 %) был получен после очистки на хроматографической колонке с силикагелем (элюент хлороформ). 1H ЯМР (250 MГц, CDCl3, δ, м.д.): 1.42 (т, 3Н, J = 7.32 Hz), 4.32 (дд, 2H, J1 = 7.02 Hz, J2 = 14.34 Hz), 7.03-7.20 (перекрывающиеся сигналы, 8H), 7.26-7.36 (перекрывающиеся сигналы, 5H), 7.46 (д, 1H, J = 3.97 Hz), 7.54 (д, 1H, J = 8.85 Hz), 8.06 (с, 1H).
Другие примеры (Примеры 3-9) несимметричных люминесцентных донорно-акцепторных молекул общей формулы (I), полученных аналогичным способом, а также некоторые основные физико-химические свойства полученных молекул представлены в Таблице 1.
Таблица №1.
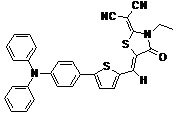
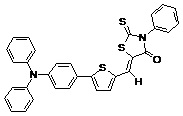

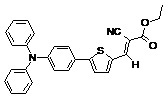
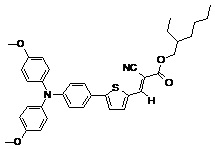
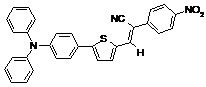

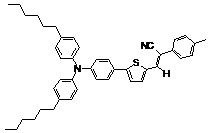
Примечание: PLQY – квантовый выход фотолюминесценции.
| название | год | авторы | номер документа |
|---|---|---|---|
| Донорно-акцепторные олигомеры на основе трифениламина с п-фторфенилдициановинильными электроноакцепторными заместителями и способ их получения | 2017 |
|
RU2694209C2 |
| Донорно-акцепторные сопряженные молекулы и способ их получения | 2014 |
|
RU2624820C2 |
| Донорно-акцепторные олигомеры с фенилдициановинильными заместителями на основе трифениламина и способ их получения | 2015 |
|
RU2667362C2 |
| ДЕНДРОНИЗОВАННЫЕ ПОЛИАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2466156C2 |
| Полимерное соединение и его применение в фотовольтаических устройствах | 2013 |
|
RU2641103C2 |
| ПОЛИАРИЛСИЛАНОВЫЕ ДЕНДРИМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2353629C1 |
| ПОЛИМЕРНАЯ ЛЮМИНЕСЦЕНТНАЯ КОМПОЗИЦИЯ ДЛЯ КОРРЕКЦИИ СВЕТА, ИЗЛУЧАЕМОГО СВЕТОДИОДНЫМИ ИСТОЧНИКАМИ ОСВЕЩЕНИЯ | 2020 |
|
RU2771378C1 |
| Полимерное соединение и его применение в фотовольтаических устройствах | 2013 |
|
RU2640810C2 |
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2396290C1 |
| Олигоарилсилановые люминофоры на основе бензотиадиазола и способ их получения | 2017 |
|
RU2671572C1 |

Группа изобретений относится к области химической технологии органических соединений. Представлены новые несимметричные люминесцентные донорно-акцепторные молекулы общей формулы (I). В другом воплощении обеспечивается способ получения новых несимметричных люминесцентных донорно-акцепторных молекул общей формулы (I). Группа изобретений обеспечивает новые соединения, обладающие эффективным поглощением света в полимерных полистирольных матрицах в диапазоне от 470 до 620 нм, высокими значениями квантового выхода фотолюминесценции от 20 до 50% в диапазоне от желтой (560 нм) до красной (710 нм) области спектра, а также высокой термической устойчивостью. 2 н. и 9 з.п. ф-лы, 4 ил., 1 табл., 2 пр.
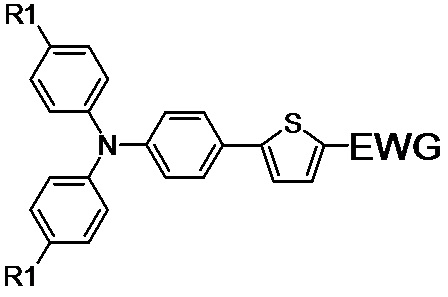
1. Несимметричные люминесцентные донорно-акцепторные молекулы общей формулы (I):
 (I),
(I),
где R1 обозначает Н или заместитель, выбранный из ряда: линейные С1-С12 алкильные группы; линейные С1-С12 алкильные группы, разделенные по крайней мере одним атомом кислорода;
EWG обозначает электроноакцепторную группу, выбранную из ряда:
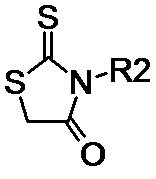
N-алкил- или N-фенил-производное 2-тиоксо-1,3-тиазолидин-4-она общей формулы (II-a):
 (II-a), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
(II-a), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
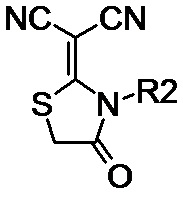
N-алкил- или N-фенил-производное 2-(дицианометилен)-1,3-тиазолидин-4-она общей формулы (II-b):
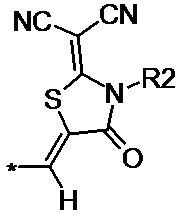 (II-b), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
(II-b), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
алкил-производное цианоацетата общей формулы (II-c):
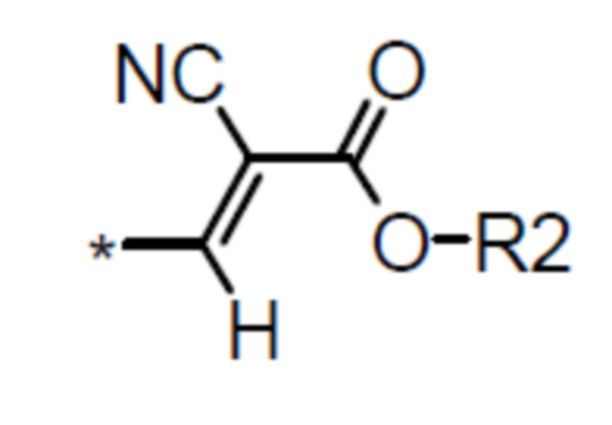 (II-c), где R2 обозначает алкильные линейные С1–С6 или разветвленные С3–С12 группы;
(II-c), где R2 обозначает алкильные линейные С1–С6 или разветвленные С3–С12 группы;
4-нитрофенил-производное ацетонитрила общей формулы (II-d):
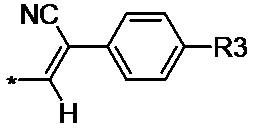 (II-d), где R3 нитрозаместитель.
(II-d), где R3 нитрозаместитель.
2. Несимметричные люминесцентные донорно-акцепторные молекулы по п. 1, отличающиеся тем, что R1 обозначает Н или заместитель, выбранный из ряда: линейные С1-С12 алкильные группы; линейные С1-С12 алкильные группы, разделенные по крайней мере одним атомом кислорода.
3. Несимметричные люминесцентные донорно-акцепторные молекулы по п. 1, отличающиеся тем, что EWG обозначает электроноакцепторную группу, выбранную из ряда соединений формулы (IIa-d).
4. Несимметричные люминесцентные донорно-акцепторные молекулы по п. 1, отличающиеся тем, что максимумы их спектров поглощения в полимерной полистирольной матрице находятся в интервале от 470 нм до 565 нм.
5. Несимметричные люминесцентные донорно-акцепторные молекулы по п. 1, отличающиеся тем, что максимумы их спектров люминесценции в полимерной полистирольной матрице находятся в интервале от 560 нм до 705 нм.
6. Несимметричные люминесцентные донорно-акцепторные молекулы по п. 1, отличающиеся тем, что их квантовый выход фотолюминесценции в полимерной полистирольной матрице составляет не менее 20%.
7. Несимметричные люминесцентные донорно-акцепторные молекулы по п. 1, отличающиеся тем, что обладают высокой термической стабильностью не менее 300оС.
8. Способ получения несимметричных люминесцентных донорно-акцепторных молекул по п. 1, заключающийся в том, что осуществляют реакцию конденсации Кнёвенагеля между альдегидом, выбранным из ряда соединений общей формулы (III):
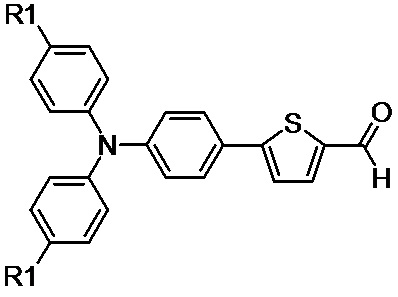 (III),
(III),
где R1 обозначает Н или заместитель, выбранный из ряда: линейные С1-С12 алкильные группы; линейные С1-С12 алкильные группы, разделенные по крайней мере одним атомом кислорода, и различными прекурсорами EWG, имеющими активные метиленовые группы, выбранными из ряда (IVa-d):
 (IV-a), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
(IV-a), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
 (IV-b), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
(IV-b), где R2 обозначает линейные С1–С6 алкильные или фенильную группы;
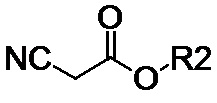 (IV-c), где R2 обозначает алкильные линейные С1–С6 или разветвленные С3–С12 группы;
(IV-c), где R2 обозначает алкильные линейные С1–С6 или разветвленные С3–С12 группы;
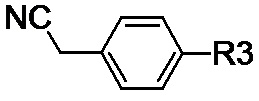 (IV-d), где R3 обозначает нитрозаместитель.
(IV-d), где R3 обозначает нитрозаместитель.
9. Способ по п. 8, отличающийся тем, что реакцию конденсации Кнёвенагеля между альдегидом и различными прекурсорами EWG, имеющими активные метиленовые группы, проводят в среде пиридина или его смеси по крайней мере с одним растворителем, выбранным из ряда толуол, тетрагидрофуран, хлороформ, дихлорэтан, хлорбензол, при этом пиридин является и катализатором.
10. Способ по п. 8, отличающийся тем, что реакцию конденсации Кнёвенагеля между альдегидом и различными прекурсорами EWG, имеющими активные метиленовые группы, проводят при температуре от +20 до +150оС, предпочтительно при температуре от +80 до +150оС.
11. Способ по п. 8, отличающийся тем, что реакцию конденсации Кнёвенагеля между альдегидом и различными прекурсорами EWG, имеющими активные метиленовые группы, проводят при нагревании микроволновым излучением.
| VICTORIEN JEUX et al | |||
| "Push-Pull Triphenylamine Chromophore Syntheses and Optoelectronic Characterizations", CHEMPLUSCHEM, 2015, P | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 2019148644 A1, 16.05.2019 | |||
| CRISTINA SISSA et al | |||
| "The effectiveness of essential-state models in the description of optical properties of branched push-pull chromophores", Physical Chemistry Chemical Physics, | |||
Авторы
Даты
2023-01-24—Публикация
2020-10-19—Подача