Изобретение относится к области химической технологии органических соединений и может найти промышленное применение при получении новых функциональных органических материалов, обладающих полупроводниковыми и фотовольтаическими свойствами. Более конкретно, изобретение относится к донорно-акцепторным молекулам линейного строения и способу их получения.
К донорно-акцепторным сопряженным молекулам в рамках данного изобретения относятся такие органические соединения линейного строения, которые представляют собой молекулы линейного строения, имеющие электронодонорный и электроноакцепторный фрагменты, связанные друг с другом через сопряженный ароматический или гетероароматический спейсер.
Известны разнообразные донорно-акцепторные молекулы как разветвленного (Angew. Chem. Int. Ed. 2005, 44, 2482, Chem. Commun., 2006, 1416-1418; J. Phys. Chem. С 2009, 113, 2636), так и линейного строения (J. Am. Chem. Soc. 2012, 134, 11064; Nature Materials, 11, 44; Adv. Mater. 2011, 23, 5387), содержащие самые различные по природе электроноакцепторные и электронодонорные блоки.
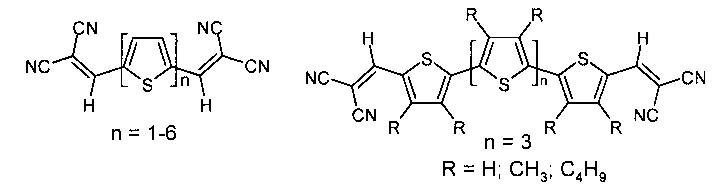
Например, P. Bauerle с соавторами описал ряд олиготиофенов, имеющих донорные олиготиенильные фрагменты и акцепторные дициановинильные заместители (Adv. Funct. Mater. 2007, 17, 2991, Adv. Funct. Mater. 2011, 21, 897).
Наиболее близким по строению к заявляемым донорно-акцепторным сопряженным молекулам, можно отнести соединение, имеющее центральный донорный дитиеносилольный блок, который связан с электроноакцепторными дициановинильными группами через сопряженный битиенильный фрагмент (J. Mater. Chem. А, 2013, 1, 7622).
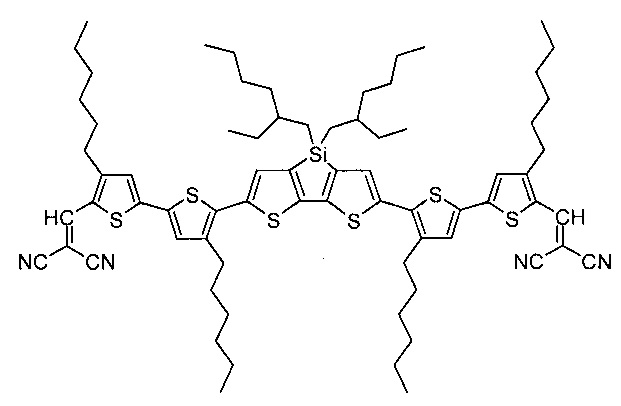
Вышеописанные олигомеры с дициановинильными группами демонстрировали эффективное поглощение в длинноволновой области видимого спектра и были использованы в качестве компонента фотоактивного слоя органических солнечных батарей. Недостатки данных соединений обусловлены их строением. Такие донорно-акцепторные молекулы содержат активные "альдегидные" протоны при дициановинильной группе, что может значительно снижать их стабильность со временем при использовании в устройствах органической электроники. Кроме того, данные соединения не могут иметь концевых алкильных групп, что сильно ограничивает варианты дизайна таких молекул и тонкой настройки их свойств, например, растворимости, фазового поведения, полупроводниковых, структурных и оптических свойств и др.
В данной заявке предлагается использовать новые донорно-акцепторные сопряженные молекулы, имеющие вместо активных "альдегидных" протонов стабильные алкильные группы при дициановинильном фрагменте, что повысит их потенциальную стабильность и позволит использовать концевые алкильные группы для настройки комплекса свойств таких соединений. Для реализации этой идеи при синтезе заявленных донорно-акцепторных сопряженных молекул вместо альдегидных прекурсоров будут использованы кетоновые прекурсоры.
Наиболее близкими к заявленному способу получения донорно-акцепторных сопряженных молекул является синтез звездообразных донорно-акцепторных олигомеров на основе трифениламина (Патент 2012, WO 2012/100908 A1; Organic Electronics 2013, 14, 219; Adv. Energy Mater. 2014, 4, 201301234), для синтеза которых проводили реакцию конденсации Кневенагеля между малононитрилом и звездообразными кетонами:
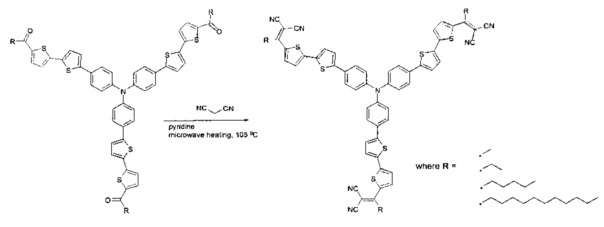
Однако получение линейных донорно-акцепторных сопряженных молекул с использованием данной схемы синтеза не описано.
Задачей заявляемого изобретения является получение нового технического результата, заключающегося в синтезе новых донорно-акцепторных олигомеров, которые могут найти применение, в частности, в качестве фотоактивных, светопоглощающих и светопреобразующих материалов в различных устройствах органической электроники и фотоники, например, в органических солнечных батареях, фотодетекторах и др. В качестве таких свойств в рамках данного изобретения выступают эффективное поглощение света в широком спектральном диапазоне, растворимость в органических растворителях и повышенная термическая стабильность.
Кроме того, задачей данного изобретения является разработка нового способа получения заявленных донорно-акцепторных сопряженных молекул, позволяющего синтезировать продукты заданного строения, высокой чистоты и пригодного к применению в промышленных условиях.
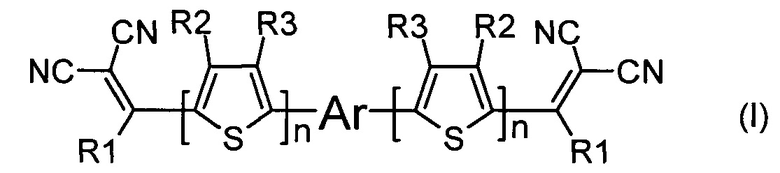
Задача решается тем, что получены донорно-акцепторные сопряженные молекулы общей формулы (I)
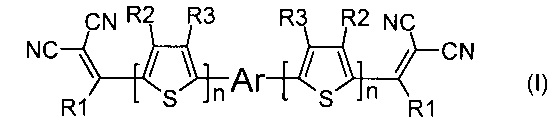
где R1 означает заместители из ряда: линейные C1-C12 или разветвленные С3-С20 или циклические С3-C8 алкильные группы; линейные C1-С12 или разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода; линейные С1-С12 или разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом серы; разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кремния; С2-С20 алкенильные группы; ароматические радикалы из ряда фенил, бензил, п-толил, о-толил, м-толил;
R2 и R3 независимо друг от друга означают Н или заместитель из вышеуказанного ряда для R1;
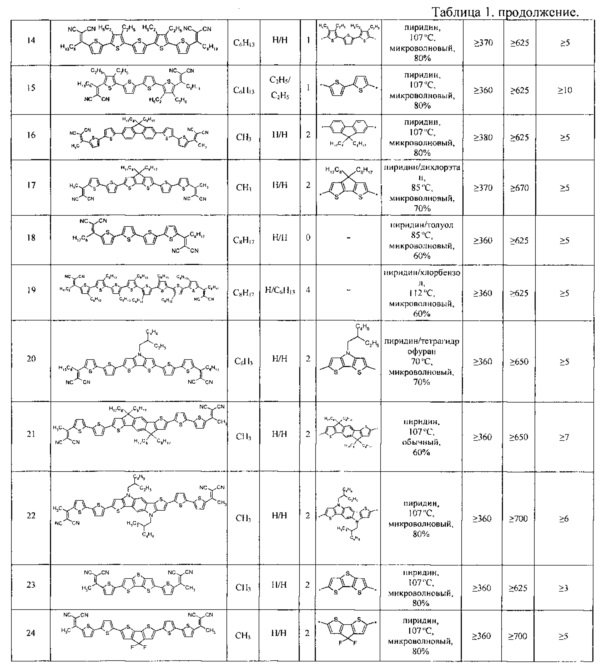
n означает 0 или целое число от 1 до 4;
Ar означает ариленовый или гетероариленовый радикал, выбранный из ряда:
тиенил-2,5-диил общей формулы (II-а)
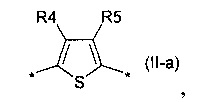
2,2'-битиофен общей формулы (II-b)
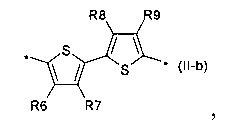
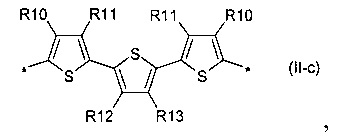
2,2':5',2''-тертиофен общей формулы (II-с)
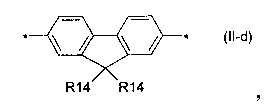
флуорен-4,4'-диил общей формулы (II-d)
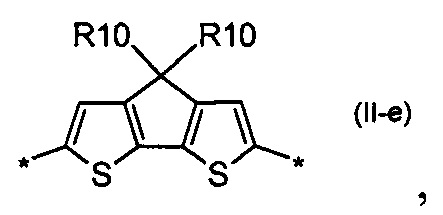
дитиено[3,2-b:2',3'-d]-силол общей формулы (II-е)
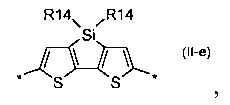
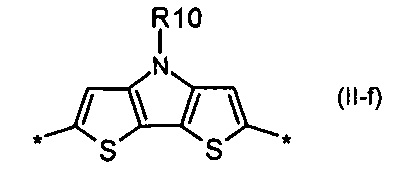
4Н-цикло[2,1-b:3,4-b']дитиофен общей формулы (II-f)
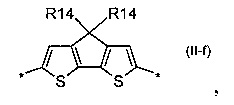
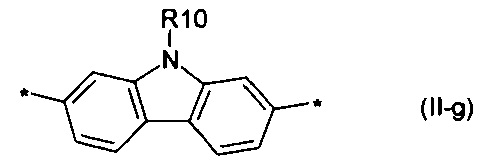
дитиенопиррол общей формулы (II-g)
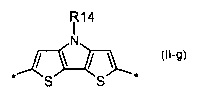
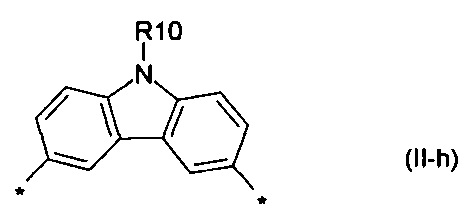
карбазол общей формулы (II-h)
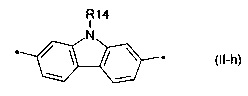
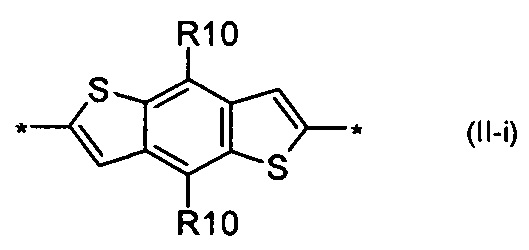
карбазол общей формулы (II-i)
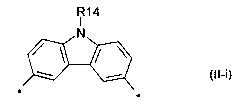
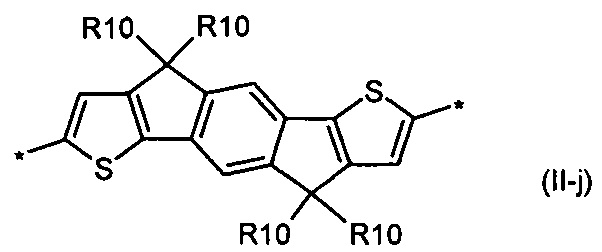
бензо[1,2-b:4,5-b']дитиофен общей формулы (II-j)
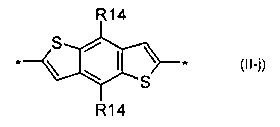
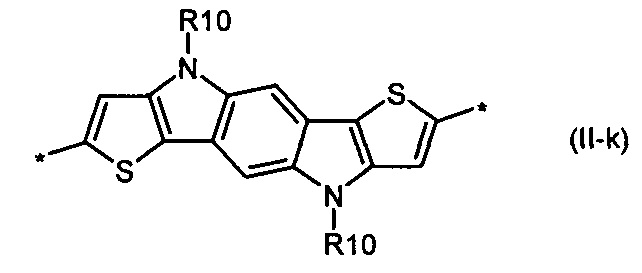
индаценодитиофен общей формулы (II-k)
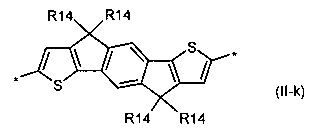
пирролоиндаценотиофен общей формулы (II-l)
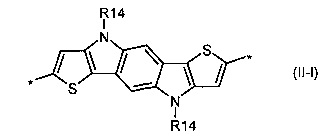
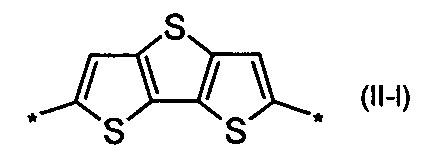
дитиено[3,2-b;2',3'-d]тиофен общей формулы (II-m)
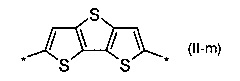
бензотиадиазол общей формулы (II-n):
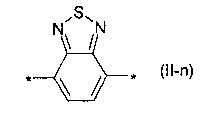
дитиено-тиенотиадиазол общей формулы (II-о):
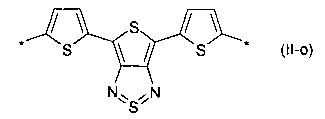
4,4-дифтор-циклопента[2,1-b:3,4-b']дитиофен общей формулы (II-р):
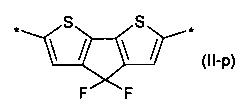
при этом R4-R14, независимо друг от друга означают Н или заместитель из вышеуказанного ряда для R1.
Донорно-акцепторные сопряженные молекулы отличаются тем, что R1 означает линейную С1-С12 или разветвленную С3-С20 алкильную группу.
Донорно-акцепторные сопряженные молекулы отличаются тем, что R2 и R3 означает Н.
Донорно-акцепторные сопряженные молекулы отличаются тем, что n имеет значения от 1-3.
Донорно-акцепторные сопряженные молекулы отличаются тем, что Ar означает дитиено[3,2-b:2',3'-d]-силол, выбранный из ряда соединений формулы (II-е).
Донорно-акцепторные сопряженные молекулы отличаются тем, что Ar означает дитиенопиррол, выбранный из ряда соединений формулы (II-g).
Донорно-акцепторные сопряженные молекулы отличаются тем, что Ar означает карбазол, выбранный из ряда соединений формулы (II-h).
Донорно-акцепторные сопряженные молекулы отличаются тем, что Ar означает карбазол, выбранный из ряда соединений формулы (II-i).
Донорно-акцепторные сопряженные молекулы отличаются тем, что Ar означает бензо[1,2-b:4,5-b']дитиофен, выбранный из ряда соединений формулы (II-j).
Донорно-акцепторные сопряженные молекулы отличаются тем, что R4-R10 при Ar означает линейную С1-С12 или разветвленную С3-С20 алкильную группу.
Донорно-акцепторные сопряженные молекулы отличаются тем, что они характеризуются термической стабильностью не ниже 250°C.
Донорно-акцепторные сопряженные молекулы отличаются тем, что спектры поглощения их тонких пленок толщиной 50-200 нм имеют край поглощения не менее 625 нм.
Донорно-акцепторные сопряженные молекулы отличаются тем, что характеризуются растворимостью не менее 2 мг/мл в о-дихлорбензоле, при комнатной температуре.
Кроме того, в частности, R1 может означать заместители из ряда: линейные С1-С12 или разветвленные С3-С20 или циклические С3-C8 алкильные группы; линейные С1-С12 или разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода; линейные С1-С12 или разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом серы; разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кремния; С2-С20 алкенильные группы; ароматические радикалы из ряда фенил, бензил, п-толил, о-толил, м-толил. Наиболее предпочтительные примеры R1 это линейные C1-C12 или разветвленные С3-С20 алкильные группы. Например, метил, этил, н-гексил, н-октил, 2-этилгексил.
В частности, у тиенильного фрагмента R2 и R3, независимо друг от друга, может означать атом водорода Н или заместитель из вышеуказанного ряда для R1. Предпочтительным примером R2 и R3 у тиенильного фрагмента является Н. В этом случае общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
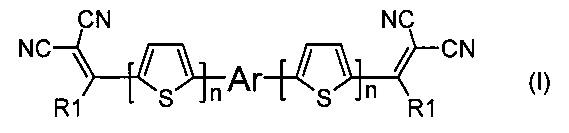
В частности, в донорно-акцепторных сопряженных молекулах n, означающее число сопряженных тиофеновых колец, может иметь значения целых чисел от 0 до 4. Наиболее предпочтительные значения n от 1 до 3, преимущественно 2. Например, в случае, когда n равно 2, то общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
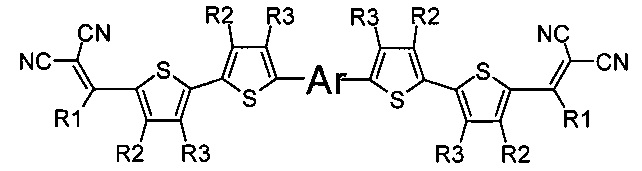
В донорно-акцепторных молекулах Ar означает ариленовый или гетероариленовый радикал, выбранный из вышеуказанного ряда (II-а)-(II-р). Положения, отмеченные в формулах (II-а)-(II-р) знаком * (звездочка), являются точками соединения, в которых структурные фрагменты (II-а)-(II-р) связаны с тиенильным фрагментом, образуя линейную сопряженную цепь. В частности, Ar может обозначать тиенил-2,5-диил общей формулы (II-а), где R4=R5=Н; 2,2'-битиофен общей формулы (II-b), где R6=R9= n-гексил; 2,2':5',2ʺ-тертиофен общей формулы (II-с), где R10-R13=Н; флуорен-4,4'-диил общей формулы (II-d), где R14= n-октил; дитиено[3,2-b:2',3'-d]-силол общей формулы (II-е), где R14= н-октил; 4Н-цикло[2,1-b:3,4-b']дитиофен общей формулы (II-f), где R14= н-октил; дитиенопиррол общей формулы (II-g), где R14= 2-этилгексил; карбазол общей формулы (II-h), где R14= фенил; карбазол общей формулы (II-i), где R14= 2-этилгексил; бензо[1,2-b:4,5-b’]дитиофен общей формулы (II-j), где R14= 2-этилгексил; индаценодитиофен общей формулы (II-k), где R14= н-гексил; пирролоиндаценотиофен общей формулы (II-1), где R14= н-октил; дитиено[3,2-b;2',3'-d]тиофен общей формулы (II-m); бензотиадиазол общей формулы (II-n); дитиено-тиенотиадиазол общей формулы (II-о); 4,4-дифтор-циклопента[2,1-b:3,4-b']дитиофен общей формулы (II-р). Наиболее предпочтительные примеры Ar: дитиено[3,2-b:2',3'-d]-силол, дитиенопиррол, карбазол, бензо[1,2-b:4,5-b’]дитиофен.
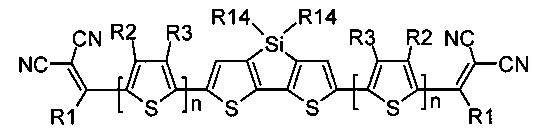
В частности, в случае, когда Ar означает дитиено[3,2-b:2',3'-d]-силол, выбранный из ряда соединений формулы (II-е), то общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
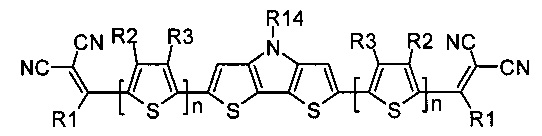
В случае, когда Ar означает дитиенопиррол, выбранный из ряда соединений формулы (II-е), то общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
В случае, когда Ar означает карбазол, выбранный из ряда соединений формулы (II-h), то общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
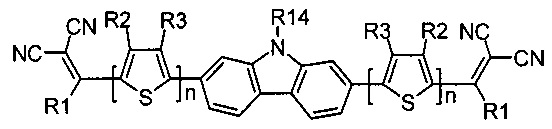
В случае, когда Ar означает карбазол, выбранный из ряда соединений формулы (II-i), то общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
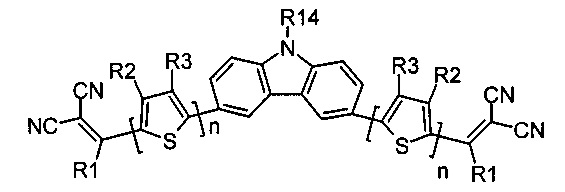
В случае, когда Ar означает бензо[1,2-b:4,5-b']дитиофен, выбранный из ряда соединений формулы (II-j), то общая формула донорно-акцепторных сопряженных молекул имеет следующий вид:
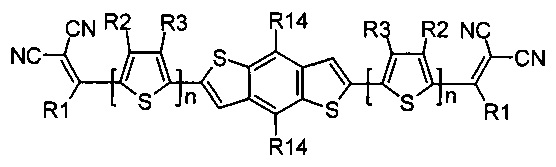
В частности, R4-R14 при Ar независимо друг от друга означают Н или заместитель из вышеуказанного ряда для R1. Предпочтительным примерами R4-R14 при Ar являются линейные С1-С12 или разветвленные С3-С20 алкилы. Например, метил, этил, н-гексил, н-октил, 2-этилгексил и др.
Представленные значения n, R1, R2-R3, R4-R14, Ar являются частными случаями и не исчерпывают все возможные значения и все возможные сочетания значений n, R1, R2-R3, R4-R14, Ar между собой.
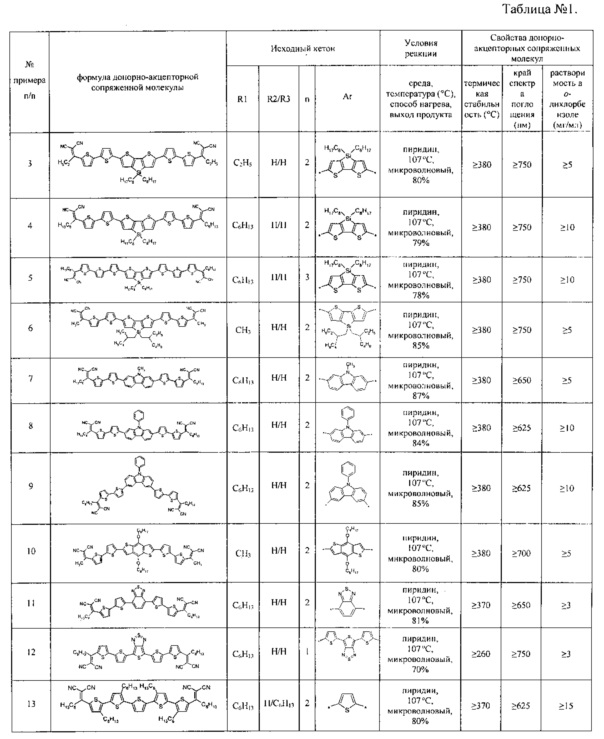
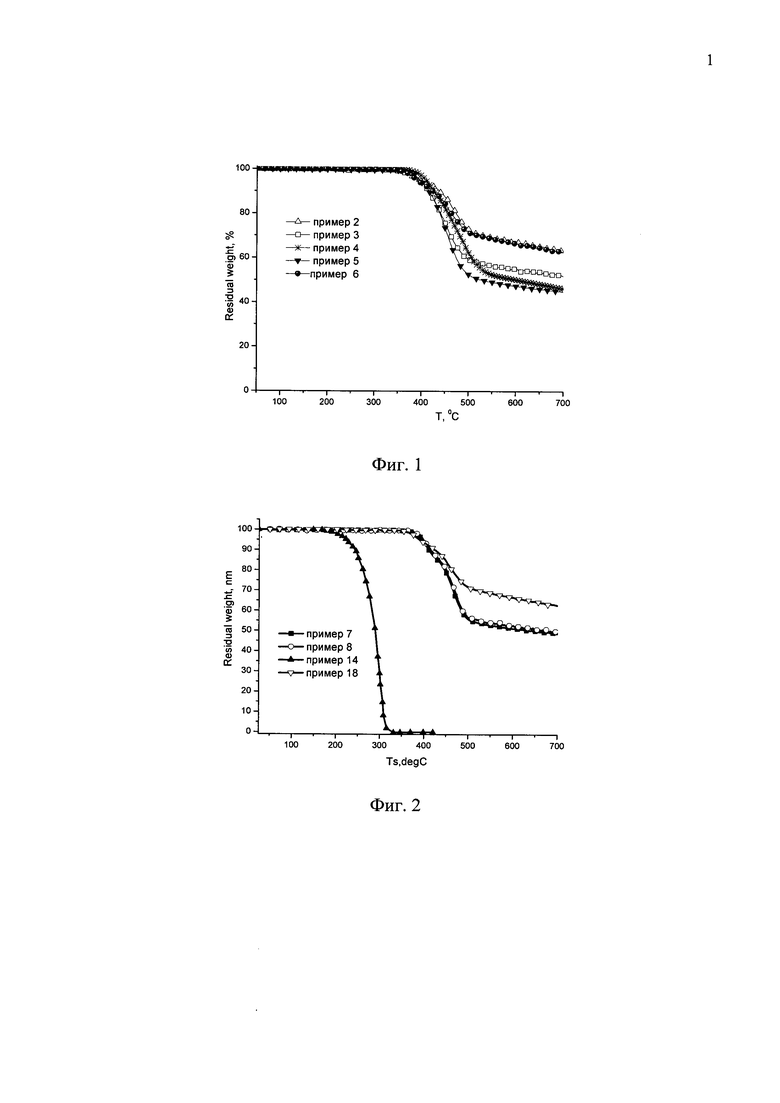
Отличительной особенностью заявленных донорно-акцепторных сопряженных молекул является их высокая термическая устойчивость, подтвержденная на некоторых примерах. В рамках данного изобретения термическая устойчивость определяется как температура потери 5% массы при нагревании вещества в инертной атмосфере. Данная температура для различных частных случаев составляет не менее 250°C, предпочтительно не менее 300°C. Данные термогравиметрического анализа (ТГА), иллюстрирующие высокую термическую стабильность заявленных донорно-акцепторных сопряженных молекул, приведены на Фиг. 1 и Фиг. 2, а также в Таблице 1.
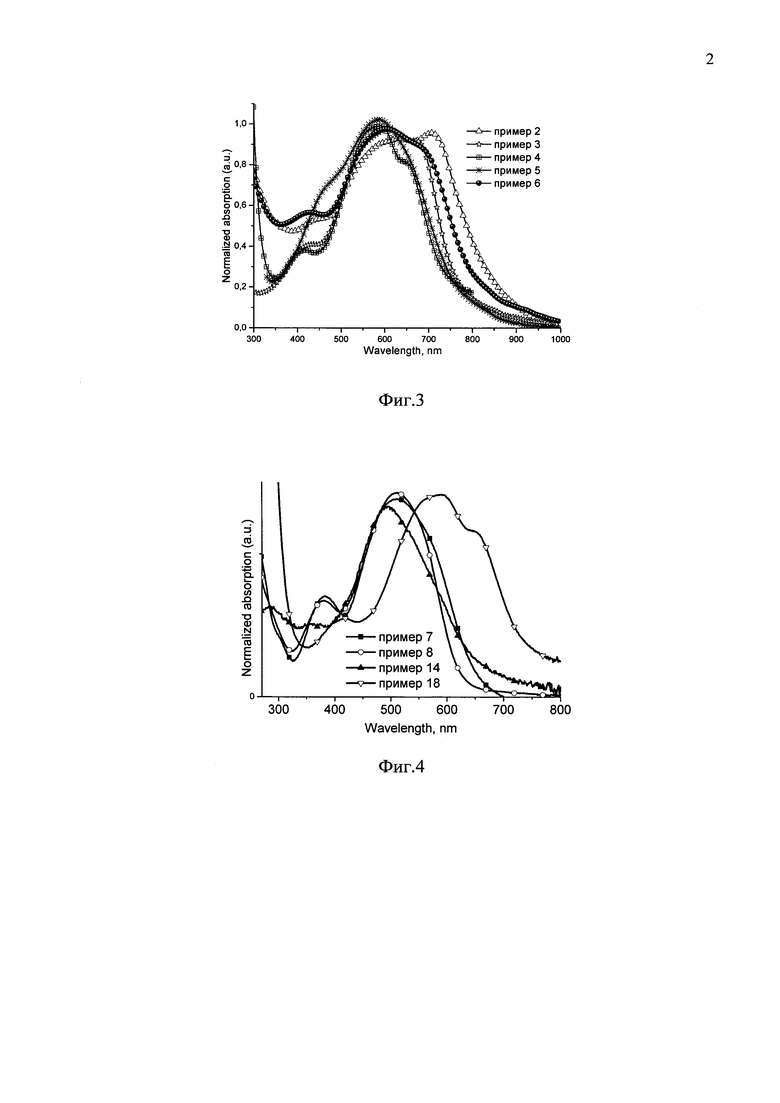
Заявленные донорно-акцепторные сопряженные молекулы содержат дициановинильные группы и сопряженные одинаковые или различные арил- или гетероарилсилановые фрагменты, обладающие эффективным поглощением света. Отличительной особенностью заявленных донорно-акцепторных сопряженных молекул является способность их тонких пленок поглощать свет в длинноволновом диапазоне спектра (400-1000 нм). В рамках данного изобретения способность к поглощению света в длинноволновом диапазоне спектра определяется тем, что спектры поглощения их тонких пленок толщиной 50-200 нм имеют край поглощения не менее 625 нм. Край поглощения для различных частных случаев донорно-акцепторных сопряженных молекул составляет не менее 625 нм, предпочтительно не менее 750 нм. Данные, иллюстрирующие способность заявленных донорно-акцепторных сопряженных молекул в пленках поглощать свет в длинноволновом диапазоне спектра, приведены на Фиг. 3 и Фиг. 4, а также в Таблице 1.
Отличительной особенностью заявленных донорно-акцепторных сопряженных молекул является их растворимость в органических растворителях, например, в тетрагидрофуране, хлороформе, хлорбензоле, о-дихлорбензоле и т.д. Растворимость является важным параметром для возможности использования донорно-акцепторных сопряженных молекул в органических солнечных батареях, поскольку, в этом случае активный слой органических солнечных батарей может быть получен из раствора, а не дорогостоящим вакуумным напылением. В рамках данного изобретения минимальной растворимостью в органических растворителях считается растворимость не менее 2 мг/мл в о-дихлорбензоле, при комнатной температуре. Предпочтительной растворимостью считается растворимость 10 мг/мл о-дихлорбензоле. Данные, иллюстрирующие способность заявленных донорно-акцепторных сопряженных молекул растворятся в о-дихлорбензоле, приведены в Таблице 1.
Приведенные данные являются только демонстрационными примерами, и ни в коей мере не ограничивают характеристик заявленных донорно-акцепторных сопряженных молекул.
Задача решается также тем, что разработан способ получения донорно-акцепторных сопряженных молекул, заключающийся в том, что осуществляют реакцию конденсации Кневенагеля между малононитрилом и кетоном, выбранным из ряда соединений общей формулы (III),
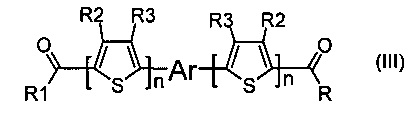
где R1, R2, R3, Ar и n имеют вышеуказанные значения.
В частности, реакцию конденсации Кневенагеля между малононитрилом и кетоном проводят в среде пиридина или его смеси с по крайней мере одним растворителем, выбранным из ряда толуол, тетрагидрофуран, хлороформ, дихлорэтан, хлорбензол, при этом пиридин является и катализатором.
В частности, реакцию конденсации Кневенагеля между малононитрилом и кетоном проводят при температуре от +20 до +150°C, предпочтительно при температуре от +80 до +112°C.
В частности, реакцию конденсации Кневенагеля между малононитрилом и кетоном проводят при нагревании микроволновым излучением.
К реакции конденсации Кневенагеля относят конденсацию альдегидов или кетонов с соединениями, содержащими активную метиленовую группу, с образованием производных этилена. В контексте данного изобретения реакция конденсации Кневенагеля между малононитрилом и кетоном, выбранным из ряда соединений общей формулы (III), приводит к замещению карбонильных групп в кетоне на дициановинильные с образованием донорно-акцепторной сопряженной молекулы общей формулы (I). Общую схему реакции можно представить следующим образом:
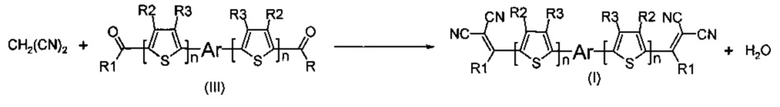
Необходимым условием проведения конденсации Кневенагеля является присутствие катализатора в реакционной среде. В качестве катализатора могут быть использованы различные основания, например, органические (триэтиламин, пиридин, пиперидин, этилат натрия и др). или неорганические (ацетат аммония, гидроксиды металлов, например, NaOH, КОН, КОН, оксиды, Al2O3 и др., соли), основания, а также их смеси с кислотами Льюиса (AlCl3, TiCl4). Предпочтительным основанием является пиридин.
Как правило, конденсацию Кневенагеля проводят в среде органического растворителя. Наиболее предпочтительным является проведение в каталитической среде пиридина без дополнительных органических растворителей. В этом случае пиридин выполняет функцию как растворителя, так и катализатора. Реакцию конденсации Кневенагеля между малононитрилом и кетоном, выбранным из ряда соединений общей формулы (III), можно проводить также в среде, представляющей собой смесь пиридина по крайней мере с одним из растворителей, выбранным из ряда толуол, тетрагидрофуран, хлороформ, дихлорэтан, хлорбензол, при этом пиридин является и катализатором.
Обычно реакцию конденсации Кневенагеля проводят при повышенных температурах с целью увеличения скорости реакции и повышения выхода целевого продукта.
Для проведения реакции конденсации Кневенагеля при повышенных температурах используют нагревание реакционной смеси. Нагревание можно проводить как традиционным способом, так и с использованием микроволнового излучения. Предпочтительно проводить нагревание реакции за счет микроволнового излучения, поскольку в этом случае нагревание происходит более равномерно, без перегрева реакционной массы, что ведет к уменьшению побочных продуктов и снижению времени реакции.
После окончания реакции продукт конденсации выделяют по известным методикам. Например, добавляют воду и органический растворитель. Органическую фазу отделяют, промывают водой до нейтральной реакции и высушивают, после чего растворитель упаривают. В качестве органического растворителя может быть использован любой не смешивающийся или ограниченно смешивающийся с водой растворитель, например, выбранный из ряда эфиров: диэтиловый эфир, метилтретбутиловый эфир, или выбранный из ряда ароматических соединений: бензол, толуол, ксилол, или выбранный из ряда хлорорганических соединений: дихлорметан, хлороформ, четыреххлористый углерод, хлорбензол. Также для выделения могут использоваться смеси органических растворителей. Выделение продукта можно производить и без применения органических растворителей, например, отгонкой растворителей из реакционной смеси, или любым другим известным методом. Предпочтительным является выделение продукта отгонкой растворителя.
Очистку сырого продукта проводят любым известным методом, например, колончатой или препаративной хроматографией в адсорбционном или эксклюзионном режиме, перекристаллизацией, дробным осаждением, дробным растворением или их любой комбинацией.
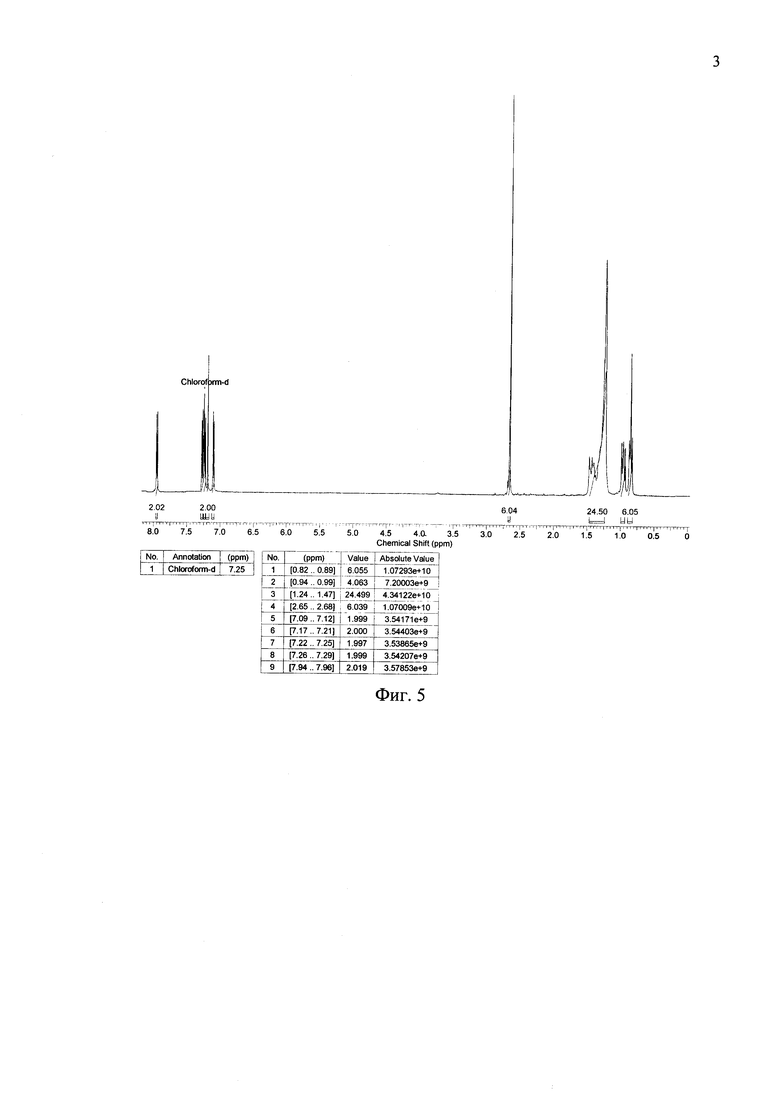
Чистоту и строение синтезированных соединений подтверждают совокупностью данных физико-химического анализа, хорошо известных специалистам, таких как хроматографические, спектроскопические, масс-спектроскопические. Наиболее предпочтительным подтверждением чистоты и структуры донорно-акцепторных сопряженных молекул являются ЯМР-спектры на ядрах 1Н и кривые, полученные гельпроникающей хроматографией (см. Фиг. 5-8).
Полученные заявленным способом донорно-акцепторные сопряженные молекулы имеют термическую стабильность до температуры не менее 250°C, предпочтительно не менее 300°C, край поглощения в тонкой пленке толщиной 50-200 не менее 625 нм, предпочтительно не менее 750 нм и растворимость не менее 2 мг/мл в о-дихлорбензоле при комнатной температуре, предпочтительно не менее 10 мг/мл. В качестве примеров смотри Таблицу 1 и Фиг. 1-4. Сочетание высокой термической стабильности, эффективного поглощения в длинноволновой области спектра и растворимости в органических растворителях делает возможным использование данного типа соединений в качестве фотоактивных, светопоглощающих и светопреобразующих материалов в различных устройствах органической электроники и фотоники, например, в органических солнечных батареях, фотодетекторах и др.
Исходные кетоны, выбранные из ряда соединений общей формулы (III), для синтеза донорно-акцепторных сопряженных молекул получают в несколько стадий, используя для этого реакции органического и металлорганического синтеза в различной последовательности. Конкретный пример получения исходного кетона общей формулы (III), где n равно 2, R1 означает СН3, R2=R3 означает Н, Ar означает дитиено[3,2-b:2',3'-d]-силол общей формулы (II-с), где R14 означает н-октил, проиллюстрирован ниже (см. пример 1).
На Фиг. 1 представлены спектры поглощения тонких пленок донорно-акцепторных сопряженных молекул по примерам 2-6.
На Фиг. 2 представлены спектры поглощения тонких пленок донорно-акцепторных сопряженных молекул по примерам 7-8.
На Фиг. 3 представлены ТГА кривые в азоте донорно-акцепторных сопряженных молекул по примерам 2-6.
На Фиг. 4 представлены ТГА кривые в азоте донорно-акцепторных сопряженных молекул по примерам 7-8.
На Фиг. 5 представлен 1Н ЯМР-спектр соединения по примеру 2.
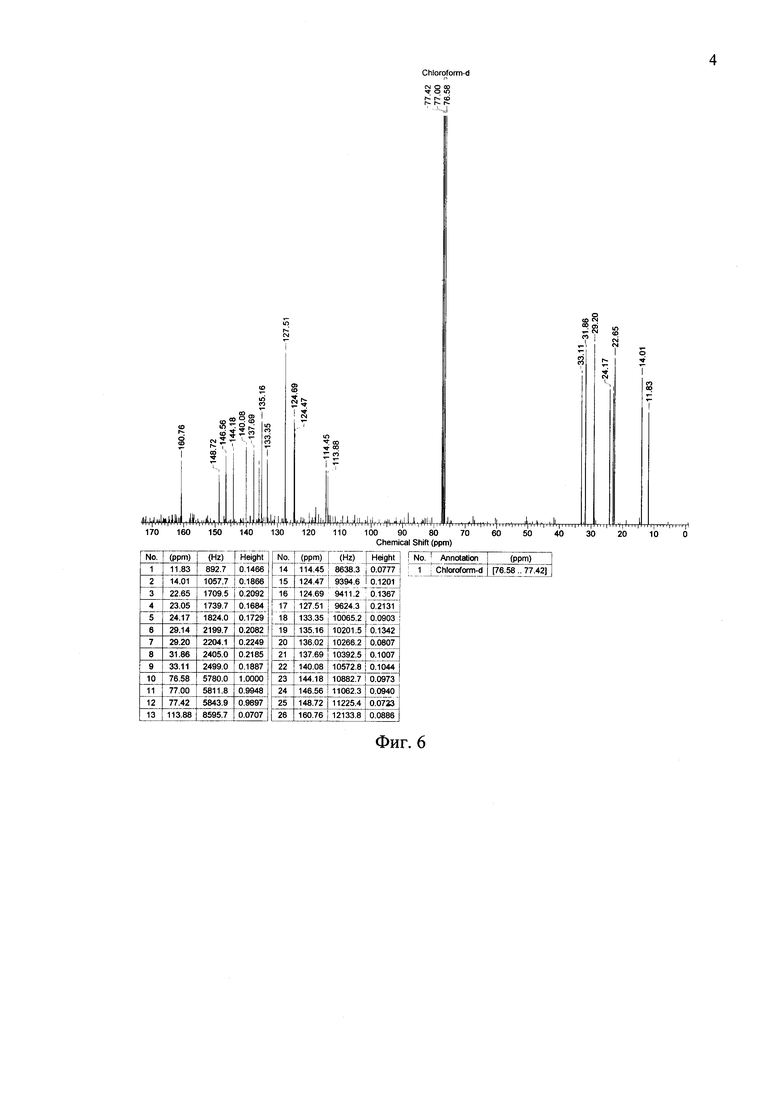
На Фиг. 6 представлен 13С ЯМР-спектр соединения по примеру 2.
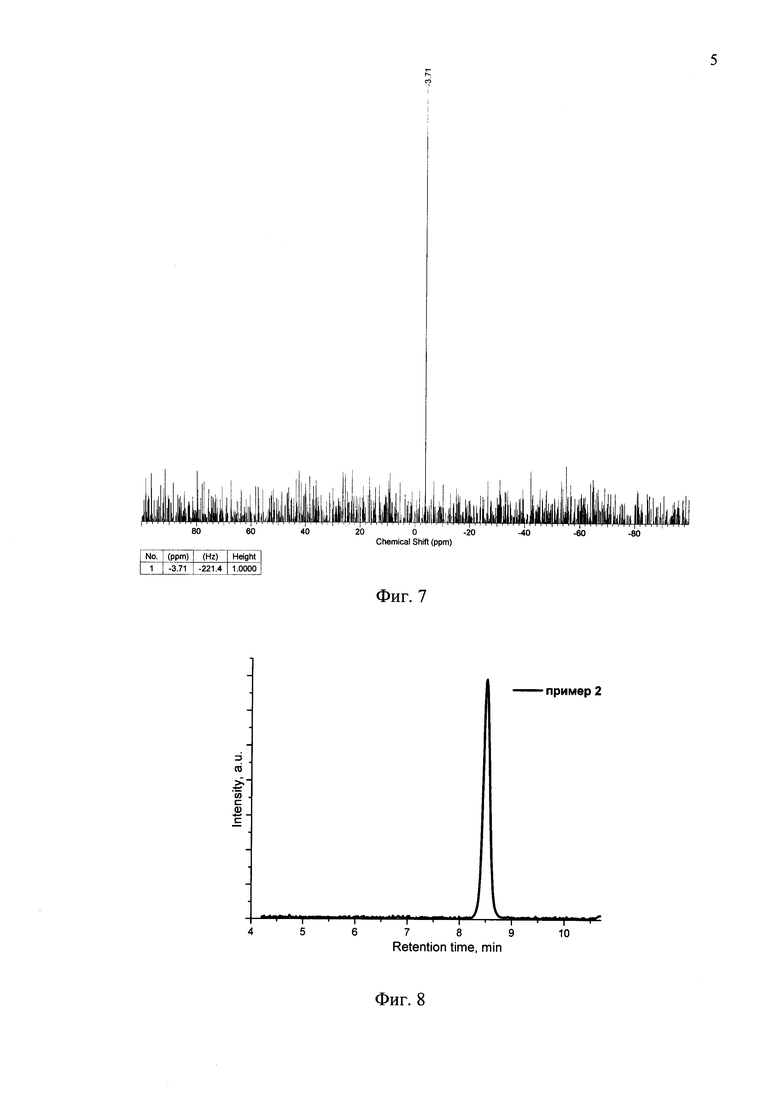
На Фиг. 7 представлен 29Si ЯМР-спектр соединения по примеру 2.
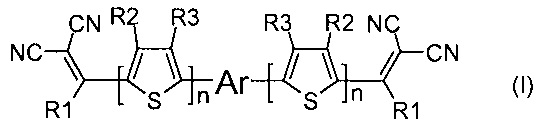
На Фиг. 8 представлены ГПХ кривая соединения, полученного по примеру 2.
Изобретение может быть проиллюстрировано нижеприведенными примерами синтеза донорно-акцепторных сопряженных молекул (см. пример 2 и Таблицу 1 примеры 3-24). При этом использовали коммерчески доступные реагенты и растворители без дополнительной очистки: 1.6 М и 2.5 М растворы н-бутиллития (BuLi) в гексане, тетракис (трифенилфосфин) палладий (0) (Pd(PPh3)4), п-толуолсульфоновая кислота, (p-TosH), малононитрил, ацетилхлорид, пропиноилхлорид, н-гептаноилхлорид, этиленгликоль, 2,2-диметил-1,3-пропандиол, 2,2'-битиофен, 5-бром-2,2'-битиофен, 2-бромтиофен, 5-бром-2,2':5',2ʺ-тертиофен и др. Дополнительные реагенты и вещества были получены, используя описанные в литературе методики. Все реакции, если не оговорено особо, проводили в атмосфере аргона.
Получение кетонов общей формулы (III) для синтеза донорно-акцепторных сопряженных молекул
Пример 1. Синтез кетона (7) общей формулы (III), где n равно 2, R1 означает СН3, R2=R3 означает Н, Ar означает дитиено[3,2-b:2',3'-d]-силол общей формулы (II-с), где R14 означает н-октил, был осуществлен постадийно согласно приведенной ниже схеме:
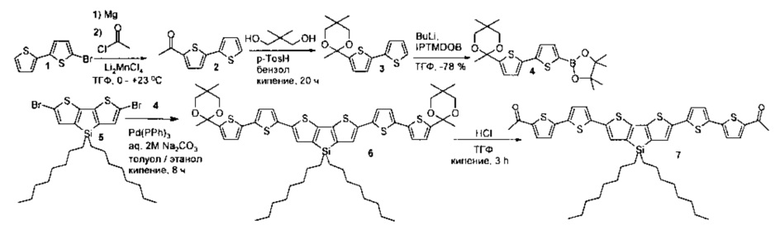
Получение соединения 2. 5-ацетил-2,2'-битиофен (2) был получен следующим образом: раствор 5-бром-2,2'-битиофена (18 г, 73.4 ммоль) в 170 мл сухого ТГФ был добавлен по каплям к суспензии магния (1.8 г, 75.0 ммоль) в 10 мл сухого ТГФ. После чего реакционную смесь перемешивали при нагревании в течение 2 часов и затем охладили до комнатной температуры. Далле полученный реагент Гриньяра прикапали к раствору ацетилхлорида (5.76 г, 73.4 ммоль) и свежеприготовленного Li2MnCl4 (1.84 ммоль) в 50 мл ТГФ при 0°C. После добавления реагента Гриньяра охлаждающую баню убрали и перемешивание продолжили в течение 1 часа. После завершения реакции реакционную смесь вылили в 400 мл холодной дистиллированной воды и трижды экстрагировали диэтиловым эфиром. Затем растворитель отогнали в вакууме. Чистый продукт (11 г, 72%) был получен перегонкой в вакууме (0.2 мБар, 133°C). 1Н ЯМР (250 МГц, CDCl3, δ, ppm): 2.54 (с, 3H), 7.05 (дд, 1Н, J1=3.7, J2=1.1 Гц), 7.15 (д, 1Н, J=4.3 Гц), 7.28-7.33 (перекрывающиеся сигналы, 2Н), 7.58 (д, 1H, J=4.3 Гц). 13С ЯМР (75 МГц, CDCl3): δ [ppm] 26.49, 124.10, 125.60, 126.46, 128.21, 133.31, 136.29, 142.35, 145.74, 190.39. Рассчитано (%) для C10H8OS2: С, 57.66; Н, 3.87; S, 30.79. Найдено: С, 57.41; Н, 3.99; S, 30.83. HRESIMS: найдено m/z 209.0094; рассчитано для [М+Н]+ 209.0100.
Получение соединения 3. 2-(2,2'-битиен-5-ил)-2,5,5-триметил-1,3-диоксан (3) был получен следующим образом: 5-ацетил-2,2'-битиофен (1) (6.0 г, 28.8 ммоль) растворили в сухом бензоле (90 мл). После добавили 2,2-диметил-1,3-пропандиол (12.0 г, 115 ммоль) и р-TosH (1.1 г, 5.8 ммоль). Реакцию перемешивали с насадкой Дина-Старка при кипячении 18 часов, после чего реакцию охладили и добавили 10 мл триэтиламина и реакционную смесь вылили в 200 мл дистиллированной воды и трижды экстрагировали толуолом. Органический слой объединили и посушили над сульфатом натрия, а растворитель отогнали при пониженном давлении. Чистый продукт (7.87 г, 93%) был получен очисткой колончатой хроматографией на силикагеле (элюент, гексан). Белый порошок, Тпл: 66-67°C. 1Н ЯМР (250 МГц, CDCl3, δ, ppm): 0.67 (с, 3H), 1.22 (с, 3H), 1.68 (с, 3H), 3.40 (д, 2Н, J=11 Гц), 3.69 (д, 2Н, J=11 Гц), 6.88 (д, 1Н, J=3.7 Гц), 6.99 (дд, 1Н, J1=3.7 Гц, J2=4.9 Гц), 7.04 (д, 1H, J=3.7 Гц), 7.13 (дд, 1Н, J1=1.2 Гц, J2=3.7 Гц), 7.19 (дд, 1Н, J1=1.2 Гц, J2=4.9 Гц). 13С ЯМР (125 МГц, CDCl3): δ [ppm] 21.91, 22.67, 29.76, 32.27, 72.01, 123.46, 123.63, 124.41, 126.65, 127.82. Рассчитано (%) для C15H18O2S2: С, 61.19; Н, 6.16; S, 21.78. Найдено: С, 61.25; Н, 6.19; S, 21.69. MALDI MS: найдено m/z 294.070; рассчитано для [М]+ 294.075.
Получение соединения 4. 1.6 М раствор бутиллития (13.27 мл, 21.2 ммоль) был прикапан к раствору 3 (6.25 г, 21.2 ммоль) в 220 мл сухого ТГФ при -78°C. После чего реакцию перемешивали при -78°C в течение часа и добавили изопропокси-4,4,5,5-тетраметил-1,3,2-диоксоборолан (4.33 мл, 21.2 ммоль) одной порцией. Затем реакцию перемешивали в течение часа при -78°C и после подняли температуру до комнатной. После завершения реакции реакционную смесь вылили в 200 мл дистиллированной воды, содержащей 21.2 мл 1 М HCl, и трижды экстрагировали диэтиловым эфиром. Затем органический слой посушили над сульфатом натрия, а растворитель отогнали в вакууме. Продукт 8.8 г (99%) был использован в следующей стадии синтеза без дополнительной очистки. Серый порошок, Тпл: 104-105°C. 1Н ЯМР (250 МГц, CDCl3, δ, ppm): 0.67 (с, 3H), 1.22 (с, 3H), 1.34 (с, 12Н), 1.67 (с, 3H), 3.40 (д, 2Н, J=11 Гц), 3.68 (д, 2Н, J=11 Гц), 6.89 (д, 1Н, J=3.7 Гц), 7.09 (д, 1Н, J=3.7 Гц), 7.19 (д, 1Н, J=3.7 Гц), 7.50 (д, 1Н, J=3.7 Гц). 13С ЯМР (125 МГц, CDCl3): δ [ppm] 21.87, 22.62, 24.75, 29.74, 32.21, 71.96, 84.17, 98.57, 124.13, 124.79, 126.35, 137.38, 137.38, 137.92, 144.04, 145.21. Рассчитано (%) для C21H29BO4S2: С, 60.00; Н, 6.95; S, 15.25. Найдено: С, 60.09; Н, 6.98; S, 15.19. MALD1-MS: найдено m/z 420.160; рассчитано для [М]+ 420.114.
Получение соединения 6. В инертной атмосфере к Pd(PPh3)4 (130 мг, 0.11 ммоль) были добавлены дегазированные растворы соединения 5 (0.52 г, 0.9 ммоль) и 4 (0.91 g, 2.2 ммоль) в смеси толуол/этанол (25/2.5 мл), а также водный раствор 2М Na2CO3 (4 мл). Реакционная смесь перемешивалась при кипении в течение 8 часов, после чего она была охлаждена до комнатной и вылита в делительную воронку, содержащую 75 мл дистиллированной воды и 100 мл толуола, и трижды экстрагировали толуолом. Затем органический слой посушили над сульфатом натрия, а растворитель отогнали в вакууме. Чистый продукт был получен хроматографически очисткой на колонке с силикагелем (элюент - толуол). Выход продукта 6 (0.75 г) составил 82%. Темно-красный порошок, Тпл: 133-134°C. 1H ЯМР (250 МГц, CDCl3): δ [ppm] 0.68 (с, 6Н), 0.85 (т, 6Н, J=6.7 Гц), 0.93 (м, М=5, 4Н, J=6.7 Гц), 1.22-1.32 (24Н, перекрывающиеся пики с максимумом при 1.23 ppm), 1.36-1.44 (уширенный сигнал, 4Н), 1.69 (с, 6), 3.42 (д, 2Н, J=11 Гц), 3.70 (д, 2Н, J=11 Гц), 6.90 (д, 2Н, J=3.7 Гц), 7.03 (д, 2Н, J=3.7 Гц), 7.04-7.06 (перекрывающиеся сигналы, 4Н), 7.12 (с, 2Н). 13С ЯМР (125 МГц, CDCl3): δ [ppm] 11.75, 14.11, 21.89, 22.64, 22.66, 24.13, 29.13, 29.23, 29.75, 31.85, 32.23, 33.17, 71.99, 98.59, 123.25, 123.83, 124.25, 126.35, 135.64, 136.38, 137.31, 137.93, 143.17, 144.60, 147.71. 29Si ЯМР (60 МГц, CDCl3, δ, ppm): -4.13. Рассчитано (%) для C54H70O4S6Si: С, 64.63; Н, 7.03; S, 19.17; Si, 2.80. Найдено: С, 64.75; Н, 7.07; S, 19.05; Si, 2.74. MALDI-MS: найдено m/z 1002.030; рассчитано для [М]+ 1002.338.
Получение соединения 7. 1.4 мл 1М HCl добавили к раствору соединения 6 (0.7 g, 0.7 ммоль) в THF (10 мл) и перемешивали реакцию при кипении в течение 3 часов. После чего реакционную смесь охладили, профильтровали. Продукт, полученный на фильтре, обильно промыли водой и посушили в вакууме. Выход продукта 7 (0.57 г) составил 98%. Темно-красный порошок, Тпл: 169-170°C. 1Н ЯМР (250 МГц, CDCl3): δ [ppm] 0.85 (т, 6Н, J=6.7 Гц), 0.94 (м, М=5, 4Н, J=6.7 Гц), 1.21-1.46 (24Н, перекрывающиеся сигналы), 2.54 (с, 6Н), 7.07 (д, 2Н, J=3.7 Гц), 7.13 (д, 2Н, J=3.7 Гц), 7.16 (с, 2Н), 7.21 (д, 2Н, J=3.7 Гц), 7.57 (д, 2Н, J=3.7 Гц). 13С ЯМР (125 МГц, CDCl3): δ [ppm] 11.70, 14.10, 22.66, 24.13, 26.48, 29.13, 29.22, 31.85, 33.15, 123.76, 124.08, 126.42, 126.99, 133.41, 134.32, 137.67, 138.61, 142.17, 143.58, 145.46, 148.20, 190.22. 29Si ЯМР (60 МГц, CDCl3, δ, ppm): -3.97. Рассчитано (%) для C44H50O2S6Si: С, 63.57; Н, 6.06; S, 23.14; Si, 3.38. Найдено: С, 63.60; Н, 6.05; S, 23.07; Si, 3.34. MALDI-MS: найдено m/z 829.951; рассчитано для [M]+ 830.904.
Получение донорно-акцепторных сопряженных молекул.
Пример 2. Общая методика способа получения донорно-акцепторных сопряженных молекул общей формулы (I) реакцией конденсации Кневенагеля между малононитрилом и кетоном, выбранным из ряда соединений общей формулы (III), приведена ниже на примере полученного выше кетона (соединение 7, пример 1), где n равно 2, R1 означает СН3, R2=R3 означает Н, Ar означает дитиено[3,2-b:2',3'-d]-силол общей формулы (II-с), где R14 означает н-октил:
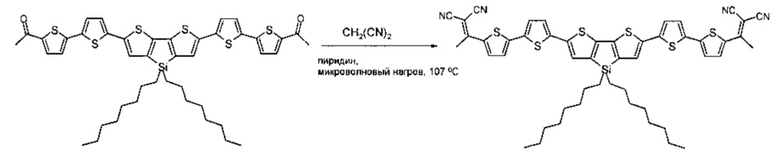
Кетон из примера 1 (0.5 g, 0.6 ммоль), малононитрил (0.24 g, 3.6 ммоль) и сухой пиридин (10 мл) помещаются в реакционный сосуд и перемешиваются в атмосфере азота в течение 8 часов при 107°C, используя контролируемый микроволновый нагрев (107°C). После окончания реакции пиридин отгоняют при пониженном давлении. Продукт очищают методом колончатой хроматографии на силикагеле (элюент дихлорметан), с последующим сокслетированием в спирте. Выход продукта (0.45 г) составил 80%. Черный порошок, Тпл: 247°C. 1Н ЯМР (250 МГц, CDCl3): δ [ppm] 0.86 (т, 6Н, J=6.7 Гц), 0.96 (м, М=5, 4Н, J=6.7 Гц), 1.24-1.47 (24Н, перекрывающиеся сигналы), 2.66 (с, 6Н), 7.10 (д, 2Н, J=3.7 Гц), 7.19 (с, 2Н), 7.23 (д, 2Н, J=4.3 Гц), 7.27 (д, 2Н, J=3.7 Гц), 7.94 (д, 2Н, J=4.3 Гц). 13С ЯМР (75 МГц, CDCl3): δ [ppm] 11.83, 14.01, 22.65, 23.05, 24.17, 29.14, 29.20, 31.86, 33.11, 113.88, 114.45, 124.47, 124.69, 127.51, 133.35, 135.16, 136.02, 137.69, 140.08, 144.18, 146.56, 148.72, 160.76. 29Si NMR (60 МГц, CDCl3, δ, ppm): -3.71. Рассчитано для (%) C50H50N4S6Si: С, 64.75; Н, 5.43; N, 6.04; S, 20.74; Si, 3.03%. Найдено: С, 64.80; Н, 5.45; N, 6.01; S, 20.69; Si, 3.00%. MALDI MS: найдено m/z 926.011; рассчитано для [М]+ 926.213.
Другие примеры (Примеры 3-24) донорно-акцепторных сопряженных молекул общей формулы (I), полученных аналогичным способом, представлены в Таблице 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| Донорно-акцепторные олигомеры с фенилдициановинильными заместителями на основе трифениламина и способ их получения | 2015 |
|
RU2667362C2 |
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2396290C1 |
| ПОЛИАРИЛСИЛАНОВЫЕ МОНОДЕНДРОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2348657C1 |
| ПОЛИМЕРЫ БЕНЗОДИТИОФЕНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ОРГАНИЧЕСКИХ ПОЛУПРОВОДНИКОВ | 2011 |
|
RU2575852C2 |
| ПОЛИАРИЛСИЛАНОВЫЕ ДЕНДРИМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2353629C1 |
| ДЕНДРОНИЗОВАННЫЕ ПОЛИАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2466156C2 |
| Донорно-акцепторные олигомеры на основе трифениламина с п-фторфенилдициановинильными электроноакцепторными заместителями и способ их получения | 2017 |
|
RU2694209C2 |
| Олигоарилсилановые люминофоры на основе бензотиадиазола и способ их получения | 2017 |
|
RU2671572C1 |
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ С РЕАКЦИОННОСПОСОБНЫМИ КОНЦЕВЫМИ ГРУППАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2544863C2 |
| 1',2',5'-тризамещенные фуллеропирролидины, способ их получения и применение в фотовольтаической ячейке | 2015 |
|
RU2669782C2 |
Изобретение относится к новым донорно-акцепторным сопряженным молекулам общей формулы (I),
 .
.
Технический результат: новые соединения, отличаются растворимостью в органических растворителях, высокой термической стабильностью и эффективным поглощением света в длинноволновой области спектра, кроме того, способ их получения технологичен. 12 з.п. ф-лы, 8 ил., 1 табл., 23 пр.
1. Донорно-акцепторные сопряженные молекулы общей формулы (I),
где R1 означает одинаковые заместители из ряда: линейные С1-С12 или разветвленные С3-С20 или циклические С3-С6 алкильные группы; ароматический радикал фенил;
R2 и R3, независимо друг от друга, означают Н или линейные С1-С12 или разветвленные С3-С20 алкильные группы;
n означает 0 или целое число от 1 до 4;
Ar означает ариленовый или гетероариленовый радикал, выбранный из ряда:
тиенил-2,5-диил общей формулы (II-а)
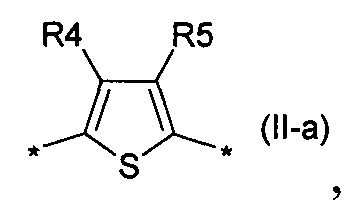
2,2'-битиофен общей формулы (II-b)
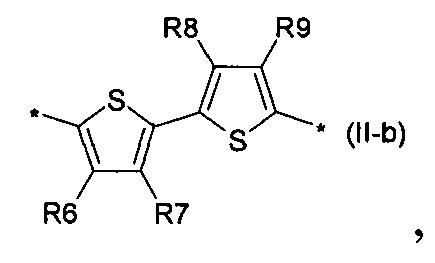
флуорен-4,4'-диил общей формулы (II-с)
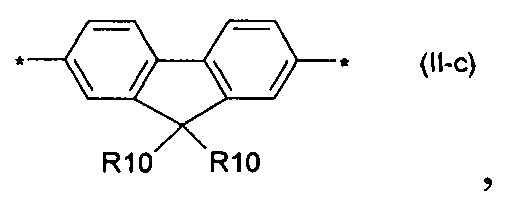
дитиено[3,2-b:2',3'-d]-силол общей формулы (II-d)
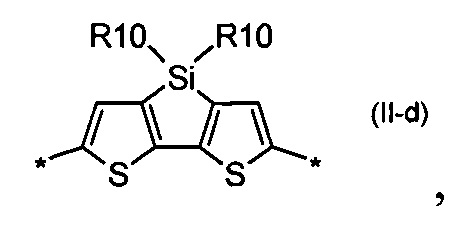
4Н-цикло[2,1-b:3,4-b']дитиофен общей формулы (II-е)
дитиенопиррол общей формулы (II-f)
карбазол общей формулы (II-g)
карбазол общей формулы (II-h)
бензо[1,2-b:4,5-b']дитиофен общей формулы (II-i)
индаценодитиофен общей формулы (II-j)
пирролоиндаценотиофен общей формулы (II-k)
дитиено[3,2-b;2',3'-d]тиофен общей формулы (II-l)
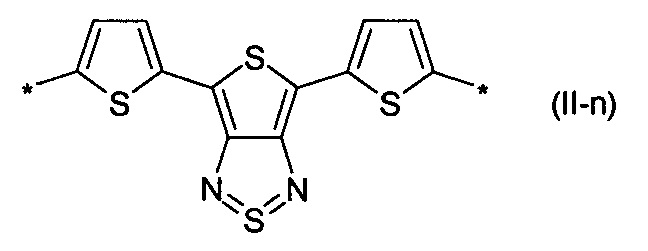
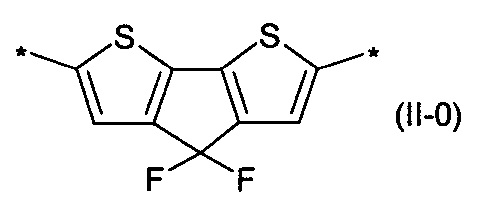
бензотиадиазол общей формулы (II-m):
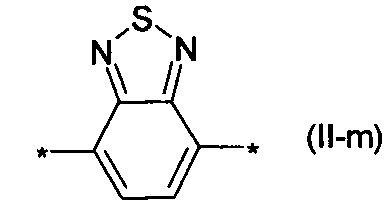
дитиено-тиенотиадиазол общей формулы (II-n):
4,4-дифтор-циклопента[2,1-b:3,4-b']дитиофен общей формулы (II-о):
при этом R4-R10, независимо друг от друга, означают Н или линейные С1-С12 или разветвленные С3-С20 алкильные группы или ароматический радикал фенил.
2. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что R1 означает линейную С1-С12 или разветвленную С3-С20 алкильную группу.
3. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что R2 и R3 означает Н.
4. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что n имеет значения 1-3.
5. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что Ar означает дитиено[3,2-b:2',3'-d]-силол, выбранный из ряда соединений формулы (II-d).
6. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что Ar означает дитиенопиррол, выбранный из ряда соединений формулы (II-f).
7. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что Ar означает карбазол, выбранный из ряда соединений формулы (II-g).
8. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что Ar означает карбазол, выбранный из ряда соединений формулы (II-h).
9. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что Ar означает бензо[1,2-b:4,5-b']дитиофен, выбранный из ряда соединений формулы (II-i).
10. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что R4-R10 при Ar означает линейную С1-С12 или разветвленную С3-С20 алкильную группу.
11. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что они характеризуются термической стабильностью не ниже 250°С.
12. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что спектры поглощения их тонких пленок толщиной 50-200 нм имеют край поглощения не менее 625 нм.
13. Донорно-акцепторные сопряженные молекулы по п. 1, отличающиеся тем, что характеризуются растворимостью не менее 2 мг/мл в о-дихлорбензоле, при комнатной температуре.
| WO 2009112319 A1, 17.09.2009 | |||
| Mishra, Amaresh; Uhrich, Christian; Reinold, Egon; Pfeiffer, Martin; Baeuerle, Peter, Advanced Energy Materials, 1(2), 265-273, 2011 | |||
| Garratt, P | |||
| J.; Vollhardt, K | |||
| Peter C., Journal of the American Chemical Society, 94(3), 1022-4, 1972 | |||
| СПОСОБ ПОЛУЧЕНИЯ ТОНКОПЛЕНОЧНЫХ ПОЛУПРОВОДНИКОВЫХ УСТРОЙСТВ НА ОСНОВЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | 2000 |
|
RU2214651C2 |
Авторы
Даты
2017-07-07—Публикация
2014-07-09—Подача