Изобретение относится к медицине, в частности к хирургии и онкологии и может быть использовано в комбинированном лечении пациентов со злокачественными заболеваниями пищевода.
Рак пищевода злокачественное заболевание, занимающее 10 место по уровню заболеваемости и 6 место по уровню смертности в мире (Sung H. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries // CA. Cancer J. Clin. Wiley, 2021. Vol. 71, № 3. P. 209-249). Чаще заболеванию подвержены мужчин в возрасте от 60 до 80 лет. Основными факторами риска возникновения рака пищевода являются курение, злоупотребление алкоголем, метаплазия эпителия пищевода (пищевод Баррета). Основными клиническими проявлениями рака пищевода являются дисфагия, одинофагия и как результат потеря веса, кахексия. Зачастую пациенты обращаются к специалисту, когда дисфагия достигает II-III степени. Согласно современным рекомендациям российского общества клинической онкологии пациенты с клинически установленной II-III стадией опухолевого процесса могут рассматриваться кандидатами как на самостоятельное хирургическое или химиолучевое (ХЛ) лечение, так и на комбинированную терапию. Однако в рамках подготовки к любому виду лечения пациенты с клиникой дисфагии должны получить соответствующее лечение с целью купирования явлений нутритивной недостаточности. Пациентам с дисфагией II-IV степени перед проведением химиолучевой терапии (ХЛТ) по радикальной программе или комбинированного лечения рекомендовано формирование гастростомы, либо, при невозможности, энтеростомы для обеспечения адекватного доступа для энтерального питания. Хирургический компонент лечения при злокачественных заболеваниях включает в себя выполнение оперативного вмешательства в объеме субтотальной резекции пищевода либо экстирпации пищевода с последующей одномоментной, либо отсроченной пластикой. Наиболее часто в качестве материала для выполнения пластики пищевода используется желудок, из которого выкраивается трубчатый стебель и анастомозируется с остающимся участком пищевода. Вышеописанные оперативные вмешательства ассоциированы с высоким риском послеоперационных осложнений и высоким уровнем послеоперационной смертности. Наиболее частым осложнением у данных пациентов, ведущим к летальному исходу, является несостоятельность анастомоза, которая развивается ввиду нарушений кровоснабжения желудочного стебля. Для снижения частоты и тяжести данного осложнения предпринимается комплекс интра и периоперационных мероприятий. Одним из которых является прекондиционирование желудка посредствам редукции кровотока по «уходящим» сосудам, кровоснабжающим тело и дно желудка.
На сегодняшний день существует огромное количество различных вариаций формирования гастростомы, однако ни один до конца не удовлетворяет всем необходимым условиям. Идеальная гастростома должна быть проста в исполнении, не должна травмировать часть желудка, которая в дальнейшем будет использоваться для формирования трубчатого трансплантата, должна обеспечивать возможность адекватного энтерального питания и не должна снижать качество жизни пациента.
Известен способ гастростомии по Beck-Carrel-Jianu (Welch, C.E.: Surgery of the Stomach and Duodenum, Yearbook Publishers, Inc., Chicago, 1955, pp. 68-85) при данном способе из большой кривизны желудка выкраивают желудочную трубку с основанием ко дну желудка. Открыто или лапароскопически обеспечивают доступ в брюшную полость. Осуществляют доступ в сальниковую сумку путем рассечения желудочно-ободочной связки с сохранением желудочно-сальниковой аркады. Правые желудочно-сальниковые сосуды пересекают на уровне антрального отдела. Желудок растягивают, вдоль большой кривизны с небольшим отступом от края желудок рассекают. Формируют желудочная трубка по большой кривизне желудка. Сформированная трубка должна быть достаточной длины для выведения на переднюю брюшную стенку без натяжения и достаточной ширины для заведения желудочного зонда. Края желудка погружают непрерывными швами. Желудочную трубку через небольшой разрез выводят на переднюю брюшную стенку, узловыми швами фиксируют к коже. В просвет заводят зонд.
Данный способ-аналог позволяет обеспечить возможность адекватного энтерального питания, однако не позволяет сохранить желудок для использования в качестве трансплантата для последующей пластики, что заведомо принуждает хирурга к использованию в качестве трансплантата участок толстой кишки, что несет большие риски для пациента.
Известна гастростомия по Кадеру (Островерхов Г.Е., Лубоцкий Д.Н., Бомаш Ю.М. Курс оперативной хирургии и топографической анатомии. - М.: Медгиз, 1963. - С. 602-605). При данном способе на передней стенке желудка формируют вертикальный трубчатый свищ путем наложения трех рядов кисетных швов. После лапаротомии на передней брюшной стенке накладывают кисетный шов таким образом, что в центре кисетного шва формируется отверстие, в которое заводится желудочный зонд. Кисетный шов затягивают на трубке. Накладывают второй ряд кисетного шва на расстоянии около сантиметра от предыдущего, затягивают, и по схожей схеме накладывают третий ряд. Гастростому выводят на переднюю брюшную стенку через небольшой разрез в левой подреберной области или левом мезогастрии, фиксируют к передней брюшной стенке узловыми швами. В конце операции гастростомическую трубку прикрепляют узловым швом к коже. Данный способ-аналог так же, как и предыдущий справляется со своей задачей обеспечения возможности адекватного энтерального питания. Однако не позволяет использовать желудок для последующей пластической операции и не снижает травматичность оперативного пособия. Желудок после данного вида оперативного вмешательства абсолютно не пригоден для последующей пластики.
Наиболее близким по достигаемому результату является способ гастростомии по Черноусову (Черноусов А.Ф., Воронов М.Е., Ручкин Д.В. Гастростомия как этап эзофагопластики // Хирургия. - 2000. - №12. - С. 23-26). Суть его заключается в формировании по малой кривизне желудка трубчатого свища с горизонтальным каналом, выстланным серозной оболочкой и грануляционной тканью. После лапаротомии выполняют полную мобилизацию малой кривизны желудка. На мобилизованный участок малой кривизны укладывают гастростомическую трубку, которую фиксируют к желудку 6-8 швами, формируя канал. Далее у конца гастростомической трубки накладывают кисетный шов и выполняют гастротомию в центе сформированного шва. В образовавшееся отверстие вводят конец трубки и фиксируют его, завязывая кисетный шов. Кисетный шов укрывают 2-3 серо-серозными швами для большей герметизации. У противоположного конца трубки формируют 2 полкисетных шва. Выводят гастростомическую трубку с двумя наложенными полукисетными швами на переднюю брюшную стенку в левом подреберье через отдельный разрез. Концы полукисетных швов проводят через все слои брюшной стенки, выкалывая по краям разреза рядом с трубкой, после чего полукисетные швы завязывают. Концами полукисетных швов обвязывают гастростомическую трубку со стороны кожи. Дополнительно фиксируют переднюю стенку желудка со стороны брюшной полости к париетальной брюшине передней брюшной стенки узловыми серозно-мышечными швами. Данный способ в большинстве случаев позволяет сохранить желудок для последующей пластики, при этом обеспечив энтеральный доступ и снизив частоту заброса желудочного содержимого по гастростоме. Однако данный способ требует выполнения лапаротомии, что увеличивает травматичность оперативного вмешательства, так же травмируется достаточно большой объем желудка необходимый для формирования канала для трубки, формирования гастротомии, кисетного шва с последующим укрыванием серозными швами.
Задачей предлагаемого изобретения является обеспечение возможности адекватного энтерального питания пациентам с дисфагией, а также подготовка желудочного стебля для последующей пластики.
Техническим результатом использования предполагаемого изобретения является обеспечение возможности адекватного энтерального питания, подготовка желудка для использования в качестве трансплантата при последующей пластике, меньшая травматичность операции у пациентов со злокачественными заболеваниями пищевода с клиникой дисфагии, высоким риском развития нутритивной недостаточности и высоким риском интраоперационных и ранних послеоперационных осложнений, связанных с гемодинамическими нарушениями в желудочном стебле, используемом для пластики после резекции пищевода.
Технический результат достигается тем, что в способе, включающем, лапароскопический доступ, выделяют левую желудочную артерию на протяжении и клипируют, по малой кривизне желудка в супрапилорическом отделе выделяют площадку для сшивающего аппарата, через зачищенную площадку заводят сшивающий аппарат, располагают его в продольном направлении относительно стенки ближе к малой кривизне, сшивающим аппаратом выполняют транссекцию желудка, сохраняя достаточные для прохождения пищи просветы, выводят сформированный антиперистальтический лоскут из малой кривизны желудка на переднюю брюшную стенку, выведенный конец лоскута срезают, в просвет устанавливают зонд.
Обеспечение возможности адекватного энтерального питания осуществляется за счет формирования трубчатой гастростомы из малой кривизны желудка, что позволяет сохранить оставшуюся части органа для последующей пластики. Снижение травматичности оперативного вмешательства достигается по средствам выполнения операции в лапароскопическом варианте. Прекондиционирование желудка путем клипирования левой желудочной артерии способствует перераспределению кровотока по оставшимся сосудам и «тренировке» желудочного стебля для последующей пластической операции, что ведет к снижению частоты послеоперационных осложнений. То, что лоскут выкраивается из малой кривизны путем рассечения желудка при помощи сшивающего аппарата, позволяет сохранить часть желудка по большой кривизне для формирования трубчатого трансплантата для последующей пластики после операций на пищеводе, а также способствует снижению частоты заброса желудочного содержимого по гастростоме.
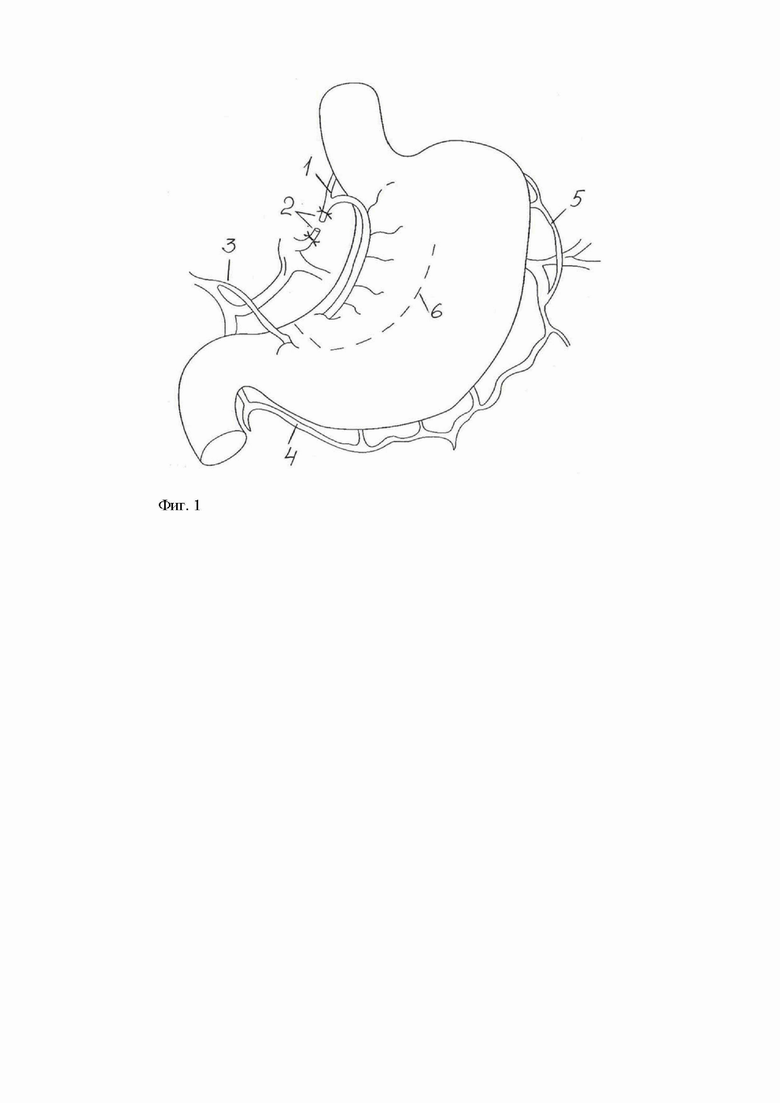
Способ поясняется фиг. 1, где: поз. 1 - левая желудочная артерия, поз. 2 - клипирование, поз. 3 - правая желудочная артерия, поз. 4 - правая желудочно-сальниковая артерия, поз. 5 - левая желудочно-сальниковая артерия, поз. 6 - линия транссекции.
Предлагаемый способ осуществляют следующим образом. Пациенту, у которого в начале или в процессе проведения неоадъювантной ХЛТ отмечается клиника дисфагии, выполняют хирургическое вмешательство лапароскопическим доступом. Формируют карбоксиперитонеум. Устанавливают оптический троакар в параумбиликальной области и 4 рабочих троакара: в правой подреберной области, в правой мезогастральной области, троакар в левой мезогастральной области (опциональный) и в левой подреберной области (предполагаемая зона выведения стомы на кожу). Вскрывают малый сальник для доступа в сальниковую сумку, выполняют лимфодиссекцию 7 группы лимфоузлов, выделяют левую желудочную артерию (ЛЖА) (Фиг. 1, поз. 1) на протяжении и клипируют (Фиг. 1, поз. 2). По малой кривизне желудка в супрапилорическом отделе выделяют площадку для сшивающего аппарата. Сохраняют для обеспечения адекватного кровоснабжения желудка правую желудочную артерию (Фиг. 1, поз. 3), правую желудочно-сальниковую артерию (Фиг. 1, поз. 4), левую желудочно-сальниковую артерию (Фиг. 1, поз. 5). Через троакар в правой подреберной области заводят сшивающий аппарат. Желудок растягивают. Через зачищенную площадку заводят сшивающий аппарат на желудок и располагают в продольном направлении относительно стенки, ближе к малой кривизне. Выполняют транссекцию желудка при помощи сшивающего аппарата так, чтобы сохранить достаточные просветы для прохождения пищи (Фиг. 1, поз. 6). Осуществляют гемостаз по ходу степлерного шва. Сформированный антиперистальтический лоскут из малой кривизны желудка выводят на переднюю брюшную стенку в проекции установленного в левой подреберной области троакара. Выведенный конец лоскута срезают в просвет, устанавливают желудочный зонд. Гастростому фиксируют к коже узловыми швами «сероза к коже». Зонд фиксируют дополнительными узловыми швами к коже. При необходимости накладывают дополнительные швы, фиксирующие серозу к париетальной брюшине. Троакарные раны ушивают.
Клинический пример
Пациентка В. 66 лет, в связи с явлениями дисфагии, одинофагии, снижения массы тела на 30 кг (ИМТ = 14,88 кг/м2), слабости и тошноты обследована. Диагностирована опухоль нижней трети пищевода, гистологически верифицирована плоскоклеточная карцинома, клинически опухоль стадирована как T3N1M0, в связи с явлениями дисфагии IV степени. Первым этапом 28.10.2020 выполнено формирование трубчатой гастростомы по предложенному способу. Доступом по Hassen был сформирован карбоксиперитонеум, установлен оптический троакар в параумбиликальной области и 4 рабочих троакара: 12 мм в правой подреберной области, 12 мм в правой мезогастральной области, 5 мм троакар в левой мезогастральной области и 12 мм в левой подреберной области. Вскрыт малый сальник для доступа в сальниковую сумку, выполнена лимфодиссекция 7 группы лимфоузлов, выделена левая желудочная артерия на протяжении с последующим клипированием. По малой кривизне желудка в супрапилорическом отделе выделена площадка для сшивающего аппарата. Правая желудочная артерия, правая желудочно-сальниковая и левая желудочно-сальниковая артерии сохранены для обеспечения адекватного кровоснабжения желудка. Через троакар в правой подреберной области заведен сшивающий аппарат. Желудок растянут, через зачищенную площадку на него заведен аппарат и расположен в продольном направлении относительно стенки, ближе к малой кривизне. Выполняют транссекцию желудка при помощи сшивающего аппарата так, чтобы сохранить достаточные для прохождения пищи просветы. Гемостаз по ходу степлерного шва. Сформированный антиперистальтический лоскут из малой кривизны желудка выведен на переднюю брюшную стенку в проекции установленного в левой подреберной области троакара. Выведенный конец лоскута срезан, в просвет установлен желудочный зонд, гастростома фиксирована к коже узловыми швами «сероза к коже». Зонд фиксирован дополнительными узловыми швами к коже. Троакарные раны ушиты. В последующем пациентке проведен курс ХЛТ (СОД 44 Гр с радиомодификацией Паклетаксел + Карбоплатин). По результатам контрольных обследований отмечена положительная динамика в виде уменьшения лимфатических узлов и опухоли, регресса явлений дисфагии. Направлена на выполнение радикального оперативного вмешательства. На момент госпитализации ИМТ 18,2 кг/м2. Выполнена 02.02.2021 операция в объеме субтотальной резекции пищевода с резекцией желудка в кардиальной области и по малой кривизне с ликвидацией гастростомы с одномоментной трансплевральной пластикой желудочным стеблем, который был заранее предподготовлен на операции, выполненной 28.10.2020 по предложенному способу. Интраоперационно и в раннем послеоперационном периоде отмечались эпизоды нестабильности гемодинамики со склонностью к гипотонии, требующие инотропной поддержки Норадреналином, что в разы увеличивает вероятность гемодинамических нарушений в трансплантате и, соответственно, увеличивает на порядок риск развития ранних послеоперционных осложнений. В отделении анестезиологии и реанимации пациентка провела 7 послеоперационных койко-дней. Выписана на 16 послеоперационные сутки в удовлетворительном состоянии на амбулаторное лечение по месту жительства. В послеоперационном периоде осложнений не наблюдалось.
Предлагаемый способ может использоваться в комбинации с другими методами лечения пациентов с заболеваниями пищевода и желудка. Позволяет купировать явления дисфагии, обеспечить энтеральный доступ для нутритивной поддержки, а также тренирует желудок для последующей пластики, что позволяет снизить риск возникновения интраоперационных и ранних послеоперационный осложнений, связанных с гемодинамическими нарушениями.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФОРМИРОВАНИЯ ЛАПАРОСКОПИЧЕСКОЙ СТЕБЕЛЬЧАТОЙ ГАСТРОСТОМЫ | 2023 |
|
RU2802999C2 |
| СПОСОБ ОДНОМОМЕНТНОЙ ТОТАЛЬНОЙ ЭЗОФАГОПЛАСТИКИ | 2000 |
|
RU2165737C1 |
| СПОСОБ ПЛАСТИКИ ПИЩЕВОДНОГО ОТВЕРСТИЯ ДИАФРАГМЫ | 2013 |
|
RU2525732C1 |
| СПОСОБ РЕЗЕКЦИИ ЖЕЛУДКА | 2000 |
|
RU2200476C2 |
| Способ лечения грыжи пищеводного отверстия диафрагмы в сочетании с хроническим калькулезным холециститом | 2018 |
|
RU2679560C1 |
| СПОСОБ ГАСТРОСТОМИИ | 2009 |
|
RU2417764C1 |
| СПОСОБ РЕЗЕКЦИИ ЖЕЛУДКА ПО ТИПУ БИЛЬРОТ-1 ПРИ РАКЕ | 1991 |
|
RU2018271C1 |
| СПОСОБ ЭЗОФАГОГАСТРОПЛАСТИКИ ПРИ РУБЦОВЫХ СУЖЕНИЯХ ПИЩЕВОДА И АНТРАЛЬНОГО ОТДЕЛА ЖЕЛУДКА | 2007 |
|
RU2356502C1 |
| Способ лапароскопического формирования культи желудка при гастроеюношунтировании по Ру | 2020 |
|
RU2727756C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ КРОВОТЕЧЕНИЯ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА | 2012 |
|
RU2492823C1 |
Изобретение относится к медицине, а именно к гастроэнтерологии, абдоминальной хирургии и онкологии. Выполняют лапароскопический доступ. Проводят выделение на протяжении и клипирование левой желудочной артерии. По малой кривизне желудка в супрапилорическом отделе выделяют площадку для сшивающего аппарата. Через выделенную площадку заводят сшивающий аппарат. Располагают его в продольном направлении относительно стенки, ближе к малой кривизне. Сшивающим аппаратом выполняют транссекцию желудка, сохраняя достаточные для прохождения пищи просветы. Выводят сформированный антиперистальтический лоскут из малой кривизны желудка на переднюю брюшную стенку. Выведенный конец лоскута срезают, в просвет устанавливают зонд. Способ обеспечивает адекватное энтеральное питание, подготовку желудка для использования в качестве трансплантата при последующей пластике, уменьшение травматичности операции у пациентов со злокачественными заболеваниями пищевода. 1 ил., 1 пр.
Способ формирования гастростомы из малой кривизны желудка с прекондиционированием желудка, включающий лапароскопический доступ, отличающийся тем, что выделяют левую желудочную артерию на протяжении и клипируют, по малой кривизне желудка в супрапилорическом отделе выделяют площадку для сшивающего аппарата, через выделенную площадку заводят сшивающий аппарат, располагают его в продольном направлении относительно стенки у малой кривизны, сшивающим аппаратом выполняют транссекцию желудка, сохраняя достаточные для прохождения пищи просветы, выводят сформированный антиперистальтический лоскут из малой кривизны желудка на переднюю брюшную стенку, выведенный конец лоскута срезают, в просвет устанавливают зонд.
| Высокоскоростной электрошпиндель к внутришлифовальным и другим станкам | 1950 |
|
SU92441A1 |
| Способ выполнения гастростомии с использованием полипропиленовой сетки | 2017 |
|
RU2691924C1 |
| US 20190351110 A1 21.11.2019 | |||
| КОСЯКОВ Б.А | |||
| Реканализирующая гастростома в хирургии рака желудка | |||
| Фундаментальные исследования, 2010, 11, с | |||
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| RICHARD G | |||
| BERRISFORD et al | |||
| Laparoscopic ischaemic conditioning of the stomach may reduce gastric-conduit morbidity following total minimally invasive | |||
Авторы
Даты
2023-02-14—Публикация
2022-02-16—Подача