Изобретение относится к сельскому хозяйству и биотехнологии и может быть использовано в генетике, селекции и семеноводстве зерновых культур.
Сорго [Sorghum bicolor (L.) Moench] - ценное сельскохозяйственное растение, возделываемое в 85 странах мира в качестве кормовой, пищевой и технической культуры. Сорго обладает рядом ценных биологических свойств: высокими кормовыми и питательными свойствами, высокой фотосинтетической активностью, устойчивостью к засухе и выносливостью к засолению почв, хорошей экологической пластичностью. Наблюдаемые в последние десятилетия изменения климата сопровождаются возрастанием температур, увеличением частоты и интенсивности засух, поэтому в последние годы интерес к сорго как перспективной страховой культуре в Российской Федерации неуклонно возрастает (1). В Российской Федерации сорго возделывается на кормовые цели, а также для пищевого (получение муки, крупы, крахмала и глюкозо-фруктозного сиропа) и технического (биоэтанол и возобновляемые источники энергии) использования (2).
Ведущей стратегией селекции сорго является создание гетерозисных гибридов на основе цитоплазматической мужской стерильности (ЦМС). В настоящее время наиболее широко используется тип ЦМС A1 (milo), впервые описанный Стивенсом и Холландом (3) как результат взаимодействия цитоплазмы milo с ядерными генами, полученными при гибридизации, от кафрского сорго. Использование гибридного сорго способствует повышению урожайности этой культуры на 20-60% (4).
Гибриды сорго получают скрещиванием стерильной линии А на основе ЦМС с линией восстановителем, обладающей функциональными аллелями генов (или генов) восстановления фертильности пыльцы (линии R). Семеноводство гибридов предусматривает поддержание генетической чистоты материнских (А) и отцовских R-линий, несущих соответственно рецессивные и доминантные аллели генов восстановления фертильности. Для получения семян A-линий их опыляют пыльцой линий-аналогов В, которые имеют ядерные гены, идентичные линиям А, но характеризуются фертильным типом цитоплазмы.
Известно, что в контроле признака восстановления фертильности пыльцы форм с ЦМС А1 (milo) принимают участие доминантные аллели не менее чем двух комплементарных генов Rf (Restoration of pollen fertility, восстановление фертильности пыльцы) - Rf1 и Rf2, а также ген Rf5 (5-8), локализованные на хромосомах SBI-08, SBI-02 и SBI-05, соответственно.
Для подтверждения наличия у отцовских линий генов восстановления фертильности пыльцы проводят тест-скрещивания материнских стерильных линий ЦМС с предполагаемыми восстановителями и полученные гибриды F1 оценивают по признаку фертильности пыльцы. Этот процесс может быть ускорен при использовании функциональных (аллель-специфичных) либо тесно сцепленных с локусами генов Rf молекулярных маркеров. Поэтому приоритетными задачами современных исследований генетических систем ЦМС-Rf является: изучение структуры и функции генов восстановления фертильности, их локализации в геноме, а также разработка на основе полученной информации эффективных молекулярных маркеров для отбора генотипов с различными аллелями этих генов (9).
Разработка доступных молекулярных маркеров генов Rf весьма актуальна для гибридной селекции сорго, так как с их помощью при создании гетерозисных гибридов F1 на основе ЦМС можно значительно ускорить процесс получения материнских стерильных линий (А), линий - закрепителей стерильности (В) и восстановителей фертильности пыльцы (R). Новые линии восстановители фертильности получают методами возвратных скрещиваний либо выделяют из расщепляющихся гибридных популяций. Отбор из расщепляющейся популяции генотипов, несущих доминантный аллель гена-восстановителя, сложен и трудоемок. Для определения восстановительной или закрепительной способности линии необходимо провести тест-скрещивание с линией ЦМС и оценить фертильность пыльцы полученных гибридов F1, т.е. для получения результата необходимо два полевых сезона. Поиск нужных генотипов в расщепляющейся гибридной популяции или в образце можно проводить и на ранней стадии развития растений, используя для этих целей маркерные признаки. В случае генов восстановления фертильности пыльцы такими маркерными признаками могут служить аллель-специфичные ДНК-маркеры, позволяющие выявлять носителей рецессивных и доминантных аллелей генов Rf.
Молекулярные ДНК-маркеры нашли широкое применение в работах по генотипированию, геномному картированию, локализации генов, контролирующих важные биологические и хозяйственно ценные признаки, структурированию генетического разнообразия, а также оценке исходного селекционного материала и семеноводстве. Особую значимость в селекционно-генетических исследованиях приобрели молекулярные ДНК маркеры, помогающие отбирать генотипы, несущие ценные аллели генов или их сочетания. Такой подход получил название маркер-опосредованной селекции (Marker Assisted Selection - MAS).
Он дает возможность ускоренного отбора ценных генотипов из генотипически разнородного селекционного материала (например, в расщепляющейся гибридной популяции).
Наиболее востребованными для проведения MAS являются ДНК-маркеры, основанные на полимеразной цепной реакции (ПНР). Число ПЦР-маркеров, используемых маркер-опосредованной селекции, велико, а выбор того или иного типа маркеров, как правило, определяется техническим оснащением лаборатории (10). Среди основанных на ПЦР молекулярных ДНК-маркеров, для идентификации в генотипе определенного гена наиболее просты в исполнении STS (Sequence Tagged Sites - сайты, меченные последовательностью), SCAR (Sequence Characterized Amplified Region - амплифицированный район с известной последовательностью) и SSR (Simple Sequence Repeats - микросателлиты или простые повторы). Современные технологии сегментирования нового поколения (New Generation Sequencing - NGS) дают возможность определять в последовательности генов интереса позиции полиморфных вариантов единичных нуклеотидов (Single Nucleotide Polymorphisms - SNPs). SNP можно выявить с помощью CAPS-маркеров (Cleaved Amplified Polymorphic Sequences - рестрицированные амплифицированные полиморфные последовательности). Они основаны на сочетании методов амплификации и рестрикции. В том случае, если при использовании STS- или SCAR-маркеров размер амплифицированных фрагментов у генотипов с различными аллелями гена оказался одинаков, а последовательности фрагмента после секвенирования оказались полиморфными, выявить этот полиморфизм можно при обработке рестриктазами (модификация RFLP-анализа). Сайты узнавания для различных рестриктаз фрагмента с известной полиморфной последовательностью определяют при помощи специальных программ. Процесс идентификации CAPS-маркера включает дополнительный этап обработки продукта амплификации (ампликона) рестриктазой, который проводят после проведения ПЦР и диагностического электрофореза.
В литературе предложено несколько молекулярных маркеров генов Rf сорго. Это серии SSR-маркеров, тесно сцепленных с локусами Rf1, Rf2 и Rf5 (5, 8, 11). Их недостатками является неполное сцепление с геном интереса, а также сравнительно ограниченная диагностическая ценность, т.е. возможность использования только для той группы генотипов, которая была использована при разработке маркера. Для преодоления этих ограничений необходимо разрабатывать аллель-специфичные маркеры.
Задачей настоящего изобретения является создание аллель-специфичного маркера, т.е. маркера, с помощью которого можно идентифицировать носителей доминантного (восстановитель фертильности) аллелей гена Rf2 - одного из комплементарных генов, необходимых для реализации признака восстановления фертильности пыльцы у сорго.
Наиболее близким к заявляемому маркеру - прототипом, является ДНК-маркер KASP (Kompetitive allele specific PCR) - маркер, разработанный для выявления однонуклеотидного полиморфизма (SNP), в частности, SNP в положении 1090 последовательности Sobic.002G057050, продуктом которой является PPR (pentatricopeptide repeat)-белок (12). Нуклеотидная замена аденина на тимин в положении 1090 первого экзона Sobic.002G057050 ассоциирована с доминантным аллелем гена Rf2. KASP-маркер оказался эффективным для идентификации доминантного аллеля Rf2 в генетическом пуле образцов зернового сорго из Западной Африки. Высокоточная KASP-технология весьма чувствительна к качеству матричной ДНК и требует использования специализированного оборудования и реагентов.
Техническим результатом изобретения является повышение точности и сокращение времени отбора генотипов сорго, несущих доминантный или рецессивный аллель гена Rf2, а также контроль генетической чистоты родительских линий и полноты гибридизации (доля гибридных семян F1) при скрещивании стерильной линии А с линией восстановителем фертильности R.
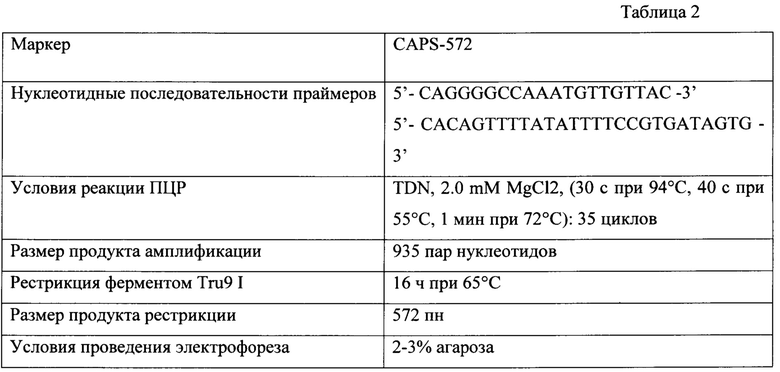
Поставленная задача достигается ПЦР-маркером длиной 572 пн, представляющим собой фрагмент, который образуется после действия рестриктазой Tru9 1 (аналог MseI) на ампликон, полученный со специфическими праймерами:
SEQ ID NO 1: 5'-CAGGGGCCAAATGTTGTTAC-3'
SEQ ID NO 2: 5'-CACAGTTTTATATTTTCCGTGATAGTG-3'.
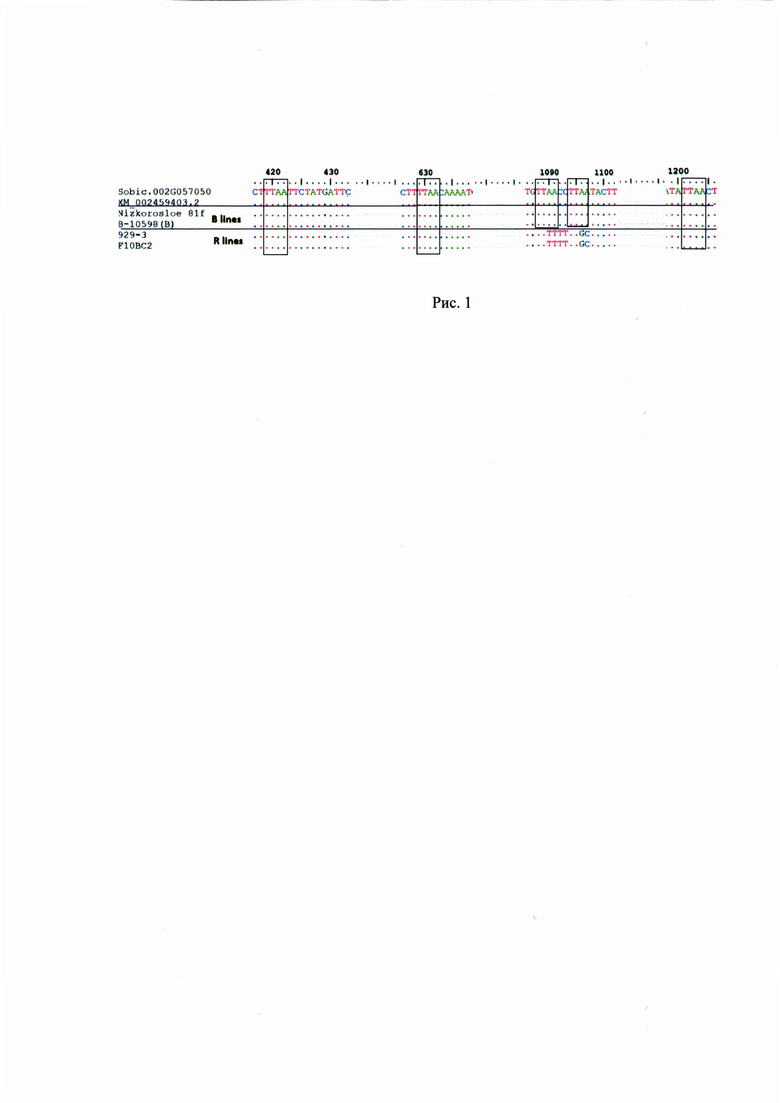
Фрагмент длиной 572 пн маркирует вариантную последовательность Sobic.002G057050 ассоциированную с геном Rf2 (12). При разработке маркера, позволившего дифференцировать R- и А/В-линии (нумерация нуклеотидов соответствует последовательности Sorbic.002G057050) ключевыми были несинонимичные мутации в позициях 1090, 1091, 1096 и 1097 в последовательности гена, приводящие к заменам аденина на тимин, тимин, гуанин и цитозин соответственно.
Для того чтобы определить число сайтов рестрикции в последовательности амплифицированного фрагмента у образцов сорго из коллекции Федерального исследовательского центра Всероссийского института генетических ресурсов растений имени Н.И. Вавилова (ВИР), различающихся по способности восстанавливать фертильность пыльцы, первоначально были исследованы фрагменты последовательности локуса Sobic.002G057050 у двух В-линий: Низкорослое 81ф, В-10598 и двух R-линий, одна из которых (929-3) получена отбором из образца хлебного сорго к-929, а вторая - путем гибридизации Низкорослое 81с × 929-3 (поколение F10BC2). Амплифицированные фрагменты длиной 935 пн были клонированы, а отдельные клоны затем секвенированы. У фертильных аналогов стерильных линий Низкорослое 81ф и В-10598 последовательности Sobic.002G057050 оказались в значительной степени сходны с референсными Sobic.002G057050 и ХМ_002459403.2 и включали пять сайтов рестрикции ферментом Tru9 I (аналог MseI). Напротив, у R-линий были найдены существенные отличия. При сравнении последовательностей фрагментов В-линий и референсных последовательностей выявили 22 SNP. Сайтов узнавания рестриктазой Tru9 I (ТТАА) было три (рис. 1). Фрагмент размером 572 пн, получаемый после действия на ампликон рестриктазы Tru9 I, оказался уникальным для R-линий.
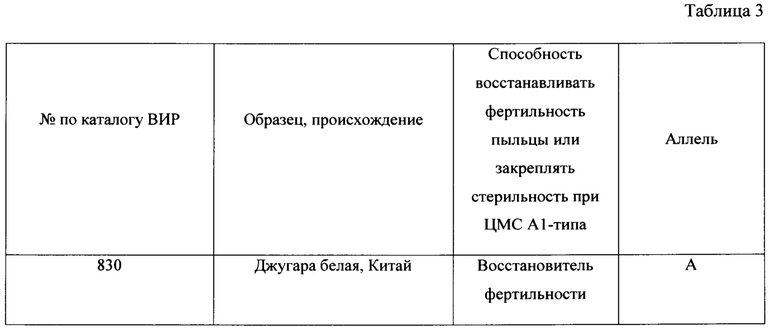
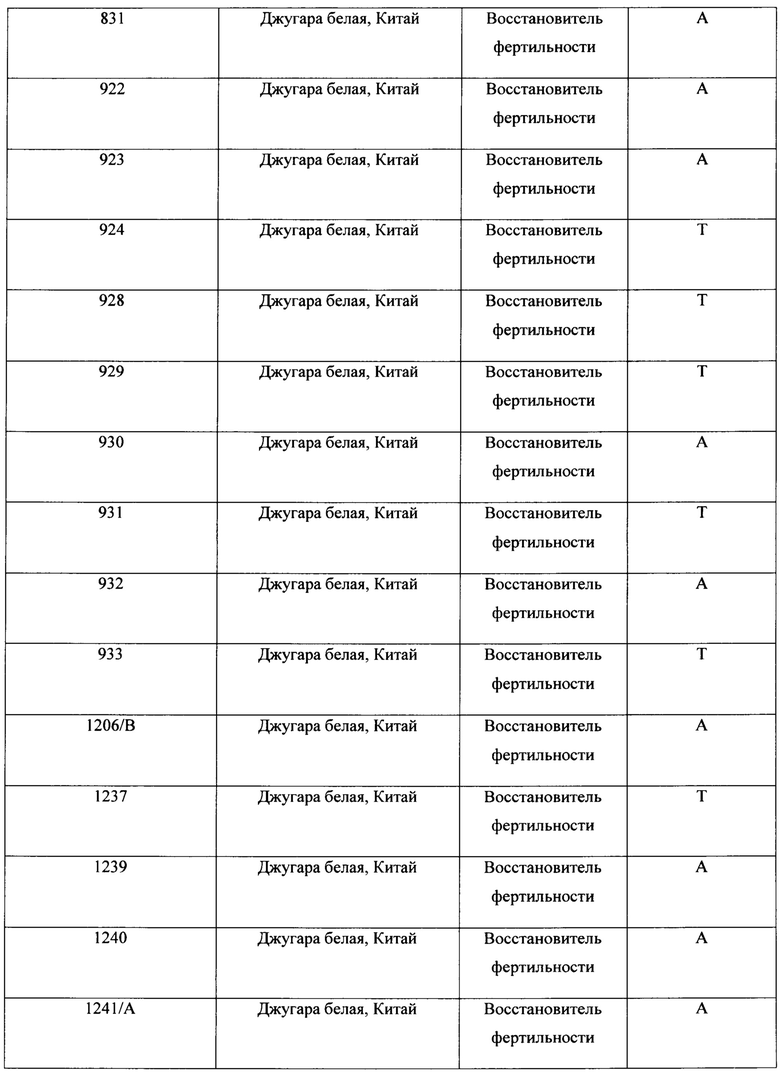
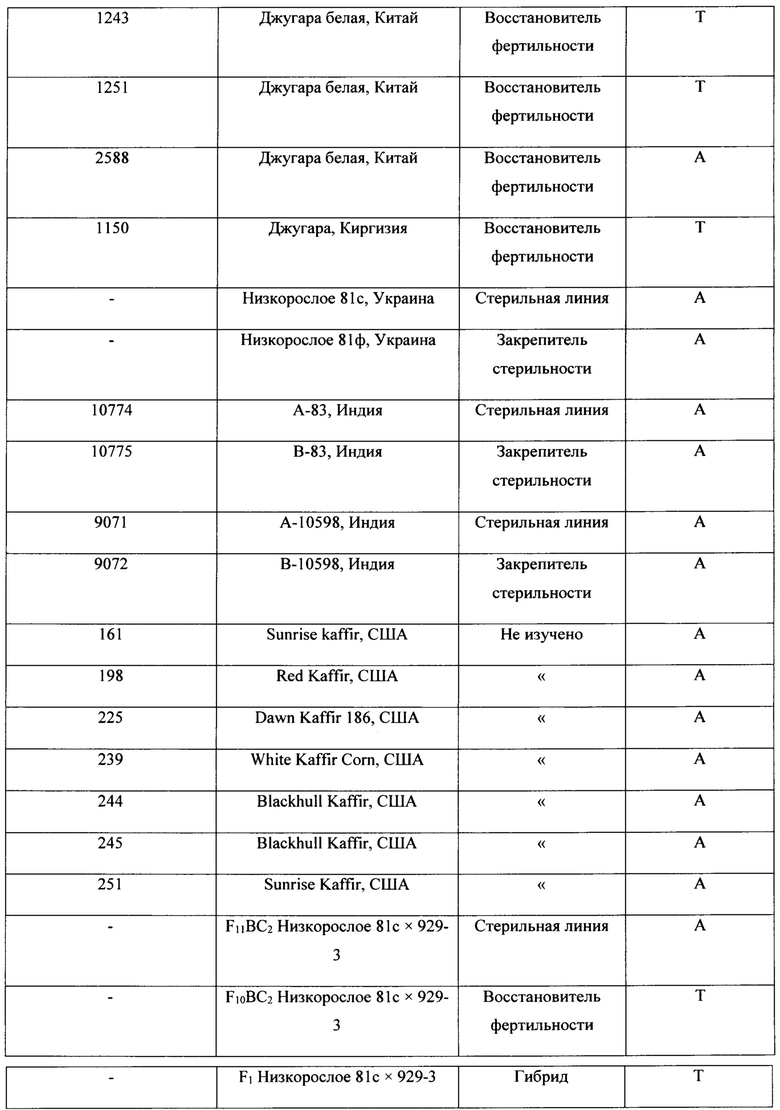
Разработанный нами маркер, названный CAPS-572, был валидирован на образцах сорго из коллекции ВИР. Исследовали 20 линий, отобранных по устойчивости к обыкновенной злаковой тле (Schizaphis graminum Rondani) из образцов хлебного сорго. Все линии восстанавливают фертильность пыльцы в полевых условиях. Кроме того, исследовали 7 линий кафрского сорго из США, способность к восстановлению фертильности пыльцы которых ранее не изучалась. Материалом служили также стерильные линии на основе ЦМС A1 (milo) Низкорослое 81с (Украина), А-10598 и А-83 (Индия), их фертильные аналоги Низкорослое 81ф, В-10598 и В-83, гибрид F1 Низкорослое 81с × 929-3 и устойчивые к S. graminum сестринские линии F10BC2, F11BC2, выделенные из гибридов от скрещиваний стерильной линии Низкорослое 81с с восстановителем 929-3, который защищен двумя доминантными генами устойчивости к краснодарской популяции фитофага. Маркерный фрагмент был найден у 10 линий сорго из западного Китая и Киргизии, используемых селекционерами в качестве восстановителей. Фрагмент не обнаружен у линий со стерильной цитоплазмой и их фертильных аналогов, а также у образцов кафрского сорго, не имеющих функциональных аллелей генов Rf. Перечень образцов и результат ПЦР анализа представлены в таблице 1.
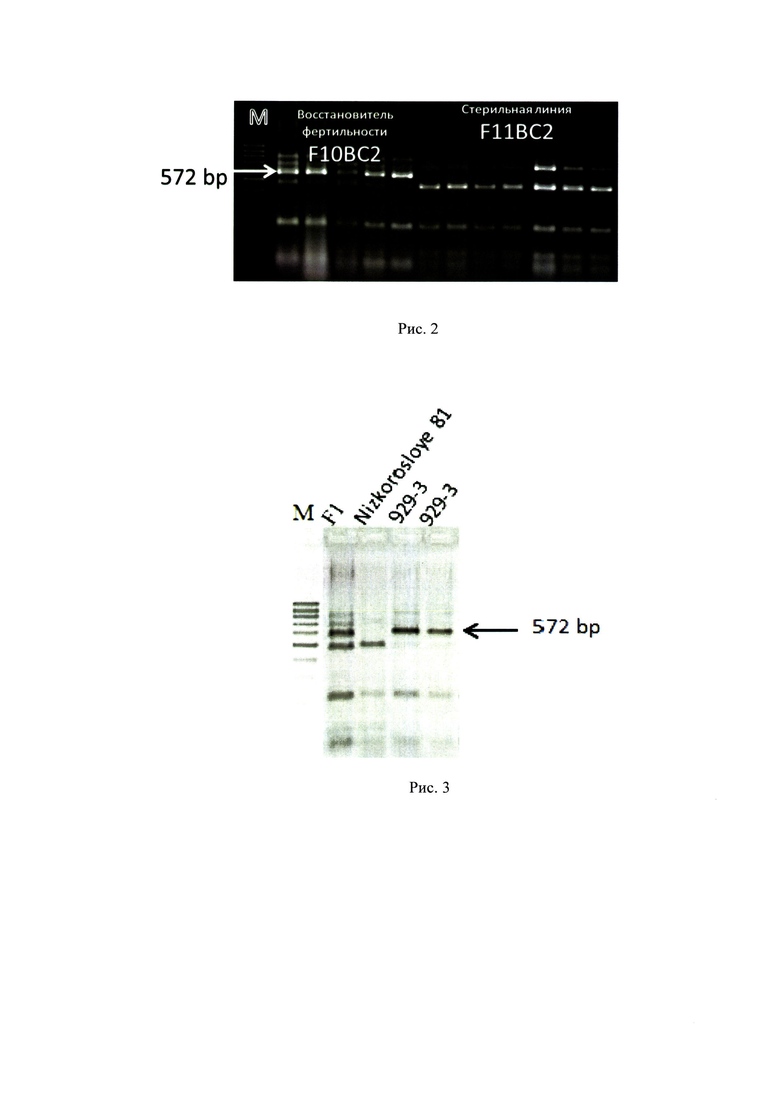
Пример 1. Оценка возможности использования маркера в гибридной селекции для идентификации в генотипе линии восстановителя фертильности доминантного аллеля Rf2 и определения чистоты линий
Выделили ДНК из отдельных растений сестринских линии F10BC2 (линия восстановитель) и F11BC2 (стерильная линия), полученных из гибридов от скрещиваний стерильной линии Низкорослое 81с с восстановителем 929-3. ДНК выделяли из 2-х недельных проростков с помощью буфера, содержащего SDS (13). Выборка составляла 5-7 растений каждого образца. С помощью праймеров амлифицировали фрагмент длиной 935 пн. Ампликоны обрабатывали рестриктазой Tru91 (использовали протокол фирмы-производителя SibEnzyme, Россия). Продукты рестрикции идентифицировали методом электрофореза в агарозном геле. По результатам электрофоретического анализа, обе линии были однородными, маркерный фрагмент длиной 572 пн обнаружен только у линии восстановителя (рис. 2).
Пример 2. Оценка возможности использования маркера CAPS-572 для определения гибридности семян F1, полученных при скрещивании стерильной линии с линией восстановителем фертильности пыльцы
ДНК выделяли из взрослых растений: гибридного растения F1, полученного от скрещивания стерильной линии Низкорослое 81с × 929-3 и родительских линий Низкорослое 81с (не имела фрагмент 572 пн) и 929-3 (имела фрагмент 572 пн) с помощью буфера, содержащего SDS (13). Выборка составляла 1-2 растений каждого образца. С помощью ПЦР, рестрикции ампликона и электрофореза в 3% агарозном геле фрагмент длиной 572 пн, характерный для отцовской линии-восстановителя, был обнаружен у растений предполагаемого гибрида F1 и таким образом была доказана гибридность семян, полученных от скрещивания стерильной линии Низкорослое 81 с и линии восстановителя фертильности 929-3.
Выделение ДНК
Выделение ДНК из проростков, выращенных в теплице или в чашках Петри на вате, и взрослых растений в поле проводили с использованием следующего протокола. Несколько кусочков листа (лучше молодого) размером около 1 см2 помещают в пробирку Eppendorf объемом 1,5 мл. Листья тщательно измельчают с помощью тефлоновых пестиков. Все операции проводят на льду. Добавляют 400 мкл автоклавированного экстракционного буфера (200 мМ трис-HCl, рН 7,5; 250 мМ NaCl; 25 мМ ЭДТА; 0,5% SDS). Тщательно и плавно перемешивают в течение 5 мин. Далее инкубируют в водяной бане при +65°С не менее 15 мин. Для ускорения процесса гомогенизации можно использовать специальный прибор - гомогенизатор (например, FastPrep24 фирмы MP Biomedicals). Отрезки листьев помещают в специальные пробирки с (Lysing matrix A tubes), добавляют экстракционный буфер и проводят гомогенизацию в течение 45 сек. Далее, для депротеинизации добавляют 200 мкл ацетата К и аккуратно перемешивают. Инкубируют на льду в течение 10 мин, центрифугируют 20 мин при 13000 об/мин и +20°С. 500 мкл образовавшейся надосадочной фракции аккуратно отбирают и перенести в новые микропробирки, используя для каждой пробы новый микронаконечник. Для осаждения ДНК добавляют равный объем (500 мкл) изопропанола и перемешивают содержимое, переворачивая пробирки. После центрифугирования при 13000 об/мин в течение 10 мин (+4°С) надосадочную жидкость сливают. Для очистка полученных фракций ДНК к осадку добавляют 1 мл 65% этанола и промывают, переворачивая пробирку. После центрифугирования в течение 10 мин при 13000 об/мин сливают надосадочную жидкость и сушат осадок при комнатной температуре, положив микропробирки горизонтально на фильтровальную бумагу примерно на 30 минут. Высушенный осадок растворяют в 100 мкл воды в течение 1 ч при комнатной температуре или в течение ночи в холодильнике при +4°С; хранить при -20°С.
Оценку качества и количества экстрагированной ДНК производят путем проведения аналитического электрофореза.
Полимеразная цепная реакция (ПЦР)
ПЦР проводили в реакционной смеси объемом 25 мкл, содержащей 1,5 мкл ДНК, 16,3 мкл Н2О, 2,5 мкл 10Х буфера, 1,0 мкл 50 мМ MgCl2, по 0,2 мМ каждого дНТФ (2,4 мкл смеси динуклеотидфосфатов с концентрацией 2,5 мМ каждого нуклеотида), по 0,5 млк 10 рМ прямого и обратного специфичных праймеров, 1 ед. ДНК-полимеразы Taq, в амплификаторе, например, MiniAmp™ Plus Thermal Cycler. Программа CAPS-572 для проведения ПЦР: преденатурация - 2 мин при 94°С; денатурация - 30 с при 94°С; отжиг матрицы с праймерами - 40 с при 55°С; полимеризация - 1 мин при 72°С; число циклов - 35 и достраивание ПЦР-фрагментов - 7 мин при 72°С. Продукты ПЦР хранили при +4°С.
Рестрикция продуктов ПЦР с ферментом Tru9 I
Рестрикцию проводили при 65°С в 10 мкл реакционной смеси (SibEnzyme, Russia). Продукты амплификации и рестрикции анализировали с помощью электрофореза в 2 или 3% агарозном геле, и визуализировали в 0.005% растворе бромистого этидия.
Результаты ПЦР представлены на рис. 2 и 3 и показывают, что заявляемый ДНК-маркер может идентифицировать растения с вариантной последовательностью Sobic.002G057050 и позволяет вести отбор растений, содержащих ген Rf2, а также определять чистоту гибридного материала и полученных линий.
Список литературы.
1. Алабушев А.В., Шишова Е.А., Романюкин А.Е., Ермолина Г.М., Горпиченко С.И. Происхождение сорго и развитие его селекции. Научный журнал КубГАУ. 2017;127(03). DOI: 10.21515/1990-4665-127-017
2. Кибальник О.П., Ефремова И.Г., Бочкарева Ю.В., Прахов А.В., Семин Д.С. продуктивность сортовых культур в зависимости от агротехнических приемов возделывания в регионах Российской Федерации. Аграрная наука Северо-Востока. 2021; 22(2):155-166. DOI: 10.30766/2072-9081.2021.22.2.155-166
3. Stephens J.С, Holland R.F. Cytoplasmic male sterility for hybrid sorghum seed production. Agronomy Journal. 1954; 46:20-23. DOI: 10.2134/agronj1954.00021962004600010006x
4. Bantilan M.C.S. Deb U.K., Gowda C.L.L., Reddy B.V.S., Obilama A.B., Evenson R.E. (eds). Sorghum genetic enhancement: Research process, dissemination and impacts. ICRISAT; 2004.
5. Klein R.R., Klein P.E., Chhabra A.K., Dong J., Pammi S., Childs K.L., Mullet J.E., Rooney W.L., Schertz K.F. Molecular mapping of the Rfl gene for pollen fertility restoration in sorghum (Sorghum bicolor L.). Theoretical and Applied Genetics. 2001; 102:1206-1212. DOI: 10.1007/S001220100575
6. Reddy P.S., Rao D.M., Reddy V.S.B., Kumar A.A. Inheritance of male-fertility restoration in А1, A2, A3 and A4(M) cytoplasmic male-sterility systems of sorghum [Sorghum bicolor (L.) Moench.]. Indian Journal of Genetics. 2010; 70(3):240-246.
7. Jordan D.R., Mace E.S., Henzell R.G., Klein P.E., Klein R.R. Molecular mapping and candidate gene identification of the Rfl gene for pollen fertility restoration in sorghum [Sorghum bicolor (L.) Moench]. Theoretical and Applied Genetics. 2010; 120:1279-1287. DOI: 10.1007/s00122-009-1255-3
8. Jordan D.R., Klein R.R., Sakrewski K.G., Henzell R.G., Klein P.E., Mace E.S. Mapping and characterization of Rf a new gene conditioning pollen fertility restoration in A1 and A2 cytoplasm in sorghum (Sorghum bicolor (L.) Moench). Theoretical and Applied Genetics. 2011; 123(3):383-396. DOI: 10.1007/s00122-011-1591-y.
9. Sykes Т., Yates S., Nagy I.; Asp Т., Small I., Studer B. In-silico identification of candidate genes for fertility restoration in cytoplasmic male sterile perennial ryegrass (Lolium perenne L.). Genome Biology and Evolution. 2016;9:351-362. DOI: 10.1093/gbe/evw047
10. Хлесткина E.K. Молекулярные маркеры в генетических исследованиях и в селекции. Вавиловский журнал генетики и селекции. 2013; 17(4/2): 1044-1054.
11. Madugula P.; Uttam A.G.; Tonapi V.A.; Ragimasalawada M. Fine mapping of Rf2, a major locus controlling pollen fertility restoration in sorghum A1 cytoplasm, encodes a PPR gene and its validation through expression analysis. Plant Breeding. 2018;137:148-161.
12. Kante M., Rattunde H.F.W., Nebie В., Weltzien E., Haussmann B.I.G., Leiser W.L. QTL mapping and validation of fertility restoration in West African sorghum A1 cytoplasm and identification of a potential causative mutation for Rf2. Theoretical and Applied Genetics. 2018; 131:2397-2412. DOI: 10.1007/s00122-018-3161-z
13. Анисимова И.Н., Алпатьева H.B., Абдуллаев P.A., Карабицина Ю.И., Кузнецова Е.Б. Скрининг генетических ресурсов растений с использованием ДНК-маркеров: основные принципы, выделение ДНК, постановка ПЦР, электрофорез в агарозном геле: (методические указания) / под ред Е.Е. Радченко. Санкт-Петербург: ВИР; 2018). DOI: 10.30901/978-5-905954-81-8

Перечень последовательностей

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФЕРТИЛЬНЫХ ЛИНИЙ СОРГО, ЯВЛЯЮЩИХСЯ ВОССТАНОВИТЕЛЯМИ ФЕРТИЛЬНОСТИ ДЛЯ ЦМС ТИПА 9Е | 2014 |
|
RU2599437C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ СТЕРИЛЬНОСТИ/ФЕРТИЛЬНОСТИ ПОДСОЛНЕЧНИКА | 2012 |
|
RU2524135C2 |
| ГЕН-ВОССТАНОВИТЕЛЬ RF4 ДЛЯ ЦИТОПЛАЗМАТИЧЕСКОЙ МУЖСКОЙ СТЕРИЛЬНОСТИ (CMS) C-ТИПА КУКУРУЗЫ, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2603005C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВОССТАНОВИТЕЛЕЙ ФЕРТИЛЬНОСТИ ДЛЯ СТЕРИЛЬНЫХ ЦИТОПЛАЗМ СОРГО ТИПОВ М35-1А И 9Е | 2010 |
|
RU2545688C2 |
| ПОЛУЧЕНИЕ ГИБРИДНЫХ СЕМЯН ЗЕРНОВЫХ КУЛЬТУР | 2015 |
|
RU2685907C2 |
| СПОСОБ ВЫЯВЛЕНИЯ АПОМИКТИЧНЫХ РАСТЕНИЙ СОРГО, ВОЗНИКШИХ ЗА СЧЕТ ПСЕВДОГАМНОЙ ФОРМЫ ДИПЛОИДНОГО АПОМИКСИСА | 2009 |
|
RU2421982C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДВУХНУЛЕВЫХ ЛИНИЙ-ВОССТАНОВИТЕЛЕЙ ФЕРТИЛЬНОСТИ BRASSICA NAPUS, ИМЕЮЩИХ ХОРОШЕЕ АГРОНОМИЧЕСКОЕ КАЧЕСТВО | 2004 |
|
RU2373698C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДОВ F1 СОРГО | 1999 |
|
RU2152713C1 |
| ГЕН-ВОССТАНОВИТЕЛЬ RF4 ДЛЯ ЦИТОПЛАЗМАТИЧЕСКОЙ МУЖСКОЙ СТЕРИЛЬНОСТИ (CMS) C-ТИПА КУКУРУЗЫ, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2747979C2 |
| ГЕН-ВОССТАНОВИТЕЛЬ RF4 ДЛЯ ЦИТОПЛАЗМАТИЧЕСКОЙ МУЖСКОЙ СТЕРИЛЬНОСТИ (CMS) C-ТИПА КУКУРУЗЫ, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2729107C2 |
Изобретение относится к сельскому хозяйству и биотехнологии. Изобретение представляет собой ДНК-маркер для селекции и семеноводства гибридов сорго на основе цитоплазматической мужской стерильности А1-типа, представляющий собой фрагмент, который образуется после действия рестриктазой Tru9 I (аналог MseI) на ампликон, полученный в ПЦР со специфическими праймерами 5'-CAGGGGCCAAATGTTGTTAC-3' и 5'-CACAGTTTTATATTTTCCGTGATAGTG-3'. Технический результат заключается в повышении точности и сокращении времени отбора генотипов сорго, несущих доминантный аллель гена Rf2, восстанавливающего фертильность пыльцы при цитоплазматической мужской стерильности А1 (milo)-типа. 3 ил., 3 табл., 2 пр.
ДНК-маркер для селекции гибридов сорго на основе цитоплазматической мужской стерильности А1-типа, представляющий собой фрагмент ДНК, расположенный на хромосоме 2 между 5547609 и 5548543 п.н., который образуется после действия рестриктазы Tru9 I на ампликон, получаемый в ПЦР с парой праймеров:
SEQ ID NO 1: 5'-CAGGGGCCAAATGTTGTTAC-3',
SEQ ID NO 2: 5'-CACAGTTTTATATTTTCCGTGATAGTG-3'.
| WO 2011090690 A1, 28.07.2011 | |||
| DHAKA N | |||
| et al | |||
| Transcriptional trajectories of anther development provide candidates for engineering male fertility in sorghum, Sci Rep., 2020, vol | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ШАВРУКОВ Ю | |||
| Н | |||
| CAPS-маркеры в биологии растений, Вавиловский журнал генетики и селекции, 2015, vol | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| АНИСИМОВА И.Н | |||
| и др | |||
| Полиморфизм | |||
Авторы
Даты
2023-03-17—Публикация
2021-12-15—Подача