Изобретение относится к биотехнологии и может быть использовано в фармацевтической промышленности, медицинской практике и исследовательских целях при создании лекарственных препаратов в виде густого раствора для профилактики инфекционных заболеваний органов дыхания.
Фицин (КФ 3.4.22.3) - цистеиновая протеаза, выделенная из латекса фиговых деревьев {Ficus species). Его структура представляет единую полипептидную цепь, свернутую в два домена. Молекулярная масса энзима составляет 25 кДа, в активный центр входит триада аминокислот - Cys, His и Asp [Holyavka М., Pankova S., Koroleva V. et al. Influence of UV radiation on molecular structure and catalytic activity of free and immobilized bromelain, ficin and papain // Journal of Photochemistry and PhotobiOiOgy B: Biology. - 2019. V. 201. - P. 111681]. В медицинской практике фицин используют для ускорения заживления кожных покровов благодаря способности энзима воздействовать на белковые компоненты как мышечной, так и соединительной тканей, при этом он действует более эффективно, чем папаин и бромелайн [Мосолов В.В. Протеолитические ферменты. - М.: Наука, 1971. - 404 с]. Показано, что фицин эффективен в борьбе с микробными биопленкам: [D.R. Baidamshina, E.Y. Trizna, F.S. Akhatova, E.V. Rozhina, R.F. Fakhrullin, A.R. Kayumov, M.G. Holyavka, V.G. Artyukhov, M.I. Bogachev Targeting microbial biofilms using ficin, a nonspecific plant protease // Scientific Reports. - 2017. V. 7. - P. 46068]. Известна косметическая фермент-содержащая композиция с протеазами, которая применяется для лечения акне, ухода за кожей и очистки кожи [Патент DE 4305460, A61K 8/66].
В настоящее время одним из приоритетных направлений развития современной медицины, химии и фармакологии является создание новых высокоэффективных лекарственных форм с использованием ферментов в качестве биокатализаторов. Однако растворимые формы ферментов являются относительно нестабильными и склонными к ингибированию различными соединениями. Иммобилизация помогает преодолеть данные проблемы за счет повышения устойчивости энзима к различным физико-химическим агентам [Холявка М.Г., Артюхов В.Г. Иммобилизованные биологические системы: биофизические аспекты и практическое применение // учебное пособие, Воронеж: Издательский дом ВГУ. - 2017. - С. 261].
Хитозан - природный поли-β-гликозид, широко использующийся в биомедицине как платформа для создания систем адресной доставки лекарственных средств и тканевой инженерии, а также в биотехнологии как матрица для иммобилизации ферментов. Полимер биосовместим, нетоксичен, однако, растворим лишь при рН<6.5, что затрудняет его использование в физиологических средах с более высокими значениями рН. Для решения этой проблемы предлагается использование солевых гюрм хитозана, например, ацетата хитозана. Ацетат хитозана успешно зареком ендовал себя при создании инновационных раноукрывных материалов [Dai,. Т., Tegos, G. Р., Burkatovskaya, М., Castano, А. Р., & Hamblin, М. R. (2008) Chitosan Acetate Bandage as a Topical Antimicrobial Dressing for Imected Burns. Antimicrobial Agents and Chemotherapy, 53(2), 393-400; Ip, M. (2011). Antimicrobial dressings. Advanced Wound Repair Therapies, 416-449.], в качестве носителя для нуклеиновых кислот [Nimesh, S. (2013) Chitosan nanoparticles. Gene Therapy, 163-196.] и средства для доставки лекарств в толгтый кишечник [Padhi, S., Behera, A., Hasnain, M.S., Nayak, A.K. (2022) Chitosan in Colon-targeted Drug Delivery. Chitosan in Drug Delivery, 107-132]. Кроме этого, ацетат хитозана является коммерчески доступным продуктом.
Известен способ получения препарата на основе фицина и низкомолекулярного хитозана 50-190 кДа, который позволяет сократить расход противовоспалительного, ранозаживляющего средства благодаря пролонгированному действию и высокой стабильности получаемой субстанции [Патент RU 2769243 С1, СПК А61К 31 '722 (2021.08); А61К 38/46 (2021.08); A61K 38/48 (2021.08); A61K 31/56 (2021.08); А61Р 17/02 (2021.08), опубл. 29.03.2022, Бюл. №10]. Он включает иммобилизацию энзима в буферном растворе на матрицу кислоторастворимого низкомолекулярного хитозана (50-190 кДа) в соотношении 20 мл буферного раствора фицина в концентрации 1 мг/мл на 1 г хитозана, при этом в качестве буферного раствора используют 0.05 М боратный буфер с добавлением КС1 с рН 8.0; инкубирование в течение 24 часов при комнатной температуре с периодическим перемешиванием; промывание образовавшегося осадка 0.05 М боратным буфером с добавлением КС1 с рН 8.0 дс отсутствия в промывных водах фицина.
Существует способ получения гетерогенного биокатализатора на основе фицина, иммобилизованного на ионообменных смолах [Патент RU 2769734 С1, СПК C12N 11/10 (2022.01); C12N 9/50 (2022.01), опубл. 05.04.2022, Бюл. №10], включающий адсорбционную иммобилизацию фицина в буферном растворе на матрицу ионооб!У анной смолы, инкубацию при комнатной температуре, промывку образовавшегося осадка буфером, при этом иммобилизацию проводят на матрицу воздушно-сухой ионообменной смолы АВ-17-2П или АВ-16-ГС, а в качестве буферного раствора для иммобилизации используют 0.05 М фосфатный буфер для ионообменной смолы АВ-17-2П, рН 11.0 или 0.05 М NaOH-KCl буфер для АВ-16-ГС.
Недостатком данных способов является то, что в результате получается нерастворимая форма фермента, которая не дает возможность проводить реакции на твердых субстратах.
Известен способ получения иммобилизованного ферментного препарата на основе фицина, гиалуроновой кислоты и полисахаридов, модифицированных виниловыми мономерами [Патент RU 2744457 C1, A61K 38/00, A61K 38/46, A61K 47/36, C12N 11/08, А61Р 17/02, опубл. 09.03.2021, Бюл. №7], включающий иммобилизацию ферментного препарата на основе фицина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты, растворение фицина в водном растворе низкомолекулярной гиалуроновой кислоты 300 к Да, или среднемолекулярной гиалуроновой кислоты 500 кДа, или высокомолекулярной гиалуроновой кислоты 800 кДа в соотношении 10 мг энзима на 2 мл водного раствора гиалуроновой кислоты различной молекулярной массы в концентрации 1.5%, при перемешивании до полного растворения при комнатной температуре; проведение иммобилизации фицина путем добавления к полученной смеси графт-сополимера карбоксиметилцеллюлозы с молекулярной массой 50-100 кДа (КМЦ) или хитозана (ХТЗ) с молекулярной массой 50-100 кДа с N-винилимидазолом (ВИ) или N,N-диметнламиноэтилметакрилатом (ДМАЭМА) в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля. Недостатком способа является высокая стоимость гиалуроновой кислот, и полисахаридов, модифицированных виниловыми мономерами.
Существует способ стабилизации протеа: для использования в косметологических целях [US 2011/0177052]. Недостатком способа является использование 1-этил-3-(3-диметиламинопропил карбодиимида, который вызывает серьезные ожоги кожи и повреждение глаз, может приводить к аллергическим кожным реакциям, при вдыхании может вызывать аллергию, симптомы астмы или затруднение дыхания, что ограничивает применение препарата в косметологии.
В качестве прототипа служил способ получения гетерогенного препарата в виде гелей на основе фицина и карбоксиметилцеллюлозы [Патент RU 2771183 С1, СПК C12N 11/04 (2022.02); C12N 11/12 (2022.02); A61K 38/46 (2022.02), опубл. 28.04.2022, Бюл. №13], включающий иммобилизацию ферментного препарата в буферном растворе в соотношении 20 мл раствора фермента в концентрации 3 мг/мл на 1 г носителя, в качестве буферного раствора для иммобилизации используют 0.05 М боратный буфер с добавлением 0.1 М KCl с рН 9.0; инкубация проводится в течение 2 часов при комнатной температуре с периодическим перемешиванием; образовавшийся осадок промывают 0.05 М трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка.
В отличие от прототипа, предлагаемый нами способ позволяет получить иммобилизованный фицин в другой форме, т.е. не в виде геля, а в форме густого раствора, включающего только иммобилизованный (стабилизированный) фицин и полностью отмытого от его нестабилизированной (неиммобилизованной) формы. Кроме того, заявленное изобретение предназначено для расширения числа полисахаридов, используемых для стабилизации препаратов фицина в медицинских целях.
Технический результат заявленного изобретения заключается в разработке способа получения гибридного препярата иммобилизованного фицина и ацетата хитозана в виде густого раствор л с абсолютной вязкостью 100-220 МПа×с, включающего только иммобилизованный (стабилизированный) фицин и полностьк отмытого от его нестабилизированной (неиммобилизованной) форгы, обладающего высокой растворимостью в воде в широком диапазоне рН.
Технический результат достигается тем, что в способе получения гибридного препарата фицина и ацетата хитозана в виде густого раствора, включающем иммобилизацию ферментного препарата фицина в буферном растворе с носителем, инкубирование при комнатной температуре в течение 2 часов и промывку, согласно изобретению, иммобилизацию фицина проводят путем комплексообразования в густой раствор ацетата хитозана с молекулярной массой 600 кДа в соотношении 10 мл раствора фицина, в концентрации 2 мг/мл, полученного растворением в буфере, на 1 г сухого ацетата хитозана, предварительно растворенного в 10 мл буфера, при постоянном перемешивании со скоростью 250 об/мин; в качестве буферного раствора для иммобилизации используют 0.05 М глициновый буфер с рН 10.0; образовавшийся в процессе инкубирования препарат в виде густого раствора промывают с помощью диализа с использованием целлофанового мешочка шириной 34 мм, вместимостью 3.7 мл на 10 мм длины с диаметром пор 25 кДа против 0.05 М трис-HCl буфера с рН 7.5, из расчета, что для промывки 21 мл полученного препарата используют 400 мл 50 мМ трис-HCl буфера с рН 7.5, диализ ведут в течение 8 часов, после чего буфер меняют на порцию свежего в объеме 400 мл и продолжают диализ еще в течение 16 часов до отсутствия в промывном растворе свободного фицина.
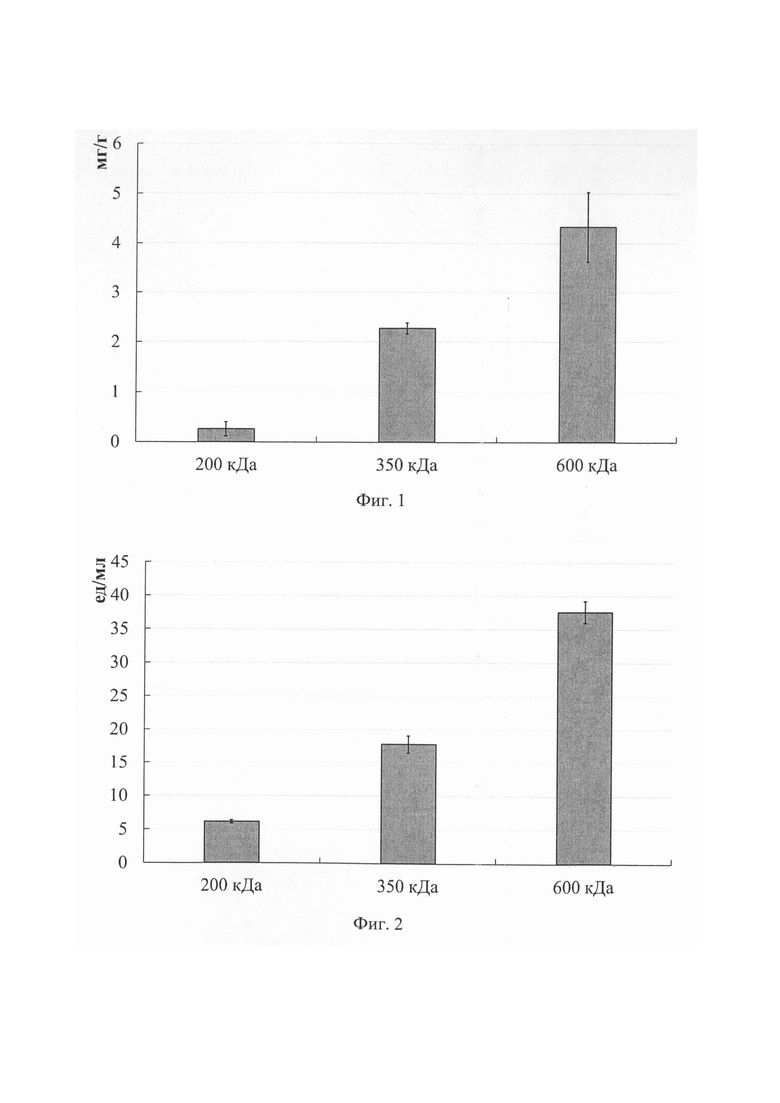
Фиг. 1. Диаграмма значений содержания белка (в мг на 1 г носителя) в гибридных препаратах в виде густого раствора фицина и ацетата хитозана с различными молекулярными массами.
Фиг. 2. Диаграмма значений общей активности (в ед на 1 мл раствора) гибридных препаратов в виде густого раствора фи дина и ацетата хитозана с различными молекулярными массами.
Пример реализации способа.
В качестве объекта исследования был выбран фицин фирмы «Sigma-Aldrich», субстратом для гидролиза служил азоказепн фирмы «Sigma-Aldrich». Для синтеза ацетата хитозана был использован хитозан фирмы «Биопрогресс» со средней молекулярной массой 600 кДа и степенью деацетилирования 0.85.
Для получения хитозана с различными молекулярными массами использовали кислотный гидролиз исходного полисахарида. Навеску хитозана массой 1 г со средней молекулярной массой 600 кДа растворяли в 100 мл 2%-ного масс, водного раствора уксусной кислоты, после чего переносили раствор в круглодонную колбу, снабженную обратным холодильником, добавляли 50 мл 0.1 М водного раствора HCl и кипятили в течение 10 минут для получения хитозана со средней молекулярной массой 350 кДа или 20 минут для получения хитозана со средней молекулярной массой 200 кДа. После смесь охлаждали до комнатной температуры, раствор нейтрализовали 30 мл 25%-ного масс, водного раствора аммиака до слабощелочного значения рН (~ 8). Полимер из реакционной массы выделяли осаждением в 500 мл изопропилового спирта ЧДА, после чего промывал? 100 мл дистиллированной воды и 50 мл 96%-ного об. этилового спирта и сушили в вакуумном сушильном шкафу при 55°С до постоянной массы.
Молекулярные массы деструктированного хитозана определяли общепринятым вискозиметрическим методом с помощью вискозиметра Уббелоде в смеси водных растворов 0.3 М уксусной кислоты и 0.2 М ацетата натрия при 25°С. Из данных вискозиметрии с помощью уравнения Марка-Куна-Хаувинка-Сакурады вычисляли значения молекулярных масс:

где 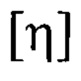 - характеристическая вязкость, дл/г, рассчитанная из данных вискозиметрии, М - средневязкостная молекулярная масса полимера, К и а -константы, равные 82x10'5 дл/г и 0.76 соответственнно [Sorokin A., Lavlinskaya М., Polymer Bulletin, 2022, Vol.79, pp.407-427. DOI: 10.1007/s00289-020-03521-9.].
- характеристическая вязкость, дл/г, рассчитанная из данных вискозиметрии, М - средневязкостная молекулярная масса полимера, К и а -константы, равные 82x10'5 дл/г и 0.76 соответственнно [Sorokin A., Lavlinskaya М., Polymer Bulletin, 2022, Vol.79, pp.407-427. DOI: 10.1007/s00289-020-03521-9.].
Ацетат хитозана получали по следующей методике: 1.00 г хитозана с молекулярной массой 200, 350 или 600 кДа раствор ли в 100 мл 2%-ной масс, водного раствора уксусной кислоты и выдерживали при постоянном перемешивании в течение 4 часов при 25°С. Полимер выделяли осаждением в 500 мл ацетона ЧДА, отфильтровывали, трижды промывали 50 мл изопропилового спирта ЧДА и сушили в вакуумном сушильном шкафу при 55°С до постоянной массы.
Подтверждение предполагаемой структуры ацетата хитозана осуществляли с помощью метода ИК-спектроскопии. ИК-спектры регистрировали в диапазоне частот 4000-400 см": на спектрометре Bruker Vertex 70 с Фурье-преобразователем (Bruker Optics, Германия) методом нарушенного полного внутреннего отражения с шаром регистрации 2 см-1.
Комплексообразование фицина и ацетата хитозана осуществляли следующим образом. К 1 г ацетата хитозана с молекулярной массой 200, 350 или 600 кДа, предварительно растворенного в 10 мл 0.05 М глицинового буфера с рН 10.0, добавляли 10 мл раствора фицина в концентрации 2 мг/мл, полученного при растворении фицина в 0.05 М глициновом буфере с рН 10.0, инкубировали в течение 2 часов при комнатной температуре при постоянном перемешивании со скоростью 250 об/мин. После окончания инкубации образовавшийся препарат в виде густого раствора очищали от несвязавшегося фермента с помощью диализа с использованием целлофанового мешочка Spectra/Por 6 Standard RC, шириной 34 мм, вместимостью 3.7 мл на 10 мм длины, изготовленного из регенерированной целлюлозы, с диаметром пор 25 кДа против 400 мл 50 мМ трис-HCl буфера с рН 7.5 в течение 8 часов, после чего буфер меняли на 400 мл свежего и продолжали диализ еще в течение 16 часов до отсутствия в промывном растворе свободного фицина. Для промывки 21 мл полученного препарата использовали 800 мл 50 мМ трис-HCl буфера с рН 7.5. По истечении этого времени осуществляли контроль наличия белка в промывных водах с помощью спектрофотометра 0-2000 при Х- 280 нм.
Содержание белка в гибридных препаратах фт цина определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275.].
Определение протеазной активности фицин- проводили на субстрате азоказеине (Sigma, США) [Sabirova A.R., Rudanova N.L., Balaban N.P., Ilyinskaya O.N., Demidyuk I.V., Kostrov S.V., Rudenkaya G.N., Sharipova M.R. A novel secreted metzincin metalloproteinase from Bacillus intermedins II FEBS Lett. - 2010 - V. 584 (21), P. 4419-4425]. К 50 мг образца добавляли 200 мкл 0.05 М трис-HCl буфера с рН 7.5, 800 мкл азоказеина (0.5% масс, в 0.05 М трис-HCl буфере, рН 7.5) и инкубировали 2 часа при 37°С.Далее добавляли 800 мкл трихлоруксусной кислоты (ТХУ) (5% масс), инкубировали 10 минут при 4°С, затем центрифугировали в течение 3 мин при 11700 g для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл раствора NaOH (3% масс.) для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 10 мм кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 50 мг образца и 200 мкл буфера (комплексообразованный фермент в контрольную пробу вносили последним, остальные операции для нее делали аналогично опытным пробам).
Единицей протеазной активности служило количество фицина, которое в условиях эксперимента гидролизует 1 мкМ азоказеина за 1 мин. Протеазную активность рассчитывали по формуле:
A=D*1000/120/200,
где А - протеазная активность препарата, мкМ/мин на 1 мг белка,
D - оптическая плотность раствора при 410 нм,
120 - время инкубации в минутах,
200 - объем пробы, мкл,
1000 - коэффициент для пересчета в мкМ.
Все экспериментальные исследования осуществляли минимум в 8-кратной повторности. Статистическая обработка полученных результатов проводилась при уровне значимости 5% с и« пользованием t-критерия Стьюдента.
Для получения гибридных препаратов фицина и ацетата хитозана с разными молекулярными массами в качестве среды для комплексообразования мы использовали 0.05 М гльциновый буфер с рН 10.0. Результаты отражены на фиг. 1-2.
Анализ содержания белка в гибридных препаратах показал, что наибольшее количество фицина (в мг на г носителя) связывается с ацетатом хитозана с молекулярной массой 600 кДа (фиг. 1).
Активность (в ед на мл раствора) фицина оказалась выше при его комплексообразовании с ацетатом хитозана с молекулярной массой 600 кДа (фиг. 2).
Мы сравнили полученные результаты по определению каталитической активности и содержания белка для препаратов фицина в густом растворе ацетата хитозана. Оптимальное соотношение содержания белка (мг на г носителя) и общей активности (в ед на мл раствора) получено при стабилизации фицина путем включения в густой раствор ацетата хитозана с молекулярной массой 600 кДа.
Таким образом, была разработана методика получения гибридного препарата фицина и ацетата хитозана в виде густого раствора с абсолютной вязкостью 100-220 МПахс, включающего только иммобилизованный (стабилизированный) фицин и полностью отмытого от его нестабилизированной (неиммобилизованной) формы, т.к. после диализа 21 мл препарата против 800 мл 50 мМ трис-HCl буфера с рН 7.5 исключается переход фермента из фазы носителя в раствор, что позволяет проводить реакции, получая продукт, не "загрязненный" ферментом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ФИЦИНА И N-МАЛЕОИЛХИТОЗАНА В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792784C1 |
| Способ получения гибридного препарата фицина и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2822735C1 |
| Способ получения гибридного препарата папаина и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2822736C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ФИЦИНА В ГЕЛЕ НА ОСНОВЕ КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ | 2021 |
|
RU2771183C1 |
| Способ получения гибридного препарата бромелайна и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2819793C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА И НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА | 2021 |
|
RU2769243C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА БРОМЕЛАЙНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788454C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ПРЕПАРАТА БРОМЕЛАЙНА И АЛЬГИНАТА НАТРИЯ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792785C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ПАПАИНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2795425C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ПРЕПАРАТА ПАПАИНА И АЛЬГИНАТА НАТРИЯ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788455C1 |
Изобретение относится к биотехнологии. Предложен способ получения гибридного препарата фицина и ацетата хитозана в форме густого раствора, включающий иммобилизацию ферментного препарата фицина в густой раствор ацетата хитозана с молекулярной массой 600 кДа в соотношении 10 мл раствора фицина в концентрации 2 мг/мл на 1 г сухого ацетата хитозана, инкубирование при комнатной температуре в течение 2 ч при постоянном перемешивании со скоростью 250 об/мин; в качестве буферного раствора для иммобилизации используют 0.05 М глициновый буфер с рН 10.0. Полученный препарат промывают с помощью диализа 50 мМ трис-HCl буфером с рН 7.5. Изобретение обеспечивает расширение арсенала способов получения стабилизированных препаратов фицина, используемых в медицинских целях. 2 ил., 1 пр.
Способ получения гибридного препарата фицина и ацетата хитозана в виде густого раствора, включающий иммобилизацию ферментного препарата фицина в буферном растворе с носителем, инкубирование при комнатной температуре в течение 2 ч и промывку, отличающийся тем, что иммобилизацию фицина проводят путем комплексообразования в густой раствор ацетата хитозана с молекулярной массой 600 кДа в соотношении 10 мл раствора фицина в концентрации 2 мг/мл, полученного растворением в буфере, на 1 г сухого ацетата хитозана, предварительно растворенного в 10 мл буфера, при постоянном перемешивании со скоростью 250 об/мин; в качестве буферного раствора для иммобилизации используют 0.05 М глициновый буфер с рН 10.0; образовавшийся в процессе инкубирования препарат в виде густого раствора промывают с помощью диализа с использованием целлофанового мешочка шириной 34 мм, вместимостью 3.7 мл на 10 мм длины, с диаметром пор 25 кДа против 50 мМ трис-HCl буфера с рН 7,5 из расчета, что для промывки 21 мл полученного препарата используют 400 мл 50 мМ трис-HCl буфера с рН 7.5, диализ ведут в течение 8 ч, после чего буфер меняют на порцию свежего в объеме 400 мл и продолжают диализ еще в течение 16 ч до отсутствия в промывном растворе свободного фицина.
| ХОЛЯВКА М.Г | |||
| "Разработка методики иммобилизации фицина на матрице хитозана для создания инновационных лекарственных препаратов"; Актуальная биотехнология, 2015, N 3 (14), с.39-40 | |||
| КОРОЛЕВА В.А | |||
| и др | |||
| "Разработка методики иммобилизации цистеиноых и сериновых протеаз на матрице кислоторастворимого среднемолекулярного хитазана"; Актуальная |
Авторы
Даты
2023-03-24—Публикация
2022-07-28—Подача