Изобретение относится к технологии нанесения покрытий на металлические поверхности с использованием концентрированных потоков энергии, в частности, к технологии получения на поверхности титановых имплантатов, работающих в организме человека, покрытий на основе титана, ниобия, циркония и азота, которые могут быть использованы в области медицины с целью получения биосовместимых низкомодульных сплавов системы Ti-Nb-Zr-N.
Известен способ нанесения биоинертных покрытий на основе ниобия на титановые имплантаты (RU №2686093 МПК A61L 27/06, A61L 2/02, С23С 4/00, C25D 11/26, опубл. 24.04.2019). Способ нанесения биоинертных покрытий на основе ниобия на титановые имплантаты включает электрический взрыв ниобиевой фольги массой 50-500 мг, формирование из продуктов взрыва импульсной многофазной плазменной струи, оплавление ею поверхности титанового имплантата при поглощаемой плотности мощности 1,5-1,8 ГВт/м2, осаждение на поверхность продуктов взрыва и формирование на ней биоинертного покрытия на основе ниобия. Недостатком способа является низкая антибактериальная активность биоинертного электровзрывного покрытия на основе ниобия.
Наиболее близким к заявляемому изобретению является способ нанесения биоинертных покрытий на основе циркония на титановые имплантаты (RU №2686092 МПК A61L 27/06, A61L 2/02, С23С 4/00, C25D 11/26, опубл. 24.04.2019). Способ нанесения биоинертных покрытий на основе циркония на титановые имплантаты включает электрический взрыв циркониевой фольги массой 50-500 мг, формирование из продуктов взрыва импульсной многофазной плазменной струи, оплавление ею поверхности титанового имплантата при поглощаемой плотности мощности 1,5-1,8 ГВт/м2, осаждение на поверхность продуктов взрыва и формирование на ней биоинертного покрытия на основе циркония.
Недостатком способа является низкая антибактериальная активность биоинертных электровзрывного покрытия на основе циркония.
Технической проблемой, решаемой заявляемым изобретением является получение биоинертного или биосовместимого покрытия на основе титана, ниобия, циркония и азота на поверхности медицинских титановых имплантатов, обладающего антибактериальной активностью.
Существующая техническая проблема решается тем, что предложен способ нанесения биоинертных покрытий на основе титана, ниобия, циркония и азота на титановые имплантаты, включающий электрический взрыв трехслойного композиционного электрически взрываемого проводника, один из слоев которого состоит из титановой фольги массой 50-500 мг, второй и третий слои соответственно состоят из ниобиевой и циркониевой фольги массами равными 0,5-2,0 массы первого слоя, формирование из продуктов взрыва импульсной многофазной плазменной струи, оплавление ею поверхности имплантата из титанового сплава при поглощаемой плотности мощности 1,5-1,8 ГВт/м2, осаждение на поверхность продуктов взрыва и формирование на ней биоинертного покрытия на основе титана, ниобия и циркония, затем азотирование в течение 3-5 часов при температуре 500-600°С и осуществление последующей импульсно-периодической электронно-пучковой обработки поверхности покрытия при поглощаемой плотности энергии 20-40 Дж/см2, длительности импульсов 150-200 мкс и количестве 3-5 импульсов.
Технический результат, получаемый при осуществлении изобретения, заключается в том, что, при электрическом взрыве композиционного электрически взрываемого проводника, состоящего из титановой, ниобиевой и циркониевой фольг, продукты разрушения образуют плазменную струю, служащую инструментом формирования на поверхности имплантатов из титановых сплавов покрытия на основе титана, ниобия и циркония. Электровзрывное напыление приводит к формированию покрытия на основе титана, ниобия и циркония с высокой адгезией с имплантатом из титанового сплава. Азотирование такого покрытия приводит к внесению в поверхностный слой ионов азота и формированию нитридов ниобия, циркония и титана, которые обеспечивают антибактериальный эффект. Импульсно-периодическая электронно-пучковая обработка приводит к формированию в покрытии высокодисперсной и однородной структуры. Поверхность покрытия приобретает зеркальный блеск. Преимущество заявляемого способа по сравнению с прототипом заключается в формировании покрытия, которое обладает лучшей пролиферативной активностью клеточных линий, противомикробной активностью и цитотоксичностью. Замещение покрытия из циркония (в случае прототипа) на покрытие на основе титана, ниобия, циркония и азота позволяет этого добиться. Достижение такого результата обеспечивает применение биоинертных металлов: титана, ниобия и циркония, а также азота, который образует нитриды этих металлов, а также находится в покрытии в виде ионов. Значения микротвердости, нанотвердости, модуля упругости и предела прочности сформированного покрытия также являются лучшими по сравнению с прототипом из-за совокупности характеристик структуры и фазового состава.
Исследования методом сканирующей электронной микроскопии показали, что при электровзрывном напылении на титановых имплантатах путем электрического взрыва трехслойного композиционного электрически взрываемого проводника, один из слоев которого состоит из титановой фольги массой 50-500 мг, второй слой - из ниобиевой фольги равной 0,5-2,0 массы первого слоя, а третий слой - из циркониевой фольги равной 0,5-2,0 массы первого слоя при поглощаемой плотности мощности 1,5-1,8 ГВт/м2 происходит формирование покрытия на основе титана, ниобия и циркония. Указанный режим, при котором поглощаемая плотность мощности составляет 1,5-1,8 ГВт/м2, установлен эмпирически и является оптимальным, поскольку при интенсивности воздействия ниже 1,5 ГВт/м2 не происходит образование рельефа между покрытием и подложкой из титанового сплава, вследствие чего возможно отслаивание покрытия, а при интенсивности воздействия выше 1,8 ГВт/м2 происходит формирование развитого рельефа поверхности напыляемого покрытия. При значении массы титановой фольги менее 50 мг становится невозможным изготовление трехслойного композиционного электрически взрываемого проводника. При значении массы титановой фольги более 500 мг покрытие на основе титана, ниобия и циркония на поверхности имплантатов из титановых сплавов обладает большим количеством дефектов. Дефекты в данном случае представлены фрагментами титановой фольги, которые не разрушились при электрическом взрыве, а лишь частично оплавились и прилипли к поверхности покрытия. При значении массы ниобиевой или циркониевой фольги менее 0,5 от массы фольги из титана будет нарушена слоистая конструкция композиционного проводника, поэтому будет невозможно поместить циркониевую фольгу над ниобиевой, что в свою очередь приведет к неравномерному перемешиванию титана, циркония и ниобия в плазменной струе при электрическом взрыве. Последнее повлияет на однородность структуры покрытия, а именно в покрытии будут наблюдаться участки, обогащенные тем или иным металлом (титаном, цирконием или ниобием). Однородность структуры покрытия будет нарушена. При значении массы ниобиевой или циркониевой фольги более 2,0 от массы фольги из титана электрический взрыв композиционного проводника не произойдет, а возникнет лишь его оплавление, поэтому импульсная плазменная струя продуктов электрического взрыва не сформируется, следовательно покрытие не образуется. В указанных режимах электровзрывного напыления граница покрытия с подложкой не является ровной, что позволяет увеличить адгезию покрытия с подложкой, что является положительной стороной данного способа.
При времени азотирования менее 3 часов и температуре ниже 500°С поверхностный слой электровзрывного покрытия на основе титана, ниобия и циркония слабо насыщается ионами азота, также не формируются нитриды ниобия, циркония и титана, что не обеспечивает антибактериальный эффект формируемому покрытию. При времени азотирования более 5 часов и температуре выше 600°С в поверхностном слое электровзрывного покрытия на основе титана, ниобия и циркония образуются твердые растворы на основе азота, и формируется дендритная структура, что повышает твердость и износостойкость этого покрытия, но делает его непригодным для эксплуатации в организме человека. В этом случае начинает изнашиваться костная ткань.
Импульсно-периодическая электронно-пучковая обработка покрытия приводит к формированию в нем более дисперсной и однородной структуры. Указанный режим является оптимальным, поскольку при поверхностной плотности энергии меньше 20 Дж/см2, длительности импульсов короче 150 мкс, количестве импульсов менее 3, не происходит образования однородной структуры в покрытии. При поверхностной плотности энергии больше 40 Дж/см2, длительности импульсов длиннее 200 мкс, количестве импульсов более 5, происходит формирование рельефа поверхности. Рельеф поверхности образуют вскрывшиеся и закристаллизовавшиеся пузыри паров материала покрытия, поднимающиеся из объема расплавленного покрытия под действием электронного пучка на его поверхность, периодические волны, возникающие из-за интенсивного растекания расплава и другие особенности электронно-пучковой обработки. Все это будет отрицательно сказываться при установке имплантата с таким покрытием в костную ткань, поскольку будут возникать повреждения костной ткани, а также частичное или полное отсутствие первичной фиксации имплантата.
Микротвердость измеряли на микротвердомере HVS-1000A. Значения микротвердости сформированного покрытия находятся в интервале 101-105 кгс/мм2. Нанотвердость измеряли с использованием системы Agilent U9820A Nano Indenter G200. Значения нанотвердости сформированного покрытия составляет 105 кгс/мм2. Модуль упругости сформированного покрытия составил 9850 кгс/мм2, предел прочности при растяжении - 29,5 кгс/мм2.
В результате такой трехстадийной обработки взаимодополняющими методами исследования покрытия: сканирующей электронной микроскопии и микрорентгеноспектрального анализа поверхности покрытия, их прямых шлифов, рентгенофазового анализа и послойным анализом методом просвечивающей электронной микроскопии установлено следующее. Методами сканирующей электронной микроскопии и микрорентгеноспектрального анализа поверхности покрытия установлено, что поверхность покрытия однородна, а распределение элементов на ней представлено только атомами элементов, из которых формировали покрытие: титана, ниобия, циркония и азота. Исследование элементного состава покрытия по его толщине показало, что основными элементами покрытия также являются титан, ниобий, цирконий и азот. Эти результаты исследования структуры покрытия на поперечном шлифе полностью согласуются с результатами исследования поверхности покрытия, изложенными выше. Методом картирования проведена визуализация распределения элементов в объеме покрытия, согласно которой, можно отметить отсутствие явно выраженных участков покрытия с преобладающим расположением того или иного элемента, то есть все элементы распределены однородно. Сформированные покрытия содержат поры. Данные покрытия предлагается использовать как биоинертные покрытия на титановых имплантатах после проведения клинических и других испытаний. Предполагается, что вторичная фиксация имплантатов с такими покрытиями будет достигаться за счет остеоинтеграции с открытыми порами покрытия, а врастание в покрытие имплантата рубцовой ткани, исходящей из мягкотканного компонента сегмента, обеспечит предохранение тканей от обсеменения (проникновения) микробными телами и возникновения воспалительной реакции при установке имплантата. Методами микрорентгеноспектрального анализа и просвечивающей электронной микроскопии установлено содержание в покрытии фаз α-Ti, Zr, Nb, NbN, Zr2N, Ti2N и NbTi4. Проведенные исследования структуры, фазового и элементного составов не выявили соединений на основе ванадия и алюминия (как правило, они содержатся в титановых сплавах медицинского назначения), которые снижают биосовместимость покрытия. Выявленные фазы содержат только титан, ниобий, цирконий и азот, являющиеся биоинертными. Этот факт позволяет утверждать, что, биосовместимость полученного покрытия будет выше по сравнению с титановым сплавами Titanium Grade 5 и ВТ6.
Пролиферативную активность клеточных линий определяли методом непосредственного подсчета количества клеток после их контакта с образцами с нанесенными покрытиями с помощью оптического микроскопа. Исследования проводили на клеточной культуре фибробластов подкожной соединительной ткани мыши (L929). Количество клеток определяли методом непосредственного подсчета при помощи 4-х сеточной камеры Горяева и оптического инвертированного микроскопа Axio Observer (Zeiss). Для подсчета клеток использовали витальную окраску трипановым синим для одновременного определения количества живых и погибших клеток. Клеточную линию культивировали в среде Игла MEM с добавлением 10% фетальной бычьей сыворотки (FBS) и 5% пенициллин-стрептомицина-глутамина в сосудах площадью 75 см2. Культивирование клеток проводили при температуре 37±1°С и 5% CO2 в течение 24 часов. Культуру клеток рассевали в культуральные 24-луночные планшеты (общий объем 2 мл) в количестве 50000 клеток на одну лунку. Образцы помещали на монослой клеток в каждую лунку. Клетки инкубировали с образцами в течение 24 часов. В ходе эксперимента за контроль принимали культуру, не контактировавшую с образцами. После инкубирования производили непосредственный подсчет клеток. В результате проведенных исследований было выявлено, что процент выживших клеток на поверхности биоинертного покрытия на основе титана, ниобия, циркония и азота составляет 100%, что указывает на высокую пролиферативную активность фибробластов. При этом на образце без покрытия (титановый сплав ВТ6) процентное содержание выживших клеток составило 90,5%.
Проводили исследования на растровом электронном микроскопе образцов с биоинертными покрытиями на основе титана, ниобия, циркония и азота. Для этого образцы с высаженными на их поверхность культурами клеток промывали и фиксировали в специальных растворах, а затем высушивали в гексане. По окончании процесса высушивания культуру извлекали из держателя и помещали в эксикатор с влагопоглотителем для временного хранения. На полученных изображениях проводили подсчет клеток фибробластов с помощью программного обеспечения «Photoshop». В результате статистического анализа полученных изображений было выявлено, что наибольшее количество клеток обнаружено на образцах с покрытием на основе титана, ниобия, циркония и азота. На образцах без покрытия (титановый сплав ВТ6) среднее количество клеток было на 20,5% меньше.
Противомикробная активность образцов была проверена методом подсчетов жизнеспособных бактерий. В этом методе in vitro динамика уничтожения бактерий в образце измерялась путем подсчета остаточных бактерий по сравнению с контролем. Культуры микроорганизмов Staphylococcus aureus (MRSA) культивировали в течение 24 часов при температуре 37±1°С, затем готовили взвесь микроорганизмов в концентрации 105 КОЕ/мл. Staphylococcus aureus 209 - грамположительные шаровидные клетки диаметром 0,5-1,5 мкм. Измерение эффективности сорбции поводили на бактериях Staphylococcus aureus согласно рекомендациям (Ворошилова А.А. Окисляющие нефть бактерии показатели интенсивности биологического окисления нефти в природных условиях / А.А. Ворошилова, Е.Д. Дианова // Микробиология. - 1952. - Т. 21. - С. 408-415.). Для определения эффективности сорбции, образцы стерилизованного в автоклаве продукта с массой 100 мг помещали в стерильные колбы и добавляли 30 мл бактериальной суспензии с концентрацией 1,0×10 КОЕ/мл. Адсорбцию микроорганизмов на образцах проводили при постоянном перемешивании суспензии в течение 30 мин на магнитной мешалке РЕ-6600 (Ecroskhim, Россия) со скоростью 500 об/мин. Далее пробы центрифугировали в течение 3 минут при скорости вращения 1300 об/мин и осуществляли посев 1 мл надосадочной жидкости на МПА. Посевы инкубировали в термостате при температуре 37±1°С в течение 24 ч. Через сутки после инкубирования проводили подсчет колоний. Остаточные жизнеспособные бактерии (КОЕ/мл) подсчитывали после 3 и 6 ч инкубации при 37°С. Микроорганизмы в PBS использовали только в качестве контролей. Для каждого образца были проведены два независимых эксперимента с пятью повторениями на образец на один эксперимент. Статистический анализ проводили с помощью непарного t-теста Стьюдента, а р<0,05 считали статистически значимым. Биоинертное покрытие на основе титана, ниобия, циркония и азота, обладает антибактериальным эффектом. Количество КОЕ уменьшается после 6 часов культивирования до 7515 с титановым имплантатом без покрытия (титановый сплав ВТ6) -10 225.
Цитотоксическое действие образцов с биоинертными танталовыми покрытиями, модифицированными ионами азота определяли при помощи МТТ-теста на клеточной культуре фибробластов подкожной соединительной ткани мыши (L929). Конечная концентрация клеток составила 0,5⋅104 клеток/100 мкл в лунке 96-луночного микропланшета. Клетки культивировали в виде монослоя в среде Игла MEM (Lonza, Швейцария) с добавлением 10% FCS, 2 mM L-глутамина и 5% пенициллин/стрептомицина/глутамина. Культивирование клеток проводили при температуре 37±1°С и 5% CO2 в течение 24 часов. После инкубирования питательную среду осторожно удаляли и два раза промывали клетки раствором DPBS. Клетки с образцами инкубировали при температуре 37±1°С и 5% CO2 в течение 24, 48 и 72 часов. Затем в каждую лунку добавляли по 100 мкл питательной среды и по 10 мкл раствора МТТ (3-4,5-диметилтиазол-2,5 дифенил тетразилия бромида). Инкубирование с раствором МТТ проводили в течение 2 часов при температуре 37±1°С и 5% CO2. По окончании инкубирования питательную среду осторожно удаляли и добавляли в каждую лунку по 100 мкл диметилсульфоксида для растворения кристаллов формазана. Через 15 минут определяли оптическую плотность на микропланшетном спектрофотометре Multiscan FC при длине волны 620 нм. Далее вычисляли процент живых клеток (CL) по формуле CL=(As/Ac)⋅100%, где As - оптическая плотность исследуемого образца, Ас - оптическая плотность контрольного образца. Контрольной группой служили клетки без добавления образца с покрытиями. Для статистической обработки данных использовались параметрические методы с уровнем достоверности р ≤0,05. Образцы с покрытиями на основе титана, ниобия, циркония и азота, не являются токсичными, что подтверждают исследования цитотоксичности. При этом, количество выживших клеток после контакта с образцом с покрытиями на основе титана, ниобия, циркония и азота на 3,5% выше, чем у образца без покрытия (титановый сплав ВТ6).
Способ поясняется рисунками, где:
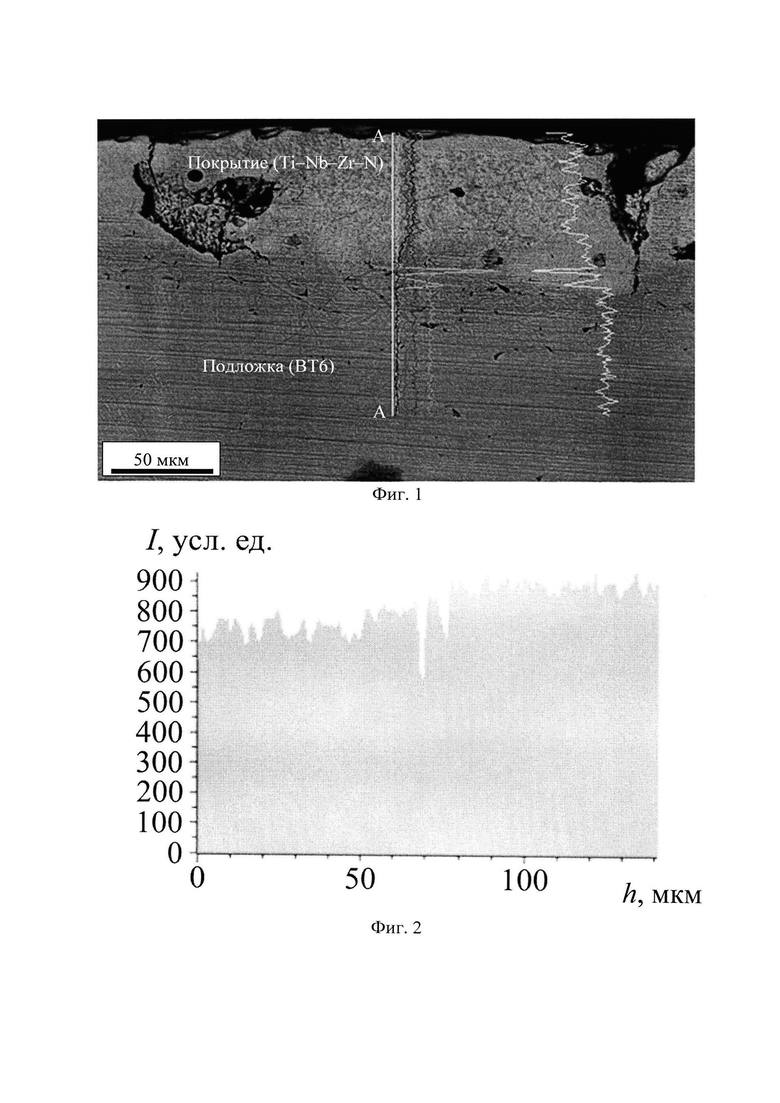
на фиг. 1 представлено электронное изображение структуры поперечного сечения поверхностного слоя биоинертного покрытия на основе титана, ниобия, циркония и азота, - покрытие получено на титановом сплаве марки ВТ6. «А-А» - линия, вдоль которой осуществлялся набор спектров для микрорентгеноспектрального анализа.
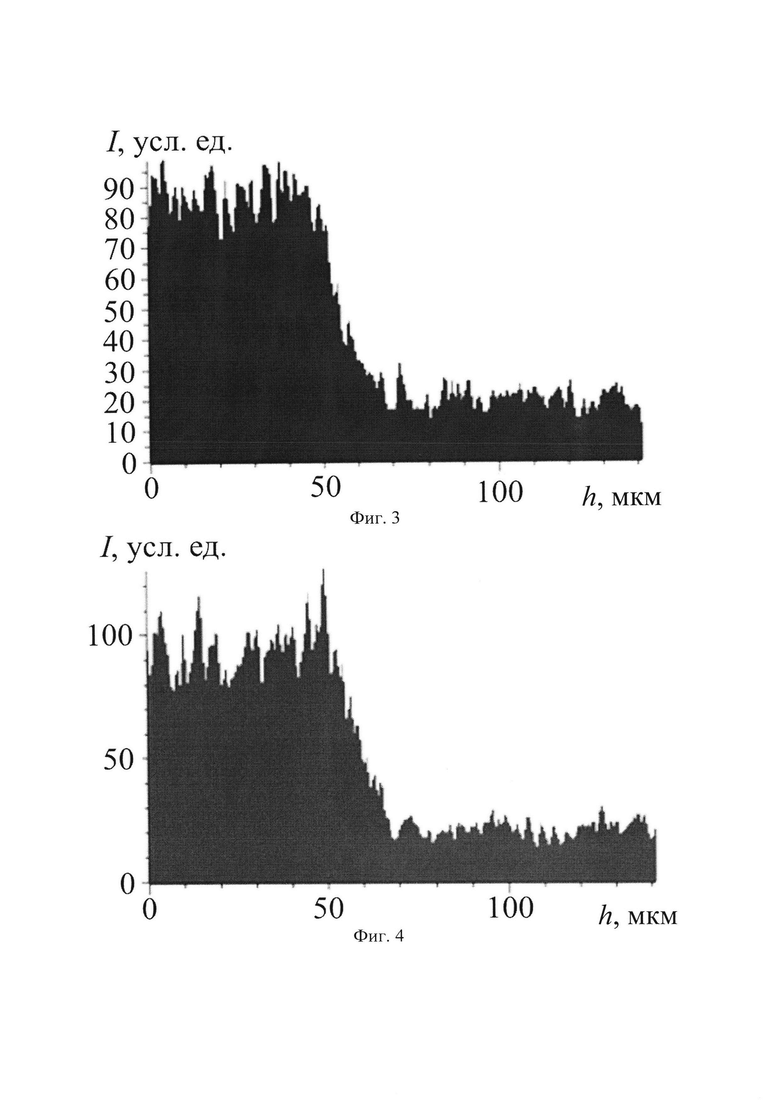
на фиг. 2 - изменение интенсивности отклика детектора микрорентгеноспектрального анализа на титан (7) в зависимости от толщины покрытия (h) вдоль линии «А-А» на фиг. 1.
на фиг. 3 - изменение интенсивности отклика детектора микрорентгеноспектрального анализа на цирконий (I) в зависимости от толщины покрытия (h) вдоль линии «А-А» на фиг. 1.
на фиг. 4 - изменение интенсивности отклика детектора микрорентгеноспектрального анализа на ниобий (I) в зависимости от толщины покрытия (h) вдоль линии «А-А» на фиг. 1.
на фиг. 5 - изменение интенсивности отклика детектора микрорентгеноспектрального анализа на азот (I) в зависимости от толщины покрытия (h) вдоль линии «А-А» на фиг. 1. Примеры конкретного осуществления способа: Пример 1.
Обработке подвергали титановый штифт (ввинчивается в челюстную кость) дентального имплантата (титановый сплав марки ВТ6, химический состав %: Ti 90,04, Fe 0,5, С 0,1, Si 0,1, V 3,5, N 0,05, Al 5,3, Zr 0,2, О 0,2, H 0,01) площадью 1 см2. Использовали трехслойный композиционный электрически взрываемый проводник, один из слоев которого состоял из тинановой фольги массой 50 мг, второй слой - из ниобиевой фольги 25 мг, а третий слой - из цикониевой фольги 25 мг. Сформированной плазменной струей оплавляли поверхность титанового штифта при поглощаемой плотности мощности 1,5 ГВт/м2 и формировали на ней электровзрывное покрытие на основе титана, ниобия и циркония. Электровзрывное напыление осуществляли на электровзрывной установке ЭВУ 60/10 М (Автоматизированная электровзрывная установка для повышения эксплуатационных характеристик материалов / Ю.Д. Жмакин, Д.А. Романов, Е.А. Будовских и др. // Промышленная энергетика. - 2011. - №6. С. 22-25). Азотирование проводили в течение 3 часов при температуре 500°С. Последующую импульсно-периодическую электронно-пучковую обработку поверхности покрытия проводили при поглощаемой плотности энергии 20 Дж/см2, длительности импульсов 150 мкс и количестве 3 импульсов. Азотирование и электронно-пучковую обработку проводили на установке «КОМПЛЕКС» (https://www.hcei.tsc.ru/ru/cat/unu/unikuum/03_06.html).
Получили биоинертное покрытие на основе титана, ниобия, циркония и азота. По вышеуказанным методикам, приведенным на с. 7-10 настоящего описания, провели испытания титанового штифта с полученным покрытием на пролиферативную активность клеточных линий, противомикробную активность и цитотоксичность. Результаты подтверждают, что процентное содержание выживших клеток при испытаниях на пролиферативную активность клеточных линий выше, чем у титанового штифта без покрытия. Также результаты подтверждают, что покрытие обладает противомикробной активностью, а также не является токсичным. Значения микротвердости, нанотвердости, модуля упругости и предела прочности сформированного покрытия находятся в интервалах соответствующих значений, приведенных на с. 6 описания.
Пример 2.
Обработке подвергали титановую пластину Т-образную косую (медицинский титановый сплав марки Titanium Grade 5, химический состав %: Ti 88,096, С 0,07, V 4,5, Н 0,014, О 0,19, N 0,04, Fe 0,39, А1 6,7) площадью 15 см2, применяемую для остеосинтеза дистального метаэпифиза лучевой кости.
Использовали трехслойный композиционный электрически взрываемый проводник, один из слоев которого состоял из тинановой фольги массой 500 мг, второй слой - из ниобиевой фольги 1000 мг, а третий слой -из циркониевой фольги 1000 мг. Сформированной плазменной струей оплавляли поверхность Т-образной косой пластины при поглощаемой плотности мощности 1,8 ГВт/м2 и формировали на ней электровзрывное покрытие на основе титана, ниобия и циркония. Электровзрывное напыление осуществляли на электровзрывной установке ЭВУ 60/10 М (Автоматизированная электровзрывная установка для повышения эксплуатационных характеристик материалов / Ю.Д. Жмакин, Д.А. Романов, Е.А. Будовских и др. // Промышленная энергетика. - 2011. - №6. С. 22-25). Азотирование проводили в течение 5 часов при температуре 600°С. Последующую импульсно-периодическую электронно-пучковую обработку поверхности покрытия проводили при поглощаемой плотности энергии 40 Дж/см2, длительности импульсов 200 мкс и количестве 5 импульсов. Азотирование и электронно-пучковую обработку проводили на установке «КОМПЛЕКС» (https://www.hcei.tsc.ru/ru/cat/unu/unikuum/03_06.html).
Получили биоинертное покрытие на основе титана, ниобия, циркония и азота. По вышеуказанным методикам, приведенным на с. 7-10 описания, провели испытания титанового штифта с полученным покрытием на пролиферативную активность клеточных линий, противомикробную активность и цитотоксичность. Результаты подтверждают, что процентное содержание выживших клеток при испытаниях на пролиферативную активность клеточных линий выше, чем у титанового штифта без покрытия. Также результаты подтверждают, что покрытие обладает противомикробной активностью, а также не является токсичным. Значения микротвердости, нанотвердости, модуля упругости и предела прочности сформированного покрытия находятся в интервалах соответствующих значений, приведенных на с. 6 описания.
Предлагаемый способ позволяет сформировать покрытие, которое по совокупности свойств, характеристикам структуры и фазовому составу позволяет увеличить срок службы имплантатов, и расширить область практического применения.

Изобретение направлено на формирование на титановых имплантатах покрытий на основе титана, ниобия, циркония и азота, которые могут быть использованы в медицинской технике, травматологии и ортопедии как биоинертные покрытия с антибактериальным эффектом. Осуществляют электрический взрыв трехслойного композиционного электрически взрываемого проводника, один из слоев которого состоит из титановой фольги массой 50-500 мг, второй и третий слои выполнены соответственно из ниобиевой и циркониевой фольги массами, равными 0,5-2,0 массы первого слоя. Формируют из продуктов взрыва импульсную многофазную плазменную струю. Оплавляют ею поверхность имплантата из титанового сплава при поглощаемой плотности мощности 1,5-1,8 ГВт/м2. Осаждают на поверхность титанового имплантата продукты взрыва и формируют на ней биоинертное покрытие на основе титана, ниобия и циркония. Затем проводят азотирование в течение 3-5 ч при температуре 500-600°С. Осуществляют последующую импульсно-периодическую электронно-пучковую обработку поверхности покрытия при поглощаемой плотности энергии 20-40 Дж/см2, длительности импульсов 150-200 мкс и количестве импульсов от 3 до 5. Обеспечивается получение биоинертного покрытия на основе титана, ниобия, циркония и азота на поверхности медицинских титановых имплантатов, обладающего антибактериальной активностью. 5 ил., 2 пр.
Способ нанесения биоинертных покрытий на основе титана, ниобия, циркония и азота на титановый имплантат, включающий электрический взрыв трехслойного композиционного электрически взрываемого проводника, один из слоев которого состоит из титановой фольги массой 50-500 мг, второй и третий слои соответственно состоят из ниобиевой и циркониевой фольги массами, равными 0,5-2,0 массы первого слоя, формирование из продуктов взрыва импульсной многофазной плазменной струи, оплавление ею поверхности имплантата из титанового сплава при поглощаемой плотности мощности 1,5-1,8 ГВт/м2, осаждение на указанную поверхность продуктов взрыва и формирование на ней биоинертного покрытия на основе титана, ниобия и циркония, затем проводят азотирование в течение 3-5 ч при температуре 500-600°С и осуществление последующей импульсно-периодической электронно-пучковой обработки поверхности покрытия при поглощаемой плотности энергии 20-40 Дж/см2, длительности импульсов 150-200 мкс и количестве импульсов от 3 до 5.
| СПОСОБ НАНЕСЕНИЯ БИОИНЕРТНЫХ ПОКРЫТИЙ НА ОСНОВЕ ЦИРКОНИЯ НА ТИТАНОВЫЕ ИМПЛАНТАТЫ | 2018 |
|
RU2686092C1 |
| НОВАЯ ПОВЕРХНОСТЬ МЕТАЛЛИЧЕСКИХ ИМПЛАНТАТОВ НА ОСНОВЕ ТИТАНА, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ВВЕДЕНИЯ В КОСТНУЮ ТКАНЬ | 2007 |
|
RU2435613C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОВЕРХНОСТИ МЕТАЛЛИЧЕСКОГО ИМПЛАНТАТА НА ОСНОВЕ ТИТАНА ДЛЯ ВСТАВЛЕНИЯ В КОСТНУЮ ТКАНЬ | 2007 |
|
RU2448739C2 |
| Устройство для выпрямления трехфазного переменного тока помощью ртутного выпрямителя | 1926 |
|
SU15569A1 |
| FR 2982618 A1, 17.05.2013 | |||
| CN 105056297 B, 23.02.2018. | |||
Авторы
Даты
2023-03-28—Публикация
2022-10-28—Подача