Изобретение относится к медицине, ветеринарии, конкретно к фармакологии, и касается применения гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в качестве мембраностабилизирующего средства для профилактики и лечения заболеваний бронхолегочной системы, в том числе при вирусных и бактериальных инфекциях, включая коронавирусную инфекцию вызываемой различными штаммами вируса SARS-COV-2
Также может быть использовано в профилактике и лечении онкологических больных при действии радиационного облучения и химиопрепаратов, при других заболеваний, связанных со стабилизацией мембраны клеток.
Многочисленные мембранные структуры клеток организма выработаны в процессе длительной эволюции форм организации клеточного пространства, фиксирования ферментных систем и регуляции метаболизма. Доказано, что при многих болезнях в первую очередь страдают именно клеточные мембраны, особенно их липидный компонент, в норме обеспечивающий непрерывность, жидкостность мембран, оптимальные условия для функционирования встроенных в мембрану ферментов, транспортных белков, многочисленных рецепторов. Установлена патогенетическая роль повреждения липидного компонента мембран эпителия органов и тканей при формировании различных патологии. В связи с этим эффективность комплексной терапии во многом зависит от степени защиты структуры и функции клеточных мембран, поэтому при любой патологии обосновано включение в лечебный комплекс мембраностабилизирующих препаратов. Указанные препараты могут быть использованы и как монотерапия для лечения и профилактики болезней, в основе которых лежит первичное повреждение клеточных мембран, в качестве защиты от различных повреждающих воздействий.
Комплекс мембраностабилизирующих средств может быть довольно широким, что обусловлено большим разнообразием факторов повреждающих структуру и функцию клеточных мембран: процессы пероксидации в результате гипоксии, стрессов; ионизирующей радиации, интоксикации тяжелыми металлами; процессы, возникающие при осмотическом, геморрагическом шоке; спонтанный и фосфолипазный гидролиз фосфолипидов; снижение энергообеспечения мембраносвязанных транспортных систем; аутоиммунное повреждение; избыточная циркуляция гормонов (катехоламины, гипервитаминоз Д); нарушение клеточного гомеостаза кальция; вирусные и бактериальные инфекции и другие.
Известно, что клеточная мембрана - это динамическая структура, которая непрерывно изменяет свою форму. Важнейшие клеточные процессы, такие как экзо - и эндоцитоз, внутриклеточный везикулярный транспорт, связаны с топологическими перестройками мембран, слиянием и делением, требующими локального нарушения бислойной структуры. Эти процессы сопряжены с формированием сильно искривленных мембранных поверхностей, определенная конфигурация и липидный состав которых поддерживается за счет специфических липид-белковых взаимодействий. Аналогичные процессы локального изменения морфологии мембран реализуются при действии радиационного облучения и химиопрепаратов и на различных стадиях инфицирования клетки бактериями и вирусами, в частности, вирусами гриппа, будь то поглощение вириона в процессе клеточного эндоцитоза, слияние вирусной и эндосомальной мембраны, предшествующее выходу генетического материала вируса в цитоплазму зараженной клетки, или отпочковывание дочерних вирусных частиц с поверхности ее плазматической мембраны. Понятно, что затраты энергии, необходимые для осуществления подобных топологических перестроек мембранных структур клетки, будут определяться механическими свойствами мембраны как сплошной среды. Необходимый формализм для такого описания был разработан в работах Хельфрика [Helfrich W. Elastic properties of lipid bilayers: theory and possible experiments // Z. Naturforsch - 1973 - 28 - P. 693-703], и дополнен Хаммом и Козловым [Hamm M. Elastic energy of tilt and bending of fluid membranes / Hamm M., Kozlov M.M. // Eur. Phys. J. - 2000 - P. 323-335]. В этих работах было предложено рассматривать липидный бислой клетки как двумерный жидкий кристалл и использовать для описания механических свойств мембран теорию упругости жидких кристаллов. В рамках этого подхода средняя ориентация липидных молекул описывается векторным полем единичных векторов, называемых директором, n. Поле директоров задается на некоторой поверхности, проходящей внутри липидного монослоя. Форма поверхности характеризуется векторным полем единичных нормалей к ней, N. В механике мембран, как правило, рассматриваются три основные независимые деформации: поперечного изгиба, наклона и латерального растяжения/сжатия. Деформация поперечного изгиба соответствует появлению угла между директорами в близких точках разделяющей поверхности, и количественно характеризуется дивергенцией директора, div(n). Деформация наклона соответствует отклонению директора от нормали и количественно характеризуется вектором наклона t = n - N. Латеральное растяжение/сжатие характеризуется относительным изменением площади разделяющей поверхности монослоя, (a - a0)/a0, где a - текущая площадь, приходящаяся на липид на разделяющей поверхности, a0 - исходная площадь. Часть свободной энергии, связанная с деформациями, представляется разложением в ряд Тейлора по этим деформационным модам относительно спонтанного состояния, в предположении малости деформаций. Кривизна монослоя в спонтанном состояние может быть отличной от нуля. Эта кривизна называется спонтанной. Спонтанная кривизна определяется липидным составом мембраны. Считается, что спонтанная кривизна многокомпонентного монослоя равна средневзвешенной по концентрациям спонтанной кривизне отдельных компонентов. Таким образом, деформационная часть свободной энергии оказывается, связана с «химическим» вкладом в силу зависимости спонтанной кривизны от концентраций липидных компонентов. Каждая из деформаций характеризуется своим модулем, т.е. энергией, которую необходимо затратить для ее реализации. Эксперименты в различных модельных липидных системах показали, что наибольший модуль характерен для деформации латерального растяжения/сжатия мембраны, и поэтому подобная деформация практически не реализуется в процессах клеточного морфогенеза, а наибольшее влияние на процессы топологических перестроек мембраны оказывает деформация поперечного изгиба [Галимзянов Т.Р. Линейное натяжение и структура границы рафта, рассчитанные с учетом деформаций изгиба, наклона и растяжения/сжатия /Т.Р. Галимзянов, Р.Ю. Молотковский, С.А. Акимов//Биол. Мембраны - 2011- 28(5) - P.415-422].
В связи с развитием неблагоприятной ситуации, связанной с распространением заболеваний, вызванных бактериальной и вирусной инфекцией, актуальным в настоящее время является разработка эффективного лекарственного препарата для предупреждения развития пневмонии, которая является главным осложнением гриппа и других вирусных инфекций (ОРВИ, включая коронавирусную инфекцию вызываемой различными штаммами вируса SARS-COV-2).
Известно, что для химического ряда 5-оксииндолов, например, умифеновира кроме вирусспецифической активности выявлено общее мембраностабилизирующее действие, что может обеспечить сохранение целостности и функциональности клеток при вирусных и бактериальных инфекциях [Galiano V., Villalain J. The Location of the Protonated and Unprotonated Forms of Arbidol in the Membrane: A Molecular Dynamics Study// J. Membrane Biol. (2016). - 249:381-391].
Известны соединения, обладающие противовирусной активностью, способ их получения /Патент РФ № 2387642, C07D401/06, опубл. 31.10.2007/.
Известно интерферониндуцирующее средство для лечения острых респираторных вирусных инфекций (ОРВИ) /Патент РФ №2445094, A61K 31/496, опубл.20.03.2012/.
Известно средство против вируса гриппа В /Патент РФ №2435582, A61K 31/40,опубл.10.12.2011/.
Известны клатратные комплексы бета-циклодекстрина с 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-н-индол-3-ил]карбонил}-4-бензилпиперазином, обладающие противовирусной активностью, их получение и применение/ Патент РФ № 2448120, C08B 37/16,опубл.20.04.2012/.
Указанные средства представляют собой гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин и обладают вирусспецифической активностью.
Технической проблемой, решаемой настоящим изобретением, является расширение арсенала средств, обладающих мембраностабилизирующим действием, то есть свойством изменять гибкость и увеличивать устойчивость мембран эпителиальных клеток организма, в том числе бронхолегочной системы, способствовать созданию специфической иммунной защиты с целью предупреждения развития пневмонии, бактериальной и вирусной этиологией, в том числе вызываемой различными штаммами вируса SARS-COV-2, а также онкологических заболеваниях при воздействии радиационного облучения и химиопрепаратов, при других заболеваний, связанных со стабилизацией мембраны клеток.
Свойство гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина изменять гибкость и увеличивать устойчивость мембран эпителиальных клеток организма, в том числе бронхолегочной системы, способствовать созданию специфической иммунной защиты является для специалиста фактом неочевидным и не вытекает из уровня техники в данной области, не обнаружено в патентной и научно-медицинской литературе.
Вышеуказанное свойство гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина может быть использовано в практическом здравоохранении и ветеринарии для повышения качества профилактики и лечения. Таким образом, предлагаемое техническое решение соответствует критериям патентоспособности изобретения, а именно «новизна», «изобретательский уровень» и «промышленная применимость».
Новым в предлагаемом изобретении является то, что в качестве мембраностабилизирующего средства, встраивающегося в бислойную липидную мембрану, приводящему к значительному (в 3 раза) уменьшению изгибной жесткости последней, ее топологической перестройке вследствие чего существенно затрудняющему проникновение вирусной частицы в эпителиальные клетки и тем самым предотвращать развитии пневмонии, вызванная бактериальной и вирусной инфекцией, в том числе вызываемыми различными штаммами вируса SARS-COV-2 может применяться гидрохлорид 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин.
Технической проблемой, на решение которой направлено заявляемое изобретение, является расширение арсенала средств, обладающих одновременно выраженным вирусоспецифическим действием и мембраностабилизирующим свойством.
Для достижения технического результата в настоящем изобретении предлагается мембраностабилизирующее средство, обладающее свойством изменять гибкость и увеличивать устойчивость мембран эпителиальных клеток организма, в том числе бронхолегочной системы, вследствие чего существенно, затрудняющему проникновение вирусной частицы в эпителиальные клетки и тем самым предотвращать развитии пневмонии, вызванная бактериальной и вирусной инфекцией, в том числе вызываемыми различными штаммами вируса SARS-COV-2.
Сущность заявленного изобретения иллюстрируется следующими рисунками:
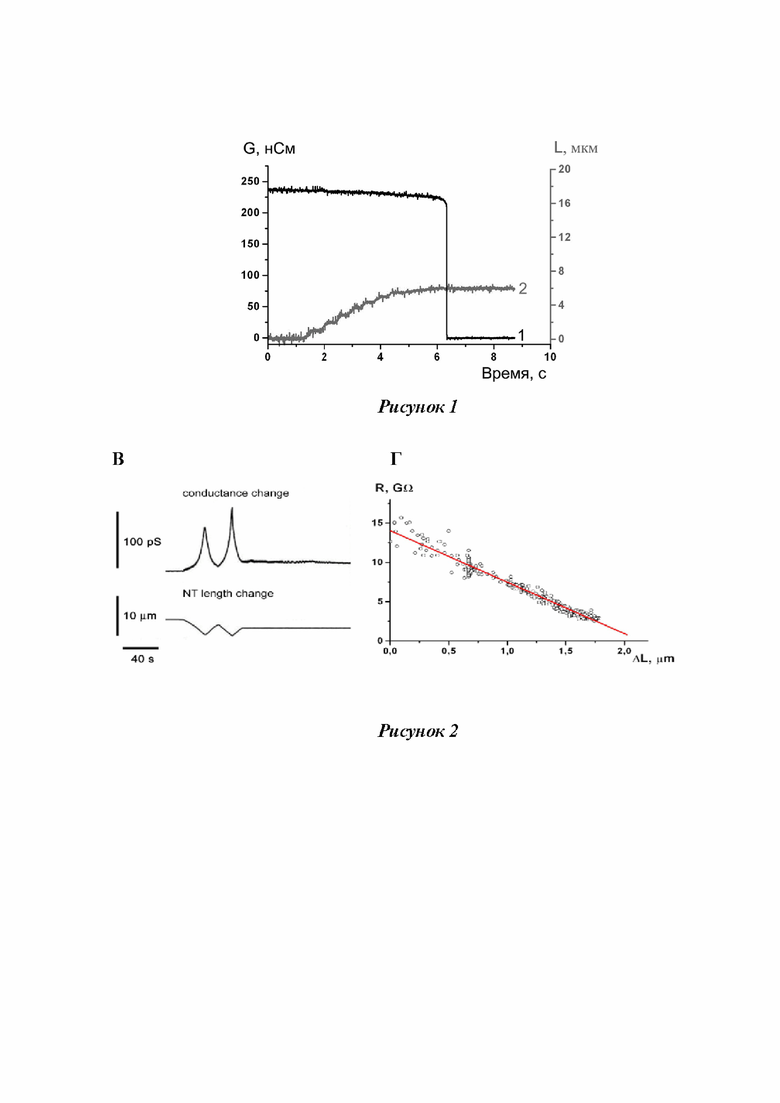
Рисунок 1 - Изменение проводимости трубки (кривая 1), вызванное отведением пэтч-пипетки от БЛМ (кривая 2, правая шкала).
Рисунок 2 - В - изменение проводимости НТ, вызванное изменением ее длины. Г - аппроксимация экспериментальной зависимости R от L линейной функцией.
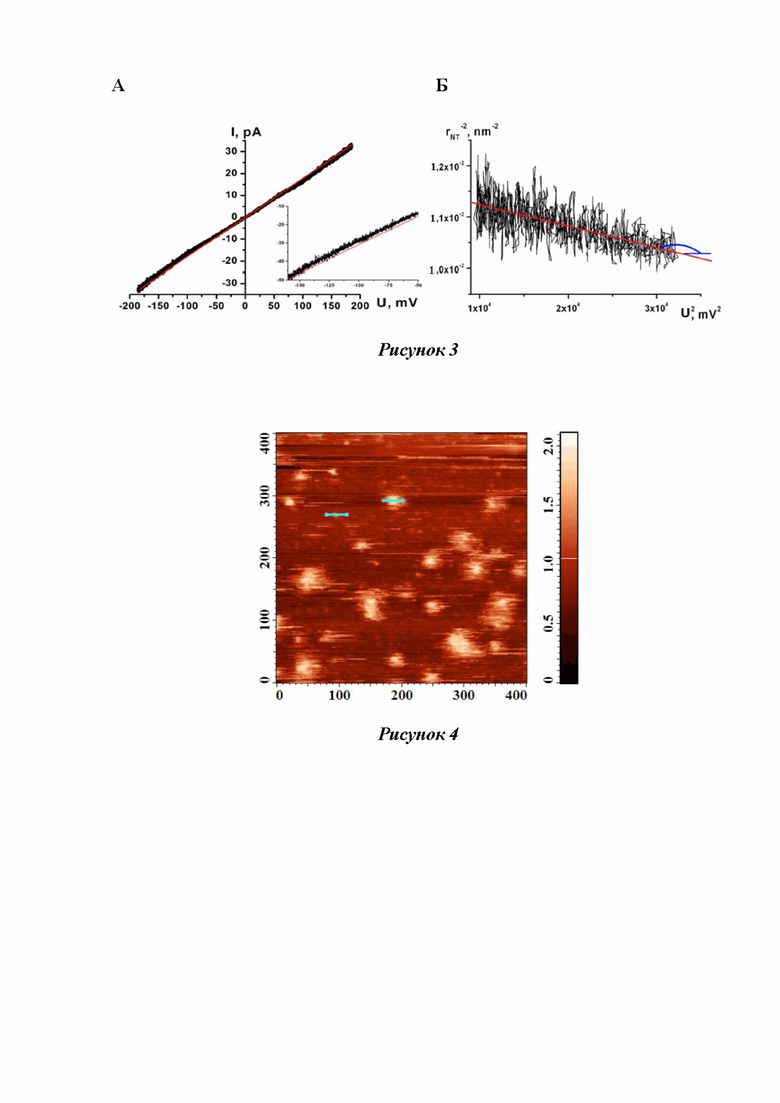
Рисунок 3 - A - вольт-амперная характеристика НТ при фиксированном значении её длины, Б - аппроксимация экспериментальной зависимости rНТ –2 от U2 линейной функцией.
Рисунок 4 - Изображение адсорбированного из водного раствора на поверхности слюды гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина. Все шкалы приведены в нм.
Рисунок 5 - Изображение адсорбированного из раствора в хлороформе на поверхности слюды гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина. Все шкалы приведены в нм.
Сущность изобретения поясняется примером конкретного выполнения.
Модель липидной нанотрубки и ее применение для анализа механических свойств мембран
Для проведения этих исследований была выбрана модель липидной нанотрубки (НТ), впервые предложенная сотрудниками лаборатории биоэлектрохимии ИФХЭ РАН, и хорошо зарекомендовавшая себя при исследованиях процесса морфогенеза липидных мембран в процессе клеточного эндоцитоза [Bashkirov P.V. GTPase cycle of dynamin is coupled to membrane squeeze and release, leading to spontaneous fission / P.V. Bashkirov, S.A. Akimov, A.I. Evseev, S.L. Schmid, J.Zimmerberg, V.A. Frolov // Cell - 2008 - 135(7) - P. 1276-1286; Shnyrova A.V. Geometric catalysis of membrane fission driven by flexible dynamin rings. / P.V. Bashkirov, S.A. Akimov, T.J. Pucadyil, J. Zimmerberg, S.L. Schmid, V.A. Frolov // Science - 2013- 339(6126) - P. 1433-1436].
Для исследования влияния гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина на механические свойства мембран использовалась экспериментальная установка, состоящая из универсального генератора PAR-175 (Princeton Applied Research, США), пэтч-кламп усилителя EPC-8 (HEKA Elektronik, Германия), четырехполюсного фильтра F-900 (Frequency Devices, США) и осциллографа OS-1420 (GOULD, Англия). Положение пипетки относительно бислойной липидной мембраны (БЛМ) варьировалось с помощью контроллеров движения Newport Motion Controller (Model 860-C2) и заранее откалиброванного микроконтроллера движения Model ESA-CSA (Newport, США) (пьезоконтроллер, позволяющий менять вертикальное положение пипетки с точностью до 0,1 мкм).
Формирование модельной бислойной липидной мембраны (БЛМ) осуществлялось методу Мюллера-Рудина [Mueller P. Methods for the formation of single bimolecular lipid membranes in aqueous solution / P. Mueller, D.O. Rudin, H.T. Tien, W.C. Wescott // J. Phys. Chem. - 1963 - 67 - P. 534-535] на отверстиях в медной решетке (EMS, США) диаметром ~100 мкм, расположенной в объеме чашки Петри. Отверстия решетки обрабатывались раствором фосфолипидов (Avanti Polar Lipids Inc., США) в смеси октан/декан 1/1 (Sigma, США) в концентрации 10 мг/мл и высушивались в атмосфере. После этого чашка Петри заполнялась раствором электролита (10 мМ KCl, 1 мМ Hepes, 0,1 мМ EDTA, pH = 7,0; 50 мМ KCl, 5 мМ Hepes, 0,5 мМ EDTA, pH = 7,0 или 100 мМ KCl, 10 мМ HEPES, pH 7,0), и на отверстия в решетке кисточкой наносилась капля раствора фосфолипидов в сквалане (Sigma, США) в концентрации 10 мг/мл, которая в течение нескольких минут спонтанно образовывала БЛМ. При этом растворитель и излишний липид уходили в объёмную фазу, окружающую БЛМ, то есть в мениск. В экспериментах использовались следующие растворы липидов: 1,2-диолеоил-sn-глицеро-3-фосфатидилхолин (DOPC), 10 мг/мл 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолин (POPC), 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE), 1,2-диолеоил-sn-глицеро-3-фосфатидилсерин (DOPS) и холестерин (Cholesterol) (Avanti Polar Lipids Inc., США) в хлороформе, концентрацией 10 мг/мл, в соотношениях, указанных в тексте.
После формирования БЛМ на хлорсеребряные электроды посредством пэтч-кламп усилителя подавался пилообразный сигнал с генератора, и регистрировался емкостной ток мембраны в режиме фиксации потенциала. С помощью микроманипулятора к мембране подводили пэтч-пипетку, так что между кончиком микропипетки и мембраной формировался плотный контакт (сопротивление контакта 1-10 ГОм), что было видно по резкому уменьшению емкостного тока. Для разрушения мембраны под пипеткой скачком менялось гидростатическое давление, что приводило к появлению тока проводимости. После этого, отводя пипетку от плоской мембраны, вытягивали мембранную трубку. Электрическая проводимость трубки измерялась в режиме фиксации разности потенциалов между измерительным электродом внутри пэтч-пипетки и земляным электродом во внешнем объеме электролита с помощью усилителя тока. Значения используемых потенциалов указаны в тексте.
Плавное изменение длины трубки осуществлялось с помощью пьезоконтроллера. Полученные данные - ток через трубку, преобразованный пэтч-кламп усилителем в напряжение (коэффициенты усиления от 1мВ/пА до 30мВ/пА), значения приложенного к концам трубки электрического напряжения и данные с индикатора пьезоконтроллера - записывались на жесткий диск компьютера после предварительной оцифровки с помощью АЦП L-305/L-1210 (L-card, Россия). Частота опроса 1 кГц. Перед вводом в компьютер сигналы пропускались через фильтр низких частот (F-900); частота среза 0,5 кГц. Показания пьезоконтроллера пересчитывались в значения вертикального смещения пипетки с помощью калибровочной кривой. При переходе МТ в НТ ток проводимости резко падал до нуля (Рисунок 1, кривая 1), после чего движение пипетки останавливалось. Далее, усиливая сигнал от тока проводимости в 10-30 раз и приближая пьезоконтроллером пипетку к мембране, снимали изменения тока проводимости через НТ, и если наблюдалось увеличение тока, то можно было сказать о наличии НТ между пипеткой и мембраной. После чего снимали зависимость силы тока проводимости от положения микропипетки.
Особенности формирования НТ позволяют следить за изменением проводимости вытягиваемой трубки в зависимости от её длины (Рисунок 3, В). Измеряемая в ходе эксперимента проводимость включает в себя проводимость НТ и проводимость утечки в месте контакта мембраны с пэтч-пипеткой. Считая, что форма НТ слабо отличается от цилиндрической, и, предполагая, что проводимость утечки постоянна (при движении пипетки меняется только длина L НТ), электрическое сопротивление R НТ должно линейно зависеть от изменения длины ΔL НТ. Действительно, линейная функция дает хорошую аппроксимацию зависимости R(L) (Рисунок 3, Г). Таким образом, так как:
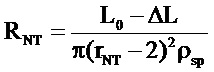 ,
,
где ρsp - удельное сопротивление электролита, то может быть вычислена как длина L НТ, так и её радиус rNT.
В случае если НТ содержит заряженные липиды, необходимо учитывать тот факт, что концентрация ионов электролита внутри НТ выше, чем снаружи [10].
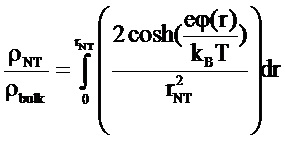 ,
,
где ρNT/ρbulk - удельная проводимость электролита внутри НТ/снаружи НТ, ϕ® - распределение потенциала внутри НТ.
Равновесный радиус такой НТ определяется как:
 .
.
Для измерения механических параметров был применен метод [Башкиров П.В. Мембранные нанотрубки в электрическом поле как система для измерения механических параметров липидного бислоя // Биол. Мембраны - 2007 - 24(2) - P. 183-192]. Суть метода заключается в анализе зависимости измеряемого радиуса НТ от величины, приложенной к ее концам разности потенциалов. Дело в том, что равновесный радиус НТ определяется корнем отношения модуля изгиба мембраны НТ к латеральному натяжению БЛМ, а согласно уравнению электрокапиллярности Липпмана, латеральное натяжение уменьшается при появлении трансмембранного напряжения. Таким образом, в результате падения электрического потенциала вдоль НТ, происходит изменение трансмембранного потенциала на стенке НТ от приложенного значения на одном конце до 0 на противоположном. Это приводит к тому, что форма НТ отклоняется от цилиндрической. Однако, как показали наши теоретические расчеты, электрическое сопротивление НТ сохраняет линейную зависимость от ее длины. Таким образом, измеряемый радиус НТ соответствует радиусу некого эффективного цилиндра, который имеет туже проводимость и длину, что и НТ. Причем величина эффективного радиуса НТ связана с механическими параметрами и величиной приложенной к концам НТ разности потенциалов следующим выражением:
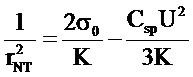 ,
,
где K - модуль изгиба мембраны, σ0 - латеральное натяжение БЛМ, Csp - удельная электрическая емкость БЛМ, U - напряжение, приложенное к концам НТ.
Следовательно, из линеаризации зависимости обратного квадрата радиуса НТ от квадрата приложенного напряжения можно найти и модуль изгиба мембраны, и латеральное натяжение БЛМ (Рисунок 3).
Результаты исследований взаимодействия гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина с липидными нанотрубками.
Для исследования влияние гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина на механику липидного матрикса клеточных мембран, с использованием модели липидных нанотрубок, был выбран липидный состав, аналогичным описанному для клеток почки собаки Майдин-Дэрби (MDCK) (основные компоненты - фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и холестерин), на которых проводилось подробное изучение клеточного и вирусного липидома, их общих черт и отличий [Gerl M.J., Quantitative analysis of the lipidomes of the influenza virus envelope and MDCK cell apical membrane / M.J. Gerl, J.L. Sampaio, S. Urban, L. Kalvodova, J.-M. Verbavatz, B. Binnington, D. Lindemann, C.A. Lingwood, A. Shevchenko, C. Schroeder, K. Simons //J. Cell Biol. - 2012 - 196(2) P. 213-221]. Кроме того, были использованы липиды как с насыщенными, так и с ненасыщенными липидными хвостами, что характерно для клеточных мембран. В ряде экспериментов, при оценке влияния заряженных липидов на процесс взаимодействия гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина с липидными мембранами, заряженные компоненты мембраны были удалены и заменены на нейтральный диолеоилфосфатидилхолин (DOPC). Аналогично, в случае экспериментов с различным количеством холестерина также отходили от клеточного состава.
Добавление гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в систему осуществлялась тремя различными способами: из раствора в деионизированной воде концентрацией 0,1 мг/мл; из раствора в 96% этиловом спирте концентрацией 1 мг/мл; либо путем добавления раствора гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в хлороформе концентрацией 1 мг/мл непосредственно к липидной смеси на стадии формирования БЛМ.
В первом случае (водный раствор концентрацией 0,1 мг/мл) гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин не растворялся полностью: в воде оставалась взвесь, которая не исчезала в течение длительного времени (две недели). Поэтому для дальнейшей работы этот раствор был выдержан в ультразвуковой ванне и отфильтрован через поры диаметром 100 нм. Полученный раствор был исследован методом атомной силовой микроскопии (АСМ) на подложке из слюды. Для этого он наносился на слюду (диаметр подложки составлял 1,5 см) в объеме около 200 мкл и инкубировался в течение 15 минут при комнатной температуре, далее каплю раствора высушивали потоком аргона. Полученный образец сканировался в резонансном режиме работы прибора (tapping mode).
Из полученного изображения (Рисунок 4) видно, что на поверхности слюды представлены сферические частицы вещества, размеры которых сильно варьируются: высоты частиц составляет от 0,6 до 1,4 нм, диаметр частиц лежит в диапазоне 20-80 нм. Полученные данные свидетельствуют о том, что в воде гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин представлена, в основном, в виде агломератов.
Как в хлороформе, так и в 96%-м растворе этилового спирта гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин в концентрации 1 мг/мл растворился полностью. Изображения, полученные методом АСМ, показали, что в этих случаях гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин представлена частицами, высоты которых лежат в диапазоне от 0,2 до 0,9 нм, а диаметр составляет от 12 до 20 нм (Рисунок 5).
Однако раствор гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в этаноле через две недели приобрел желтоватый окрас, интенсивность которого зависела от ее концентрации. Это может свидетельствовать о переходе гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина из формы гидрохлорида в форму основания.
Было проведено исследование взаимодействия спиртового раствора гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина с мембраной следующего липидного состава: DOPC/DOPE/POPC/Cholesterol = 49/13/13/25 mol%. (DOPC - диолеоилфосфатидилхолин; DOPE - диолеоилфосфатидилэтаноламин; POPC - пальмитоилолеоилфосфатидилолин).
Было показано, что добавление спиртового раствора гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в систему до конечной концентрации в 1 мкг/мл (буфер 10 мМ KCl, 1 мМ Hepes, 0,1 мМ EDTA, pH = 7,0) статистически достоверно уменьшает изгибный модуль мембраны в два раза. Дальнейшее увеличение концентрации гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в растворе до 2 мкг/мл не приводило к статистически значимому изменению модуля изгиба. Было выявлено, что латеральное натяжение мембраны не зависело от наличия гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в растворе. В контрольных экспериментах было показано, что при добавлении этилового спирта к мембране (максимальное значение объемной доли спирта в растворе достигало 0,2%, что соответствовало аналогичной добавке спиртового раствора гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина) изгибный модуль мембраны не изменялся. Однако, тот факт, что в спиртовом растворе гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина, возможно, переходит из формы гидрохлорида в форму основания, не позволяет сделать определенный вывод о влиянии исходного гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина на мембрану при добавлении его в спиртовом растворе.
Было проведено исследование свойств мембраны при наличии в ней гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина. Для этого в раствор липидов DOPC/DOPE/POPC/Cholesterol, растворенных в хлороформе, был добавлен гидрохлорид 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин, также растворенный в хлороформе (концентрация 1 мг/мл). Эксперименты проводились для следующего соотношения компонентов: DOPC/DOPE/POPC/Cholesterol/ гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин = 49-X/13/13/25/X mol%, где X принимает значения: 0,02; 0,1; 0,5 mol%. Полученные значения модуля изгиба мембраны не зависели от исходной концентрации гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в смеси, и составили (0,3±0,1)×10-19 Дж. Значение модуля изгиба в отсутствии гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина составили (0,9±0,1)×10-19, то есть гидрохлорид 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин, изначально добавленный в состав мембраны, понижает ее модуль изгиба в 3 раза. Причем, факт отсутствия зависимости модуля изгиба от концентрации гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в мембране, скорее всего, говорит о том, что уже при концентрации 0,02 mol% достигается практически предельно возможная ее концентрация в бислойной липидной мембране.
Было проведено исследование взаимодействия водного раствора гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина, приготовленного, как описано выше, с мембраной в зависимости от концентрации холестерина в ней. Эксперименты проводились с буферным раствором: 50 мМ KCl, 5 мМ Hepes, 0,5 мМ EDTA, pH = 7,0 , липидным составом DOPC/DOPE/POPC/Cholesterol = 49/13/13/25 mol% и DOPC/DOPE/POPC/Cholesterol = 34/13/13/40 mol%. При 25 mol% холестерина в отсутствии гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина значение модуля изгиба составляет с, после добавления гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина модуль уменьшился до значения (0,4±0,1)×10-19 Дж, что, в пределах погрешности измерений, соответствует результатам, полученным при его внесении непосредственно в состав мембраны из раствора в хлороформе (падение модуля изгиба в 2-3 раза). В случае 40 mol% холестерина, что соответствует его уровню в составе липидной оболочки вируса гриппа [Gerl M.J., Quantitative analysis of the lipidomes of the influenza virus envelope and MDCK cell apical membrane / M.J. Gerl, J.L. Sampaio, S. Urban, L. Kalvodova, J.-M. Verbavatz, B. Binnington, D. Lindemann, C.A. Lingwood, A. Shevchenko, C. Schroeder, K. Simons //J. Cell Biol. - 2012 - 196(2) P. 213-221], в отсутствии гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина значение модуля изгиба совпадает со значением для мембраны при 25 mol% холестерина (0,9±0,1)×10-19 Дж. После добавления водного раствора гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина значение данного модуля составило (0,6±0,1)×10-19 Дж, то есть его эффект на изгибную жесткость мембраны уменьшился пропорционально концентрации холестерина в мембране.
При введении в систему заряженный липидов (фосфатидилсерин) до уровня, соответствующего среднему содержанию данных липидов в клеточных мембранах (состав DOPC/DOPE/POPC/Cholesterol/DOPS = 34/13/13/25/15 mol%) (DOPS - диолеоилфосфатидилсерин) эффект гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина на уменьшение изгибной жесткости мембраны становился наиболее выраженным: наблюдалось падение модуля изгиба от (0,88±0,14)×10-19 Дж до (0,22 ± 0,10) × 10-19 Дж.
Таким образом, проведено исследования влияния гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина на механические свойства липидных мембран на модели липидных нанотрубок. Были рассмотрены три возможных варианты добавления гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в систему: в виде отфильтрованного водного раствора, в виде раствора в спирте и путем непосредственного введения в состав мембраны из раствора в хлороформе. Во всех этих случаях отмечено, что при добавлении гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина к липидной мембране изгибная жесткость последней уменьшалась. Однако в случае спиртового раствора происходил переход гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина из формы гидрохлорида в форму основания, в связи с чем для дальнейших исследований эти растворы не использовались. Факт совпадения результатов для случая добавления гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в виде водного раствора в омывающий мембрану буфер с результатами для непосредственного его встраивания в состав БЛМ показывают, что во всех случаях наблюдается встраивание гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в мембрану, приводящее к 3-х кратному уменьшению изгибной жесткости последней. Причем предельная концентрация гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в составе липидного бислоя не превышает 0,02 мольных процента. Так как низкая изгибная жесткость мембран, как было сказано выше, упрощает локальные топологические перестройки мембран клеток [Campelo F. Helfrich model of membrane bending: from Gibbs theory of liquid interfaces to membranes as thick anisotropic elastic layers / F. Campelo, C. Arnarez, S.J. Marrink, M.M. Kozlov // Adv. Colloid Interface Sci. - 2014 -208 P. 25-33], то гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин, может ускорять процессы жизнедеятельности клетки, синаптической передачи, фагоцитоза и т.п. Необходимо отметить, что максимальный эффект падения изгибной жесткости наблюдался при наличии в составе мембраны заряженных липидов, то есть именно в том случае, когда липидный состав нанотрубок максимально близко отображал состав клеточных мембран.
Таким образом, у гидрохлорида 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина обнаружено не только выраженное вирусоспецифическое действие, но и свойства изменять гибкость и увеличивать устойчивость мембран эпителиальных клеток организма в том числе бронхолегочной системы, вследствие чего существенно затрудняющему проникновение вирусной частицы в эпителиальные клетки и тем самым предотвращать развитии пневмонии, вызванная бактериальной и вирусной инфекцией в том числе вызываемыми различными штаммами вируса SARS-COV-2. Результаты проведенных исследований позволяют рассматривать гидрохлорид 1-{[6-бром-1- метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин к применению до- и во время вирусной эпидемии, в том числе для предупреждения развития вирусной пневмонии, которая является главным осложнением гриппа и других вирусных инфекций (ОРВИ, включая коронавирусную инфекцию вызываемой различными штаммами вируса SARS-COV-2).
Также следует отметить, что гидрохлорид 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазин, обладая мембраностабилизирующим действием может предупреждать повреждения липидного компонента мембран эпителия органов и тканей за счет увеличения их устойчивости к химио- и радиотерапии опухолей у онкологических больных и тем самым повысить эффективность лечения и снизить побочные эффекты противоопухолевых лекарственных средств и облучения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛАТРАТНЫЕ КОМПЛЕКСЫ БЕТА-ЦИКЛОДЕКСТРИНА С 1-{[6-БРОМ-1-МЕТИЛ-5-МЕТОКСИ-2-ФЕНИЛТИОМЕТИЛ-1-Н-ИНДОЛ-3-ИЛ]КАРБОНИЛ}-4-БЕНЗИЛПИПЕРАЗИНОМ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2010 |
|
RU2448120C1 |
| СРЕДСТВО ПРОТИВ ВИРУСА ГРИППА В | 2010 |
|
RU2435582C1 |
| ПРОИЗВОДНЫЕ 5-ЗАМЕЩЕННЫХ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2387642C2 |
| ИНТЕРФЕРОНИНДУЦИРУЮЩЕЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ (ОРВИ) | 2010 |
|
RU2445094C1 |
| ПРОИЗВОДНЫЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2552422C2 |
| ПОЛУЧЕНИЕ ВОДОРАСТВОРИМОГО СОЕДИНЕНИЯ ДИГИДРОХЛОРИДА 6-БРОМ-1-МЕТИЛ-5-МЕТОКСИ-2-(1-ПИПЕРИДИНОМЕТИЛ)-3-(2-ДИЭТИЛАМИНОЭТОКСИ) КАРБОНИЛИНДОЛА | 2024 |
|
RU2835077C1 |
| ПРОИЗВОДНОЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ SARS-COV-2 | 2022 |
|
RU2820633C1 |
| ОНКОГЕННОЕ RAS-СПЕЦИФИЧНОЕ ЦИТОТОКСИЧЕСКОЕ СОЕДИНЕНИЕ И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2006 |
|
RU2448703C2 |
| ПРОИЗВОДНЫЕ АРИЛМОЧЕВИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ N-ФОРМИЛПЕПТИДНОГО-1 РЕЦЕПТОРА (FPRL-1) | 2012 |
|
RU2627271C2 |
| ПРОИЗВОДНЫЕ 5-ГИДРОКСИ-4-АМИНОМЕТИЛ-1-ЦИКЛОГЕКСИЛ (ИЛИ ЦИКЛОГЕПТИЛ)-3-АЛКОКСИКАРБОНИЛИНДОЛОВ, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2386616C2 |

Настоящее изобретение относится к области медицины, а именно к применению гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в качестве мембраностабилизирующего средства для профилактики и лечения заболеваний бронхолегочной системы. Настоящее изобретение обеспечивает расширение арсенала средств, обладающих одновременно выраженным вирусоспецифическим действием и мембраностабилизирующим свойством. 2 з.п. ф-лы, 5 ил.
1. Применение гидрохлорида 1-{[6-бром-1-метил-5-метокси-2-фенилтиометил-1-Н-индол-3-ил]карбонил}-4-бензилпиперазина в качестве мембраностабилизирующего средства для профилактики и лечения заболеваний бронхолегочной системы.
2. Применение по п.1, отличающееся тем, что заболевания бронхолегочной системы при вирусных и бактериальных инфекциях.
3. Применение по п.2, отличающееся тем, что вирусные инфекции представляют собой коронавирусную инфекцию, вызываемую различными штаммами вируса SARS-COV-2.
| ИНТЕРФЕРОНИНДУЦИРУЮЩЕЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ (ОРВИ) | 2010 |
|
RU2445094C1 |
| ПРОИЗВОДНЫЕ 5-ЗАМЕЩЕННЫХ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2387642C2 |
| Способ переработки латуней, бронз и др. сплавов | 1930 |
|
SU21442A1 |
| Ляпина С.А | |||
| и др., Структурно-функциональная организация мембран нейтрофилов при бронхолегочных заболеваниях и коррекция их антиоксидантными препаратами, 2017, N 6, стр.256. | |||
Авторы
Даты
2023-04-11—Публикация
2021-08-16—Подача