Предлагаемое изобретение относится к медицине, а именно к педиатрии, и может быть использовано для прогнозирования развития ожирения в детском возрасте в Республике Башкортостан.
В настоящее время наблюдается рост детского ожирения во всем мире и в России [Бочарова О.В., Теплякова Е.Д. Ожирение у детей и подростков - проблема здравоохранения XXI века. Казанский мед. ж. 2020. Том 101, №3. С. 381-388]. К причинам детского ожирения относят нарушение пищевого поведения, заболевания, прием лекарственных средств, гиподинамия, наследственная предрасположенность. Наличие детского ожирения обуславливает риск метаболического синдрома, сахарного диабета 2, инсулинорезистентности [Петеркова В.А., Васюкова О.В. К вопросу о новой классификации ожирения у детей и подростков // Проблемы эндокринологии. 2015. Том 61, №2. С. 39 44]. По данным ВОЗ 50% детей с избыточным весом в детском возрасте страдают ожирением во взрослом, а в подростковом - эта вероятность увеличивается до 80% [Саидова Л.Б., Бадритдинова М.Н., Раупов А.А. Эпидемиология и состояние выявляемости ряда экстрагенитальных заболеваний, метаболического синдрома среди женщин фертильного возраста (обзор литературы) // Актуальные проблемы гуманитарных и естественных наук. 2018. №6. С. 131-141].
Известен способ оценки индивидуального риска формирования избыточной массы тела и ожирения у детей, потребляющих питьевую воду с повышенным содержанием хлороформа и тетрахлорметана, характеризующийся тем, что осуществляют отбор пробы крови, определение в ней концентрации хлороформа и тетрахлорметана, определение уровней общего холестерина и липопротеида низкой плотности (ЛПНП). Проводят анамнестическое обследование ребенка по трехбалльной шкале и генотипирование. Риск формирования у ребенка избыточной массы тела прогнозируют в случае повышения уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л, наличия у ребенка 6 и более баллов при анамнестическом обследовании, наличия гетерозиготного генотипа гена HTR2A rs7997012, повышения концентрации тетрахлорметана в крови выше референтной и концентрации хлороформа в пределах 5,17-5,59 мкг/л. Риск формирования ожирения прогнозируют при концентрации хлороформа равной или более 5,79 мкг/л [Патент RU 2619872, 2017]. Недостатком способа является то, что он может быть использован только в группе детей, употребляющих воду с повышенным содержанием хлороформа и тетрахлорметана.
Наиболее близким аналогом изобретения является способ прогнозирования риска развития ожирения в детском возрасте, заключающийся в том, что проводят определение факторов риска и расчет по формуле. Из анамнеза выявляют такие факторы риска как отягощенная наследственность по артериальной гипертензии, отягощенная наследственность по ожирению, отягощенная наследственность по обменным нарушениям - ожирение и сахарный диабет у лиц I, II степени родства, патологическое течение беременности - преэклампсия, неполная семья, низкая физическая активность, носительство изоформы Е4 гена АРОЕ, носительство G-аллеля гена PPARG. Выясняют длительность исключительно грудного вскармливания. Риск развития ожирения определяют по формуле [Патент RU №2696446, 2019]. Недостатками метода являются трудоемкость ввиду сбора множественной информации об обследуемом лице, а также невысокая точность, поскольку не всегда возможно оценить наследственную отягощенность по всем перечисленным признакам.
Задачей изобретения стала разработка объективного, высокоинформативного способа прогнозирования развития ожирения в детском возрасте, позволяющего в количественном отношении оценить риск возникновения данного заболевания у детей, проживающих в Республике Башкортостан.
Технический результат при использовании изобретения - повышение точности прогноза.
Самым эффективным в предотвращении взрывного роста детского ожирения являются профилактические мероприятия. Под первичной профилактикой подразумевается выявление групп повышенного риска по ожирению среди детей с использованием данных о молекулярно-генетических биомаркерах чувствительности. Применение на практике разработанного способа обеспечит выявление детей с высоким риском развития ожирения.
Предлагаемый способ прогнозирования риска развития детского ожирения в Республике Башкортостан осуществляется следующим образом.
ДНК выделяют из лимфоцитов периферической крови. В качестве консерванта используют раствор следующего состава: 0,48% лимонной кислоты, 1,32% цитрата натрия, 1,47%) глюкозы. При заборе крови к 1 мл консерванта добавляют 6 мл крови и хорошо перемешивают.
Для получения ДНК необходимой степени чистоты и достаточного молекулярного веса используется метод выделения ДНК из крови фенольно-хлороформной экстракцией, описанный Мэтью (Mathew С.С. The isolation of high molecular weight eukaryotic DNA // Methods in Molecular Biology / Ed. Walker J.M., N.Y., L.: Human Press. - 1984. - V. 2. -P. 31-34).
1. Кровь в пробирке с консервантом тщательно перемешивается и переливается в центрифужный стакан на 100 мл, туда же добавляют 50 мл охлажденного лизирующего буфера, содержащего 320 мМ сахарозы, 1% раствор тритона Х-100, 5 мМ MgCl2, 10мМ трисНCl (рН 7,6).
2. Смесь центрифугируют 20 мин. при 4000 об./мин.
3. Надосадочную жидкость сливают, к получившемуся осадку приливают 8 мл 25 мМ ЭДТА, рН 8,0, суспензируют.
4. К суспензии добавляют 0,8 мл 10% SDS и протеиназу К (концентрация - 10 мг/мл). Смесь для лизиса оставляют на ночь в термостате при температуре 38°С.
Экстракцию ДНК осуществляют в следующем порядке.
1. Для депротеинизации к лизату добавляют 0,5 мл 5М перхлората натрия и 8 мл фенола, насыщенного 1М трисHCl до рН 7,8.
2. Смесь центрифугируют при 3000 об./мин. в течение 10 мин.
3. Отбирают водную фазу, содержащую ДНК, РНК и неденатурированные белки.
4. Отобранную фазу обрабатывают смесью фенол-хлороформа (1:1), а затем - хлороформом.
5. Препараты осаждают двумя объемами 96% этанола.
6. Образовавшийся осадок ДНК растворяют в 1,5 мл деионизированной Н20; раствор хранят при -20°С.
В дальнейшем полученную ДНК используют в качестве матрицы для полимеразной цепной реакции (ПЦР) для амплификации локуса rs3803300 гена протеинкиназы 1 AKT1 и локуса rs279845 гена рецептора гамма-аминомасляной кислоты GABRA2. Специфические последовательности олигонуклеотидных праймеров и условия ПЦР-анализа полиморфных локусов подбирались с помощью пакета программ DNA Star 5.05 и баз данных http//www.ncbi.nlm.nih.gov/snp.
Состав реакционной смеси для ПЦР был следующим: 0.1-1 мкг геномной ДНК, 0.5 мкМ каждого олигопраймера, 250 мкМ каждо-го дезоксинуклеозидтрифосфата (Promega, USA) помещали в 10 мкл однократного буфера для ПЦР следующего состава: 60 mM Tris-HCl, рН 8.5 при 25°С, 1.5 mM MgCl2, 25 mM KCl; 10 mM 2-меркаптоэтанол; 0.1% Тритон Х-100. Далее добавляют 5 единиц Taq- ДНК-полимеразы, 20-30 мкл минерального масла. Режим амплификации: 30 циклов со следующими параметрами: 94°С - 5 мин, 95°С - 30 секунд, 60°С -30 секунд, 72°С - 30 секунд. После 30-го цикла проводили инкубацию при 72°С в течение 5 минут.
Нуклеотидные замены в положении в промоторном регионе гена AKT1 и интронныйе полиморфный маркер гена GABRA2, выявляют при помощи ПЦР-ПДРФ анализа. Для этого 7 мкл амплификата смешивают с 5 ед. соответствующих эндонуклеаз рестрикции, смесь выдерживают при 37°С в течение 10-12 часов в термостате для рестриктаз Alw26 I и Hinf I. Затем проводят электрофорез в вертикальном 7% полиакриламидном геле. В качестве электролита для электрофореза применяют 1X боратный буфер (0.089 М трис HCl рН=7.8; 0.089 М борная кислота, 0.002 М ЭДТА с рН=8.0). Данные о размерах получаемых фрагментов представлены в таблице 1.
Статистическая обработка результатов исследования проводилась с применением программного обеспечения MS Office Excel. При попарном сравнении частот аллелей и генотипов в группах больных и контроля применялся критерий χ2 для таблиц сопряженности 2×2 с поправкой Йейтса на непрерывность [http://www.biometrica.tomsk.ru/]. При обнаружении статистически значимых различий (р<0,05) между исследуемыми выборками проводилась оценка показателя отношения шансов (odds ratio, OR), а также границ его 95%-ого доверительного интервала (CI 95%). Наблюдаемое распределение частот аллелей и генотипов по всем исследованным локусам соответствует ожидаемым из уравнения Харди-Вайнберга.
При выявлении генотипов AG или АА полиморфного локуса rs3803300 гена AKT1 и генотипов AT или АА полиморфного локуса rs279845 гена GABRA2 прогнозируют риск развития ожирения у ребенка.
Нами были исследованы образцы ДНК у 263 ребенок с ожирением и 409 детей без ожирения. Средний возраст испытуемых с ожирением составил 6.5 лет, детей в контрольной группе 7.2 лет.
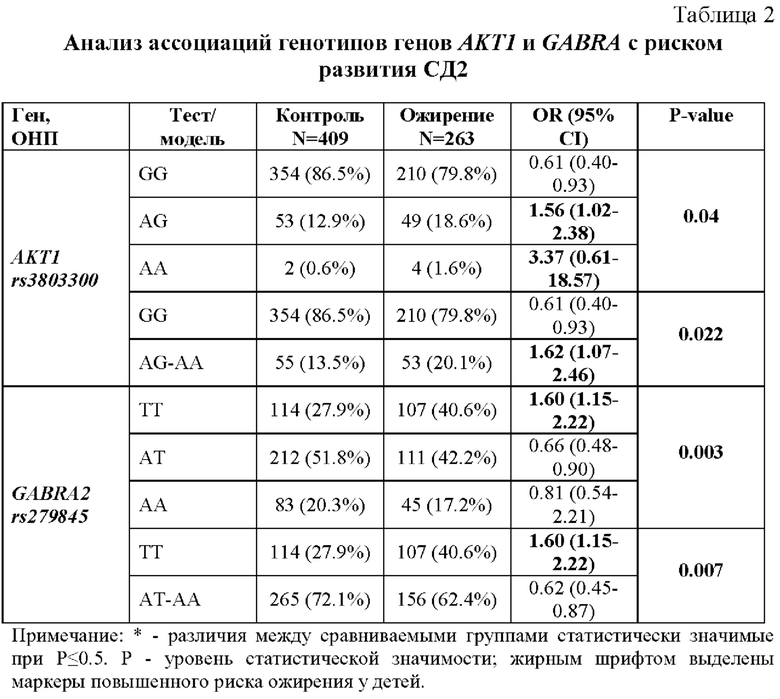
Исследование полиморфных вариантов rs3803300 гена AKT1 и rs279845 гена GABRA2 среди детей с ожирением выявило следующие результаты (табл. 2). В группе детей с ожирением статистически значимо повышена частота генотипов AG-AA rs3803300 гена AKT1 и частота генотипов АТ-АА полиморфного локуса rs279845 гена GABRA2. Повышенный риск детского ожирения ассоциирован с вариантами AG-AA локуса rs3803300 гена AKT1 и АТ-АА локуса rs279845 гена GABRA2.
Для количественной оценки относительного риска развития заболевания для каждого из вышеуказанных генетических маркеров мы вычислили показатель соотношения шансов (oddsratio - OR). Для этого мы использовали формулу, предложенную Бландом [Bland, J.M. The odds ratio / J.M. Bland, D.G. Altaian // Br. Med. J. - 2000. - Vol.320. - P. 1468]: OR=(a×d)/(b×c), где a - число лиц с наличием, b - с отсутствием маркера (аллеля или генотипа) среди больных; с и d - число лиц соответственно с наличием и отсутствием маркера среди здоровых. Повышенный риск развития детского ожирения диагностируются при OR более 1.0.
Приводим пример конкретного расчета. В группе детей с ожирением идентифицировано 53 ребенка с генотипами риска AG-AA по полиморфному локусу rs3803300 гена AKT1, т.е. а=53. У 210 детей с ожирением генотипы риска не идентифицированы, поэтому b=210. В контрольной группе выявлено 55 испытуемых с генотипами AG-AA, следовательно, с=55. В контрольной группе варианты риска отсутствуют у 354 детей, это значит, что d=354. Подставив эти значения в вышеприведенную формулу, получим:
OR=(53×354)/(210×55)=18762/11550=1.62. Следовательно, у лиц, имеющих варианты гомозигот по редкому аллелю и гетерозигот AG-AA, риск развития детского ожирения повышен в 1.62 раз по сравнению с контролем. Вычисленные по результатам исследования показатели OR в дальнейшем используются в ходе разработки генетического паспорта пациента. Полученные в нашем исследовании показатели OR при наличии рисковых генотипов по локусам AKT1 rs3803300 и GABRA2 rs279845 представлены в таблице 2.
Изобретение иллюстрируется следующими клиническими примерами.
Пример 1.
Пациент Р., 16 лет, страдает ожирением с 10 лет. В семье было выявлено наличие факторов риска: мама страдает ожирением III степени. У ребенка было произведен забор биологического материала 4 мл крови. Результаты проведенного молекулярно-генетического анализа с последующим выделением ДНК методом фенольно-хлороформной экстракции и амплификацией фрагментов генов AKT1 rs3803300, GABRA2 rs279845 в реакционной смеси, содержащей 0.1-1 мкг геномной ДНК, 1 ед. Taq-полимеразы, 0.25 мкМ каждого олигопраймера, 250 мкМ каждого дезоксинуклеозидтрифосфата в 25 мкл однократного буфера для ПЦР. После амплификации провели рестрикцию, а далее электрофорез фрагментов при постоянном напряжении 250- 300 вольт после 15-минутного преэлектрофореза. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и анализировали при ультрафиолетовом освещении на трансиллюминаторе. При исследовании полиморфного локуса AKT1 rs3803300 был выявлен генотип АА, при котором показатель соотношения шансов развития ожирения составляет 3.37 (табл. 2). По локусу GABRA2 rs279845 также был выявлен генотип риска АА в этом случае вероятность развития ожирения повышается в 0.81 (табл. 2).
Родителям пациента были предложены мероприятия по коррекции веса ребенка, медикаментозные препараты, увеличение двигательной активности. Данные рекомендации не были выполнены в полном объеме, при обследовании через два года у ребенка был диагностирован сахарный диабет 2 типа, вес продолжал увеличиваться.
Пример 2.
Мама пациентки У. больна метаболическим синдромом и ожирением в течение последних двух лет. Обратилась по вопросу генетического консультирования дочери 6 лет, также страдающей ожирением с рождения. Для проведения генетического тестирования было взято 4 мл крови у мамы и дочери. Выделение ДНК было осуществлено с помощью метода фенольно-хлороформной экстракции с последующим проведением ПЦР-ПДРФ анализа локусов AKT1 rs3803300, GABRA2 rs279845
У дочери было взято 4 мл венозной крови с последующим выделением ДНК методом фенольно-хлороформной экстракции и амплификацией фрагментов генов AKT1 rs3803300, GABRA2 rs279845 в реакционной смеси, содержащей 0,1-1 мкг геномной ДНК, 1 ед. Taq-полимеразы, 0,25 мкМ каждого олигопраймера, 250 мкМ каждого дезоксинуклеозидтрифосфата в 25 мкл однократного буфера для ПЦР для каждого локуса. Было осуществлено расцепление полученных амплификатов маркеров rs3803300 гена AKT1 с добавлением фермента Alw26 I и rs279845 гена GABRA2.
После амплификации проводили электрофорез фрагментов генов AKT1 rs3803300, GABRA2 rs279845 при постоянном напряжении 250-300 вольт после 15-минутного преэлектрофореза. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и анализировали при ультрафиолетовом освещении на трансиллюминаторе.
При исследовании полиморфного локуса AKT1 rs3803300 был выявлен генотип АА при котором показатель соотношения шансов развития ожирения составляет 3.37 и генотип AT rs279845 гена GABRA2, в этом случае риск составляет 0.66 (табл. 2).
Учитывая высокий генетический риск ожирения у ребенка, родителям были предложены превентивные мероприятия по коррекции веса ребенка изменение образа жизни, диетотерапию, расширение физической активности. Данные рекомендации не были выполнены в полном объеме, дочь пациентки продолжила набирать вес.
Пример 3.
Пациент Н., 14 лет, страдает ожирением с 8 лет. В семье было выявлено наличие факторов риска: мама страдает ожирением III степени. У папы ребенка ожирение II степени и артериальная гипертензия. На консультации у эндокринолога родителям ребенка было предложено проведение молекулярно-генетического исследования для определения риска развития детского ожирения. У пациента был произведен забор биологического материала 4 мл крови. Результаты проведенного молекулярно-генетического анализа с последующим выделением ДНК методом фенольно-хлороформной экстракции и амплификацией фрагментов генов AKT1 rs3803300, GABRA2 rs279845 в реакционной смеси, содержащей 0.1-1 мкг геномной ДНК, 1 ед. Taq-полимеразы, 0.25 мкМ каждого олигопраймера, 250 мкМ каждого дезоксинуклеозидтрифосфата в 25 мкл однократного буфера для ПЦР. После амплификации провели рестрикцию, а далее электрофорез фрагментов при постоянном напряжении 250- 300 вольт после 15-минутного преэлектрофореза. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и анализировали при ультрафиолетовом освещении на трансиллюминаторе. При исследовании полиморфного локуса AKT1 rs3803300 был выявлен генотип AG при котором показатель соотношения шансов развития ожирения составляет 1.56 и генотип АА rs279845 гена GABRA2, в этом случае риск составляет 0.81 (табл. 2).
Родителям пациента были предложены мероприятия по коррекции веса ребенка: диетотерапия, медикаментозные препараты, увеличение двигательной активности. Данные рекомендации не были выполнены в полном объеме, при обследовании через два года у ребенка была диагностирована артериальная гипертензия, ожирение сохранялось.
Пример 4.
Пациент Б., 8 лет, находился на лечении в стационаре по поводу обструктивного бронхита. Дополнительно было диагностировано эндогенно-конституциональное ожирение I степени. У мамы пациента выявлен метаболический синдромом и ожирением в течение последних десяти лет.Семье рекомендовали консультацию эндокринолога. Пациенту было предложено проведение молекулярно-генетического исследования для определения риска развития детского ожирения. Для проведения молекулярно-генетического анализа у пациента К. было взято 4 мл венозной крови с последующим выделением ДНК методом фенольно-хлороформной экстракции и амплификацией фрагментов генов AKT1 rs3803300, GABRA2 rs279845 в реакционной смеси, содержащей 0,1-1 мкг геномной ДНК, 1 ед. Taq-полимеразы, 0,25 мкМ каждого олигопраймера, 250 мкМ каждого дезоксинуклеозидтрифосфата в 25 мкл однократного буфера для ПЦР. После амплификации провели электрофорез фрагментов при постоянном напряжении 250- 300 вольт после 15-минутного преэлектрофореза. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и анализировали при ультрафиолетовом освещении на трансиллюминаторе. При исследовании полиморфного локуса AKT1 rs3803300 был выявлен генотип AG при котором показатель соотношения шансов развития ожирения составляет 1.56 и генотип AT rs279845 гена GABRA2, в этом случае риск составляет 0.66 (табл. 2).
Родителям ребенка были предложены превентивные мероприятия по коррекции веса ребенка путем диетотерапии и расширения физической активности. Данные рекомендации не были выполнены в полном объеме, сын пациентка продолжил набирать вес, что было зафиксировано на повторной консультации у эндокринолога через год.
Пример 5.
Пациент К., 4 года, обратился к гастроэнтереологу по поводу болей в животе. Была диагностирована дискинезии желчевыводящих путей и ожирение I степени. Семье рекомендовали консультацию эндокринолога. Пациенту было предложено проведение молекулярно-генетического исследования для определения риска развития детского ожирения. Для проведения молекулярно-генетического анализа у пациента К. было взято 4 мл венозной крови с последующим выделением ДНК методом фенольно-хлороформной экстракции и амплификацией фрагментов генов AKT1 rs3803300, GABRA2 rs279845 в реакционной смеси, содержащей 0,1-1 мкг геномной ДНК, 1 ед. Taq-полимеразы, 0,25 мкМ каждого олигопраймера, 250 мкМ каждого дезоксинуклеозидтрифосфата в 25 мкл однократного буфера для ПЦР. После амплификации провели электрофорез фрагментов при постоянном напряжении 250- 300 вольт после 15-минутного преэлектрофореза. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и анализировали при ультрафиолетовом освещении на трансиллюминаторе. При исследовании полиморфного локуса AKT1 rs3803300 был выявлен генотип пониженного риска GG (показатель соотношения шансов развития ожирения в этом случае составляет 0.61), а при исследовании полиморфного локуса GABRA2 rs279845 был выявлен протективный генотип ТТ (OR=1.60) (табл. 2).
Для данных вариантов прогноз развития ожирения в дальнейшем является благоприятным. В последующем родители к эндокринологу не обращались.
Приведенные примеры демонстрируют прогностическую и диагностическую значимость предлагаемого способа. Способ позволяет прогнозировать риск развития детского ожирения до его клинических проявлений и развития коморбидных состояний заболевания.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования врожденной расщелины губы и нёба у ребёнка при планировании беременности в регионе с экотоксикантами с применением генетических маркеров | 2021 |
|
RU2760786C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ САХАРНОГО ДИАБЕТА 2 ТИПА У НАСЕЛЕНИЯ БАШКОРТОСТАНА | 2018 |
|
RU2688208C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ ОСТРЫХ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ У ДЕТЕЙ | 2012 |
|
RU2483307C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПЕРВИЧНОЙ АДЕНТИИ | 2009 |
|
RU2394242C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ В-КЛЕТОЧНЫХ И Т-КЛЕТОЧНЫХ НЕХОДЖКИНСКИХ ЛИМФОМ | 2012 |
|
RU2490638C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ НЕХОДЖКИНСКИХ ЛИМФОМ | 2012 |
|
RU2490641C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОТВЕТА НА ХИМИОТЕРАПИЮ ПРИ ХРОНИЧЕСКОМ ЛИМФОЛЕЙКОЗЕ | 2012 |
|
RU2495427C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ МНОЖЕСТВЕННОЙ МИЕЛОМЫ | 2005 |
|
RU2282852C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ТОКСИЧЕСКОГО ГЕПАТИТА ПРИ ХИМИОТЕРАПИИ МНОЖЕСТВЕННОЙ МИЕЛОМЫ | 2005 |
|
RU2283494C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОЙ ФОРМЫ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2012 |
|
RU2490642C1 |
Изобретение относится к медицине, а именно к педиатрии, и может быть использовано для прогнозирования развития ожирения у детей, проживающих в Республике Башкортостан. Из лимфоцитов периферической венозной крови выделяют ДНК. Проводят амплификацию локуса rs3803300 гена протеинкиназы 1 AKT1 и локуса rs279845 гена рецептора гамма-аминомасляной кислоты GABRA2. При выявлении генотипов AG или AA полиморфного локуса rs3803300 гена AKT1 и генотипов АТ или АА полиморфного локуса rs279845 гена GABRA2 прогнозируют риск развития ожирения у ребенка. Способ обеспечивает повышение точности прогноза за счет выявления факторов предрасположенности к развитию заболевания. 2 табл., 5 пр.
Способ прогнозирования развития ожирения у детей, проживающих в Республике Башкортостан, включающий выделение ДНК из лимфоцитов периферической венозной крови, генотипирование методом полимеразной цепной реакции синтеза ДНК, отличающийся тем, что проводят амплификацию локуса rs3803300 гена протеинкиназы 1 AKT1 и локуса rs279845 гена рецептора гамма-аминомасляной кислоты GABRA2 и при выявлении генотипов AG или AA полиморфного локуса rs3803300 гена AKT1 и генотипов АТ или АА полиморфного локуса rs279845 гена GABRA2 прогнозируют риск развития ожирения у ребенка.
| Способ прогнозирования риска развития ожирения в детском возрасте | 2018 |
|
RU2696446C1 |
| CN 106834501 A, 13.06.2017 | |||
| BAUER L.O | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Am J Addict | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ZHAO J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Medicine | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
Авторы
Даты
2023-04-27—Публикация
2022-06-06—Подача