Настоящее изобретение относится к применению пористых волокон, имеющих пористость свыше 20 нм, в частности, полиэфирсульфоновых пористых волокон, для снижения в крови и производных крови концентрации произведенных из крови внеклеточных везикул, в частности, микровезикул, и экзосом и экзомеров, и к способам получения и анализа таких обедненных образцов.
Предпосылки создания изобретения
Внеклеточные везикулы представляют собой 30-нм – 2-мкм мембранные образования клеточного происхождения. Они включают апоптозные тельца (больше 1 мкм), онкосомы (больше 1 мкм), микровезикулы (200 нм – 1 мкм), экзосомы (30-120 нм) и экзомеры (примерно 35 мкм) (Van Der Pol et al., Zhang et al.).
Пористые волокна (HF) являются классом полупроницаемых барьеров, которые применяются, в частности, в области диализа (Ishihara et al.). Их основной характеристикой является их пористость, т.е. средний диаметр пор и распределение пор. В области медицины их типично используют в качестве фильтров при гемодиализе, гемофильтрации и плазмаферезе.
Пористые волокна получают с использованием различных материалов, включая целлюлозу, эфир целлюлозы, полисульфон, полиэфирсульфон (PES), полиметилметакрилат (ПММА), полиамид, азотсодержащие полимеры, стекло, диоксид кремния, ацетат целлюлозы, поливинилиденфторид (ПВДФ), поливинилхлорид (ПВХ), политетрафторэтилен (ПТФЭ), сложный полиэфир, керамику, полиимид, полиэфиримид, полиэтиленимин-функционализированный полиамидимид (торлон™), поливиниловый спирт (ПВС). (Seo-Hyun Pak et al.; Xing Yanga et al., Hailin Zhu et. аl.; Amir Dashti et al.; Ze-Lin Qiu et al.; Li FS et al.; Labreche Y et al.; Zhang Y et al.; Higa M. et al., Mock 2007).
В технике имеется множество примеров того, как можно получить кровь и производные крови для анализа.
Получение производных крови обычно страдает от активации тромбоцитов и белых клеток крови и гемолиза. Активации тромбоцитов можно достичь, например, просто встряхивая пробирку, содержащую образец крови (Black et al.). Также присутствие внеклеточных везикул гемопоэтического происхождения является известным запутывающим фактором в случае выделения и молекулярного анализа внеклеточных везикул паренхимного и стромального происхождения, влияющих на отношение сигнал-шум при анализе и на воспроизводимость результатов.
Уровень техники
Пористые волокна описаны на известном уровне техники в связи с их способностью удерживать везикулы или не допускать их прохождения из-за своей пористости (WO2007127848, WO2001082958), или потому, что пористые волокна химически модифицированы для того, чтобы связывать везикулы (WO2015130956).
Краткое описание фигур
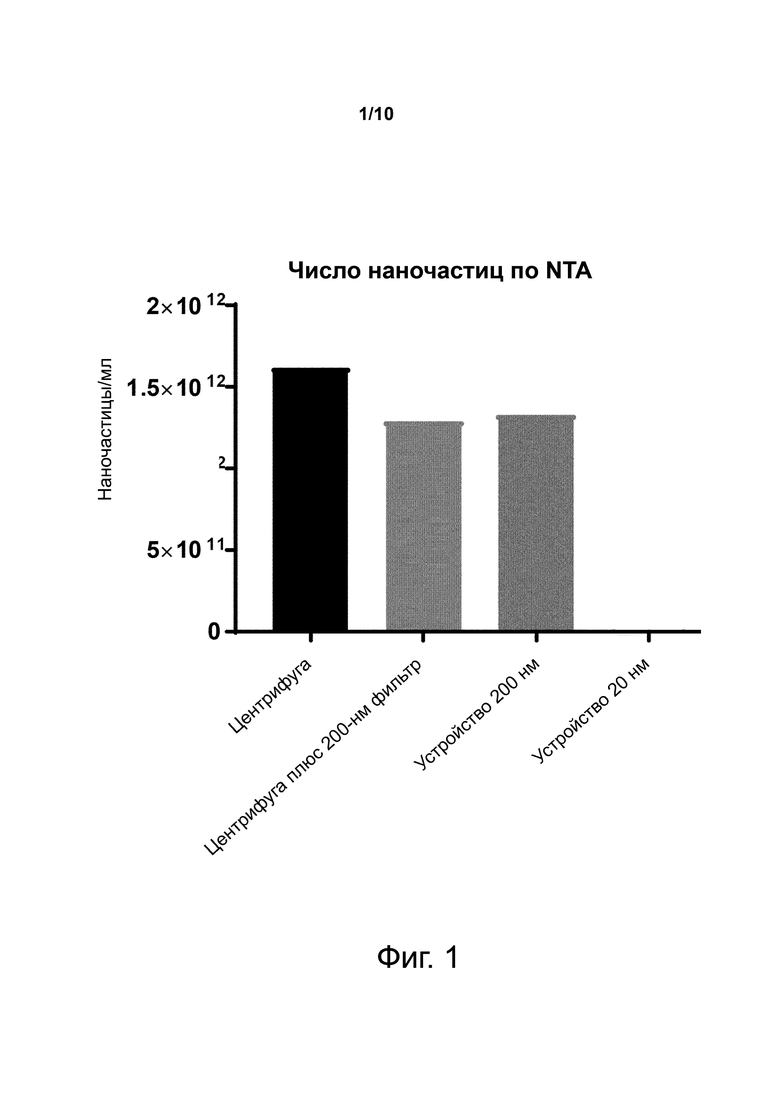
Фиг. 1. Число наночастиц в плазме, полученной центрифугированием, фильтрацией через устройство с HF с пористостью 200 нм или фильтрацией через устройство с HF с пористостью 20 нм.
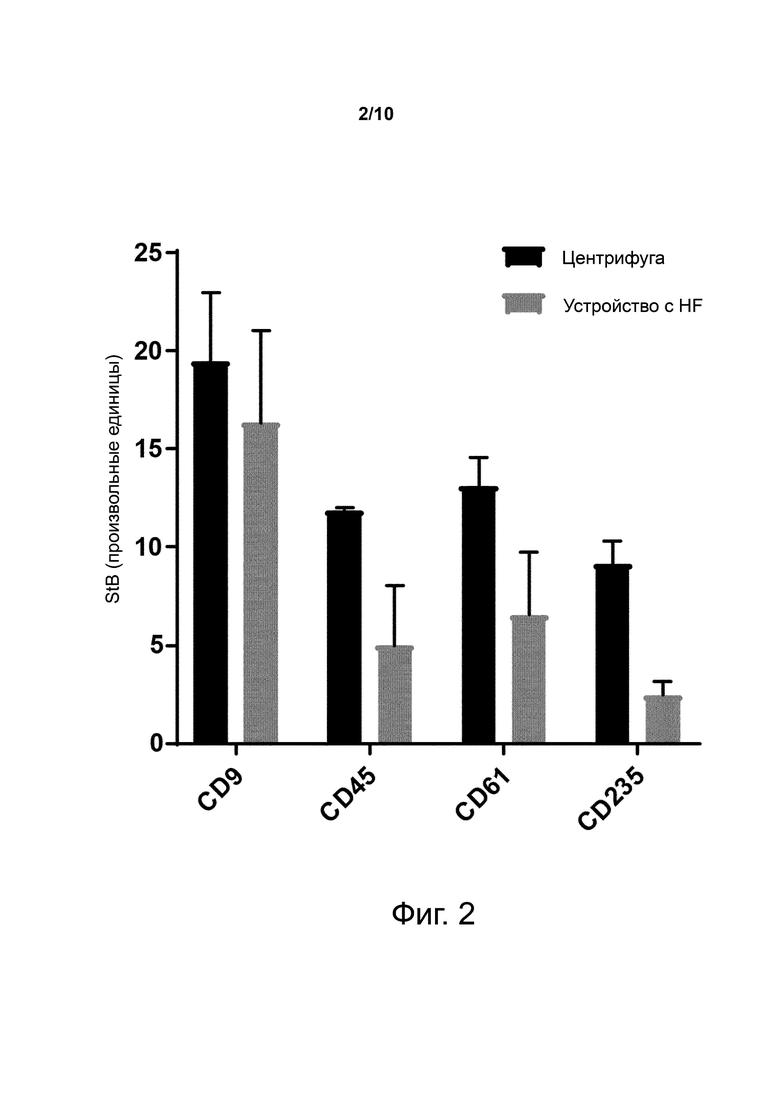
Фиг. 2. Количества экзосом из крови, измеренные в образцах плазмы, полученных фильтрацией через устройство с HF с пористостью 200 нм, или с помощью числа копий (копии/мл) аллельного гена BRAF в плазме трех пациентов с метастастатической меланомой, полученной центрифугированием.
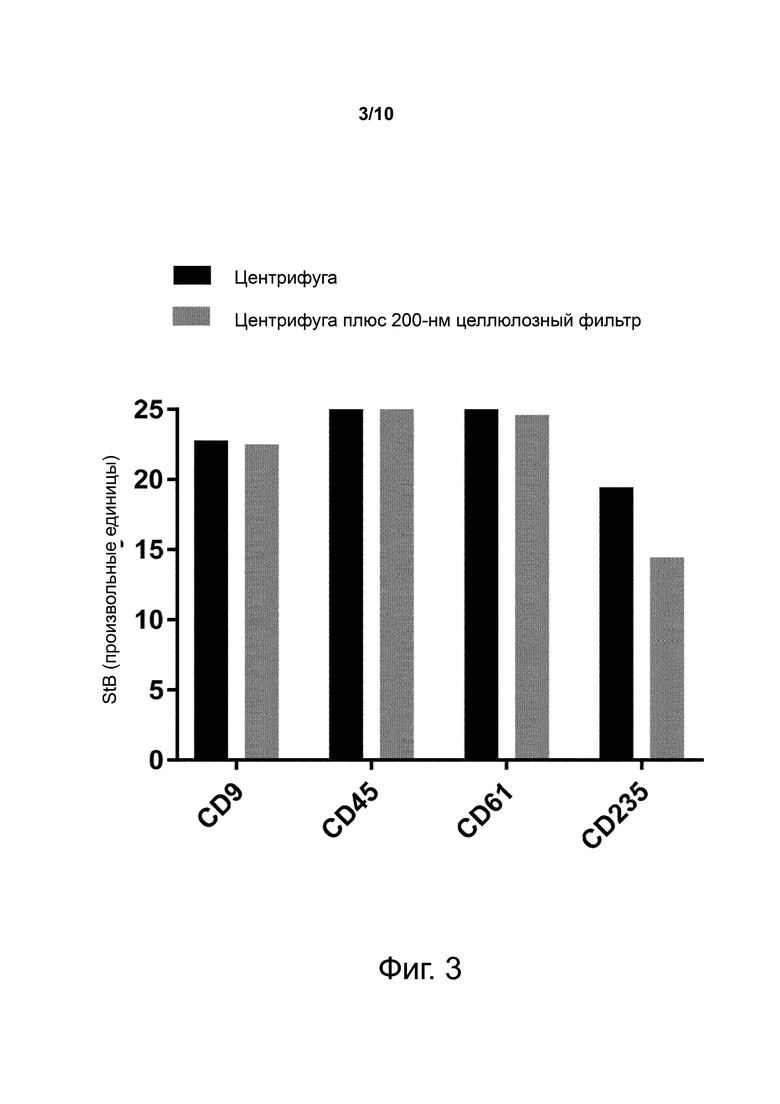
Фиг. 3. Количества экзосом из крови, измеренные в образцах плазмы, полученных фильтрацией через целлюлозный не-HF фильтр с пористостью 200 нм.
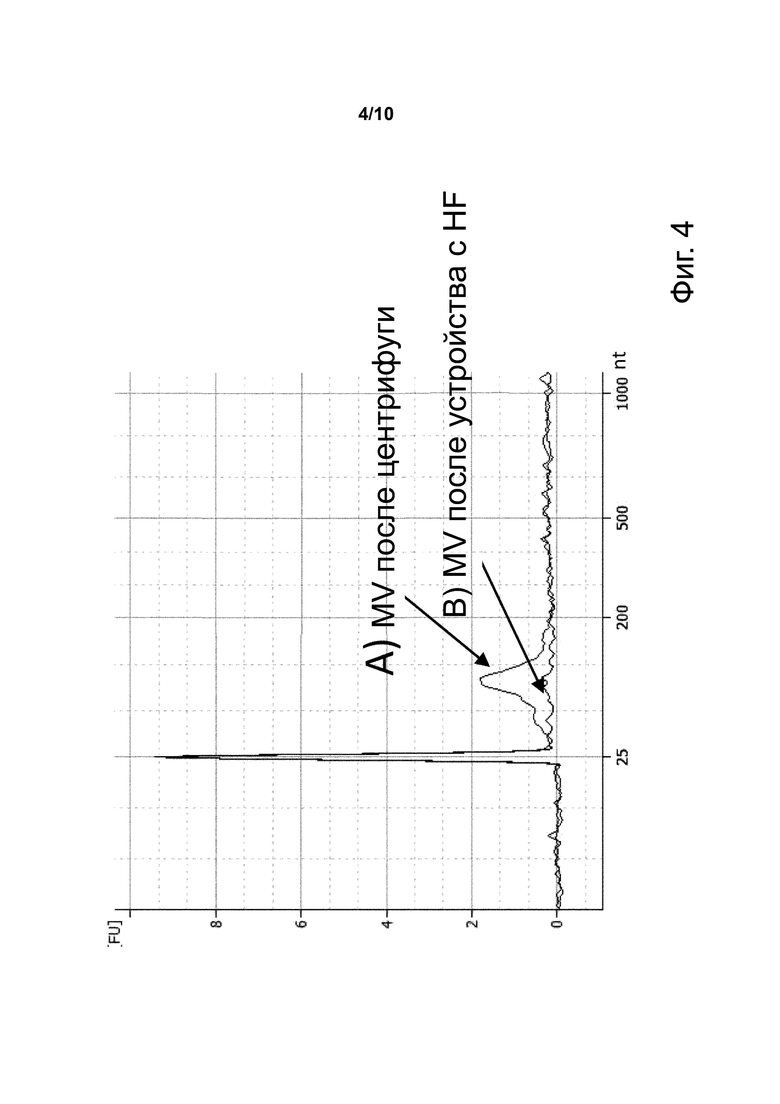
Фиг. 4. Электрофореграмма малых РНК микровезикул, присутствующих в образцах плазмы, полученных фильтрацией через устройство с HF с пористостью 200 нм, или центрифугированием.
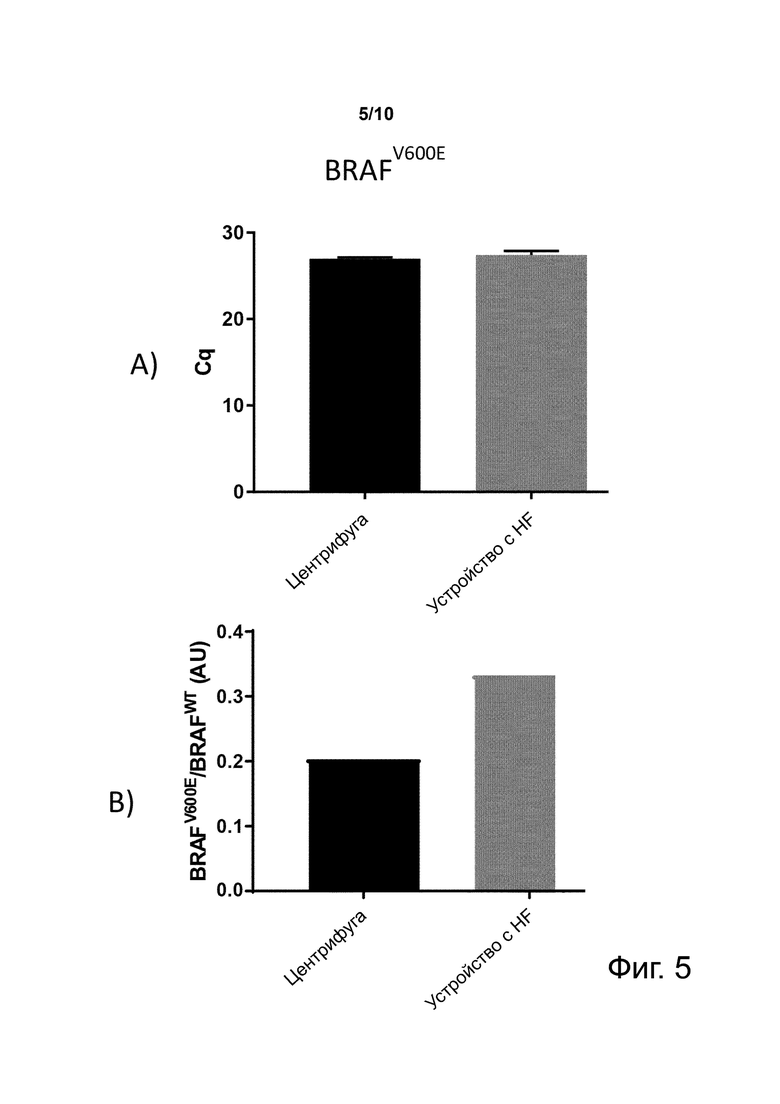
Фиг. 5. Уровни мутации BRAFV600E (A) или отношение BRAFV600E к BRAFWT (B) в экзосомах опухоли, выступивших в крови здоровых доноров, при измерении после центрифугирования или фильтрации через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
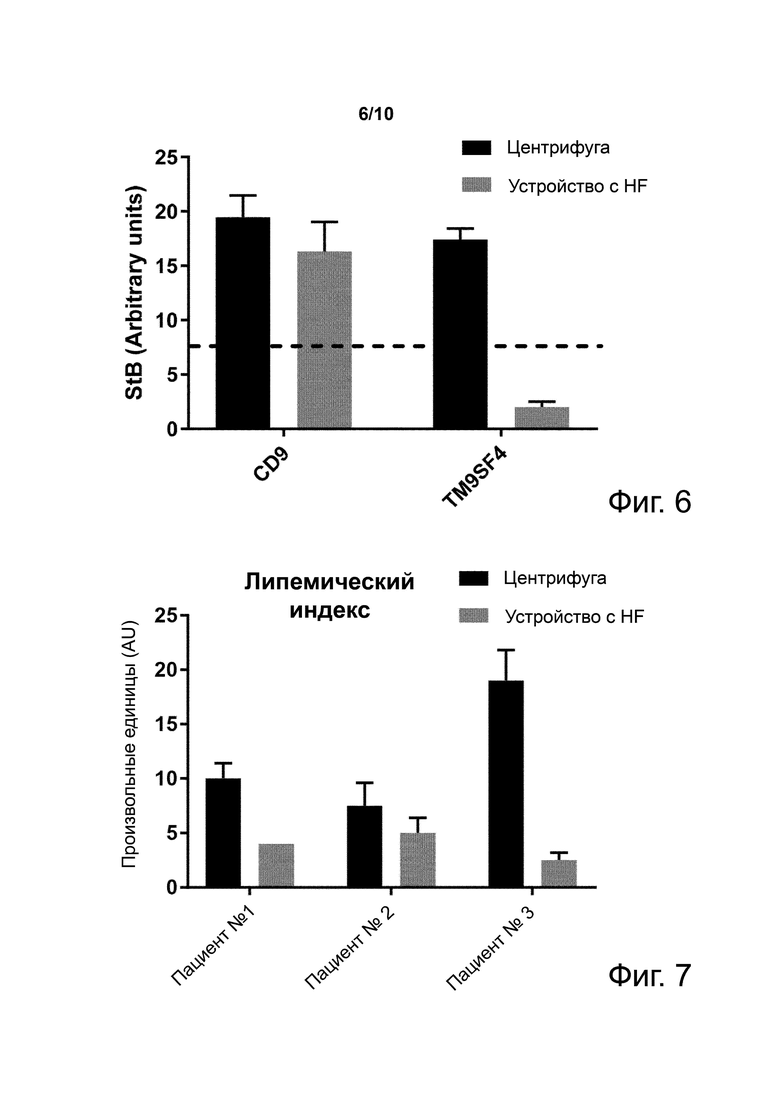
Фиг. 6. Количества CD9- и TM9SF4-положительных экзосом, измеренные в образцах плазмы, полученных фильтрацией через устройство с HF с пористостью 200 нм или центрифугированием.
Фиг. 7. Липемический индекс образцов плазмы здоровых доноров после центрифугирования или фильтрации через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
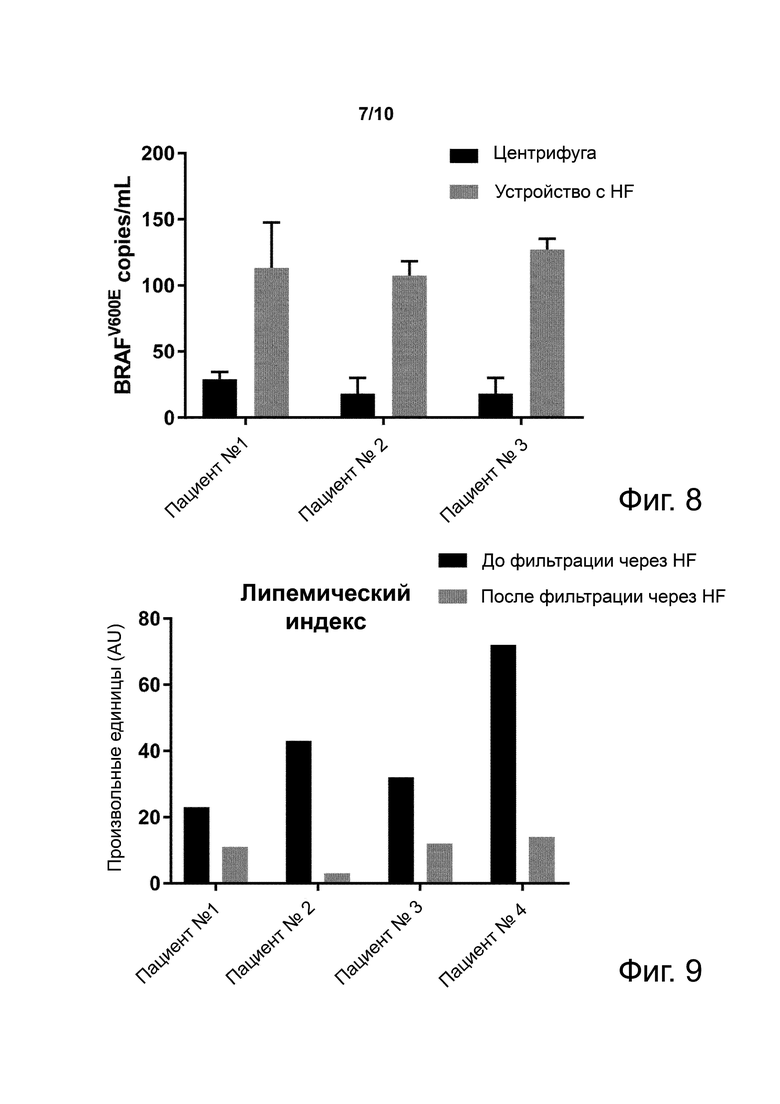
Фиг. 8. Уровни копий мутации BRAFV600E (копии/мл) в экзосомах опухоли, выступивших в плазме здоровых доноров, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
Фиг. 9. Липемический индекс образцов плазмы до и после центрифугирования или фильтрации через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
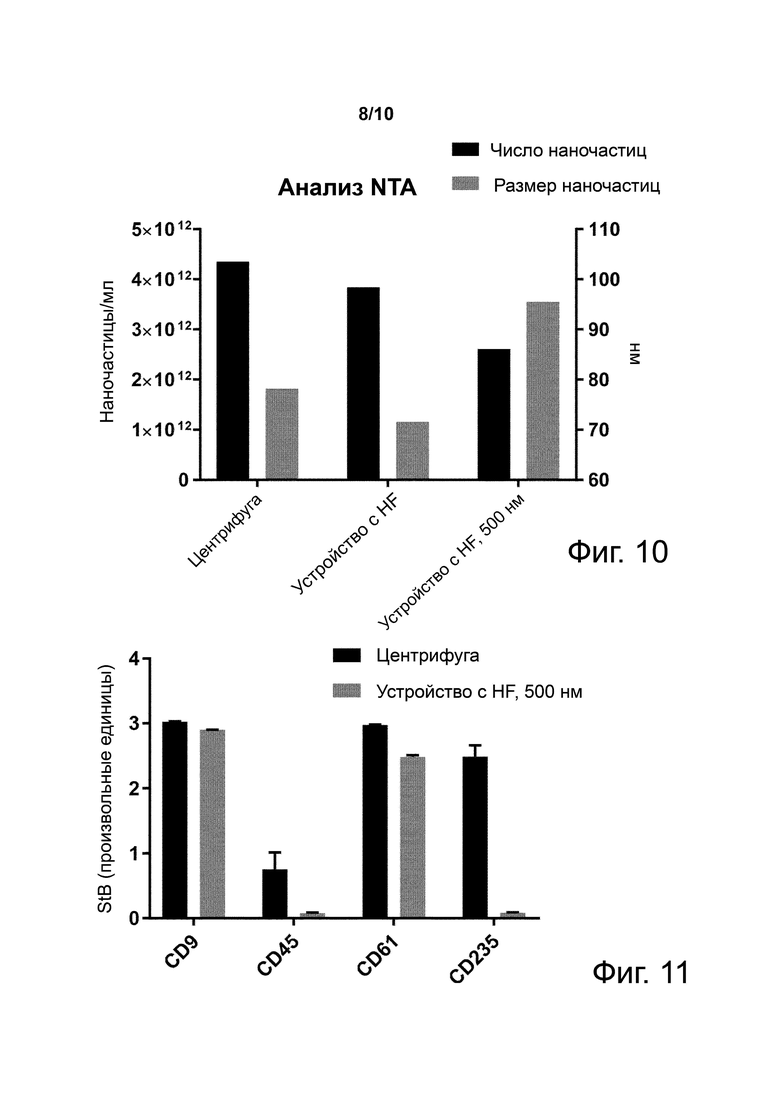
Фиг. 10. Число наночастиц в плазме, полученной из цельной крови с использованием центрифуги или фильтра из полиэфирсульфонового HF с пористостью 200 нм или с пористостью 500 нм.
Фиг. 11. Количества CD9-, CD45-, CD 61- и CD 235-положительных экзосом, измеренные в образцах плазмы, полученных или центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 500 нм.
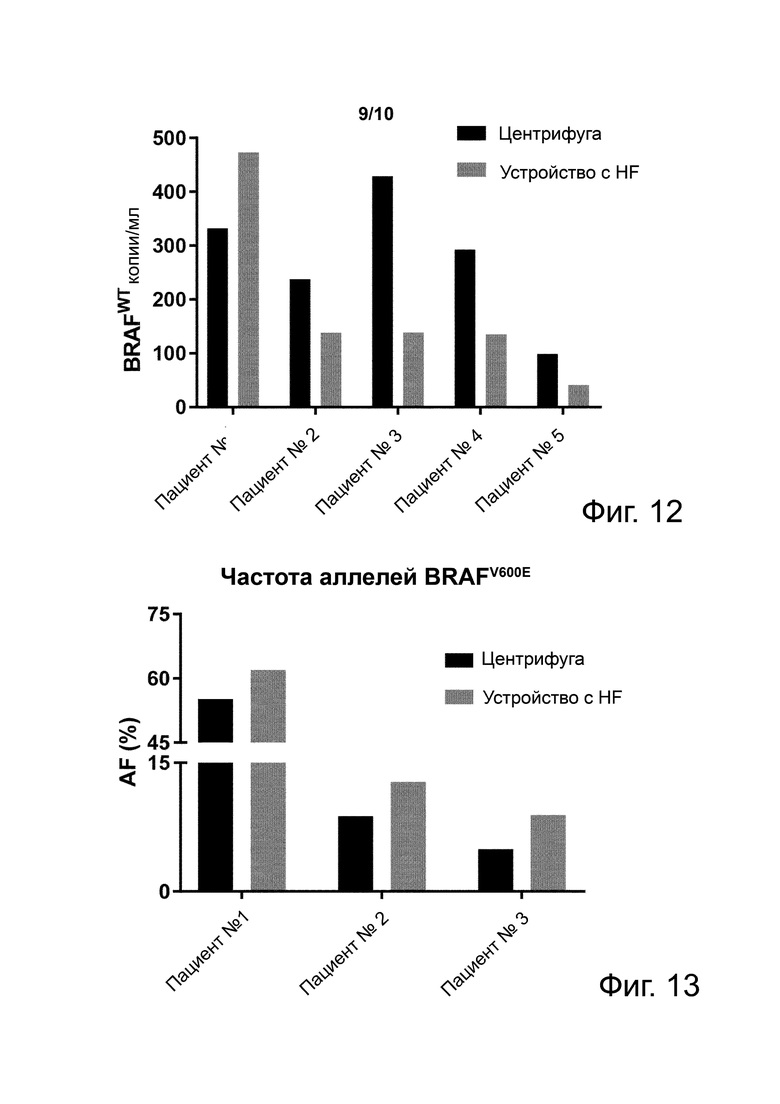
Фиг. 12. Уровни копий (копии/мл) гена BRAF в плазме пациентов с метастастатической меланомой, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
Фиг. 13. Частоты аллелей копий (копии/мл) гена BRAF в плазме пациентов с метастастатической меланомой, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
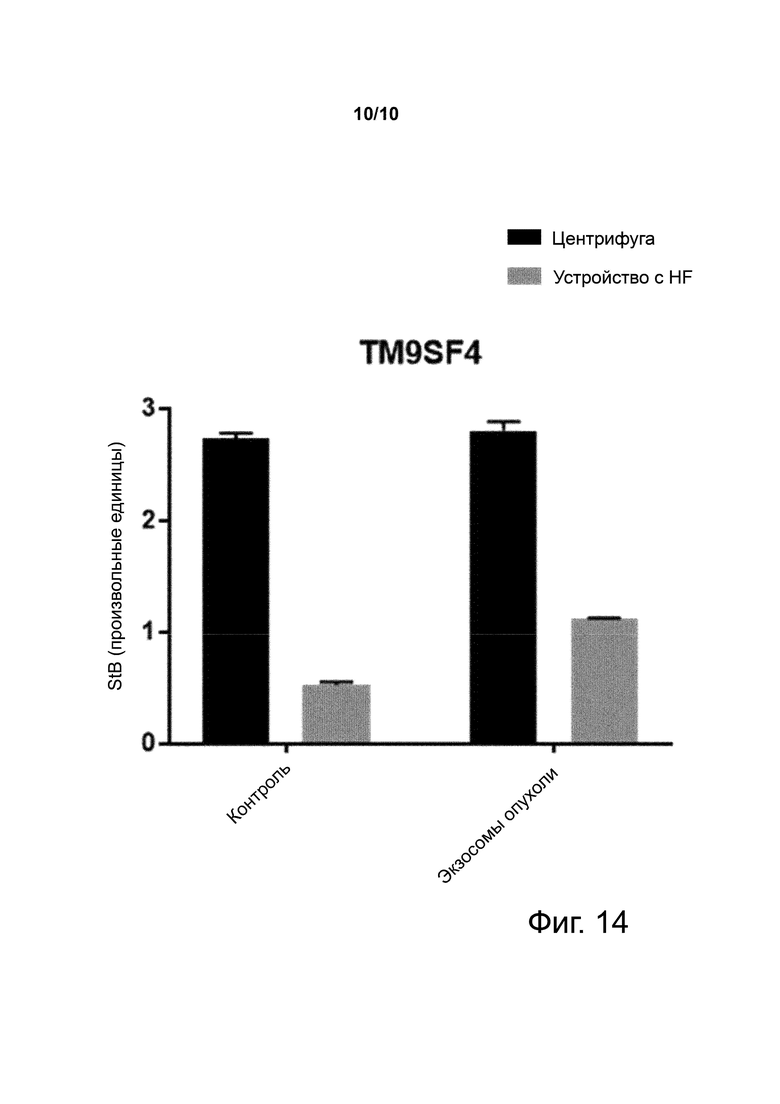
Фиг. 14. Количества TM9SF4-положительных экзосом, измеренные в образцах плазмы с выбросом экзосом опухоли, и полученных фильтрацией через устройство с HF с пористостью 200 нм или центрифугированием.
Подробное описание изобретения
Авторы изобретения неожиданно обнаружили, что использование пористых волокон, имеющих пористость выше 20 нм, при гравитационной фильтрации дает возможность снизить концентрацию внеклеточных везикул, происходящих из некоторых компонентов крови и имеющих размер, который меньше пористости пористых волокон.
В первом аспекте настоящее изобретение относится к применению in vitro пористых волокон, имеющих пористость выше 20 нм, для снижения в образце крови или происходящей из крови жидкости, путем гравитационной фильтрации, концентрации внеклеточных везикул, причем такие внеклеточные везикулы имеют размер, который меньше пористости пористых волокон, и происходят из компонентов крови, выбранных из группы, включающей красные клетки крови, белые клетки крови, тромбоциты и их комбинации.
Во втором аспекте настоящее изобретение относится к способу получения in vitro крови или производного крови, существенно обедненного внеклеточными везикулами, происходящими из компонентов крови, выбранных из группы, включающей красные клетки крови, белые клетки крови, тромбоциты и их любую комбинацию, причем способ включает стадии гравитационной фильтрации образца крови или происходящей из крови жидкости через фильтр, включающий пористые волокна, имеющие пористость выше 20 нм, причем таким образом получают кровь или производное крови, существенно обедненное внеклеточными везикулами, причем такие внеклеточные везикулы имеют размер, который меньше пористости пористых волокон.
В третьем аспекте настоящее изобретение относится к способу анализа in vitro содержания внеклеточных везикул в образце крови или происходящей из крови жидкости, причем такой способ включает
а) гравитационную фильтрацию образца крови или происходящей из крови жидкости через фильтр из пористых волокон, имеющих пористость выше 20 нм, причем посредством этого получают фильтрат,
b) анализ содержания внеклеточных везикул в фильтрате, полученном на стадии а).
Специалисту будет известно, какой анализ выполнять и как его выполнять в зависимости от обстоятельств и на основе его собственного опыта и литературы, доступной в этой области. Такой анализ может быть направлен, например, на измерение количеств внеклеточных везикул, которые удерживают определенный белок на своей поверхности, при использовании твердофазного иммуноферментного анализа (ELISA) или проточной цитометрии (FACS). Другие анализы могут быть направлены на подсчет числа всех наночастиц в образце через анализ трекинга наночастиц (NTA) или измерение экспрессии генов с помощью количественной полимеразной цепной реакции в реальном времени (кПЦР (qRT-PCR) или секвенирования следующего поколения (NGS).
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна включают полиэфирсульфоновые пористые волокна.
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна состоят из полиэфирсульфоновых пористых волокон.
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна включают материал, выбранный из списка, включающего целлюлозу, эфир целлюлозы, полисульфон, полиэфирсульфон (PES), полиметилметакрилат (ПММА), полиамид, азотсодержащие полимеры, стекло, диоксид кремния, ацетат целлюлозы, поливинилиденфторид (ПВДФ), поливинилхлорид (ПВХ), политетрафторэтилен (ПТФЭ), сложный полиэфир, керамику, полиимид, полиэфиримид, полиэтиленимин-функционализированный полиамидимид (торлон™) и поливиниловый спирт (ПВС).
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна заключаются в материале, выбранном из списка, включающего целлюлозу, эфир целлюлозы, полисульфон, полиэфирсульфон (PES), полиметилметакрилат (ПММА), полиамид, азотсодержащие полимеры, стекло, диоксид кремния, ацетат целлюлозы, поливинилиденфторид (ПВДФ), поливинилхлорид (ПВХ), политетрафторэтилен (ПТФЭ), сложный полиэфир, керамику, полиимид, полиэфиримид, полиэтиленимин-функционализированный полиамидимид (торлон™) и поливиниловый спирт (ПВС).
В воплощении в соответствии с любым аспектом настоящего изобретения пористость выбирают из списка, включающего пористость выше 20 нм, выше 25 нм, выше 30 нм, выше 35 нм, выше 40 нм, выше 45 нм, выше 50 нм, выше 55 нм, выше 60 нм, выше 65 нм, выше 70 нм, выше 75 нм, выше 80 нм, выше 85 нм, выше 90 нм, выше 95 нм, выше 100 нм, выше 105 нм, выше 110 нм, выше 115 нм, выше 120 нм, выше 125 нм, выше 130 нм, выше 135 нм, выше 140 нм, выше 145 нм, выше 150 нм, выше 155 нм, выше 160 нм, выше 165 нм, выше 170 нм, выше 175 нм, выше 180 нм, выше 185 нм, выше 190 нм, выше 195 нм и выше 200 нм.
В воплощении в соответствии с любым аспектом настоящего изобретения пористость составляет ниже 500 нм.
В воплощении в соответствии с любым аспектом настоящего изобретения пористость выбирают из списка, включающего пористость примерно 150 нм, примерно 200 нм, примерно 250 нм, примерно 300 нм, примерно 350 нм, примерно 400 нм, примерно 450 нм, примерно 500 нм и в любом интервале, включающем эти величины.
В воплощении в соответствии с любым аспектом настоящего изобретения пористость выбирают из списка, включающего пористость 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, примерно 400 нм, 450 нм, 500 нм и в любом интервале, включающем эти величины.
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна имеют пористость, выбранную из группы интервалов, включающих примерно 150 – примерно 250 нм, примерно 150 – примерно 300 нм, примерно 150 – примерно 350 нм, примерно 150 – примерно 400 нм, примерно 150 – примерно 450 нм, примерно 150 – примерно 500 нм, примерно 200 – примерно 250 нм, примерно 200 – примерно 300 нм, примерно 200 – примерно 350 нм, примерно 200 – примерно 400 нм, примерно 200 – примерно 450 нм и примерно 200 – примерно 500 нм.
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна имеют пористость, выбранную из группы интервалов, включающих 150 – 250 нм, 150 – 300 нм, 150 – 350 нм, 150 – 400 нм, 150 – 450 нм, 150 – 500 нм, 200 – 250 нм, 200 – 300 нм, 200 – 350 нм, 200 – 400 нм, 200 – 450 нм и 200 – 500 нм.
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна имеют пористость примерно 200 нм.
В воплощении в соответствии с любым аспектом настоящего изобретения пористые волокна имеют пористость, равную 200 нм.
В воплощении в соответствии с любым аспектом настоящего изобретения образец происходящей из крови жидкости является образцом плазмы.
В воплощении в соответствии с любым аспектом настоящего изобретения внеклеточные везикулы выбирают из группы, включающей микровезикулы, экзосомы, экзомеры и их комбинации.
Все воплощения можно комбинировать для генерации новых воплощений в соответствии с любым из указанных выше аспектов изобретения.
Примеры
Теперь изобретение будет описываться с помощью не ограничивающих его примеров.
Материалы и методы
А) Сбор крови
Все пациенты голодают с полуночи до забора крови утром. Кровь собирают или в мешок для крови, содержащий CPD (CompoFlow; Fresenius Kabi), или собирают в пробирки с K2-EDTA для плазмы (VACUTAINER® Becton Dickinson, пурпурная крышка, REF 367864, 6,0 мл). Затем пробирки K2-EDTA переворачивают 5 или 6 раз, оставляют в вертикальном положении и хранят при комнатной температуре (20-25°C) до дальнейшей обработки.
В) Получение плазмы с помощью центрифуги
Получение плазмы с помощью центрифуги выполняют в пределах часа от сбора крови путем центрифугирования цельной крови при 1500 g в течение 10 минут при 20-25°C. Плазму собирают с использованием одноразовой пипетки Пастера (Steroglass, REF: LPMW032653; 5 мл), избегая ее ресуспендирования, остановившись на 3-4 мм выше лейкоцитной пленки. Образцы проверяют визуально на следы липидов, желчь (Itterum) или гемолиз. Плазму собирают в 15-мл пробирки типа Фалькон, осторожно переворачивают, помещают аликвоты в меченные криопробирки (кат.номер n°BSM 535, Biosigma) и хранят при -20°C.
С) Плазма, полученная фильтрацией через целлюлозный не-HF фильтр с пористостью 200 нм
Плазму получают центрифугированием, как описано ранее, и фильтруют через целлюлозный не-HF фильтр с пористостью 200 нм (кат.номер 190-9920; Nalgene). Фильтрованную плазму собирают в 15-мл пробирки типа Фалькон, помещают аликвоты в 2-мл микроцентрифужные пробирки и хранят при -20°C для дальнейшего использования.
D) Плазма, полученная фильтрацией через устройства с полиэфирсульфоновыми волокнами с пористостью 20/200 нм
Плазму получают с использованием вариантов коммерчески доступного устройства с полиэфирсульфоновыми волокнами с пористостью 20 нм или 200 нм, обычно используемого для гемодиализа (Plasmart 50; Medica Srl, Italy). Устройство модифицировано путем уменьшения длины от 150 мм до 60 мм, причем таким образом уменьшается объем крови, требуемой для примирования. Коротко, один из двух боковых выводов соединяют с мешком с цельной кровью или пробиркой K2-EDTA, в то время как другой вывод с противоположной стороны устройства соединяют с пустым мешком. Третий боковой вывод соединяют с пустым мешком для сбора фильтрованной плазмы. Мешок с кровью оставляют при RT в течение по меньшей мере 30 минут и осторожно перемешивают перед применением.
Сорок миллилитров цельной крови фильтруют через устройство путем гравитационной фильтрации, собирают в боковом мешке 15 мл (30%) плазмы, переносят в 50-мл пробирку типа Фалькон, распределяют аликвотами в 2-мл микроцентрифужные пробирки и хранят при -20°C. Цельную кровь и ее клеточные компоненты в ретентате концентрируют, собирают в боковой мешок и отбрасывают.
Е) Анализ трекинга наночастиц (NTA)
Перед анализом образцы плазмы центрифугируют при 13000g для устранения более крупных везикул, которые могут повлиять на анализ, и дополнительно разбавляют PBS 1:10000. NTA выполняют с использованием прибора LM10 Nanosight (Malvern, UK), устанавливая уровень камеры на 16 и затвор на 13000. Концентрацию частиц вычисляют как среднее из трех независимых измерений.
F) Определение количества экзосом ELISA
Образцы плазмы оттаивают при RT, и к каждому образцу добавляют 1 мкл коктейля ингибиторов протеаз (1000×; Sigma, кат.ном. P-834) для сохранения белковых биомаркеров. Образцы плазмы центрифугируют при 1200g в течение 20 минут при комнатной температуре (RT) для устранения оставшихся красных клеток крови и клеточного дебриса. Полученный супернатант собирают и разбавляют фосфатным буфером (PBS) в объемном соотношении 1:1.
Коротко, 100 мкл разбавленной плазмы инкубируют в течение ночи при 4°С в 96-луночных планшетах, предварительно сенсибилизированных 0,1 мкг/лунка антителом анти-CD9 (кат.ном. HBM-CD9-100, HansaBioMed Life Sciences Ltd), анти-CD45 антителом (кат.ном. 610265, BD), анти-CD61 антителом (кат.ном. 555752, BD); анти-CD235 антителом (кат.ном. 555569, BD) и анти-TM9SF4 антителом (2 мкг/мл). После трех промывок буфером для промывки (PBS-твин 0,05%) планшеты инкубируют с биотинилированным анти-CD9 антителом (кат.ном. 558749, BD Pharmigen), инкубируют в течение 2 час при 4°С, трижды промывают буфером для промывки, инкубируют в течение одного часа при 4°С с совместимым с конъюгатом поли-HRP-стрептавидин вторичным антителом (кат.ном. 21140, Pierce) и трижды промывают буфером для промывки. Колориметрическую реакцию начинают, добавляя в каждую лунку 100 мкл раствора субстрата (TMBlue POD; раствор A и B, 1:1, Pierce), инкубируя 10 минут в темноте при RT, и останавливают, добавляя 100 мкл стоп-раствора (1N серная кислота). Регистрируют поглощение O/D при 450 нм с помощью M1000 Tecan, и результаты выражают в виде отношения сигнала к шуму (StB).
G) Получение осадка микровезикул
Плазму, полученную центрифугированием, и плазму, полученную фильтрацией через пористые волокна, дополнительно центрифугируют при 10000g в течение 30 минут при RT, и получают осадок микровезикул (MV). Осадок MV ресуспендируют в 100 мкл PBS перед дальнейшей обработкой.
Н) Экстрагирование малых РНК из осадка MV и анализ электрофореграммы
РНК экстрагируют из осадков MV с использованием набора для общего иммунозахвата экзосом и экстрагирования РНК (Overall Exosome Immunocapture and RNA extraction) из биожидкостей человека и сред для клеток (кат.ном. HBM-RNA-BOF-20; HansaBioMed Life Sciences Ldt, Estonia) и элюируют в 15 мл буфера для элюирования согласно инструкциям изготовителя. Пять микролитров экстрагированных РНК загружают в набор RNA 6000 Pico Kit (кат.ном. 5067-1513; Agilent Technologies) и пропускают на приборе Bioanalyzer, и получают электрофореграмму РНК.
I) Добавление к образцам крови с BRAFV600E-положительных экзосом опухоли и выделение экзосом-ассоциированной ДНК.
Десять миллилитров цельной крови здоровых пациентов-доноров «понизывают» 80 мкл BRAFV600E-положительных экзосом опухоли, закупленных у коммерческого поставщика (5,5 мкл/мкл, клеточная линия COLO1, HansaBioMed Life Sciences Ldt).
Из добавленных экзосом опухоли экстрагируют экзосом-ассоциированную ДНК (экзо-ДНК (Exo-DNA)) и очищают с использованием коммерчески доступного набора для экстрагирования циркулирующей ДНК (seleCTEVTM low input DNA; Exosomics Siena Spa, Italy). Коротко, экзосомы захватываются из плазмы с использованием пептида из набора и осаждаются после 2-часовой инкубации. Осадки экзосом лизируют с помощью буфера для лизиса из набора и расщепляют протеиназой К для высвобождения ДНК из белковых комплексов K. Затем к образцу добавляют этанол, загружают в спин-колонку с кремнеземной мембраной и центрифугируют при 10000g в течение 1 минуты. После центрифугирования свободную жидкость отбрасывают. Выполняют две стадии промывки согласно инструкциям изготовителя для того, чтобы перед элюированием избавиться от загрязнений растворителей и происходящих из плазмы ингибиторов. Экзо-ДНК элюируют в 50 мкл буфера для элюирования и хранят при -20°C до использования.
Амплификация генов BRAFV600E и BRAFWT кПЦР
Смесь для каждой кПЦР включает 10 мкл очищенной экзо-ДНК, универсальные зонды 1X SsoAdvanced Universal Probes Mastermix (Biorad; US), 0,625 мкл праймеров (10 мкM) и 0,3125 мкл флуоресцентного зонда (10 мкM) в общем объеме 25мкл. Используют следующие праймер и зонды:
a) BRAFWT FW: TAGGTGATTTTGGTCTAGCTACAG+T;
b) BRAFWT RW: TTAATCAGTGGAAAAATAGCCTCA;
c) BRAFV600E FW: TAGGTGATTTTGGTCTAGCTACAG+A;
d) BRAFV600E RW TTAATCAGTGGAAAAATAGCCTCA;
e) зонд 5’-FAM CCGAAGGGGATC+CAGACAA+CTGTTCAAACTGCCTTCGG-3BHQ1 -3.
После тщательного перемешивания каждую реакционную смесь загружают, при трехкратном повторе, в 96-луночный планшет для ПЦР, и запускают следующую программу кПЦР: 95°C в течение 3', 40 циклов при 95°C в течение 5'' и 60°C в течение 30’', за которыми следует конечная стадия выдержки при 4°C. Для того, чтобы вычислить % восстановленного BRAFV600E, используют следующую формулу: = [2^(Ctзагрузка –Ctвыделение)]%.
L) Детекция копий гена BRAFV600E цифровой капельной ПЦР
Реакционная смесь для каждой цифровой капельной ПЦР включает 10 мкл очищенной экзо-ДНК, 2Х набора ddPCR Supermix для зондов (кат.ном. 186301; Biorad), 20X анализа для детекции мутаций BRAF V600E (анализ ID: dHsaMDV2010027; Biorad) и 5 мкл воды без ДНКазы. Каждую реакционную смесь загружают согласно инструкциям изготовителя, и запускают следующую программу с ddPCR: 95°C в течение 10', 40 циклов при 95°C в течение 30'' и 56°C в течение 1', с последующей конечной стадией выдержки при 4°C. Копии гена BRAF V600E и частоты аллелей вычисляют с использованием программы QuantaSoft (Biorad).
М) Количественное определение липемического индекса образцов плазмы
Липемический индекс измеряют в 500 мкл плазмы с использованием набора Serum Index Gen.2 на приборе Cobas согласно инструкциям изготовителя (кат.ном. 05172179190; Roche).
Пример 1. Устройство с пористым волокном (HF) с 200-нм порами эффективно сепарирует богатую наночастицами плазму из крови
Фиг. 1 показывает число наночастиц с помощью анализа трекинга наночастиц (NTA) плазмы, полученной из цельной крови с использованием центрифуги, центрифуги плюс целлюлозный не-HF 200-нм фильтр или полиэфирсульфонового пористого волокна с пористостью 200 нм или пористостью 20 нм.
Таким образом, показано, что способ по изобретению позволяет получить число наночастиц, схожее с использованием центрифуги плюс целлюлозный не-HF фильтр.
Пример 2. Плазма, полученная при фильтрации цельной крови через 200-нм HF, имеет меньше внеклеточных везикул, происходящих из красных и белых клеток крови, чем плазма, полученная на центрифуге
Фиг. 2 показывает количества внеклеточных везикул, захваченных из плазмы здоровых доноров, полученной центрифугированием или фильтрацией через устройство с полиэфирсульновым HF с пористостью 200 нм, с использованием анти-CD9 антитела (общий маркер EV), анти-CD45 антитела (общий маркер белых клеток крови), анти-CD61 антитела (общий маркер тромбоцитов) или анти-CD235 антитела (общий маркер эритроцитов).
Таким образом, показано, что использование устройства с полиэфирсульновым HF с пористостью 200 нм обедняет образец внеклеточными везикулами, происходящими или из белых клеток крови, или из красных клеток крови или тромбоцитов.
Пример 3. Целлюлозный 200-нм не-HF фильтр не отсекает выбранные субпопуляции внеклеточных везикул
Фиг. 3 показывает количества внеклеточных везикул, захваченных из плазмы, полученной центрифугированием или фильтрацией через целлюлозный 200-нм не-HF фильтр, с использованием анти-CD9 антитела (общий маркер EV), анти-CD45 антитела (общий маркер белых клеток крови), анти-CD61 антитела (общий маркер тромбоцитов) или анти-CD235 антитела (общий маркер эритроцитов).
Таким образом, показано, что такой фильтр не обедняет образец внеклеточными везикулами, происходящими или из белых клеток крови, или из красных клеток крови или тромбоцитов.
Пример 4. Устройство с 200-нм HF действительно отбирает частицы размером меньше указанного
Фиг. 4 показывает электрофореграмму малых РНК микровезикул, полученную с (А) образцом плазмы, полученным центрифугированием цельной крови, и (В) образцом плазмы, полученным фильтрацией цельной крови через устройство с полиэфирсульфоновым HF с пористостью 200 нм.
Такие результаты показывают, что плазма, полученная фильтрацией через устройство с HF, очищена от некоторых микровезикул, которые присутствуют в плазме, полученной центрифугированием. Из литературы известно, что эти микровезикулы крупнее 200 нм (Van der Pol et al.), следовательно, пористость 200 нм действительно отбирает частицы размером меньше указанного.
Пример 5. BRAFV600E–положительные экзосомы опухоли эффективно восстанавливаются в плазме, полученной из цельной крови после фильтрации с помощью устройства с 200-нм HF
Фиг. 5 показывает уровни мутации BRAFV600E (A) или соотношение BRAFV600E против BRAFWT (B) в экзосомах опухоли при измерении после центрифурования или фильтрации через устройство с полиэфирсульфоновым HF с пористостью 200 нм образца цельной крови, который «пронзен» такими экзосомами опухоли, как описано выше в разделе «Материалы и методы».
Видно, что способ по изобретению не изменяет существенно уровни экзосом опухоли, обнаруженные в образце плазмы, соотносительно с классическим способом центрифугирования.
Кроме того, различие на фиг. 5В ясно показывает, как способ по изобретению снижает уровень BRAFWT как следствие обеднения BRAFWT–несущими внеклеточными везикулами.
Пример 6. Фильтрация через HF с пористостью 200 нм устраняет ложный положительный сигнал маркера метаболизма ТМ9SF4
Фиг. 6 показывает количества экзосом, захваченных из плазмы здоровых доноров, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм, с использованием анти-CD9 антитела (общий маркер EV) или анти-TM9SF4 антитела (маркер метаболизма, экспрессированный на экзосомах, происходящих как из опухолевых паренхимных, так и стромальных клеток, претерпевающих переключение гликолиза (Lozupone et al. 2009; Lozupone et al. 2015), но также из активированных гемопоэтических клеток (Paolillo et al).
Видно, что уровни TM9SF4-положительных экзосом из плазмы здоровых доноров, полученной способом по изобретению, ниже диагностического порога (пунктирная линия), установленного для положительной детекции. Напротив, уровни TM9SF4-положительных экзосом из плазмы здоровых доноров, полученной центрифугированием, выше такого диагностического порога, что приводит к ложной положительной детекции. Результат предполагает, что фильтрация через HF значительно снижает запутывающий эффект из-за активации клеток крови, облегчающей детекцию биомаркера на экзосомах из паренхимных и стромальных клеток.
Пример 7. Фильтрация крови через HF снижает липемический индекс плазмы
Фиг. 7 показывает липемический индекс трех образцов плазмы, полученной из крови здоровых доноров после центрифугирования или фильтрации через устройство с полиэфирсульфоновым HF с пористостью 200 нм. Результаты показывают, что фильтрация через HF снижает липемический индекс всех трех образцов плазмы по сравнению с центрифугированием. Такой результат можно, по меньшей мере частично, объяснить снижением числа богатых триглицеридами хиломикронов – везикул, которые имеют диаметр, колеблющийся от 70 нм до 1000 нм (De Haene et al.).
Пример 8. Снижение липемического индекса фильтрацией через HF улучшает извлечение мутаций
Фиг. 8 показывает уровни копий мутации BRAFV600E (копии/мл) в экзосомах опухоли, добавленных в плазму здоровых доноров, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм. Результаты показывают, что больше копий мутаций извлекается из фильтрованной через HF плазмы, чем из центрифугированной плазмы. Улучшенное извлечение мутаций коррелирует с наблюдаемым уменьшением липемического индекса, наблюдаемого в том же наборе образов плазмы.
Пример 9. Фильтрация через HF образцов липемической плазмы снижает их липемический индекс
Фиг. 9 показывает липемический индекс образцов плазмы до и после центрифугирования или фильтрации через устройство с полиэфирсульфоновым HF с пористостью 200 нм. Результаты показывают, что фильтрация через HF снижает липемический индекс всех трех образцов липемической плазмы по сравнению с центрифугированием, что совпадает со способностью устройства снижать уровни богатых триглицеридами хиломикронов.
Пример 10. Устройство с пористым волокном (HF) с 500-нм порами эффективно сепарирует богатую наночастицами плазму из крови
Фиг. 10 показывает число наночастиц в плазме с помощью анализа трекинга наночастиц (NTA) плазмы, полученной из цельной крови с использованием центрифуги или фильтра из полиэфирсульфонового HF с пористостью 200 нм или с пористостью 500 нм.
Таким образом показано, что фильтр из HF с пористостью 500 нм позволяет получить схожее число наночастиц при сравнении с центрифугой и фильтром из HF с пористостью 200 нм. Как ожидалось, средний размер наночастиц незначительно увеличивается с фильтром из 500-нм HF по сравнению с центрифугой и фильтром из HF с пористостью 200 нм.
Пример 11. Плазма, полученная фильтрацией цельной крови через 500-нм HF, имеет меньше внеклеточных везикул из красных и белых клеток крови, чем плазма, полученная центрифугированием
Фиг. 11 показывает количества внеклеточных везикул, захваченных из плазмы здоровых доноров, полученной или центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 500 нм, с использованием анти-CD9 антитела (общий маркер EV), анти-CD45 антитела (общий маркер белых клеток крови), анти-CD61 антитела (общий маркер тромбоцитов) или анти-CD235 антитела (общий маркер эритроцитов).
Таким образом, показано, что использование устройства с полиэфирсульфоновым HF с пористостью 500 нм очищает образец от внеклеточных везикул, происходящих или из белых клеток крови или из красных клеток крови, но не имеет существенно действия на происходящие из тромбоцитов внеклеточные везикулы.
Пример 12. Фильтрация через HF снижает уровни гена BRAF дикого типа в плазме пациентов с метастастатической меланомой
Фиг. 12 показывает уровни копий (копии/мл) гена BRAF дикого типа в плазме пациентов с метастастатической меланомой, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм. Результаты показывают, что 4 из пяти образцов плазмы, полученной с помощью устройства с HF, имеют значительно меньше копий гена BRAF, чем образцы, полученные центрифугированием. Такой результат показывает, что фильтрация через HF снижает уровни гена BRAF дикого типа в плазме больных раком.
Пример 13. Фильтрация через HF улучшает частоту аллелей мутации BRAFV600E в плазме пациентов с метастастатической меланомой
Фиг. 13 показывает частоту аллелей мутации гена BRAFV600E в плазме трех пациентов с метастастатической меланомой, полученной центрифугированием или фильтрацией через устройство с полиэфирсульфоновым HF с пористостью 200 нм. Результаты показывают, что фильтрация через HF улучшает частоту аллелей BRAFV600E в каждом образце. Такой результат совпадает со снижением уровней копий гена BRAF дикого типа, наблюдаемым в этих образцах.
Пример 14. Фильтрация через HF с пористостью 200 нм облегчает детекцию экзосом опухоли в плазме
Фиг. 14 показывает количества экзосом опухоли, захваченных из плазмы, полученной из крови с добавленными экзосомами опухоли или центрифугированием или фильтрацией через устройство с HF с пористостью 200 нм, с использованием анти-TM9SF4 антитела – маркера метаболизма, экспрессированного экзосомами, происходящими как из паренхимных, так и стромальных опухолевых клеток, претерпевающих переключение гликолиза.
Показано, что уровни TM9SF4-положительных экзосом опухоли повышаются в плазме, полученной из «пронзенной» экзосомами опухоли крови фильтрацией через устройство с HF с пористостью 200 нм. Напротив, не наблюдается изменения в уровнях TM9SF4-положительных экзосом опухоли в плазме, полученной центрифугированием, из-за высокого фонового шума, генерированного происходящими из крови везикулами. Результат предполагает, что фильтрация через HF значительно ослабляет запутывающий эффект из-за активации, облегчающей детекцию биомаркера на экзосомах опухоли.
Библиография
Black A, Pienimaeki-Roemer A, Kenyon O, Orsó E, Schmitz G. Platelet-derived extracellular vesicles in plateletpheresis concentrates as a quality control approach. Transfusion. 2015, Sep.55(9): 2184-96.
Ishihara K, Hasegawa T, Watanabe J, Iwasaki Y. Artif. Organs. 2002, Dec.26(12): 1014-9.
Van der Pol E, Böing AN, Harrison P, Sturk A, Nieuwland R. Classification, functions, and clinical relevance of extracellular vesicles. Pharmacol. Rev., 2012, Jul, 64(3): 676-705.
Mock I., Membrane Processes, Vol.1, Encyclopedia of Desalination and Water Resources, http://www.desware.net/Sample-Chapters/D05/D09-006.pdf
Zhang H, Freitas D, Kim HS, Fabijanic K, Li Z, Chen H, Mark MT, Molina H, Martin AB, Bojmar L, Fang J, Rampersaud S, Hoshino A, Matei I, Kenific CM, Nakajima M, Mutvei AP, Sansone P, Buehring W, Wang H, Jimenez JP, Cohen-Gould L, Paknejad N, Brendel M, Manova-Todorova K, Magalhães A, Ferreira JA, Osório H, Silva AM, Massey A, Cubillos-Ruiz JR, Galletti G, Giannakakou P, Cuervo AM, Blenis J, Schwartz R, Brady MS, Peinado H, Bromberg J, Matsui H, Reis CA, Lyden D. Identification of distinct nanoparticles and subsets of extracellular vesicles by asymmetric flow field-flow fractionation. Nat. Cell Biol., 2018, Mar. 20(3): 332-343.
Lozupone F, Perdicchio M, Brambilla D, Borghi M, Meschini S, Barca S, Marino ML, Logozzi M, Federici C, Iessi E, de Milito A, Fais S. The human homologue of Dictyostelium discoideum phg1A is expressed by human metastatic melanoma cells. EMBO Rep. 2009, Dec.10(12): 1348-54.
Lozupone F, Borghi M, Marzoli F, Azzarito T, Matarrese P, Iessi E, Venturi G, Meschini S, Canitano A, Bona R, Cara A, Fais S. TM9SF4 is a novel V-ATPase-interacting protein that modulates tumor pH alterations asso ciated with drug resistance and invasiveness of colon cancer cells. Oncogene, 2015, Oct 1; 34(40): 5163-74.
Paolillo R, Spinello I, Quaranta MT, Pasquini L, Pelosi E, Lo Coco F, Testa U, Labbaye C. Human TM9SF4 Is a New Gene Down-Regulated by Hypoxia and Involved in Cell Adhesion of Leukemic Cells. PLoS One. 2015, May 11; 10(5): e0126968.
De Haene H, Taes Y, Christophe A, Delanghe J. Comparison of triglyceride concentration with lipemic index in disorders of triglyceride and glycerol metabolism. Clin. Chem. Lab. Med., 2006; 44(2): 220-2
Seo-Hyun Pak, Yong-Woo Jeon, Myung-Seop Shin and Hyung Chul Koh. Preparation of Cellulose Acetate Hollow-Fiber Membranes for CO2/CH4 Separation. Environmental Engineering Science, Vol. 33, No. 1 Original Articles, Volume 369, Issues 1–2, 1 March 2011, Pages 437-447.
Xing Yanga, Rong Wanga, Lei Shi, Anthony G. Fanea, Marcin Debowski. Performance improvement of PVDF hollow fiber-based membrane distillation process. Journal of Membrane Science. Volume 369, Issues 1–2, 1 March 2011, Pages 437-447.
Hailin Zhu, Hongjie Wanga, Feng Wanga, Yuhai Guo, Huapeng Zhang, Jianyong Chen. Preparation and properties of PTFE hollow fiber membranes for desalination through vacuum membrane distillation. Journal of Membrane Science. Volume 446, 1 November 2013, Pages 145-153.
Amir Dashti, Morteza Asghari. Recent Progresses in Ceramic Hollow-Fiber Membranes. ChemBioENg Reviews.03 February 2015. https://doi.org/10.1002/cben.201400014
Ze-Lin Qiu, Xin Kong, Jia-JiaYuan, Yu-Jie Shen, Bao-ku Zhu, Li-Ping Zhu, Zhi-Kan Yao, Chuyang Y. Tang. Cross-linked PVC/hyperbranched polyester composite hollow fiber membranes for dye removal. Reactive and Functional Polymers. Volume 122, January 2018, Pages 51-59.
Li FS, Qiu W, Lively RP, Lee JS, Rownaghi AA, Koros WJ. Polyethyleneimine-functionalized polyamide imide (Torlon) hollow-fiber sorbents for post-combustion CO2 capture. ChemSusChem. 2013, Jul;6(7):216-23.
Labreche Y, Fan Y, Rezaei F, Lively RP, Jones CW, Koros WJ. Poly(amide-imide)/silica supported PEI hollow fiber sorbents for postcombustion CO(2) capture by RTSA. ACS Appl. Mater Interfaces. 2014, Nov 12; 6(21): 19336-46.
Zhang Y, Zhong F, Xia S, Wang X, Li J. Autohydrogenotrophic denitrification of drinking water using a polyvinyl chloride hollow fiber membrane biofilm reactor. J Hazard Mater., 2009, Oct 15; 170(1): 203-9.
Higa M, Kakihana Y, Sugimoto T, Toyota K. Preparation of PVA-Based Hollow Fiber Ion-Exchange Membranes and Their Performance for Donnan Dialysis. Membranes (Basel). 2019, Jan 2;,9(1). pii: E4.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТАВА ИНДИВИДУАЛЬНЫХ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ В КРОВИ ЧЕЛОВЕКА | 2014 |
|
RU2583940C1 |
| Набор для выделения экзосом | 2023 |
|
RU2824663C1 |
| СПОСОБЫ И НАБОРЫ, ИМЕЮЩИЕ ОТНОШЕНИЕ К ЗАХВАТУ CA-IX-ПОЗИТИВНЫХ ЭКЗОСОМ | 2018 |
|
RU2770592C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |
| Способ и устройство для выделения внеклеточных везикул из биологических жидкостей с помощью каскадной ультрафильтрации | 2017 |
|
RU2745613C1 |
| ЭКЗОСОМАЛЬНЫЕ БИОМАРКЕРЫ | 2015 |
|
RU2712223C2 |
| НОВЫЙ СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ И ОХАРАКТЕРИЗОВАНИЯ МИКРОВЕЗИКУЛ В ЖИДКОСТЯХ ОРГАНИЗМА ЧЕЛОВЕКА | 2009 |
|
RU2520741C2 |
| ЭКЗОСОМЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ВАКЦИНЫ | 2016 |
|
RU2763524C2 |
| НАНО- И МИКРОЧАСТИЦЫ ДЛЯ ИЗОЛЯЦИИ СПЕЦИФИЧЕСКИХ СУБПОПУЛЯЦИЙ ЭКЗОСОМ И ИХ АНАЛИЗА | 2020 |
|
RU2733884C1 |
| Способ изоляции микровезикул из крови | 2017 |
|
RU2651521C1 |
Группа изобретений относится к области пористых волокон для снижения в крови и производных крови концентрации произведенных из крови внеклеточных везикул, в частности микровезикул, и экзосом и экзомеров. Предлагается применение in vitro пористых волокон, имеющих пористость от 20 до 500 нм, при гравитационной фильтрации, для снижения концентрации внеклеточных везикул в образце крови или образце жидкости, происходящей из компонентов крови, выбранных из группы, включающей красные клетки крови, белые клетки крови, тромбоциты и их комбинации, причем такие внеклеточные везикулы имеют размер, который меньше пористости пористых волокон. Также раскрывается способ in vitro получения крови или производного крови со сниженной концентрацией внеклеточных везикул, происходящих из компонентов крови, способ in vitro анализа содержания внеклеточных везикул в образце крови или образце жидкости, происходящей из крови. Группа изобретений обеспечивает снижение концентрации внеклеточных везикул в образце крови или образце жидкости при использовании пористых волокон, имеющих пористость от 20 до 500 нм. 3 н. и 18 з.п. ф-лы, 14 ил., 14 пр.
1. Применение in vitro пористых волокон, имеющих пористость от 20 до 500 нм, при гравитационной фильтрации, для снижения концентрации внеклеточных везикул в образце крови или образце жидкости, происходящей из компонентов крови, выбранных из группы, включающей красные клетки крови, белые клетки крови, тромбоциты и их комбинации, причем такие внеклеточные везикулы имеют размер, который меньше пористости пористых волокон.
2. Применение по п. 1, где пористые волокна включают полиэфирсульфоновые пористые волокна.
3. Применение по п. 1, где пористые волокна состоят из полиэфирсульфоновых пористых волокон.
4. Применение по любому из пп. 1-3, где внеклеточные везикулы выбирают из группы, включающей микровезикулы, экзосомы, экзомеры и их комбинации.
5. Применение по пп. 1-4, где пористость пористых волокон составляет 200 нм.
6. Применение по любому из пп. 1-4, где пористость пористых волокон составляет от 150 до 500 нм.
7. Применение по любому из пп. 1-6, где образец жидкости, происходящей из крови, представляет собой образец плазмы.
8. Способ in vitro получения крови или производного крови со сниженной концентрацией внеклеточных везикул, происходящих из компонентов крови, выбранных из группы, включающей красные клетки крови, белые клетки крови, тромбоциты и любые их комбинации, который включает стадию гравитационной фильтрации крови или образца жидкости, происходящей из крови, через фильтр, включающий пористые волокна, имеющие пористость от 20 до 500 нм, что приводит к получению крови или производного крови со сниженной концентрацией указанных внеклеточных везикул, причем такие внеклеточные везикулы имеют размер, который меньше пористости пористых волокон.
9. Способ по п. 8, где пористые волокна включают полиэфирсульфоновые пористые волокна.
10. Способ по п. 8, где пористые волокна состоят из полиэфирсульфоновых пористых волокон.
11. Способ по любому из пп. 8-10, где внеклеточные везикулы выбирают из группы, включающей микровезикулы, экзосомы, экзомеры и их комбинации.
12. Способ по любому из пп. 8-11, где пористость пористых волокон составляет 200 нм.
13. Способ по любому из пп. 8-11, где пористость пористых волокон составляет от 150 до 500 нм.
14. Способ по любому из пп. 8-13, где образец жидкости, происходящей из крови, представляет собой образец плазмы.
15. Способ in vitro анализа содержания внеклеточных везикул в образце крови или образце жидкости, происходящей из крови, включающий
а) гравитационную фильтрацию образца крови или образца жидкости, происходящей из крови, через фильтр из пористых волокон, имеющих пористость от 20 до 500 нм, где посредством этого получают фильтрат;
b) анализ содержания внеклеточных везикул в фильтрате, полученном на стадии а),
где внеклеточные везикулы представляют собой внеклеточные везикулы, происходящие из компонентов крови, выбранных группы, включающей красные клетки крови, белые клетки крови, тромбоциты и их комбинации.
16. Способ по п. 15, где пористые волокна включают полиэфирсульфоновые пористые волокна.
17. Способ по п. 15, где пористые волокна состоят из полиэфирсульфоновых пористых волокон.
18. Способ по любому из пп. 15-17, где внеклеточные везикулы выбирают из группы, включающей микровезикулы, экзосомы, экзомеры и их комбинации.
19. Способ по любому из пп. 15-18, где пористость пористых волокон составляет 200 нм.
20. Способ по любому из пп. 15-18, где пористость пористых волокон составляет от 150 до 500 нм.
21. Способ по любому из пп. 15-20, где образец жидкости, происходящей из крови, представляет собой образец плазмы.
| WO 2007127848 A1, 08.11.2007 | |||
| H | |||
| HACKSTEIN ET AL., "Prospective quality control study of a novel gravity-driven whole blood separation system suitable for humanitarian crises", VOX SANGUINIS., CH, (20171101), vol | |||
| Прялка для изготовления крученой нити | 1920 |
|
SU112A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| WO 2016181300 A1, 17.11.2016 | |||
| СПОСОБ ПОЛУЧЕНИЯ АСИММЕТРИЧНОГО МИКРОПОРИСТОГО ПОЛОГО ВОЛОКНА И АСИММЕТРИЧНОЕ МИКРОПОРИСТОЕ ПОЛОЕ ВОЛОКНО | 1992 |
|
RU2086296C1 |
| Весы для автоматического взвешивания жидкостей | 1926 |
|
SU5425A1 |
Авторы
Даты
2023-05-22—Публикация
2019-03-29—Подача