Изобретение относится к медицине, а именно к биохимическим исследованиям биологических объектов, и может найти применение в диагностике онкологических и злокачественных заболеваний.
В последние годы интенсивно разрабатывается новый подход персонализированной оценки рисков заболеваний - так называемая "жидкая биопсия" - малоинвазивная, ранняя диагностика опухолей, неонкологических патологий, а также пренатальная диагностика на основе анализа внеклеточной, так называемой "свободно циркулирующей внеклеточной ДНК" и экзосом. Главное достоинство разрабатываемой платформы "жидкостной биопсии" - малая инвазивность взятия биологического образца. Экзосомы секретируются всеми типами клеток и являются медиаторами клеточной коммуникации, поскольку служат средством межклеточной передачи биологических сигналов, способных изменять функции и физиологию клеток-мишеней. Экзосомы определяются как мембранные везикулы размером 40-200 нм, плавучая плотность которых находится в диапазоне от 1,10 до 1,18 г/мл. В отличие от других типов внеклеточных везикул (микровезикул, апоптотических телец), которые образуются в результате прямого отпочковывания от плазматической мембраны родительской клетки, экзосомы формируются в специализированных эндосомальных клеточных компартментах - мультивезикулярных тельцах и секретируются во внеклеточное пространство путем их слияния с клеточной мембраной. Экзосомы содержат в себе различные белки, нуклеиновые кислоты, липиды и метаболиты. Набор этих биомолекул отражает тип и патофизиологическое состояние секретирующих их клеток. Поскольку экзосомы обнаруживаются во многих биологических жидкостях организма, то количественный и качественный анализ циркулирующих экзосом может быть перспективным инструментом малоинвазивной диагностики заболеваний, мониторинга эффективности лечения и доклинического выявления рецидивов. В настоящее время активно исследуются диагностические возможности протеомного анализа и профилирования микроРНК экзосом, выделенных из плазмы, мочи, слюны и других жидкостей пациентов с разными заболеваниями. Такие природные свойства экзосом, как малый размер, стабильность в кровеносном русле, низкая иммуногенность, способность селективно транспортировать на большие расстояния свое содержимое в клетки-мишени, а также возможность модификации их поверхности и содержимого, делают эти нановезикулы идеальными носителями для адресной доставки лекарственных препаратов, для создания вакцин, а также как рассматриваются как перспективный кандидат "жидкостной биопсии".
Хотя экзосомы имеют большой диагностический и терапевтический потенциал, однако отсутствие стандартизированных методов их эффективного выделения ограничивает внедрение экзосомальных технологий в клиническую практику. Прежде всего, это связано с тем, что во внеклеточных жидкостях циркулирует большое количество разнообразных мембранных внеклеточных везикул, из которых экзосомы составляют только определенную часть. В любой биологической жидкости, помимо экзосом, циркулируют и другие близкие по размеру, массе и плотности к экзосомам компоненты: белки, липопротеины различной плотности, нуклеопротеиновые комплексы, мембранные везикулы других типов и др. При этом сам пул экзосом также довольно гетерогенный. Он состоит из субпопуляций нановезикул, которые отличаются по размеру, морфологии, поверхностным маркерам, биохимическому содержанию. Контаминация препаратов экзосом не-экзосомальными компонентами биологической жидкости может приводить к завышенной количественной оценке содержимого экзосом. С другой стороны, в процессе выделения часть экзосом может разрушаться или теряться, например, из-за агрегации нановезикул или низкого уровня экспрессии мембранных маркеров, что также будет искажать результаты.
Спектр контаминирующих компонентов может меняться в зависимости от источника экзосом. Так, например, основным загрязняющим компонентом при выделении из крови могут быть липопротеины и сывороточный альбумин, которые присутствуют в крови в значительном количестве. Концентрация липопротеинов в сыворотке на порядки превосходит концентрацию циркулирующих внеклеточных везикул. При этом отделить экзосомы от липопротеинов чрезвычайно сложно из-за близости их размеров и плотностей. Основной проблемой при выделении из мочи является уромодулин (белок Tamm-Horsfall), концентрация которого может достигать 1.5 мг/мл. Полимерная сеть, формируемая этим белком, может связывать экзосомы, снижая эффективность выделения. В связи с вышеизложенным, очень важно получить препарат внеклеточных микровезикул, максимально обогащенный именно экзосомами.
Существующие методы выделения экзосом можно классифицировать следующим образом.
Ультрацентрифугирование - разделения везикул под действием центробежной силы. Метод основан на разной скорости оседания частиц, отличающихся по размеру и плотности. Выделяют три варианта метода, основанных на центрифугировании: дифференциальное центрифугирование, зонально-скоростное градиентное центрифугирование и изопикническое градиентное центрифугирование. Метод не требует использования коммерческих наборов реагентов, однако он малопродуктивен - не более 6 образцов за центрифугирование, трудоемкий, продолжительный и требует использование дорогостоящего оборудования.
Метод и гель-фильтрации, или эксклюзионной хроматографии, разделяет частицы по гидродинамическому радиусу за счет их разной способности проникать в поры геля неподвижной фазы. Этот метод был эффективно адаптирован для выделения экзосом из разных типов жидкостей. Эта технология используется в коммерческих наборах для выделения экзосом SmartSEC™ Single for EV Isolation (System Biosciences), qEV (Izon Science), PURE-EVs (Hansa Biomed). Однако, метод не позволяет разделить везикулы близкого размера, но разного типа, а также отделить экзосомы от других биомолекул близкого размера. Поэтому экзосомальная фракция экзосом часто загрязнена мелкими не экзосомальными везикулами, крупными белковыми агрегатами и липопротеинами, такими как хиломикроны, липопротеины низкой и очень низкой плотности Недостатком метода является и невысокий выход экзосом, которые к тому же и разбавлены элюентом.
Твердофазное связывание с карбидом кремния. Данный подход к выделению экзосом предложен компанией Norgen Biotek [Haj-Ahmad Y., inventor; Norgen Biotek Corp., assignee. Methods for extracellular vesicle isolation and selective removal. United States Patent US US 10160964 B2, 2018 Dec 25]. Он реализован в коммерческих наборах фирмы: Plasma/Serum Exosome Purification, Kit, Urine Exosome Purification Kits, Cell Culture Media Exosome Purification Kits и Saliva Exosome Purification Kit. Метод основан на селективном связывании липидов экзосом с карбидом кремния в зависимости от pH раствора и значения изоэлектрической точки. К недостаткам метода следует отнести необходимость использования специальных микро-колонок, что ограничивает производительность метода и неизбирательность связывания всех внеклеточных гидрофобных частиц и агрегатов макромолекул во внеклеточных жидкостях.
Аффинное взаимодействие. Эта группа методов основана на способности различных биомолекул, присутствующих на поверхности везикул (липидов, полисахаридов, протеинов), к аффинному взаимодействию с другими молекулами, включая антитела, лектины и липид-связывающие протеины. На поверхности экзосомальных мембран экспонированы различные белки, включая тетраспанины CD9, CD63, CD81, CD82, белки теплового шока HSP70 и Hsp90, антигены главного комплекса гистосовместимости и др. Антитела к этим белкам используются как для анализа экзосомальной фракции, так и для иммунопреципитации экзосом. Для иммунопреципитации обычно используют антитела, конъюгированные с твердофазным носителем (латекс, силикон), который может быть в виде магнитных частиц, покрытых полимером (Dynabeads, Thermo Fisher Scientifi), колонки для центрифугирования (Exo Trap Exosomes Isolation Spin Column, Cosmo Bio), модифицированных наконечников для пипеток (monolithic silica microtips - MSIA D.A.R.T., Thermo Fisher Scientific) и др. Взаимодействие между антителом, иммобилизованным на поверхности матрикса, и мембраной экзосом относительно сильное, что позволяет отмыть связанные экзосомы от многочисленных компонентов биологической жидкости. Разнообразие используемых антител и носителей в разных форматах объясняет наличие большого количества используемых протоколов, основанных на аффинном взаимодействии. Например, в работе Clayton A. с соавторами экзосомы, секретируемые В-лимфоцитами, выделялись из кондиционной среды с помощью магнитной сепарации, используя магнитные частицы с конъюгированными HLA-антителами (Clayton A., Court J., Navabi H., et al. 2001. Analysis of antigen presenting cell derived exosomes, based on immuno-magnetic isolation and flow cytometry. J. Immunol. Methods. 247 (1-2), 163-174). Магнитные частицы инкубировали с кондиционной средой в течение 24 часов, после чего собирали их с помощью магнита и отмывали. Выделенные частицы характеризовали с помощью трансмиссионной электронной микроскопии и проточной цитометрии. Другая исследовательская группа перед магнитной сепарацией экзосом из различных клеточных линий сначала сконцентрировала везикулы из кондиционной среды с помощью гидрофильного полимера, используя коммерческий набор компании Thermo Fisher - Total Exosome Isolation Reagent (Oksvold M.P., Neurauter A, Pedersen K.W. 2015. Magnetic bead-based isolation of exosomes. In: RNA Interference. Methods in Molecular Biology (Methods and Protocols), 1218. Ed. Sioud M. New York: Humana Press, pp. 465-481). После инкубации с реагентом в течение 12 часов и центрифугирования, осадок ресуспендировали в буфере PBS. Экзосомы из обогащенного препарата были выделены с помощью магнитных частиц, конъюгированных с антителами к CD9, CD63 и CD81. Анализ методами трансмиссионной микроскопии, проточной цитометрии и Western-блота показал, что выделенный препарат содержал везикулы одинакового или близкого размера, с однообразной морфологией и не содержал примесей белков и белковых агрегатов.
Основным преимуществом метода аффинного связывания является чистота препарата, которая обеспечивается специфичностью антиген-антительного связывания. Эта же специфичность является одновременно и минусом метода, поскольку она способствует обогащению конечного продукта экзосомами с высоким уровнем определенного поверхностного маркера и потере экзосом с низким уровнем его экспрессии. Недостатком метода также являются ограничения, связанные с доступностью антител, а также сложности отделения экзосом от связавшихся антител.
ПЭГ-преципитация. Популярным осаждающим микровезикулы агентом является полиэтиленгликоль (ПЭГ). Он давно используется клеточной биологии для осаждения вирусных частиц, нуклеиновых кислот и комплексов биомолекул. Экспериментально установленный феномен преципитации в присутствии ПЭГ пока мало изучен. Теоретическими моделями, описывающими этот процесс, являются теория исключенного объема и теория эффективной силы притяжения, обусловленной исключенным объемом. Согласно модели исключенного объема, преципитация молекул происходит в результате уменьшения их гидратации в присутствии полимера. Вторая модель объясняет преципитацию эффектом притяжения молекул, обусловленную осмотическим давлением полиэтиленгликоля]. Преимуществами этого метода являются простота и скорость, что позволяет одновременно анализировать несколько проб, а также минимальные потери в процессе выделения. В настоящее время по частоте использования ПЭГ-преципитация уступает только ультрацентрифугированию. Обычно, для выделения экзосом используется 8-12% ПЭГ 6 kDa (Ludwig A.K., De Miroschedji K., Doeppner T.R., et al. 2018. Precipitation with polyethylene glycol followed by washing and pelleting by ultracentrifugation enriches extracellular vesicles from tissue culture supernatants in small and large scales. J. Extracel. Vesicles. 7, 1528109) и 8-10% ПЭГ 8 kDa (Rider M.A., Hurwitz S.N., Meckes D.G. 2016. ExtraPEG: A polyethylene glycol-based method for enrichment of extracellular vesicles. Sci. Rep. 6, 23978). Среди достоинств метода можно выделить то, что в отличие от ультрацентрифугирования и ультрафильтрации, во время которых везикулы могут деформироваться, метод преципитации позволяет получить морфологически и функционально качественные экзосомы. Главным недостатком метода является низкая чистота препарата экзосом. Этот метод только концентрирует экзосомальную фракцию, но не позволяет отделить другие микровезикулы, макромолекулярные агрегаты и другие микрочастицы, не являющиеся экзосомами. Контаминация препаратов экзосом белками плазмы крови является общей проблемой всех вышеперечисленных методов, именно поэтому все существующие коммерческие наборы для выделения экзосом компаний Invitrogen, Norgen Biotech, System Biosciences, Life Technologies и QIAGEN основаны на предварительном ферментативном удаление избытка белка с помощью фермента протеиназы К. Кроме того, примеси полиэтиленгликоля в целевом продукте, а также плохая растворимость осажденных агрегатов ограничивают дальнейший анализ и использование выделенных экзосом. На основе ПЭГ-преципитации зарегистрированы патенты и созданы наборы реагентов компаниями Life Technologies Corporation (Methods and compositions for exosome isolation. US 9,671,321 B2) и System Biosciences (US 9,005,888 B2). Компания Life Technologies Corporation зарегистрировала патент на основе ПЭГ с молекулярной массой 6000 дальтон, а компания System Biosciences зарегистрировала патент на основе ПЭГ с молекулярной массой 8000 дальтон.
Наиболее часто используемым и близким к предлагаемому является набор “Total Exosome Isolation Kit (from plasma)” компании Life Technologies, который взят нам в качестве прототипа. В состав прототипа входят следующие компоненты: раствор протеиназы К ("Proteinase K”) и раствор реагента для осаждения экзосом (“Exosome Precipitation Reagent from plasma”).
Согласно протоколу набора-прототипа, к каждой пробе плазмы крови объемом 1 мл следует добавить 0,5 мл буфера 1×PBS, после чего добавить 0,05 объема раствора протеиназы К и инкубировать смесь 10 мин при +37°С. После инкубации к смеси добавляют 0,2 объема раствора реагента для осаждения экзосом, тщательно перемешивают содержимое пробирки и инкубируют полученную смесь в течение 30 мин в интервале температур от +2°С до +8°С. После окончания инкубации пробирку со смесью центрифугируют при 10000 g в течение 10 мин, после чего удаляют и отбрасывают супернатант. Оставшийся после центрифугирования осадок содержит экзосомы. Осадок ресуспендируют в необходимом объеме (0,1-0,5 мл, в зависимости от выхода микровезикул) буфера 1×PBS.
Набор прототип позволяет выделять микровезикулы из плазмы крови с высоким выходом. Однако, плазму предварительно необходимо в 1,5 раза разбавить буфером PBS, который не включен в состав набора, а для удаления избытка белка плазмы в прототипе необходимо использовать ферментативную деградацию белка с помощью протеиназы К. Все это приводит к дополнительному разбавлению пробы и удлинению процедуры выделения экзосом, а также может разрушить белки наружной мембраны, которые используются в качестве антигенных детерминант при последующей верификации экзосом. Процедура выделения требует использование термостата на +37°С в процессе инкубации с протеиназой К и охладителя +2°С - +8°С в процессе инкубации плазмы с реагентом для осаждения экзосом. Общее время инкубаций по протоколу достаточно продолжительна и составляет 40 мин. Следует также отметить, что набор прототип не содержит в своем составе все растворы, необходимые для реализации протокола выделения, не включен буфер 1×PBS, необходимый для начального разведения плазмы и для заключительной ресуспензии осадка экзосом.
В связи с вышеизложенным, процедура выделения экзосом набором прототипом достаточно продолжительная, а полученный препарат помимо экзосом содержит также примеси других типов внеклеточных микровезикул по причине отсутствия специфичности осаждения.
Технический результат настоящего изобретения состоит в увеличении выхода экзосом из биологических жидкостей, повышении чистоты препарата экзосом, а также сокращении времени их выделения.
Этот результат достигается тем, что в известном наборе для выделения экзосом, состоящем из осаждающего экзосомы агента, промывочного раствора и элюирующего буфера на основе раствора 0,15M цитрата натрия с pH 7,5, согласно изобретению, в качестве осаждающего экзосомы агента он содержит термический полипептид [лизин-аргинин]n (n=10-50) с молекулярной массой 3-15 килодальтон и промывочный раствор на основе 10 мМ NaCl. Мы применили подход для аффинного выделения экзосом, основываясь на ранее разработанном нами способе и наборе для выделения внеклеточной ДНК (патент RU 2753768 C1), в основе которого лежит способность положительного заряженного термического белка полилизина с образовывать прочные связи с олигофосфатными кластерами ДНК (RU 2753768 C1). В искомом наборе, выделения экзосом более эффективным оказался другой термический полипептид [лизин-аргинин]n (n=10-50), несущий более сильный положительный заряд, позволяющий специфически связывать экзосомы через фосфатные остатки фосфолипидов, что позволило эффективно и избирательно концентрировать экзосомы и отделить их как от белков плазмы крови, так и от других микрочастиц и микровезикул не экзосомальной природы, в результате чего был получен более чистый препарат с более высоким, чем в прототипе выходом, что привело к техническому результату. Использование термического полипептида [лизин-аргинин]n, вместо ферментативной обработки пробы в прототипе позволило сократить продолжительность выделения, что привело к техническому результату. Использование в искомом наборе гипотонического промывочного раствора на основе 10 мМ NaCl удаляет остаточный сывороточный альбумин со стенок пробирки, что позволило повысить чистоту препарата экзосом. Все это позволяет существенно повысить выход и чистоту экзосом, что привело к техническому результату.
Состав набора для выделения экзосом:
Набор состоит из трех растворов, каждый из которых находится в отдельном флаконе и добавляется отдельно в реакционную смесь в соответствии с нижеприведенной методикой выделения, а также инструкции по выделению экзосом. Флаконы с ингредиентами набора находятся в картонной коробке с ячейками для их вертикального расположения.
Набор реагентов имеет следующий состав:
1. Аффинный связывающий экзосомы агент - термический полипептид [лизин-аргинин]n - 12 мл.
2. Промывочный раствор (10 мМ NaCl) - 50 мл.
3. Элюирующий буфер (0,15 М цитрат натрия, рН 7,5) - 20 мл.
Примеры использования набора.
Пример 1
Для иллюстрации получения экзосом приводим пример №1 - выделение экзосом из плазмы крови человека с использованием данного набора. К 1 мл плазмы крови добавить 100 мкл связывающего экзосомы раствора, тщательно перемешать и инкубировать 15 мин при комнатной температуре, эпизодически перемешивая содержимое пробирки. Центрифугировать пробирку при 10000 g в течение 3 минут. К осадку на дне пробирки добавить 0,5 мл гипотонического промывочного буфера, интенсивно перемешать содержимое на механическом встряхивателе. Центрифугировать пробирку при 10000 g в течение 3 минут. Аккуратно удалить и отбросить супернатант. К осадку добавить 0,5 мл промывочного буфера, интенсивно перемешать содержимое на механическом встряхивателе. Центрифугировать пробирку при 10000 g в течение 3 минут. К отмытому осадку на дне пробирки добавить 0,2 мл элюирующего экзосомы буфера, интенсивно перемешать содержимое на механическом встряхивателе. Центрифугировать пробирку при 10000 g в течение 3 минут для удаления нежелательных агрегатов. Аккуратно собрать, не касаясь дна пробирки кончиком пипетки, и перенести в чистую пробирку содержащий экзосомы супернатант. Количество экзосом в пробе определяют с помощью анализатора траекторий наночастиц NanoSight LM10 (Malvern Instruments). Выход экзосом составляет 1-10×1010 частиц в 1 мл исходной плазмы крови, в зависимости от пациента. Препарат экзосом хранят при температуре +4°С в течение суток, либо замороженным при -20°С в течение нескольких дней, при более длительном хранении следует использовать морозильную камеру -80°С.
Технический результат настоящего изобретения состоит в упрощении и ускорении получения более чистого препарата экзосом из биологических жидкостей (кровь, моча) за счет аффинного связывания, агрегации и осаждения экзосом. Этот результат достигается тем, что в известном способе получения экзосом, включающем добавление к 1 части биологической жидкости 0,1 части раствора термального полипептида [лизин-аргинин]n (10 мг/мл), тщательном перемешивании смеси и инкубации в течение 15 мин, с последующим осаждением комплекса экзосомы-термальный поли[лизин-аргинин]n центрифугированием при 10000 g в течение 3 минут.
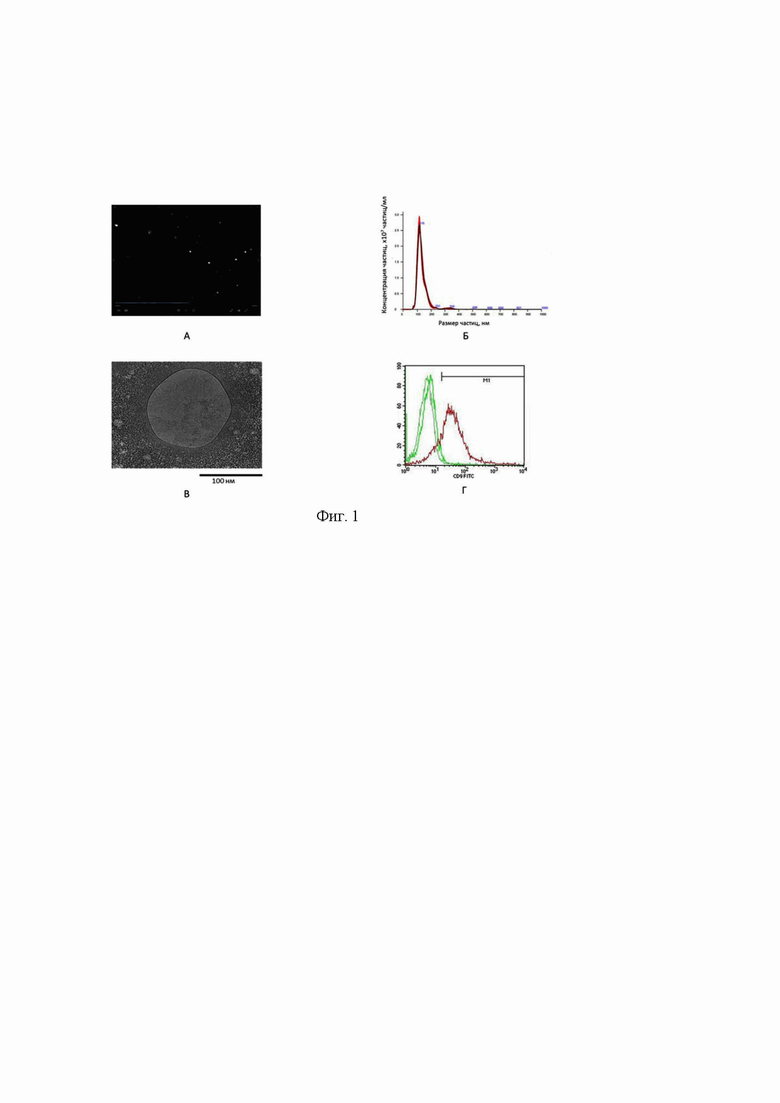
Верификация экзосомальной природы выделенных частиц проведена в соответствии с требованиями Международного общества изучения внеклеточных везикул (International Society for Extracellular Vesicles). Для подтверждения экзосомальной природы микровезикул в препаратах, полученных с помощью искомого набора реагентов, были использованы следующие тесты: 1 - оценка размеров и концентрации везикул методом анализа траектории наночастиц; 2 - оценка размеров и морфологии везикул с помощью электронной микроскопии; 3 - идентификация экзосомальных иммуномаркеров методами Вестерн-блоттинга или проточной цитофлуометрии. На Фиг. 1 представлены характеристики выделенных искомым набором экзосом в соответствии с требованиями Международного общества. Из рисунков следует, что выделенные искомым набором микровезикулы являются экзосомами по всем трем критериям: размер в диапазоне 90-145 нм и концентрация 4×1010 частиц в 1 мл исходной плазмы крови (Фиг. 1 А-Б), везикулярная морфология и наличие двуслойной мембраны (Фиг. 1В), присутствие специфического иммуномаркера CD9 в составе микровезикул, который локализован в наружном мембранном слое экзосом (Фиг. 1Г).
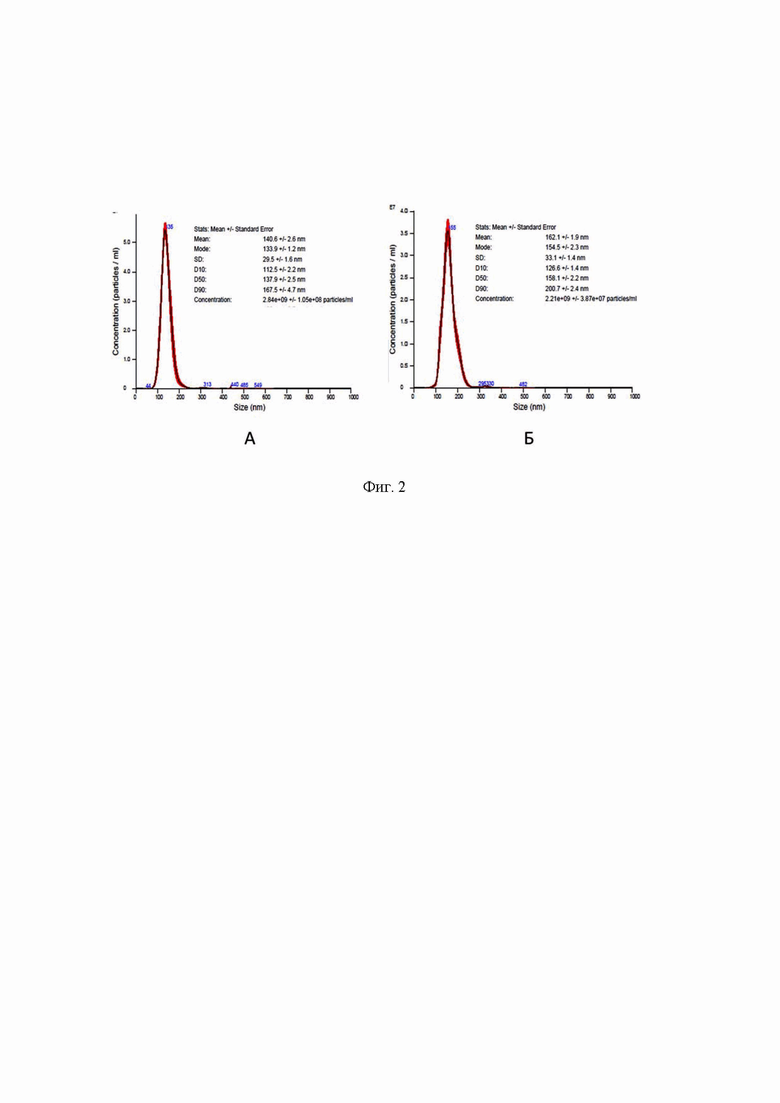
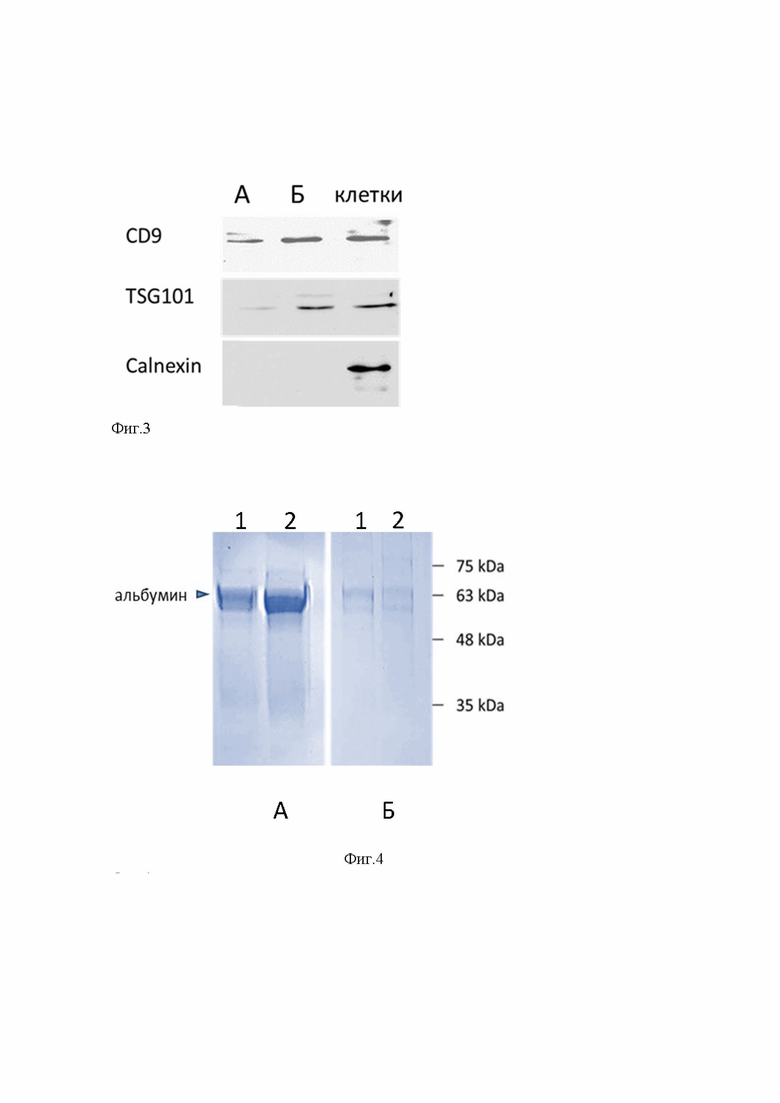
Эффективность выделения экзосом нашим набором и коммерческим набором “Total Exosome Isolation Kit (from plasma)” компании Life Technologies, который взят нам в качестве прототипа, оценивали по следующим характеристикам выделенных везикул: концентрация, размер, экспрессия экзосом специфических иммуномаркеров. Концентрацию и размер везикул определяли с помощью анализатора NTA NanoSight LM10 (Malvern Instruments), оснащенным красным лазером (длина волны 642 нм), а экспрессию маркерных белков экзосом - методом Вестерн-блоттинга с использованием коммерческих антител к CD9, TGS 101 и негативного контроля - Calnexin. Экзосомы были выделены из 1 мл плазмы здорового донора в трех повторах для каждого метода. На Фиг. 2 представлена сравнительная эффективность выделения и анализ чистоты микровезикул, выделенных прототипом (Фиг. 2А) и данным набором (Фиг. 2 Б). Искомый набор выделяет из 1 мл плазмы крови 2,8×1010 микровезикул, тогда как прототип 2,2×1010, то есть выход микровезикул прототипа меньше и составляет 85,7% от искомого. Также видно, что наибольшее количество везикул, размер которых лежит в пределах, характерных для экзосом (90-150 нм), содержится в препарате, выделенных искомым набором, в то время как в пробах, выделенных прототипом 50% везикул имеют размер больше 150 нм, что свидетельствует о том, что данный препарат загрязнен крупными частицами, размер которых значительно больше размера экзосом.
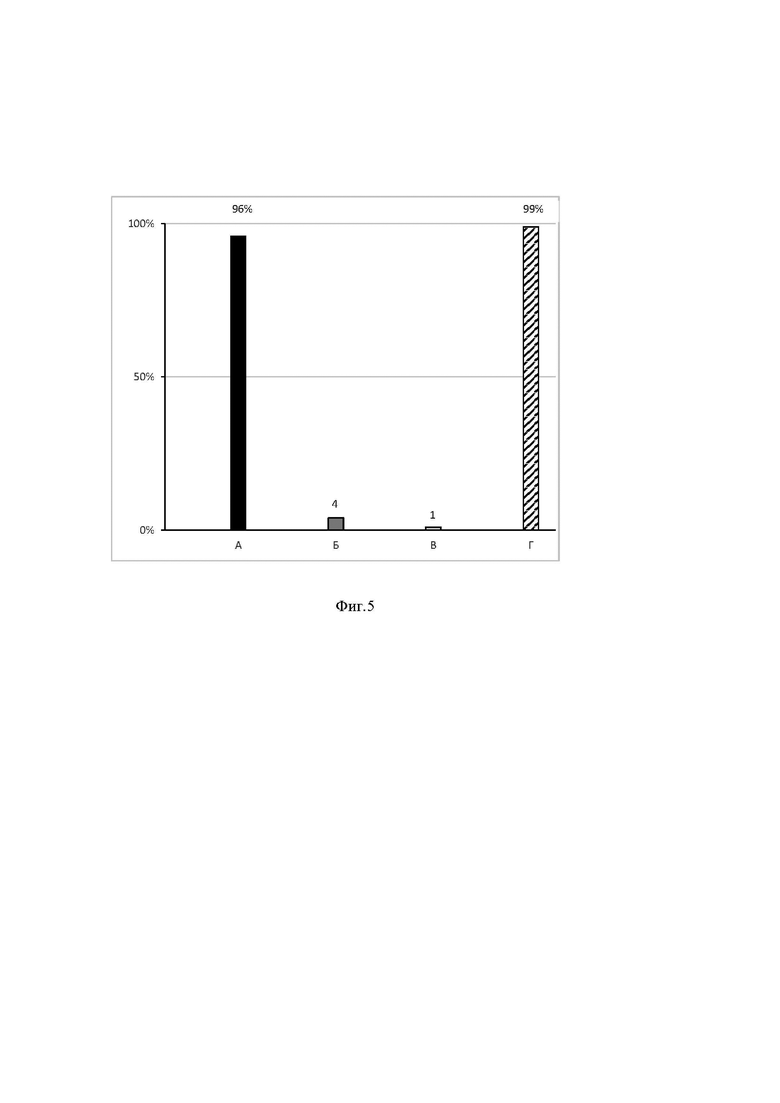
Важным параметром чистоты экзосом является отсутствие примеси белков из биологической жидкости. Так, в плазме крови содержится большое количество альбумина, что препятствует получению чистых препаратов экзосом. Мы сравнили количество альбумина в препаратах экзосом, выделенных искомым набором и прототипом. На Фиг. 3 представлены результаты электрофоретического разделения в полиакриламидном геле белков из препаратов везикул, выделенных искомым набором (Фиг. 3А) и прототипом (Фиг. 3Б) из плазмы крови двух здоровых доноров. Из электрофореграммы видно, что количество загрязнений сывороточного альбумина в препарате экзосом, выделенных прототипом на порядок выше, чем в препарате, выделенном искомым набором.
Процент экзосом в суммарных препаратах микровезикул и их загрязнение не экзосомальными частицами было проанализировано по величине экспрессии экзосомального маркерова CD9 методом Вестерн-блоттинга (Фиг. 4). Из фигуры 4 следует, что интенсивность сигнала в препарате экзосом, выделенных искомым набором выше (Фиг. 4А), чем в препарате, выделенном набором прототипом (Фиг. 4Б). Поскольку количество экзосом в препарате прямо коррелирует с интенсивностью сигнала, полученные данные означают, что препарат микровезикл, выделенный искомым набором, содержит больше экзосом, чем препарат, выделенный прототипом.
Другим важным критерием чистоты выделенных препаратов экзосом является величина примеси в них свободно циркулирующей внеклеточной ДНК (вкДНК), которая присутствует во всех внеклеточных жидкостях, наряду с экзосомами. Так как и на основе экзосом и на основе вкДНК разрабатываются высокочувствительные диагностические платформы, необходимо, чтобы выделяемые препараты не были взаимно контаминированы этими двумя пулами внеклеточных частиц. Ранее нами было показано, что разработанный нами термический олигопептид имеет разное сродство к вкДНК (высокое) и экзосомам (умеренное), что позволяет раздельно выделить пулы экзосом и свободно циркулирующей ДНК из одного образца биожидкости. Для количественной оценки величины примеси вкДНК в препаратах экзосом, выделенным искомым набором и прототипом, из каждого препарата экзосом выделяли внеклеточную ДНК с использованием ранее разработанного нами набора (патент на изобретение 2753768 С1, 23.08.2021: «Набор для выделения ДНК»). Для того, чтобы количественно оценить содержание в препаратах экзосом вкДНК генов с различной функциональной направленностью, локализацией и представленностью в геноме, использовались праймеры к ядерному однокопийному гену бета2-микроглобулин. ПЦР в реальном времени проводили на амплификаторе CFX96 Touch Real-Time Detection System (Bio-Rad) с использованием коммерческой набора BlazeTaq SYBR Green (GeneCopoeia, США). Концентрацию вкДНК рассчитывали на основании калибровочной кривой зависимости количества амплифицированной ДНК от концентрации ДНК однокопийного гена бета2-микроглобулина. Количество амплифицированной ДНК находилось в линейной зависимости от концентрации ДНК в диапазоне от 10 до 0,1 нг/мл. Сопоставляли общее количество вкДНК в осадке экзосом и в реконструированной суспензии. Как следует из Фиг. 5, основная часть вкДНК (96%), выделенной нашим набором, осталась связанной с агентом в осадке (Фиг. 5, А), тогда как с реконструированными в растворе экзосомами ассоциировано порядка 4% ДНК (Фиг. 5, Б), которая является истинно экзосомальной и локализована внутри микровезикул. Напротив, при выделении экзосом набором прототипом, более 99% вкДНК находится в растворе вместе реконструированных микровезикул (Фиг. 5, Г) и лишь менее 1% вкДНК выявляется в осадке (Фиг. 5, В), что связано с тем, что прототип не способен разделить экзосомы и вкДНК - они вместе осаждаются из плазмы крови и вместе ресуспендируются в буфере 1×PBS. Таким образом, по трем параметрам чистоты (наличие микривезикул большего размера, примеси сывороточного альбумина и внеклеточной ДНК) наш набор позволяет получить более высокоочищенный препарат экзосом, по сравнению с набором компании Life Technologies, который взят нами в качестве прототипа.
Как видно из приведенных примеров, по параметрам чистоты наш набор позволяет сократить время выделения и получить более высокоочищенный препарат экзосом, по сравнению с набором компании Life Technologies. В отличие от всех существующих наборов, только наш позволяет разделить и отдельно выделить экзосомы и вкДНК из одного образца. Общее время всех инкубаций по протоколу прототипа составляет 40 минут, тогда как у нас только 15 минут. Процедура выделения экзосом набором Life Technologies требует использования термостата, охлаждающей камеры и центрифуги, тогда как инстументарий нашего набора ограничивается только центрифугой. Преимуществом нашего набора также является то, что он включает все используемые в протоколе выделения растворы, тогда как в составе набора Total Exosome Isolation Kit (from plasma)” отсутствует раствор, необходимый для разбавления плазмы крови и ресуспендирования осадка экзосом.
Предлагаемый набор, по сравнению с известными, имеет ряд существенных преимуществ:
1. Использование вместо ферметативной деградации белка протеиназой К аффинно осаждающего экзосомы агента (термический полипептид [лизин-аргинин]n) обеспечивает получение более чистых и интактных препаратов экзосом по сравнению с прототипом.
2. Использование экзосом-осаждающего агента - термического полипептида [лизин-аргинин]n - обеспечивает получение более высококачественных препаратов экзосом, свободных от альбумина и свободно циркулирующей внеклеточной ДНК, которая выделяется вместе с экзосомами при выделении прототипом, а также от более крупных микровезикул, которые не являются экзосомами.
Набор разработан авторами в лаборатории генной инженерии Федерального государственного бюджетного учреждения «Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова» Министерства здравоохранения Российской Федерации.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ и устройство для выделения внеклеточных везикул из биологических жидкостей с помощью каскадной ультрафильтрации | 2017 |
|
RU2745613C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОСОМ ИЗ ПЛАЗМЫ КРОВИ | 2020 |
|
RU2741776C1 |
| Биологический микрочип для обнаружения опухолевых экзосом в сыворотке крови человека для диагностики колоректального рака | 2016 |
|
RU2682721C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОСОМ ИЗ ПЛАЗМЫ КРОВИ | 2020 |
|
RU2741638C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ ИЗ КРОВИ | 2016 |
|
RU2608509C1 |
| Способ изоляции микровезикул из крови | 2017 |
|
RU2651521C1 |
| ПРИМЕНЕНИЕ ПОРИСТЫХ ВОЛОКОН ДЛЯ ПОЛУЧЕНИЯ КРОВИ ИЛИ ПРОИЗВОДНОГО КРОВИ, ОБЕДНЕННЫХ КЛЕТКАМИ КРОВИ И ТРОМБОЦИТАМИ, ПРОИСХОДЯЩИМИ ИЗ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ | 2019 |
|
RU2796378C2 |
| Способ выделения экзосом из кондиционированной среды культуры клеток | 2020 |
|
RU2750928C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ ИЗ КРОВИ | 2014 |
|
RU2556825C1 |
Изобретение относится к медицине, а именно к биохимическим исследованиям биологических объектов, и может найти применение в диагностике онкологических и злокачественных заболеваний. Набор для выделения экзосом состоит из осаждающего экзосомы агента, промывочного раствора и элюирующего буфера на основе раствора 0,15 M цитрата натрия с pH 7,5. В качестве осаждающего экзосомы агента он содержит термический полипептид со звеном цепи лизин-аргинин и количеством звеньев 10-50 с молекулярной массой 3-15 килодальтон и промывочный раствор на основе 10 мМ NaCl. Изобретение обеспечивает увеличение выхода экзосом из биологических жидкостей, повышение чистоты препарата экзосом, а также сокращение времени их выделения. 5 ил., 1 пр.
Набор для выделения экзосом, состоящий из осаждающего экзосомы агента, промывочного раствора и элюирующего буфера на основе раствора 0,15 M цитрата натрия с pH 7,5, отличающийся тем, что в качестве осаждающего экзосомы агента он содержит термический полипептид со звеном цепи лизин-аргинин и количеством звеньев 10-50 с молекулярной массой 3-15 килодальтон и промывочный раствор на основе 10 мМ NaCl.
| US 0009671321 B2, 06.06.2017 | |||
| US 9005888 B2, 14.04.2015 | |||
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |
| ГОРШКОВ А.Н | |||
| и др | |||
| Сравнительный анализ методов выделения экзосом из культуральной среды.//Цитология, T | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| Приспособление для градации давления в воздухопроводе воздушных тормозов | 1921 |
|
SU193A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ ИЗ КРОВИ | 2014 |
|
RU2556825C1 |
Авторы
Даты
2024-08-12—Публикация
2023-11-24—Подача