Изобретение относится к области химической технологии получения новых материалов, композиций на основе оксида алюминия для различного назначения, в том числе и для медицины - для применения их в качестве лекарственных препаратов, носителей - дозаторов для биологически активных веществ, гемосорбентов, для использования в ветеринарии, косметологии.
Оксид алюминия широко используется в промышленности в качестве адсорбентов, носителей для катализаторов. Большим достоинством оксида алюминия является термодинамическая стабильность, надежность технологий получения, доступность сырья, налаженное промышленное производство разных модификаций и размеров гранул.
Известно использование оксида алюминия для получения углеродминерального сорбента, получаемого при высокотемпературном нанесении (800°С) углерода на оксид алюминия и широко применяющегося в медицинской практике как энтеросорбента и гемосорбента для детоксикации крови при целом ряде патологий [1].
Известен способ получения сорбентов медицинского назначения на основе оксида алюминия с улучшенными органолептическими и потребительскими свойствами (сорбенты белого цвета) на основе оксида алюминия и модифицирующего компонента - кремнийорганического полимера полидиметилсилоксана (ПДМС), создающего гидрофобные центры на поверхности оксида алюминия, подобно углероду в углеродминеральном сорбенте. Сорбент характеризуется достаточно высокими сорбционными свойствами, в меньшей степени, по сравнению с углеродминеральным сорбентом на основе оксида алюминия, травмирует элементы крови [2]. Наиболее близким по технической сущности способом получения заявляемого гемосорбента, является способ получения сорбента путем совместной иммобилизации на поверхности оксида алюминия лития цитрата четырехводного и полидиметилсилоксана с последующей низкотемпературной сущкой [3]. Такой подход позволяет получить сорбент с пролонгированным высвобождением лития с твердой поверхности сорбента при его контакте с жидкой фазой, например, при контакте с кровью.
Известно, что факт постепенного высвобождения лития с поверхности сорбента особенно важен в связи с быстрым преодолением литием гематоэнцефалического барьера и быстрым поступлением в мозг, что и обусловливает низкий терапевтический индекс по его концентрации в крови при терапии психоэмоциональных расстройств, зачастую отягощенных различными патологиями. Превышение же терапевтической дозы лития приводит к тяжелым побочным явлениям [4].
Недостатком такого способа для получения сорбента и на его основе гемосорбента является невозможность операций промывки гемосорбента от пылевых частиц, что повлечет за собой и полное высвобождение лития с поверхности. Известно, что одним из основных требований, предъявляемых к гемосорбентам, является отсутствие пыления.
Предлагаемое изобретение решает эту задачу по способу получения безопасного гемосорбента с включением стадии предварительного обеспыливания путем отмывки дистиллированной водой и сушки исходного оксида алюминия, с последующей иммобилизацией полидиметилсилоксана и лития цитрата на поверхности обеспыленного оксида алюминия.
Технический результат заключается в улучшении качества получаемого сорбента для целей гемосорбции за счет удаления пыли и с сохранением показателей по текстурным параметрам, по сорбционной активности и высвобождению лития с поверхности сорбента.
Задача решается способом получения гемосорбента на основе оксида алюминия, включающим предварительную стадию обеспыливания исходного оксида алюминия путем промывки дистиллированной водой (в объеме в 6-20 раз превышающем объем сорбента) при температуре 50-85°С при перемешивании. Степень запыленности контролируют по содержанию твердых частиц размером более 2-5 мкм по анализу на приборе «Coulter». Промывные воды считаются прозрачными, если содержание частиц размером 2-5 мкм не превышает 1000/ мл и частиц с размером более 5 мкм не более 250/мл [1].
После последней промывки и высушивания оксида алюминия до влажности 3-5% проводят иммобилизацию путем физической адсорбции смеси водного раствора лития цитрата и водной эмульсии полидиметилсилоксана с размерами частиц до 400 нм на поверхности оксида алюминия с мезо-, макропористой структурой в условиях перемешивания с последующей низкотемпературной сушкой при 50°С до влажности до 5 мас. % и далее - температурной обработкой при 200°С в течение 1 ч с формированием гидрофильно-гидрофобной природы поверхности за счет гидрофильных центров оксида алюминия и гидрофобизатора - полидиметилсилоксана. Получаемый сорбент в виде округлых гранул белого цвета с размерами частиц 0,2-1 мм содержат до 0,5% лития и 0,6% ПДМС.
Такая технология получения с предварительной отмывкой от пылевых частиц исходного оксида алюминия, просушкой до влажности 3-5% и дальнейшей иммобилизацией на его поверхности лития лимоннокислого и полидиметилсилоксана позволяет получить сорбент, пригодный для использования в качестве гемосорбента. Гемосорбент обеспечивает нормотимическое действие за счет пролонгированного высвобождения лития с поверхности гемосорбента при контакте с кровью и проявление детоксицирующих функций гемосорбента, что подтверждается сорбционной активностью по отношению к маркеру среднемолекулярных токсинов - красителю метиленовому голубому. Формирование гидрофильно-гидрофобной химической природы поверхности гемосорбента осуществляется за счет иммобилизации полимера - полидиметилсилоксана на гидрофильной поверхности оксида алюминия. Получаемый продукт удовлетворяет требованиям, предъявляемым к гемосорбентам. Сущность изобретения иллюстрируется следующими примерами и таблицей 1.
Пример 1.
Носитель - оксид алюминия с размером округлых гранул 0,2-1,0 мм в количестве 50 см3 помещают в круглодонную стеклянную колбу на 500 см3. Включают медленное вращение колбы (до 30 об/мин) при включенном обогреве, постепенно добавляют приготовленную дистиллированную воду в объеме 100 мл с температурой 50°С и продолжают перемешивание 10 минут. Сливают опалесцирующую белым цветом воду. Процедуру проводят еще дважды (в 1 мл раствора содержится 130 частиц с размером более 5 мкм). После чего воду сливают и при перемешивании высушивают оксид алюминия до влажности 3-5%. Затем добавляют смесь раствора лития цитрата (содержащий 0,05% лития в 10 мл воды) и водной эмульсии ПДМС с размером частиц до 400 нм (0,2% ПДМС в 15 мл водной эмульсии). Перемешивание проводят с одновременной сушкой в течение 4 ч до сыпучего состояния с влажностью до 5%. Далее сорбент (после выгрузки) подвергают термообработке в сушильном шкафу при 200°С в течение 1 ч. После охлаждения гемосорбент выгружают.
Характеристики гемосорбента следующие: гранулы белого цвета, величина удельной поверхности 181,7 м2/г, объем пор 0,33 см3/г, содержание лития 0,05%, адсорбционная способность по красителю метиленовому голубому 25, 2 мг/г сорбента. При контакте сорбента с водой в соотношении 1:50 при 37°С и периодическом круговом перемешивании в течение 30 минут в водный раствор высвобождается 57,3% лития.
Пример 2.
Носитель - оксид алюминия с размером округлых гранул 0,4-1,0 мм в количестве 50 см3 помещают в круглодонную стеклянную колбу на 500 см3. Включают медленное вращение колбы при включенном обогреве, постепенно добавляют приготовленную дистиллированную воду в объеме 100 мл с температурой 70°С и продолжают вращение 10 минут. Сливают опалесцирующую белым цветом воду. Процедуру проводят еще 4 раза (в 1 мл раствора содержится 25 частиц с размером более 5 мкм). После чего воду сливают и при перемешивании высушивают оксид алюминия до влажности 3-5%. Затем добавляют смесь раствора лития цитрата (содержащий 0,2% лития в 10 мл воды) и водной эмульсии ПДМС с размером частиц до 400 нм, (0,6% ПДМС в 15 мл водной эмульсии). Перемешивание с одновременной сушкой проводят течение 3,5 ч до сыпучего состояния с влажностью до 5%. Далее сорбент подвергают термообработке в сушильном шкафу при 200°С в течение 1 ч. После охлаждения гемосорбент выгружают.
Характеристики гемосорбента следующие: гранулы белого цвета, величина удельной поверхности 178,5 м2/г, объем пор 0,32 см3/г, содержание лития 0,2%, адсорбционная способность по красителю метиленовому голубому 29,6 мг/г сорбента. При контакте сорбента с водой в соотношении 1:50 при 37°С и периодическом круговом перемешивании в течение 30 минут в водный раствор высвобождается 58, 3% лития.
Пример 3.
Носитель - оксид алюминия с размером округлых гранул 0,2-0,8 мм в количестве 50 см3 помещают в круглодонную стеклянную колбу на 500 см3. Включают медленное вращение колбы при включенном обогреве, постепенно добавляют приготовленную дистиллированную воду в объеме 100 мл с температурой 85°С и продолжают вращение 10 минут. Сливают опалесцирующую белым цветом воду. Процедуру проводят еще 9 раз (в сумме 20 объемов воды на один объем носителя оксида алюминия до полного отсутствия пылевых частиц). После чего воду сливают и при перемешивании высушивают оксид алюминия до влажности 3-5%. Затем добавляют раствор лития цитрата (содержащий 0,5% лития в 10 мл воды) и водной эмульсии ПДМС эффективным размером частиц до 400 нм, (0,4% ПДМС в 15 мл водной эмульсии). Перемешивание и сушку до 0,5% влаги проводят в течение 3 ч до сыпучего состояния с влажностью до 5%. Далее сорбент подвергают термообработке в сушильном шкафу при 200°С в течение 1 ч. После охлаждения гемосорбент выгружают. Характеристики гемосорбента следующие: гранулы белого цвета, величина удельной поверхности 180,5 м2/г, объем пор 0,32 см3/г, содержание лития 0,5%, адсорбционная способность по красителю метиленовому голубому 31,6 мг/г сорбента. При контакте сорбента с водой в соотношении 1:50 при 37°С и периодическом круговом перемешивании в течение 30 минут в водный раствор высвобождается 59, 5% лития.
Данные по примерам представлены в Таблице 1.
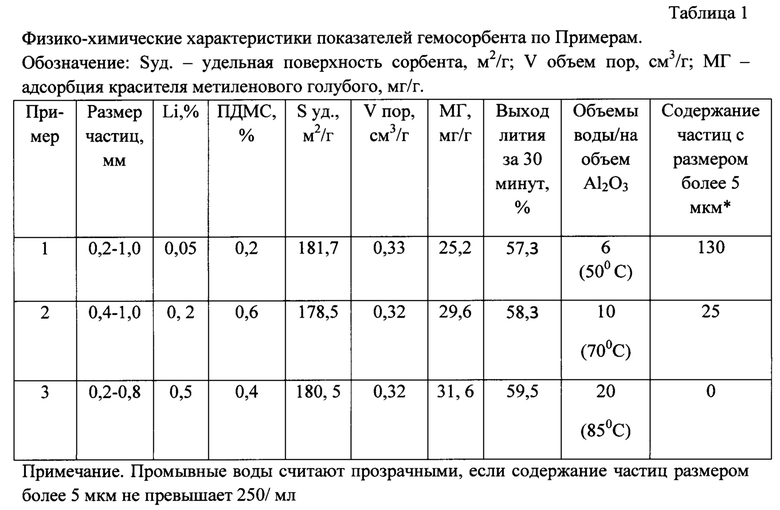
Из таблицы 1 видно, что принципиально все использованные режимы отмывки с разным количеством воды обеспечивают необходимый уровень чистоты оксида алюминия. При выбранных режимах получения все образцы имеют высокие показатели по пористой структуре - удельной поверхности и объему пор, обладают достаточной адсорбционной способностью по отношению к красителю метиленовому голубому и на достаточном уровне обеспечивают высвобождение лития с поверхности сорбента при контакте с водой по стандартной методике.
Биологические свойства сорбентов исследовали по отношению к наиболее уязвимым клеткам крови - тромбоцитам, изучали их гемокоагуляционные свойства. Ввиду дорогостоящего эксперимента был выбран один из полученных образцов по Примеру 3. Исследовали его влияние на показатели свертывающей активности крови «in vitro». Для этого применяли следующую методику перфузии крови: через колонку с 2,0 см3 гемосорбента пропускали 20 мл стабилизированной цитратом натрия крови донора. Процедура выполнялась с помощью перистальтического насоса Heidolph PD 5201 («Heidolph») со скоростью 5,0 мл/ мин. Перед проведением исследования в колонку с сухим сорбентом вносили 5,0 мл физиологического (0,15 М) раствора, при этом инкубирование проводилось на протяжении 1-5 мин для заполнения пор сорбента. Все манипуляции осуществлялись при комнатной температуре. Для сравнения использовали образец сорбента СИАЛ без лития, полученный по аналогичной методике. Для сравнения использовали также гемосорбент СУМС-1, применявшийся успешно в медицинской практике.
Получение крови и плазмы крови для исследования:
Взятие венозной крови осуществляли из локтевой вены в пробирки VACUETTE, рассчитанные на 9 мл крови (9NCCoagulationsodiumcitrate 3,2%). В случае выполнения теста генерации тромбина кровь отдельно забирали в пробирки объемом 4,5 мл (BDVacutainer, 9 NC, 0,129 Msodiumcitrate). Для подсчета числа тромбоцитов в крови кровь стабилизировали натриевой солью ЭДТА.
После проведения гемосорбции кровь исследовали методом компьютерной тромбоэластометрии, а часть - подвергали центрифугированию с целью получения бедной тромбоцитами плазмы (БТП). Режим центрифугирования - 1200 g в течение 15 мин.
Исследованные образцы и их обозначения):
1. Кровь/БТП вне всякого воздействия (Контроль 1).
2. Кровь/БТП после пропускания через перистальтический насос (Контроль 2).
3. Кровь/БТП после пропускания через колонку с гемосорбентом по Примеру 3
4. Кровь/БТП после пропускания через колонку с сорбентом СИАЛ.
5. Кровь/БТП после пропускания через колонку с гемосорбентом СУМС-1.
Хранение образцов перед проведением исследования:
Кровь и плазма (БТП) из нее полученная исследовалась в течение 2-х часов после получения и хранения при комнатной температуре. Для оценки генерации тромбина аликвоты БТП замораживали в охладителе MDF-192 Ultra low temperature freezer (Sanyo) при -50°C на срок до 5 суток.
Проводили следующие исследования:
Подсчет количества тромбоцитов в крови осуществляли с помощью гематологического анализатора МЕК-7222 J/K («NihonKohden»). Исследовали параметры: силиконовое время свертывания, каолиновое время свертывания, активированное парциальное тромбопластиновое время, протромбиновое время, оценка концентрации фибриногена, оценивали уровень растворимых фибрин-мономерных комплексов в БТП - РФМК (синоним - растворимого фибрина) в плазме, активность антитромбина, уровень плазминогена* (Примечание: * - препараты производства фирмы «Технология-Стандарт», Россия; клотинговые и амидолитические измерения проводили на автоматическом коагулометре «Sysmex СА-1500» (фирмы «Sysmex Corporation»).
Интегральные методы оценки системы гемостаза:
Калиброванная тромбография в БТП крови по Hemker (2003) (синоним - тест генерации тромбина; ТГТ). Для выполнения ТГТ использовали планшетный флюориметр Fluoroskan Ascent «Thermo Fisher SCIENTIFIC», оснащенный диспенсером, с программным обеспечением «Thrombinoscope 3.0.0.26». Коагуляция исследуемой плазмы крови осуществлялась в присутствии 5 пмоль тканевого фактора и 4 мкмоль фосфолипидов (РРР-Reagent 5 pM, ThrombinCalibrator, FluCa-Kit). Генерация тромбина в бедной тромбоцитами плазме крови регистрировалась посредством измерения сигнала при гидролизе флуорогенного субстрата (Z-Gly-Gly-Arg-AMC).
Учитывали следующие показатели ТГТ: Lagtime (время запаздывания, мин) - характеризует начало образования тромбина, достаточного для образования первых нитей фибрина; Peakthrombin - пиковая концентрация тромбина, нмоль/л - максимальная концентрация тромбина в единицу времени и ЕТР (endogenous thrombin potential - эндогенный тромбиновый потенциал, нмоль/мин) - оценивающий площадь кривой генерации тромбина, учитывающей особенности инактивации этого фермента; ttPeak - время достижения пика тромбина в мин. Исследования каждой пробы проводились в двух параллельных постановках, средний результат учитывался автоматически, в соответствии с использованной программой.
Тромбоэластометрия стабилизированной цитратом крови (ТЭМ) с применением тромбоэластометра 4-х канального RotemGamma, фирмы «TemInnovationsGmbH» и реагента «star-ТЕМ» фирмы «Pentapharm GmbH», использованного в режиме «Natem». Анализировали следующие параметры ТЭМ: СТ - время свертывания, сек; MCF - максимальная плотность сгустка фибрина, мм; CFT - время образования сгустка фибрина, сек; α - угол и скорость образования сгустков фибрина, град; А10 - значение плотности сгустка на 10 мин, мм, А15 - значение плотности сгустка на 15 мин, мм.
Анализ полученных данных показал, что проведенные исследования продемонстрировали, в первую очередь, повреждающее действие на кровь собственно самой процедуры, связанной с использованием перистальтического насоса.
Полученные изменения (при сравнении данных в группах Контроля 1 и Контроля 2) проявили себя в снижении числа тромбоцитов в крови (в 3,9 раза), сокращении времени свертывания в силиконовом и каолиновом тестах (соответственно, в 1,8 и 1,8 раза). Как известно, укорочение силиконового времени свертывания крови связано с контактной активацией фактора XII, а такое же изменение каолинового времени - с увеличением количества фосфолипидов, которые высвобождаются из клеток крови при их повреждении. Это подтверждает то, что показания АПТВ не менялись, где контактная и фосфолипидная активность, как известно, избыточны и стандартизированы.
Об активации свертывания крови при прохождении крови через перистальтический насос свидетельствовали также ускорение хронометрических (СТ и CFT, в 2,1 и 1,5 раза, соответственно), а также увеличение плотностных показателей тромбоэластометрии (MCF и угла альфа, в 1,2 и 1,3, соответственно).
Это же физическое воздействие на кровь способствовало усилению генерации тромбина (по ЕТР и Reakthrombin, в 1,2 и 2,0 раза, соответственно).
Тем не менее, если провести анализ полученных данных вне влияния самой процедуры перфузии крови с использованием перистальтического насоса, указанные выше, то видно, что различные гемосорбенты оказывали по разному влияние на кровь.
Сорбент СИАЛ снижал количество тромбоцитов в 2,3 раза по сравнению с Контролем 2. В то же время сорбент СУМС-1 не оказывал влияние на данный показатель, а сорбент по Примеру №3 обеспечивал протективное (по отношению к сорбенту СИАЛ и действию перистальтического насоса) действие на эти клетки. В данном случае число тромбоцитов увеличивалось в 1,5 раза по сравнению с кровью после воздействия перистальтического насоса и сорбента СУМС-1 и в 3,5 раза по сравнению с сорбентом СИАЛ (таблица 2).
Сорбент по Примеру №3 оказался наименее реактогенным по сравнению с другими сорбентами в части активации свертывания крови. Более того, он снижал эту активацию по ряду показателей (протромбиновому тесту, показателям тромбоэластометрии, силиконовому, каолиновому, тромбиновому времени свертывания и АПТВ), в том числе за счет уменьшения уровня фибриногена (с 1,83 г/л до 0,51 г/л). В то же время этот сорбент способствовал умеренному снижению активности антитромбина и уровня плазминогена (на 8,8% и 5,6%, соответственно). Данные приведены в таблице 2.
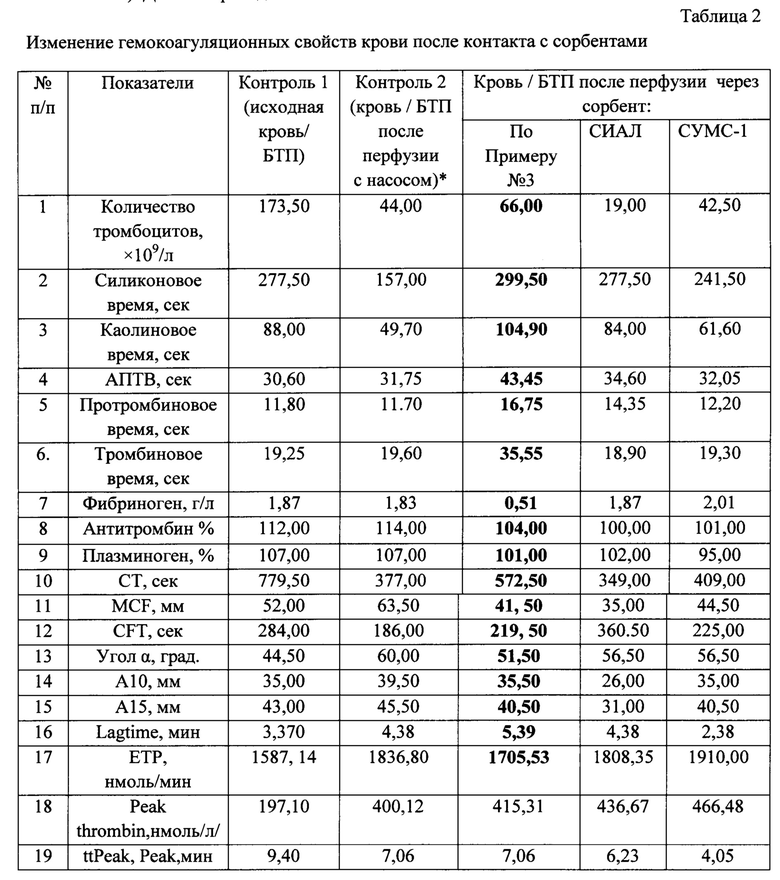
Примечание: Кровь/БТП - бедной тромбоцитами плазмы (БТП); АПТВ-активированное парциальное (частичное) тромбопластиновое время; Lagtime - время запаздывания, характеризует начало образования тромбина, достаточного для образования первых нитей фибрина, мин/; Peakthrombin - пиковая концентрация тромбина -максимальная концентрация тромбина в единицу времени, нмоль/л; ЕТР-(endogenousthrombinpotential) - эндогенный тромбиновый потенциал, нмоль/мин (оценивающий площадь кривой генерации тромбина, учитывающей особенности инактивации этого фермента); ttPeak - время достижения пика тромбина в мин. Анализировались следующие параметры тромбоэластометрии (ТЭМ): СТ - время свертывания, сек; MCF - максимальная плотность сгустка фибрина, мм; CFT - время образования сгустка фибрина, сек; α - угол и скорость образования сгустков фибрина, град; А10 - значение плотности сгустка на 10 мин, мм; А15 - значение плотности сгустка на 15 мин, мм.
Таким образом, представленный способ получения сорбента с нормотимическими свойствами позволяет получать обеспыленный сорбент за счет предварительной промывки исходной матрицы - оксида алюминия и последующей иммобилизации активной молекулы лития цитрата четырехводного и кремнийорганического полимера полидиметилсилоксана, последний в силу своего распределения в порах блокирует лития цитрат и обеспечивает его постепенное высвобождение с поверхности при контакте с жидкой средой. Препараты лития являются эффективными нормотимиками (стабилизаторами настроения) при аффективных расстройствах, психоэмоциональных напряжениях, сопровождающих различные патологические состояния. Включение в структуру сорбента препарата лития обеспечивает его дозированное поступление в кровь при процедурах гемосорбции с одновременной сорбцией из крови токсических агентов разной молекулярной массы. Как правило, при гемосорбции осуществляется быстрая детоксикация организма, но важным условием является минимальная травмируемость клеток крови, особенно тромбоцитов. Изменение гемокоагуляционных свойств крови после контакта с литийсодержащим сорбентом показало наоборот протективное действие сорбента за счет лития на тромбоциты практически по всем показателям.
Исследования в этом направлении имеют важное значение для медицинской науки и практики в рамках изучения возможностей и эффектов экстракорпорального воздействия на кровь. Сорбент по предложенному способу получения имеет минимальное повреждающее действие на кровь (в сравнении с другими составами), снижает гемостатический потенциал и имеет перспективы к использованию не только для детоксикации организма при различных патологиях, но и в целом для нормализации психоэмоционального состояния.
Цитированные источники
1. Авт. Свид. 1330783 Способ получения углеродминерального гемосорбента (Рачковская Л.Н. и др.), 15.04.1987 г.
2. Пат. РФ №2142846, Бюлл. №35, 1999. Пористый сорбент на основе оксида алюминия (Рачковская Л.Н и др.).
3. Пат. РФ 2662577 от 26.07.18., Бюл. №21 от 26.07.18. Способ получения композиции на основе оксида алюминия (Рачковская Л.Н., Рачковский Э.Э. и др).
4. AnnaV. Shurlygina, LyubovN.Rachkovskaya, MargaritaV. Robinson, AnastasiaA. Kotlyarova, MaximA. Korolev, Andrey Yu. Letyagin.The Possibilities of Safe Lithium Therapy in the Treatment of Neurological Psychoemotional Disorders. In book: Frontiers in Clinical Drug Research - CNS and Neurological Disorders. 2021, vol. 9 171-205. Bentham Science Publishers Ltd. Editors: Atta-ur-Rahman, FRS(Kings College University of Cambridge, Cambridge UK), ZareenAmtul (The University of Windsor, Department of Chemistry and Biochemistry, Windsor, ON Canada.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения функционального фибриногена | 2017 |
|
RU2669796C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВРЕМЕНИ САМОСБОРКИ ФИБРИН-МОНОМЕРА | 2007 |
|
RU2366955C2 |
| СПОСОБ ДИАГНОСТИКИ РИСКА РАЗВИТИЯ ВАЗОПАТИИ У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ | 2007 |
|
RU2331883C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ | 2017 |
|
RU2662577C1 |
| СПОСОБ КОРРЕКЦИИ ВАЗОПАТИИ У НОВОРОЖДЕННЫХ ПОРОСЯТ С АНЕМИЕЙ | 2009 |
|
RU2400219C1 |
| СПОСОБ НИВЕЛИРОВАНИЯ РАННИХ ПРОЯВЛЕНИЙ ВАЗОПАТИИ У НОВОРОЖДЕННЫХ ПОРОСЯТ С АНЕМИЕЙ | 2009 |
|
RU2399372C1 |
| СПОСОБ КОРРЕКЦИИ СУБКЛИНИЧЕСКОЙ ВАЗОПАТИИ У НОВОРОЖДЕННЫХ ПОРОСЯТ С АНЕМИЕЙ | 2007 |
|
RU2352327C1 |
| СПОСОБ КОРРЕКЦИИ ОСЛАБЛЕНИЯ ФУНКЦИЙ СТЕНКИ СОСУДОВ У НОВОРОЖДЕННЫХ ПОРОСЯТ С АНЕМИЕЙ | 2007 |
|
RU2352328C1 |
| СПОСОБ УСТРАНЕНИЯ ВАЗОПАТИИ У НОВОРОЖДЕННЫХ ТЕЛЯТ С ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИЕЙ | 2011 |
|
RU2463072C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПЛАЗМИНОГЕНА | 2000 |
|
RU2189590C2 |
Настоящее изобретение относится к способу получения гемосорбента, включающему нанесение путем иммобилизации при температуре 50°С лития цитрата и водной эмульсии полидиметилсилоксана на предварительно отмытый горячей водой от пылевых частиц оксид алюминия с мезо-, макропористой структурой в условиях перемешивания с последующей сушкой и термообработкой, где обеспыливание оксида алюминия обеспечивается промывкой водой при температуре 50-85°С при перемешивании с использованием 6-20 объемов воды на объем сорбента. Настоящее изобретение обеспечивает улучшение качества получаемого сорбента для целей гемосорбции за счет удаления пыли и с сохранением показателей по текстурным параметрам, по сорбционной активности и высвобождению лития с поверхности сорбента. 2 табл., 3 пр.
Способ получения гемосорбента, включающий нанесение путем иммобилизации при температуре 50°С лития цитрата и водной эмульсии полидиметилсилоксана на предварительно отмытый горячей водой от пылевых частиц оксид алюминия с мезо-, макропористой структурой в условиях перемешивания с последующей сушкой и термообработкой, где обеспыливание оксида алюминия обеспечивается промывкой водой при температуре 50-85°С при перемешивании с использованием 6-20 объемов воды на объем сорбента.
| ПОРИСТЫЙ СОРБЕНТ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ - НООЛИТ | 1998 |
|
RU2142846C1 |
| Композиция на основе оксида алюминия, полидиметилсилоксана и фукоксантина | 2020 |
|
RU2760264C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ | 2017 |
|
RU2662577C1 |
| ПОРИСТЫЙ СОРБЕНТ С НОРМОТИМИЧЕСКИМИ СВОЙСТВАМИ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ | 2016 |
|
RU2620118C1 |
Авторы
Даты
2023-05-31—Публикация
2022-06-02—Подача