Настоящее изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано в пищевой биотехнологии для разработки технологии производства подсластителей белковой природы.
Натуральные подсластители, такие как сахароза, играют важную роль в жизни человека. улучшают аромат и вкусовые качества продуктов. Добавление сахара в пищу придает ей сладкий вкус, а также при относительно высокой концентрации ингибирует рост патогенов. Однако, избыточное потребление сахарозы увеличивает риск приобретения метаболических нарушений, таких как сердечно-сосудистые заболевания, ожирение, инсулинорезистентность и диабет II типа. В качестве альтернативы на сегодняшний день используется несколько искусственных подсластителей, таких как аспартам или ацесульфам К. Они имеют свои недостатки, например, являются канцерогенами. Таким образом, сладкие белки имеют потенциал в качестве безопасного, легкоусвояемого и низкокалорийного заменителя сахара.
Браззеин, выделенный из плодов западноафриканского растения Pentadiplandra brazzeana в 1994 году представляет собой многообещающий белок -подсластитель из-за его интенсивного сладкого и сахароподобного вкуса, а также хорошей стабильности в широком диапазоне значений рН и температуры (Assadi-Porter et al., 2000). Стоит отметить, что молекула браззеина содержит 54 аминокислотных остатка, что соответствует молекулярной массе около 6.4 кДа, и это самый маленький из всех известных сладких белков. Основная форма браззеина на N-конце содержит остаток пироглутамата, в то время как в минорной форме он отсутствует. При этом основная форма имеет присущую сладость, превосходящая сахарозу в 500 раз по массе (в 9500 раз в пересчете на молекулу), тогда как минорная форма еще в два раза слаще основной. Структура браззеина, полученная методом 1H ЯМР-спектроскопии, подтвердила, что браззеин содержит одну короткую α-спираль и три антипараллельных β-листа, удерживаемых вместе четырьмя дисульфидными связями. В обеспечении связывания с вкусовыми рецепторами семейства T1R1 - T1R3 важную роль играют остатки 29 - 33 и 39 - 43, в особенности остаток аргинина R43 и остаток глутаминовой кислоты E36 и С-конец. Для применения браззеина в пищевой промышленности производство необходимо разработать эффективное технологичное решение с целью максимизации удельного выхода продукта. Следовательно, для решения этой задачи применяются различные системы гетерологичной экспрессии генов, такие как бактерии Escherichia coli, Bacillus subtilis, Lactococcus lactis, Bacillus licheniformis, дрожжи Pichia pastoris и Kluyveromyces lactis, а также трансгенные растения. Использование бактериальной системы экспрессии Е. coli позволяет получить высокие количества целевого продукта, однако небольшой размер полипептида может сильно повлиять на стабильность мРНК в ходе посттранскрипционных процессов, а наличие четырех интрамолекулярных дисульфидных связей будет являться причиной агрегации гетерологичного белка и его накопления преимущественно в тельцах включения в неактивной форме. Длительность, трудоемкость и дороговизна методов - характерная черта экспрессии гетерологичного белка при использовании трансгенных растений. Более того очистка такого продукта будет являться крайне затруднительной для масштабирования в промышленных целях, в связи с чем такой продукт как правило используют в виде целых клеток или плодов, содержащих браззеин. Клетки дрожжей сочетают в себе преимущества данных систем. Эти низшие эукариоты обладают развитой системой эндоплазматического ретикулума для осуществления разнообразных посттрансляционных модификаций протеинов, а также просты и удобны в культивировании. Но небольшой полипептид вероятнее всего будет подвергаться протеолизу из-за секреции большого количества хозяйских протеаз, приводя к гетерогенности. Выделение небольших полипептидов из культуральной жидкости дрожжей также будет осложняется сложностью применения мембранных методов концентрирования и высаливания. Таким образом, можно констатировать, что получение рекомбинантного браззеина в достаточных для применения количествах является нетривиальной задачей. По результатам на сегодняшний день выход целевого продукта не превышает 120 мг с литра культуры продуцентов при культивировании в колбе.
Таким образом, аналогом-прототипом получаемого рекомбинантного белка является браззеин и его производные. В данном случае наиболее близкими техническим решением к заявляемому, на наш взгляд, являются следующие:
1. В патенте WO 2017/130222 описан способ получения мутантной формы браззеина в виде гибрида с лидерной последовательностью PelB (PelB-Brazzein (A28D)), которая обеспечивает транслокацию в периплазматическое пространство клеток E. coli штамма BL21(DE3). Известно, что периплазма E. coli содержит набор ферментов, обеспечивающих корректное образование дисульфидных связей, что особенно важно для браззеина. В условиях культивирования с подпиткой, содержащей сахарозу и лактозу, в качестве источников углерода (fed-batch) в биореакторе удалось получить выход порядка 0.5 грамма с литра. Однако биосинтез целевого продукта с его последующей транслокацией имеет ряд ключевых недостатков. Зачастую транслокация протекает значительно медленнее, чем биосинтез, вследствие чего сложные и цистеин-богатые белки депонируются в тельца включения и не экспортируются в периплазму. Также в патенте отмечен факт неполного протеолиза гибридного белка PelB-Brazzein. С точки зрения дальнейшей технологии, очевидно, что выделение и очистка белков из периплазмы требует больших объемов в пересчете на единицу биомассы, в результате чего потери на данной стадии могут составлять до половины от всего выделяемого продукта.
2. В работе («Efficient Production of Recombinant Brazzein, a Small, Heat-Stable, Sweet-Tasting Protein of Plant Origin», Assadi-Porter, et al 2000) был разработан эффективный метод гибридной экспрессии браззеина с нуклеазой S. aureus в качестве белка-партнера. Нуклеотидная последовательность, кодирующая гибридный белок была оптимизирована для обеспечения стабильности гетерологичной мРНК и клонирована в экспрессионный вектор pET3a. Клетки E. coli BL21(DE3) pLysS были трансформированы полученной конструкцией, а колонии трансформантов выращивали на среде LB, содержащей канамицин и хлорамфеникол. В качестве индуктора использовали ИПТГ, который добавляли к клеткам, достигшим оптической плотности 1 ед., в концентрации 0.1 мМ. Конечный выход целевого гибридного белка составил 130 - 150 мг с литра, что соответствует 36 - 42 мг с литра браззеина. Однако, порядка 50 - 70% целевого белка локализовалось в виде телец включения, и, таким образом, получение браззеина потребовало проведения солюбилизации нерастворимого белка в гуанидин гидрохлориде и дальнейшего рефолдинга. Данное обстоятельство, в комплексе, с использованием токсичного цианбромида для отщепления белка-партнера, делает данный способ получения практически нереализуемым на практике.
3. В работе («Efficient and rapid protein expression and purification of small high disulfide containing sweet protein brazzein in E. coli», Assadi-Porter, et al 2008) был разработан эффективный метод гибридной экспрессии браззеина с белком Sumo S. cerevisiae в качестве партнера. Структура SUMO сходна с пространственной структурой убиквитина, представляющего собой глобулярную структуру, где β-слои фланкированы вокруг одной α-спирали. Известно, что при синтезе целевого белка в слитом с SUMO виде, наблюдается заметное увеличение экспрессии гена рекомбинантного белка, кроме того, увеличивается и его растворимость. Другим положительным качеством слитной продукции с SUMO является простота расщепления гибридных продуктов SUMO-гидролазами. Они не требуют наличия специфической последовательности и не модифицируют N-конец целевого белка, поскольку узнают третичную структуру SUMO. Нуклеотидная последовательность, кодирующая гибридный белок была оптимизирована по кодонному составу для клеток бактерий и клонирована в экспрессионный вектор pET24d под контроль сильного индуцибельного промотора РНК-полимеразы фага Т7. Клетки E. coli BL21-CodonPlus (DE3) RIPL были трансформированы полученной конструкцией, а колонии трансформантов выращивали на среде LB, содержащей канамицин. В качестве индуктора использовали ИПТГ, который добавляли к клеткам, достигшим оптической плотности 1 ед., в концентрации 0.5 мМ. Во время индукции температуру культивирования понижали до 25°С. Конечный выход браззеина составил 50 мг с 10 грамм влажной биомассы E. coli.
Целевой белок нарабатывался в растворимой форме, а расщепление Sumo-гидролазой Ulp1 осуществлялось с эффективностью 90%, в отличие от работы 2, где эффективность гидролиза пептидной связи бромистым цианом составила лишь 50%.
Изобретение решает задачу получения полипептида со свойствами сладкого белка браззеина путем биосинтеза в клетках E. coli, а также увеличение сладости белка путем белковоинженерного подхода.
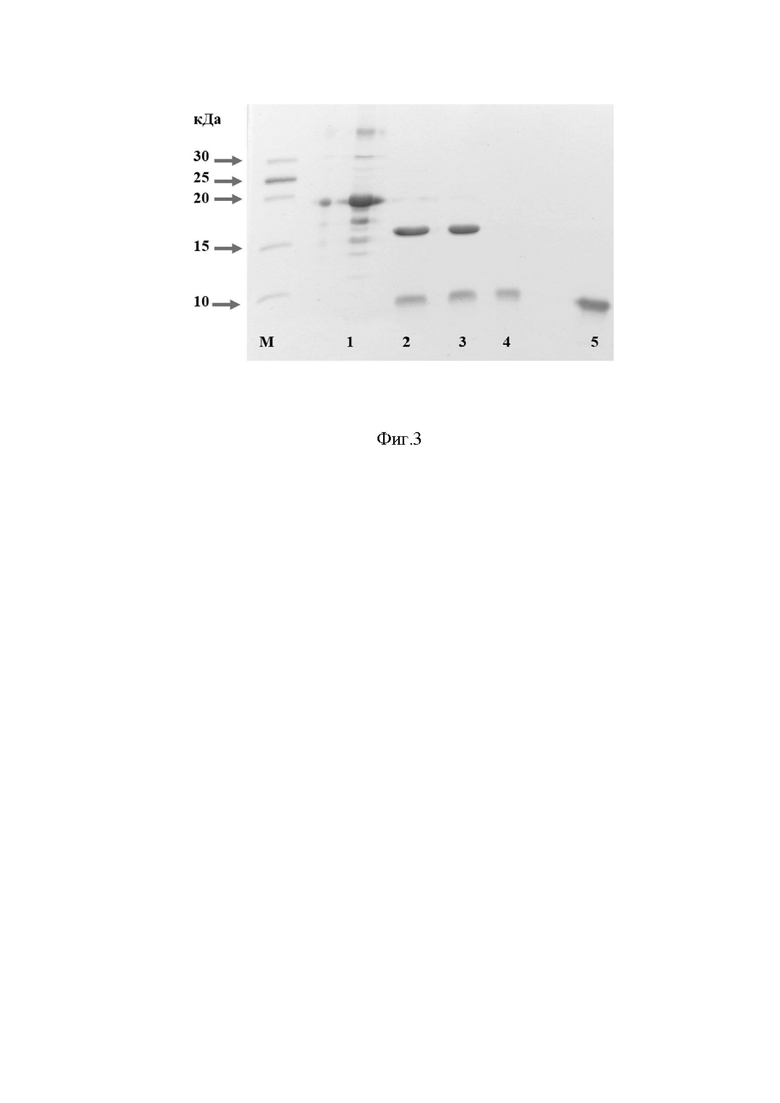
Форма браззеина, так называемая Brazzein_4М впервые в данной работе была получена на основе анализа литературы. Так в ряде работ показано, что тройная мутация браззеина (H31R/E36D/E41A) повышает сладость молекулы до 20000 раз по сравнению с сахарозой («Multiple mutations of the critical amino acid residues for the sweetness of the sweet-tasting protein, brazzein», Joo-Won Lee et al, 2013), также, как и мутация А19K («Structure function relationships of brazzein variants with altered interactions with the human sweet taste receptor», Kiran K. Singarapu et al, 2016).
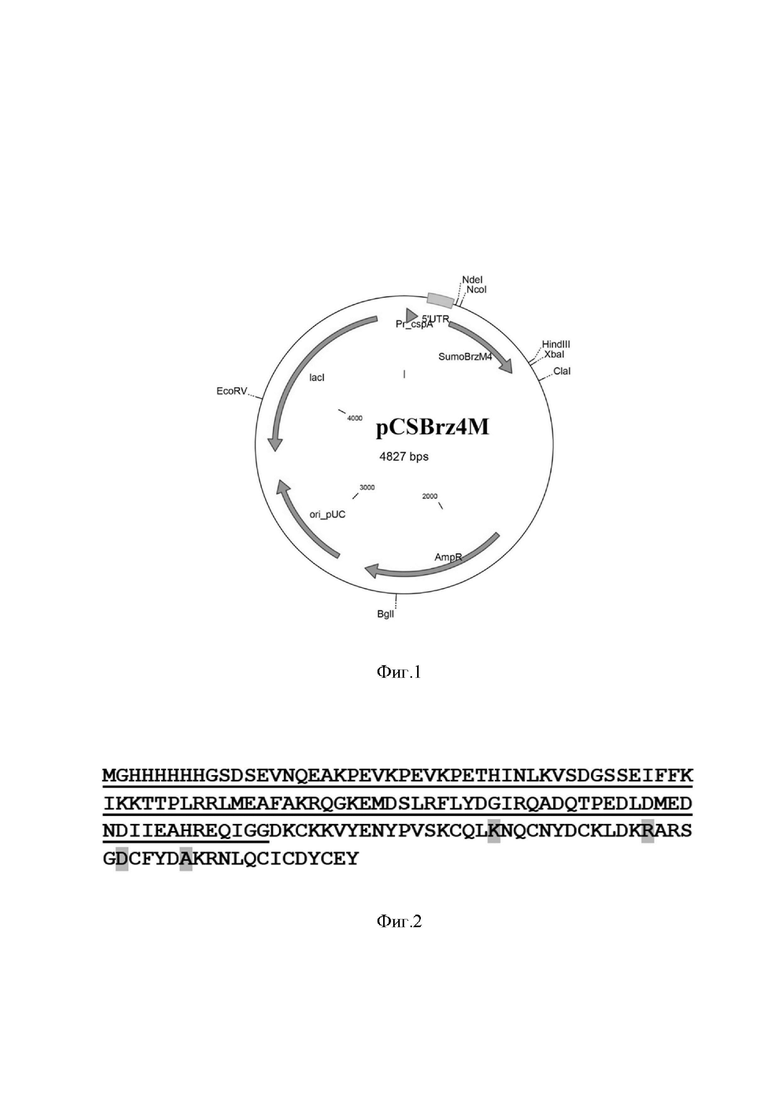
В настоящем изобретении была поставлена задача получения плазмидного вектора с геном Brazzein_4М, а также штамма-продуцента пептида со свойствами сладкого белка браззеина. Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pCSBrz4M, кодирующей синтез полипептида со свойствами сладкого белка браззеина, обеспечивающей биосинтез с уровнем порядка 200 мг рекомбинантного белка / л культуры. Высокоэффективный синтез целевого полипептида обеспечивается следующими факторами: целевой ген оптимизирован с учетом частоты использования кодонов, предсказания вторичной структуры мРНК и находится под контролем температурочувствительного промотора cspA, активирующегося при понижении температуры и контролируемого lac-оператором, находится в слитом состоянии с геном, кодирующим белок-партнер Sumo; рекомбинантная плазмидная ДНК pCSBrz4M, кодирующая полипептид со свойствами сладкого белка браззеина, характеризуется следующими признаками: имеет молекулярную массу 3.26 MDa (4.827 тп.о.); кодирует аминокислотную последовательность гена Brazzein_4М; состоит из NdeI|HindIII - - фрагмента ДНК плазмиды pCOLDIII длиной 4.342 п.о., содержащего ген Bla, определяющий устойчивость трансформированных плазмидой pCSBrz4M клеток к ампициллину, CspA-промотор E. coli, 5'-нетранслируемую область гена CspA длиной 133 п.о., ориджин репликации pUC, обеспечивающий высокую копийность вектора в клетке продуцента, ген LacI - репрессора лактозного оперона, длиной 1082 п.о., а также нуклеотидной последовательности SumoBrz4M, длиной 485 п.о.
Уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: NdeI - - 271, NcoI - - 294, HindIII - - 757, XbaI - - 775, ClaI - - 865, BglI - - 2454, EcoRV - - 3861. Особенностью предложенной плазмидной конструкции является то, что нуклеотидная последовательность сладкого белка браззеина сконструирована с учетом уникального сочетания точечных мутаций, а также оптимизирована по частоте встречаемости кодонов E. coli с оптимальным процентным соотношением GC-пар и содержит на N-конце последовательность белка-партнера Sumo1 S. cerevisiae.
Для получения штамма-продуцента полипептида со структурой и свойствами сладкого белка браззеина трансформируют клетки E. coli BL21 рекомбинантной плазмидой pCSBrz4M.
Полученный штамм BL21_pCSBrz4M характеризуется следующими признаками.
Морфологические признаки. Клетки крупные палочковидной формы, 0.5 - 0.7 мкм, подвижные, грамотрицательные.
Культуральные признаки. При росте на плотной среде YT колонии круглые, гладкие, блестящие, прозрачно-серые, край ровный, диаметр колоний 0.5 - 2 мм; консистенция гелеобразная. Рост в жидкой среде LB характеризуется ровным помутнением с образованием легкого осадка и характерными завихрениями при перемешивании.
Физико-биохимические признаки. Клетки имеют генотип fhuA2 [lon] ompT gal [dcm] ΔhsdS, растут при температуре 12-42°С при оптимуме рН 4.1-5.7. В качестве источника азота используют как минеральные соли в виде смеси, так и органические соединения в виде триптических белковых гидролизатов или дрожжевого экстракта. В качестве источника углерода используют сахарозу, глюкозу, лактозу.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), карбенициллину (до 100 мкг/мл) и их аналогам, обусловленную наличием в векторе гена бета-лактамазы. Штамм не проявляет устойчивости к канамицину, хлорамфениколу, тетрациклину. Штамм E. coli BL21_pCSBrz4M обеспечивает синтез полипептида со свойствами сладкого белка браззеина в количестве не менее 200 мг целевого белка на литр культуры. Совокупность перечисленных свойств штамма обусловливает большую технологическую эффективность процесса получения рекомбинантного сладкого белка. На фиг. 1 представлена физическая карта рекомбинантной плазмиды pCSBrz4M, где указаны уникальные сайты эндонуклеаз рестрикции, AmpR - ген β-лактамазы, lacI -ген lac-репрессора, ori_pUC - ориджин репликации E.coli, pr_cspA - промотор белка теплового шока E.coli, 5’-UTR - регуляторная область промотора cspA E.coli; на фиг. 2 - - аминокислотная последовательность рекомбинантного гибридного полипептида со свойствами сладкого белка браззеина, экспрессируемого с помощью рекомбинантного вектора pCSBrz4M, подчеркнута аминокислотная последовательность белка-партнера Sumo в составе гибрида, зеленым цветом выделены сайты, в которые были внесены мутации; на фиг. 3 - результаты денатурирующего ПААГ-гель электрофореза образцов полученного в ходе биосинтеза полипептида со свойствами сладкого белка браззеина при определении уровня экспрессии и дальнейшем выделении из лизата штамма-продуцента. Слева расположен маркер молекулярных весов (10; 15; 20; 25; 30 кДа), далее 1 - образец после рефолдинга, 2, 3 - результат расщепления гибрида Sumo-BrzM4; 4, 5 - образцы очищенного полипептида BrzM4 в разных концентрациях.
Изобретение иллюстрируется следующими примерами. При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [Sambrook, J., Fritsch, E,F„ and Maniatis, T. Molecular Cloning; A Laboratory Manual, 1989, 2nd ed. Cold Spring Harbor Laboratory Press, New York; Ausubel, F.M., Brent, R., Kingston, R. E., Moore, D.D., Seidman, J.G., Smith, J.A., & Struhl, K. Current Protocols in Molecular Biology, 1997, John Wiley and Sons, New York].
Пример 1. Создание экспрессионного вектора pCSBrz4M. В качестве исходного материала служил вектор pCOLDIII (TaKaRa Bio Inc, Япония). С целью накопления векторной ДНК проводили трансформацию компетентных клеток штамма Escherichia coli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F'proAB laclqZ M15 Tn10 (Tetr)] (Stratagene, США), затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Исходя из известной нуклеотидной последовательности плазмидного вектора и гибридного гена Sumo-BrzM4 были сконструированы олигонуклеотидные последовательности для наработки искусственного гена, кодирующего гибридный полипептид со свойствами сладкого белка браззеина с необходимыми концевыми сайтами рестрикции. ПЦР-амплификацию проводили в два этапа. В реакцию вносили эквимолярную смесь (5 мкМ каждого) олигонуклеотидных праймеров (всех, кроме крайних), составляющих ген, взаимно перекрывающихся между собой на 6-15 нуклеотидов, 0.2 мкМ раствора dNTP, 1/10 часть реакционного 10х буфера и 1U термостабильной ДНК-полимеразы PfuI. Температуру отжига праймеров рассчитывали по стандартной формуле: Tm(°C) = 2⋅[NА+NТ] + 4⋅[NC+NG]-10, где Nx - количество соответствующих оснований. Реакцию проводили по следующей схеме: денатурация ДНК при 95°С, 5 минут; затем 10 циклов: денатурация ДНК при 95°С, 1 минута; отжиг праймеров при 44°С, 40 секунд; синтез ДНК при 74°С, 2,5 минуты. Вторую амплификацию проводили, используя в качестве матрицы, раствор первой реакции и крайние праймеры, обеспечивающие синтез гена с необходимыми сайтами рестрикции, по следующей схеме: денатурация ДНК при 95°С, 5 минут; затем 30 циклов: денатурация ДНК при 95°С, 1 минута; отжиг праймеров при 55°С, 1 минута; синтез ДНК при 74°С, 2,5 минуты. Смесь для ПЦР (50 мкл): 5 мкл 10-кратного буфера для РƒuI-полимеразы («Thermo Fisher Scientific»); 5 мкл реакции 1; 0,5 мкл 100 мкМ праймера dQBrz1; 0,5 мкл 100 мкМ праймера dQBrz4; 1 мкл 10 мМ dNTP каждого вида («Thermo Fisher Scientific»); 43 мкл деионизованной воды; 0,5 мкл PƒuI ДНК-полимеразы («Thermo Fisher Scientific»). После амплификации 5 мкл ПЦР смеси анализировали методом электрофореза в 2%-ном агарозном геле и выявляли гомогенный фрагмент размером около 485 пн. Фрагмент выделяли из геля с помощью набора GelElute Plasmid Miniprep Kit (Sigma, США) в соответствии с инструкцией производителя. 200 нг исходной плазмиды и 100 нг фрагмента (гена Sumo-BrzM4) гидролизовали 20 единицами рестриктаз NcoI (New England Biolabs, США) и HindIII (New England Biolabs, США). Выделенный из агарозного геля NcoI/HindIII фрагмент клонировали в NcoI/HindIII вектор pCOLDIII - лигировали с помощью Т4 ДНК лигазы (на 20 нг вектора 4 нг фрагмента). Полученной лигазной смесью трансформировали компетентные клетки штамма Escherichia coli XL1-Blue, затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Полученные образцы ДНК анализировали совместным гидролизом рестриктазами NcoI/HindIII, EcoRI/BglII, и отбирали «положительные» клоны, содержащие NcoI/HindIII фрагменты размером 485 и 4342 п.н., фрагменты EcoRI/BglII размером 1407 п.н. и 3420 п.н., а плазмиды анализировали на наличие мутаций методом секвенирования ДНК (ЗАО «Евроген»). В конечном счете отбирают экспрессионный вектор, который обозначали как pCSBrz4M.
Пример 2. Создание экспрессионных кассет и отбор трансформантов для синтеза гибридного пептида со свойствами сладкого белка браззеина в клетках бактерии E. coli. Необходимым условием стабильной экспрессии генов является создание экспрессионной кассеты. Бактериальная система E. coli выгодно отличается от других систем экспрессии тем, что для стабильной экспрессии рекомбинантных белков достаточно ввести в клетку вектор в кольцевой форме, нет нужды интегрировать экспрессионную кассету в геном. Для получения трансформантов приготовили ночную культуру штамма E.coli BL21: выращивали в объеме 2 мл в жидкой среде YT при 37°С. Ночную культуру разбавили в 100 раз средой YT и выращивали при 37°С в шейкере-инкубаторе оптической плотности культуры 0.6 о.е. Собрали клетки с 1 мл культуры центрифугированием в мини-центрифуге при 12000 g в течение 30 секунд. Далее удалили супернатант, а клеточную пеллету суспендировали в 100 мкл 0.1 М СaCl2, содержащего 1 мг PEG 8000. Пробирку инкубировали во льду 5 минут, а затем добавили 10 нг вектора pCSBrz4M и инкубировали во льду еще 10 минут. После инкубирования подвергли клетки тепловому шоку при 42°С в течение 30 сек и затем вернули в лед на 2 мин., после чего разбавили в 10 раз средой YT и высеяли 100 мкл суспензии на чашки с плотной средой YT, содержащей антибиотик ампициллин в концентрации 100 мкг/мл.
Полученные после инкубирования чашек при 37°С в течение 16 часов клоны отбирали для определения уровня экспрессии гибридного полипептида.
Пример 3. Культивирование трансформантов и определение уровня экспрессии гибридного полипептида Sumo-BrzM4.
Трансформанты с чашек переносили в колбы со средой YT и растили при 37°С до оптической плотности 0,5-1 ед. Затем в асептических условиях проводили индукцию добавлением 1 мМ ИПТГ. Культивирование проводили в течение 10 часов при температуре 20°С. После выращивания биомассу отделяли от культуральной жидкости центрифугированием при 5000×g в течение 10 минут при 4°С. После лизиса биомассы полученный осветленный лизат смешивали с 1/6 объема «Sample Loading Buffer 6×» и анализировали при помощи денатурирующего ПААГ-электрофореза в стандартном режиме. Клон с максимальным уровнем экспрессии обозначили как E. coli_BL21_pCSBrz4M.
Группа изобретений относится к биотехнологии, в частности к генетической инженерии. Предложена рекомбинантная плазмида pCSBrz4M, кодирущая полную аминокислотную последовательность гибридного полипептида со свойствами сладкого белка браззеина, обеспечивающая стабильную экспрессию гибридного полипептида, а также высокий уровень накопления целевого белка в растворимой форме в цитоплазме E. сoli. Предложен также рекомбинантный штамм E. coli_BL21_pCSBrz4M, являющийся продуцентом гибридного полипептида со свойствами сладкого белка браззеина, и полученный путем трансформации клеток штамма E. coli BL21 рекомбинантным плазмидным вектором pCSBrz4M. Изобретения позволяют осуществить высокоэффективный синтез гибридного полипептида со свойствами сладкого белка браззеина. 2 н.п. ф-лы, 3 ил., 3 пр.
1. Рекомбинантная плазмида pCSBrz4M, характеризующаяся конструктивным выполнением, представленным на фиг. 1, кодирущая полную аминокислотную последовательность гибридного полипептида со свойствами сладкого белка браззеина, представленную на фиг. 2, обеспечивающая стабильную экспрессию гибридного полипептида, а также высокий уровень накопления целевого белка в растворимой форме в цитоплазме E. coli.
2. Рекомбинантный штамм E. coli_BL21_pCSBrz4M - продуцент гибридного полипептида со свойствами сладкого белка браззеина, полученный путем трансформации клеток штамма E. coli BL21 рекомбинантным плазмидным вектором pCSBrz4M по п. 1.
| ASSADI-PORTER F.M | |||
| ET.AL | |||
| Efficient and rapid protein expression and purification of small high disulfide containing sweet protein brazzein in E | |||
| coli | |||
| PROTEIN EXPR PURIF | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| US 8592181 B2, 26.11.2013 | |||
| GHANAVATIAN P | |||
| et al., Structural features and activity of Brazzein and its mutants upon substitution of a surfaced | |||
Авторы
Даты
2023-07-05—Публикация
2022-09-30—Подача