Изобретение относится к биотехнологии, в частности к генетической инженерии. Может быть использовано для получения клеток Escherichia coli, экспрессирующих на поверхности альтернативный каркасный белок 10-й домен фибронектина человека и его варианты - искусственные связывающие белки.
Наиболее распространенными связывающими белками являются моноклональные антитела, однако их терапевтическое применение ограничивается высокой стоимостью производства из-за использования дорогостоящей системы экспрессии в клетках млекопитающих. Кроме того, слабое проникновение в ткани в силу большого размера снижает эффективность антител в лечении ряда заболеваний. Искусственные молекулы, обладающие способностью к высокоаффинному связыванию антигена, но лишенные указанных недостатков, могут быть получены на основе альтернативных каркасных белков (АКБ). Такие белки, являющиеся основой для конструирования искусственных связывающих молекул методами белковой инженерии, характеризуются высокой стабильностью, небольшой молекулярной массой и могут быть получены с помощью бактериальной системы экспрессии [Wurch Т., Pierré A., Depil S. (2012) Novel protein scaffolds as emerging therapeutic proteins: from discovery to clinical proof-of-concept. Trends Biotechnol. V. 30. P. 575-582].
10-й домен фибронектина человека (10Fn3) является одним из наиболее часто используемых АКБ. 10Fn3 имеет небольшой размер, обладает исключительной термостабильностью и растворимостью. В его молекуле отсутствуют остатки цистеина, что способствует высокому уровню его экспрессии в Е. coli. Присутствие в нормальной сыворотке в концентрации 0,1 мг/мл обеспечивает низкую иммуногенность этого белка и открывает широкие возможности его использования в качестве основы для создания терапевтических средств.
Три из экспонированных петель 10Fn3 - ВС, DE и FG - являются структурными аналогами участков антител, обеспечивающих связывание антигенов. В состав петли FG входит последовательность Arg-Gly-Asp (RGD), которая необходима для специфического связывания интегринов. Таким образом, фибронектиновый модуль представляет собой специализированный связывающий белок, структура которого обеспечивает природную способность взаимодействовать с различными лигандами. На основе 10Fn3 получен ряд искусственных связывающих белков, обладающих высокой специфичностью и константой диссоциации в пико- и наномолярной области [Lipovšek D. (2011) Adnectins: engineered target-binding protein therapeutics. Prot. Engin. Des. Sel. V. 24. P. 3-9].
Экспонирование комбинаторных библиотек связывающих белков на поверхности микробных клеток (клеточный дисплей) является современным высокоэффективным методом, позволяющим проводить селекцию вариантов, обладающих высокой аффинностью к целевому лиганду [van Bloois Е., Winter R.Т., Kolmar Н., Fraaije М.W. (2011) Decorating microbes: surface display of proteins on Escherichia coli. Trends Biotechnol. V. 29. P. 79-86]. Для отбора вариантов 10Fn3 чаще всего используется система дрожжевого дисплея, в которой белки экспонируются на поверхности в виде гибрида с субъединицей белка Aga2p [Lipovšek D., Lippow S.M., Hackel В.J., Gregson M.W., Cheng P., Kapila A., Wittrup K.D. (2007) Evolution of an interloop disulfide bond in high-affinity antibody mimics based on fibronectin type III domain and selected by yeast surface display: molecular convergence with single-domain camelid and shark antibodies. J. Mol. Biol. V. 368. P. 1024-1041]. Недостатком данной системы является пониженная эффективность трансформации дрожжей по сравнению с Е. coli, вследствие чего размер библиотек (число вариантов) в этом случае оказывается существенно меньше. Системы бактериального дисплея на основе Е. coli позволяют проводить скрининг более представительных библиотек, кроме того, для этих бактерий известны различные способы экспонирования связывающих белков на поверхности.
Наиболее популярным подходом для конструирования систем клеточного дисплея связывающих белков является использование механизма секреции V типа на основе аутотранспортеров внешней мембраны грамотрицательных бактерий. Их молекулы состоят из N-концевого пассажирского и С-концевого транслокаторного доменов, соединенных альфа-спиральным сегментом [Dautin N., Bernstein H.D. (2007) Annu. Rev. Microbiol. Protein secretion in gram-negative bacteria via the autotransporter pathway. V. 61. P. 89-112]. Замена природного пассажирского домена на рекомбинантный белок с помощью генноинженерных методов позволяет получать гибридные аутотранспортеры, экспонирующие целевой белок на поверхности клеток.
Известен способ получения клеток Е. coli, экспрессирующих на поверхности одноцепочечное антитело (scFv) против коронавируса TGEV-возбудителя гастроэнтерита, с использованием транслокаторного домена IgA протеазы Neisseria gonorrhoeae [Veiga Е., de Lorenzo V., Fernández L.A. (2003) Neutralization of enteric coronaviruses with Escherichia coli cells expressing single-chain Fv-autotransporter fusions. J. Virol. V. 77. P. 13396-13398]. С этой целью ген, кодирующий гибрид нейтрализующего TGEV одноцепочечного антитела 6AC3-scFv и транслокаторного домена, клонировали в плазмиде р6АС3β в единой рамке считывания с кодирующей последовательностью сигнального пептида PelB под контролем lac-промотора. Для обеспечения синтеза рекомбинантного белка проводили индукцию добавлением 0.1 мМ ИПТГ и выращивали культуру штамма-продуцента в течение 3 часов при 30°С. Анализ экспрессии методом Вестерн-блота обнаружил наличие большого количества продуктов протеолитической деградации рекомбинантного белка, что указывает на отсутствие правильного фолдинга пассажирского домена и является недостатком данного способа.
Описан способ получения клеток Е. coli, экспрессирующих на поверхности однодоменное верблюжье антитело (VHH домен) в виде гибрида с транслокаторным доменом аутотранспортера EhaA [Salema V, Marín Е, Martínez-Arteaga R, Ruano-Gallego D, Fraile S, et al. (2013) Selection of Single Domain Antibodies from Immune Libraries Displayed on the Surface of E. coli Cells with Two β-Domains of Opposite Topologies. PLoS ONE 8(9): e75126], а также способ получения клеток, экспрессирующих на поверхности аффибоди (альтернативный каркасный белок на основе IgG-связывающего домена Staphyllococcus aureus) в виде гибридного белка с аутотранспортером AIDA-I энтеропатогенных штаммов Е. coli [Fleetwood F., Andersson K.G., Ståhl S., Löfblom J. (2014) An engineered autotransporter-based surface expression vector enables efficient display of Affibody molecules on OmpT-negative E. coli as well as protease-mediated secretion in OmpT-positive strains. Microb. Cell Fact. V. 13. P. 179]. Оба способа характеризуются высоким уровнем экспрессии белков на поверхности клеток Е. coli, позволяющим проводить отбор вариантов, связывающих целевые лиганды. Однако как VHH домены, так и аффибоди по своему происхождению не являются человеческими белками, поэтому их использование может приводить к развитию нежелательных иммунных реакций в организме.
Наиболее близким к заявленному является способ получения клеток Е. coli, экспрессирующих на поверхности CTLA4-связывающий антикалин в виде гибрида с транслокаторным доменом аутотранспортера EspP. Ген рекомбинантного аутотранспортера, объединенный в единую рамку считывания с кодирующей последовательностью сигнального пептида OmpA, клонировали под контролем регулируемого tet-промотора. Экспрессию гена индуцировали добавлением 25 нг/мл ангидротетрациклина и выращивали культуру в течение 2 часов при 30°С. Недостатком указанного способа является относительно низкий уровень экспрессии связывающего белка на поверхности клеток - около 3000 молекул на клетку [Binder, U., Matschiner, G., Theobald, I., & Skerra, A. (2010) High-throughput sorting of an Anticalin library via EspP-mediated functional display on the Escherichia coli cell surface. J. Mol. Biol. V. 400. P. 783-802].
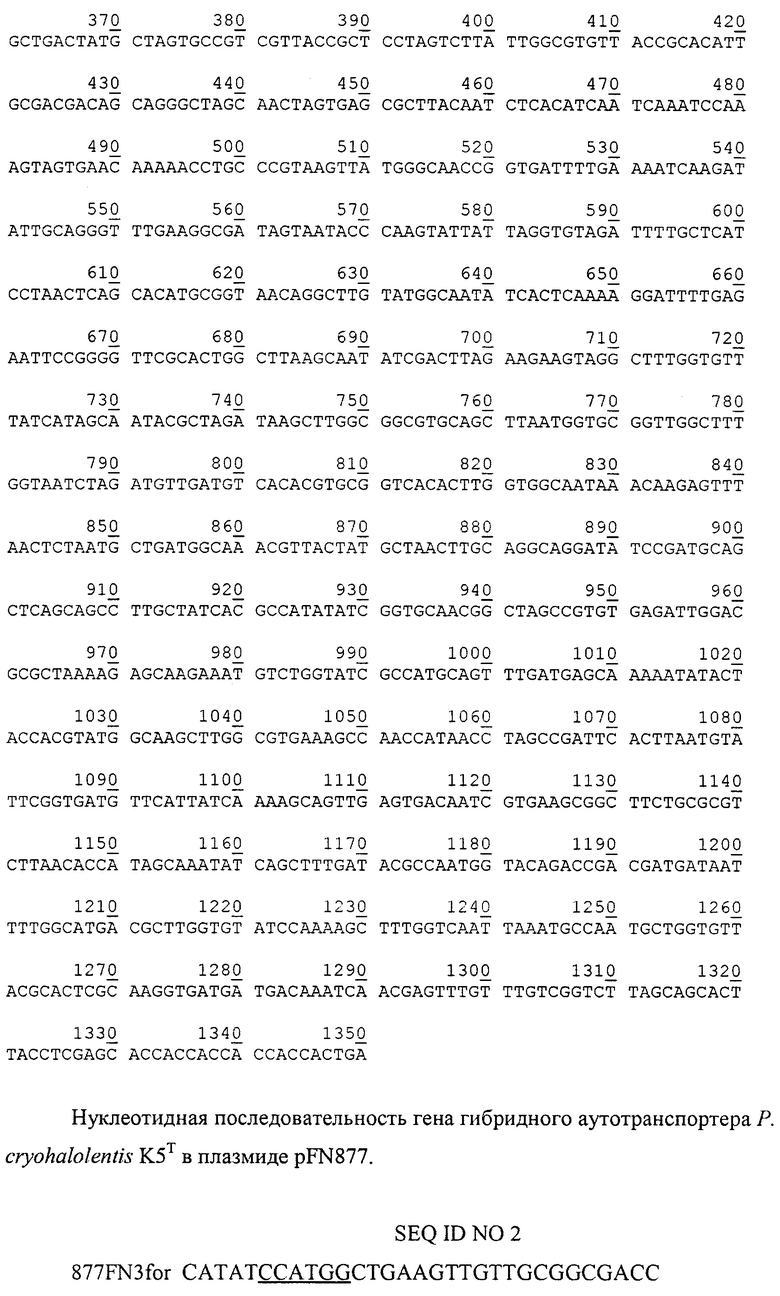
Технической задачей изобретения является получение штамма-продуцента, экспрессирующего на поверхности клеток полипептид со свойствами альтернативного каркасного белка в виде гибрида с транслокаторным доменом аутотранспортера, а также повышение уровня его экспрессии на поверхности клеток. Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pEFN877, детерминирующей экспрессию на поверхности клеток гибридного полипептида со свойствами 10-го домена фибронектина человека, с мол. массой 3,52 Md (5,801 т.п.о.), состоящей из NcoI/XhoI-фрагмента ДНК плазмиды pET20b(+) длиной 3,654 т.п.о., включающего промотор T7lac, терминатор транскрипции бактериофага Т7, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pEFN877 клеток к ампициллину, участок ori инициации репликации, сигнальную последовательность pelB пектатлиазы В Erwinia carotovora; и NcoI/XhoI-фрагмента ДНК размером 2,147 т.п.о., содержащего гибридный ген EFN877, кодирующий аминокислотные последовательности эстеразы P. cryohalolentis K5T, 10-го домена фибронектина человека и аутотранспортера P. cryohalolentis K5T в единой рамке считывания; содержащей уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: NdeI - 2371, NcoI - 2305, BamHI - 1433, SalGI - 1151, XhoI - 158, а также за счет штамма бактерий Е. coli BL21(DE3)pLysS/pEFN877 - продуцента гибридного полипептида со свойствами 10-го домена фибронектина человека на клеточной поверхности.
Рекомбинантная плазмидная ДНК pEFN877 кодирует индуцибельный синтез гибридного полипептида со свойствами 10-го домена фибронектина человека, а штамм Е. coli BL21(DE3)pLysS/pEFN877 обеспечивает синтез и секрецию этого полипептида на поверхность клеток с уровнем экспрессии не ниже 9000 молекул на клетку. Индуцибельный высокий уровень синтеза целевого полипептида обеспечивается тем, что плазмида pEFN877 содержит промотор T7lac и усилитель трансляции гена 10 бактериофага Т7, а экспрессия на поверхности клеток - наличием в составе кодирующей последовательности гибридного белка сигнальной последовательности pelB и С-концевого домена аутотранспортера P. cryohalolentis K5T, а также клонированием в 5'-направлении от гена 10Fn3 кодирующей последовательности эстеразы P. cryohalolentis K5T.
Особенностью предложенной плазмидной конструкции является наличие в ее составе кодирующей последовательности гибридного белка, состоящего из сигнальной последовательности pelB, эстеразы P. cryohalolentis K5T, 10Fn3 и С-концевого домена аутотранспортера P. cryohalolentis K5T (SEQ ID NO 9), под контролем сильного регулируемого промотора T7lac, что, в сочетании с наличием в хромосоме хозяйского штамма гена РНК-полимеразы бактериофага Т7 и компонентов системы секреции в мембране клеток, обеспечивает индуцибельный синтез целевого белка (SEQ ID NO 10) на поверхности клеток с высоким выходом, достигаемым при малых концентрациях индуктора. Клонирование в 5'-направлении от гена 10Fn3 кодирующей последовательности эстеразы P. cryohalolentis K5T обеспечивает более высокую скорость сворачивания С-концевой части пассажирского домена по сравнению с N-концевой. Известно, что 10Fn3 обладает высокой скоростью сворачивания и стабильной пространственной структурой [Plaxco K.W., Spitzfaden С., Campbell I.D., Dobson СМ. (1996) Rapid refolding of a proline-rich all-beta-sheet fibronectin type III module. Proc. Nat. Acad. Sci. V. 93. P. 10703-10706], а эстераза P. cryohalolentis K5T относится к холодоактивным ферментам, для которых характерна низкая стабильность [Novototskaya-Vlasova K., Petrovskaya L., Yakimov S., Gilichinsky D. (2012) Cloning, purification, and characterization of a cold-adapted esterase produced by Psychrobacter cryohalolentis K5T from Siberian cryopeg. FEMS Microbiol. Ecol. V. 82. P. 367-75]. Наличие на N-конце пассажирского домена белка, обладающего низкой стабильностью, а в С-концевой части белка со стабильной пространственной структурой обеспечивает высокую эффективность его экспорта на поверхность клеток штамма-продуцента [Renn J.P., Junker M., Besingi R.N., Braselmann E., Clark P.L. (2012) ATP-independent control of autotransporter virulence protein transport via the folding properties of the secreted protein. Chem. Biol. V. 19. P. 287-296].
Для получения штамма-продуцента гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток компетентные клетки Е. coli штамма BL21(DE3)pLysS трансформируют рекомбинантной плазмидой pEFN877.
Полученный штамм Е. coli BL21(DE3)pLysS/pEFN877 характеризуется следующими признаками.
Морфологические признаки: клетки мелкие, палочковидной формы, грамотрицательные, подвижные, размером 1×3-5 мкм, неспороносные.
Культуральные признаки: при росте на агаризованной LB-среде преобладают мелкие колонии диаметром 1-3 мм; круглые, гладкие, полупрозрачные, блестящие, серые, край ровный; консистенция пастообразная. Могут встречаться крупные колонии диаметром 4-5 мм; круглые, гладкие, матовые, край волнистый. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется равномерным помутнением среды.
Физиолого-биохимические признаки. Клетки штамма продуцента могут расти в диапазоне температур 20-42°С, оптимальная температура роста составляет 37°С. Наиболее благоприятные для роста значения pH находятся в интервале 6,8-7,2. При росте в аэробных условиях, культура может усваивать азот как органических соединений (пептон, триптон, аминокислоты, дрожжевой экстракт), так и аммонийных солей. Углерод усваивается в форме углеводов, многоатомных спиртов (глицерин), аминокислот.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы, и к хлорамфениколу (до 34 мкг/мл), обусловленную присутствием в хозяйском штамме плазмиды pLysS.
Способ, условия и состав среды для хранения штамма. LB-бульон с 15% глицерином, при температуре -70°С, в криовиалах.
Технический результат заявленного изобретения заключается в получении штамма Е. coli BL21(DE3)pLysS/pEFN877, экспрессирующего гибридный полипептид со свойствами 10-го домена фибронектина человека на поверхности клеток в количестве не менее 9000 молекул на клетку при концентрации индуктора 0,1 мМ. В отличие от прототипа в данном штамме достигается в 3 раза более высокий уровень экспрессии целевого белка на поверхности клеток. Совокупность перечисленных свойств штамма Е. coli BL21(DE3)pLysS/pEFN877 обусловливает большую технологичность процесса получения клеток, экспрессирующих на поверхности гибридный полипептид со свойствами 10-го домена фибронектина человека.
Изобретение иллюстрируют графические материалы.
Фиг. 1. Физическая карта рекомбинантной плазмиды pEFN877. Указаны уникальные сайты эндонуклеаз рестрикции. Т7 promoter - промотор бактериофага Т7, Т7 terminator - терминатор транскрипции бактериофага Т7, Ар - ген устойчивости к ампициллину, ori - участок инициации репликации плазмиды, EFN877 - рекомбинантный ген EFN877, кодирующий аминокислотную последовательность гибридного полипептида со свойствами 10-го домена фибронектина человека.
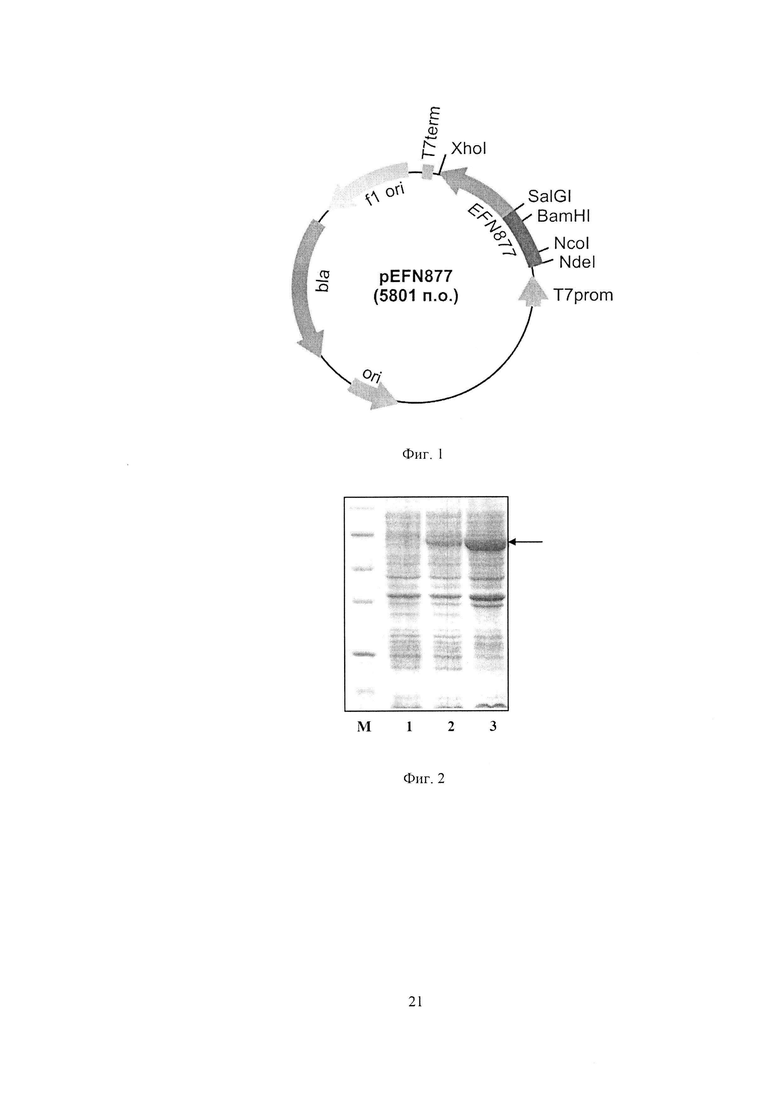
Фиг. 2. Электрофореграмма лизатов клеток штамма-продуцента Е. coli BL21(DE3)pLysS/pEFN877 до (дорожка 1) и после индукции (дорожки 2) и мембранной фракции клеток штамма-продуцента Е. coli BL21(DE3)pLysS/pEFN877 после индукции ИПТГ (дорожка 3) в 13%-ном полиакриламидном геле (М - белковые маркеры молекулярной массы); стрелкой указано положение целевого гибридного белка.
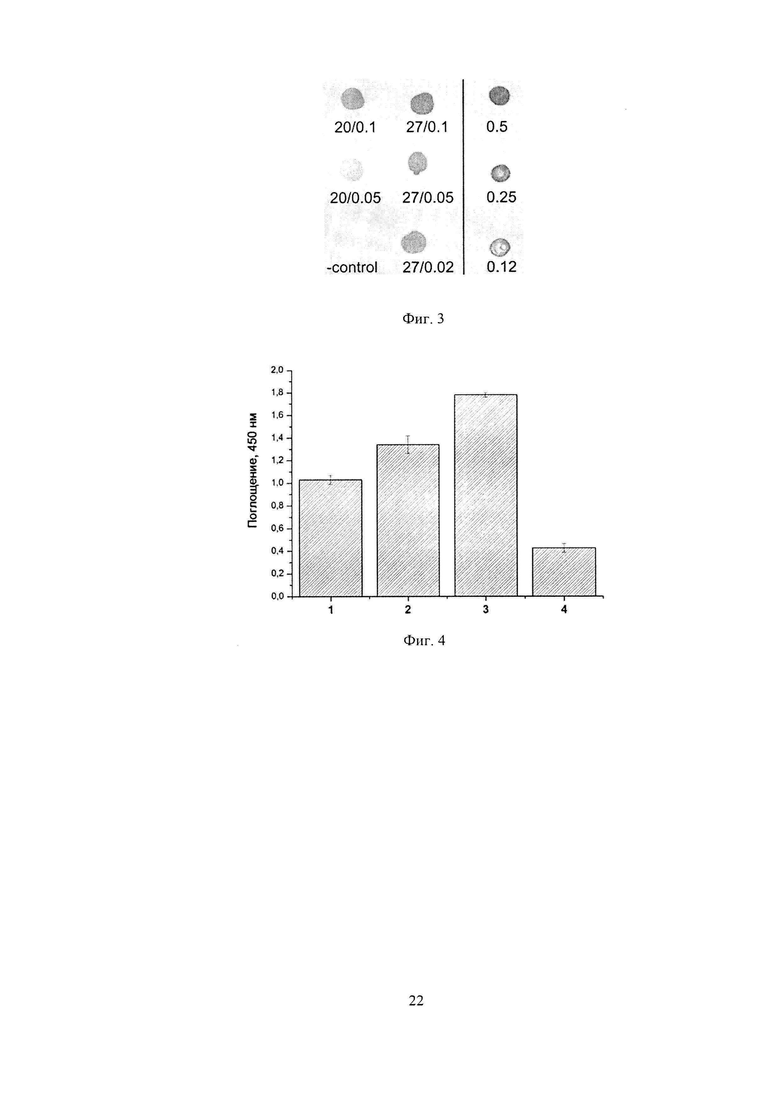
Фиг. 3. Анализ экспрессии 10Fn3 на поверхности клеток Е. coli с помощью дот-блота. Цифры на левой панели указывают температуру выращивания/концентрацию добавленного ИПТГ, на правой - количество в мкг очищенного рекомбинантного 10Fn3, нанесенного в качестве контроля; control - клетки Е. coli BL21(DE3)pLysS без плазмиды.
Фиг. 4. Анализ методом ELISA ФНО-связывающей активности клеток BL21(DE3)pLysS, экспрессирующих на поверхности библиотеку генов 10Fn3. Приведены средние (из 5 повторностей) результаты измерений поглощения в культурах клеток, полученных в результате последовательных циклов отбора (1-3) и контрольных клеток того же штамма, трансформированных плазмидой pEFN877 (4).
Изобретение иллюстрируют следующие примеры.
Пример 1
Конструирование рекомбинантной плазмидной ДНК pFN877
Для амплификации гена 10Fn3 проводят полимеразную цепную реакцию (ПЦР) на матрице плазмидной ДНК pETFN3 [Петровская Л.Е., Шингарова Л.Н., Крюкова Е.А., Болдырева Е.Ф., Якимов С.А., Гурьянова С.В., Новоселецкий В.Н., Долгих Д.А., Кирпичников М.П. (2012) Конструирование TNF-связывающих белков на основе домена фибронектина методом пересадки гипервариабельных участков антитела F10. Биохимия. Т. 77. С. 79-89] в реакционной смеси объемом 50 мкл, содержащей 50 пмоль праймера 877FN3for (SEQ ID NO 2), 50 пмоль праймера 877FN3rev (SEQ ID NO 3), 2 мМ каждого из четырех dNTP, 5 мкл 10× буфера для Pfu ДНК-полимеразы (Fermentas) и 2.5 е.а. Pfu ДНК-полимеразы. Полимеразную цепную реакцию (ПЦР) проводят в следующем режиме: денатурация - 40 с, 94°С; отжиг - 40 с, 52°С; достройка - 40 с, 72°С; количество циклов - 25. 2 мкг ПЦР-продукта обрабатывают рестриктазами NcoI и PauI (Fermentas) в условиях, рекомендованных производителем ферментов, фрагмент длиной 0,279 т.п.о. выделяют из 1% агарозного геля. 0,5 мкг полученного фрагмента и 0.2 мкг плазмидного вектора рАТ877 [Petrovskaya L.E., Novototskaya-Vlasova K.А., Kryukova Е.А., Rivkina E.M., Dolgikh D.A., Kirpichnikov M.P. Cell surface display of cold-active esterase EstPc with the use of a new auto transporter from Psychrobacter cryohalolentis K5T. Extremophiles. 2015. V. 19. P. 161-170], кодирующего ген аутотранспортера, линеаризированного обработкой рестриктазами NcoI и PauI, длиной 4,634 п.о. лигируют в течение 4 ч при 12°С в 10 мкл раствора, содержащего 40 мМ трис-HCl (pH 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 3 е.а. Т4 ДНК-лигазы (Fermentas, Литва). 5 мкл лигазной смеси используют для трансформации компетентных клеток Е. coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-arap, содержащий 100 мкг/мл ампициллина.
Из выросших клонов выделяют плазмидную ДНК и обрабатывают рестриктазами NcoI и PauI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1% агарозном геле. Структуру клонированного гена в отобранных клонах подтверждают определением нуклеотидной последовательности. В результате получают плазмидную ДНК pFN877 (SEQ ID NO 1), содержащую кодирующую последовательность гибрида 10-го домена фибронектина человека и транслокаторного домена аутотранспортера P. cryohalolentis K5T. Кроме того, в данной плазмиде в результате клонирования возникает сайт узнавания рестриктазы SalGI, используемый на следующем этапе.
Пример 2
Конструирование рекомбинантной плазмидной ДНК pEFN877
Для амплификации гена 10Fn3 проводят ПЦР на матрице плазмидной ДНК pETFN3 в смеси объемом 50 мкл, содержащей 50 пмоль праймера Bam_FN (SEQ ID NO 4), 50 пмоль праймера FN_Sal (SEQ ID NO 5), 2 мМ каждого из четырех dNTP, 5 мкл 10× буфера для Pfu ДНК-полимеразы (Fermentas) и 2.5 е.а. Pfu ДНК-полимеразы. Полимеразную цепную реакцию (ПЦР) проводят в следующем режиме: денатурация - 40 с, 94°С; отжиг - 40 с, 52°С; достройка - 40 с, 72°С; количество циклов - 25. 2 мкг ПЦР-продукта обрабатывают рестриктазами BamHI и SalGI (Fermentas) в условиях, рекомендованных производителем ферментов, фрагмент длиной 0,282 т.п.о. выделяют из 1% агарозного геля.
Для амплификации гена эстеразы P. cryohalolentis K5T проводят ПЦР на матрице плазмидной ДНК pET32a(+)/EstPc [Novototskaya-Vlasova K., Petrovskaya L., Yakimov S., Gilichinsky D. Cloning, purification, and characterization of a cold-adapted esterase produced by Psychrobacter cryohalolentis K5T from Siberian cryopeg. FEMS Microbiol. Ecol. 2012. V. 82. P. 367-375] в смеси объемом 50 мкл следующего состава: 50 пмоль праймера 23NcoF (SEQ ID NO 6), 50 пмоль праймера 23BamR (SEQ ID NO 7), 2 мМ каждого из четырех dNTP, 5 мкл 10× буфера для Pfu ДНК-полимеразы (Fermentas), 2.5 е.а. Pfu ДНК-полимеразы (Fermentas). Реакцию проводят в следующем режиме: денатурация - 40 с, 94°С; отжиг - 40 с, 52°С; достройка - 60 с, 72°С; количество циклов - 25. 2 мкг ПЦР-продукта обрабатывают рестриктазами NcoI и BamHI (Fermentas) в условиях, рекомендованных производителем ферментов, фрагмент длиной 0,885 т.п.о. выделяют из 1% агарозного геля.
По 0,5 мкг полученных фрагментов и 0.2 мкг плазмидного вектора pFN877, линеаризированного обработкой рестриктазами NcoI и SalGI, длиной 4,647 п.о. лигируют в течение 4 ч при 12°С в 10 мкл раствора, содержащего 40 мМ трис-HCl (pH 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 3 е.а. Т4 ДНК-лигазы (Fermentas, Литва). 5 мкл лигазной смеси используют для трансформации компетентных клеток Е. coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-arap, содержащий 100 мкг/мл ампициллина.
Из выросших клонов выделяют плазмидную ДНК и обрабатывают рестриктазами NcoI и SalGI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1% агарозном геле. Структуру клонированного гена в отобранных клонах подтверждают определением нуклеотидной последовательности. В результате получают плазмидную ДНК pEFN877.
Пример 3
Получение штамма-продуцента гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток
Рекомбинантной плазмидной ДНК pEFN877 трансформируют компетентные клетки Е. coli BL21(DE3)pLysS (Novagen) и после выращивания рекомбинантных клонов на LB-arape с ампициллином (100 мкг/мл) и хлорамфениколом (34 мкг/мл) при 37°С получают штамм-продуцент гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток.
Пример 4
Определение продуктивности штамма-продуцента гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток
Для определения продуктивности клетки E. coli BL21(DE3)pLysS/pEFN877 выращивают при 37°С в 5 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина и 34 мкг/мл хлорамфеникола, в течение 16 ч на качалке при 250 об/мин. Полученную ночную культуру в объеме 200 мкл переносят в 5 мл жидкой среды LB (разбавление до оптической плотности 0.15-0.20 при длине волны 560 нм), содержащей 100 мкг/мл ампициллина и 34 мкг/мл хлорамфеникола, и выращивают до оптической плотности 0,8 (длина волны 560 нм) при 37°С и перемешивании 250 об/мин. Добавляют ИПТГ до конечной концентрации 0,1 мМ, после чего клетки выращивают в течение 1,5 ч при 27°С и перемешивании 200 об/мин. Отбирают пробу культуры в количестве 1 оптическая единица (длина волны 560 нм) и центрифугируют 5 мин при скорости 7000 об/мин. Осажденные клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, pH 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005%) бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 10 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия. По окончании электрофореза гель прокрашивают при помощи кумасси R-250. После отмывки красителя гель сканируют и проводят математическую обработку результатов с помощью программы Scion Image (Scion Corp., США). По данным сканирования содержание гибридного белка, состоящего из эстеразы, 10Fn3 и С-концевого домена аутотранспортера P. cryohalolentis K5T, составляет 10% от общего клеточного белка. На фиг. 2 представлена электрофореграмма лизатов клеток штамма-продуцента Е. coli BL21(DE3)pLysS/pEFN877 (дорожки 1 и 2) в 13%-ном полиакриламидном геле до (дорожка 1) и после индукции ИПТГ (дорожка 2) (М - белковые маркеры молекулярной массы; стрелкой указано положение целевого полипептида).
Пример 5
Анализ локализации гибридного полипептида со свойствами 10-го домена фибронектина человека в клетках штамма-продуцента Е. coli BL21(DE3)pLysS/pEFN877
Проводят индукцию биосинтеза целевого белка в клетках штамма-продуцента Е. coli BL21(DE3)pLysS/pEFN877 ИПТГ (конечная концентрация 0,1 мМ) в течение 3 ч при 27°С. Клетки центрифугируют 15 мин при 7000 об/мин. 1 г влажной биомассы индуцированных клеток ресуспендируют в 10 мл буфера (50 мМ Трис-HCl, 200 мМ NaCl, pH 8,0) после чего разрушают клетки обработкой в ультразвуковом дезинтеграторе Branson Sonifier 450, не допуская нагрева выше 10°С. Полученную суспензию центрифугируют 30 мин при 6000 об/мин. Полученный супернатант повторно центрифугируют 1 час при 100000 g для осаждения мембранных белков. Осадок суспендируют в 1 мл буфера 50 мМ Трис-HCl pH 8,0; 5 мкл полученной суспензии смешивают с 5 мкл буфера, содержащего 125 мМ трис-HCl, pH 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 10 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия, гель прокрашивают при помощи кумасси R-250. По результатам электрофореза гибридный белок, состоящий из эстеразы, 10Fn3 и С-концевого домена аутотранспортера P. cryohalolentis K5T, обнаруживается в мембранной фракции клеток штамма-продуцента (фиг. 2, дорожка 3).
Пример 6
Анализ уровня экспрессии гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток методом дот-блота
Проводят индукцию биосинтеза целевого белка в клетках штамма-продуцента Е. coli BL21(DE3)pLysS/pEFN877 ИПТГ (конечная концентрация 0,02, 0.05, или 0,1 мМ) в течение 1,5 ч при 27°С, а также при 20°С. Клетки центрифугируют 5 мин при 3000 об/мин и дважды промывают буфером PBS (pH 7.2). Осадок после промывки и центрифугирования суспендируют в буфере PBS, так, чтобы оптическая плотность полученной суспензии составила 10,0 (длина волны 560 нм). 2 мкл полученной суспензии наносят на нитроцеллюлозную мембрану (Bio-Rad), предварительно уравновешенную в PBS. В качестве отрицательного контроля наносят 2 мкл приготовленной аналогичным образом суспензии клеток Е. coli BL21(DE3)pLysS, не содержащих плазмиду. В качестве положительного контроля наносят различные количества очищенного рекомбинантного 10Fn3, полученного как описано в (Петровская Л.Е., Шингарова Л.Н., Крюкова Е.А., Болдырева Е.Ф., Якимов С.А., Гурьянова С.В., Новоселецкий В.Н., Долгих Д.А., Кирпичников М.П. (2012) Конструирование TNF-связывающих белков на основе домена фибронектина методом пересадки гипервариабельных участков антитела F10. Биохимия. Т. 77. С. 79-89]. Высушенную мембрану промывают PBS, после чего выдерживают в PBS+1% БСА в течение часа при комнатной температуре. Добавляют моноклональные мышиные антитела к 10Fn3 (Hybridoma Laboratories) в разведении 1:1000 и инкубируют в течение часа при комнатной температуре. Промывают мембрану 3 раза PBS+0.1% Tween 20 и добавляют конъюгат анти-мышь-HRP (Sigma) в разведении 1:5000. Инкубируют в течение часа при комнатной температуре, после чего промывают мембрану 3 раза PBS+0.1% Tween 20. Окрашивание осуществляют с использованием преципитирующего однокомпонентного раствора ТМВ (GenWay Biotech). После промывки дистиллированной водой окрашенную мембрану высушивают. На фиг. 3 приведены результаты анализа уровня экспрессии 10Fn3 на поверхности клеток методом дот-блота. По результатам эксперимента, уровень экспрессии альтернативного каркасного белка 10Fn3 на поверхности клеток штамма-продуцента в оптимальных условиях (27°С, 0,1 мМ ИПТГ, 1,5 ч) составляет около 0,3 мкг на 2×107 клеток. Это соответствует содержанию около 10000 молекул на клетку, что в 3 раза выше, чем у прототипа.
Пример 7
Конструирование библиотеки вариантов генов 10Fn3 в плазмиде pEFN877 для отбора TNF-связывающих белков методом бактериального дисплея
На первом этапе с помощью ПЦР получают набор вариантов (библиотеку) генов 1()Fn3, кодирующих петли ВС, DE и FG с рандомизированной последовательностью и фланкированных на 5'- и 3'-концах сайтами узнавания рестриктаз BamHI и SalGI для последующего клонирования. В качестве матрицы используют суммарную плазмидную ДНК, полученную в результате селекции библиотеки генов 10Fn3 методом бесклеточного CIS-дисплея [Шингарова Л.Н., Петровская Л.Е., Крюкова Е.А., Болдырева Е.Ф., Долгих Д.А., Кирпичников М.П. Рекомбинантная плазмидная ДНК рЕТ3.54, кодирующая полипептид FN3.54, взаимодействующий с фактором некроза опухолей человека, и штамм бактерий Escherichia coli - продуцент полипептида FN3.54, взаимодействующего с фактором некроза опухолей человека. Патент №2531547 от 26.08.2014]. Амплификацию проводят в присутствии праймеров Bam_FN (SEQ ID NO 4) и FN_Sal (SEQ ID NO 5) в объеме 50 мкл с использованием 0,5 мкг матрицы, 50 пмоль каждого из праймеров, 2 мМ каждого из четырех dNTP, 5 мкл 10× буфера для Pfu ДНК-полимеразы (Fermentas) и 2.5 е.а. Pfu ДНК-полимеразы (Fermentas). Реакцию проводят в следующем режиме: денатурация - 1 мин, 94°С; отжиг - 40 с, 56°С; достройка - 40 с, 72°С; количество циклов - 25. Продукт ПЦР выделяют из агарозного геля с использованием MinElute Gel Extraction Kit (Qiagen).
На втором этапе ПЦР-продукт обрабатывают совместно рестриктазами BamHI и SalGI, выделяют фрагмент (0,294 т.п.о.) из 1,5% агарозного геля. 0,5 мкг полученного фрагмента и 0.2 мкг плазмидного вектора pEFN877, линеаризированного обработкой рестриктазами BamHI и SalGI, лигируют в течение 3 ч при 13°С в 10 мкл раствора, содержащего 40 мМ трис-HCl (pH 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 3 е.а. Т4 ДНК-лигазы (Fermentas, Литва). 5 мкл лигазной смеси используют для трансформации компетентных клеток Е. coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-arap, содержащий 100 мкг/мл ампициллина. Полученные клоны смывают с чашки 5 мл среды LB и выделяют суммарную плазмидную ДНК, содержащую библиотеку генов 10Fn3.
Пример 8
Селекция ФНО-связывающих вариантов 10Fn3 методом бактериального дисплея
Клетки E. coli штамма BL21(DE3)pLysS трансформируют суммарной плазмидной ДНК, содержащей библиотеку генов 10Fn3, и выращивают ночную культуру при 37°С в 5 мл среды LB, содержащей ампициллин (100 мкг/мл), хлорамфеникол (34 мкг/мл), 0,2% глюкозу. Ночную культуру разбавляют 20 мл среды LB, содержащей (100 мкг/мл) до мутности 0,1 ОЕ560 нм, растят до 0,6-0,8 ОЕ560 нм и проводят индукцию экспрессии 0,1 мМ ИПТГ в течение 1 ч при 25°С и 220 об./мин. Клетки осаждают центрифугированием (2000 g, 4°С, 15 мин.) и ресуспендируют в 1,5 мл холодного буфера PBS. Для селекции клеток, экспонирующих на поверхности ФНО-связывающие белки, к суспензии добавляют биотинилированный ФНО до концентрации 100 нМ, инкубируют 1 ч. при 4°С и перемешивании и осаждают клетки центрифугированием. Далее ресуспендируют в 750 мкл PBS и добавляют 150 мкг магнитных шариков Dynabeads М-280 Streptavidin (Invitrogen), предварительно обработанных буфером ВВ (3% БСА, 0,1 мг/мл ДНК-носителя в PBS). Суспензию инкубируют 30 мин при 4°С и перемешивании, шарики со связавшимися клетками собирают магнитом, промывают 2 раза по 750 мкл холодным PBS, переносят в 5 мл среды LB с ампициллином, хлорамфениколом и глюкозой и выращивают ночную культуру. Аналогично проводят еще 2 раунда селекции. После 3 раундов выделяют суммарную ДНК, кодирующую библиотеку ФНО-связывающих вариантов 10Fn3.
Пример 9
Анализ эффективности селекции методом ИФА
Эффективность отбора библиотеки ФНО-связывающих вариантов 10Fn3, экспонированных на поверхности клеток E. coli, проверяют после каждого раунда селекции методом иммуноферментного анализа. Для этого 2 ОЕ560 клеток штамма BL21(DE3)pLysS, экспрессирующих на поверхности библиотеку генов 10Fn3, после индукции центрифугируют (2000 g, 4°С, 15 мин.), промывают холодным PBS и инкубируют в течение 1 ч при 4°С в присутствии 100 нМ биотинилированного ФНО. Клетки осаждают, промывают холодным PBS и обрабатывают в течение 30 мин конъюгатом нейтравидин-пероксидаза (Thermo Scientific, США). Затем клетки осаждают, промывают PBS для удаления конъюгата, суспендируют в 500 мкл PBS и помещают по 50 мкл суспензии в лунки планшета для ИФА (Corning). Для визуализации иммунных комплексов в лунки добавляют по 50 мкл однокомпонентного раствора ТМВ (GenWay Biotech), через 5 мин реакцию останавливают добавлением 50 мкл 10% серной кислоты. Поглощение в лунках измеряют с помощью ридера Model 680 (Bio-Rad) при длине волны 450 нм. Измерения проводят в 5 повторностях. В качестве отрицательного контроля используют клетки того же штамма, трансформированные плазмидой pEFN877 и обработанные в тех же условиях. Результаты проведенного эксперимента (фиг. 4) показывают, что в результате отбора происходит постепенное повышение эффективности взаимодействия с ФНО клеток, экспрессирующих на поверхности библиотеку вариантов 10Fn3.
Перечень последовательностей, представленных в описании изобретения





Изобретение относится к области биотехнологии и может быть использовано для получения гибридного полипептида альтернативный каркасный белок 10-й домен фибронектина человека. Рекомбинантную плазмидную ДНК pEFN877 конструируют на основе плазмиды pET20b(+) длиной 3,654 т.п.о. Полученная плазмида pEFN877 содержит гибридный ген EFN877 с SEQ ID NO: 8, кодирующий аминокислотные последовательности эстеразы P. cryohalolentis K5T, 10-го домена фибронектина человека и аутотранспортера P. cryohalolentis K5T в единой рамке считывания, расположенные в соответствии с фиг. 1. Штамм бактерий Е. coli BL21(DE3)pLysS/pEFN877 получают путем трансформации компетентных клеток Е. coli BL21(DE3)pLysS плазмидной ДНК pEFN877. Изобретение позволяет получить штамм клеток Е. coli - продуцент гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток. 2 н.п. ф-лы, 4 ил., 9 пр.
1. Рекомбинантная плазмидная ДНК pEFN877, детерминирующая экспрессию на поверхности клеток гибридного полипептида со свойствами 10-го домена фибронектина человека, с мол. массой 3,52 Md (5,801 т.п.о.), состоящей из NcoI/XhoI - фрагмента ДНК плазмиды pET20b(+) длиной 3,654 т.п.о., включающего промотор T7lac, терминатор транскрипции бактериофага Т7, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pEFN877 клеток к ампициллину, участок ori инициации репликации, сигнальную последовательность pelB пектатлиазы В Erwinia carotovora; и NcoI/XhoI - фрагмента ДНК размером 2,147 т.п.о., содержащего гибридный ген EFN877 с SEQ ID NO: 8, кодирующий аминокислотные последовательности эстеразы P. cryohalolentis K5T, 10-го домена фибронектина человека и аутотранспортера P. cryohalolentis K5T в единой рамке считывания, расположенные в соответствии с фиг. 1.
2. Штамм бактерий Е. coli BL21(DE3)pLysS/pEFN877, полученный путем трансформации компетентных клеток Е. coli BL21(DE3)pLysS плазмидной ДНК pEFN877 по п. 1 - продуцент гибридного полипептида со свойствами 10-го домена фибронектина человека на поверхности клеток.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК РЕТ3.54, КОДИРУЮЩАЯ ПОЛИПЕПТИД FN3.54, ВЗАИМОДЕЙСТВУЮЩИЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛЕЙ ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА FN3.54, ВЗАИМОДЕЙСТВУЮЩЕГО С ФАКТОРОМ НЕКРОЗА ОПУХОЛЕЙ ЧЕЛОВЕКА | 2013 |
|
RU2531547C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pEst877, ДЕТЕРМИНИРУЮЩАЯ ЭКСПРЕССИЮ ПОЛИПЕПТИДА С АКТИВНОСТЬЮ ЭСТЕРАЗЫ Psychrobacter cryohalolentis К5 НА ПОВЕРХНОСТИ КЛЕТОК ESCHERICHIA COLI, И ШТАММ БАКТЕРИЙ Escherichia coli BL21(DE3)pLysS/pEst877-ПРОДУЦЕНТ ПОЛИПЕПТИДА С АКТИВНОСТЬЮ ЭСТЕРАЗЫ Psychrobacter cryohalolentis К5 НА ПОВЕРХНОСТИ КЛЕТОК | 2013 |
|
RU2526213C1 |
| BINDER U | |||
| ET AL., High-throughput sorting of an Anticalin library via EspP-mediated functional display on the Escherichia coli cell surface, J | |||
| Mol | |||
| Biol., 2010, v.400,n.4,p.783-802 | |||
| ПЕТРОВСКАЯ Л | |||
| Е | |||
| и др., ГИБРИДНЫЕ ФЛУОРЕСЦЕНТНЫЕ БЕЛКИНА ОСНОВЕ 10-го ДОМЕНА ФИБРОНЕКТИНА ЧЕЛОВЕКА, БИООРГАНИЧЕСКАЯ ХИМИЯ, 2014, т | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Аппарат для передачи изображений неподвижных и движущихся предметов | 1923 |
|
SU405A1 |
Авторы
Даты
2017-01-10—Публикация
2015-06-03—Подача