Область техники
Изобретение относится к области биотехнологии, в частности к генетической инженерии. Изобретение предлагает рекомбинантную плазмидную ДНК для получения рекомбинантного инсулина человека и может быть использовано для приготовления лекарственных препаратов, в частности, инсулинов и их аналогов для лечения сахарного диабета.
Краткое описание изобретения
Изобретение относится к биотехнологии. Данное изобретение может быть использовано для получения рекомбинантного проинсулина человека, имеющего в своем составе цепь B, С- пептид и цепь А. Предложена рекомбинантная плазмидная ДНК, содержащая гибридный tac-промотор, терминатор рибосомного оперона Е. coli, искусственный ген, кодирующий гибридный полипептид, состоящий из короткой лидерной последовательности фрагмента человеческого белка HGS, субстрата тирозин-киназы, пептидного линкера GlyHis6GlySerArg, сайта протеолиза «Арг», цепи B, сайта протеолиза «Арг Арг», С-пептида, сайт протеолиза «Арг» и цепи А. Более подробно, предложена рекомбинантная плазмидная ДНК pF265, кодирующая гибридный полипептид, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, с молекулярной массой 1,4 МДа (4537 п.о.), содержащая:
- BglII/XhoI фрагмент плазмиды pBR322, включающий ген β-лактамазы (bla), определяющий устойчивость бактериальных клеток к ампициллину; участок инициации репликации (ori);
- ROP ген, регулирующий копийность плазмиды;
- XhoI/EcoRI фрагмент, представляющий собой гибридный Tac-промотор транскрипции;
- EcoRI/HindIII фрагмент, содержащий искусственный ген, в котором последовательность короткого лидерного пептида MetLeuTyrTyrGluGlyLeuGlnAsp соединена через пептидный линкер с последовательностью GlyHis6GlySerArg, с аминокислотной последовательностью проинсулина;
- HindIII/BglII фрагмент, содержащий терминатор оперона рибосомальных РНК rrnB, транскрипционный репрессор LacI, регулирующий транскрипцию Tac-промотора,
- уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: EcoRI - 115, BamHI - 176, SpeI - 438, HindIII - 444, BglII - 1872, NdeI - 2476, AatII - 4468.
Также предложен штамм Escherichia coli BL21/pF265 - продуцент гибридного полипептида с последовательностью проинсулина человека, трансформированный рекомбинантной плазмидной ДНК согласно изобретению и гибридный полипептид, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, с молекулярной массой 1,4 МДа (4537 п.о.), полученный с помощью рекомбинантной плазмидной ДНК согласно изобретению. Биосинтез гибридного полипептида индуцируется изопропилтиогалактопиранозидом, При этом уровень биосинтеза составляет не ниже 4,5% от массы влажного осадка клеточной биомассы.
Настоящее изобретение позволяет увеличить долю инсулина в гибридном полипептиде до 49,5% и повысить эффективность очистки целевого продукта за счет элиминации близкородственной примеси Арг0-А-инсулин. Изобретение направлено на получение высокопродуктивных бактериальных штаммов - продуцентов, использование которых может значительно удешевить процесс производства инсулина и инсулиновых аналогов.
Предшествующий уровень техники
В настоящее время сахарный диабет представляет собой серьезнейшую медицинскую и социально-экономическую проблему во всем мире. Число больных сахарным диабетом 1 типа постоянно растет, и эффективная заместительная инсулинотерапия как основной способ терапии инсулинозависимого сахарного диабета, имеет, в связи с этим, особое значение (1).
Инсулин - гормон поджелудочной железы, регулирующий процессы углеводного обмена и поддержания нормального уровня сахара в крови. Потребности в данном препарате не могут быть покрыты инсулином животного происхождения из-за ограниченности сырьевой базы. Кроме того, существует необходимость в использовании при лечении диабета различных инсулиновых аналогов, демонстрирующих лучший терапевтический эффект, чем природный инсулин, большую продолжительность действия и более раннее наступление действия в организме.
Связи с этим разработка способов получения генно-инженерных инсулинов является актуальной медицинской задачей.
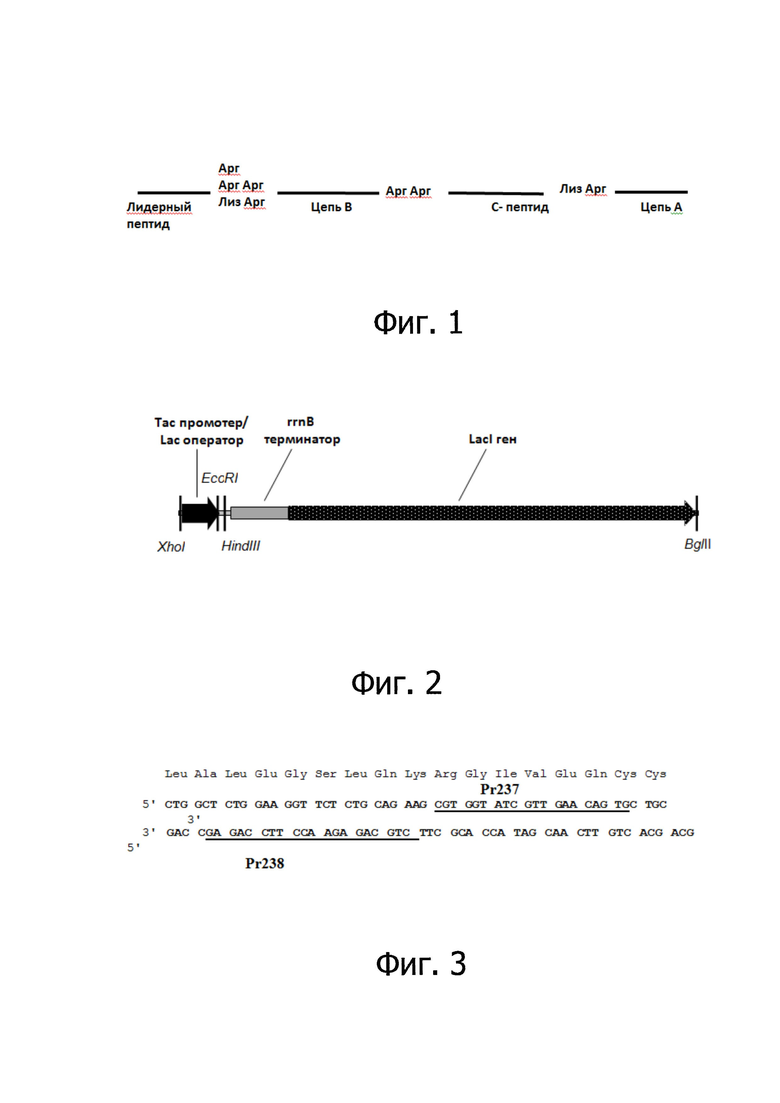
В настоящее время наиболее перспективной является технология получения инсулина с использованием методологии экспрессии гена проинсулина человека в клетках Escherichia coli в составе гибридных полипептидов в виде нерастворимых "телец включения" (2). Структура одноцепочечного предшественника (гибридного полипептида), экспрессируемого в известных штаммах-продуцентах человеческого инсулина, представляет собой лидерный пептид, сайт протеолиза «Арг» или «Лиз» или «Лиз Арг», цепь B, сайт протеолиза «Арг Арг», С-пептид, сайт протеолиза «Лиз Арг», цепь А (Фиг. 1).
Необходимость включать лидерные пептиды в состав гибридного полипептида связана с низкой стабильностью проинсулина человека в клетках Escherichia coli, время полужизни которого составляет 2 минуты (4). В качестве лидерных последовательностей, защищающих проинсулин от протеолитической деградации, используют глутатион-трансферазу (3), иммуноглобулин (IgG), связывающий домен белка А из S.aureus (4), интерлейкин-2 (5) и др.
Технологическая схема получения инсулина человеческого из гибридного полипептида характеризуется следующими этапами: наращивание биомассы клеток штамма-продуцента, выделение телец включения, денатурация гибридного полипептида, ренатурация гибридного полипептида. Следующим этапом технологического процесса является ферментативный гидролиз с использованием смеси двух ферментов: трипсина и карбоксипептидазы B. Под действием трипсина осуществляется гидролиз пептидной связи преимущественно после аргинина, а под действием карбоксипептидазы B - отщепляются положительно заряженные аминокислоты с C-конца инсулина (лизин и аргинин). В результате совместного гидролиза трипсином и карбоксипептидазой B образуется нативный инсулин.
Наиболее близкими по технической сущности к предлагаемому изобретению являются рекомбинантные плазмиды ДНК pPINS07 и pHINS11, обеспечивающие синтез гибридных полипептидов, имеющих в своем составе IgG-связывающий домен стафилококкового белка А (6) и N-концевой фрагмент гамма-интерферона человека (7), соответственно.
Патент РФ №2144957 описывает штамм E.coli JM109/pPINS07, обеспечивающий синтез гибридного полипептида с уровнем экспрессии не ниже 25-30%. Рекомбинантная плазмидная ДНК pPINS07, описанная в данном документе, детерминирует синтез гибридного полипептида, в котором единственный IgG-связывающий домен стафилококкового белка А соединен через пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина человека. Преимущества предложенного конструкта заключаются в высоком уровне экспрессии гибридного полипептида и в его эффективной ренатурации (рефолдинге) и, как следствие, высоком выходе правильно свернутого полипептида. Существенным недостатком данной рекомбинантной плазмидной ДНК pPINS07 является то, что она кодирует белок с низкой долей инсулина, составляющего около 33% (6).
Патент РФ №2354702 описывает рекомбинантную плазмидную ДНК pHINS11 и штамм E.coli JM109/ pHINS11, трансформированный с ее помощью. Данная плазмидная ДНК детерминирует синтез гибридного полипептида, в котором N-концевой фрагмент гамма-интерферона человека соединен через пептидный линкер HisProGlySerHisHisHisHisGlySerArg с аминокислотной последовательностью проинсулина человека и обеспечивает его высокую экспрессию. Использование этих конструкций в технологическом процессе позволяет получать высокоочищенный инсулин человека с чистотой не ниже 98% и активностью не менее 27,5 МЕ/мг. Для данного штамма-продуцента характерен высокий уровень биосинтеза гибридного полипептида и более высокая доля инсулина в гибридном полипептиде (38%) по сравнения с рекомбинантной плазмидной ДНК pPINS07 (33%), но при этом стадия ренатурации продуцируемого гибридного полипептида была недостаточно эффективна (7).
В целом, к недостаткам использованных ранее генетических конструкций для экспрессии гибридного полипептида относятся:
Низкий выход конечного продукта - инсулина. Это связанно с тем, что лидерные пептиды представляют собой достаточно протяженные аминокислотные последовательности и составляют от 40 до 60% массы гибридного полипептида.
Образование близкородственной примеси Арг0-А-инсулин в результате гидролиза трипсином пептидной связи после лизина в положении между С-пептидом и А-цепью (Фиг. 1).
Суть настоящего изобретения состоит в существенном сокращении размера гибридного белка за счет использования короткой лидерной последовательности, состоящей из 31 аминокислоты и изменении сайта протеолиза между С-пептидом и А-цепью на «Арг».
Настоящее изобретение позволяет увеличить долю инсулина в гибридном белке до 49,5% и повысить эффективность очистки целевого продукта за счет элиминации близкородственной примеси Арг0-А-инсулин. Изобретение направлено на получение высокопродуктивных бактериальных штаммов - продуцентов, использование которых может значительно удешевить процесс производства инсулина и инсулиновых аналогов.
Поставленная задача решается конструированием рекомбинантной плазмидной ДНК pF265 и штамма Escherichia coli BL21/pF265, трансформированного с ее помощью, обеспечивающего синтез гибридного полипептида с уровнем экспрессии не ниже 4,5% от сырого веса клеточной биомассы.
Описание фигур
На Фиг. 1 показана структура одноцепочечного предшественника (гибридного полипептида), экспрессируемого в известных штаммах-продуцентах человеческого инсулина.
На Фиг. 2 представлена структура последовательности ДНК, полученной методом химического синтеза.
На Фиг. 3 показано расположение праймеров на плазмиде pF173 для сайт-направленного мутагенеза сайта протеолиза между С-пептидом и А-цепью.
На Фиг. 4 первичная структура EcoRI/HindIII-фрагмента плазмиды pF265, кодирующая гибридный белок. Выделены подчеркиванием инициирующий и терминирующие кодоны, и обозначены сайты узнавания рестриктаз.
Сайты протеолиза гибридного белка обозначены жирным шрифтом.
На Фиг. 5 представлена физическая карта плазмиды pF265. Указаны сайты эндонуклеаз рестрикции, pBR322 ori - участок инициации репликации плазмиды, Ptac - гибридный промотор транскрипции, rrnB - терминатор транскрипции рибосомного оперона Е. coli, лидерный пептид - MetLeuTyrTyrGluGlyLeuGlnAsp, фрагмент человеческого белка HGS, субстрата тирозин киназы (TKS), и пептидный линкер GlyHis6GlySerArg, Проинсулин - проинсулин человека, LacI - транскрипционный репрессор, регулирующий транскрипцию Tac-промотора, а также праймеры Pr033 и Pr039.
Подробное описание изобретения
Предложена рекомбинантная плазмидная ДНК pF265, кодирующая гибридный полипептид, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, с молекулярной массой 1,4 МДа (4537 п.о.), содержащая:
- BglII/XhoI фрагмент плазмиды pBR322, включающий ген β-лактамазы (bla), определяющий устойчивость бактериальных клеток к ампициллину; участок инициации репликации (ori);
- ROP ген, регулирующий копийность плазмиды;
- XhoI/EcoRI фрагмент, представляющий собой гибридный Tac-промотор транскрипции;
- EcoRI/HindIII фрагмент, содержащий искусственный ген, в котором последовательность короткого лидерного пептида MetLeuTyrTyrGluGlyLeuGlnAsp соединена через пептидный линкер с последовательностью GlyHis6GlySerArg, с аминокислотной последовательностью проинсулина;
- HindIII/BglII фрагмент, содержащий терминатор оперона рибосомальных РНК rrnB, транскрипционный репрессор LacI, регулирующий транскрипцию Tac-промотора,
- уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: EcoRI - 115, BamHI - 176, SpeI - 438, HindIII - 444, BglII - 1872, NdeI - 2476, AatII - 4468.
При этом, в одном из вариантов, данная рекомбинантная плазмидная ДНК имеет размер 4537 п.о.
Кроме того, предложен штамм Escherichia coli BL21/pF265, являющийся продуцентом гибридного полипептида с последовательностью проинсулина человека, трансформированный рекомбинантной плазмидной ДНК согласно изобретению.
Общим недостатком гибридных полипептидов в патентах, описанных в предшествующем уровне техники, является низкая доля инсулина в гибридном полипептиде и наличие сайта протеолиза «Лиз Арг» между С-пептидом и А-цепью, допускающего образование близкородственной примеси Арг0-А-инсулин.
Авторы настоящего изобретения установили, что при существенном сокращении размера гибридного полипептида за счет использования короткой лидерной последовательности, состоящей из 31 аминокислоты, и изменении сайта протеолиза между С-пептидом и А-цепью на «Арг» можно достичь высоких выходов целевого продукта. Дополнительно, предложен гибридный полипептид, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, полученный с помощью рекомбинантной плазмидной ДНК согласно изобретению.
В составе лидерного пептида имеется короткая последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, образующая выраженную пространственную структуру типа «альфа-спираль». Наличие N-концевого альфа-спирального участка в лидерном пептиде положительно влияет на уровень ренатурации гибридного белка.
Согласно изобретению, при использовании описанной рекомбинантной плазмидной ДНК можно существенно увеличить долю инсулина в гибридном полипептиде, в данном случае, до 49,5% и повысить эффективность очистки целевого продукта за счет элиминации близкородственной примеси Арг0-А-инсулин. Настоящее изобретение направлено на получение высокопродуктивных бактериальных штаммов - продуцентов, использование которых может значительно упростить процесс производства инсулина и инсулиновых аналогов и снизить затраты на очистку целевого продукта.
Исходной плазмидой для создания экспрессионного вектора pF265 послужила плазмида pF019, представляющая собой рекомбинантный вектор pBR322 (8), в которой методами молекулярного клонирования был полностью удален ген устойчивости к тетрациклину (пример 1).
На следующем этапе синтезировали фрагмент ДНК размером 1,6 кБ, содержащий следующие элементы и сайты рестрикции (Фиг. 2):
- Tac промотер и Lac оператор для контроля экспрессии гибридного полипептида (9), фланкированный сайтами рестрикции XhoI и EcoRI.
- Терминатор транскрипции rnnB оперона штамма K-12 ER3413 (REGION: 4143199..4143361), перед которым расположен сайт рестрикции HindIII.
- LacI ген штамма K-12 ER3413 (REGION: 365804 to 367006) с сайтом рестрикции BglII на 3’-конце.
Введение LacI гена в экспрессионную конструкции решает задачу контроля экспрессии гибридного полипептида при использовании широкого круга штаммов-хозяев, включая BL21, характеризующийся повышенной стабильностью рекомбинантных полипептидов за счет удаления клеточных протеаз lon и ompT.
Синтезированный фрагмент ДНК и плазмида pF019 инкубировали с эндонуклеазами рестрикции XhoI и BglII в течение 3-х часов при 37°С. Соответствующие ДНК-фрагменты выделяли из агарозного геля с использованием набора Quiagen и лигировали с помощью T4 ДНК лигазы. После электропорации XL1-Blue штамма E.coli выделенные из выросших колоний рекомбинантные плазмидные ДНК анализировали с помощью методов ПЦР и секвенирования.
Таким образом, получили экспрессионный вектор pF20 на основе плазмиды pBR322, содержащий Тас промотер, rnnB терминатор и LacI ген, кодирующий транскрипционный репрессор Тас промотера, а также сайты рестрикции EcoRI и HindIII для последующей вставки гена, кодирующего гибридный полпептид.
ДНК последовательность гибридного полипептида, содержащая в качестве лидерного пептида IgG-связывающий домен белка А из Staphylococcus aureus, пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина человека, вырезали из плазмиды pPIN07 (6) с помощью эндонуклеаз рестрикции EcoRI/HindIII и вставляли по соответствующим сайтам рестрикции в экпрессионный вектор pF20 описанным выше способом, при этом в получаемом векторе появлялся сайт рестрикции BamHI, образованный кодирующей последовательностью двух аминокислот пептидного линкера GlySer (GGATCC). В результате получали рекомбинантную плазмидную ДНК pF100.
На следующим этапе получали рекомбинантную плазмидную ДНК pF173 после замены ДНК последовательности IgG-связывающего домена белка А из Staphylococcus aureus ДНК последовательностью, кодирующей более короткий лидерный пептид MetLeuTyrTyrGluGlyLeuGlnAsp, представляющий собой фрагмент человеческого белка HGS, субстрата тирозин-киназы (TKS), регулируемой фактором роста гепатоцитов (пример 2). Аминокислотную последовательность LeuTyrTyrGluGlyLeuGlnAsp локализовали в альфа-спиральном участке белка TKS (№ 3D структуры в базе данных PDB: 3F1I). Наличие альфа-спирального участка в лидерном пептиде способствует эффективной ренатурации получаемого гибридного полипептида.
Методом сайт-направленного мутагенеза в плазмиде pF173 удаляли кодон «aag» в положении 373-375, соответствующий аминокислоте лизин сайта протеолиза «Лиз Арг» между С-пептидом и А-цепью проинсулина (пример 3).
В результате получили рекомбинантную плазмидную ДНК pF265, кодирующую гибридный полипептид с аминокислотной последовательностью проинсулина человека, характеризуется следующими признаками: имеет молекулярную массу 1,4 МДа (4537 п.о.); состоит из следующих структурных элементов (Фиг.5): BglII/XhoI фрагмент плазмиды pBR322, включающий ген β-лактамазы (bla), определяющий устойчивость бактериальных клеток к ампициллину; участок инициации репликации (ori); ROP ген, регулирующий копийность плазмиды; XhoI/EcoRI фрагмент, представляющий собой гибридный Tac-промотор транскрипции; EcoRI/HindIII фрагмент, содержащий искусственный ген, в котором последовательность короткого лидерного пептида MetLeuTyrTyrGluGlyLeuGlnAsp соединена через пептидный линкер GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека; HindIII/BglII фрагмент, содержащий терминатор оперона рибосомальных РНК rrnB, а также транскрипционный репрессор LacI, регулирующий транскрипцию Tac-промотора; содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: EcoRI - 115, BamHI - 176, SpeI - 438, HindIII - 444, BglII - 1872, NdeI - 2476, AatII - 4468.
Преимуществами предложенной рекомбинантной плазмидной ДНК конструкции являются высокая доля инсулина в гибридном полипептиде (49,5%), наличие в составе лидерного пептида последовательности, образующей пространственную структуру типа «альфа-спирали» для улучшения эффективности ренатурации гибридного полипептида, модификация сайта протеолиза между С-пептидом и А-цепью, исключающая образование близкородственной примеси Арг0-А-инсулин при ферментативном гидролизе получаемого гибридного полипептида.
Для получения штамма-продуцента гибридного полипептида с проинсулином человека электрокомпетентные клетки штамма реципиента Escherichia coli BL21 трансформировали рекомбинантной плазмидной ДНК pF265 методом электропорации согласно описанной методике (10) и высевали на LB-агар, содержащий 100 мкг/мл ампициллина.
Полученный штамм-продуцент Escherichia coli BL21/pF265 после трансформации рекомбинантной плазмидной ДНК согласно изобретению характеризуется следующими признаками:
- Морфологические признаки: клетки мелкие, палочковидной формы, грамотрицательные, неспороносные, размером 1x3,5 мкм, подвижные, с хорошо различимыми тельцами включения после индукции синтеза гибридного полипептида.
- Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, полупрозрачные, блестящие, серые. Край ровный, диаметр колоний 1-3 мм, консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением.
- Физиолого-биохимические признаки: клетки растут при температуре
4-42°С, оптимум рН 6,8-7,6. В качестве источника азота используют как минеральные соли аммония, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт. В качестве источника углерода при росте на минимальной среде используют глицерин, углеводы, аминокислоты.
- Устойчивость к антибиотикам: клетки штамма-продуцента проявляют устойчивость к ампициллину (до 300 мг/мл), обусловленную наличием в плазмиде гена β-лактамазы (bla).
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование промежуточной генетической конструкции pF019.
ПЦР-продукт размером 2.8 кб, полученный в результате амплификации плазмиды pBR322 с праймерами Pr033 (5' - ccaacgtaacagatct (BglII) aacagctcgaactcgag (XhoI) ttgaagacgaaagggcctcg - 3') и Pr039 (5' - ccaaccgtaacagatct (BglII) ctgtggaacacctacatctg- 3’), вырезали из геля, очищали с использованием набора Qiagen. После инкубации с эндонуклеазой рестрикции BglII в течение 3-х часов при 37°С очищенный ДНК-фрагмент лигировали с помощью T4 ДНК-лигазы и использовали для трансформации XL1-Blue штамма E.coli (Agilent Technology, 200249) методом электропорации. Корректность плазмидной ДНК, выделенной из колоний, выросших на среде LB с ампицилином (100 мкг/мл) подтверждали секвенированием. Описанным выше способом была получена плазмида pF019, представляющая собой фрагмент плазмиды pBR322 с полной делецией гена устойчивости к тетрациклину.
Пример 2. Конструирование промежуточной рекомбинантной плазмидной ДНК pF173.
Для введения в состав проинсулина короткого лидерного пептида были синтезированы праймеры pr096 (tcaacgtaacgaattct atg ctg tat tat gaa ggc ctg cag gac ggc agc agc cac cac catcatcatcatggatcccg) и pr130 (tgcctggcggcagtagcgcg). Праймер pr096 имеет в своем составе сайт узнавания эндонуклеазы рестрикции EcoRI; область, кодирующую аминокислотную последовательность лидерного пептида; последовательность, соответствующую пептидному линкеру His6GlySerArg конструкции pF100.
В состав реакционной смеси (100 мкл) для полимеразной цепной реакции (ПЦР) входили следующие компоненты:
10 мкл 10-кратного буфера для Pfu ДНК-полимеразы,
0,1 нг плазмидной ДНК pF100,
1 л смеси 10 мМ dNTP,
0,5 л каждого праймера (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (30 сек).
Продукты амплификации анализировали с помощью электрофореза в агарозном геле с использованием интеркалирующего красителя GelRed, Biotium. ПЦР-продукт, соответствующий по размеру 600 п.о., вырезали из геля и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit. Электрофорез проводили в стандартном буфере TBE (Трис-борат-ЭДТА) c использованием 1%-й агарозы. ДНК визуализировали с помощью гельдокументирующей системы Fusion-SL2-400.
Вырезанный из геля ПЦР-продукт и плазмиду pF100 инкубировали с эндонуклеазами рестрикции EcoRI и HindIII в течение 3-х часов при 37°С. Соответствующие ДНК-фрагменты (330 п.о. и 4,2 кб) выделяли из агарозного геля с использованием набора Quiagen и лигировали с помощью T4 ДНК- лигазы. После электропорации XL1-Blue штамма E.coli выделенные из выросших колоний плазмидные ДНК анализировали с помощью методов ПЦР и секвенирования.
Пример 3. Конструирование рекомбинантной плазмидной ДНК pF265 с помощью сайт-направленного мутагенеза плазмиды pF173.
Для модификации сайта протеолиза «Лиз Арг» между С-пептидом и А-цепью проинсулина человека синтезировали олигонуклеотиды Pr237 (cgtggtatcgttgaacagtg) и Pr238 (ctgcagagaaccttccagag), содержащие фосфатную группу с 5’- конца (Фиг. 3).
В состав реакционной смеси (100 мкл) для полимеразной цепной реакции (ПЦР) входили следующие компоненты:
10 л 10-кратного буфера для Pfu ДНК-полимеразы,
0, 1 нг плазмидной ДНК pF173,
1 л. смеси 10 мМ dNTP,
0,5 л. каждого праймера (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (3 мин).
Продукты амплификации анализировали с помощью электрофореза в агарозном геле с использованием интеркалирующего красителя GelRed, Biotium. ПЦР-продукт, соответствующий по размеру плазмиде pF173 (4,5 кБ), вырезали из геля и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit. Электрофорез проводили в стандартном буфере TBE c использованием 1%-й агарозы. ДНК визуализировали с помощью гельдокументирующей системы Fusion-SL2-400.
Для получения рекомбинантной плазмидной ДНК pF265 концы выделенного из геля ПЦР-продукта лигировали с помощью T4 ДНК-лигазы (NEB). Лигирующую смесь (10 μl) использовали для трансформации штамма BL21 методом электропорации. После трансформации отбирали колонии, выращенные на среде с ампициллином, из них выделяли плазмиды и анализировали с помощью секвенирования последовательности гибридного полипептида. В результате получали рекомбинантную плазмидную ДНК pF265, экспрессирующую проинсулин человека в составе гибридного полипептида.
Пример 4. Определение продуктивности штамма-продуцента гибридного полипептида.А
Индивидуальной колонией клеток штамма E. coli BL21, содержащей плазмиду pF265, инокулировали 2 мл LB среды, содержащей ампициллин в концентрации 100 мкг/мл, растили в термошейкере при 37°С в течение 22 часов при перемешивании (170 об./мин). После измерения оптической плотности OD600 ночной культуры засевали 40 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина (ODстартовая600 = 0,1) и растили 1-2 часа при 37°С на шэйкере-инкубаторе при перемешивании (180 об/мин) до достижения оптической плотности OD600 = (0,8 ± 0,2). 20 мл культуры переносили в другую колбу (контроль без индукции), к оставшимся 20 мл добавляли 10 мкл 1М ИПТГ (конечная концентрация ИПТГ - 0,5 мМ). После 4 часов инкубирования на шэйкере-инкубаторе при перемешивании (180 об/мин) клеточные культуры центрифугировали (15 мин, 3000 об/мин), определяли массу влажного осадка клеток, замораживали. Содержание гибридного полипептида в % от массы влажного осадка измеряли методом капиллярного электрофореза. Оно составило не ниже 4,5% от массы влажного осадка клеточной биомассы.
Источники информации:
1. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates, and projections. Diabetes care. 1998 Sep;21(9):1414-31. PubMed PMID: 9727886.
2. Баирамашвили ДИ. Генноинженерный инсулин человека: успехи и перспективы. Рос хим ж (Ж Рос об-ва им ДИ Менделеева). 2005;XLIX(1):34-45.
3. Berg H, Walter M, Mauch L, Seissler J, Northemann W. Recombinant human preproinsulin. Expression, purification and reaction with insulin autoantibodies in sera from patients with insulin-dependent diabetes mellitus. Journal of immunological methods. 1993 Sep 15;164(2):221-31. PubMed PMID: 8370928.
4. Jonasson P, Nilsson J, Samuelsson E, Moks T, Stahl S, Uhlen M. Single-step trypsin cleavage of a fusion protein to obtain human insulin and its C peptide. European journal of biochemistry / FEBS. 1996 Mar 1;236(2):656-61. PubMed PMID: 8612642.
5. Castellanos-Serra LR, Hardy E, Ubieta R, Vispo NS, Fernandez C, Besada V, et al. Expression and folding of an interleukin-2-proinsulin fusion protein and its conversion into insulin by a single step enzymatic removal of the C-peptide and the N-terminal fused sequence. FEBS letters. 1996 Jan 8;378(2):171-6. PubMed PMID: 8549827.
6. Коробко ВГ, Болдырева ЕФ, Шингарова ЛН. Рекомбинантная плазмидная ДНК pPINS07, кодирующая гибридный полипептид, содержащий проинсулин человека, и штамм бактерий Escherichia coli - продуцент гибридного полипептида, содержащего проинсулин человека: Патент РФ №2144957; 1999.
7. Шматченко ВВ, Шматченко НА, Байдусь АН. Рекомбинантная плазмидная ДНК pHINS11, кодирующая гибридный белок - предшественник инсулина человека, клетка Escherichia coli, трансформированная рекомбинантной плазмидной ДНК pPHINS11, штамм бактерий Escherichia coli JM109/pHINS11 - продуцент гибридного полипептида - предшественника инсулина человека и способ получения инсулина человека2006. http://bd.patent.su/2263000-2263999/pat/servl/servletc85e.html.
8. Bolivar F, Rodriguez RL, Greene PJ, Betlach MC, Heyneker HL, Boyer HW, et al. Construction and characterization of new cloning vehicles. II. A multipurpose cloning system. Gene. 1977;2(2):95-113. PubMed PMID: 344137. Epub 1977/01/01.
9. de Boer HA, Comstock LJ, Vasser M. The tac promoter: a functional hybrid derived from the trp and lac promoters. Proceedings of the National Academy of Sciences of the United States of America. 1983 Jan;80(1):21-5. PubMed PMID: 6337371.
10. Lessard JC. Transformation of E. coli via electroporation. Methods in enzymology. 2013;529:321-7. PubMed PMID: 24011058. Epub 2013/09/10.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Zakrytoe Aktsionernoe Obshchestvo "FARM-Kholding"
<120> Recombinant Plasmid DNA pF265 encoding Hybrid polypeptide comprising a human proinsulin, and human proinsulin- comprising hybrid polypeptide producer bacterial strain Escherichia coli
<140> RU 2019116103
<141> 2019-05-23
<160> 1
<210> 1
<211> 9
<212> PRT
<213> E. coli
<400> 1
MetLeuTyrTyrGluGlyLeuGlnAsp
<210> 2
<211> 10
<212> PRT
<213> E. coli
<400> 2
GlyHisHisHisHisHisHisGlySerArg
<210> 3
<211> 9
<212> PRT
<213> E. coli
<400> 3
HisHisHisHisHisHisGlySerArg
<210> 4
<211> 11
<212> PRT
<213> E. coli
<400> 4
HisProGlySerHisHisHisHisGlySerArg
<210> 5
<211> 8
<212> PRT
<213> E. coli
<400> 5
LeuTyrTyrGluGlyLeuGlnAsp
<210> 6
<211> 53
<212> DNA
<213> E. coli
<400> 6
ccaacgtaacagatct 16
aacagctcgaactcgag 17
ttgaagacgaaagggcctcg 20
<210> 7
<211> 37
<212> DNA
<213> E. coli
<400> 7
ccaaccgtaacagatct 17
ctgtggaacacctacatctg 20
<210> 8
<211> 79
<212> DNA
<213> E. coli
<400> 8
tcaacgtaacgaattct 17
atgctgtattatgaaggcctgcaggacggcagcagccaccac 42
catcatcatcatggatcccg 20
<210> 9
<211> 20
<212> DNA
<213> E. coli
<400> 9
tgcctggcggcagtagcgcg 20
<210> 10
<211> 20
<212> DNA
<213> E. coli
<400> 10
cgtggtatcgttgaacagtg 20
<210> 11
<211> 20
<212> DNA
<213> E. coli
<400> 11
ctgcagagaaccttccagag 20
<210> 12
<211> 720
<212> DNA
<213> E. coli
<400> 12
tttgtttaactttaagaaggagagaattctatgctgtattatgaa 45
aaacaaattgaaattcttcctctcttaagatacgacataatactt 45
ggcctgcaggacggcagcagccaccaccatcatcatcatggatcc 45
ccggacgtcctgccgtcgtcggtggtggtagtagtagtacctagg 45
cgttttgttaaccaacacctgtgcggttctcacctggttgaagct 45
gcaaaacaattggttgtggacacgccaagagtggaccaacttcga45
ctgtacctggtttgcggtgaacgtggtttcttctacaccccgaag45
gacatggaccaaacgccacttgcaccaaagaagatgtggggcttc45
acccgtcgtgaagctgaagacctgcaggttggtcaggttgaactg45
tgggcagcacttcgacttctggacgtccaaccagtccaacttgac 45
ggtggtggtccgggtgctggtagcctgcaaccgctggctctggaa 45
ccaccaccaggcccacgaccatcggacgttggcgaccgagacctt45
ggttctctgcagcgtggtatcgttgaacagtgctgcacctctatc 45
ccaagagacgtcgcaccatagcaacttgtcacgacgtggagatag 45
tgctctctgtaccagctggaaaactactgcaactagtaagcttag45
acgagagacatggtcgaccttttgatgacgttgatcattcgaatc45
<210> 13
<211> 106
<212> PRT
<213> E. coli
<400> 13
MetLeuTyrTyrGlu5
GlyLeuGlnAspGlySerSerHisHisHisHisHisHisGlySer15
ArgPheValAsnGlnHisLeuCysGlySerHisLeuValGluAla15
LeuTyrLeuValCysGlyGluArgGlyPhePheTyrThrProLys 15
ThrArgArgGluAlaGluAspLeuGlnValGlyGlnValGluLeu 15
GlyGlyGlyProGlyAlaGlySerLeuGlnProLeuAlaLeuGlu 15
GlySerLeuGlnArgGlyIleValGluGlnCysCysThrSerIle 15
CysSerLeuTyrGlnLeuGluAsnTyrCysAsn11
<---

Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению терапевтических белков, и может быть использовано для получения рекомбинантного проинсулина человека. Рекомбинантный проинсулин получают в составе гибридного полипептида, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А. Для этого используют рекомбинантную плазмидную ДНК pF265 и штамм-продуцент Escherichia coli BL21/pF265. Изобретение обеспечивает синтез гибридного полипептида с уровнем экспрессии не ниже 4,5% от сырого веса клеточной биомассы, позволяет увеличить долю инсулина в гибридном белке до 49,5% и повысить эффективность очистки целевого продукта за счет элиминации близкородственной примеси Арг0-А-инсулин. 3 н.п. ф-лы, 5 ил., 4 пр. 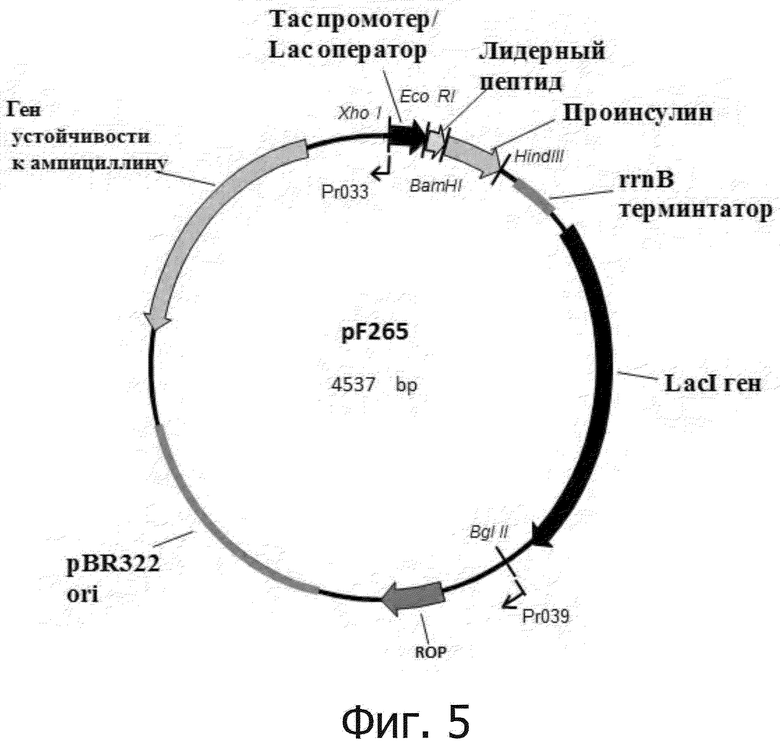
1. Рекомбинантная плазмидная ДНК pF265 для экспрессии в Escherichia coli проинсулина человека в составе гибридного полипептида, имеющая карту плазмиды как показано на Фиг. 5, с молекулярной массой 1,4 МДа (4537 п.о.),
кодирующая гибридный полипептид, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, включающий аминокислотную последовательность SEQ ID NO:13,
при этом плазмидная ДНК pF265 содержит:
- BglII/XhoI фрагмент плазмиды pBR322, включающий ген β-лактамазы (bla), определяющий устойчивость бактериальных клеток к ампициллину; участок инициации репликации (ori);
- ROP ген, регулирующий копийность плазмиды;
- XhoI/EcoRI фрагмент, представляющий собой гибридный Tac-промотор транскрипции;
- EcoRI/HindIII фрагмент, содержащий искусственный ген, в котором нуклеотидная последовательность соответствует SEQ ID NO:12;
- HindIII/BglII фрагмент, содержащий терминатор оперона рибосомальных РНК rrnB, транскрипционный репрессор LacI, регулирующий транскрипцию Tac-промотора,
- уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: EcoRI - 115, BamHI – 176, SpeI – 438, HindIII – 444, BglII – 1872, NdeI – 2476, AatII – 4468.
2. Штамм Escherichiacoli BL21/pF265 - продуцент гибридного полипептида с последовательностью проинсулина человека, при этом штамм получен путем трансформации клеток штамма E.coli BL21 рекомбинантной плазмидной ДНК pF265 по п. 1.
3. Гибридный полипептид проинсулина человека, в котором последовательность MetLeuTyrTyrGluGlyLeuGlnAsp фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер GlyHis6GlySerArg с последовательностью проинсулина человека, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, включающий аминокислотную последовательность SEQ ID NO: 13.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pHINS11, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК-ПРЕДШЕСТВЕННИК ИНСУЛИНА ЧЕЛОВЕКА, КЛЕТКА Escherichia coli, ТРАНСФОРМИРОВАННАЯ РЕКОМБИНАНТНОЙ ПЛАЗМИДНОЙ ДНК pHINS11, ШТАММ БАКТЕРИЙ Escherichia coli JM109/pHINS11 - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА-ПРЕДШЕСТВЕННИКА ИНСУЛИНА ЧЕЛОВЕКА И СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНА ЧЕЛОВЕКА | 2006 |
|
RU2354702C2 |
| ШТАММ БАКТЕРИЙ Escherichia coli JM109/pHINS21 - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА С ПРОИНСУЛИНОМ ЧЕЛОВЕКА И СПОСОБ ПОЛУЧЕНИЯ ПРОИНСУЛИНА ЧЕЛОВЕКА | 2007 |
|
RU2376368C2 |
| US 8507221 B2, 13.08.2013. | |||
Авторы
Даты
2020-07-30—Публикация
2019-05-24—Подача