Область техники
Настоящее изобретение относится к области медицинских устройств, предназначенных для контакта с живыми клетками или тканью, в частности, к имплантатам для имплантации в живую ткань, и к способам получения таких медицинских устройств.
Уровень техники
Для любого типа медицинских устройств, предназначенных для контакта с живой тканью, биологическая совместимость является важным вопросом. Риск реакции на чужеродные тела, образования тромбов и возникновения инфекции, наряду с другими проблемами, должны быть оценены и минимизированы, чтобы избежать отрицательных эффектов, как местных, так и относящихся ко всему организму, которые в противном случае могут негативно сказаться на здоровье пациента и/или привести к неэффективности устройства. Это в особенности относится к постоянным имплантатам.
Заживление или регенерация ткани вокруг имплантата часто жизненно важно, чтобы сохранить имплантат и его работоспособность, в частности, для долговечных имплантатов. Это особенно важно для несущих нагрузку имплантатов, таких как зубы или ортопедические имплантаты.
Зубные имплантационные системы широко используют для замены поврежденных или утраченных натуральных зубов. В таких имплантационных системах зубной фиксатор (винт), обычно выполненный из титана или титанового сплава, устанавливают в челюстную кость пациента, чтобы заменить корень натурального зуба. Затем к фиксатору прикрепляют конструкцию абатмента, чтобы создать штифт для части протезируемого зуба, выступающей из костной ткани через десну в ротовую полость пациента. На указанный абатмент в конечном итоге можно установить протез или коронку.
Для зубных фиксаторов необходимо сильное скрепление между костной тканью и имплантатом. Для имплантатов, предназначенных для контакта с мягкой тканью, таких как абатменты, которые должны быть частично расположены в мягкой десневой ткани, совместимость является также важной для полного функционирования имплантата. Обычно после имплантации зубной имплантационной системы абатмент частично или полностью окружен десневой тканью. Желательно, чтобы десневая ткань заживлялась быстро и вплотную вокруг имплантата, как по медицинским, так и по эстетическим соображениям. Непроницаемое уплотнение между слизистой оболочкой полости рта и зубным имплантатом служит в качестве барьера для микробной среды ротовой полости и является решающим для удачной имплантации. Это особенно важно для пациентов с плохой гигиеной полости рта и/или недостаточным качеством костной ткани или слизистой оболочки. Плохое заживление или плохое скрепление между мягкой тканью и имплантатом повышает риск возникновения инфекции и периимплантита, что в конечном итоге может привести к резорбции костной ткани и отторжению имплантата.
Существует несколько приемов повышения шансов успешной имплантации медицинского устройства, например, увеличение скорости образования новой ткани и/или, в случаях, когда желательно обеспечить соединение ткань-имплантат, увеличение скорости прикрепления ткани к поверхности имплантата, или снижение риска возникновения инфекции. Ускорения образования новой ткани можно достичь, например, путем различной модификации поверхности и/или осаждения биоактивных агентов на поверхность.
В настоящее время риск возникновения инфекции в связи с зубными имплантатами в первую очередь предупреждают превентивными мерами, такими как поддержание хорошей гигиены полости рта. После образования биопленки на поверхности зубного имплантата, ее трудно удалить путем нанесения бактерицидных агентов. В случае возникновения инфекции в костной или мягкой ткани, окружающей имплантат (периимплантит), основной операцией является механическая санация, иногда в сочетании с обработкой антибиотиками, антисептиками и/или ультразвуковой или лазерной обработкой.
Следовательно, в технике существует потребность в улучшенных комплексах мер для обработки или предотвращения инфекции, не только в связи с зубными имплантатами, но и в связи с любым типом имплантатов или другого медицинского устройства, предназначенного для контакта с живой тканью.
Краткое описание изобретения
Целью настоящего изобретения является по меньшей мере частичное преодоление проблем известного уровня техники. В частности, целью изобретения является обеспечение медицинского устройства, которое снижает риск пагубной инфекции, вызываемой микробами.
В одном аспекте этих и других целей достигают с помощью медицинского устройства, содержащего поверхность, предназначенную для контакта с живой тканью, причем указанная поверхность включает наночастицы, содержащие нетоксичный постпереходный металл, такой как галлий и/или висмут, и имеющие средний размер 500 нм или менее. Наличие нетоксичного постпереходного металла обеспечивает бактерицидные свойства. Следовательно, риск возникновения инфекции в месте имплантации может быть снижен. Более того, покрытие из наночастиц позволяет обеспечить требуемые поверхностные свойства с точки зрения электрохимических свойств и шероховатости поверхности и, поскольку наночастицы малы, пористость покрытия из наночастиц ограничена, что снижает риск проникновения микробов через поверхность. Кроме того, полагают, что покрытие из наночастиц, включающих нетоксичный постпереходный металл, можно изменять, например, в отношении толщины слоя, так, чтобы обеспечить определенное окрашивание, которое может быть чрезвычайно желательным в определенных областях применения, например, для зубных имплантатов.
Термин «постпереходный» металл в общем относится к металлическим элементам, расположенным в 13-16 группах и 3-6 периодах Периодической таблицы. Постпереходные металлы 13-15 групп и 3-6 периодов являются предпочтительными.
В воплощениях изобретения используемые постпереходные металлы являются нетоксичными. Как используют в данном описании, «нетоксичные» означает, что рассматриваемое вещество (например, соединение или элемент) не повреждает клетки млекопитающих, при концентрациях, которые оказывают смертельное действие на бактериальные клетки.
Более того, постпереходный металл, используемый в настоящем изобретении, обычно оказывает противомикробный или бактерицидный эффект. Постпереходные металлы, которые считают обладающими некоторым противомикробным или бактерицидным эффектом (включая любой олигодинамический эффект), включают по меньшей мере галлий, олово, свинец и висмут.
В свете вышеизложенного, в изобретении можно использовать по меньшей мере один нетоксичный постпереходный металл противомикробного действия, который предпочтительно выбирают из галлия и висмута.
В воплощениях изобретения наночастицы могут включать соединение нетоксичного постпереходного металла. Как используют в данном описании, термин «соединение постпереходного металла» относится к химическому соединению, включающему по меньшей мере один постпереходный металл и по меньшей мере один дополнительный элемент. Неограничивающие примеры таких соединений включают оксиды, содержащие постпереходные металлы, нитриды, содержащие постпереходные металлы, сплавы по меньшей мере одного постпереходного металла и соли, содержащие постпереходные металлы. Соединение может включать два или более постпереходных металлов. Термин «соединение(я) постпереходного металла» также относится к соединениям, включающим один или более других металлов, в частности биосовместимые металлы, такие как титан, в дополнение к одному или более постпереходных металлов. Нетоксичный постпереходный металл и по меньшей мере один дополнительный элемент могут быть связаны посредством ковалентной связи или ионной связи.
В воплощениях изобретения нетоксичный постпереходный металл выбирают из висмута и галлия. Соединение(я) нетоксичного постпереходного металла можно выбирать из соединения(ий) висмута и соединения(ий) галлия.
В воплощениях изобретения наночастицы могут включать соединение галлия. Соединение галлия может быть выбрано из группы, состоящей из оксида галлия, нитрида галлия, оксидов металлов, содержащих галлий, и нитридов металлов, содержащих галлий. В воплощениях изобретения наночастицы могут включать элементарный висмут или соединение висмута. В частности, соединение висмута выбирают из группы, состоящей из оксида висмута, нитрида висмута, оксидов металлов, содержащих висмут, и нитридов металлов, содержащих висмут.
Термин «соединение галлия» также включает соединения, содержащие один или более других металлов, помимо галлия, в частности, титан и/или висмут. Таким образом, оксиды титана и галлия, нитриды титана и галлия и т.д. охватывает определение «соединение галлия». Термин «оксиды металлов, содержащие галлий», означает оксид, возможно содержащий один или более дополнительных элементов, помимо галлия и кислорода, например, металл, такой как титан. Примеры «оксидов, содержащих галлий», включают оксид галлия, оксид галлия и титана, оксид галлия и висмута и т.д.
Аналогично, термин «соединение висмута» относится к химическому соединению, содержащему висмут и по меньшей мере один дополнительный элемент. Неограничивающие примеры соединений висмута включают оксид висмута, нитрид висмута, оксиды металлов, содержащие висмут, и нитриды металлов, содержащие висмут. Термин «соединение висмута» также охватывает соединения, содержащие другие металлы, помимо висмута, в частности, титан и/или галлий. Таким образом, оксиды висмута и титана, нитриды висмута и титана и т.д. охватывает определение «соединение висмута». Более того, под термином «оксиды металлов, содержащие висмут», понимают оксиды, возможно содержащие один или более дополнительных элементов, помимо висмута и кислорода, например, металл, такой как титан или галлий. Таким образом, примеры «оксидов, содержащих висмут», включают оксид висмута, а также оксид висмута и титана, оксид галлия и висмута и т.д.
В воплощениях изобретения наночастицы могут иметь средний размер 300 нм или менее, 250 нм или менее, 200 нм или менее, например, 100 нм или менее, такой как 50 нм или менее, 30 нм или менее, или 25 нм или менее.
В воплощениях изобретения поверхность также может включать наночастицы диоксида титана со средним размером 100 нм или менее, например, 50 нм или менее, таким как 30 нм или менее. Оксид титана является инертным, биологически совместимым материалом и поверхностный слой, включающий частицы диоксида титана, позволяет обеспечить требуемые свойства поверхности в отношении электрохимических свойств и шероховатости поверхности.
В воплощениях изобретения наночастицы могут образовывать слой. Такой слой может иметь толщину от 8 нм до приблизительно 1 мкм, обычно от 50 нм до 500 нм, например, от 100 нм до 400 нм. Такой слой может быть монослоем из наночастиц. Более того, слой может представлять собой непрерывный слой из наночастиц. Обычно слой может полностью покрывать поверхность расположенной под ним основы. Наночастицы могут быть равномерно распределены по всему слою.
Обычно медицинское устройство включает основу с поверхностью, на которую нанесены наночастицы. В воплощениях изобретения основа может включать металл или сплав, например, титан, цирконий, гафний, ванадий, ниобий, тантал, кобальт или иридий, или их сплавы, в частности титан или титановый сплав. В воплощениях изобретения основа может включать керамический материал, который может быть выбран из оксида титана, нитрида титана, оксида циркония и их сочетаний.
В воплощениях изобретения часть основы, которая находится в контакте с наночастицами, может включать оксид титана, в частности естественный оксид титана.
В воплощениях изобретения основа может являться небиорассасывающейся.
Обычно медицинское устройство предназначено для имплантации по меньшей мере частично в живую ткань. Например, медицинское устройство может представлять собой зубной имплантат, такой как зубной штифт, предназначенный для внедрения, по меньшей мерее частично, в живую костную ткань, или зубной абатмент, предназначенный для контакта с живой мягкой тканью. Альтернативно, медицинское устройство может представлять собой ортопедический имплантат. В других воплощениях медицинское устройство может представлять собой фиксируемый на кости слуховой аппарат или его часть.
В воплощениях изобретения медицинское устройство может представлять собой стент. В других воплощениях медицинское устройство может представлять собой шунт.
В другом аспекте, в изобретении обеспечивают способ получения медицинского устройства, включающий следующие стадии:
а) обеспечение основы, содержащей поверхность;
б) обеспечение дисперсии наночастиц, включающих нетоксичный постпереходный металл, такой как галлий и/или висмут, причем наночастицы дисперигруют в растворителе, и наночастицы имеют средний размер менее 500 нм, например, менее 100 нм или менее 50 нм, и
в) нанесение дисперсии наночастиц на поверхность основы.
Наночастицы могут быть полностью диспергированы в растворителе. Такая монодисперсия обеспечивает улучшенное регулирование операции нанесения покрытия и позволяет наносить непрерывный, гомогенный слой, даже монослой из наночастиц на поверхность.
Например, дисперсию можно наносить на поверхность посредством центрифугирования.
В воплощениях изобретения поверхность основы перед стадией (в) может быть подвергнута обработке для придания ей шероховатости, такой как абразивная струйная обработка и/или химическое травление.
В воплощениях изобретения способ может дополнительно включать одну или более чем одну стадию, обеспечивающую испарение растворителя и/или спекание наночастиц. Спекание слоя наночастиц позволяет улучшить прикрепление наночастиц к основе. Спекание наночастиц может привести к образованию керамического слоя или подобного керамическому слоя.
В другом аспекте, в изобретении обеспечивают способ имплантации медицинского устройства в живой организм человека или животного, включающий:
а) обеспечение медицинского устройства, как описано выше, и
б) имплантацию медицинского устройства в живой организм человека или животного, причем медицинское устройство располагают так, что по меньшей мере часть поверхности, включающей наночастицы, содержащие нетоксичный постпереходный металл, контактирует с живой тканью.
Имплантация настоящего медицинского устройства в живую ткань с обеспечением контакта с тканью поверхности, включающей наночастицы, позволяет снизить риск микробной, в частности, бактериальной инфекции ткани. Избегая инфекции, повышают шансы успешной имплантации, особенно для пролонгированных и/или долгосрочных периодов имплантации.
Следует отметить, что изобретение относится ко всем возможным сочетаниям признаков, указанных в формуле изобретения.
Краткое описание чертежей
На Фиг. 1a-b представлены изображения поверхности основы без наночастиц, выполненные посредством сканирующей электронной микроскопии (СЭМ) с различным увеличением.
На Фиг. 2a-b представлены изображения поверхности основы, покрытой наночастицами оксида висмута, в соответствии с воплощениями изобретения, выполненные посредством сканирующей электронной микроскопии (СЭМ) с различным увеличением.
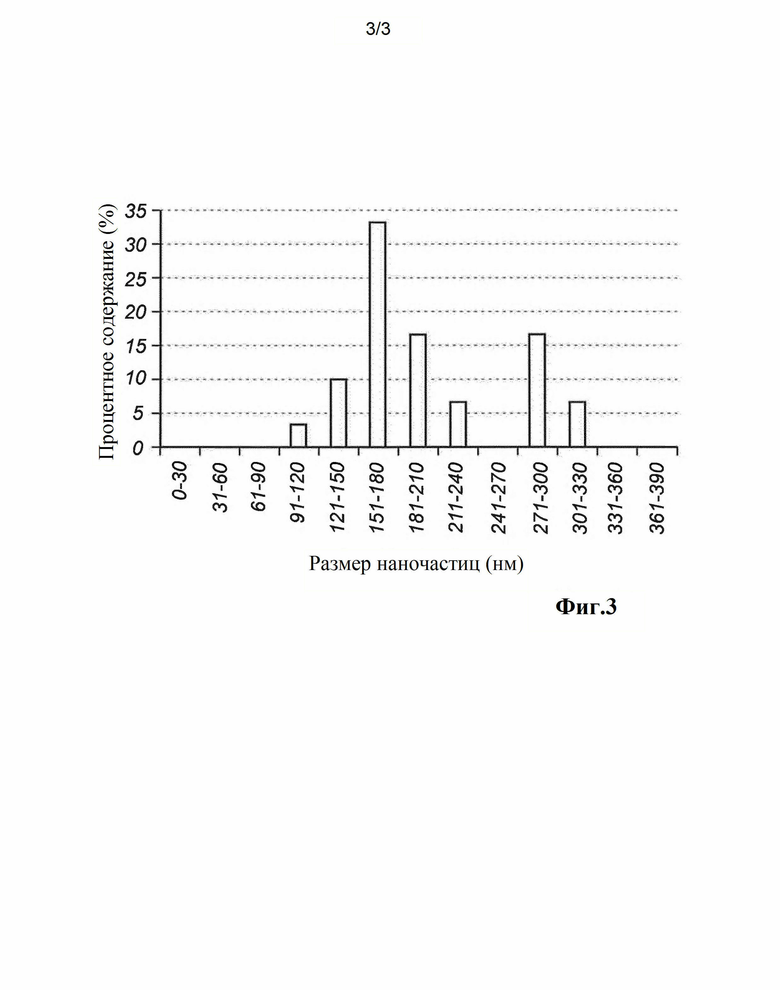
На Фиг. 3 показана зависимость, представляющая распределение по размерам наночастиц оксида висмута, используемых в воплощениях изобретения.
Подробное описание изобретения
В соответствии с настоящим изобретением, наночастицы, содержащие нетоксичный постпереходный металл, такой как галлий и/или висмут, например, в форме оксида (оксидов) или нитрида (нитридов), могут быть нанесены на поверхность медицинского устройства с получением поверхности, обладающей противомикробными свойствами. Поверхность медицинского устройства, включающая наночастицы, обычно является поверхностью, предназначенной для контакта с живой тканью.
Термин «нетоксичный постпереходный металл» в общем относится к металлическим элементам 13-16 групп и 3-6 периодов Периодической таблицы. Обычно алюминий, галлий, индий, таллий, олово, свинец, висмут и полоний относят к постпереходным металлам. В отличие от этого, переходными металлами являются элементы 3-12 группы. Германий и сурьму относят не к постпереходным металлам, а к металлоидам.
16 группа Периодической таблицы содержит только один постпереходный металл - полоний, который является токсичным. Следовательно, в настоящем изобретении, постпереходные металлы 13-15 групп и 3-6 периодов являются предпочтительными.
В воплощениях изобретения используемые постпереходные металлы, являются нетоксичными.
Как используют в данном описании, «нетоксичный» означает, что рассматриваемое вещество (например, соединение или элемент), не повреждает клетки млекопитающих при концентрациях, которые оказывают смертельное действие на бактериальные клетки.
Примеры постпереходных металлов, которые являются токсичными, включают таллий (Tl), свинец (Pb) и полоний (Po). Другие постпереходные металлы (например, индий (In) и олово (Sn)) можно считать нетоксичными в форме чистого металла, но они могут быть токсичными в других формах, или когда они образуют соединения с другими элементами.
Нетоксичные постпереходные металлы, используемые в настоящем изобретении, обычно являются нетоксичными, когда присутствуют в элементарной форме и/или в виде ионов металлов и/или в виде одного из соединений, приведенных в качестве примера в данном описании.
Более того, постпереходный металл, используемый в настоящем изобретении, обычно оказывает противомикробный или бактерицидный эффект. Элементы, известные как обладающие противомикробными свойствами, включают, например, Ga, Bi, Ag, Zn, Au, Pt, Pd, Ir, Cu, Sn и Sb. Постпереходные металлы, которые считают обладающими некоторым противомикробным или бактерицидным эффектом (включая любой олигодинамический эффект), включают по меньшей мере галлий (Ga), олово (Pb) и висмут (Вi).
С учетом вышеизложенного, в медицинском устройстве в соответствии с воплощениями изобретения можно использовать по меньшей мере один нетоксичный постпереходный металл противомикробного действия, который может быть выбран из галлия и висмута.
Галлий используют в медицине по меньшей мере с 1940-х годов, главным образом в качестве радиоактивного агента для медицинской визуализации. Бактерицидные свойства галлия изучены в ряде исследований. Галлий действует посредством нарушения метаболизма железа. Можно предположить, что галлий также эффективен против других микробов, например, грибков, таких как дрожжи или плесневые грибы.
Известно, что висмут обладает бактерицидным действием. Ранее висмут использовали для лечения сифилиса и в настоящее время используют субсалицилат висмута и субцитрат висмута для лечения язвы желудка и двенадцатиперстной кишки, вызываемой Helicobacter pylori. Механизм действия данного вещества еще не до конца понятен. Биброкатол представляет собой органическое соединение, содержащее висмут, которое используют для лечения глазных инфекций, а субсалицилат висмута и субкарбонат висмута используют в качестве компонентов фармацевтических противодиарейных препаратов.
В Директивном документе 2007/47/ec медицинское устройство определено как «любой прибор, аппарат, приспособление, программное обеспечение, материал или другое изделие, используемое отдельно или в сочетании, включая программное обеспечение, предназначенное его изготовителем для использования специально в диагностических и/или терапевтических целях и необходимое для его надлежащего применения, предназначенное производителем для использования для человека». В контексте настоящего изобретения рассматриваются только медицинские устройства, предназначенные для контакта с живой тканью, т.е. любой прибор, аппарат, приспособление, программное обеспечение, материал или другое изделие физического характера, предназначенное для нанесения, внедрения, имплантации или иного приведения в контакт с телом, частью тела или органом. Кроме того, в контексте настоящего изобретения указанное тело, часть тела или орган может быть таковым, принадлежащим человеку или животному, обычно млекопитающему. Однако предпочтительно медицинское устройство предназначено для человека. Медицинские устройства, попадающие под приведенное выше определение, представляют собой, например, имплантаты, катетеры, шунты, трубки, стенты, внутриматочные устройства и протезы.
В частности, медицинское устройство может быть медицинским устройством, предназначенным для имплантации в живую ткань или для внедрения в тело или часть тела пациента, включая внедрение в полость тела.
Настоящее медицинское устройство может быть предназначено для кратковременного, пролонгированного или долгосрочного контакта с живой тканью. «Кратковременный» контакт означает продолжительность контакта менее 24 часа, в соответствии с определениями, приведенными в ISO 10993-1 для биологической оценки медицинских устройств. Кроме того «пролонгированный» контакт в соответствии с данным стандартом относится к продолжительности контакта от 24 ч до 30 суток. Соответственно, согласно этому же стандарту, «долгосрочный» контакт означает продолжительность контакта более 30 суток. В некоторых воплощениях изобретения медицинское устройство по изобретению может представлять собой постоянный имплантат, который должен оставаться в течение месяцев, лет или даже в течение всей жизни в теле пациента.
Как используют в данном описании, термин «имплантат» охватывает любое устройство, по меньшей мере часть которого предназначена для имплантации в организм позвоночного животного, в частности млекопитающего, такого как человек. Имплантаты можно использовать для замены анатомических элементов и/или восстановления любой функции тела. В общем, имплантат состоит из одной или нескольких частей имплантата, например, зубной имплантат обычно включает зубной фиксатор, сопряженный со вторичными частями имплантата, такими как абатмент и/или восстановленный зуб. Однако любое устройство, такое как зубной фиксатор, предназначенное для имплантации, можно отдельно отнести к имплантату, даже если к нему должны быть присоединены другие части.
«Биосовместимый» означает материал или объект, который, при контакте с живой тканью сам по себе не вызывает неблагоприятную биологическую реакцию (например, раздражение или другие иммунологические реакции) живой ткани.
«Небиорассасывающийся» означает материал или объект, который не разрушается полностью химически и/или биологически после внедрения в живой организм, даже в течение периода до нескольких лет. Небиорассасывающееся медицинское устройство может содержать вещества, которые высвобождаются в тело пациента после имплантации, но в таком случае основная конструкция медицинского устройства остается неповрежденной. Например, любое медицинское устройство, включающее металлическую или керамическую основу, является небиорассасывающимся.
«Мягкая ткань» означает любой тип ткани, в частности, типы тканей млекопитающих, отличные от костной или хрящевой ткани. Примеры мягкой ткани, для которой подходит настоящее медицинское устройство, включают, но не ограничены перечисленным, соединительную ткань, волокнистую ткань, эпителиальную ткань, сосудистую ткань, мышечную ткань, слизистую оболочку и кожу.
В данном описании термин «наночастицы» относится к частицам со средним размером 500 нм или менее, который обычно измеряют с помощью просвечивающей электронной микроскопии (ПЭМ) или динамического рассеяния света (ДРС).
Медицинское устройство по настоящему изобретению обычно включает основу с поверхностью, предназначенной для контакта с живой тканью, и по меньшей мере часть указанной поверхности включает описанные в данной заявке наночастицы.
В воплощениях изобретения основа может включать металлический материал. Обычно основа включает тело, по меньшей мере частично сформированное из металлического материала. Металлический материал может быть выбран из титана, циркония, гафния, ванадия, ниобия, тантала, кобальта и иридия, и их сплавов. Поверхность основы, которая находится в контакте с наночастицами, например, может включать оксид титана, в частности, в воплощениях, в которых основа включает или сформирована из титана. В таких воплощениях оксид титана может быть естественным оксидом титана, который естественным образом и моментально образуется на поверхности титана при контакте с кислородом, например, на воздухе. В воплощениях, в которых подложка включает или сформирована из другого металлического материала, указанного выше, поверхность этого материала, находящая в контакте с наночастицами, обычно включает естественный оксид соответствующего металла, указанного выше.
В других воплощениях, основа может включать неметаллический материал, такой как биосовместимый керамический материал, например, оксид циркония или биосовместимый полимерный материал. Подходящие материалы известны специалисту в данной области техники. В таких воплощениях основа может быть сформирована из керамического материала или из полимерного материла. В случае полимерного материала, обычно, но не обязательно, он не является биоразлагаемым.
Наночастицы могут содержать висмут, элементарный или в форме соединения, или соединение галлия. Обычно наночастицы содержат по меньшей мере одно соединение, выбранное из оксида галлия, нитрида галлия, оксида висмута, нитрида висмута, элементарного висмута и сочетаний этих материалов с другими элементами, обычно металлами.
Например, наночастицы могут представлять собой наночастицы металла, например, наночастицы висмута или галлия и/или висмута, смешанные с одним или более чем одним другим металлом. Альтернативно, наночастицы могут представлять собой наночастицы оксида металла, например, наночастицы оксида галлия или наночастицы оксида висмута, или наночастицы смешанного оксида металла (включающего по меньшей мере один элемент, выбранный из висмута и галлия), например, допированные висмутом или галлием наночастицы оксида титана. Альтернативно, наночастицы могут представлять собой наночастицы нитрида металла, например, наночастицы нитрида галлия.
Отдельная наночастица может в основном состоять из элементарного постпереходного металла, в частности, элементарного висмута, или соединения нетоксичного постпереходного металла, такого как соединение галлия или висмута, например, из оксида галлия, нитрида галлия, оксида висмута или нитрида висмута. В данном случае, выражение «в основном состоит из» означает, что наночастицы состоят из элемента или соединения, но допустимы небольшие количества примесей, например, меди, кремния и т.д., которые могут присутствовать при общем содержании, например, до 10 ат. %, таком как до 5 ат. % или до 2 ат. %, и обычно по меньшей мере менее 1 ат. %, исходя из химического состава наночастиц. Следовательно, в воплощениях, в которых наночастицы в основном состоят из нетоксичного постпереходного металла или соединения нетоксичного постпереходного металла, например, висмута, или соединения висмута, или соединения галлия, содержание нетоксичного постпереходного металла или соединения нетоксичного постпереходного металла составляет по меньшей мере 90 ат. % (включая элемент или элементы, отличные от нетоксичного постпереходного металла в случае соединения), обычно, по меньшей мере 95 ат. %, а более предпочтительно, по меньшей мере 98 ат. % или даже 99 ат. %. В данном случае, термин «примеси» относится к нежелательным элементам и соединениям, содержащимся в наночастице. Такие примеси могут не удаляться простой очисткой. В отличие от этого, поверхностное загрязнение, например, углеродом, который может быть удален очисткой наночастиц и удерживанием их в атмосфере с регулируемыми параметрами, например, в воде, не считают примесью в пределах вышеприведенного определения. Загрязнение углеродом поверхности наночастиц может привести к высокой атомной концентрации углерода (например, до 30 ат. %); однако, тем не менее, наночастицы могут в основном состоять из указанного нетоксичного постпереходного металла или соединения нетоксичного постпереходного металла.
В некоторых воплощениях отдельная наночастица может содержать более одного нетоксичного постпереходного металла, например, как висмут, так и галлий, и/или в форме нитрида, а также оксида. В других воплощениях, наночастицы, в основном состоящие из любого материала, выбранного из оксида галлия, нитрида галлия, элементарного висмута, оксида висмута или нитрида висмута, можно использовать в сочетании по меньшей мере с одним другим типом наночастиц, состоящих из любого другого материала, выбранного из оксида галлия, нитрида галлия, элементарного висмута, оксида висмута или нитрида висмута. Наночастицы, в основном состоящие из соединений висмута или галлия, также можно смешивать с наночастицами, содержащими как висмут, так и галлий в одной наночастице.
В общем, по меньшей мере один нетоксичный постпереходный металл, в частности, галлий и/или висмут, может присутствовать в наночастицах, обычно в количестве от 5 ат. % до 50 ат. %, например, от 10 ат. % до 50 ат. % или от 10 ат. % до 40 ат. % или от 15 ат. % до 40 ат. %. В случае использования элементарного висмута, содержание висмута в наночастицах может составлять от 5 ат. % до 100 ат. %.
В других воплощениях изобретения отдельная наночастица может включать титан или соединение титана (например, оксид или нитрид), помимо галлия и/или висмута. В таких воплощениях содержание галлия или висмута в наночастицах может быть ниже, например, от 5 до 15 ат. %.
Также предусмотрено использование одного или более дополнительных типов наночастиц в сочетании с одним или более типами содержащих галлий или висмут наночастиц; в одном воплощении можно использовать дополнительные наночастицы, содержащие, например, металл или соединение металла или в основном состоящие из металла или соединения металла. Предпочтительные примеры включают соединения титана, такие как оксид титана и нитрид титана.
Поверхностный слой нанесенных наночастиц может иметь атомное содержание висмута и/или галлия в тех же диапазонах, как указано выше для наночастиц как таковых. Следовательно, медицинское устройство может включать основу с поверхностным слоем, имеющим содержание галлия и/или висмута от 5 ат. % до 50 ат. % (до 100 % в случае наночастиц, состоящих из элементарного висмута), например от 10 ат. % до 50 ат. %, или от 10 ат. % до 40 ат. %, или от 15 ат. % до 40 ат. %.
Наночастицы в соответствии с воплощениями изобретения обычно имеют средний размер 500 нм или менее. В воплощениях изобретения наночастицы могут иметь средний размер 300 нм или менее, 200 нм или менее, 100 нм или менее, 50 нм или менее, такой как 30 нм или менее. Например, средний размер наночастиц может составлять от 10 до 500 нм, например, от 20 до 300 нм, от 50 до 250 нм или от 50 до 200 нм.
В воплощениях изобретения наночастицы могут иметь такое распределение по размерам, что по меньшей мере 50 % наночастиц имеют средний размер от 50 до 250 нм.
В одном воплощении в соответствии с настоящим изобретением, медицинское устройство представляет собой зубной абатмент, предназначенный для внедрения по меньшей мере частично в десневую ткань. Абатмент включает тело основы, имеющее внешнюю поверхность. По меньшей мере часть внешней поверхности предназначена для контакта с десневой тканью (поверхность контакта с мягкой тканью) и включает описанные здесь наночастицы. Наночастицы, присутствующие на поверхности, могут придавать поверхности желаемую окраску, в частности, в случае применения в стоматологии. Цвет осажденного слоя наночастиц может зависеть от толщины слоя.
При нанесении тонкого, относительно однородного слоя наночастиц на поверхность медицинского устройства могут быть получены свойства поверхности, отличные от таких свойств, получаемых в случае нанесения не состоящего из частиц слоя или покрытия такого же химического состава и с такой же степенью кристалличности, где объемные свойства материала являются более доминирующими. Например, показано, что мелкие наночастицы имеют более высокий поверхностный заряд по сравнению с более крупными аналогами (Zareen Abbas, Christophe Labbez, Sture Nordholm and Elisabet Ahlberg., J.Phys.Chem. C 2008, 112, 5715-5723). Полагают, что это может оказывать влияние на образование апатита, а также на адсорбцию белков и клеток на поверхности, покрытой такими наночастицами.
Обычно наночастицы имеют по существу сферическую форму, хотя возможна до некоторой степени неравномерная морфология.
В воплощениях изобретения, в которых галлий и/или висмут присутствует в виде оксида, этот оксид может по меньшей мере частично находиться в кристаллической форме.
Наночастицы позволяют обеспечить нанопористый слой на поверхности медицинского устройства. Наночастицы могут быть плотно упакованы на поверхности, что приводит к образованию слоя с собственной пористостью, составляющей от 0,225*R для монослоев или от 0,732*R для многослойной структуры, где R представляет собой радиус наночастиц. Многослойная структура, т.е. слой, включающий более одной наночастицы в направлении, перпендикулярном к поверхности, на которой присутствуют наночастицы, может иметь более высокую пористость вследствие несовпадения упаковки наночастиц. Пористая природа слоев приводит к увеличенной площади поверхности раздела по сравнению с поверхностью без наночастиц. Более того, наночастицы также обеспечивают более высокую площадь электрохимически активной поверхности, поскольку электролит может проникать в пористую структуру. Таким образом, структура с наночастицами, которая образует внешнюю поверхность медицинского устройства, может быть более реакционно-способной и может обладать электронными свойствами, отличными от таких свойств поверхности без наночастиц или поверхности, содержащей покрытие из частиц большего размера, чем наночастицы, используемые в настоящем изобретении.
Кроме того, также обнаружено, что электронные свойства оксидной пленки, прокрывающей поверхность костного имплантата, оказывают большее влияние на прикрепление клеток и образование центров кристаллизации апатита, чем в случае незначительных изменений топографии, и что менее изолирующая оксидная пленка может быть предпочтительной, например, для титановых зубных имплантатов. Более того, слой наночастиц, как используют в воплощениях настоящего изобретения, может иметь такую малую пористость, которая не позволяет бактериям проникать внутрь слоя и/или накапливаться в нем.
Как указано выше, в некоторых воплощениях поверхность может дополнительно включать наночастицы, содержащие другой металл или соединение металла, помимо наночастиц, содержащих галлий и/или висмут. Указанный другой металл или соединение металла может представлять собой диоксид титана. Оксид титана может состоять и главным образом из анатаза (по меньшей мере 50 % анатаза). Однако также можно использовать другие оксиды металлов, возможно в сочетании с диоксидом титана. В воплощениях изобретения дополнительные наночастицы могут включать (i) наночастицы, в основном состоящие из диоксида титана, а также возможно (ii) наночастицы, в основном состоящие из оксида одного или более металлов, выбранных из группы, состоящей из циркония, гафния, ванадия, ниобия, тантала, кобальта и иридия, причем оксиды циркония и/или иридия являются особенно предпочтительными. При смешивании наночастиц титана с наночастицами одного или более вышеуказанных оксидов можно получить различные свойства образованного слоя, например, в отношении цвета, прочности и/или электронных свойств. Например, в сочетании с наночастицами диоксида титана, наночастицы оксида иридия можно использовать для улучшения электронных свойств слоя. Получение наночастиц оксида титана, а также определение их характеристик и их осаждение, описаны в неопубликованной европейской заявке на патент №11165686.4, поданной 11 мая 2011 г, которая включена в данный документ посредством ссылки.
В воплощениях изобретения наночастицы образуют слой по меньшей мере на части поверхности медицинского устройства. Таким образом, поскольку поверхность медицинского устройства предназначена для контакта с живой тканью, наночастицы предназначены для нахождения в контакте с живой тканью, в частности, костной или мягкой тканью.
В воплощениях изобретения образованный наночастицами слой может иметь толщину от 8 нм до приблизительно 1 мкм, обычно от 50 нм до 500 нм, например, от 100 нм до 400 нм. Тонкие слои являются предпочтительными из-за лучшей адгезии к поверхности основы. Также, в случае спеченного слоя наночастиц, описанного ниже, такие тонкие слои могут иметь более высокую прочность, чем более толстые слои. Слой может представлять собой монослой из наночастиц. Таким образом, нижний предел толщины слоя приблизительно равен размеру наночастиц. Тонкий слой из наночастиц снижает шероховатость поверхности на субмикронном уровне, при этом сохраняя шероховатость поверхности в более крупном масштабе (уровень дробеструйной обработки). Такая топография поверхности может иметь преимущество для долгосрочной остеоинтеграции костного имплантата.
В воплощениях изобретения слой наночастиц может иметь среднюю высоту поверхности (Sa) от 5 нм до 150 нм, например, от 5 до 50 нм.
Слой может представлять собой непрерывный слой наночастиц, который может покрывать по меньшей мере часть поверхности. Термин «непрерывный слой» означает связанный слой, образующий единую область. В противоположность непрерывному слою, может быть получен несплошной слой, состоящий из отдельных областей. В воплощениях изобретения наночастицы могут образовывать слой, который полностью покрывает поверхность медицинского устройства.
В воплощениях изобретения наночастицы однородно распределены по всему слою.
В воплощениях изобретения наночастицы могут быть подвергнуты спеканию. Бережное спекание слоя наночастиц позволяет улучшить прикрепление наночастиц к основе. Спекание наночастиц может привести к получению керамического или подобного керамическому слоя. Однако наночастицы также можно не подвергать спеканию.
Наночастицы, включающие висмут и/или галлий, могут быть получены известными способами. Получение монодисперсных наночастиц висмута описано в Yu et al., J. Am. Chem. Soc. (2001) 123:9198-9199. Получение наночастиц оксида галлия описано в Krajczyk et al., J. Microscopy (2006) 223:231-233, и получение монодисперсных наночастиц оксида висмута описано в Li et al., Mater. Chem. Phys. (2006) 99:174-180. Получение висмута, допированного наночастицами оксида титана описано в Lv et al., J. Hazardous Mater. (2009) 161:396-40. Получение наночастиц нитрида галлия описано в Nyk et al., Mater. Sci. Semicon. Proces. (2005) 8:511-514. Предшественники галлия и/или висмута, описанные в вышеупомянутых документах, включают Ga2O3, Bi(NO3)3, BiCl3 и Bi-[N(SiMe3)2]3.
Медицинское устройство в соответствии с воплощениями изобретения может быть получено посредством
а) обеспечения биосовместимой основы с поверхностью;
б) обеспечения дисперсии наночастиц, содержащих нетоксичный постпереходный металл и имеющих средний размер менее 500 нм, при этом наночастицы диспергируют в растворителе; и
в) нанесения дисперсии наночастиц на поверхность основы.
В частности, наночастицы могут содержать соединение нетоксичного постпереходного металла, как описано выше, в частности, оксид или нитрид нетоксичного постпереходного металла, такой как оксид или нитрид галлия и/или висмута, как описано выше.
Обычно наночастицы имеют средний размер частиц 100 нм или менее, например, 50 нм или менее или 30 нм или менее.
В дисперсии, обеспечиваемой на стадии (б), наночастицы могут быть полностью диспергированы, и такие частицы также называют «монодиспергированными». В таких воплощениях на стадии (в) каждая наночастица, присутствующая в дисперсии, наносится на поверхность отдельно. Однако после нанесения на поверхность основы, наночастицы плотно прилегают друг к другу с получением плотно упакованной структуры.
Растворитель может представлять собой водный растворитель, например, деионизированную воду.
В воплощениях изобретения дисперсия наночастиц оксида металла может быть получена посредством
б-i) проведения регулируемого гидролиза галлиевого и/или висмутового предшественника с получением коллоидной дисперсии, и
б-ii) проведения диализа коллоидной дисперсии.
Стадию (б-i) обычно осуществляют посредством медленного, например, по капле, добавления предшественника в деионизированную воду. Гидролиз предшественника может быть выполнен при параметрах процесса (например, таких как температура, концентрация, рН, продолжительность процесса), отрегулированных в соответствии с известными химическими принципами, чтобы получить требуемый результат.
Дисперсию можно наносить на основу любым подходящим методом, в том числе центрифугированием, распылением, погружением, окунанием, с использованием золь-гель технологии, электрофоретическим осаждением и т.д.
В воплощениях изобретения способ дополнительно включает обеспечение возможности испарения растворителя после нанесения дисперсии.
При необходимости, способ может дополнительно включать стадию спекания наночастиц. В воплощениях изобретения также можно использовать двухстадийный способ, в котором наносят и спекают первый слой наночастиц, а затем наносят дополнительные наночастицы оксида металла, как описано выше, которые не подвергают спеканию. Таким образом можно реализовать преимущества как спеченных, так и неспеченных наночастиц.
В воплощениях изобретения поверхность основы может быть подвергнута обработке для придания шероховатости перед стадией (в). Примеры обработки для придания шероховатости включают струйную обработку абразивным материалом и химическое травление. Альтернативно, основу можно обрабатывать на токарном станке или подвергать обработке для снижения шероховатости, такой как полирование.
Примеры
Пример 1. Получение
Были изготовлены таблетки из титана (сорт 4) технической чистоты (т.ч.), и их подвергали очистке перед напылением покрытия из наночастиц оксида висмута (Bi2O3). Содержащие висмут наночастицы (торговое название продукта BI-OX-03-NP.200N, American Elements, США) диспергировали в ацетатном буфере с рН, равным 5,0. Очищенные таблетки закрепляли на вращающемся электроде. Скорость вращения электрода увеличивали, и таблетки погружали в ацетатный буфер, содержащий наночастицы оксида висмута, на 5 с. Скорость вращения снижали до 0 об/мин, и таблетки погружали в химический стакан с деионизированной водой на 5 с для удаления оставшихся несвязанных содержащих висмут наночастиц с поверхности. Таблетки сушили, а затем упаковывали в пластмассовые контейнеры и стерилизовали посредством облучения электронным пучком.
Пример 2. Определение характеристик поверхности
Для всех экспериментов по определению характеристик поверхности использовали образцы титана технической чистоты (т.ч.) и образцы с нанесенным методом центрифугирования покрытием из содержащих висмут наночастиц, полученных как описано в примере 1.
2а) Морфология поверхности и химия поверхности
Морфологию поверхности и химию поверхности исследовали с помощью средовой сканирующей электронной микроскопии (СЭМ) (XL30 ESEM, Philips, Нидерланды)/ энергодисперсионной спектроскопии (ЭДС) (Genesis System, EDAX Inc., США) при ускоряющем напряжении 30 кВ и 10 кВ для морфологии поверхности и химии поверхности, соответственно.
На Фиг. 1а и 1b представлен образец без покрытия при увеличении в 100 раз (Фиг. 1а) и 500 раз (Фиг. 1b), соответственно. Можно заметить следы механической обработки, а не частицы. В противоположность этому, на Фиг. 2а и b представлен образец с нанесенным покрытием при тех же увеличениях. Как можно увидеть на Фиг. 2а-b, образцы с покрытием частично, но не полностью покрыты диспергированными наночастицами.
Измеряли диаметр частиц Bi2O3 на поверхности образцов, и результаты сведены в таблицу 1. На Фиг. 3 также показано распределение частиц по размерам. Из-за ограниченного разрешения используемого технического оснащения, наночастицы мельче 115 нм трудно или невозможно определить и измерить. Таким образом, хотя в данном примере минимальный измеренный размер наночастиц составлял 115 нм, нельзя исключить наличие более мелких наночастиц.
Таблица 1. Размер наночастиц Bi2O3, измеренный с помощью СЭМ (n=3)
По данным анализа, концентрация висмута (Bi) на образцах с нанесенным центрифугированием покрытием из Bi2O3 составляла 5,1 атомных % (ат. %). Концентрации Bi в наночастицах, содержащих висмут, составляла 43,9 ат. % (см. таблицу 2). Кроме этого, были обнаружены следующие элементы: титан (Ti) и кислород (О). Глубину анализа с помощью данной методики оценивали равной приблизительно 1 мкм, т.е. она превышала толщину слоя наночастиц.
Таблица 2. Исследование с помощью ЭДС химии поверхности образцов с нанесенным центрифугированием покрытием и без покрытия, соответственно. Цифры представляют собой средние значения (n=9); стандартные отклонения приведены в скобках.
(ат. %)
* При исследовании с помощью ЭДС прибор показывал 10,6 ат. % N и 89,4 ат. % Ti, поскольку энергии возбуждения для Ti La (электронная оболочка) и N Ka (электронная оболочка), очень близки и составляют 0,45 кэВ и 0,38 кэВ, соответственно, но титановые образцы без покрытия не состоят из азота.
** Глубину анализа с помощью данной методики оценивали равной приблизительно 1 мкм, т.е. она превышает диаметр содержащей висмут наночастицы; следовательно, также регистрировали Ti в теле образца (основе).
Пример 3. Противомикробное действие
а) Подавление роста бактерий с использования метода контакта с пленкой
Метод контакта с пленкой, описанный в M.Yasuyuki, K.Kunihiro, S.Kurissery, N.Kanavillil, Y.Sato, Y.Kikuchi. Biofouling 26 (2010) 851-858, использовали для оценки противомикробного действия. Были приготовлены чашки Петри со штриховой культурой Pseudomonas aeruginosa (РА01) и 1 колонию засевали в 5 мл триптического соевого бульона (ТСБ) в культуральные пробирки и выращивали при встряхивании в течение 18 часов. Измеряли плотность клеток в спектрофотометре при OD 600 нм и количество клеток считали с использованием камеры подсчета клеток. Клеточную культуру доводили до плотности 1-5⋅106 клеток/мл с помощью стерильного ТСБ. В стерильных условиях приготавливали образцы таблеток (диаметром 6,25 мм) из титана технической чистоты (т.ч.) и таблеток из титана т.ч. с нанесенными центрифугированием покрытием из наночастиц Bi2O3, полученных согласно примеру 1, и помещали в соответствующие лунки 12-луночного планшета. Вырубали тонкую прозрачную полимерную пленку и стерилизовали, используя 70% этанол и УФ облучение на каждой стороне. Каплю бактерий в ТСБ объемом 15 мкл наносили на каждый образец. Одну тонкую полимерную пленку помещали на каждый образец поверх бактерий, так что бактериальный раствор равномерно распределялся по поверхности образца, что обеспечивало хороший контакт. С каждого образца удаляли пленку в стерильных условиях и промывали ее посредством нанесения пипеткой 1 мл ФБР (фосфатный буферный раствор) на поверхность в отдельной микропробирке Эппендорфа емкостью 2 мл для каждого образца. Образцы перемещали в те же микропробирки Эппендорфа, что и используемые при промывке пленки. Сначала поверхность каждого образца промывали посредством нанесения пипеткой точно такого же ФБР, как используемый для промывки пленки. Затем образцы обрабатывали ультразвуком в течение 1 мин и интенсивно перемешивали в течение 1 мин в точно такой же пробирке, которую ранее использовали для промывки пленки. Затем выполняли последовательные разбавления и определение количества микроорганизмов посевом в чашках Петри. Чашки выдерживали в течение 24 ч и подсчитывали и записывали число колоний. Таблетки титана с нанесенными центрифугированием наночастицами Bi2O3 показали слабый бактерицидный эффект против РА01, по сравнению с титаном без покрытия, см. таблицу 3.
Таблица 3. Бактерицидное действие против P. aeruginosa (PA01), рассчитанное как относительное снижение в процентах после 24 ч инкубации испытываемого образца
Специалисту в данной области техники понятно, что настоящее изобретение никоим образом не ограничено описанными выше предпочтительными воплощениями. Напротив, возможно множество модификаций и вариантов в пределах области защиты изобретения, определенной приложенной формулой изобретения.
Кроме того, варианты раскрытых воплощений могут быть понятны специалисту из изучения чертежей, описания и приложенной формулы изобретения и реализованы при применении на практике настоящего изобретения. В формуле изобретение слово «содержащий» не исключает другие элементы или стадии, и указание элемента в единственном числе не исключает наличия множества элементов. Сам по себе факт, что некоторые признаки указаны в отличных друг от друга зависимых пунктах не означает, что сочетание этих признаков нельзя использовать для достижения преимущества.
| название | год | авторы | номер документа |
|---|---|---|---|
| Медицинское устройство с поверхностью, включающей наночастицы | 2013 |
|
RU2669808C2 |
| Медицинское устройство с поверхностью, содержащей металл противомикробного действия | 2013 |
|
RU2651463C1 |
| Медицинское устройство с поверхностью, содержащей оксид галлия | 2013 |
|
RU2636515C1 |
| БИОСОВМЕСТИМЫЙ КОМПОНЕНТ | 2012 |
|
RU2630055C2 |
| Медицинское устройство, содержащее коллаген VI | 2014 |
|
RU2693408C2 |
| БИОСОВМЕСТИМЫЕ МНОГОКОМПОНЕНТНЫЕ НАНОСТРУКТУРНЫЕ ПОКРЫТИЯ ДЛЯ МЕДИЦИНЫ | 2005 |
|
RU2281122C1 |
| ИМПЛАНТИРУЕМОЕ УСТРОЙСТВО, УПРАВЛЯЕМОЕ МАГНИТНЫМ ПОЛЕМ, И СПОСОБ ВЫСВОБОЖДЕНИЯ ИЗ НЕГО ЛЕКАРСТВА | 2013 |
|
RU2563387C2 |
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2473366C2 |
| МНОГОФУНКЦИОНАЛЬНЫЕ БИОСОВМЕСТИМЫЕ НАНОСТРУКТУРНЫЕ ПЛЕНКИ ДЛЯ МЕДИЦИНЫ | 2007 |
|
RU2333009C1 |
| ДЕНТАЛЬНЫЙ ВНУТРИКОСТНЫЙ ИМПЛАНТАТ И МАТЕРИАЛ С ЭФФЕКТОМ ПАМЯТИ ФОРМЫ ДЛЯ ЕГО ИЗГОТОВЛЕНИЯ | 2008 |
|
RU2397732C2 |


Заявленное изобретение относится к области медицины. Раскрыт способ получения зубного имплантата, включающий обеспечение основы зубного имплантата, имеющей поверхность; обеспечение дисперсии наночастиц, содержащих нетоксичный постпереходный металл висмут, причем указанные наночастицы диспергируют в растворителе, и указанные наночастицы имеют средний размер менее 500 нм, причем указанный висмут представлен в виде оксида висмута, и нанесение указанной дисперсии наночастиц на поверхность указанной основы. Изобретение обеспечивает создание противомикробного покрытия из наночастиц. 20 з.п. ф-лы, 5 ил., 3 табл., 3 пр.
1. Способ получения зубного имплантата, включающий:
а) обеспечение основы зубного имплантата, имеющей поверхность;
б) обеспечение дисперсии наночастиц, содержащих нетоксичный постпереходный металл висмут, причем указанные наночастицы диспергируют в растворителе, и указанные наночастицы имеют средний размер менее 500 нм, причем указанный висмут представлен в виде оксида висмута; и
в) нанесение указанной дисперсии наночастиц на поверхность указанной основы.
2. Способ по п.1, в котором указанные наночастицы дополнительно содержат висмут.
3. Способ по п.1, в котором указанные наночастицы дополнительно содержат галлий.
4. Способ по п.3, в котором указанные наночастицы содержат соединение галлия.
5. Способ по п.4, в котором указанное соединение галлия выбрано из группы, состоящей из оксида галлия, нитрида галлия, оксидов металлов, содержащих галлий, и нитридов металлов, содержащих галлий.
6. Способ по п.1, в котором наночастицы имеют средний размер 100 нм или менее.
7. Способ по п.1, в котором указанные наночастицы образуют поверхностный слой.
8. Способ по п.7, в котором указанный слой имеет толщину от 8 нм до 1 мкм.
9. Способ по п.7, в котором указанный слой имеет толщину от 50 нм до 500 нм.
10. Способ по п.7, в котором указанный слой представляет собой монослой из указанных наночастиц.
11. Способ по п.1, в котором указанная основа является небиорассасывающейся.
12. Способ по п.1, в котором указанная основа включает металл или сплав.
13. Способ по п.12, в котором указанная основа включает титан, цирконий, гафний, ванадий, ниобий, тантал, кобальт или иридий, или их сплавы, предпочтительно титан или сплав титана.
14. Способ п.1, в котором указанная основа включает керамический материал.
15. Способ по п.14, в котором указанный керамический материал выбран из оксида титана, нитрида титана, оксида циркония и их сочетаний.
16. Способ по п.1, в котором зубной имплантат предназначен для имплантации по меньшей мере частично в живую ткань.
17. Способ по п.1, в котором зубной имплантат представляет собой зубной фиксатор, предназначенный для внедрения, по меньшей мере частично, в живую костную ткань.
18. Способ по п.1, в котором зубной имплантат представляет собой зубной абатмент, предназначенный для контакта с живой мягкой тканью.
19. Способ по п.1, где способ представляет собой способ получения зубного имплантата, имеющего антибактериальную поверхность.
20. Способ по п.1, в котором указанные наночастицы полностью диспергируют в указанном растворителе.
21. Способ по п.1, в котором указанную дисперсию наносят на указанную поверхность посредством центрифугирования.
| US 20110003083 A1, 06.01.2011 | |||
| US 20080008654 A1, 10.01.2008 | |||
| US 20100196440 A1, 05.08.2010 | |||
| US 20010055622 A1, 27.12.2001 | |||
| US 20030207975 A1, 06.11.2003 | |||
| US 20100173264 A1, 08.07.2010 | |||
| US 20110230943 A1, 22.09.2011 | |||
| RU 2008139083 A, 20.05.2010 | |||
| CHAPMAN J | |||
| et al | |||
| Period four metal nanoparticles on the inhibition of biofouling // Colloids and |
Авторы
Даты
2023-07-20—Публикация
2013-04-29—Подача