ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет предварительной заявки на патент США 62/642538, поданной 13 марта 2018 года, которая настоящим включена посредством отсылок во всей своей полноте и во всех отношениях.
[0002] УРОВЕНЬ ТЕХНИКИ
[0003] Старение характеризуется постепенной потерей функции, происходящей на молекулярном, клеточном, тканевом и организменном уровнях. На уровне хроматина старение связано с прогрессирующим накоплением эпигенетических ошибок, которые в конечном итоге приводят к нарушению регуляции генов, истощению стволовых клеток, старению и нарушению регуляции гомеостаза клеток/тканей. Технология ядерного перепрограммирования до плюрипотентности посредством оверэкспрессии небольшого числа факторов транскрипции может обратить возраст и идентичность любой клетки до эмбриональной клетки при направлении эпигенетического перепрограммирования. Нежелательное устранение идентичности клеток представляет проблему при разработке омолаживающих терапий из-за нарушения структуры, функции и распределения типов клеток в тканях и органах.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] Ввиду вышеизложенного существует потребность в улучшенных способах омоложения клеток, которые позволяют избежать дедифференцировки и потери идентичности клеток. Настоящее изобретение направлено на удовлетворение этой потребности, а также предоставляет дополнительные преимущества.
[0005] Настоящее изобретение в целом относится к клеточному омоложению, тканевой инженерии и регенеративной медицине. В частности, изобретение относится к композициям и способам омоложения старых клеток и тканей с восстановлением функциональности путем кратковременного воздействия неинтегрированных мРНК, кодирующих факторы перепрограммирования, которые омолаживают клетки, сохраняя при этом дифференцированное состояние клеток.
[0006] Изобретение относится к клеточной терапии с применением омоложенных клеток. В частности, изобретение относится к способам омоложения старых клеток и тканей для восстановления функциональности путем кратковременного воздействия неинтегрированных мРНК, кодирующих факторы перепрограммирования, которые омолаживают клетки, сохраняя клетки в дифференцированном состоянии.
[0007] В одном аспекте в настоящем документе предложены способы омоложения клеток, включающие трансфекцию клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд, с получением в результате омоложенных клеток.
[0008] В одном аспекте в настоящем документе предложен способ лечения субъекта от возрастного заболевания или состояния, нарушения с дегенерацией хрящевой ткани, нейродегенеративного нарушения и/или скелетно-мышечной дисфункции. Способы включают введение терапевтически эффективного количества клеток, которые включают одну или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования.
[0009] В одном аспекте в настоящем документе предложен способ лечения субъекта от возрастного заболевания или состояния, нарушения с дегенерацией хрящевой ткани, и/или субъекта, который имеет скелетно-мышечную дисфункцию. Способы включают введение терапевтически эффективного количества одной или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования.
[0010] В одном аспекте в настоящем документе предложены способы омолаживания инженерно модифицированной ткани ex vivo. Методы включают трансфекцию ткани одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд, с получением в результате омоложенной инженерно модифицированной ткани.
[0011] В одном аспекте в настоящем документе предложены фармацевтические композиции, включающие омоложенные клетки, полученные путем трансфекции клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд.
[0012] Таким образом, в одном аспекте изобретение включает способ омолаживания клеток, включающий: a) трансфекцию клетки одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где указанную трансфекцию проводят один раз в день в течение по меньшей мере двух дней и не более чем 4 дней; и b) трансляцию одной или более неинтегративных матричных РНК с получением одного или более факторов клеточного перепрограммирования в клетках, что приводит к транзиентному перепрограммированию клеток, где клетки подвергаются омолаживанию без дедифференцировки в стволовые клетки. Способ может применяться на клетках in vitro, ex vivo или in vivo.
[0013] В некоторых вариантах осуществления трансфекцию одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, проводят один раз в день в течение 2 дней, 3 дней или 4 дней.
[0014] В некоторых вариантах осуществления один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В одном варианте осуществления один или более факторов клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0015] Способ можно проводить на любом типе клетки. В некоторых вариантах осуществления клетки являются клетками млекопитающих (например, человек, не относящийся к человеку примат, грызун, кошка, собака, корова, лошадь, свинья, коза и т.д.). Например, способ можно проводить на фибробластах, эндотелиальных клетках, хондроцитах или стволовых клетках скелетных мышц. В другом варианте осуществления клетки получают у пожилого субъекта.
[0016] В некоторых вариантах осуществления транзиентное перепрограммирование приводит к повышению экспрессии HP1γ, H3K9me3, поддерживающего ламину белка LAP2α и SIRT1, снижению экспрессии ГМ-КСФ, IL18 и ФНОα, уменьшению ядерной укладки, уменьшению блеббинга, увеличению формирования аутофагосом в клетках, повышению активности химотрипсин-подобных протеасом, повышению трансмембранного потенциала митохондрий или снижению уровня активных форм кислорода (АФК).
[0017] В некоторых вариантах осуществления клетки находятся в ткани или органе. Транзиентное перепрограммирование, согласно способам, описанным в настоящем документе, может восстанавливать функцию клеток в ткани или органе, повышать активность клеток в ткани или органе, уменьшать количество стареющих клеток в ткани или органе, улучшать репликационную способность клеток в ткани или органе или увеличению времени жизни клеток в ткани или органе.
[0018] В другом аспекте изобретение включает способ лечения субъекта от возрастного заболевания или состояния, включающий: a) трансфекцию клеток субъекта одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где указанную трансфекцию проводят один раз в день в течение по меньшей мере двух дней и не более чем 4 дней; и b) эспрессию одного или более факторов клеточного перепрограммирования в клетках у субъекта, что приводит к транзиентному перепрограммированию клеток, где клетки подвергаются омолаживанию без дедифференцировки в стволовые клетки. Клетки могут быть трансфицированы ex vivo или in vivo.
[0019] В некоторых вариантах осуществления один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В одном варианте осуществления один или более факторов клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0020] В некоторых вариантах осуществления возрастное заболевание или состояние является дегенеративным заболеванием, нейродегенеративным заболеванием, сердечно-сосудистым заболеванием, заболеванием периферических сосудов, дерматологическим заболеванием, заболеванием глаз, аутоиммунным заболеванием, эндокринным нарушением, нарушением обмена веществ, заболеванием опорно-двигательного аппарата, заболеванием пищеварительной системы или респираторным заболеванием.
[0021] В другом варианте осуществления изобретение включает способ лечения субъекта от заболевания или нарушения, включающего дегенерацию хрящевой ткани, где способ включает: a) трансфекцию хондроцитов субъекта одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где указанную трансфекцию проводят один раз в день в течение по меньшей мере двух дней и не более чем 4 дней; и b) экспрессию одного или более факторов клеточного перепрограммирования в хондроцитах, что приводит к транзиентному перепрограммированию хондроцитов, где хондроциты подвергаются омолаживанию без дедифференцировки в стволовые клетки. Омоложенные хондроциты можно пересаживать, например, в пораженный артритом сустав субъекта.
[0022] Способ могут проводить ex vivo, in vitro или in vivo. В одном варианте осуществления хондроциты выделяют из образца хряща, полученного у субъекта, и трансфицируют ex vivo, после чего пересаживают субъекту.
[0023] В некоторых вариантах осуществления заболеванием или нарушением, включающим дегенерацию хряща, является артрит (например, остеоартроз или ревматоидный артрит).
[0024] В некоторых вариантах осуществления лечение уменьшает воспаление у субъекта.
[0025] В некоторых вариантах осуществления лечение снижает экспрессию RANKL, iNOS, IL6, IL8, BDNF, IFNα, IFNγ и LIF и повышает экспрессию COL2A1 в хондроцитах.
[0026] В другом аспекте изобретение включает способ лечения заболевания или нарушения, включающего дегенерацию мышц у субъекта, где способ включает: a) трансфекцию стволовых клеток скелетных мышц субъекта одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, при этом указанную трансфекцию проводят один раз в день в течение по меньшей мере двух дней и не более чем 4 дней; и b) экспрессию одного или более факторов клеточного перепрограммирования в стволовых клетках скелетных мышц, что приводит к транзиентному перепрограммированию стволовых клеток скелетных мышц, при этом стволовые клетки скелетных мышц подвергаются омолаживанию без потери их способности дифференцироваться в мышечные клетки.
[0027] Способ могут проводить ex vivo, in vitro или in vivo. В одном варианте осуществления стволовые клетки скелетных мышц выделяют из образца мышечной ткани, полученного у субъекта, и трансфицируют ex vivo, после чего пересаживают в мышцу, требующую восстановления или регенерации, у субъекта.
[0028] В некоторых вариантах осуществления один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В одном варианте осуществления один или более факторов клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0029] В некоторых вариантах осуществления лечение восстанавливает активность стволовых клеток скелетных мышц. В некоторых вариантах осуществления лечение приводит к регенерации мышечных волокон.
[0030] Способы согласно изобретению могут проводить у любого субъекта. В некоторых вариантах осуществления субъектом является млекопитающее, например, человек, не относящийся к человеку примат, грызун, кошка, собака, корова, лошадь, свинья или коза. В некоторых вариантах осуществления субъект является пожилым.
[0031] Эти и другие варианты осуществления настоящего изобретения будут очевидны специалистам в данной области с учетом настоящего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0032] На ФИГ. 1A-1L показано, что транзиентное перепрограммирование возвращает физиологию старых фибробластов в более молодое состояние. На ФИГ. 1A показан характерный график, демонстрирующий изменение эффекта (АФК) в зависимости от продолжительности лечения: два дня транзиентного перепрограммирования в сравнении с четырьмя днями, с последующим покоем в течение двух дней в обоих случаях. Все ящичные диаграммы и гистограммы создают после комбинирования данных по всем отдельным клеткам, биологическим и техническим повторностям для удобства просмотра. Показанный уровень значимости позволяет успешно выполнить одно парное сравнение для вариабельности между пациентами. На ФИГ. 1В показано количественное определение уровней маркеров гетерохроматина H3K9me3 и HP1γ в отдельных клетках с использованием иммуноцитохимии. На ФИГ. 1C показана количественное определение присутствия поддерживающего ядерную ламину полипептида LAP2α в отдельных клетках и процента аномальных ядер (свернутых или вздутых) в каждой популяции с использованием иммуноцитохимии. На ФИГ. 1D показаны результаты визуализации живых клеток с меченными флуоресцентными метками субстратами, расщепляемыми во время образования аутофагосом в отдельных клетках, и с химотрипсиноподобной 20S протеолитической активностью в общей популяции. На ФИГ. 1E показан потенциал митохондриальной мембраны отдельных клеток и уровни АФК, определенные количественно с помощью специфичных для митохондрий красителей. На ФИГ. 1F показано количественное иммуноокрашивание отдельных клеток на SIRT1. На ФИГ. 1G показаны результаты количественной флуоресцентной гибридизации теломер in situ (QFISH) на отдельной клетке. На ФИГ. 1Н показаны результаты окрашивания SAβGal в стареющих популяциях. На ФИГ. 1I показано количественное определение профилей воспалительных цитокинов с использованием панелей конъюгированных с аналитическими антителами гранул для мультиплексной цитометрии. На ФИГ. 1J показан репрезентативный график, на котором показано сохранение омолаживающих изменений в течение более длительных периодов покоя, через 4 и 6 дней после 4-дневного транзиентного перепрограммирования. Затем клетки в каждой когорте подвергали секвенированию РНК с парными концевыми чтениями по 80 пар оснований с получением транскриптомных профилей для каждой группы (Молодые, Старые и Обработанные - R4X2). На ФИГ. 1K показан Анализ основных компонентов в подпространстве, определяемом сигнатурой старения. На ФИГ. 1L показано сравнение логарифмических кратных изменений между молодыми и старыми (ось x) и обработанными и старыми (ось y). Темно-серые точки означают все гены сигнатуры старения, а светло-серые точки - гены, которые также перекрываются с сигнатурой обработки, со значимым различием между обработанными и старыми. Большинство генов расположено вдоль линии y=x, что означает, что величина изменений при обработке точно соответствует величине различия между молодыми и старыми. Значимость вычисляли при использовании t-критерия Стьюдента, попарно между обработанными и старыми, а также по группам при сравнении с молодыми пациентами. P-значение: *<.05, **<.01, ***<.001, цвет звездочек соответствует сравниваемой популяции.
[0033] На ФИГ. 2A-2K показано, что транзиентное перепрограммирование возвращает старую физиологию в более молодое состояние в эндотелиальных клетках. На ФИГ. 2A показан репрезентативный график, демонстрирующий изменение эффекта (АФК) в зависимости от продолжительности обработки: два дня транзиентного перепрограммирования в сравнении с четырьмя днями, с последующим покоем в течение двух дняей в обоих случаях. Все ящичные диаграммы и гистограммы создают после комбинирования данных по всем отдельным клеткам, биологическим и техническим повторностям для удобства просмотра. Показанный уровень значимости позволяет успешно выполнить одно парное сравнение для вариабельности между пациентами. На ФИГ. 2В показано количественное определение уровней маркеров гетерохроматина H3K9me3 и HP1γ в отдельных клетках с использованием иммуноцитохимии. На ФИГ. 2C показана количественное определение присутствия поддерживающего ядерную ламину полипептида LAP2α в отдельных клетках и процента аномальных ядер (свернутых или вздутых) в каждой популяции с использованием иммуноцитохимии. На ФИГ. 2D показаны результаты визуализации живых клеток с меченными флуоресцентными метками субстратами, расщепляемыми во время образования аутофагосом в отдельных клетках, и с химотрипсиноподобной 20S протеолитической активностью в общей популяции. На ФИГ. 2E показан трансмембранный потенциал митохондрий в отдельных клетках и уровни АФК, определенные количественно с помощью специфичных для митохондрий красителей. На ФИГ. 2F показано количественное иммуноокрашивание отдельных клеток на SIRT1. На ФИГ. 2G показаны результаты количественной флуоресцентной гибридизации теломер in situ (QFISH) на отдельной клетке. На ФИГ. 2Н показаны результаты окрашивания SAβGal в стареющих популяциях. На ФИГ. 1I показан репрезентативный график, на котором показано сохранение омолаживающих изменений в течение более длительных периодов покоя, через 4 и 6 дней после 4-дневного транзиентного перепрограммирования. Затем клетки в каждой когорте подвергали секвенированию РНК с парными концевыми чтениями по 80 пар оснований с получением транскриптомных профилей для каждой группы (Молодые, Старые и Обработанные - R4X2). На ФИГ. 1J показан Анализ основных компонентов в подпространстве, определяемом сигнатурой старения. На ФИГ. 1K показано сравнение логарифмических кратных изменений между молодыми и старыми (ось x) и обработанными и старыми (ось y). Темно-серые точки означают все гены сигнатуры старения, а светло-серые точки - гены, которые также перекрываются с сигнатурой обработки, со значимым различием между обработанными и старыми. Большинство генов расположено вдоль линии y=x, что означает, что величина изменений при обработке точно соответствует величине различия между молодыми и старыми. Значимость вычисляли при использовании t-критерия Стьюдента, попарно между обработанными и старыми, а также по группам при сравнении с молодыми пациентами. P-значение: *<.05, **<.01, ***<.001, цвет звездочек соответствует сравниваемой популяции.
[0034] На ФИГ. 3A-3I показано, что транзиентное перепрограммирование облегчает фенотипы остеоартроза в пораженных хондроцитах: Все ящичные диаграммы и гистограммы комбинировали по биологическим и техническим повторностям для удобства просмотра Показанный уровень значимости позволяет успешно выполнить одно парное сравнение для вариабельности между пациентами. Обработанный относится к оптимизированному перепрограммированию в течение трех дней и покою в течение двух дней. На ФИГ. 3A показана популяция после окрашивания клеток на жизнеспособности. На ФИГ. 3B показана оценка уровней РНК анаболических факторов COL2A1 с помощью кОТ-ПЦР. На ФИГ. 3C показано количественное определение концентрации АТФ в каждой когорте. На ФИГ. 3D показана оценка уровней РНК антиоксиданта SOD2 с помощью кОТ-ПЦР, следует отметить, что молодые уровни ниже OA, поскольку повышение SOD2 эффективно только тогда, когда присутствует АФК, т.е. в состоянии ОА (ФИГ. 3E). На ФИГ. 3F и 3G показана оценка уровней РНК катаболических факторов MMP13 (ФИГ. 3F) и MMP3 (ФИГ. 3G) с помощью кОТ-ПЦР. На ФИГ. 3H и 3I показана оценка уровней РНК профилей провоспалительных факторов RANKL (ФИГ. 3H) и iNOS (ФИГ. 3I) с помощью ОТ-ПЦР при использовании панелей конъюгированных с аналитическими антителами гранул для мультиплексного цитометрического анализа. Значимость вычисляли при использовании t-критерия Стьюдента, попарно между обработанными и старыми, а также по группам при сравнении с молодыми пациентами. P-значение: *<.05, **<.01, ***<.001.
[0035] На ФИГ. 4A-4G показано, что транзиентное перепрограммирование восстанавливает активность старых мышечных стволовых клеток. На ФИГ. 4A показаны измерения активации MuSC из состояния покоя. Свежевыделенные старые MuSC инкубировали с ЭдУ, фиксировали после двух дней обработки и одного или двух дней покоя. Все ящичные диаграммы и гистограммы комбинировали по биологическим и техническим повторностям для удобства просмотра. Показанный уровень значимости позволяет успешно выполнить одно парное сравнение для вариабельности между пациентами. На ФИГ. 4B показаны количественно определенные результаты биолюминесценции, измеренной у мышей через 11 дней после трансплантации в TA мышцы обработанных/необработанных+мышиные MuSC с люциферазой, в различные точки времени после трансплантации и повреждения. На ФИГ. 4C показано количественное определение иммунофлуоресцентного окрашивания на экспрессию GFP в поперечных срезах TA мышц мышей, вызуализированных и количественно определенных на ФИГ. 4B. На ФИГ. 4D показано количественное определение площади поперечного сечения полученных от доноров GFP+ волокон в TA мышцах, которые были реципиентами пересаженных MuSC. На ФИГ. 4E показаны результаты визуализации биолюминесценции TA мышц, повторно поврежденных через 60 д (второе повреждение) после трансплантации. Второе повреждение делали с целью проверки, усилился ли сигнал биолюминесценции в результате активации и размножения люцифераза+/GFP+ MuSC, которые были первоначально пересажены и которые прижились под базальной ламиной. На ФИГ. 4F показаны количественно определенные результаты биолюминесценции, измеренной у мышей через 11 дней после трансплантации в TA мышцы обработанных люцифераза+ человеческих MuSC. На ФИГ. 4G показано изменение отношения биолюминесценции обработанных и необработанных MuSC, полученных от здоровых доноров разных возрастных групп. Значимость вычисляли с использованием t-критерия Стьюдента, попарно между обработанными и старыми, а также по группами при сравнении с молодыми пациентами. P-значение: *<.05, **<.01, ***<.001, цвет звездочек соответствует сравниваемой популяции.
[0036] На ФИГ. 5A-5J показано, что транзиентное перепрограммирование обращает старую физиологию в более молодое состояние в фибробластах и эндотелиальных клетках человека. Фибробласты и эндотелиальные клетки были получены от не имеющих других патологий молодых и пожилых лиц. На ФИГ. 5А показано распределение эпигенетических и ядерных маркеров для H3K9me3. На ФИГ. 5B показано распределение эпигенетических и ядерных маркеров HP1γ. На ФИГ. 5C показано распределение эпигенетических и ядерных маркеров LAP2α. На ФИГ. 5D показано распределение питательных веществ и регуляция энергии для SIRT1. На ФИГ. 5E показано распределение питательных веществ и регуляция энергии для трансмембранного потенциала митохондрий. На ФИГ. 5F показано распределение питательных веществ и регуляция энергии для АФК митохондрий. На ФИГ. 5G показано распределение и выведение больших объемов продуктов распада и старение аутофагосомы. На ФИГ. 5H показана протеасомная активность для молодых, старых и обработанных клеток. На ФИГ. 5I показана активность старения для молодых, старых и обработанных клеток. На ФИГ. 5J показаны секретируемые цитокины в молодых, старых и обработанных клетках.
[0037] На ФИГ. 6A-6I показаны транскриптомные и метиломные исследования для старых фибробластов и эндотелиальных клеток. На ФИГ. 6A показано сравнение транскриптомных профилей молодых и старых фибробластов. Данные показывают, что 961 ген (5,85%) в фибробластах (678 апрегулированных, 289 даунрегулированных) отличался в молодых и старых клетках с критериями значимости p<.05 и log порогом кратного изменения +/-0,5. На ФИГ. 6B показан PCA анализ для фибробластов. На ФИГ. 6C показан анализ экспрессии для фибробластов. На ФИГ. 6D показан профиль молодых в сравнении со старыми клетками для эндотелиальных клеток. Данные показывают, что 748 генов (4,80%) в эндотелиальных клетках (389 апрегулированных, 377 даунрегулированных) отличались в молодых и старых клетках с критериями значимости p<.05 и log порогом кратного изменения +/-0,5. На ФИГ. 6E показан PCA анализ для эндотелиальных клеток. На ФИГ. 6F показан анализ экспрессии для эндотелиальных клеток. ФИГ. 6G представляет собой график возраста метилирования для фибробластов при оценке с использованием часов Хорвата до и после обработки и данные, которые демонстрируют общую тенденцию к снижению. ФИГ. 6H представляет собой график возраста метилирования для эндотелиальных клеток при оценке с использованием часов Хорвата до и после обработки и данные, которые демонстрируют общую тенденцию к снижению. ФИГ. 6I представляет собой дендрограмму, на которой показана неконтролируемая кластеризация профилей метилирования по статусу лечения, половой принадлежности, пациенту и типу клеток. Кластеризация демонстрирует общее сохранение идентичности клеток, по меньшей мере, при сравнении фибробластов и эндотелиальных клеток.
[0038] На ФИГ. 7A-7M показано транзиентное перепрограммирование пораженных остеоартрозом хондроцитов и мезенхимальных стволовых клеток. ФИГ. 7A-I представляют собой данные, показывающие, что транзиентное перепрограммирование облегчает воспалительные фенотипы в пораженных хондроцитах. Хондроциты получали у пожилых пациентов с поздней стадией остеоартроза (ОА) из биопсии хряща. Старые клетки OA и транзиентно перепрограммированные клетки OA оценивали на специфические фенотипы OA. Все ящичные диаграммы и гистограммы комбинировали по биологическим и техническим повторностям для удобства просмотра. Общее ранжирование по значимости устанавливали со вторым по строгости p-значением. Значимость вычисляли с использованием t-критериев Стьюдента. P-значение: *<.05, **<.01, ***<.001. Планки погрешностей показывают RMSE (среднеквадратическую ошибку). На ФИГ. 7А показано повышение уровней АТФ при обработке в хондроцитах путем измерения концентрации АТФ с использованием флуорофора на основе глицерина. На ФИГ. 7B показана активность АФК при визуализации живых одиночных клеток, захватывающих активируемые супероксидами флуоресцентные красители, демонстрирующая ослабление сигнала после обработки. На ФИГ. 7C показаны результаты оценки с помощью кОТ-ПЦР уровней РНК антиоксиданта SOD2, которые были повышены при обработке. На ФИГ. 7D показана пролиферация молодых, старых и обработанных старых хондроцитов с изменением показателей старых обработанных клеток в сторону уровней, близких к молодым клеткам. На ФИГ. 7E показаны данные кОТ-ПЦР, отражающие повышение уровней РНК компонента белка внеклеточного матрикса COL2A1 в молодых, старых и обработанных старых хондроцитах с изменением показателей старых обработанных клеток в сторону уровней, близких к молодым клеткам. ФИГ. 7F представляет собой данные, показывающие, что уровни хондрогенной идентичности и функции фактора транскрипции SOX9 согласно кОТ-ПЦР сохраняются после обработки. На ФИГ. 7G представлена оценка с помощью ОТ-ПЦР, показывающая, что обработка снижает уровни внутриклеточной РНК лиганда NF-κB RANKL. На ФИГ. 7H представлена оценка с помощью ОТ-ПЦР, показывающая, что обработка снижает уровни iNOS для продукции оксида азота в качестве ответа и для распространения воспалительного стимула с изменением, близким к таковому у молодых хондроцитов. ФИГ. 7I представляет собой данные, отражающие, что цитокиновый профиль секреции хондроцитов демонстрирует повышение провоспалительных цитокинов, которое уменьшается при обработке. ФИГ. 7J представляет собой график, на котором показано распределение изменений между пациентами в сторону снижения уровней p16 при терапии мезенхимальными стволовыми клетками. ФИГ. 7K представляет собой график, на котором показано распределение изменений между пациентами в сторону снижения уровней p21 при терапии мезенхимальными стволовыми клетками. ФИГ. 7L показано кратное изменение, соответствующее увеличению пролиферации старых и обработанных мезенхимальных стволовых клеток. На ФИГ. 7M показан процент стареющих старых и обработанных мезенхимальных стволовых клеток, соответствующий уменьшению клеточного старения.
[0039] На ФИГ. 8A-8J показаны эффекты транзиентного перепрограммирования инженерно модифицированной ткани кожи. На ФИГ. 8A-8C показаны параметры старения кожи для фибробластов и кератиноцитов. На ФИГ. 8А показана гистологическая оценка, включающая показатели морфологии, структуры и организации, демонстрирующая улучшение при лечении мРНК, но не при лечении распространенным на рынке дерматологическим средством, ретиноевой кислотой. На ФИГ. 8B показано снижение параметров старения, показанных на ФИГ. 8B (SaβGal) и на левой панели ФИГ. 8C (p16), и параметров воспаления, показанных на центральной панели ФИГ. 8C (IL-8) и правой панели ФИГ. 8C (MMP-1), при обработке мРНК и дополнительное сравнение с действием ретиноевой кислоты. На ФИГ. 8D-8J показана регенерация мышц в сателлитных клетках. На ФИГ. 8D показаны количественно определенные результаты биолюминесценции, измеренной у мышей через 11 дней после трансплантации в TA мышцы обработанных люцифераза+ человеческих MuSC. На ФИГ. 8E показаная биолюминесценция в когортах возрастом 10-30 дней, возрастом 30-55 дней и возрастом 60-80 дней. Различие в отношении биолюминесценции между обработанными и необработанными MuSC, полученными от здоровых доноров разных возрастных групп. Значимость вычисляли с использованием t-критерия Стьюдента, попарно между обработанными и старыми, а также по группам при сравнении с молодыми пациентами (возрастные группы 10-30: n=5; 30-55: n=7; 60-80: n=5). P-значение: *<.05, **<.01, ***<.001, цвет звездочек соответствует сравниваемой популяции. На ФИГ. 8F показаны измерения силы тетанических сокращений старых мышц после повреждения и трансплантации старых MuSC. ТА мышцы иссекали и проводили электрофизиологическое исследование ex vivo для определения силы тетанических сокращений. Исходный уровень усилия, создаваемого мышцами без трансплантации, измеряли у молодых (4 месяца, синяя пунктирная линия) и старых (27 месяцев, красная пунктирная линия) мышей. Обработанные старые MuSC пересаживали в TA мышцы старых мышей и через 30 дней измеряли создаваемую силу (n=5). На ФИГ. 8G показаны количественно определенные результаты биолюминесценции в обработанных, старых и молодых клетках в различные точки времени после трансплантации и повреждения (n=10). На ФИГ. 8H показана количественная оценка иммунофлуоресцентного окрашивания в поперечных срезах TA мышей, которым трансплантировали старые обработанные и старые необработанные клетки (n=5). ФИГ. 8I представляет собой график, на котором показана количественная оценка площади поперечного сечения GFP+ волокон, полученных от доноров, в TA мышцах, которые являлись реципиентами трансплантированных MuSC (n=5). На ФИГ. 8J показаны результаты биолюминесцентной визуализации TA мышц, повторно поврежденных через 60 дней (второе повреждение) после трансплантации MuSC (n=6). Второе повреждение делали с целью проверки, усилился ли сигнал биолюминесценции в результате активации и размножения люцифераза+ /GFP+ MuSC, которые были первоначально пересажены и которые прижились под базальной ламиной.
[0040] На ФИГ. 9A-9D показана трансфекция эпителиальных клеток роговицы с транзиентно перепрограммированными клетками. На ФИГ. 9A показано уменьшение старения при измерении по экспрессии p16 в старых клетках в сравнении с обработанными клетками. На ФИГ. 9B показано уменьшение старения при измерении по экспрессии p21 в старых клетках в сравнении с обработанными клетками. На ФИГ. 9C показано снижение воспалительного фактора IL8 в старых клетках в сравнении с обработанными клетками. На ФИГ. 9D показано увеличение биогенеза митохондрий при измерении по экспрессии PGC1α.
[0041] ФИГ. 10 является диаграммой, на которой показано P-значение изменения клеточноспецифических маркеров в обработанных и старых клетках при использовании анализа RNAseq. Ни один из 8 маркеров фибробластов и 50 маркеров эндотелиальных клеток не показал существенного изменения их соответствующих типов клеток при обработке, что указывает на сохранение идентичности клеток.
[0042] На ФИГ. 11 показаны признаки старения, которые исследовали при использовании панели из 11 утвержденных анализов.
ПОДРОБНОЕ ОПИСАНИЕ
[0043] При практическом применении описанной здесь технологии будут использоваться, если не указано иное, обычные методы медицины, клеточной биологии, фармакологии, химии, биохимии, молекулярной биологии и методы рекомбинантной ДНК, а также иммунология в пределах квалификации в данной области. Такие методы полностью объяснены в литературе. См., Например, G. Vunjak-Novakovic and R. I. Freshney Culture of Cells for Tissue Engineering (Wiley-Liss, 1st edition, 2006); Arthritis Research: Methods and Protocols, Vols. 1 and 2: (Methods in Molecular Medicine, Cope ed., Humana Press, 2007); Cartilage and Osteoarthritis (Methods in Molecular Medicine, M. Sabatini P. Pastoureau, and F. De Ceuninck eds., Humana Press; 2004); Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell eds., Blackwell Scientific Publications); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., последнее издание); и Sambrook et al., Molecular Cloning: A Laboratory Manual (3-е издание, 2001).
[0044] Все публикации, патенты и заявки на патент, цитируемые в настоящем документе, выше или ниже, настоящим включены посредством отсылок во всей своей полноте.
I. Определения
[0045] При описании настоящего изобретения будут использоваться следующие термины, которые имеют определения, указанные ниже.
[0046] Следует отметить, что при использовании в настоящем описании и прилагаемой формуле изобретения, формы единственного числа "a", "an" и "the" включают множественные ссылки, если из содержания прямо не следует иное. Таким образом, например, ссылка на "клетку" включает смесь двух или более клеток, и т.п.
[0047] В тексте настоящего описания ссылка, например, на "один вариант осуществления", "вариант осуществления", "еще один вариант осуществления", "конкретный вариант осуществления", "сходный вариант осуществления", "определенный вариант осуществления", "дополнительный вариант осуществления" или "другой вариант осуществления", или их комбинации, означает, что конкретный признак, структура или характеристика, описанные в связи с таким вариантом осуществления, включены по меньшей мере в один вариант осуществления настоящего изобретения. Таким образом, появление предшествующих фраз в различных разделах настоящего описания не должны обязательно относиться к одному и тому же варианту осуществления. Кроме того, конкретные признаки, структуры или характеристики можно комбинировать любым подходящим образом в одном или более вариантах осуществления.
[0048] При использовании в настоящем документе термин "приблизительно" означает диапазон значений, включающий указанное значение, которое специалист в данной области техники будет считать достаточно похожим с указанным значением. В вариантах осуществления термин "приблизительно" означает в пределах стандартного отклонения при использовании измерений, обычно принятых в данной области техники. В вариантах осуществления изобретения приблизительно означает диапазон, распространяющий до +/- 10% от указанного значения. В вариантах осуществления "приблизительно" означает указанное значение.
[0049] По всему тексту настоящего описания, если из контекста не следует иное, следует понимать, что такие слова как "включать", "включает" и "включающий" подразумевают включение указанного этапа или элемента, или группы этапов или элементов, но не исключение какого-либо другого этапа или элемента, или группы этапов или элементов. Под "состоящим из" подразумевается включающий и ограниченный тем, что следует за фразой "состоящий из". Таким образом, фраза "состоящий из" указывает, что перечисленные элементы являются требуемыми или обязательными, и что не могут присутствовать никакие другие элементы. Под "состоящим по существу из" подразумевается включающий любые элементы, перечисленные после фразы, и ограниченный другими элементами, которые не препятствуют или не способствуют активности или действию, указанным в описании перечисленных элементов. Таким образом, фраза "состоящий по существу из" указывает, что перечисленные элементы являются требуемыми или обязательными, но что никакие другие элементы не являются необязательными и могут присутствовать или могут не присутствовать, в зависимости от того, влияют ли они на активность или действие перечисленных элементов.
[0050] При использовании в настоящем документе термин "биосовместимый" обычно относится к материалу и его любым метаболитам или продуктам распада, которые обычно не являются токсичными для реципиента и не вызывают значимых нежелательных эффектов у субъекта.
[0051] При использовании в настоящем документе термин "клетка" относится к интактной живой клетке, природной или модифицированной. Клетка может быть выделена из других клеток, смешана с другими клетками в культуре или присутствовать в ткани (фрагментированной или интактной) или организме. Способы, описанные в настоящем документе, могут выполнять, например, на образце, включающем одну клетку, популяцию клеток или ткань, или орган, включающий клетки.
[0052] При использовании в настоящем документе термин "неинтегративный" в отношении матричной РНК (мРНК) относится к молекуле мРНК, которая не интегрирована внутрихромосомно или внехромосомно в геном хозяина, и не интегрирована в вектор.
[0053] При использовании в настоящем документе термин "трансфекция" относится к захвату экзогенной ДНК или РНК клеткой. Клетка была "трансфицирована", если экзогенная ДНК или РНК были введены внутрь клеточной мембраны. В уровне техники широко известен ряд методов трансфекции. См., например, Graham et al. (1973) Virology, 52:456, Sambrook et al. (2001) Molecular Cloning, a laboratory manual, 3rd edition, Cold Spring Harbor Laboratories, New York, Davis et al. (1995) Basic Methods in Molecular Biology, 2nd edition, McGraw-Hill, и Chu et al. (1981) Gene 13:197. Такие методы могут применяться для введения одной или более экзогенных молекул ДНК или РНК в клетки. Термин относится как к стабильному, так и к транзиентному захвату молекул РНК или ДНК. Например, трансфекция может использоваться для транзиентного введения мРНК, кодирующих факторы перепрограммирования клеток, в клетки, нуждающиеся в омоложении.
[0054] При использовании в настоящем документе, термин "транзиентное перепрограммирование" относится к воздействию на клетки факторов клеточного перепрограммирования в течение периода времени, достаточного для омоложения клеток (т.е. устранения всех или некоторых характерных признаков старения), но не настолько длительного, чтобы вызвать дедифференцировку в стволовые клетки. Такое транзиентное перепрограммирование дает омоложенные клетки, сохраняющие свою идентичность (т.е. дифференцированного клеточного типа).
[0055] При использовании в настоящем документе термин "омоложенная клетка (клетки)" относится к старым клеткам, которые были подвергнуты обработке или транзиентно перепрограммированию одним или более факторами клеточного перепрограммирования, таким образом, что клетки имеют транскриптомный профиль более молодой клетки, но при этом сохраняют один или более маркеров клеточной идентичности.
[0056] При использовании в настоящем документе термин "клетка млекопитающего" относится к любой клетке, полученной от субъекта-млекопитающего, подходящей для трансплантации тому же или другому субъекту. Клетка может быть ксеногенной, аутологичной или аллогенной. Клетка может быть первичной клеткой, полученной непосредственно от субъекта-млекопитающего. Клетка может также быть клеткой, полученной из культуры и при размножении клетки, полученной от субъекта. В некоторых вариантах осуществления клетка была генетически модифицирована для экспрессии рекомбинантного белка и/или нуклеиновой кислоты.
[0057] При использовании в настоящем документе термин "стволовая клетка" относится к клетке, которая сохраняет способность самообновляться при митотическом клеточном делении и которая может дифференцироваться в различные типы специализированных клеток. Стволовые клетки млекопитающих можно разделить на три широкие категории: эмбриональные стволовые клетки, которые происходят из бластоцист, взрослые стволовые клетки, которые находятся в тканях взрослых, и стволовые клетки пуповинной крови, которые находятся в пуповине. В развивающемся эмбрионе стволовые клетки могут дифференцироваться во все специализированные эмбриональные ткани. У взрослых организмов стволовые клетки и клетки-предшественники действуют как система восстановления организма, восполняя специализированные клетки. Тотипотентные стволовые клетки образуются в результате слияния яйцеклетки и сперматозоида. Клетки, образующиеся при нескольких первых делениях оплодотворенной яйцеклетки, также являются тотипотентными. Эти клетки могут дифференцироваться в эмбриональные и внеэмбриональные типы клеток. Плюрипотентные стволовые клетки являются потомками тотипотентных клеток и могут дифференцироваться в клетки, происходящие из любого из трех зародышевых листков. Мультипотентные стволовые клетки могут давать только клетки близкородственного семейства клеток (например, гемопоэтические стволовые клетки дифференцируются в эритроциты, лейкоциты, тромбоциты и т.д.). Унипотентные клетки могут продуцировать только один тип клеток, но обладают свойством самообновления, которое отличает их от нестволовых клеток. Индуцированные плюрипотентные стволовые клетки являются типом плюрипотентных стволовых клеток, полученных из взрослых клеток, которые были перепрограммированы в эмбрионально-подобное плюрипотентное состояние. Индуцированные плюрипотентные стволовые клетки могут быть получены, например, из взрослых соматических клеток, таких как клетки кожи или крови.
[0058] При использовании в настоящем документе термин "транскриптомный профиль" относится к набору всех молекул РНК в одной клетке или популяции клеток. Иногда его используют для обозначения всех РНК или только мРНК, в зависимости от конкретного эксперимента. Он отличается от экзома тем, что включает только те молекулы РНК, которые присутствуют в определенной популяции клеток, и обычно включает количество или концентрацию каждой молекулы РНК в дополнение к молекулярным идентичностям. Методы получения транскриптомного профиля включают ДНК микрочипы и технологии секвенирования следующего поколения, такие как RNA-Seq. Транскрипцию также можно изучать на уровне отдельных клеток с помощью транскриптомики одиночных клеток. Существует два основных способа определения последовательностей транскриптомов. Один подход картирует чтения последовательности на референсном геноме либо самого организма (чей транскриптом изучают), либо близкородственного вида. В другом подходе, сборке транскриптомов de novo, используется программа для получения транскриптов непосредственно из коротких чтений последовательности.
[0059] При использовании в настоящем документе термин "среднеквадратическая ошибка" или "RMSE" относится к стандартному отклонению остатков (ошибкам прогнозирования). Остатки являются показателем того, насколько далеко от регрессионной кривой удалены точки данных. RMSE является мерой того, насколько разбросаны эти остатки. Другими словами, это говорит о том, насколько данные сосредоточены около линии наилучшего соответствия.
[0060] При использовании в настоящем документе термин "жизнеспособность клетки" относится к количеству клеток, которые являются живыми или мертвыми, на основе всего образца клеток. Высокая жизнеспособность клеток, как определено в настоящем документе, относится к популяции клеток, в которой больше 85% всех клеток жизнеспособны, предпочтительно больше 90-95%, и более предпочтительно к популяции, характеризуемой высокой жизнеспособностью клеток, содержащей больше 99% жизнеспособных клеток.
[0061] При использовании в настоящем документе термин "аутофагосома" относится к сферической структуре с двухслойными мембранами. Это - ключевая структура в макроаутофагии, внутриклеточной системе деградации содержимого цитоплазмы (например, аномальных внутриклеточных белков, избыточных или поврежденных органелл), а также проникших в клетку микроорганизмов. После своего образования аутофагосомы доставляют цитоплазматические компоненты в лизосомы. Наружная мембрана аутофагосомы объединяется с лизосомой, образуя аутолизосому. Гидролазы в лизосомах расщепляют доставленное аутофагосомой содержимое и ее внутреннюю мембрану.
[0062] При использовании в настоящем документе термин "активность протеасомы" относится к деградации ненужных или поврежденных белков протеасомой, белковым комплексом, путем протеолиза, химической реакции, которая расщепляет пептидные связи. Термин "химотрипсин-подобная активность протеасом" относится к определенной каталитической активности протеасом.
[0063] При использовании в настоящем документе термин "трансмембранный потенциал митохондрий" относится к электрическому потенциалу и протонному градиенту, которые возникают в результате окислительно-восстановительных превращений, связанных с активностью цикла Кребса, и служат промежуточной формой запасания энергии для синтеза АТФ. Он создается протонными насосами и является важным процессом накопления энергии во время окислительного фосфорилирования. Он играет ключевую роль в митохондриальном гомеостазе посредством селективной элиминации нефункциональной митохондрии.
[0064] При использовании в настоящем документе термин "фармацевтически приемлемое вспомогательное вещество или носитель" относятся к вспомогательному веществу, которое необязательно может быть включено в композиции согласно изобретению, и которое не вызывает значимых неблагоприятных токсикологических эффектов у пациента.
[0065] При использовании в настоящем документе термин "активные формы кислорода" или "АФК" представляют собой химически активные химические соединения, содержащие кислород. Примеры включают пероксиды, супероксид, гидроксильный радикал, атомарный кислород и альфа-кислород. В биологическом контексте АФК образуются как природный побочный продукт нормального обмена кислорода и играют важные роли в клеточной сигнализации и гомеостазе.
[0066] При использовании в настоящем документе термин "связанный со старением секреторный фенотип" или "SASP" относится к набору различных цитокинов, хемокинов, факторов роста и протеаз, которые являются характерным признаком стареющих клеток. Стареющие клетки являются стабильными, неделящимися клетками, которые все еще метаболически активны и демонстрируют апрегуляцию широкого ряда генов, включая гены, которые кодируют секретируемые белки, такие как воспалительные цитокины, хемокины, факторы ремоделирования внеклеточного матрикса и факторы роста. Эти секретируемые белки функционируют физиологически в микроокружении ткани, в которой они могут усиливать реакцию стресса и общаться с соседними клетками. Этот фенотип, который называют связанным со старением секреторным фенотипом (SASP), раскрывает паракринную функцию стареющих клеток и является важной особенностью, отличающей стареющие клетки от нестареющих, клеток с остановкой клеточного цикла, таких как покоящиеся клетки и терминально дифференцированные клетки. "Цитокины SASP" относятся, в частности, к цитокинам, вырабатываемым стареющими клетками, с формированием связанного со старением секреторного фенотипа. Цитокины включают, без ограничения IL18, IL1A, GROA, IL22 и IL9.
[0067] При использовании в настоящем документе термин "ландшафт метилирования" относится к профилю метилирования ДНК в клетке или популяции клеток.
[0068] При использовании в настоящем документе термин "эпигенетические часы" относится к биохимическому анализу, который может использоваться для измерения возраста. Анализ основан на уровнях метилирования ДНК. Первые мультитканевые эпигенетические часы, эпигенетические часы Хорвата или "часы Хорвата", были разработаны Стивом Хорватом (Horvath 2013).
[0069] При использовании в настоящем документе термин "факторы клеточные перепрограммирования" относится к набору факторов транскрипции, которые могут превращать взрослые или дифференцированные клетки в плюрипотентные стволовые клетки. В вариантах осуществления в настоящем документе факторы включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0070] "Фармацевтически приемлемая соль" включает, без ограничения, соли аминокислот, соли, полученные с неорганическими кислотами, такие как хлорид, сульфат, фосфат, дифосфат, бромид и нитрат, или соли, полученные из соответствующей формы неорганической кислоты любого из предыдущего, например, гидрохлорид и т.д., или соли, полученные с органической кислотой, такие как малат, малеат, фумарат, тартрат, сукцинат, этилсукцинат, цитрат, ацетат, лактат, метансульфонат, бензоат, аскорбат, пара-толуолсульфонат, пальмоат, салицилат и стеарат, а также эстолат, глюцептат и лактобионат. Аналогичным образом, соли, содержащие фармацевтически приемлемые катионы, включают, без ограничения, натрий, калий, кальций, алюминий, литий и аммоний (включая замещенный аммоний).
[0071] При использовании в настоящем документе термин "трансплантировать" относится к переносу клетки, ткани или органа субъекту из другого источника. Термин не ограничен конкретным способом переноса. Клетки могут трансплантировать любым подходящим способом, таким как инъекция или хирургическая имплантация.
[0072] При использовании в настоящем документе термин "артрит" включает, без ограничения, остеоартроз, ревматоидный артрит, волчаночный артрит, ювенильный идиопатический артрит, реактивный артрит, энтеропатический артрит и псориатический артрит.
[0073] При использовании в настоящем документе термин "возрастное заболевание или состояние" относится к любому состоянию, заболеванию или нарушению, связанному со старением, такому как, без ограничения перечисленными, нейродегенеративные заболевания (например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз, деменция и инсульт), сердечно-сосудистые заболевания и заболевания периферических сосудов (например, атеросклероз, заболевание периферических артерий (ЗПА), гематомы, кальцинозия, тромбоз, эмболии и аневризмы), заболевания глаз (например, возрастная макулодистрофия, глаукома, катаракта, синдром сухого глаза, диабетическая ретинопатия, потеря зрения), дерматологические заболевания (кожная атрофия и истончение, эластолиз и сморщивание кожи, гиперплазия или гипоплазия сальных желез, сенильное лентиго и другие нарушения пигментации, седеющие волосы, потеря или истончение волос и хронические кожные язвы), аутоиммунные заболевания (например, ревматическая полимиалгия (РП), гигантоклеточный артериит (ГКА), ревматоидный артрит (РА), кристаллические артропатии и спондилоартропатия (САП)), эндокринная и метаболическая дисфункция (например, гипопитуитаризм у взрослых, гипотиреоз, апатический тиреотоксикоз, остеопороз, сахарный диабет, недостаточность надпочечников, различные формы гипогонадизма и эндокринные злокачественные образования), заболевания опорно-двигательного аппарата (например, артрит, остеопороз, миелома, подагра, болезнь Пэджета, переломы кости, синдром недостаточности костного мозга, анкилоз, диффузный идиопатический скелетный гиперостоз, гематогенный остеомиелит, мышечная атрофия, периферическая нейропатия, рассеянный склероз, боковой амиотрофический склероз (БАС), мышечная дистрофия Дюшенна, первичный боковой склероз и тяжелая миастения), заболевания пищеварительной системы (например, цирроз печени, фиброз печени, пищевод Баррета), респираторные заболевания (например, фиброз легких, хроническая обструктивная болезнь легких, астма, хронический бронхит, тромбоэмболия легочной артерии (ТЭЛА), рак легкого и инфекции), а также любые другие заболевания и нарушения, связанные со старением.
[0074] При использовании в настоящем документе термин "заболевание или нарушение, включающее дегенерацию хряща" означает любое заболевание или нарушение, включающее дегенерацию хряща и/или сустава. Термин "заболевание или нарушение, включающее дегенерацию хряща" включает состояния, нарушения, синдромы, заболевания и повреждения, которые влияют на межпозвоночные диски или сочленения (например, суставные сочленения) у животных, включая людей, и включает, без ограничения перечисленными, артрит, хондрофазию, спондилоартропатию, анкилозирующий спондилит, красную волчанку, рецидивирующий полихондрит и синдром Шегрена.
[0075] При использовании в настоящем документе термин "заболевание или нарушение, связанное с мышечной дегенерацией" является любым заболеванием или нарушением, включающим мышечную дегенерацию. Термин включает состояния, нарушения, синдромы, заболевания и повреждения, которые поражают мышечную ткань, такие как, без ограничения перечисленными, мышечную атрофию, мышечную дисфункцию, разрывы мышц, ожоги, хирургическое вмешательство, периферическую нейропатия, рассеянный склероз, боковой амиотрофический склероз (БАС), мышечную дистрофию Дюшенна, первичный боковой склероз, тяжелую миастению, рак, СПИД, застойную сердечную недостаточность, хроническую обструктивную болезнь легких (ХОБЛ), заболевание печени, почечную недостаточность, нарушения пищевого поведения, недостаточность питания, голодание, инфекции или лечение глюкокортикоидами.
[0076] Под "терапевтически эффективной дозой или количеством" подразумевается количество омолаженных клеток или неинтегративных матричных РНК, которые вызывают положительный терапевтический ответ у субъекта, нуждающегося в восстановлении или регенерации ткани, например, количество, которое восстанавливает функцию и/или приводит к образованию новой ткани на участке лечения. Омоложенные клетки могут быть получены путем трансфекции in vitro, ex vivo или in vivo одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, как описано в настоящем документе. Таким образом, например, "положительный терапевтический ответ" может быть улучшением возрастного заболевания или состояния в связи с терапией и/или уменьшением одного или более симптомов возрастного заболевания или состояния в связи с лечением, таким как восстановление функциональности тканей, уменьшение боли, улучшение жизнеспособности, увеличение силы, увеличение подвижности и/или улучшение когнитивной функции. Требуемое точное количество (клеток или мРНК) будет изменяться между субъектами в зависимости от вида, возраста и общего состояния субъекта, тяжести состояния, подвергаемого лечению, способа введения и т.п. Подходящее "эффективное" количество в любом отдельном случае может быть определено специалистом в данной области при использовании стандартных экспериментов на основе информации, предоставленной в настоящем документе.
[0077] Например, терапевтически эффективная доза или количество омоложенных хондроцитов означает количество, которое при введении, как описано в настоящем документе, вызывает положительный терапевтический ответ у субъекта, имеющего повреждение или атрофию хряща, например, количество, которое приводит к образованию нового хряща на участке лечения (например, в поврежденном суставе). Например, терапевтически эффективная доза или количество может использоваться для лечения повреждения или атрофии хряща в результате травматического повреждения или дегенеративного заболевания, такого как артрит или другое заболевание, включающее дегенерацию хрящевой ткани. Предпочтительно терапевтически эффективное количество восстанавливает функцию и/или снимает боль и воспаление, связанные с повреждением или потерей хряща.
[0078] В другом примере под терапевтически эффективной дозой или количеством омоложенных стволовых клеток скелетных мышц подразумевается количество, которое при введении, как описано в настоящем документе, вызывает положительный терапевтический ответ у субъекта, имеющего повреждение или атрофию мышц, например, количество, которое приводит к образованию новых мышечных волокон на участке лечения (например, в поврежденной мышце). Например, терапевтически эффективная доза или количество могут использоваться для лечения повреждения или атрофии мышц в результате травматического повреждения или заболевания, или нарушения, включающего дегенерацию мышц. Предпочтительно терапевтически эффективное количество улучшает мышечную силу и функцию.
[0079] При использовании в настоящем документе термины "субъект", "лицо" и "пациент" используются в настоящем описании попеременно и относятся к любому субъекту-позвоночному, в том числе, без ограничения, к человеку и другим приматам, включая не относящихся к человеку приматов, таких как шимпанзе и другие виды человекообразных обезьян и обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, овцы, свиньи, козы и лошади; домашних млекопитающих, таких как собаки и кошки; грызунов, таких как мыши, крысы, кролики, хомяки и морские свинки; птиц, включая домашних, диких и промысловых птиц, таких как куры, индейки и другие куриные, утки, гуси и т.п. В некоторых случаях способы согласно изобретению находят применение на экспериментальных животных, в ветеринарии и при разработке моделей заболевания на животных. Термин не обозначает конкретный возраст. Таким образом, подразумевается включение как взрослых, так и новорожденных.
II. Способы
[0080] Перед подробным описанием настоящего изобретения следует понимать, что настоящее изобретение не ограничивается конкретными составами или параметрами процессов, которые, конечно, могут изменяться. Также следует понимать, что терминология, используемая в настоящем описании, предназначена только для описания конкретных вариантов осуществления настоящего изобретения и не предназначена для ограничения.
[0081] Хотя ряд способов и материалов, аналогичных или эквивалентных описанным в настоящем документе, могут использоваться при практическом осуществлении настоящего изобретения, в настоящем документе описаны предпочтительные материалы и способы.
[0082] Настоящее изобретение относится к способам омоложения старых клеток и тканей для восстановления функциональности посредством транзиентной оверэкспрессии мРНК, воздействующей, например, на функцию митохондрий, протеолитическую активность, уровни гетерохроматина, метилирование гистонов, полипептиды ядерной ламины, секрецию цитокинов или старение. В частности, авторы изобретения показали, что мРНК, кодирующие OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG, могут применяться для омоложения различных типов клеток, включая фибробласты, эндотелиальные клетки, хондроциты и стволовые клетки скелетных мышц, при сохранении клеток в дифференцированном состоянии.
[0083] Для дальнейшего понимания изобретения ниже приведено более подробное обсуждение, касающееся способов омоложения клеток посредством транзиентного перепрограммирования с применением мРНК и клеточной терапии с использованием таких омоложенных клеток.
a. Омолаживание клеток
[0084] В одном аспекте в настоящем документе предложены способы омолаживания клеток, включающие трансфекцию клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд, с получением в результате омоложенных клеток.
[0085] В вариантах осуществления омоложенные клетки имеют фенотип или профиль активности, подобные молодой клетке. Фенотип или профиль активности включает одно или более из транскриптомного профиля, экспрессии гена одного или более ядерных и/или эпигенетических маркеров, протеолитической активности, состояния и функции митохондрий, экспрессии цитокинов SASP и ландшафта метилирования.
[0086] В вариантах осуществления омоложенные клетки имеют транскриптомный профиль, который больше похож на транскриптомный профиль молодых клеток. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии одного или более генов, выбранных из RPL37, RHOA, SRSF3, EPHB4, ARHGAP18, RPL31, FKBP2, MAP1LC3B2, Elf1, Phf8, Pol2s2, Taf1 и Sin3a. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена RPL37. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена RHOA. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена SRSF3. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена EPHB4. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена ARHGAP18. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена RPL31. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена FKBP2. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена MAP1LC3B2. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена Elf1. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена Phf8. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена Pol2s2. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена Taf1. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии гена Sin3a. В вариантах осуществления транскриптомный профиль омоложенных клеток включает повышение экспрессии генов RPL37, RHOA, SRSF3, EPHB4, ARHGAP18, RPL31, FKBP2, MAP1LC3B2, Elf1, Phf8, Pol2s2, Taf1 и Sin3a.
[0087] В вариантах осуществления омоложенные клетки демонстрируют повышенную экспрессию гена одного или более ядерных и/или эпигенетических маркеров по сравнению с референсным значением. В вариантах осуществления один или более ядерных и/или эпигенетических маркеров выбраны из HP1-гамма, H3K9me3, поддерживающего ламину белка LAP2-альфа и белка SIRT1. В вариантах осуществления омоложенные клетки демонстрируют повышенную экспрессию гена HP1-гамма. В вариантах осуществления омоложенные клетки демонстрируют повышенную экспрессию гена H3K9me3. В вариантах осуществления омоложенные клетки демонстрируют повышенную экспрессию гена поддерживающего ламину белка LAP2-альфа. В вариантах осуществления омоложенные клетки демонстрируют повышенную экспрессию гена белка SIRT1. В вариантах осуществления омоложенные клетки демонстрируют повышенную экспрессию гена HP1-гамма, H3K9me3, поддерживающего ламину белка LAP2-альфа и белка SIRT1.
[0088] В вариантах осуществления омоложенные клетки обладают протеолитической активностью, которая больше похожа на протеолитическую активность молодых клеток. В вариантах осуществления протеолитическую активность измеряют как повышенное образование аутофагосом в клетке, повышенную химотрипсин-подобную активность протеасом или комбинацию этого. В вариантах осуществления протеолитическую активность измеряют как повышенное образование аутофагосом в клетке. В вариантах осуществления протеолитическую активность измеряют как повышенную химотрипсин-подобную активность протеасом. В вариантах осуществления протеолитическую активность измеряют как повышенное образование аутофагосом в клетке и повышенную химотрипсин-подобную активность протеасом.
[0089] В вариантах осуществления омоложенные клетки демонстрируют улучшенное состояние и функцию митохондрий по сравнению с референсным значением. В вариантах осуществления, улучшенное состояние и функцию митохондрий измеряют как повышение трансмембранного потенциала митохондрии, снижение активных форм кислорода (АФК) или комбинацию этого. В вариантах осуществления улучшенное состояние и функции митохондрии измеряют как повышенный трансмембранный потенциал митохондрии. В вариантах осуществления улучшенное состояние и функции митохондрии измеряют как снижение активных форм кислорода (АФК). В вариантах осуществления, улучшенное состояние и функцию митохондрии измеряют как увеличенный трансмембранный потенциал митохондрии и снижение активных форм кислорода (АФК).
[0090] В вариантах осуществления омоложенные клетки демонстрируют сниженную экспрессию одного или более цитокинов SASP в сравнении с референсным значением. В вариантах осуществления один или более цитокинов SASP включают IL18, IL1A, GROA, IL22 и IL9. В вариантах осуществления омоложенные клетки демонстрируют сниженную экспрессию IL18. В вариантах осуществления, омоложенные клетки демонстрируют сниженную экспрессию IL1A. В вариантах осуществления, омоложенные клетки демонстрируют сниженную экспрессию GROA. В вариантах осуществления, омоложенные клетки демонстрируют сниженную экспрессию IL22. В вариантах осуществления, омоложенные клетки демонстрируют сниженную экспрессию IL9. В вариантах осуществления, омоложенные клетки демонстрируют сниженную экспрессию IL18, IL1A, GROA, IL22 и IL9.
[0091] В вариантах осуществления омоложенные клетки демонстрируют обращение ландшафта метилирования. В вариантах осуществления обращение ландшафта метилирования измеряют при оценке с использованием часов Хорвата.
[0092] В вариантах осуществления референсное значение получено из старой клетки.
[0093] В вариантах осуществления клетки омолаживают путем транзиентного перепрограммирования с применением мРНК, кодирующих один или более факторов клеточного перепрограммирования. Транзиентное перепрограммирование осуществляют путем трансфекции клеток неинтегративными мРНК один раз в день, в течение по меньшей мере двух и не более чем 5 дней. Под "неинтегративным" подразумевается, что молекула мРНК не интегрируется внутрихромосомно или внехромосомно в геном хозяина и не интегрирована в вектор, таким образом, перепрограммирование является транзиентным и не нарушает идентичность омоложенной клетки (т.е. клетка сохраняет способность к дифференцировке в свой зрелый клеточный тип). В вариантах осуществления транзиентное перепрограммирование клеток устраняет различные характерные признаки старения, избегая при этом полной дедифференцировки клеток в стволовые клетки.
[0094] В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью метода трансфекции, выбранной из трансфекции, опосредованной липофектамином и LT-1, трансфекции, опосредованной декстраном, осаждения фосфатом кальция, трансфекции, опосредованной полибреном, электропорации, инкапсулирования мРНК в липосомах и прямой микроинъекции. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью трансфекции, опосредованной липофектамином и LT-1. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью декстран-опосредованной трансфекции. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью осаждения фосфатом кальция. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью полибрен-опосредованной трансфекции. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью электропорации. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью инкапсулирования мРНК в липосомах. В вариантах осуществления трансфекция клеток матричными РНК может быть выполнена с помощью прямой микроинъекции.
[0095] Обращение клеточного возраста или омолаживание достигается путем транзиентной оверэкспрессии одной или более мРНК, кодирующих факторы клеточного перепрограммирования. Такие факторы клеточного перепрограммирования могут включать факторы транскрипции, эпигенетические ремоделирующие средства или малые молекулы, влияющие на митохондриальную функцию, протеолитическую активность, уровни гетерохроматина, метилирование гистонов, полипептиды ядерной ламины, секрецию цитокинов или старение. В вариантах осуществления факторы клеточного перепрограммирования включают одно или более из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В другом варианте осуществления факторы клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В некоторых вариантах осуществления факторы клеточного перепрограммирования состоят из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0096] В вариантах осуществления способы, предложенные в настоящем документе, могут применяться к любому типу клеток, нуждающихся в омоложении. Клетка может быть выделена из других клеток, смешана с другими клетками в культуре или может находиться в ткани (фрагментированной или интактной) или живом организме. Способы, описанные в настоящем документе, могут выполнять, например, на образце, включающем одну клетку, популяцию клеток или ткань, или орган, содержащий клетки. Клетки, выбранные для омоложения, будут зависеть от требуемого терапевтического эффекта для лечения возрастного заболевания или состояния.
[0097] В вариантах осуществления клетки являются клетками млекопитающего. В вариантах осуществления клетки являются клетками человека. В вариантах осуществления клетки получены от пожилого субъекта.
[0098] В вариантах осуществления способы, предложенные в настоящем документе, могут выполнять в отношении клеток, ткани или органов нервной системы, мышечной системы, дыхательной системы, сердечно-сосудистой системы, скелетной системы, репродуктивной системы, покровной системы, лимфатической системы, выделительной системы, эндокринной системы (например, эндокринной и экзокринной) или пищеварительной системы. Любой тип клеток потенциально можно омолаживать, как описано в настоящем документе, включая, помимо прочего, эпителиальные клетки (например, плоские, кубовидные, цилиндрические и псевдомногослойные эпителиальные клетки), эндотелиальные клетки (например, эндотелиальные клетки вен, артерий и лимфатических сосудов), а также клетки соединительной ткани, мышц и нервной системы. Такие клетки могут включать, без ограничения перечисленными, эпидермальные клетки, фибробласты, хондроциты, клетки скелетных мышц, сателлитные клетки, клетки сердечной мышцы, гладкомышечные клетки, кератиноциты, базальные клетки, амелобласты, экзокринные секреторные клетки, миоэпителиальные клетки, остеобласты, остеокласты, нейроны (например, сенсорные нейроны, моторные нейроны и интернейроны), глиальные клетки (например, олигодендроциты, астроциты, эпендимные клетки, микроглия, шванновские клетки и сателлитные клетки), столбовые клетки, адипоциты, перициты, звездчатые клетки, пневмоциты, клетки крови и иммунной системы (например, эритроциты, моноциты, дендритные клетки, макрофаги, нейтрофилы, эозинофилы, тучные клетки, T-клетки, B-клетки, NK-клетки), гормоносекретирующие клетки, половые клетки, интерстициальные клетки, клетки хрусталика, фоторецепторные клетки, клетки вкусовых рецепторов и обонятельные клетки; а также клетки и/или ткани из почки, печени, поджелудочной железы, желудка, селезенки, желчного пузыря, кишечника, мочевого пузыря, легких, предстательной железы, молочных желез, мочеполовых путей, клетки гипофиза, полости рта, пищевода, кожи, волос, ногтей, щитовидной железы, паращитовидной железы, надпочечника, глаз, носа или головного мозга.
[0099] В некоторых вариантах осуществления клетки выбраны из фибробластов, эндотелиальных клеток, хондроцитов, стволовых клеток скелетных мышц, кератиноцитов, мезенхимальных стволовых клеток и эпителиальных клеток роговицы. В вариантах осуществления клетки являются фибробластами. В вариантах осуществления клетки являются эндотелиальными клетками. В вариантах осуществления клетки являются хондроцитами. В вариантах осуществления клетки являются стволовыми клетками скелетных мышц. В вариантах осуществления клетки являются кератиноцитами. В вариантах осуществления клетки являются мезенхимальными стволовыми клетками. В вариантах осуществления клетки являются эпителиальными клетками роговицы.
[0100] В вариантах осуществления омоложенные фибробласты демонстрируют транскриптомный профиль, аналогичный транскриптомному профилю молодых фибробластов. В вариантах осуществления омоложенные фибробласты демонстрируют повышенную экспрессию генов одного или более ядерных и/или эпигенетических маркеров по сравнению с референсным значением, как описано выше. В вариантах осуществления омоложенные фибробласты обладают протеолитической активностью, которая больше похожа на протеолитическую активность молодых клеток, как описано выше. В вариантах осуществления омоложенные фибробласты демонстрируют улучшенное состояние и функцию митохондрий по сравнению с референсным значением, как описано выше. В вариантах осуществления омоложенные фибробласты демонстрируют обращение ландшафта метилирования.
[0101] В вариантах осуществления омоложенные эндотелиальные клетки демонстрируют транскриптомный профиль, подобный транскриптомному профилю молодых эндотелиальных клеток. В вариантах осуществления омоложенные эндотелиальные клетки демонстрируют повышенную экспрессию гена одного или более ядерных и/или эпигенетических маркеров по сравнению с референсным значением, как описано выше. В вариантах осуществления омоложенные эндотелиальные клетки обладают протеолитической активностью, которая больше похожа на протеолитическую активность молодых клеток, как описано выше. В вариантах осуществления омоложенные эндотелиальные клетки демонстрируют улучшенное состояние и функцию митохондрий по сравнению с референсным значением, как описано выше. В вариантах осуществления омоложенные эндотелиальные клетки демонстрируют обращение ландшафта метилирования.
[0102] В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию воспалительных факторов и/или и повышенный АТФ и обмен коллагена. В вариантах осуществления воспалительные факторы включают RANKL, iNOS2, IL6, IFNα, MCP3 и MIP1A. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию RANKL. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию INOS2. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию IL6. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию IFNα. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию MCP3. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию MIP1A. В вариантах осуществления омоложенные хондроциты демонстрируют сниженную экспрессию RANKL, iNOS2, IL6, IFNα, MCP3 и MIP1A. В вариантах осуществления омоложенные хондроциты демонстрирует повышенный АТФ и обмен коллагена. В вариантах осуществления АТФ и обмен коллагена измеряют по одному или более из повышенных уровней АТФ, снижения АФК и повышенной экспрессии SOD2, повышенной экспрессии COL2A1 и общей пролиферации в хондроцитах. В вариантах осуществления АТФ и обмен коллагена измеряют по повышенным уровням АТФ. В вариантах осуществления АТФ и обмен коллагена измеряют по снижению АФК и повышенной экспрессии SOD2. В вариантах осуществления АТФ и обмен коллагена измеряют по повышенной экспрессии COL2A1 и общей пролиферации в хондроцитах.
[0103] В вариантах осуществления омоложенные стволовые клетки скелетных мышц демонстрируют более высокую пролиферативную способность, повышенную способность к дифференцировке в миобласты и мышечные волокна, восстановленную более низкую кинетику активации из покоящегося состояния, способность омолаживать мышечную микронишу, восстанавливать свойственную молодым мышцам силу или комбинацию этого.
[0104] В вариантах осуществления омоложенные кератиноциты демонстрируют более высокую пролиферативную способность, сниженный воспалительный фенотип, более низкую экспрессию RNAKL и INOS2, сниженную экспрессию цитокинов MIP1A, IL6, IFNa, MCP3, повышенный АТФ, повышенные уровни экспрессии SOD2 и COL2A1.
[0105] В вариантах осуществления омоложенные мезенхимальные стволовые клетки демонстрируют снижение параметров старения, повышенную пролиферацию клеток и/или снижение уровней АФК. В вариантах осуществления омоложенные мезенхимальные стволовые клетки демонстрируют снижение параметров старения. В вариантах осуществления параметры старения включают экспрессию p16, экспрессию p21 и положительное окрашивание на SAβGal. В вариантах осуществления омоложенные мезенхимальные стволовые клетки демонстрируют повышенную пролиферацию клеток. В вариантах осуществления омоложенные мезенхимальные стволовые клетки демонстрируют снижение уровней АФК. В вариантах осуществления омоложенные мезенхимальные стволовые клетки демонстрируют снижение параметров старения, повышенную пролиферацию клеток и снижение уровней АФК.
[0106] В вариантах осуществления омоложенные эпителиальные клетки роговицы демонстрируют снижение параметров старения. В вариантах осуществления параметры старения включают одно или более из экспрессии p21, экспрессии p16, PGC1α биогенеза митохондрий и экспрессии воспалительного фактора IL8. В вариантах осуществления параметры старения включают p21. В вариантах осуществления параметры старения включают экспрессию p16. В вариантах осуществления параметры старения включают PGC1α биогенеза митохондрий. В вариантах осуществления параметры старения включают экспрессию воспалительного фактора IL8. В вариантах осуществления параметры старения включают одно из экспрессии p21, экспрессии p16, PGC1α биогенеза митохондрий и экспрессии воспалительного фактора IL8.
[0107] Способы согласно изобретению могут применяться для омолаживания клеток в культуре (например, ex vivo или in vitro), для улучшения функции и активности с целью применения в клеточной терапии. Клетки, используемые при лечении пациента, могут быть аутологичными или аллогенными. Предпочтительно клетки получают от пациента или совместимого донора. Например, в терапии ex vivo, клетки получают непосредственно у пациента, подлежащего лечению, трансфицируют мРНК, кодирующими факторы клеточного перепрограммирования, как описано в настоящем документе, и повторно имплантируют пациенту. Такие клетки могут быть получены, например, в результате биопсии или операции, выполняемой у пациента. В альтернативе, клетки, нуждающиеся в омоложении, могут трансфицировать непосредственно in vivo при использовании мРНК, кодирующих факторы клеточного перепрограммирования.
[0108] Трансфекцию могут проводить с помощью любого подходящего способа, известного в уровне техники, который предусматривает транзиентный захват мРНК, кодирующих факторы клеточного перепрограммирования в клетки, нуждающиеся в омоложении (т.е. для транзиентного перепрограммирования). В вариантах осуществления способы ex vivo, in vitro или in vivo доставки мРНК в клетки субъекта могут включать способ, выбранный из опосредованной липофектамином и LT-1 трансфекции, опосредованной декстраном трансфекции, осажения фосфатом кальция, опосредованной полибреном трансфекции, электропорации, инкапсулирования мРНК в липосомах, прямой микроинъекции мРНК в клетки или комбинации этого.
b. Композиции
[0109] В одном аспекте в настоящем документе предложены фармацевтические композиции, включающие омоложенные клетки, полученные путем трансфекции клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования в течение не более чем пяти (5) дней подряд.
[0110] В вариантах осуществления омоложенные клетки являются аутологичными. В вариантах осуществления омоложенные клетки являются аллогенными.
[0111] В вариантах осуществления один или более факторов клеточного перепрограммирования выбраны из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В вариантах осуществления факторами клеточного перепрограммирования являются OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0112] В вариантах осуществления омоложенные клетки демонстрируют одно или более из следующего: повышенную экспрессию HP1-гамма, H3K9me3, LAP2-альфа, SIRT1, повышенный потенциал митохондриальной мембраны и сниженные активные формы кислорода и сниженную экспрессию цитокинов SASP. В вариантах осуществления цитокины SASP включают один или более из IL18, IL1A, GROA, IL22 и IL9.
[0113] В некоторых вариантах осуществления композиции, включающие омоложенные клетки, для применения в клеточной терапии могут дополнительно включают один или более дополнительных факторов, таких как питательные вещества, цитокины, факторы роста, компоненты внеклеточного матрикса (ECM), антибиотики, антиоксиданты или иммунодепрессанты для улучшения функции или жизнеспособности клеток. Композиция также может дополнительно включать фармацевтически приемлемый носитель.
[0114] Примеры факторов роста включают, без ограничения перечисленными, фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF), трансформирующий фактор роста бета (TGF-β), эпирегулин, эпидермальный фактор роста ("EGF"), фактор роста эндотелиальных клеток ("ECGF"), фактор роста нервов ("NGF"), фактор ингибирования лейкоза ("LIF"), костный морфогенетический белок 4 ("BMP-4"), фактор роста гепатоцитов ("HGF"), фактор роста эндотелия сосудов A ("VEGF-A") и октапептид холецистокинина.
[0115] Примеры компонентов ECM включают, без ограничения перечисленными, протеогликаны (например, хондроитинсульфат, гепарансульфат и кератансульфат), непротеогликановые полисахариды (например, гиалуроновую кислоту), волокна (например, коллаген и эластин) и другие компоненты ECM (например, фибронектин и ламинин).
[0116] Примеры иммунодепрессантов включают, без ограничения перечисленными, стероидные (например, преднизон) или нестероидные (например, сиролимус (Рапамун, Wyeth-Ayerst Canada), такролимус (Програф, Fujisawa Canada) и антитело к IL2R даклизумаб (Зенапакс, Roche Canada). Другие иммунодепрессанты включают 15-деоксиспергуалин, циклоспорин, метотрексат, рапамицин, Рапамун (сиролимус/рапамицин), FK506 или Лизофиллин (LSF).
[0117] Одно или более фармацевтически приемлемых вспомогательных веществ также может быть включено. Примеры включают, без ограничения, углеводы, неорганические соли, противомикробные средства, антиоксиданты, поверхностно-активные вещества, буферы, кислоты, основания и их комбинации.
[0118] Например, может быть включено противомикробное средство для предотвращения или сдерживания роста микроорганизмов. Неограничивающие примеры противомикробных средств, подходящих для существующего раскрытия, включает хлорид бензалкония, хлорид бензетония, бензиловый спирт, хлорид цетилпиридия, хлорбутанол, фенол, фенилэтиловый спирт, фенилнитрат ртути, тимерсол и их комбинации. Противомикробные средства также включают антибиотики, которые также могут использоваться для предотвращения бактериальной инфекции. Примеры антибиотиков включают амоксициллин, пенициллин, сульфамиды, цефалоспорины, эритомицин, стрептомицин, гентамицин, тетрациклин, кларитромицин, ципрофлоксацин, азитромицин и т.п. Также включены противогрибковые средства, такие как миконазол и терконазол.
[0119] Также могут быть включены различные антиоксиданты, такие как молекулы, содержащие тиольные группы, такие как восстановленный глутатион (GSH) или его предшественники, глутатион или аналоги глутатиона, сложный моноэфир глутатиона и N-ацетилцистеин. Другие подходящие антиоксиданты включают супероксиддисмутазу, каталазу, витамин Е, тролокс, липоевую кислоту, лазароиды, бутилгидроксианизол (ВНА), витамин K и т.п.
[0120] Вспомогательные вещества, подходящие для инъекционных композиций, включают воду, спирты, полиолы, глицерин, растительные масла, фосфолипиды и поверхностно-активные вещества. Углевод, такой как сахар, дериватизированный сахар, такой как альдит, альдоновая кислота, этерифицированный сахар и/или сахарный полимер, могут присутствовать в качестве вспомогательного вещества. Конкретные углеводные вспомогательные вещества включают, например: моносахариды, такие как фруктозу, мальтозу, галактозу, глюкозу, D-маннозу, сорбозу и т.п.; дисахариды, такие как лактозу, сахарозу, трегалозу, целлобиозу и т.п.; полисахариды, такие как рафинозу, мелецитозу, мальтодекстрины, декстраны, крахмалы и т.п.; и альдиты, такие как маннит, ксилит, мальтит, лактит, ксилит, сорбит (глюцит), пиранозилсорбит, миоинозит и т.п.. Наполнитель также может включать неорганическую соль или буфер, такой как лимонную кислоту, хлорид натрия, хлорид калия, сульфат натрия, нитрат калия, одноосновный фосфат натрия, двухосновный фосфат натрия и их комбинации.
[0121] Кислоты или основания также могут присутствовать в качестве вспомогательного вещества. Неограничивающие примеры кислот, которые могут использоваться, включают кислоты, выбранные из группы, состоящей из соляной кислоты, уксусной кислоты, фосфорной кислоты, лимонной кислоты, яблочной кислоты, молочной кислоты, муравьиной кислоты, трихлоруксусной кислоты, азотной кислоты, хлорной кислоты, фосфорной кислоты, серной кислоты, фумаровой кислоты и их комбинаций. Примеры подходящих оснований включают, без ограничения перечисленными, основания, выбранные из группы, состоящей из гидроксида натрия, ацетата натрия, гидроксида аммония, гидроксида калия, ацетата аммония, ацетата калия, фосфата натрия, фосфата калия, цитрата натрия, формиата натрия, сульфата натрия, сульфата калия, фумарата калия и их комбинаций.
[0122] Как правило, оптимальное количество любого отдельного вспомогательного вещества определяется посредством стандартных экспериментов, т.е. путем приготовления композиций, содержащих переменные количества вспомогательного вещества (изменяющегося в пределах от низкого к высокому), исследования стабильности и других параметров, и затем определения диапазона, в котором достигается оптимальная эффективность без значимых нежелательных эффектов. Впрочем, как правило, вспомогательное вещество(а) будет присутствовать в композиции в количестве от приблизительно 1% до приблизительно 99% по весу, предпочтительно от приблизительно 5% до приблизительно 98% по весу, более предпочтительно от приблизительно 15 до приблизительно 95% по весу вспомогательного вещества, при этом наиболее предпочтительными являются концентрации меньше 30% по весу. Эти указанные выше фармацевтические вспомогательные вещества наряду с другими вспомогательными веществами описаны в изданиях "Remington: The Science & Practice of Pharmacy", 19th ed., Williams & Williams, (1995), the "Physician's Desk Reference", 52nd ed., Medical Economics, Montvale, NJ (1998), и Kibbe, A.H., Handbook of Pharmaceutical Excipients, 3rd Edition, American Pharmaceutical Association, Washington, D.C., 2000.
c. Введение
[0123] Способы согласно изобретению могут применяться для лечения субъекта от возрастного заболевания или состояния. Например, клеточная терапия, включающая транзиентное перепрограммирование клеток путем трансфекции неинтегративными мРНК, кодирующими факторы перепрограммирования (например, in vitro, ex vivo или in vivo), может применяться для лечения субъекта от различных возрастных заболеваний и состояний, таких как, без ограничения, нейродегенеративные заболевания (например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз, деменция и инсульт), сердечно-сосудистые заболевания и заболевания периферических сосудов (например, атеросклероз, заболевание периферических артерий (ЗПА), гематомы, кальцинозия, тромбоз, эмболии и аневризмы), заболевания глаз (например, возрастная макулодистрофия, глаукома, катаракта, синдром сухого глаза, диабетическая ретинопатия, потеря зрения), дерматологические заболевания (кожная атрофия и истончение, эластолиз и сморщивание кожи, гиперплазия или гипоплазия сальных желез, сенильное лентиго и другие нарушения пигментации, седеющие волосы, потеря или истончение волос и хронические кожные язвы), аутоиммунные заболевания (например, ревматическая полимиалгия (РП), гигантоклеточный артериит (ГКА), ревматоидный артрит (РА), кристаллические артропатии и спондилоартропатия (САП)), эндокринная и метаболическая дисфункция (например, гипопитуитаризм у взрослых, гипотиреоз, апатический тиреотоксикоз, остеопороз, сахарный диабет, недостаточность надпочечников, различные формы гипогонадизма и эндокринные злокачественные образования), заболевания опорно-двигательного аппарата (например, артрит, остеопороз, миелома, подагра, болезнь Пэджета, переломы кости, синдром недостаточности костного мозга, анкилоз, диффузный идиопатический скелетный гиперостоз, гематогенный остеомиелит, мышечная атрофия, периферическая нейропатия, рассеянный склероз, боковой амиотрофический склероз (БАС), мышечная дистрофия Дюшенна, первичный боковой склероз и тяжелая миастения), заболевания пищеварительной системы (например, цирроз печени, фиброз печени, пищевод Баррета), респираторные заболевания (например, фиброз легких, хроническая обструктивная болезнь легких, астма, хронический бронхит, тромбоэмболия легочной артерии (ТЭЛА), рак легкого и инфекции), а также любые другие заболевания и нарушения, связанные со старением.
[0124] В одном аспекте в настоящем документе предложен способ лечения субъекта от возрастного заболевания или состояния, нарушения с дегенерацией хрящевой ткани, нейродегенеративного нарушения и/или скелетно-мышечной дисфункции. Способы включают введение терапевтически эффективного количества клеток, которые включают одну или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования.
[0125] По меньшей мере один терапевтически эффективный курс лечения путем трансфекции одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, могут назначать субъекту для лечения возрастного заболевания или состояния.
[0126] В вариантах осуществления возрастное заболевание или состояние выбрано из глазной, кожной или скелетно-мышечной дисфункции.
[0127] В вариантах осуществления субъект имеет нарушение с дегенерацией хрящевой ткани. В вариантах осуществления нарушение выбрано из артрита, хондрофазии, спондилоартропатии, анкилозирующего спондилита, красной волчанки, рецидивирующего полихондрита и синдрома Шегрена. В вариантах осуществления заболеванием является артрит. В вариантах осуществления заболеванием является хондрофазию. В вариантах осуществления заболеванием является спондилоартропатию. В вариантах осуществления заболеванием является анкилозирующий спондилит. В вариантах осуществления заболеванием является красная волчанка. В вариантах осуществления нарушением является рецидивирующий полихондрит. В вариантах осуществления нарушением является синдром Шегрена.
[0128] В вариантах осуществления лечение снижает экспрессию одного или более воспалительных факторов и/или и повышает АТФ и обмен коллагена. В вариантах осуществления воспалительные факторы выбраны из RANKL, iNOS2, IL6, IFNα, MCP3 и MIP1A. В вариантах осуществления АТФ и обмен коллагена измеряют по одному или более из повышенных уровней АТФ, снижения АФК и повышения SOD2, повышения COL2A1 и общей пролиферации в хондроцитах.
[0129] В вариантах осуществления при лечении субъекта клетками, омоложенными путем трансфекции ex vivo или in vitro в культуре клеток, композиции для трансплантации омоложенных клеток, как правило, хотя не обязательно, вводят путем инъекции или хирургической имплантацией в область, требующую регенерации или восстановления ткани.
[0130] В вариантах осуществления терапевтически эффективное количество омоложенных клеток выбирают из фибробластов, эндотелиальных клеток, хондроцитов, стволовых клеток скелетных мышц, кератиноцитов, мезенхимальных стволовых клеток и эпителиальных клеток роговицы. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются фибробласты. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются эндотелиальные клетки. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются хондроциты. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются стволовые клетки скелетных мышц. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются кератиноциты. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются мезенхимальные стволовые клетки. В вариантах осуществления терапевтически эффективным количеством омоложенных клеток являются эпителиальные клетки роговицы.
[0131] В вариантах осуществления омоложенная эпителиальная роговица демонстрирует снижение параметров старения. В вариантах осуществления параметры старения включают одно или более из экспрессии p21 и p16, PGC1α биогенеза митохондрий и экспрессии воспалительного фактора IL8.
[0132] В одном варианте осуществления хондроциты в области повреждения или атрофии хряща трансфицированы in vivo эффективным количеством одной или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования, достаточным для того, чтобы привести к омоложению хондроцитов и образованию нового хряща на участке лечения. В альтернативе омоложенные хондроциты, полученные путем трансфекции ex vivo или in vitro, можно вводить местно в область повреждения или атрофии хряща, такую как поврежденный сустав или другой подходящий участок лечения у субъекта. Под терапевтически эффективной дозой или количеством омоложенных хондроцитов подразумевается количество, которое вызывает положительный терапевтический ответ у субъекта, имеющего повреждение или атрофию хряща, например, количество, которое приводит к образованию нового хряща на участке лечения (например, поврежденном суставе). Например, терапевтически эффективная доза или количество можно применять для лечения повреждения или атрофии хряща в результате травматического повреждения или дегенеративного заболевания, такого как артрит или другое заболевание, включающее дегенерацию хряща. Предпочтительно терапевтически эффективное количество восстанавливает функцию и/или снимает боль и воспаление, связанные с повреждением или потерей хряща.
[0133] В другом варианте осуществления стволовые клетки скелетных мышц трансфицированы in vivo эффективным количеством одной или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования, достаточным, чтобы привести к омоложению (т.е. восстановить активность) стволовых клеток скелетных мышц и образования новых мышечных волокон на участке лечения (например, в поврежденной мышце). В альтернативе омоложенные стволовые клетки скелетных мышц, полученные путем трансфекции ex vivo или in vitro, могут вводить местно в поврежденную мышцу, нуждающуюся в восстановлении или регенерации. Например, терапевтически эффективная доза или количество могут использоваться для лечения повреждения или атрофии мышцы в результате травматического повреждения, мышечной атрофии или заболевания, или нарушения, включающего дегенерацию мышцы. Под терапевтически эффективной дозой или количеством омоложенной стволовых клеток скелетных мышц подразумевается количество, которое вызывает положительный терапевтический ответ у субъекта, имеющего повреждение или атрофию мышцы, такое как количество, приводящее к образованию новых мышечных волокон на участке лечения (например, в поврежденной мышце). Предпочтительно терапевтически эффективное количество улучшает силу и функцию мышцы, облегчает боль, улучшает выносливость и/или повышает подвижность.
[0134] В одном аспекте в настоящем документе предложены способы лечения субъекта от возрастного заболевания или состояния, нарушения с дегенерацией хрящевой ткани и/или субъекта, который имеет скелетно-мышечную дисфункцию, как описано в настоящем документе выше. Способы включают введение терапевтически эффективного количества одной или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования, как описано в настоящем документе выше.
[0135] В вариантах осуществления клетки у субъекта могут быть подвергнуты омоложению путем трансфекции in vivo эффективным количеством одной или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования, как описано в настоящем документе.
[0136] В одном аспекте в настоящем документе предложены способы омолаживания инженерно модифицированной ткани ex vivo. Способы включают трансфекцию ткани одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд с получением в результате омоложенной инженерно модифицированной ткани.
[0137] В вариантах осуществления инженерно модифицированная ткань демонстрирует снижение параметров старения, провоспалительных факторов, улучшение гистологической оценки или комбинацию этого. В вариантах осуществления инженерно модифицированная ткань демонстрирует снижение одного или более параметров старения. В вариантах осуществления параметры старения отобраны из экспрессии p16, положительного окрашивания на SaβGal и экспрессии провоспалительных факторов IL8 и MMP1. В вариантах осуществления инженерно модифицированная ткань демонстрирует снижение экспрессии p16. В вариантах осуществления инженерно модифицированная ткань демонстрирует снижение положительного окрашивания на SaβGal. В вариантах осуществления инженерно модифицированная ткань демонстрирует снижение экспрессии провоспалительных факторов IL8 и MMP1. В вариантах осуществления инженерно модифицированная ткань демонстрирует улучшение гистологической оценки. В вариантах осуществления гистологическая оценка включает морфологию, организацию и/или качество.
[0138] В вариантах осуществления инженерно модифицированная ткань является инженерно модифицированной тканью кожи и органеллами.
d. Наборы
[0139] В изобретении также предложены наборы, включающие один или более контейнеров, содержащих композиции, включающие одну или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования для транзиентного перепрограммирования клеток. Наборы могут дополнительно включить трансфицирующие средства, среды для культивирования клеток и, необязательно, один или более других факторов, таких как факторы роста, компоненты ECM, антибиотики и т.п. мРНК, кодирующие факторы клеточного перепрограммирования, и/или другие композиции могут находиться в жидкой или лиофилизированной форме. Такие наборы также могут включать компоненты, которые сохраняют или поддерживают мРНК, которые защищают их от деградации. Такие компоненты могут не содержать РНКазы или защищать от воздействия РНКаз. Подходящие контейнеры для композиций включают, например, бутылки, флаконы, шприцы и пробирки. Контейнеры могут быть изготовлены из различных материалов, включая стекло или пластмассу. Контейнер может иметь стерильный порт доступа (например, контейнер может быть пакетом или флаконом с раствором для внутривенного введения, имеющим пробку, прокалываемую иглой для подкожной инъекции).
[0140] Набор может дополнительно включать второй контейнер, включающий фармацевтически приемлемый буфер, такой как фосфатно-солевой буферный раствор, раствор Рингера или раствор декстрозы. Он может также содержать другие материалы, необходимые для конечного пользователя, включая другие фармацевтически приемлемые растворы для приготовления, такие как буферы, разбавители, фильтры, иглы и шприцы или другие устройства доставки. Устройство доставки может быть предварительно наполнено композициями.
[0141] Набор также может включать вкладыш в упаковку, содержащий письменные инструкции по применению для лечения возрастного заболевания или состояний. Вкладыш в упаковку может быть неутвержденным проектом вкладыша в упаковку или может быть вкладышем в упаковку, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) или другим регулирующим органом.
[0142] В некоторых вариантах осуществления набор включает мРНК, кодирующие один или более факторов клеточного перепрограммирования, выбранных из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG. В одном варианте осуществления набор включает мРНК, кодирующие факторы клеточного перепрограммирования OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
III. Экспериментальная часть
[0143] Ниже представлены примеры конкретных вариантов для осуществления настоящего изобретения. Примеры предоставлены исключительно в иллюстративных целях и не предназначены для ограничения объема настоящего изобретения каким-либо образом.
[0144] Были предприняты усилия для обеспечения точности используемых числовых значений (например, количеств, температур и т.д.), однако, конечно, не следует исключать некоторую экспериментальную ошибку и отклонение.
[0145] Следует понимать, что примеры и варианты осуществления, описанные в настоящем документе, предназначены исключительно для иллюстративных целей, и что на их основе различные модификации или изменения будут предположены специалистами в данной области техники и должны быть включены в сущность и объем настоящей заявки, а также в объем прилагаемой формулы изобретения. Все публикации, патенты и заявки на патенты, цитируемые в настоящем документе, включены посредством отсылки во всей своей полноте во всех отношениях.
ПРИМЕРЫ
Пример 1: Транзиентное и неинтегративное клеточное перепрограммирование вызывает многогранное обращение старения
[0146] Эксперименты, описанные в настоящем документе, определяют степень влияния обращения возраста, которое может быть достигнуто с помощью протокола транзиентного перепрограммирования, которое останавливается до того, как идентичность клеток будет необратимо утрачена. Недавно полученные данные также показали, что частичное трансгенное перепрограммирование может смягчать возрастные признаки и увеличивать продолжительность жизни у прогероидных мышей. Однако неизвестно, как эта форма 'эпигенетического омоложения' может широко применяться к естественному старению и, что важно, как ее можно безопасно перенести на клетки человека. Данные, представленные в настоящем документе, показывают, что транзиентное перепрограммирование на основе технологий мРНК обращает вспять признаки физиологического старения, снижает фенотипы возрастных заболеваний и восстанавливает регенеративный ответ, уменьшающийся с возрастом в соматических и стволовых клетках, полученных из клинических образцов человека. Неинтегративный способ транзиенного перепрограммирования клеток, описанный в настоящем документе, открывает путь к новой, более универсальной стратегии омолаживающей клеточной терапии ex vivo в направлении регенеративной медицины, а также омолаживающей тканевой терапии in vivo для задержки или обращения вспять физиологического разрушения при естественном старении и патогенеза возрастных заболеваний.
[0147] Чтобы проверить, может ли быть достигнуто какое-либо существенное и измеримое перепрограммирование клеточного возраста до наступления точки невозврата, и может ли это привести к какому-либо улучшению клеточной функции и физиологии, влияние транзиентного перепрограммирования на стареющую физиологию двух различных типов клеток, фибробласты и эндотелиальные клетки, полученные от субъектов, не имеющих иных патологий, оценивали и сравнивали с клетками того же типа, полученными от молодых доноров. Фибробласты получали из измельченных биопсий кожи руки и живота (25-35 лет для молодого контроля, n=3, и 60-70 лет для возрастной группы, n=3), в то время как эндотелиальные клетки выделяли из подвздошной вены и артерии после обработки коллагеназой (15-25 лет для молодого контроля, n=3, и 45-50 лет для возрастной группы, n=3).
[0148] Использовали протокол неинтегративного перепрограммирования. Протокол был оптимизирован, основан на смеси мРНК, экспрессирующих OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG (OSKMLN). Исследовали длительность множественного перепрограммирования, и хотя оба типа клеток демонстрировали быстрое изменение многих параметров старения уже на этапе R2X2 (две трансфекции перепрограммирования с двухдневным покоем с возвратом в базальное состояние), наиболее выраженный эффект наблюдали при R4X2 (ФИГ. 1A и 2A). Протокол стабильно давал колонии индуцированных плюрипотентных стволовых клеток (иПСК), независимо от возраста доноров, после 12-15 ежедневных трансфекций; предположили, что PNR в данной платформе происходит примерно в день 5 перепрограммирования, основываясь на наблюдении, что первая детектируемая экспрессия эндогенных днкРНК, связанных с плюрипотентностью, происходит в день 5. Таким образом, был утвержден протокол транзиентного перепрограммирования, в котором OSKMLN ежедневно трансфицировали в течение четырех дней подряд и проводили анализ экспрессии генов через два дня после перерыва.
[0149] Парное секвенирование спаренных концов РНК выполняли на клетках обоих типах для трех одинаковых когорт: молодых (Y), необработанных старых (UA) и обработанных старых (TA). Сначала сравнивали квантильно нормализованные транскриптомы молодых и необработанных старых клеток для каждого типа клеток ("Y и UA"). Данные показывают, что 961 ген (5,85%) в фибробластах (678 с апрегуляцией, 289 с даунрегуляцией) и 748 генов (4,80%) в эндотелиальных клетках (389 с апрегуляцией, 377 с даунрегуляцией) различались между молодыми и старыми клетками с критерием значимости p<0,05 и логарифмическим порогом кратного изменения +/-0,5 (ФИГ.6). Эти наборы генов были обогащены для многих известных путей старения, идентифицированных в коллекции наборов маркерных генов в базе данных молекулярных сигнатур. После картирования направленности экспрессии выше или ниже среднего уровня для каждого гена, наблюдали четкое сходство между обработанными и молодыми клетками в отличие от старых клеток, как в случае фибробластов, так и эндотелиальных клеток. Провели анализ основных компонентов (PCA) в этом пространстве набора генов, и при этом было определено, что молодые и старые популяции были разделены по первому основному компоненту (PC1), что объясняло 64,8% дисперсии фибробластов и 60,9% дисперсии эндотелиальных клеток. Примечательно то, что обработанные клетки также объединялись в кластер ближе к молодой популяции по PC1 (ФИГ. 1K и 2J).
[0150] При использовании таких же критериев значимости, определенных выше, сравнивали необработанные и обработанные старые популяции ("UA и TA") и обнаружили, что 1042 гена в фибробластах (734 с апрегуляцией, 308 с даунрегуляцией) и 992 гена в эндотелиальных клетках (461 с апрегуляцией, 531 с даунрегуляцией) экспрессировались дифференцированно. Интересно, что в этих наборах генов также обнаружили обогащение путей старения, в базах данных молекулярных сигнатур. При сравнении профилей молодых и необработанных старых ("Y и UA") и необработанных старых в сравнении с обработанными старыми ("UA и TA") для каждого типа клеток, наблюдали совпадение 24,7% для фибробластов (отношение шансов 4,53, p<0,05) и совпадение 16,7% для эндотелиальных клеток (отношение шансов 3,84, p<0,05) с направленностью изменения экспрессии генов, совпадающей с таковой у молодых (то есть если выше в молодых, то выше и в обработанных старых); меньше 0,5% показали противоположную динамику в обоих типах клеток.
[0151] Затем эти транскриптомные профили использовали для проверки сохранения идентичности клеток после транзиентного перепрограммирования. С этой целью, используя установленные маркеры идентичности клеток, подтвердили, что ни один из них не изменился в существенной степени после лечения (ФИГ. 10). Кроме того, не удалось обнаружить экспрессию каких-либо маркеров, связанных с плюрипотентностью (кроме трансфицированных мРНК OSKMLN) (ФИГ. 10). В целом анализ транскриптомных сигнатур показал, что транзиентное перепрограммирование устанавливает более молодой профиль экспрессии генов, сохраняя при этом идентичность клеток.
[0152] Эпигенетические часы, основанные на уровнях метилирования ДНК, являются наиболее точным молекулярным биомаркером возраста в тканях и клетках различных типов и позволяют прогнозировать множество возрастных состояний, включая продолжительность жизни. Как известно, экзогенная экспрессия канонических факторов перепрограммирования (OSKM) уменьшает эпигенетический возраст первичных клеток до пренатального состояния. Для проверки, может ли транзиентная экспрессия OSKMLN сдвигать обратно эпигенетические часы, использовали два типа эпигенетических часов, которые можно применить к фибробластам и эндотелиальным клеткам человека: оригинальные эпигенетические часы Хорвата для любых тканей (на основе 353 цитозин-фосфат-гуаниновых (CpG) пар) и часы кожи и крови (на основе 391 CpG пары).
[0153] Согласно универсальным тканевым эпигенетическим часам, транзиентный OSKMLN значительно (P-значение для двусторонней модели смешанных эффектов=0,023) уменьшал возраст по метилированию ДНК (среднее различие в возрасте = -3,40 года, стандартная ошибка 1,17). Эффект омоложения был более выраженным в эндотелиальных клетках (среднее различие в возрасте = -4,94 года, SE=1,63, ФИГ. 6H), чем в фибробластах (среднее различие в возрасте = -1,84, SE=1,46, ФИГ. 6G). Качественно аналогичные, но менее значимые результаты могут быть получены с использованием эпигенетических часов кожи и крови (общий эффект омоложения -1,35 года, SE=0,67, P-значение в односторонней модели смешанных эффектов=0,042, среднее омоложение эндотелиальных клеток и фибробластов составляет -1,62 года и -1,07 соответственно).
[0154] На основе этих результатов анализировали влияние транзиентного перепрограммирования на различные признаки физиологического старения клеток. Использовали панель из 11 утвержденных анализов, охватывающих маркеры старения (ФИГ. 11), при этом большую часть анализов выполняли при использовании высокопроизводительной визуализации отдельных клеток, чтобы зафиксировать количественные изменения в отдельных клетках и изменения распределения во всей популяции клеток. Все анализы проводили отдельно для каждой отдельной клеточной линии (в общей сложности 19 линий фибробластов: 3 молодых, 8 старых и 8 обработанных; в общей сложности 17 линий эндотелиальных клеток: 3 молодых, 7 старых и 7 обработанных). Статистический анализ проводили в каждой парной серии образцов; затем данные объединяли по возрастным категориям для простоты представления (подробное описание использованных статистических методов см. в Материалах и методах). Контрольные эксперименты проводили с применением такой же схемы трансфекции при использовании мРНК, кодирующей GFP.
[0155] Чтобы расширить данные по эпигенетике, проводили эксперименты по количественному измерению с помощью иммунофлуоресценции (IF) эпигенетического репрессивного маркера H3K9me3, ассоциированного с гетерохроматином белка HP1γ и поддерживающего ядерную ламину белка LAP2α (ФИГ. 1B, 1C, 2B, 2C, 5A-C). Старые фибробласты и эндотелиальные клетки показали снижение ядерного сигнала для всех трех маркеров по сравнению с молодыми клетками. Обработка старых клеток привела к повышению этих маркеров в обоих типах клеток. Затем оба пути, участвующие в протеолитической активности клеток, исследовали путем измерения образования аутофагосом и химотрипсин-подобной протеасомной активности, которые снижаются с возрастом. Обработка повышала оба пути до уровней, подобных или даже выше, чем у молодых клеток, что указывает на то, что ранние этапы перепрограммирования способствуют активному выведению деградированных биомолекул (ФИГ. 1D, 2D, 5G-H).
[0156] Что касается энергетического метаболизма, старые клетки демонстрируют сниженную митохондриальную активность, накопление активных форм кислорода (АФК) и нарушение регуляции чувствительности к питательным веществам. Таким образом, влияние обработки на старые клетки исследовали путем измерения трансмембранного потенциала митохондрий, митохондриальных АФК и уровней белка сиртуина 1 (SIRT1) в клетках. Транзиентное перепрограммирование повышало трансмембранный потенциал митохондрий в обоих типах клеток (ФИГ. 1E левая панель, 2E левая панель, 5E), при этом оно снижало АФК (ФИГ. 1E правая панель, 2E правая панель, 5F) и повышало уровни белка SIRT1 в фибробластах, аналогично молодым клеткам (ФИГ. 1F, 2F и 5D). Окрашивание на ассоциированную со старением бета-галактозидазу показало значительное снижение количества стареющих клеток в старых эндотелиальных клетках (ФИГ. 1H, 2H и 5I). Это снижение сопровождалось снижением провоспалительных цитокинов ассоциированного со старением секреторного фенотипа (SASP) (5J), опять же в эндотелиальных клетках. Наконец, ни в одном из типов клеток длина теломер, измеренная с помощью количественной флуоресцентной гибридизации in situ, не показала значимого увеличения при обработке (ФИГ. 1G и 2G), что позволяет предположить, что клетки не были дедифференцированы в подобное стволовым клеткам состояние, в котором активность теломеразы была бы реактивирована.
[0157] Затем оценивали стойкость этих эффектов, и при этом было обнаружено, что большинство из них в значительной степени сохранялось через четыре и шесть дней после прекращения перепрограммирования. То, как быстро проявляются эти физиологические омолаживающие изменения, исследовали путем повтора тех же серий экспериментов на фибробластах и эндотелиальных клетках, которые трансфицировали всего два дня подряд. Примечательно то, что данные показали, что большинство омолаживающих эффектов можно было наблюдать уже через два дня обработки, хотя большинство из них были более умеренными.
[0158] В совокупности представленные данные демонстрируют, что транзиентная экспрессия OSKMLN может вызывать быстрое, устойчивое уменьшение клеточного возраста в клетках человека на транскриптомном, эпигенетическом и клеточном уровнях. Важно то, что эти данные демонстрируют, что процесс "клеточного омоложения", который в настоящем описании называется эпигенетическим перепрограммированием старения или "ERA", очень рано и быстро задействуется в процессе перепрограммирования иПСК. Эти эпигенетические и транскрипционные изменения происходят до того, как произойдет какое-либо эпигенетическое перепрограммирование клеточной идентичности.
[0159] С этими признаками положительного влияния ERA на клеточное старение, были проведены эксперименты с целью исследования, может ли ERA также обращать воспалительные фенотипы, связанные со старением. После получения предварительного подтверждения такого обращения в эндотелиальных клетках (ФИГ. 5J) анализ был расширен с включением остеоартроза, заболевания, сильно связанного со старением и характеризующегося выраженным воспалительным спектром, поражающим хондроциты в суставе. Хондроциты выделяли из хрящей пациентов в возрасте 60-70 лет, перенесших операцию по полной замене суставов из-за поздней стадии ОА, и сравнивали результаты лечения с хондроцитами, выделенными у молодых лиц. Транзиентное перепрограммирование проводили в течение двух или трех дней, а анализ проводили через два дня после прекращения перепрограммирования, хотя более устойчивый эффект у пациентов наблюдали при более длительном лечении. Лечение показало значительное снижение уровней провоспалительных цитокинов (ФИГ. 7I), внутриклеточной мРНК RANKL и iNOS2, а также уровней воспалительных факторов, секретируемых клетками (ФИГ. 3H-I и 7I). Кроме того, ERA способствовало пролиферации клеток (ФИГ. 3A и 7D), повышало продукцию АТФ (ФИГ. 3C и 7A) и снижало окислительный стресс, о чем свидетельствовало снижение митохондриальных АФК и повышение уровней РНК антиоксиданта SOD2 (ФИГ. 3D, 3E, 7B и 7D), гена, даунрегуляция которого была показана при ОА. ERA не влияло на уровень экспрессии SOX9 (основного фактора транскрипции, определяющего идентичность и функцию хондроцитов) и значительно повышало уровень экспрессии COL2A1 (основного коллагена в суставном хряще) (кОТ-ПЦР на ФИГ. 3B, 7E и 7F), указывая на сохранение идентичности хондрогенных клеток. В совокупности эти результаты показывают, что транзиентная экспрессия OSKMLN может способствовать частичному обращению экспрессии генов и клеточной физиологии в старых хондроцитах OA в сторону более здорового состояния.
[0160] Потеря функции и регенеративной способности стволовых клеток представляет собой еще один важный признак старения. Проводили эксперименты по оценке влияния транзиентного перепрограммирования на возрастные изменения в соматических стволовых клетках, которые нарушают регенерацию. Во-первых, эффект транзиентного перепрограммирования исследовали на стволовых клетках скелетных мышц мыши (MuSC). MuSC обрабатывали в течение 2 дней, при этом их поддерживали в состоянии покоя при использовании искусственной ниши. Первоначальные эксперименты проводили с молодыми (3 месяца) и старыми (20-24 месяца) мышиными MuSC, выделенными с помощью FACS. Обработка старых MuSC сокращала как время первого деления, приближаясь к более быстрой кинетике активации покоящихся молодых MuSC, так и митохондриальную массу. Более того, обработка частично возвращала сниженную способность одиночных MuSC образовывать колонии. Эти клетки дополнительно культивировали, и данные показали, что обработка не изменяла экспрессии миогенного маркера MyoD, но вместо этого улучшала их способность дифференцироваться в мышечные трубочки, указывая на то, что транзиентное перепрограммирование не нарушает миогенный путь дифференцировки, но может усиливать миогенный потенциал.
[0161] Затем проверяли функцию и способность MuSC к регенерации новой ткани in vivo. Для этого молодые, старые или транзиентно перепрограммированные старые MuSC трансдуцировали лентивирусом, экспрессирующим люциферазу и зеленый флуоресцентный белок (GFP), после чего клетки трансплантировали в поврежденные передние большеберцовые мышцы (ТА) мышей с ослабленным иммунитетом. Продольная биолюминесцентная визуализация (BLI) первоначально показала, что мышцы после трансплантации обработанных старых MuSC показали наиболее высокий сигнал (день 4, ФИГ. 4B), но стали сопоставимы с мышцами с молодыми MuSC в день 11 после трансплантации; и наоборот, мышцы с необработанными старыми MuSC показали более низкие сигналы во всех точках времени после трансплантации (ФИГ. 4B). Иммунофлуоресцентный анализ дополнительно выявил более высокое количество мышечных волокон донорского происхождения (GFP+) в мышцах ТА после трансплантации обработанных MuSC по сравнению с необработанными старыми MuSC (ФИГ. 4C). Более того, GFP+ мышечные волокна из обработанных старых клеток демонстрируют увеличенную площадь поперечного сечения по сравнению с их необработанными аналогами, и фактически даже больше, чем в молодых контролях (ФИГ. 4D). В совокупности эти результаты указывают на улучшенный потенциал регенерации тканей транзиентно перепрограммированных старых MuSC. Через 3 месяца всех мышей подвергали аутопсии, при которой не было обнаружено никаких неопластических очагов или тератом.
[0162] Для проверки потенциальных долгосрочных эффектов лечения, второе повреждение наносили через 60 дней после трансплантации клеток, при этом данные снова показали, что мышцы TA после трансплантации транзиентно перепрограммированных старых клеток MuSC давали более высокие сигналы BLI (ФИГ. 4E).
[0163] Саркопения является возрастным заболеванием, которое характеризуется потерей мышечной массы и силы. Аналогичным образом, у мышей мышечные функции демонстрируют прогрессирующую дегенерацию с возрастом. С целью проверки, улучшит ли транзиентное перепрограммирование старых MuSC клеточное лечение при восстановлении физиологических функций мышц у старых мышей, проводили электрофизиологическое исследование для измерения выработки тетанической силы в мышцах ТА, выделенных у молодых (4 месяца) или старых (27 месяцев) мышей с иммунодефицитом. Данные показали, что мышцы ТА старых мышей обладают более низкими силами тетанических сокращений по сравнению с молодыми мышами, что свидетельствует о возрастной потере силы (ФИГ. 8F). Затем MuSC выделяли у старых мышей (20-24 месяца). После обработки старых MuSC клетки трансплантировали в поврежденные кардиотоксином мышцы ТА старых (27 месяцев) мышей с иммунодефицитом. На полную регенерацию пересаженных мышц отвели тридцать (30) дней. Электрофизиологическое исследование проводили для измерения силы тетанического сокращения. Мышцы после трансплантации необработанных старых MuSC, показали силу, сравнимую с не подвергавшимися трансплантации мышцами старых контрольных мышей (Фиг. 4h). Напротив, мышцы, получавшие обработанные старые MuSC, показали тетаническую силу, сопоставимую с мышцами молодых контрольных мышей без трансплантации. Эти результаты подтверждают, что транзиентное перепрограммирование в комбинации с терапией на основе MuSC может восстанавливать физиологическую функцию старых мышц до уровня молодых мышц.
[0164] Наконец, эти результаты перенесли на человеческие MuSC. Исследование повторяли при использовании операционных образцов, полученных от пациентов разного возраста (от 10 до 80 лет), с трансдукцией их лентивирусными векторами, экспрессирующими GFP и люциферазу. Как и у мышей, трансплантация транзиентно перепрограммированных старых человеческих MuSC приводила к усилению сигналов BLI по сравнению с необработанными MuSC от того же лица и сравнимому уровню сигналов, наблюдаемых с молодыми MuSC (ФИГ. 8D). Примечательно, что отношение сигналов BLI между контрлатеральными мышцами с обработанными и необработанными MuSC было выше в старшей возрастной группе (60-80 лет), чем в группах более молодого возраста (10-30 или 30-55 лет), что дает основания предполагать, что ERA восстанавливает в старых клетках потерянные функции до более молодых уровней (ФИГ. 8E). В совокупности эти результаты указывают, что транзиентное перепрограммирование частично восстанавливает активность старых MuSC до степени, аналогичной таковой у молодых MuSC, без нарушения их пути дифференцировки, и, таким образом, обладает потенциалом в качестве клеточной терапии в регенеративной медицине.
[0165] Трехмерные (3D), сконструированные in vitro образцы кожи воссоздавали, комбинируя фибробласты и кератиноциты от пациентов старше 65 лет, и трансфицировали путем добавления смеси факторов перепрограммирования в среду культивирования. Гистологический анализ проводили для оценки качества и присваивали числовую оценку (Фиг. 8А). Омоложение наблюдали с факторами перепрограммирования, как измеряли по увеличению числовой оценки по сравнению с контрольными необработанными образцами и образцами, обработанными ретиноевой кислотой.
[0166] Эпителиальные клетки сетчатки культивировали ex vivo и транзиентно перепрограммировали OSKMN в течение двух или трех дней. Результаты показали значительное снижение экспрессии p16 (ФИГ. 9A), p21 (ФИГ. 9B), IL8 и (ФИГ. 9C) PGC1a (ФИГ. 9D).
[0167] Ядерное перепрограммирование в индуцированные плюрипотентные стволовые клетки (иПСК) представляет собой многоэтапный процесс, включающий инициацию, созревание и стабилизацию. По завершении такого динамического и сложного "эпигенетического перепрограммирования", иПСК становятся не только плюрипотентными, но и молодыми. Данные в настоящем документе продемонстрировали, что неинтегративная платформа транзиентного клеточного перепрограммирования на основе мРНК может очень быстро обращать вспять признаки старения в фазе инициации, пока эпигенетическое стирание идентичности клетки еще не произошло. Данные показывают, что процесс омоложения происходит в старых клетках человека, с восстановлением утраченной функциональности в больных клетках и старых стволовых клетках с сохранением при этом клеточной идентичности.
[0168] Пример 2: Методы
[0169] Трансфекция мРНК: Клетки трансфицировали либо с использованием mRNA-In (mTI Global Stem) для фибробластов и хондроцитов, чтобы снизить токсичность клеток, либо Lipofectamine MessengerMax (Thermo Fisher) для эндотелиальных клеток и MuSC, которые было труднее трансфицировать, с использованием протокола производителя. Культуральную среду меняли для фибробластов и эндотелиальных клеток через 4 часа после трансфекции, но не для хондроцитов или MuSC, так как для получения значительного захвата мРНК требовалось инкубирование в течение ночи. Эффективность доставки подтверждали по мРНК GFP и иммуноокрашивании отдельных факторов в смеси OSKMNL. Синтез мРНК и оптимизацию трансфекции проводили совместно с Йенсом Дуррути-Дуррути (Jens Durruthy-Durruthy), также членом Sebastiano Lab, и лабораториями в компании ESI BIO, в которой он был консультантом.
[0170] Выделение и культивирование фибробластов: Выделение производили у здорового пациента, которому делали биопсию в мезиальной части середины плеча или на животе с использованием 2 мм Панч-биопсий, взятых в смешанной группе пациентов мужского и женского пола возрастом 60-70 лет (пожилых) и 30-40 лет (молодых). Клетки культивировали из этих эксплантатов и поддерживали в минимальной среде Игла с солями Эрла и добавкой заменимых аминокислот, 10% фетальной бычьей сыворотки и 1% пенициллина/стрептомицина.
[0171] Выделение и культивирование эндотелиальных клеток: Выделение проводили в Институте Кориелла из подвздошной артерии и вены, удаленных у доноров перед наступлением смерти, которые умерли от внезапной травмы головы, но не имели других патологий, возрастом 45-50 лет (пожилые) и подростков (молодые). Ткань обрабатывали коллагеназой и клетки, высвобожденные из просвета, использовали для инициации культуры. Клетки поддерживали в Среде 199 с добавкой 2 мМ L-глутамина, 15 фетальной бычьей сыворотки, 0,02 мг/мл добавки для роста эндотелия, 0,05 мг/мл гепарина и 1% пенициллина/стрептомицина.
[0172] Иммуноцитохимия ядер: Клетки промывали HBSS, затем фиксировали 15% параформальдегидом в PBS в течение 15 минут. Затем клетки блокировали в течение 30 минут блокирующим раствором, содержащим 1% BSA и 0,3% Triton X-100 в PBS. Затем наносили первичные антитела в 1% BSA и 0,3% Triton X-100 в PBS и оставляли для инкубирования на ночь при 4°C. На следующий день клетки промывали HBSS, после чего добавляли соответствующие вторичные антитела, меченные Alexa Flour, и инкубировали в течение 2 часов. Затем клетки снова промывали и после этого окрашивали DAPI в течение 30 минут. Наконец, клетки помещали в HBSS для визуализации.
[0173] Окрашивание формирования аутофагосомы: Клетки промывали HBSS и помещали в окрашивающий раствор, содержащий флуоресцентный маркер аутофагосом на основе LC3 (Sigma). Затем клетки инкубировали при 37°C с 5% CO2 в течение 20 минут. Затем клетки 2 раза промывали HBSS/Ca/Mg. После этого клетки окрашивали в течение 15 минут при использовании CellTracker Deep Red, красителя для мечения клеток. Затем клетки помещали в HBSS/Ca/Mg для визуализации одиночных клеток с помощью системы Operetta.
[0174] Измерение активности протеасом: Лунки сначала окрашивали PrestoBlue (Thermo), красителем для оценки жизнеспособности клеток, в течение 10 минут. Сигналы лунок считывали с помощью флуоресцентного анализатора планшетов TECAN. Затем клетки промывали HBSS/Ca/Mg, после чего переносили в исходную среду, содержащую флуорогенный субстрат LLVY-R110 (Sigma), который расщепляется под действием химотрипсин-подобной активности 20S-протеасомы. Затем клетки инкубировали при 37°C с 5% CO2 в течение 2 часов, после чего снова считывали на флуоресцентном анализаторе планшетов TECAN.
[0175] Окрашивание митохондрий в зависимости от трансмембранного потенциала: Тетраметилродамин, метиловый эфир, перхлорат (Thermo) добавляли в среду культивирования клеток, этот краситель блокируется митохондриями в зависимости от их трансмембранного потенциала. Затем клетки инкубировали в течение 30 минут при 37°C с 5% CO2. Затем клетки 2 раза промывали HBSS/Ca/Mg, после чего окрашивали в течение 15 минут при использовании CellTracker Deep Red. Наконец, клетки визуализировали в свежем HBSS/Ca/Mg с помощью системы Operetta.
[0176] Измерение АФК в митохондриях: Клетки промывали HBSS/Ca/Mg, затем помещали в HBSS/Ca/Mg, содержащий MitoSOX, флуорогенный краситель, который окисляется супероксидами в митохондрии. Клетки инкубировали в течение 10 минут при 37°C с 5% CO2. Затем клетки два раза промывали HBSS/Ca/Mg, после чего окрашивали в течение 15 минут при использовании CellTracker Deep Red. Наконец, клетки визуализировали в свежем HBSS/Ca/Mg с помощью системы Operetta.
[0177] Гистохимия SaβGal: Клетки два раза промывали HBSS/Ca/Mg, затем фиксировали 15% параформальдегидом в PBS в течение 6 минут. Затем клетки 3 раза промывали HBSS/Ca/Mg, после чего окрашивали хромогенным субстратом X-Gal, расщепляемым эндогенной B-галактозидазой. Клетки выдерживали в окрашивающем растворе и инкубировали в течение ночи при 37°C с атмосферным CO2. На следующий день клетки снова промывали HBSS/Ca/Mg, после чего помещали в 70% раствор глицерина для визуализации под светлопольным микроскопом Leica.
[0178] Анализ профиля цитокинов: Эта работа была выполнена совместно с Центром иммунного мониторинга человека при Стэнфордском университете. Клеточные среды собирали и центрифугировали при 400 rcf в течение 10 минут при КТ. Затем супернатант мгновенно замораживали в жидком азоте до анализа. Анализ проводили с использованием 63-плексного набора биомаркеров человека (eBiosciences/Affymetrix). Гранулы добавляли в 96-луночный планшет и промывали в промывателе Biotek ELx405. Образцы добавляли в планшет, содержащий смешанные гранулы, связанные с антителами, и инкубировали при комнатной температуре в течение 1 часа с последующим инкубированием в течение ночи при 4°C при встряхивании. Этапы инкубирования при низкой и комнатной температуре выполнялись на орбитальном шейкере при 500-600 об/мин. После инкубирования в течение ночи планшеты промывали в промывателе Biotek ELx405, а затем добавляли биотинилированное детектирующее антитело на 75 минут при комнатной температуре со встряхиванием. Планшет промывали, как указано выше, и добавляли стрептавидин-ФЭ. После инкубирования в течение 30 минут при комнатной температуре проводили промывку, как указано выше, и добавляли в лунки буфер для считывания. Каждый образец измеряли в двух повторностях. Планшеты считывали с помощью прибора Luminex 200 с нижней границей 50 гранул на образец на цитокин. Во все лунки добавляли специальные контрольные гранулы для анализа производства Radix Biosolutions.
[0179] Антитела: 5 первичных антител использовали для измерений ядер: Кроличье антитело против метилированного гистона H3K9me3 (1:4000), мышиное антитело против маркера гетерохроматина HP1γ (1:200), кроличье антитело против ядерного организационного белка LAP2α (1:500), мышиное антитело против маркера ядерной оболочки ламинина A/C и кроличье антитело против SIRT1 (1:200).
[0180] Секвенирование РНК и анализ данных
[0181] Клетки промывали и лизировали Тризолом (Thermo). Суммарную РНК выделяли при использовании набора для очистки суммарной РНК (Norgen Biotek Corp) и оценивали качество РНК с помощью набора для анализа РНК ScreenTape (R6K ScreenTape, Agilent), РНК с показателем целостности RIN>9 подвергали обратной транскрипции с получением кДНК. Библиотеки кДНК получали при использовании 1 мкг суммарной РНК с использованием набора TruSeq RNA Sample Preparation Kit v2 (Illumina). Качество РНК оценивали с помощью Agilent Bioanalyzer 2100, РНК с RIN>9 подвергали обратной транскрипции с получением кДНК. Библиотеки кДНК получали при использовании 500 нг суммарной РНК с использованием набора TruSeq RNA Sample Preparation Kit v2 (Illumina) с дополнительным преимуществом молекулярной индексации. Перед какими-либо этапами ПЦР-амплификации все концы фрагментов кДНК рандомно лигировали с парой адаптеров, содержащих уникальную молекулярную метку длиной 8 п.н. Библиотеки кДНК с молекулярными метками затем амплифицировали с помощью ПЦР (15 циклов) и затем подвергали контролю качества (QC) с использованием Bioanalzyer и Qubit. После успешного QC их секвенировали на платформе Illumina Nextseq с получением односторонних чтений длиной 80 п.н. Чтения обрезали, по 2 нуклеотида на каждом конце, для удаления фрагментов низкого качества и улучшения картирования в геноме. Полученные чтения длиной 78 нуклеотидов уплотняли путем удаления дубликатов, но отслеживая, сколько раз каждая последовательность встречалась в каждом образце в базе данных. Затем уникальные чтения картировали в геноме человека с использованием точных совпадений. Неверные чтения, пересекающее экзон-экзонные границы, а также чтения с ошибками и SNP/мутациями, но они не оказывали существенного влияния на оценку уровней экспрессии каждого гена. Затем каждому картированному чтению присваивали аннотации из лежащего в основе генома. В случае нескольких аннотаций (например, мкРНК, встречающейся в интроне гена) использовали иерархию на основе эвристического подхода для придания уникальности каждому чтению. Затем ее использовали для идентификации чтений, относящихся к каждому транскрипту, при этом устанавливали перекрывание каждого положения в транскрипте. Это перекрывание является неравномерным и резким, поэтому медианное значение этого перекрывания использовали в качестве оценки экспрессии гена. Для сравнения экспрессии в разных образцах использовали квантильную нормализацию. Дальнейший анализ данных выполняли в MATLAB. Затем вычисляли отношения уровней экспрессии для оценки логарифма (по основанию 2) кратного изменения. Для определения значимости использовали t-критерий Стьюдента с пороговым значением p<0,05. Для идентификации факторов транскрипции использовали генный анализ ENCODE, который был разработан и переведен в открытый доступ лабораторией Атула Бьютта, ведущей исследования в области биомедицинской информатики в Стэнфордском центре.
[0182] Мыши: Самцы мышей C57BL/6 и мыши NSG были получены из Jackson Laboratory. Самки мышей NOD/MrkBomTac-Prkdcscid были получены из Taconic Biosciences. Мышей содержали в виварии Системы медицинсково обслуживания Департамента по делам ветеранов Пало-Альто (VAPAHCS). Протоколы на животных были одобрены Административным советом по уходу за лабораторными животными Стэнфордского университета.
[0183] Образцы скелетных мышц человека: Возраст участников составлял от 10 до 78 лет. Образцы биопсии мышц человека были взяты после предоставления пациентами информированного согласия, как часть протокола исследований с участием людей, одобренного Наблюдательным советом Стэнфордского университета. Все эксперименты проводили с использованием свежих образцов мышц, в зависимости от доступности клинических процедур. Обработку образцов для клеточного анализа начинали в течение от одного до двенадцати часов после выделения образца. Во всех исследованиях стандартное отклонение отражает вариабельность данных, полученных в исследованиях с использованием истинных биологических реплик (то есть уникальных доноров). Данные не коррелировали с информацией, идентифицирующей личность донора.
[0184] Выделение и очистка MuSC: Мышцы забирали с задних конечностей и механически разделяли с получением фрагментированной мышечной суспензии. После этого в течение 45-50 минут проводили расщепление в растворе Коллагеназы II-Ham's F10 (500 единиц в мл; Invitrogen). После промывки проводили второе расщепление в течение 30 минут Коллагеназой II (100 единиц в мл) и Диспазой (2 единицы в мл; ThermoFisher). Полученную суспензию клеток промывали, фильтровали и окрашивали антителами VCAM-биотин (клон 429; BD Bioscience), CD31-ФИТЦ (клон MEC 13.3; BD Bioscience), CD45-АФЦ (клон 30-F11; BD Bioscience) и Sca-1-Pacific-Blue (клон D7; Biolegend) в разведении 1:100. Человеческие MuSC очищали из свежих операционных образцов 50,51. Операционные образцы осторожно вырезали из жировой и фиброзной ткани и приготавливали суспензию разделенных мышц, как описано для мышечной ткани. Полученную суспензию клеток затем промывали, фильтровали и окрашивали антителом к CD31-Alexa Fluor 488 (клон WM59; BioLegend; #303110, 1:75), антителом к CD45-Alexa Fluor 488 (клон HI30; Invitrogen; #MHCD4520, 1:75), антителом к CD34-ФИТЦ (клон 581; BioLegend; #343503, 1:75), антителом к CD29-АФЦ (клон TS2/16; BioLegend; #303008, 1:75) и антителом к NCAM-биотин (клон HCD56; BioLegend; #318319, 1:75). Затем несвязавшиеся первичные антитела промывали и инкубировали клетки в течение 15 мин при 4°C в стрептавидин-ФЭ/Cy7 (BioLegend) для обнаружения NCAM-биотина. Сортировку клеток выполняли на калиброванных проточных цитометрах BD-FACS Aria II или BD FACSAria III, оборудованных 488 нм, 633 нм и 405 нм лазерами, с получением популяции MuSC. Небольшую фракцию отсортированных клеток сеяли и окрашивали на Pax7 и MyoD для оценки чистоты отсортированной популяции. По поводу стратегии FACS-гейтирования, см. Дополнительную информацию.
[0185] Визуализация биолюминесценции: Биолюминесцентную визуализацию проводили с использованием системы Xenogen IVIS-Spectrum (Caliper Life Sciences). Мышам делали анестезию 2% изофлураном при скорости потока 2,5 л/мин (n=4). Вводили внутрибрюшинную инъекцию D-люциферина (50 мг/мл, Biosynth International Inc.), растворенного в стерильном PBS. Сразу после инъекции мышей визуализировали в течение 30 секунд при максимальной чувствительности (деление диафрагмы 1) при наибольшем разрешении (малый биннинг). Каждую минуту делали 30-секундную экспозицию, пока пиковая интенсивность биолюминесцентного сигнала не начинала уменьшаться. Каждое изображение сохраняли для последующего анализа. Визуализацию проводили вслепую: исследователям, выполнявшим визуализацию, не была известна идентифицирующая информация по экспериментальным условиям для трансплантированных клеток.
[0186] Анализ изображения биолюминесценции: Анализ каждого изображения выполняли с помощью программы Living Image, версии 4.0 (Caliper Life Sciences). Вручную сгенерированный круг помещали сверху интересующей области и изменяли его размер, чтобы полностью окружить конечность или указанную область у реципиентной мыши. Аналогичным образом, фоновую интересующую область помещали на область у мыши вне конечности, подвергавшейся трансплантации.
[0187] Сбор тканей: ТА мышцы осторожно отделяли от кости, взвешивали и помещали в 0,5% раствор ПФА для фиксации на ночь. Затем мышцы переносили в 20% раствор сахарозы на 3 часа или до тех пор, пока мышцы не достигали точки насыщения и не начинали опускаться. Затем ткани заливали и замораживали в среде Optimal Cutting Temperature (OCT) и хранили при -80°C до изготовления срезов. Срезы изготавливали на криостате Leica CM3050S, который был установлен на получение срезов толщиной 10 мкм. Срезы устанавливали на предметные стекла Fisherbrand Colorfrost. Эти препараты хранили при -20°C до проведения иммуногистохимического исследования.
[0188] Гистология: Мышцы TA фиксировали в течение 5 часов при использовании 0,5% параформальдегида для электронной микроскопии и затем переносили в 20% сахарозу на ночь. Затем мышцы замораживали в OCT, в замороженном состоянии изготавливали срезы толщиной 10 мкм и окрашивали. Для колориметрического окрашивания гематоксилином и эозином (Sigma) или Gomorri Trichrome (Richard-Allan Scientific), образцы обрабатывали согласно протоколам, рекомендованным производителем.
[0189] Иммуноокрашивание MuSC: Одночасовую стадию блокирования с использованием 20% ослиной сыворотки/0,3% Triton в PBS использовали для предотвращения нежелательного связывания первичных антител для всех образцов. Добавляли первичные антитела и инкубировали в течение ночи при 4°C в 20% ослиной сыворотке/0,3% Triton в PBS. После 4 промывок 0,3% PBST, добавляли конъюгированные с флуоресцентной меткой вторичные антитела и инкубировали при комнатной температуре в течение 1 часа в 0,3% PBST. После 3 дополнительных промывок каждый препарат устанавливали при использовании среды для заливки Fluoview.
[0190] Антитела: В этом исследовании использовали следующие антитела. Источник каждого антитела указан. Мышь: GFP (Invitrogen, #A11122, 1:250); Люцифераза (Sigma-Aldrich, #L0159, 1:200); Коллаген I (Cedarlane Labs, #CL50151AP, 1:200); HSP47 (Abcam, #ab77609, 1:200).
[0191] Визуализация: Образцы визуализировали при использовании стандартной флуоресцентной микроскопии и 10× или 20× объектива для воздушной иммерсии. Программа для визуализации Volocity использовалась для настройки фильтров возбуждения и эмиссии и поставлялась с предварительно установленными настройками для фильтра AlexaFluor, которые использовались при каждой возможности. Время экспозиции оптимизировали во время первого раунда визуализации, а затем оставляли постоянным в течение всей последующей визуализации.
[0192] Анализ изображения: Image J использовали для вычисления процента площади, состоящей из коллагена, при использовании плагина цветового порога для создания маски только для области, положительной на коллаген. Затем эту область делили на общую площадь образца, которая была определена с помощью бесплатного средства для рисования. Все остальные анализы выполняли при использовании программы Volocity и ручного подсчета волокон с помощью бесплатного средства для рисования, а также ручного подсчета количества ядер, волокон eMHC+, нервно-мышечных синапсов и кровеносных сосудов.
[0193] Лентивирусная трансдукция: Репортеры люциферазу и белок GFP субклонировали в лентивирусный вектор третьего поколения на основе ВИЧ-1 (CD51X DPS, SystemBio). Для трансдукции свежевыделенные клетки MuSC сеяли при плотности 30000-40000 клеток в лунке на покрытый поли-D-лизином (Millipore Sigma, A-003-E) и ECM 8-луночную слайд-камеру (Millipore Sigma, PEZGS0896) и инкубировали с 5 мкл концентрированного вируса в лунке и 8 мкг/мл полибрена (Santa Cruz Biotechnology, sc-134220). Планшеты центрифугировали в течение 5 минут при 3200 g и в течение 1 часа при 2500 g, при 25°C. Затем клетки два раза промывали свежей средой, снимали с планшетов и ресуспендировали в конечном объеме в соответствии с экспериментальными условиями.
[0194] Окрашивание MitoTracker и анализ методом проточной цитометрии: Клетки MuSC, подвергаемые перепрограммированию, и контроли два раза промывали чистой Hams F10 (без сыворотки или пен/стреп). Затем MuSC окрашивали 0,5 мкМ MitoTracker Green FM (ThermoFisher, M7514) и DAPI в течение 30 минут при 37°C, три раза промывали чистой Hams F10 и исследовали при использовании проточного цитометра BD FACSAria III.
[0195] Статистический анализ: Если не указано иное, все статистические анализы проводили при использовании MATLAB R2017a (MathWorks Software) или GraphPad Prism 5 (GraphPad Software). Для статистического анализа использовали t-критерий. Все планки погрешностей представляют собой s.e.m .; *р<0,05; **p<0,001; ***р<0,0001.
[0196] Несмотря на то, что были проиллюстрированы и описаны предпочтительные варианты осуществления изобретения, следует понимать, что в них могут быть внесены различные изменения без отступления за рамки сущности и объема изобретения.
ИСПОЛЬЗОВАННЫЕ ИСТОЧНИКИ
Zhang, R., Chen, H. Z. & Liu, D. P. The Four Layers of Aging. Cell Syst1, 180-186, doi:10.1016/j.cels.2015.09.002 (2015).
2 Mahmoudi, S. & Brunet, A. Aging and reprogramming: a two-way street. Curr Opin Cell Biol24, 744-756, doi:10.1016/j.ceb.2012.10.004 (2012).
3 Booth, L. N. & Brunet, A. The Aging Epigenome. Mol Cell62, 728-744, doi:10.1016/j.molcel.2016.05.013 (2016).
4 Studer, L., Vera, E. & Cornacchia, D. Programming and Reprogramming Cellular Age in the Era of Induced Pluripotency. Cell Stem Cell16, 591-600, doi:10.1016/j.stem.2015.05.004 (2015).
5 Horvath, S. DNA methylation age of human tissues and cell types. Genome Biol14, R115, doi:10.1186/gb-2013-14-10-r115 (2013).
6 Ocampo, A. et al. In Vivo Amelioration of Age-Associated Hallmarks by Partial Reprogramming. Cell167, 1719-1733 e1712, doi:10.1016/j.cell.2016.11.052 (2016).
7 Miller, J. & Studer, L. Aging in iPS cells. Aging (Albany NY)6, 246-247, doi:10.18632/aging.100653 (2014).
8 Miller, J. D. et al. Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell Stem Cell13, 691-705, doi:10.1016/j.stem.2013.11.006 (2013).
9 Mertens, J. et al. Directly Reprogrammed Human Neurons Retain Aging-Associated Transcriptomic Signatures and Reveal Age-Related Nucleocytoplasmic Defects. Cell Stem Cell17, 705-718, doi:10.1016/j.stem.2015.09.001 (2015).
10 Durruthy, J. D. & Sebastiano, V. Derivation of GMP-compliant integration-free hiPSCs using modified mRNAs. Methods Mol Biol1283, 31-42, doi:10.1007/7651_2014_124 (2015).
11 Durruthy-Durruthy, J. et al. The primate-specific noncoding RNA HPAT5 regulates pluripotency during human preimplantation development and nuclear reprogramming. Nature genetics48, 44-52, doi:10.1038/ng.3449 (2016).
12 Liberzon, A. et al. The Molecular Signatures Database (MSigDB) hallmark gene set collection. Cell Syst1, 417-425, doi:10.1016/j.cels.2015.12.004 (2015).
13 Marioni, R. E. et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol16, 25, doi:10.1186/s13059-015-0584-6 (2015).
14 Horvath, S. & Raj, K. DNA methylation-based biomarkers and the epigenetic clock theory of ageing. Nat Rev Genet19, 371-384, doi:10.1038/s41576-018-0004-3 (2018).
15 Chen, B. H. et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death. Aging (Albany NY)8, 1844-1865, doi:10.18632/aging.101020 (2016).
16 Horvath, S. et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging (Albany NY)10, 1758-1775, doi:10.18632/aging.101508 (2018).
17 Lopez-Otin, C., Blasco, M. A., Partridge, L., Serrano, M. & Kroemer, G. The hallmarks of aging. Cell153, 1194-1217, doi:10.1016/j.cell.2013.05.039 (2013).
18 Gamerdinger, M. et al. Protein quality control during aging involves recruitment of the macroautophagy pathway by BAG3. EMBO J28, 889-901, doi:10.1038/emboj.2009.29 (2009).
19 Kang, H. T., Lee, K. B., Kim, S. Y., Choi, H. R. & Park, S. C. Autophagy impairment induces premature senescence in primary human fibroblasts. PloS one6, e23367, doi:10.1371/journal.pone.0023367 (2011).
20 Donato, A. J. et al. SIRT-1 and vascular endothelial dysfunction with ageing in mice and humans. J Physiol589, 4545-4554, doi:10.1113/jphysiol.2011.211219 (2011).
21 Hamilton, J. A. GM-CSF in inflammation and autoimmunity. Trends Immunol23, 403-408 (2002).
22 Gerdes, N. et al. Expression of interleukin (IL)-18 and functional IL-18 receptor on human vascular endothelial cells, smooth muscle cells, and macrophages: implications for atherogenesis. J Exp Med195, 245-257 (2002).
23 Canela, A., Vera, E., Klatt, P. & Blasco, M. A. High-throughput telomere length quantification by FISH and its application to human population studies. Proc Natl Acad Sci U S A104, 5300-5305, doi:10.1073/pnas.0609367104 (2007).
24 Zhang, Y. & Jordan, J. M. Epidemiology of osteoarthritis. Clin Geriatr Med26, 355-369, doi:10.1016/j.cger.2010.03.001 (2010).
25 Scott, J. L. et al. Superoxide dismutase downregulation in osteoarthritis progression and end-stage disease. Ann Rheum Dis69, 1502-1510, doi:10.1136/ard.2009.119966 (2010).
26 Quarta, M. et al. An artificial niche preserves the quiescence of muscle stem cells and enhances their therapeutic efficacy. Nat Biotechnol34, 752-759, doi:10.1038/nbt.3576 (2016).
27 Schultz, E. & Lipton, B. H. Skeletal muscle satellite cells: changes in proliferation potential as a function of age. Mech Ageing Dev20, 377-383 (1982).
28 Collins-Hooper, H. et al. Age-related changes in speed and mechanism of adult skeletal muscle stem cell migration. Stem Cells30, 1182-1195, doi:10.1002/stem.1088 (2012).
29 Garcia-Prat, L. et al. Autophagy maintains stemness by preventing senescence. Nature529, 37-42, doi:10.1038/nature16187 (2016).
30 Chang, J. et al. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nat Med22, 78-83, doi:10.1038/nm.4010 (2016).
31 Calvani, R. et al. Biomarkers for physical frailty and sarcopenia. Aging Clin Exp Res29, 29-34, doi:10.1007/s40520-016-0708-1 (2017).
32 Naranjo, J. D., Dziki, J. L. & Badylak, S. F. Regenerative Medicine Approaches for Age-Related Muscle Loss and Sarcopenia: A Mini-Review. Gerontology63, 580-589, doi:10.1159/000479278 (2017).
33 Ballak, S. B., Degens, H., de Haan, A. & Jaspers, R. T. Aging related changes in determinants of muscle force generating capacity: a comparison of muscle aging in men and male rodents. Ageing Res Rev14, 43-55, doi:10.1016/j.arr.2014.01.005 (2014).
34 Sayed, R. K. et al. Identification of morphological markers of sarcopenia at early stage of aging in skeletal muscle of mice. Exp Gerontol83, 22-30, doi:10.1016/j.exger.2016.07.007 (2016).
35 David, L. & Polo, J. M. Phases of reprogramming. Stem Cell Res12, 754-761, doi:10.1016/j.scr.2014.03.007 (2014).
36 Yener Ilce, B., Cagin, U. & Yilmazer, A. Cellular reprogramming: A new way to understand aging mechanisms. Wiley Interdiscip Rev Dev Biol7, doi:10.1002/wdev.308 (2018).
37 Rando, T. A. & Chang, H. Y. Aging, rejuvenation, and epigenetic reprogramming: resetting the aging clock. Cell148, 46-57, doi:10.1016/j.cell.2012.01.003 (2012).
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ P
[0197] Вариант осуществления P1. Способ омолажения клеток, включающий: a) трансфекцию клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где трансфекцию выполняют один раз в день в течение по меньшей мере двух дней и не больше чем 4 дней; и b) трансляцию одной или более неинтегративных матричных РНК с получением одного или более факторов клеточного перепрограммирования в клетках, что приводит к транзиентному перепрограммированию клеток, где клетки омолаживаются без дедифференцировки в стволовые клетки.
[0198] Вариант осуществления P2. Способ согласно варианту осуществления P1, где один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0199] Вариант осуществления P3. Способ согласно варианту осуществления P2, где факторы клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0200] Вариант осуществления P4. Способ согласно варианту осуществления P1, где клетки являются клетками млекопитающих.
[0201] Вариант осуществления P5. Способ согласно варианту осуществления P4, где клетки являются клетками человека.
[0202] Вариант осуществления P6. Способ согласно варианту осуществления P1, где клетки получены от пожилого субъекта.
[0203] Вариант осуществления P7. Способ согласно варианту осуществления P1, где клетки являются фибробластами, эндотелиальными клетками, хондроцитами или стволовыми клетками скелетных мышц.
[0204] Вариант осуществления P8. Способ согласно варианту осуществления P1, где транзиентное перепрограммирование приводит к повышению экспрессии HP1-гамма, H3K9me3, поддерживающего ламину белка, LAP2-альфа и белка SIRT1, уменьшению ядерной укладки, уменьшению блеббинга, увеличению формирования аутофагосом в клетках, повышению активности химотрипсин-подобных протеасом, повышению трансмембранного потенциала митохондрий или снижению уровня активных формы кислорода (АФК).
[0205] Вариант осуществления P9. Способ согласно варианту осуществления P1, где клетки находятся в ткани или органе.
[0206] Вариант осуществления P10. Способ согласно варианту осуществления P9, где транзиентное перепрограммирование снижает количество стареющих клеток в ткани или органе.
[0207] Вариант осуществления P11. Способ согласно варианту осуществления P9, где транзиентное перепрограммирование снижает экспрессию GMSCF, IL18 и TNFα.
[0208] Вариант осуществления P12. Способ согласно варианту осуществления P9, где лечение восстанавливает функцию, повышает активность, повышает жизнеспособность или увеличивает репликационную способность или время жизни клеток в ткани или органе.
[0209] Вариант осуществления P13. Способ согласно варианту осуществления P1, где способ проводят in vitro, ex vivo или in vivo.
[0210] Вариант осуществления P14. Способ согласно варианту осуществления P1, где трансфекцию проводят один раз в день в течение 3 дней или 4 дней.
[0211] Вариант осуществления P15. Способ лечения субъекта от возрастного заболевания или состояния, включающий: a) трансфекцию нуждающихся в омоложении клеток in vivo или ex vivo одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где трансфекцию выполняют один раз в день в течение по меньшей мере двух дней и не больше чем 4 дней; и b) экспрессию одного или более факторов клеточного перепрограммирования в клетках, что приводит к транзиентному перепрограммированию клеток, где клетки омолаживаются без дедифференцировки в стволовые клетки.
[0212] Вариант осуществления P16. Способ согласно варианту осуществления P15, где один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0213] Вариант осуществления P17. Способ согласно варианту осуществления P16, где факторы клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0214] Вариант осуществления P18. Способ согласно варианту осуществления P15, дополнительно включающий пересадку омоложенных клеток субъекту.
[0215] Вариант осуществления P19. Способ согласно варианту осуществления P15, где возрастное заболевание или состояние является дегенеративным заболеванием.
[0216] Вариант осуществления P20. Способ согласно варианту осуществления P15, где возрастное заболевание или состояние является нейродегенеративным заболеванием или заболеванием опорно-двигательного аппарата.
[0217] Вариант осуществления P21. Способ лечения субъекта от заболевания или нарушения, включающего дегенерацию хряща, где спосою включает: a) трансфекцию нуждающихся в омоложении хондроцитов in vivo или ex vivo одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где трансфекцию выполняют один раз в день в течение по меньшей мере двух дней и не больше чем 4 дней; и b) экспрессию одного или более факторов клеточного перепрограммирования в хондроцитах, что приводит к транзиентному перепрограммированию хондроцитов, где хондроциты омолаживаются без дедифференцировки в стволовые клетки.
[0218] Вариант осуществления P22. Способ согласно варианту осуществления P21, где один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0219] Вариант осуществления P23. Способ согласно варианту осуществления P22, где факторы клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0220] Вариант осуществления P24. Способ согласно варианту осуществления P21, где заболевание или нарушение, включающее дегенерацию хряща, является артритом.
[0221] Вариант осуществления P25. Способ согласно варианту осуществления P24, где артрит является остеоартрозом или ревматоидным артритом.
[0222] Вариант осуществления P26. Способ согласно варианту осуществления P21, где лечение уменьшает воспаление у субъекта.
[0223] Вариант осуществления P27. Способ согласно варианту осуществления P21, где трансфекцию проводят ex vivo и пересаживают омоложенные хондроциты в пораженный артритом сустав субъекта.
[0224] Вариант осуществления P28. Способ согласно варианту осуществления P27, где хондроциты выделены из образца хряща, полученного у субъекта.
[0225] Вариант осуществления P29. Способ согласно варианту осуществления P21, где лечение снижает экспрессию RANKL, iNOS, IL6, IL8, BDNF, IFNα, IFNγ и LIF и повышает экспрессию SOX9 и COL2A1 в хондроцитах.
[0226] Вариант осуществления P30. Способ согласно варианту осуществления P21, где субъектом является пожилой субъект.
[0227] Вариант осуществления P31. Способ согласно варианту осуществления P21, где субъектом является субъект млекопитающее.
[0228] Вариант осуществления P32. Способ согласно варианту осуществления P31, где субъектом млекопитающим является человек.
[0229] Вариант осуществления P33. Способ лечения заболевания или нарушения, включающего мышечную дегенерацию, у субъекта, где способ включает: a) трансфекцию стволовых клеток скелетных мышц in vivo или ex vivo одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, где трансфекцию проводят один раз в день в течение по меньшей мере двух дней и не больше чем 4 дней; и b) экспрессию одного или более факторов клеточного перепрограммирования в стволовых клетках скелетных мышц, что приводит к транзиентному перепрограммированию стволовых клеток скелетных мышц, где стволовые клетки скелетных мышц омолаживаются без потери их способности дифференцироваться в мышечные клетки.
[0230] Вариант осуществления P34. Способ согласно варианту осуществления P33, где один или более факторов клеточного перепрограммирования выбраны из группы, состоящей из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0231] Вариант осуществления P35. Способ согласно варианту осуществления P34, где факторы клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0232] Вариант осуществления P36. Способ согласно варианту осуществления P33, где трансфекцию проводят ex vivo и омоложенные стволовые клетки скелетных мышц пересаживают в нуждающуюся в репарации или регенерации мышцу у субъекта.
[0233] Вариант осуществления P37. Способ согласно варианту осуществления P33, где стволовые клетки скелетных мышц выделены из образца мышцы, полученного у субъекта.
[0234] Вариант осуществления P38. Способ согласно варианту осуществления P33, где лечение приводит к регенерации мышечных волокон.
[0235] Вариант осуществления P39. Способ согласно варианту осуществления P33, где лечение восстанавливает активность стволовых клеток скелетных мышц.
[0236] Вариант осуществления P40. Способ согласно варианту осуществления P33, где субъектом является пожилой субъект.
[0237] Вариант осуществления P41. Способ согласно варианту осуществления P33, где субъектом является субъект млекопитающее.
[0238] Вариант осуществления P42. Способ согласно варианту осуществления P41, где субъектом млекопитающим является человек.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[0239] Вариант осуществления 1. Способ омолажения клеток, включающий трансфекцию клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд, с получением в результате омоложенных клеток.
[0240] Вариант осуществления 2. Способ согласно варианту осуществления 1, где транскриптомный профиль омоложенных клеток становится более похожим на транскриптомный профиль молодых клеток.
[0241] Вариант осуществления 3. Способ согласно варианту осуществления 2, где транскриптомный профиль омоложенных клеток включает повышение экспрессии одного или более генов, выбранных из RPL37, RHOA, SRSF3, EPHB4, ARHGAP18, RPL31, FKBP2, MAP1LC3B2, Elf1, Phf8, Pol2s2, Taf1 и Sin3a.
[0242] Вариант осуществления 4. Способ согласно любому из предыдущих вариантов осуществления, где омоложенные клетки демонстрируют повышенную экспрессию гена одного или более ядерных и/или эпигенетических маркеров по сравнению с референсным значением.
[0243] Вариант осуществления 5. Способ согласно варианту осуществления 4, где маркер выбран из HP1-гамма, H3K9me3, поддерживающего ламину белка LAP2-альфа и белка SIRT1.
[0244] Вариант осуществления 6. Способ согласно любому из предыдущих вариантов осуществления, где омоложенные клетки демонстрируют повышенную протеолитическую активность по сравнению с референсным значением.
[0245] Вариант осуществления 7. Способ согласно варианту осуществления 6, где повышенную протеолитическую активность измеряют как увеличенное образование аутофагосом в клетке, повышенную химотрипсин-подобную протеасомную активность или комбинацию этого.
[0246] Вариант осуществления 8. Способ согласно любому из предыдущих вариантов осуществления, где омоложенные клетки демонстрируют улучшенное состояние и функцию митохондрий по сравнению с референсным значением.
[0247] Вариант осуществления 9. Способ согласно варианту осуществления 8, где улучшенное состояние и функция митохондрий измеряется как увеличение трансмембранного потенциала митохондрий, снижение активных форм кислорода (АФК) или их комбинация.
[0248] Вариант осуществления 10. Способ согласно любому из предыдущих вариантов осуществления, где омоложенные клетки демонстрируют сниженную экспрессию одного или более цитокинов SASP по сравнению с референсным значением.
[0249] Вариант осуществления 11. Способ согласно варианту осуществления 10, где цитокины SASP включают один или более из IL18, IL1A, GROA, IL22 и IL9.
[0250] Вариант осуществления 12. Способ согласно любому из предыдущих вариантов осуществления, где омоложенные клетки демонстрируют обращение ландшафта метилирования.
[0251] Вариант осуществления 13. Способ согласно варианту осуществления 12, где обращение ландшафта метилирования измеряют с помощью оценки по часам Хорвата.
[0252] Вариант осуществления 14. Способ согласно любому из вариантов осуществления 4-13, где референсное значение получено из старой клетки.
[0253] Вариант осуществления 15. Способ согласно любому из предыдущих вариантов осуществления, где трансфекция клеток матричными РНК включает способ, выбранный из опосредованной липофектамином и LT-1 трансфекции, опосредованной декстраном трансфекции, осаждения фосфатом кальция, опосредованной полибреном трансфекции, электропорации, инкапсулирования мРНК в липосомах и прямой микроинъекции.
[0254] Вариант осуществления 16. Способ согласно любому из предыдущих вариантов осуществления, где один или более факторов клеточного перепрограммирования выбраны из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0255] Вариант осуществления 17. Способ согласно любому из предыдущих вариантов осуществления, где один или более факторов клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0256] Вариант осуществления 18. Способ согласно любому из предыдущих вариантов осуществления, где клетки являются клетками млекопитающих.
[0257] Вариант осуществления 19. Способ согласно любому из предыдущих вариантов осуществления, где клетки являются клетками человека.
[0258] Вариант осуществления 20. Способ согласно любому из предыдущих вариантов осуществления, где клетки получены от пожилого субъекта.
[0259] Вариант осуществления 21. Способ согласно любому из предыдущих вариантов осуществления, где клетки выбраны из фибробластов, эндотелиальных клеток, хондроцитов, стволовых клеток скелетных мышц, кератиноцитов, мезенхимальных стволовых клеток и эпителиальных клеток роговицы.
[0260] Вариант осуществления 22. Способ согласно варианту осуществления 21, где клетки являются мезенхимальными стволовыми клетками.
[0261] Вариант осуществления 23. Способ согласно варианту осуществления 22, где омоложенные мезенхимальные стволовые клетки демонстрируют снижение параметров старения (p16, p21 и положительное окрашивание SAβGal), увеличенную пролиферацию клеток и/или снижение уровней АФК.
[0262] Вариант осуществления 24. Способ согласно любому из предыдущих вариантов осуществления, где способ выполняют in vitro, ex vivo или in vivo.
[0263] Вариант осуществления 25. Способ согласно варианту осуществления 24, где способ выполняют in vivo.
[0264] Вариант осуществления 26. Способ согласно варианту осуществления 25, где клетки находятся в ткани или органе.
[0265] Вариант осуществления 27. Способ согласно любому из вариантов осуществления 25-27, где способ снижает количество стареющих клеток в ткани или органе.
[0266] Вариант осуществления 28. Способ согласно любому из вариантов осуществления 25-27, где способ снижает экспрессию одного или более из IL18, IL1A, GROA, IL22 и IL9.
[0267] Вариант осуществления 29. Способ согласно любому из предыдущих вариантов осуществления, где способ восстанавливает функцию, повышает активность, повышает жизнеспособность, увеличивает репликационную способность или время жизни клеток или комбинация этого.
[0268] Вариант осуществления 30. Способ согласно любому из вариантов осуществления 1-24, где трансфекцию проводят один раз в день в течение 5 дней.
[0269] Вариант осуществления 31. Способ согласно любому из вариантов осуществления 1-24, где трансфекцию проводят один раз в день в течение 4 дней.
[0270] Вариант осуществления 32. Способ согласно любому из вариантов осуществления 1-24, где трансфекцию проводят один раз в день в течение 3 дней.
[0271] Вариант осуществления 33. Способ согласно любому из вариантов осуществления 1-24, где трансфекцию проводят один раз в день в течение 2 дней.
[0272] Вариант осуществления 34. Способ лечения субъекта от возрастного заболевания или состояния, нарушения с дегенерацией хрящевой ткани, нейродегенеративного нарушения и/или скелетно-мышечной дисфункции, включающий введение терапевтически эффективного количества клеток, где клетки включают одну или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования.
[0273] Вариант осуществления 35. Способ согласно варианту осуществления 34, где один или более факторов клеточного перепрограммирования выбраны из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0274] Вариант осуществления 36. Способ согласно любому из вариантов осуществления 34-35, где один или более факторов клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0275] Вариант осуществления 37. Способ согласно любому из вариантов осуществления 34-36, где субъект имеет возрастное заболевание или состояние.
[0276] Вариант осуществления 38. Способ согласно варианту осуществления 34, где возрастное заболевание или состояние выбраны из глазной, кожной или скелетно-мышечной дисфункции.
[0277] Вариант осуществления 39. Способ согласно любому из вариантов осуществления 34-36, где субъект имеет нарушение с дегенерацией хрящевой ткани.
[0278] Вариант осуществления 40. Способ согласно варианту осуществления 39, где нарушение выбрано из артрита, хондрофазии, спондилоартропатии, анкилозирующего спондилита, красной волчанки, рецидиврующего полихондрита и синдрома Шегрена.
[0279] Вариант осуществления 41. Способ согласно любому из вариантов осуществления 39 или 40, где лечение снижает экспрессию воспалительных факторов и/или и повышает АТФ и обмен коллагена.
[0280] Вариант осуществления 42. Способ согласно варианту осуществления 41, где воспалительные факторы выбраны из RANKL, iNOS2, IL6, IFNα, MCP3 и MIP1A.
[0281] Вариант осуществления 43. Способ согласно варианту осуществления 42, где АТФ и обмен коллагена измеряют по одному или более из повышенных уровней АТФ, сниженных АФК и повышенного SOD2, повышенного COL2A1 и общей пролиферации в хондроцитах.
[0282] Вариант осуществления 44. Способ согласно любому из вариантов осуществления 34-36, где субъект имеет скелетно-мышечную дисфункцию.
[0283] Вариант осуществления 45. Способ согласно любому из вариантов осуществления 34-44, где введение терапевтически эффективного количества клеток включает инъекцию или хирургическую имплантацию.
[0284] Вариант осуществления 46. Способ согласно любому из вариантов осуществления 34-45, где терапевтически эффективное количество омоложенных клеток выбрано из фибробластов, эндотелиальных клеток, хондроцитов, стволовых клеток скелетных мышц, кератиноцитов, мезенхимальных стволовых клеток и эпителиальных клеток роговицы.
[0285] Вариант осуществления 47. Способ согласно варианту осуществления 46, где терапевтически эффективное количество омоложенных клеток является эпителиальными клетками роговицы.
[0286] Вариант осуществления 48. Способ согласно варианту осуществления 47, где омоложенный эпителий роговицы демонстрирует снижение параметров старения.
[0287] Вариант осуществления 49. Способ согласно варианту осуществления 48, где параметры старения включают одно или более из экспрессии p21 и p16, PGC1α биогенеза митохондрий и экспрессии воспалительного фактора IL8.
[0288] Вариант осуществления 50. Способ лечения субъекта от возрастного заболевания или состояния, нарушения с дегенерацией хрящевой ткани и/или субъекта, имеющего скелетно-мышечную дисфункцию, где способ включает введение терапевтически эффективного количества одной или более неинтегративных матричных РНК, кодирующих один или более факторов клеточного перепрограммирования.
[0289] Вариант осуществления 51. Способ согласно варианту осуществления 50, где один или более факторов клеточного перепрограммирования выбраны из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0290] Вариант осуществления 52. Способ согласно любому из вариантов осуществления 50-51-48, где один или более факторов клеточного перепрограммирования включают OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
[0291] Вариант осуществления 53. Способ согласно любому из вариантов осуществления 50-52, где субъект имеет возрастное заболевание или состояние.
[0292] Вариант осуществления 54. Способ согласно варианту осуществления 53, где возрастное заболевание или состояние выбраны из глазной, кожной или скелетно-мышечной дисфункции.
[0293] Вариант осуществления 55. Способ согласно любому из вариантов осуществления 50-52, где субъект имеет нарушение с дегенерацией хрящевой ткани.
[0294] Вариант осуществления 56. Способ согласно варианту осуществления 55, где нарушение выбрано из артрита, хондрофазии, спондилоартропатии, анкилозирующего спондилита, красной волчанки, рецидивирующего полихондрита и синдрома Шегрена.
[0295] Вариант осуществления 57. Способ согласно любому из вариантов осуществления 50-52, где субъект имеет скелетно-мышечную дисфункцию.
[0296] Вариант осуществления 58. Способ согласно любому из вариантов осуществления 50-57, где введение терапевтически эффективного количества одной или более неинтегративных матричных РНК включает прямую инъекцию в клетку-мишень.
[0297] Вариант осуществления 59. Способ согласно варианту осуществления 58, где клетка-мишень выбрана из эпителиальных клеток, эндотелиальных клеток, клеток соединительной ткани, мышечных клеток и клеток нервной системы.
[0298] Вариант осуществления 60. Способ омолаживания инженерно модифицированной ткани ex vivo, включающий трансфекцию ткани одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд, с получением в результате омоложенной инженерно модифицированной ткани.
[0299] Вариант осуществления 61. Способ согласно варианту осуществления 60, где инженерно модифицированная ткань демонстрирует снижение параметров старения, провоспалительных факторов, улучшение гистологической оценки или комбинацию этого.
[0300] Вариант осуществления 62. Способ согласно любому из вариантов осуществления 60 или 61, где инженерно модифицированная ткань является инженерно модифицированной тканью кожи.
[0301] Вариант осуществления 63. Способ согласно любому из вариантов осуществления 60-62, где параметры старения выбраны из p16 и положительного окрашивания SaβGal и провоспалительных факторов IL8 и MMP1
[0302] Вариант осуществления 64. Способ согласно любому из вариантов осуществления 60-63, где гистологическая оценка включает морфологию, организацию и/или качество.
[0303] Вариант осуществления 65. Фармацевтическая композиция, включающая омоложенные клетки, где омоложенные клетки получены путем трансфекции клеток одной или более неинтегративными матричными РНК, кодирующими один или более факторов клеточного перепрограммирования, в течение не более чем пяти (5) дней подряд.
[0304] Вариант осуществления 66. Способ согласно любому из предыдущих вариантов осуществления, где один или более факторов клеточного перепрограммирования выбраны из OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG
[0305] Вариант осуществления 67. Композиция согласно варианту осуществления 65 или 66, где клетки демонстрируют одно или более из следующего: повышенную экспрессию HP1-гамма, H3K9me3, LAP2-альфа, SIRT1, повышенный потенциал митохондриальной мембраны и снижение активных форм кислорода и сниженную экспрессию цитокинов SASP.
[0306] Вариант осуществления 68. Композиция согласно варианту осуществления 67, где цитокины SASP включают один или более из IL18, IL1A, GROA, IL22 и IL9.
[0307] Вариант осуществления 69. Композиция согласно любому из вариантов осуществления 65-68, дополнительно включающая один или более дополнительных компонентов, выбранных из питательных веществ, цитокинов, факторов роста, компонентов внеклеточного матрикса (ECM), антибиотиков, антиоксидантов и иммунодепрессантов.
[0308] Вариант осуществления 70. Композиция согласно любому из вариантов осуществления 65-69, дополнительно включающая фармацевтически приемлемый носитель.
[0309] Вариант осуществления 71. Композиция согласно любому из вариантов осуществления 65-70, где клетки являются аутологичными или аллогенными.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ ЭКСПРЕССИИ РНК В КЛЕТКЕ | 2018 |
|
RU2784654C2 |
| СТИМУЛЯЦИЯ ПУТИ Wnt ПРИ ПЕРЕПРОГРАММИРОВАНИИ СОМАТИЧЕСКИХ КЛЕТОК | 2008 |
|
RU2492232C2 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК | 2012 |
|
RU2691027C2 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК | 2012 |
|
RU2624139C2 |
| ПЕРСОНАЛИЗИРОВАННОЕ ПОЛУЧЕНИЕ БИОПРЕПАРАТОВ И СПОСОБ ПЕРЕПРОГРАММИРОВАНИЯ СТВОЛОВЫХ КЛЕТОК | 2012 |
|
RU2595390C2 |
| ПОСЛЕДОВАТЕЛЬНОСТИ 3'-UTR ДЛЯ СТАБИЛИЗАЦИИ РНК | 2016 |
|
RU2720934C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ПАЦИЕНТОВ С СИНДРОМОМ ДАУНА | 2012 |
|
RU2492233C1 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ, СПОСОБЫ И НАБОРЫ, СВЯЗАННЫЕ С УДЛИНЕНИЕМ ТЕЛОМЕР | 2014 |
|
RU2766120C2 |
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА | 2012 |
|
RU2656156C2 |
| ПОСЛЕДОВАТЕЛЬНОСТИ 3'-UTR ДЛЯ СТАБИЛИЗАЦИИ РНК | 2016 |
|
RU2783165C1 |
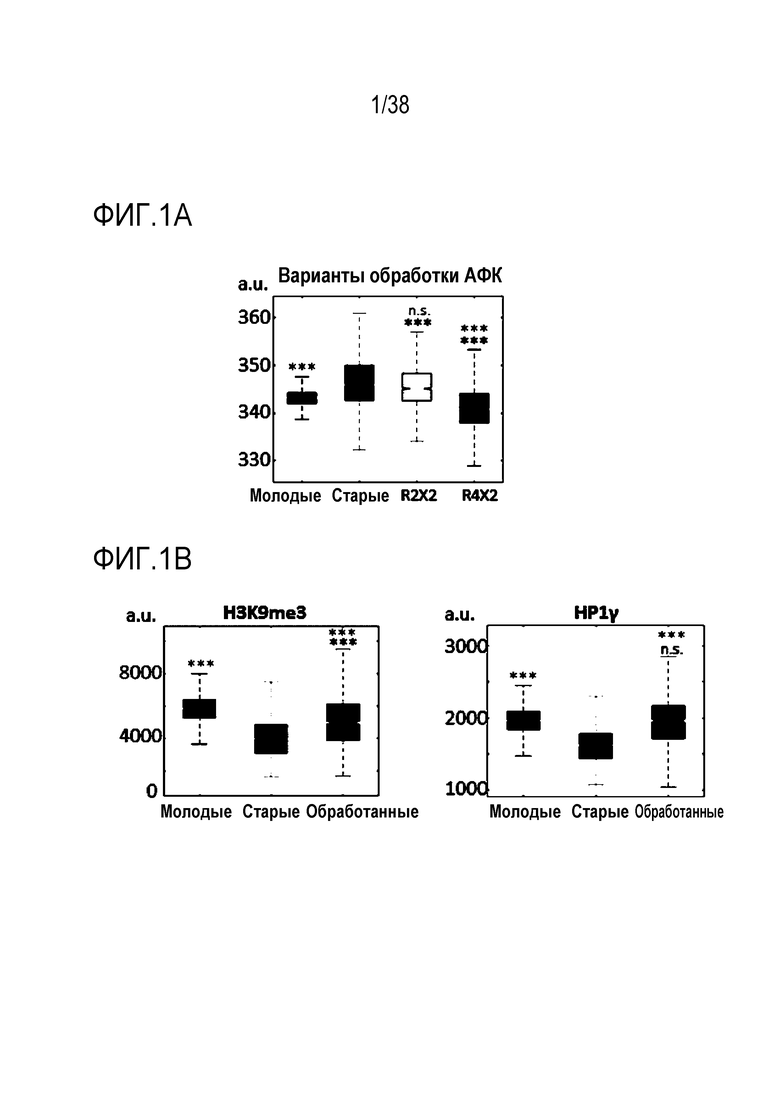
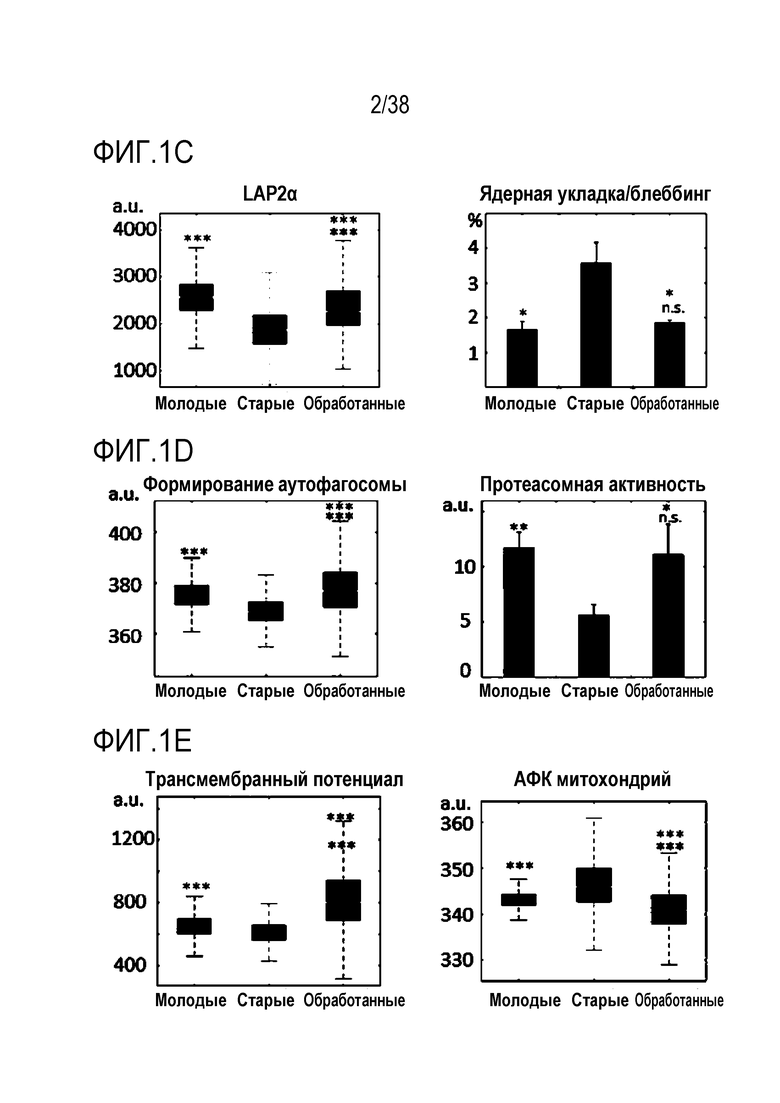
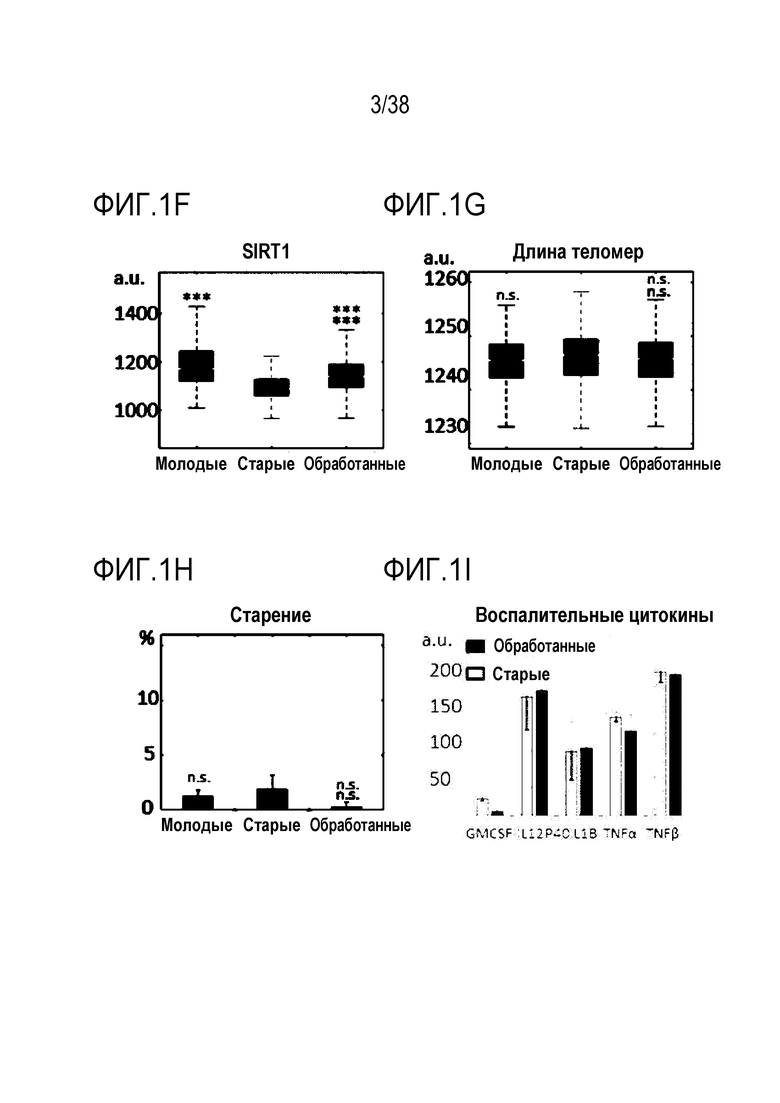
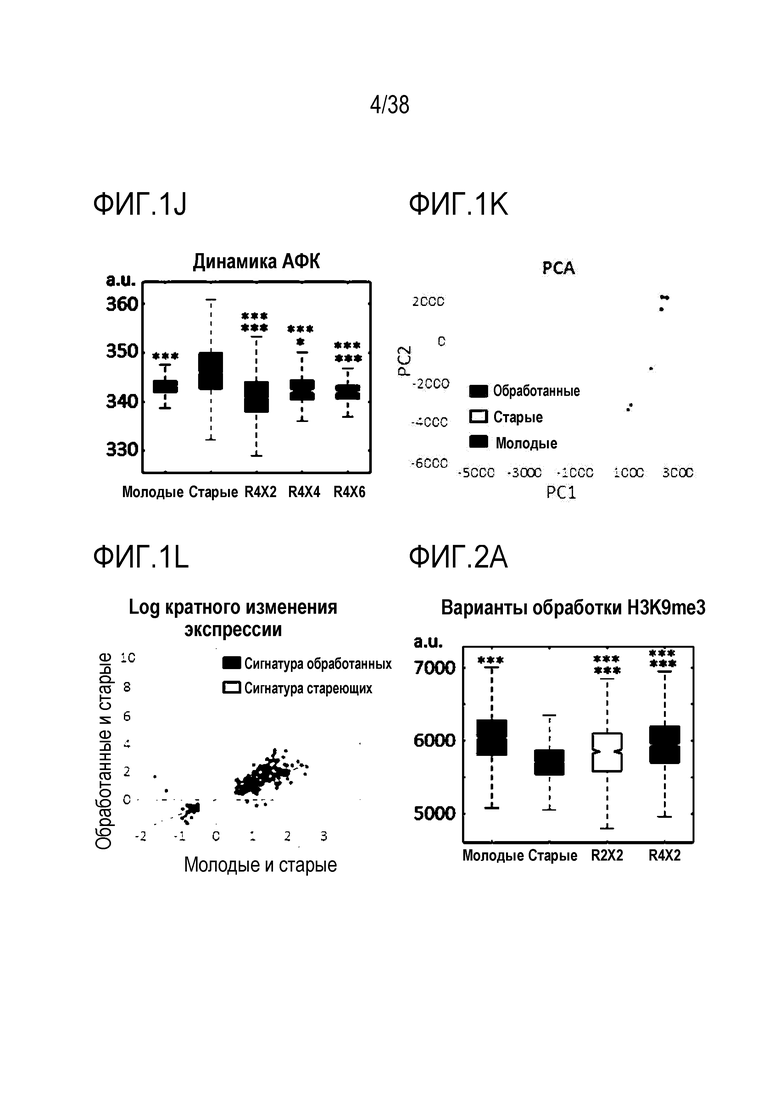
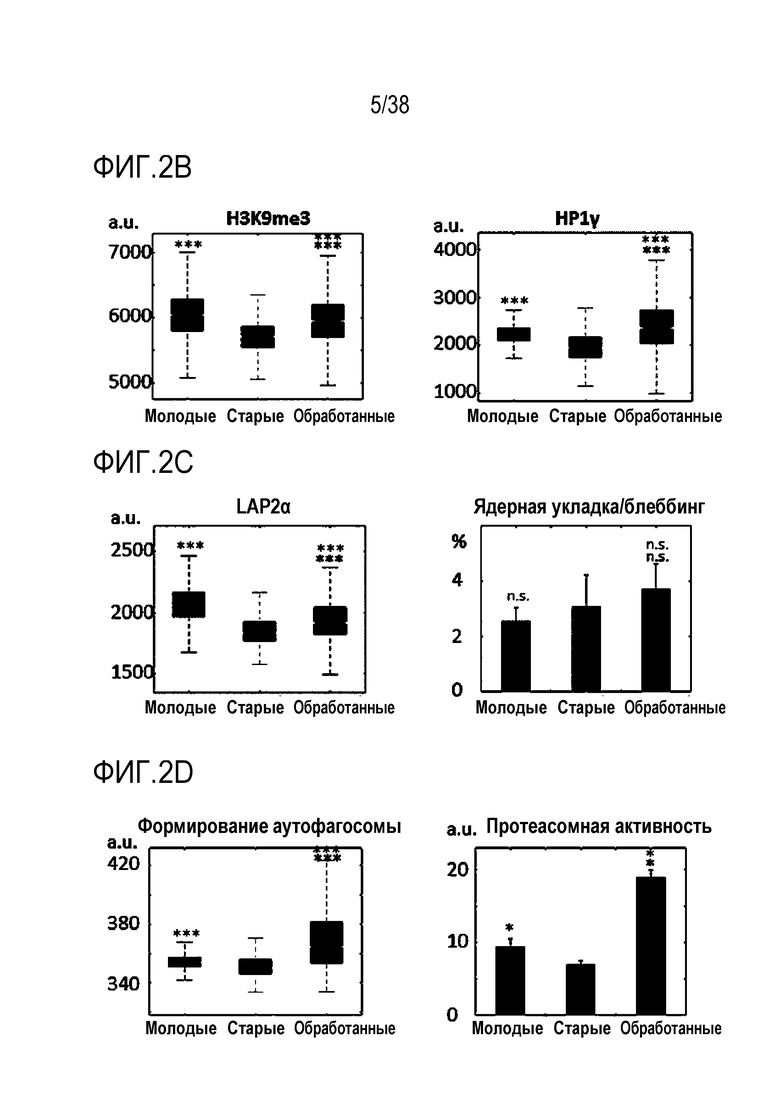
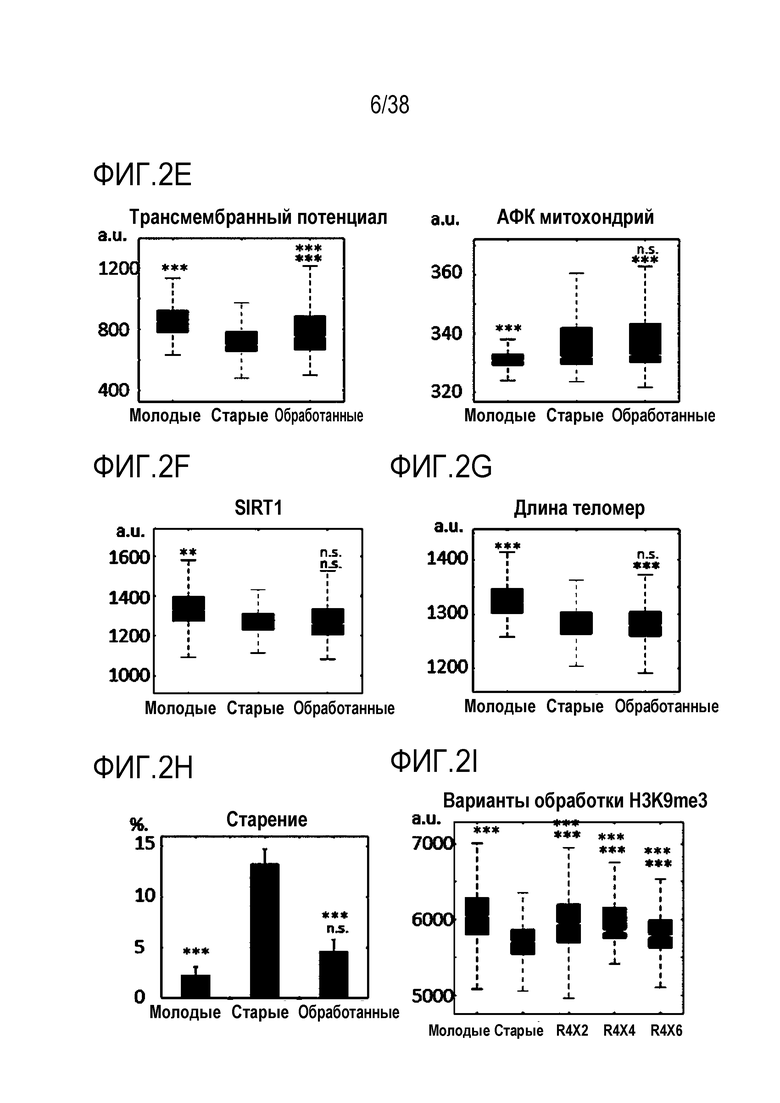
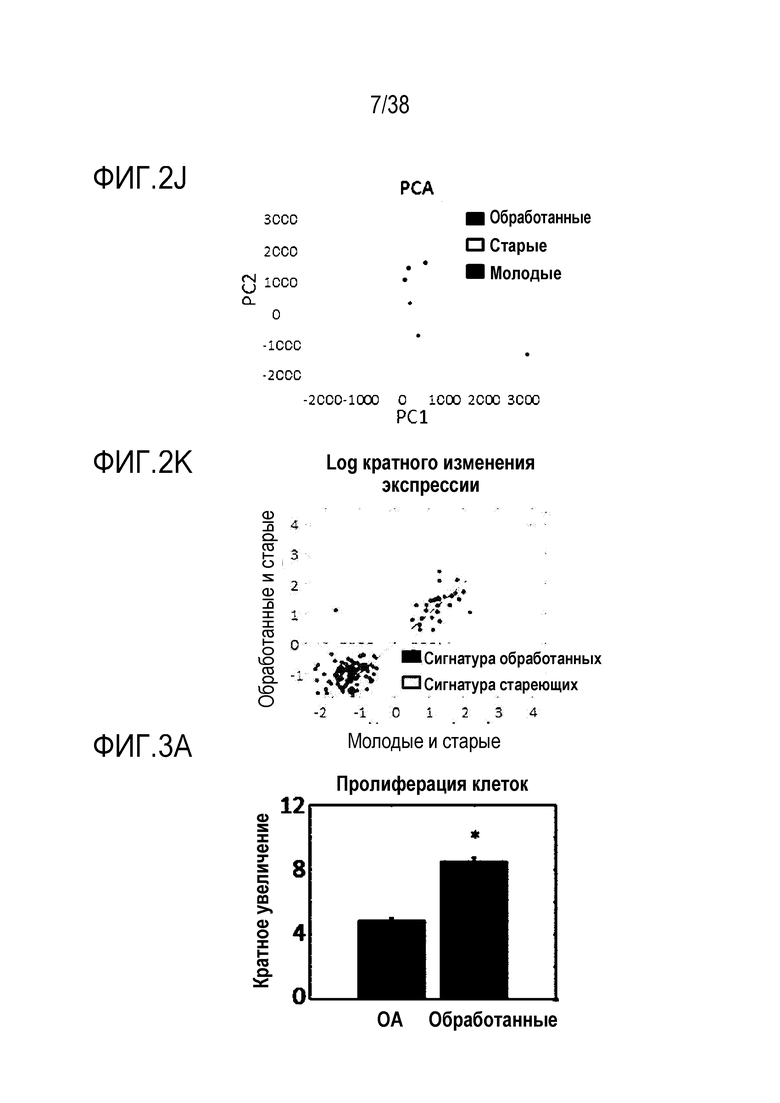
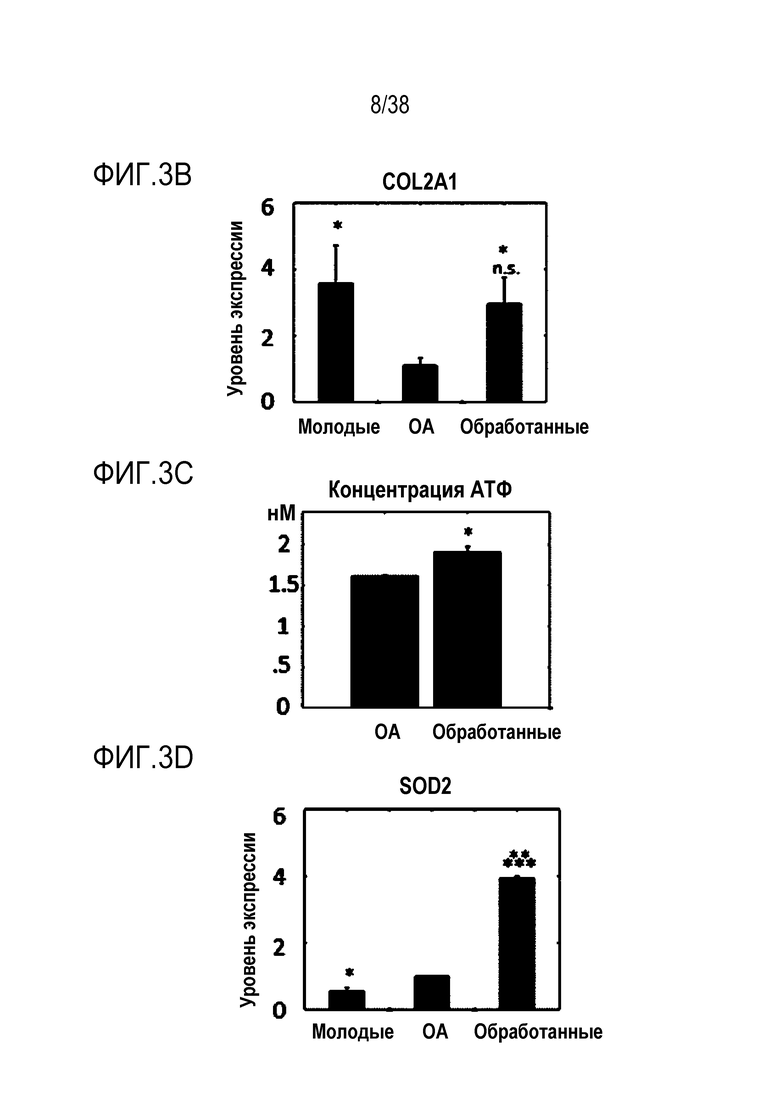
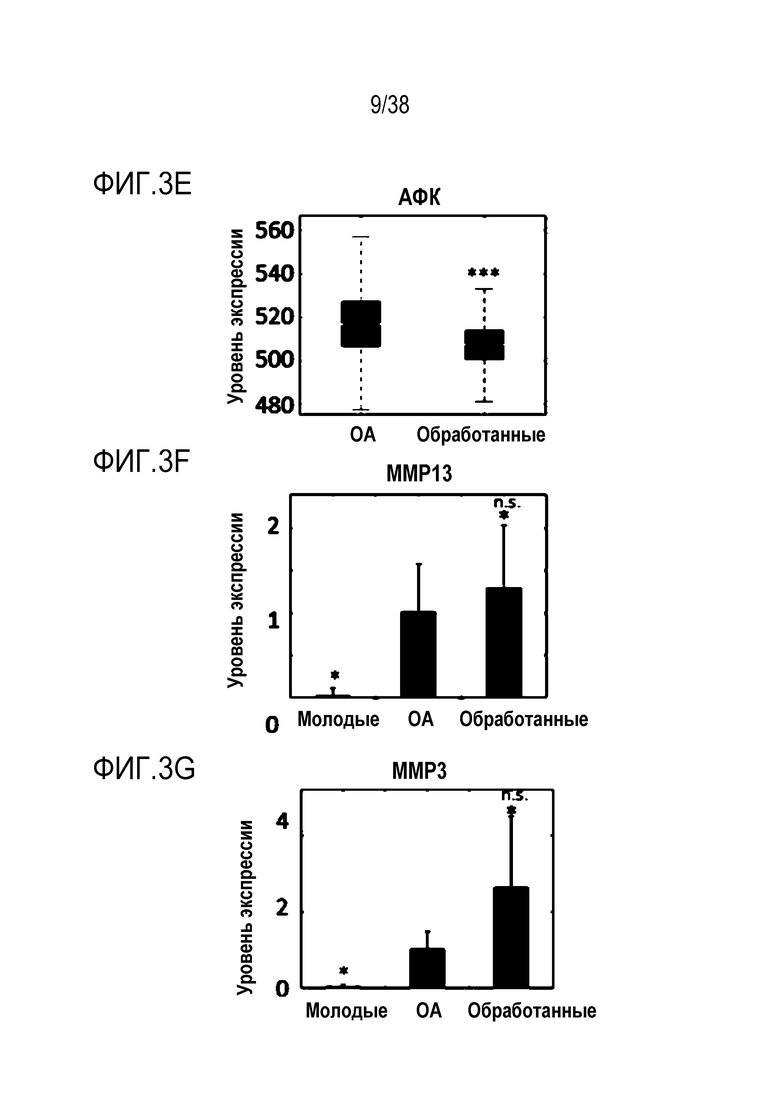
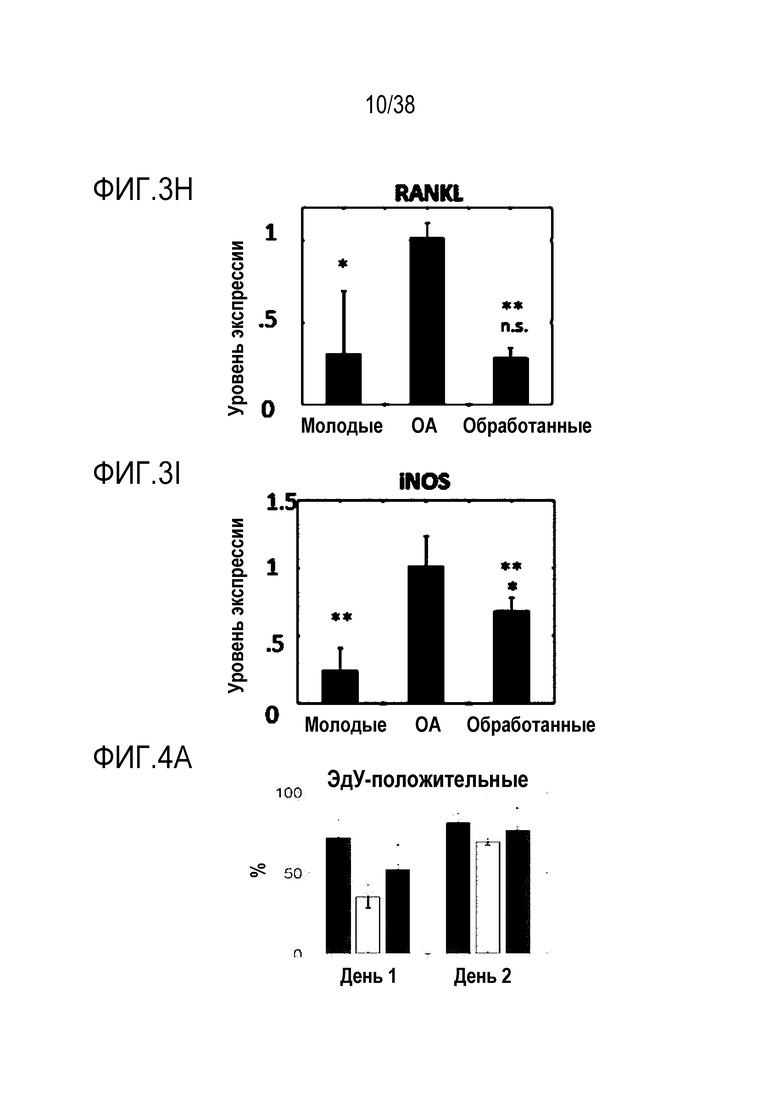
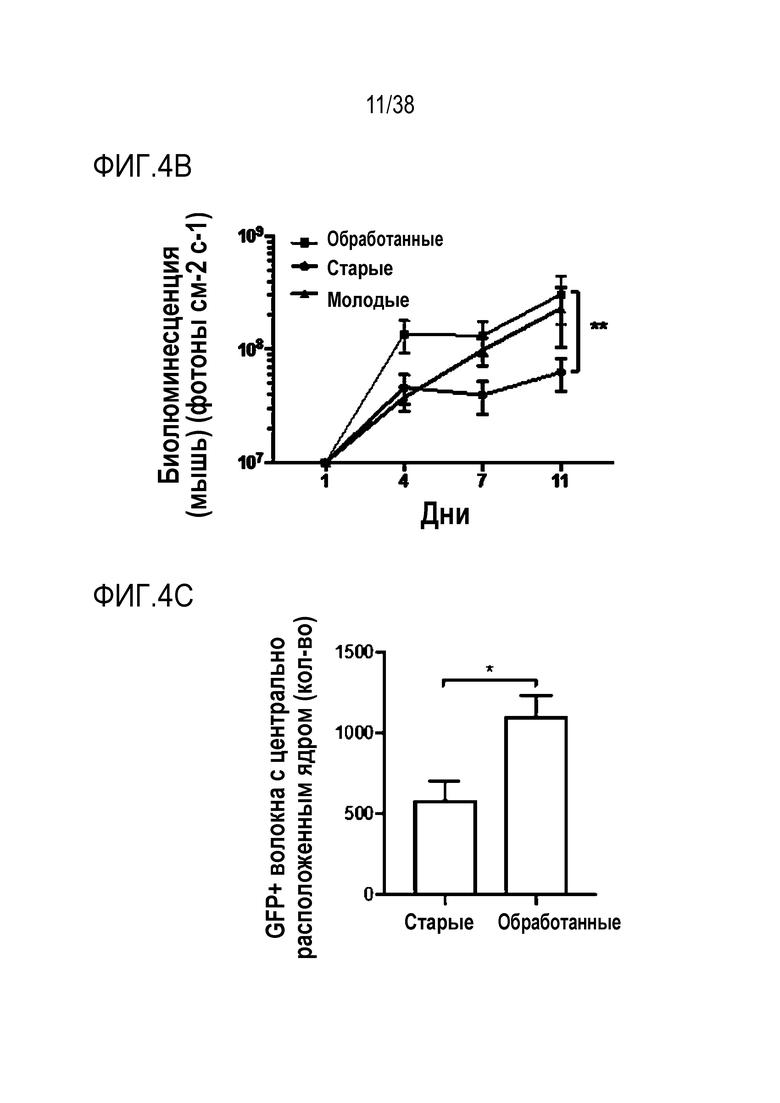
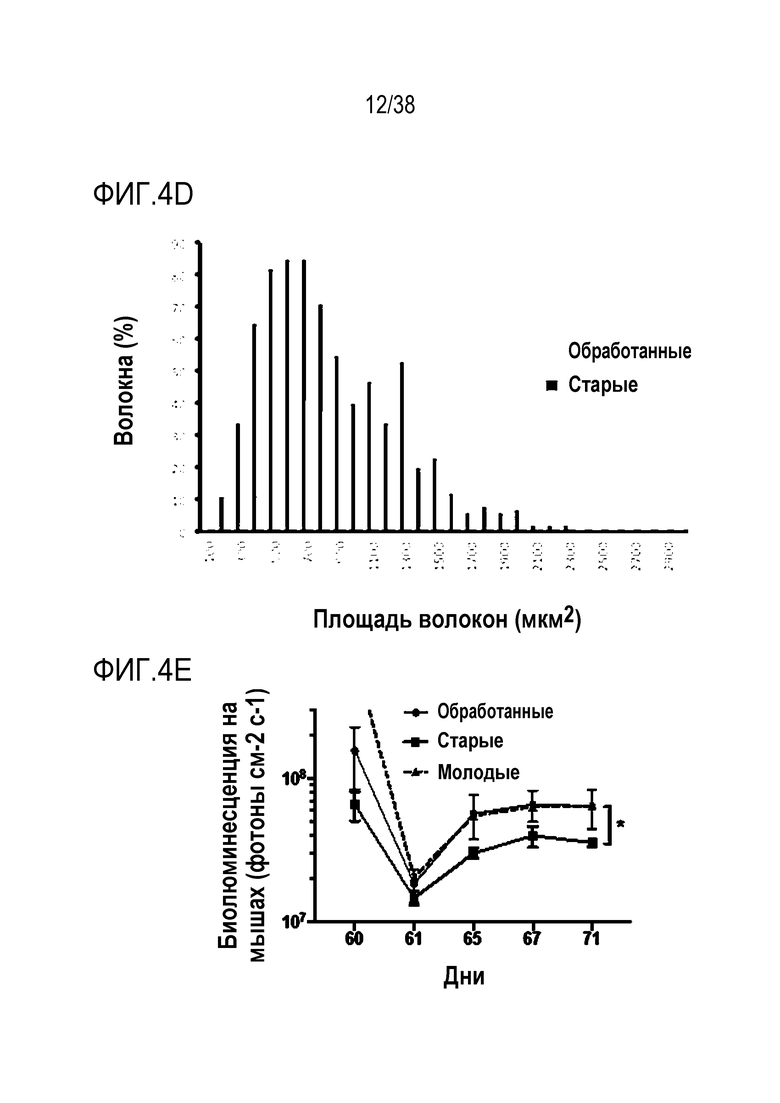
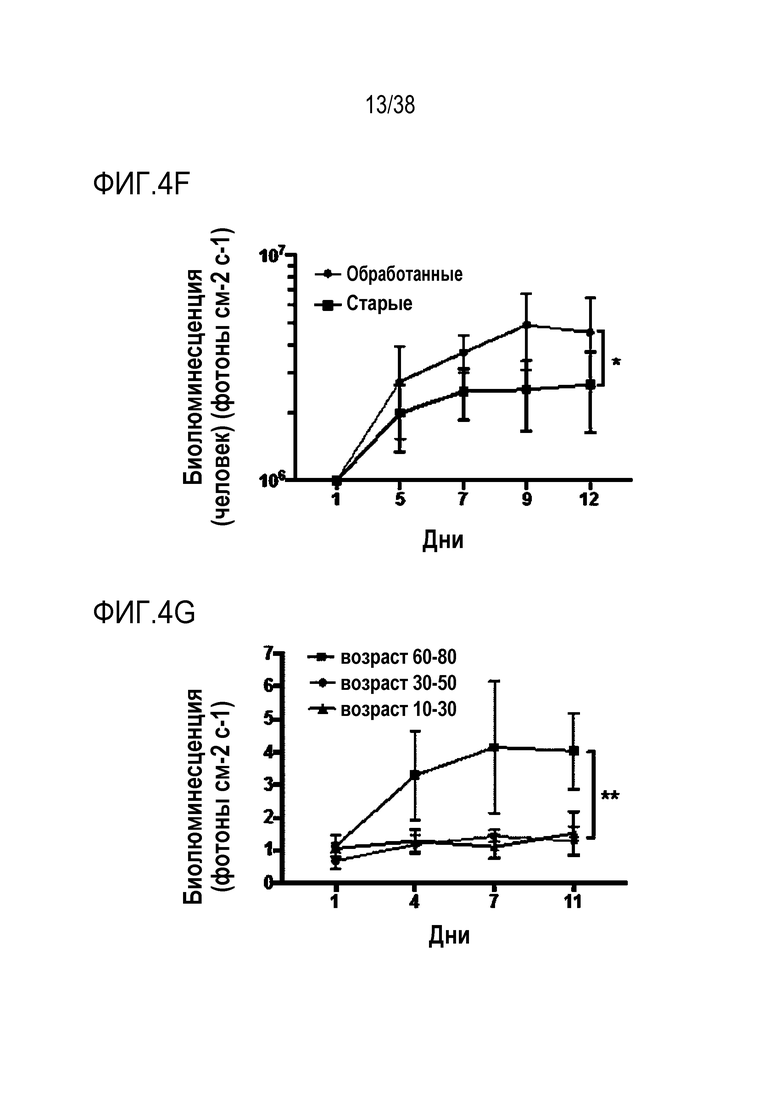
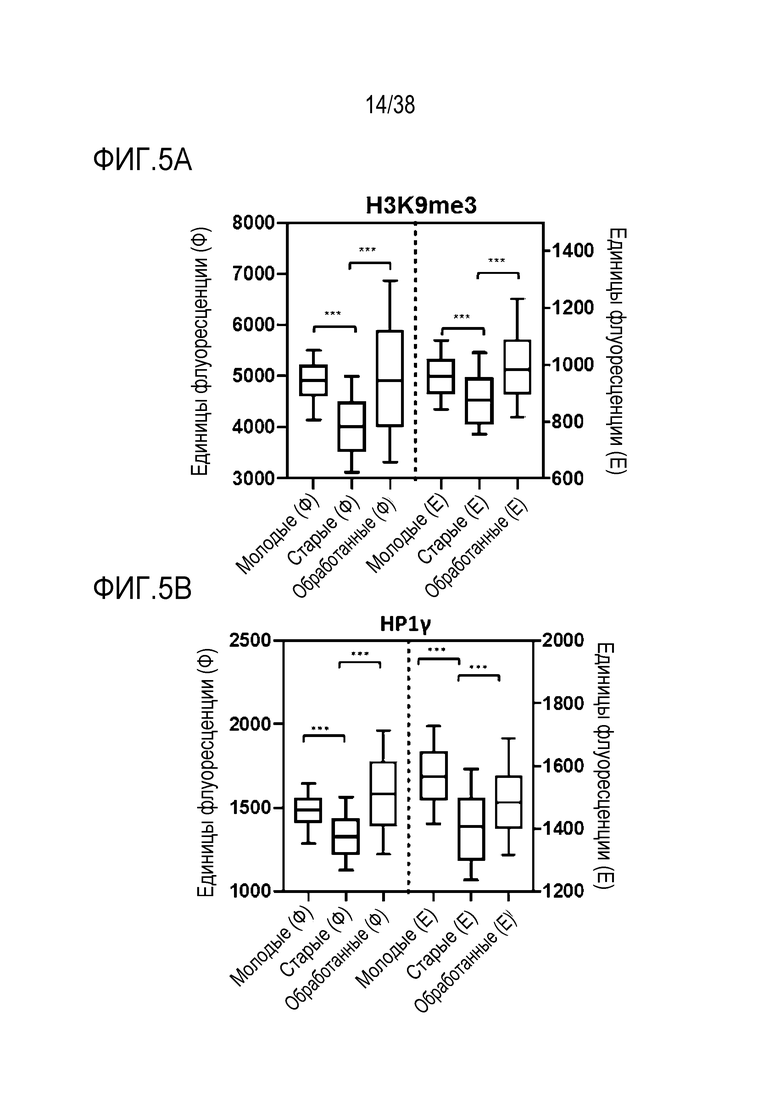
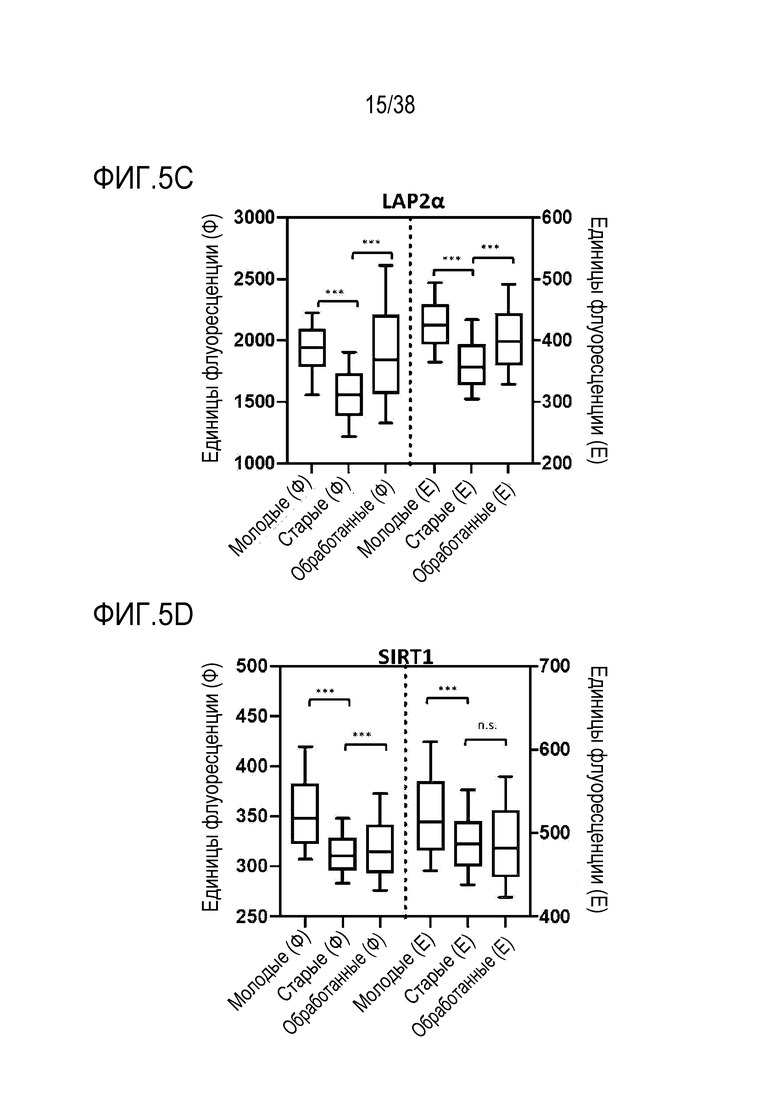
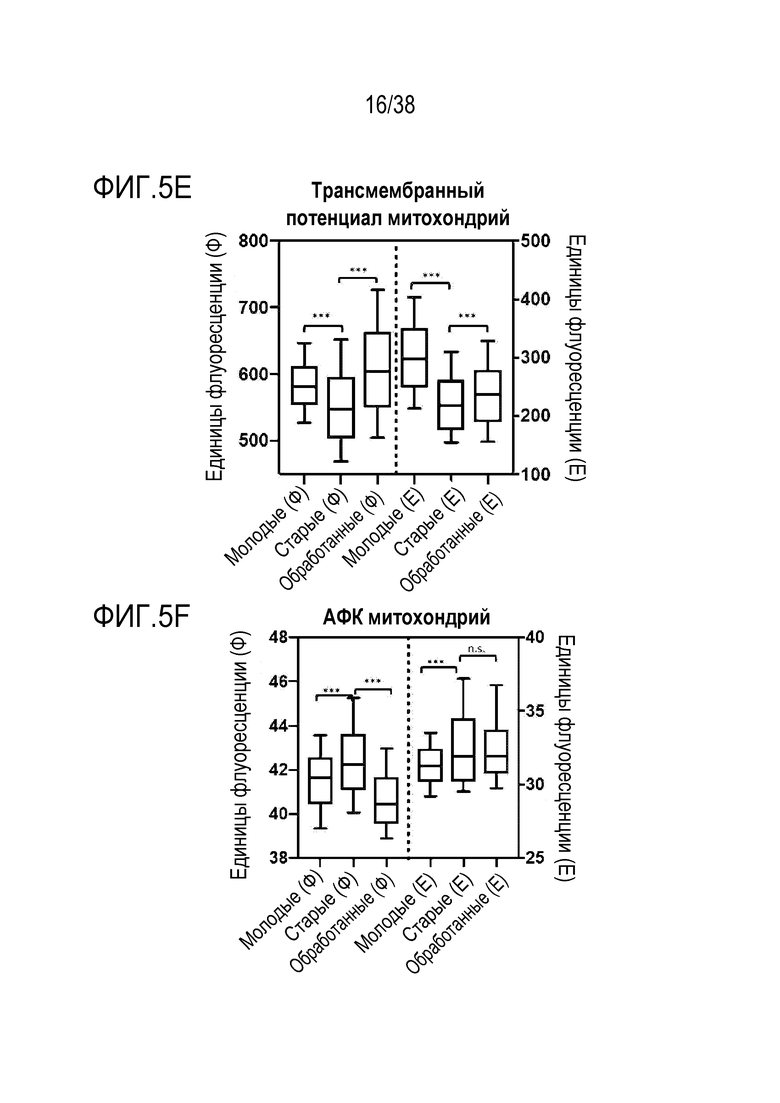
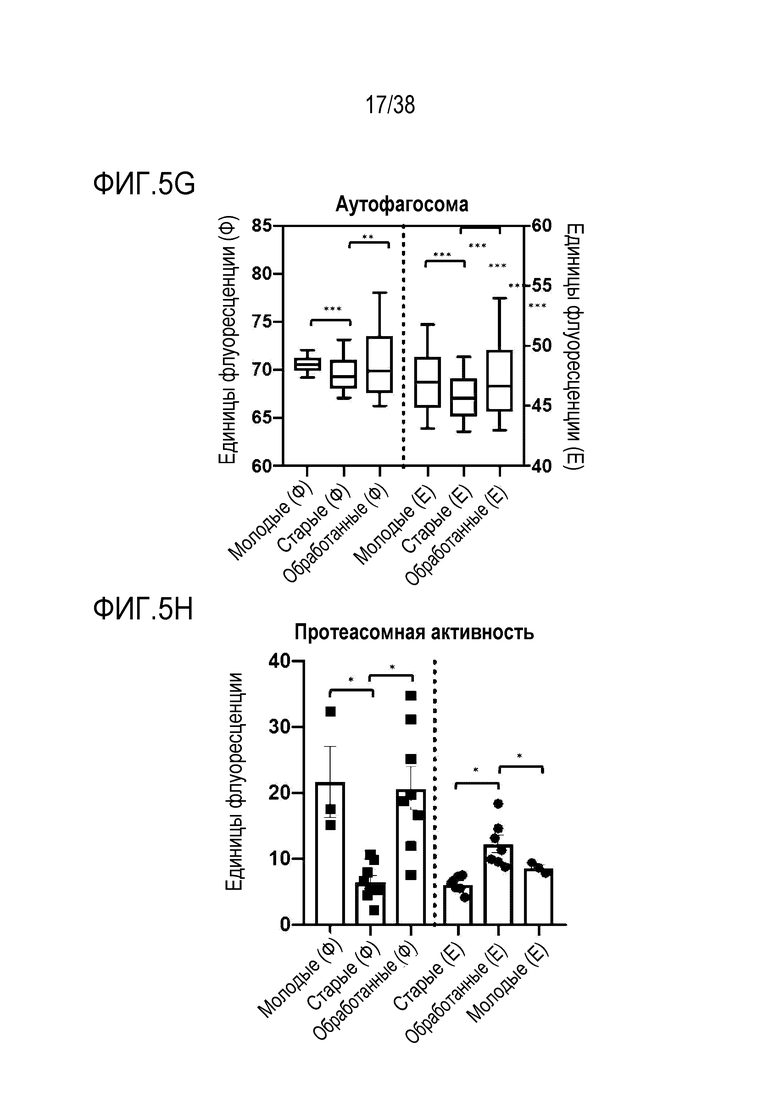
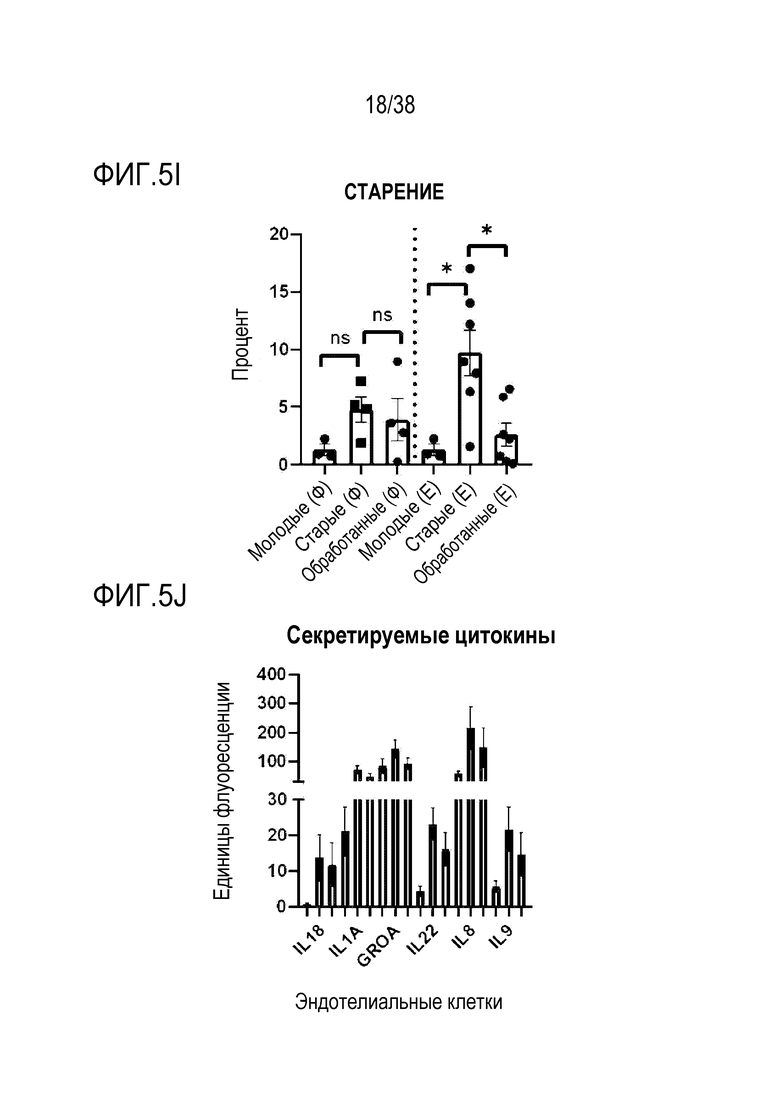
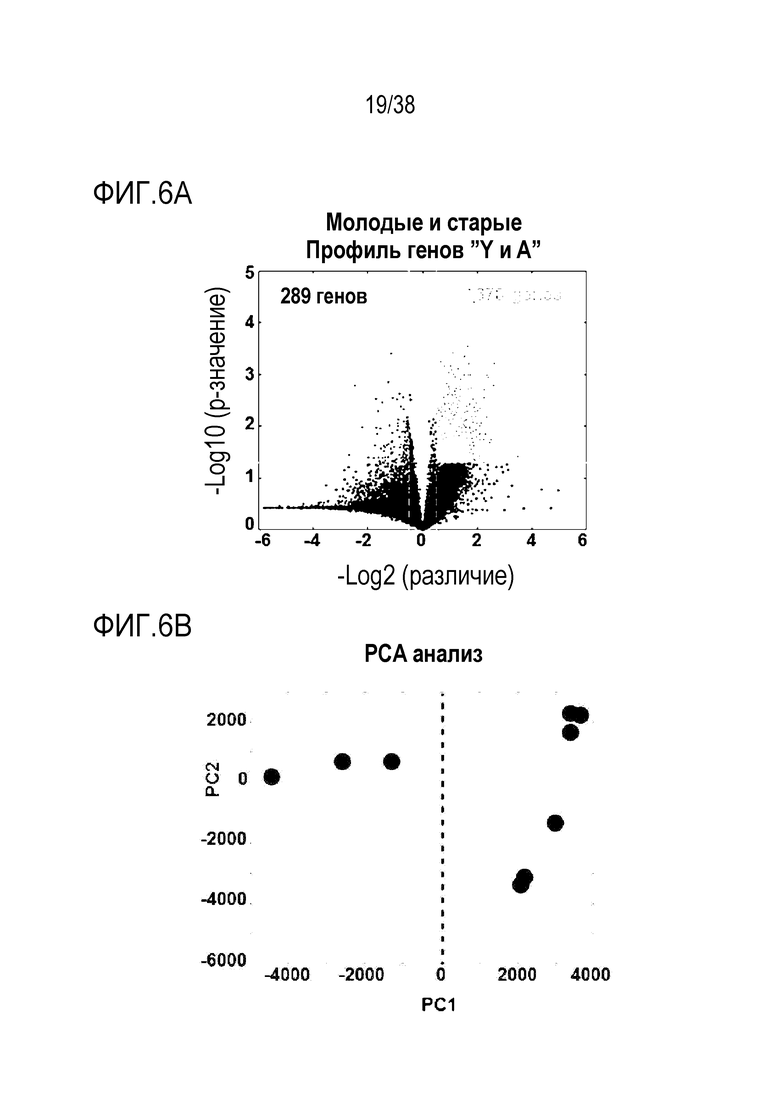
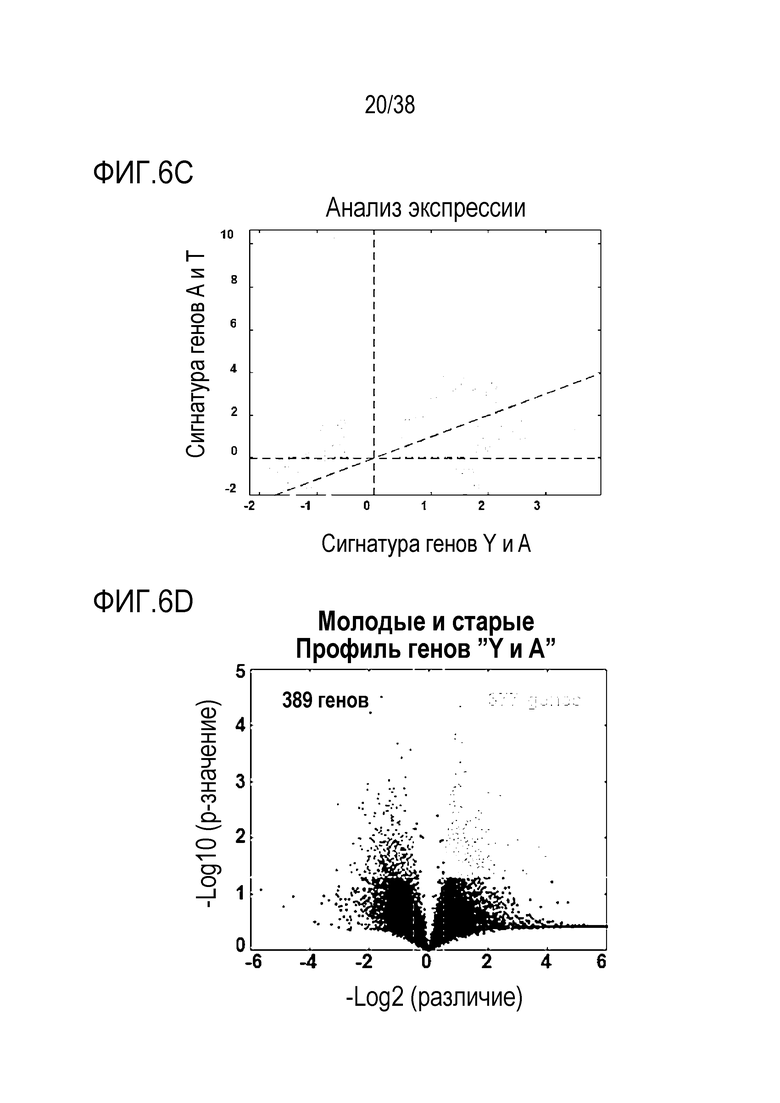
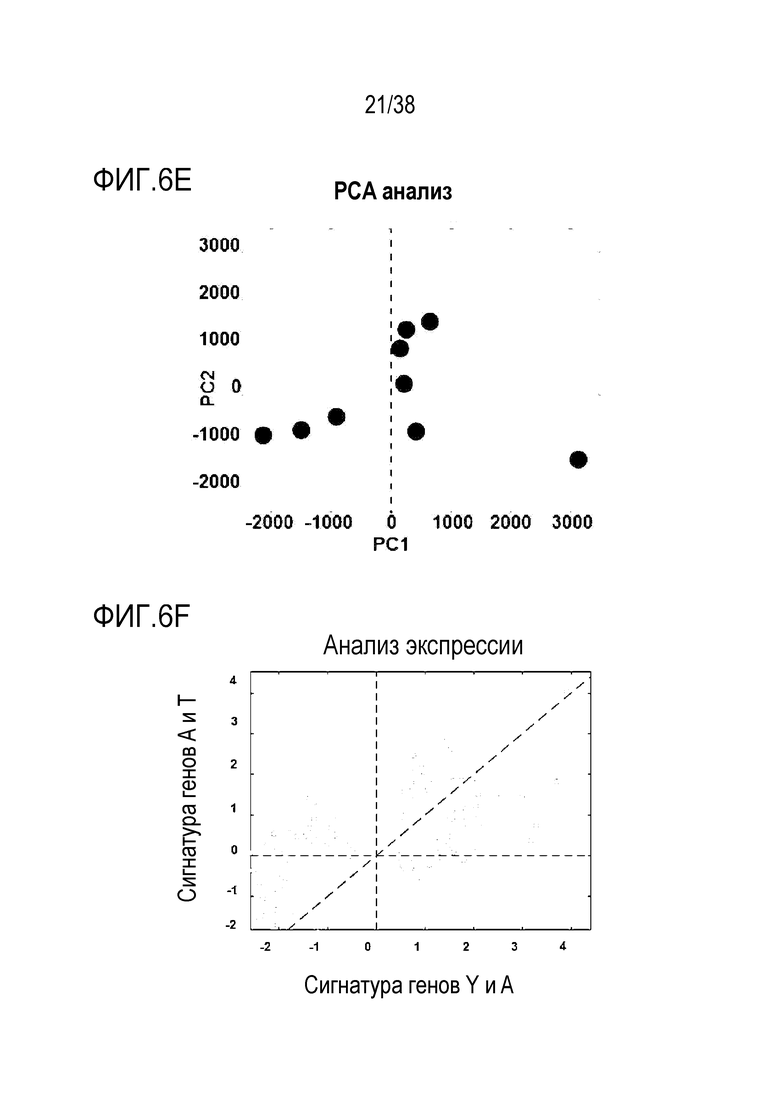
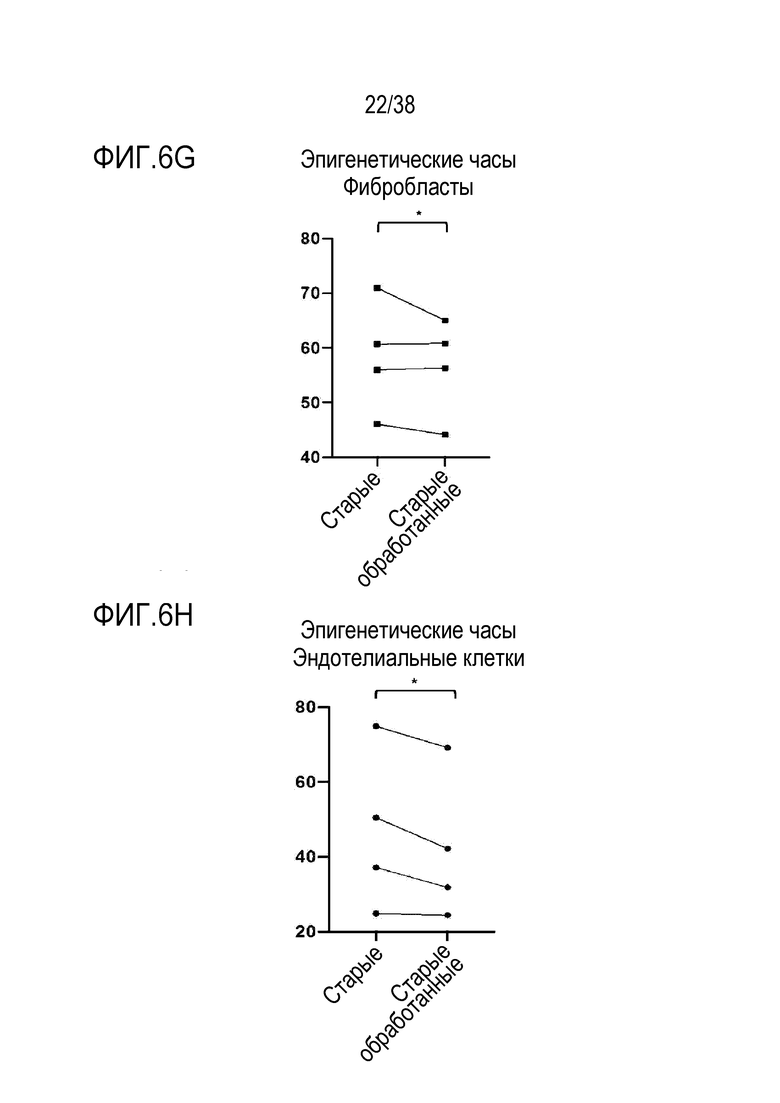
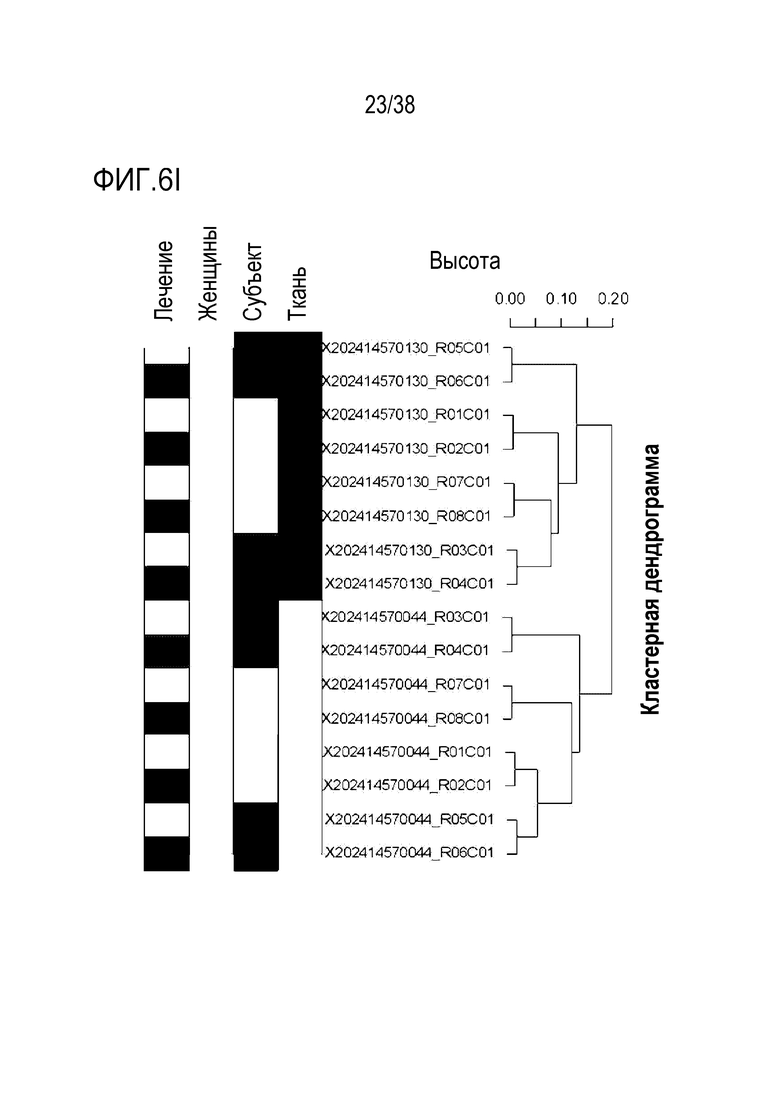
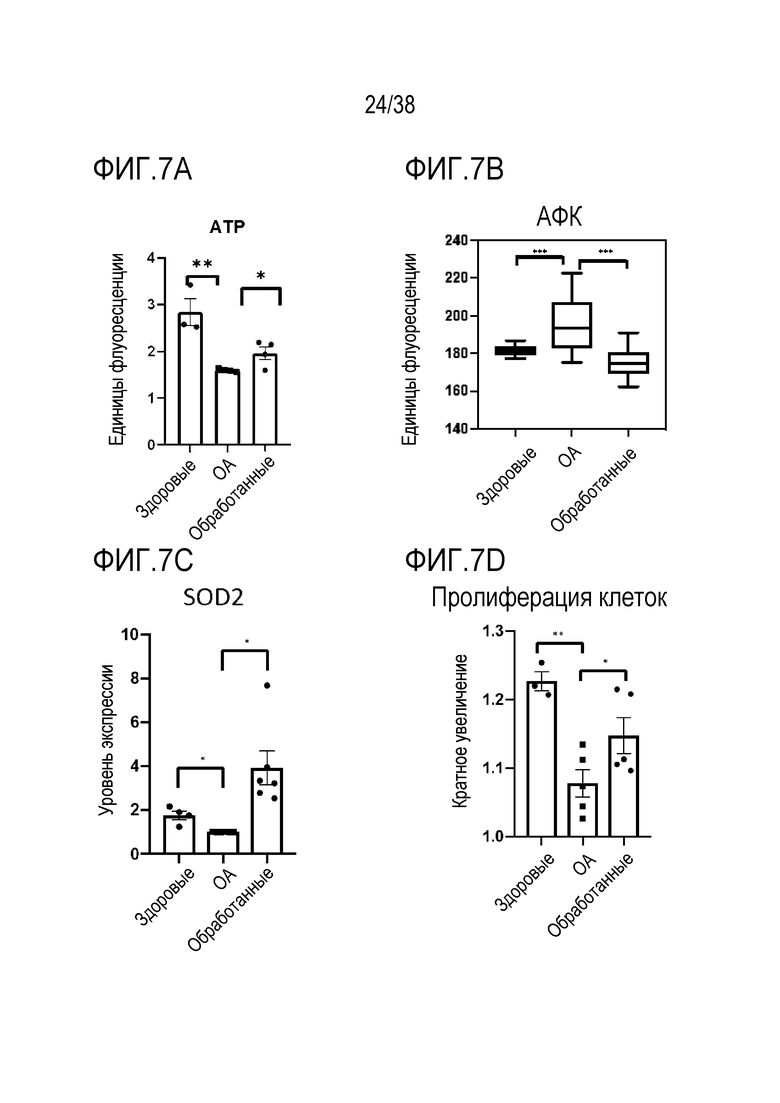

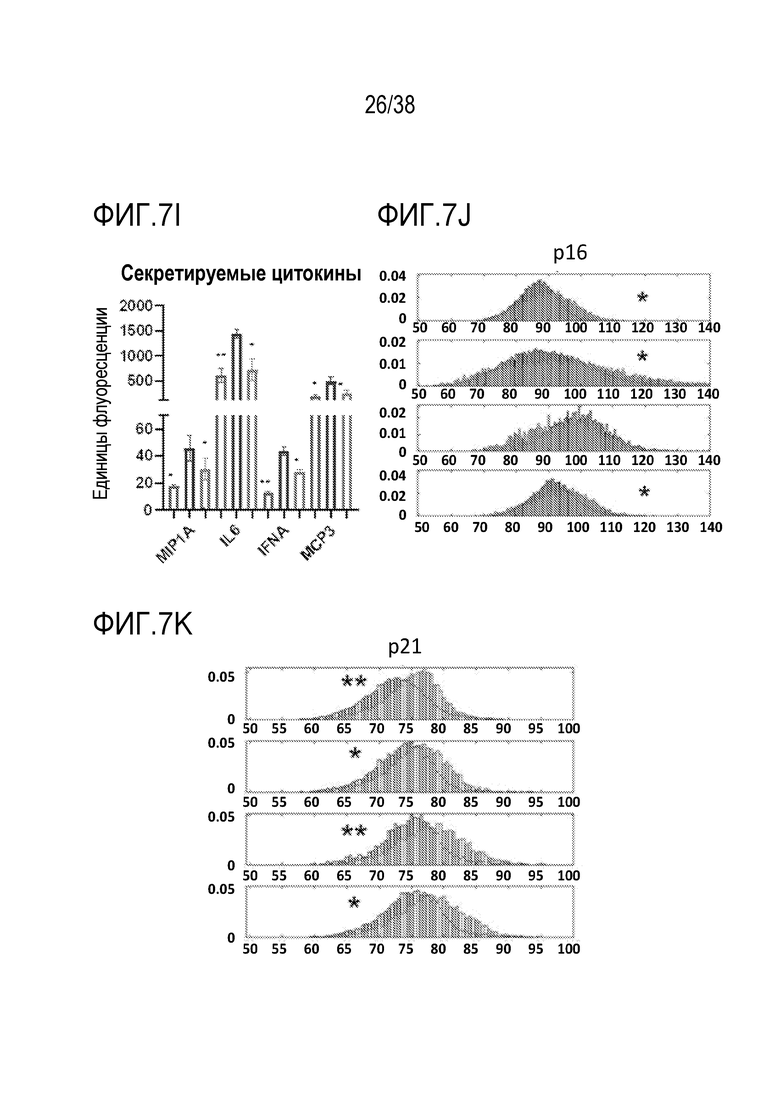
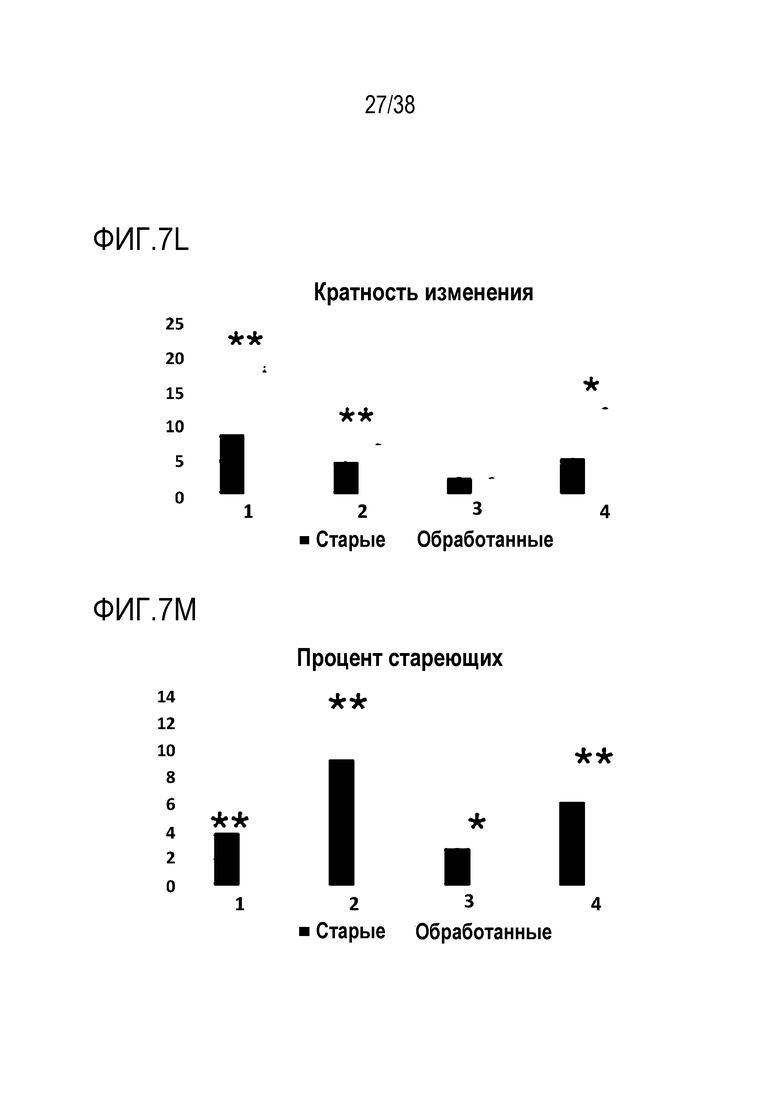
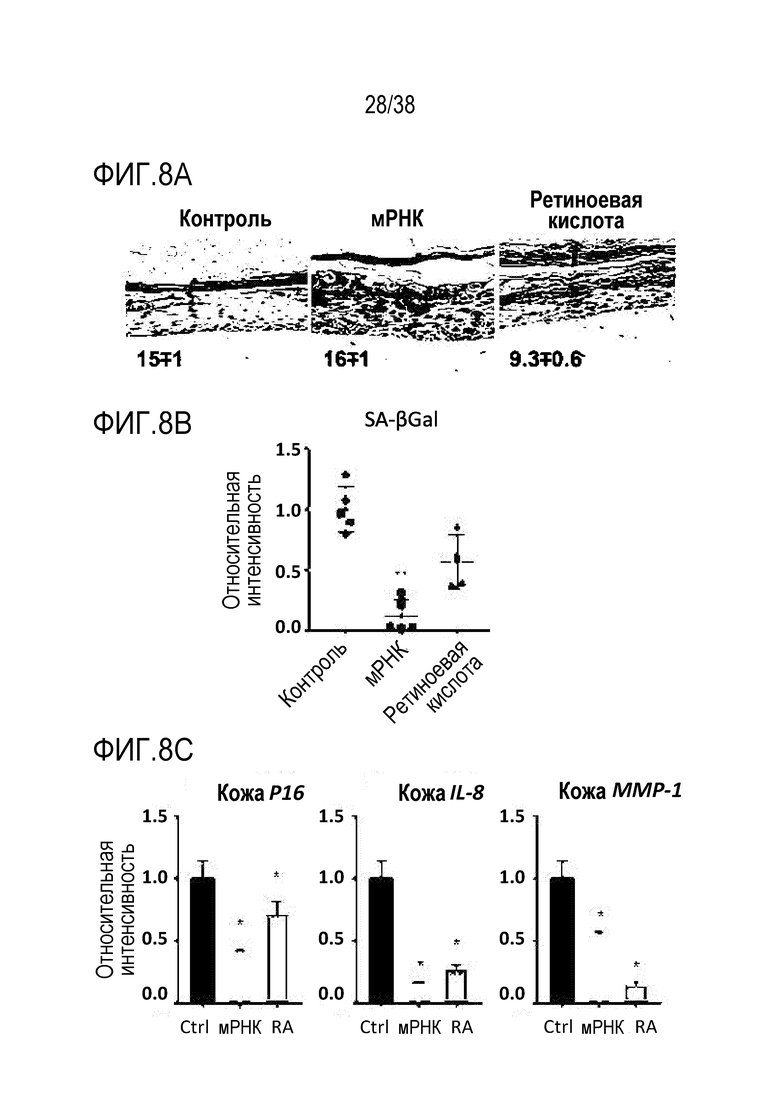
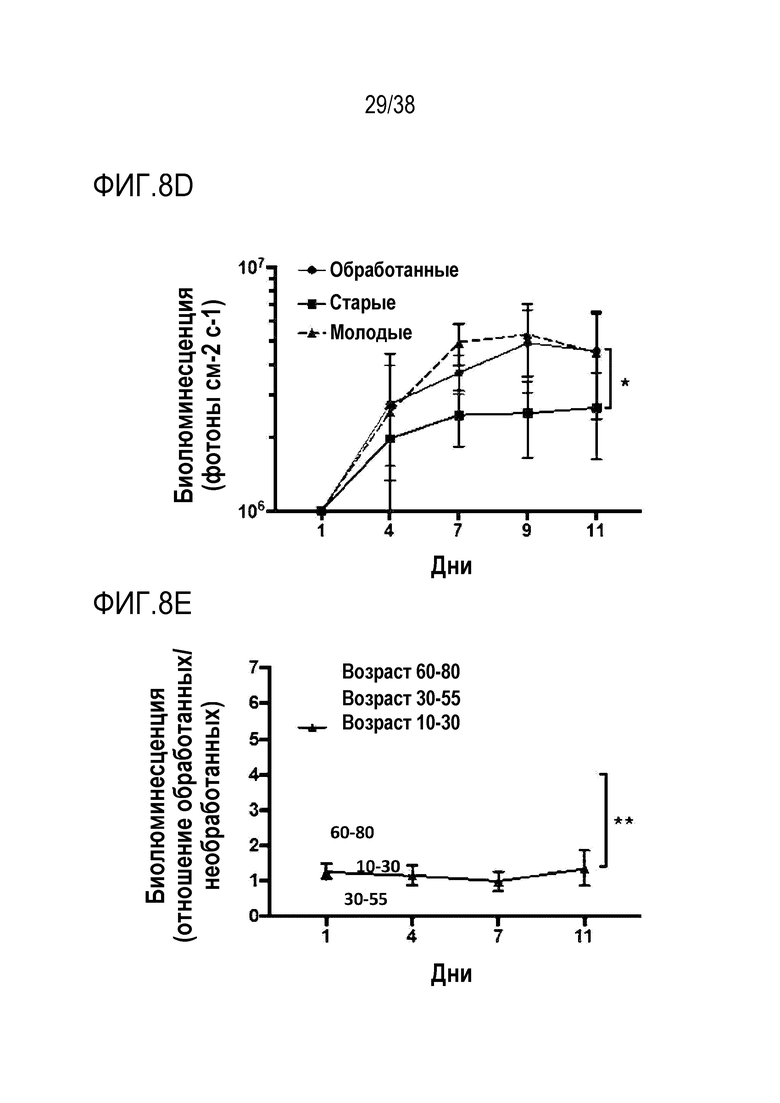
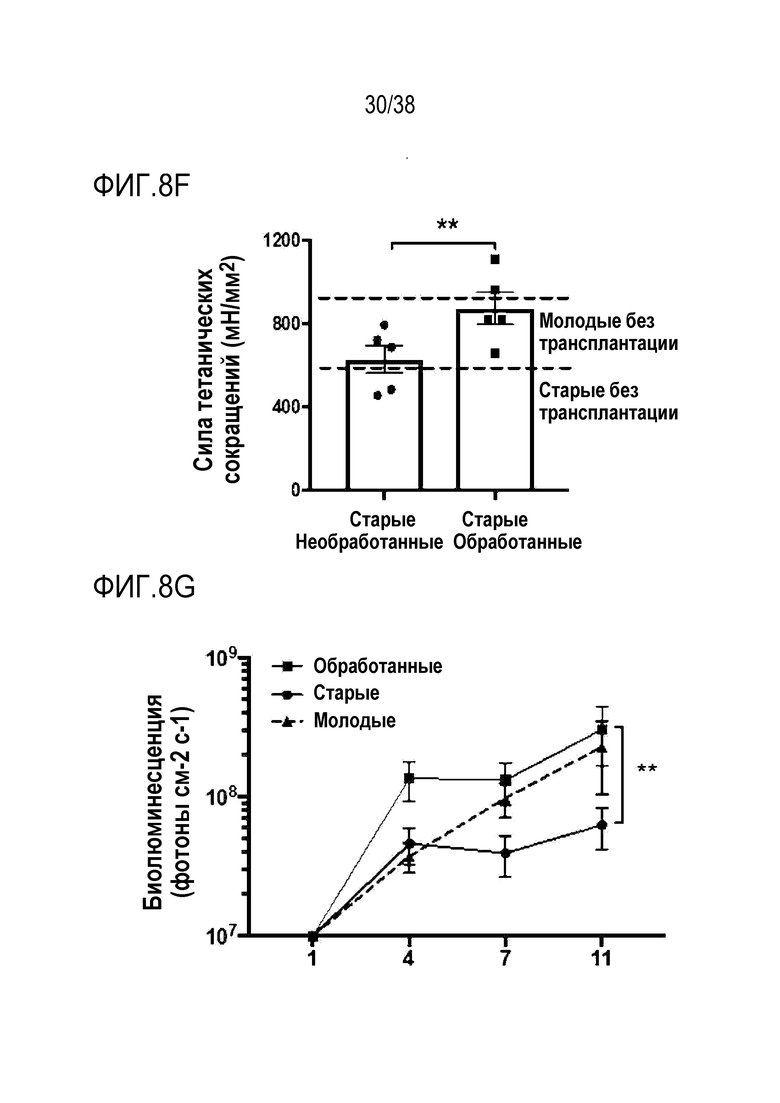
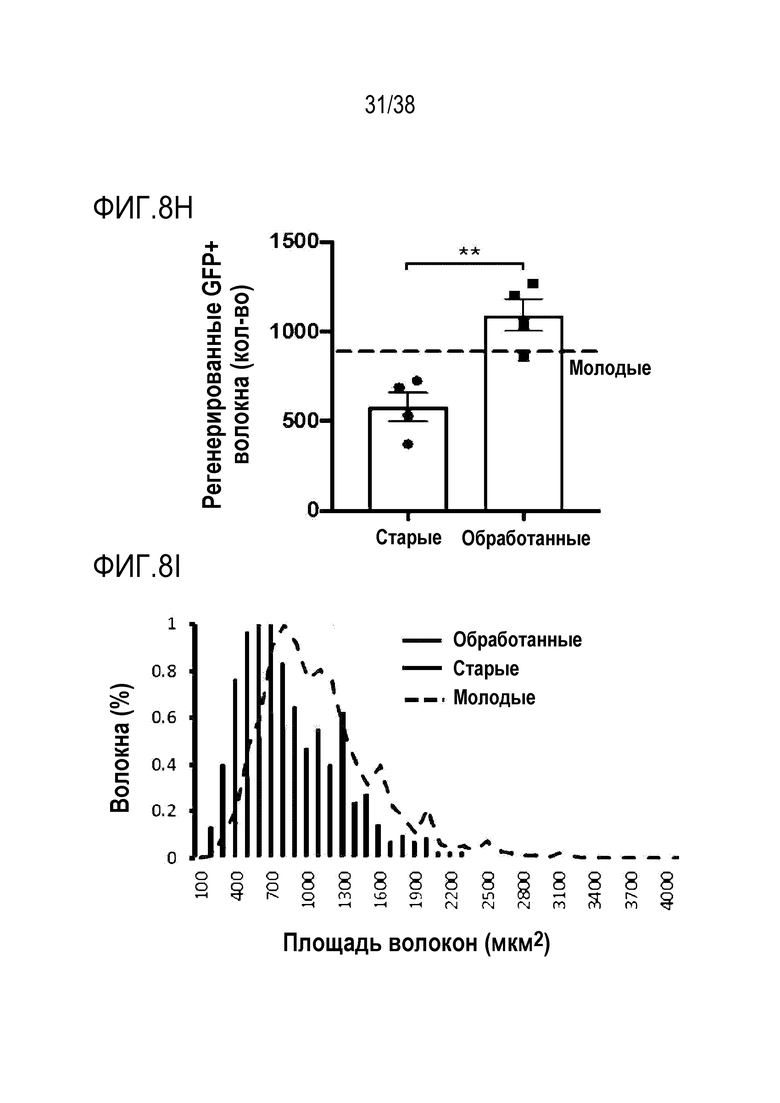
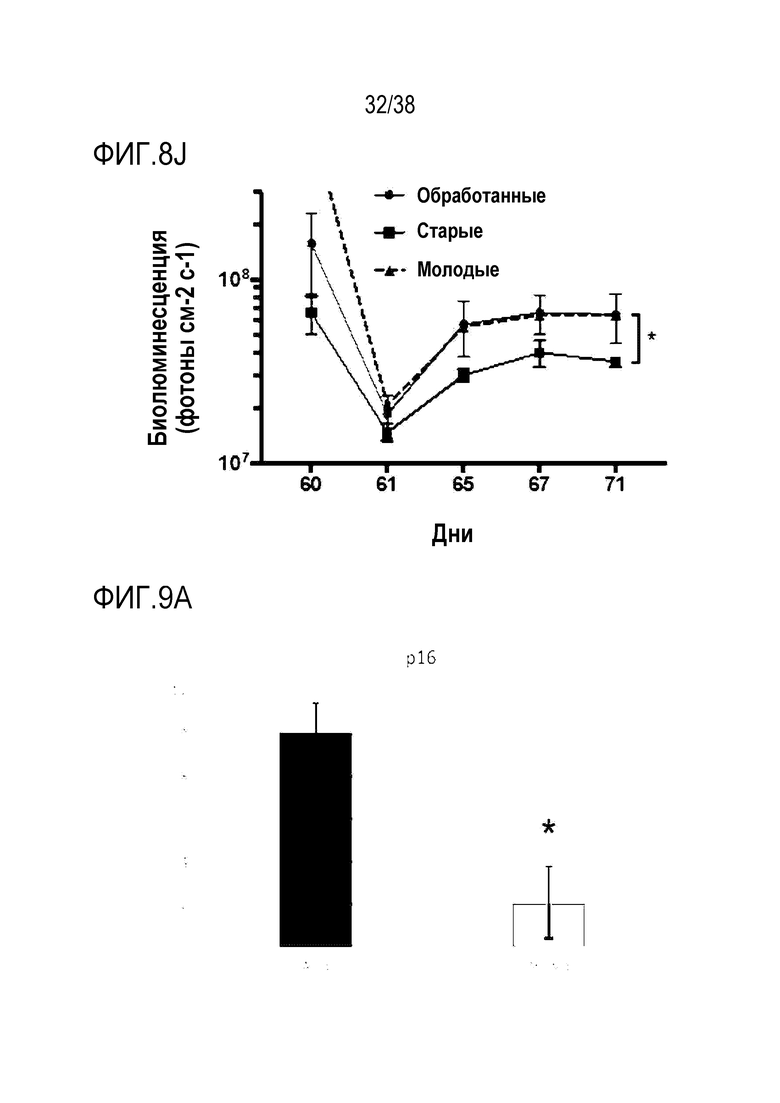
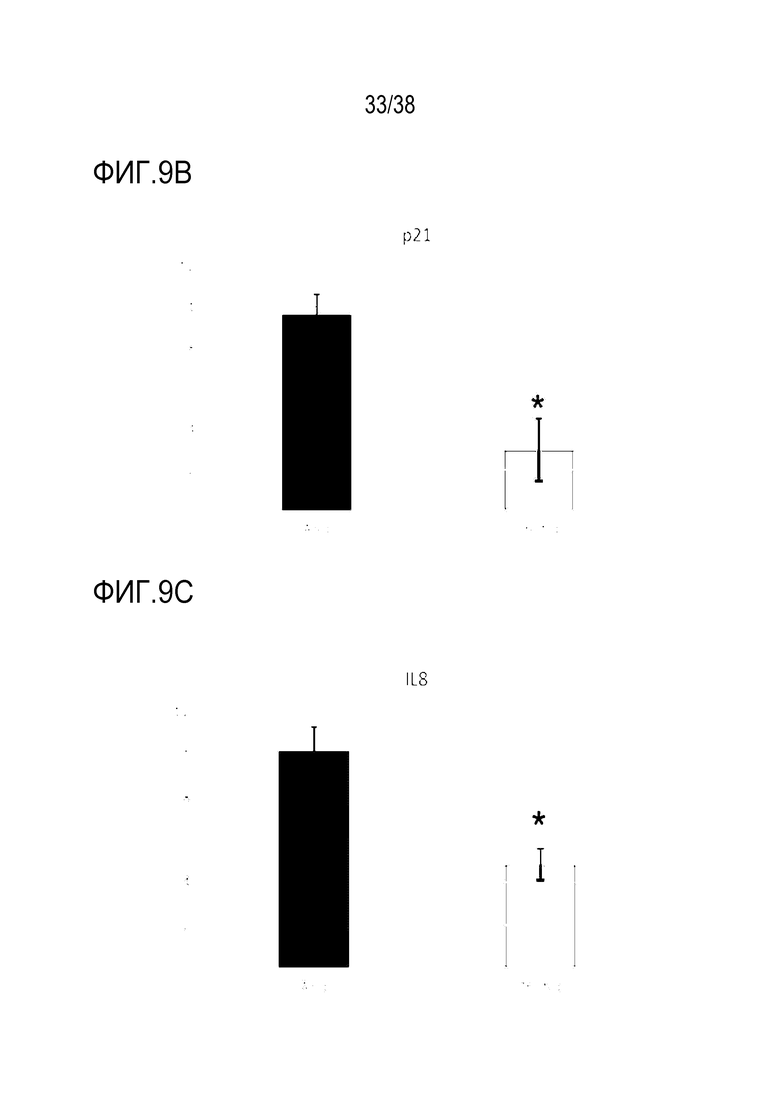
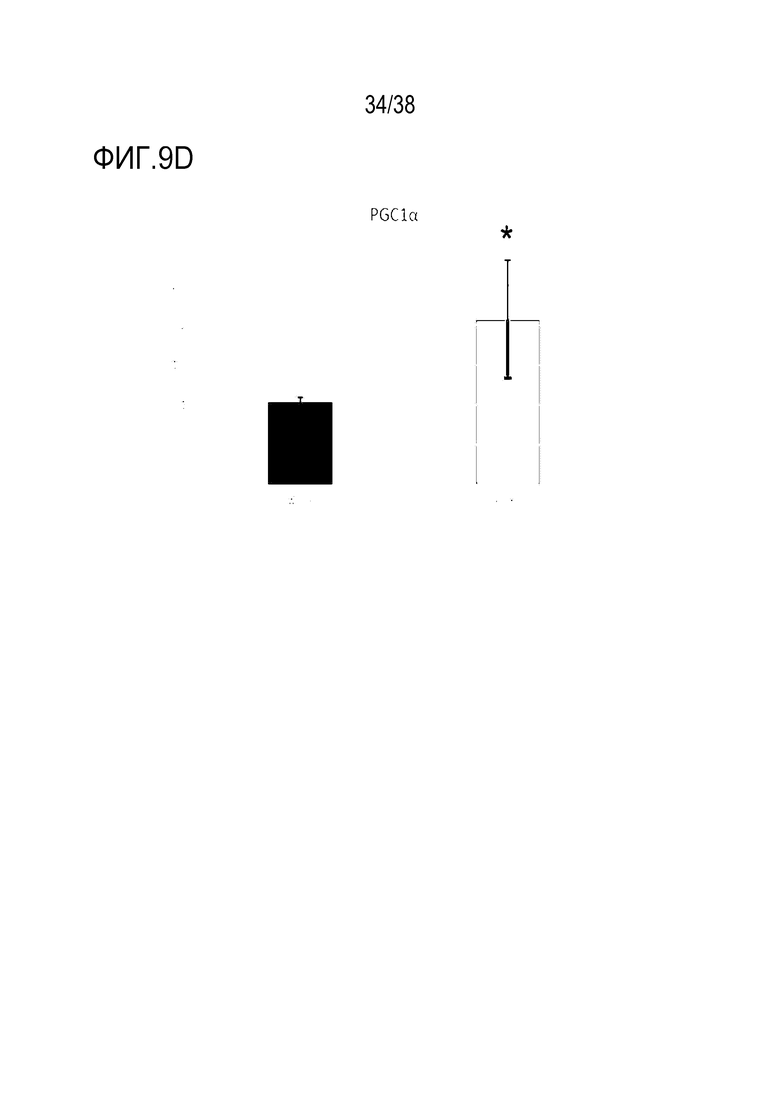
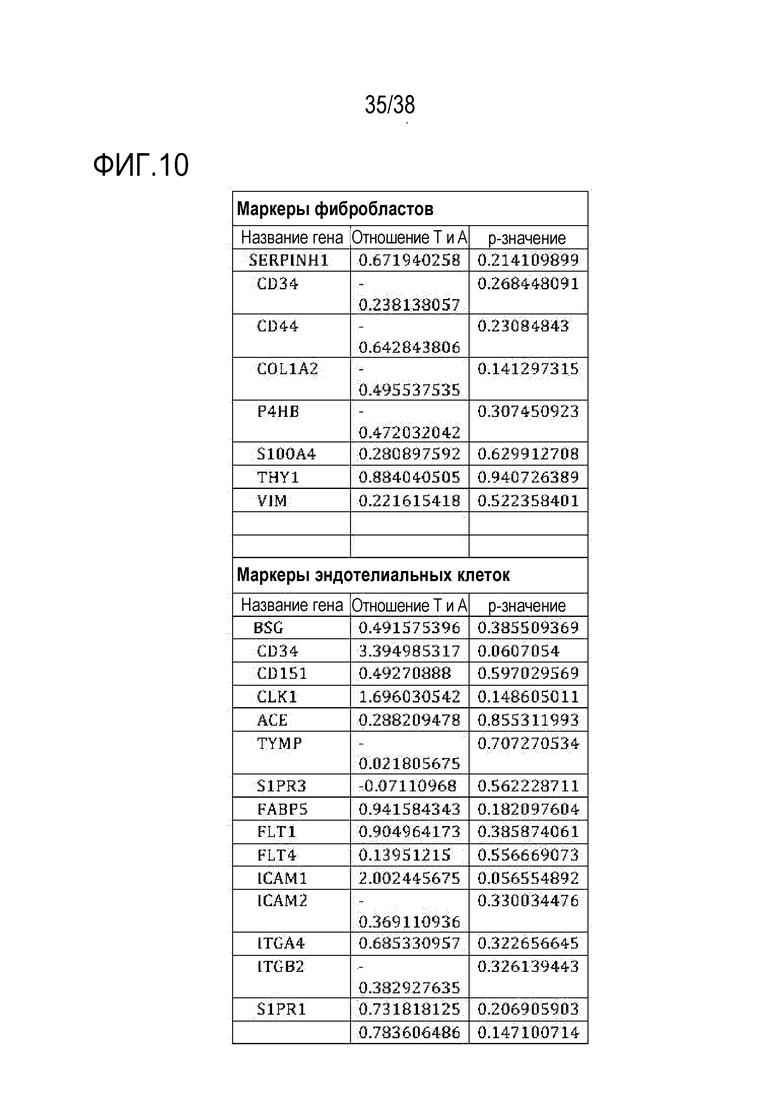
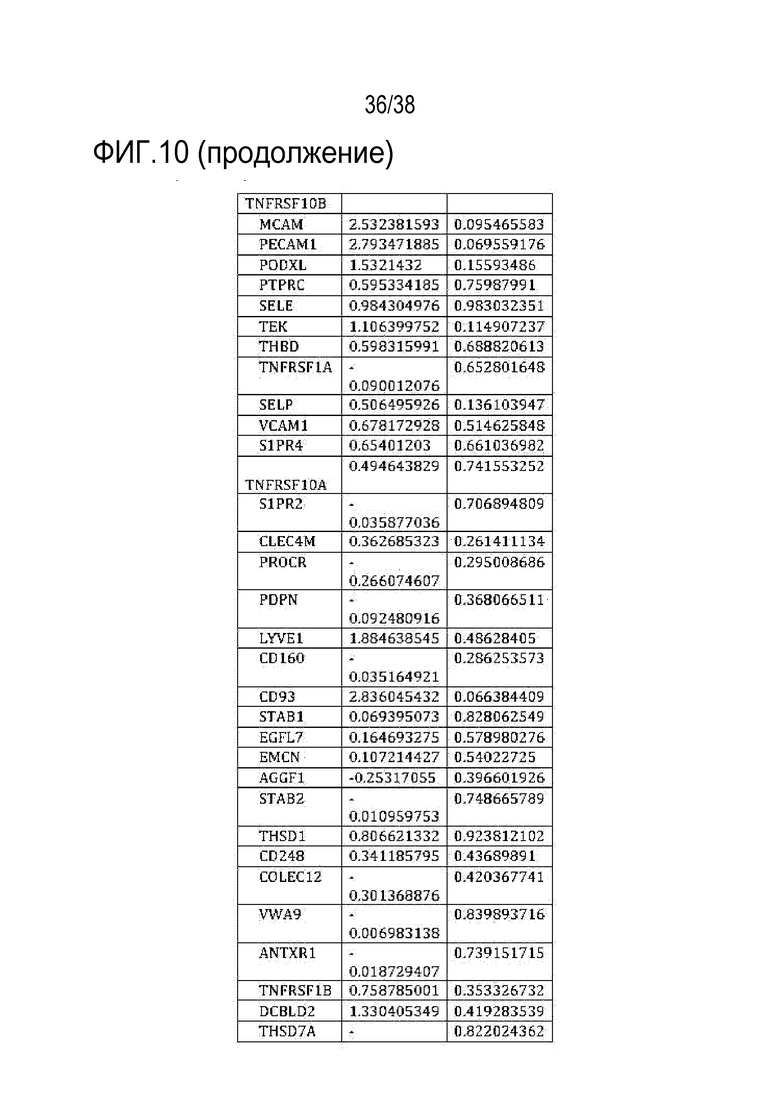

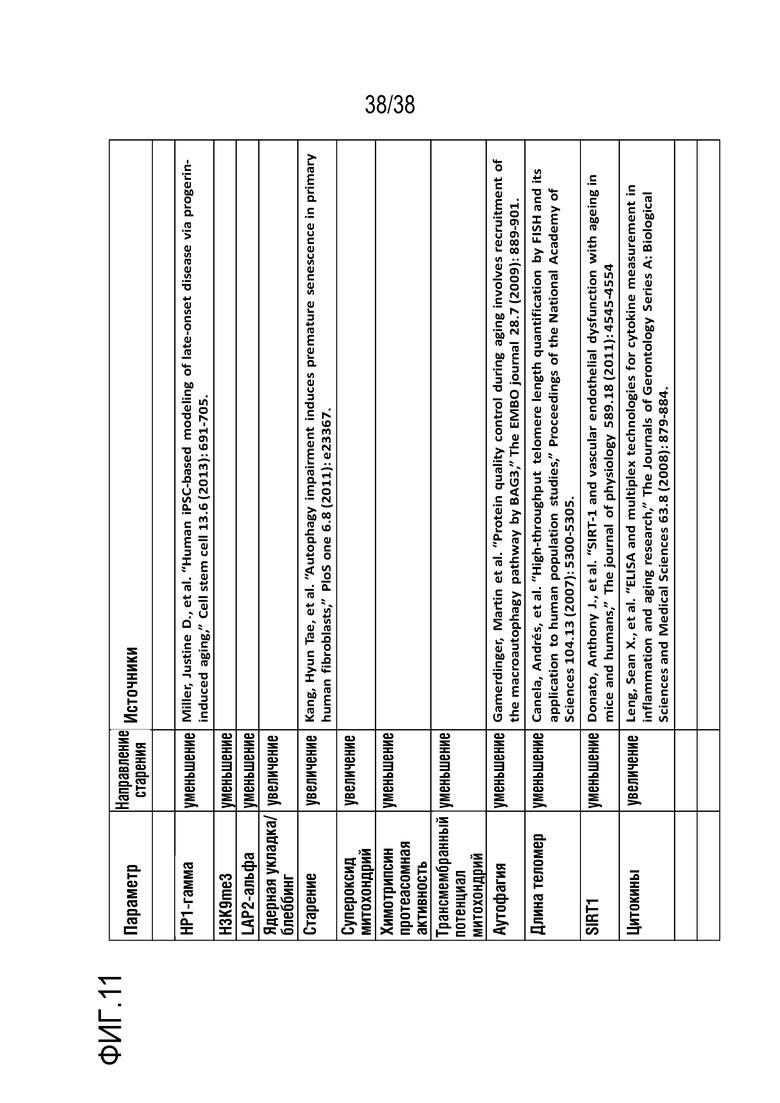
Настоящее изобретение относится к области биотехнологии, а именно к способам обработки соматической клетки, включающим воздействие на соматическую клетку матричной РНК (мРНК), кодирующей один или более факторов клеточного перепрограммирования, что приводит к получению омоложенной клетки при сохранении клеточной идентичности. В настоящем документе предложены способы и композиции, полезные для внутриклеточного омоложения, тканевой инженерии и регенеративной медицины. Раскрыты композиции и способы омоложения старых клеток и тканей с восстановлением функциональности. 4 н. и 28 з.п. ф-лы, 11 ил.
1. Способ обработки соматической клетки, включающий:
воздействие на соматическую клетку матричной РНК (мРНК), кодирующей один или более факторов клеточного перепрограммирования,
в результате чего указанное воздействие приводит к экспрессии одного или более факторов клеточного перепрограммирования в соматической клетке с получением омоложенной клетки при сохранении клеточной идентичности; и
где один или более факторов клеточного перепрограммирования включает фактор клеточного перепрограммирования, выбранный из группы, состоящей из Oct4, Sox2, Klf4, cMyc, Lin28 и NANOG.
2. Способ по п.1, где указанное воздействие включает предоставление композиции, включающей мРНК, где композиция включает вспомогательное вещество для трансфекции.
3. Способ по п.2, где указанная композиция включает липосомы, где мРНК заключена в липосомах.
4. Способ по п.1, где указанное воздействие приводит к трансфекции мРНК, кодирующей один или более факторов клеточного перепрограммирования, в соматическую клетку.
5. Способ по п.1, где указанное воздействие осуществляют in vitro, in vivo или ex vivo.
6. Способ по п.5, где указанное воздействие осуществляют ex vivo.
7. Способ по п.5, где указанное воздействие осуществляют in vivo, и указанное воздействие приводит к трансфекции мРНК, кодирующей один или более факторов клеточного перепрограммирования, в соматическую клетку для внутриклеточной экспрессии одного или более факторов клеточного перепрограммирования.
8. Способ по п.1, где указанную соматическую клетку выбирают из группы, состоящей из клеток крови и клеток иммунной системы.
9. Способ по п.1, где указанная соматическая клетка выбрана из группы, состоящей из фибробластов, эндотелиальных клеток, клеток соединительной ткани, хондроцитов, стволовых клеток скелетных мышц, мышечных клеток, клеток нервной системы, кератиноцитов, мезенхимальных стволовых клеток и эпителиальных клеток роговицы.
10. Способ по п.9, где указанная клетка крови является макрофагом, эритроцитом, моноцитом, нейтрофилом или эозинофилом.
11. Способ по п.8, где указанная клетка человека находится в ткани или органе.
12. Способ по п.11, где ткань или орган являются кожей, волосами, легким, хрящом или глазом.
13. Способ по п.1, где указанное воздействие включает воздействие на соматическую клетку мРНК не больше 5 дней подряд.
14. Способ по п.11, дополнительно включающий прерывание указанного воздействия и повтор указанного воздействия после указанного прерывания.
15. Способ по п.1, где указанное воздействие включает воздействие на соматическую клетку мРНК в течение приблизительно 2-5 дней подряд.
16. Способ по п.15, дополнительно включающий прерывание указанного воздействия и повтор указанного воздействия после указанного прерывания.
17. Способ обработки дифференцированной клетки, включающий:
введение мРНК, кодирующей один или более факторов клеточного перепрограммирования, в дифференцированную клетку для экспрессии одного или более факторов клеточного перепрограммирования с получением в результате клетки, сохраняющей свою клеточную дифференцировку, и которая экспрессирует один или более факторов клеточного перепрограммирования с получением омоложенной клетки; и
где один или более факторов клеточного перепрограммирования включает фактор клеточного перепрограммирования, выбранный из группы, состоящей из Oct4, Sox2, Klf4, cMyc, Lin28 и NANOG.
18. Способ лечения возрастного заболевания или состояния, включающий:
воздействие на дифференцированные клетки, связанные с возрастным заболеванием или состоянием, мРНК, кодирующей один или более факторов клеточного перепрограммирования,
в результате чего указанное воздействие приводит к экспрессии одного или более факторов клеточного перепрограммирования в дифференцированных клетках с получением омоложенных клеток при сохранении клеточной дифференцировки; и
где один или более факторов клеточного перепрограммирования включает фактор клеточного перепрограммирования, выбранный из группы, состоящей из Oct4, Sox2, Klf4, cMyc, Lin28 и NANOG.
19. Способ по п.18, где возрастное заболевание или состояние является дерматологическим заболеванием или состоянием, глазным заболеванием или состоянием, респираторным заболеванием или состоянием, или скелетно-мышечной заболеванием или состоянием.
20. Способ по п.19, где дерматологическое заболевание или состояние является кожной атрофией, внутрикожным эластолизом, сморщиванием кожи, гиперплазией сальных желез, гипоплазией сальных желез, сенильным лентиго, нарушением пигментации, седеющими волосами, потерей волос, истончением волос или хронической кожной язвой.
21. Способ по п.19, где глазное заболевание или состояние является возрастной макулодистрофией, глаукомой, катарактой, синдромом сухого глаза, диабетической ретинопатией или потерей зрения.
22. Способ по п.19, где респираторное заболевание или состояние является легочным фиброзом, хронической обструктивной болезнью легких, астмой, хроническим бронхитом, легочной эмболией, раком легкого или легочной инфекцией.
23. Способ по п.19, где скелетно-мышечное заболевание или состояние является артритом, остеопорозом, миеломой, подагрой, болезнью Пэджета, переломом кости, синдромом недостаточности костного мозга, анкилозом, диффузным идиопатическим скелетным гиперостозом, гематогенным остеомиелитом, мышечной атрофией, периферической нейропатией, рассеянным склерозом, боковым амиотрофическим склерозом, мышечной дистрофией Дюшенна, первичным боковым склерозом или тяжелой миастенией.
24. Способ по п.18, где указанное воздействие включает воздействие на дифференцированные клетки мРНК не больше 5 дней подряд.
25. Способ по п.24, дополнительно включающий прерывание указанного воздействия и повтор указанного воздействия после указанного прерывания.
26. Способ лечения нарушения дегенерации хряща у субъекта, включающий:
воздействие на хондроциты, связанные с нарушением дегенерации хряща у субъекта, мРНК, кодирующей один или более факторов клеточного перепрограммирования,
в результате чего указанное воздействие приводит к экспрессии одного или более факторов клеточного перепрограммирования в хондроцитах с получением омоложенных хондроцитов при сохранении клеточной дифференцировки; и
где один или более факторов клеточного перепрограммирования включает фактор клеточного перепрограммирования, выбранный из группы, состоящей из Oct4, Sox2, Klf4, cMyc, Lin28 и NANOG.
27. Способ по п.26, где нарушение с дегенерацией хрящевой ткани является артритом.
28. Способ по п.27, где артрит является остеоартрозом или ревматоидным артритом.
29. Способ по п.26, где указанное воздействие осуществляют in vivo или ex vivo.
30. Способ по п.29, где указанное воздействие осуществляют ex vivo, и способ дополнительно включает пересадку омоложенных хондроцитов субъекту.
31. Способ по п.26, где указанное воздействие включает воздействие на дифференцированные клетки мРНК не больше 5 дней подряд.
32. Способ по п.31, дополнительно включающий прерывание указанного воздействия и повтор указанного воздействия после указанного прерывания.
| US 9476031 B2, 25.10.2016 | |||
| US 2017363618 A1, 21.12.2017 | |||
| LEE J | |||
| et al., Human iPSC-derived chondrocytes mimic juvenile chondrocyte function for the dual advantage of increased proliferation and resistance to IL-1β, Stem Cell Research & Therapy, 2017, vol | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Нагревательный прибор для центрального отопления | 1920 |
|
SU244A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| HERBERTS C.A | |||
| et al., Risk factors in | |||
Авторы
Даты
2023-08-07—Публикация
2019-03-13—Подача