Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к добавке для воды для добавления в питьевую воду и более конкретно к кормовой добавке для добавления в питьевую воду, содержащей как питательные, так и микробиологические компоненты, для улучшенного здоровья животных.
Предшествующий уровень техники настоящего изобретения
Сельскохозяйственные животные, выращиваемые в экстенсивных системах, как известно, страдают от ряда проблем, большинство из которых связано с плотностью их выращивания, что может повлиять на их здоровье и общую производительность. Первой проблемой являются заболевания, которые быстро распространяются среди расположенных близко друг к другу (и часто высоко генетически однородных) животных и могут вызывать как смертность, так и потерю производительности. Вторая важная проблема связана с составом и производством кормов, в которых часто не хватает основных микроэлементов, необходимых для оптимального здоровья. Третья проблема связана с окружающей средой, которая часто ограничивает передвижение животных и вызывает стресс из-за чрезмерной скученности и/или отсутствия подходящего для вида социального взаимодействия. Этот стресс вместе с другими факторами экологического стресса, такими как повышение глобальных температур, приводит к заметному увеличению воспалительных маркеров, влияющих на факторы производительности, необходимые для поддержания сельского хозяйства.
Традиционные подходы, известные в данной области техники, концентрируются на постепенной минимизации этих проблем. Широко распространенное использование антибиотиков среди фермеров (часто при низких дозах из-за их стимулирующего действия на рост) привело к широко распространенной резистентности к антибиотикам у распространенных патогенных бактерий, а также к усилению противодействия со стороны общества из-за опасений в отношении потенциальных последующих эффектов, которые могут быть связаны с потреблением на постоянной основе следовых количеств этих химических веществ в мясе.
Хорошо изученный и экономически важный пример этих проблем можно найти в системах, используемых для экстенсивного выращивания цыплят-бройлеров. В данном случае необходимость экономии в результате роста масштабов производства привела к появлению экстенсивных систем фермерского хозяйства, которые в значительной степени основаны на применении фармацевтических средств (в основном, антибиотиков) и механизации для улучшения здоровья и производительности плотно содержащихся животных, выращиваемых на экономически выгодных кормах, тщательно составленных с точки зрения необходимости питательных веществ. Масштаб и повсеместный характер отрасли привели к тому, что производители, продающие свою продукцию на перенасыщенном рынке, получают все более низкую прибыль. Это усугубило тенденцию к созданию все более крупных и более интенсивных систем и сделало проблемы борьбы с болезнями и доступного повышения производительности еще более актуальными.
Аспектом вышеупомянутых проблем, который стал очевидным только недавно, является роль микрофлоры кишечника в контроле патогенных микроорганизмов, усвоении питательных веществ и общем состоянии здоровья животных. Даже в отношении здоровья человека микрофлора кишечника получила широкое признание и как ключевой компонент множества проблем, связанных со здоровьем, и как плохо изученный пробел в наших медицинских знаниях. Микрофлора других животных, которая считается столь же важной, как и микрофлора человека, остается еще менее изученной. Однако метаболическая коммуникация между видами в кишечнике участвует в уменьшении воспаления, теплового стресса и повышении уровня антител у сельскохозяйственных животных.
Короткоцепочечные жирные кислоты (SCFA) представляют собой основные конечные продукты ферментации неперевариваемых углеводов (NDC), которые становятся доступными для микробиоты кишечника (Morrison and Preston, 2016). SCFA, как правило, образуются путем сахаролитической ферментации углеводов, которые не перевариваются и не всасываются в кишечном тракте. Основными продуктами являются формиат, ацетат, пропионат и бутират (Morrison and Preston, 2016).
Органические карбоновые кислоты представляют собой кислоты общей структуры R-COOH, включая жирные кислоты и аминокислоты. Как правило, их обычно идентифицируют по их тривиальным названиям, и обычно они имеют суффикс «овая кислота». Карбоксилатный анион (R-COO-) обычно имеет суффикс «ат». Карбоновые кислоты, известные в данной области техники, включают угольную кислоту, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, капроновую кислоту, энантовую кислоту, каприловую кислоту, пеларгоновую кислоту, каприновую кислоту, ундециловую кислоту, лауриновую кислоту, тридециловую кислоту, миристиновую кислоту, пентадециловую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, нонадециловую кислоту и арахидиновую кислоту.
У видов домашней птицы наиболее распространенными бактериями, влияющими на здоровье кишечника домашней птицы, являются Salmonella, Camphylobacter и Е. coli. Эти виды, как известно, контролируются полезными бактериями просвета кишечника, особенно Lactobacillus. Известно, что действие карбоновых кислот SCFA, продуцируемых этими бактериями, на негативные кишечные бактерии, такие как указанные, может оказывать весьма положительный эффект на домашнюю птицу. SCFA снижают уровни патогенов в зобе/железистом желудке, регулируют микрофлору кишечника, улучшают переваривание кормов для повышения производительности.
Роль формиата в кишечнике связана с метаногенезом, и, как оказалось, он естественным образом повышается при воспалительных состояниях, что указывает на его роль в уменьшении воспаления.
Органические SCFA являются антимикробными по своей природе и, как известно, влияют преимущественно на грамотрицательные бактерии. Известно, что SCFA естественным образом продуцируются грамположительными кишечными микрорганизмами. Кроме того, известно, что SCFA оказывают обширное влияние на физиологию хозяина посредством питательных, регулирующих и иммуномодулирующих функций, а также могут влиять на приспособляемость бактерий как форму кислотного стресса (Sun and O'Riordan, 2013).
Муравьиная кислота и формиаты, как известно, увеличивают структуру и длину ворсинок эндотелия у домашней птицы. Увеличение высоты ворсинок различных сегментов тонкой кишки может быть связано с ролью кишечного эпителия как естественного барьера против патогенных бактерий и токсичных веществ.
Использование ферментов в качестве кормовых добавок известно в данной области техники как одна из стратегий, используемых для улучшения пищевой ценности неусваиваемых кормов для домашней птицы. Экзогенные ферменты, такие как эндо-1,4*Р ксиланаза (ЕС.3.2.1.8), которая относится к гемицеллюлазам, как правило, включены в кормы на основе пшеницы для домашней птицы с целью разложения антипитательных арабиноксиланов (АХ) и ксилановых фракций пшеницы, что, следовательно, может улучшить усвоение питательных веществ и рост домашней птицы (Vandeplas et al., 2009).
Инозитол представляет собой шестиуглеродный сахар, изомер глюкозы и карбоциклический полиол, присутствующий во многих биологических соединениях, таких как фосфатидилинозитол (Rucker et al., 2008) (Sosenko and Bancalari, 2012) (Corrado and Santamaria, 2015). Мио-инозитол, форма инозитола, в большом количестве присутствует в растениях в фосфорсодержащих формах, как правило, в виде фитиновой кислоты или инозитолгексафосфата (IP6). Многие виды птиц, особенно птиц бройлерного типа, не способны извлекать фитиновую кислоту из растений или растительных источников из-за отсутствия пищеварительного фермента фитазы, необходимого для удаления фосфатных групп. Добавление ферментов, таких как фитаза (Klopfenstein, et al., 2002), известно в данной области техники. Однако механизм действия фитазы восстанавливает IP6 до любого из инозитолпента-(IP5), тетра-(IP4) и трифосфата (IP3) (также известных как фитаты). Они отличаются от изомерной структуры мио-инозитола, который не содержит фосфат.
Наиболее известной формой инозитола (С6 Н12 О6) является мио-инозитол, который ранее рассматривался как член комплекса витаминов В (а именно, витамин В8). Мио-инозитол является компонентом плазматической мембраны и играет ключевую роль во многих биологических процессах, включая внутриклеточную передачу сигналов, контроль внутриклеточной концентрации кальция и поддержание потенциала клеточной мембраны. Комбинация пищеварительных ферментов корма и высоких доз мио-инозитола, как известно в данной области техники, влияет на генную экспрессию и/или микробные сообщества у домашней птицы. Также известно, что мио-инозитол играет роль в регулировании уровней кортизола и кортикостерона у домашней птицы.
Секретируемые патогенами вещества, как известно, вызывают нарушения всасывания питательных веществ организмом хозяина. Снижение концентрации этих веществ в кишечнике, как соответственно известно, приводит к повышению усвояемости питательных веществ, модифицируя метаболизм и уменьшая хронические воспалительные процессы низкой степени тяжести на слизистой оболочке кишечника. Хроническое воспаление у домашней птицы (называемое «ожог кишечника») широко известно в данной области техники и приводит к низкому питательному эффекту неусваиваемых кормов, таких как фитиновая кислота и арабиноксиланы. Также известно, что оно приводит к чрезмерному росту патогенных бактерий в кишечнике, все из которых способствуют повышению восприимчивости к заболеваниям.
Виды Lactobacillus известны в данной области техники как важные компоненты здоровых микробиомов кишечника. В частности, Lactobacillus plantarum (L. plantarum), в отличие от других строгих анаэробов, является аэротолерантным. У этих организмов отсутствует фермент каталаза, но почти всегда присутствует супероксиддисмутаза. L. plantarum по своей природе способны контролировать негативную патогенную флору желудочно-кишечного тракта посредством кислородзависимого уничтожения патогенов (Prescott et al., 2002). Они включают анаэробы, такие как Mycobacterium spp., Escherichia coli (E.coli.), Listeria spp., Clostridium spp. и Enterobacteriaceae, включая Salmonella spp. (Prescott et al., 2002). Согласно Vandeplas et al., 2009, пробиотик L plantarum в сочетании с ксиланазными ферментами обладает способностью снижать эффекты Salmonella typhimurium посредством процесса конкурентного исключения при добавлении в корм.
В WO 2010/117255 описан состав кормовой добавки или пищевой добавки, полученный из более чем одного штамма молочнокислых бактерий. Эту добавку используют для кормления животных с однокамерным желудком. Заявленные молочнокислые бактерии выбраны из группы, содержащей Lactobacillus plantarum. В этой заявке на патент также заявлен корм для животных, включающий питательные вещества, бактериоцины, витамин (sic), органические кислоты или их комбинации. Заявленный витамин может включать витамин В, а заявленные органические кислоты могут включать муравьиную кислоту, уксусную кислоту и молочную кислоту. Здесь следует отметить, что витамин В и органические кислоты, хотя и были заявлены, но не были продемонстрированы. Таким образом, продемонстрированные изменения в количестве молочнокислых бактерий и Enterobacteriaceae в фекалиях, морфологии тонкого кишечника и концентрации VFA в фекалиях явно являются результатом комбинации заявленных специфических штаммов молочнокислых бактерий.
Аналогично вышеупомянутой заявке на патент Thahn et al. описывают использование метаболитов Lactobacillus (полученных в результате добавления в корм комбинаций конкретных штаммов Lactobacillus) для улучшения здоровья кишечника домашней птицы. В данном источнике еще раз продемонстрированы известные преимущества добавления в корм пробиотиков на улучшение превращения корма у животных с однокамерным желудком. Как и в вышеупомянутой заявке на патент, органические кислоты, измеренные по концентрации VFA в фекалиях (т.е. экскретированные VFA), используют в качестве косвенного маркера состава микрофлоры кишечника, и не предпринималось никаких попыток ни непосредственно измерить влияние концентрации добавки VFA (т.е. потребленных VFA) на здоровье кишечника, ни количественно оценить синергетические эффекты пробиотиков и непосредственно питательных введений в корм.
Принимая во внимание вышеизложенное, очевидно, что в настоящее время существует потребность в нефармакологической добавке или добавочном корме, которые улучшают производительность и здоровье сельскохозяйственных животных (особенно домашней птицы) и снижают использование антибиотиков.
Задача настоящего изобретения
Соответственно задача настоящего изобретения состоит в обеспечении кормовой добавки для животных, которая снижает потребность в фармацевтических средствах и приносит пользу как здоровью животных, так и производительности.
Краткое раскрытие настоящего изобретения
Согласно первому аспекту настоящее изобретение относится к кормовой добавке для добавления в питьевую воду, содержащей:
- короткоцепочечные жирные кислоты,
- азотистое соединение,
- источник инозитола, и
- источник ксиланазы,
где короткоцепочечные жирные кислоты выбраны из группы, содержащей муравьиную кислоту, пропионовую кислоту и масляную кислоту, в любой комбинации, азотистое соединение выбрано из группы, содержащей аммиак и пропионат аммония, в любой комбинации, источник инозитола представляет собой мио-инозитол, и источник ксиланазы выбран из группы, содержащей Lactobacillus plantarum и выделенную ксиланазу, в любой комбинации.
В контексте настоящего изобретения выделенная ксиланаза предпочтительно относится к рН-резистентному типу, как известно в данной области техники.
Согласно варианту осуществления настоящего изобретения кормовая добавка может дополнительно включать молочную кислоту.
Согласно варианту осуществления настоящего изобретения кормовая добавка может дополнительно включать среднецепочечные жирные кислоты. Согласно предпочтительному варианту осуществления настоящего изобретения среднецепочечные жирные кислоты могут включать лауриновую кислоту и пальмитиновую кислоту.
Согласно варианту осуществления настоящего изобретения кормовая добавка может дополнительно включать бактерии, выбранные из группы, содержащей Lactobacillus spp., Propionibacterium spp. и Bacillus spp., в любой комбинации.
Согласно варианту осуществления настоящего изобретения кормовая добавка может дополнительно включать источник магния. Согласно предпочтительному варианту осуществления настоящего изобретения источник магния может представлять собой бисглицинат магния.
Согласно варианту осуществления настоящего изобретения кормовая добавка может быть добавлена в питьевую воду для потребления сельскохозяйственными животными.
Согласно предпочтительному варианту осуществления настоящего изобретения сельскохозяйственными животными могут быть животные с однокамерным желудком. Согласно другому предпочтительному варианту осуществления настоящего изобретения животными с однокамерным желудком может быть рыба. Согласно альтернативному варианту осуществления настоящего изобретения животными с однокамерным желудком может быть домашняя птица. Согласно предпочтительному альтернативному варианту осуществления настоящего изобретения домашней птицей может быть курица.
Согласно второму аспекту настоящее изобретение относится к кормовой добавке для добавления в питьевую воду для потребления домашней птицей, причем кормовая добавка содержит:
- от 30 мас. % до 50 мас. % пропионовой кислоты,
- от 5 мас. % до 30 мас. % молочной кислоты,
- от 1 мас. % до 15 мас. % муравьиной кислоты,
- от 5 мас. % до 15 мас. % аммиака,
- от 10 мас. % до 15 мас. % пропионата аммония,
- от 0,1 мас. % до 1 мас. % магния,
- от 0,5 мас. % до 3 мас. % лимонной кислоты,
- от 0,5 мас. % до 15 мас. % мио-инозитола,
- от 1 мас. % до 10 мас. % культуры Lactobacillus plantarum, и
- от 0,5 мас. % до 6 мас. % ксиланазы.
Эти и другие задачи, признаки и преимущества настоящего изобретения станут очевидны специалистам в данной области техники на основе подробного описания настоящего изобретения.
Описание предпочтительных вариантов осуществления настоящего изобретения
Неограничивающий пример предпочтительного варианта осуществления настоящего изобретения описан более подробно далее.
Примеры
Состав и тестирование смеси
Для того чтобы получить кормовую добавку согласно варианту осуществления настоящего изобретения 10-24% молочной кислоты (l-молочная кислота CAS 79-33-4), 35-50% пропионовой кислоты (чистая пропионовая кислота CAS 79-09-4) и 2,5-9,9% муравьиной кислоты (CAS 64-18-6) объединяли и нейтролизовывали с помощью аммиака (в виде гидроксида аммония марки CP), как требуется для буферизации раствора, и начальное значение рН доводили до 3,2-4,2.
Все химические вещества получали из местных и мировых коммерческих источников.
Карбоновые кислоты представляют собой кислоты Бренстеда-Лоури, так как они являются донорами протонов (Н+). Это наиболее распространенный тип органических кислот. Карбоновые кислоты, как правило, являются слабыми кислотами, что означает, что они только частично диссоциируют на катионы Н+ и анионы RCOO- в нейтральном водном растворе. Например, при комнатной температуре в одномолярном растворе уксусной кислоты диссоциирует только 0,4% молекул кислоты. pKa был введен как показатель для выражения кислотности слабых кислот, где pKa определяется следующим образом: pKa=log10Ka.
Вышеуказанный принцип применяли, используя различные значения pKa, равные 3,86, 4,87 и 3,75, для молочной, пропионовой и муравьиной кислоты, соответственно, при 25°С. Затем добавляли объемы каждой кислоты в соответствии со следующим значением конечной концентрации с получением раствора объемом 1 л с концентрацией 1 М, устанавливаемой посредством добавления воды:
- от 40 мас. % до 50 мас. % пропионовой кислоты,
- от 15 мас. % до 30 мас. % молочной кислоты, и
- от 1 мас. % до 15 мас. % муравьиной кислоты.
Раствор затем титровали ионами аммония (NH4+) в виде NH4OH (раствор гидроксида аммония) с получением от 5 об.% до 15 об.% аммиака сразу при конечной концентрации.
Конечное значение рН основной композиции этой основной смеси SCFA составляло 3,2-4,2.
В основную смеси кормовой добавки сразу после получения добавляли дополнительные соединения. Этими соединениями были магний (в виде бисглицината магния) (полностью прореагировавший аминокислотный хелат магния), инозитол (в виде мио-инозитола) и лимонная кислота. Продукт был получен из местного источника коммерческим путем.
Конечная концентрация вышеуказанных ингредиентов была следующей: от 0,1 мас. % до 1 мас. % магния, от 0,5 мас. % до 3 мас. % лимонной кислоты и от 0,5 мас. % до 15 мас. % мио-инозитола.
Этот вариант осуществления настоящего изобретения содержит только L.plantarum в качестве пробиотика. Используемый пробиотический штамм был приобретен коммерческим путем. Пробиотик добавляли в жидкой форме при конечной концентрации от 1 мас. % до 10 мас. %, при этом ксиланазу добавляли при концентрации от 0,5 до 6 мас. %. Используемые штаммы представляли собой штамм Lactobacillus plantarum от CWBI, CWBI Germany Belgium. Однако L. plantarum АТСС 1804 также был успешно протестирован наряду со штаммами из домашнего коровьего сыра, овечьего сыра и сыворотки, полученными на местных молочных заводах. Благодаря его аэротолерантной природе L. plantarum не подвергался отрицательному воздействию при транспортировке по водопроводу.
Все штаммы хранили при -80° в 30%-ом глицериновом бульоне. Сухие порошки также могут быть получены бактериальной ферментацией в соответствующих культуральных бульонах, как известно в данной области техники. В этом варианте осуществления настоящего изобретения использовали бульон MRS (De Man, Rogosa and Sharpe), полученный у соответствующих мировых поставщиков. Ферментация происходила в течение 24 часов при 37°С. Культуры центрифугировали при 8000 оборотах в минуту в течение 30 минут при 4°С (7BZ-Neo 1600-001). Перед использованием жизнеспособность и биохимические свойства клеток определяли с помощью API.
Сразу после достижения конечной концентрации кормовую добавку добавляли в питьевую воду для птиц. Дозирование осуществляли с помощью автоматизированной системы на ферме или вручную через напорные баки, сливающие непосредственно в питьевую воду, так чтобы повысить биодоступность. Пробы воды регулярно отбирали для измерения значения рН.
Результаты опытов по откорму цыплят-бройлеров были определены в отношении обработки по сравнению с антибиотиками и другими лечебными вмешательствами. В опытах использовали Ross 308 и Cobb 500 в виде вылупившихся птиц, выращиваемых для производства бройлеров. Результаты приведены в Таблице 1.


Таблица 1: Результаты традиционных данных по противомикробной эффективности для опытов на ферме, проведенных для коммерческих бройлеров Ross 308 и Cobb 500, сгруппированных в группы обработки и группы контроля. Группы обработки показали лучшую эффективность против Salmonella spp. и E.coli spp., чем группы, получавшие антибиотики. Экспериментальные группы выращивали в отдельных птичниках вместимостью от ~20000 до ~46000 птиц на птичник. Необнаруживаемое количество Camphylobacter и Clostridium perfrigens spp. было определено у контрольных птиц и птиц, подвергнутых обработке.
Освещение постоянно поддерживали как в птичниках групп обработки, так и в птичниках контрольных групп. Во все птичники групп обработки и птичники контрольных групп подавали корм и воду без ограничений.
В птичники групп обработки, как правило, подавали смесь в течение дней 1-4, дней 8-10, дней 18-24 и дней 28-32 опыта. Обработку можно продлить на циклы более 33 дней. В среднем в птичниках контрольных групп обработку проводили в течение дней 1-4 и по мере необходимости в соответствии с предписаниями. Все циклы на ферме были протестированы в течение 24 месяцев.
Обработка показала улучшение эффективности против E.coli spp., равное 69,81%, в соответствии с методом ISO4832:2007, и более хорошие результаты эффективности против Salmonella spp. согласно методу ISO6579:2003 получены в группах обработки, как показано в Таблице 1.
Неожиданно было обнаружено, что кормовая добавка как стимулирует рост кишечных бактерий Lactobacillus, так и уменьшает или устраняет дрожжи и плесень (измерено в образцах фекалий), что подтверждается метагеномным анализом 16S, одновременно предотвращая рост негативной кишечной микрофлоры, такой как Salmonella spp., Е. coli. и Clostridia spp. Обнаружение большого процента неизвестных видов обеспечивает культивирование новых видов бактерий. Кроме того, неожиданно было обнаружено, что птичники групп обработки показали существенное снижение коэффициента превращения корма (FCR) и более высокие стандарты коэффициента эффективности производства (PEF) (Таблица 2). Показатели смертности показывают улучшение на 0,8% по сравнению с птичниками контрольных групп, что означает, что обработка работает так же хорошо и более эффективно, чем фармацевтическое вмешательство.
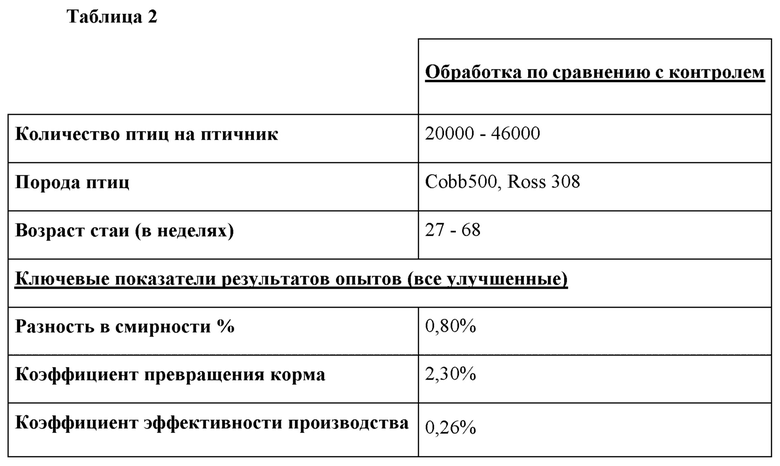
Таблица 2: Краткое изложение консолидированных результатов на ферме в виде сравнения групп обработки и контрольных групп коммерческих бройлеров. Опыты проводили в течение 2 лет на коммерческих фермах в реальном масштабе времени. Антибиотики были эффективно заменены обработкой, и в группах обработки наблюдали улучшение ключевых показателей.
Анализ данных бактериального 16S метагеномного анализа
Методология
Образцы фекалий коммерческих бройлеров из птичников контрольных групп и групп обработки, в каждом из которых содержится 40000 птиц, были случайным образом собраны и помещены в стерильные пробирки для сбора образцов (100 г).
Образцы транспортировали при 5°С и немедленно помещали в пробирки для сбора фекалий Zymo Research RNA/DNA Shield™. Затем собранные образцы были готовы для целевого чувствительного микробиомного анализа.
Образцы отправляли коммерческому поставщику услуг NGS, и геномную ДНК экстрагировали с применением набора ZymoBIOMICS. Кратко, образцы геномной ДНК амплифицировали с помощью ПЦР с использованием универсальной пары праймеров (341F и 785R, нацеленные на V3 и V4 гена 16S рРНК). Полученные ампликоны выделяли из геля, и репарированные на конце и Illumina-специфичные адаптерные последовательности лигировали с каждым ампликоном.
После количественного определения ДНК образцы были индивидуально проиндексированы, и была проведена еще одна стадия очистки на основе микроносителей. Затем ампликоны секвенировали на платформе Illumina's MiSeq с использованием набора MiSeq v3 (600 циклов).
Для каждого образца было получено 20 МБ данных (считывания спаренных концов длиной 2×300 пар оснований). Анализ данных на основе BLAST проводили с использованием разработанного своими силами конвейера анализа данных.
Для каждого образца данные обрезали и использовали только данные считывания >q20 (т.е. высокого качества). Каждое считывание подвергали анализу BLAST, и файл результатов сохраняли. Подсчитывали наилучшее совпадение для каждого результата BLAST (т.е. название рода и вида) и записывали, сколько раз каждый вид появлялся как «совпадение». Количество считываний представляет собой число считываний, совпадающих с соответствующим организмом в столбце 1 (название организма/название совпадения). В случае, когда результат BLAST не был обнаружен для определенного считывания, это количество считываний указывали в поле «нет совпадений». Информацию о таксонах для каждого совпадения BLAST записывали.
Для оценки влияния настоящего изобретения на микробиомный метагеном следовали двум протоколам обработки. Они описаны ниже:
Обработка 1: дни 1-5: 4 л: 1000 л, дни 18-20: 4 л: 1000 л, дни 25-27: 8 л: 1000 л, дни 30-31: 10 л: 1000 л
Обработка 2: дни 1-4: 1 л: 1000 л, дни 21-24: 2 л: 1000 л
Контроль: Обработка антибиотиком, день 1-4
Результаты
Результаты для 16S РНК показали заметное увеличение количества Firmicutes для обоих протоколов обработки, 53,73% для Обработки 1 и 42,27%) для Обработки 2, и заметное снижение количества Actinobacteria и Bacteroidetes по сравнению с 2,47% для контроля (Таблица 3). Соотношение Firmicutes/Bacteroidetes (F/B) является важным, поскольку Firmicutes более эффективны в качестве источника энергии, чем Bacteroidetes, способствуя более эффективному усвоению калорий и последующему набору веса (Krajmalnik-Brown R, et al., 2012).
Кроме того, было показано, что Firmicutes, в случае доминантных обогащенных генов, как известно, связаны с транспортировкой питательных веществ и общим набором веса, в то время как более высокое относительное количество Actinobacteria и Bacteroidetes и обогащение генов, связанных с углеводным обменом, было обнаружено в микробиомах фенотипов постного мяса (Dugas LR et al., 2016). Углеводный обмен является важным в питании бройлеров, но из-за антипитательного действия кормовых ингредиентов, таких как кукуруза и пшеница, важно сосредоточиться на улучшении кишечных микробиомов, которые могут улучшить общее использование питательных веществ, включая использование жиров и белков для улучшения набора веса.
Значительное увеличение относительной численности Firmicutes и более высокое соотношение F/B, как показано в настоящем изобретении, таким образом, представляет собой новый подход к улучшению превращения корма у бройлеров без фармацевтических средств. Традиционное терапевтическое введение антибиотиков может быть связано с увеличенным средним живым весом (ALW) и прибавкой в весе, но это в основном обусловлено углеводным обменом, и, учитывая угрозы повышенной резистентности к антибиотикам, важно сосредоточить внимание на дополнительных питательных введениях в корм, что улучшает использование всех типов кормов, в том числе с повышенным содержанием белка и жира.
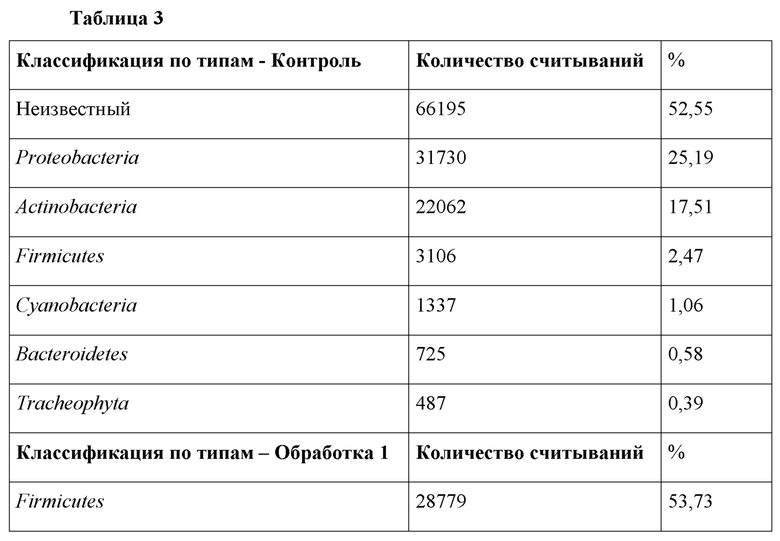
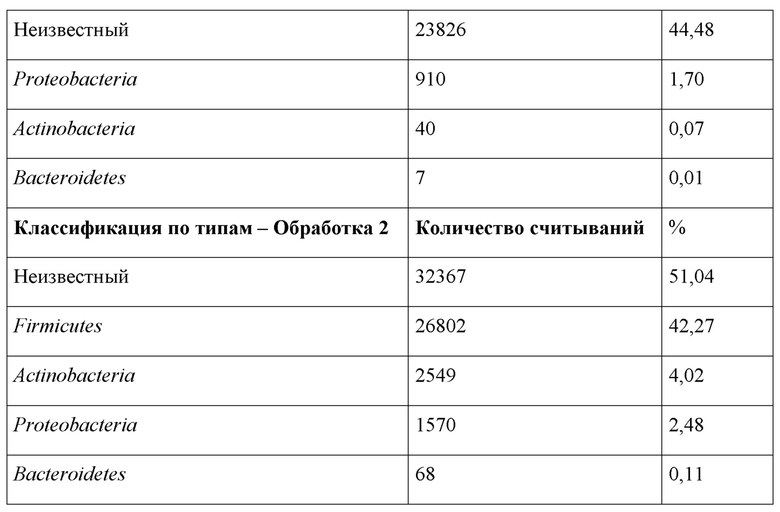
Таблица 3: Результаты анализа 16S метагеномной классификации бактериального типа для Обработки 1 (дни 1-5: 4 л: 1000 л, дни 18-20: 4 л: 1000 л, дни 25-27: 8 л: 1000 л, дни 30-31: 10 л: 1000 л) и Обработки 2 (дни 1-4: 1 л: 1000 л, дни 21-24: 2 л: 1000 л), показывающие заметное увеличение количества Firmicutes и заметное снижение количества Actinobacteria и Bacteroidetes по сравнению с контрольной рутинной терапевтической обработкой антибиотиками коммерческих бройлеров.
Наблюдается, что Обработка 1 и Обработка 2 показали 40,71% и 53,58%, Lactobacillales по сравнению с 2,38% для контроля. Преобладающими видами, обнаруженными в контрольных образцах, были Rhodospirillales и Actinomycetes. Actinomycetes для Обработки 2 составляли 4%, для Обработки 1-0,04%, a Rhodospirillales для Обработки 1 и Обработки 2 составляли 0,02% и 0,01%, соответственно. В настоящем документе продемонстрирован эффект настоящего изобретения и его способность изменять весь состав микробиомы, а также продемонстрировали синергетический эффект непосредственного питательного введения в корм. Важно отметить, что в данной области техники может быть известно, что SCFA улучшают здоровье кишечника, однако не известно о каких-либо сделанных попытках понять точные изменения классификации после таких введений в корм.
Эксперимент В был разработан для проверки результатов 16S РНК анализа из эксперимента А и в нем использовали только протокол Обработки 1. Здесь необходимо отметить, что порядок Lactobacillales снова является преобладающим обнаруженным штаммом бактерий. В данном эксперименте подтверждено, что Lactobacillales являются преобладающими видами после обработки по сравнению с контрольными птицами бройлерного типа, получавшими антибиотики.
Кроме того, следует отметить, что оба образца обработки показали более высокое содержание Lactobacillaceae, 52,95% и 40,28%, соответственно, по сравнению с 2,37% для контрольных образцов. Контрольные образцы показали 18,29% для Acetobacteraceae и 14,94% для Propionibacteriaceae.
В результате обоих экспериментов и классификации как по порядку, так и по семейству отмечено, что кормовая добавка, содержащая SCFA и мио-инозитол, изменила микробную колонизацию просвета кишечника коммерческих птиц бройлерного типа в пользу улучшающих здоровье Firmicutes и, что важно, Lactobacillales spp. Таким образом, было показано, что введение высокой дозы продолжает изменять модель колонизации кишечника в пользу Lactobacillus, которые, как известно, предотвращают колонизацию кишечника кишечными патогенами. Степень, при которой возникают эти изменения колонизации, ранее не была продемонстрирована для кормления комбинацией SCFA, описанной в настоящем документе.
Результаты анализа BLAST неожиданным образом не показали Lactobacillus plantarum spp. Неожиданно было обнаружено, что кормление карбоновыми кислотами может создать единообразие в просвете кишечника, как показано для Обработки 1.
В Таблице 4 ниже показаны результаты BLAST для каждого из проведенных экспериментов, где показано это единообразие. Подтверждено, что более высокие уровни дозы действительно создают большее единообразие в кишечнике и исключают негативные виды патогенов, которые, как известно, негативно влияют на такие показатели на ферме, как FCR, PEF и смертность, а также связанные риски загрязнения пищевых продуктов.
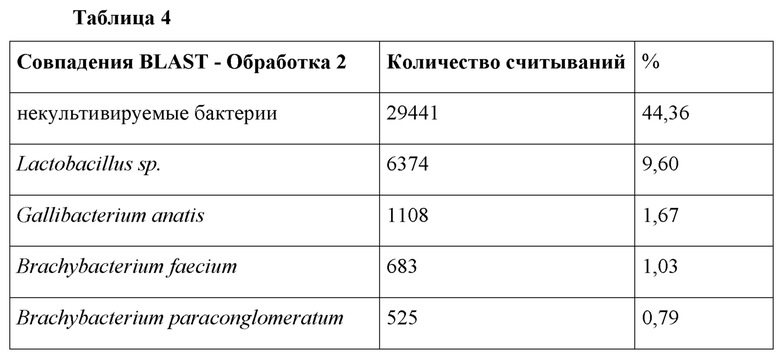
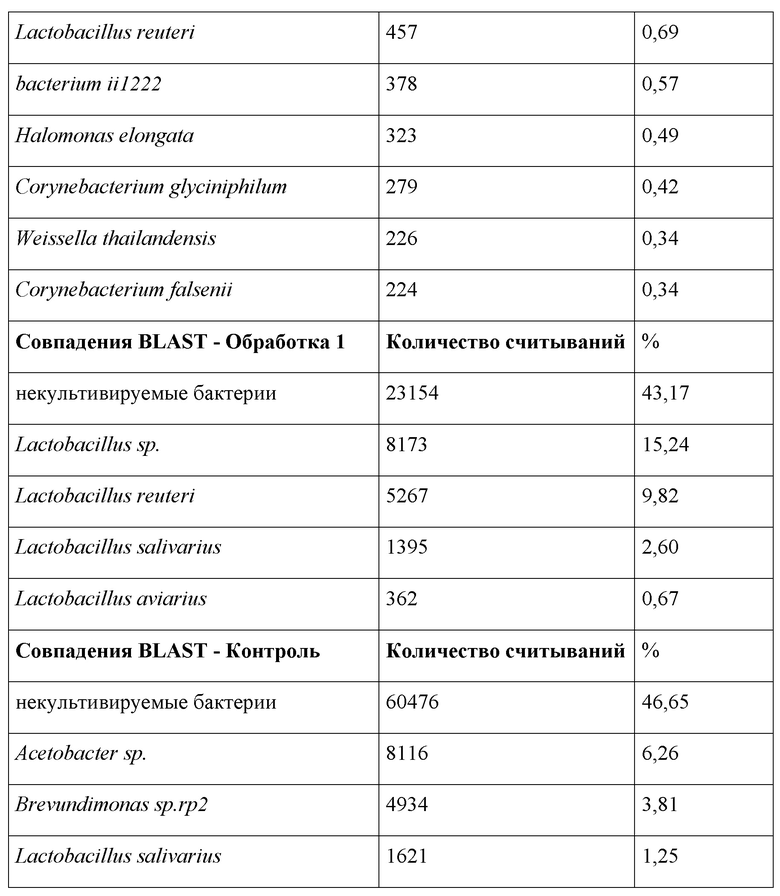
Таблица 4: Обобщенные результаты BLAST для 16S метагеномных анализов для коммерческих птиц бройлерного типа, обработанных вариантом осуществления изобретения, по сравнению с птицами, получавшими начальную терапевтическую дозировку антибиотиков на ферме.
У природных комменсальных для птиц патогенов не было обнаружено резистентности к добавке согласно настоящему изобретению. Однако необходимо отметить, что при более низких уровнях доз согласно настоящему изобретению патоген Gallibacterium anatis обнаруживается на уровне 1,67%. Это патоген быстроразвивающегося заболевания домашней птицы. В связи с растущим беспокойством в отношении бактерии G. anatis и ее плохо изученными кинетикой роста, маркерами вирулентности, патогенезом и вакциной (вакцинами) для борьбы с ней, необходимо отметить, что в настоящей заявке показано, что при более высоких дозах эта бактерия отсутствует.Gallibacterium anatis (ранее известная как Pasteurella anatis) относится к комменсалам в верхних дыхательных путях и нижних половых путях здоровых кур (Singh et al., 2016). Ее колонизация в верхних дыхательных путях может играть роль в вирулентности других возбудителей заболеваний, таких как штаммы птичьего гриппа. Здесь необходимо отметить, что для Обработки 1 не было 16S РНК геномного подтверждения этой патогенной бактерии. Авторы настоящего изобретения экстраполировали, что кормление при более высоких уровнях доз играет роль в устойчивости к заболеваниям.
Хотя инфекция G. anatis подлежит лечению антибиотиками, частота неэффективности лечения является вновь возникшей и повторяющейся проблемой, а мультирезистентные штаммы G. anatis показали резистентность к лекарственным сульфамидным препаратам, новобиоцину, тилозину, клиндамицину, тетрациклину и пенициллину. В настоящей заявке показано, что резистентность не проявляется при более высоких уровнях доз, и что уровень дозы является важным фактором при обработке комбинациями SCFA и пробиотиков. Кормовая добавка согласно настоящему изобретению способна эффективно предотвращать появление новых патогенов с повышенной резистентностью к известным антибиотикам.
Дальнейшее тестирование конкретных вариантов осуществления настоящего изобретения
Конкретный вариант осуществления настоящего изобретения, полученный, как описано выше, был протестирован на цыплятах-бройлерах. В качестве положительного контроля использовали птичники, обработанные антибиотиками. Смесь была приготовлена с использованием следующего соотношения компонентов:
- 47,2 мас. % пропионовой кислоты,
- 22,45 мас. % молочной кислоты,
- 8,75 мас. % муравьиной кислоты,
- 11,55 мас. % аммиака,
- 0,27 мас. % магния,
- 1,08 мас. % лимонной кислоты,
- 5,41 мас. % мио-инозитола,
- 2,24 мас. % культуры Lactobacillus plantarum, и
- 1,05 мас. % ксиланазы.
РНК-секвенирование
Для РНК-секвенирования (RNA Seq), также называемого секвенированием методом дробовика полного транскриптома (WTSS), используют секвенирование нового поколения (NGS) для выявления присутствия и количества РНК в биологическом образце в данный момент времени. RNA Seq используют для анализа постоянно изменяющегося клеточного транскриптома (Chu and Corey, 2012).
В настоящее время общепризнано, что РНК-секвенирование является инструментом глубокого секвенирования, который обеспечивает высокий охват и использует те же концепции, что и ДНК-секвенирование, но для которого получение библиотеки является совершенно иным (Chu and Corey, 2012). Получение библиотеки Seq РНК, как правило, включает обратную транскрипцию. Наиболее важным является то, что Seq РНК облегчает возможность увидеть изменения экспрессии генов с течением времени или различия в экспрессии генов для разных групп или обработок (Maher et al., 2009).
Seq РНК включено в настоящее изобретение для того, чтобы понять на какие пути влияет используемый в настоящее время вариант осуществления настоящего изобретения, и выявить новые пути экспрессии генов, которые еще не изучены. К настоящему времени, после картирования куриного генома в 2004 г., не было сделано попыток понять и картировать ферменты, специфически регулирующие функцию белка на протеомном уровне у курицы (база данных USDA). С этой целью в рамках настоящего изобретении были обнаружены экспрессии новых генов, и они были связаны с новыми ферментами у птиц, обработанных вариантом осуществления настоящего изобретения.
Успешный репродуктивный цикл, питание, рост и устойчивость к заболеваниям являются важными для промышленности показателями, и понимание на молекулярном уровне позволяет исследователям далее разрабатывать новые продукты для борьбы с заболеваниями. Известно, что органические кислоты играют роль в замене антибиотиков, но не в той роли, которую они играют в развитии устойчивости к заболеваниям или успешном репродуктивном цикле.
Методология
Данные RNA Seq для настоящего изобретения были получены для того, чтобы установить неизвестные пути, которые инициируются различным образом у обработанных и контрольных птиц.
Образцы крови брали у 2 птиц из каждого из контрольного экспериментального птичника и экспериментального птичника обработки. Образцы помещали в пробирки DNA/RNA Shield Tubes (Zymo Research Corp, по лицензии Pangea Laboratory) в объеме 3 мл. Одних и тех же птиц использовали в течение 33-х дневного периода, чтобы отслеживать данные транскриптомы в течение этого периода. Сбор и подготовка образцов были разработаны для того, чтобы увидеть изменения экспрессии генов с течением времени и различия между группой, получавшей обычные антибиотики, и группой, получавшей вариант осуществления настоящего изобретения, как показано в Таблице 5.
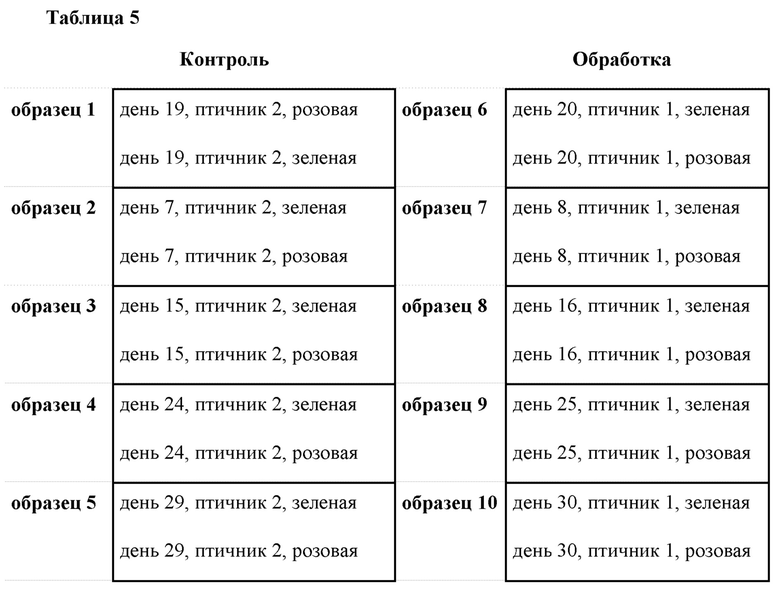
Таблица 5: Коллекция образцов и разработка протокола для анализа РНК-секвенирования для оценки различий в экспрессии генов с течением времени и между контрольными (получавшими антибиотик) птицами и птицами, получавшими обработку. По две птицы из каждого птичника (розовая и зеленая) подвергались забору образцов крови в течение 33 дней. Образцы были объединены для обеспечения данных глубокого РНК-секвенирования и рандомизации.
Подготовка образца и протокол были проведены в соответствии с системой Illumina MiSeq. Затем образцы отправляли коммерческому поставщику услуг NGS, и геномную ДНК экстрагировали с помощью набора ZymoBIOMICS. Кратко, образцы геномной ДНК амплифицировали с помощью ПЦР с использованием универсальной пары праймеров (341F и 785R, нацеленные на V3 и V4 гена 16S рРНК). Полученные ампликоны выделяли из геля, и репарированные на конце и Illumina-специфичные адаптерные последовательности лигировали с каждым ампликоном.
После количественного определения ДНК образцы были индивидуально проиндексированы, и была проведена еще одна стадия очистки на основе микроносителей. Затем ампликоны секвенировали на платформе Alumina's MiSeq с использованием набора MiSeq v3 (600 циклов). Для каждого образца было получено 20 МБ данных (считывания спаренных концов длиной 2×300 пар оснований). Анализ данных на основе BLAST проводили с использованием разработанного своими силами конвейера анализа данных.
Затем метаданные РНК направляли на анализ тепловой карты. Этот анализ одновременно объединяет в кластеры образцы и признаки, представляя двумерную тепловую карту значений экспрессии. Здесь каждый столбец соответствует одному образцу, а каждая строка соответствует признаку (гену или транскрипту). Образцы и признаки подвергались иерархической кластеризации. Известные метаданные о каждом образце добавляли в виде наложения. Для сопоставления образцов использовали нормализацию ТММ, а для сопоставимости признаков использовали нормализацию по z-показателю. После создания тепловую карту использовали для идентификации интересующих генов.
Кластеры с иерархической кластеризацией характеризуются подобием профилей их экспрессии в наборе образцов, и алгоритм для целей данного исследования требует указания меры расстояния и кластерной связи при оценке данных. Евклидово расстояние выбирали мерой расстояния, где обычное расстояние между двумя точками представляет собой длину соединяющего их сегмента.
Если u=(u1, u2, …, un), и v=(v1, v2, …, vn), тогда евклидово расстояние между u и v равно
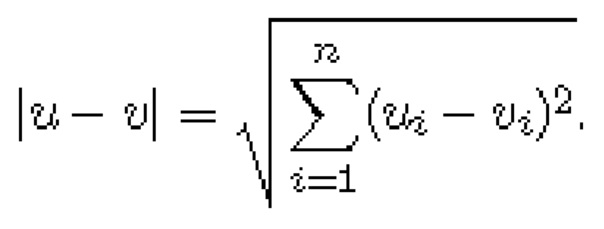
Кластерная связь, выбранная для целей настоящего анализа, представляет собой полную связь, где расстояние между двумя кластерами вычисляется как максимальное расстояние от объекта до объекта d(xi, yi), где xi происходит из первого кластера, a yi происходит из второго кластера. Другими словами, это расстояние между двумя самыми дальними объектами в кластере.
Инструменты картирования были использованы для выравнивания последовательностей с эталонным куриным геномом (доступен на ftp://ftp.ensembl.org/pub/release-94/fasta/gallus_gallus/dna/: Gallus gallus genome build 5, март 2017 г.). Подсчитывали количество считываний на ген. Для того, чтобы исключить гены с очень низким количеством считываний исключали признаки с менее чем 20 считываниями по меньшей мере как в контроле, так и в обработке.
Результаты
В результате РНК-секвенирования было получено в среднем 15000 считываний на образец. Был визуализирован различно распространенных транскриптов, а также их кластеризация. Активация пути различалась для контрольной группы и группы обработки, где группы обработки показали активацию канонических путей регуляции теплового стресса, развития устойчивости к заболеваниям и поддержания нервной системы.
Была получена тепловая карта лонгитудинального исследования Seq РНК, сравнивающая транскриптомику коммерческого бройлера для обработки вариантом осуществления настоящего изобретения по сравнению с обработкой антибиотиками. Была показана в целом более высокая скорость экспрессии по сравнению с контрольными группами для ключевого канонического пути активации регуляции теплового стресса (HSPA2), развития устойчивости к заболеваниям (OASL, MACF1, OTUD1, BF1 и BF2) и поддержания нервной системы (ТМЕМ184 В и EEF2). Данное исследование также продемонстрировало повышенную экспрессию клеточных иммунных путей посредством активации МАР-киназных путей через ТМЕМ184 В, антигена МНС класса I через BF1 и BF2, биосинтеза белка через EEF2 для птиц группы обработки по сравнению с контрольными птицами.
Эти результаты подтверждают неожиданный эффект настоящего изобретения, состоящий в усиленной активации регуляции стресса, устойчивости к заболеваниям и поддержания нервной системы, обеспечении механистической связи между результатами, полученными при испытаниях настоящего изобретения, и вариантом осуществления настоящего изобретения Таким образом, настоящее изобретение обеспечивает новый подход снижения и эффективного замещения потребности в фармацевтических средствах, а также увеличивает как здоровье животных, так и производительность.
Ссылочные источники
Chu Y, Corey DR. RNA sequencing: platform selection, experimental design, and data interpretation. Nucleic Acid Therapeutics, 2012, Vol 22, No 4, 271-4.
Dugas LR, Fuller M, Gilbert J, Layden ВТ. The obese gut microbiome across the epidemiologic transition. Emerging Themes in Epidemiology, 2016, Vol 13, 2.
Klopfenstein TJ, Angel R, Cromwell G, Erickson GE, Fox DG, Parsons C, Satter LD, Sutton AL, Baker DH. Animal Diet Modification to Decrease the Potential for Nitrogen and Phosphorus Pollution. Council for Agricultural Science and Technology, 2002.
Krajmalnik-Brown R, Hhan ZE, Kang DW, DiBaise JK. Effects of gut microbes on nutrient absorption and energy regulation. Nutrition in Clinical Practice, 2012, Vol 27, 201-214.
Maher CA, Kumar-Sinha С, Cao X, Kalyana-Sundaram S, Han B, Jing X, Sam L, Barrette T, Palanisamy N, Chinnaiyan AM. Transcriptome sequencing to detect gene fusions in cancer. Nature, 2009, Vol 458, No 7234, 97-101.
Morrison DJ, Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism. Gut Microbes, 2016, Vol 7, No 3, 189-200.
Prescott JP, Lansing M, Harley JP, Klein DA. Microbiology 5th Edition. McGraw Hill Companies, 2002, 128-129.
Singh SV, Singh BR, Sinha DK, Kumar VOR, Vadhana PA, et al. Gallibacterium anatis: An Emerging Pathogen of Poultry Birds and Domiciled Birds. Journal of Veterinary Science and Technology, 2016, Vol 7, 324.
Sun Y, O'Riordan, MXD. Regulation of bacterial pathogenesis by intestinal Short-Chain Fatty Acids. Adv Appl Mircobiol, 2016, Vol 85, 93-118.
Thranh NT, Loh TC, Foo HL, Hair-bejo H, Azhar BK. Effects of feeding metabolite combinations produced by Lactobaccilus plantarum on growth performance, faecal microbial population, small intestine villus height and faecal volatile fatty acids in broilers. Brit Poult Sci, 2009, Vol 50, 298-306.
Vandeplas S, Dubois Dauphin R, Thiry C, Beckers Y, Welling G W, Thonart P, Thewis A. Efficiency of a Lactobacillus plantarum-xylanase combination on growth performances, microflora populations, and nutrient digestibilities of broilers infected with Salmonella Typhimurium. Poul Sci, 2009, Vol 88, No 8, 1643-1654.
Wei S, Morrison M, Yu Z. Bacterial census of poultry intestinal microbiome. Poult Sci, 2013, Vol 92, 671-83.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОНЕНТЫ НА ОСНОВЕ МИКРООРГАНИЗМА РОДА BACILLUS ДЛЯ ИНГИБИРОВАНИЯ ИЛИ ЗАМЕДЛЕНИЯ РОСТА ENTEROCOCCUS SPP. У ЖИВОТНЫХ | 2017 |
|
RU2789148C2 |
| Способ получения кормовой композиции с функциональными свойствами для птицеводства | 2023 |
|
RU2819889C1 |
| Кормовая добавка с фитопробиотической активностью для профилактики и лечения болезней сельскохозяйственной птицы | 2022 |
|
RU2779603C1 |
| ИСПОЛЬЗОВАНИЕ МИКРОБНЫХ СООБЩЕСТВ ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2017 |
|
RU2823233C2 |
| КОМПОЗИЦИЯ КОРМА ДЛЯ ЖИВОТНЫХ | 2008 |
|
RU2400101C2 |
| ИСПОЛЬЗОВАНИЕ МИКРОБНЫХ СООБЩЕСТВ ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2017 |
|
RU2758387C2 |
| БАКТЕРИАЛЬНЫЕ ШТАММЫ, ВЫДЕЛЕННЫЕ ИЗ СВИНЕЙ | 2012 |
|
RU2677890C2 |
| СПОСОБ ПРИМЕНЕНИЯ ШТАММА BacilluS subtilis QST713 ДЛЯ УЛУЧШЕНИЯ ПОКАЗАТЕЛЕЙ РОСТА ЖИВОТНОГО | 2009 |
|
RU2544952C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГОМОПРОБИОТИЧЕСКОГО БАКТЕРИЙНОГО ПРЕПАРАТА, СОДЕРЖАЩЕГО ЖИВЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ | 1999 |
|
RU2146288C1 |
| Кормовая добавка для сельскохозяйственных животных и птиц | 2022 |
|
RU2808208C1 |
Группа изобретений относится к сельскому хозяйству, в частности к кормопроизводству и может быть использовано в виде кормовой добавки, добавляемой в питьевую воду для улучшенного здоровья домашней птице. Кормовая добавка содержит короткоцепочечные жирные кислоты, азотистое соединение, источник инозитола и источник ксиланазы. Использование группы изобретений позволит снизить потребность в фармацевтических средствах и принесет пользу как здоровью домашней птице, так и ее продуктивности. 2 н. и 6 з.п. ф-лы, 5 табл.
1. Кормовая добавка для добавления в питьевую воду для потребления домашней птицей, где кормовая добавка содержит:
- муравьиную кислоту, пропионовую кислоту и масляную кислоту, в любой комбинации,
- аммиак и пропионат аммония, в любой комбинации,
- Lactobacillus plantarum и выделенную ксиланазу, в любой комбинации, и
- мио-инозитол.
2. Кормовая добавка по п. 1, где добавка дополнительно содержит молочную кислоту.
3. Кормовая добавка по п. 1 или 2, где добавка дополнительно содержит среднецепочечные жирные кислоты.
4. Кормовая добавка по п. 3, где среднецепочечные жирные кислоты включают лауриновую кислоту и пальмитиновую кислоту.
5. Кормовая добавка по любому из пп. 1-4, где добавка дополнительно содержит бактерии, выбранные из группы, содержащей Lactobacillus spp., Propionibacterium spp. и Bacillus spp., в любой комбинации.
6. Кормовая добавка по любому из пп. 1-5, где добавка дополнительно содержит бисглицинат магния.
7. Кормовая добавка по пп. 1-6, где домашней птицей является курица.
8. Кормовая добавка для добавления в питьевую воду для потребления домашней птицей, где кормовая добавка содержит:
- от 30 мас.% до 50 мас.% пропионовой кислоты,
- от 5 мас.% до 30 мас.% молочной кислоты,
- от 1 мас.% до 15 мас.% муравьиной кислоты,
- от 5 мас.% до 15 мас.% аммиака,
- от 10 мас.% до 15 мас.% пропионата аммония,
- от 0,1 мас.% до 1 мас.% магния,
- от 0,5 мас.% до 3 мас.% лимонной кислоты,
- от 0,5 мас.% до 15 мас.% мио-инозитола,
- от 1 мас.% до 10 мас.% культуры Lactobacillus plantarum, и
- от 0,5 мас.% до 6 мас.% ксиланазы.
| EP 3020284A1, 18.0.2016 | |||
| WO 2014159185A1, 02.10.2014 | |||
| WO 2013165566A1, 07.11.2013 | |||
| 0 |
|
SU253085A1 | |
Авторы
Даты
2023-09-29—Публикация
2018-12-18—Подача