ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак молочной железы является наиболее часто диагностируемой злокачественной опухолью у женщин и ведущей причиной женской смертности, обусловленной раком, во всем мире. Согласно оценкам, общая заболеваемость раком молочной железы достигнет 5 миллионов женщин в следующие десять лет [Parkin, DM and Fernandez LM, Use of statistics to assess the global burden of breast cancer. Breast Journal. 2006; (12, Suppl 1):S70-80; World Health Statistics. 2008, World Health Organization.] В 2007 г. рак молочной железы стал причиной приблизительно 540000 летальных исходов по всему миру [World Health Organization Fact Sheet No. 297. 2008; доступен на сайте WHO.]
Семейство erbB (гомологов онкогена вируса эритробластного лейкоза) TKI (ингибиторов тирозинкиназ) состоит из 4 членов: erbB-1 (EGFR (рецептор эпидермального фактора роста)), erbB-2 (HER-2, neu), erbB-3 (HER-3) и erbB-4 (HER-4). Семейство рецепторов erbB вовлечено в пролиферацию клеток, онкогенез и метастазирование и аномально экспрессировано в опухолях многих типов. HER2-положительные виды рака молочной железы, то есть, виды рака молочной железы с положительным результатом теста на белок, называемый человеческим EGFR, связанные со сверхэкспрессией белка Erb-2 или амплификацией гена erbB-2 в раковых опухолях молочной железы, связаны с более агрессивным клиническим течением заболевания и менее благоприятным прогнозом [Slamon D, Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987 (235):177-182].
Трастузумаб, гуманизированное моноклональное антитело, селективно связывающееся с человеческим рецептором erbB-2, улучшает прогноз у женщин с erbB-2-положительным раком молочной железы. У пациентов с метастатическим раком молочной железы со сверхэкспрессией erbB-2 трастузумаб в комбинации с химиотерапией улучшает регрессию опухоли, увеличивает время до прогрессирования опухоли и повышает среднюю выживаемость по сравнению с химиотерапией самой по себе, что привело к его одобрению в качестве лечения первой линии при метастазировании. [Ligibel JA and Winer EP, Trastuzumab/chemotherapy combinations in metastatic breast cancer. Seminars in Oncology. 2002; 29(3 Suppl 11): 38-43]. Герцептин (трастузумаб) [Package insert, Genentech (2008)]. Трастузумаб был также одобрен для применения в адъювантной терапии в комбинации с другими лекарственными средствами для лечения метастатического рака молочной железы со сверхэкспрессией erbB-2 с поражением лимфатических узлов или без поражения лимфатических узлов (без рецепторов эстрогенов (ER-отрицательного)/без рецепторов прогестерона (PgR-отрицательного)). Так, трастузумаб используют в качестве части схемы лечения, состоящей из (а) доксорубицина, циклофосфамида и либо паклитаксела, либо доцетаксела, (б) схемы лечения с доцетакселом и карбоплатином, и (в) в качестве монотерапии после комбинированной антрациклиновой терапии.
В настоящее время стандартным лечением после постановки диагноза HER-положительного рака молочной железы является хирургическое вмешательство с последующей адъювантной терапией в течение года. Стандартная адъювантная терапия представляет собой некоторую комбинацию химиотерапии, лучевой терапии, гормональной терапии для лечения ER/PR-положительного заболевания и трастузумаба. Несмотря на проведение адъювантной терапии у пациентов с ранней стадией рака молочной железы сохраняется риск рецидива. В опубликованных сообщениях о лечении трастузумабом продемонстрированы показатели выживаемости без признаков заболевания в диапазоне от 80,6% [Smith I, et al. 2-year follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer: a randomized controlled trial. Lancet. 2007; 369:29-36] за три года до 85,9%-82% за четыре года [Perez EA, et al., Updated results of the combined analysis of NCCTG N9831 and NSABP B-31 adjuvant chemotherapy with/without trastuzumab in patients with HER2-positive breast cancer. Journal of Clinical Oncology. ASCO Annual Meeting Proceedings. 2007; 25(18S): 512 и Slamon D, et al., Phase III trial comparing AC-T with AC-TH and with TCH in the adjuvant treatment of HER2 positive early breast cancer patients: second interim efficacy analysis. Presentation by Slamon D. SABCC 2006].
Было описано применение HKI-272 (нератиниба) для лечения опухолей [патент США № 6288082]. Нератиниб является сильным необратимым ингибитором всех erbB. Нератиниб представляет собой небольшую молекулу, которую можно вводить перорально и которая ингибирует erbB-1, erbB-2 и erbB-4 на уровне внутриклеточных тирозинкиназных доменов, что отличается от механизма действия трастузумаба. Нератиниб уменьшает аутофосфорилирование erbB-1 и erbB-2, последующую передачу сигнала и рост erbB-1- и erbB-2-зависимых клеточных линий. Доклинические данные позволяют предположить, что нератиниб будет иметь противоопухолевую активность у раковых клеточных линий, экспрессирующих erbB-1 и/или erbB 2, с клеточной средней ингибирующей концентрацией (IC50) менее 100 нМ [Rabindran SK, et al. Antitumor activity of HKI-272, an orally active, irreversible inhibitor of the HER-2 tyrosine kinase. Cancer Research. 2004;64(11):3958-65].
Существует потребность в лекарственных средствах и схемах лечения, улучшающих показатели выживаемости пациентов, и/или лекарственных средствах и схемах лечения, уменьшающих рецидивы рака молочной железы после завершения основного лечения и адъювантной терапии.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте согласно изобретению предложена схема лечения опухоли со сверхэкспрессией/амплификацией HER-2/neu, включающая проведение курса лечения нератинибом в качестве продолжения адъювантной терапии трастузумабом у пациентов с раком со сверхэкспрессией/амплификацией HER-2/neu, например нератиниб вводят после завершения хирургического лечения и стандартной адъювантной терапии.
В другом аспекте согласно изобретению предложены способ или схема снижения частоты рецидива рака молочной железы со сверхэкспрессией/амплификацией HER-2/neu у пациентов по сравнению с пациентами, получающими только основное лечение и адъювантную терапию трастузумабом. Способ включает введение нератиниба указанным пациентам после основного лечения и стандартной адъювантной терапии трастузумабом. В одном воплощении способ также используют после завершения одной или более чем одной обычной неоадъювантной терапии или стандартной адъювантной терапии.
В еще одном аспекте согласно изобретению предложена схема увеличения выживаемости без признаков инвазивного заболевания, включающая лечение пациентов с раком нератинибом после завершения основного лечения и стандартной адъювантной терапии трастузумабом. В одном воплощении лечение нератинибом начинают в пределах от двух недель до сорока восьми месяцев после хирургического лечения и стандартной адъювантной терапии трастузумабом.
Другие аспекты и преимущества изобретения будут очевидны на основании следующего подробного описания изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном воплощении согласно изобретению предложена расширенная схема лечения для проведения адъювантной терапии рака со сверхэкспрессией/амплификацией HER-2/neu, включающая проведение курса лечения нератинибом у пациентов с раком со сверхэкспрессией/амплификацией HER-2/neu. Такая расширенная адъювантная терапия включает начало лечения нератинибом после завершения адъювантной терапии трастузумабом. Эту расширенную адъювантную терапию используют для обеспечения увеличенной выживаемости без признаков инвазивного заболевания (IDFS) или выживаемости без признаков заболевания при протоковом раке in situ (DFS-DCIS) и/или увеличения общей выживаемости, времени до системного рецидива и выживаемости без признаков системного рецидива.
При использовании здесь выживаемость без признаков инвазивного заболевания (IDFS) определяют как время от даты рандомизации до даты IDFS-события, включая инвазивный ипсилатеральный рецидив опухоли молочной железы, местный/регионарный инвазивный рецидив, системный рецидив, смерть от любой причины, инвазивный контралатеральный рак молочной железы и другой первичный инвазивный рак (не являющийся раком молочной железы). DFS-DCIS определяют как время от рандомизации до первого появления любого IDFS-события или протокового рака in situ. Выживаемость без признаков системного рецидива (DDFS) представляет собой время от рандомизации до первого системного рецидива или смерти от любой причины. Время до системного рецидива (TTDR) определяют как время от рандомизации до даты первого системного рецидива опухоли, не учитывая местные/регионарные рецидивы и другие виды рака молочной железы или виды рака, не являющиеся раком молочной железы, и рассматривая случаи смерти до системного рецидива рака молочной железы как явления, исключающие возможность определения времени до системного рецидива («censoring events»).
Таким образом, расширенная адъювантная терапия по изобретению с использованием нератиниба увеличивает выживаемость без признаков заболевания путем снижения риска рецидива или смерти. В одном воплощении расширенная адъювантная терапия нератинибом снижает риск, то есть, показатель риска, рецидива рака или смерти на 30% или 20% по сравнению с обычно наблюдаемым после лечения трастузумабом.
В другом воплощении при применении расширенной схемы лечения нератинибом, описанной здесь, менее 15%, менее 10% и/или менее 5% пациентов, получивших основное лечение и адъювантную терапию, имеют рак через три года после начала лечения. В еще одном воплощении при применении расширенной схемы лечения нератинибом, описанной здесь, менее 20%, менее 15% и/или менее 5% пациентов, получивших основное лечение и адъювантную терапию, имеют рак через пять лет после начала лечения.
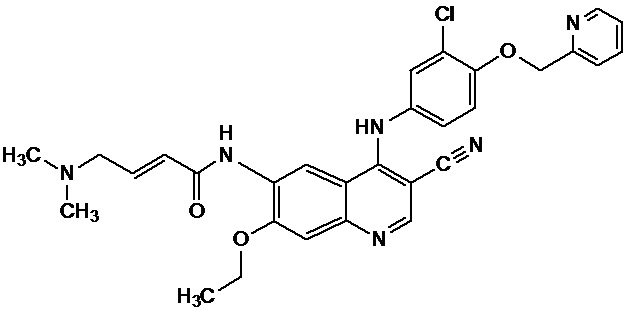
При использовании здесь нератиниб относится к HKI-272-соединению, имеющему следующую основную структуру:
 ,
,
в форме его свободного основания. Возможно, могут быть использованы его фармацевтически приемлемые соль или гидрат. Основная структура, представленная выше, является определенным HKI-272-соединением, называемым HKI-272 или нератинибом, которое имеет химическое название [(2E)-N-[4-[[3-хлор-4-[(пиридин-2-ил)метокси]фенил]амино]-3-циано-7-этоксихинолин-6-ил]-4-(диметиламино)бут-2-енамид].
Вместо нератиниба может быть использовано другое HKI-272-соединение, хотя в настоящее время это менее предпочтительно. В одном воплощении «HKI-272-соединение» относится к соединению, дериватизированному из основной структуры нератиниба, показанной выше. Подходящие производные могут включать, например, сложный эфир, простой эфир или карбамат. Такое HKI-272-соединение может иметь структуру:
 ,
,
где:
R1 представляет собой галоген;
R2 представляет собой пиридинил, тиофенил, пиримидинил, тиазолил или фенил, где R2 возможно замещен заместителями в количестве до трех;
R3 представляет собой O или S;
R4 представляет собой CH3 или CH2CH2OCH3;
R5 представляет собой CH3 или CH2CH3; и
n представляет собой 0 или 1.
При использовании здесь термин «галоген» относится к Cl, Br, I и F.
Также включены фармацевтически приемлемые соли, гидраты и пролекарства нератиниба и/или других HKI-соединений, описанных здесь. «Фармацевтически приемлемые соли и эфиры» относятся к солям и эфирам, являющимся фармацевтически приемлемыми и имеющим желаемые фармакологические свойства. Такие соли включают, например, соли, которые могут быть образованы там, где кислотные протоны, присутствующие в соединениях, способны взаимодействовать с неорганическими или органическими основаниями. Подходящие неорганические соли включают, например, соли, образованные щелочными металлами или щелочно-земельными металлами, например, натрием, калием, магнием, кальцием, алюминием. Подходящие органические соли также включают, например, соли, образованные органическими основаниями, такими как аминные основания, например, этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и тому подобное, и основания, которые могут образовывать N-тетраалкиламмониевые соли, такие как N-тетрабутиламмониевые соли. Фармацевтически приемлемые соли могут также включать соли присоединения кислот, образованные путем взаимодействия основных группировок, таких как амины, в исходном соединении с неорганическими кислотами (например, соляной и бромоводородной кислотами) и органическими кислотами (например, уксусной кислотой, лимонной кислотой, малеиновой кислотой, пропионовой, молочной, винной, янтарной, фумаровой, малеиновой, малоновой, миндальной, яблочной, фталевой, соляной, бромоводородной, фосфорной, азотной, серной кислотами и алкан- и аренсульфокислотами, такими как метансульфокислота и бензолсульфокислота, нафталинсульфокислота, толуолсульфокислота, камфорсульфокислота). Другие подходящие примеры фармацевтически приемлемых солей включают, без ограничения, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, гидрофосфат, изоникотинат, лактат, салицилат, гидроцитрат, тартрат, олеат, таннат, пантотенат, гидротартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат (glucaronate), сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, памоат (то есть, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)), и соли жирных кислот, такие как капроат, лаурат, миристат, пальмитат, стеарат, олеат, линолеат и линоленат.
Фармацевтически приемлемый эфиры включают эфиры, образованные карбоксигруппами, сульфонилоксигруппами и фосфоноксигруппами, присутствующими в соединениях по изобретению, например, эфиры с алкилами с неразветвленной цепью, имеющими 1-6 атомов углерода, или алкильными группами с разветвленной цепью, содержащими 1-6 атомов углерода, включая метиловые, этиловые, пропиловые, бутиловые, 2-метилпропиловые и 1,1-диметилэтиловые эфиры, циклоалкиловые эфиры, алкилариловые эфиры, бензиловые эфиры и тому подобное. В случае присутствия двух кислотных групп фармацевтически приемлемые соль или эфир могут представлять собой кислые соль или эфир или некислые соль или эфир; и, сходным образом, в случае присутствия более чем двух кислотных групп в образовании соли или эфира могут быть задействованы некоторые или все такие группы. Соединения, использованные здесь, могут присутствовать в форме свободного основания или в форме соли и/или эфира, и подразумевают, что указание таких соединений включает как исходное соединение (в форме свободного основания), так и его фармацевтически приемлемые соли или эфиры. Также, одно или более чем одно соединение, использованное здесь, может присутствовать в более чем одной стереоизомерной форме, и подразумевают, что указание таких соединений включает все индивидуальные стереоизомеры и все смеси (рацемические или нерацемические) таких стереоизомеров.
Получение HKI-272-соединений, разновидностью которых является нератиниб, подробно описано в публикации заявки на патент США № 2005/0059678, включенной сюда посредством ссылки. См. также патент США № 6288082, патент США № 6002008, патент США № 6297258 и публикацию заявки на патент США № 2007/0104721, включенные сюда посредством ссылки. Способы, описанные в этих документах, могут также быть использованы для получения нератиниба и/или других HKI-272 и замещенных 3-хинолиновых соединений, используемых здесь, и включены сюда посредством ссылки. В дополнение к способам, описанным в этих документах, в публикациях международных заявок на патенты № WO-96/33978 и WO-96/33980, включенных сюда посредством ссылки, описаны способы, применимые для получения этих HKI-272-соединений. Хотя в этих способах описано получение определенных хиназолинов, они также применимы для получения соответствующих замещенных 3-цианохинолинов и включены сюда посредством ссылки.
Термин «лечение» или «лечить» относится к введению нератиниба субъекту для предотвращения, или задержки, облегчения, или остановки, или подавления развития симптомов или состояний, связанных с опухолями.
Трастузумаб и способы его получения и изготовления из него композиций были описаны. См., например, патент США № 6821515, патент США № 6399063 и патент США № 6387371. Трастузумаб имеется в продаже от Genentech под названием «Герцептин» («Herceptin»). При использовании здесь термин «трастузумаб» включает трастузумаб и измененные формы и производные трастузумаба. Термин «трастузумаб» включает агенты, направленные на тот же эпитоп рецептора Her-2, на который направлен трастузумаб. Этот эпитоп известен из H.S. Cho et al., Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab, Nature 421 (2003), pp. 756–760.
При использовании здесь опухоли с амплификацией/сверхэкспрессией erB-2 (используемого взаимозаменяемо с Her-2 и neu) включают определенные виды рака молочной железы и другие опухоли, которые могут включать рак яичника, мочевого пузыря, желудка, поджелудочной железы, колоректальный рак, рак предстательной железы и легкого, включая немелкоклеточный рак легкого. Другие опухоли с экспрессией или сверхэкспрессией ErbB1 включают множество солидных опухолей человека, включая немелкоклеточный рак легкого (NSCL), рак предстательной железы, молочной железы, колоректальный рак и рак яичника. Способы исследования образцов для определения наличия в опухоли сверхэкспрессии erb-1 и/или erB-2/Her-2 известны специалистам в данной области техники.
Основное лечение и адъювантная противоопухолевая терапия
Как определено здесь, основное лечение представляет собой начальное лечение, проводимое у пациента после постановки диагноза опухоли, такой как опухоль со сверхэкспрессией/амплификацией HER-2/neu. Основное лечение также называют радикальным местным лечением. Основное лечение опухоли со сверхэкспрессией/амплификацией HER-2/neu включает хирургическое вмешательство (в случае рака молочной железы оно может включать лампэктомию, модифицированную радикальную мастэктомию, мастэктомию) и/или лучевую терапию, по отдельности или в комбинации. Адъювантная терапия относится к лечению, обычно проводимому после начального или основного лечения для увеличения вероятности выздоровления. В настоящее время стандартная адъювантная терапия опухоли со сверхэкспрессией/амплификацией HER-2/neu включает, например, химиотерапию и/или терапию антителами. Обычно, если одну или более чем одну из этих адъювантных терапий проводят до основного лечения (например, хирургического вмешательства), ее называют неоадъювантной терапией. В следующих частях описания термин «неоадъювантный/адъювантный» использован в качестве условного обозначения для обозначения как неоадъювантной, так и стандартной адъювантной терапии. Возможно одновременное проведение адъювантной терапии одного или более чем одного типа.
В одном воплощении у пациента уже может быть проведена химиотерапия, включающая применение схемы лечения с использованием антрациклина или таксана или любой схемы лечения с использованием циклофосфамида, метотрексата и 5-фторурацила. Такая химиотерапия может включать одно или более чем одно из антрациклина, такого как доксорубицин, циклофосфамида, паклитаксела, доцетаксела и карбоплатина. Другая подходящая неоадъювантная/адъювантная терапия представляет собой комбинированную антрациклиновую терапию. Другие неоадъювантные/адъювантные терапии включают, среди прочего, лапатиниб [дитозилат лапатиниба, тайкерб, TYKERB®], пертузумаб [Roche, Genentech], бевацизумаб [авастин, Avastin®, Genentech], трастузумаб-DM-1 [Genentech]. Выбор неоадъювантной или адъювантной терапии не является ограничением настоящего изобретения. Расширенную адъювантную терапию по изобретению начинают после завершения лечения трастузумабом. Трастузумаб обычно вводят после завершения химиотерапии или одновременно с химиотерапией в качестве поддерживающей терапии. Для трастузумаба предполагают однократные дозы и многократные дозы. В одном воплощении однократную дозу насыщения трастузумаба в диапазоне приблизительно 4-5 мг/кг вводят внутривенной инфузией продолжительностью 90 минут в 1 сутки с последующим введением приблизительно 2 мг/кг в неделю, начиная с 8 суток. Обычно 1 цикл составляет 3 недели. Перерывы между циклами могут составлять от 1 до 2-3 недель. В другом воплощении трастузумаб вводят по схеме применения «каждые 3 недели» с использованием 8 мг/кг в качестве дозы насыщения и 6 мг/кг в качестве поддерживающей дозы. Трастузумаб можно также вводить в дозе 6 мг/кг один раз каждые 3-4 недели. Могут быть разработаны и использованы другие схемы применения трастузумаба.
В одном воплощении пациент мог уже получить основное лечение, а также, в дополнение к неоадъювантной/адъювантной терапии трастузумабом, другую неоадъювантную/адъювантную терапию. В одном воплощении одну или более чем одну адъювантную терапию можно продолжать после завершения лечения трастузумабом в процессе расширенной адъювантной терапии. Соответствующим образом, ни основное лечение, ни неоадъювантная/адъювантная терапия не включают лечение нератинибом до начала расширенной схемы лечения нератинибом по изобретению.
Расширенная схема лечения нератинибом по изобретению
В одном воплощении расширенную схему лечения нератинибом, описанную здесь, начинают через приблизительно один год, приблизительно два года или приблизительно три года после начала основного лечения. Расширенную схему адъювантной терапии нератинибом начинают после завершения неоадъювантной/адъювантной терапии трастузумабом.
Расширенную схему лечения, описанную здесь, можно начинать после завершения по меньшей мере одного введения трастузумаба, цикла неоадъювантной/адъювантной терапии трастузумабом продолжительностью по меньшей мере 3 недели, по меньшей мере трех циклов неоадъювантной/адъювантной терапии трастузумабом продолжительностью по меньшей мере 3 недели, по меньшей мере четырех месяцев, по меньшей мере шести месяцев, по меньшей мере восьми месяцев или по меньшей мере одного года неоадъювантной/адъювантной терапии трастузумабом. В одном воплощении расширенную схему лечения нератинибом начинают через по меньшей мере приблизительно две недели, по меньшей мере приблизительно один месяц, по меньшей мере приблизительно шесть месяцев, по меньшей мере приблизительно девять месяцев или через приблизительно от одного года до четырех лет после завершения лечения трастузумабом.
Как описано здесь, расширенную схему лечения нератинибом используют для снижения частоты рецидива рака молочной железы со сверхэкспрессией/амплификацией HER-2/neu у пациентов. Эта частота может быть измерена во временной точке шесть месяцев, один год, три года или пять лет после начала лечения. Схема лечения включает введение нератиниба этим пациентам после основного лечения и неоадъювантной/адъювантной терапии. В другом воплощении расширенную схему лечения нератинибом используют для увеличения выживаемости без признаков инвазивного заболевания, DFS-DCIS, выживаемости без признаков системного рецидива и/или времени до системного рецидива у пациентов с раком.
Эта расширенная адъювантная терапия по изобретению может включать только однократную дозу нератиниба после завершения лечения трастузумабом. Тем не менее, в другом воплощении расширенную схему лечения нератинибом проводят на протяжении периода продолжительностью один месяц, два месяца, по меньшей мере шесть месяцев, по меньшей мере один год, по меньшей мере 18 месяцев или в течение более длительных периодов, по необходимости или желанию. В другом воплощении пациенты получают лечение нератинибом в течение периода продолжительностью от приблизительно 8 месяцев до приблизительно 5 лет, от приблизительно 12 месяцев (одного года) до приблизительно трех лет или в течение более длительных или коротких периодов по определению профессионального врача.
При использовании здесь термин «введение» относительно введения нератиниба означает либо непосредственное введение соединения или композиции, либо введение пролекарства, производного или аналога, из которого в организме образуется эффективное количество соединения-нератиниба.
При использовании здесь и за исключением мест, где это отмечено особо, термины «индивид», «субъект» и «пациент» использованы взаимозаменяемо и относятся к любому животному, включая млекопитающих, предпочтительно мышам, крысам, другим грызунам, кроликам, собакам, кошкам, свиньям, крупному рогатому скоту, овцам, лошадям, приматам, не являющимся людьми, и людям. Желательно, термин «индивид», «субъект» или «пациент» относится к человеку. В большинстве воплощений субъекты или пациенты нуждаются в терапевтическом лечении. Соответственно, термин «субъект» или «пациент» при использовании здесь обозначает любого пациента-млекопитающего или субъекта-млекопитающего, у которого может быть применена заявленная схема лечения.
При использовании здесь термин «эффективное количество» или «фармацевтически эффективное количество» при введении субъекту для лечения опухоли означает количество, достаточное для ингибирования, замедления, уменьшения или устранения поражений или опухолевого роста у субъекта, или для ингибирования, замедления или уменьшения прогрессирования заболевания и/или повышения показателя выживаемости без признаков прогрессирования у субъекта.
Нератиниб (или выбранное HKI-272-соединение) может быть введено, например, перорально, в диапазоне доз приблизительно от 0,01 до 100 мг/кг. В одном воплощении нератиниб вводят в диапазоне доз от приблизительно 0,1 до приблизительно 90 мг/кг. В другом воплощении нератиниб вводят в диапазоне доз от приблизительно 1 до приблизительно 80 мг/кг. В другом воплощении нератиниб вводят в диапазоне доз от приблизительно 10 до приблизительно 70 мг/кг. В еще одном воплощении нератиниб вводят в диапазоне доз от приблизительно 15 до приблизительно 60 мг/кг. В еще одном воплощении нератиниб вводят в диапазоне доз от приблизительно 20 до приблизительно 240 мг в сутки, по меньшей мере приблизительно 40 мг, по меньшей мере приблизительно 120 мг или по меньшей мере приблизительно 160 мг в дни цикла, в которые его вводят. Специалист в данной области техники может легко провести эмпирические исследования активности для определения биологической активности соединения в биологических анализах и, таким образом, определить, какую дозу вводить при введении соединения другим способом введения.
В одном воплощении доза нератиниба для перорального введения составляет по меньшей мере приблизительно 700 мг в неделю. В другом воплощении доза нератиниба для перорального введения составляет от приблизительно 800 мг в неделю до по меньшей мере приблизительно 1700 мг в неделю. В другом воплощении доза нератиниба для перорального введения составляет от приблизительно 840 мг в неделю до приблизительно 1680 мг в неделю. В другом воплощении доза нератиниба для перорального введения составляет от приблизительно 900 мг в неделю до приблизительно 1600 мг в неделю. В другом воплощении доза нератиниба для перорального введения составляет от приблизительно 1000 мг в неделю до приблизительно 1500 мг в неделю. В еще одном воплощении доза нератиниба для перорального введения составляет от приблизительно 1100 мг в неделю до приблизительно 1400 мг в неделю. В еще одном воплощении доза нератиниба для перорального введения составляет от приблизительно 1200 мг в неделю до приблизительно 1300 мг в неделю. Точные дозы определяет лечащий врач на основании опыта с отдельным субъектом, подлежащим лечению. Другие схемы и варианты лечения предсказуемы, и их определяют под руководством врача.
Для нератиниба желательно, чтобы это соединение было представлено в форме стандартной дозы. Нератиниб может быть введен в диапазоне доз приблизительно от 0,01 до 100 мг/кг или в диапазоне доз от 0,1 до 10 мг/кг. В одном воплощении нератиниб вводят перорально 1-6 раз в сутки, чаще 1-4 раза в сутки. Подходящие стандартные лекарственные формы включают таблетки, капсулы и порошки в саше или флаконах. Такие стандартные лекарственные формы могут содержать от 0,1 до 300 мг нератиниба, от 2 до 100 мг, в дозе от 120 мг до 300 мг в сутки или 240 мг в сутки. Альтернативно, нератиниб может быть введен другим подходящим способом введения, например внутривенным. В еще одном воплощении нератиниб вводят один раз в неделю. В определенных ситуациях введение нератиниба может быть задержано или прекращено на непродолжительный период (например, 1, 2 или три недели) на протяжении курса лечения. Такие задержка или прекращение могут происходить один раз или несколько раз на протяжении курса лечения. Эффективное количество будет известно специалисту в данной области техники; оно также будет зависеть от формы соединения. Специалист в данной области техники может легко провести эмпирические исследования активности для определения биологической активности соединения в биологических анализах и, таким образом, определить дозу для введения.
В одном воплощении подходящие примеры фармацевтических носителей, используемых здесь, включают, без ограничения, эксципиенты, разбавители, наполнители, разрыхлители, смазывающие вещества и другие агенты, которые могут выполнять функцию носителя. Термин «фармацевтически приемлемый эксципиент» означает эксципиент, применимый в изготовлении фармацевтической композиции, являющийся, в целом, безопасным, нетоксичным и желательным, и включает эксципиенты, приемлемые для использования в ветеринарии, а также для фармацевтического применения у человека. Такие эксципиенты могут быть твердыми, жидкими, полутвердыми или, в случае аэрозольной композиции, газообразными. Фармацевтические композиции изготавливают согласно приемлемым фармацевтическим способам, таким как способы, описанные в Remingtons Pharmaceutical Sciences, 17th edition, ed. Alfonoso R. Gennaro, Mack Publishing Company, Easton, Pa. (1985). Фармацевтически приемлемые носители представляют собой носители, совместимые с другими ингредиентами композиции и являющиеся биологически приемлемыми. Подходящие фармацевтически приемлемые эксципиенты или носители для композиции в форме таблетки или каплеты включают, например, инертные эксципиенты, такие как лактоза, карбонат натрия, фосфат кальция или карбонат кальция; агенты для гранулирования и разрыхлители, такие как кукурузный крахмал или альгиновая кислота; связывающие агенты, такие как желатин или крахмал; смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк; консерванты, такие как этил- или пропил-4-гидроксибензоат; и антиоксиданты, такие как аскорбиновая кислота. Композиции в форме таблетки или каплеты могут не быть покрыты оболочкой или быть покрыты оболочкой, либо для изменения их разрушения и последующего всасывания активного ингредиента в желудочно-кишечном тракте, либо для улучшения их стабильности и/или внешнего вида, с использованием обычных агентов для нанесения оболочек и способов, хорошо известных в данной области техники.
В одном воплощении согласно изобретению предложена расширенная схема лечения рака со сверхэкспрессией/амплификацией HER-2/neu, включающая проведение курса расширенного лечения нератинибом у пациентов с раком со сверхэкспрессией/амплификацией HER-2/neu. Такое расширенное лечение включает начало лечения нератинибом после завершения хирургического лечения и/или адъювантной терапии. Это расширенное лечение используют для обеспечения увеличенной выживаемости без признаков инвазивного заболевания и/или увеличения общей выживаемости, времени до системного рецидива и выживаемости без признаков системного рецидива.
Как описано здесь, расширенную схему лечения нератинибом начинают по меньшей мере через один, по меньшей мере через два или по меньшей мере через три года после начала начального лечения. В одном воплощении лечение нератинибом начинают через от по меньшей мере приблизительно 2 недель до приблизительно четырех лет после завершения основного лечения и стандартной неоадъювантной/адъювантной терапии.
В одном воплощении выбранное сопутствующее лечение может быть использовано в сочетании с расширенной схемой лечения нератинибом. Например, пациенты могут дополнительно получать сопутствующее лечение бисфосфонатами для лечения остеопении или остеопороза. В другом воплощении пациенты могут дополнительно получать сопутствующую эндокринную терапию. Возможно, такое сопутствующее лечение может не являться адъювантной терапией, но представлять собой лечение других состояний или симптомов, которые могут присутствовать у пациента.
Фармацевтические упаковки/наборы
Изобретение включает продукт или фармацевтическую упаковку, включающие курс противоопухолевого лечения для одного млекопитающего-индивида, включающие один или более чем один контейнер, содержащий одну, от одной до четырех или более единиц нератиниба и, возможно, одну, от одной до четырех или более единиц другого активного агента.
В другом воплощении фармацевтические упаковки включают курс противоопухолевого лечения для одного млекопитающего-индивида, включающие контейнер, содержащий единицу рапамицина в стандартной лекарственной форме, контейнер, содержащий единицу нератиниба и, возможно, контейнер с другим активным агентом.
В некоторых воплощениях композиции по изобретению представлены в упаковках в форме, готовой для введения. В других воплощениях композиции по изобретению представлены в концентрированной форме в упаковках, возможно, с разбавителем, необходимым для приготовления конечного раствора для введения. В других воплощениях продукт содержит соединение, применимое в изобретении, в твердой форме и, возможно, отдельный контейнер с подходящим растворителем или носителем для этого соединения, применимого в изобретении.
В других воплощениях указанные выше упаковки/наборы включают другие компоненты, например, инструкции для разведения, смешивания и/или введения продукта, другие контейнеры, шприцы, иглы и так далее. Другие такие компоненты упаковок/наборов будут очевидны для специалиста в данной области техники.
В следующих примерах показано применение комбинаций по изобретению. Следует понимать, что по причинам, известным специалистам в данной области техники, могут быть произведены изменения или модификации, например, в изготовлении компонентов, способах введения и дозах.
ПРИМЕРЫ
Нератиниб в качестве монотерапии был изучен в исследовании 2 фазы у субъектов с метастатическим erbB-2-положительным раком молочной железы. Шестьдесят шесть субъектов с предшествующим лечением трастузумабом были включены в группу А; 70 субъектов без какого-либо предшествующего применения трастузумаба были включены в группу Б. Частоту объективных ответов и среднюю выживаемость без признаков прогрессирования использовали в качестве критериев противоопухолевой активности.
Согласно предварительным данным, основанным на независимой рентгенологической оценке, среди субъектов с предшествующим лечением трастузумабом общая частота ответов (ORR) составила 26% (показатель достоверности (CI) 95%), и средняя выживаемость без признаков прогрессирования (PFS) составила 23 недели (CI 95%). Для пациентов без предшествующего применения трастузумаба ORR составила 57% (CI 95%) и средняя PFS составила 40 недель (95% CI). Противоопухолевая активность в группе А обеспечивает основание для исследования нератиниба в качестве монотерапии у субъектов, не поддающихся лечению трастузумабом.
В группе А средняя продолжительность применения трастузумаба составила 60 недель. Двадцать восемь (28%) субъектов получали трастузумаб в качестве адъювантной или неоадъювантной терапии. У большинства (48%) субъектов проводили один курс лечения трастузумабом при метастазировании, и у приблизительно 43% пациентов проводили второй или третий курс лечения трастузумабом по поводу метастазирующей опухоли. Субъекты из группы А ранее также получали интенсивное лечение цитотоксическими агентами, при этом у 53% субъектов ранее было проведено 2-3 курса лечения, и у других 27% ранее было проведено более 3 курсов лечения цитотоксическими агентами. Вместе взятые, эти данные о предшествующем лечении характеризуют исследованную популяцию группы А как неоднократно получавшую лечение ранее и, вероятно, не поддающуюся лечению. Как таковая, ORR 26% в популяции, не поддающейся лечению, позволяет предположить, что нератиниб, вероятно, является высокоактивным агентом в отношении erbB-2-положительного рака молочной железы.
Основным неблагоприятным явлением, связанным с нератинибом, является диарея, которая, в целом, хорошо поддавалась коррекции лекарственными средствами, прекращением лечения или изменением дозы. Другие частые неблагоприятные явления представляют собой тошноту, рвоту, утомление и анорексию.
Пример 1
В рандомизированном двойном слепом плацебо-контролируемом исследовании 3 фазы нератиниб сравнивают с плацебо после лечения трастузумабом у женщин с ранней стадией рака молочной железы со сверхэкспрессией/амплификацией HER-2/neu. Субъекты должны завершить курс предшествующей адъювантной терапии трастузумабом. Если субъект получал трастузумаб менее 12 месяцев, он должен получить по меньшей мере 8 предшествующих доз, и должно быть отмечено, что субъект либо является неподходящим для получения дальнейшей адъювантной терапии трастузумабом, либо не может получать дальнейшую адъювантную терапию трастузумабом. После завершения курса предшествующей адъювантной терапии, включающей лечение трастузумабом в течение по меньшей мере 8 и предпочтительно 12 месяцев, субъекты являются подходящими для лечения с применением схемы лечения, описанной здесь. Последняя доза трастузумаба должна быть введена не менее чем за 2 недели и не более чем за 4 года до начала рандомизации. Рандомизацию проводили по следующим стратификационным факторам: ER- и/или PgR-положительный или ER- и PgR-отрицательный; поражение лимфатических узлов (0, 1-3, 4 или более); давность диагноза менее или более 3 лет; введение трастузумаба последовательно или одновременно с химиотерапией.
Подходящих пациентов случайным образом распределяют в соотношении 1:1 в одну из двух следующих групп: нератиниб, 240 мг в сутки в течение 1 года; или плацебо, ежедневно в течение 1 года. После прекращения исследуемого лечения наблюдение субъектов будут продолжать на предмет рецидивов заболевания и выживаемости до достижения заданного числа событий, определяющих выживаемость без признаков инвазивного заболевания (IDFS-событий), и на предмет общей выживаемости до окончания исследования. Первичная конечная точка оценки эффективности IDFS и вторичные конечные точки времени до события будут анализировать с использованием стратифицированного логарифмического рангового критерия. Отношение рисков и соответствующий 95% доверительный интервал будут получать из стратифицированной регрессионной модели пропорциональных рисков Кокса [DR Cox, 1972, “Regression Models and Life Tables (with Discussion)”, Journal of the Royal Statistical Society, Series B 34:187-220]. Средние значения времени до события и связанные с ними 95% доверительные интервалы будут оценивать с применением способа Каплана-Мейера [Kaplan, E.L. and Meier, Paul. "Nonparametric estimation from incomplete observations." J. Am. Stat. Assoc. 53, 457-481 (1958)]. Первичный анализ эффективности будут проводить в популяции, начавшей получать лечение, которую определяют как всех субъектов, прошедших рандомизацию. Неблагоприятные явления и серьезные неблагоприятные явления будут суммировать по группе лечения для популяции для оценки безопасности, которую определяют как всех субъектов, которым были введены нератиниб или плацебо. Частоту диареи 3 или более высокой степени также будут суммировать и различия между группами лечения будут анализировать с использованием критерия Мантеля-Гензеля [Mantel N & Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J. Nat. Cancer Inst. 22:719-48, 1959].
Все публикации, процитированные в данном описании, включены сюда посредством ссылки. В то время как изобретение было описано со ссылкой на конкретные воплощения, следует понимать, что могут быть осуществлены модификации без выхода за рамки сущности изобретения. Подразумевают, что такие модификации входят в объем приложенной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Схема лечения рака молочной железы с использованием нератиниба | 2014 |
|
RU2685715C2 |
| ПРОТИВООПУХОЛЕВЫЕ КОМБИНАЦИИ ИЗ 4-АНИЛИНО-3-ЦИАНОХИНОЛИНОВ И КАПЕЦИТАБИНА | 2009 |
|
RU2498804C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ТРАСТУЗУМАБОМ-MCC-DM1 И ПЕРТУЗУМАБОМ | 2015 |
|
RU2725093C2 |
| АНТИОПЛАСТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ НКI-272 И ВИНОРЕЛБИН | 2009 |
|
RU2492860C2 |
| АНТИНЕОПЛАСТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ HKI-272 И ВИНОРЕЛБИН | 2013 |
|
RU2670974C2 |
| ИДЕНТИФИКАЦИЯ ПАЦИЕНТОВ, НУЖДАЮЩИХСЯ В СОВМЕСТНОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРА PD-L1 | 2013 |
|
RU2692773C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ БЛОКИРОВАНИЕМ СЕМАФОРИНА 4D (SEMA4D) И ТЕРАПИЕЙ ДК1 | 2020 |
|
RU2801828C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА, УСТОЙЧИВОГО К ГЕФИТИНИБУ | 2006 |
|
RU2405566C9 |
| ДУОКАРМИЦИНОВЫЕ ADC, ДЕМОНСТРИРУЮЩИЕ УЛУЧШЕННУЮ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ IN VIVO | 2015 |
|
RU2689779C2 |
| ДУОКАРМИЦИНОВЫЕ ADC, ДЕМОНСТРИРУЮЩИЕ УЛУЧШЕННУЮ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ IN VIVO | 2015 |
|
RU2769700C2 |
Изобретение относится к области онкологии. Описана расширенная схема лечения рака со сверхэкспрессией/амплификацией HER-2/neu, включающая проведение курса лечения нератинибом у пациентов с раком со сверхэкспрессией/амплификацией HER-2/neu после завершения хирургического лечения и адъювантной терапии. Схема лечения нератинибом может быть продлена на период продолжительностью от двенадцати месяцев до пяти лет. Предложенная схема обеспечивает снижение риска рецидива заболевания. 9 з.п. ф-лы.
1. Применение нератиниба или его фармацевтически приемлемой соли в способе лечения рака молочной железы со сверхэкспрессией/амплификацией HER-2/neu в расширенной схеме адъювантной терапии нератинибом, где способ включает использование расширенной схемы адъювантной терапии нератинибом у пациента, имеющего рак молочной железы со сверхэкспрессией/амплификацией HER-2/neu,
где расширенную схему адъювантной терапии нератинибом начинают через по меньшей мере 2 недели, по меньшей мере один месяц, по меньшей мере шесть месяцев или по меньшей мере девять месяцев после завершения адъювантной терапии трастузумабом, и
где расширенную схему адъювантной терапии нератинибом проводят в течение периода по меньшей мере шесть месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, от 8 месяцев до 5 лет, или от 12 месяцев до приблизительно трех лет.
2. Применение по п. 1, где расширенная схема адъювантной терапии нератинибом снижает частоту рецидива рака молочной железы со сверхэкспрессией/амплификацией HER-2/neu у пациента.
3. Применение по п. 1 или 2, где расширенная схема адъювантной терапии нератинибом увеличивает выживаемость без признаков инвазивного заболевания (IDFS), выживаемость без признаков заболевания при протоковом раке in situ (DFS-DCIS), выживаемость без признаков системного рецидива (DDFS) и/или время до системного рецидива (TTDR) у пациента.
4. Применение по любому из пп. 1-3, где нератиниб или его фармацевтически приемлемая соль представлены в стандартной лекарственной форме.
5. Применение по п. 4, где стандартная лекарственная форма содержит от 0,1 до 300 мг или от 2 до 100 мг нератиниба или его фармацевтически приемлемой соли.
6. Применение по п. 4 или 5, где стандартная лекарственная форма представляет собой таблетку, капсулу и порошок в саше или флаконах.
7. Применение по любому из пп. 4-6, где нератиниб или его фармацевтически приемлемую соль вводят перорально 1-6 раз в сутки.
8. Применение по п. 7, где нератиниб или его фармацевтически приемлемую соль вводят перорально 1-4 раза в сутки.
9. Применение по любому из пп. 4-8, где нератиниб или его фармацевтически приемлемую соль вводят в дозе от 120 до 300 мг в сутки или 240 мг в сутки.
10. Применение по любому из пп. 1-9, где фармацевтически приемлемая соль представляет собой соль сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, гидрофосфат, изоникотинат, лактат, салицилат, гидроцитрат, тартрат, олеат, таннат, пантотенат, гидротартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, n-толуолсульфонат, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат), капроат, лаурат, миристат, пальмитат, стеарат, олеат, линолеат и линоленат.
| WO 2007056118 A1, 18.05.2007 | |||
| US 6403630 B1, 2002.06.11 | |||
| WONG KK, A phase I study with neratinib (HKI-272), an irreversible pan ErbB receptor tyrosine kinase inhibitor, in patients with solid tumors | |||
| Clin Cancer Res | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| VIANI G.A | |||
| et al., | |||
Авторы
Даты
2023-10-04—Публикация
2019-04-02—Подача