[0001] Агрессивные свойства различных типов рака преимущественно запускаются онкодрайверами, такими как HER2, HER3, EGFR, с-МЕТ, которые в высокой степени вовлечены в рост, пролиферацию, выживаемость и дифференцировку клеток. Сверхэкспрессия данных онкодрайверов связана с неблагоприятным прогнозом и играет ключевую роль в устойчивости опухолевых клеток к таргетной (направленной) терапии. Протоковая карцинома in situ (ПКИС, DCIS) является ранней формой РМЖ стадии 0, с которой сталкиваются приблизительно 60000 женщин в США каждый год. У таких женщин повышен риск (25%) возникновения другого случая РМЖ. Несмотря на очень хороший прогноз и выживаемость 98%, есть некоторые предположения, что у женщин, включая женщин в возрасте ниже 40 лет, женщин афроамериканского происхождения и женщин с негативной по рецептору эстрогенов (ERneg) ПКИС выявляют 7 - 15%-ный риск умереть от последующего РМЖ, вероятно из-за диссеминированных раковых клеток (ДРК), которые ускользают до клинического детектирования инвазивного рака молочной железы (иРМЖ). Приблизительно 33-50% очагов ПКИС высокой степени злокачественности экспрессируют белок HER2, и у еще одной трети наблюдают умеренную экспрессию HER2. Авторы настоящего изобретения показали, что у этих женщин с HER2 ПКИС значительно большая вероятность наличия компонента иРМЖ, обнаруживаемого в их ПКИС, обычно Т1а/b (Т1а - опухоли менее 5 мм, T1b - опухоли размером 5 мм - 1 см (см., например, American Joint Committee on Cancer (AJCC) Staging Manual-8th Edition, Amin, M.B., et al. Eds., Springer Nature (2017)), и повышенный риск рецидива опухоли в ипсилатеральной молочной железе. У пациентов с T1b иРМЖ риск последующей смертности повышается до 20-30%, следовательно, большинству из данных женщин предлагают адъювантную химиотерапию трастузумабом для снижения риска. Несмотря на эффективность, даже введение раз в неделю паклитаксела и трастузумаба может привести к неврологическим, сердечным, когнитивным, а также другим осложнениям. У множества таких пациентов выявляют большие области ПКИС, смешанного с Т1а/b иРМЖ, и они получают еще более интенсивный курс химиотерапии, такой как РТСН, так как стадию Т иРМЖ может быть трудно различить. Множеству также требуется мастэктомия вследствие больших областей ПКИС, которые не всегда отвечают на неоадъювантную терапию. Если эти опухоли также положительны по рецептору эстрогенов, пациентов также лечат еще 5 лет антиэстрогенами, дополнительно усугубляя осложнения. Подводя итог, некоторые пациенты с HER2 ПКИС потенциально недополучают лечение, и у них остается повышенный риск последующих явлений со стороны молочной железы, даже несколько повышенной смертности, и пациенты с Т1а/Ь не могут нечасто быть перелеченными. Поскольку существующие направленные стратегии менее эффективны, существует потребность в эффективных иммунотерапевтических стратегиях.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0002] Предложены способы и композиции, относящиеся к новой комбинированной терапии, включающей нагруженные онкодрайвером дендритные клетки и ингибиторы иммунорегуляторных молекул.
[0003] В одном аспекте настоящего изобретения предложена противораковая комбинированная терапия, включающая по меньшей мере одну дендритную клетку, нагруженную онкодрайвером (таким как, например, рецептор эпидермального фактора роста человека (HER) 2 (HER2)), и по меньшей мере один ингибитор иммунорегуляторной молекулы (такой как, например, семафорин (SEMA) 4D (SEMA4D) или VEGF); причем ингибируемая иммунорегуляторная молекула влияет на сосудистую сеть опухоли.
[0004] В одном аспекте настоящего изобретения предложены способы лечения, предотвращения, уменьшения и/или ингибирования рака (такого как, например, рак молочной железы (включая трижды негативный рак молочной железы, метастатический рак молочной железы (мРМЖ), протоковую карциному in situ (ПКИС) и инвазивный рак молочной железы (иРМЖ)), меланома, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак мочевого пузыря, рак яичника и рак желудка, и включая первичные опухоли и опухоли с отдаленными метастазами) у субъекта, включающие введение противораковой комбинированной терапии в соответствии с любым предшествующим аспектом. Таким образом, в одном аспекте настоящего изобретения предложены способы лечения рака у субъекта, включающие введение указанному субъекту по меньшей мере одной дендритной клетки, нагруженной онкодрайвером (таким как, например, рецептор эпидермального фактора роста человека (HER) 2 (HER2)), и по меньшей мере одного ингибитора иммунорегуляторной молекулы (такой как, например, семафорин (SEMA) 4D (SEMA4D) или VEGF); причем ингибируемая иммунорегуляторная молекула влияет на сосудистую сеть опухоли.
[0005] Также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых по меньшей мере один ингибитор иммунорегуляторной молекулы вводят системно и/или нагруженную онкодрайвером дендритную клетку вводят внутрь опухоли.
[0006] В одном аспекте настоящего изобретения также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых нагруженную онкодрайвером дендритную клетку активируют IL-12 перед введением.
[0007] В соответствии с настоящим изобретением также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых по меньшей мере один ингибитор иммунорегуляторной молекулы включает антитело или функциональный фрагмент антитела, которые связываются с SEMA4D (в данной заявке также называют CD100), такие как, например, антитела против SEMA4D Mab 67 или VX15/2503 (Пепинемаб). См., например, патент США №8,496,938, включенный в данную заявку посредством ссылки.
[0008] В одном аспекте настоящего изобретения также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых дендритные клетки удаляют из субъекта и нагружают онкодрайвером ex vivo.
[0009] В соответствии с настоящим изобретением также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых нагруженные дендритные клетки вводят по меньшей мере за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36 часов, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21, 28, 30, 31, 45 дней, 2, 3, 4, 5 или 6 месяцев до введения по меньшей мере одного ингибитора иммунорегуляторной молекулы; вводят одновременно с по меньшей мере одним ингибитором иммунорегуляторной молекулы; или в которых по меньшей мере один ингибитор иммунорегуляторной молекулы вводят по меньшей мере за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36 часов, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21, 28, 30, 31, 45 дней, 2, 3, 4, 5 или 6 месяцев до введения нагруженных дендритных клеток.
[0010] В одном аспекте настоящего изобретения предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых по меньшей мере одну нагруженную дендритную клетку вводят по меньшей мере 1, 2, 3, 4, 5, 6,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 раза в день или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 раз в неделю в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 дней, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 недель.
[0011] В соответствии с настоящим изобретением также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых по меньшей мере один ингибитор иммунорегуляторной молекулы вводят по меньшей мере 1,2, 3,4, 5,6,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21, 22, 23 или 24 раза в день или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 раз в неделю в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 дней, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 недель.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0012] На сопроводительных фигурах, которые входят в объем и являются частью настоящего описания, проиллюстрировано несколько вариантов реализации, и они вместе с описанием иллюстрируют предложенные композиции и способы.
[0013] На Фигурах 1А, 1В, 1С и 1D показана прогрессирующая утрата ответов Th1 против онкодрайвера по мере прогрессирования экспрессирующего онкодрайвер заболевания молочной железы, и ассоциация иммунитета против онкодрайвера с улучшенными клиническими исходами. На ФИГ. 1А показана утрата ответа Th1 на HER-2 по мере прогрессирования положительного по HER-2 заболевания; на ФИГ. 1В показано, что вакцина, но не стандартная терапия, помогает восстановить направленный против HER-2 иммунитет Th1; на ФИГ. 1С показано, что иммунитет Th1 против HER-2 позволяет спрогнозировать клинический ответ на стандартную терапию; и на ФИГ. 1D показано, что способность Th1 отвечать на HER-2 позволяет спрогнозировать выживаемость без признаков заболевания после стандартной терапии. Сокращения: ПКИС: протоковая карцинома in situ; иРМЖ: инвазивный рак молочной железы; Тх: терапия; ППО: полный патоморфологический ответ; ER: рецептор эстрогенов; ТНРМЖ: трижды негативный рак молочной железы.
[0014] На Фигурах 2А, 2В и 2С показано, что краткосрочный курс терапии антиэстрогенами с сопутствующей вакцинацией вакциной на основе дендритных клеток 1 типа (ДК1) улучшает уровень ППО (ФИГ. 2А) и иммунитет Th1 против HER2 (ФИГ. 2 В) у субъектов с гормонозависимым (ER-положительным) заболеванием, и что полный патоморфологический ответ (ППО) позволяет спрогнозировать длительное отсутствие последующих явлений в молочной железе (ПЯМЖ) у всех вакцинированных субъектов (ФИГ. 2С).
[0015] На Фигурах 3А - 3G показано, что внутриопухолевые ДК1 в комбинации с антителом против SEMA4D вызывают регресс опухоли в положительной по HER2 модели TUBO. ФИГ. 3А: экспрессия SEMA4D в клетках TUBO, измеренная с помощью иммуногистохимии, по сравнению с антителом IgG изотопического контроля. ФИГ. 3В: Внутриопухолевая инъекция внутриопухолевых нагруженных пептидом HER2 II класса ДК1 в комбинации с антителом против SEMA4D, которое вводили интраперитонеально, в модели одной опухоли (ФИГ. 3В1), и кривая выживаемости (ФИГ. 3В2). ФИГ. 3С: Эффективность внутриопухолевых ДК1 в комбинации с антителом против SEMA4D в билатеральной модели (ФИГ. 3С1 и ФИГ. 3С2); несущих TUBO мышей лечили либо не нагруженными, либо нагруженными пептидом HER2 II класса активированными ДК1 отдельно или в комбинации с антителом против SEMA4D. ФИГ. 3D: ИГХ окрашивание SEMA4D у пациентов ПКИС и иРМЖ, числа указывают на количество пациентов с положительным окрашиванием SEMA4D. ФИГ. ЗЕ: Инфильтрация миелоидных супрессорных клеток (МСК) на мг опухоли от лечения ДК1 отдельно, антителом против SEMA4D отдельно или в комбинации. ФИГ. 3F: Инфильтрация CD4 Т-клеток на мг опухоли. ФИГ. 3G: Инфильтрация CD4 Т-клеток (абсолютное количество) в лимфатический узел.
[0016] На Фигурах 4А, 4В и 4С показано, что Т-клетки из мышей, которых лечили HER2-ДК1+aSema4D, по пролиферации, функции и специфичности превосходили Т-клетки из мышей, только вакцинированных HER2^K1. ФИГ. 4А: Кратность размножения после трех недель размножения CD4 Т-клеток in vitro. CD4+ Т-клетки выделяли из выделенных спленоцитов из вакцинированных мышей, применяя EASYSEP™ (Stemcell Technologies), и совместно культивировали с нагруженными пептидом HER2 ДК1 с последующим размножением в присутствии IL-2 и IL-7 в течение трех недель. ФИГ. 4В: Размноженные Т-клетки из ДК1+ мышей, которых лечили антителом против SEMA4D, были более антигенспецифичными по отношению к пептидным антигенам HER2/neu р5, р435 и р1209 по сравнению с Т-клетками из вакцинированных ДК1 мышей. ФИГ. 4С: Совокупный ответ IFN-γ размноженных Т-клеток.
[0017] На Фигурах 5А, 5В и 5С показано детектирование ДРК у трансгенных по neu мышей. ФИГ. 5А: Проточная цитометрия ДРК в костном мозге (КМ) с окрашиванием экспрессии цито кератина 8/18 и HER2. ФИГ. 5В: Иммунофлуоресцентное окрашивание HER2, цитокератина и ki67. ФИГ. 5С: Детектирование ДРК в различных органах мышей NeuT.
[0018] На Фигурах 6А, 6В, 6С и 6D показано, что вакцина на основе нагруженных пептидом HER2 ДК1 предотвращает развитие опухоли молочной железы, вызывает старение клеток и удаляет ДРК у мышей NeuT. ФИГ. 6А: Иммунофлуоресцентное окрашивание ДРК костного мозга из контрольных и вакцинированных ДК1 мышей NeuT. ФИГ. 6В: Детектируемая с помощью ультразвука опухолевая масса в молочных железах. ФИГ. 6С: Процент ДРК в костном мозге измеряли, применяя проточную цитометрию. ФИГ. 6D: Детектирование стареющих клеток с применением анализа p-gal. Типичные изображения после окрашивания p-gal.
[0019] На Фигурах 7А и 7В показано, что лечение вакциной на основе нагруженных пептидом HER2 ДК1 и антителом против SEMA4D вызывало инфильтрацию В-клеток в молочные железы и инфильтрацию CD4+Т-клеток в костный мозг мышей NeuT. ФИГ. 7А: Мышей NeuT в возрасте 8 недель лечили вакциной на основе нагруженных пептидом HER2 ДК1 (две инъекции в неделю в течение трех недель) или антителом против SEMA4D. На 16 неделе мышей умерщвляли и собирали молочные железы. Получали суспензию отдельных клеток молочных желез и окрашивали положительные по CD19 В-клетки, затем проводили анализ с помощью проточной цитометрии. Наблюдали повышенные уровни CDa19+ В-клеток у вакцинированных ДК1 мышей и мышей, которых лечили антителом против SEMA4D, по сравнению с не получившим лечение контролем. ФИГ. 7 В: Клетки костного мозга, полученные из контрольных и вакцинированных ДК1 мышей NeuT, окрашивали на маркеры CD4 и CD8 Т-клеток и анализировали с помощью проточной цитометрии. Наблюдали повышенные количества CD4 Т-клеток и CD8 Т-клеток в костном мозге вакцинированных ДК1 мышей NeuT по сравнению с не получившими лечение контрольными мышами.
[0020] На Фигурах 8А, 8В, 8С, 8D и 8Е показано, что двойное блокирование HER2 и HER3 в комбинации с цитокином Th1 опосредует старение и апоптоз клеток рака молочной железы SK-BR-3. ФИГ. 8А: двойное блокирование HER2/HER3 в клетках SK-BR-3 в комбинации с цитокинами Th1 - TNF-α и IFN-γ - увеличивает количество стареющих клеток, в клетках наблюдали более интенсивное окрашивание SA-β-gal. ФИГ. 8В: клетки SK-BR-3 необработанные (1), обработанные TNF-α и IFN-γ (2), или обработанные трастузумабом (Герцептин, Н (TZm)) и пертузумабом (Per) (3), или обработанные TNF-α, IFN-γ и TZm и Per (4). ФИГ. 8С: Вестерн-блоттинг клеток SK-BR-3 после обработки цитокинами Th1 в комбинации с TZm и Per, которая индуцировала экспрессию ингибитора В циклинзависимой киназы 4, также известной как p15INK4b, и расщепленной каспазы-3 (обработки пронумерованы как на панели В). ФИГ. 8D и ФИГ. 8Е: Апоптоз, визуализированный с помощью окрашивания аннексином V/PI (обработки пронумерованы как на панелях D и Е).
[0021] На Фигурах 9А, 9В и 9С показано, что цитокины Th1 - TNF-α и IFN-γ - вызывали старение и апоптоз клеток в устойчивых к трастузумабу и пертузумабу клетках рака молочной железы. ФИГ. 9А: клетки НСС-1419 и ЛМТ-1; 1) необработанные; 2) обработанные TNF-α и IFN-γ; 3) обработанные TZm и Per или 4) обработанные TNF-α, IFN-γ, Tzm и Per. ФИГ. 9А. % SA-β-gal-положительных клеток. ФИГ. 9В: Вестерн-блоттинг экспрессии p15INKb и расщепленной каспазы-3 в НСС-1419 после обработки. ФИГ. 9С: Вестерн-блоттинг клеток ЛМТ-1. Винкулин использовали в качестве контроля.
[0022] На Фигурах 10А и 10В показано опосредованное HER2-специфифными CD4+ Th1 старение и апоптоз клеток рака молочной железы человека со сверхэкспрессией HER2. ФИГ. 10А: Клетки SK-BR-3, совместно культивированные с CD4+ Т-клетками отдельно (только CD4+ (1)), CD4+ Т-клетками + нагруженные пептидом HER2 незрелые дендритные клетки (CD4+ НДК Н (2)), с CD4+ Т-клетками + нагруженные пептидом HER2 зрелые дендритные клетки (CD4+ ДК Н (3)), или с CD4+ ДК Н с трастузумабом (Tzm) и пертузумабом (Per) (4), или с CD4+ Т-клетками + нагруженные посторонним пептидом зрелые дендритные клетки (BRAF (CD4+ ДК В) (5); или с сурвивином (CD4+ ДК S) (6)), с Tzm и Per. ФИГ. 10В: Вестерн-блоттинг опухолевых клеток показал повышение экспрессии p15INK4b и расщепленной каспазы-3, что свидетельствовало о вызванном старении и апоптозе клеток, соответственно, при совместном культивировании ДК H/CD4+ Т-клеток в присутствии Tzm и Per, но не в группах ДК В, ДК S и НДК Н. Винкулин использовали в качестве контроля загрузки.
[0023] На Фигуре 11 показано, что IFN-γ, который вводили подкожно дважды в неделю с еженедельным введением Таксола и стандартной дозы трастузумаба и пертузумаба в качестве терапии первой линии пациентам с метастатическим раком молочной железы, был безопасен и приводил к стабилизации заболевания или частичному ответу.
[0024] На Фигурах 12А, 12В, 12С и 12D показано иммуногистохимическое окрашивание инфильтрации лимфоцитов до и после введения вакцины ДК1 в ПКИС. На ФИГ. 12А и ФИГ. 12В видны области плотного инфильтрата лимфоцитов; на ФИГ. 12С и ФИГ. 12D видны области с небольшим ответом или без ответа.
[0025] На Фигуре 13 показано скопление лимфоцитов в ПКИС до и после вакцинации ДК1. Показана инфильтрация CD4, CD8 и CD20.
[0026] На Фигуре 14 показана инфильтрация лимфоцитов в протоки ПКИС после вакцинации ДК1.
[0027] На Фигурах 15А и 15В показано, что комбинированная терапия внутриопухолевыми ДК1 и антителом против SEMA4D улучшает васкуляризацию опухоли. ФИГ. 15А: Уклон кривых МРТ с динамическим контрастным усилением (ДКУ-МРТ) рассчитывали после в/в введения гадовиста (контрастное вещество для МРТ на основе гадолиния, 0,2 ммоль/кг). Несмотря на объем опухоли, для комбинированного лечения наблюдали меньший уклон, что свидетельствует о меньшем пропотевании жидкости через сосуды. ФИГ. 15В: По кривым ДКУ-МРТ для опухолей TUBO видно, что при комбинированной терапии кривая ДКУ ниже. Результаты представлены в виде относительного значения (относительно первой точки кривой), чтобы показать достоверное сравнение между опухолями.
[0028] На Фигуре 16 показана карта МРТ с химическим обменом-переносом спинового насыщения (МРТ-ХО-ПСН, CEST) (рН опухоли) опухоли TUBO, которую лечили антителом против SEMA4D. Справа налево: Т2-взвешенное изображение, представляющее область интереса (ОИ), карта рН (на вставке показано среднее значение рН и его стандартное отклонение) и гистограмма, на которой представлены значения рН для всех подсчитанных пикселей.
[0029] На Фигурах 17А - F показано, что CD4+ Т-клетки необходимы для активности против SEMA4D. ФИГ. 17А: Средний размер опухоли (мм2) в модели рака молочной железы Her2 TUBO у мышей в динамике после лечения HER2 ДК1, антителом против SEMA4D, HER2 ДК1 плюс антитело против SEMA4D или контрольным IgG. ФИГ. 17В: Процент выживаемости несущих опухоль Her2 TUBO мышей после лечения HER2 ДК1, антителом против SEMA4D, HER2 ДК1 плюс антитело против SEMA4D или контрольным IgG. ФИГ. 17С: Средний размер опухоли (мм2) у обедненных CD4 несущих опухоль Her2 TUBO мышей в динамике после лечения HER2 ДК1, антителом против SEMA4D, HER2 ДК1 плюс антитело против SEMA4D или без лечения. ФИГ. 17D: Процент выживаемости обедненных CD4 несущих опухоль Her2 TUBO мышей после лечения HER2 ДКТ, антителом против SEMA4D, HER2 ДКТ плюс антитело против SEMA4D или без лечения. ФИГ. 17Е: Размер опухоли (мм2) у отдельных несущих опухоль Нег2 TUBO мышей в динамике после лечения HER2 ДК1, антителом против SEMA4D, HER2 ДК1 плюс антитело против SEMA4D или контрольным IgG. Полный регресс опухолей наблюдали у контрольных мышей Balb/c после лечения антителом против SEMA4D и комбинацией антитела против SEMA4D плюс HER2 ДК1. ФИГ. 17F: Размер опухоли (мм2) у отдельных обедненных CD4 несущих опухоль Her2 TUBO мышей в динамике после лечения HER2 ДК1, антителом против SEMA4D, HER2 ДК1 плюс антитело против SEMA4D или контрольным IgG (17Е, F: показаны кривые роста опухоли для каждой мыши; ПО (полный ответ) = полный регресс опухоли; объем опухоли <50 мм2) (* р<0,05, **р<0,01).
[0030] На Фигурах 18А - С показано, что рецептор Fc-гамма (FcRγ) необходим для полного регресса опухоли после лечения комбинированной терапией. ФИГ. 18А: Средний размер опухоли (мм2) у несущих опухоль мышей BALB/C.129P2(B6)-FcerigtmlRav N12, которых лечили HER2 ДК, антителом против SEMA4D, HER2 ДК плюс антитело против SEMA4D; или не лечили. ФИГ. 18В: Процент выживаемости несущих опухоль мышей CA29P2(B6)-FcerlgtmlRav N12, которых лечили HER2 ДК, антителом против SEMA4D, HER2 ДК плюс антитело против SEMA4D; или не лечили. ФИГ. 18С: Показаны кривые роста опухоли для каждой мыши. Не наблюдали полного регресса опухолей у мышей с недостаточностью FcRγ (* р<0,05, **р<0,01).
[0031] На Фигуре 19 показано, что интерферон гамма (IFN-γ) необходим для противоопухолевой активности ДК1, антитела против SEMA4D и комбинированной терапии. Показан средний размер опухоли (мм2) у мышей Balb/С с нокаутом (KO) IFN-γ (C.129S7 (B6)-IFNgtm1Ts/J (IFN-γKO, Jackson Laboratories), которые несли опухоли, полученные из клеток рака молочной железы мыши Her2 TUBO, в динамике после лечения HER2 ДК1, антителом против SEMA4D, HER2 ДК1 плюс антитело против SEMA4D или контрольным IgG.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
0032] Перед тем, как будут раскрыты и описаны соединения, композиции, изделия, устройства и/или способы в соответствии с настоящим изобретением, должно быть понятно, что они не ограничены конкретными способами синтеза или конкретными способами рекомбинантной биотехнологии, если не указано иное, или конкретными реагентами, если не указано иное, так как они, разумеется, могут меняться. Также должно быть понятно, что терминология, используемая в данной заявке, предназначена исключительно для описания конкретных вариантов реализации и не предназначена для ограничения.
Определения
[0033] Используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают ссылку на множественное число, если в контексте явно не указано иное. Таким образом, например, упоминание «фармацевтического носителя» включает смеси двух или более таких носителей, и тому подобное.
[0034] Диапазоны могут быть выражены в данной заявке как от «приблизительно» одного конкретного значения и/или до «приблизительно» другого конкретного значения. Когда такой диапазон выражен, другой вариант реализации включает от одного конкретного значения и/или до другого конкретного значения. Аналогично, когда значения выражены в виде приблизительных величин, с использованием перед ними термина «приблизительно», понятно, что конкретное значение образует другой вариант реализации. Кроме того, будет понятно, что крайние точки каждого из диапазонов значимы как относительно другой крайней точки, так и независимо от другой крайней точки. Также понятно, что существует множество значений, описанных в данной заявке, и что каждое значение в данной заявке также описано как «приблизительно» данное конкретное значение, дополнительно к самому значению. Например, если описано значение «10», то также описано «приблизительно 10». Также понятно, что когда описано некоторое значение, то также описано значение, которое «меньше или равно» указанному значению, «больше или равно указанному значению», и возможные диапазоны между значениями, что должным образом понимает квалифицированный специалист. Например, если описано значение «10», то также описано значение, «меньшее или равное 10», а также «большее или равное 10». Также понятно, что по всему тексту настоящей заявки данные представлены во множестве различных форматов, и что эти данные представляют собой конечные точки и начальные точки, а также диапазоны для любой комбинации точек данных. Например, если описаны конкретная точка данных «10» и конкретная точка данных «15», то должно быть понятно, что считают описанными значения, большие, большие или равные, меньшие, меньшие или равные и равные 10 и 15, а также значения между 10 и 15. Также понятно, что также описана каждая единица между двумя конкретными единицами. Например, если описаны 10 и 15, то также описаны 11, 12, 13 и 14.
[0035] В настоящем описании и в следующей формуле изобретения будут ссылаться на множество терминов, которые следует понимать, как имеющие описанные ниже значения.
[0036] «Необязательный» или «необязательно» означает, что описанное после него событие или обстоятельство может произойти или может не произойти, и что в объем настоящего описания входят случаи, когда указанное событие или обстоятельство происходит, и случаи, когда оно не происходит.
[0037] «Снижение» может относиться к любому изменению, которое приводит к меньшей величине симптома, заболевания, композиции, состояния или активности. Вещество также понимают как снижающее выход продукта гена, когда выход продукта гена в присутствии вещества меньше по сравнению с выходом продукта гена в отсутствие указанного вещества. Также, например, снижение может представлять собой такое изменение симптомов расстройства, что симптомы становятся меньше, чем наблюдаемые ранее. Снижение может представлять собой любое отдельное, срединное или среднее снижение состояния, симптома, активности, композиции в статистически значимом количестве. Таким образом, снижение может представлять собой 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100%-ное снижение, при условии, что снижение статистически значимо.
[0038] Термины «ингибируют», «ингибируя» и «ингибирование» означают снижение активности, ответа, состояния, заболевания или другого биологического параметра. Это может включать, но не ограничено полным нарушением активности, ответа, состояния или заболевания. Это также может включать, например, уменьшение на 10% активности, ответа, состояния или заболевания по сравнению с нативным или контрольным уровнем. Таким образом, уменьшение может быть на 10, 20, 30, 40, 50, 60, 70, 80, 90, 100% или на любую величину между указанными значениями по сравнению с нативным или контрольным уровнем.
[0039] Под термином «уменьшать» или другими формами указанного термина, такими как «уменьшая» или «уменьшение», подразумевают уменьшение явления или свойства (например, роста опухоли). Должно быть понятно, что обычно это уменьшение происходит относительно некоторого стандартного или ожидаемого значения, другими словами, оно относительно, но не всегда необходимо, чтобы было указано такое стандартное или относительное значение. Например, «уменьшает рост опухоли» означает уменьшение скорости роста опухоли по сравнению со стандартом или контролем.
[0040] Под термином «предотвращать» или другими формами указанного термина, такими как «предотвращая» или «предотвращение», подразумевают остановку конкретного явления или свойства, стабилизацию или отсрочивание развития или прогрессирования конкретного явления или свойства, или минимизирование вероятности того, что конкретные явления или свойства будут происходить. «Предотвращать» не требует сравнения с контролем, так как оно обычно более абсолютно, чем, например, «уменьшать». В настоящей заявке что-то может быть уменьшено, но не предотвращено, но что-то, что уменьшено, также может быть предотвращено. Аналогичным образом, что-то может быть предотвращено, но не уменьшено, но что-то, что предотвращено, также может быть уменьшено. Должно быть понятно, что когда используют термины «уменьшать» или «предотвращать», если конкретно не указано иное, использование другого слова также явно описано.
[0041] «Биосовместимый», как правило, относится к материалу и любым его метаболитам или продуктам деградации, которые, как правило, нетоксичны для реципиента и не вызывают значительных нежелательных явлений у субъекта.
[0042] Предполагается, что «включающий/содержащий» означает, что композиции, способы и т.д. включают перечисленные элементы, но не исключают другие. Формулировка «состоящий по существу из», когда ее используют для определения композиций и способов, должна означать включение перечисленных элементов, но исключение других элементов с любой неотъемлемой значимостью для комбинации. Таким образом, формулировка «композиция, состоящая по существу из элементов», в соответствии с определениями в данном тексте, не будет исключать следовые примеси в результате способов выделения и очистки и фармацевтически приемлемые носители, такие как фосфатно-солевой буферный раствор, консерванты и тому подобное. «Состоящий из» должно означать исключение более чем следовых элементов других ингредиентов и существенных этапов способа введения композиций, предложенных и/или заявленных в настоящем описании. Варианты реализации, которые определяются каждым из данных переходных терминов, входят в объем настоящего изобретения.
[0043] «Контроль» представляет собой альтернативного субъекта или альтернативный образец, используемый в эксперименте с целью сравнения. Контроль может быть «положительным» или «отрицательным».
[0044] «Эффективное количество» агента относится к достаточному количеству агента для получения желательного эффекта. Количество агента, которое «эффективно», будет изменяться от субъекта к субъекту в зависимости от множества факторов, таких как возраст и общее состояние субъекта, конкретный агент или агенты, и тому подобных факторов. Таким образом, не всегда возможно точно обозначить подсчитанное «эффективное количество». Тем не менее, подходящее «эффективное количество» в любом конкретном случае может определить средний специалист в данной области путем проведения обычного эксперимента. Также в настоящей заявке, и если не указано иное, «эффективное количество» агента также может относиться к количеству, охватывающему как терапевтически эффективные количества, так и профилактически эффективные количества. «Эффективное количество» агента, необходимое, чтобы добиться терапевтического действия, может изменяться в соответствии с такими факторами, как возраст, пол и масса тела субъекта. Схемы приема лекарственного средства можно отрегулировать, чтобы обеспечить оптимальный терапевтический ответ. Например, несколько разделенных доз можно вводить ежедневно или дозу можно пропорционально уменьшить, как указано, в зависимости от потребностей терапевтической ситуации.
[0045] «Фармацевтически приемлемый» компонент может относиться к компоненту, который не является неприемлемым с биологической или другой точки зрения, т.е., указанный компонент можно включить в фармацевтический состав, предложенный в настоящем описании, и вводить субъекту, как описано в настоящей заявке, не вызывая значительных нежелательных биологических эффектов или не взаимодействуя каким-либо вредным образом с любым из других компонентов состава, в котором он содержится. Когда его используют по отношению к введению человеку, данный термин, как правило, подразумевает, что компонент удовлетворил необходимым стандартам токсикологических и производственных испытаний, или что он включен в Справочник по неактивным компонентам, подготовленный Управлением США по надзору за качеством пищевых продуктов и лекарственных средств.
[0046] «Фармацевтически приемлемый носитель» (иногда называют «носителем») означает носитель или вспомогательное вещество, которое пригодно для приготовления фармацевтической или терапевтической композиции, которая в целом безопасна и нетоксична и содержит носитель, который приемлем для ветеринарии и/или фармацевтического или терапевтического применения у человека. Термины «носитель» или «фармацевтически приемлемый носитель» могут включать, но не ограничены фосфатно-солевым буферным раствором, водой, эмульсиями (такими как эмульсия масло/вода или вода/масло) и/или различными типами смачивающих агентов. В настоящей заявке термин «носитель» включает, но не ограничен любым вспомогательным веществом, разбавителем, наполнителем, солью, буфером, стабилизатором, солюбилизатором, липидом, стабилизатором или другим материалом, хорошо известным в данной области для применения в фармацевтических составах и дополнительно описанным в данной заявке.
[0047] «Фармакологически активный» (или просто «активный»), как в «фармакологически активном» производном или аналоге, может относиться к производному или аналогу (например, соли, сложному эфиру, амиду, конъюгату, метаболиту, изомеру, фрагменту и т.д.) с тем же типом фармакологической активности, что и у исходного соединения, и приблизительно в эквивалентной степени.
[0048] «Полимер» относится к относительно высокомолекулярному органическому соединению, природному или синтетическому, структура которого может быть представлена повторяющимся небольшим звеном - мономером. Неограничивающие примеры полимеров включают полиэтилен, каучук, целлюлозу. Синтетические полимеры обычно образованы посредством полимеризации путем добавления или конденсации мономеров. Термин «сополимер» относится к полимеру, образованному из двух или более различных повторяющихся звеньев (остатков мономера). В качестве примера и без ограничения, сополимер может представлять собой чередующийся сополимер, статистический сополимер, блок-сополимер или привитый сополимер. Также предполагается, что, в некоторых аспектах, различные фрагменты блоков блок-сополимера могут сами содержать сополимеры. В объем термина «полимер» входят все формы полимеров, включая, но не ограничиваясь природными полимерами, синтетическими полимерами, гомополимерами, гетерополимерами или сополимерами, аддитивными полимерами и т.д.
[0049] «Связывающая молекула» или «антигенсвязывающая молекула» (например, антитело или его антигенсвязывающий фрагмент) в настоящей заявке относится, в наиболее широком смысле, к молекуле, которая специфично связывает антигенную детерминанту. В одном варианте реализации связывающая молекула специфично связывается с иммунорегуляторной молекулой (такой как, например, полипептид трансмембранного SEMA4D (CD100) массой приблизительно 150 кДа или полипептид растворимого SEMA4D массой приблизительно 120 кДа). В другом варианте реализации связывающая молекула представляет собой антитело или антигенсвязывающий его фрагмент, например, MAb 67 или пепинемаб.
[0050] «Терапевтический агент» относится к любой композиции, которая оказывает полезное биологическое действие. Полезные биологические действия включают как терапевтические действия, например, лечение расстройства или другого нежелательного физиологического состояния, так и профилактические действия, например, предотвращение расстройства или другого нежелательного физиологического состояния (например, неиммуногенного рака). Также в объем указанных терминов входят фармацевтически приемлемые, фармакологически активные производные полезных агентов, конкретно упомянутых в настоящей заявке, включая, но не ограничиваясь солями, эфирами, амидами, проагентами, активными метаболитами, изомерами, фрагментами, аналогами и тому подобными агентами. Когда используют термин «терапевтический агент», тогда, или когда конкретно обозначен конкретный агент, должно быть понятно, что указанный термин включает сам агент, а также фармацевтически приемлемые, фармакологически активные соли, эфиры, амиды, проагенты, конъюгаты, активные метаболиты, изомеры, фрагменты, аналоги и т.д.
[0051] «Терапевтически эффективное количество» или «терапевтически эффективная доза» композиции (например, композиции, содержащей агент) относится к количеству, которое эффективно, чтобы добиться желательного терапевтического результата. В некоторых вариантах реализации желательный терапевтический результат представляет собой контролирование диабета I типа. В некоторых вариантах реализации желательный терапевтический результат представляет собой контролирование ожирения. Терапевтически эффективные количества данного терапевтического агента, как правило, будут изменяться в зависимости от таких факторов, как тип и тяжесть расстройства или заболевания, которое лечат, и возраст, пол и масса тела субъекта. Термин также может относиться к количеству терапевтического агента, или к скорости доставки терапевтического агента (например, количеству с течением времени), эффективным, чтобы способствовать желательному терапевтическому действию, такому как снятие боли. Точное желательное терапевтическое действие будет изменяться в зависимости от состояния, которое лечат, переносимости субъектом, агента и/или состава агента, который надлежит вводить (например, эффективности терапевтического агента, концентрации агента в составе и тому подобного), и различных других факторов, которые известны средними специалистам в данной области техники. В некоторых случаях желательного биологического или медицинского ответа добиваются после введения множества дозировок композиции субъекту в течение периода, состоящего дни, недели или годы.
[0052] По всему тексту настоящей заявки приводятся ссылки на различные публикации. Описания данных публикаций настоящим полностью включены в данную заявку посредством ссылки, чтобы более полно описать существующий уровень техники, к которому относится настоящее изобретение. Описанные ссылочные материалы также отдельно и конкретно включены в данную заявку посредством ссылки в отношении материала, содержащегося в них, который обсуждается в предложении, в котором ссылаются на указанный ссылочный материал.
Композиции
[0053] Описаны компоненты, которые будут использовать для получения описанных композиций, а также сами композиции, которые будут применять в способах, описанных в настоящей заявке. Данные и другие материалы описаны в настоящей заявке, и должно быть понятно, что когда описаны комбинации, подгруппы, взаимодействия, группы и т.д. данных материалов, то, хотя конкретное упоминание каждой из различных отдельных и совокупных комбинаций и перестановок данных соединений может не быть явно представлено, каждая конкретно предложена и описана в данной заявке. Например, если описан и обсуждается конкретный ингибитор иммунорегуляторной молекулы или нагруженная онкодрайвером дендритная клетка, и обсуждается множество модификаций, которые можно осуществить с множеством молекул, включая ингибитор иммунорегуляторной молекулы или нагруженную онкодрайвером дендритную клетку, то конкретно предложены все без исключения комбинации и перестановки ингибитора иммунорегуляторной молекулы или нагруженной онкодрайвером дендритной клетки, и модификации, которые возможны, если явно не указано иное. Таким образом, если описан класс молекул А, В и С, а также класс молекул D, Е и F и описан пример комбинированной молекулы А-D, то даже если каждая отдельно не упомянута, то предполагается, что каждая отдельно и в совокупности, то есть комбинации А-Е, A-F, B-D, В-Е, B-F, C-D, С-Е и С-F, считают описанными. Аналогичным образом, также описаны любые их подгруппы или комбинации. Таким образом, например, будут считать описанной подгруппу А - Е, В - F и С - Е. Эта концепция распространяется на все аспекты настоящей заявки, включая, но не ограничиваясь этапами способов получения и применения описанных композиций. Таким образом, если есть различные дополнительные этапы, которые можно осуществить, то должно быть понятно, что каждый из данных дополнительных этапов можно осуществить с любым конкретным вариантом реализации или комбинацией вариантов реализации описанных способов.
[0054] У пациентов, у которых выявляют ПКИС, обычно очень хороший прогноз, тем не менее, у тех, у кого ПКИС проявляется в возрасте <40 лет, у женщин афроамериканского происхождения и женщин с ERneg ПКИС немного повышен риск смерти от последующего РМЖ, который, похоже, не предотвращается ни хирургическим вмешательством, ни облучением. Вторая проблема состоит в том, что у множества молодых пациентов также присутствуют большие области экспрессирующей HER2 ПКИС, которые содержат области инвазии Т1а/T1b. Таких пациентов обычно либо лечат путем мастэктомии, вследствие величины площади кальцификаций, или лечат курсом химиотерапии сильными неоадъювантами: карбоплатином, таксотером с трастузумабом и пертузумабом (РТСН), или таксолом и трастузумабом (ТН), - которые приводят к хорошей выживаемости, но пациенты страдают от длительных последствий обширного хирургического вмешательства, облучения и химиотерапии. В дни персонализированной медицины данные пациенты нуждаются в более персонализированной эффективной терапии, которая как уменьшает шансы последующей смертности от РМЖ, так и, в то же время, уменьшает избыточное лечение, которое они получают в рамках химиотерапии: год трастузумаба, облучения и часто мастэктомию. Пациенты с метастатическим раком молочной железы (мРМЖ) остро нуждаются в новых иммунотерапевтических средствах для уменьшения смертности, особенно те, которые становятся невосприимчивыми к направленной терапии.
[0055] Сверхэкспрессия HER-2/neu играет важную роль в развитии рака молочной железы (РМЖ), и его экспрессия в протоковой карциноме in situ (ПКИС) связана с развитием инвазивного РМЖ (иРМЖ). Происходит прогрессирующая утрата системного иммунного ответа Th1 против HER2 у пациентов с положительной по HER2 ПКИС и инвазивным РМЖ. Введение вакцины на основе нагруженных пептидом HER2 II класса поляризованных дендритных клеток I типа (HER2-ДК1) частично восстанавливает иммунные ответы Th1 против HER2 приблизительно с 30%-ным уровнем полного патоморфологического ответа (ППО) у пациентов с ПКИС. Существует возможность улучшить иммунный ответ и клиническую активность у пациентов с ранним HER2 РМЖ. Семафорин 4D (SEMA4D) представляет собой семейство растворимых и трансмембранных белков, которые необходимы для развития тканей и органов и участвуют в регуляции иммунитета. Сверхэкспрессия SEMA4D коррелирует с неблагоприятным прогнозом и прогрессированием опухоли при различных типах рака. В настоящем исследовании изучали повышение моноклональным антителом мыши против SEMA4D (предоставленным Vaccinex) в комбинации с вакциной ДК1 противоопухолевого иммунного ответа в доклинической модели положительного по HER2 рака молочной железы TUBO.
[0056] В одном аспекте настоящего изобретения предложена противораковая комбинированная терапия, включающая по меньшей мере одну дендритную клетку, нагруженную онкодрайвером (таким как, например, рецептор эпидермального фактора роста человека HER2), и по меньшей мере один ингибитор иммунорегуляторной молекулы (такой как, например, семафорин (SEMA) 4D (SEMA4D) или VEGF). В некоторых неограничивающих аспектах ингибируемая иммунорегуляторная молекула может влиять на сосудистую сеть опухоли.
[0057] Понятно и предполагается в настоящей заявке, что описанную противораковую комбинированную терапию можно применять для лечения, предотвращения, уменьшения и/или ингибирования любого заболевания, при котором происходит неконтролируемая пролиферация клеток, такого как типы рака, включая первичные опухоли и опухоли с отдаленными метастазами. Неограничивающий перечень различных типов рака описан далее: лимфомы (ходжкинские и неходжкинские), лейкозы, карциномы, карциномы солидных тканей, плоскоклеточные карциномы, аденокарциномы, саркомы, глиомы, высокой степени злокачественности глиомы, бластомы, нейробластомы, плазмацитомы, гистиоцитомы, меланомы, аденомы, гипоксические опухоли, миеломы, связанные со СПИДом лимфомы или саркомы, метастатические типы рака или рак в целом.
[0058] Типичный, но неограничивающий перечень типов рака, для лечения которых можно применять описанные композиции, приведен далее: лимфома, В-клеточная лимфома, Т-клеточная лимфома, фунгоидный микоз, болезнь Ходжкина, миелоидный лейкоз, рак мочевого пузыря, рак головного мозга, рак нервной системы, рак головы и шеи, плоскоклеточная карцинома головы и шеи, типы рака легких, такие как мелкоклеточный рак легких и немелкоклеточный рак легких, нейробластома/глиобластома, рак яичников, рак кожи, рак печени, меланома, плоскоклеточные карциномы рта, глотки, гортани и легкого, рак шейки матки, карцинома шейки матки, рак молочной железы (включая трижды негативный рак молочной железы, метастатический рак молочной железы (мРМЖ), протоковую карциному in situ (ПКИС) и инвазивный рак молочной железы (иРМЖ)), и эпителиальный рак, рак почки, урогенитальный рак, легких рак, карцинома пищевода, карцинома головы и шеи, рак толстой кишки, типы гематопоэтического рака; рак яичка; колоректальный рак, рак предстательной железы или рак поджелудочной железы. Таким образом, в одном аспекте настоящего изобретения предложены способы лечения, предотвращения, уменьшения и/или ингибирования рака (такого как, например, рак молочной железы (включая трижды негативный рак молочной железы, метастатический рак молочной железы (мРМЖ), протоковую карциному in situ (ПКИС) и инвазивный рак молочной железы (иРМЖ)), меланома, колоректальный рак, рак поджелудочной железы и рак предстательной железы, включая первичные опухоли и опухоли с отдаленными метастазами) у субъекта, включающие введение противораковой комбинированной терапии в соответствии с любым предшествующим аспектом. Например, в настоящей заявке описаны способы лечения, предотвращения, уменьшения и/или ингибирования рака у субъекта, включающие введение указанному субъекту по меньшей мере одной дендритной клетки, нагруженной онкодрайвером (таким как, например, рецептор эпидермального фактора роста человека (HER) HER2), и по меньшей мере одного ингибитора иммунорегуляторной молекулы (такой как, например, семафорин (SEMA) 4D (SEMA4D) или VEGF). В некоторых неограничивающих аспектах, ингибируемая иммунорегуляторная молекула может влиять на сосудистую сеть опухоли.
[0059] В одном аспекте должно быть понятно, что описанные способы и противораковая комбинированная терапия включают ингибитор иммунорегуляторных молекул, которые как оказывают иммунорегуляторное действие, так и, в некоторых неограничивающих аспектах, могут влиять на сосудистую сеть опухоли. Понятно и предполагается в настоящей заявке, что указанные ингибиторы могут включать любую малую молекулу, пептид, белок, антитело (включая любые функциональные фрагменты антитела или другой связывающей молекулы), и/или функциональную нуклеиновую кислоту (миРНК, РНК, аптамер), которая ингибирует иммунорегуляторную и/или сосудистую активность иммунорегуляторной молекулы. В одном аспекте ингибитор иммунорегуляторной молекулы включает ингибитор SEMA4D - пепинемаб (антитело против SEMA4D).
Антитела
Антитела в целом.
[0060] Термин «антитела» используют в настоящей заявке в широком смысле, и он включает как поликлональные, так и моноклональные антитела. Дополнительно к интактным молекулам иммуноглобулинов, также в объем термина «антитела» входят фрагменты или полимеры таких молекул иммуноглобулинов, и человеческие или гуманизированные варианты молекул иммуноглобулинов или их фрагменты, при условии, что они выбраны по их способности взаимодействовать с иммунорегуляторной молекулой (такой как, например, семафорин (SEMA) 4D (SEMA4D) или VEGF) так, что ингибируется иммунорегуляторная активность иммунорегуляторной молекулы и/или ее влияние на сосудистую сеть опухоли. Можно исследовать желательную активность антител, применяя способы анализа in vitro, описанные в настоящей заявке, или с помощью аналогичных способов, после чего можно исследовать терапевтические и/или профилактические активности in vivo в соответствии с известными способами клинического тестирования. Нативные антитела обычно представляют собой гетеротетрамерные гликопротеины, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Обычно, каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, хотя количество дисульфидных связей различно в тяжелых цепях различных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь также содержит равномерно распределенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь содержит на одном конце вариабельный домен (V(H)), а затем множество константных доменов. Каждая легкая цепь содержит вариабельный домен на одном конце (V(L)) и константный домен на другом конце; константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Считают, что определенные аминокислотные остатки образуют поверхность контакта между вариабельными доменами легкой и тяжелой цепей. Легкие цепи антител из любых видов позвоночных можно отнести к одному из двух явно различных типов, названных каппа (k) и лямбда (l), на основании последовательностей аминокислот их константных доменов. В зависимости от последовательности аминокислот константного домена тяжелых цепей, иммуноглобулины можно отнести к различным классам. Существует пять основных классов иммуноглобулинов человека: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно подразделить на подклассы (изотипы), например, IgG-1, IgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2. Специалист в данной области определит сопоставимые классы для мыши. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно.
[0061] Термин «вариабельный» используют в настоящей заявке для описания некоторых частей вариабельных доменов, которые отличаются по последовательности среди антител и используются для специфичности каждого конкретного антитела к конкретному антигену и связывания с ним. Тем не менее, вариабельность обычно не равномерно распределена по вариабельным доменам антител. Она обычно сконцентрирована в трех фрагментах, названных определяющими комплементарность областями (CDR) или гипервариабельными участками в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называют каркасом (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре области FR, по большей части принимающие b-складчатую конформацию, соединенные тремя CDR, которые образуют петли, соединяющие и, в некоторых случаях, образующие часть b-складчатой структуры. CDR в каждой цепи удерживаются в непосредственной близости друг к другу областями FR и, вместе с CDR из другой цепи, вносят вклад в образование сайта связывания антигена антитела (см. Kabat Е. A. et al., «Sequences of Proteins of Immunological Interest», Национальные институты здравоохранения, Бетесда, Мэриленд (1987)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но осуществляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности.
[0062] В некоторых антителах или их антигенсвязывающих фрагментах, вариантах или производных, описанных в настоящей заявке (таких как, например, антитело против SEMA4D - пепинемаб), части тяжелой цепи одной полипептидной цепи мультимера идентичны таковым на второй полипептидной цепи мультимера. В качестве альтернативы, содержащие часть тяжелой цепи мономеры не идентичны. Например, каждый мономер может содержать отличный сайт связывания мишени, образуя, например, биспецифичное антитело.
[0063] Части тяжелой цепи связывающей молекулы для применения в способах диагностики и лечения, описанных в настоящей заявке, могут быть получены из различных молекул иммуноглобулинов. Например, часть тяжелой цепи полипептида может содержать домен CH1, полученный из молекулы IgG1, и шарнирную область, полученную из молекулы IgG3. В другом примере часть тяжелой цепи может содержать шарнирную область, полученную частично из молекулы IgG1 и частично из молекулы IgG3. В другом примере часть тяжелой цепи может содержать химерный шарнир, происходящий частично из молекулы IgG1 и частично из молекулы IgG4.
[0064] В настоящей заявке термин «часть легкой цепи» включает последовательности аминокислот, полученные из легкой цепи иммуноглобулина, например, легкой цепи каппа или лямбда. Предпочтительно, часть легкой цепи содержит по меньшей мере один из доменов VL или CL.
[0065] Антитела против SEMA4D или их антигенсвязывающие фрагменты, варианты или производные, описанные в настоящей заявке, могут быть описаны или определены с точки зрения эпитопа(-ов) или части(-ей) антигена, например, целевого полипептида, описанного в настоящей заявке (например, SEMA4D), который они распознают или специфично связывают. Часть целевого полипептида, которая специфично взаимодействует с антигенсвязывающим доменом антитела, представляет собой «эпитоп» или «антигенную детерминанту». Целевой полипептид может содержать один эпитоп, но обычно содержит по меньшей мере два эпитопа, и может содержать любое количество эпитопов, в зависимости от размера, конформации и типа антигена. Более того, следует отметить, что «эпитоп» на целевом полипептиде может представлять собой или может содержать неполипептидные элементы, например, эпитоп может содержать углеводную боковую цепь.
[0066] Считают, что минимальный размер пептидного или полипептидного эпитопа антитела составляет приблизительно четыре - пять аминокислот. Пептидные или полипептидные эпитопы предпочтительно содержат по меньшей мере семь, более предпочтительно по меньшей мере девять и наиболее предпочтительно от по меньшей мере приблизительно 15 до приблизительно 30 аминокислот. Поскольку CDR может распознавать антигенный пептид или полипептид в его третичной форме, аминокислоты, составляющие эпитоп, не обязательно должны быть смежными и, в некоторых случаях, могут даже не находиться на одной пептидной цепи. Пептидный или полипептидный эпитоп, узнаваемый антителами против SEMA4D, может содержать последовательность из по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, более предпочтительно по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25 или от приблизительно 15 до приблизительно 30 смежных или несмежных аминокислот SEMA4D.
[0067] Под формулировкой «специфично связывает», как правило, подразумевают, что антитело связывается с эпитопом посредством антигенсвязывающего домена, и что связывание подразумевает некоторую комплементарность между антигенсвязывающий доменом и эпитопом. Согласно этому определению говорят, что антитело «специфично связывается» с эпитопом, когда оно связывается с этим эпитопом, посредством своего антигенсвязывающего домена, легче, чем оно будет связываться с произвольным неродственным эпитопом. Термин «специфичность» используют в настоящей заявке, чтобы оценить относительную аффинность, с которой некоторое антитело связывается с некоторым эпитопом. Например, можно считать, что у антитела «А» выше специфичность к данному эпитопу, чем у антитела «В», или можно сказать, что антитело «А» связывается с эпитопом «С» с большей специфичностью, чем его специфичность к родственному эпитопу «D».
[0068] Под «предпочтительно связывает» подразумевают, что антитело специфично связывается с эпитопом легче, чем оно будет связываться с родственным, сходным, гомологичным или аналогичным эпитопом. Таким образом, антитело, которое «предпочтительно связывается» с данным эпитопом, более вероятно будет связываться с этим эпитопом, чем с родственным эпитопом, даже если такое антитело может давать перекрестную реакцию с родственным эпитопом.
[0069] Термин «моноклональное антитело» в настоящей заявке относится к антителу, полученному из по существу гомогенной популяции антител, т.е., отдельные антитела в популяции идентичны за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в небольшой подгруппе молекул антител. Моноклональные антитела в настоящей заявке, в частности, включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретного вида или относящихся к конкретному классу или подклассу антител, тогда как остальная часть цепи(-ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желательную антагонистическую активность.
[0070] Описанные моноклональные антитела можно получить, применяя любую процедуру, в результате которой образуются моноклональные антитела. Например, описанные моноклональные антитела можно получить, применяя гибридомные способы, такие как способы, описанные у Kohler и Milstein, Nature, 256:495 (1975). В гибридомном способе, мышь или другое подходящее животное-хозяина обычно иммунизируют иммунизирующим агентом, чтобы получить лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с иммунизирующим агентом. В качестве альтернативы, указанные лимфоциты можно иммунизировать in vitro.
[0071] Моноклональные антитела также можно получить с помощью способов рекомбинантных ДНК. ДНК, кодирующие описанные моноклональные антитела, можно легко выделить и секвенировать, применяя обычные процедуры (например, применяя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Библиотеки антител или активных фрагментов антител также можно получить и подвергнуть скринингу, применяя методики фагового дисплея, например, описанные в патенте США №5,804,440, Burton et al., и патенте США №6,096,441, Barbas et al.
[0072] Способы in vitro также подходят для получения моновалентных антител. Расщепление антител для получения их фрагментов, особенно, фрагментов Fab, можно осуществить, применяя обычные методики, известные в данной области техники. Например, расщепление можно осуществить, применяя папаин. Примеры расщепления папаином описаны в WO 94/29348, опубликованной 22 декабря 1994 г., и в патенте США номер 4,342,566. В результате расщепления папаином антител обычно образуется два идентичных антигенсвязывающих фрагмента, названных фрагментами Fab, каждый с одним сайтом связывания антигена, и остаточный фрагмент Fc. В результате обработки пепсином образуется фрагмент, который содержит два антигенсвязывающих центра антитела и все еще способен перекрестно связывать антиген.
[0073] В настоящей заявке в объем термина «антитело или его фрагменты» входят химерные антитела и гибридные антитела, с двойной или множественной специфичностью к антигену или эпитопу, и фрагменты, такие как F(ab')2, Fab', Fab, Fd, Fv, scFv, связанные дисульфидными связями Fv (sdFv), фрагменты, содержащие один или оба домена VH или VL, и тому подобные фрагменты, включая гибридные фрагменты. Таким образом, предложены фрагменты антител, у которых сохранилась способность связывания со специфичными антигенами. Например, фрагменты антител, у которых сохранилась активность связывания иммунорегуляторной молекулы (такой как, например, семафорин (SEMA) 4D (SEMA4D) или VEGF), входят в объем значения термина «антитело или его фрагмент». Такие антитела и фрагменты можно получить, применяя методики, известные в данной области техники, и их можно подвергнуть скринингу на специфичность и активность в соответствии со способами, представленными в разделе «Примеры», и обычными способами получения антител и скрининга специфичности и активности антител (см. Harlow и Lane. Antibodies, А Laboratory Manual. Cold Spring Harbor Publications, Нью-Йорк, (1988)).
[0074] Также входят в объем значения термина «антитело или его фрагменты» конъюгаты фрагментов антител и антигенсвязывающие белки (одноцепочечные антитела).
[0075] Фрагменты, либо присоединенные к другой последовательности, либо нет, также могут сдержать вставки, делеции, замены или другие выбранные модификации конкретных областей или конкретных аминокислотных остатков, при условии, что активность антитела или фрагмента антитела значительно не изменяется или не нарушается по сравнению с немодифицированным антителом или фрагментом антитела. Данные модификации могут придать некоторые дополнительные свойства, например, удалить/добавить аминокислоты, способные образовывать дисульфидные связи, повысить продолжительность биологического существования, изменить секреторные свойства и т.д. В любом случае, антитело или фрагмент антитела должны обладать биологически активным свойством, таким как специфичное связывание с распознаваемым антигеном. Функциональные или активные участки антитела или фрагмента антитела можно обнаружить путем мутагенеза определенного участка белка, а затем экспрессии и тестирования экспрессированного полипептида. Такие способы понятны для практикующего специалиста в данной области техники и могут включать сайт-специфичный мутагенез нуклеиновой кислоты, кодирующей антитело или фрагмент антитела (Zoller, M.J. Curr. Opin. Biotechnol. 3:348-354, 1992).
[0076] В настоящей заявке термин «часть тяжелой цепи» включает последовательности аминокислот, полученные из тяжелой цепи иммуноглобулина. Полипептид, содержащий часть тяжелой цепи, содержит по меньшей мере один из: домена СН1, шарнирного (например, верхней, средней и/или нижней шарнирной области) домена, домена СН2, домена СН3 или его варианта или фрагмента.
[0077] В настоящей заявке термин «антитело» или «антитела» может также относиться к антителу человека и/или гуманизированному антителу. Многие не являющиеся человеческими антитела (например, происходящие из мыши, крысы или кролика) по своей природе являются антигенами для людей и, следовательно, могут вызывать нежелательные иммунные ответы при введении людям. Следовательно, применение человеческих или гуманизированных антител в указанных способах способствует уменьшению вероятности того, что антитело, введенное человеку, вызовет нежелательный иммунный ответ.
Антитела человека.
[0078] Описанные антитела человека можно получить, применяя любую методику. Описанные антитела человека также можно получить из трансгенных животных. Например, были описаны трансгенные мутантные мыши, которые способны продуцировать полный репертуар антител человека в ответ на иммунизацию (см., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551-255 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immunol, 7:33 (1993)). В частности, гомозиготная делеция гена участка соединения (3(H)) тяжелой цепи антитела в данных химерных мышах и мышах с мутациями в генах зародышевой линии приводит к полному ингибированию продукции эндогенных антител, и успешный перенос ряда генов антител зародышевой линии человека таким мышам с мутациями в генах зародышевой линии приводит к продукции антител человека после провокации антигеном. Проводят селекцию антител, проявляющих желательную активность, применяя Env-CD4-корецепторные комплексы, описанные в данной заявке.
Гуманизированные антитела
[0079] Методики гуманизирования антител, как правило, включают применение технологии рекомбинантных ДНК для манипулирования над последовательностью ДНК, кодирующей одну или более полипептидных цепей молекулы антитела. Соответственно, гуманизированная форма не являющегося человеческим антитела (или его фрагмента) представляет собой химерное антитело или цепь антитела (или ее фрагмент, такой как sFv, Fv, Fab, Fab', F(ab')2 или другая антигенсвязывающая часть антитела), которая содержит часть сайта связывания антигена из не являющегося человеческим (донорного) антитела, встроенную в каркас антитела человека (реципиентного антитела).
[0080] Для получения гуманизированного антитела, остатки из одной или более определяющих комплементарность областей (CDR) реципиентной (человеческой) молекулы антитела заменяют на остатки из одного или более CDR донорной (не являющейся человеческой) молекулы антитела, у которой, как известно, есть желательные свойства связывания антигена (например, некоторый уровень специфичности и аффинности к целевому антигену). В некоторых случаях, каркасные остатки Fv (FR) антитела человека заменяют на соответствующие не являющиеся человеческими остатки. Гуманизированные антитела могут также содержать остатки, которые не обнаруживают ни в реципиентном антителе, ни в донорных последовательностях CDR или каркаса. Как правило, гуманизированное антитело содержит один или более аминокислотных остатков, внедренных в него, из источника, который не является человеческим. На практике, гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и необязательно некоторые остатки FR заменены на остатки из аналогичных сайтов в антителах грызунов. Гуманизированные антитела, как правило, содержат по меньшей мере часть константной области (Fc) антитела, обычно таковую из антитела человека (Jones et al., Nature, 321:522-525 (1986), Reichmann et al., Nature, 332:323-327 (1988), и Presta, Curr. Opin. Struct. Biol, 2:593-596 (1992)).
[0081] Способы гуманизирования не являющихся человеческими антител хорошо известны в данной области техники. Например, гуманизированные антитела можно получить в соответствии со способами, описанными Winter и коллегами (Jones et al., Nature, 321:522-525 (1986), Riechmann et al., Nature, 332:323-327 (1988), Verhoeyen et al., Science, 239:1534-1536 (1988)), путем замены CDR грызуна или последовательностей CDR на соответствующие последовательности из антитела человека. Способы, которые можно применять для получения гуманизированных антител, также описаны в патенте США №4,816,567 (Cabilly et al.), патенте США №5,565,332 (Hoogenboom et al.), патенте США №5,721,367 (Kay et al.), патенте США №5,837,243 (Deo et al.), патенте США №5,939,598 (Kucherlapati et al.), патенте США №6,130,364 (Jakobovits et al.) и патенте США №6,180,377 (Morgan et al.)
Антитела против SEMA4D.
[0082] В одном аспекте ингибитор иммунорегуляторной молекулы может представлять собой ингибитор SEMA4D - пепинемаб (антитело против SEMA4D), такой как описанные в US 8496938, US 8816058, US 9605055 и US 9676840, патентах, которые включены в данную заявку посредством ссылки как описывающие антитела против SEMA4D (против DC100). Были разработаны моноклональные антитела против SEMA4D, чтобы нейтрализовать SEMA4D, включая MAb 67, MAb 2503 и MAb 76.
[0083] Антитела, которые связывают SEMA4D, были описаны в данной области техники. См., например, публикацию заявки на патент США №2008/0219971 А1, международную заявку на патент WO 93/14125 и Herold et at, Int. Immunol. 7(1): 1-8 (1995), каждая из которых полностью включена в настоящую заявку посредством ссылки.
[0084] Антитела против SEMA4D или их антигенсвязывающие фрагменты, варианты или производные могут включать, например, MAb 2503, MAb 67 или MAb 76. В некоторых вариантах реализации антитела против SEMA4D связывают SEMA4D человека, мыши или как человека, так и мыши. В других вариантах реализации антитела против SEMA4D блокируют связывание SEMA4D с его рецептором, например, плексином-В1 или плексином-В2.
[0085] Понятно и предполагается в настоящей заявке, что в описанную противораковую комбинированную терапию и способы лечения, ингибирования, уменьшения и/или предотвращения рака с применением указанной противораковой комбинированной терапии может входить более чем один ингибитор иммунорегуляторной молекулы и более чем одна популяция нагруженных дендритных клеток, причем каждая популяция нагруженных дендритных клеток нагружена одним и тем же или различными онкодрайверами.
[0086] Термин «субъект» относится к любому индивиду, который является мишенью введения или лечения. Субъектом может быть позвоночное, например, млекопитающее. В одном аспекте субъект может представлять собой человека, не являющегося человеком примата, бычьего, лошадиного, свиного, псового или кошачьего. Субъект также может представлять собой морскую свинку, крысу, хомяка, кролика, мышь или крота. Таким образом, субъект может представлять собой человека или ветеринарного пациента. Термин «пациент» относится к субъекту, которого лечит клиницист, например, врач.
[0087] Термин «терапевтически эффективный» относится к используемому количеству композиции, которого достаточно для снижения выраженности одной или более причин или симптомов заболевания или расстройства. Такое снижение выраженности требует лишь уменьшения или изменения, не обязательно устранения.
[0088] Термин «лечение» относится к медицинскому ведению пациента с целью лечения, снижения выраженности, стабилизации или предотвращения заболевания, патологического состояния или расстройства. Данный термин включает активное лечение, то есть, лечение, направленное, в частности, на улучшение заболевания, патологического состояния или расстройства, а также включает этиологическое лечение, то есть, лечение, направленное на устранение причины связанного заболевания, патологического состояния или расстройства. Кроме того, данный термин включает паллиативное лечение, то есть, лечение, разработанное скорее для снятия симптомов, чем для лечения заболевания, патологического состояния или расстройства; профилактическое лечение, то есть, лечение, направленное на минимизирование или частичное или полное подавление развития связанного заболевания, патологического состояния или расстройства; и поддерживающее лечение, то есть, лечение, используемое в дополнение к другой специфичной терапии, направленной на улучшение связанного заболевания, патологического состояния или расстройства.
[0089] В одном аспекте, понятно и предполагается в настоящей заявке, что нагруженные дендритные клетки можно активировать перед введением, а также перед нагрузкой онкодрайвером. Активации дендритных клеток (ДК1) можно добиться путем приведения в контакт указанных клеток с IFN-γ, TNFα, CD40, IL21 и/или IL-12. В одном аспекте, дополнительно понятно, что собственные дендритные клетки субъекта можно удалить и нагрузить ex vivo, а затем перенести обратно в организм субъекта для применения в описанной противораковой комбинированной терапии для лечения, предотвращения, уменьшения и/или ингибирования рака.
[0090] Понятно и предполагается в настоящей заявке, что описанную противораковую комбинированную терапию можно вводить любым путем, который сочтет подходящим лечащий врач. «Введение» субъекту включает любой путь введения или доставки агента субъекту, местно и/или системно. Введение можно осуществить с помощью любого подходящего пути, включая пероральный, топический, внутривенный, подкожный, чрескожный, трансдермальный, внутримышечный, внутрисуставный, парентеральный путь, внутрь артериол, внутрикожный, интравентрикулярный, интракраниальный, интраперитонеальный, внутриочаговый, интраназальный, ректальный, вагинальный путь, посредством ингаляции, посредством имплантированной емкости, парентеральный путь (например, методики подкожных, внутривенных, внутримышечных, внутрисуставных, интрасиновиальных, внутриопухолевых, внутристернальных, интратекальных, интраперитонеальных, внутрипеченочных, внутриочаговых и интракраниальных инъекций или инфузий), и тому подобные пути. «Совместное введение», «введение в комбинации», «одновременное введение» или «вводили одновременно» в настоящей заявке означает, что соединения вводят в один момент времени или по существу незамедлительно друг за другом. В последнем из упомянутых случаев два соединения вводят в достаточно близкие моменты времени, чтобы наблюдаемые результаты были неотличимы от результатов, достигнутых, когда указанные соединения вводят в один момент времени. «Системное введение» относится к введению или доставке агента субъекту посредством пути, который позволяет ввести или доставить агент в обширные области организма субъекта (например, более чем в 50% организма), например, посредством проникновения в систему кровообращения или лимфатическую систему. Напротив, «местное введение» относится к введению или доставке агента субъекту посредством пути, который позволяет ввести или доставить агент в область введения или в область, расположенную непосредственно рядом с местом введения, и не вводит агент системно в терапевтически значимом количестве. Например, введенные местно агенты легко детектируются поблизости от места введения, но не детектируются или детектируются в незначительных количествах в отдаленных областях организма субъекта. Введение включает введение самим субъектом и введение другим субъектом. В одном аспекте настоящего изобретения предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых по меньшей мере один ингибитор иммунорегуляторной молекулы вводят системно, и/или нагруженную онкодрайвером дендритную клетку вводят внутрь опухоли.
[0091] Понятно и предполагается в настоящей заявке, что хотя однократное введение компонентов описанной противораковой комбинированной терапии (т.е., нагруженных дендритных клеток и/или ингибитора иммунорегуляторной молекулы) будет идеальным, не каждый пациент будет отвечать одинаковым образом. Таким образом, в одном аспекте настоящего изобретения предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак; в которых по меньшей мере одну нагруженную дендритную клетку вводят по меньшей мере 1, 2, 3,4, 5,6,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 раза в день или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 раз в неделю в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 дней, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 недель. В соответствии с настоящим изобретением также предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак, в соответствии с любым предшествующим аспектом; в которых по меньшей мере один ингибитор иммунорегуляторной молекулы вводят по меньшей мере 1, 2, 3, 4, 5, 6,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 раза в день или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 раз в неделю в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 дней, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 недель. Дополнительно понятно и предполагается в настоящей заявке, что порядок и продолжительность введения компонентов может изменяться подходящим образом в зависимости от субъекта, которого лечат. В одном аспекте настоящего изобретения предложены способы противораковой комбинированной терапии, которые лечат, предотвращают, уменьшают и/или ингибируют рак; в которых нагруженные дендритные клетки вводят по меньшей мере за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36 часов, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21, 28, 30, 31, 45 дней, 2, 3, 4, 5 или 6 месяцев до введения по меньшей мере одного ингибитора иммунорегуляторной молекулы; вводят одновременно с по меньшей мере одним ингибитором иммунорегуляторной молекулы; или в которых по меньшей мере один ингибитор иммунорегуляторной молекулы вводят по меньшей мере за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36 часов, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21, 28, 30, 31, 45 дней, 2, 3, 4, 5 или 6 месяцев до введения нагруженных дендритных клеток.
[0092] Как отмечено выше, в настоящей заявке предполагается, что описанные способы лечения, ингибирования, уменьшения и/или предотвращения рака можно дополнить любым терапевтическим лечением рака, включая, но не ограничиваясь хирургическим, рентгенологическим и/или фармацевтическим лечением рака. В настоящей заявке «хирургическое лечение» относится к иссечению опухоли с помощью любых средств, известных в данной области техники. Аналогично, «фармацевтическое лечение» относится к введению любого противоракового агента, известного в данной области техники, включая, но не ограничиваясь перечисленными агентами: Абемациклиб, Абиратерон Ацетат, Абитрексат (Метотрексат), Абраксан (состав со стабилизированными альбумином наночастицами паклитаксела), ABVD, ABVE, ABVE-PC, АС, АС-Т, Адцетрис (Брентуксимаб ведотин), ADE, Адо-трастузумаба эмтанзин, Адриамицин (Доксорубицина гидрохлорид), Афатиниба дималеат, Афинитор (Эверолимус), Акинзео (Нетупитант и Палоносетрона гидрохлорид), Алдара (Имихимод), Альдеслейкин, Алеценза (Алектиниб), Алектиниб, Алемтузумаб, Алимта (Пеметрексед динатрия), Аликвопа (Копанлисиба гидрохлорид), Алкеран для инъекций (Мелфалана гидрохлорид), Алкеран в таблетках (Мелфалан), Алокси (Палоносетрона гидрохлорид), Алунбриг (Бригатиниб), Амбохлорин (Хлорамбуцил), Амбоклорина хлорамбуцил, Амифостин, аминолевулиновая кислота, Анастрозол, Апрепитант, Аредиа (Памидронат динатрия), Аримидекс (Анастрозол), Аромазин (Эксеместан), Арранон (Неларабин), триоксид мышьяка, Арзерра (Офатумумаб), Аспарагиназа Erwinia chrysanthemi, Атезолизумаб, Авастин (Бевацизумаб), Авелумаб, Акситиниб, Азацитидин, Бавенсио (Авелумаб), ВЕАСОРР, Беценум (Кармустин), Белеодак (Белиностат), Белиностат, Бендамустина гидрохлорид, ВЕР, Беспонса (Инотузумаба озогамицин), Бевацизумаб, Бексаротен, Бексксар (Тозитумомаб и йод I 131 Тозитумомаб), Бикалутамид, BiCNU (Кармустин), Блеомицин, Блинатумомаб, Блинцито (Блинатумомаб), Бортезомиб, Бозулиф (Бозутиниб), Бозутиниб, Брентуксимаб ведотин, Бригатиниб, BuMel, Бусульфан, Бусулфекс (Бусульфан), Кабазитаксел, Кабометикс (Кабозантиниба S-малат), Кабозантиниба S-малат, CAF, Кэмпас (Алемтузумаб), Камптозар (Иринотекана гидрохлорид), Капецитабин, САРОХ, Карак (Фторурацил топический), Карбоплатин, КАРБОПЛАТИН-ТАКСОЛ, Карфилзомиб, Кармубрис (Кармустин), Кармустин, Кармустин имплант, Касодекс (Бикалутамид), СЕМ, Церитиниб, Церубидин (Даунорубицина гидрохлорид), Церварикс (рекомбинантная бивалентная вакцина против ВПЧ), Цетуксимаб, CEV, Хлорамбуцил, ХЛОРАМБУЦИЛ-ПРЕДНИЗОН, CHOP, Цисплатин, Кладрибин, Клафен (Циклофосфамид), Клофарабин, Клофорекс (Клофарабин), Клолар (Клофарабин), CMF, Кобиметиниб, Кометрик (Кабозантиниба S-малат), Копанлисиба гидрохлорид, COPDAC, СОРР, COPP-ABV, Космеген (Дактиномицин), Котеллик (Кобиметиниб), Кризотиниб, CVP, Циклофосфамид, Цифос (Ифосфамид), Цирамза (Рамуцирумаб), Цитарабин, Цитарабин липосомальный, Цитозар-U (Цитарабин), Цитоксан (Циклофосфамид), Дабрафениб, Дакарбазин, Дакоген (Децитабин), Дактиномицин, Даратумумаб, Дарзалекс (Даратумумаб), Дазатиниб, Даунорубицина гидрохлорид, Даунорубицина гидрохлорид и Цитарабин липосомальный, Децитабин, Дефибротид натрия, Дефителио (Дефибротид натрия), Дегареликс, Денилейкин Дифтитокс, Деносумаб, Депоцит (Цитарабин липосомальный), Дексаметазон, Дексразоксана гидрохлорид, Динутуксимаб, Доцетаксел, Доксил (Доксорубицина гидрохлорид липосомальный), Доксорубицина гидрохлорид, Доксорубицина гидрохлорид липосомальный, Dox-SL (Доксорубицина гидрохлорид липосомальный), DTIC-Dome (Дакарбазин), Дурвалумаб, Эфудекс (Фторурацил топический), Элитек (Расбуриказа), Элленс (Эпирубицина гидрохлорид), Элотузумаб, Элоксатин (Оксалиплатин), Элтромбопаг оламин, Эменд (Апрепитант), Эмплисити (Элотузумаб), Энасидениба мезилат, Энзалутамид, Эпирубицина гидрохлорид, EPOCH, Эрбитукс (Цетуксимаб), Эрибулина мезилат, Эриведж (Висмодегиб), Эрлотиниба гидрохлорид, Эрвиназа (Аспарагиназа Erwinia chrysanthemi), Этиол (Амифостин), Этопофос (Этопозида фосфат), Этопозид, Этопозида фосфат, Эвацет (Доксорубицина гидрохлорид липосомальный), Эверолимус, Эвиста (Ралоксифена гидрохлорид), Эвомела (Мелфалана гидрохлорид), Эксеместан, 5-FU (Фторурацил для инъекций), 5-FU (Фторурацил топический), Фарестон (Торемифен), Фаридак (Панобиностат), Фазлодекс (Фулвестрант), FEC, Фемара (Летрозол), Филграстим, Флудара (Фосфат флударабина), Фосфат флударабина, Флуороплекс (Фторурацил топический), Фторурацил для инъекций, Фторурацил топический, Флутамид, Фолекс (Метотрексат), Фолекс PFS (Метотрексат), FOLFIPJ, FOLFIPJ-БЕВАЦИЗУМАБ, FOLFIRI-ЦЕТУКСИМАБ, FOLFIRINOX, FOLFOX, Фолотин (Пралатрексат), FU-LV, Фулвестрант, Гардасил (рекомбинантная четырехвалентная вакцина против ВПЧ), Гардасил 9 (Рекомбинантная девятивалентная вакцина против ВПЧ), Газива (Обинутузумаб), Гефитиниб, Гемцитабина гидрохлорид, ГЕМЦИТАБИН-ЦИСПЛАТИН, ГЕМЦИТАБИН-ОКСАЛИПЛАТИН, Гемтузумаба озогамицин, Гемзар (Гемцитабина гидрохлорид), Гилотриф (Афатиниба дималеат), Гливек (Иматиниб Мезилат), Глиадел (Кармустин имплант), Глиадел вафер (Кармустин имплант), Глюкарпидаза, Гозерелина ацетат, Халавен (Эрибулина мезилат), Гемангеол (Пропранолола гидрохлорид), Герцептин (Трастузумаб), рекомбинантная бивалентная вакцина против ВПЧ, рекомбинантная девятивалентная вакцина против ВПЧ, рекомбинантная четырехвалентная вакцина против ВПЧ, Гикамтин (Топотекана гидрохлорид), Гидреа (Гидроксимочевина), гидроксимочевина, гипер-CVAD, Ибранс (Палбоциклиб), Ибритумомаба тиуксетан, Ибрутиниб, ICE, Иклусиг (Понатиниба гидрохлорид), Идамицин (Идарубицина гидрохлорид), Идарубицина гидрохлорид, Иделалисиб, Идхифа (Энасидениба мезилат), Ифекс (Ифосфамид), Ифосфамид, Ifosfamidum (Ифосфамид), IL-2 (Альдеслейкин), Иматиниба мезилат, Имбрувика (Ибрутиниб), Имфинзи (Дурвалумаб), Имихимод, Имлигик (Талимогена лагерпарепвек), Инлита (Акситиниб), Инотузумаба озогамицин, интерферон альфа-2b, рекомбинантный, интерлейкин-2 (Альдеслейкин), Интрон А (рекомбинантный интерферон альфа-2b), йод I 131 Тозитумомаб и Тозитумомаб, Ипилимумаб, Иресса (Гефитиниб), Иринотекана гидрохлорид, Иринотекана гидрохлорид липосомальный, Истодакс (Ромидепсин), Иксабепилон, Иксазомиба цитрат, Икземпра (Иксабепилон), Джакафи (Руксолитиниба фосфат), JEB, Джевтана (Кабазитаксел), Кадсила (Адо-трастузумаба эмтанзин), Кеоксифен (Ралоксифена гидрохлорид), Кепиванс (Палифермин), Китруда (Пембролизумаб), Кискали (Рибоциклиб), Кимрия (Тисагенлеклейсел), Кипролис (Карфилзомиб), Ланреотида ацетат, Дитозилат лапатиниба, Лартруво (Оларатумаб), Леналидомид, Ленватиниба мезилат, Ленвима (Ленватиниба мезилат), Летрозол, Лейковорин кальция, Лейкеран (Хлорамбуцил), Лейпролида ацетат, Лейстатин (Кладрибин), Левулан (Аминолевулиновая кислота), Линфолизин (Хлорамбуцил), Липодокс (Доксорубицина гидрохлорид липосомальный), Ломустин, Лонсурф (Трифлуридин и Типирацила гидрохлорид), Люпрон (Лейпролида ацетат), Люпрон депо (Лейпролида ацетат), Люпрон депо-пед (Лейпролида ацетат), Линпарза (Олапариб), Марквибо (Винкристина сульфат липосомальный), Матулан (Прокарбазина гидрохлорид), Мехлоретамина гидрохлорид, Мегестрола ацетат, Мекинист (Траметиниб), Мелфалан, Мелфалана гидрохлорид, Меркаптопурин, Месна, Меснекс (Месна), Метазоластон (Темозоломид), Метотрексат, Метотрексат LPF (Метотрексат), Метилналтрексона бромид, Мексат (Метотрексат), Мексат-AQ (Метотрексат), Мидостаурин, Митомицин С, Митоксантрона гидрохлорид, Митозитрекс (Митомицин С), МОРР, Мозобаил (Плериксафор), Мустарген (Мехлоретамина гидрохлорид), Мутамицин (Митомицин С), Милеран (Бусульфан), Милосар (Азацитидин), Милотарг (Гемтузумаба озогамицин), наночастицы паклитаксела (состав со стабилизированными альбумином наночастицами паклитаксела), Навельбин (Винорелбина тартрат), Нецитумумаб, Неларабин, Неосар (Циклофосфамид), Нератиниба малеат, Нерлинкс (Нератиниба малеат), Нетупитант и Палоносетрона гидрохлорид, Неуласта (Пегфилграстим), Нейпоген (Филграстим), Нексавар (Сопафениба тозилат), Ниландрон (Нилутамид), Нилотиниб, Нилутамид, Нинларо (Иксазомиба цитрат), Нирапариба тозилат моногидрат, Ниволумаб, Нолвадекс (Тамоксифена цитрат), Энплейт (Ромиплостим), Обинутузумаб, Одомзо (Сонидегиб), ОЕРА, Офатумумаб, OFF, Олапариб, Оларатумаб, Омацетаксина мепесукцинат, Онкаспар (Пэгаспаргаза), Ондансетрона гидрохлорид, Онивайд (Иринотекана гидрохлорид липосомальный), Онтак (Денилейкина дифтитокс), Опдиво (Ниволумаб), ОРРА, Осимертиниб, Оксалиплатин, Паклитаксел, состав со стабилизированными альбумином наночастицами паклитаксела, PAD, Палбоциклиб, Палифермин, Палоносетрона гидрохлорид, Палоносетрона гидрохлорид и Нетупитант, Памидронат динатрия, Панитумумаб, Панобиностат, Параплат (Карбоплатин), Параплатин (Карбоплатин), Пазопаниба гидрохлорид, PCV, РЕВ, Пэгаспаргаза, Пегфилграстим, Пэгинтерферон альфа-2b, ПЭГ-интрон (Пэгинтерферон альфа-2b), Пембролизумаб, Пеметрексед динатрия, Перьета (Пертузумаб), Пертузумаб, Платинол (Цисплатин), Платинол-AQ (Цисплатин), Плериксафор, Помалидомид, Помалист (По мал ид о мид), Понатиниба гидрохлорид, Портрацца (Нецитумумаб), Пралатрексат, Преднизон, Прокарбазина гидрохлорид, Пролейкин (Альдеслейкин), Пролиа (Деносумаб), Промакта (Элтромбопаг оламин), Пропранолола гидрохлорид, Провенж (Сипулейцел-Т), Пуринтол (Меркаптопурин), Пуриксан (Меркаптопурин), Радия 223 дихлорид, Ралоксифена гидрохлорид, Рамуцирумаб, Расбуриказа, R-CHOP, R-CVP, рекомбинантная бивалентная вакцина против вируса папилломы человека (ВПЧ), рекомбинантная девятивалентная вакцина против вируса папилломы человека (ВПЧ), рекомбинантная четырехвалентная вакцина против вируса папилломы человека (ВПЧ), рекомбинантный интерферон альфа-2b, Регорафениб, Релистор (Метилналтрексона бромид), R-EPOCH, Ревлимид (Леналидомид), Ревматрекс (Метотрексат), Рибоциклиб, R-ICE, Ритуксан (Ритуксимаб), Ритуксан хицела (Ритуксимаб и Гиалуронидаза человека), Ритуксимаб, Ритуксимаб и Гиалуронидаза человека, Ролапитанта гидрохлорид, Ромидепсин, Ромиплостим, Рубидомицин (Даунорубицина гидрохлорид), Рубрака (Рукапариба камсилат), Рукапариба камсилат, Руксолитиниба фосфат, Ридапт (Мидостаурин), Склерозол внутриплевральный аэрозоль (тальк), Силтуксимаб, Сипулейцел-Т, Соматулин депо (Ланреотида ацетат), Сонидегиб, Сопафениба тозилат, Спрайсел (Дазатиниб), STANFORD V, стерильный порошок талька (тальк), Стеритальк (Тальк), Стиварга (Регорафениб), Сунитиниба малат, Сутент (Сунитиниба малат), Силатрон (пэгинтерферон альфа-2b), Силвант (Силтуксимаб), Синрибо (Омацетаксин Мепесукцинат), Таблоид (Тиогуанин), ТАС, Тафинлар (Дабрафениб), Тагриссо (Осимертиниб), тальк, Талимогена лагерпарепвек, Тамоксифена цитрат, Тарабин PFS (Цитарабин), Тарцева (Эрлотиниба гидрохлорид), Таргретин (Бексаротен), Тасигна (Нилотиниб), Таксол (Паклитаксел), Таксотер (Доцетаксел), Тецентрик (Атезолизумаб), Темодар (Темозоломид), Темозоломид, Темсиролимус, Талидомид, Таломид (Талидомид), Тиогуанин, Тиотепа, Тисагенлеклейсел, Толак (фторурацил топический), Топотекана гидрохлорид, Торемифен, Торизел (Темсиролимус), Тозитумомаб и йод I 131 Тозитумомаб, Тотект (Дексразоксана гидрохлорид), TPF, Трабектедин, Траметиниб, Трастузумаб, Треанда (Бендамустина гидрохлорид), Трифлуридин и Типирацила гидрохлорид, Трисенокс (Триоксид мышьяка), Тайкерб (Дитозилат лапатиниба), Унитуксин (Динутуксимаб), уридина триацетат, VAC, Вандетаниб, VAMP, Варуби (Ролапитанта гидрохлорид), Вектибикс (Панитумумаб), VeIP, Велбан (Винбластина сульфат), Велкейд (Бортезомиб), Велсар (Винбластина сульфат), Вемурафениб, Венклекста (Венетоклакс), Венетоклакс, Верзенио (Абемациклиб), Виадур (Лейпролида ацетат), Вайдаза (Азацитидин), Винбластина сульфат, Винказар PFS (Винкристина сульфат), Винкристина сульфат, Винкристина сульфат липосомальный, Винорелбина тартрат, VIP, Висмодегиб, Вистогард (уридина триацетат), Вораксаза (Глюкарпидаза), Вориностат, Вотриент (Пазопаниба гидрохлорид), Виксеос (Даунорубицина гидрохлорид и Цитарабин липосомальный), Веллковорин (Лейковорин кальция), Ксалкори (Кризотиниб), Кселода (Капецитабин), XELIRI, XELOX, Эксджива (Деносумаб), Ксофиго (радия 223 дихлорид), Кстанди (Энзалутамид), Ервой (Ипилимумаб), Йонделис (Трабектедин), Залтрап (Зив-афлиберцепт), Зарксио (Филграстим), Зейджула (Нирапариба тозилата моногидрат), Зелбораф (Вемурафениб), Зевалин (Ибритумомаба тиуксетан), Зинекард (Дексразоксана гидрохлорид), Зив-афлиберцепт, Зофран (Ондансетрона гидрохлорид), Золадекс (Гозерелина ацетат), золедроновая кислота, Золинза (Вориностат), Зомета (Золедроновая кислота), Зиделиг (Иделалисиб), Зикадия (Церитиниб) и/или Зитига (Абиратерона ацетат). Также в настоящей заявке предложены химиотерапевтические средства, которые представляют собой ингибиторы блокаторов PD1/PDL1 (такие как, например, ламбролизумаб, ниволумаб, пембролизумаб, пидилизумаб, BMS-936559, атезолизумаб, дурвалумаб или авелумаб).
Фармацевтические носители/доставка фармацевтических продуктов.
[0093] Выше описано, что композиции также можно вводить in vivo в фармацевтически приемлемом носителе. Под «фармацевтически приемлемым» подразумевают материал, который не является биологически или иным образом нежелательным, т.е., указанный материал можно вводить субъекту вместе с нуклеиновой кислотой или вектором, не вызывая каких-либо нежелательных биологических эффектов, или без взаимодействия вредным образом с любыми из других компонентов фармацевтической композиции, в которой оно содержится. Носитель, естественно, будут выбирать, чтобы минимизировать какую-либо деградацию активного ингредиента и минимизировать любые нежелательные побочные действия у субъекта, что будет хорошо известно специалисту в данной области техники.
[0094] Композиции можно вводить перорально, парентерально (например, внутривенно), путем внутримышечной инъекции, путем интраперитонеальной инъекции, трансдермально, экстракорпорально, топически или тому подобными путями, включая топическое интраназальное введение или введение с помощью ингалятора. В настоящей заявке «топическое интраназальное введение» означает доставку композиций в нос и носовые ходы через одну или обе ноздри и может включать доставку с помощью механизма распыления или механизма закапывания, или посредством аэрозольного распыления нуклеиновой кислоты или вектора. Введение композиций с помощью ингалятора можно осуществить через нос или рот путем доставки с помощью механизма распыления или механизма закапывания. Доставку также можно осуществить непосредственно в любую область респираторной системы (например, в легкие) путем интубации. Точное необходимое количество композиций будет изменяться от субъекта к субъекту, в зависимости от вида, возраста, массы тела и общего состояния субъекта, тяжести аллергического расстройства, которое лечат, конкретной используемой нуклеиновой кислоты или вектора, способа введения и тому подобных факторов. Таким образом, невозможно установить точное количество каждой композиции. Тем не менее, подходящее количество может определить средний специалист в данной области техники путем лишь проведения обычного исследования, учитывая идею, описанную в данной заявке.
[0095] Парентеральное введение композиции, если ее применяют, как правило, осуществляют путем инъекции. Инъецируемые формы можно получить в виде обычных форм, либо в виде жидких растворов или суспензий, либо в виде твердых форм, подходящих для растворения суспензии в жидкости перед инъекцией, либо в виде эмульсий. Совсем недавно измененный подход к парентеральному введению включает применение системы медленного высвобождения или продолжительного высвобождения, такой что поддерживается постоянная дозировка. См., например, патент США №3,610,795, описание которого включено в данную заявку посредством ссылки.
[0096] Материалы могут находиться в растворе, суспензии (например, включены в микрочастицы, липосомы или клетки). Они могут быть нацелены на конкретный тип клеток с помощью антител, рецепторов или лигандов рецепторов. В следующих ссылочных материалах приведены примеры применения данной технологии для нацеливания специфичных белков на опухолевую ткань (Senter, et al., Bioconjugate Chem., 2:447-451, (1991); Bagshawe, K.D., Br. J. Cancer, 60:275-281, (1989); Bagshawe, et al., Br. J. Cancer, 58:700-703, (1988); Senter, et al., Bioconjugate Chem., 4:3-9, (1993); Battelli, et al., Cancer Immunol. Immunother., 35:421-425, (1992); Pietersz и McKenzie, Immunolog. Reviews, 129:57-80, (1992); и Roffler, et al., Biochem. Pharmacol, 42:2062-2065, (1991)). Носители, такие как липосомы-невидимки («stealth») и другие конъюгированные с антителами липосомы (включая опосредованное липидами нацеливание лекарственного средства на карциному кишечника), опосредованное рецептором нацеливание ДНК с помощью специфичных для клетки лигандов, направленное лимфоцитами нацеливание на опухоль и высокоспецифичное нацеливание терапевтическим ретровирусом на клетки глиомы мыши in vivo. В следующих ссылочных материалах приведены примеры применения данной технологии для нацеливания специфичных белков на опухолевую ткань (Hughes et al., Cancer Research, 49:6214-6220, (1989); и Litzinger и Huang, Biochimica et Biophysica Acta, 1104:179-187, (1992)). Обычно, рецепторы участвуют в путях эндоцитоза, либо конститутивных, либо индуцированных лигандом. Данные рецепторы кластеризуются в ямки, окаймленные клатрином, проникают в клетку посредством покрытых клатрином везикул, проходят через кислую эндосому, в которой рецепторы сортируются, а затем либо возвращаются на поверхность клетки, либо запасаются внутри клетки, либо деградируют в лизосомах. Пути интернализации служат для различных функций, таких как поглощение питательных веществ, удаление активированных белков, клиренс макромолекул, проникновение условно-патогенных вирусов и токсинов, диссоциация и деградация лиганда и регуляция на уровне рецептора. Множество рецепторов следуют более чем одному внутриклеточному пути в зависимости от типа клеток, концентрации рецептора, типа лиганда, валентности лиганда и концентрации лиганда. Молекулярные и клеточные механизмы рецептор-опосредованного эндоцитоза были описаны (Brown и Greene, DNA and Cell Biology 10:6, 399-409(1991)).
Фармацевтически приемлемые носители.
[0097] Композиции, включая антитела, можно применять для терапии в комбинации с фармацевтически приемлемым носителем.
[0098] Подходящие носители и их составы описаны в Remington: The Science and Practice of Pharmacy (19 oe изд.) ред. A.R. Gennaro, Mack Publishing Company, Истон, Пенсильвания 1995. Обычно, подходящее количество фармацевтически приемлемой соли используют в составе, чтобы сделать состав изотоническим. Примеры фармацевтически приемлемого носителя включают, но не ограничены солевым раствором, раствором Рингера и раствором декстрозы. рН раствора составляет предпочтительно от приблизительно 5 до приблизительно 8 и более предпочтительно от приблизительно 7 до приблизительно 7,5. Дополнительные носители включают препараты с замедленным высвобождением, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, указанные матрицы находятся в виде формованных изделий, например, пленок, липосом или микрочастиц. Для специалистов в данной области должно быть понятно, что некоторые носители могут быть более предпочтительными в зависимости, например, от пути введения и концентрации композиции, которую вводят.
[0099] Фармацевтические носители известны специалистам в данной области техники. Они чаще всего будут представлять собой стандартные носители для введения лекарственных средств людям, включая растворы, такие как стерильная вода, солевой раствор и буферные растворы при физиологическом рН. Композиции можно вводить внутримышечно или подкожно. Другие соединения будут вводить в соответствии со стандартными процедурами, используемыми специалистами в данной области техники.
[0100] Фармацевтические композиции могут содержать носители, загустители, разбавители, буферы, консерванты, поверхностно-активные агенты и тому подобные агенты, дополнительно к выбранной молекуле. Фармацевтические композиции также могут содержать один или более активных ингредиентов, таких как противомикробные агенты, противовоспалительные агенты, анестезирующие средства и тому подобные агенты.
[0101] Фармацевтическую композицию можно вводить множеством путей в зависимости от того, желательно ли местное или системное лечение, и от области, которую лечат. Введение может быть топическим (включая офтальмическое, вагинальное, ректальное, интраназальное введение), пероральным, посредством ингаляции или парентеральным, например, с помощью внутривенной капельницы, подкожной, интраперитонеальной или внутримышечной инъекции. Описанные антитела можно вводить внутривенно, интраперитонеально, внутримышечно, подкожно, внутрь полости или трансдермально.
[0102] Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей представляют собой про пиле нгликоль, полиэтиле нгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевой раствор и буферные среды. Среды для парентерального введения включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла. Среды для внутривенного введения включают восполнители жидкости и питательных веществ, восполнители электролитов (такие как на основе декстрозы Рингера), и тому подобные агенты. Также могут присутствовать консерванты и другие вспомогательные вещества, такие как, например, противомикробные средства, антиоксиданты, хелатирующие агенты и инертные газы, и тому подобные вещества.
[0103] Составы для топического введения могут включать мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимы или желательны обычные фармацевтические носители, водные, порошковые или маслянистые основы, загустители и тому подобные агенты.
[0104] Композиции для перорального введения включают порошки или гранулы, суспензии или растворы в водных или неводных средах, капсулы, саше или таблетки. Могут потребоваться загустители, ароматизаторы, разбавители, эмульгаторы, диспергирующие вспомогательные средства или связующие вещества.
[0105] Некоторые из композиций потенциально можно вводить в виде фармацевтически приемлемой соли присоединения кислоты или основания, образованной путем реакции с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, перхлорная кислота, азотная кислота, тиоциановая кислота, серная кислота и фосфорная кислота, и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота и фумаровая кислота, или путем реакции с неорганическим основанием, таким как гидроксид натрия, гидроксид аммония, гидроксид калия, и органическими основаниями, такими как моно-, ди-, триалкил- и ариламины и содержащие заместители этаноламины.
Терапевтические применения.
[0106] Эффективные дозировки и схемы введения композиций можно определить опытным путем, и их определение входит в рамки компетенции в данной области техники. Диапазоны дозировок для введения композиций представляют собой диапазоны, достаточно большие для получения желательного эффекта, при котором оказывается влияние на симптомы расстройства. Дозировка не должна быть такой большой, чтобы вызывать нежелательные побочные действия, такие как нежелательные перекрестные реакции, анафилактические реакции и тому подобное. Как правило, дозировка будет изменяться в зависимости от возраста, состояния, пола и степени заболевания у пациента, пути введения или того, входят ли другие лекарственные средства в схему приема, и ее может определить специалист в данной области техники. Дозировку может скорректировать лечащий врач в случае любых противопоказаний. Дозировка может изменяться, и можно вводить ее одной или более введениями доз ежедневно, в течение одного или нескольких дней. В литературе можно найти руководство по подходящим дозировкам для данных классов фармацевтических продуктов. Например, руководство по выбору подходящих доз антител можно найти в литературе по терапевтическим применениям антител, например, в Handbook of Monoclonal Antibodies, Ferrone et al., eds., Noges Publications, Park Ridge, N.J., (1985) ch. 22 and pp.303-357; Smith et al., Antibodies in Human Diagnosis and Therapy, Haber et al., eds., Raven Press, New York (1977) pp.365-389. Обычная суточная дозировка антитела, применяемого отдельно, может находится в диапазоне приблизительно от 1 мкг/кг до 100 мг/кг массы тела или более в день, в зависимости от упомянутых выше факторов.
Примеры
[0107] Следующие примеры предложены для того, чтобы предоставить средним специалистам в данной области техники полное раскрытие и описание того, как соединения, композиции, изделия, устройства и/или способы, заявленные в настоящей заявке, получают и оценивают, и предполагается, что они лишь являются примерами и не предполагают ограничения настоящего изобретения. Были предприняты попытки обеспечить достоверность в отношении чисел (например, количеств, температуры и т.д.), но следует учитывать некоторые ошибки и отклонения. Если не указано иное, части представляют собой части по массе, температура указана в °С или находится на уровне температуры окружающей среды и давление близко или равно атмосферному.
Пример 1. Ответы Th1 против онкодрайвера при раке молочной железы.
[0108] Большинство опухолей молочной железы экспрессируют онкодрайверы, включая HER2, EGFR (ER+ и ТНРМЖ), С-МЕТ (ТНРМЖ) и HER3 (ER+, HER2 и ТНРМЖ). Данные онкодрайверы или нисходящие от них сигнальные пути часто являются мишенями для множества лекарств, и пациентов с метастатическим раком молочной железы (мРМЖ) часто лечат направленными агентами, такими как антиэстрогены, ингибиторы CDK4/6, нацеленные на HER2 лекарственные средства и ингибиторы АКТ. Большинство из данных пациентов, тем не менее, становятся нечувствительны к лекарственным средствам или перестают отвечать на терапию, и их заболевание прогрессирует. Таким образом, данные пациенты нуждаются в дополнительных методах лечения. Лекарственные средства, направленные на контрольные точки, показали перспективную, но ограниченную эффективность при мРМЖ, следовательно, идентификация эффективных новых иммунотерапевтических средств, которые можно комбинировать с направленными агентами, чтобы сделать их более эффективными при мРМЖ, будет крайне желательна. Онкодрайверы могут быть важными подходящими мишенями иммунного ответа, о чем свидетельствуют приведенные ниже результаты.
Доказательство утраты ответа Th1 против онкодрайверов в процессе онкогенеза.
[0109] Здоровые взрослые женщины имеют исключительно высокий предсуществующий иммунитет Th1 против HER2 (ФИГ. 1А и 1С, см., например, Datta J, et al., Oncoimmunology. 2015;4:el022301; Datta J, et al., Breast Cancer Res. 2015;17:71; и Fracol, M., et al., Ann Surg Oncol (2017) 24: 407. https://doi.org/10,1245/sl0434-016-5584-6) в периферической крови. Эти Tbetpos Th1 клетки, тем не менее, прогрессивно утрачиваются в процессе онкогенеза. Такое нарушение впервые обнаруживается на стадии протоковой карциномы in situ (ПКИС), и становится сильно выраженным к I стадии инвазивного рака молочной железы (иРМЖ) (ФИГ. 1А, 1С и 1D). Такой утраты иммунных ответов Th1 против HER2 не наблюдают в процессе онкогенеза HER2neg (ФИГ. 1А), а также не наблюдают утраты ответов против других (неопухолевых) контрольных антигенов (результаты не представлены), указывая на то, что такое подавление селективно по отношению к антигену и не является результатом общей иммунологической толерантности. Стандартная терапия хирургическим вмешательством, облучением и химиотерапией трастузумабом обычно не корректирует такую утрату Th1 против HER2, но вакцинация нагруженными HER2 дендритными клетками I типа (ДК1) может резко повысить CD4 Th1 против HER2 в периферической крови, свидетельствуя о том, что это не неизменное нарушение, но, вместо этого, нарушение, которое можно скорректировать подходящей иммунизацией (ФИГ. 1В). Неясно, указывает ли такое снижение сигналов CD4 Th1 в периферической крови на истинную утрату клеток, или же означает их перемещение из центрального кровообращения в периферические сайты.
Ответ Th1 против HER2 коррелирует с клиническими исходами.
[0110] Пациенты с HER2pos иРМЖ, достигающие полного патоморфологического ответа (ППО) на неоадъювантную химиотерапию (NAC), демонстрируют улучшенную выживаемость, тогда как у пациентов с остаточным заболеванием на момент хирургического вмешательства демонстрируют повышенный риск рецидива. Хотя у пациентов с инвазивным HER2pos иРМЖ выявляют подавленный иммунитет Thl против HER2 как у группы, у некоторых индивидов наблюдается глубокое подавление, тогда как у других сохраняется умеренная чувствительность. У тех пациентов, у которых восстанавливаются или частично сохраняются Th1 против HER2, демонстрируют более высокий уровень ППО на неоадъювантную химиотерапию/терапию трастузумабом, тогда как у тех пациентов, у которых есть остаточное заболевание, выявляют наименьшие ответы CD4 Th1 против HER2 (ФИГ. 1D). Показана утрата репертуара, но также наблюдается значимое различие в общих и кумулятивных ответах. Утрата иммунного ответа CD4 против онкодрайвера представляет собой снижение продукции интерферона гамма (IFN-γ) в популяции Tbetpos Th1, но не в популяции GATA 3pos Th2, указывая на то, что иммунный ответ Th1 может быть крайне важным для опосредования ответов против онкодрайверов РМЖ. Действительно, повышенная экспрессия генов иммунной системы в опухоли связана с улучшенными исходами. Мы также исследовали взаимосвязь между иммунитетом против HER2 и выживаемостью без признаков заболевания (ВБЗ). У пациентов с рецидивом и уменьшенной ВБЗ выявляют наиболее сниженный иммунный ответ Th1 против HER2 (ФИГ. 1F), тогда как у пациентов с сохранившимся ответом Th1 против HER2 в периферической крови выявляют существенно большую ВБЗ (ФИГ. 1F). Такое нарушение CD4Th1 в периферической крови может отражать иммунологическую активность за пределами периферии или истинную утрату толеризованного или истощенного ответа.
Пример 2. Стимуляция CD4 Th1 против HER-2 с применением терапии ДК1 при раннем HER2pos раке молочной железы.
[0111] На данный момент авторы настоящего изобретения провели четыре клинических испытания: два с пациентами с HER2pos ПКИС и два с пациентами с HER2pos иРМЖ. См. Lowenfeld L, et al. Clin Cancer Res. 2017; 23:2961-71. Все четыре испытания документально подтвердили, что можно повысить ответ CD4 Th1 против HER2 в периферической крови с помощью введения вакцины на основе ДК, что в действительности не коррелирует с ответом на терапию, но демонстрирует, что введение ДК1 стимулирует CD4 Th1 против HER2. Пациенты с ПКИС получили лишь четыре/шесть вакцин раз в неделю, либо в отдаленные паховые лимфатические узлы, либо в область ПКИС в молочной железе, тогда как пациенты с инвазивным раком получили изначально шесть внутриузловых вакцин раз в неделю, а затем получали раз в три месяца внутриузловые бустерные дозы х 3. У восьмидесяти пяти процентов пациентов продемонстрировали повышение CD4 Th1 против HER2. В двух исследованиях ПКИС, в которых ДК1 вводили в неоадъювантном режиме, приблизительно у 30% пациентов с ERneg продемонстрировали ППО на вакцинацию ДК1 (ФИГ. 2А), и у ERpos HER2pos пациентов добавление к терапии антиэстрогенами вакцинации ДК1 улучшало ППО до сходного уровня (ФИГ. 2А) с минимального фонового ответа, что свидетельствует об эффективности комбинированного подхода. Терапия ДК1 была эффективной независимо от того, вводили ли их в отдаленные лимфатические узлы, или в область ПКИС в молочной железе. Интересно, что у тех, кто достиг ППО, продемонстрировали наиболее высокие уровни CD4 Th1 против HER2 в сторожевых лимфоузлах (ФИГ. 2В). Это свидетельствует о том, что достижение значимого ответа CD4 Th1 против HER2 в локальной регионарной области опухоли приводит к наиболее сильному клиническому ответу, и побудило авторов настоящего изобретения исследовать это дополнительно в доклинических моделях, что привело к описанной в настоящем изобретении эффективной терапии с помощью ДК1. Хотя лишь небольшие количества субъектов достигают ППО при ПКИС в результате терапии ДК1, она приводит к очень благоприятному уменьшению любых последующих явлений в молочной железе ((ПЯМЖ), ФИГ. 2С) по сравнению с пациентами, достигшими ППО, которое будет важно для уменьшения рецидивов и уменьшения смертности у пациентов ПКИС с высоким риском. Авторы настоящего изобретения исследовали влияние терапии ДК1 и цитокинов Th1 на диссеминированные раковые клетки (ДРК), так как это может быть важно для уменьшения смертности. Для пациентов с очагами иРМЖ Т1а/b в их ПКИС наблюдалось лишь приблизительно 8% случаев обнаружения отсутствия остаточного заболевания при хирургическом вмешательстве. Ясно, что такая терапия была перспективной, но необходимо было улучшить ее, чтобы разработать ее как удовлетворительную терапию для группы пациентов с экспрессирующими HER2 ПКИС и Т1а/b иРМЖ. Таким образом, авторы настоящего изобретения вернулись к доклиническим моделям, чтобы провести исследование с учетом этой возможности.
Пример 3. Вакцины на основе ДК1 в комбинации с блокированием SEMA4D.
[0112] Семафорин 4D (SEMA4D) является представителем семейства молекул поверхности клетки, которые необходимы для развития тканей и органов и участвуют в иммунной регуляции. Было показано, что антитела против SEMA4D регулируют инфильтрацию лимфоцитов в опухолях (см., например, патент США №9,243,068). В данном примере авторы настоящего изобретения скомбинировали моноклональное антитело против SEMA4D (Mab 67, см., например, патент США №8,496,938) с вакцинацией ДК1 в модели опухоли HER2 TUBO на мышах, как описано далее. Впервые показали экспрессию SEMA4D с помощью иммуногистохимии в линии клеток TUBO опухоли молочной железы мыши (номер доступа CVCL 2A33, Rovero, S., et al., J. Immonol 765:5133-5142 (2000)) (ФИГ. 3А). Для модели с одной опухолью (ФИГ. 3В1) мыши Ba1b/c получили 2,5е5 клеток TUBO подкожно в правый бок в день 0. Когда опухоли были пальпируемы на 7 день, мышей произвольно разделили на четыре группы. Мыши получали монотерапию либо контрольным антителом, либо антителом против SEMA4D интраперитонеально до конечной точки или получали HER2-ДК1 внутрь опухоли еженедельно в течение шести недель. Для комбинированной терапии мыши получали антитело против SEMA4D перед получением первой внутриопухолевой инъекции HER2-ДК1, которые вводили раз в неделю в течение шести недель. Для билатеральной модели мышам Ba1b/c (N = 6) вводили подкожно путем инъекции в оба бока 2,5×105 опухолевых клеток/сайт в день 0. ДК получали, заставляли созреть до ДК1, как описано ранее (Cintolo JA, 2016, Melanoma Res. 2016 Feb;26(1): 1-1 i), и нагружали пептидами neu. Мыши Ba1b/c получали вакцины на основе ДК внутрь опухоли раз в неделю в течение шести недель. У животных с двумя локализациями опухоли данную вакцину вводили только в одну из двух опухолей. Mab 67 вводили интраперитонеально в концентрации 10 мг/кг массы тела с периодичностью раз в неделю. Контрольные мыши получили антитела изотипического контроля, лечение ДК или Mab 67 отдельно. Опухоли измеряли каждые 2-3 дня с помощью штангенциркуля до достижения контрольной точки. Для сравнения измерений in vitro проводили однофакторный дисперсионный анализ (с последующим апостериорным критерием Тьюки). Для сравнения измерений in vivo использовали тот же критерий для измерений опухоли, которые проводили в каждый момент времени. Критерий Манна-Уитни использовали для сравнения между двумя группами лечения. Все статистические оценки результатов проводили, применяя программное обеспечение GraphPad Prism. Статистическая значимость достигалась при р<0,05.
[0113] Системное введение антитела против SEMA4D с внутриопухолевым введением нагруженных HER2 ДК1 мышам, несущим развившиеся опухоли TUBO, приводило к полному регрессу опухоли, которую лечили вакциной, по сравнению с лечением антителом против SEMA4D или ДК1 отдельно (ФИГ. ЗВ1). Это приводило к повышенной выживаемости (ФИГ. 3В2). Внутриопухолевая инъекция HER2 ДКТ в одну опухоль приводила к регрессу контралатеральных опухолей, в которые не вводили инъекцию (ФИГ. 3С1 и 3С2). Дополнительный анализ методом проточной цитометрии продемонстрировал повышение ответов CD4 Th1 против HER2, включая уменьшенную инфильтрацию опухоли миелоидными супрессорными клетками (ФИГ. 3Е), повышенную инфильтрацию опухоли CD4 Т-клетками (ФИГ. 3F) и повышенную инфильтрацию лимфатических узлов CD4 Т-клетками (ФИГ. 3G). Потенциальное значение для опухолей человека подчеркивается тем фактом, что SEMA4D экспрессировался приблизительно в 60% HER2 ПКИС или HER2 иРМЖ человека, что измеряли с помощью иммуногистохимии (ФИГ. 3D).
Пример 4. Введение внутрь опухоли нагруженных HER2 ДК1 и системное введение антитела против SEMA4D приводило к сильным противоопухолевым ответам Thl.
[0114] Селезенки собирали из мышей, которых вылечили от опухолей TUBO путем комбинированного системного введения антитела против SEMA4D с внутриопухолевой терапией нагруженными HER2 ДК1, как описано в Примере 3, а также из контрольных мышей, вакцинированных внутрь опухоли вакциной ДК1 отдельно или в комбинации с антителом против SEMA4D, и CD4+Т-клетки выделяли из спленоцитов, совместно культивировали с нагруженными HER2 ДК1 в течение трех-четырех дней, а затем размножали в присутствии IL-2 (10 ед/мл) и IL-7 (20 нг/мл) в течение трех недель. Сравнивали клетки, размноженные из селезенок, собранных из мышей, вакцинированных нагруженными HER2 ДК1, либо отдельно, либо в комбинации с системным лечением антителом против SEMA4D (ФИГ. 4). Результаты свидетельствуют о том, что размножение in vitro CD4 Т-клеток из мышей, которым давали комбинированную терапию, было приблизительно 7-кратным, по сравнению с таковым для контрольных мышей, которое было приблизительно 3-кратным (ФИГ. 4А). У CD4 Т-клеток, размноженных из селезенок мышей, которым вводили комбинированную терапию, также выявили сильную специфичность к антигенам пептидам, происходящим из HER2/neu - р5, р435 и р1209 (см., например, Jalali et al., Nanomedicine;8:692-701 (2012)), по сравнению с CD4 Т-клетками, размноженными из мышей, которые получили вакцину ДК1 отдельно (ФИГ. 4В). Более того, для CD4 Т-клеток, размноженных из селезенок мышей, которым вводили комбинированную терапию, выявили сильную продукцию IFN-γ, указывая на сильный ответ Th1 (ФИГ. 4С). Данные результаты показали, что CD4 Т-клетки из мышей, которых лечили HER2-ДК1+aSema4D, превосходили по пролиферации, функции и специфичности Т-клетки из мышей, вакцинированных HER2-ДК1 отдельно.
Пример 5. Лечение ДК1 трансгенных мышей BALB/c Neu Т влияет на диссеминированные раковые клетки в экспрессирующей HER2 карциноме молочной железы.
[0115] Вакцины на основе ДКТ исследовали в пациентах с HER2 с остаточным заболеванием после неоадъювантной химиотерапии/трастузумаба, введение ДК1 было безопасным и приводило к повышению CD4 Th1 против HER2, и не наблюдалось рецидивов среди 17 пациентов при последующем наблюдении в среднем в течение 40 месяцев. Поскольку множество из таких пациентов, у которых неизбежен рецидив, будут нести диссеминированные раковые клетки (ДРК), авторы настоящего изобретения хотели исследовать влияние цитокинов Th1, а также CD4 Th1 клеток на ДРК. Для этого авторы настоящего изобретения использовали трансгенную модель на мышах BALB/c Neu Т. NeuT представляет собой трансгенную модель на мышах рака молочной железы, в которой промотор вируса опухоли молочной железы (MMTV) мыши запускает экспрессию neuT, и у мышей развиваются самопроизвольные опухоли в жировом теле молочных желез самок мышей. Когда самки мышей BALB-neuT достигают возраста 21-28 дней, белок neuT сверхэкспрессируется в молочных железах, и начинают образовываться области атипичной гиперплазии, которые прогрессируют до карцином in situ приблизительно к 60 дню и до инвазивного рака к 120 150 дню. Неопластическое изменение происходит, хотя и асинхронно, во всех молочных железах, так что приблизительно к 120 дню пальпируется одна или более опухолей, и приблизительно к 230 дню все 10 молочных желез содержат пальпируемые опухоли. Авторы настоящего изобретения и другие исследователи продемонстрировали, что присутствуют диссеминированные раковые клетки, которые можно обнаружить в нескольких органах перед появлением карцином молочной железы (ФИГ. 5А и 5В). Такие HER2+ положительные по цитокератину клетки можно детектировать в костном мозге, легких и печени начиная с 9 недели, и они составляют 10-15% клеток и находятся в состоянии с умерено низкой пролиферацией, что измеряли по Ki67 (ФИГ. 5С). Вакцинация мышей нагруженными HER2 ДК1 после 9 недели, когда присутствуют ДРК, но перед развитием карциномы молочной железы, приводила к снижению количества ДРК, а также к сниженной экспрессии Ki67 (ФИГ. 6А). Вакцины на основе ДК1 уменьшали развитие карциномы молочной железы на 16 неделе (ФИГ. 6В). Также наблюдали пониженное количество ДРК (ФИГ. 6С) и повышение маркеров старения клеток опухоли в ДРК из мышей NeuT, которых лечили ДК1. На ФИГ. 6D показана экспрессия р-галактозидазы, общеизвестного маркера старения клеток. Эти последние результаты свидетельствует о том, что помимо влияния терапии на первичное или метастатическое заболевание, при внутриопухолевой терапии, ДК1 могут посредством индукции направленных против HER2 CD4 Т-клеток запускать старение клеток и защищать от развития опухоли, и могут оказывать влияние на смертность от РМЖ.
Пример 6. Инфильтрация иммунных клеток после лечения ДК1 или SEMA4D.
[0116] Трансгенных по BALB-neu (Neu Т) мышей лечили в возрасте 8 недель подкожными инъекциями 1×106 нагруженных пептидом neu крысы ДК1 дважды в неделю или антителом против SEMA4D, которое вводили еженедельно при концентрации 10 мг/кг массы тела. На 16 неделе мышей умерщвляли и собирали молочные железы. Получали суспензию отдельных клеток молочных желез и окрашивали положительные по CD 19 В-клетки, а затем анализировали с помощью проточной цитометрии. Наблюдали повышенный уровень CD 19+ В-клеток у вакцинированных ДК1 мышей и у мышей, которых лечили антителом против SEMA4D, по сравнению с не получившим лечение контролем, что свидетельствовало об инфильтрации В-клеток в молочные железы (ФИГ. 7А). Скопление В-клеток в области опухоли свидетельствует о том, что противоопухолевые антитела играют роль в осуществлении эффектов, наблюдаемых при терапии ДК1 с SEMA4D. Кроме того, клетки костного мозга, полученные из контрольных и вакцинированных ДК1 мышей NeuT, окрашивали на маркеры CD4 и CD8 Т-клеток и анализировали с помощью проточной цитометрии. Наблюдали повышенные количества CD4 Т-клеток и CD8 Т-клеток в костном мозге вакцинированных ДК1 мышей NeuT по сравнению с не получившими лечение контрольными мышами (ФИГ. 7В).
Пример 7. IFN-γ и TNF-α из CD4 Th1 вызывают индукцию старения клеток опухоли в экспрессирующем HER2 раке молочной железы.
[0117] Поскольку CD4 и В-клетки (АПК МНС II класса) скапливаются вокруг протоков ПКИС, авторы настоящего изобретения исследовали влияние цитокинов Th1 на HER2 клетки РМЖ. IFN-γ и TNF-α вызывают индукцию как апоптоза, так и старения клеток опухоли - экспрессирующих HER2 клеток РМЖ. Терапевтическую пользу блокирования передачи сигналов HER2/HER3 при раке молочной железы продемонстрировали как в исследованиях in vitro, так и клинически. Авторы настоящего изобретения исследовали действие в отношении индукции апоптоза и старения клеток цитокинов Th1 в линиях клеток с высокой и промежуточной экспрессией HER2, которую блокировали с помощью миРНК HER2 и HER3 (Фигура 2). Хотя комбинированная обработка TNF-α и IFN-γ клеток SK-BR-3 с нокдауном HER3 значительно не повышала количество стареющих клеток, наблюдали более интенсивное окрашивание SA-β-gal в клетках с обработкой для двойного нокдауна HER2/HER3 в комбинации с цитокинами Th1 (Фигура 8А). Трастузумаб -гуманизированное рекомбинантное моноклональное антитело, направленное против внеклеточного субдомена IV HER2 - ингибирует независимую от лиганда димеризацию, блокирует нисходящие пролиферативные сигнальные пути и вызывает антителозависимую клеточную цитотоксичность (АЗКЦ), а пертузумаб - другое гуманизированное рекомбинантное моноклональное антитело, нацеленное на внеклеточный субдомен II HER2 - предотвращает зависимую от лиганда гетеродимеризацию с другими представителями семейства HER, что также ингибирует пролиферативные сигнальные пути и вызывает АЗКЦ. Вместе оба антитела действуют комплементарным образом. Авторы настоящего изобретения применили эту концепцию вызванного цитокинами Th1 старения и апоптоза клеток по отношению к комбинированной модели, применяя обработку TNF-α и IFN-γ вместе с трастузумабом и пертузумабом. Авторы настоящего изобретения обнаружили, что в клетках SK-BR-3 HER2hlgh количество стареющих клеток повышалось синергично при обработке комбинацией цитокинов и антител по сравнению с необработанными клетками, клетками, которые обрабатывали цитокинами отдельно, или клетками, которые обрабатывали антителами отдельно, что измеряли по окрашиванию SA-β-gal (Фигура 8В, р < 0,001) и экспрессии p15INK4b (ингибитора В циклинзависимой киназы 4, также известного как pl5INK4b) (Фигура 8С). Примечательно, что комбинированная обработка не только вызывала относительно высокий процент синих стареющих клеток, но также наблюдалось значительно меньшее количество клеток в целом. Повышенный апоптоз при аддитивном подходе продемонстрировали по повышенной экспрессии активной каспазы-3 (Фигура 8С) и по повышенному количеству положительных по аннексину V и йодиду пропидия клеток (Фигуры 8D и Е). Авторы настоящего изобретения исследовали способность TNF-α и IFN-γ вызывать старение и апоптоз клеток в устойчивых к трастузумабу и пертузумабу линиях клеток. Обработка клеток НСС-1419 и JIMT-1 трастузумабом и пертузумабом не вызывала старение или апоптоз клеток (Фигура 9). Тем не менее, двойная обработка цитокинами и направленная терапия вызывала значительно большее старение клеток, о чем свидетельствовал анализ SA-β-gal (Фигура 9А), и повышала экспрессию p15INK4b в клетках НСС-1419 (Фигура 9В) и клетках ЛМТ-1 (Фигура 9С). Цитокины Th1 в комбинации с блокированием HER2/HER3 могут вызывать старение и апоптоз клеток опухоли даже в линиях клеток, устойчивых к трастузумабу и пертузумабу.
[0118] Авторы настоящего изобретения затем исследовали, могут ли клетки CD4 Th1 против HER2 влиять на клетки HER2pos РМЖ, отделенные мембраной трансвел (transwell). Культивирование клеток рака молочной железы SK-BR-3 совместно с CD4+ Т-клетками из пациентов с раком молочной железы, примированными пептидами HER2 II класса, приводило к старению и апоптозу клеток SK-BR-3, о чем свидетельствовало повышенное окрашивание SA-β-gal (Фигура 10А) и экспрессия pl5INK4b и расщепленной каспазы-3 (Фигура 10В, CD4+- ДК Н, 3). CD4+ Т-клетки, примированные либо незрелыми дендритными клетками (CD4+- НДК Н (2)), либо зрелыми ДК плюс посторонние пептиды II класса (BRAF: CD4+- ДК В (5); или сурвивин: CD4+- ДК S (6)), были не способны вызывать старение или апоптоз клеток SK-BR-3. Аналогично ранее продемонстрированному синергичному действию, старение и апоптоз клеток значительно возрастали, когда в культуру добавляли трастузумаб и пертузумаб (4), о чем свидетельствовало повышенное окрашивание SA-β-gal (Фигура 10А, р<0,001) и экспрессия p15INK4b и расщепленной каспазы-3 (Фигура 10В, CD4+- ДК Н TP, 4). Эти результаты указывают на то, что клеткам CD4 Th1 против HER2 не требуется непосредственно взаимодействовать с опухолевыми клетками, и они скорее взаимодействуют с антиген представляющими клетками (АПК) в микроокружении опухоли (МОО), и цитокины Th1 могут действовать синергично с направленной терапией против HER2. Это может служить основой для того, чтобы присутствовали ДК1, нагруженные и связанные в окружении опухоли, чтобы запустить ответы CD4 Th1 против HER2, и для возможности, что антитела, такие как HP, могут действовать синергично с цитокинами Th1, чтобы уничтожать опухолевые клетки.
Пример 8. Клиническая активность цитокинов Th1 (IFN-γ) при положительном по HER2 раке молочной железы.
[0119] Авторы настоящего изобретения основывались на доклинических данных при разработке фазы I/II испытания, в котором исследовали, может ли введение IFN-γ быть безопасным и оказывать влияние на клинический ответ. В испытании I фазы продемонстрировали, что IFN-γ, который вводили подкожно три раза в неделю вместе с ТНР пациентам с первой линией терапии метастатического РМЖ, был безопасным и приводил к стабилизации заболевания или частичному ответу (ФИГ. 11). Теперь оно продвинулось до испытания II фазы, в котором введение осуществляли в неоадъювантном контексте пациентам с >Т2 ER+HER2+ иРМЖ. На данный момент в исследование включено 15 пациентов, и у двух из первых четырех пациентов наблюдали ППО. Авторы настоящего изобретения обнадежены этим результатом, так как у такого подтипа пациентов, которых лечат РТСН, значительно более токсичным режимом, демонстрируют уровень ППО приблизительно 27%. В настоящей заявке показано, что данный режим по меньшей мере успешно сохраняет установившийся уровень ППО и, следовательно, этот режим может заменить более токсичные режимы простым потенциально более эффективным режимом, применяя комбинацию иммунотерапии с цитокинами Th1 и стандартной терапией. Авторы настоящего изобретения определяли, могут ли вакцины на основе ДК1 запускать сходный ответ у положительных по HER2 пациентов на неоадъювантной терапии, чтобы вызвать ППО в комбинации с РТСН. Полученные результаты указывают на клиническую пользу Th1 цитокинов, таких как IFN-γ, в отношении влияния на HER2 опухоли, и готовы стать компонентами истинных нехимиотерапевтических режимов при HER2 РМЖ.
Пример 9. У пациентов, отвечающих на вакцины на основе ДК1, нагруженных HER2, встречаются скопления В- и Т-клеток.
[0120] Хотя у пациентов с ППО демонстрируют отсутствие остаточных протоков с ПКИС в молочной железе, множество пациентов с остаточным заболеванием дают возможность оценить ответ в молочной железе пациентов с остаточным заболеванием. Ответ в молочной железе часто гетерогенный, с областями плотного лимфоцитарного инфильтрата (ФИГ. 12А и В) и областями с небольшим ответом или без ответа (ФИГ. 12С и D). Скопление лимфоцитов представляет собой большую фракцию CD4 Т-клеток, а также CD20+ В-клеток и некоторого количества CD8 Т-клеток (ФИГ. 13). Данные структуры имитируют эктопические лимфоидные структуры, которые связаны с благоприятными ответами. У пациентов со значительными скоплениями таких лимфоидных структур в протоках ПКИС и около них авторы настоящего изобретения часто наблюдают умирающие или мертвые протоки, что свидетельствует о том, что иммунный ответ вызывает гибель и элиминирование ПКИС (ФИГ. 14).
Влияние антитела против SEMA4D на МОО и сосудистую сеть опухоли.
[0121] SEMA4D был описан как стимулятор ангиогенеза опухоли и, следовательно, был связан с прогрессированием опухоли (см., например, Zhou, et al. Methods Mol. Biol 1493:429-441 (2017)). Для исследования того, как SEMA4D изменяет МОО, в частности, васкуляризацию опухоли, авторы настоящего изобретения наблюдали васкуляризацию опухоли у мышей, которым вводили путем инъекции клетки TUBO, как описано в Примере 3, с помощью МРТ in vivo. МРТ с динамическим контрастным усилением (ДКУ) использовали для исследования различных свойств васкуляризации опухоли: используя площадь под кривой (AUC), уклон, время до максимума, авторы настоящего изобретения определили состояние васкуляризации опухоли. Авторы настоящего изобретения вводили путем инъекции 0,2 ммоль/кг гадовиста через хвостовую вену, чтобы исследовать, как однократное введение ДК1 отдельно, или антитела против SEMA4D отдельно, или обоих агентов в комбинации влияет на васкуляризацию опухоли и регресс опухоли. Авторы настоящего изобретения наблюдали меньший уклон, меньшее накопление контрастного вещества и меньшее пропотевание жидкости через сосуды (ФИГ. 15А и В) у мышей, которые получили комбинированную терапию, по сравнению с не получившими лечение мышами или мышами, получившими монотерапию. Полученные результаты свидетельствуют о том, что комбинированная терапия внутриопухолевыми ДК1 с системным введением антитела против SEMA4D улучшает васкуляризацию опухоли, о чем свидетельствовал меньший уклон, меньшее накопление контрастного вещества и меньшее пропотевание жидкости через сосуды, что может играть роль в стимуляции полного регресса опухоли как в модели одной опухоли TUBO, так и в билатеральной модели.
Пример 10. Влияние антитела против SEMA4D на рН опухоли.
[0122] Влияние антитела против SEMA4D на рН опухоли. Было показано, что опухоли имеют кислую среду, и ацидоз опухоли коррелировал с неблагоприятным прогнозом, и для уменьшения кислотности опухоли сильно важна ее васкуляризация; авторы настоящего изобретения исследовали рН опухоли с помощью экспериментов МРТ с химическим обменом-переносом спинового насыщения (CEST). На Фигуре 16 показано, что авторы настоящего изобретения наблюдали, что лечение SEMA4D отдельно оказывает влияние на сдвиг рН опухоли от кислого до щелочного с течением времени.
[0123] Моноклональное антитело мыши Mab 67, описанное выше, описано, например, в патенте США№8,496,938.
[0124] Последовательности аминокислот генов VH и VL MAb 67 представлены ниже, участки
CDR1, CDR2 и CDR3 подчеркнуты.
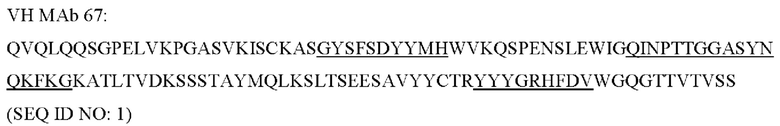

1. Mab VX15/2503 (пепинемаб) представляет собой гуманизированный вариант MAb 67 и также описано в патенте США №8,496,938. Последовательности аминокислот VX15/2503 представлены ниже.
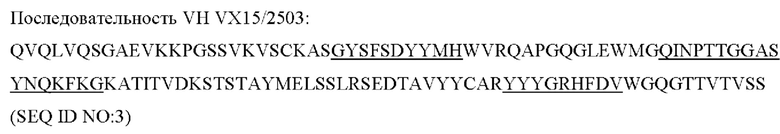
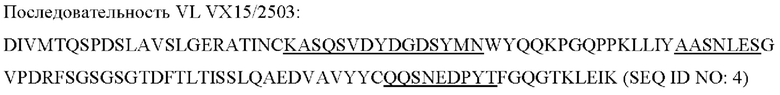
Пример 11. Обеднение CD4+ Т-клетками нейтрализует активность антитела против SEMA4D, как отдельно, так и в комбинации с лечением ДК-1.
[0125] В целом, CD4+ Т-клетки играют главную роль в провокации и формировании приобретенных иммунных ответов. Для исследования того, необходимы ли CD4+ Т-клетки для клинического ответа на комбинированную терапию вакциной HER2 ДК1/антителом против SEMA4D, получали обедненных CD4 несущих опухоль мышей, и иммунный ответ на лечение сравнивали с таковым у не обедненных CD4 («нормальных») несущих опухоль мышей.
[0126] Мыши Ba1b/C получили 2,5е5 клеток TUBO подкожно в правый бок в 0 день. Когда опухоли были пальпируемы на 7 день, мышей произвольно разделили на четыре группы. Мыши получали интраперитонеальную монотерапию либо антителом изотипического контроля IgG, либо антителом против SEMA4D/MAb67 (10 мг/кг массы тела) до достижения конечной точки или получали 1е6/100 мкл HER2-ДК1 внутрь опухоли еженедельно в течение шести недель. Для комбинированной терапии мыши получали антитело против SEMA4D перед получением первой внутриопухолевой инъекции НЕК2-ДК1 раз в неделю в течение шести недель.
[0127] Обедненных CD4 мышей Ba1b/c получали путем интраперитонеального введения 300 мкг антитела, удаляющего CD4 (клон GK1.4), начиная за три дня до имплантации опухоли TUBO, и лечение антителом против CD4 продолжали по две инъекции в неделю до достижения конечной точки (см. Evans, Е. Е., et al. (2015). Cancer Immunol Res 3(6): 689-70). Обедненных CD4 мышей лечили монотерапией, антителом против SEMA4D/MAb67 или комбинированной терапией, как описано выше для несущих опухоль не обедненных CD4 мышей.
[0128] Средний объем опухоли и выживаемость каждой группы показаны на ФИГ. 17А D: 17А и В (контроль, без обеднения CD4; объем опухоли и выживаемость, соответственно), и 17С и D (обеднение CD4). На Фигурах 17 Е (контроль, без обеднения CD4) и 17F (обеднение CD4) показаны кривые роста опухоли для каждой мыши. Полный регресс опухоли наблюдали после лечения антителом против SEMA4D, и активность дополнительно повышалась при комбинированной терапии. Все мыши, которых лечили комбинированной терапией в необедненной группе, выжили в течение периода тестирования, составляющего шестьдесят дней (ФИГ. 17В), и у 4/5 из данных мышей выявили полный регресс опухоли (ФИГ. 17Е). Тем не менее, обеднение CD4+ Т-клетками полностью нейтрализовало действие лечения антителом против SEMA4D, как отдельно, так и в комбинации с вакциной ДК-1 (ФИГ. 17D). Полученные результаты свидетельствуют о том, что CD4+ Т-клетки необходимы для клинически эффективного ответа на терапию, направленную против SEMA4D.
Пример 12. Роль рецепторов Fc-гамма (FcγR) в клиническом действии комбинированной терапии.
[0129] Опосредованные FcγR функции, чаще всего связанные с терапевтическими антителами, представляют собой такие функции, которые опосредуют элиминирование клетки-мишени - антителозависимую клеточную цитотоксичность (АЗКЦ), которая представляет собой механизм опосредованной клетками иммунной защиты, посредством которого эффекторная клетка иммунной системы активно лизирует клетку-мишень, антигены на поверхности мембраны которой были связаны специфичными антителами. Данные функции запускаются, когда у антитела, связавшегося с антигеном на поверхности целевой клетки, достаточная авидность, чтобы запустить передачу сигналов через FcγR на эффекторных клетках, таких как NK-клетки и макрофаги, которые затем уничтожают клетки-мишени путем непосредственного киллинга или фагоцитоза. На доклинических моделях показано, что данные формы FcyR-опосредованной цитотоксичности являются важным компонентом механизма действия некоторых нацеленных на опухоль антител (Clynes RA et al., Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets. Nat Med. 2000, 6: 443-446).
[0130] Для исследования роли FcγR в клиническом ответе на комбинированную терапию получали мышей с нокаутом FcγR. Вкратце, была создана модель путем направленного нарушения гена Fcerlg путем введения нового стоп-кодона в клетки Е14 ES и введения целевых клеток путем инъекции в бластоцисты C57BL/6. Гетерозиготы на фоне C57BL/6 скрещивали, чтобы получить мышей с гомозиготной целевой мутацией. Мышей затем возвратно скрещивали в двенадцати поколениях (N12) с инбредным фоновым генотипом BALB/cByJ (Takai Т, Li М, Sylvestre D, Clynes R, Ravetch J. (1994) FcRγ Chain Deletion results in Pleiotrophic Effector Cell Defects).
[0131] Нокаутным мышам BALB/C-Fcerlg (С.129P2(В6)-Fcer1gtmlRav N12) вводили путем подкожной инъекции в оба бока 2,5×105 опухолевых клеток/сайт в 0 день. ДК получали, заставляли созреть до ДК1 и нагружали пептидами neu МНС II класса. Мыши получили 1е6/100 мкл вакцины ДК1 внутрь опухоли раз в неделю в течение шести недель. У животных с двумя локализациями опухоли вакцину вводили только в одну из двух опухолей. Антитело против SEMA4D Mab 67 вводили интраперитонеально при концентрации 10 мг/кг массы тела с периодичностью раз в неделю. Контрольные мыши получили антитела изотипического контроля, лечение ДК или Mab 67 отдельно. Опухоли измеряли каждые 2-3 дня с помощью штангенциркуля до достижения контрольной точки. Средний объем опухоли в группе лечения и выживаемость в каждой группе показана на ФИГ. 18А и 18В, соответственно. Кривые роста опухоли для каждой мыши показаны на ФИГ. 18С (ПО = полный регресс опухоли; объем опухоли <50 мм2).
[0132] Полученные результаты показывают, что у мышей, у которых нет экспрессии рецептора Fc-гамма, комбинированная терапия значительно замедляла рост опухоли по сравнению с отсутствием лечения или лечением одним агентом (ФИГ. 18А и В). Тем не менее, полный регресс опухоли не был достигнут (ФИГ. 18 В), в противоположность контрольным мышам, которых лечили комбинированной терапией (ФИГ. 17Е), что свидетельствует о том, что рецептор Fc-гамма необходим для полной противоопухолевой эффективности комбинированной терапии.
Пример 12. Роль IFN-γ в клиническом действии комбинированной терапии.
[0133] Интерферон-гамма (IFN-γ) представляет собой плейотропную молекулу, с которой связаны антипролиферативные, проапоптические и противоопухолевые механизмы. Считают, что данный эффекторный цитокин является главным эффектором иммунитета и представляет собой ключевой цитокин Th1, важный для противоопухолевого иммунного ответа.
[0134] Для исследования роли IFN-γ в клиническом ответе на комбинированную терапию, создавали опухоли в мышах Ba1b/C с нокаутом (KO) IFN-гамма (С.129S7 (В6)-IFNgtmlTs/J (IFN-γKO, Jackson Laboratories). Мышам вводили подкожно в правый бок 2,5е5 клеток TUBO в 0 день. Дендритные клетки получали, заставляли созреть до ДК1 и нагружали пептидами neu МНС II класса. На 7 день, когда опухоли были пальпируемы, мышей произвольно разделили на четыре группы. Мыши получали монотерапию интраперитонеально либо контрольным антителом, либо антителом против SEMA4D (10 мг/кг массы тела) до достижения конечной точки или получали 1е6/100 мкл HER/2-ДК1 внутрь опухоли еженедельно в течение шести недель. Для комбинированной терапии мыши получали антитело против SEMA4D перед получением первой внутриопухолевой инъекции HER2-ДК1 раз в неделю в течение шести недель. Опухоли измеряли каждые 2-3 дня с помощью штангенциркуля до достижения контрольной точки. Средний объем опухоли для каждой группы представлен на Фигуре 19.
[0135] Результаты демонстрируют, что для противоопухолевой активности ДК1, антитела против SEMA и их комбинации требуется IFN-γ. Эти результаты аналогичны таковым, полученным для обеднения CD4 иммунокомпетентных мышей (Фигура 17), демонстрируя, что как IFN-γ, так и CD4 клетки необходимы для противоопухолевого ответа на терапию, направленную против SEMA4D.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> H. LEE MOFFITT CANCER CENTER AND RESEARCH INSTITUTE, INC.
VACCINEX, INC.
<120> КОМБИНИРОВАННАЯ ТЕРАПИЯ БЛОКИРОВАНИЕМ СЕМАФОРИНА 4D (SEMA4D)
И ТЕРАПИЕЙ ДК1
<130> 8555.035WO
<140>
<141>
<150> 62/865,027
<151> 2019-06-21
<160> 16
<170> PatentIn версии 3.5
<210> 1
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
полипептид"
<400> 1
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ser Asp Tyr
20 25 30
Tyr Met His Trp Val Lys Gln Ser Pro Glu Asn Ser Leu Glu Trp Ile
35 40 45
Gly Gln Ile Asn Pro Thr Thr Gly Gly Ala Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Lys Ser Leu Thr Ser Glu Glu Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Tyr Tyr Gly Arg His Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 2
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
полипептид"
<400> 2
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 3
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
полипептид"
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ser Asp Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gln Ile Asn Pro Thr Thr Gly Gly Ala Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Tyr Gly Arg His Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 4
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
полипептид"
<400> 4
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 5
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 5
Gly Tyr Ser Phe Ser Asp Tyr Tyr Met His
1 5 10
<210> 6
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 6
Gln Ile Asn Pro Thr Thr Gly Gly Ala Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 7
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 7
Tyr Tyr Tyr Gly Arg His Phe Asp Val
1 5
<210> 8
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 8
Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr Met Asn
1 5 10 15
<210> 9
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 9
Ala Ala Ser Asn Leu Glu Ser
1 5
<210> 10
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 10
Gln Gln Ser Asn Glu Asp Pro Tyr Thr
1 5
<210> 11
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 11
Gly Tyr Ser Phe Ser Asp Tyr Tyr Met His
1 5 10
<210> 12
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 12
Gln Ile Asn Pro Thr Thr Gly Gly Ala Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 13
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 13
Tyr Tyr Tyr Gly Arg His Phe Asp Val
1 5
<210> 14
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 14
Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr Met Asn
1 5 10 15
<210> 15
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 15
Ala Ala Ser Asn Leu Glu Ser
1 5
<210> 16
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
пептид"
<400> 16
Gln Gln Ser Asn Glu Asp Pro Tyr Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ АНТИТЕЛА К СЕМАФОРИНУ 4D В КОМБИНАЦИИ С ЭПИГЕНЕТИЧЕСКИМ МОДУЛИРУЮЩИМ АГЕНТОМ | 2018 |
|
RU2783535C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА ПУТЕМ ВНУТРИВЕННОГО ВВЕДЕНИЯ РЕКОМБИНАНТНОГО MVA И АНТИТЕЛА | 2018 |
|
RU2795103C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ СВЯЗЫВАЮЩИЕ TIGIT АГЕНТЫ | 2017 |
|
RU2765410C2 |
| АНТИ-ГАЛЕКТИН-9 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2840501C1 |
| ВЕКТОР, КОЭКСПРЕССИРУЮЩИЙ МОЛЕКУЛЫ ДЛЯ ВАКЦИНАЦИИ И КОСТИМУЛИРУЮЩИЕ МОЛЕКУЛЫ | 2016 |
|
RU2714157C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2733315C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
| Вирусный вектор | 2020 |
|
RU2799418C1 |
| КОМБИНАЦИЯ АНТИТЕЛ CD30XCD16 ДЛЯ ТЕРАПИИ С АНТАГОНИСТОМ PD-1 | 2016 |
|
RU2761352C2 |
| Способ активации цитотоксических Т-лимфоцитов в популяции мононуклеарных клеток крови при помощи мембранных везикул, полученных из генетически модифицированных опухолевых клеток меланомы М14 со сверхэкспрессией интерлейкина 2 | 2022 |
|
RU2790867C1 |
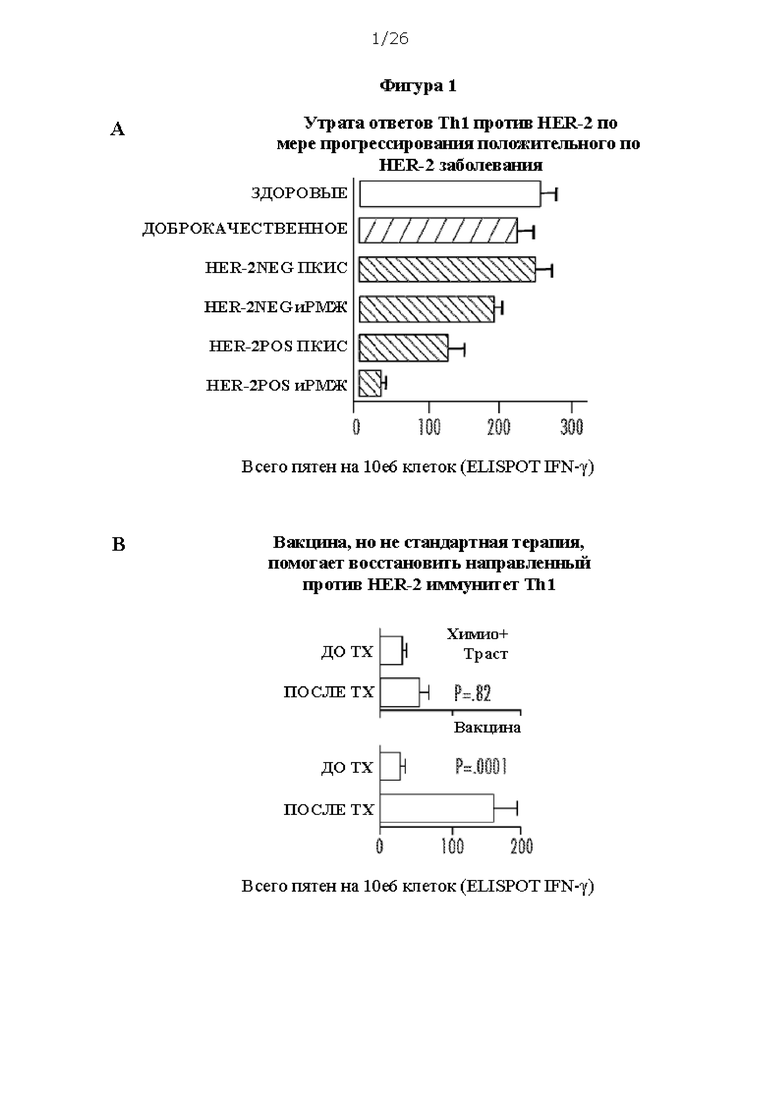
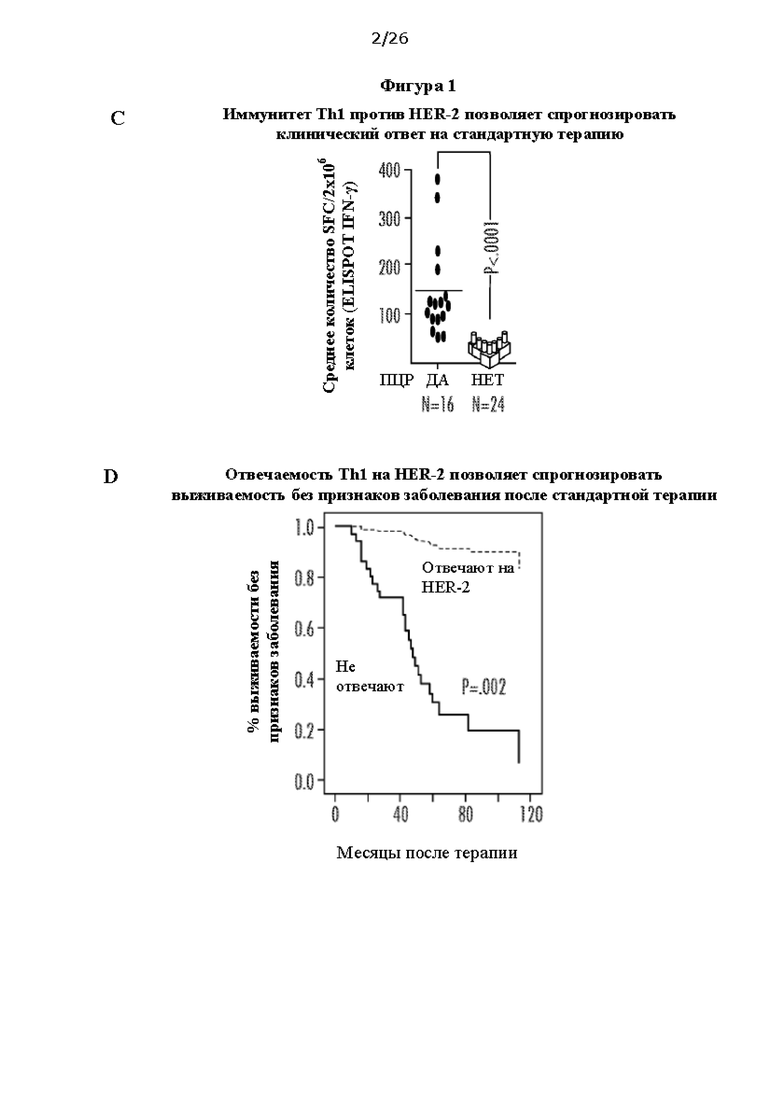
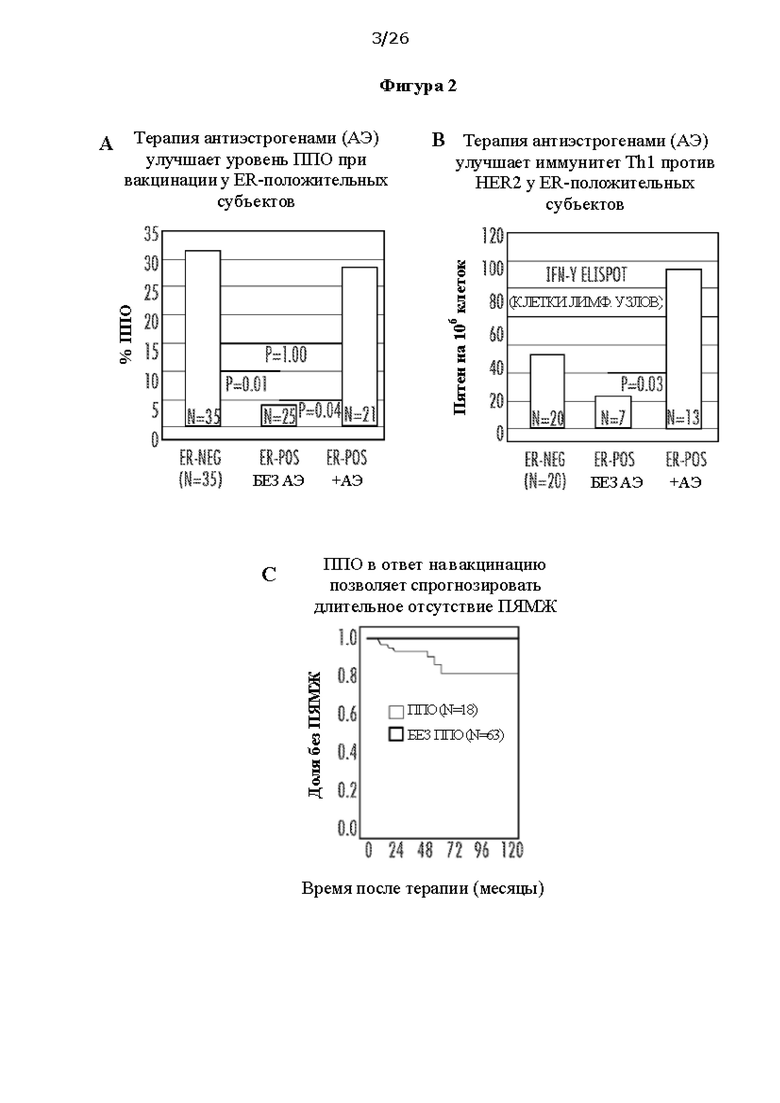
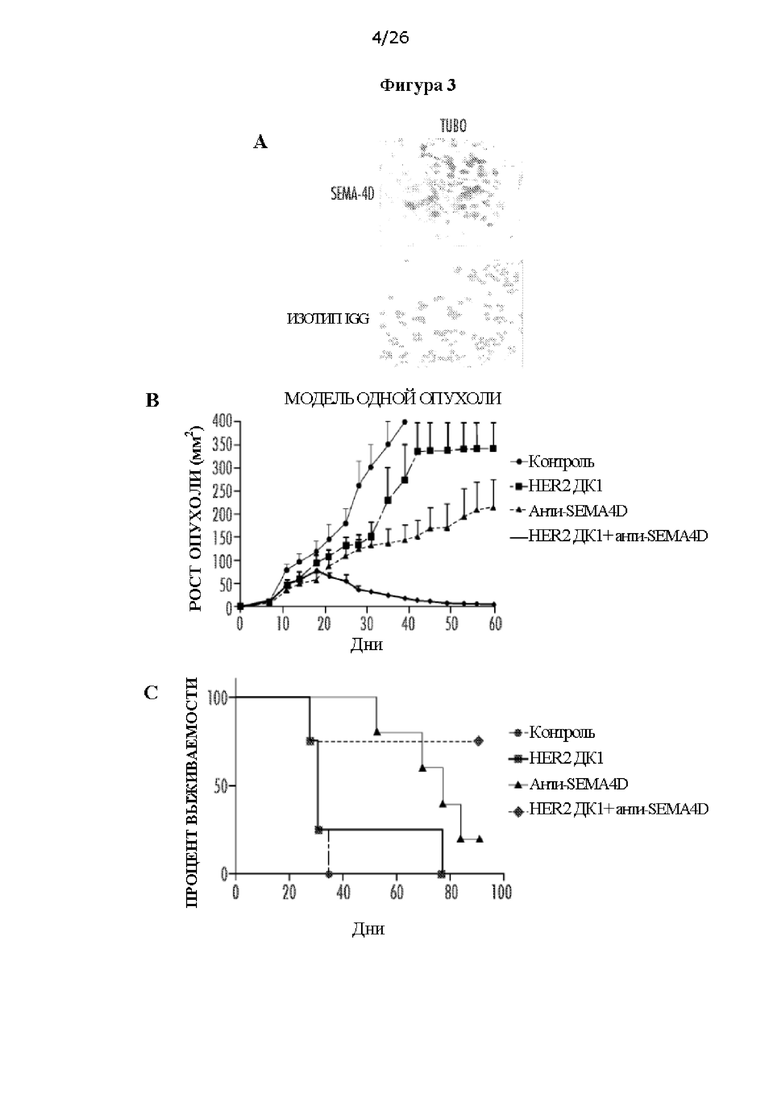

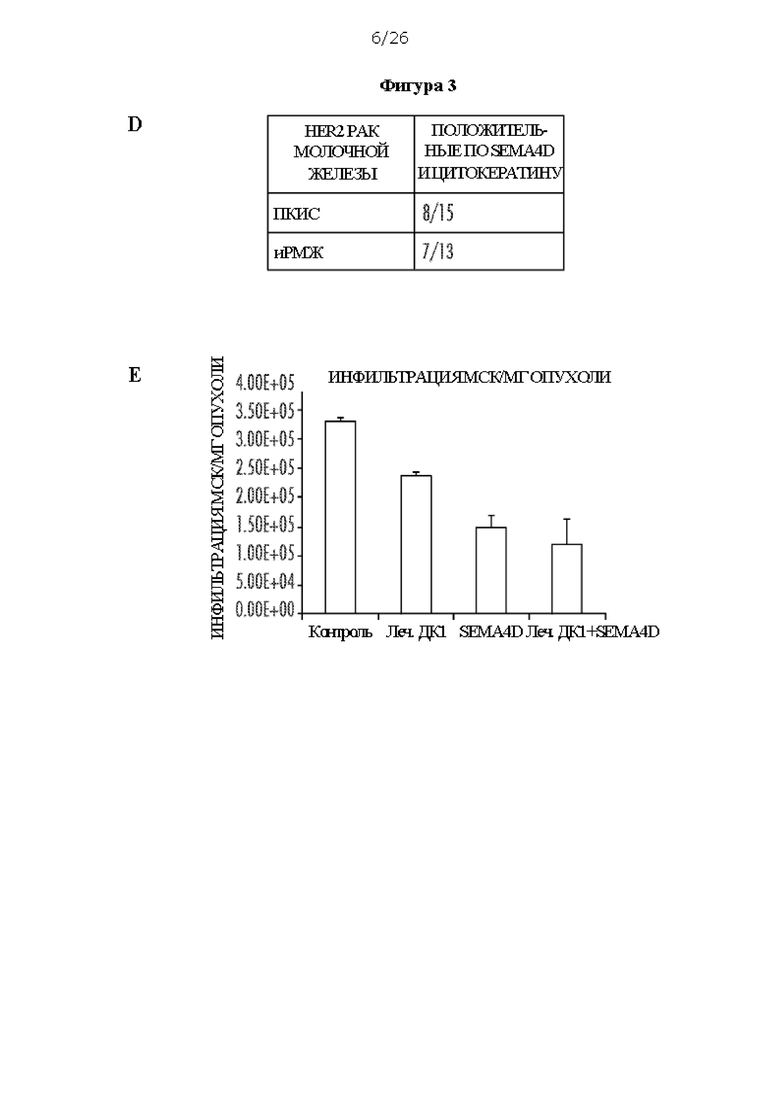
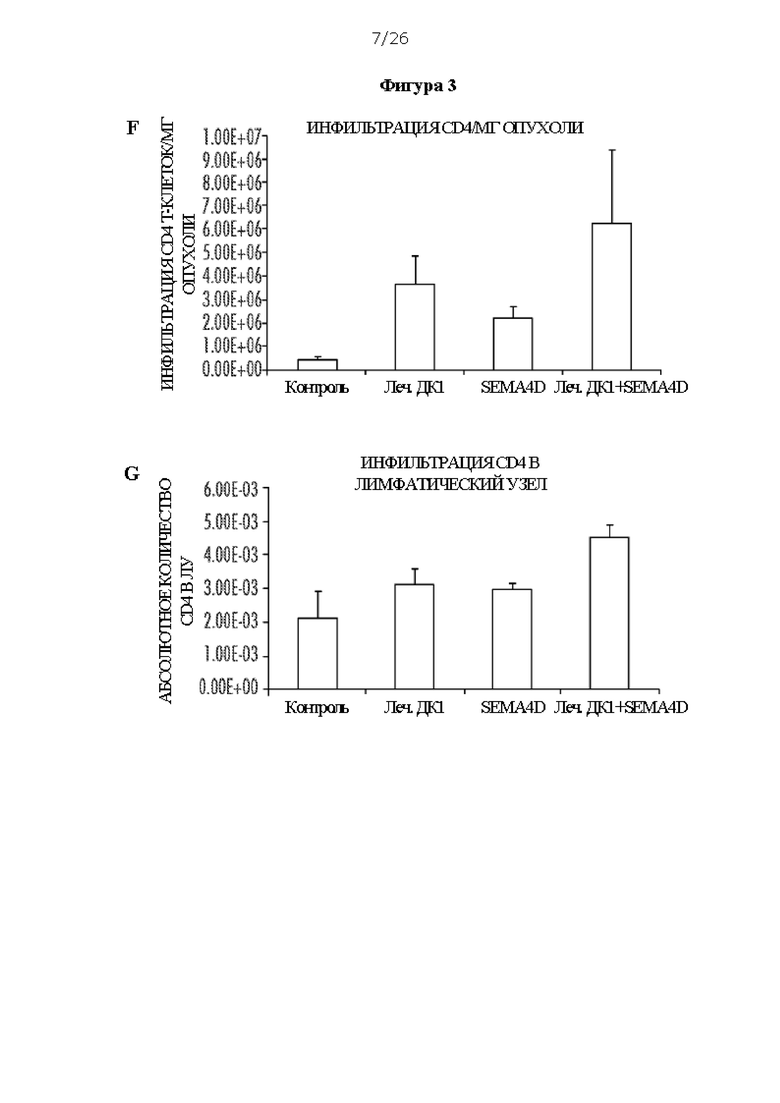

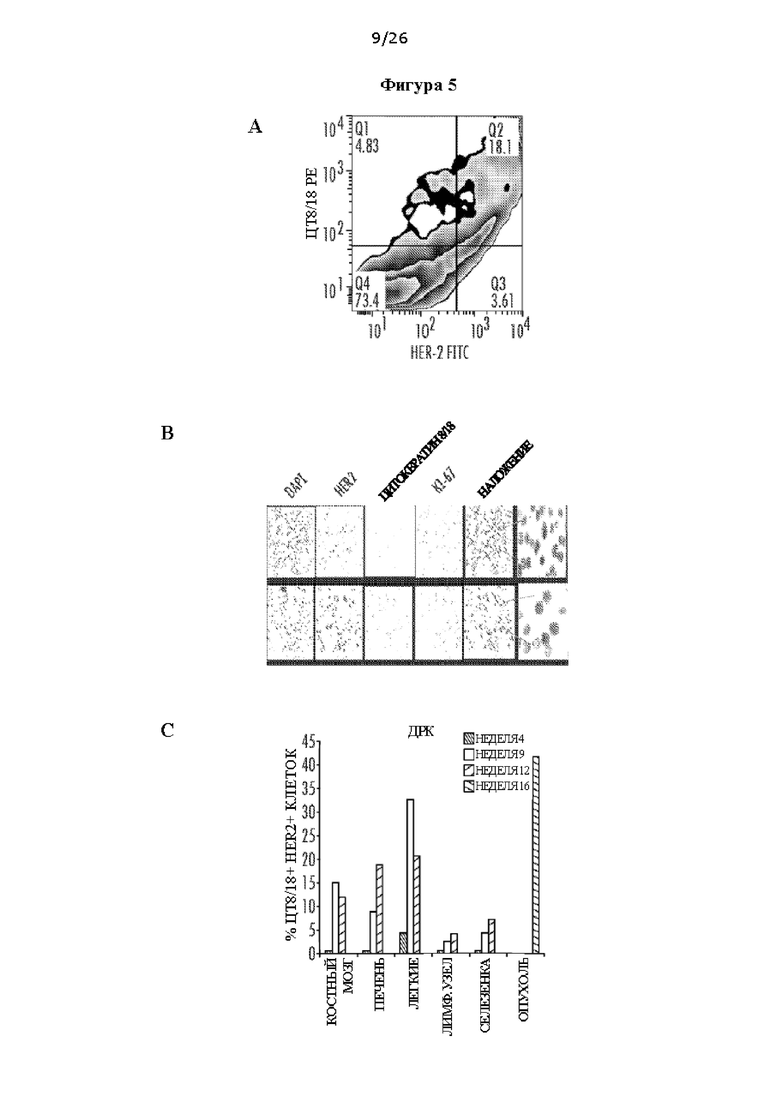
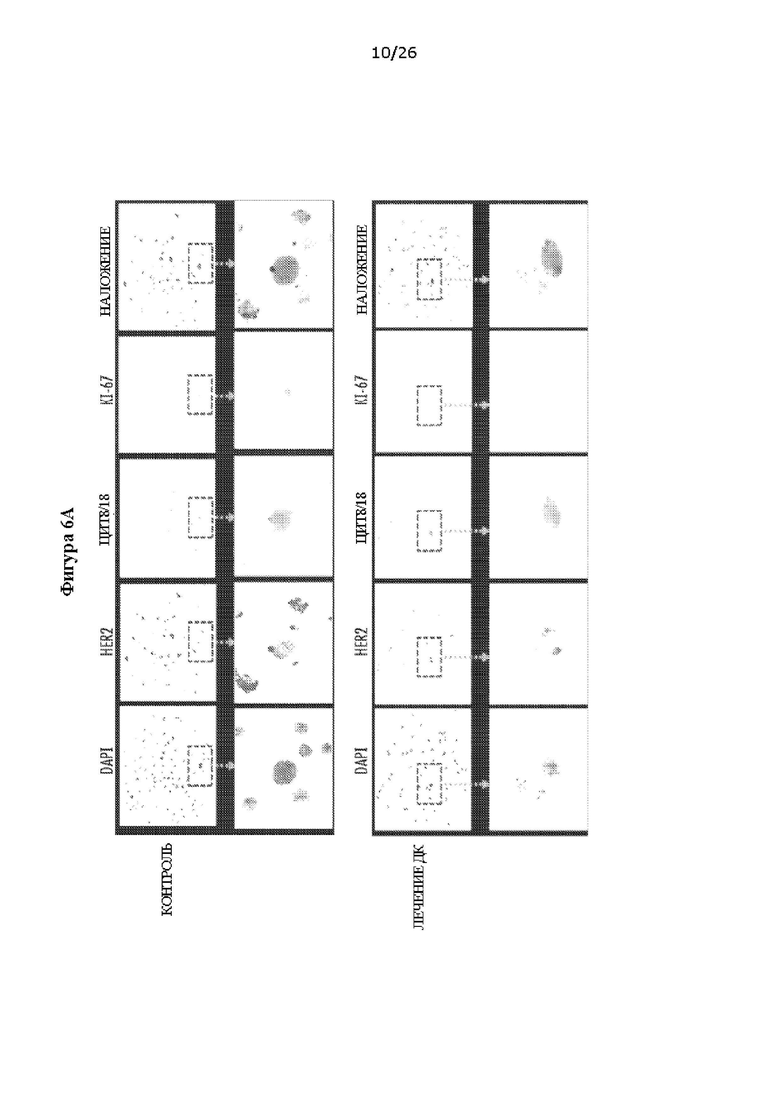

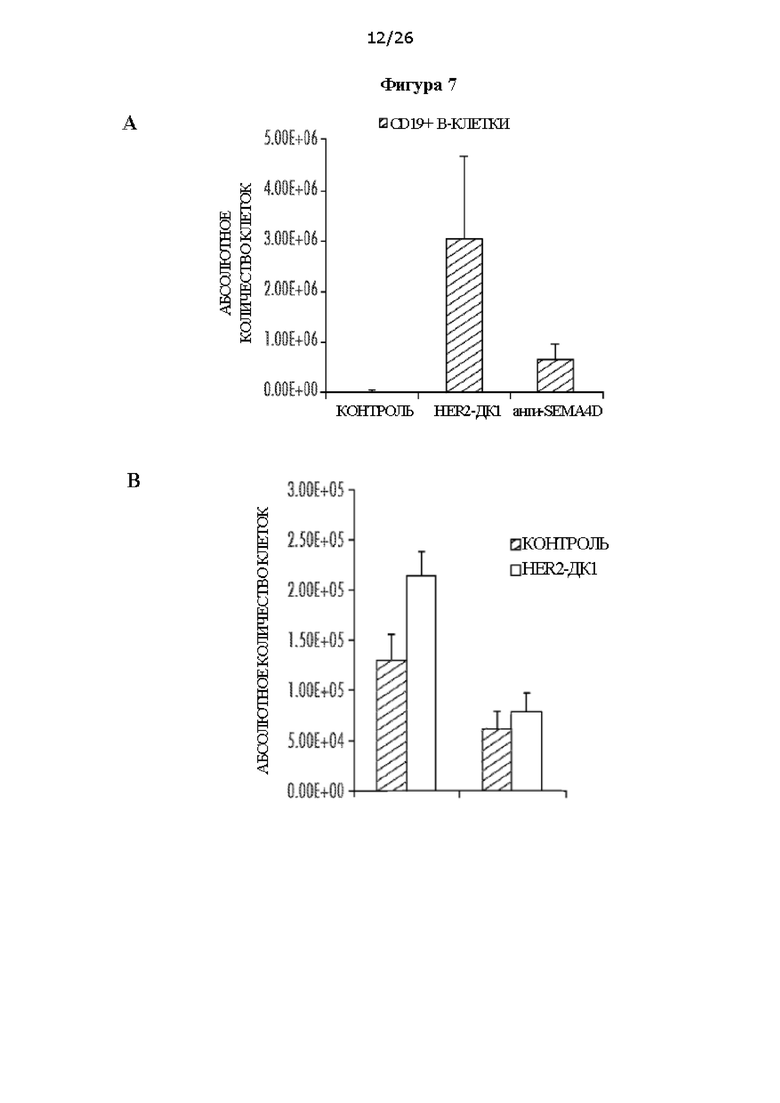
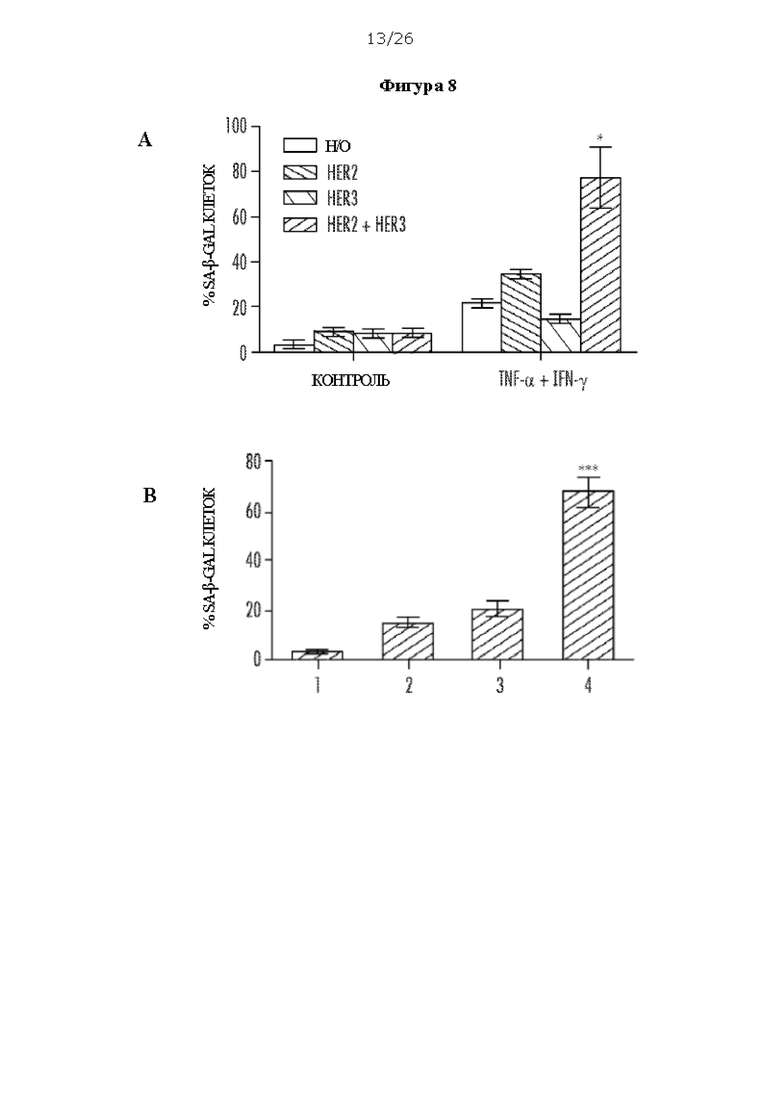
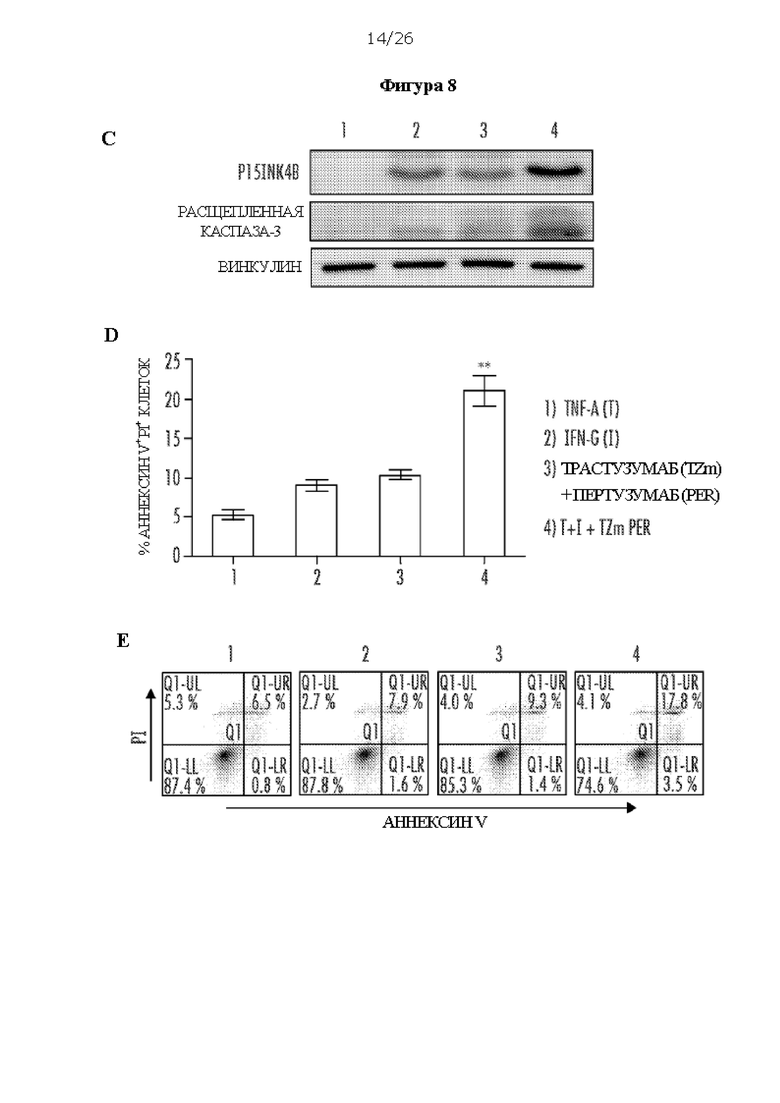
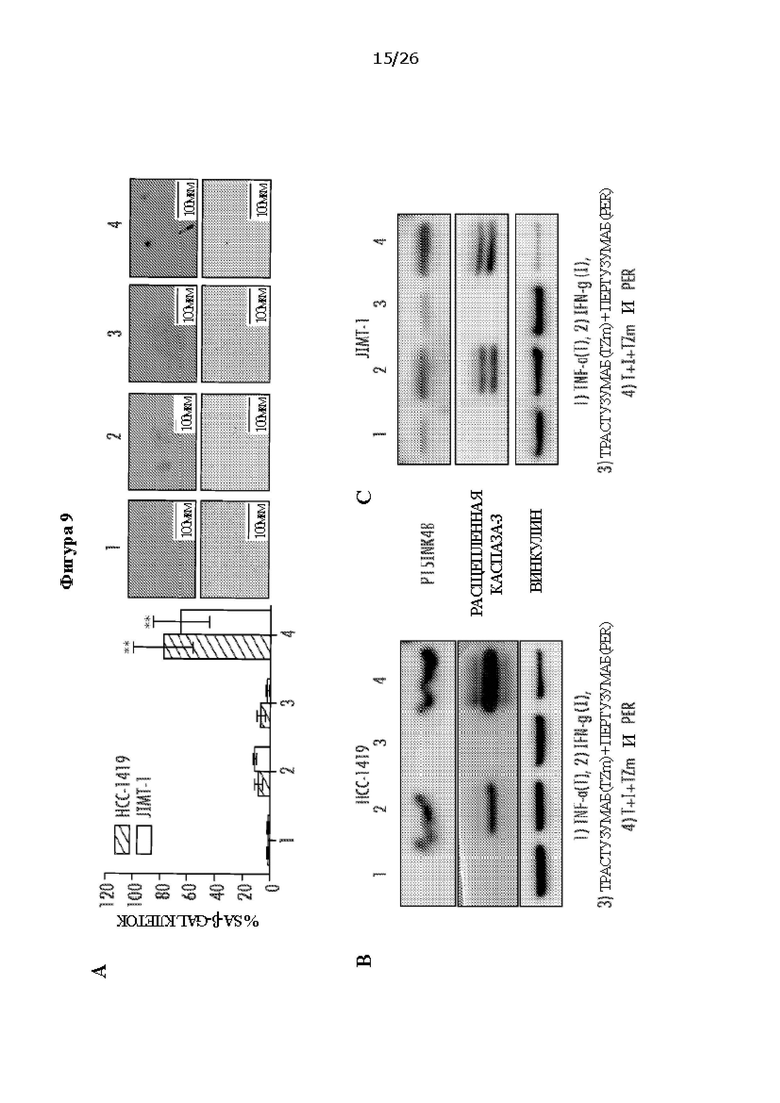
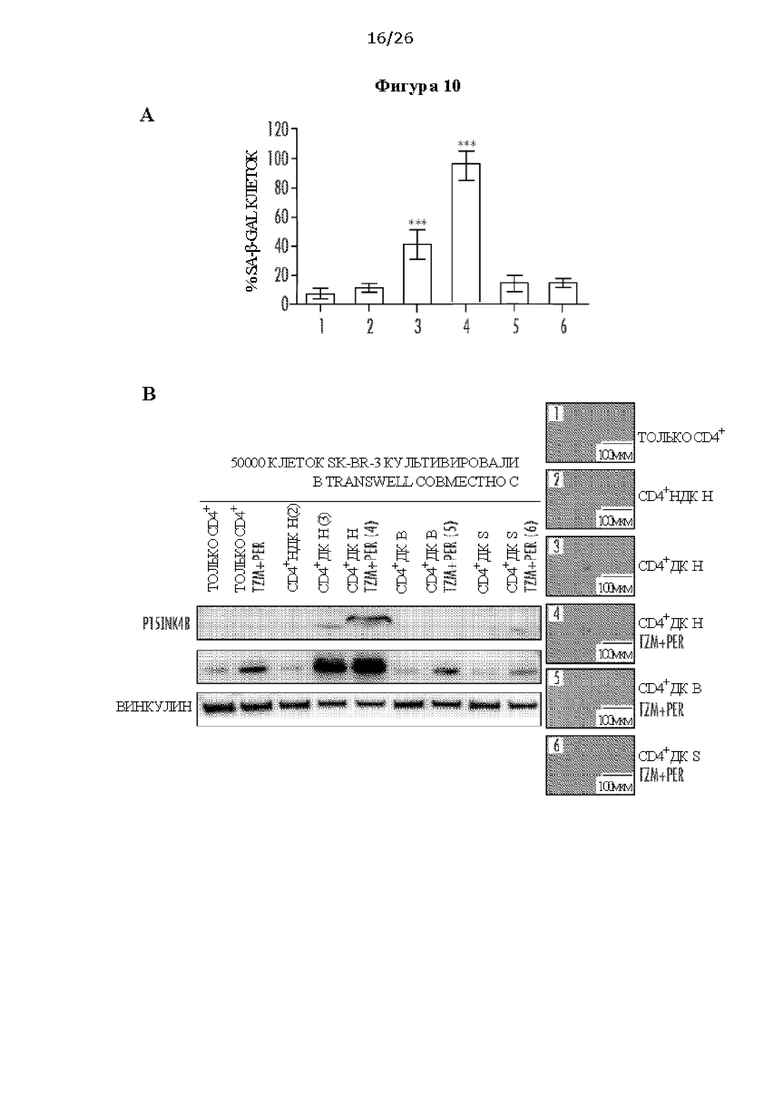

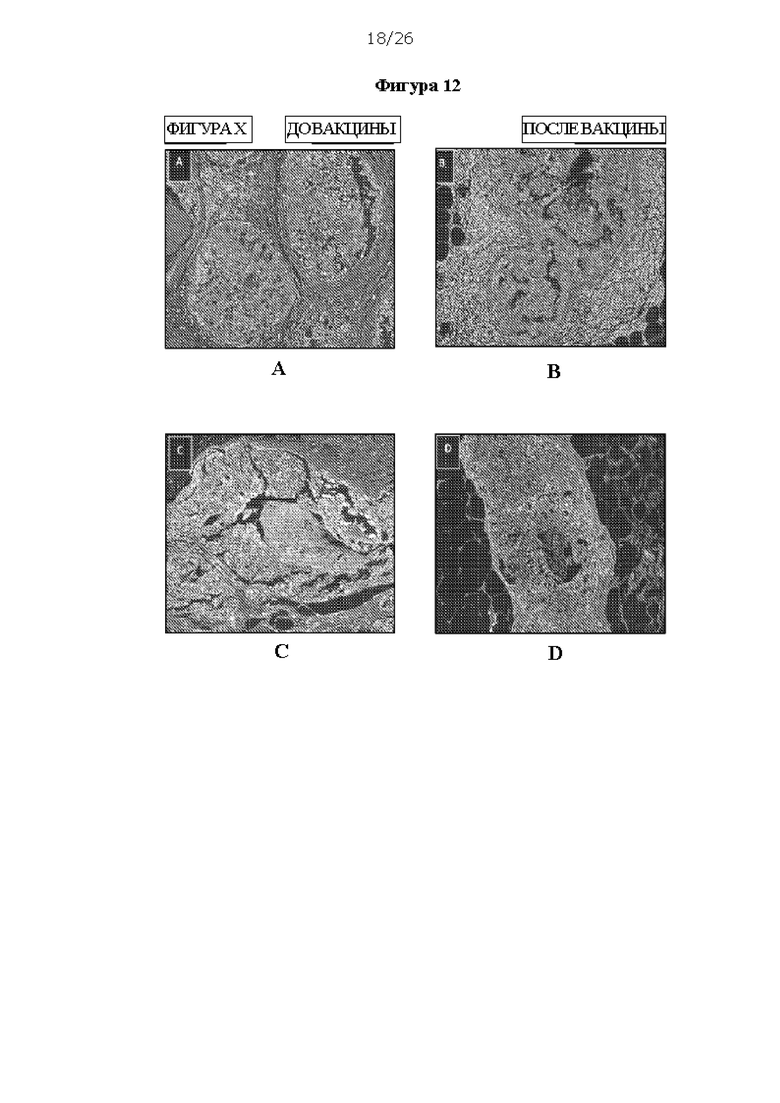

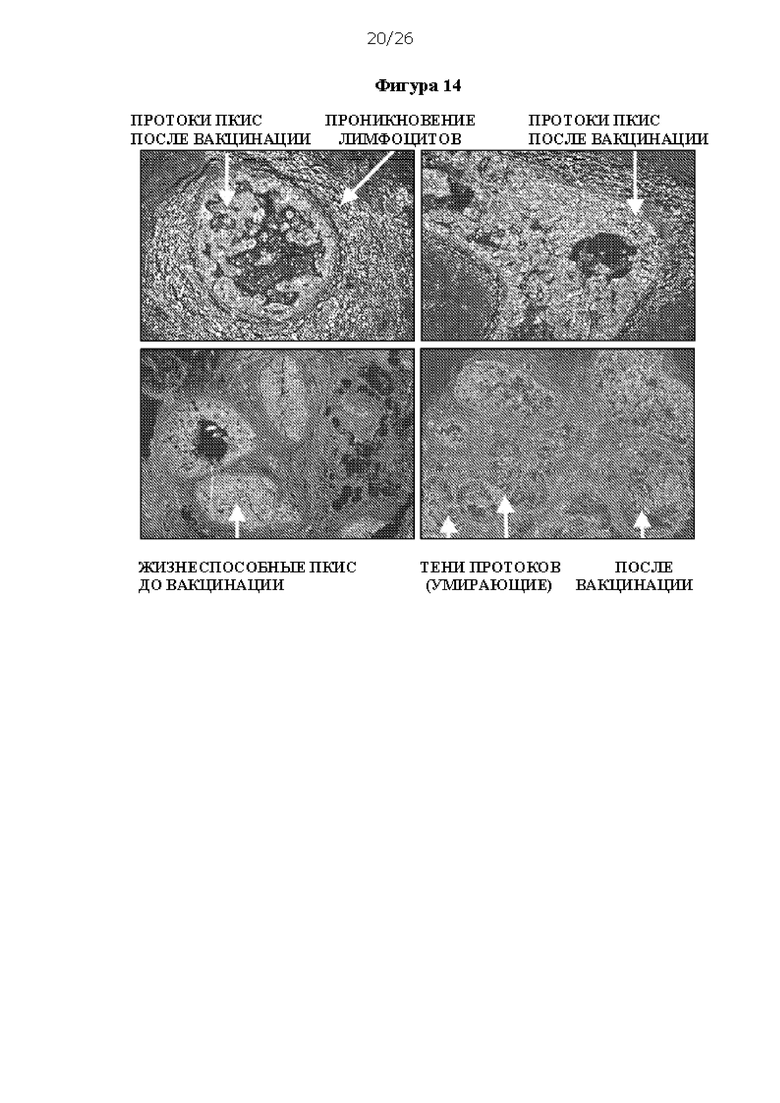
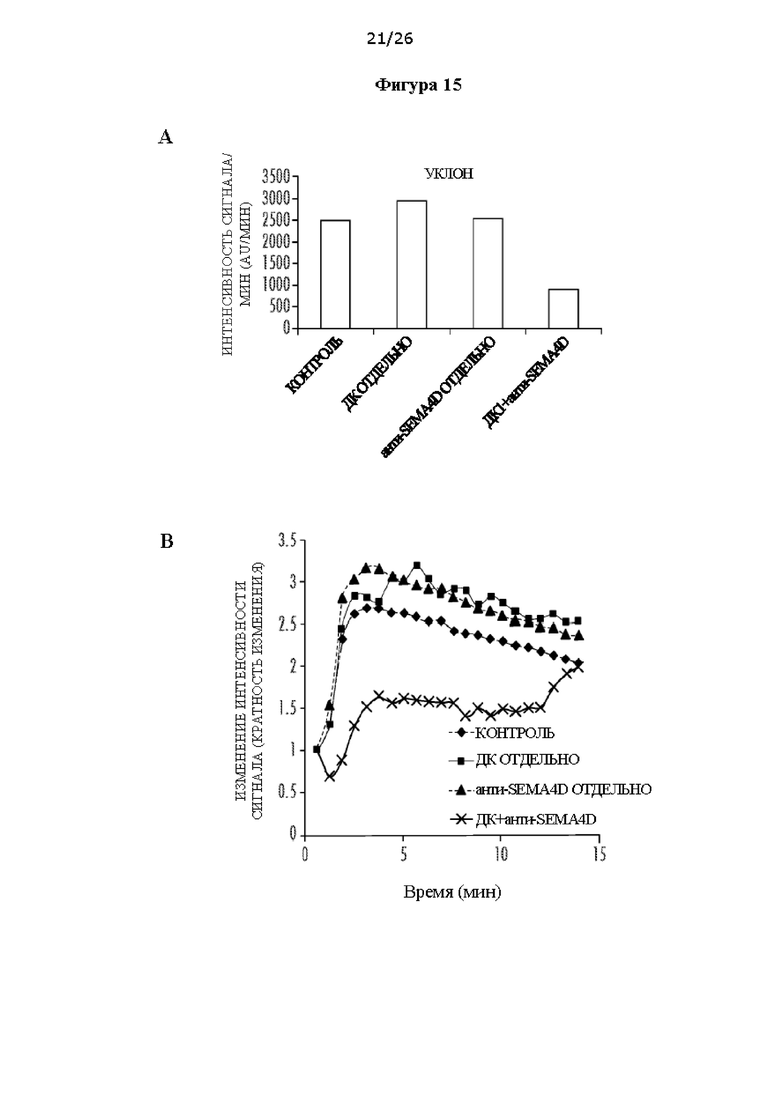

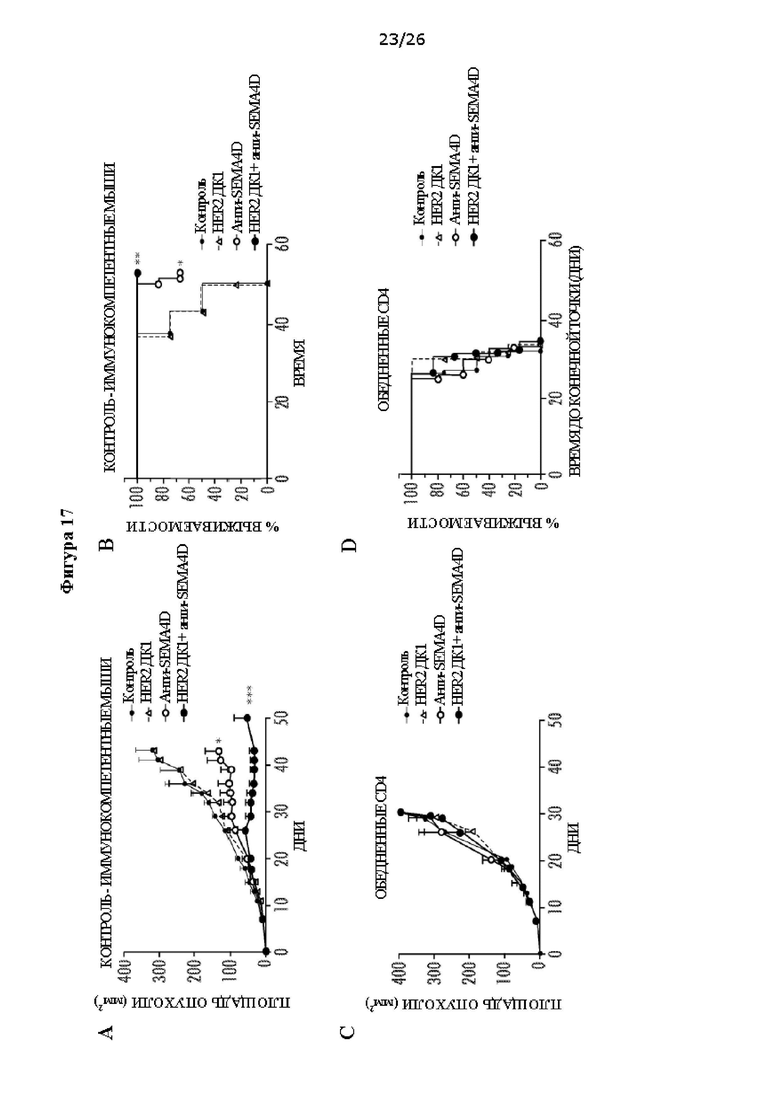
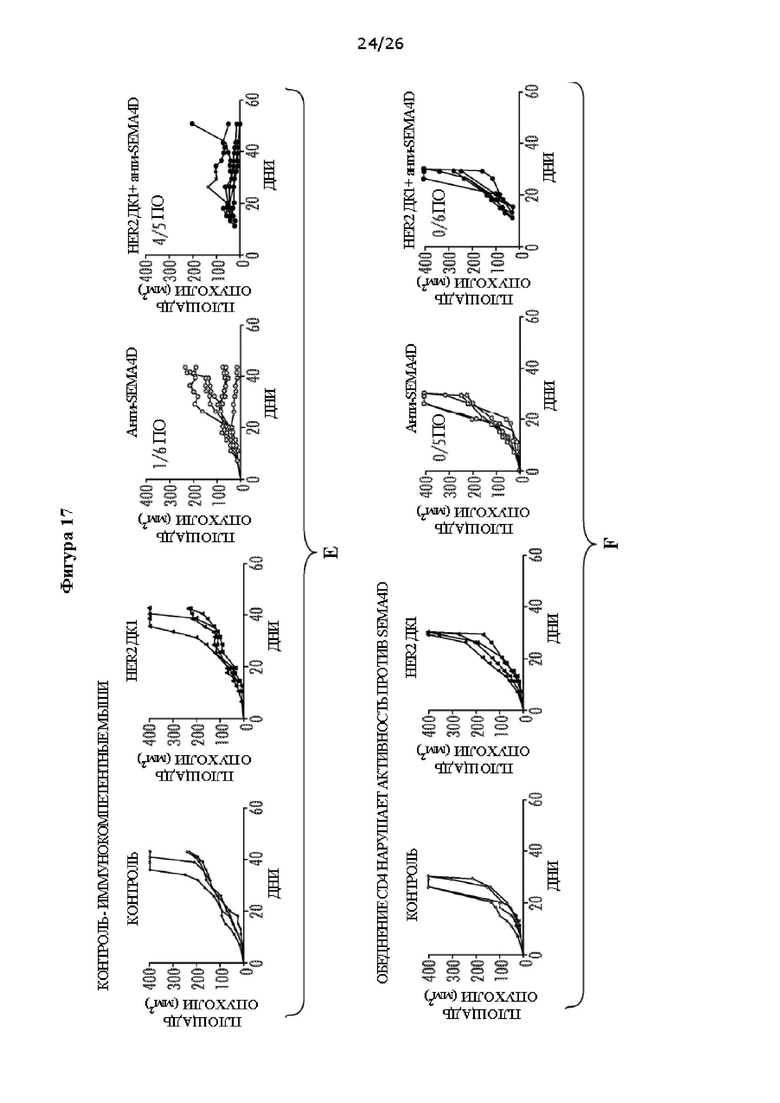
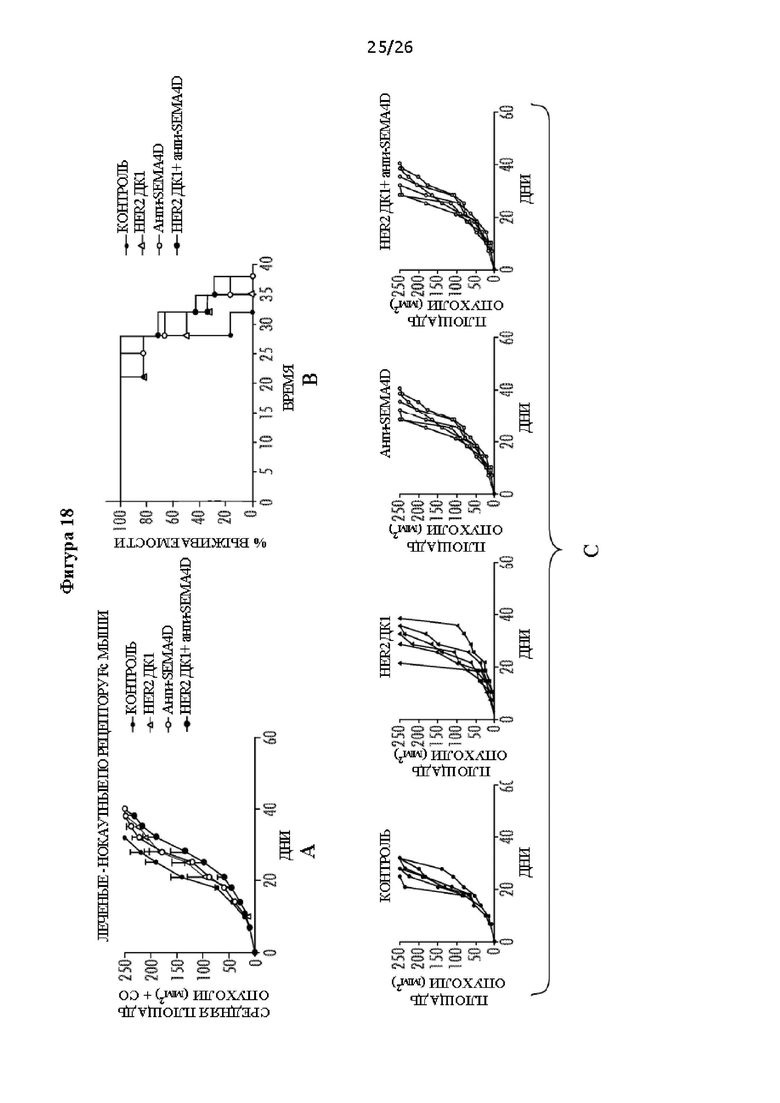
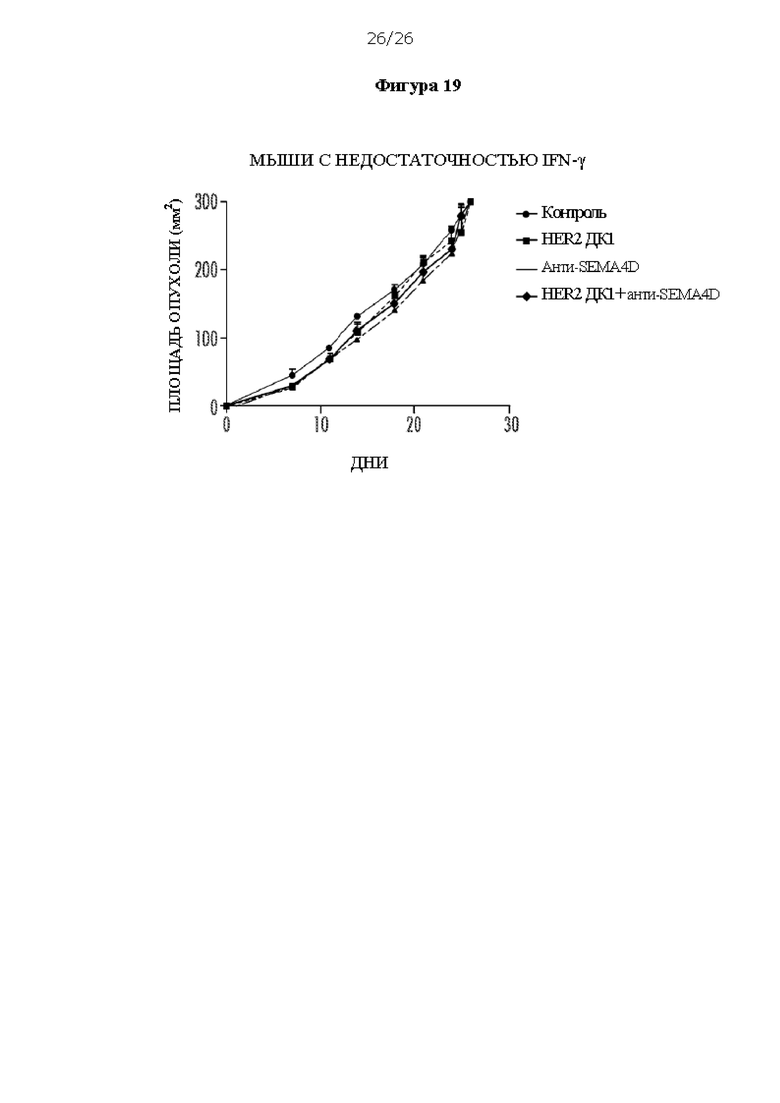
Группа изобретений относится к области биотехнологии и медицины. Предложен способ лечения HER2-положительного рака, который экспрессирует SEMA4D, у субъекта. Способ включает внутриопухолевое введение субъекту терапевтически эффективного количества дендритных клеток, нагруженных онкодрайвером HER2, в комбинации с системным введением эффективного количества анти-SEMA4D-антитела или его антиген-связывающего фрагмента, охарактеризованных аминокислотными последовательностями определяющих комплементарность областей (CDRs) с SEQ ID NO: 5-7,8-10 или SEQ ID NO: 11-13,14-16. Предложено также применение комбинации указанных дендритных клеток, нагруженных онкодрайвером HER2, и указанного анти-SEMA4D-антитела или его антиген-связывающего фрагмента для лечения HER2-положительного рака, который экспрессирует SEMA4D. Изобретения обеспечивают эффективное лечение HER2-положительного рака, который экспрессирует SEMA4D, в частности, регресс как инъецированных, так и не инъецированных дендритными клетками, нагруженными HER2, опухолей. 2 н. и 8 з.п. ф-лы, 19 ил., 12 пр.
1. Способ лечения рака у субъекта, включающий введение указанному субъекту терапевтически эффективного количества дендритных клеток, нагруженных онкодрайвером, в комбинации с эффективным количеством ингибитора иммунорегуляторной молекулы, причем указанный онкодрайвер представляет собой рецептор эпидермального фактора роста человека 2 (HER2), и указанный ингибитор иммунорегуляторной молекулы представляет собой антитело или антиген-связывающий фрагмент указанного антитела, которые специфично связывают семафорин 4D (SEMA4D); причем указанные антитело или антиген-связывающий фрагмент указанного антитела содержат:
(i) вариабельный домен тяжелой цепи (VH), который содержит VHCDRs 1-3, содержащие SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7, соответственно, и вариабельный домен легкой цепи (VL), который содержит VLCDRs 1-3, содержащие SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, соответственно; или
(ii) вариабельный домен тяжелой цепи (VH), который содержит VH CDRs 1-3, содержащие SEQ ID NO:11, SEQ ID NO: 12 и SEQ ID NO: 13, соответственно, и вариабельный домен легкой цепи (VL), который содержит VLCDRs 1-3, содержащие SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, соответственно;
и при этом указанные нагруженные HER2 дендритные клетки вводят путем внутриопухолевого введения, и указанное антитело или антиген-связывающий фрагмент указанного антитела вводят системно, и причем указанный рак представляет собой HER2-положительный рак, который экспрессирует SEMA4D.
2. Способ по п. 1, отличающийся тем, что нагруженную онкодрайвером дендритную клетку активируют интерлейкином-12 (IL-12) перед введением.
3. Способ по п. 1, отличающийся тем, что указанное антитело представляет собой пепинемаб.
4. Способ по любому из пп. 1-3, отличающийся тем, что по меньшей мере одна дендритная клетка, нагруженная онкодрайвером, получена путем удаления дендритных клеток из субъекта, который подлежит лечению указанной противораковой комбинированной терапией, и нагрузки указанным онкодрайвером ex vivo.
5. Способ по любому из пп. 1-4, отличающийся тем, что указанный HER2-положительный рак представляет собой рак молочной железы, меланому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак мочевого пузыря, рак яичника, рак желудка, любую их комбинацию или любые их метастазы.
6. Применение комбинации для лечения рака у субъекта, причём указанная комбинация включает по меньшей мере одну дендритную клетку, нагруженную онкодрайвером, который представляет собой рецептор эпидермального фактора роста человека 2 (HER2), и эффективное количество ингибитора иммунорегуляторной молекулы, причем указанный ингибитор иммунорегуляторной молекулы представляет собой антитело или антиген-связывающий фрагмент указанного антитела, которые специфично связывают семафорин 4D (SEMA4D), и при этом указанные антитело или антиген-связывающий фрагмент указанного антитела содержат:
(i) вариабельный домен тяжелой цепи (VH), который содержит VHCDRs 1-3, содержащие SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7, соответственно, и вариабельный домен легкой цепи (VL), который содержит VLCDRs 1-3, содержащие SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, соответственно, или
(ii) вариабельный домен тяжелой цепи (VH), который содержит VH CDRs 1-3, содержащие SEQ ID NO:11, SEQ ID NO: 12 и SEQ ID NO: 13, соответственно, и вариабельный домен легкой цепи (VL), который содержит VL CDRs 1-3, содержащие SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, соответственно;
причём указанное применение включает внутриопухолевое введение терапевтически эффективного количества нагруженных HER2 дендритных клеток в комбинации с системным введением эффективного количества указанного ингибитора иммунорегуляторной молекулы, и при этом указанный рак представляет собой HER2-положительный рак, который экспрессирует SEMA4D.
7. Применение по п. 6, отличающееся тем, что указанную нагруженную онкодрайвером дендритную клетку активируют IL-12 перед введением.
8. Применение по п. 6 или 7, отличающееся тем, что указанное антитело представляет собой пепинемаб.
9. Применение по любому из пп. 6-8, отличающееся тем, что указанная по меньшей мере одна дендритная клетка, нагруженная онкодрайвером, получена путем удаления дендритных клеток из субъекта, который подлежит лечению указанной противораковой комбинированной терапией, и нагрузки указанным онкодрайвером ex vivo.
10. Применение по любому из пп. 6-9, отличающееся тем, что указанный HER2-положительный рак представляет собой рак молочной железы, меланому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак мочевого пузыря, рак яичника, рак желудка, любую их комбинацию или любые их метастазы.
| TANYI J.L | |||
| ET AL | |||
| Personalized cancer vaccine effectively mobilizes antitumor T cell immunity in ovarian cancer | |||
| SCIENCE TRANSLATIONAL MEDICINE | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| WO 2014209802 A1, 31.12.2014 | |||
| CHIANG, CH | |||
| ET.AL | |||
| A dendritic cell vaccine pulsed with autologous hypochlorous acid-oxidized ovarian cancer lysate primes effective broad antitumor | |||
Авторы
Даты
2023-08-16—Публикация
2020-06-19—Подача