Изобретение относится к медицине, а именно к внутренним болезням, кардиологии, сосудистой хирургии, и предназначено для прогнозирования разрыва аневризмы брюшной аорты (АБА) у больных с выявленной ранее АБА, которая является распространенным заболеванием, особенно у мужчин в возрасте старше 60 лет. Среди патологических расширений различных отделов аорты на долю брюшной ее части приходится около 80%, при этом клинически значимые аневризмы>40 мм в диаметре присутствуют примерно у 1% мужчин в возрасте от 55 до 64 лет и увеличиваются на 2-4% за десятилетие [1]. Ведущими факторами риска АБА являются возраст, мужской пол и курение [2]. Разрыв аневризмы, при котором уровень смертности достигает 70-95%, встречается у 1-3% мужчин в возрасте ≥65 лет.
Известно, что формирование аневризмы в инфраренальном отделе аорты обусловлено, помимо прочего, рядом гемодинамических причин. Возникающий в этой зоне гемодинамический удар, а также повышенное периферическое сопротивление в артериях нижних конечностей, приводят к увеличению бокового давления в аорте. Увеличение аневризмы после ее формирования связано с усилением тангенциального напряжения внутри стенки аорты при росте давления внутри аневризмы и ассоциировано с уменьшением толщины ее стенки [3].
В прогрессировании АБА присутствует широкий спектр причин: от молекулярно-генетических до биомеханических и, соответственно, разрыв АБА является сложным событием, зависящим от множества факторов. Поэтому оценка риска разрыва по общим параметрам, таким как максимальный диаметр и скорость роста, позволяет лишь приблизительно судить о вероятности разрыва и не может предсказать индивидуальный риск пациента [4].
Согласно последним рекомендациям, считается, что фактор, от которого зависит разрыв АБА, в основном ее размер [5]. При этом риск разрыва в значительной степени связан со скоростью ее расширения. Длительный период субклинического увеличения диаметра и объема аневризмы предшествует образованию больших АБА с высоким риском разрыва. Мета-анализ более 15000 пациентов с АБА диаметром 3,0-5,5 см показал отсутствие различий в скорости роста аневризмы между мужчинами и женщинами, в среднем она составила 2,2 мм / год; курение увеличивало скорость роста аневризмы на 0,35 мм / год, а диабет уменьшал на 0,51 мм / год [6]. В пределах исследуемого диапазона диаметров наблюдалось экспоненциальное увеличение средних скоростей роста от 1,3 мм / год для аневризм диаметром 3,0 см до 3,6 мм / год для аневризм, достигающих 5,0 см. В исследовании С.Oliver-Williams et al. [7] было отмечено, что темпы роста аневризмы не изменились за последние 25 лет. С точки зрения биомеханики - закона Лапласа, рост АБА сопровождается значительным увеличением напряжения стенок сосудов. Ежегодный риск разрыва является низким при АБА<50 мм (<1-3%), и возрастает до 10% при АБА 50-60 мм и 20% при диаметре >60 мм [8].
Как показывают результаты многочисленных исследований, опасность АБА заключается, прежде всего, в возможности ее разрыва. Это осложнение АБА является 10-й по счету причиной смерти у мужчин и может быть предотвращено своевременным хирургическим вмешательством. В настоящее время в действующих клинических рекомендациях по лечению АБА наибольший риск разрыва определяется при достижении диаметра АБА 50 мм и выше. На основании этого показателя принимается решение о необходимости инвазивной коррекции АБА с помощью открытой операции или эндопротезирования. Более раннее вмешательство является неэффективным из-за превалирования рисков осложнений над пользой от предотвращения разрыва, а отложенная операция связана с риском непрогнозируемого по времени разрыва АБА.
Вместе с тем, обширный клинический опыт показал, что ориентироваться только на размер аневризмы для оценки риска ее разрыва недостаточно, так как существует ряд дополнительных факторов, которые способствуют увеличению риска разрыва АБА при меньшем ее диаметре и, наоборот, в ряде случаев, разрыв не происходит при значительном превышении этого показателя.
Известен способ диагностики и/или прогнозирования вероятности разрыва АБА, не достигших критического размера, требующего хирургической коррекции [9 - Патент №RU 2722816; 2019] у пациентов с «малыми» аневризмами брюшного отдела аорты. Для данного вида аневризм характерны размеры, превышающие нормальные значения, однако не достигающие порога оперативного вмешательства при общепринятой практике. Стандартной тактикой ведения подобных пациентов считается наблюдение за размерами аневризмы, оценка прогрессирования размеров аневризмы и медикаментозная терапия. Для улучшение эффективности лечения пациентов с малыми аневризмами аорты предложен детальный анализа состояния стенок аневризмы аорты по данным комплексной мультиспиральной компьютерной томографии. Для этого проводят комплексную мультиспиральную компьютерную томографию брюшного отдела аорты. При этом сначала проводят бесконтрастное исследование и выявляют наличие кровоизлияния в тромб. После этого выполняют двухфазное контрастное усиление с болюсным введением контрастного препарата и выявляют наличие участков диссекции, изъязвлений стенок и тромба аневризмы аорты. При определении кровоизлияния в тромб выполняют хирургическое вмешательство в экстренном порядке. При выявлении локальной диссекции или дочерних аневризм или их сочетания, а также при выявлении изъязвлений стенок и тромба в аневризме выполняют хирургическое вмешательство в течение интервала времени от 2 дней до 1 месяца. Недостатком этого способа является невозможность постоянного мониторирования роста АБА из-за высокой лучевой нагрузки и возможности осложнений из-за повторного применения контраста.
Известен способ [10 - Патент US 7044920; 2003], в котором используется система мониторинга давления в аневризме брюшной аорты, содержащая, по меньшей мере, один датчик давления, расположенный в аневризматическом мешке, и по меньшей мере, один датчик давления, расположенный в брюшной области тела за пределами аневризматического мешка, где контроллер сообщается с датчиками давления. Градиент давления между абдоминальной областью и аневризматическим мешком определяется на основе давлений, передаваемых на контроллер от датчиков давления аневризматического мешка и брюшной полости. В известном способе используется носитель, хранящий компьютерную программу, содержащую код для получения данных о давлении от датчика, расположенного за пределами аневризматической полости, для расчета градиента давления, что дает возможность постоянного мониторирования роста АБА. Главным недостатком способа является его инвазивный характер и высокая стоимость этого типа мониторинга АБА.
Наиболее близким аналогом, принятым в качестве прототипа, [11 - Патент RU 2 771 963, 2022], является способ in vitro диагностики аневризмы у субъекта, предусматривающий определение в выделенном образце от субъекта уровня продукта экспрессии генов экстраклеточного матрикса COL11A1, COL5A2, TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, причем, когда уровень продуктов экспрессии выше эталонного значения, это указывает на то, что у субъекта имеется аневризма, и, причем, эталонное значение представляет собой заранее определенный уровень продукта экспрессии, полученного от здорового субъекта или группы здоровых субъектов, причем, когда продукты экспрессии характеризуются следующими уровнями: по меньшей мере, 15-кратная сверх экспрессия относительно эталонного значения для COL11A1; по меньшей мере, 5-кратная сверх экспрессия относительно эталонного значения для COL5A2; по меньшей мере, 10-кратная сверх экспрессия относительно эталонного значения для TGFB1; по меньшей мере, 10-кратная сверх экспрессия относительно эталонного значения для ММР2; по меньшей мере, 12-кратная сверх экспрессия относительно эталонного значения для ММР9; по меньшей мере, 10-кратная сверх экспрессия относительно эталонного значения для ВМР1; по меньшей мере, 5-кратная сверх экспрессия относительно эталонного значения для ITGA4 или, по меньшей мере, 8-кратная сверх экспрессия относительно эталонного значения для ITGB1, что указывает на высокий риск разрыва аневризмы.
Недостатком известного способа является то, что для его применения требуется определение значительного количества показателей, дорогостоящих лабораторных наборов, праймеров и необходимой сопутствующей клинической дифференциальной диагностики полиморбидных состояний обследуемых пациентов. Главным недостатком данного способа является его привязка к размеру аневризмы, что не всегда ассоциировано с биомеханическим напряжением сосудистой стенки.
Целью заявляемого изобретения является прогнозирование риска разрыва ранее диагностированной АБА без использования дорогостоящего оборудования и регулярного мониторинга прогрессирования АБА без дополнительной лучевой нагрузки.
Поставленная цель достигается посредством разработки способа основанного на определении количества циркулирующих эндотелиальных клеток у пациентов с установленным диагнозом аневризмы абдоминальной аорты, которое строго коррелирует с пиковым напряжением сосудистой стенки, ассоциированным с риском ее разрыва.
Новый способ оценки риска разрыва аневризмы абдоминальной аорты, основанный на количественном определении циркулирующих эндотелиальных клеток в сыворотке крови пациента с установленным у него ранее диагнозом аневризмы абдоминальной аорты, в соответствии с заявляемым изобретением, позволяет риск разрыва аневризмы абдоминальной аорты определять по количеству циркулирующих эндотелиальных клеток в сыворотке крови пациента, при этом при их значении менее 8 на 106 лейкоцитов в период текущего года оценивают риск разрыва аневризмы абдоминальной аорты как низкий до 3%, а при их значении более 35 на 106 лейкоцитов такой риск оценивают как высокий от 6% до 35%.
Для достижения указанной цели по прогнозированию риска разрыва ранее диагностированной АБА, был разработан и апробирован способ, основанный на определении количества циркулирующих эндотелиальных клеток у пациентов с установленным диагнозом аневризмы абдоминальной аорты, строго коррелирующего с пиковым напряжением сосудистой стенки, ассоциированным с риском ее разрыва.
Было обследовано 125 пациентов с АБА. Большинство пациентов относятся к лицам мужского пола и пожилого возраста. Средний возраст больных АБА составил 68,9±7,7 лет. Мужчины составили 88% от общего числа пациентов. Самому молодому пациенту было 50 лет, наиболее пожилому - 85 лет.
Критериями включения больных с АБА являлись:
1. Мужчины или женщины в возрасте старше 45 лет;
2. Наличие информированного согласия на участие в исследование;
3. Наличие у пациента подтвержденного диагноза: «Аневризма инфраренального и юкстаренального отделов брюшной аорты»; Критерии исключения из исследования включали следующие параметры:
1. Наличие у пациента подтвержденного диагноза: «Аневризма супраренального отдела брюшной аорты»;
2. Ожидаемая продолжительность жизни менее 2 лет;
3. Психиатрические или другие состояния, не позволяющие проведение исследования;
4. Коагулопатия или заболевания с неконтролируемым кровотечением;
5. Хроническая почечная недостаточность, уровень креатинина крови >2.0 мг/дл (0,177 ммоль/л);
6. АБА воспалительного генеза;
7. Заболевания соединительной ткани (в том числе синдром Марфана);
8. Инфаркт миокарда или ОНМК в течение последних 3-х месяцев;
9. Беременность;
10. Тяжелое общее состояние пациента, не позволяющее проведение хирургического вмешательства;
11. Отказ пациента от участия в исследовании.
Заявленный способ оценки риска разрыва аневризмы абдоминальной аорты осуществляется следующим образом. Подсчет количества ЦЭК в периферической крови производился с использованием меченых флуорохромами моноклональных антител к поверхностным маркерам клеток: CD 146-РЕ, в качестве метки для ЦЭК и CD45-PC5 (Beckman Coulter, США), как панлейкоцитарный маркер. Для исследования использовалась цельная венозная кровь, взятая натощак в утренние часы из локтевой вены в стерильные вакуумные пробирки, содержащие 100 мкл 0,5 М ЭДТА (рН 8,0) в качестве антикоагулянта. Полученные данные интерпретировались следующим образом: при количестве ЦЭК менее 8 на 106 лейкоцитов риск разрыва аневризмы в период текущего года оценивают как низкий, т.е. менее 3%, а при их количестве более 35 на 106 лейкоцитов как высокий - от 6% до 35%.
Пороговые значения риска разрыва АБА в зависимости от количества ЦЭК были получены с использованием коммерческой компьютерной программы математического моделирования биомеханического эквивалента риска разрыва аневризмы (A4clinics VASCOPS GmbH, Австрия). Биомеханическая оценка риска разрыва аневризмы с помощью данной программы основана на моделировании целостной оценки риска разрыва путем интеграции расчетных значений, основанных на известных факторах риска с индивидуальными результатами компьютерной томографии АБА. Основным выходным параметром биомеханической оценки риска разрыва АБА являются пиковое напряжение стенки (ПНС) и коэффициент пикового риска разрыва стенки (ПРРС), которым соответствует годовой риск биомеханического разрыва аневризмы в процентах, определенный создателями программы на основании ретроспективного анализа базы данных [12]. Авторами заявляемого способа был проведен корреляционный анализ биомеханических параметров риска разрыва аневризмы с использованием программы A4clinics VASCOPS GmbH, (Австрия) с результатами анализа показателей, ассоциированных с прогрессированием размера АБА: НК-лимфоцитов, моноцитов, ЦЭК, активностью металлопротеиназ 2 и 9 типа. Обнаружилось, что прямая высоко-достоверная корреляция с биомеханическими параметрами имеет место только в отношении количества ЦЭК, как это видно из корреляционной связи между показателями биомеханического метода оценки риска разрыва АБА и значениями клеточных и биохимических маркеров функционального состояния сосудистой стенки, представленной в Таблице 1.
В первой графе таблицы 1 в качестве клеточных маркеров представлены лимфоциты натуральные киллеры (НК клетки), циркулирующие эндотелиальные клетки ((ЦЭК) и моноциты, а биохимических маркеров - металлопротеиназа 2 (ММР2) и металло-протеиназа 9 (ММП9). В оглавлении двух других граф обозначены биомеханические параметры АБА: пиковое напряжение стенки (ПНС) и пиковый риск разрыва стенки (ПРРС). В каждой ячейке представлены коэффициенты корреляции между этими показателями: значение коэффициента корреляции 0,7<r<1,0 - связь сильная прямая; 0,3<r<0,7 - связь умеренная прямая; -0,3<r<0,3 - связь слабая; -0,7<r<-0,3 - связь умеренная обратная; -1,0<r<-0,7 - связь сильная обратная.
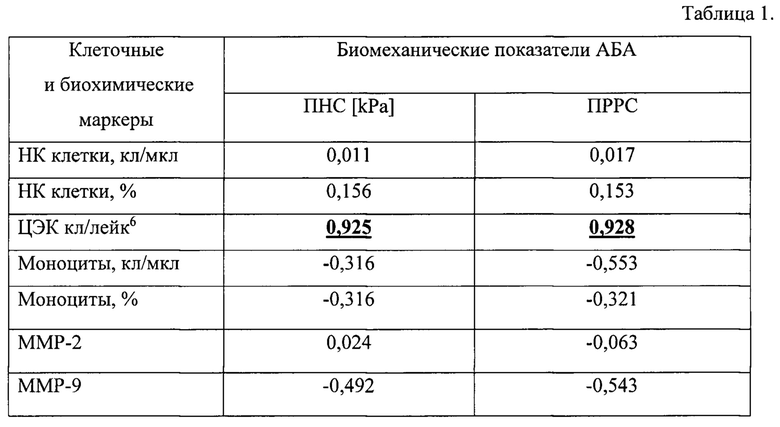
Из Таблицы 1 видно, что прямая высоко-достоверная корреляция с биомеханическими параметрами ПНС и ПРРС имеет место только в отношении количества ЦЭК (r=0,925 и r=928, соответственно), тогда как другие клеточные и биохимические маркеры не имеют выраженной корреляционной связи с биомеханическими параметрами АБА.
По результатам корреляционного анализа было проведено сопоставление вероятности годового риска разрыва АБА по биомеханическим параметрам с данными содержания ЦЭК в крови пациентов.
Разработанный способ позволяет идентифицировать и мониторировать пациентов с высоким риском разрыва АБА с использованием доступного лабораторного оборудования без лучевой нагрузки, связанной с применением компьютерной томографии и дорогостоящих результатов компьютерного анализа томограмм, осуществляемого зарубежным поставщиком.
Сущность и преимущества заявленного способа иллюстрируются приведенными ниже в Таблице 2 результатами определения риска разрыва АБА на основании сопоставления данных биомеханического анализа обследованных пациентов и содержания ЦЭК в крови на примере 7-ми пациентов.
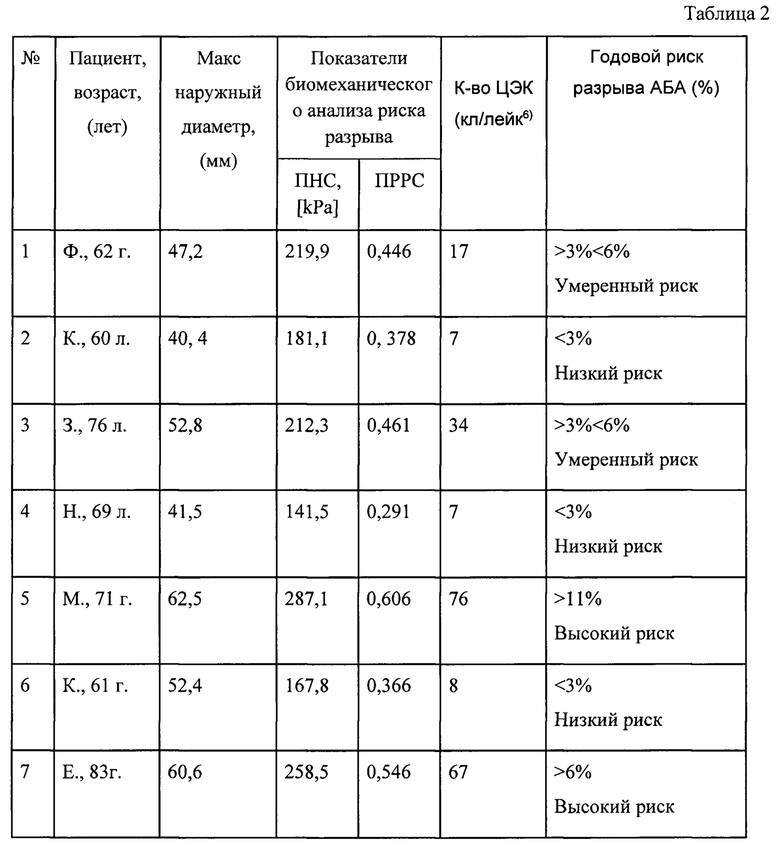
Как видно из приведенных в Таблице 2 сведений, оценка риска разрыва аневризмы по биомеханическим параметрам и по количеству ЦЭК дают совпадающие результаты.
Пример 1. Пациент М., 71 г. с диагностированной аневризмой брюшной аорты. По данным компьютерной томографии у пациента был определен максимальный диаметр веретенообразной аневризмы 62,5 мм, что более значения 50 мм и предусматривает возможность оперативного лечения. При анализе биомеханических параметров аневризмы с помощью программы A4clinics VASCOPS получен коэффициент пикового риска разрыва стенки (ПРРС)=0,606, что характеризует риск разрыва как высокий - более 11% и является показанием к хирургическому вмешательству. Количество ЦЭК, определенное у данного пациента с помощью проточной цитофотометрии - 76 кл/лейк6 также позволяет оценивать риск разрыва как высокий. Пациенту было рекомендовано оперативное лечение.
Пример 2. Пациент К., 61 г. с диагностированной аневризмой брюшной аорты. По данным компьютерной томографии у пациента был определен максимальный диаметр веретенообразной аневризмы 52,4 мм, что более значения 50 мм и может быть основанием для оперативного лечения. Вместе с тем, при анализе биомеханических параметров аневризмы с помощью программы A4clinics VASCOPS получен коэффициент пикового риска разрыва стенки (ПРРС)=0,366, что характеризует риск разрыва как низкий - менее 3%. Количество ЦЭК, определенное у данного пациента с помощью проточной цитофотометрии - 8 кл/лейк6, что также позволяет оценивать риск разрыва как низкий. Пациенту рекомендована консервативная терапия и контрольное обследование через 6 мес. При последующем наблюдении в течение 18 мес. у пациента не было выявлено документированных инструментальных признаков клинических осложнений аневризмы абдоминальной аорты, включая ее разрыв.
Как видно из приведенных конкретных примеров, заявленный способ показал высокий и надежный уровень прогнозирования риска разрыва аневризмы брюшной аорты, характеризуется простотой выполнения исследования с исключением избыточной лучевой нагрузки, неинвазивностью, быстротой получения сведений о риске разрыва аневризмы, более низкой стоимостью по сравнению с продуктом-аналогом и может применяться с использованием доступной приборной базы - проточного цитофотометра.
Список использованных источников информации.
1. Покровский, А.В. Заболевания аорты и ее ветвей / А.В. Покровский // М.: Медицина, 1979. - 328 с.
2. Kent, K.С. Analysis of risk factors for abdominal aortic aneurysm in a cohort of more than 3 million individuals / K.C. Kent, R.M. Zwolak, N.N. Egorova [et al.] // J. Vase Surg. - 2010. - Vol. 52, №3. - P. 539-548.
3. Ашер, А. Сосудистая хирургия по Хаймовичу / А. Ашер, А.В. Покровский // Издательство Бином. - 2012. - Том 1. - 45 с.
4. Должанский, О.В. Аневризма аорты при идиопатическом кистозном медионекрозе Эрдгейма в патолого-анатомической и судебно-медицинской практике / О.В. Должанский, М.А. Шилова, Е.М. Пальцева [и др.] // Архив патологии. - 2016. - Том 78, №4. - С. 3-9.
5. Никоненко, А.А. Медикаментозное лечение аневризмы брюшной аорты. / А.А. Никоненко // Запорожский медицинский журнал. - 2013. - Том 81, №6. - С. 28-31.
6. Sweeting, M.J. Collaborators R. Meta-analysis of individual patient data to examine factors affecting growth and rupture of small abdominal aortic aneurysms / M.J. Sweeting, S.G. Thompson, L.C. Brown [et al.] // Br. J. Surg. - 2012. - Vol. 99, №5. - P. 655-665.
7. Oliver-Williams, C. Lessons learned about prevalence and growth rates of abdominal aortic aneurysms from a 25-year ultrasound population screening programme / C. Oliver-Williams, M.J. Sweeting, G. Turton [et al.] // Br. J. Surg. - 2018. - Vol. 105, №1. - P. 68-74.
8. The UK Small Aneurysm Trial Participants. Mortality results for randomised controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms/Lancet. - 1998. - Vol. 352, №10153. - P. 1649-1655.
9. Патент RU 2722816; 2019.
10. Патент US 7044920; 2003.
11. Патент RU 2771963; 2022 (прототип).
12. Gasser, T.C. A novel strategy to translate the biomechanical rupture risk of abdominal aortic aneurysms to their equivalent diameter risk: Method and retrospective validation / T.C. Gasser, A. Nchimi, J. Swedenborg [et al.] // Europ. J. Vase Endovasc Surg. - 2014. - Vol. 47, №3. - P. 288-295.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ МАРКЕРОВ РАННЕГО И ПОЗДНЕГО РЕМОДЕЛИРОВАНИЯ СУПРАРЕНАЛЬНОГО И ИНФРАРЕНАЛЬНОГО ОТДЕЛОВ АОРТЫ У ПАЦИЕНТОВ С РАЗНОЙ СТЕПЕНЬЮ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ УЛЬТРАЗВУКОВЫМИ МЕТОДАМИ | 2016 |
|
RU2638463C2 |
| СПОСОБ ЭНДОВАСКУЛЯРНОЙ ПРОФИЛАКТИКИ И КОРРЕКЦИИ ЭНДОЛИКОВ I ТИПА ПРИ ЭНДОПРОТЕЗИРОВАНИИ АОРТЫ | 2020 |
|
RU2752029C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ С ГИГАНТСКИМИ АНЕВРИЗМАМИ АОРТЫ | 2019 |
|
RU2736392C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ АНЕВРИЗМЫ БРЮШНОЙ АОРТЫ | 2006 |
|
RU2332939C1 |
| Способ протезирования нисходящего сегмента грудной аорты | 2018 |
|
RU2696756C1 |
| СПОСОБ ОЦЕНКИ СТЕПЕНИ РИСКА РАЗРЫВА АНЕВРИЗМЫ БРЮШНОГО ОТДЕЛА АОРТЫ ПО ДАННЫМ КОМПЬЮТЕРНОЙ АОРТОГРАФИИ | 2022 |
|
RU2792768C1 |
| СПОСОБ ОЦЕНКИ СТЕПЕНИ РИСКА РАЗРЫВА АНЕВРИЗМЫ БРЮШНОГО ОТДЕЛА АОРТЫ ПО ДАННЫМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ | 2023 |
|
RU2806520C1 |
| Система стент-графта для лечения аневризм и расслоения аорты и способ лечения аневризмы и расслоения аорты с ее использованием | 2021 |
|
RU2764567C1 |
| СПОСОБ ОДНОМОМЕНТНОГО ПОЛНОГО ПРОТЕЗИРОВАНИЯ ГРУДНОЙ АОРТЫ | 2020 |
|
RU2755214C1 |
| Способ диагностики травматической дисфункции эндотелия при сочетанной шокогенной травме | 2021 |
|
RU2782135C1 |
Изобретение относится к медицине, а именно к сосудистой хирургии, и может быть использовано для оценки риска разрыва аневризмы абдоминальной аорты. Проводят количественное определение циркулирующих эндотелиальных клеток в сыворотке крови пациента с установленным у него ранее диагнозом аневризмы абдоминальной аорты. Риск разрыва аневризмы абдоминальной аорты определяют по количеству циркулирующих эндотелиальных клеток в сыворотке крови пациента. При значении которых 8 и менее на 106 лейкоцитов оценивают в период текущего года риск разрыва аневризмы абдоминальной аорты как низкий до 3%. При их значении более 35 на 106 лейкоцитов такой риск оценивают как высокий от 6% до 35%. Способ обеспечивает возможность прогнозирования риска разрыва ранее диагностированной аневризмы абдоминальной аорты без использования дорогостоящего оборудования и регулярного мониторинга прогрессирования аневризмы абдоминальной аорты, без дополнительной лучевой нагрузки; за счет определения количества циркулирующих эндотелиальных клеток у пациентов с установленным диагнозом аневризмы абдоминальной аорты, которое строго коррелирует с пиковым напряжением сосудистой стенки, ассоциированным с риском ее разрыва. 2 табл., 2 пр.
Способ оценки риска разрыва аневризмы абдоминальной аорты, включающий количественное определение циркулирующих эндотелиальных клеток в сыворотке крови пациента с установленным у него ранее диагнозом аневризмы абдоминальной аорты, характеризующийся тем, что риск разрыва аневризмы абдоминальной аорты определяют по количеству циркулирующих эндотелиальных клеток в сыворотке крови пациента, при значении которых 8 и менее на 106 лейкоцитов оценивают в период текущего года риск разрыва аневризмы абдоминальной аорты как низкий до 3%, а при их значении более 35 на 106 лейкоцитов такой риск оценивают как высокий от 6% до 35%.
| СПОСОБ ОЦЕНКИ СТЕПЕНИ РИСКА РАЗРЫВА АНЕВРИЗМЫ БРЮШНОГО ОТДЕЛА АОРТЫ ПО ДАННЫМ КОМПЬЮТЕРНОЙ АОРТОГРАФИИ | 2022 |
|
RU2792768C1 |
| Транспортерное приспособление к льнотрепальной машине | 1930 |
|
SU21332A1 |
| US 20180010186 A1, 11.01.2018 | |||
| WO 2019219195 A1, 21.11.2019 | |||
| WO 2012011029 A1, 26.01.2012 | |||
| СВЕТЛИКОВ А.В | |||
| Аневризмы брюшной аорты: концептуальный подход к инвазивным вмешательствам | |||
| Диссер | |||
| СПб | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| DEROO E | |||
| et al | |||
| Endothelial dysfunction in the pathogenesis of abdominal aortic | |||
Авторы
Даты
2023-11-30—Публикация
2022-12-26—Подача