Изобретение относится к преимплантационному генетическому тестированию моногенных заболеваний. В настоящее время в мире насчитывается более 350 миллионов людей, страдающих редким заболеванием (по данным RARE Project). Общее количество таких заболеваний по подсчетам European Organization for Rare Diseases (EURORDIS) варьируется от 5 до 7 тысяч. При этом около 80% редких заболеваний имеют генетическую причину. Известная генетическая основа заболевания позволяет с высокой точностью предсказать не только здоровье уже родившегося ребенка, но и оценить риск рождения такого ребенка при анализе генотипов родителей, а также провести генетическую диагностику на самых ранних этапах. Преимплантационное генетическое тестирование (ГИТ) моногенного заболевания становится мощным инструментом для профилактики таких заболеваний.
Настоящее изобретение относится к способу преимплантационного генетического тестирования лице-лопаточно-плечевой мышечной дистрофии (ЛЛПМД, мышечной дистрофии Ландузи-Дежерина).
Лице-лопаточно-плечевая мышечная дистрофия занимает второе место среди дистрофий по распространенности после миодистрофии Дюшенна. В настоящий момент примерно 87000 людей по всему миру страдают от этого заболевания [https://www.facio-therapies.com/about-fshd/, Saad N, Pyne N, Copeland J, Harper S. Engineering more efficient therapeutic miRNAs for FSHD gene therapy. Mol Ther. 2020; 28:1-592.]. Это заболевание приводит к медленно прогрессирующему ослаблению лицевых мышц, мышц стабилизаторов плечевого пояса, сгибателей стопы. Тяжесть ЛЛПМД сильно варьирует, однако примерно 20% пациентов со временем нуждаются в инвалидном кресле. Генетически выделяют две формы заболевания ЛЛПМД1 и ЛЛПМД2. ЛЛПМД 1 возникает при сокращении количества повторов (менее 10) в D4Z4 локусе гена DUX4 при разрешающем гаплотипе 4qA на 4 хромосоме. [Richard J. F.L. Lemmers, Marielle Wohlgemuth, Rune R. Frants, George W. Padberg, Eva Morava, Silvere M. van der Maarel. Contractions of D4Z4 on 4qB Subtelomeres Do Not Cause Facioscapulohumeral Muscular Dystrophy. The American Journal of Human Genetics.Volume 75, Issue 6. 2004. Pages 1124-1130. https://doi.org/10.1086/426035.] Патогенные варианты в гене SMCHD1 на фоне разрешающего 4qA гаплотипа приводят к ЛЛПМД2. При этом молекулярный механизм возникновения заболевания для обеих форм одинаков: при сокращении количества повторов или нефункционирующем белке гена SMCHD1 снижается метилирование участка гена DUX4, что приводит к экспрессии этого гена и накоплению токсичного белка DUX4. Так как для возникновения заболевания необходимо наличие двух факторов (гаплотип 4qA и сокращение повторов в DUX4 или патогенный вариант в SMCHD1) ЛЛПМД характеризуется дигенным типом наследования.
Молекулярная диагностика этого заболевания крайне сложна с технической точки зрения. Дело в том, что последовательность участка хромосомы 4 с геном DUX4 в высокой степени схожа с последовательностью теломерного участка длинного плеча хромосомы 10, поэтому при определении количества повторов и гаплотипа 4qA/B необходимо отличать информацию о хромосоме 10 и 4. Вторая проблема - это длина исследуемой последовательности. Протяженность одного повтора составляет 3,3 т.п.н., что приводит к необходимости проводить гель-электрофорез с фрагментамии ДНК более 10 т.п.н. и использовать дорогостоящее оборудование.
ПГТ ЛЛПМД проводится для семей, имеющих подтвержденную молекулярно-генетическую природу заболевания. Важно отметить, что обоснование патогенности и каузативности генетических вариантов происходит до проведения ПГТ моногенного заболевания и не входит ни в цели и задачи ПГТ моногенного заболевания, ни в комплекс мероприятий по проведению ПГТ моногенного заболевания. Оценку патогенности проводят по международному стандарту - по критериям, описанным в 2015 году Американским Колледжем Медицинской генетики и Геномики (American College of Medical Genetics and Genomics-Association for Molecular Pathology (ACMG-AMP)) в ходе поиска молекулярно-генетической причины заболевания. ПГТ рекомендуется семьям с высоким риском рождения ребенка с тяжелым (неизлечимым) наследственным заболеванием с установленными патогенными вариантами, обуславливающими этот риск. ПГТ позволяет выбрать из всех эмбрионов, полученных при ЭКО, эмбрионы без патогенных вариантов и, следовательно, без риска развития заболевания.
Основной проблемой при генетической диагностике эмбрионов является малое исходное количество биоматериала, так как биоптат содержит от одной до трех клеток. В этом случае для повышения эффективности и точности анализа важно как полностью исключить возможность т контаминации, так и нивелировать возможный эффект неравномерной и/или неполной амплификации, а также деградации биоматериала. Это требует разработки тест-системы с особыми характеристиками. При этом тест-система разрабатывается с учетом возможности использовать биоматериал разного типа - тотальную ДНК, выделенную из разных тканей, продукт полногеномной амплификации (Whole Genome Amplification, WGA), а также единичные клетки. Сочетание универсальности по отношению к биоматериалу с поэтапной амплификацией целевых фрагментов позволяет проводить анализ нескольких патогенных вариантов для одного образца, в том числе на единичных клетках, а также выявить ситуацию неполной амплификации, контаминации или деградации образца. Еще одной, особенностью ПГТ является отсутствие информации о биологических особенностях эмбриона: в отличие от взрослого человека, у эмбриона могут быть любые хромосомные аномалии, которые усложняют задачу оценки статуса эмбриона по конкретному генетическому варианту. Поэтому тест-система для ПГТ моногенного заболевания должна давать возможность выявить такие случаи и оценить их влияние на достоверность результата диагностики. В случае ЛЛПМД проведение ПГТ-М осложнено молекулярно-генетической природой заболевания, так как при анализе генома единичных клеток нет возможности получить длинные фрагменты ДНК, а для диагностики этого заболевания исследуют фрагменты более 10 т.п.н. Это делает невозможным прямую диагностику наличия патогенного варианта в гене DUX4 в виде уменьшения количества повторов.
Описания близкого технического решения не обнаружено в общедоступных источниках.
Представленный нами метод ПГТ ЛЛПМД решает задачу разработки точного способа преимплантационного генетического тестирования этого ? моногенного заболевания, который можно было бы применять на биоматериале различного типа: ДНК, выделенную из разных тканей, продукт полногеномной амплификации (WGA), единичные клетки.
Техническим результатом стало создание тест-системы для диагностики патогенного варианта (уменьшение количества повторов в локусе D4Z4) в гене DUX4 с двойной системой детекции - детекция наличия разрешающего гаплотипа 4qA и косвенное выявление унаследованного патогенного варианта от родителя с заболеванием. Детекция разрешающего гаплотипа 4qA проводится с помощью SSLP (Simple Sequence Length Polymorphisms, полиморфизм длин простой последовательности) анализа: определение длины фрагментов в особом участке, который располагается в 3,5 т.п.н. проксимальнее гена DUX4. Из-за высокой гомологичности последовательностей этого участка между хромосомой 4 и 10 мы выявляем гаплотип четырех хромосом в этом анализе (двух четвертых хромосом и двух десятых хромосом), хотя информация о хромосоме 10 не является значимой в отношении заболевания. Определение гаплотипа 4qA/B у эмбриона позволяет снизить риск ошибки тестирования из-за рекомбинантных хромосом, так как отсутствие разрешающего гаплотипа 4qA является достаточным для подтверждения того, что эмбрион не унаследовал заболевание. Для SSLP анализа биоматериала эмбрионов мы оптимизировали протокол амплификации фрагмента ДНК с праймерами, опубликованными ранее Lemmers RJ и коллегами [Lemmers RJ, Wohlgemuth М, van der Gaag KJ, van der Vliet PJ, van Teijlingen CM, de Knijff P, Padberg GW, Frants RR, van der Maarel SM. Specific sequence variations within the 4q35 region are associated with facioscapulohumeral muscular dystrophy. Am J Hum Genet. 2007 Nov;81(5):884-94]. В данной работе эти праймеры использовались с целью изучения вариаций нуклеотидных последовательностей в области локуса D4Z4 и выделения определенных гаплотипов в популяции. Протокол амплификации был опубликован авторами позднее на сайте Медицинского центра Рочестерского университета [Lemmers RJ. Genotyping of the SSLP. LUMC, Leiden, The Netherlands. Internet: https://www.urmc.rochester.edu/MediaLibraries/URMCMedia/fields-center/documents/SSLPanalysis2010-6-3watermark.pdf (Дата посещения страницы - 24.10.2022)]. При использовании данных праймеров, длина получаемого фрагмента в 161 п. н. соответствует гаплотипу 4qA. Представленный в документе протокол подходит для геномной ДНК, поэтому на его базе нами был разработан новый протокол для ПГТ-М, позволяющий проводить анализ в условиях малого количества ДНК и необходимости амплифицировать и другие фрагменты ДНК в * мультиплексной ПЦР. Праймеры, представленные в статье, были использованы в обоих раундах ПЦР. Протокол, использованный в работе Lemmers RJ и коллегами был следующим: этап денатурации при температуре 98°С в течение 3 минут, затем 32 цикла: денатурация 98°С 15 секунд, отжиг праймеров - 60°С 30 секунд, синтез матрицы - 72°С 15 секунд, этап достройки всех матриц 72°С 30 минут.Состав смеси был следующим: на один образец приходилось 14,5 мкл воды, свободной от нуклеаз, 5 мкл HF-ГЩР буфера, 2,5 мкл смеси деоксинуклеотидов концентрацией 2 мМ, по 0,4 мкл каждого праймера концентрацией 10 мкМ, 0,2 мкл полимеразы Phusion и по 2 мкл геномной ДНК концентрацией 2,5 нг/мкл. Наше нововведение заключается в добавлении 1 го раунда мутиплексной ПЦР, где упомянутые в статье праймеры используются наряду с праймерами для косвенной диагностики, что будет подробнее описано ниже.
Длина получаемого фрагмента в 161 п. н. не является эксклюзивной для гаплотипа 4qA. В редких случаях (у 0,7% Европейской популяции) эта длина может сочетаться с гаплотипом 4qB. Однако, при наличии у пациента клинического диагноза ЛЛПМД, можно быть уверенными, что фрагмент длиной 161 у данного человека точно соответствует гаплотипу 4qA, так как без этого гаплотипа у пациента не развилось бы заболевание. Соответственно, эмбрионы, унаследовавшие от пациента этот аллель, унаследуют и само заболевание.
Косвенная диагностика заключается в анализе наследования молекулярно-генетических маркеров, сцепленных с патогенным вариантом. Для этого на расстоянии не более 5 мБ (что соответствует 5% кроссинговера в среднем) от гена DUX4 были выбраны полиморфные локусы, называемые STR (short tandem repeat - короткий тандемный повтор), с гетерозиготностью не менее 0,70 для обеспечения максимальной информативности косвенной диагностики. Сложность косвенной диагностики ЛЛПМД заключается в том, что исследуемый регион находится рядом с теломерой, поэтому STR для анализа находятся только с одной стороны. Это снижает точность анализа, так как не позволяет отследить события рекомбинации, когда маркеры, у родителя сцепленные с патогенным вариантом, могут оказаться сцеплены с непатогенным аллелем у эмбриона и наоборот.При этом вероятность рекомбинации для этого региона повышена из-за особенностей его последовательности и наличия гомологичных участков на хромосоме 10. Поэтому важным достижением разработанной тест-системы стало сочетание косвенной диагностики с адаптированным для условий ПГТ-М SSLP анализом. Для каждого из STR локусов были подобраны праймеры для амплификации по типу гнездовой или полугнездовой ПЦР в 2 раунда, позволяющей повысить точность и эффективность амплификации. В тест-систему были включены 12 STR локусов для гена DUX4: D4S3032, D4S2349, D4S171, D4S1540, D4S2688, D4S426, D4S2299, D4S2390, D4S1652, D4S2930, D4S2283, D4S1523. Праймеры для амплификации находятся на - хромосоме в районе координат 186018023-190311520 (в соответствии с hg19). Последовательности праймеров для амплификации фрагментов ДНК, содержащих перечисленные STR локусы указаны в формуле изобретения в перечне SEQ ID NO 1-39. Важно отметить, что при подборе праймеров соблюдали ряд особенных требований: длина продукта с внешними праймерами для первого раунда ПЦР не должна превышать 500 п. н. (для наработки с фрагментов, получаемых при полногеномной амплификации), длина продукта с внутренних праймеров для второго раунда ПЦР от 120 до 350 п. н., высокая специфичность внешних праймеров, температура отжига не отличается более, чем на 1°С.
Подготовительный этап ПГТ
На подготовительном этапе проводится отработка тест-системы: подбор условий амплификации, оптимальных для работы праймеров, анализ эффективности и специфичности ПЦР-амплификации в обоих раундах, оценки универсальности тест-системы для биообразцов различного типа (ДНК, продукт WGA, единичные клетки). При отработке тест-системы были приготовлены стоковые разведения праймеров с концентрацией ЮОтМ, и рабочие разведения комбинаций праймеров (комбинация пар праймеров для 1 и 2 раунда ПЦР) с концентрацией ЮтМ каждого праймера в растворе. Так как в рамках диагностики клинического материала могут быть использованы различные типы матриц, при отработке тест-системы были использованы две биопсии единичных клеток, находящихся в специальном лизирующем буфере (1×PCR Buffer, 0,1% Tween-20, 0,1% Triton Х-100, 1 мкг Proteinase K), два образца продуктов полногеномной амплификации биопсиий эмбриона (WGA), а также тотальной ДНК членов семьи, выделенной из крови, для составления родословной и выявления сцепления патогенного варианта с аллелями полиморфных маркеров.
В рамках гнездовой и полугнездовой ПЦР амплификация проводится в два этапа. На первом этапе проводится мультиплексная ПЦР со всеми внешними праймерами для всех локусов, входящих в тест-систему, для обогащения образца всеми целевыми фрагментами. На втором этапе проводится индивидуальная амплификация каждого фрагмента с внутренними праймерами.
Полугнездовая ПЦР
Для первого этапа были подобраны внешние высокоспецифичные праймеры для амплификации фрагментов от 300 до 500 п. н. Для второго этапа были подобраны праймеры для амплификации фрагментов длиной не более 350 пар оснований, а также были введены метки для детекции методом фрагментного анализа. Последовательности праймеров для амплификации фрагментов ДНК, содержащих STR локусы указаны в формуле изобретения в перечне SEQ ID NO 1-39. Для SSLP анализа в обоих раундах использовались одни и те же ранее опубликованные праймеры: прямой 5'-GGTGGAGTTCTGGTTTCAGC-(HEX)-3' и обратный 5'-CCTGTGCTTCAGAGGCATTTG-3'. ПЦР-смесь для первого раунда амплификации содержала 1×ПЦР буфер с Mg2+ (Евроген, Россия), 0.1 тМ каждого деоксинуклеотида, 0.15 дМ каждого праймера, 2,5 U/μl ДНК полимеразы HsTaq (Евроген, Россия), 6% диметилсульфоксида (DMSO) и 1 мкл тотальной ДНК или 2,5 мкл WGA или 5 мкл лизирующего буфера с образцом в качестве матрицы. Первый этап амплификации проводился по следующему протоколу: этап денатурации 94°С в течение 2 минут, 30 циклов с понижением температуры отжига праймеров с 62 до 45°С в каждом, этап достройки всех матриц 72°С 10 минут. Далее продукты 1-ого этапа были разнесены в индивидуальные пробирки с одной парой праймеров на определенный локус.
В состав ПЦР смеси для второго этапа входили 1×ПЦР буфер с Mg2+ (Евроген, Россия), 0.5×RediLoad™ загрузочный буфер (Thermo Fisher Scientific, USA), 0.2 mM каждого деоксинуклеотида, 0.2 дМ каждого праймера, 1U/μ1 ДНК полимеразы HsTaq (Евроген, Россия), 6% диметилсульфоксида (DMSO) и 1 д1 ПЦР-продукта первого этапа амплификации в качестве матрицы. Второй этап амплификации проводился по следующему протоколу: этап денатурации 95°С в течение 2 минут, 35 циклов: денатурация 95°С 30 секунд, отжиг праймеров - 57°С 30 секунд, синтез матрицы - 72°С 1 минута, этап достройки всех матриц 72°С 5 минут., Оценку эффективности и специфичности амплификации проводили с помощью электрофореза в 2% агарозном геле. Результат электрофореза в агарозном геле позволяет определить необходимую степень разведения продуктов амплификации для нанесения на фрагментный анализ (продукты амплификации ДНК членов семьи). Для SSLP анализа второй этап амплификации отличался от второго этапа для амплификации STR локусов. В состав ПЦР смеси для второго этапа входили 1× HF буфер (Thermo Fisher Scientific, USA), 0.5×RediLoad™ загрузочный буфер (Thermo Fisher Scientific, USA), 0.2 mM каждого дезоксинуклеотида, 0.2 дМ каждого праймера, 1U/μ1 ДНК полимеразы Phusion enzyme (Thermo Fisher Scientific, USA) и 3 μl ПЦР-продукта первого этапа амплификации в качестве матрицы. Второй этап амплификации проводился по ранее опубликованному протоколу: этап денатурации 98°С в течение 3 минут, 32 циклов: денатурация 98°С 15 секунд, отжиг праймеров - 60°С 30 секунд, синтез матрицы - 72°С 15 секунд, этап достройки всех матриц 72°С 30 минут.
Фрагментный анализ продуктов амплификации проводится с помощью капиллярного электрофореза на приборе 3130×1 Genetic Analyzer (Applied Biosystems, USA). По результатам фрагментного анализа составляется родословная и отмечаются информативные полиморфные STR-локусы для каждой семьи, которые в дальнейшем используются в клинической диагностике. Локусы делятся на неинформативные (носитель патогенного варианта гомозиготен по этому локусу), полуинформативные (на некоторых из родительских хромосом аллели по этому маркеру совпадают), информативные (на всех хромосомах родителей аллели этого маркера разные, что дает возможность отличить каждую из них при анализе генотипа эмбриона).
Пример 1
Пациенты А
В ЦГРМ Генетико обратилась семья А, в которой партнер страдал от ЛЛПМД, вызванной сокращением количества повторов D4Z4 в гене DUX4 при разрешающем гаплотипе 4qA. Паре было рекомендовано проведение ПГТ заболевания ЛЛПМД в рамках ЭКО для отбора эмбрионов, не унаследовавших заболевание.
Гаплотипирование семьи
На первом этапе был получен биоматериал (периферическая кровь) супругов и их родителей, а также здорового брата супруга с заболеванием для детекции патогенного варианта и выявления групп сцепления аллелей полиморфных маркеров. Последовательности праймеров для амплификации фрагментов ДНК, содержащих STR локусы указаны в формуле изобретения в -перечне SEQ ID NO 1-39. Было проанализировано 12 STR локусов. Из них 10 оказались информативными по партнеру. Таким образом, образцы эмбрионов тестировались только на информативные маркеры.
Аллели полиморфных маркеров партнера пациентки, сцепленные с гаплотипом 4А161 будут считаться патогенными, так как у всех пациентов с ЛЛПМД был обнаружен этот гаплотип и другого общего для всех пациентов галотипа 4q в локусе D4Z4 не описано. Однако из-за того, что ни у одного из родственников партнера пациентки нет этого заболевания, важно отметить, что сцепление с патогенным аллелем предположительное и основано на статистических данных об описанных пациентах с ЛЛПМД. Определение гаплотипа у партнера и его матери проводилось вне рамок ПГТ-М и было подтверждено как методом SSLP так и секвенированием по Сенгеру.
Аллели полиморфных маркеров, совпадающие у партнера и его матери - также носителя гаплотипа 4А161 в локусе D4Z4 - признавались сцепленными друг с другом и с патогенным вариантом. Аллели полиморфных маркеров, совпадающие у партнера и его отца, признавались сцепленными друг с другом и с нормальным аллелем локуса D4Z4, так как у отца не было обнаружено разрешающего гаплотипа 4А161 в локусе D4Z4. Гаплотипирование пациентки проводилось подобным образом. Аллели полиморфных маркеров, совпадающие у пациентки и ее отца, признавались сцепленными друг с другом и с нормальным аллелем локуса D4Z4. Аллели полиморфных маркеров, совпадающие у пациентки и ее матери, признавались сцепленными друг с другом и с нормальным аллелем локуса D4Z4.
В результате гаплотипирования и определения групп сцепления для семьи А из примера были получены результаты, представленные в таблице 1. Аллели, указанные на одной строке, располагаются на одной хромосоме, то есть, представляют группу сцепления. Таким образом для каждого члена семьи представлено 2 группы сцепления, соответствующие каждой из двух четвертых хромосом. Цифрами в таблице записаны длины ампликонов в парах нуклеотидов; их длины зависят от количества повторов в маркере STR.
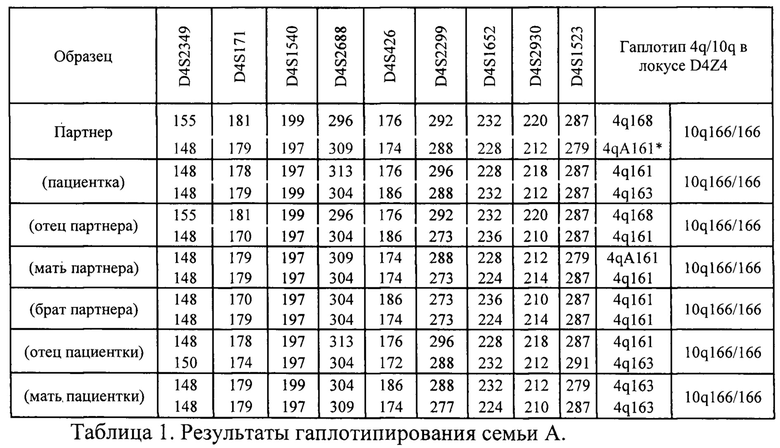
В результате гаплотипирования был сделан вывод, что у партнера пациентки с патогенным вариантом были сцеплены следующие аллели STR-маркеров: D4S2349 - 148, D4S171 - 179, D4S1540 - 197, D4S2688 - 309, D4S426 - 174, D4S2299 - 288, D4S1652 - 228, D4S2930 - 212, D4S1523 - 279
Преимплантационное генетическое тестирование
В цикле ЭКО было получено 4 эмбриона, проведена биопсия на 5 день развития (в клинике ЭКО), биоптат в буфере для WGA (lxPBS (Invitrogen, США), 1% поливинилпирролидона (PVP) (Fertipro, Бельгия)) направлен в лабораторию «Генетико». Для контроля контаминации на разных этапах работы с образцом в лаборатории разработана система контролей: контроль контаминации буфера для биопсии, контроль контаминации при транспортировке (одна пробирка с буфером не открывается эмбриологом), контроль контаминации каждого образца (проба среды из последней отмывочной капли биопсиийного материала). Все эти контроли вместе с образцами проходят этап полногеномной амплификации, после которого будет заметно малейшее количество ДНК, контаминировавшей контроли. Полногеномную амлификацию проводили с помощью коммерческого набора SurePlex (Illumina, США).
Продукт полногеномной амплификации, а также ДНК всех членов семьи амплифицировали в 1 этапе в мультиплексной ПЦР с праймерами для детекции патогенного варианта и праймерами для информативных для семьи А полиморфных маркеров в соответствии с разработанным в рамках подготовительного этапа протоколом для тест-системы. На 2 этапе амплификацию проводили для каждого маркера отдельно в соответствии с разработанным протоколом для тест-системы. Таким образом были установлены группы сцепления, унаследованные каждым эмбрионом. Полученные результаты представлены в таблице 2.
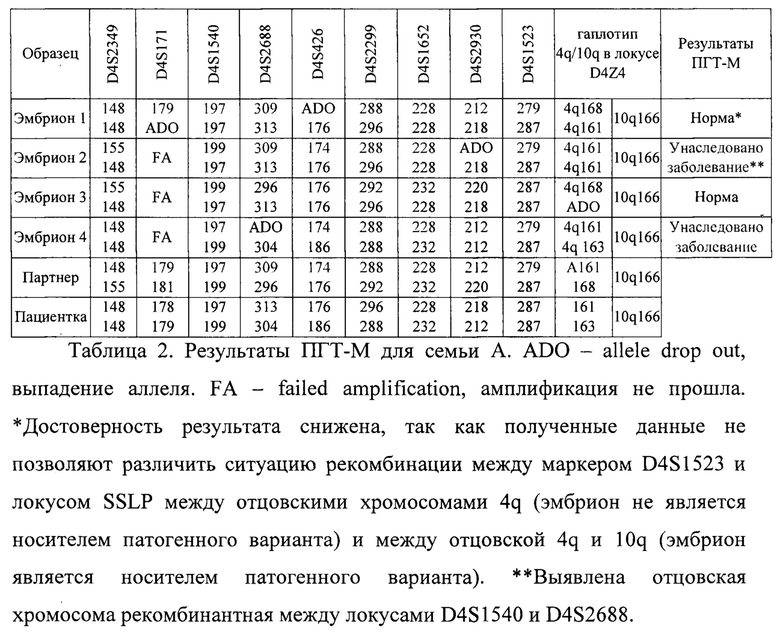
По результатам диагностики 2 эмбриона (эмбрион 1 и 3) не унаследовали заболевание. При этом достоверность результата для эмбриона 1 снижена, так как полученные данные не позволяют различить ситуацию рекомбинации между маркером D4S1523 и локусом SSLP между отцовскими хромосомами 4q (эмбрион не является носителем патогенного варианта) и между отцовской 4q и 10q (эмбрион является носителем патогенного варианта). У эмбрионов 2 и 4 выявлен гаплотип, соответствующий унаследованному заболеванию. По запросу пациентов эмбриону 3 было проведено тестирование на хромосомные аномалии. По результатам всех проведенных тестов эмбрион 3 был рекомендован к переносу.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Способ
преимплантационного генетического тестирования
лице-лопаточно-плечевой мышечной дистрофии.xml" softwareName="WIPO
Sequence" softwareVersion="2.2.0" productionDate="2023-02-28">
<ApplicantFileReference>Способ преимплантационного генетического
тестирования лице-лопаточно-плечевой мышечной
дистрофии</ApplicantFileReference>
<ApplicantName languageCode="ru">Публичное акционерное общество
«Центр Генетики и Репродуктивной Медицины «ГЕНЕТИКО»</ApplicantName>
<ApplicantNameLatin>GENETICO PJSC</ApplicantNameLatin>
<InventionTitle languageCode="ru">Способ преимплантационного
генетического тестирования лице-лопаточно-плечевой мышечной
дистрофии</InventionTitle>
<SequenceTotalQuantity>39</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cgctgtagaaaagtgaaatga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gctagaaatcggaccatttaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>25</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..25</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgtaaattcttattacctgctttca</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>taaccttgtgtagctgccat</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gcctcacttttggaatcagt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>24</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..24</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q12">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgtagttttataggccaaattcag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q14">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggaaagctcatttgaaagtatgt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="8">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q16">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ctcccaaatctaaacccatc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="9">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q18">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgggtaaagagtgaggctg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="10">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q20">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gacatagtcctccttttgtcgt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="11">
<INSDSeq>
<INSDSeq_length>17</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..17</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q22">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gattttgggggtgggat</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="12">
<INSDSeq>
<INSDSeq_length>18</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..18</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q24">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cttgaacccgtgaagtgg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="13">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q26">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cagggtgatcgaaactcag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="14">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q28">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aggggaaactatggaataacag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="15">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q30">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gataacagtgacgttccatgtc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="16">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q32">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgtgaaatgaccacagtcaag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="17">
<INSDSeq>
<INSDSeq_length>18</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..18</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q34">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>agaatggcatgaacctgg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="18">
<INSDSeq>
<INSDSeq_length>25</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..25</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q36">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atacactgcatccatatatacaagg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="19">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q38">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>agctcttggttctcggatc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="20">
<INSDSeq>
<INSDSeq_length>18</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..18</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q40">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgtgccgttctactggtg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="21">
<INSDSeq>
<INSDSeq_length>17</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..17</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q42">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gtgaacgaatgcccatg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="22">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q44">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aaacggataccaacaccag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="23">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q46">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>agagaggctgatgtaaagtgag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="24">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q48">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ctcattttcccctttccact</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="25">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q50">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gtggttttcatcatgagatgc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="26">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q52">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aggactgaaaacacctgtagc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="27">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q54">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gagaattttccattagccaga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="28">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q56">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ccagtgattacagtttgtggt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="29">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q58">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgtgtccacttatgttggct</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="30">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q60">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgcccaccatttgtacaat</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="31">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q62">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tcatggtaggttaatcccacg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="32">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q64">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgcccaccatttgtacaatg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="33">
<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q66">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aactgctactatttatgccactg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="34">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q68">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggatggtagagtgaagatgcta</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="35">
<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q70">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gaaatcgaccaggatataattga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="36">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q72">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggacatagcatttctacagcag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="37">
<INSDSeq>
<INSDSeq_length>18</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..18</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q74">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gccttctactcacatgcg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="38">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q76">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aaacccgacctcaactctaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="39">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q78">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tttgcatcaccatctagtcc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ преимплантационного генетического тестирования синдрома Мартина-Белл | 2022 |
|
RU2796834C1 |
| Способ преимплантационного генетического тестирования синдрома Смита-Лемли-Опица | 2023 |
|
RU2816650C1 |
| Способ преимплантационного генетического тестирования ахондроплазии | 2022 |
|
RU2795482C1 |
| Способ преимплантационного генетического тестирования наследственной зонулярной катаракты | 2022 |
|
RU2799541C1 |
| Способ преимплантационного генетического тестирования болезни Штаргардта | 2023 |
|
RU2831940C1 |
| Способ преимплантационного генетического тестирования спондилоэпифизарной дисплазии | 2022 |
|
RU2803650C1 |
| Способ преимплантационного генетического тестирования болезни Гентингтона | 2024 |
|
RU2840728C1 |
| Способ преимплантационного генетического тестирования Синдрома Марфана | 2023 |
|
RU2837158C1 |
| Способ преимплантационного генетического тестирования синдрома Альпорта | 2022 |
|
RU2795481C1 |
| Способ преимплантационного генетического тестирования остеопетроза 4 типа | 2022 |
|
RU2795483C1 |
Изобретение относится к медицинской генетике. Описан способ преимплантационного генетического тестирования лице-лопаточно-плечевой мышечной дистрофии. Выявляют наследование патогенного варианта - уменьшение количества повторов в локусе D4Z4 в гене DUX4, с двойной системой детекции - прямая детекция наличия разрешающего гаплотипа 4qA и косвенное выявление унаследованного патогенного варианта от родителя с заболеванием. Прямую детекцию наличия разрешающего гаплотипа 4qA осуществляют с помощью праймеров для амплификации: прямой GGTGGAGTTCTGGTTTCAGC-(HEX) и обратный CCTGTGCTTCAGAGGCATTTG. Косвенную детекцию осуществляют с помощью праймеров для анализа наследования молекулярно-генетических маркеров типа STR, сцепленных с патогенным вариантом, выбранных из SEQ ID NO: 1-39. При этом используют праймеры, направленные на те STR, аллели которых разные на хромосомах родителей, при этом диагностику проводят в два этапа полугнездовой ПЦР: на первом этапе проводят мультиплексную ПЦР с внешними праймерами, на втором этапе проводят индивидуальную ПЦР каждого фрагмента с внутренними праймерами для STR, а также ПЦР в 2 раунда для прямой детекции наличия разрешающего гаплотипа 4qA. Изобретение расширяет арсенал средств преимплантационного генетического тестирования лице-лопаточно-плечевой мышечной дистрофии. 2 табл., 1 пр.
Способ преимплантационного генетического тестирования лице-лопаточно-плечевой мышечной дистрофии, предусматривающий выявление наследования патогенного варианта - уменьшение количества повторов в локусе D4Z4 в гене DUX4, с двойной системой детекции - прямая детекция наличия разрешающего гаплотипа 4qA и косвенное выявление унаследованного патогенного варианта от родителя с заболеванием, где прямую детекцию наличия разрешающего гаплотипа 4qA осуществляют с помощью праймеров для амплификации: прямой 5'-GGTGGAGTTCTGGTTTCAGC-(HEX)-3' и обратный 5'-CCTGTGCTTCAGAGGCATTTG-3', а косвенную детекцию осуществляют с помощью праймеров для анализа наследования молекулярно-генетических маркеров типа STR, сцепленных с патогенным вариантом, выбранных из SEQ ID NO: 1-39, при этом используют праймеры, направленные на те STR, аллели которых разные на хромосомах родителей, при этом диагностику проводят в два этапа полугнездовой ПЦР: на первом этапе проводят мультиплексную ПЦР с внешними праймерами, на втором этапе проводят индивидуальную ПЦР каждого фрагмента с внутренними праймерами для STR, а также ПЦР в 2 раунда для прямой детекции наличия разрешающего гаплотипа 4qA.
| RU 2775416 C1, 30.06.2022 | |||
| WO 2010104025 А1, 16.09.2010 | |||
| Л.Г | |||
| КИРИЛЛОВА, А.А | |||
| ШЕВЧЕНКО и др | |||
| Лице-лопаточно-плечевая миодистрофия Ландузи-Дежерина в клинике нейропедиатрии | |||
| Здоровье ребенка, 2011, 1(28), стр.124-128. |
Авторы
Даты
2023-12-05—Публикация
2023-03-02—Подача