Изобретение относится к экспериментальной медицине и онкологии, а именно к фотодинамической терапии (ФДТ) и химиотерапии (XT) и может быть использовано для лечения злокачественного образования - соединительнотканной опухоли саркома М-1 крыс.
На протяжении многих лет борьбы с онкологическими заболеваниями происходит совершенствование хорошо известных методов лечения, а также активная разработка новых методов противоопухолевой терапии. Все методы лечения направлены на максимальное уничтожение опухолевых клеток. Для каждого метода характерны различные механизмы воздействия на опухолевые клетки, вызывающие их гибель. Эффективность лечебного воздействия определяется длительностью торможения роста опухоли от начала воздействия.
Фотодинамическая терапия (ФДТ) относится к локальным формам терапии. Этот метод лечения злокачественных опухолей основан на способности ФС селективно накапливаться в опухолевой ткани вследствие особенностей биохимии опухолевых клеток, а дальше под воздействием лазерного света с определенной длинной волны генерировать активные формы кислорода (АФК), оказывающие цитотоксический эффект на клетки опухолевого узла. Во время сеанса ФДТ в опухолевых клетках происходит разрушение органелл и различных биомолекул под действием главного цитотоксического агента - синглетного кислорода. По мере прогрессирования повреждений и вовлечения в этот процесс различных сигнальных систем клетки, может индуцироваться ее апоптоз. В случае исследований на животных важными могут быть и непрямые эффекты, такие как, ишемический некроз вследствие повреждения сосудов опухоли. Эффекты ФДТ можно модулировать, меняя дозу, конъюгируя фотосенсибилизаторы с липопротеинами или химиопрепаратами, включая ФС в липосомы или наночастицы. При этом использование ФДТ имеет свои пределы и это, прежде всего, ограниченная глубина повреждения опухолевой ткани. При этом ФДТ имеет преимущества перед химиотерапией, включая избирательность поражения, отсутствие рисков хирургического вмешательства и тяжелых системных осложнений, низкую стоимость лечения. Во многих странах мира ученые и клиницисты ведут исследования, направленные на разработку новых и оптимизацию уже существующих режимов ФДТ злокачественных опухолей различных морфологических типов и локализаций, а также на создание новых более эффективных и безопасных лекарственных средств - фотосенсибилизаторов (ФС).
В качестве ФС использовали дипропоксибактериопурпурин (DPBP) - производное природного бактериохлорофилла а. Такие фотосенсибилизаторы перспективны благодаря их поглощению в ближней ИК-области спектра (700-830 нм), где проницаемость света в ткани максимальна, что позволяет воздействовать на глубокозалегающие пораженные ткани.
Химиотерапия (XT) - это медикаментозный метод лечения в онкологии. Для его реализации используются цитотоксические средства, направленные на гибель опухолевых клеток. Противоопухолевая XT способна тормозить пролиферацию опухолевых клеток или приводить к их полной гибели. Но все химиопрепараты оказывают побочное (токсическое) действие на нормальные интенсивно пролиферирующие ткани - костный мозг, клетки иммунной системы и это, в свою очередь, усугубляет течение опухолевого процесса. Важнейшим принципом XT является соблюдение правил применения препарата: дозировка, способ введения, интервалы между введениями.
Современный подход при создании новых противоопухолевых препаратов основан на определении молекулярных мишеней, специфических для раковых клеток, и нацелен на поиск ингибиторов этих мишеней. В этом направлении ведется активный поиск индукторов апоптоза опухолевых клеток, ингибиторов ангиогенеза, важнейших ферментов нуклеинового обмена - топоизомераз I и II, теломеразы, протеинкиназ различных типов, регулирующих клеточный цикл, и препаратов, преодолевающих лекарственную устойчивость опухолевых клеток.
Химиопрепарат - Доксорубицин (DOX) - пористая масса красного цвета, активное вещество: доксорубицина гидрохлорид - 10 мг; вспомогательное вещество: маннитол (маннит) - 40 мг. Противоопухолевый антибиотик антрациклинового ряда, известный с конца 1960-х годов, который оказывает антимитотическое и антипролиферативное действие. Производится полусинтетически, исходя из даунорубицина, а также продуцируется микроорганизмами Streptomyces coeruleorubidus или Streptomyces peucetius. Цитотоксическое действие доксорубицина в отношении злокачественных клеток обусловлено интеркаляцией в ДНК, а также способностью доксорубицина связываться с липидами клеточной мембраны. Клетки чувствительны к препарату в S- и G2- фазах митоза. Интеркаляция ингибирует репликацию нуклеотидов и активность ДНК- и РНК-полимераз. Взаимодействие доксорубицина с топоизомеразой II с образованием ДНК-расщепляемых комплексов считают важным механизмом цитотоксического действия доксорубицина. Связь с белками плазмы составляет около 75%. После внутривенного введения быстро элиминируется из крови, концентрируясь в печени, почках, миокарде, селезенке, легких. Однако серьезными недостатками доксорубицина является отсутствие селективности распределения в организме, специфичности в отношении опухоли и, как следствие, развитие серьезных побочных реакций при его применении, включая поражение многих органов и тканей: сердца, почек, костного мозга и других, причем именно кардиотоксичность является лимитирующим фактором, препятствующим эскалации дозы цитостатика, и, соответственно, достижению высокой эффективности.
Сочетанная терапия или комбинированная терапия.
ХТ+ФДТ или ФДТ+ХТ - это методы лечения злокачественных новообразований, позволяющие минимизировать негативные побочные эффекты, присущие каждому из применяемых методов в отдельности за счет снижения дозы каждого. Все химиопрепараты оказывают побочное (токсическое) действие на нормальные интенсивно пролиферирующие ткани - костный мозг, клетки иммунной системы и это, в свою очередь, усугубляет течение опухолевого процесса. Фотодинамическая терапия сама по себе имеет ряд преимуществ, в том числе, отсутствие тяжелых местных и системных осложнений. Кроме того, в основе лечебного действия лазерного излучения лежит нормализация трофических процессов, бактерицидное действие, усиление действия лекарственных препаратов, усиление иммунных и регенеративных процессов, местные и системные изменения микроциркуляции, связывание токсинов в крови и др. Но при проведении ФДТ не всегда достигается необходимый эффект из-за недостаточной глубины воздействия света. Перспективным высокоэффективным методом в лечении злокачественных новообразований является комбинированное применение XT и ФДТ, что позволяет достичь не только большей противоопухолевой эффективности, но и снятия повреждающего действия химиопрепаратов.
Известна фосфолипидная композиция доксорубицина для лечения больных раком молочной железы (RU 2714137 C1), а также опухолей другой локализации на основе доксорубицина в фосфолипидной матрице с размером частиц 10-20 нм, включающая фосфолипид растительного происхождения с содержанием фосфатидилхолина не менее 95%, доксорубицина гидрохлорид и мальтозу при следующем соотношении компонентов, мас. %: доксорубицина гидрохлорид 0,9-1,1; фосфолипид 18-22; мальтозы моногидрат 76,9-81,1. Технический результат - уменьшение токсичности композиции в целом при сохранении ее терапевтической эффективности, снижение выраженности ладонно-подошвенного синдрома у больных, получающих химиотерапевтическое лечение, снижение стоимости курса лечения.
Однако, для получения значимого противоопухолевого эффекта 10-15 мг/кг необходима большая доза доксорубицина.
Известна фармацевтическая композиция для лечения онкологических заболеваний в форме фосфолипидных наночастиц размером 10-30 нм, включающей фосфатидилхолин, мальтозу и доксорубицин при следующем соотношении компонентов, мас. %: фосфатидилхолин 20-43, мальтоза 55-78, доксорубицин 2-8 (RU 2411935 С1). Композиция активнее накапливается в ткани опухоли и эффективнее тормозит рост опухоли у мышей с карциномой LLC по сравнению со свободным доксорубицином.
Недостаток данного исследования - большая доза доксорубицина необходимая для получения значимого противоопухолевого эффекта 15 мг/кг (суммарно за курс).
Известен способ комбинированного органосохраняющего лечения злокачественных опухолей орбиты (RU 2286187 C1). Технический результат достигается благодаря комбинации трех способов: орбитотомии с иссечением опухоли ad maximum, фотодинамической терапии с использованием дозы фотосенсибилизатора Фотосенса 10 мг/кг и при равномерном распределении световой энергии в полости орбиты после иссечения опухоли и при выбранном режиме лазерного воздействия, а также химиотерапии. Облучение лазерным излучением с длиной волны 670 нм, находящейся в максимуме спектра поглощения применяемого фотосенсибилизатора с суммарной плотностью мощности 120-800 мВт/см2. Химиотерапия применяется по одному из известных классических рекомендуемых вариантов, например, винкристин + циклофосфан + актиномицин Д или топотекан + циклофосфамид и/или топотекан + циклофосфамид + винкристин или любая другая схема, выбор которой определяется гистогенезом опухоли и ее чувствительностью к химиопрепаратам
Недостаток данного исследования - большая доза химиотерапевтического воздействия и большая доза ФС 10,0 мг/кг.
Самым близким (прототипом) является способ лечения рака легкого (RU 2682293 С2). Осуществляют эндоскопическую фотодинамическую терапию (ФДТ), сначала внутривенно капельно в течение от 30 до 40 мин вводят фотосенсибилизатор «Фотолон» в дозе от 1,1 до 1,4 мг/кг массы тела больного. Через 3 ч после введения фотосенсибилизатора проводят сеанс лазерного облучения внутрибронхиального/внутритрахеального компонента опухоли через 3 ч. После ФДТ проводят цитостатическую химиотерапию по схемам Цисплатин 120 мг в первый день и Этопозид 200 мг в 1, 2, 3 дни или Карбоплатин 600 мг в первый день и Этопозид 200 мг в 1, 2, 3 дни. Цикл лечения повторяют 2-3 раза с интервалом от 21 до 28 дней. Затем проводят дистанционную лучевую терапию в разовой очаговой дозе 2 Гр или 2,4 Гр до суммарной очаговой дозы до 60 или 70 Гр.
Однако, в данном способе используют большую дозу химиотерапевтического воздействия в сочетании с лучевой терапией.
Техническим результатом предлагаемого изобретения является разработка способа терапии для достижения полной эрадикации саркомы М-1 крыс с использованием нового лекарственного средства: коньюгата фотосенсибилизатора дипропокси бактериопурпурина (DPBP) с химиопрепаратом доксорубицин (DOX) - DPBP-DOX, с минимальными повреждениями окружающих здоровых тканей и увеличивающим продолжительность жизни.
Технический результат достигается тем, что также как и в известном способе (прототипе) проводят фотодинамическую терапию и химиотерапию, путем внутривенного введения лекарственного препарата и лазерного воздействия на опухолевый узел через определенный лекарственно-световой интервал.
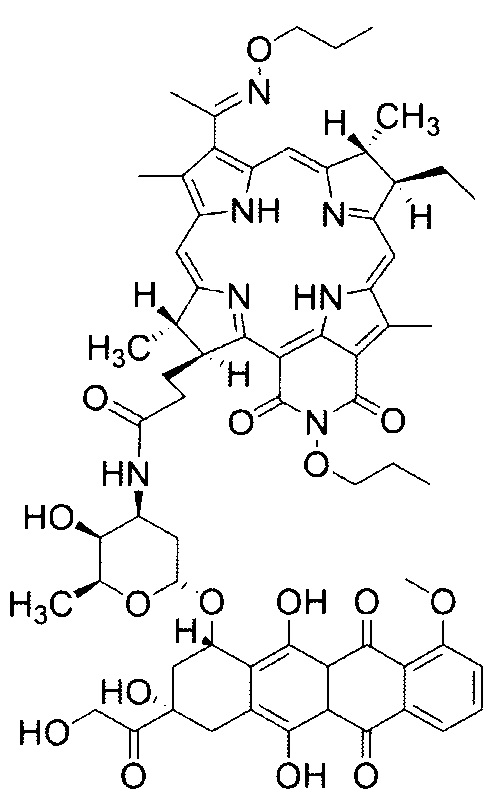
Особенностью данного способа является то, что однократно внутривенно вводят коньюгат, обладающий одновременно свойствами фотосенсибилизатора и препарата для химиотерапии со структурной формулой:
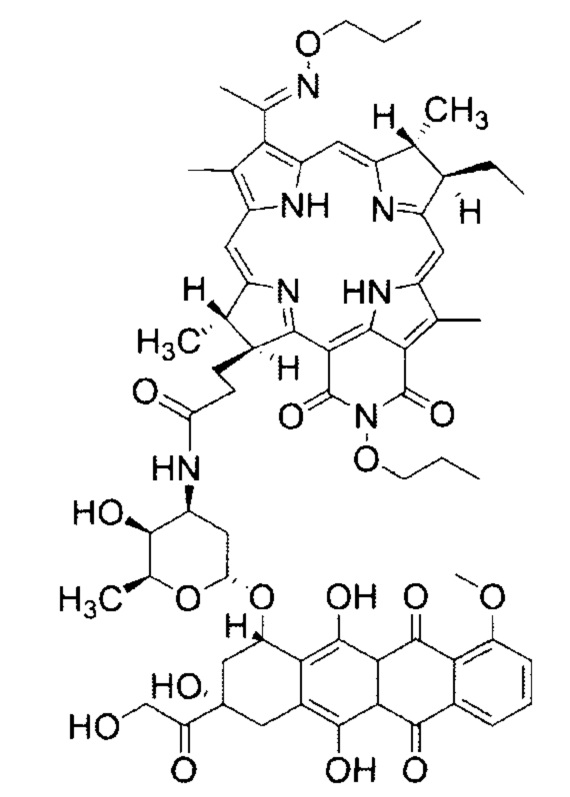 ,
,
в дозе 5 мг/кг, причем массовая доля дипропоксибактериопурпурина (DPBP) в конъюгате составляет - 2,76 мг/кг, а доксорубицина (DOX) - 2,24 мг/кг, а затем через временной интервал 90-120 минут проводят воздействие на опухолевый узел лазерным светом с длиной волны 810 нм со следующими параметрами: плотность энергии Е - 150 Дж/см2 и плотность мощности Ps - 0,48 Вт/см2.
Изобретение поясняется подробным описанием, сериями опытов, таблицами и иллюстрациями, на которых изображено:
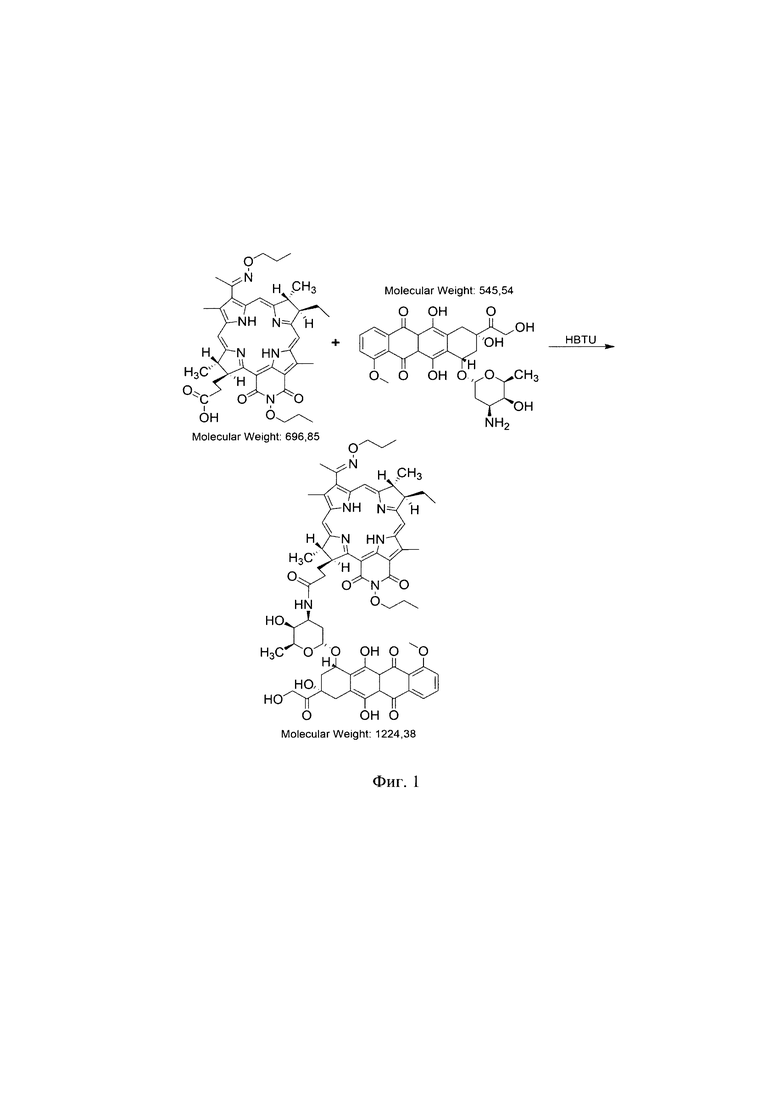
Фиг. 1 - Структурная формула конъюгата: фотосенсибилизатора - дипропоксибактериопурпурина (DPBP) и химиопрепарата - доксорубицина (DOX).
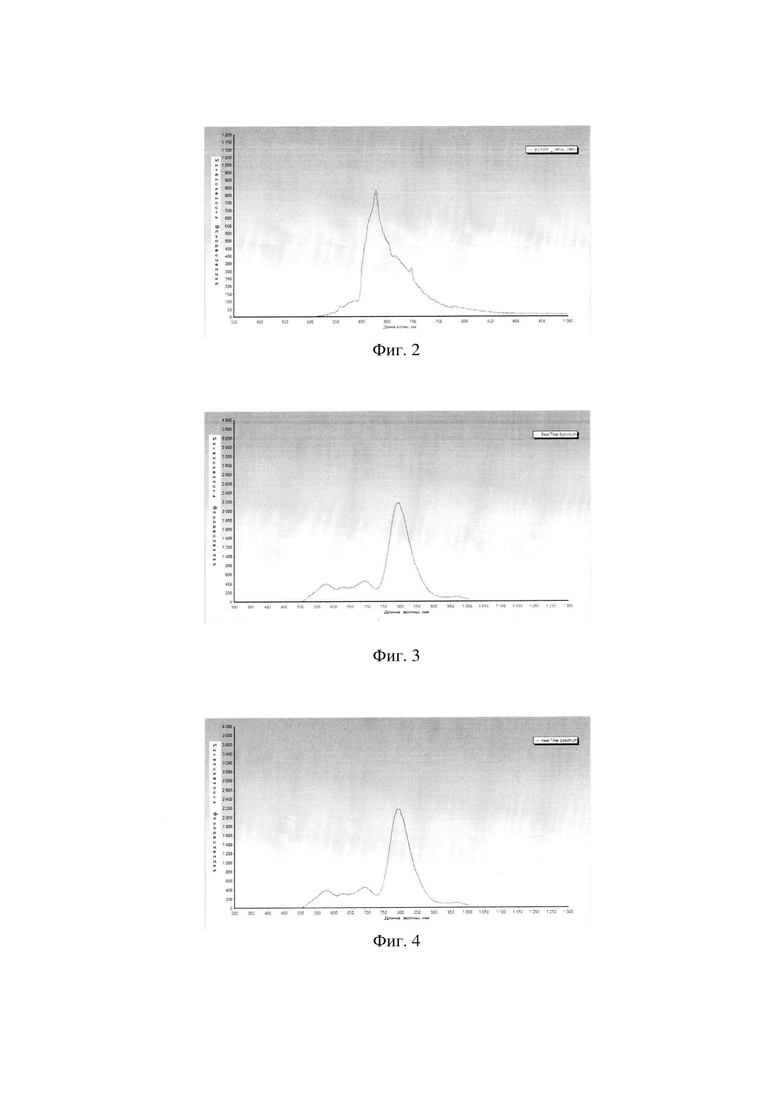
Фиг. 2 - Спектр флуоресценции доксорубицина (DOX).
Фиг. 3 - Спектр флюоресценции дипропоксибактериопурпурина (DPBP).
Фиг. 4 - Спектр флюоресценции конъюгата DPBP-DOX.
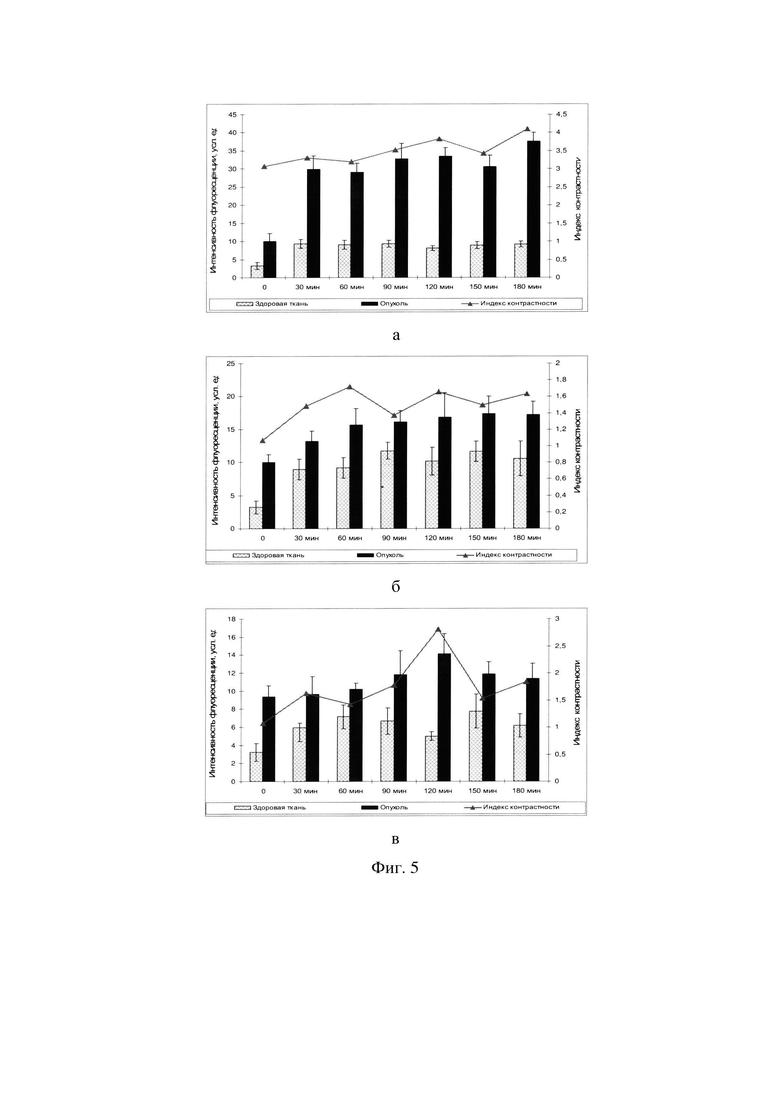
Фиг. 5 - Динамика накопления препаратов в опухоли и окружающих тканях бедра при их внутривенном введении в дозе 5,0 мг/кг: а) доксорубицин (DOX); б) дипропоксибактериопурпурин (DPBP); в) конъюгат DPBP-DOX.
Подробное описание.
Эксперимент in vivo проводился на белых беспородных половозрелых лабораторных крысах (96 самок с массой тела 150-200 г), в качестве экспериментальной модели опухоли использовали соединительнотканную саркому М-1. Работа выполнена с соблюдением международных рекомендаций по проведению исследований с использованием лабораторных животных, изложенных в «Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях» (Страсбург, 1987).
Саркому М-1 перевивали в виде кусочков опухоли донора, подкожно с внешней стороны левого бедра. В опыт крыс отбирали на 7-9 сутки после перевивки при достижении наибольшего диаметра опухолевых узлов 0,8-1,0 см и методом рандомизации распределяли на опытные и контрольные группы. Контролем служили животные-опухоленосители без какого-либо воздействия.
Проведенные исследования in vivo установили высокую противоопухолевую эффективность терапии (схема лечения III, табл.2, позиция 6) перевиваемой соединительнотканной злокачественной саркомы М-1 крыс с использованием препарата со структурной формулой (Фиг. 1). Установлено, что значительная противоопухолевая эффективность достигается при внутривенном введении коньюгата DPBP-DOX в общей дозе 5,0 мг/кг (2,76 мг/кг DPBP и 2,24 мг/кг DOX) с последующим проведением сеанса ФДТ с параметрами лазерного воздействия - плотность энергии Е - 150 Дж/см2, плотность мощности Ps - 0,48 Вт/см2. При таком сочетании параметров терапии наступает полное излечение на 90 сутки у 83,3% животных.
Исследование проводилось на девяти опытных группах крыс с саркомой М-1. Были использованы 6 схем лечения саркомы М-1 (Таблица 1).
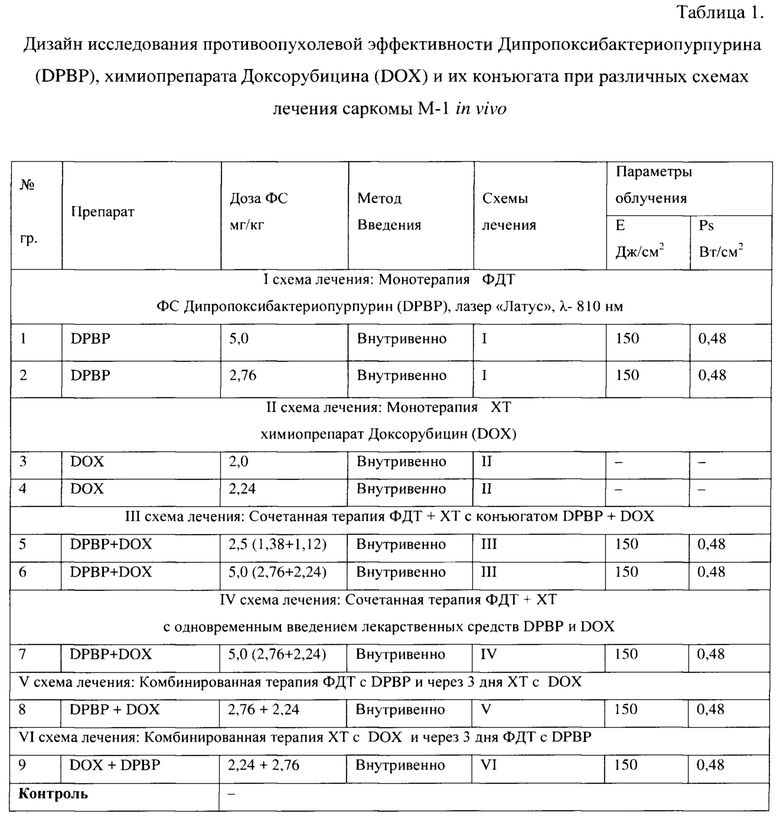
Все группы опытных животных наблюдались до 90 суток после проведенного лечения.
I. Изучение флуоресцирующих свойств исследуемых веществ и динамики их накопления.
Накопление препаратов в опухоли и окружающих здоровых тканях изучали методом лазерной спектрометрии с помощью установки ЛЭСА-01-Биоспек, Россия. Уровень концентрации препаратов оценивали по интенсивности флуоресценции в усл. ед., селективность определяли по индексу контрастности (опухоль/здоровая ткань). Первое измерение проводили до введения препаратов (0 мин), затем через каждые 30 минут до 180 минут. Определение концентрации препаратов и динамики содержания в тканях in vivo необходимо для определения оптимального времени от момента введения до лазерного воздействия.
II. Изучение эффективности XT.
Химиопрепарат DOX вводили внутривенно однократно в дозах 2,0; 2,24; 5,0 и 10,0 мг/кг крысам в хвостовую вену.
III. Изучение эффективности ФДТ.
Источником лазерного излучения служил полупроводниковый лазерный аппарат «Латус» производства ЗАО «Полупроводниковые приборы» (Санкт-Петербург) с длиной волны излучения 810 нм. Диаметр светового пятна составлял 1,5-2,5 см. Животные при облучении находились под общим тиопенталовым наркозом (внутрибрюшинно 2,5% раствор в объеме 0,2 мл/100 г массы животного).
Сеанс ФДТ проводили локально однократно с использованием в качестве ФС DPBP, который вводили внутривенно крысам в хвостовую вену.
Объем опухоли измеряли: до проведения лечения (V0), и на 7, 14, и 28 сутки после терапии. Конечный срок исследования был выбран исходя из необходимости сравнения динамики роста опухоли у мышей с продолженным ростом после терапии с контрольными животными, так как на данный срок исследования уже начиналась гибель контрольных животных.
IV. Изучение эффективности сочетанной и комбинированной терапии.
При проведении данных видов терапии применялись те же дозы химиопрепарата (DOX) и ФС (DPBP) и те же параметры лазерного излучения. Сочетанную терапию с коньюгатом DPBP-DOX или с одновременным введением лекарственных средств DPBP и DOX. Комбинированную терапию проводили с теми же препаратами, используя разную последовательность проведения монотерапий с временным интервалом через 3-е суток. Препараты вводили внутривенно крысам в хвостовую вену.
В качестве критериев определения противоопухолевой эффективности использовали:
1. Коэффициент абсолютного прироста опухоли (К). Для этого сначала вычисляли объемы опухолей по формуле: 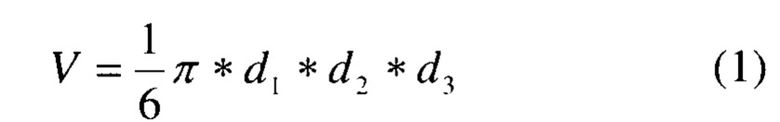
где: d1, d2, d3 - три взаимно перпендикулярные диаметры опухоли,
V - объем опухоли в см3.
Коэффициент абсолютного прироста опухоли (К) рассчитываем по формуле:

где: V0 - объем опухоли до воздействия,
Vt - объем опухоли на определенный срок наблюдения;
2. Торможение роста опухоли (ТРО%) по формуле:
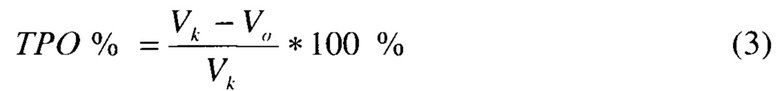
3. Частичная регрессия опухоли - уменьшение опухолей на 50% или больше.
4. Процент животных в группе с полной регрессией (ПР) опухоли (К=-1,00). За полную регрессию опухоли принимали отсутствие видимой и пальпируемой опухоли.
5. Средняя продолжительность жизни животных (СПЖ, сут) животных и увеличение продолжительности жизни (УПЖ%) по сравнению с контролем. Значимым считается УПЖ ≥50%.
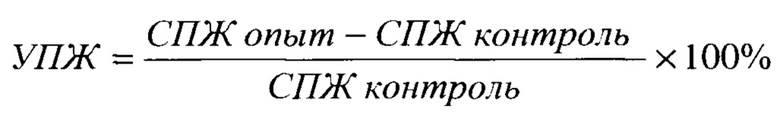
6. Критерий излеченности животных - отсутствие рецидивирования опухоли в течение 90 суток после ФДТ.
Статистическую обработку результатов для независимых групп выполняли с использованием программ Statistica 6.0. Описательная статистика представлена в виде среднего арифметического и стандартной ошибки среднего (М±m). Для оценки уровня значимости межгрупповых различий использовали U-критерий Манна-Уитни при р <0,05.
Результаты исследования.
I. Изучение динамики накопления ФС в опухоли и здоровой ткани.
Результативность фотодинамического воздействия ФС в значительной степени определяется процессами связывания и накопления пигментов в составе тканевых структур.
Изучение накопления различных фотоактивных веществ в клетках является важным аспектом скрининговых исследований, позволяющим оптимизировать условия фотодинамического воздействия (определения лекарственно-светового интервала (ЛСВИ) - время от момента введения ФС до облучения лазером, что позволяет проводить лечение на высоком уровне накопления ФС в опухоли при минимальной концентрации его в нормальной ткани.
Наблюдалось увеличение оптической плотности флуоресценции данных препаратов при 810 нм (Фиг. 2-4).
На фигуре 5 (а-в) видно, что через 30 минут после внутривенного введения лекарственных средств происходит увеличение уровня их содержания, как в опухоли, так и в окружающей ткани:
- DOX - Увеличение накопления препарата в большей степени в опухоли статистически значимо не только по сравнению с исходными величинами (собственная флуоресценция биологических тканей (р<0,001), но и по сравнению с окружающей тканью (р<0,05). Максимальная селективность отмечалась через 90-180 минут.
- DPBP - Увеличение накопления опухолевой тканью по сравнению с окружающей здоровой тканью (р<0,05). Оптимальный ЛСВИ - от 30 минут до 120 минут.
- Конъюгат DPBP-DOX оптимальный ЛСВИ - от 60 минут до 120 минут и в данный период наименьшее накопление в окружающих здоровых тканях.
Схема лечения - I (табл. 2, табл. 3).
При проведении сеанса ФДТ с препаратом DPBP в дозе 2,76 мг/кг при параметрах лазерного воздействия Е=150 Дж/см2; Ps=0,48 Вт/см2 до 90 суток после лечения процент животных с полной регрессией опухоли составил 16,7. При увеличении дозы ФС до 5,0 мг/кг при тех же параметрах лазерного воздействия процент животных с полной регрессией опухоли составил 75 вплоть до 90 суток после лечения.
Таким образом, после сеанса ФДТ с данными параметрами проведения опыта через 3 месяца наблюдалось излечение у 16,7% и 75% животных.
Схема лечения - II (табл. 2, табл. 3).
При проведении XT в группах животных с дозами DOX 2,0 и 2,24 мг/кг наблюдался прогрессирующий рост опухолевых узлов, но темп прироста был ниже, чем в контрольной группе (ТРО на 21 сутки составило - с дозой 2,0 мг/кг - 41,4%). При введении препарата в дозе 2,24 мг/кг на 90 сутки после терапии наблюдалось 33,2% излеченных животных.
Таким образом, наиболее эффективной была XT в дозе 2,24 мг/кг, полная регрессия опухоли наблюдалась до 90 суток после терапии у 33,2% животных.
Схема лечения - III (табл. 2, табл. 3).
После проведения сочетанной терапии с конъюгатом DPBP+DOX в общей дозе - 2,5 мг/кг (1,38+1,12 мг/кг) наблюдался прогрессирующий рост опухоли, процент излеченных животных через 3 месяца после терапии 0%. При увеличении дозы конъюгата до 5,0 мг/кг получен значительный противоопухолевый эффект. Процент излеченных животных через 3 месяца после терапии 83,3%. Также наблюдалось достоверное увеличение УПЖ у животных с продолженным ростом опухолевых узлов - 65,6%.
Схема лечения - IV (табл. 2, табл. 3).
Проведение сочетанной терапии с одновременным введением двух препаратов DPBP и DOX в такой же общей дозе 5,0 мг/кг (2,76 мг/кг DPBP и 2,24 мг/кг DOX) не дало положительного эффекта, сравнимого с эффектом, полученным при применении коньюгата. Процент излеченных животных через 3 месяца после терапии составил всего 16,7%.
Схема лечения - V (табл. 2, табл. 3).
Проведение комбинированной терапии (ФДТ и через 3 суток XT) в общей дозе 5,0 мг/кг (2,76 мг/кг DPBP + 2,24 мг/кг DOX) продемонстрировало значительную противоопухолевую эффективность. Процент излеченных животных через 3 месяца после терапии составлял 80%.
Схема лечения - VI (табл. 2, табл. 3).
Проведение комбинированной терапии (XT и через 3 суток ФДТ) в общей дозе 5,0 мг/кг (2,24 мг/кг DOX + 2,76 мг/кг DPBP) оказалась неэффективной, процент излеченных животных через 3 месяца после терапии 0%. 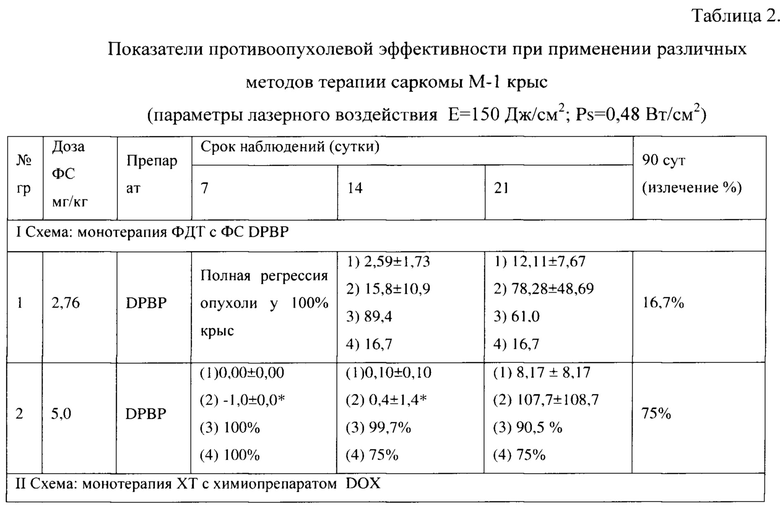
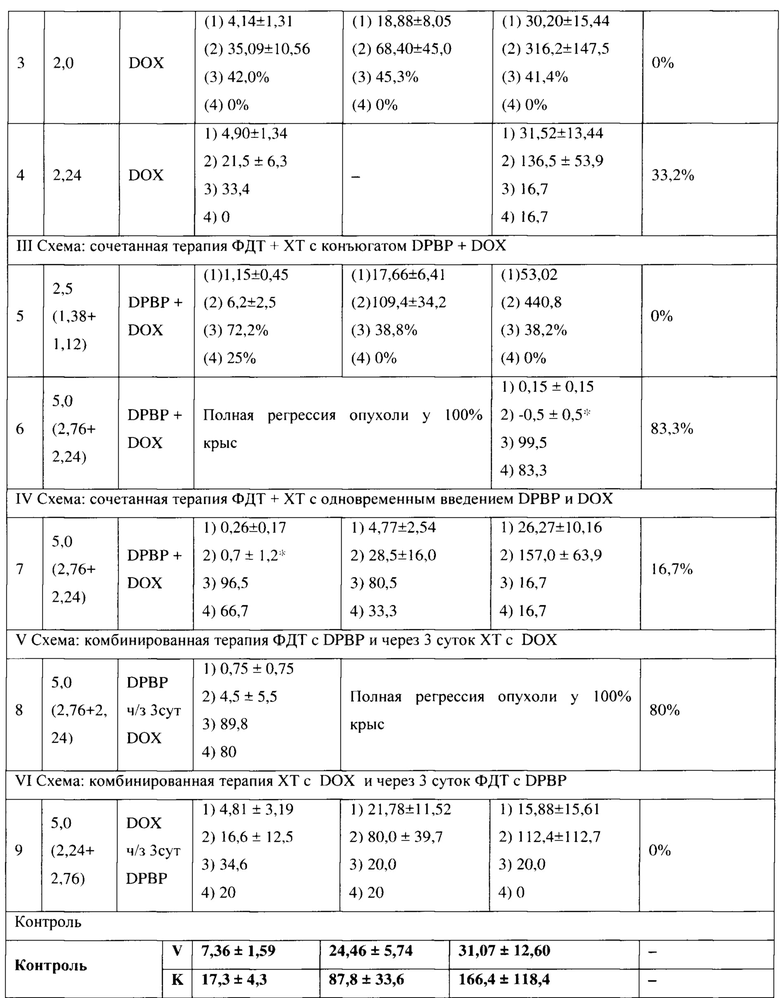 с Примечание: (1) объем опухоли (V,м3); (2) коэффициент прироста опухоли (К); (3) торможение роста опухоли (ТРО, %); (4) процент животных с полной регрессией опухоли (ПР, %);
с Примечание: (1) объем опухоли (V,м3); (2) коэффициент прироста опухоли (К); (3) торможение роста опухоли (ТРО, %); (4) процент животных с полной регрессией опухоли (ПР, %);
* р<0,05 - данные опыта достоверно отличаются в сравнении с контролем.
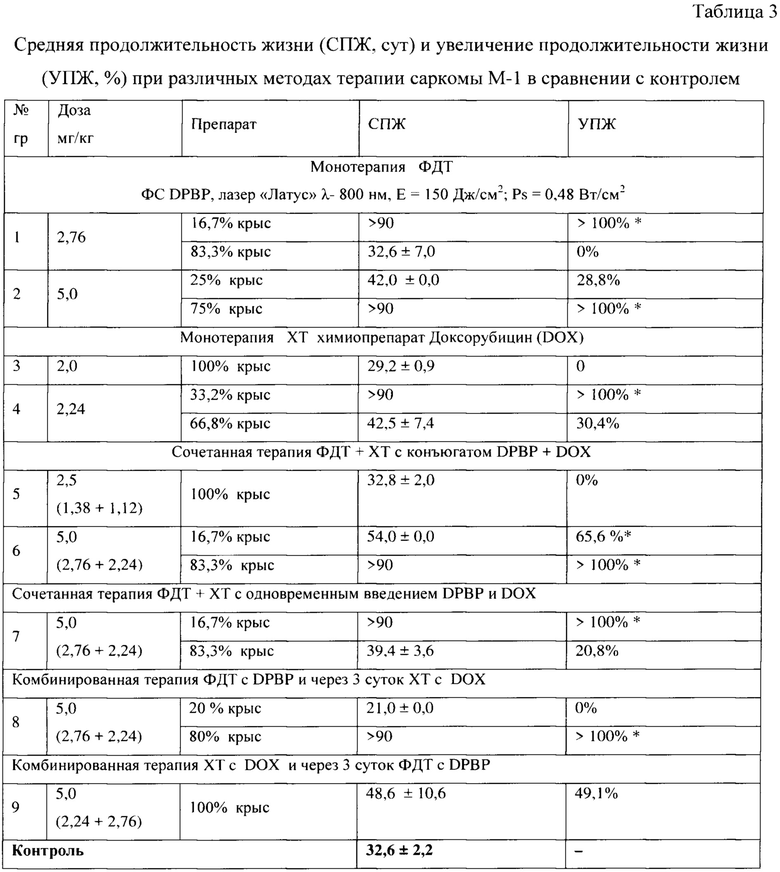
Примечание: * значимое увеличение продолжительности жизни крыс с опухолью по сравнению с контролем (УПЖ>50%);
>90 и >100% * - животные, полностью излеченные через 3 месяца после ФДТ (на 90 сутки все животные выводились из опыта путем эвтаназии с помощью СО2).
Заключение.
В результате исследований установлена высокая противоопухолевая эффективность конъюгата фотосенсибилизатора DPBP и химиопрепарата DOX (Фиг. 1) для терапии поверхностной злокачественной солидной соединительнотканной опухоли саркома М-1 крыс (схема лечения III, табл.2, позиция 6).
Лекарственно световой интервал (время от момента введения ФС до облучения лазером) - 90-120 минут. Несмотря на небольшие (общая доза 5,0 мг/кг) дозы внутривенного введения ФС - 2,76 мг/кг и химиопрепарата - 2,24 мг/кг (что при экстраполяции на дозу человека составляет 0,49 мг/кг и 0,37 мг/кг), и применение невысоких параметров лазерного воздействия (Е - 150 Дж/см2, Ps - 0,48 Вт/см2) в результате был получен выраженный положительный эффект, заключавшийся в ликвидации новообразования у 83,3% животных на 90 сутки после лечения и достоверное увеличение продолжительности жизни у крыс с продолженным ростом опухоли по сравнению с контролем.
При применении IV схемы лечения - комбинированная терапия (ФДТ с DPBP и через 3 суток XT с DOX) в тех же дозах внутривенного введения лекарственных средств 5,0 мг/кг (2,76+2,24 мг/кг) и при тех же параметрах лазерного воздействия (Е - 150 Дж/см2, Ps - 0,48 Вт/см2) - наблюдалась полная регрессия опухоли у 80% животных на 90 сутки после терапии, но продолжительность жизни у особей с продолженным ростом была равна показателям контрольных крыс. Лекарственно световой интервал составлял 30-60 минут.
При проведении монотерапии с ФС DPBP и с химиопрепаратом DOX при тех же параметрах проведения опытов, процент излеченных животных на 90 сутки после терапии составлял 16,7 и 33,2 соответственно.
Токсического воздействия на животных (ухудшение общего состояния животных, их подвижности, потери веса) не наблюдалось при всех схемах проведения опытов.
Предложенный способ позволяет добиться выраженного терапевтического эффекта с минимальными повреждениями окружающих здоровых тканей, заключающегося в полном излечении у 83,3% животных вплоть до 90-х суток после проведенного лечения, а также увеличить продолжительность жизни у крыс с продолженным ростом опухоли по сравнению с контролем.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ КАРЦИНОМА ЭРЛИХА МЫШЕЙ С ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА | 2022 |
|
RU2788766C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ПОВЕРХНОСТНОЙ СОЛИДНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ САРКОМЫ М-1 КРЫС | 2021 |
|
RU2776449C1 |
| Способ проведения фотодинамической терапии солидной карциномы Эрлиха мышей | 2021 |
|
RU2774589C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ПОВЕРХНОСТНОЙ СОЛИДНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ САРКОМЫ М-1 КРЫС | 2019 |
|
RU2704202C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ЭКТОДЕРМАЛЬНОЙ ОПУХОЛИ МЕЛАНОМЫ B16 МЫШЕЙ | 2020 |
|
RU2724867C2 |
| СПОСОБ ОРГАНОСОХРАНЯЮЩЕГО ЛЕЧЕНИЯ ПЛОСКОКЛЕТОЧНОГО РАКА СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА сТ1N0M0 ПРИ ГЛУБИНЕ ИНВАЗИИ ОПУХОЛИ ДО 5 ММ | 2023 |
|
RU2824427C2 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕВИВНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ САРКОМЫ М-1 КРЫС ПРИ КОМБИНИРОВАННОМ ВОЗДЕЙСТВИИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И ЛУЧЕВОЙ ТЕРАПИИ | 2021 |
|
RU2763663C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ МЕЛАНОМА В-16 МЫШЕЙ ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА С ПСМА-ЛИГАНДОМ | 2020 |
|
RU2739193C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕВИВНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ САРКОМЫ М-1 КРЫС ПРИ КОМБИНИРОВАННОМ ВОЗДЕЙСТВИИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И ЛУЧЕВОЙ ТЕРАПИИ | 2021 |
|
RU2767272C2 |
| СПОСОБ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ ПРИ ПРОВЕДЕНИИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ С ФОТОСЕНСИБИЛИЗАТОРОМ ФОТОРАН Е6 ПЕРЕВИВНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ ОПУХОЛИ САРКОМА М-1 КРЫС, ПОЛОЖИТЕЛЬНОЙ ПО МУТАНТНОМУ ГЕНУ р53 | 2020 |
|
RU2736261C2 |
Изобретение относится к области экспериментальной медицины и онкологии и раскрывает способ сочетанной терапии соединительнотканной саркомы М-1 крыс с использованием коньюгата дипропоксибактериопурпурина с доксорубицином, включающий фотодинамическую терапию и химиотерапию, осуществляемый путем внутривенного введения лекарственного препарата и последующего лазерного воздействия на опухолевый узел через определенный лекарственно-световой интервал, отличающийся тем, что однократно внутривенно вводят коньюгат, обладающий одновременно свойствами фотосенсибилизатора и препарата для химиотерапии со структурной формулой, в дозе 5 мг/кг, причем массовая доля дипропоксибактериопурпурина (DPBP) в конъюгате составляет - 2,76 мг/кг, а доксорубицина (DOX) - 2,24 мг/кг, а затем через временной интервал 90-120 минут проводят воздействие на опухолевый узел лазерным светом с длиной волны 810 нм со следующими параметрами: плотность энергии Е - 150 Дж/см2 и плотность мощности Ps - 0,48 Вт/см2. Техническим результатом предлагаемого изобретения является полная эрадикации саркомы М-1 крыс с использованием нового лекарственного средства: коньюгата фотосенсибилизатора дипропокси бактериопурпурина (DPBP) с химиопрепаратом доксорубицин (DOX) - DPBP-DOX, с минимальными повреждениями окружающих здоровых тканей и увеличивающим продолжительность жизни. 5 ил., 3 табл.
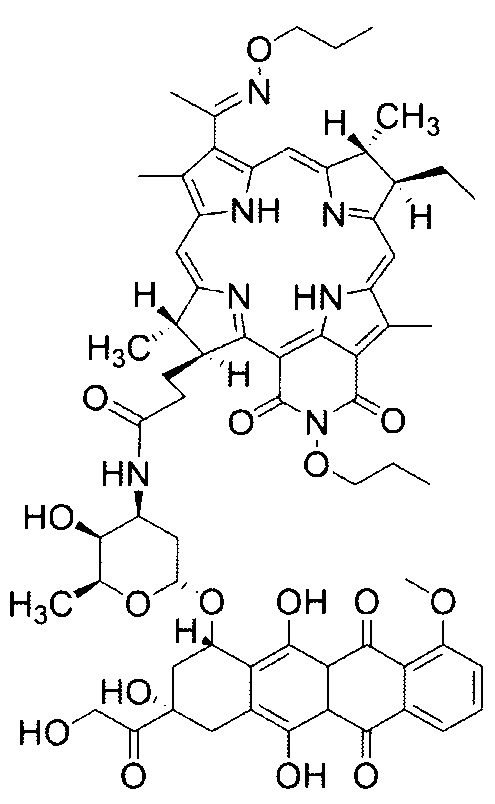
Способ сочетанной терапии соединительнотканной саркомы М-1 крыс с использованием коньюгата дипропоксибактериопурпурина с доксорубицином, включающий фотодинамическую терапию и химиотерапию, осуществляемый путем внутривенного введения лекарственного препарата и последующего лазерного воздействия на опухолевый узел через определенный лекарственно-световой интервал, отличающийся тем, что однократно внутривенно вводят коньюгат, обладающий одновременно свойствами фотосенсибилизатора и препарата для химиотерапии со структурной формулой:
 ,
,
в дозе 5 мг/кг, причем массовая доля дипропоксибактериопурпурина (DPBP) в конъюгате составляет - 2,76 мг/кг, а доксорубицина (DOX) - 2,24 мг/кг, а затем через временной интервал 90-120 минут проводят воздействие на опухолевый узел лазерным светом с длиной волны 810 нм со следующими параметрами: плотность энергии Е - 150 Дж/см2 и плотность мощности Ps - 0,48 Вт/см2.
| АБРАМОВА О.Б | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| Клиническая фармакология и | |||
Авторы
Даты
2023-12-05—Публикация
2023-05-05—Подача