Группа изобретений относится к области биохимии, молекулярной биологии и генетическим исследованиям в селекции растений гороха посевного Pisum sativum L., в частности к молекулярному маркеру типа CAPS для идентификации растений гороха, гомозиготных по аллели PsLykXA. Также изобретение относится к применению вышеуказанного маркера для использования в селекции растений гороха, имеющих повышенную специфичность по отношению к симбиотическим клубеньковым бактериям.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Горох посевной (Pisum sativum L.) вступает в симбиоз с почвенными клубеньковыми бактериями (ризобиями), в результате чего симбиотическая система приобретает способность к биологической фиксации азота. Различные разновидности гороха имеют различную специфичность по отношению к ризобиям, то есть существуют разновидности, вступающие в симбиоз с широким кругом клубеньковым бактериям (к ним относятся все современные сорта гороха), а также разновидности, способные вступать в симбиоз только с небольшим числом штаммов клубеньковых бактерий (например, дикие разновидности гороха из Афганистана, т.н. «афганские горохи»).
В почвах Российской Федерации в основном представлены штаммы клубеньковых бактерий, которые фиксируют азот неэффективно, в то же время штаммы, используемые в биопрепаратах, фиксируют азот более эффективно. Однако применение биопрепаратов на фоне аборигенной микрофлоры часто приводит к тому, что клубеньковые бактерии из биопрепарата проигрывают конкуренцию аборигенным штаммам, в результате чего симбиоз образуется с аборигенными штаммами (то есть применение биопрепарата оказывается неоправданным, поскольку штаммы из биопрепарата не вступают в симбиоз с растениями). Для того, чтобы ограничить круг штаммов, с которыми должны взаимодействовать растения гороха, целесообразно придать современным сортам гороха свойство узкой специфичности взаимодействия с ризобиями, характерное для «афганских горохов» (чтобы растение выбирало из почвы именно штамм, вносимый в составе биопрепарата, и не взаимодействовало с аборигенной микрофлорой).
УРОВЕНЬ ТЕХНИКИ
В настоящее время известно, что специфичность симбиоза гороха с клубеньковыми бактериями зависит от наличия в геноме бактерий гена NodX (штаммы клубеньковых бактерий с геном NodX вступают в симбиоз как с современными сортами гороха, так и с разновидностями гороха из Афганистана, в то время как штаммы клубеньковых бактерий без гена NodX вступают в симбиоз только с современными сортами гороха, но не с «афганскими горохами») (Firmin et al., 1993) [1]). Со стороны растения данный признак контролируется геном PsLykX, аллельное состояние которого отличается у современных сортов гороха и «афганских горохов», причём «афганские горохи», например, типовая линия NGB2150, несут уникальное аллельное состояние гена PsLykX (Sulima et al., 2017 [2]; Sulima et al., 2019) [3]. Для облегчения селекции сортов, получаемых в результате внесения аллели PsLykXA от донорных линий, целесообразно использовать молекулярный маркер, так как признак специфичности проявляется на сроке от 14 до 28 дней после инокуляции растений клубеньковыми бактериями, и для его анализа необходимо проводить анализ корневой системы, т.е. извлекать растения из субстрата, после чего жизнеспособность растений значительно снижается.
Из уровня техники известны также следующие источники информации.
Известен источник информации Sulima et al., 2017 [2], в котором идентифицирована последовательность гена гороха PsLykX, кодирующего рецепторную киназу, воспринимающую структуру сигнальной молекулы, выделяемой ризобиями (Nod-фактора). Также в данном источнике описаны последовательности 1 экзона гена PsLykX (который кодирует рецепторный домен белка) у европейских сортов гороха и «афганских горохов», в том числе выявлены нуклеотидные замены, характерные для афганской аллели гена PsLykX.
Недостатком является то, что в данном источнике для молекулярно-генетической идентификации афганской аллели PsLykXA использовано секвенирование по Сэнгеру (данный способ является более длительным и дорогим, чем анализ молекулярного маркера, предложенного в изобретении). Альтернативным способом идентификации растений гороха, несущих афганскую аллель гена PsLykXA, является выращивание этих растений в условиях инокуляции штаммом клубеньковых бактерий Rhizobium leguminosarum bv. viciae, не несущим гена nodX (например, штаммом Rhizobium leguminosarum bv. viciae RCAM1026), с последующим извлечением растений из субстрата и анализом фенотипа корневых систем (отсутствие клубеньков на корнях является признаком растений, гомозиготных по афганской аллели гена PsLykXA). Извлечение растений из субстрата снижает их жизнеспособность и семенную продуктивность, поэтому использование данного подхода в селекции новых сортов гороха нецелесообразно.
Известен источник информации Sulima et al., 2019 [3], в котором идентифицированы последовательности 1 экзона гена PsLykX у серии генотипов гороха, происходящих из Малой Азии (Афганистана, Таджикистана и Туркменистана). В данном источнике описан альтернативный аллельный вариант гена PsLykX, характерный для разновидностей гороха из Таджикистана и приводящий к фенотипу, подобному фенотипу «афганских горохов».
Недостатком является то, что в данном источнике для молекулярно-генетической идентификации аллельного состояния гена PsLykX также использовано секвенирование по Сэнгеру, аналогично сведениям, представленным в источнике [2], а также для идентификации аллельного состояния гена PsLykX использован способ, связанный с извлечением растений из субстрата, описанный в источнике [2].
В качестве наиболее близкого аналога (прототипа) может рассматриваться молекулярный маркер типа CAPS, созданный и описанный в диссертации Сулимы А.С., 2020 [4] для анализа наследования гена PsLykX (и продемонстрировавший совместное наследование генов PsLykX и PsSym37, что свидетельствует о их близком расположении в геноме). В диссертации Сулимы А.С., взятой за прототип, был проведён анализ наследования гена PsLykX при помощи молекулярного маркера типа CAPS на популяции растений F2, полученной от скрещивания двух «европейских» линий, т.е. «афганская» аллель не присутствовала ни у одного из родительских генотипов. Для создания маркера был использован другой полиморфный сайт, а также другие праймеры и другая эндонуклеаза рестрикции. Для определения локализации гена PsLykX производился косегрегационный анализ маркеров типа CAPS, представляющих собой участки генов PsLykX и PsSym37, на выборке растений F2 (SGE Fix--1×1238). Также приведены последовательности праймеров, использованных в работе, отличающиеся от праймеров, предлагаемых в настоящем изобретении.
Недостатком наиболее близкого технического решения является то, что данный аналог не может использоваться для анализа наследования аллельного состояния PsLykXA, поскольку для создания маркера использован полиморфный сайт, отсутствующий в последовательности «афганской» аллели PsLykXA.
Кроме этого, в прототипе для идентификации аллельного состояния гена PsLykX использовался способ, описанный в источнике [2], согласно которому анализируемые растения выращивали в условиях инокуляции штаммом клубеньковых бактерий Rhizobium leguminosarum bv. viciae, не несущим гена nodX, извлекали из субстрата и проводили визуальный анализ фенотипа корневых систем (отсутствие клубеньков на корнях является признаком растений, гомозиготных по афганской аллели гена PsLykXA). Извлечение растений из субстрата снижает их жизнеспособность и семенную продуктивность, поэтому использование данного подхода в селекции новых сортов гороха нецелесообразно.
В результате проведенного анализа уровня техники можно сделать вывод о том, что предлагаемая группа изобретений может быть признана соответствующей критериям патентоспособности «новизна» и «изобретательский уровень» до даты испрашиваемого приоритета.
Целью предлагаемых технических решений является создание молекулярного маркера и способа, позволяющих значительно увеличить эффективность селекции гороха по признаку высокой специфичности взаимодействия с клубеньковыми бактериями.
Техническим результатом от реализации заявленной группы изобретений является увеличение эффективности, скорости и точности идентификации, а также упрощение идентификации растений гороха Pisum sativum L., гомозиготных по аллели PsLykXA, обуславливающей формирование повышенной специфичности по отношению к симбиотическим клубеньковым бактериям.
Впервые выявлен новый генетический маркер типа CAPS для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA.
Указанный технический результат реализуется заявленной группой изобретений, включающей:
1. Молекулярный маркер типа CAPS для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA с номером доступа в GenBank MN187362.1, упомянутый молекулярный маркер основан на полиморфном сайте PsLykX c.227C>A.
2. Способ для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA.
Технический результат достигается за счет того, что на основе последовательности гена PsLykX создан молекулярно-генетический маркер, использование которого позволяет идентифицировать растения гороха посевного Pisum sativum L., гомозиготные по аллели PsLykXA, на основании проведения полимеразной цепной реакции на ДНК этих растений с последующим гидролизом продукта амплификации эндонуклеазой рестрикции. При этом не требуется проводить инокуляцию растений клубеньковыми бактериями, а также извлекать растения из субстрата, в котором они растут.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Для достижения технического результата, а также устранения недостатков имеющихся аналогов и прототипа, заявителем предложены молекулярно-генетический маркер типа CAPS у растений гороха посевного Pisum sativum L. и способ идентификации растений, являющихся носителем аллели, обуславливающей формирование повышенной специфичности по отношению к симбиотическим клубеньковым бактериям.
Группа изобретений объединена единым изобретательским замыслом.
ОБЪЕКТ ИЗОБРЕТЕНИЯ
В настоящей группе изобретений описаны молекулярный маркер и способ для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA.
Указанный технический результат достигается совокупностью существенных признаков, представленной в формуле изобретения.
В одной неограничивающей реализации изобретения предложен молекулярный маркер типа CAPS для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA с номером доступа в GenBank MN187362.1, при этом упомянутый молекулярный маркер основан на полиморфном сайте PsLykX c.227C>A, включающий:
- праймер (A1) с последовательностью:
(1) CTAATATTTAGCTTACTATTGTTTCTG;
- праймер (В1) с последовательностью:
(2) CAAAACTTGAACTGAAGTCAAACTTGC;
или
- праймер (A2) с последовательностью:
(3) GCTTCTTACCATGTCATGCCTGCA;
- праймер (В2) с последовательностью:
(4) ACACATGTCCCAAGAATTCACCTCCA;
- эндонуклеаза рестрикции Hpy188III.
В другой неограничивающей реализации изобретения предложен способ для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA с номером доступа в GenBank MN187362.1, включающий:
а) амплификацию ДНК растений гороха, которую проводят с помощью пары праймеров А1В1 или A2B2, входящих в состав вышеупомянутого молекулярного маркера, при этом пара праймеров А1В1 позволяет амплифицировать продукт длиной 381 п. н.; пара праймеров A2B2 позволяет амплифицировать продукт длиной 208 п. н.;
б) гидролиз продукта амплификации, который проводят с помощью эндонуклеазы рестрикции Hpy188III, входящей в состав вышеупомянутого молекулярного маркера;
в) определение числа гидролизованных продуктов амплификации и их размера, при этом:
- при гидролизе продукта, амплифицированного с использованием пары праймеров А1В1, в случае выявления двух фрагментов размером 217 п. н. и 164 п. н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA;
- при гидролизе продукта, амплифицированного с использованием пары праймеров А2В2, в случае выявления двух фрагментов размером 127 п. н. и 81 п. н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA.
Ещё в одном дополнительном примере реализации изобретения предложен способ для идентификации растений гороха посевного Pisum sativum L., в котором амплификацию проводят при следующих условиях:
предварительная денатурация: при 95 - 98 °С в течение 15-45 с;
циклы амплификации: денатурация при 95-98 °С в течение 10-45 с, отжиг при 50-60 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
конечная элонгация: при 72 °С в течение 2-10 мин,
при этом амплификация включает от 25 до 35 циклов.
Ещё в одном дополнительном примере реализации изобретения предложен способ для идентификации растений гороха посевного Pisum sativum L., в котором амплификацию проводят при следующих условиях:
предварительная денатурация: при 95 - 98 °С в течение 15-45 с,
первый цикл амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 62 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
второй цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 61 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
третий цикл амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 60 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
четвертый цикл амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 59 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
пятый цикл амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 58 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
шестой цикл амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 57 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
седьмой цикл амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 56 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
остальные циклы амплификации: денатурация при 95 - 98 °С в течение 15-45 с, отжиг при 55 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с
конечная элонгация: при 72 °С в течение 2-10 мин, при этом амплификация включает от 25 до 35 циклов.
Ещё в одном дополнительном примере реализации изобретения предложен способ для идентификации растений гороха посевного Pisum sativum L., в котором гидролиз продукта амплификации эндонуклеазой рестрикции Hpy188III проводят при 37 °С в течение 1-10 часов, а также дополнительно проводят инактивацию эндонуклеазы рестрикции: при 65 °С в течение 10-30 мин.
КРАТКОЕ ОПИСАНИЕ ФИГУР, ТАБЛИЦ, ИНЫХ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Изобретение иллюстрируются следующими графическими материалами и таблицами.
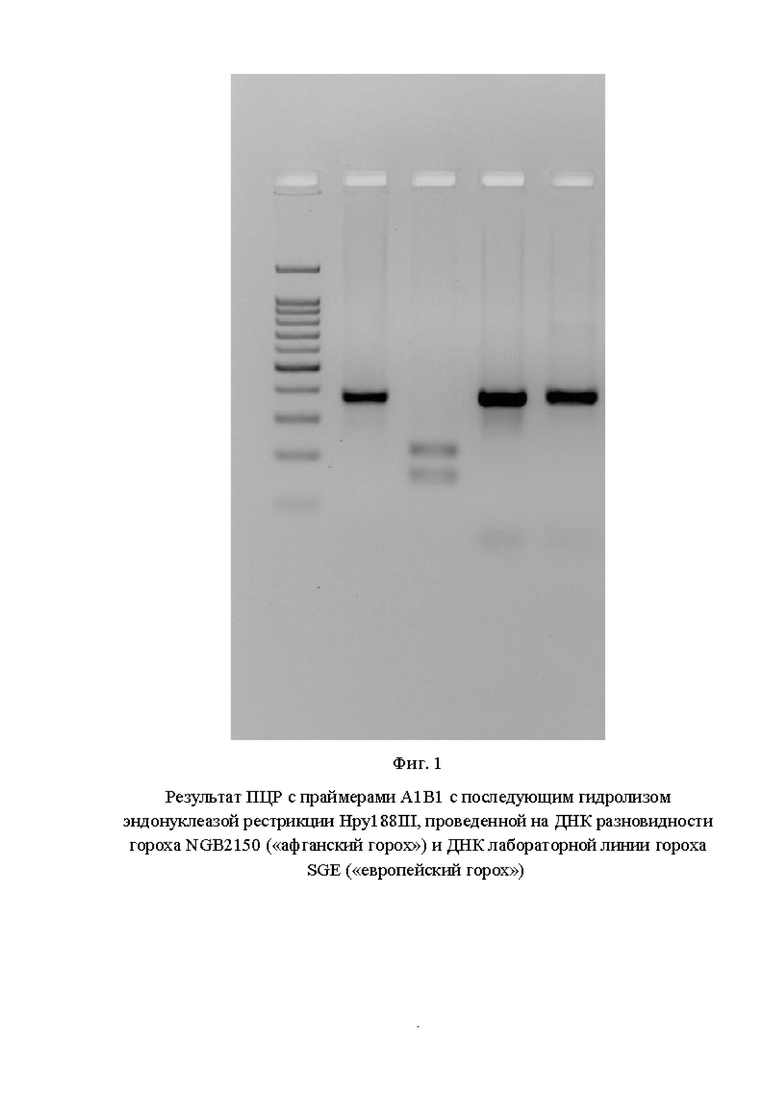
На фигуре 1 показан результат ПЦР с праймерами А1В1 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
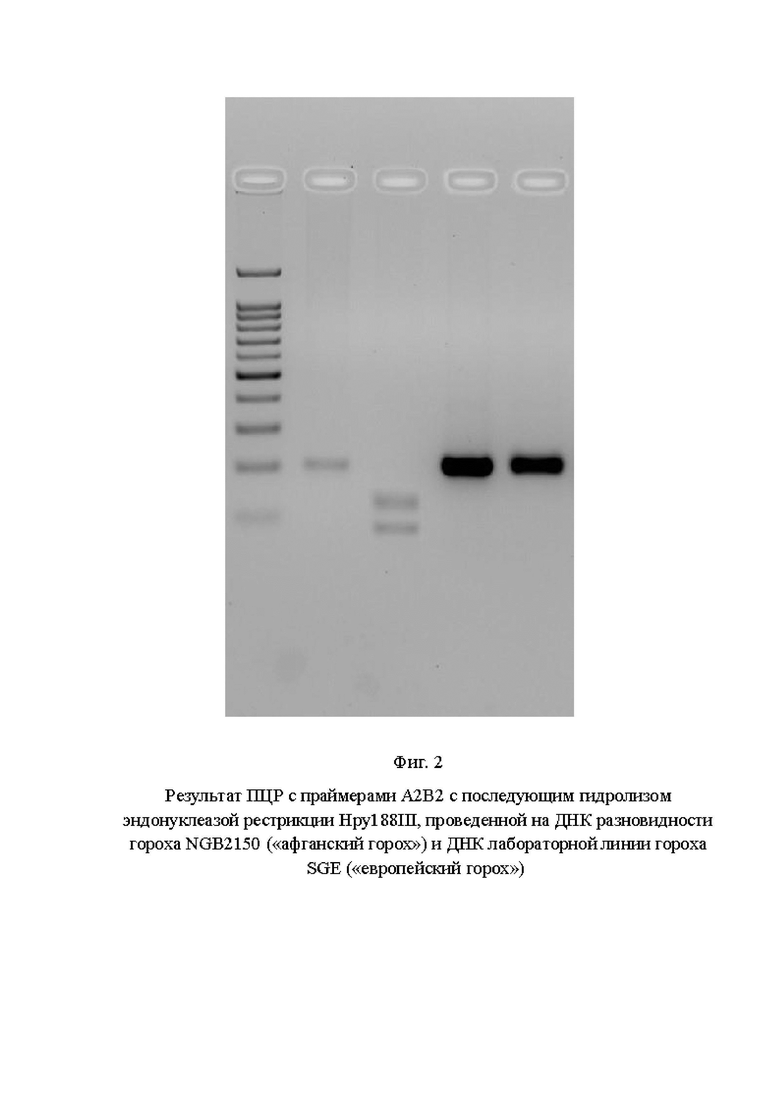
На фигуре 2 показан результат ПЦР с праймерами А2В2 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
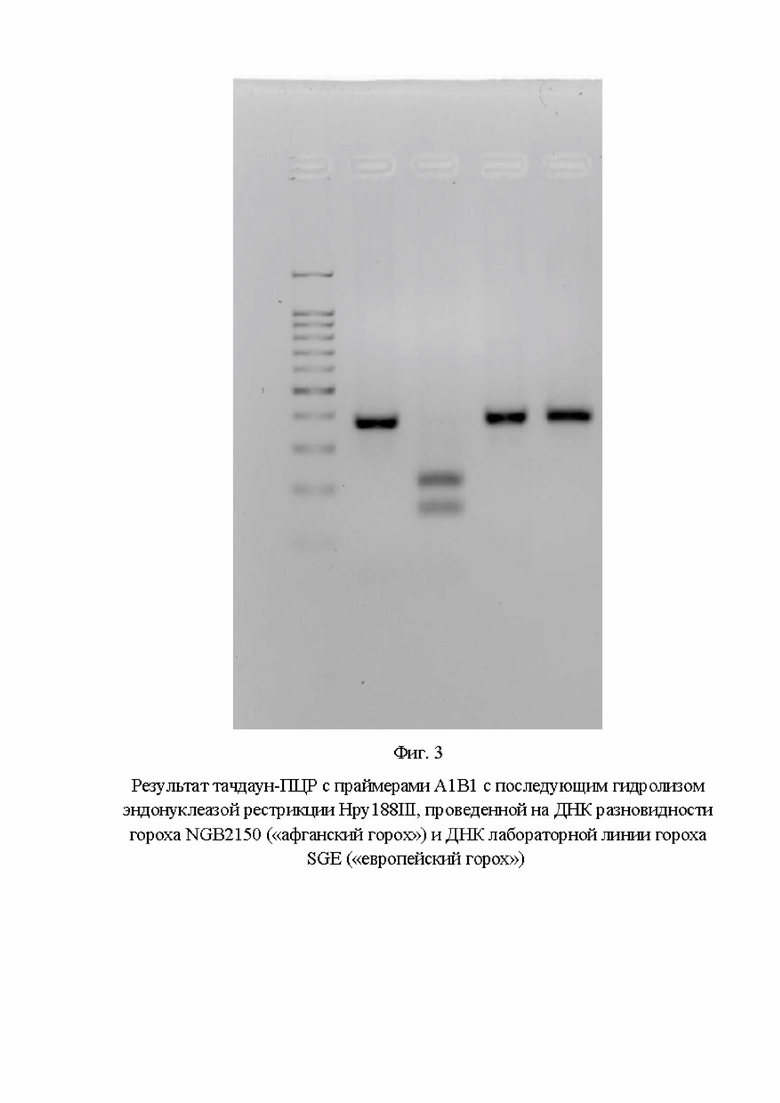
На фигуре 3 показан результат тачдаун-ПЦР с праймерами А1В1 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
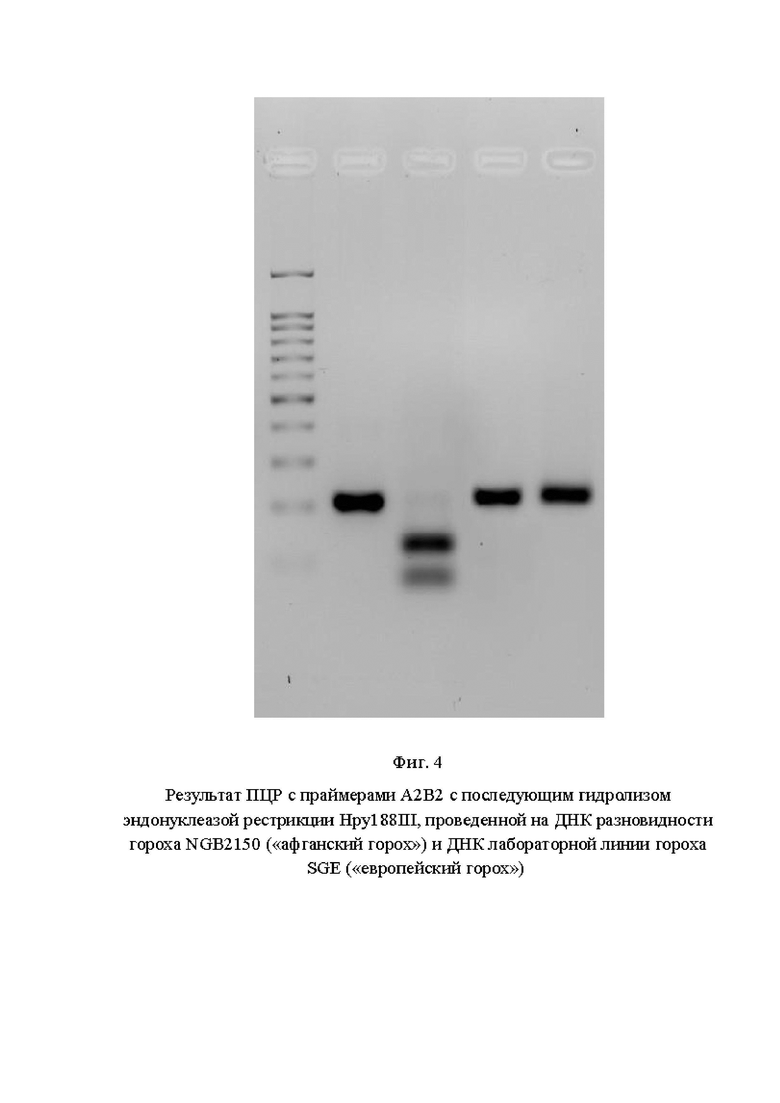
На фигуре 4 показан результат тачдаун-ПЦР с праймерами А2В2 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
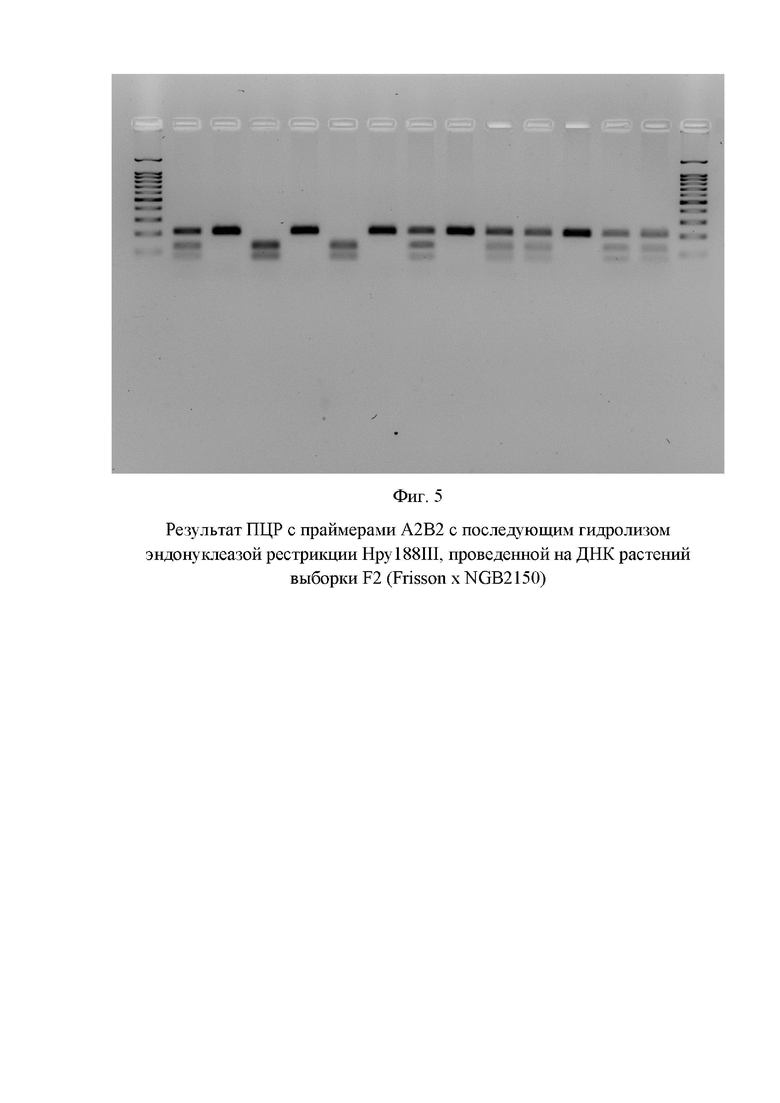
На фигуре 5 показан результат генотипирования растений выборки F2, полученной от скрещивания «европейского гороха» сорта Frisson и «афганского гороха» NGB2150, при помощи праймеров А2В2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения и общая терминология
Далее будут приведены ссылки на определенные варианты осуществления изобретения, примеры которых проиллюстрированы предлагаемым маркером и способом. Подразумевается, что группа изобретений охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, как определено в формуле изобретения.
Специалисту в данной области известны многие способы и материалы, аналогичные или эквивалентные описанным в данном документе, которые могут быть использованы при практическом осуществлении настоящей группы изобретений.
Настоящее изобретение не ограничивается изложенными в данном документе способами и материалами. В случае, если один или несколько из включенных литературных ссылок, патентов и аналогичных материалов отличается от или противоречит данной заявке, включая, в частности, определенные термины, использование терминов, описанные приемы и т.п., преимущественную силу имеет настоящая заявка.
Далее следует принять во внимание, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления изобретения, могут быть представлены также совместно в одном варианте. И наоборот, разнообразные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления изобретения, могут быть представлены отдельно или в любой подходящей подкомбинации.
Если представлен диапазон значений, то следует понимать, что каждое промежуточное значение, до десятых долей единицы нижнего предела, если из контекста явно не следует иное между верхней и нижней границами этого диапазона и любые другие указанные или промежуточные значения в этом установленном интервале охватываются настоящим изобретением. Верхние и нижние пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны, что также входит в объем изобретения, с учетом любого конкретно исключенного предела в указанном диапазоне. Когда указано, что диапазон включает один или оба предела, диапазоны, исключающие любое из обоих включенных пределов, также входят в объем изобретения.
Все публикации, патенты и заявки на патенты включены в настоящий документ посредством ссылки. Хотя в вышеприведенном описании это изобретение было описано в отношении некоторых предпочтительных вариантов его осуществления, и многие детали были изложены в целях иллюстрации, для специалистов в данной области техники будет очевидно, что изобретение допускает дополнительные варианты осуществления и что некоторые детали, описанные в данном документе, могут значительно изменяться без отклонения от сущности изобретения.
Использование терминов в единственном числе в контексте описания изобретения должно толковаться как охватывающее как единственное, так и множественное число, если иное не указано в данном документе или явно не противоречит контексту.
Термины «состоящий из», «имеющий», «включающий» и «содержащий» следует толковать как неограничивающие термины, т.е. означающие «включая, но не ограничиваясь», если не указано иное.
Использование любых и всех примеров или иллюстративного языка (например, «такой как»), представленных в данном документе, предназначено просто для лучшего описания изобретения и не налагает ограничения на объем изобретения, если иное не заявлено.
Никакие формулировки в описании не следует истолковывать как указывающие на какой-либо не заявленный элемент как существенный для практического применения изобретения.
Здесь описаны варианты осуществления этого изобретения, включая лучший из известных изобретателям способа осуществления изобретения. Разновидности этих вариантов осуществления могут стать очевидными для специалистов в данной области техники после прочтения предшествующего описания. Авторы ожидают, что квалифицированные специалисты будут использовать такие варианты в зависимости от обстоятельств, и авторы предполагают, что изобретение будет реализовано на практике иначе, чем конкретно описано в данном документе. Соответственно, это изобретение включает в себя все модификации и эквиваленты признаков, изложенных в прилагаемой формуле изобретения, как это разрешено действующим законодательством. Более того, любая комбинация вышеописанных признаков во всех их возможных вариациях охватывается изобретением, если иное не указано в данном документе или иным образом явно не противоречит контексту.
Для описания настоящего изобретения используются следующие термины.
Все технические и научные термины, использованные в данном документе, имеют такое значение, какое обычно понимается специалистами в области, к которой относится изобретение, если не указано иное. Все патенты и публикации, на которые имеются ссылки в данном документе, полностью включены в изобретение посредством ссылки.
Сокращения, используемые в настоящем описании, включая приведенные в иллюстративных схемах и последующих примерах, хорошо известны среднему специалисту.
Некоторые из терминов и сокращений используют как нижеследующие:
Аллель PsLykXA - это аллельное состояние гена PsLykX, присутствующее у «афганских горохов» (разновидностей гороха, происходящих из Малой Азии и характеризующихся высокой специфичностью взаимодействия с клубеньковыми бактериями) и придающее им свойство высокой специфичности взаимодействия с клубеньковыми бактериями.
Амплификация - это процесс многократного копирования специфической последовательности ДНК, осуществляемый при помощи специального фермента - ДНК-полимеразы в ходе полимеразной цепной реакции (ПЦР).
Гидролиз продукта амплификации - это процесс ферментативного разделения двухцепочечной ДНК на фрагменты меньшей длины, осуществляемый специальным ферментом - эндонуклеазой рестрикции - по специфическим сайтам (сайтам рестрикции).
Гомозиготный - содержащий одинаковые аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Маркер типа CAPS для идентификации растений - это молекулярно-генетический маркер, аллельные состояния которого определяются после амплификации и гидролиза продукта амплификации по результату анализа гель-электрофореза (от англ. Cleaved Amplified Polymorphic Sequence - гидролизованная амплифицированная полиморфная последовательность).
Полиморфный сайт PsLykX c.227C>A - сайт в позиции 227 кодирующей последовательности гена PsLykX, в котором у «европейских горохов» находится нуклеотид С, а у «афганских горохов» - нуклеотид А.
Праймер - это ДНКовый олигонуклеотид, используемый при амплификации в ходе ПЦР, который фланкирует участок ДНК, подвергаемый амплификации. В ПЦР используется пара праймеров (прямой праймер - фланкирует участок ДНК с одной стороны, и обратный - фланкирует участок ДНК с другой стороны).
п. н. - это сокращенное обозначение пар нуклеотидов, характеризующих размер фрагментов продукта амплификации.
Тачдаун-полимеразная цепная реакция - это метод полимеразной цепной реакции (ПЦР), с помощью которого праймеры избегают амплификации неспецифических последовательностей за счет того, что температура отжига во время полимеразной цепной реакции для первых циклов реакции устанавливается высокой и затем снижается от цикла к циклу до тех пор, пока не дойдет до оптимальной для данной пары праймеров темепературы отжига, подобранной опытным путем. При температурах выше этой точки будет происходить только очень специфическое спаривание оснований между праймером и матрицей, что позволит избежать неспецифической амплификации.
Эндонуклеаза рестрикции Hpy188III - это фермент, катализирующий гидролиз двухцепочечной ДНК внутри специфического сайта рестрикции (TC^NNGA).
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ И ПРИМЕРЫ
В основе предлагаемой группы изобретений при проведении селекционных работ лежит использование в качестве донора признака узкой специфичности разновидностей гороха из Афганистана, несущих аллель PsLykXA (либо, например, интрогрессионных линий, у которых афганская аллель PsLykXA уже находится в геномном окружении современного европейского сорта гороха). Использование данного маркера позволяет на ранних сроках (от 1 недели) выявлять в популяции растения, несущие аллель PsLykXA в гомозиготном состоянии.
Молекулярный маркер типа CAPS был создан на основании анализа полиморфизма последовательностей 1 экзона гена PsLykX «афганских горохов» и европейских сортов. Было проведено выравнивание последовательностей 1 экзона гена PsLykX «афганской» разновидности гороха NGB2150 (номер доступа в GenBank MN187362.1) и европейского сорта Cameor (номер доступа в GenBank MF135533.1), на основании чего были выявлены полиморфные сайты, в которых находятся однонуклеотидные замены. Данные замены были проанализированы при помощи программы dCAPS Finder 2.0 (http://helix.wustl.edu/dcaps/), в результате чего было установлено, что полиморфный сайт PsLykX c.227C>A пригоден для создания на его основе молекулярного маркера типа CAPS, поскольку в варианте аллельного состояния PsLykXA (свойственного «афганским горохам») присутствует сайт распознавания эндонуклеазы рестрикции Hpy188III. Аллельный вариант гена PsLykX у европейских сортов гороха, в свою очередь, не имеет сайта распознавания эндонуклеазы рестрикции Hpy188III. К последовательности гена PsLykX были подобраны пары праймеров (А1В1 и А2В2), позволяющие эффективно проводить амплификацию фрагмента, содержащего полиморфный сайт PsLykX c.227C>A. Гидролиз амплифицированного фрагмента эндонуклеазой рестрикции Hpy188III позволяет определять аллельное состояние гена PsLykX.
Данный молекулярный маркер типа CAPS для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA с номером доступа в GenBank MN187362.1, при этом молекулярный маркер основан на полиморфном сайте PsLykX c.227C>A, включает:
- праймер (A1) с последовательностью:
(1) CTAATATTTAGCTTACTATTGTTTCTG;
- праймер (В1) с последовательностью:
(2) CAAAACTTGAACTGAAGTCAAACTTGC;
или
- праймер (A2) с последовательностью:
(3) GCTTCTTACCATGTCATGCCTGCA;
- праймер (В2) с последовательностью:
(4) ACACATGTCCCAAGAATTCACCTCCA;
- эндонуклеазу рестрикции Hpy188III.
Пара праймеров А1В1 позволяет амплифицировать продукт длиной 381 п. н.; пара праймеров A2B2 позволяет амплифицировать продукт длиной 208 п. н.
Эндонуклеаза рестрикции Hpy188III используется для определения аллельного состояния гена PsLykX:
- при гидролизе продукта, амплифицированного с использованием пары праймеров А1В1, в случае выявления двух фрагментов размером 217 п. н. и 164 п. н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA;
- при гидролизе продукта, амплифицированного с использованием пары праймеров А2В2, в случае выявления двух фрагментов размером 127 п. н. и 81 п. н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA.
Для использования маркера проводят реакцию ПЦР с праймерами А1 и В1 либо с праймерами А2 и В2 с использованием в качестве матрицы ДНК исследуемых образцов гороха посевного Pisum sativum L. Затем проводят гидролиз продуктов амплификации эндонуклеазой рестрикции Hpy188III. Результат гидролиза анализируют в агарозном геле.
Таким образом, использование праймеров А1В1 либо А2В2 с последующей обработкой продукта амплификации эндонуклеазой рестрикции Hpy188III позволяет идентифицировать растения гороха, гомозиготные по аллели PsLykXA.
Способ для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA с номером доступа в GenBank MN187362.1 включает амплификацию ДНК растений гороха, которую проводят с помощью пары праймеров А1В1 или A2B2, входящих в состав молекулярного маркера по п. 1, при этом пара праймеров А1В1 позволяет амплифицировать продукт длиной 381 п. н., пара праймеров A2B2 позволяет амплифицировать продукт длиной 208 п. н. Далее проводят гидролиз продукта амплификации с помощью эндонуклеазы рестрикции Hpy188III, входящей в состав молекулярного маркера по п. 1. Затем осуществляют определение числа гидролизованных продуктов амплификации и их размера, при этом: при гидролизе продукта, амплифицированного с использованием пары праймеров А1В1, в случае выявления двух фрагментов размером 217 п. н. и 164 п. н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA. При гидролизе продукта, амплифицированного с использованием пары праймеров А2В2, в случае выявления двух фрагментов размером 127 п. н. и 81 п. н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA.
Сущность и промышленная применимость заявленной группы изобретений поясняются следующими примерами, ни в коей мере не уменьшая притязания по формуле изобретения во всех частных формах воплощения признаков.
Пример 1
Провели амплификацию с использованием пары праймеров А1В1 на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
Смесь для амплификации готовили на основе набора 5X ScreenMix-HS (Евроген, Москва, РФ), праймеров и воды деионизированной, свободной от нуклеаз (Евроген, Москва, РФ). Использовали следующие компоненты:
5X ScreenMix-HS - 10,00 мкл,
Праймер А1 в концентрации 10 µM - 2,50 мкл,
Праймер В1 в концентрации 10 µM - 2,50 мкл,
ДНК исследуемых образцов гороха - 4,00 мкл,
Вода деионизированная - 31,00 мкл,
Общий объем смеси 50 мкл.
Амплификацию проводили в приборе Bio-RAD T100 Thermal Cycler (Bio-Rad, США) в следующих условиях:
предварительная денатурация: при 95 °С в течение 30 с;
циклы амплификации: денатурация при 95 °С в течение 30 с, отжиг при 55 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
конечная элонгация: при 72 °С в течение 5 мин,
при этом амплификация включала 35 циклов.
После провели гидролиз эндонуклеазой рестрикции Hpy188III (New England Biolabs, США) в буфере CutSmart (New England Biolabs, США) с использованием следующих компонентов:
Буфер CutSmart 10Х - 3,15 мкл,
Эндонуклеаза рестрикции Hpy188III - 0,36 мкл,
Вода деионизированная - 12,99 мкл,
Продукт амплификации - 15 мкл,
Общий объем смеси 31,5 мкл.
Гидролиз эндонуклеазой рестрикции Hpy188III провели в следующих условиях: инкубация при 37 °С в течение 1 часа, инактивация фермента при 65 °С в течение 25 мин.
Затем провели гель-электрофорез в агарозном геле (2,5%) в буфере TAE 1% в следующих условиях: 100W, 50 минут. Результат гель-электрофореза представлен на Фиг. 1 «Результат ПЦР с праймерами А1В1 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
На Фиг. 1 показаны (слева направо): 1 дорожка - маркер молекулярного веса 100+bp; 2 дорожка - результат ПЦР на ДНК NGB2150; 3 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК NGB2150; 4 дорожка - результат ПЦР на ДНК SGE; 5 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК SGE.
По результатам анализа видно, что использование предлагаемого маркера (пара праймеров А1В1) позволяет однозначно идентифицировать растение, гомозиготное по аллели PsLykXA, так как в результате гидролиза продукта амплификации на ДНК данного растения выявлено два фрагмента размером 217 и 164 п. н.
Пример 2
Провели амплификацию с использованием пары праймеров А2В2 на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
Смесь для амплификации готовили на основе набора 5X ScreenMix-HS (Евроген, Москва, РФ), праймеров и воды деионизированной, свободной от нуклеаз (Евроген, Москва, РФ). Использовали следующие компоненты:
5X ScreenMix-HS - 10,00 мкл
Праймер А2 в концентрации 10 µM - 2,50 мкл,
Праймер В2 в концентрации 10 µM - 2,50 мкл,
ДНК исследуемых образцов гороха - 4,00 мкл,
Вода деионизированная - 31,00 мкл,
Общий объем смеси 50 мкл.
Амплификацию проводили в приборе Bio-RAD T100 Thermal Cycler (Bio-Rad, США) в следующих условиях:
предварительная денатурация: при 95 °С в течение 30 с;
циклы амплификации: денатурация при 95 °С в течение 30 с, отжиг при 55 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
конечная элонгация: при 72 °С в течение 5 мин,
при этом амплификация включала 35 циклов.
После провели гидролиз эндонуклеазой рестрикции Hpy188III (New England Biolabs, США) в буфере CutSmart (New England Biolabs, США) с использованием следующих компонентов:
Буфер CutSmart 10Х - 3,15 мкл,
Эндонуклеаза рестрикции Hpy188III - 0,36 мкл,
Вода деионизированная - 12,99 мкл,
Продукт амплификации - 15 мкл,
Общий объем смеси 31,5 мкл.
Гидролиз эндонуклеазой рестрикции Hpy188III провели в следующих условиях: инкубация при 37 °С в течение 1 часа, инактивация фермента при 65 °С в течение 25 мин.
Затем провели гель-электрофорез в агарозном геле (2,5%) в буфере TAE 1% в следующих условиях: 100W, 50 минут. Результат гель-электрофореза представлен на Фиг. 2 «Результат ПЦР с праймерами А2В2 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
На Фиг. 2 показаны (слева направо): 1 дорожка - маркер молекулярного веса 100+bp; 2 дорожка - результат ПЦР на ДНК NGB2150; 3 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК NGB2150; 4 дорожка - результат ПЦР на ДНК SGE; 5 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК SGE».
По результатам анализа видно, что использование предлагаемого маркера (пара праймеров А2В2) позволяет однозначно идентифицировать растение, гомозиготное по аллели PsLykXA, так как в результате гидролиза продукта амплификации на ДНК данного растения выявлено два фрагмента размером 127 и 81 п. н.
Пример 3
Провели амплификацию с использованием пары праймеров А1В1 на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
Смесь для амплификации готовили на основе набора 5X ScreenMix-HS (Евроген, Москва, РФ), праймеров и воды деионизированной, свободной от нуклеаз (Евроген, Москва, РФ). Использовали следующие компоненты:
5X ScreenMix-HS - 10,00 мкл,
Праймер А1 в концентрации 10 µM - 2,50 мкл,
Праймер В1 в концентрации 10 µM - 2,50 мкл,
ДНК исследуемых образцов гороха - 4,00 мкл,
Вода деионизированная - 31,00 мкл,
Общий объем смеси 50 мкл.
Амплификацию проводили в приборе Bio-RAD T100 Thermal Cycler (Bio-Rad, США) в следующих условиях:
предварительная денатурация: при 95 °С в течение 30 с;
первый цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 62 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
второй цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 61 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
третий цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 60 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
четвертый цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 59 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
пятый цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 58 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
шестой цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 57 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
седьмой цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 56 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
остальные циклы амплификации: денатурация при 95 °С в течение 30 с, отжиг при 55 °С в течение 30 с, элонгация при 72 °С в течение 60 с
конечная элонгация: при 72 °С в течение 5 мин, при этом амплификация включала 35 циклов.
После провели гидролиз эндонуклеазой рестрикции Hpy188III (New England Biolabs, США) в буфере CutSmart (New England Biolabs, США) с использованием следующих компонентов:
Буфер CutSmart 10Х - 3,15 мкл,
Эндонуклеаза рестрикции Hpy188III - 0,36 мкл,
Вода деионизированная - 12,99 мкл,
Продукт амплификации - 15 мкл,
Общий объем смеси 31,5 мкл.
Гидролиз эндонуклеазой рестрикции Hpy188III провели в следующих условиях: инкубация при 37 °С в течение 1 часа, инактивация фермента при 65 °С в течение 25 мин.
Затем провели гель-электрофорез в агарозном геле (2,5%) в буфере TAE 1% в следующих условиях: 100W, 50 минут. Результат гель-электрофореза представлен на Фиг. 3 «Результат тачдаун-ПЦР с праймерами А1В1 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»)».
На Фиг. 3 показаны (слева направо): 1 дорожка - маркер молекулярного веса 100+bp; 2 дорожка - результат ПЦР на ДНК NGB2150; 3 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК NGB2150; 4 дорожка - результат ПЦР на ДНК SGE; 5 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК SGE».
По результатам анализа видно, что использование предлагаемого маркера (пара праймеров А1В1) в варианте тачдаун-ПЦР позволяет однозначно идентифицировать растение, гомозиготное по аллели PsLykXA, так как в результате гидролиза продукта амплификации на ДНК данного растения выявлено два фрагмента размером 217 и 164 п. н.
Пример 4
Провели амплификацию с использованием пары праймеров А2В2 на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
Смесь для амплификации готовили на основе набора 5X ScreenMix-HS (Евроген, Москва, РФ), праймеров и воды деионизированной, свободной от нуклеаз (Евроген, Москва, РФ). Использовали следующие компоненты:
5X ScreenMix-HS - 10,00 мкл,
Праймер А1 в концентрации 10 µM - 2,50 мкл,
Праймер В1 в концентрации 10 µM - 2,50 мкл,
ДНК исследуемых образцов гороха - 4,00 мкл,
Вода деионизированная - 31,00 мкл,
Общий объем смеси 50 мкл.
Амплификацию проводили в приборе Bio-RAD T100 Thermal Cycler (Bio-Rad, США) в следующих условиях:
предварительная денатурация: при 95 °С в течение 30 с;
первый цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 62 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
второй цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 61 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
третий цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 60 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
четвертый цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 59 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
пятый цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 58 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
шестой цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 57 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
седьмой цикл амплификации: денатурация при 95 °С в течение 30 с, отжиг при 56 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
остальные циклы амплификации: денатурация при 95 °С в течение 30 с, отжиг при 55 °С в течение 30 с, элонгация при 72 °С в течение 60 с
конечная элонгация: при 72 °С в течение 5 мин, при этом амплификация включала 35 циклов.
После этого провели гидролиз эндонуклеазой рестрикции Hpy188III (New England Biolabs, США) в буфере CutSmart (New England Biolabs, США) с использованием следующих компонентов:
Буфер CutSmart 10Х - 3,15 мкл,
Эндонуклеаза рестрикции Hpy188III - 0,36 мкл,
Вода деионизированная - 12,99 мкл,
Продукт амплификации - 15 мкл,
Общий объем смеси 31,5 мкл.
Гидролиз эндонуклеазой рестрикции Hpy188III провели в следующих условиях: инкубация при 37 °С в течение 1 часа, инактивация фермента при 65 °С в течение 25 мин.
Затем провели гель-электрофорез в агарозном геле (2,5%) в буфере TAE 1% в следующих условиях: 100W, 50 минут. Результат гель-электрофореза представлен на Фиг. 4 «Результат ПЦР с праймерами А2В2 с последующим гидролизом эндонуклеазой рестрикции Hpy188III, проведенной на ДНК разновидности гороха NGB2150 («афганский горох») и ДНК лабораторной линии гороха SGE («европейский горох»).
На Фиг. 4 показаны: 1 дорожка - маркер молекулярного веса 100+bp; 2 дорожка - результат ПЦР на ДНК NGB2150; 3 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК NGB2150; 4 дорожка - результат ПЦР на ДНК SGE; 5 дорожка - результат гидролиза ПЦР-фрагмента, полученного на ДНК SGE».
По результатам анализа видно, что использование предлагаемого маркера (пара праймеров А2В2) в варианте тачдаун-ПЦР позволяет однозначно идентифицировать растение, гомозиготное по аллели PsLykXA, так как в результате гидролиза продукта амплификации на ДНК данного растения выявлено два фрагмента размером 127 и 81 п. н.
Пример 5
Провели анализ аллельного состояния гена PsLykX с использованием заявляемого маркера на популяции растений F2 (Frisson x NGB2150). Родительская линия Frisson представляет собой европейский сорт гороха, линия NGB2150 - «афганский горох». Семена растений были стерилизованы концентрированной серной кислотой в течение 10 минут, промыты 5 раз дистиллированной водой и проращены в чашках Петри со стерильным 1% агаром в темноте при комнатной температуре. Проростки были индивидуально высажены в 500 мл контейнеры со стерильным вермикулитом, политы 100 мл раствора минерального питания без связанного азота (состав приведен в Таблице 1) и инокулированы 100 мл суспензии культуры Rhizobium leguminosarum bv. viciae RCAM1026 с содержанием бактерий не менее 106 КОЕ/мл. Растения были выращены в фитотроне Vötsch Industrietechnik VB 1014 (Германия) температуре 21°C, влажности 70%, режим дня/ночи 16:8 часов.
Таблица 1 - Состав раствора минерального питания
На сроке 14 дней после посадки, когда растения имели два-три листа, с пронумерованных растений собрали по одному листу и выделили из листьев ДНК при помощи набора Qiagen Plant Mini Kit (Qiagen, Германия) по протоколу производителя. Выделенные препараты ДНК (в концентрации от 30 до 100 нг/мкл) использовали для амплификации. Было проанализировано 22 растения.
Смесь для амплификации готовили на основе набора 5X ScreenMix-HS (Евроген, Москва, РФ), праймеров и воды деионизированной, свободной от нуклеаз (Евроген, Москва, РФ). Использовали следующие компоненты:
5X ScreenMix-HS - 10,00 мкл
Праймер А2 в концентрации 10 µM - 2,50 мкл
Праймер В2 в концентрации 10 µM - 2,50 мкл
ДНК исследуемых образцов гороха - 4,00 мкл
Вода деионизированная - 31,00 мкл
Общий объем смеси 50 мкл.
Амплификацию проводили в приборе Bio-RAD T100 Thermal Cycler (Bio-Rad, США) в следующих условиях:
предварительная денатурация: при 95 °С в течение 30 с;
циклы амплификации: денатурация при 95 °С в течение 30 с, отжиг при 55 °С в течение 30 с, элонгация при 72 °С в течение 60 с,
конечная элонгация: при 72 °С в течение 5 мин,
при этом амплификация включала 35 циклов.
После провели гидролиз эндонуклеазой рестрикции Hpy188III (New England Biolabs, США) в буфере CutSmart (New England Biolabs, США) с использованием следующих компонентов:
Буфер CutSmart 10Х - 3,15 мкл,
Эндонуклеаза рестрикции Hpy188III - 0,36 мкл,
Вода деионизированная - 12,99 мкл,
Продукт амплификации - 15 мкл,
Общий объем смеси 31,5 мкл.
Гидролиз эндонуклеазой рестрикции Hpy188III провели в следующих условиях: инкубация при 37 °С в течение 10 часов, инактивация фермента при 65 °С в течение 25 мин.
Затем провели гель-электрофорез в агарозном геле (2,5%) в буфере TAE 1% в следующих условиях: 100W, 50 минут. Результат гель-электрофореза для первых 6 проб представлен на Фиг. 5 «Результат ПЦР с праймерами А2В2 и результат последующего гидролиза эндонуклеазой рестрикции Hpy188III, проведенных на ДНК растений выборки F2 (Frisson x NGB2150).
На Фиг. 5 показаны (слева направо): 1 дорожка - маркер молекулярного веса 100+bp; 2-14 дорожки -результат гидролиза ПЦР-фрагмента, полученного на ДНК растения из выборки F2 (Frisson x NGB2150); 15 дорожка - маркер молекулярного веса 100+bp.
По результатам анализа видно, что использование предлагаемого маркера (пара праймеров А2В2) позволяет однозначно идентифицировать среди растений популяции F2 (Frisson x NGB2150) растения, гомозиготные по аллели PsLykXA (на Фиг. 5 образцы на 4 и 6 дорожках относятся к растениям, гомозиготным по аллели PsLykXA), так как в результате гидролиза продукта амплификации на ДНК этих растений выявлено два фрагмента размером 127 и 81 п. н.
В дальнейшем на сроке 28 дней после посадки растения были извлечены из субстрата, и был проведен визуальный осмотр их корневой системы. В результате было установлено, что соотношение растений, образовавших клубеньки и не образовавших клубеньки, составляет 17:5 (что соответствует расщеплению 3:1, характерному для моногенного наследования рецессивной аллели гена PsLykX). При этом только 5 растений, не образовавших клубеньки, по результатам анализа молекулярного маркера идентифицированы как гомозиготные по аллели PsLykXA. Таким образом, продемонстрирована успешная идентификация растений, гомозиготных по аллели по аллели PsLykXA, при помощи анализа заявляемого молекулярного маркера.
Эквиваленты.
Специалистам в данной области будут очевидны, или они смогут достоверно установить при помощи обычных экспериментальных методик, многочисленные эквиваленты конкретных вариантов реализации, описанные в настоящем документе. Предполагается, что такие эквиваленты входят в объем охраны следующей формулы изобретения.
Резюмируя вышесказанное, заявленная группа изобретений может быть признана соответствующей критерию патентоспособности «Промышленная применимость» во всех частных формах воплощения признаков формулы изобретения до даты испрашиваемого приоритета.
Таким образом заявленная группа изобретений позволяет достигать технический результат, т.е. увеличить эффективность, скорость и точность идентификации, а также упростить идентификацию растений гороха Pisum sativum L., гомозиготных по аллели PsLykXA.
Источники литературы:
1. Firmin J. L. et al. Resistance to nodulation of cv. Afghanistan peas is overcome by nodX, which mediates an O-acetylation of the Rhizobium leguminosarum lipo-oligosaccharide nodulation factor //Molecular microbiology. - 1993. - Т. 10. - №. 2. - С. 351-360.
2. Sulima A. S. et al. Selection signatures in the first exon of paralogous receptor kinase genes from the Sym2 region of the Pisum sativum L. genome //Frontiers in Plant Science. - 2017. - Т. 8. - С. 1957.
3. Sulima A. S. et al. New sources of Sym2A allele in the pea (Pisum sativum L.) carry the unique variant of candidate LysM-RLK gene LykX //PeerJ. - 2019. - Т. 7. - С. e8070.
4. Сулима А.С. «Характеристика гена LykX, определяющего специфичность взаимодействий Гороха посевного (Pisum sativum L.) с клубеньковыми бактериями Rhizobium leguminosarum», диссертация на соиск. уч. степ. к.б.н., СПб, 2020 г (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЯРНЫЙ МАРКЕР FR_ER1 И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ СЕЛЕКЦИИ НОВЫХ СОРТОВ ГОРОХА, УСТОЙЧИВЫХ К МУЧНИСТОЙ РОСЕ | 2013 |
|
RU2593691C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ КУР К ВИРУСНЫМ ИНФЕКЦИЯМ | 2007 |
|
RU2352640C1 |
| СПОСОБ ДИАГНОСТИКИ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ТРОМБОФИЛИИ | 2007 |
|
RU2352641C1 |
| CAPS-маркер для отбора гибридов ячменя, не накапливающих проантоцианидины в зерне | 2023 |
|
RU2809369C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ (ВАРИАНТЫ) | 2001 |
|
RU2187812C1 |
| Способ идентификации видов хищных клещей рода Amblyseius | 2023 |
|
RU2804853C1 |
| СПОСОБ МОЛЕКУЛЯРНОГО МАРКИРОВАНИЯ, ОСНОВАННЫЙ НА МИКРОСАТЕЛЛИТНЫХ ЛОКУСАХ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ГЕНЕТИЧЕСКОЙ ПАСПОРТИЗАЦИИ СЕЛЕКЦИОННЫХ ДОСТИЖЕНИЙ РАСТЕНИЙ РОДА RUBUS | 2018 |
|
RU2732922C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АЛЛЕЛЕЙ ГЕНА ХЕМОКИНОВОГО РЕЦЕПТОРА CCR2 ПО ПОЛИМОРФНОМУ САЙТУ V64I | 2001 |
|
RU2180922C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПОЛИМОРФИЗМА R287Q В 8 ЭКЗОНЕ ГЕНА ЦИТОЗОЛЬНОЙ ЭПОКСИДГИДРОЛАЗЫ У ЧЕЛОВЕКА | 2006 |
|
RU2346053C2 |
| Способ прогнозирования предрасположенности к посттравматическому гонартрозу | 2021 |
|
RU2770004C1 |
Группа изобретений относится к области биотехнологии, а именно к молекулярному маркеру типа CAPS для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA. Также изобретение относится к применению вышеуказанного маркера для использования в селекции растений гороха. Для реализации способа идентификации растений гороха проводят амплификацию ДНК растений гороха с помощью пары праймеров А1В1 или A2B2, входящих в состав молекулярного маркера, осуществляют гидролиз продукта амплификации с помощью эндонуклеазы рестрикции Hpy188III, входящей в состав молекулярного маркера, определяют число гидролизованных продуктов амплификации и их размер. При гидролизе продукта, амплифицированного с использованием пары праймеров А1В1, в случае выявления двух фрагментов размером 217 п.н. и 164 п.н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA. При гидролизе продукта, амплифицированного с использованием пары праймеров А2В2, в случае выявления двух фрагментов размером 127 п.н. и 81 п.н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA. Изобретение позволяет увеличить эффективность, скорость и точность идентификации, а также упростить идентификацию растений гороха Pisum sativum L., гомозиготных по аллели PsLykXА, обуславливающей формирование повышенной специфичности по отношению к симбиотическим клубеньковым бактериям. 2 н. и 3 з.п. ф-лы, 5 ил., 1 табл., 5 пр.
1. Молекулярный маркер типа CAPS для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA, при этом молекулярный маркер основан на полиморфном сайте PsLykX c.227C>A, включающий:
- праймер (A1) с последовательностью:
(1) CTAATATTTAGCTTACTATTGTTTCTG;
- праймер (В1) с последовательностью:
(2) CAAAACTTGAACTGAAGTCAAACTTGC;
или
- праймер (A2) с последовательностью:
(3) GCTTCTTACCATGTCATGCCTGCA;
- праймер (В2) с последовательностью:
(4) ACACATGTCCCAAGAATTCACCTCCA;
- эндонуклеазу рестрикции Hpy188III.
2. Способ для идентификации растений гороха посевного Pisum sativum L., гомозиготных по аллели PsLykXA, включающий:
а) амплификацию ДНК растений гороха, которую проводят с помощью пары праймеров A1В1 с последовательностью, соответственно:
CTAATATTTAGCTTACTATTGTTTCTG;
CAAAACTTGAACTGAAGTCAAACTTGC;
или A2В2 с последовательностью, соответственно:
GCTTCTTACCATGTCATGCCTGCA;
ACACATGTCCCAAGAATTCACCTCCA;
при этом пара праймеров А1В1 позволяет амплифицировать продукт длиной 381 п.н.,
пара праймеров A2B2 позволяет амплифицировать продукт длиной 208 п.н.;
б) гидролиз продукта амплификации, который проводят с помощью эндонуклеазы рестрикции Hpy188III;
в) определение числа гидролизованных продуктов амплификации и их размера, при этом:
- при гидролизе продукта, амплифицированного с использованием пары праймеров А1В1, в случае выявления двух фрагментов размером 217 п.н. и 164 п.н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA;
- при гидролизе продукта, амплифицированного с использованием пары праймеров А2В2, в случае выявления двух фрагментов размером 127 п.н. и 81 п.н. идентифицируют растение гороха посевного Pisum sativum L. как гомозиготное по аллели PsLykXA.
3. Способ для идентификации растений гороха посевного Pisum sativum L. по п.2, в котором амплификацию проводят при следующих условиях:
предварительная денатурация: при 95-98 °С в течение 15-45 с;
циклы амплификации: денатурация при 95-98 °С в течение 10-45 с, отжиг при 50-60 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
конечная элонгация: при 72 °С в течение 2-10 мин,
при этом амплификация включает от 25 до 35 циклов.
4. Способ для идентификации растений гороха посевного Pisum sativum L. по п.2, в котором амплификацию проводят при следующих условиях:
предварительная денатурация: при 95-98 °С в течение 15-45 с,
первый цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 62 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
второй цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 61 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
третий цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 60 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
четвертый цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 59 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
пятый цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 58 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
шестой цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 57 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
седьмой цикл амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 56 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
остальные циклы амплификации: денатурация при 95-98 °С в течение 15-45 с, отжиг при 55 °С в течение 15-45 с, элонгация при 72 °С в течение 30-90 с,
конечная элонгация: при 72 °С в течение 2-10 мин, при этом амплификация включает от 25 до 35 циклов.
5. Способ для идентификации растений гороха посевного Pisum sativum L. по п.2, в котором гидролиз продукта амплификации эндонуклеазой рестрикции Hpy188III проводят при 37 °С в течение 1-10 ч, а также дополнительно проводят инактивацию эндонуклеазы рестрикции: при 65 °С в течение 10-30 мин.
| СУЛИМА А.С | |||
| "Характеристика гена LykX, определяющего специфичность взаимодействий гороха посевного (Рisum sativum L.) с клубеньковыми бактериями Rhizobium leguminosarum", диссертация Санкт-Петербург, 2020, 121 с | |||
| RU 2012147570 A, 10.09.2014 | |||
| FIRMIN J | |||
| L | |||
| et al., Resistance to nodulation of cv | |||
| Afghanistan peas is overcome by nodX, which mediates |
Авторы
Даты
2024-03-15—Публикация
2023-10-21—Подача